Патент на изобретение №2155770
|
||||||||||||||||||||||||||
(54) 17-ДИФТОРМЕТИЛЕН-ЭСТРАТРИЕНЫ, СОЕДИНЕНИЯ И СПОСОБ ИХ ПОЛУЧЕНИЯ
(57) Реферат: Описываются новые соединения – 17-дифторметилен-эстратриены общей формулы I, где R1 обозначает атом водорода или C1-C10-алкил; R5 обозначает метил или этил; R2 обозначает атом водорода или C1-C10-алкил в  – или – или  -положении; R3 обозначает атом водорода или C1-C10-алкилокси в -положении; R3 обозначает атом водорода или C1-C10-алкилокси в  – или – или  -положении; R4 обозначает атом водорода в -положении; R4 обозначает атом водорода в  – или – или  -положении; А, В, D, Е и G обозначают каждый атом водорода и, в случае необходимости, дополнительно по меньшей мере одна из пар заместителей G и R2, R2 и R4, R4 и А, А и R3, D и Е обозначает двойную связь. Соединения проявляют антиокислительные и сосудисто-защитные свойства и поэтому могут найти применение для лечения и профилактики самых различных заболеваний. -положении; А, В, D, Е и G обозначают каждый атом водорода и, в случае необходимости, дополнительно по меньшей мере одна из пар заместителей G и R2, R2 и R4, R4 и А, А и R3, D и Е обозначает двойную связь. Соединения проявляют антиокислительные и сосудисто-защитные свойства и поэтому могут найти применение для лечения и профилактики самых различных заболеваний.
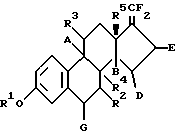 3 с. и 9 з.п. ф-лы, 2 ил., 1 табл. Изобретение относится к 17-дифторметилен-эстратриенам, к способу их получения и к их применению для получения фармацевтических продуктов (лекарственных средств). 17-дифторметилен-эстратриены согласно данному изобретению отличаются общей формулой I: 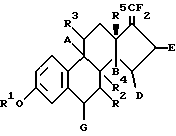 где R1 обозначает атом водорода или группу C1-C10-алкила, R5 обозначает группу метила или этила, и R2 обозначает атом водорода или  – или – или  – постоянную группу C1-C10-алкила, – постоянную группу C1-C10-алкила,R3 обозначает атом водорода или  – или – или  – постоянную группу С1-С10-алкилокси, – постоянную группу С1-С10-алкилокси,R4 обозначает  – или – или  -постоянный атом водорода, и A, B, D, E и G каждый обозначают атом водорода, и в случае необходимости дополнительно, по меньшей мере, одна из пар заместителей G и R2, R2 и R4, R4 и А, А и R3, В и D, D и E обозначает двойную связь.
Изобретение относится, предпочтительно, к таким соединениям общей формулы I, -постоянный атом водорода, и A, B, D, E и G каждый обозначают атом водорода, и в случае необходимости дополнительно, по меньшей мере, одна из пар заместителей G и R2, R2 и R4, R4 и А, А и R3, В и D, D и E обозначает двойную связь.
Изобретение относится, предпочтительно, к таким соединениям общей формулы I,где R1 обозначает атом водорода или группу С1-С10-алкила, R5 обозначает метил- или этилгруппу, и А, В, D, E, G, R2 и R3 обозначают атом водорода и R4 обозначает  – или – или  – постоянный атом водорода или R2 с R4, R4 с А, А с R3, B c D, D с E или G с R2 обозначают дополнительную связь и другие из этих заместителей обозначают атом водорода, или – постоянный атом водорода или R2 с R4, R4 с А, А с R3, B c D, D с E или G с R2 обозначают дополнительную связь и другие из этих заместителей обозначают атом водорода, илиR2 обозначает  -постоянную группу С1-С10-алкила, причем в этом случае А, В, D, E, G, R3 и R4 представляют соответственно атом водорода, или -постоянную группу С1-С10-алкила, причем в этом случае А, В, D, E, G, R3 и R4 представляют соответственно атом водорода, илиR3 обозначает  -постоянную группу С1-С10-алкилокси, причем в этом случае А, В, D, E, G и R2 и R4 представляют соответственно атом водорода.
У остатков R1, R2 и R3 в случае, если они являются С1-С10, -алилом или алкокси, то речь идет об остатке метила, этила, n-пропила, изопропила, n-бутила, изо-бутила или трет.- бутила или об их более высоких прямых или разветвленных гомологах или в случае R3 о соответствующем алкоксиостатке. Предпочтительным является остаток метила или метокси. Для R1 предпочтительным является атом водорода.
Для R5, в первую очередь, речь идет о группе метила.
Кроме того, предпочтительными являются такие соединения общей формулы 1, где А, В, D, E, G, R2, R3 и R4 представляют атомы водорода или где А, В, D, E, R3 и R4 представляют атомы водорода и G с R2 обозначают дополнительную связь.
Согласно данному изобретению особенно предпочтительными являются нижеследующие названные соединения: -постоянную группу С1-С10-алкилокси, причем в этом случае А, В, D, E, G и R2 и R4 представляют соответственно атом водорода.
У остатков R1, R2 и R3 в случае, если они являются С1-С10, -алилом или алкокси, то речь идет об остатке метила, этила, n-пропила, изопропила, n-бутила, изо-бутила или трет.- бутила или об их более высоких прямых или разветвленных гомологах или в случае R3 о соответствующем алкоксиостатке. Предпочтительным является остаток метила или метокси. Для R1 предпочтительным является атом водорода.
Для R5, в первую очередь, речь идет о группе метила.
Кроме того, предпочтительными являются такие соединения общей формулы 1, где А, В, D, E, G, R2, R3 и R4 представляют атомы водорода или где А, В, D, E, R3 и R4 представляют атомы водорода и G с R2 обозначают дополнительную связь.
Согласно данному изобретению особенно предпочтительными являются нижеследующие названные соединения:17-дифторметилен-эстра-1,3,5 (10) -триен-3-ол, 17-дифторметилен-эстра-1,3,5 (10)6-тетраен-3-ол, 17-дифторметилен-11  -метокси-эстра-1,3,5(10)-триен-3-ол, -метокси-эстра-1,3,5(10)-триен-3-ол,17-дифторметилен-эстра-1,3,5(10),7-тетраен-3-ол, 17-дифторметилен-эстра-1,3,5(10),8-тетраен-3-ол, 17-дифторметилен-эстра-1,3,5(10),9(11)-тетраен-3-ол, 17-дифторметилен-3-метокси-эстра-1,3,5(10),15-тетраен, 17-дифторметилен-эстра-1,3,5(10),15-тетраен-3-ол, 17-дифторметипен-7  -метил-эстра-1,3,5(10)-триен-3-ол, -метил-эстра-1,3,5(10)-триен-3-ол,17-дифторметилен-8  -эстра-1,3,5(10)-триен-3-ол, -эстра-1,3,5(10)-триен-3-ол,17-дифторметилен-3-метокси-18-метил-эстра-1,3,5(10) -триен, 17-дифторметилен-18-метил-эстра-1,3,5(10)-триен-3-ол. Соединения, наиболее близкие данным соединениям по структуре, описаны в EP-A 0 320 438 и представляют 17-моногалогенметилен-эстратриены. Известные 17-галогенметилен-эстратриены проявляют меньшее сродство к рецепторам эстрогена, как эстрадиолу, и вызывают по сравнению с эстрадиолом повышенную проницаемость оболочки клетки и кровеносных/лимфатических сосудов. Поэтому эти соединения особенно пригодны для лечения явлений, которые появляются в результате второго периода действия эстрадиола (климактерические жалобы). Новые 17-дифторметилен-эстратриены согласно изобретению показывают новые, совершенно неожиданные, до сих пор не описанные для вышеназванных 17-моногалогенметилен-эстратриенов и других стероидов фармакологические свойства. У 17-дифторметилен-эстратриенов речь идет об очень слабых эстрогенах, как можно было установить при помощи стандартных исследований связи на рецепторе эстрогена и в испытаниях трансактивирования, при которых 17-  -эстрадиол служил сравнительным веществом (M.T.Bocquel и др., Nucleic Acid Research 17: 2571-95; S.Green и др., Nucleic Acid Research 16:369,1989; L. Tora и др. , ЕМВО J. 8:1981-86, 1989; J.E.Burch и др.,Моl. Cell. Biol. 8: 1123-31, 1988).
Было найдено, что 17-дифторметилен-эстратриены имеют неожиданно антиокислительные и сосудисто-защитные свойства и применяются поэтому для лечения и профилактики самых различных заболеваний (напр.Siegfried и др., JPET 260: 668, 1992; Chao и др., J.Immunol. 149:2736, 1992; Corbett & Mc Daniel, Диабеты, 41:897, 1992; Siminiak и др., Intl.J.Cardiol.,45:171, 1994).
Для характеристики соединений с предполагаемыми антиокислительными и сосудисто-защитными свойствами привлекали различные методы испытаний, результаты которых позволяют сделать вывод о том, имеют ли тестированные соединения антиокислительные и сосудисто-защитные свойства.
Антиокислительные и сосудисто-защитные свойства новых соединений основываются как на прямом действии в результате предотвращения окисления LDL, так и на косвенном действии в результате высвобождения сосудорасширяющей окиси азота (NO) из эндотелиальных клеток.
Экспериментальные методы и результаты LDL-окисления (липопротеинов низкой плотности) -эстрадиол служил сравнительным веществом (M.T.Bocquel и др., Nucleic Acid Research 17: 2571-95; S.Green и др., Nucleic Acid Research 16:369,1989; L. Tora и др. , ЕМВО J. 8:1981-86, 1989; J.E.Burch и др.,Моl. Cell. Biol. 8: 1123-31, 1988).
Было найдено, что 17-дифторметилен-эстратриены имеют неожиданно антиокислительные и сосудисто-защитные свойства и применяются поэтому для лечения и профилактики самых различных заболеваний (напр.Siegfried и др., JPET 260: 668, 1992; Chao и др., J.Immunol. 149:2736, 1992; Corbett & Mc Daniel, Диабеты, 41:897, 1992; Siminiak и др., Intl.J.Cardiol.,45:171, 1994).
Для характеристики соединений с предполагаемыми антиокислительными и сосудисто-защитными свойствами привлекали различные методы испытаний, результаты которых позволяют сделать вывод о том, имеют ли тестированные соединения антиокислительные и сосудисто-защитные свойства.
Антиокислительные и сосудисто-защитные свойства новых соединений основываются как на прямом действии в результате предотвращения окисления LDL, так и на косвенном действии в результате высвобождения сосудорасширяющей окиси азота (NO) из эндотелиальных клеток.
Экспериментальные методы и результаты LDL-окисления (липопротеинов низкой плотности)Так как окислительные модификации липопротеинов могут представлять наследственный фактор при развитии артериосклероза (Steinberq и др., N.EnqI.J. Med. 320:915, 1989; Esterbauer и др. Free Radical Bioloqy & Medicine 13:341, 1992), соединения общей формулы I исследовали на их способность влиять на окисление LDL’ (липопротеинов низкой плотности). Чтобы определять антиокислительные способности соединений общей формулы I, был разработан анализ, который основан на методах Веди (J.Lipid Res. 32:1359-69, 1991). Для этого измеряют изменения хроматографического поведения человеческих LDL на основе индуцированного ионами меди окисления. Человеческий LDL был заказан в Orqanon Teknika, Rockville M.D. Его разбавляли свободными Ca- и Mq-ионами PBS (буферного фосфатного раствора) до концентрации протеина 0,5 мг/мл и, чтобы удалять ЕДТА (этилендиаминтетрауксусную кислоту) перед окислением, проводили диализ относительно этого буферного раствора при 4oC. В этом случае окисляли LDL добавкой 10 мкМ сульфата меди с последующим инкубированием при 37oC в водяной бане, в сосуде Эппендорфа. Тест-соединение, растворенное в DMSO (диметилсульфоксиде), добавляли в конечном объеме в 1%. Окисление останавливали добавкой 1 мМ ЕДТА. Пробы хранили до FPLC анализа (быстро действующей жидкостной хроматографии протеина) при 4oC. Было установлено, что хроматографическое поведение окисленных LDL’ более одной недели остается постоянным. FPLC-анализ Пробы (0,1 мл с 0,5 мг LDL протеина) анализировали на 1 мл Q – сефарозеколонке (Hi-Trap Q, Фармация). Абсорбцию измеряли постоянно при 280 нм и интегрировали пики для квантования. Начальный буферный раствор (буферный раствор А) состоял из 10 мМ Трис-HCl, pH 7,5 с 1 мМ ЕДТА. При этих условиях LDL связывали полностью колонкой. Элюирование проводили со ступенчатым градиентом буферного раствора В (буферный раствор А + 1М NaCI). Анализировали пять фракций (очерчивали): фракция А (0,2 М соль), фракция В (0,3 М соль), фракция С (0,4 М соль), фракция D (0,5 М соль) и фракция E (0,6 М соль). Немодифицированный купленный LDL ведет себя немного неоднородно. Его полностью элюируют во фракциях А+В. В течение инкубационного периода всегда модифицируют LDL сильнее, так что элюируют его при более высоких концентрациях соли. В течение первого инкубационного часа благодаря меди находили часть протеина во фракции С. После 3-4 часов почти полностью элюировали протеин во фракциях С и D. После 24 часов все протеины были превращены в форму или в формы, которые элюировали во фракциях D+E. Степень окисления LDL определяют при помощи показателя окисления. 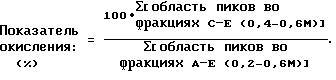 При окислении, вызванном медью в течение 3-4 часов, была найдена область 60-90% для LDL, не обработанных веществом общей формулы 1. Только редко наблюдали более низкий показатель окисления. Все эксперименты, в которых достигали показателя окисления при положительном контроле не менее 60%, не учитывали. Добавка 1 мМ ЕДТА во время инкубирования с медью (отрицательный контроль) препятствовала изменениям LDL подвижности хроматографии (показатель окисления 0%). Действия 17-дифторметилен-эстратриенов на обусловленное медью LDL окисление показывают (таблица 1), что они защищают LDL перед окислением (причем эстрадиол имеет более сильное антиокислительное действие, чем 17-дифторметилен-эстратриены). 2. Вазорелаксация на изолированной аорте крысы Удаляли аорту Spraque-Daweley-крыс мужского пола, освобождали от всякого прилипшего жира и от соединительной ткани и разрезали на кольца размером 2 мм. Эндотелий механически удаляли с внутренних поверхностей сосудов нескольких колец аорты. Кольца подвешивали отдельно в 10 мл растворов органов при 37oC, которые содержали раствор Кребса-Хензелейта (КНS), имеющий pH 7,4, если он насыщен 95% O2 и 5% CO2. Перед началом опыта ткань эквилибрировали на 90 минут при 1 г натяжения. Изометрическое натяжение измеряли при помощи “силового преобразователя” (Grass FT03C) и записывали на рекордере (Gould ТА 5000). Все ткани стягивались при помощи KCl (30 мМ) и затем три раза промывались в свежем растворе Кребса-Хензелейта (KHS).Сосудистые кольца стягивали или при помощи 30 мМ KCl или при помощи 100 нМ фенилэфрина (РЕ). Чтобы проверить присутствие или отсутствие эндотелия, к ткани добавляли 1 мкМ ацетилхолина (Ach). Кривые концентрации-релаксации для 17  -эстрадиола и 17-дифторметилен-11 -эстрадиола и 17-дифторметилен-11 -метокси-эстра-1,3,5(10), 6-тетраен-3-ола (соединение А) получали кумулятивным присоединением испытываемого вещества в полулогарифмических компонентах концентраций к растворам тканей. Ответы были вычислены как изменения в процентах сокращения и представлены графически на фиг.1 и 2. При этом E обозначает эндотелий и + или – обозначает ткань с (+) или без (-) эндотелия.
Подводя итог, можно установить, что новые 17-дифторметилен-эстратриены на изолированной аорте крысы вызывают расслабление гладкой мускулатуры; в противоположность 17 -метокси-эстра-1,3,5(10), 6-тетраен-3-ола (соединение А) получали кумулятивным присоединением испытываемого вещества в полулогарифмических компонентах концентраций к растворам тканей. Ответы были вычислены как изменения в процентах сокращения и представлены графически на фиг.1 и 2. При этом E обозначает эндотелий и + или – обозначает ткань с (+) или без (-) эндотелия.
Подводя итог, можно установить, что новые 17-дифторметилен-эстратриены на изолированной аорте крысы вызывают расслабление гладкой мускулатуры; в противоположность 17  -эстрадиолу, который оказывает свое расслабляющее влияние на аорту независимо от эндотелия, новые соединения индуцируют вазорелаксацию благодаря высвобождению NO из эндотелия.
Эти результаты фармакологических тестов показывают, что соединения общей формулы I имеют сосудисто-защитные свойства, так как: -эстрадиолу, который оказывает свое расслабляющее влияние на аорту независимо от эндотелия, новые соединения индуцируют вазорелаксацию благодаря высвобождению NO из эндотелия.
Эти результаты фармакологических тестов показывают, что соединения общей формулы I имеют сосудисто-защитные свойства, так как:– сосудистая релаксация защищает сосуды от последствий возрастающего местного (спазмы сосудов в коронарных и мозговых артериях) или общего (напр., гипертензия) мышечного тонуса гладкой мускулатуры; – высвобождение NO из эндотелия приводит к сосудистой релаксации (Furchqott & Zawadski, Nature 288:373, 1980), препятствует агрегации тромбоцитов (Radomcki и др.,Lancet 2:1057, 1987) и предотвращает миграцию лейкоцитов на стенке сосуда (Chao и др., J.lmmunol., 149:2736, 1992). Антиокислительные свойства соединений могут предотвращать повреждения сосудов свободными радикалами, которые были вызваны активированными лейкоцитами (полиморфноядерными и одноядерными) и которые являются основной причиной для образования атеросклеротического повреждения и его прогрессирования (Steinberq и др., N.Engl.J.Med. 320:915, 1989). На основании этих неожиданных фармакологических свойств новые соединения согласно изобретению общей формулы I используют для профилактики и лечения, в частности, следующих заболеваний: атеросклероз, гипертензия, спазмы сосудов (коронарные и мозговые), диабетические васкулопатии (напр., невропатия, нефропатия, ретинопатия), ишемия сердца и головного мозга, инфаркт миокарда, инсульт, реперфузионный синдром после ишемии (сердца, головного мозга и т.д. ), воспаления, ревматический артрит, бронхиальная астма, заболевания почек (напр. , гломерулонефрит, нейтродегенеративные заболевания (напр., болезнь Альцгеймера). Эти действия не были описаны для 17- галогенметилен-эстратриенов и представляют совершенно новые и неожиданные возможности в профилактике и в лечении вышеназванных заболеваний. Изобретение относится также к фармацевтическим препаратам, которые содержат соединения общей формулы I. Использование зависит от области применения. При оральном применении, например, используют форму таблеток, капсул в мягкой желатиновой оболочке, которые содержат растворы, используемые в мягких желатиновых капсулах, водные или масляные суспензии, эмульсии, пилюли, пастилки, сиропы, эликсиры или аэрозоли и т.п. При парентеральном применении соединения общей формулы I можно использовать в форме депо-инъекций, имплантатов или мышечных, подкожных и внутривенных инъекций. Получение фармацевтических препаратов, которые содержат соединения общей формулы I, осуществляют по известным из уровня техники методам (литературный источник). Фармацевтические препараты должны были содержать 17-дифторметилен-эстратриены в концентрации активного вещества 0,1-100 мг/кг/день. Соответствующая концентрация активного вещества зависит от болезни, которую лечат, или от тяжести соответствующего заболевания. Изобретение относится также к способу получения соединений общей формулы I. Их получают по изобретению взаимодействием 17-кето-соединения общей формулы II. 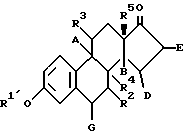 где R1′ обозначает гидроксизащитную группу и А, В, D, E, G, R2, R3, R4 и R5 имеют указанное в формуле I значение, с дифторметил-дифенил-фосфин-окисью или с диэтил-(дифторметил)фосфонатом в присутствии сильного основания в апротонном растворителе при температуре флегмы 50-100oC, затем, в случае необходимости, 3-гидроксизащитную группу отщепляют под действием кислоты и по желанию 3-гидроксизащитную группу этерифицируют. 3-гидроксизащитная группа R1′ представляет, или легко отщепляемый в кислой или основной среде остаток, как, например, тетрагидропиранил-группу (ТНР), или замещенную группу силила с тремя одинаковыми, двумя одинаковыми или тремя различными остатками С1-С4-алкила и/или арила с прямой или разветвленной цепью, как, например, группу триметила, трет.-бутилдиметила, метилдифенила или трет. -бутилфенилсилила или группу метила (R1=R1′=CH3), которая, конечно, может быть удалена только при характерных условиях. В качестве сильных оснований согласно изобретению принимают во внимание литийдиизопропиламид, гидрид натрия, трет.-бутилат калия, бутиллитий и т.п. Взаимодействие кетона общей формулы II осуществляют в апротонном растворителе, как, например, тетрагидрофуран, диметилсульфоксид, диметилформамид, диоксан или в смеси этих растворителей. Температура реакции должна составлять, предпочтительно, между 50oC и 100oC. Условия для отщепления 3-гидроксизащитной группы зависят от ее природы: защитные группы, как ТНР-группу или остаток силила, можно удалять под действием слабой кислоты, как щавелевая кислота, или кислого ионообменника, в то время как группу метила можно отщеплять в результате действия сильных кислот по Льюису, например, гидрид дибутилалюминия. Этерификацию свободной 3-гидроксигруппы осуществляют известным образом при помощи дающего остаток R1 реактива. Получение необходимых для дифторметиленирования 17-кетонов с защищенной 3-гидроксифункцией осуществляют взаимодействием соответствующего, известного 3-гидроксисоединения с дигидропираном под влиянием пара-толуолсульфокислоты в тетрагидрофуране или другими известными специалисту методами для защиты гидроксигрупп. Нижеследующие примеры служат для более подробного пояснения данного изобретения, не ограничивая его. ПРИМЕР 1 17-дифторметилен-эстра-1,3,5(10)-триен-3-ол 757 мг окись дифторметил-дифенил-фосфина (M.L.Edwards и др. Tetrahedron Letters стр. 5571, 1990) в 38 мл тетрагидрофурана медленно смешивают при -50oC с 1,5 мл 2-молярного раствора литийдиизопропиламина, перемешивают 1 час, смешивают с раствором 1,06 г 3-тетрагидропиранилокси-эстра-1,3,5(10)-триен-17-она в 11 мл тетрагидрофурана. 15 минут перемешивают при -50oC, оставляют до возврата к комнатной температуре и перемешивают 3,5 часа при температуре раствора 80oC. Для обработки добавляют воду, три раза экстрагируют уксусным эфиром, промывают органические фазы до нейтрального состояния насыщенным раствором хлористого натрия, сушат над сульфатом натрия и сгущают в вакууме досуха. Получают 1,3 г сырого 17-дифторметилен- 3-(тетрагидро-пиран-2-ил-окси)-эстра-1,3,5 (10)-триена. 1,3 г сырого 17-дифторметилен-3-(тетрагидро-пиран-2-ил-окси) эстра-1,3,5(10)-триена суспендируют в 30 мл метанола и 3 мл воды, перемешивают с 1,3 г щавелевой кислоты 1 час при температуре раствора 100oC. Затем добавляют воду, три раза экстрагируют дихлорметаном, промывают до нейтрального состояния, сушат над сульфатом натрия и сгущают в вакууме досуха. Получают 1,0 г сырого 17-дифторметилен-эстра-1,3,5(10)-триен-3-ола, который хроматографируют на силикагеле с гексаном/уксусным эфиром. Получают 480 мг чистого 17-дифторметилен-эстра-1,3,5 (10)-триен-3-ола в виде бесцветных кристаллов с точкой плавления 154-156oC. ПРИМЕР 2 17-дифторметилен-эстра-1,3,5(10),6-тетраен-3-ол а) 3-тетрагидропиранилокси-эстра-1,3,5(10), 6-тетраен-17-он Суспензию 2,6 г 3-гидрокси-эстра-1,3,5(10), 6-тетраен-17-она в 26 мл тетрагидрофурана и 2,6 мл дигидропирана перемешивают с 12,3 мг пара-толуолсульфокислоты 3 часа при комнатной температуре. Затем разбавляют уксусным эфиром, промывают раствором бикарбоната натрия и насыщенным раствором хлористого натрия, сушат над сульфатом натрия и сгущают в вакууме. Получают 3,0 г 3-тетрагидропиранилокси-эстра-1,3,5(10), 6-тетраен-17-она в виде бесцветных кристаллов. b) 17-дифторметилен-3-тетрагидропиранилокси-эстра-1, 3, 5 (10), 6-тетраен Раствор 715 мг окиси дифторметилдифенилфосфина в 36 мл тетрагидрофурана медленно смешивают при температуре раствора -50oC с 1,42 мл 2-молярного раствора литийдиизопропиламида и перемешивают 1 час. Затем медленно добавляют раствор 1 г 3-тетрагидропиранилокси-эстра-1,3,5 (10),6-тетраен-17-она в 10 мл тетрагидрофурана, 15 минут перемешивают, медленно нагревают при температуре раствора от -50oC до 100oC и кипятят 2,5 часа с обратным холодильником. Для обработки добавляют воду, экстрагируют уксусным эфиром, промывают водой и насыщенным раствором хлористого натрия, сушат над сульфатом натрия и сгущают в вакууме. Получают 1,1 г 17-дифторметилен-3-тетрагидропиранил-окси-эстра-1,3,5(10), 6-тетраена в виде бесцветных кристаллов. с) 17-дифторметилен-эстра-1,3,5(10),6-тетраен-3-ол Суспензию 1,1 г 17-дифторметилен-3-тетрагидропиранилокси-эстра-1,3,5 (10), 6-тетраена в 25 мл метанола и 2,5 мл воды кипятят с обратным холодильником с 1,1 мг щавелевой кислоты 1,5 часа при температуре раствора 100oC. Затем добавляют воду, экстрагируют дихлорметаном, промывают водой, раствором бикарбоната натрия и насыщенным раствором хлористого натрия, сушат над сульфатом натрия, сгущают в вакууме и хроматографируют на силикагеле с гексаном/уксусным эфиром. Получают 0,6 г 17- дифторметилен-эстра-1,3,5 (10), 6-тетраен-3-ола в виде бесцветных кристаллов с точкой плавления 132-134oC [  ]2D2 =- 167,9oC (с= 0,505% в пиридине).
ПРИМЕР 3 ]2D2 =- 167,9oC (с= 0,505% в пиридине).
ПРИМЕР 317-дифторметилен-11  -метокси-эстра-1,3,5 (10)-триен-3-ол -метокси-эстра-1,3,5 (10)-триен-3-олa) 11  -метокси-3-тетрагидропиранолокси-эстра-1,3,5(10)-триен-17-он.
Суспензию 2,0 г 11 -метокси-3-тетрагидропиранолокси-эстра-1,3,5(10)-триен-17-он.
Суспензию 2,0 г 11  -метокси-3-гидрокси-эстра- 1,3,5(10)-триен-17-она в 20 мл толуола, 5 мл тетрагидрофурана и 3,0 мл дигидропирана перемешивают с 20 мг пара-толуолсульфокислоты 24 часа при комнатной температуре. Затем добавляют 0,5 мл пиридина, разбавляют уксусным эфиром, промывают раствором бикарбоната натрия и насыщенным раствором хлористого натрия, сушат над сульфатом натрия, сгущают в вакууме и хроматографируют на силикагеле с гексаном/ацетоном. Получают 1,9 г 11 -метокси-3-гидрокси-эстра- 1,3,5(10)-триен-17-она в 20 мл толуола, 5 мл тетрагидрофурана и 3,0 мл дигидропирана перемешивают с 20 мг пара-толуолсульфокислоты 24 часа при комнатной температуре. Затем добавляют 0,5 мл пиридина, разбавляют уксусным эфиром, промывают раствором бикарбоната натрия и насыщенным раствором хлористого натрия, сушат над сульфатом натрия, сгущают в вакууме и хроматографируют на силикагеле с гексаном/ацетоном. Получают 1,9 г 11  -метокси-3-тетрагидропиранилокси-эстра-1,3,5(10)-триен-17-она в виде бесцветных кристаллов с точкой плавления 147oC [ -метокси-3-тетрагидропиранилокси-эстра-1,3,5(10)-триен-17-она в виде бесцветных кристаллов с точкой плавления 147oC [ ]2D2 =+147,2o (с=0,5% в пиридине).
b)17-дифторметилен-11 ]2D2 =+147,2o (с=0,5% в пиридине).
b)17-дифторметилен-11 -метокси-3-тетрагидропиранилокси-эстра-1,3,5(10)-триен.
Раствор 3 г окиси дифторметилдифенилфосфина в 80 мл тетрагидрофурана при температуре раствора -50oC медленно смешивают с 5,85 мл 2-молярного раствора литийдиизопропиламида и перемешивают 1 час. Затем медленно добавляют раствор 1,8 г 11 -метокси-3-тетрагидропиранилокси-эстра-1,3,5(10)-триен.
Раствор 3 г окиси дифторметилдифенилфосфина в 80 мл тетрагидрофурана при температуре раствора -50oC медленно смешивают с 5,85 мл 2-молярного раствора литийдиизопропиламида и перемешивают 1 час. Затем медленно добавляют раствор 1,8 г 11  – метокси-3-тетрагидропиранилокси-эстра-1,3,5(10)-триен-17- она в 40 мл тетрагидрофурана, перемешивают 15 минут, медленно нагревают при -50oC до температуры раствора 100oC и кипятят 2,5 часа с обратным холодильником. Для обработки разбавляют уксусным эфиром и водой, отсасывают на целите, дополнительно промывают уксусным эфиром, промывают водой и насыщенным раствором хлористого натрия, сушат над сульфатом натрия, сгущают в вакууме и хроматографируют на силикагеле с гексаном/уксусным эфиром/триэтиламином. Получают 1,3 г 17- дифторметилен-11 – метокси-3-тетрагидропиранилокси-эстра-1,3,5(10)-триен-17- она в 40 мл тетрагидрофурана, перемешивают 15 минут, медленно нагревают при -50oC до температуры раствора 100oC и кипятят 2,5 часа с обратным холодильником. Для обработки разбавляют уксусным эфиром и водой, отсасывают на целите, дополнительно промывают уксусным эфиром, промывают водой и насыщенным раствором хлористого натрия, сушат над сульфатом натрия, сгущают в вакууме и хроматографируют на силикагеле с гексаном/уксусным эфиром/триэтиламином. Получают 1,3 г 17- дифторметилен-11  -метокси-3-тетрагидропиранилокси-эстра-1,3,5(10)- триена с точкой плавления 124-125oC [ -метокси-3-тетрагидропиранилокси-эстра-1,3,5(10)- триена с точкой плавления 124-125oC [ ]2D2 =+60,0 o (с= 0,505% в пиридине).
b) 17-дифторметилен-11 ]2D2 =+60,0 o (с= 0,505% в пиридине).
b) 17-дифторметилен-11 -метокси-эстра-1,3,5(10)-триен-3-ол -метокси-эстра-1,3,5(10)-триен-3-олСуспензию 1,2 г 17-дифторметилен-11  -метокси-3- тетрагидропиранилокси-эстра-1,3,5(10)-триена в 25 мл метанола и 2,6 мл воды кипятят с обратным холодильником с 1,2 г щавелевой кислоты 0,5 часа при температуре раствора 100oC. Затем сгущают в вакууме, разбавляют уксусным эфиром, промывают водой, раствором бикарбоната натрия и насыщенным раствором хлористого натрия, сушат над сульфатом натрия, сгущают в вакууме и хроматографируют на силикагеле с гексаном/ацетоном. После кристаллизации из гексана получают 0,9 г 17-дифторметилен-11 -метокси-3- тетрагидропиранилокси-эстра-1,3,5(10)-триена в 25 мл метанола и 2,6 мл воды кипятят с обратным холодильником с 1,2 г щавелевой кислоты 0,5 часа при температуре раствора 100oC. Затем сгущают в вакууме, разбавляют уксусным эфиром, промывают водой, раствором бикарбоната натрия и насыщенным раствором хлористого натрия, сушат над сульфатом натрия, сгущают в вакууме и хроматографируют на силикагеле с гексаном/ацетоном. После кристаллизации из гексана получают 0,9 г 17-дифторметилен-11  -метокси-эстра-1,3,5(10)-триен-3-ола в виде бесцветных кристаллов с точкой плавления 245-247oC = [ -метокси-эстра-1,3,5(10)-триен-3-ола в виде бесцветных кристаллов с точкой плавления 245-247oC = [ ]2D2 +77,3o (с=0,535% в пиридине).
ПРИМЕР 4 ]2D2 +77,3o (с=0,535% в пиридине).
ПРИМЕР 417-дифторметилен-эстра-1,3,5(10),7-тетраен-3-ол а) 3-тетрагидропиранилокси-эстра-1,3,5(10),7-тетраен-17-он Суспензию 2,0 г 3-гидрокси-эстра-1, 3,5(10),7-тетраен-17-она в 20 мл тетрагидрофурана и 2,0 мл дигидропирана перемешивают с 9,6 мг пара-толуолсульфокислоты 24 часа при комнатной температуре. Затем добавляют 0,3 мл пиридина, разбавляют уксусным эфиром, промывают раствором бикарбоната натрия и насыщенным раствором хлористого натрия, сушат над сульфатом натрия, сгущают в вакууме и хроматографируют на силикагеле с гексаном/ацетоном. Получают 1,9 г 3-тетрагидропиранилокси-эстра-1,3,5(10), 7-тетраен-17-она в виде бесцветных кристаллов с точкой плавления 147-149oC [  ]2D2 = + 209,7 (с=0,5% в пиридине).
b) 17-дифторметилен-3-тетрагидропиранилокси-эстра-1,3,5 (10),7-тетраен ]2D2 = + 209,7 (с=0,5% в пиридине).
b) 17-дифторметилен-3-тетрагидропиранилокси-эстра-1,3,5 (10),7-тетраенРаствор 3 г окиси дифторметилдифенилфосфина в 85 мм тетрагидрофурана при температуре раствора -50oC медленно смешивают с 6 мл 2-молярного раствора литийдиизопропиламида и перемешивают 1 час. Затем медленно добавляют раствор 1,7 г 3-тетрагидропиранилокси-эстра-1,3,5(10),7-тетраен-17-она в 42 мл тетрагидрофурана, перемешивают 15 минут, медленно нагревают от -50oC до 100oC температуры раствора и кипятят 2,5 часа с обратным холодильником. Для обработки разбавляют уксусным эфиром и водой, отсасывают на целите, дополнительно промывают уксусным эфиром и насыщенным раствором хлористого натрия, сушат над сульфатом натрия, сгущают в вакууме и хроматографируют на силикагеле с гексаном/уксусным эфиром/триэтиламином. Получают 1,0 г 17- дифторметилен-3-тетрагидропиранилокси-эстра-1,3,5(10), 7- тетраена в виде бесцветных кристаллов с точкой плавления 83- 84oC [  ]2D2 = +139,6o (с=0,5% в пиридине).
с) 17-дифторметилен-эстра-1,3,5(10), 7-тетраен-3-ол ]2D2 = +139,6o (с=0,5% в пиридине).
с) 17-дифторметилен-эстра-1,3,5(10), 7-тетраен-3-олСуспензию 950 мг 17-дифторметипен-3-тетрагидропиранилокси-эстра-1,3,5(10), 7-тетраена в 20 мл метанола и 2,0 мл воды нагревают при флегме с 950 мг щавелевой кислоты 0,5 часа при температуре раствора 100oC. Затем сгущают в вакууме, разбавляют уксусным эфиром, промывают водой, раствором бикарбоната натрия и насыщенным раствором хлористого натрия, сушат над сульфатом натрия, сгущают в вакууме и хроматографируют на силикагеле с гексаном/уксусным эфиром. Получают 0,6 г 17-дифторметилен-эстра- 1,3,5(10)7-тетраен-3-ола в виде бесцветных кристаллов с точкой плавления 126-129oC [  ]2D2 = +163,7o (с=0,505% в пиридине).
ПРИМЕР 5 ]2D2 = +163,7o (с=0,505% в пиридине).
ПРИМЕР 517-дифторметилен-эстра-1,3,5(10),8-тетраен-3-ол а) 3-тетрагидропиранилокси-эстра-1,3,5(10),8-тетраен-17-он Суспензию 2,0 г 3-гидрокси-эстра-1,3,5(10), 8-тетраен-17-она в 20 мл тетрагидрофурана и 2,0 мл дигидропирана перемешивают с 9,4 мг пара-толуолсульфокислоты 3 часа при комнатной температуре. Затем добавляют 0,3 мл пиридина, разбавляют уксусным эфиром, промывают раствором бикарбоната натрия и насыщенным раствором хлористого натрия, сушат над сульфатом натрия, сгущают в вакууме и хроматографируют на силикагеле с гексаном/ацетоном/триэтиламином. Получают 2,4 г 3-тетрагидропиранилокси-эстра-1,3,5 (10),8-тетраен-17-она в виде бесцветных кристаллов с точкой плавления 122-125oC [  ]2D2 =+0,00o (с=0,515% в пиридине).
b) 17-дифторметилен-3-тетрагидропиранилокси-эстра-1,3,5 (10),8-тетраен ]2D2 =+0,00o (с=0,515% в пиридине).
b) 17-дифторметилен-3-тетрагидропиранилокси-эстра-1,3,5 (10),8-тетраенРаствор 2,7 г окиси дифторметилдифенилфосфина в 85 мл тетрагидрофурана медленно смешивают при температуре раствора -50oC с 5,3 мл 2-молярного раствора литийдиизопропиламида и 1 час перемешивают. Затем медленно добавляют раствор 1,5 г 3- тетрагидропиранилокси-эстра-1,3,5 (10),8-тетраен-17-она в 42 мл тетрагидрофурана, перемешивают 15 минут, медленно нагревают при температуре раствора от -50oC до 100oC и кипятят 2,5 часа с обратным холодильником. Для обработки разбавляют уксусным эфиром и водой, промывают водой, сушат над сульфатом натрия, сгущают в вакууме, хроматографируют на силикагеле с гексаном/уксусным эфиром. Получают 1,0 г 17-дифторметилен-3-тетрагидропиранилокси- эстра-1,3,5 (10), 8-тетраена в виде бесцветных кристаллов с точкой плавления 124-125oC [  ]2D2 = + 2,0 (с=0,525% в пиридине).
с) 17-дифторметилен-эстра-1,3,5 (10),8-тетраен-3-ол ]2D2 = + 2,0 (с=0,525% в пиридине).
с) 17-дифторметилен-эстра-1,3,5 (10),8-тетраен-3-олСуспензию 927 мг 17-дифторметилен-3-тетрагидропиранилокси-эстра-1,3,5(10),8-тетраена в 20 мл метанола и 2,0 мл воды кипятят с 950 мг щавелевой кислоты с обратным холодильником 0,5 часа при температуре раствора 100oC. Затем сгущают в вакууме, разбавляют уксусным эфиром, три раза промывают водой, один раз раствором бикарбоната натрия и насыщенным раствором хлористого натрия, сушат над сульфатом натрия и сгущают в вакууме. После кристаллизации из гексана получают 0,5 г 17-дифторметилен- эстра-1,3,5(10), 8-тетраен-3-ола в виде бесцветных кристаллов с точкой плавления 127-128oC [  ]2D2 =-1,5o (с=0,515% в пиридине).
ПРИМЕР 6 ]2D2 =-1,5o (с=0,515% в пиридине).
ПРИМЕР 617-дифторметилен-эстра-1,3,5(10),9(11)-тетраен-3-ол а) 3-тетрагидропиранилокси-эстра-1,3,5(10),9(11)-тетраен-17-он Суспензию 2,0 г 3-гидрокси-эстра-1,3,5(10),9(11)-тетраен-17-она в 20 мл тетрагидрофурана и 3,0 мл дигидропирана перемешивают с 15 мг пара-толуолсульфокислоты 29 часов при комнатной температуре. Затем добавляют 0,3 мл пиридина, разбавляют уксусным эфиром, промывают раствором бикарбоната натрия и насыщенным раствором хлористого натрия, сушат над сульфатом натрия, сгущают в вакууме и хроматографируют на силикагеле с гексаном/ ацетоном/триэтиламином. Получают 2,3 г 3-тетрагидропиранилокси-эстра-1,3,5(10), 9(11)-тетраен-17-она в виде бесцветного масла [  ]2D2 = +122,5o (с=0,515% в пиридине).
b) 17-дифторметилен-3-тетрагидропиранилокси-эстра-1,3,5 (10),9(11)-тетраен ]2D2 = +122,5o (с=0,515% в пиридине).
b) 17-дифторметилен-3-тетрагидропиранилокси-эстра-1,3,5 (10),9(11)-тетраенРаствор 3,85 г дифторметилдифенилфосфинокиси в 107 мл тетрагидрофурана медленно смешивают при температуре раствора -50oC с 7,6 мл 2-молярного раствора литийдиизопропиламида и перемешивают 1 час. Затем медленно добавляют раствор 2,14 г 3-тетрагидропиранилокси-эстра-1,3,5(10),9(11)-тетраен-17-она в 42 мл тетрагидрофурана, перемешивают 15 минут, медленно нагревают при температуре раствора от -50oC до 100oC и кипятят 2,5 часа с обратным холодильником. Для обработки разбавляют уксусным эфиром и водой, отсасывают на целите, дополнительно промывают уксусным эфиром, водой и насыщенным раствором хлористого натрия, сушат над сульфатом натрия, сгущают в вакууме и хроматографируют на силикагеле с гексаном/уксусным эфиром/триэтиламином. Получают 1,0 г 17-дифторметилен-3-тетрагидропиранилокси-эстра- 1,3,5(10), 9(11)-тетраена в виде бесцветного масла [  ]2D2 = +52,6o (с=0,5% в пиридине).
с) 17-дифторметилен-эстра-1,3,5(10),9(11)-тетраен-3-ол ]2D2 = +52,6o (с=0,5% в пиридине).
с) 17-дифторметилен-эстра-1,3,5(10),9(11)-тетраен-3-олСуспензию 900 мг 17-дифторметилен 3-тетрагидропиранилокси-эстра-1,3,5(10),9(11)-тетраена в 19 мл метанола и 1,9 мл воды кипятят с 900 мг щавелевой кислоты 0,5 часа с обратным холодильником при температуре раствора 100oC. Затем сгущают в вакууме, разбавляют уксусным эфиром, три раза промывают водой, один раз раствором бикарбоната натрия и насыщенным раствором хлористого натрия, сушат над сульфатом натрия, сгущают в вакууме и хроматографируют на силикагеле с гексаном/уксусным эфиром. После кристаллизации из гексана получают 0,5 г 17-дифторметилен-эстра- 1,3,5(10),9(11-тетраен-3-ола в виде бесцветных кристаллов с точкой плавления 134-135oC [  ]2D2 = +89,6o (с = 0,515% в пиридине).
ПРИМЕР 7 ]2D2 = +89,6o (с = 0,515% в пиридине).
ПРИМЕР 717-дифторметилен-3-метокси-эстра-1,3,5(10),15-тетраен Раствор 9,4 г диэтил-(дифторметил)фосфоната в 150 мл тетрагидрофурана медленно примешивают при температуре раствора -50oC к 25 мл 2-молярного раствора литийдиизопропиламида и перемешивают 1 час. Затем медленно добавляют раствор 5,6 г 3-метокси-эстра-1,3,5(10),15-тетраен-17-она в 173 мл тетрагидрофурана, перемешивают 15 минут, медленно нагревают при температуре раствора от -50oC до 100oC и кипятят с обратным холодильником 6 часов. Для обработки сгущают в вакууме до половины объема, разбавляют уксусным эфиром, промывают водой и насыщенным раствором хлористого натрия, сушат над сульфатом натрия, сгущают в вакууме и хроматографируют на силикагеле с гексаном/уксусным эфиром/триэтиламином. Получают 3,0 г 17-дифторметилен-3-метокси- эстра-1,3,5(10), 15-тетраена в виде бесцветных кристаллов с точкой плавления 122-123oC, [  ]2D2 =-120,9o (с=0,515% в пиридине).
ПРИМЕР 8 ]2D2 =-120,9o (с=0,515% в пиридине).
ПРИМЕР 817-дифторметилен-эстра-1,3,5(10),15-тетраен-3-ол Раствор 2,4 г 17-дифторметилен-3-метокси-эстра-1,3,5 (10), 15-тетраена в 49 мл толуола кипятят с обратным холодильником с 49 мл 1,6-молярного раствора диизобутилалюминийгидрида в толуоле 1 час при температуре раствора 140oC. Затем охлаждают до комнатной температуры, медленно подают на 200 г льда, примешивают к 400 мл 2-нормальной серной кислоты, перемешивают 1 час при комнатной температуре, три раза экстрагируют уксусным эфиром, промывают органические фазы водой и насыщенным раствором хлористого натрия, сушат над сульфатом натрия, сгущают в вакууме и хроматографируют на силикагеле с гексаном/уксусным эфиром. Получают 1,37 г 17- дифторметилен-эстра-1,3,5(10), 15-тетраен-3-ола в виде бесцветных кристаллов с точкой плавления 126-127oC [  ]2D2 = -120,4 (с = 0,505% в пиридине).
ПРИМЕР 9 ]2D2 = -120,4 (с = 0,505% в пиридине).
ПРИМЕР 917-дифторметилен-7  -метил-эстра-1,3,5(10)-триен-3-ол -метил-эстра-1,3,5(10)-триен-3-ола) 7  -метил-3-тетрагидропиранилокси-эстра-1,3,5(10)-триен-17-он -метил-3-тетрагидропиранилокси-эстра-1,3,5(10)-триен-17-онСуспензию 1,2 г 3-гидpoкcи-7  -мeтил-эcтpa-1,3,5 (10) -триен-17-она в 12 мл толуола и 1,2 мл дигидропирана перемешивают с 5,6 мг пара-толуолсульфокислоты 2 часа при комнатной температуре. Затем разбавляют уксусным эфиром, промывают раствором бикарбоната натрия и насыщенным раствором хлористого натрия, сушат над сульфатом натрия, сгущают в вакууме и хроматографируют на силикагеле с гексаном/ацетоном. Получают 1,22 г 7 -мeтил-эcтpa-1,3,5 (10) -триен-17-она в 12 мл толуола и 1,2 мл дигидропирана перемешивают с 5,6 мг пара-толуолсульфокислоты 2 часа при комнатной температуре. Затем разбавляют уксусным эфиром, промывают раствором бикарбоната натрия и насыщенным раствором хлористого натрия, сушат над сульфатом натрия, сгущают в вакууме и хроматографируют на силикагеле с гексаном/ацетоном. Получают 1,22 г 7  -метил- 3-тетрагидропиранилокси-эстра-1,3,5(10)-триен-17-она.
b) 17-дифторметилен-7 -метил- 3-тетрагидропиранилокси-эстра-1,3,5(10)-триен-17-она.
b) 17-дифторметилен-7  -метил-3-тетрагидропиранилокси- эстра-1,3,5(10)-триен -метил-3-тетрагидропиранилокси- эстра-1,3,5(10)-триенРаствор 2 г окиси дифторметилдифенилфосфина в 55 мл тетрагидрофурана при температуре раствора -50oC медленно смешивают с 3,9 мл 2-молярного раствора литийдиизопропиламида и перемешивают 1 час. Затем добавляют раствор 1,15 г 7  -метил-3-тетрагидропиранилокси-эстра-1,3,5(10)-триен-17-она в 20 мл тетрагидрофурана, медленно перемешивают 15 минут, медленно нагревают при температуре раствора от -50oC до 100oC и кипятят с обратным холодильником 2,5 часа. Для обработки разбавляют уксусным эфиром и водой, отсасывают на целите, дополнительно промывают уксусным эфиром, промывают водой и насыщенным раствором хлористого натрия, сушат над сульфатом натрия, сгущают в вакууме и хроматографируют на силикагеле с гексаном/уксусным эфиром/триэтиламином. Получают 1,3 г вещества в виде бесцветных кристаллов с точкой плавления 85-86oC [ -метил-3-тетрагидропиранилокси-эстра-1,3,5(10)-триен-17-она в 20 мл тетрагидрофурана, медленно перемешивают 15 минут, медленно нагревают при температуре раствора от -50oC до 100oC и кипятят с обратным холодильником 2,5 часа. Для обработки разбавляют уксусным эфиром и водой, отсасывают на целите, дополнительно промывают уксусным эфиром, промывают водой и насыщенным раствором хлористого натрия, сушат над сульфатом натрия, сгущают в вакууме и хроматографируют на силикагеле с гексаном/уксусным эфиром/триэтиламином. Получают 1,3 г вещества в виде бесцветных кристаллов с точкой плавления 85-86oC [ ]2D2 =-59,4o (с= 0,535% в пиридине).
с) 17-дифторметилен-7 ]2D2 =-59,4o (с= 0,535% в пиридине).
с) 17-дифторметилен-7  -метил-эстра-1,3,5(10)-триен- 3-ол -метил-эстра-1,3,5(10)-триен- 3-олСуспензию 1,2 г 17-дифторметилен-7  -метил-3- тетрагидропиранилокси-эстра-1,3,5(10)-триена в 25 мл метанола и 2,5 мл воды кипятят с обратным холодильником с 1,2 г щавелевой кислоты 1 час при температуре раствора 100oC. Затем сгущают в вакууме, разбавляют уксусным эфиром, промывают водой, раствором бикарбоната натрия и насыщенным раствором хлористого натрия, сушат над сульфатом натрия, сгущают в вакууме и хроматографируют на силикагеле с гексаном/ацетоном. После кристаллизации из гексана получают 0,9 г 17-дифторметилен-7 -метил-3- тетрагидропиранилокси-эстра-1,3,5(10)-триена в 25 мл метанола и 2,5 мл воды кипятят с обратным холодильником с 1,2 г щавелевой кислоты 1 час при температуре раствора 100oC. Затем сгущают в вакууме, разбавляют уксусным эфиром, промывают водой, раствором бикарбоната натрия и насыщенным раствором хлористого натрия, сушат над сульфатом натрия, сгущают в вакууме и хроматографируют на силикагеле с гексаном/ацетоном. После кристаллизации из гексана получают 0,9 г 17-дифторметилен-7  -метил-эстра-1,3,5(10)-триен-3-ола в виде бесцветных кристаллов с точкой плавления 119-120oC [ -метил-эстра-1,3,5(10)-триен-3-ола в виде бесцветных кристаллов с точкой плавления 119-120oC [ ]2D2 =-10,6o (с=0,5% в пиридине).
ПРИМЕР 10 ]2D2 =-10,6o (с=0,5% в пиридине).
ПРИМЕР 1017-дифторметилен-8  эстра-1,3,5(10)-триен-3-ол эстра-1,3,5(10)-триен-3-ола) 3-тетрагидропиранилокси-8  эстра-1,3,5(10)- триен-17-он эстра-1,3,5(10)- триен-17-онСуспензию 2,0 г 3-гидрокси-8  эстра-1,3,5(10)-триен-17-она в 20 мл тетрагидрофурана и 2,0 мл дигидропирана перемешивают с 15 мг пара-толуолсульфокислоты 24 часа при комнатной температуре. Затем добавляют 0,3 мл пиридина, разбавляют уксусным эфиром, промывают раствором бикарбоната натрия и насыщенным раствором хлористого натрия, сушат над сульфатом натрия, сгущают в вакууме и хроматографируют на силикагеле с гексаном/ацетоном. Получают 2,2 г 3-тетрагидропиранилокси- 8 эстра-1,3,5(10)-триен-17-она в 20 мл тетрагидрофурана и 2,0 мл дигидропирана перемешивают с 15 мг пара-толуолсульфокислоты 24 часа при комнатной температуре. Затем добавляют 0,3 мл пиридина, разбавляют уксусным эфиром, промывают раствором бикарбоната натрия и насыщенным раствором хлористого натрия, сушат над сульфатом натрия, сгущают в вакууме и хроматографируют на силикагеле с гексаном/ацетоном. Получают 2,2 г 3-тетрагидропиранилокси- 8  -эстра-1,3,5(10)-триен-17-она в виде бесцветных кристаллов с точкой плавления 153-155oC [ -эстра-1,3,5(10)-триен-17-она в виде бесцветных кристаллов с точкой плавления 153-155oC [ ]2D2 = +47,5 (с=0,53% в пиридине).
b) 17-дифторметилен-3-тетрагидропиранилокси-8 ]2D2 = +47,5 (с=0,53% в пиридине).
b) 17-дифторметилен-3-тетрагидропиранилокси-8  -экстра-1,3,5(10)-триен -экстра-1,3,5(10)-триенРаствор 3,5 г окиси дифторметилдифенилфосфина в 100 мл тетрагидрофурана примешивают при температуре раствора от -50oC медленно к 7 мл 2-молярного раствора литийдиизопропиламида и перемешивают 1 час. Затем медленно добавляют раствор 2 г 3-тетрагидропиранилокси-8  -эстра-1,3,5(10)-триен-17-она в 50 мл тетрагидрофурана, 15 минут перемешивают, медленно нагревают при температуре раствора от -50oC до 100oC и кипятят с обратным холодильником 2 часа. Для обработки разбавляют уксусным эфиром и водой, отсасывают на целите, дополнительно промывают уксусным эфиром, промывают водой и насыщенным раствором хлористого натрия, сушат над сульфатом натрия, сгущают в вакууме и хроматографируют на силикагеле с гексаном/уксусным эфиром/триэтиламином. Получают 1,3 г 17-дифторметилен-3-тетрагидропиранилокси-8 -эстра-1,3,5(10)-триен-17-она в 50 мл тетрагидрофурана, 15 минут перемешивают, медленно нагревают при температуре раствора от -50oC до 100oC и кипятят с обратным холодильником 2 часа. Для обработки разбавляют уксусным эфиром и водой, отсасывают на целите, дополнительно промывают уксусным эфиром, промывают водой и насыщенным раствором хлористого натрия, сушат над сульфатом натрия, сгущают в вакууме и хроматографируют на силикагеле с гексаном/уксусным эфиром/триэтиламином. Получают 1,3 г 17-дифторметилен-3-тетрагидропиранилокси-8  -эстра-1,3,5 (10)-триена в виде бесцветных кристаллов с точкой плавления 90-91oC [ -эстра-1,3,5 (10)-триена в виде бесцветных кристаллов с точкой плавления 90-91oC [ ]2D2 = -9,2o (c=0,5% в пиридине).
с) 17-дифторметилен-8 ]2D2 = -9,2o (c=0,5% в пиридине).
с) 17-дифторметилен-8  -эстра-1,3,5(10)-триен-3-ол -эстра-1,3,5(10)-триен-3-олСуспензию 1,2 г 17-дифторметилен-3-тетрагидропиранилокси-8  -эстра-1,3,5(10)-триена в 25 мл метанола и 2,5 мл воды кипятят с обратным холодильником с 1,2 мг щавелевой кислоты 0,5 часа при температуре раствора 100oC. Затем сгущают в вакууме, разбавляют уксусным эфиром, промывают водой, раствором бикарбоната натрия и насыщенным раствором хлористого натрия, сушат над сульфатом натрия, сгущают в вакууме и хроматографируют на силикагеле с гексаном/уксусным эфиром. Получают 0,9 г 17- дифторметилен-8 -эстра-1,3,5(10)-триена в 25 мл метанола и 2,5 мл воды кипятят с обратным холодильником с 1,2 мг щавелевой кислоты 0,5 часа при температуре раствора 100oC. Затем сгущают в вакууме, разбавляют уксусным эфиром, промывают водой, раствором бикарбоната натрия и насыщенным раствором хлористого натрия, сушат над сульфатом натрия, сгущают в вакууме и хроматографируют на силикагеле с гексаном/уксусным эфиром. Получают 0,9 г 17- дифторметилен-8  -эстра-1,3,5(10)-триен-3-ола в виде бесцветных кристаллов с точкой плавления 119-120oC [ -эстра-1,3,5(10)-триен-3-ола в виде бесцветных кристаллов с точкой плавления 119-120oC [ ]2D2 =-10,6 (с=0,5% в пиридине).
ПРИМЕР 11 ]2D2 =-10,6 (с=0,5% в пиридине).
ПРИМЕР 1117-дифторметилен-3-метокси-18-метил-эстра-1,3,5(10)-триен Раствор 9,4 г диэтил(дифторметил)фосфоната в 150 мл тетрагидрофурана медленно смешивают при температуре раствора -50oC с 25 мл 2-молярного раствора литийдиизопропиламида и перемешивают 1 час. Затем медленно добавляют раствор 6 г 3-метокси-18-метил-эстра-1,3,5 (10)-триен-17-она в 173 мл тетрагидрофурана, перемешивают 15 минут, медленно нагревают при температуре раствора от -50o до 100oC и кипятят с обратным холодильником 6 часов. Для обработки разбавляют уксусным эфиром, промывают водой и насыщенным раствором хлористого натрия, сушат над сульфатом натрия, сгущают в вакууме и хроматографируют на силикагеле с гексаном/уксусным эфиром. Получают 5,4 г 17-дифторметилен-3-метокси-18- метил-эстра-1,3,5(10)-триена в виде бесцветных кристаллов с точкой плавления 145-146oC [  ]2D2 = +40,2o (с=0,515% в пиридине).
ПРИМЕР 12 ]2D2 = +40,2o (с=0,515% в пиридине).
ПРИМЕР 1217-дифторметилен-18-метил-эстра-1,3,5(10)-триен-3-ол Раствор 5 г 17-дифторметилен-3-метокси-18-метил-эстра-1, 3,5(10)-триена в 95 мл толуола кипятят с обратным холодильником с 95 мл 1,6-молярного раствора диизобутилалюминийгидрида в толуоле 3 часа при температуре раствора 140oC. Затем охлаждают до комнатной температуры, медленно подают на 200 г льда, примешивают к 400 мл 1-молярной серной кислоты, перемешивают 1 час при комнатной температуре, экстрагируют три раза уксусным эфиром, промывают органические фазы водой и насыщенным раствором хлористого натрия, сушат над сульфатом натрия, сгущают в вакууме и хроматографируют на силикагеле с гексаном/уксусным эфиром. Получают 4,5 г 17-дифторметилен-18-метил-эстра-1,3,5(10)-триен-3-ола в виде бесцветных кристаллов с точкой плавления 120-121oC [  ]22D/ = +37,8 (с=0,5% в пиридине). ]22D/ = +37,8 (с=0,5% в пиридине).
Формула изобретения
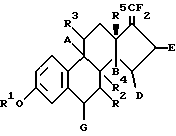 где R1 обозначает атом водорода или С1 – С10 алкил; R5 означает метил или этил; R2 означает атом водорода или С1 – С10 алкил в  – или – или  -положении; -положении;R3 означает атом водорода или С1 – С10 алкокси в  – или – или  -положении; -положении;R4 означает атом водорода в  – или – или  -положении; -положении;А, В, D, E и G означают каждый атом водорода и, в случае необходимости, дополнительно, по меньшей мере, одна из пар заместителей G и R2, R2 и R4, R4 и А, А и R3, D и Е означают двойную связь. 2. 17-Дифторметилен-эстратриены по п.1, общей формулы I, где R1 обозначает атом водорода или С1 – С10-алкил; R5 обозначает метил или этил; А, В, D, E, G, R2 и R3 обозначают каждый атом водорода и R4 обозначает  – или – или  – постоянный атом водорода или R2 с R4, R4 с А, А с R3, D с Е или G с R2 обозначают дополнительную связь, и другие из этих заместителей обозначают каждый атом водорода, или R2 обозначает – постоянный атом водорода или R2 с R4, R4 с А, А с R3, D с Е или G с R2 обозначают дополнительную связь, и другие из этих заместителей обозначают каждый атом водорода, или R2 обозначает  -постоянную группу С1 – С10-алкила, причем в этом случае А, В, D, E, G, R3 и R4 обозначают соответственно атом водорода, или R3 обозначает -постоянную группу С1 – С10-алкила, причем в этом случае А, В, D, E, G, R3 и R4 обозначают соответственно атом водорода, или R3 обозначает  -постоянную группу С1 – С10-алкилокси, причем в этом случае А, В, D, E, G, R2 и R4 обозначают соответственно атом водорода.
3. 17-Дифторметилен-эстратриены по п.1 общей формулы I, где R1 представляет атом водорода.
4. 17-Дифторметилен-эстратриены по п.1 общей формулы I, где R1 представляет группу метила.
5. 17-Дифторметилен-эстратриены по п.1 общей формулы I, где R2 представляет группу метила.
6. 17-Дифторметилен-эстратриены по п.1 общей формулы I, где R3 представляет группу метокси.
7. 17-Дифторметилен-эстратриены по п.1 общей формулы I, где R5 представляет группу метила.
8. 17-Дифторметилен-эстратриены по п.1 общей формулы I, где А, В, D, E, G, R2, R3 и R4 представляют атомы водорода.
9. 17-Дифторметилен-эстратриены по п.1 общей формулы I, где А, В, D, E, R3 и R4 представляют атомы водорода и G с R2 обозначают дополнительную связь.
10. 17-Дифторметилен-эстратриены общей формулы I по п.1, представляющие собой: -постоянную группу С1 – С10-алкилокси, причем в этом случае А, В, D, E, G, R2 и R4 обозначают соответственно атом водорода.
3. 17-Дифторметилен-эстратриены по п.1 общей формулы I, где R1 представляет атом водорода.
4. 17-Дифторметилен-эстратриены по п.1 общей формулы I, где R1 представляет группу метила.
5. 17-Дифторметилен-эстратриены по п.1 общей формулы I, где R2 представляет группу метила.
6. 17-Дифторметилен-эстратриены по п.1 общей формулы I, где R3 представляет группу метокси.
7. 17-Дифторметилен-эстратриены по п.1 общей формулы I, где R5 представляет группу метила.
8. 17-Дифторметилен-эстратриены по п.1 общей формулы I, где А, В, D, E, G, R2, R3 и R4 представляют атомы водорода.
9. 17-Дифторметилен-эстратриены по п.1 общей формулы I, где А, В, D, E, R3 и R4 представляют атомы водорода и G с R2 обозначают дополнительную связь.
10. 17-Дифторметилен-эстратриены общей формулы I по п.1, представляющие собой:17-дифторметилен-эстра-1,3,5(10)-триен-3-ол, 17-дифторметилен-эстра-1,3,5(10),6-тетраен-3-ол, 17-дифторметилен-11  -метокси-эстра-1,3,5(10)-триен-3-ол, -метокси-эстра-1,3,5(10)-триен-3-ол,17-дифторметилен-эстра-1,3,5(10),7-тетраен-3-ол, 17-дифторметилен-эстра-1,3,5(10),8-тетраен-3-ол, 17-дифторметилен-эстра-1,3,5(10),9(11)-тетраен-3-ол, 17-дифторметилен-3-метокси-эстра-1,3,5(10),15-тетраен, 17-дифторметилен-эстра-1,3,5(10),15-тетраен-3-ол, 17-дифторметилен-7  -метил-эстра-1,3,5(10)-триен-3-ол, -метил-эстра-1,3,5(10)-триен-3-ол,17-дифторметилен-8  -эстра-1,3,5(10)-триен-3-ол, -эстра-1,3,5(10)-триен-3-ол,17-дифторметилен-3-метокси-18-метил-эстра-1,3,5(10)-триен, 17-дифторметилен-18-метил-эстра-1,3,5(10)-триен-3-ол. 11. Соединения общей формулы I по п.1, обладающие антиокислительными и сосудозащитными свойствами. 12. Способ получения 17-дифторметилен-эстратриенов общей формулы I по п. 1, отличающийся тем, что 17-кето-соединение общей формулы II 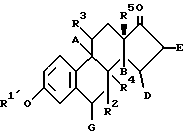 где R1′ обозначает гидроксизащитную группу; А, В, D, E, G, R2, R3, R4 и R5 имеют указанное в формуле I значение, вступают во взаимодействие с окисью дифторметилдефенил-фосфина или с диэтил-(дифторметил)-фосфонатом в присутствии сильного основания в апротонном растворителе при температуре кипения с обратным холодильником 50 – 100oC и затем, в случае необходимости, отщепляют гидроксизащитную группу под действием кислоты. РИСУНКИ
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 14.03.2001
Номер и год публикации бюллетеня: 14-2004
Извещение опубликовано: 20.05.2004
|
||||||||||||||||||||||||||
