Патент на изобретение №2155759
|
||||||||||||||||||||||||||
(54) АМИНОСПИРТЫ АЦЕТИЛЕНОВОГО РЯДА, ОБЛАДАЮЩИЕ ВЫРАЖЕННЫМИ М-ХОЛИНОЛИТИЧЕСКИМИ СВОЙСТВАМИ И СЛАБО УГНЕТАЮЩИЕ ЦЕНТРАЛЬНУЮ НЕРВНУЮ СИСТЕМУ
(57) Реферат: Изобретение относится к химии биологически активных соединений, избирательно блокирующих М-холинореактивные системы и оказывающих слабое угнетающее действие на центральную нервную систему (ЦНС). Описываются новые соединения – гидрохлориды замещенных аминобутинолов общей формулы (1b-1Vb). Вышеуказанные аминоспирты являются активными и малотоксичными центральными М-холинолитиками, которые по активности превосходят известные наиболее эффективные препараты и слабее них угнетают ЦНС. 3 табл. 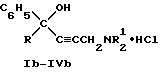 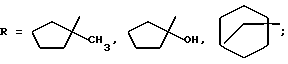 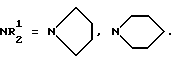
Изобретение относится к области химии биологически активных соединений, в частности к получению соединений, избирательно блокирующих M-холинореактивные системы и оказывающих слабое угнетающее действие на центральную нервную систему (ЦНС). Известно [Кузнецов С. Г. , Голиков С.Н. Синтетические атропиноподобные вещества. – Л., 1962], что соединения, обладающие следующей структурой 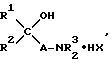 где R1 и R2 – арильные, гетероциклические, циклоалкильные остатки одинаковые или разные; A – полиметиленовая цепь либо цепочка, включающая помимо углеродных атомов также простые и сложные эфирные, карбоксамидные группировки, кратные связи; NR23 – диалкиламиногруппа, в том числе и насыщенный гетероцикл; X – анион подходящей кислоты, проявляют холинолитические свойства. При этом те соединения, где R1 или R2 является циклоалкилом, часто более активны и менее токсичны, чем их диарильные аналоги [Кузнецов С.Г., Голиков С.Н. Синтетические атропиноподобные вещества. – Л. , 1962]. Однако для всех холинолитиков характерно угнетение ими в большей или меньшей степени центральной нервной системы (ЦНС). Задачей настоящего предлагаемого изобретения является попытка получения таких замещенных аминобутинолов, у которых сочеталась бы высокая холинолитическая активность и слабое угнетающее действие на ЦНС. Для этого были разработаны методы синтеза и получены соединения, в которых одним из заместителей R1 или R2 был алициклический радикал, замещенный в положении 1 каким-либо остатком. Холиноблокаторы с такими третичными циклоалкильными радикалами при карбинольном атоме углерода в литературе не известны. Целевые аминобутинолы, в которых один из остатков у карбинольного атома углерода был фенилом, а второй представлял собой третичный циклоалкил, синтезировались путем аминометилирования соответствующим образом замещенных пропинолов по реакции Манниха по схеме: 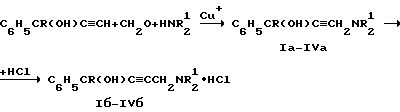 Свойства полученных аминобутинолов и их солей приведены в табл. 1. Результаты изучения холинолитической активности препаратов помещены в табл. 2, данные по угнетению ими ЦНС – в табл. 3; в последние две для сравнения включены дополнительно данные для дифенилзамещенных аминобутинолов V-VI, а также широко известных холиноблокирующих препаратов из группы аминоэфиров и 1,3-аминопропанола – амизила (VII), атропина (VIII) и циклодола (IX). Как следует из табл. 2 и 3, вновь полученные аминоспирты являются активными и малотоксичными центральными M – холинолитиками, которые по активности превосходят известные наиболее эффективные препараты и слабее их угнетают ЦНС. Существенно, что это угнетающее действие проявляется в дозах, превосходящих холинолитические. Приведенные результаты иллюстрируются следующими примерами. 1-Фенил- 1-(1′-метилциклопентил)-4-пирролидино-2-бутин-1-ол(1а). Смесь 0.01 ммоль 1-Фенил-1-(1′-метилциклопентил)-2-пропин-1-ола, 0.01 ммоль пирролидина, 0.012 ммоль параформа, 0.05 г CuCI в 25 мл спирта кипятят в течение 6 часов. Массу по охлаждении выливают на смесь 100 г льда и 5 мл соляной кислоты, промывают суспензию эфиром (30 мл) и нейтрализуют водным аммиаком до отчетливо щелочной реакции раствора. Основание аминоспирта дважды извлекают 15 мл хлороформа, сушат безводным сульфатом магния, растворитель удаляют и твердый остаток очищают кристаллизацией из октана. Выход соединения 1а 85%, т. пл. 121.5-122oC. Гидрохлорид аминоспирта (1б) получают обработкой хлороформного раствора (25 мл) основания спиртовым HCl до кислой реакции на конго. Т. пл. 206-207.7oC (изопропанол). Остальные аминоспирты и их соли получают аналогично (табл. 1). Все синтезированные соединения анализировались на содержание углерода, водорода и азота (основания аминобутинолов) или ионного хлора (гидрохлориды). Результаты анализа совпадают с вычисленными по брутто-формуле. ИК спектры сняты на спектрометре UR-20, призма LiF, кювета толщиной 1 мм с окнами из NaCI. Исследовали растворы в CCl4 с концентрацией 1 – 2%. Температуры плавления определены в приборе Боэтиуса. Формула изобретения
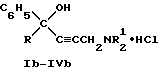 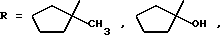  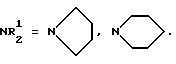 обладающие высокой холинолитической активностью, низкой токсичностью и слабым угнетением центральной нервной системы. РИСУНКИ
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 26.03.2001
Номер и год публикации бюллетеня: 1-2003
Извещение опубликовано: 10.01.2003
|
||||||||||||||||||||||||||
