Патент на изобретение №2155753
|
||||||||||||||||||||||||||
(54) ПРОИЗВОДНЫЕ АМИНО(ТИО)ЭФИРОВ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ
(57) Реферат: Описываются новые производные амино(тио) эфиров формулы (I), где X представляет собой кислород, серу, или, если R0 и R1 вместе не являются алкиленовой цепью с 1-3 атомами, то CH2; Z представляет собой -(CH2)n1-(CHA)n2-(СН2)n3, причем n1 = 0, 1, 2 или 3, n2 = 0 или 1, n3 = 0, 1, 2 или 3, при условии, что n1+n2+n3 < 4; R0 представляет собой водород или A; R1 представляет собой водород, A, OA, фенокси, Ph, OH, F, Cl, Br, CN, CF3, COOH, COOA, ацилокси с 1-4 атомами углерода, карбоксиамидо, или R0 и R1 вместе представляют собой алкиленовую цепь с 1-3 атомами углерода или алкениленовую цепь с 2-3 атомами углерода; R2 представляет собой водород, A, Ac или -CH2-R4, R3 представляет собой -CH2-R4 или -CHA-R4; R4 представляет собой Ph , 2-, 3- или 4-пиридил, незамещенный или монозамещенный R5, тиофен незамещенный, моно- или дизамещенный A, OA, OH, F, Cl, Br, или другой тиенильной группой; R5 представляет собой фенильную группу, которая является незамещенной, или моно-, ди-, три-, тетра-, или пентазамещенной F, CF3, частично или полностью фторированной A, A и/или OA; R6 R7, R8 и R9 каждый независимо представляет собой H, A, OA, фенокси, OH, F, Br, I, CN, CF3, NO2, NH2, Ph, Cl и/или R1 и R6 вместе представляют собой алкиленовую цепь с 3-4 атомами углерода, A представляет собой алкил с 1-6 атомами углерода, Ph представляет собой фенил, незамещенный или замещенный R5, 2-, 3- или 4-пиридилом или феноксильной группой; и физиологически приемлемые соли этих производных. Новые соединения оказывают действие на центральную нервную систему, особенно в качестве агонистов и антагонистов серотонина. Они могут найти применение в качестве активных ингредиентов транквилизаторов, антидепрессантов, нейролептиков и/или гипотензивных средств. Описывается также способ соединений формулы (I), фармацевтическая композиция на их основе и способ получения композиции. 5 с. и 4 з.п.ф-лы, 1 табл. 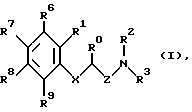
Изобретение относится к новым производным амино(тио)эфиров формулы I 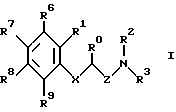 где X представляет собой кислород, серу, сульфинил, сульфонил или, если R0 и R1 вместе не являются алкиленовой цепью с 1 – 3 атомами, то CH2: Z представляет собой -(CH2)n1-(CHA)n2-(CH2)n3, причем n1 = 0, 1, 2 или 3, n2 = 0 или 1, n3 = 0, 1, 3 или 3, при условии, что n1 + n2 + n3 < 4; R0 представляет собой водород или A; R1 представляет собой водород, A, OA, фенокси, Ph, OH, F, Cl, Br, CN, CF3, COOH, COOA, ацилокси с 1-4 атомами углерода, карбоксиамидо, -CHNH2, -CH2NHA, -CH2NA2, -CH2NHAc, -CH2NHSO2CH3, или R0 и R1 вместе представляют собой алкиленовую цепь с 1 – 3 атомами углерода или алкениленовую цепь с 2 – 3 атомами углерода; R2 представляет собой водород, A, Ac или -CH2-R4; R3 представляет собой -CH2-R4, или -CHA-R4; R4 представляет собой Ph, 2-, 3- или 4-пиридил (незамещенный или монозамещенный R5), или тиофен (незамещенный, моно- или дизамещенный A, OA, OH, F, Cl, Br, CN и/или CF3, или другой тиенильный группой); R5 представляет собой фенильную группу, которая является незамещенной, или моно-, ди-, три-, тетра-, или пентазамещенной F, CF3, частично или полностью фторированной A, A и/или OA; R6, R7, R8 и R9 каждый независимо представляет собой H, A, OA, фенокси, OH, F, Cl, Br, I, CN, CF3 , NO2, NH2, NHA, NA2, Ac, Ph, циклоалкил c 3-7 атомами углерода, -CH2NH2, -CH2NHA, -CH2NA2, -CH2N HAC или -CH2NHSO2CH3 или два ближайших остатка вместе представляют собой алкиленовую цепь с 3-4 атомами углерода, и/или R1 и R6вместе предлставляют собой цепь с 3-4 атомами углерода; A представляет собой алкил с 1-6 атомами углерода; Ac представляет собой алканоил с 1-10 атомами углерода или ароил с 7 – 11 атомами углерода; Ph представляет собой фенил (незамещенный или замещенный R5, 2-, 3- или 4-пиридилом или феноксильной группой); и физиологически приемлемые соли их производных. Целью настоящего изобретения являются новые производные амино(тио)эфиры, обладающие ценными фармакологическими свойствами и которые можно использовать для приготовления лекарственных препаратов. Обнаружено, что соединения формулы 1 и их биологически совместимые кислые соли, являющиеся продуктами присоединения, обладают ценными фармакологическими свойствами. В частности, они оказывают действие на центральную нервную систему, особенно в качестве агонистов и антагонистов серотонина. Эти соединения препятствуют связыванию меченных тритием серотониновых лиганд с рецепторами гиппокампа (Cossery et al., European J. Pharmacol. 140 (1987), 143-155). Эти соединения изменяют также накопление 3-4-гидроксифенилаланина в corpus, striatum (полосатое тело) и накопление 5-НТР в сращениях ядер (Seyfried et al., European J. Pharmacol. 160 (1989), 31-41). Они оказывают также анальгезирующее и гипотензивное действие: например, у крыс, которым введен катетер и у которых постоянное спонтанно повышенное артериальное давление (SHR /Okamoto/ NIO-MO-CHB- Kisslegg; способ: см. Weeks and Jones, Proc. Soc. Exptl. Biol. Med. 104 (1960), 646-648), непосредственно измеряемое кровяное давление снижалось после перорального приема соединений. Они применимы также для профилактики и лечения последствий церебрального инфаркта (Apoplexia cerebri), например ударов и церебральной ишемии. Эти соединения можно использовать для лечения заболеваний, которые связаны с вмешательствами в серотонинэргическую и допаминэргическую системы, и которые связаны с рецепторами, сходными с рецепторами 5-гидрокситриптамина (тип 5HTIA) и/или допамина (тип D 2). Данные соединения пригодны для лечения нарушений центральной нервной системы, таких как беспокойство, напряженное состояние и депрессии, сексуальные расстройства, вызванные нарушениями центральной нервной системы, нарушения сна или абсорбции пищи. Более того, эти соединения можно использовать для устранения различных видов умственной неполноценности, для улучшения способности к учению и памяти, а также для лечения болезни Альцгеймера. Эти соединения можно применять при психозе (шизофрении). Таким образом, соединения формулы I и их биологически совместимые кислые соли, являющиеся продуктами присоединения, могут применяться в качестве активных ингредиентов транквилизаторов, антидепрессантов, нейролептиков и/или гипотензивных средств, а также в качестве промежуточных соединений для получения других фармацевтически-активных ингредиентов. Настоящее изобретение относится к производным амино(тио)эфиров формулы I и их биологически совместимым кислым солям, являющимся продуктами присоединения. Радикал А представляет собой алкил с 1, 2, 3, 4, 5 или 6 атомами углерода, особенно с 1-2 атомами углерода, предпочтительно метил, а также этил, n-пропил, изопропил, n-бутил, изобутил, втор-бутил или трет-бутил. ОА представляет собой предпочтительно метокси, а также этокси, n-пропокси, изопропокси, n-бутокси, изобутокси, втор-бутокси или трет-бутокси, NHA представляет собой предпочтительно метиламино, а также этиламино, n-пропиламино, изопропиламино, n-бутиламино, изобутиламино, втор-бутиламино или трет-бутиламино. NA2 представляет собой предпочтительно диметиламино, а также N-этил-N-метиламино, диэтиламино, -n-пропиламино, диизопропиламино или ди-n-бутиламино. Ac представляет собой предпочтительно алканоил с 1-6 атомами углерода, в частности с 1, 2, 3 или 4 атомами углерода, предпочтительно формил или ацетил, и, далее (предпочтительно) пропионил, бутирил, изобутирил, пентаноил или гексаноил, а также предпочтительно бензоил, о- m- или p-толуил, 1- или 2-нафтоил. X представляет собой предпочтительно кислород или серу, а Z представляет собой, главным образом, -CH2, -(CH2)2-, -(CH2)3-, -(CHCH3)-, а также предпочтительно -CH2– (CHCH3), -(CH2)2-(CHCH3), -CH2-(CHCH3)-CH2– или -(CHCH3)-(CH2)2. Остаток R0 представляет собой предпочтительно H или метил, но R0 и R1 вместе представляют собой алкиленовую цепь, предпочтительно состоящую из 2 атомов углерода. Если R1 имеет иное значение, помимо вышеуказанного, то он представляет собой предпочтительно водород, A, OA, CONH2 или CN. R2 представляет собой предпочтительно H или A, а R3 представляет собой предпочтительно 2-, 3- или 4-пиридилметил или фенил, замещенный другим фенилом, или, далее, R3 представляет собой тиенил, предпочтительно замещенный другой тиенильной группой. Радикал R3 имеет значение, главным образом, 2, 3 или 4-пиридилметил, 5-фенил-3-пиридилметил, 3-бифенилметил, 5-(фторфенил)-3-пиридилметил, 5-(метоксифенил)-3-пиридилметил, 4′-фтор-3-бифенилметил, или 4-(тиенил)-2-тиенилметил. Далее, радикал R3 предпочтительно имеет значение 2, 4, 5 или 6-(m-фторфенил)-3-пиридилметил, 3, 4, 5 или 6-(m-фторфенил)-2-пиридилметил или 2 или 3-(m-фторфенил)-4-пиридилметил, где вместо “m” стоят префиксы “моно-“, “ди-“, “три-“, “тетра” или “пента”. R6, R7, R8 и R9 независимо, имеют предпочтительные значения H, A, OA, Cl, CN или CF3. Далее, R1 и R6 предпочтительно вместе представляют собой алкиленовую цепь с 4 атомами углерода. Далее, еще одно предпочтительное значение: два соседних остатка, выбранных из R6, R7, R8 и R9, вместе представляют собой алкиленовую цепь с 3-4 атомами углерода. Изобретение относится, в частности, к таким соединениям формулы I, в которых по меньшей мере один из указанных радикалов имеет одно из вышеуказанных значений, особенно из числа предпочтительных значений. Некоторые предпочтительные группы соединений могут быть выражены приведенными ниже частичными формулами с Ia по Ii, которые соответствуют формуле I и в которых радикалы и остальные параметры, соответствуют радикалам и параметрам формулы I, за исключением следующих: в Ia X представляет совой кислород, R0 и R1 вместе представляют собой -(CH2)2, Z представляет собой метилен, а R6, R7, R8 и R9 представляют собой водород; в Ib X представляет собой кислород, R0 и R1 вместе представляют собой -(CH2)2-, Z представляет собой метилен, а R4 представляет собой пиридил или бифенил, незамещенный или монозамещенный; в Ic X представляет собой кислород, R0 и R1 вместе представляют собой -(CH2)2-, Z представляет собой метилен, a R4 представляет собой 5-(4-фторфенил)-3-пиридил; в Id X представляет собой кислород, R0 и R1 вместе представляют собой метилен, а R4 представляет собой 5-(4-фторфенил)-3-пиридил; в Ie X представляет собой кислород, R0 представляет собой водород, Z представляет собой метилен, а R4 представляет собой 5-(4-фторфенил)-3-пиридил; в If X представляет собой кислород, R0 и R1 представляют собой водород, Z представляет собой метилен, а R4 представляет собой 5-(4-фторфеинл)-3-пиридил; в Ig, X представляет собой кислород, R0 представляет собой водород, R1 представляет собой хлор, этил или метокси, Z представляет собой метилен, a R4 представляет собой 5-(4-фторфенил)-3-пиридил; в Ih X представляет собой кислород, Z представляет собой метилен, а R4 представляет собой 5-фенил-3-пиридил; в Ii X представляет собой кислород, Z представляет собой -(CH2)2-, -(CH) – или -(CHCH3)-, а R4 представляет собой 5-(4-фторфенил)-3-пиридил; а также соли этих соединений. Наиболее предпочитаемыми соединениями являются соединения, имеющие частичную формулу Ik и Iak – Iik, которые соответствуют частичным формулам I, а также Ia – Ii, но в которых дополнительно: X представляет собой серу, сульфинил или сульфонил. Настоящее изобретение относится также к способу получения производных имино(тио)эфиров формулы I и их солей и заключается в том, что соединение формулы II 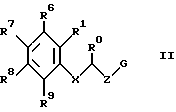 где G представляет собой Cl, Br, I, OH или OH-группа, функционально модифицированная до образования химически активной группы, особенно удаляемой группы, а радикалы R0, R1, R6, R7, R8, R9, X и Z имеют вышеуказанные значения, взаимодействуют с амином формулы III HNR2R3 где R2 и R3 имеют вышеуказанные значения, или тем, что соединения формулы IV 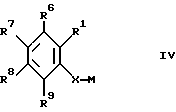 где M представляет собой H, Li+, Na+, K+, NH4+ или другой подходящий ион металла, а X, R1, R6, R7, R8 и R9 имеют вышеуказанные значения, взаимодействуют с соединением формулы V 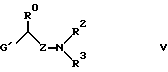 где G’ имеет те же значения, что G, а R0, R2, R3 и Z имеют вышеуказанные значения, или тем, что соединение формулы VI 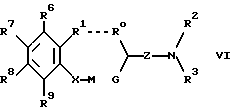 где R0 и R1 вместе представляют собой алкиленовую цепь с 1-3 атомами углерода, а R2, R3, R6, R7, R8, R9, X, Z, M и G имеют значения, указанные выше, подвергают реакции циклизации до образования аминоэфирного или аминотиоэфирного производного формулы I, или тем, что соединение формулы I, за исключением тех соединений формулы I, в которых один или более атомов водорода замещены одной или более восстанавливаемой групп и/или одной или более дополнительными связями C-C и/или C-N, обрабатывают восстановителем, или тем, что соединение формулы I, за исключением тех соединений формулы I, в которых один или более атомов водорода заменены одной или более группами, способными вступать в реакцию сольволиза, обрабатывают реагентом, вызывающим реакцию сольволиза и/или тем, что группа OA может быть расщеплена до образования группы OH, и/или тем, что группа Ar преобразована в другую группу Ar, и/или тем, что полученное основание или кислота формулы I преобразуется в одну из своих солей после обработки кислотой или основанием. Соединение формулы I можно получить также другими известными способами, такими как описанные в литературе способы (например, в таких работах, как Houben-Weyl, Methoden der Organischen Chemie (Methods of Organic Chemistry), Georg-Thieme-Verlag, Stuttgart; Organic Reactions, John Wiley & Sons, Inc, New York), а именно с использованием таких условий проведения реакции, которые известны и пригодны для указанных реакций. Возможно также использование других известных вариантов. При желании исходные материалы для способа по изобретению могут быть получены на месте, при этом их не выделяют из реакционной среды, но сразу проводят дальнейшие реакции до получения соединений формулы I. В производных формулы II G представляет собой предпочтительно Cl или Br, но может представлять собой также I, ОН или OH-группу, функционально модифицированную до получения химически активной группы, особенно алкилсульфонилокси с 1-6 атомами углерода (например, метансульфонилокси) или арилсульфонилокси с 6-10 атомами углерода (например, бензолсульфонилокси, р-толуолсульфонилокси, нафталин-1 или 2-сульфонилокси). Некоторые из соединений формулы II и, в частности, формулы III, являются известными; неизвестные соединения формул II и III можно легко получить теми же способами, что и известные соединения этих формул. Первичные спирты формулы II можно получить, например, путем восстановления соответствующих карбоновых кислот или сложных эфиров. Обработка тионилхлоридом, бромистым водородом, трехбромистым фосфором или аналогичным галогенным соединением дает соответствующие галогениды соединений формулы II. Соответствующие сульфонилоксильные соединения можно получить из спиртов формулы II путем взаимодействия с соответствующими сульфонилхлоридами. Соединения йода формулы 7 можно получить, например, путем взаимодействия йодида калия с соответствующими эфирами р-толуолсульфокислоты. Большинство производных аминов формулы III являются известными и могут быть получены, например, путем алкилирования или ацилирования известных аминов. Взаимодействие соединений формул II и III производится способами, известными из литературы по алкилированию аминов. Компоненты можно расплавлять вместе при отсутствии растворителя, в запечатанной пробирке или, при необходимости, в автоклаве. Но можно производить взаимодействие соединений и в присутствии инертного растворителя. В числе примеров подходящих растворителей – углеводороды, такие как бензол, толуол или ксилол; кетоны, такие как ацетон или бутанон, спирты, такие как метанол, этанол, изопропанол или n-бутанол; простые эфиры, такие как тетрагидрофуран (THF) или диоксан амиды, такие как диметилформамид (DMF) или N-метил-пирролидон, или нитрилы, такие как ацетонитрил или другие, смеси этих растворителей друг с другом или с водой. Иногда желательно добавить реагент, связывающей кислоты, например гидроксид щелочного металла или щелочно-земельного металла, карбонат или бикарбонат, или другую соль щелочного или щелочно-земельного металла слабой кислоты, предпочтительно калиевую, натриевую или кальциевую соль, или добавить органическое основание такое как триэтиламин, диметиланилин, пиридин или хитолин, или аминный компонент в избыточном количестве. Время протекания реакции – от нескольких минут до 14 дней, в зависимости от выбранных условий, а температура реакции – от около 0 до 150o, обычно от 20 до 130o. Можно получить соединение формулы I путем взаимодействия соединения формулы IV с соединением формулы G’ (CHR0)-Z -NR2R3 (V). Некоторые из соединений формулы V и, в особенности, формулы IV, являются известными; неизвестные соединения можно легко получить теми же способами, что и известные. Так, соединения формулы IV можно легко получить путем реакции метилирования фенола или тиофенола с, например, гидридами, такими как NaH, KH, или с фениллитием или метиллитием. Соединение типа соединения формулы IV можно получить также путем окисления тиофенолов до получения сульфинильных или сульфонильных соединений. Амины формулы V можно получить, используя в качестве исходного соединения первичный амин, с помощью различных известных способов алкилирования или ацилирования аминов. Можно также превратить соответствующее замещенное нитро-соединение в амины формулы V путем восстановления с последующим алкилированием. Взаимодействие соединений IV и V осуществляется с помощью способов, известных из литературы по образованию простых эфиров, тиоэфиров или сложных эфиров. Компоненты можно расплавлять один с другим вместе непосредственно, без растворителя, в закрытой должным образом пробирке или в автоклаве, при нормальном или повышенном давлении, причем для повышения давления может быть добавлен инертный газ, такой как N2. Но можно осуществлять взаимодействие соединений и в присутствии инертного растворителя. Подходящими являются растворители, указанные выше для реакций соединений II с соединениями III. Положительный эффект может дать добавка реагента, связывающего кислоты. Подходящими являются те же основания, которые перечислены для реакций соединений II с соединениями III. В зависимости от выбранных реакционных условий оптимальное время реакции – от нескольких минут до 14 дней, а температура реакции может быть от около 0 до 150o, обычно от 20 до 130o. Далее, соединение формулы I можно получить путем циклизации соединения формулы VI, где R0 и R1 вместе представляют собой алкиленовую цепь с 1-3 атомами углерода. Соединения формулы VI можно получить, например, путем восстановления кетонов, аналогичных соединению VI, где CHG-группа заменена карбонильной группой. Реакция циклизации соединения формулы VI производится способами, описанными выше для взаимодействия соединений IV и V и при аналогичных условиях. Соединение формулы I можно получить также путем обработки исходного вещества, в котором атомы водорода замещены одной или более восстанавливаемой группами и/или одной или более дополнительными связями C-C и/или C-N, с восстановителем, предпочтительно при температурах от -80 до +250o, в присутствии по меньшей мере одного инертного растворителя. Восстанавливаемыми группами (группами, которые могут быть замещены водородом) являются, в частности, кислород в карбонильной группе, гидроксил, арилсульфонилокси (например, р-толуолсульфонилокси), N-бензолсульфонил, N-бензил или O-бензил. В принципе, соединения, содержащие только одну из вышеуказанных групп или дополнительных связей, или соединения, содержащие две или более из вышеуказанных или дополнительных связей, соседствующих одна с другой, можно преобразовать в соединение формулы I путем восстановления, причем одновременно можно восстановить заместители в группе Ind, которые присутствуют в исходном соединении. Это проводят, например, используя выделяющийся водород или сложные гидриды металлов, или с помощью реакции восстановления Вольфа-Кишнера, или при восстановлении газообразным водородом при использовании переходного металла в качестве катализатора. Предпочтительными исходными материалами для реакции восстановления являются соединения формулы VII 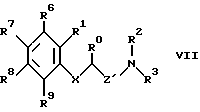 где Z’ представляет собой цепь, соответствующую радикалу Z, за исключением того, что одна или более групп -CH2 замещена группой -CO- и/или один или более атомов водорода замещен Cl, Br, F, SH или OH. Соединения формулы VII можно получить путем амидирования кислот, галогенангидридов, ангидридов или сложных эфиров первичными или вторичными аминами. Предпочтительно производить взаимодействие свободной карбоновой кислоты с амином в условиях, применяемых для синтеза пептидов. Такую реакцию предпочтительно проводят в присутствии осушителя, например карбодиимида, такого как дициклогексилкарбодиимид или N-(3-диметиламинопропил)-N-этилкарбодиимид, или пропанфосфоновый ангидрид (см. Angew Chem. 92, 129 (1980)), дифенилфосфорилазида или 2-этокси-N-этоксикарбонил-1,2-дигидрохинолин, в инертном растворителе, например галогенизированном углеводороде, таком как метиленхлорид, сложном эфире, например тетрагидрофуране или диоксане, в амиде, например диметилформамиде или диметилацетамиде, или нитриле, таком как ацетонитрил, при температурах от около -10o до 40oC, предпочтительно от 0o до 30oC. Выделяющийся водород используют в качестве восстановителя; это можно производить, например, путем обработки металлов слабыми кислотами или основаниями. Можно, например, использовать смесь цинка с раствором гидроокиси щелочного металла или смесь железа с уксусной кислотой. Можно также использовать натрий или другой щелочной металл в спирте, таком как этанол, изопропанол, бутанол, амил или изоамил или фенол. Можно также использовать алюминиево-никелевый сплав в водно-щелочном растворителе, причем при необходимости в него добавляют этанол. Для получения выделяющегося водорода можно использовать также натриевую или алюминиевую амальгаму в водно-спиртовом или водном растворе. Реакция может производиться также в гетерогенной фазе, и в этом случае удобно использовать водную фазу и бензольную или толуольную фазы. Другими восстановителями, которые являются предпочтительными согласно настоящему изобретению, являются сложные гидриды металлов, такие как LiAlH4, NaBH4, гидрид диизобутилалюминия или NaAl (OCH2CH2OCH2)2H2, а также диборан, причем при желании могут быть добавлены такие катализаторы, как BF3, AlCl3 или LiBr. В числе растворителей, подходящих в данном случае, эфиры, такие как диэтиловый эфир, ди-n-бутиловый эфир, тетрагидрофуран, диоксан, диглим или 1,2-диметоксиэтан, а также углеводороды, такие как бензол. Для восстановления с помощью NaBF4 используют в качестве растворителей первичные спирты, такие как метанол или этанол, а также воду и водные растворы спиртов. Восстановление этими способами предпочтительно проводят при температурах от -80 до +150 градусов, особенно от около 0 до около 100 градусов. Восстановление групп -CO в амидах кислот (например, формулы VI, где Z’ представляет собой группу -(CH2)n1-(CHA)n2-CO), до групп CH2 предпочтительно производить с использованием LiAlH4 в тетрагидрофуране при температурах от около 0o до 66oC. Можно также восстановить одну или более карбонильных групп до CH2 способом Вольфа-Кишнера, например обработкой безводным гидразином в абсолютном этаноле под давлением при температурах от около 150o до 250oC. В качестве катализатора предпочтительно использовать алкоголят натрия. Восстановление можно производить и по способу Хуанга-Минлона путем взаимодействия с гидразингидратом в высококипящем водорастворимом растворителе, таком как диэтиленгликоль или триэтиленгликоль, в присутствия щелочи, например гидроокиси натрия. Реакционную смесь обычно кипятят в течение около 3-4 часов. Затем воду отгоняют и образовавшийся гидразон разлагают при температурах до около 200oC, реакцию восстановления Вольфа-Кишнера можно также проводить с гидразином в диметилсульфоксиде при комнатной температуре. Более того, определенные реакции восстановления можно производить с использованием газообразного H2 в присутствии переходных металлов в качестве катализатора, например скелетного никелевого катализатора гидрирования или Pd. В этом случае, например, Cl, Br, I, SH, или в отдельных случаях даже OH-группы могут быть замещены водородом. Нитрогруппы также можно превратить в группы NH2 путем каталитического гидрирования с Pd/H2 в метаноле. Соединения, имеющие формулу I, за исключением тех соединений, в которых одни или более атомов H замещены одной или более группами, вступающими в реакцию сольволиза, могут быть подвергнуты реакции сольволиза, особенно гидролиза, до получения соединений формулы I. Исходные материалы для сольволиза можно получить, например, путем взаимодействия соединений формулы III с соединениями, имеющими формулу II, за исключением соединений, в которых один или более атомов H замещены одной или более группами, вступающими в реакцию сольволиза. Так, в частности, производные 1-ациламина, имеющие формулу I, за исключением соединений, содержащих в 1 позиции радикала ацильную группу, предпочтительно алканоил, алкилсульфонил или арилсульфонил с максимум 10 атомами углерода в каждом случае, такие как метансульфонил, бензолсульфонил или р-толуолсульфонил, можно подвергнуть гидролизу до получения соответствующих производных вторичных аминов, например, в кислой или (предпочтительно) нейтральной или щелочной среде при температурах от 0 до 200 градусов. В качестве основания используют гидроокись натрия, калия или кальция, карбонат натрия или калия или аммиак. В числе растворителей предпочтительна вода; низшие спирты, такие как метанол или этанол; сложные эфиры, такие как тетрагидрофуран или диоксан; сульфоны, такие как тетраметиленсульфон или их смеси, особенно смеси, содержащие воду. Гидролиз можно производить также просто водой, особенно при температуре кипения. Соединение формулы I можно далее преобразовать в другое соединение формулы I с помощью известных способов. Соединения формулы I, в которых, например, радикал R2 представляет собой водород, можно преобразовать в соединения с трет-аминогруппами путем алкилирования или ацилирования остатка, состоящего из вторичного амина, в мертвом растворителе, например в галогенизированном углеводороде, таком как метиленхлорид, в эфире, таком как тетрагидрофуран или диоксан, в амиде, таком как диметилформамид или диметилацетамид, или нитриле, таком как ацетонитрил, при температурах от около -10 до температуры кипения растворителя, предпочтительно от 0 до 70 градусов. Более того, другие первичные аминогруппы можно превратить во вторичные аминогруппы или третичные аминогруппы с помощью известных реакций алкилирования. Соединения формулы I можно превратить также в другие производные формулы I путем трансформации радикала Ar. Сложные эфиры формулы I, в которых радикал Ph моно- или дизамещен O-алкилом, можно расщепить до образования соответствующих гидроксильных производных. Можно, например, расщеплять эфиры обработкой комплексом диметилсульфид-трибромид бора, например в толуоле, эфирах, таких как тетрагидрофуран или диметилсульфоксид, или путем расплавления с пиридином или анилингалоидводородами, предпочтительно пиридингидрохлоридом, при температурах около 150-250 градусов. Если необходимо исключить побочные реакции соединения формулы I, то радикалы Ph можно хлорировать, бромировать или алкилировать в условиях реакций Фриделя-Крафтса, путем взаимодействия с соответствующим галогеном или алкилхлоридом или алкилбромидом в присутствии кислот Льюиса в качестве катализатора, таких как AlCl3, FeBr3 или Fe, при температурах от 30o до 150oC, желательно от 50o до 150oC в инертном растворителе, например в углеводородах, тетрагидрофуране или четыреххлористом углероде, при этом соединение формулы I будет получено в качестве производного. Кроме того, с помощью известных реакций возможно провести восстановление нитрогруппы до аминогруппы. Соединения формулы I могут иметь одни или более центров асимметрии. Таким образом, эти соединения можно получить в виде рацематов или в оптически-активной форме, если используют оптически-активные исходные материалы. При синтезе соединения, обладающие двумя или более центрами асимметрии, обычно получают в виде рацемических смесей, из которых можно выделить отдельные рацематы в чистом виде, например, с помощью перекристаллизации из инертных растворителей. При желании полученные рацематы химически или путем кристаллизации конгломератов расщепляют известными способами, получая оптические антиподы. В предпочтительном варианте изобретения диастереоизомеры образуются из рацемата путем взаимодействия с оптически-активным расщепляющим агентом. В качестве расщепляющего агента используют оптически-активные кислоты, такие как D- и L-формы защищенных производных аминокислот, например тозилпролин, винная кислота, дибензоилвинная кислота, диацетилвинная кислота, камфор-сульфоновая кислота, миндальная кислота, яблочная кислота, или молочная кислота. Различные формы диастереоизомеров расщепляют известным способом, например фракционированной кристаллизацией, а оптически-активные соединения формулы I высвобождают из диастереоизомеров известным способом. Основание формулы I можно с помощью кислоты преобразовать в соответствующую кислую соль. Для этой реакции пригодны кислоты, которые дают биологически совместимые соли. Можно использовать неорганические кислоты, например серную кислоту, галоидводородные кислоты, например хлористо-водородную кислоту или бромисто-водородную кислоту, фосфорные кислоты, например ортофосфорную кислоту, азотную кислоту и сульфаминовую кислоту, а также органические кислоты, а конкретно алифатические ациклические аралифатические, ароматические или гетероциклические моноосновные или полиосновные карбоновые, сульфоновые и серные кислоты, такие как муравьиная кислота, уксусная кислота, пропионовая кислота, пивалиновая кислота, диэтилуксусная кислота, малоновая кислота, янтарная кислота, пимелиновая кислота, фумаровая кислота, малеиновая кислота, молочная кислота, винная кислота, яблочная кислота, бензойная кислота, салициловая кислота, 2-фенилпропионовая кислота, лимонная кислота, глюконовая кислота, аскорбиновая кислота, никотиновая кислота, изоникотиновая кислота, метансульфоновая кислота, или этансульфоновая кислота, этандисульфоновая кислота, 2-гидроксиэтансульфоновая кислота, бензолсульфоновая кислота, р-толуолсульфоновая кислота, нафталинмоносулфоновая кислота и нафталиндисульфоновая кислота, а также лаурилсерная кислота. При желании свободные основания формулы I можно получить из солей этих соединений путем обработки сильными основаниями, такими как гидроокись натрия или калия, или карбонат натрия или калия, при условии, что в молекуле нет других кислотных групп. В тех случаях, когда соединения формулы I имеют свободные кислотные группы с помощью обработки основаниями их можно перевести в соответствующее основание. Подходящими основаниями являются гидроокиси щелочных металлов, гидроокиси щелочно-земельных металлов или органические основания в виде первичных, вторичных или третичных аминов. Далее, настоящее изобретение относится к использованию соединений формулы I и биологически совместимых солей этих соединений для производства фармацевтических препаратов, особенно нехимическим путем. Для этого эти соединения можно разделять на подходящие дозы и соединить по меньшей мере с одним наполнителем или, при необходимости, вспомогательным средством; в комбинации с одним или более дополнительным активным ингредиентом. Далее, настоящее изобретение относится также к композициям, особенно фармацевтическим препаратам, содержащим по меньшей мере одно соединение формулы I и/или одну из биологически совместимых солей этих соединений. Эти препараты можно использовать в качестве лекарств для медицинских и ветеринарных целей. В качестве наполнителей могут выступать органические или неорганические вещества, пригодные для внутреннего (например, перорального) парентерального или местного назначения, и которые не вступают в реакции с новыми соединениями; примерами таких наполнителей являются вода, растительные масла, бензиловые спирты, полиэтиленгликоли, желатин, углеводороды, такие как лактоза или крахмал, стеарат магния, тальк и вазелин. Таблетки, таблетки в облатках, капсулы, сиропы, соки, капли и свечи используются для парентерального введения, растворы, предпочтительно масляные или водные, а также суспензии, эмульсии или имплантанты используются для парентерального введения, а мази, кремы и порошки используются для местного назначения. Новые соединения можно также лиофилизировать и полученные лиофилизаты можно использовать, например, для производства препаратов для инъекций. Указанные препараты можно стерилизовать и/или они могут содержать вспомогательные средства, такие как смазывающие вещества, консерванты, стабилизаторы и/или смачивающие вещества, эмульгаторы, соли, влияющие на осмотическое давление, буферные вещества, красители, вкусовые добавки и/или ароматизаторы. При желании они могут содержать также один или более дополнительный активный ингредиент, например один или более витамин. Соединения формулы I и их биологически совместимые соли можно использовать для лечения людей или животных и для борьбы с заболеваниями. Данные соединения пригодны для лечения нарушений центральной нервной системы, также как беспокойство, напряженное состояние и депрессия и/или психозы, а также побочных воздействий лечений гипертензии (например, с помощью аметилдопа). Эти соединения можно применять также в эндокринологии и гинекологии, например для лечения акромегалии, гипогонадизма, вторичной аменореи, предменструального синдрома и нежелательной пуэперальной лактации, а также для профилактики и лечения церебральных нарушений (например, мигреней), особенно в гериатрии, аналогично определенным эрготалкалоидам, и для лечения последствий церебрального инфаркта (Apoplexia cerebri), таких как удар и церебральная ишемия. Далее, соединения по изобретению пригодны для устранения умственной неполноценности, для улучшения способностей к учению и памяти, а также для лечения болезни Альцгеймера. При лечении указанных заболеваний вещества формулы I по изобретению обычно назначают так же, как известные выпускаемые промышленностью препараты (например, бромокриптин, дигидроэргокорнин), предпочтительно в дозировках от около 0,2 до 500 мг, особенно от 0,2 до 50 мг на дозу. Предпочтительная дневная доза составляет от 0,001 до 10 мг/кг массы тела. Низкие дозировки (от около 0,2 до 1 мг на дозу; от около 0,001 до 0,005 мг/кг массы тела) особенно подходят для препаратов от мигрени; дозировки от 10 до 50 мг на дозу предпочтительны для других случаев. Однако конкретная доза для каждого индивидуального пациента зависит от большого числа различных факторов, например от активности конкретного используемого соединения, возраста, массы тела, общего состояния здоровья, пола, диеты, времени и способа введения, скорости выведения и тяжести заболевания, при котором применяется данная терапия. Предпочтительным является пероральное введение. В приведенных ниже примерах термин “обычная обработка” означает следующее: при необходимости добавляют воду, проводят экстрагирование метиленхоридом, органическую фазу отделяют, высушивают сульфатом натрия и фильтруют, фильтрат выпаривают и остаток очищают хроматографией на силикагеле и/или кристаллизацией. Температуры указаны в градусах Цельсия. ПРИМЕР 1 Раствор 2,8 г 2-аминометил-хромана, который можно получить путем взаимодействия 3-(2-гидроксифенил)-пропанола с KCN с последующим каталитическим восстановлением 2-цианохроманом и 2,2 г 3-(хлорметил)-пиридина в 250 мл диметилформамида перемешивают вместе с 1 г N-метил-морфолина в течение 12 часов при 20oC и подвергают обычной обработке до получения N-(3-пиридилметил)-N- (2-хроманил-метил)-амина. После перемешивания с 0,5 частями малеиновой кислоты в 100 мл этанола получают малеат, температура плавления которого 163-164oC. Нижеследующие соединения получают аналогичным способом: из 2-аминометил-хромана и 3-(хлорметил)-5-(4-метоксифенил)- пиридина получают N-[5-(4-метоксифенил)-3-пиридилметил] -N- (2-хроманилметил)-амина малеат, температура плавления 177-178 градусов; из 2-аминометил-хромана и 3-(хлорметил)-5-фенилпиридина получили N-(5-фенил-3-пиридилметил)-N-(2-хроманилметил)-амина малеат, температура плавления 184 градуса; из 2-аминоэтил-хромана и 3-(хлорметил)-бифенила получили N-3-бифенилэтил-N-(2-хроманилметил)-амина малеат, температура плавления 162 градуса; из 2-аминометил-6-фенил-хромана и 3-(хлорметил)-5-(4-фтор-фенил)-пиридина получают N-[5-(4-фторфенил)-3-пиридилметил] -N-(6-фенил-2-хроманилметил)-амина малеат, температура плавления 222-224oC; из 2-аминометил-хромана и 3-(хлорметил)-5-(4-фторфенил)- пиридина получают N-[5-(4-фторфенил)-3-пиридилметил]-N- (2-хроманилметил)-амина малеат, температура плавления 182-183oC; из 2-аминометил-хромана и 3-(хлорметил)-бифенила получают N-3-бифенилметил-N-(2-хлорманилметил)-амина малеат, температура плавления 174-175oC; из 2-аминометил-хромана и 3-(xлopметил)-4′-фторбифенила получают N-(4′-фтop-3-бифенилметил)-N-(2-xpoманилметил)-амина малеат, температура плавления 183-184oC; из 2-аминометил-8-метоксихромана и 3-(хлорметил)-5-(4-фторфенил)-пиридина получают N-[5-(4-фторфенил) -3-пиридилметил]-N-[(8-метокси -2-хроманил)метил]- амина малеат, температура плавления 160-165oC; из 2-аминометил-7-метоксихоромана и 3-(хлорметил)-5-(4-фторфенил)-пиридина получают N-[5-(4-фторфенил) -3-пиридилметил] -N-(7-метокси-2 -хроманил)метил]-амина малеат, температура 170,5-172oC; из 2-аминометил-6-метоксихромана и 3-(хлорметил)-5-(4-фторфенил)-пиридина получают N-[5-(4-фторфенил)-3-пиридиметил] -N-[(6-метоксихроман-2-ил) метил]-амина малеат; из 2-аминометил-5-метоксихромана и 3-(хлорметил)-5-(4-фторфенил) -пиридина получают N-[5-(4-фторфенил) -3-пиридилметил]-N- [(5-метоксихроман-2-ил)метил]-амина малеат, температура плавления 181-183oC; из 2-аминометил-8-нитрохромана и 3-(хлорметил)-5-(4-фторфенил)-пиридина получают N-[5-(4-фторфенил) -3-пиридилметил]- N-[(8-нитрохроман-2 -ил)метил] -амина малеат; из 2-aминометил-2,3,4,5-тетрагидро -1-бензоксепина и 3-(хлорметил)-5-(4-фторфенил)-пиридина получают N-[5-(4-фторфенил)- 3-пиридилметил]-N-[2-(2,3,4,5 -тетрагидро-1-бензоксепин метил] -амина малеат, температура плавления 194-195oC; из 2-аминоэтилхромана и 3-(хлорметил)-5-(4-фторфенил)-пиридина получают N-[5-(4-фторфенил) -3-пиридилметил] -N-(2-хорманилэтил)-амина малеат, температура плавления 160oC; из 3-амино-2,3,4,5-тетрагидро -1-бензоксепина и 3-(хлорметил)- -5-(4-фторфенил)-пиридина получают N-[5-(4-фторфенил)- 3-пиридилметил] -N-3-(2,3,4,5 -тетрагидро-1-бензоксепинил)-амина малеат, температура плавления 179-180oC; из 2-аминометил-8-гидроксихромана и 3-(хлорметил)-5-(4-фторфенил)-пиридина получают N-[5-(4-фтopфенил)-3-пиpидилметил] -N-[(8-гидроксихроманил)метил]-амина малеат, температура плавления 173oC; из 2-аминометил-8-метоксихромана и 3-(хлорметил)-4′-фторбифенила получают N-(4′-фтор-3-бифенилилметил)-N-[(8-метокси-2-хроманил)метил] -амина малеат, температура плавления 176oC; из 2-аминометил-6-фторхромана и 3-(хлорметил)-5-(4-фторфенил)-пиридина получают N-[5-(4-фторфенил)-3-пиридилметил] -N-[(6-фтор-2-хроманил)метил] – амина малеат, температура плавления 169-170oC; из 2-аминометил-хромана и 3-(2-пиридил)-хлорметилбензола получают N-[3-(2-пиридил)-фенилметил] -N-2-хроманил-метиламина малеат, температура плавления 201oC; из 2-аминометил-хромана и 3-(3-пиридил)-хлорметил-бензола получают N-[3-(пиридил)-фенилметил] -N-2-хроманил-метиламина малеат, температура плавления 120oC; из 2-аминометил-8-метоксихромана и 3-(3-пиридил)-хлорметилбензола получают N-[3-(3-пиридил)-фенилметил] – N-(8-метокси-2-хроманил)-метил]-амина малеат, температура плавления 85oC; из 2-аминометил-8-метоксихромана и 3-(2-пиридил)-хлорметилбензола получают N-[3-(2-пиридил)фенилметил]-N-(8-метокси-2-хроманил)-метил]-амина малеат, температура плавления 167oC. Нижеследующие соединения получают аналогичным способом (вместо малеиновой кислоты соединения обрабатывают 0,1 н. раствором HCl до получения гидрохлоридов): из 2-аминометилхромана и 3-(хлорметил)-4′-метилбифенила получают N-(4′-метил-3-бифенилметил)-N-2-хроманил-метил-амина гидрохлорид, температура плавления 206-207oC; из 2-аминометилхромана и 3-(хлорметил)-4′-метоксибифенила получают N-(4′-метокси-3-бифенилметил)-N-2-хроманил-метил-амина гидрохлорид, температура плавления 191-192oC; из 2-аминометилхромана и 3-(хлорметил)-4′-трифторметилбифенила получают N-(4′-трифторметил-3-бифенилметил)-N-2-хроманил-метил-амина гидрохлорид, температура плавления 181-182oC; из 2-аминометилхромана и 3-(хлорметил)-3′-трифторметилбифенила получают N-(3′-трифторметил-3-бифенилметил)-N-2-хроманил-метил-амина гидрохлорид, температура плавления 161-162oC; из 2-аминометил-8-метоксихромана и 3-(хлорметил)-4′-трифторметилбифенила получают N-(4′-трифторметил-3-бифенилметил) -N-[(8-метокси-2-хроманил)- метил]амина гидрохлорид, температура плавления 206-207oC; из 2-аминометил-8-метоксихромана и 3-(хлорметил)-3′-трифторметилбифенила получают N-(3′-трифторметил-3-бифенилметил) -N-[(8-метокси-2-хроманил)- метил]амина гидрохлорид, температура плавления 206oC; из 2-аминометил-8-метоксихромана и 3-(хлорметил)-4′-метилбифенила получают N-(4′-метил-3-бифенилилметил) -N-[(8-метокси-2-хроманил) -метил]-амина гидрохлорид, температура плавления 188-189oC; из 2-аминометил-8-метоксихромана и 3-(хлорметил)-4′-метоксибифенила получают N-(4′-метокси-3-бифенилилметил) -N-[(8-метокси-2-хроманил) -метил]-амина гидрохлорид, температура плавления 186-187oC; из 2-аминометил-8-метоксихромана и 3-(хлорметил)бифенила получают N-(3-бифенилилметил) -N-[(8-метокси-2-хроманил) -метил] -амина гидрохлорид, температура плавления 211-212oC; из 2-аминометил-6-нитрохромана и 3-(хлорметил)-5-(4-фторфенил)- пиридина получают N-[5-(4-фторфенил) -3-пиридилметил] -N-[(6-нитрохроман- 2-ил)-метил]-амина малеат; из 2-аминометил-7-нитрохромана и 3-(хлорметил)-5-(4-фторфенил)- пиридина получают N-[5-(4-фторфенил) -3-пиридилметил] -N-[(7-нитрохроман- 2-ил)-метил]-амина малеат; из 2-аминометил-8-хлорхромана и 3-(хлорметил)-5-(4-фторфенил)- пиридина получают N-[5-(4-фторфенил)-3-пиридил метил] -N-[(8-нитрохроман-2-ил)-метил] -амина малеат; из 2-аминометил-6-хлорхромана и 3-(хлорметил)-5-(4-фторфенил)- пиридина получают N-[5-(4-фторфенил)-3-пиридилметил] -N-[(6-хлорхроман- 2-ил)-метил] -амин, температура плавления 78-80oC; из 2-аминометил-7-хлорхромана и 3-(хлорметил)-5-(4-фторфенил)- пиридина получают N-[5-(4-фторфенил)-3-пиридилметил] -N-[(7-хлорхроман- 2-ил)-метил] -амина малеат; из 2-аминометил-8-цианохромана и 3-(хлорметил)-5-(4-фторфенил)- пиридина получают N-[5-(4-фторфенил)-3-пиридилметил] -N-[(8-цианохроман- 2-ил)-метил] -амина малеат; из 2-аминометил-6-цианохромана и 3-(хлорметил)-5-(4-фторфенил)- пиридина получают N-[5-(4-фторфенил)-3-пиридилметил] -N-[(6-цианохроман- 2-ил)-метил] -амина малеат; из 2-аминометил-5-цианохромана и 3-(хлорметил)-5-(4-фторфенил)- пиридина получают N-[5-(4-фторфенил)-3-пиридилметил] -N-[(5-цианохроман- 2-ил)-метил] -амина малеат; из 2-аминометил-5-фторхромана и 3-(хлорметил)-5-(4-фторфенил)- пиридина получают N-[5-(4-фторфенил)-3-пиридилметил] -N-[(5-фторхроман- 2-ил)-метил] -амина малеат; из 2-аминометил-6-фторхромана и 3-(хлорметил)-5-(4-фторфенил)- пиридина получают N-[5-(4-фторфенил)-3-пиридилметил] -N-[(6-фторхроман- 2-ил)-метил] -амина малеат; из 2-аминометилхромана и 3-(хлорметил)-5-(3,4-дифторфенил)- пиридина получают N-[5-(3,4-дифторфенил) -3-пиридилметил] -N-(2-хроманметил)-амина малеат, температура плавления 175-177oC; из 2-аминометилхромана и 3-феноксибензилхлорида получают N-(3-феноксибензил)-N-(2-хроманметил)-амина малеат, температура плавления 150-152oC; из 2-аминометилхромана и 2-(хлорметил)-4-фенилпиридина получают N-(4-фенил-2-пиридилметил)-N-[2-хроманметил)-амина малеат, температура плавления 156-158oC; из 2-аминометил-6-бромхромана и 3-(хлорметил)-5-(4-фторфенил)- пиридина получают N-[5-(4-фторфенил)-3-пиридилметил] -N-[2- (6-бромхроман)-метил]-амина малеат; из 2-аминометил-бензофурана и 3-(хлорметил)-5-(4-фторфенил)- пиридина получают N-(5-(4-фторфенил)-3-пиридилметил)-N- (2-бензофуранметил)-амина малеат, температура плавления 147 градусов; из 2-аминометил-7-фторхромана и 3-(хлорметил)-5-(4-фторфенил)- пиридина получают N-[5-(4-фторфенил)-3-пиридилметил] -N- [(7-фторхроман-2-ил)-метил] -амина малеат; из 2-аминометил-8-фторхромана и 3-(хлорметил)-5-(4-фторфенил)- пиридина получают N-[5-(4-фторфенил)-3-пиридилметил] -N- [(8-фторхроман-2-ил)-метил] -амина малеат; из 2-аминометил-6-трифторметилхромана и 3-(хлорметил)-5-(4-фторфенил)-пиридина получают N-[5-(4-фторфенил) -3-пиридилметил]-N-[(6-трифторметилхроман-2-ил-метил]-амина малеат; из 2-аминометил-8-трифторметилхромана и 3-(хлорметил)-5-(4-фторфенил)-пиридина получают N-[5-(4-фторфенил) -3-пиридилметил]-N-[(8-трифторметилхроман-2-ил)метил]-амина малеат. ПРИМЕР 2 Взаимодействуя 2-аминометил-2,3-дигидробензофуран с 3-(хлорметил)-5-(4-фторфенил)-пиридином так же, как в Примере 1, получают N-[5-(4-фторфенил)-3-пиридилметил] -N- [(2,3-дигидробензофуран-2-ил)метил] -амина малеат, температура плавления которого 178-180oC. Нижеследующие соединения получают аналогичным способом: из 2-аминометил-2,3-дигидробензофурана и 3-(хлорметил)-5- (4-метоксифенил)-пиридина получают N-[5-(4-метоксифенил)- 3-пиридилметил] -N-[(2,3-дигидробензофуран -2-ил)-метил]-амина малеат; из 2-аминометил-2,3-дигидробензофурана и 3-(хлорметил)-5- (3,4-диметоксифенил)-пиридина получают N-[5-(3,4-диметоксифенил)- 3-пиридилметил]-N-[(2,3-дигидробензофуран-2-ил) -метил]-амина малеат; из 2-аминометил-2,3-дигидробензофурана и 3-(хлорметил)-5- (2,4-диметоксифенил)-пиридина получают N-[5-(2,4-диметоксифенил)- 3-пиридилметил]-N-[(2,3-дигидробензофуран-2- ил)-метил]-амина малеат; из 2-аминометил-2,3-дигидробензофурана и 3-(хлорметил)-5- (3,4,5-трифторфенил)-пиридина получают N-[5-(3,4,5-трифторфенил)- 3-пиридилметил]-N-[(2,3-дигидробензофуран-2-ил) -метил]-амина малеат; из 2-аминометил-2,3-дигидробензофурана и 3-(хлорметил)-5- (2,3,4,5,6-пентафторфенил)-пиридина получают N-[5-(2,3,4,5,6-пентафторфенил) -3-пиридилметил]-N-[(2,3-дигидробензофуран -2-ил)-метил]-амина малеат. ПРИМЕР 3 Смесь состоящую из 2,2 г 3-метилфенола, предпочтительно его натриевой соли, и 5,6 г N-(2-хлорэтил)-N-[5-(4- фторфенил)-3-пиридилметил] амина (“А”) [получаемую из фталимидкалиевой соли путем взаимодействия с 5-(4-фторфенил)-3-хлорметил-пиридином, расщепления продукта гидразином и последующего взаимодействия с 1,2-дихлорэтаном] в 50 мл ацетонитрила перемешивают в течение 5 часов при 50oC и подвергают обычной обработке. Получают N-[2-(3-метоксифенокси)-этил] -N-[5-(4-фторфенил)-3- -пиридилметил] -амин. После перемешивания с 0,5 частями малеиновой кислоты получают малеат, температура плавления которого 152-154oC. Нижеследующие соединения получают аналогичным способом: из натриевой соли 2,4-дихлорфенола и соединения “А” получают N-[2-(2,4-дихлорфенокси)-этил] -N-[5-(4-фторфенил)-3- -пиридил-метил] -амина малеат, температура плавления 148-150oC; из натриевой соли 3-метоксифенола и соединения “А” получают N-[2-(3-метоксифенокси)-этил] -N-[5-(4-фторфенил)-3- -пиридилметил]-амина малеат, температура плавления 122-124oC; из натриевой соли 4-метоксифенола и соединения “А” получают N-[2-(4-метоксифенокси)-этил] -N-[5-(4-фторфенил)-3-пиридилметил] -амин, температура плавления 94-96oC; из натриевой соли 3-хлорфенола и соединения “А” получают N-[2-(3-хлорфенокси)-этил] -N-[5-(4-фторфенил)-3-пиридилметил]-амина малеат, температура плавления 150-152oC; из натриевой соли 2-хлорфенола и соединения “А” получают N-[2-(2-хлорфенокси)-этил] -N-[5-(4-фторфенил)-3-пиридилметил]-амина малеат, температура плавления 153-155oC; из натриевой соли 2-метоксифенола и соединения “А” получают N-[2-(2-метоксифенокси)-этил] -N-[5-(4-фторфенил)-3-пиридилметил] – -амина малеат, температура плавления 134-136oC; из натриевой соли 4-хлорфенола и соединения “А” получают N-[2-(4-хлорфенокси)-этил]-N-[5-(4-фторфенил)-3-пиридилметил]- -амина малеат, температура плавления 163-164oC; из натриевой соли 2-этилфенола и соединения “А” получают N-[2-(2-этилфенокси)-этил]-N-[5-(4-фторфенил)-3-пиридилметил]- -амина малеат, температура плавления 128-130oC; из натриевой соли 3-цианофенола и соединения “А” получают N-[2-(3-цианофенокси)-этил] -N-[5-(4-фторфенил)-3-пиридилметил] – -амина оксалат, температура плавления 245oC; из натриевой соли 4-цианофенола и соединения “А” получают N-[2-(4-цианофенокси)-этил] -N-[5-(4-фторфенил)-3-пиридилметил] – -амина оксалат, температура плавления 250oC; из натриевой соли фенола и N-(3-феноксибензил)-амина получают N-(2-феноксиэтил)-N-(3-феноксибензил)-амина малеат, температура плавления 166-168oC; из натриевой соли фенола и соединения “А” получают N-(2-феноксиэтил)-N-[5-(4-фторфенил)-3-пиридилметил]-амин, температура плавления 84-86oC. ПРИМЕР 4 Путем взаимодействия 2-аминометил-6-метоксихромана с 3-(хлорметил)-5-(4-фторфенил)-пиридином, проводимой так же, как в Примере 1, получают N-[5-(4-фторфенил)3-пиридилметил] -N- [(6-метокси-2-хроманил)-метил] -амин. В результате перемешивании с соляной кислотой получают дигидрохлорид, температура плавления которого 205-206oC. ПРИМЕР 5 Путем взаимодействия 2-аминометилхромана с 3-(хлорметил)-5- (4-фторфенил)-пиридином, проводимой так же, как в Примере 1, получают N-[5-(4-фтopфенил)-3-пиридилметил] -N-(2-хроманилметил)-амин. В результате перемешивания с соляной кислотой получают дигидрохлорид-полугидрат, температура плавления которого 210-213oC. ПРИМЕР 6 Раствор 1,8 г 3-аминометил-бифенила, который можно получить путем восстановления 3-цианобифенил и 1,6 г 2-хлор-этил-фенилового эфира, который можно получить путем взаимодействия фенолята с дихлорэтаном в 200 мл ацетонитрида перемешивают в течение 8 часов при комнатной температуре и подвергают обычной обработке до получения N-(3-бифенилметил)-2-феноксиэтил-амина. После перемешивания с 0,5 частями малеиновой кислоты в 100 мл этанола получают малеат, температура плавления которого 178-180oC. Нижеследущие соединения получают аналогичным способом, из 3-аминометил-4′-фторбифенила и 2-хлорэтил-фенилового эфира получают N-(4′-фтор-3-бифенилметил)-N-2-феноксиэтил-амина малеат, температура плавления 194-196oC; из 3-аминометил-2′-4′-дифторбифенила и 2-хлорэтил-фенилового эфира получают N-(2′-4′-дифтор-3-бифенилметил)-N-2-феноксиэтил-амин; из 3-аминометил-5-фенилпиридина и 2-хлорэтил-фенилового эфира получают N-(5-фенил-3-пиридилметил)-N-2-феноксиэтил-амин, температура плавления 77-79oC; из 2-аминометил-4(3-тиенил)-тиофена и 2-хлорэтил-фенилового эфира получают N-[4-(3-тиенил)-2-тиенилметил]-N-2-феноксиэтил-амин, температура плавления 96-98oC; из 2-аминометил-4-метилтиофена и 2-хлорэтил-фенилового эфира получают N-(4-метил-2-тиенилметил)-N-2-феноксиэтил-амин; из 2-аминометил-4-метокситиофена и 2-хлорэтил-фенилового эфира получают N-(4-метокси-2-тиенилметил)-N-2-феноксиэтил-амин; из 2-аминометил-4-этилтиофена и 2-хлорэтил-фенилового эфира получают N-(4-этил-2-тиенилметил)-N-2-феноксиэтил-амин; из 2-аминометил-4-хлортиофена и 2-хлорэтил-фенилового эфира получают N-(4-хлор-2-тиенилметил)-N-2-феноксиэтил-амин; из 3-аминометил-4′-фторбифенила и 2-хлорэтил-(3-цианофенил)эфира получают N-(4′-фтор-3-бифенилметил)-N-2-(3-цианофеноксиэтил)-амин, температура плавления которого 158-160oC; из 3-аминометилбифенила и 2-хлорэтил-(2-метоксифенил)эфира получают N-(3-бифенилметил)-N-2-(2-метоксифенокси)этиламин, температура плавления которого 72-74oC; из 3-аминометилбифенила и 2-хлорэтил-2-бифенил-эфира получают N-(3-бифенилметил)-N-2-(2-бифенилокси)этиламина, малеат температура плавления которого 146-148oC; из 3-аминометил-5-(4-фторфенил)-пиридина и 2-хлорэтил- -(2-бифенилил)-эфира получают N-[5-(4-фторфенил-3-пиридилметил)] -N-2- -(2-бифенилокси)этиламин, температура плавления которого 134-136oC; из 3-аминометилбифенила и 2-хлорэтил-(2-гидроксифенил)-эфира получают N-(3-бифенилметил)] -N-2-(2-гидроксифенокси)этиламин, температура плавления которого 88-90oC. ПРИМЕР 7 Раствор 1,2 г 2-гидроксибензонитрила и 2,5 г N-2-хлорэтил-N- (5-фенил-3-пиридилметил)-амина, который можно получить путем взаимодействия 2-гидроксиэтиламина с 3-хлорметил-5-фенил-пиридином и последующего преобразования продукта реакции в 2-хлорэтильное соединение путем взаимодействия с PCl3, в 200 мл ацетонитрила перемешивают в течение 5 часов при комнатной температуре и подвергают обычной обработке до получения N-[2-(2-цианофенокси)-этил]-N-(5-фенил-3-пиридилметил)-амина. После перемешивания с 0,5 частями щавелевой кислоты в 100 мл этанола получают оксалат, температура плавления которого 208oC. Нижеследующие соединения получают аналогичным способом: из 2-хлорфенола и N-2-хлорэтил-N-(5-фенил-3-пиридилметил)-амина получают N-[2-(2-хлорфенокси)-этил] -N-(5-фенил-3-пиридилметил)амин; из 2-метилфенола и N-2-хлорэтил-N-(5-фенил-3-пиридилметил)- амина получают N-[2-(2-метилфенокси)-этил] -N-(5-фенил-3-пиридилметил)амин; из 4-хлорфенола и N-2-хлорэтил-N-(5-фенил-3-пиридилметил)-амина получают N-[2-(4-хлорфенокси)этил] -N-(5-фенил-3-пиридилметил)амин; из 4-цианофенола и N-2-хлорэтил-N-(5-фенил-N-пиридилметил)-амина получают N-[2-(4-цианофенокси)этил] -N-(5-фенил-3-пиридилметил)амин; из 3-этилфенола и N-2-хлорэтил-N-(5-фенил-3-пиридилметил)-амина получают N-[2-(3-этилфенокси)этил] -N-(5-фенил-3-пиридилметил)амин; из 4-трифторметилфенола и N-2-хлорэтил-N- (5-фенил-3-пиридилметил)-амина получают N-[2-(4-трифторметилфенокси)этил] -N-(5-фенил-3-пиридилметил)амин; из 2-бромфенола и N-2-хлорэтил-N- (5-фенил-3-пиридилметил)-амина получают N-[2-(2-бромфенокси)этил] -N-(5-фенил-3-пиридилметил)амин; из 2-аминометилфенила и N-2-хлорэтил-N-(5-фенил-3-пиридилметил)-амина получают N-[2-(2-аминометилфенокси)этил] -N-(5-фенил-3-пиридилметил)амин; из 4-метоксифенола и N-2-хлорэтил-N-(5-фенил-3-пиридилметил)-амина получают N-[2-(4-метоксифенокси)этил] -N-(5-фенил-3-пиридилметил)амин; из 3-аминометилфенола и N-2-хлорэтил-N-(5-фенил-3-пиридилметил)-амина получают N-[2-(3-аминометилфенокси) этил]-N-(5-фенил -3-пиридилметил)амин; из 4-аминометилфенола и N-2-хлорэтил-N-(5-фенил-3-пиридилметил)-амина получают N-[2-(4-аминометилфенокси)этил] -N-(5-фенил-3-пиридилметил)амин. ПРИМЕР 8 Смесь, состоящую из 3,1 г N-[2-(2-цианофенокси)этил]-N-(5-фенил-3-пиридилметил)амина, 3 г NaOH, 50 мл воды и 40 мл моноэтилового эфира диэтиленгликоля перемешивают в течение 3 часов при температуре бани в 140oC. Смесь охлаждают и подвергают обычной обработке, и получают N-[2-(2-карбокси-амидофенокси)этил] -N-(5-фенил-3-пиридилметил)амин. После перемешивания с 0,5 частями щавелевой кислоты в 100 мл этанола получают оксалат, температура плавления которого 230oC. ПРИМЕР 9 Способом, аналогичным описанному в Примере 8, получают N-(5-фенил-3-пиридилметил)амин путем частичного гидролиза N-[2-(4-цианофенокси)этил]-N-(5-фенил-3-пиридилметил)амина. ПРИМЕР 10 Используя в качестве исходного вещества N-[2-(4-цианофенокси)этил]-N-(5-фенил-3-пиридилметил)амин способом, аналогичным описанному в Примере 8, с применением кипячения в течение 16 часов и последующей обычной обработки получают N-[2-(4-карбоксифенокси)этил]-N-(5-фенил-3-пиридилметил)амин. ПРИМЕР 11 Используя в качестве исходного вещества N-[2-(2-цианофенокси) -этил]-N-(5-фенил-3-пиридилметил)амин способом, аналогичным описанному в Примере 8, с использованием кипячения в течение 16 часов и последующей обычной обработки получают N-[2-(2-карбоксифенокси)-этил] -N-(5-фенил-3-пиридилметил)амин. ПРИМЕР 12 По способу, аналогичному описанному в Примере 7, раствор 2,3 г фенолята натрия и 2,5 г N-3-хлорпропил-N-[5-(4-фторфенил)-3-пиридилметил]амина, который можно получить путем взаимодействия 3-гидроксипропиламина с 3-хлорметил-5-(4-фторфенил)-пиридином с последующим преобразованием продукта реакции в 3-хлорпропиловое соединение путем взаимодействия с PCl3, в 200 мл ацетонитрила перемешивают в течение 5 часов при комнатной температуре и подвергают обычной обработке до получения N-(3-феноксипропил)-N-[5-(4-фторфенил)-3-пиридилметил] амина. После перемешивания с 0,5 частями щавелевой кислоты в 100 мл смеси этанол/вода получают оксалат-полугидрат, температура плавления которого 217oC. Нижеследующие соединения получают аналогичным способом: из фенолята натрия и N-4-хлорбутил-N-[5-(4-фторфенил)-3-пиридилметил] -амина получают N-(4-феноксибутил) -N-[5-(4-фторфенил) -3-пиридилметил]амина малеат, температура плавления которого 143oC; из фенолята натрия и N-2-хлоризопропил-N-[5-(4-фторфенил) -3-пиридилметил] -амина получают N-(2-феноксиизопропил) -N-[5-(4-фторфенил)-3-пиридилметил]амина малеат, температура плавления которого 123 – 125oC; из тиофенолята натрия и N-2-хлорэтил-N-[5-(4-фторфенил)-3-пиридилметил] -амина получают N-(2-тиофеноксиэтил) -N-[5-(4-фторфенил) -3-пиридилметил] амина оксалат, температура плавления которого 230oC; из тиофенолята натрия и N-4-хлорбутил -N-(5-фенил-3-пиридилметил)амина получают N-(4-тиофеноксибутил)-N-(5-фенил -3-пиридилметил)амин; из тиофенолята натрия и N-3-хлорпропил-N-(5-фенил)-3-пиридилметил)амина получают N-(3-тиофеноксипропил) -N-(5-фенил-3-пиридилметил)амин; из тиофенолята натрия и N-2-хлоризопропил-N-(5-фенил)-3-пиридилметил)амина получают N-(2-тиофеноксиизопропил)-N-(5-фенил -3-пиридилметил)амин. ПРИМЕР 13 Способом, аналогичным описанному в Примере 7, получают следующие соединения: из 2-хлор-тиофенола и N-2-хлорэтил-N-(5-фенил-3-пиридилметил)амина получают N-[2-(2-хлортиофенокси)-этил] -N-(5-фенил-3-пиридилметил)амин; из 2-метил-тиофенола и N-2-хлорэтил-N-(5-фенил-3-пиридилметил)амина получают N-[2-(2-метилхлортиофенокси)-этил] -N-(5-фенил-3-пиридилметил)амин; из 4-хлорл-тиофенола и N-2-хлорэтил-N-(5-фенил-3-пиридилметил)амина получают N-[2-(4-хлортиофенокси)-этил] -N-(5-фенил-3-пиридилметил)амин; из 4-циано-тиофенола и N-2-хлорэтил-N-(5-фенил-3-пиридилметил)амина получают N-[2-(4-цианотиофенокси)-этил] -N-(5-фенил-3-пиридилметил)амин; из 3-этил-тиофенола и N-2-хлорэтил-N-(5-фенил-3-пиридилметил)амина получают N-[2-(3-этилтиофенокси)-этил] -N-(5-фенил-3-пиридилметил)амин; из 4-трифторметил-тиофенола и N-2-хлорэтил-N-(5-фенил-3-пиридилметил)амина получают N-[2-(4-трифторметилтиофенокси)-этил] -N-(5-фенил-3-пиридилметил)амин; из 2-бром-тиофенола и N-2-хлорэтил-N-(5-фенил-3-пиридилметил)амина получают N-[2-(2-бромтиофенокси)-этил] -N-(5-фенил-3-пиридилметил)амин; из 2-аминометил-тиофенола и N-2-хлорэтил-N-(5-фенил-3-пиридилметил)амина получают N-[2-(2-аминометилтиофенокси) -этил] -N-(5-фенил-3-пиридилметил)амин; из 4-метокси-тиофенола и N-2-хлорэтил-N-(5-фенил-3-пиридилметил)амина получают N-[2-(4-метокситиофенокси)-этил] -N-(5-фенил-3-пиридилметил)амин; из 3-аминометил-тиофенола и N-2-хлорэтил-N-(5-фенил-3-пиридилметил)амина получают N-[2-(3-аминометилтиофенокси) -этил] -N-(5-фенил-3-пиридилметил)амин; из 4-аминометил-тиофенола и N-2-хлорэтил-N-(5-фенил-3-пиридилметил)амина получают N-[2-(4-аминометилтиофенокси) -этил] -N-(5-фенил-3-пиридилметил)амин. ПРИМЕР 14 Раствор 2,8 г N-[2-(2-метоксифенокси)-этил] -N-[5-(4-фторфенил)-3-пиридилметил]-амина, который можно получить способом, описанным в Примере 3, и одну эквивалентную часть 3-хлорметил-5-(4-фторфенил)пиридина в 125 мл ацетонитрила перемешивают в течение 6 часов при 40oC и подвергают обычной обработке до получения N-[2-(2-метоксифенокси)-этил] -N,N-бис-[5-(4-фторфенил)-3- пиридилметил]-амина, температура плавления которого 90 – 92oC. Нижеследующие соединения получают аналогичным способом путем взаимодействия с 3-хлорметил-5-(4-фторфенил)-пиридином: N-(4-феноксибутил)-N-(5-фенил-3-пиридилметил)-амин-N-(4-феноксибутил)- N-(5-фенил-3-пиридилметил) -N-[5-(4-фторфенил)-3-пиридилметил]-амин; N-(2-феноксиизопропил)-N-(5-фенил-3-пиридилметил)-амин-N-(2-феноксиизопропил)- N-(5-фенил-3-пиридилметил) -N-[5-(4-фторфенил)-3-пиридилметил]-амин; N-(2-тиофеноксиэтил)-N-(5-фенил-3-пиридилметил)-амин-N-(2-тиофеноксиэтил)- N-(5-фенил-3-пиридилметил) -N-[5-(4-фтор-фенил)-3-пиридилметил]-амин; N-(4-тиофеноксибутил)-N-(5-фенил-3-пиридилметил)-амин-N-(4-тиофеноксибутил)- N-(5-фенил-3-пиридилметил) -N-[5-(4-фторфенил)-3-пиридилметил]-амин. ПРИМЕР 15 По способу, аналогичному описанному в Примере 7, раствор 2,3 г 1 нафтолята натрия и 2,9 г N-2-хлорэтил-N-[5-(4-фторфенил)-3-пиридилметил]амина, который можно получить путем взаимодействия 2-гидроксиэтиламина с 3-хлорметил-5- (4-фторфенил)-пиридином с последующим преобразованием продукта реакции в 2-хлорэтильное соединение путем взаимодействия с PCl3 в 200 мл ацетонитрила перемешивают в течение 5 часов при комнатной температуре и подвергают обычной обработке до получения N-[2-(1-нафтилокси)-этил]-N-[5-(4-фторфенил)-3-пиридилметил] амина, температура плавления которого 92 – 94oC. Нижеследующие соединения получают аналогичным способом путем взаимодействия 2-нафтолята : с N-2-хлорэтил-N-[5-(4-фторфенил)-3-пиридилметил] амином: N-[2-(2-нафтокси)-этил] -N-[5-(4-фторфенил)-3-пиридилметил] амин, температура плавления которого 128 – 130oC; с N-2-хлорэтил-N-[5-(4-дифторфенил)-3-пиридилметил]амином: N-[2-(2-нафтокси)-этил]-N-[5-(2,4-дифторфенил)-3-пиридилметил]амин. ПРИМЕР 16 Раствор 2,1 г N-(2-феноксиэтил)-N-[5-фторфенил)-3-пиридилметил]амина, который можно получить способом, описанным в Примере 3, в 100 мл тетрагидрофурана обрабатывают 2 мл метилйодида при перемешивании в течение 3 часов. После обычной обработки получают N-(2-феноксиэтил)-N-[5-(4-фторфенил)-3-пиридилметил] -N-метиламина оксалат, температура плавления которого 159 – 161oC. Нижеследующие соединения получают аналогичным способом путем алкилирования вторичных аминов: N-[5-(4-фторфенил)-3-пиридилметил] -N-(2-хроманилметил)-N-метиламин, температура плавления которого 71oC; N-3-бифенилметил-N-(2-хроманилметил)-N-метиламин. ПРИМЕР 17 Путем взаимодействия N-[5-(4-фторфенил)-3-пиридилметил] -амина с 1 хлор-3-фенилпропаном по способу, описанному в Примере 1, получают N-[5-(4-фторфенил)-3-пиридилметил] -N-(3-фенилпропил)-амин, температура плавления которого < 50oC. ПРИМЕР 18 Способом, аналогичным способу, описанному в Примере 3, путем взаимодействия соли фенолята натрия с N-(2-хлорэтал)-N-3-(2-пиридил)-хлорметилбензолом получают N-[3-(2-пиридил)-фенилметил] -N-[2-(фенокси)-этил] -амина малеат, температура плавления которого 170oC, соли фенолята натрия с N-(2-хлорэтал)-N-3-(3-пиридил)-хлорметилбензолом получают N-[3-(3-пиридил)-фенилметил] -N-[2-(фенокси)-этил] -амина малеат, температура плавления которого 123 – 125oC. Получение энантиомерных соединений. ПРИМЕР 19 Раствор 4,5 г 2-аминометил-хромана, который можно получить путем взаимодействия 3-(2-гидроксифенил)пропанала с KCN и последующим каталитическим восстановлением 2-цианохромана, и 3,9 г тозилпролина в 190 мл этанола нагревают с обратным холодильником в течение 15 минут. После этого раствор охлаждают до 5oC при перемешивании. В процессе охлаждения добавляют несколько кристаллов чистого (R)-2-аминометил-хромана. Температуру раствора поддерживают на уровне 5oC, раствор перемешивают в течение 18 часов, после чего отделяют чистый энантиомер (R)-2-аминометил-хромана. Процесс кристаллизации повторяют дважды с кристаллами, полученными от первой кристаллизации, до получения избытка энантиомеров в свыше 99%. После этого (R)-2-аминометил-хроман взаимодействуют с 3-(хлорметил)-5-(4-фторфенил)пиридином так, как описано в Примере 1, до получения (R)-(-)2-[5-(4-фторфенил)-3-пиридил-метиламинометил] -хромана [=(R)-(-)-1N-[5-(4-фторфенил)-3-пиридилметил]-N-(2-хроманилметил) -амина] . После перемешивания с 0,1 н. раствором соляной кислоты получают дигидрохлорид, температура плавления которого 234 -235oC; [  20] = -65o (c = 1, метанол).
Аналогичным способом взаимодействуя (S)-2-аминометилхроман с 3-(хлорметил)-5-(4-фторфенил)пиридином получают: (S)-(+)-2-[5-(4-фторфенил)-3-пиридил-метиламинометил] -хроман [= (S)-(+)-1N-5-(4-фторфенил)-3-пиридилметил] -N-(2-хроманилметил)- амин] . После перемешивания с 0,1 н. раствором соляной кислоты получают дигидрохлорид, температура плавления которого 227 – 228oC; 20] = -65o (c = 1, метанол).
Аналогичным способом взаимодействуя (S)-2-аминометилхроман с 3-(хлорметил)-5-(4-фторфенил)пиридином получают: (S)-(+)-2-[5-(4-фторфенил)-3-пиридил-метиламинометил] -хроман [= (S)-(+)-1N-5-(4-фторфенил)-3-пиридилметил] -N-(2-хроманилметил)- амин] . После перемешивания с 0,1 н. раствором соляной кислоты получают дигидрохлорид, температура плавления которого 227 – 228oC;[  20] = + 62o (c = 1, метанол).
Аналогичным образом взаимодействуя (S)-2-аминометил-8-метоксихроман с 3-(хлорметил)-5- (4-фторфенил)пиридином получают: (S)-(+)-2-[5- (4-фторфенил)-3-пиридил- метиламинометил]-8-метокси -хроман [=(S)-(+)-1N- [5-(4-фторфенил)-3-пиридилметил] -N-[2-(8-метоксихроманил) -метил] – амин] . После перемешивания с 0,1 н. раствором соляной кислоты получают дигидрохлорид, температура плавления которого 214 – 215oC.
Аналогичным способом взаимодействуя (R)-2-аминометил-8-метоксихроман с 3-(хлорметил)-5-(4-фторфенил)пиридином получают: (R)-(-)-2-[5-(4-фторфенил) -3-пиридил-метиламинометил] -8-метоксихроман [= (R)-(-)-1N -[5-(4-фторфенил)-3-пиридилметил] -N-[2-(8-метокихроманил)- метил]-амин. После перемешивания с 0,1 н. раствором соляной кислоты получают дигидрохлорид, температура плавления которого 214oC.
ПРИМЕР 20 20] = + 62o (c = 1, метанол).
Аналогичным образом взаимодействуя (S)-2-аминометил-8-метоксихроман с 3-(хлорметил)-5- (4-фторфенил)пиридином получают: (S)-(+)-2-[5- (4-фторфенил)-3-пиридил- метиламинометил]-8-метокси -хроман [=(S)-(+)-1N- [5-(4-фторфенил)-3-пиридилметил] -N-[2-(8-метоксихроманил) -метил] – амин] . После перемешивания с 0,1 н. раствором соляной кислоты получают дигидрохлорид, температура плавления которого 214 – 215oC.
Аналогичным способом взаимодействуя (R)-2-аминометил-8-метоксихроман с 3-(хлорметил)-5-(4-фторфенил)пиридином получают: (R)-(-)-2-[5-(4-фторфенил) -3-пиридил-метиламинометил] -8-метоксихроман [= (R)-(-)-1N -[5-(4-фторфенил)-3-пиридилметил] -N-[2-(8-метокихроманил)- метил]-амин. После перемешивания с 0,1 н. раствором соляной кислоты получают дигидрохлорид, температура плавления которого 214oC.
ПРИМЕР 20Раствор, содержащий 5 г (R)-2-аминометилхромана, полученный взаимодействием 2-карбоксихроман с (+)-фенилэтиламином, отделением кристаллизованного диастереомера, очисткой путем перекристаллизации из этанола, преобразованием в этилхроманат, дополнительно очисткой с помощью хиральных фаз ВЭЖК (ChiracelTM), преобразовать в амид, восстановлением LiAlH4 или VitrideTM в тетрагидрофуране до получения (R)-2-аминометилхромана, взаимодействует с 3-(хлорметил)-5-фенилпиридином так же, как в Примере 1, до получения (R)-(-)-2-[5-фенил-3 -пиридил-метиламинометил] хромана [=(R)-(-)-1N- (5-фенил-3-пиридилметил)-N-(2-хроманилметил) амин]. После перемешивания с 0,1 н. раствором соляной кислоты получают дигидрохлорид, температура плавления которого 243-244oC. Аналогичным способом путем взаимодействия (S)-2-аминометил-хроман с 3-(хлорметил)-5-фенилпиридином получают: (S)-(+)-2-(5-фенил)-3-пиридил -метиламинометил-хроман [= (S)-(+)-1N-(5-фенил-3-пиридил-метил)-N-(2-хроманилметил)-амин] . После перемешивания с 0,1 н. раствором соляной кислоты получают дигидрохлорид, температура плавления которого 244-245oC. Аналогичным способом путем взаимодействия (S)-2-аминометил-8-метоксихроман с 3-(хлорметил)-4′-фторбифенилом получают: (S)-(+)-2-[4′-3-бифенилил -метиламинометил]-8-метокси-хроман [=(S)-(+)-1N-[4′-фтор -3-бифенилил-метил] -N-[2-(8-метоксихроманил)- метил] -амин] . После перемешивания с 0,1 н. раствором соляной кислоты получают дигидрохлорид, температура плавления которого 189-190oC; [  20] = +74o (c = 1, метанол).
Аналогичным способом путем взаимодействия (R)-2-аминометил-8-метоксихроман с 3-(хлорметил)-4′-фторбифенилом получают: (R)-(-)-2-[4′-фтор-3- бифенилил-метиламинометил] -8-метоксихроман [=(R)-(-)-1N-[4′-фтор -3-бифенилил-метил] -N-[2-(8-метоксихроманил)- метил]-амин]. После перемешивания с 0,1 н. раствором соляной кислоты получают дигидрохлорид, температура плавления которого 189-190oC; 20] = +74o (c = 1, метанол).
Аналогичным способом путем взаимодействия (R)-2-аминометил-8-метоксихроман с 3-(хлорметил)-4′-фторбифенилом получают: (R)-(-)-2-[4′-фтор-3- бифенилил-метиламинометил] -8-метоксихроман [=(R)-(-)-1N-[4′-фтор -3-бифенилил-метил] -N-[2-(8-метоксихроманил)- метил]-амин]. После перемешивания с 0,1 н. раствором соляной кислоты получают дигидрохлорид, температура плавления которого 189-190oC;[  20] = -74,3o (c = 1, метанол).
Нижеследующие примеры относятся к фармацевтическим препаратам.
ПРИМЕР A: ампулы для инъекций 20] = -74,3o (c = 1, метанол).
Нижеследующие примеры относятся к фармацевтическим препаратам.
ПРИМЕР A: ампулы для инъекцийpH раствора 100 г активного соединения формулы I и 5 г динатрийфосфата в 3 л дважды дистиллированной воды доводят до 6,5 с помощью 2 н. соляной кислоты, фильтруют и стерилизуют, затем раствором заполняют ампулы для инъекций и в стерильных условиях проводят лиофилизацию, после чего ампулы запечатывают в стерильных условиях. Каждая ампула для инъекций содержит 5 мг активного соединения. ПРИМЕР B: свечи Смесь, состоящую из 20 г активного соединения формулы I, расплавляют с 100 г соевого лецитина и 1400 г кокосового масла, затем смесь разливают по формам и оставляют до охлаждения. Каждая свеча содержит 20 мг активного соединения. ПРИМЕР C: раствор Раствор 1 г активного соединения формулы I, 9, 38 г NaH2PO4  H2O, 28,48 г Na2HPO4 H2O, 28,48 г Na2HPO4  12H2O и 0,1 г бензалкониумхлорида приготавливают в 940 мл дважды дистиллированной воды. pH раствора доводят до 6,8, получая общий объем в 1 л, затем раствор стерилизуют излучением. Такой раствор можно использовать в качестве главных капель.
ПРИМЕР D: мазь 12H2O и 0,1 г бензалкониумхлорида приготавливают в 940 мл дважды дистиллированной воды. pH раствора доводят до 6,8, получая общий объем в 1 л, затем раствор стерилизуют излучением. Такой раствор можно использовать в качестве главных капель.
ПРИМЕР D: мазь500 мг активного соединения формулы I в асептических условиях смешивают с 99,5 г вазелина. ПРИМЕР E: таблетки Смесь 100 активного соединения формулы I, 1 кг лактозы, 600 г микрокристаллической целлюлозы, 600 г маисового крахмала, 100 г поливинилпирролидона, 80 г талька и 10 г стеарата магния прессуют обычным способом до получения таблеток так, чтобы каждая таблетка содержала 10 мг активного соединения. ПРИМЕР G: Таблетки с покрытием Таблетки прессуют как описано в Примере E, затем обычным способом наносят покрытие из сахарозы, маисового крахмала, талька, трагаканта и красителя. ПРИМЕР C: капсулы Твердые желатиновые капсулы заполняют активным соединением формулы I обычным способом так, чтобы каждая капсула содержала 5 мг активного соединения. ПРИМЕР H: спрей для ингаляций 14 г активного соединения формулы I растворяют в 10 л изотонического раствора NaCl, затем раствором заполняют флаконы промышленного изготовления, имеющие насосный механизм. Раствором можно орошать рот или нос. Одно распыление (около 0,1 мл) соответствует дозе в около 0,14 мг. Данные испытаний даны в таблице. Формула изобретения
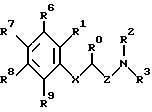 где Х представляет собой кислород, серу, или, если R0 и R1 вместе не являются алкиленовой цепью с 1 – 3 атомами, то СН2; Z представляет собой -(CH2)n1 – (CHA)n2 – (CH2)n3, причем n1 = 0, 1, 2 или 3; n2 = 0 или 1; n3 = 0, 1, 2 или 3, при условии, что n1 + n2 + n3 < 4; R0 представляет собой водород или А; R1 представляет собой водород, А, ОА, фенокси, Ph, OH, F, Cl, Br, CN, CF3, COOH, COOA, ацитокси с 1 – 4 атомами углерода, карбоксиамидо, или R0 и R1 вместе представляют собой алкиленовую цепь с 1 – 3 атомами углерода или алкениленовую цепь с 2 – 3 атомами углерода; R2 представляет собой водород, А, Ас или -СН2-R4; R3 представляет собой -СН2-R4 или -СНА-R4; R4 представляет собой Ph, 2-, 3- или 4-пиридил, незамещенный или монозамещенный R5, или тиофен, незамещенный, моно- или дизамещенный А, ОА, ОН, F, Cl, Br, или другой тиенильной группой; R5 представляет собой фенильную группу, которая является незамещенной, или моно-, ди-, три-, тетра-, или пентазамещенной F, CF3, частично или полностью фторированной А, А и/или ОА; R6, R7, R8 и R9 каждый независимо представляет собой Н, А, ОА, фенокси, ОН, F, Br, I, CN, CF3, NO2, NH2, Ph, Cl и/или R1 и R6 вместе представляют собой алкиленовую цепь с 3 – 4 атомами углерода; А представляет собой алкил с 1 – 6 атомами углерода; Ph представляет собой фенил, незамещенный или замещенный, R5, 2-, 3- или 4-пиридилом или феноксильной группой; и физиологически приемлемые соли этих производных. 2. Производные амино(тио)эфиров по п.1, отличающиеся тем, что они представляют собой а) N-(3-пиридилметил)-N-2-хроманил-метиламин; b) N-(5-фенил-3-пиридилметил)-N-2-хроманил-метиламин; с) N-[5-(4-метоксифенил)-3-пиридилметил]-N-2-хроманил-метиламин; d) N-[5-(4-фторфенил)-3-пиридилметил]-N-2-хроманил-метиламин; е) N-(4′-фтор-3-бифенилметил)-N-2-хроманил-метиламин; f) N-(3-бифенилметил)-N-2-хроманил-метиламин; g) N-[5-(4-фторфенил)-3-пиридилметил]-N-2-(1-нафтилокси)-этанамин; 3. Производные амино(тио)эфиров по п.1, отличающиеся тем, что они представляют собой а) N-[5-(4-фторфенил)-3-пиридилметил]-N-(3-феноксипропил)-амин; b) N-[5-(4-фторфенил)-3-пиридилметил]-N-(4-феноксибутил)-амин; с) N-[5-(4-фторфенил)-3-пиридилметил]-N-(2-фенилтиоэтил)-амин; d) N-(5-фенил-3-пиридилметил)-N-[(2-цианофенокси)-этил]амин; е) N-[5-(4-фторфенил)-3-пиридилметил] -N-[(8-метокси-2-хроманил)-метил] -амин; f) N-[5-(4-фторфенил)-3-пиридилметил]-N-[2-(3-метилфенокси)-этил]-амин; g) N-[5-(4-фторфенил)-3-пиридилметил] -N-[2-(2,4-дихлорфенокси)-этил]-амин и физиологически приемлемые соли этих соединений. 4. Соединения общей формулы I по п.1, отличающиеся тем, что они являются энантиомерами. 5. Способ получения производных амино(тио)эфиров формулы I по п.1 и их солей, отличающийся тем, что соединение формулы II 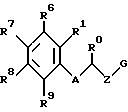 где G представляет собой Cl, Br, I, OH или ОН-группу, функционально модифицированную до образования химически активной группы, особенно удаляемой группы, а радикалы R0, R1, R6, R7, R8, R9, Х и Z имеют вышеуказанные значения, взаимодействуют с амином формулы III HNR2R3, где R2 и R3 имеют вышеуказанные значения, и/или полученное основание или кислота формулы I преобразуется в одну из своих солей в результате обработки кислотой или основанием. 6. Способ получения соединения формулы I по п.1 и их солей, отличающийся тем, что соединение формулы IV 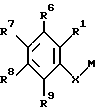 где М представляет собой Н, Li+, Na+, K+, NH4+ или другой подходящий ион металла, а Х, R1, R6, R7, R8 и R9 имеют вышеуказанные значения, взаимодействуют с соединением формулы V 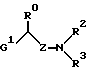 где G1 имеет те же значения, что G, а R0, R2, R3 и Z имеют вышеуказанные значения, и полученное основание или кислоту формулы I преобразуют в одну из своих солей путем обработки кислотой или основанием. 7. Способ получения фармацевтических композиций, отличающийся тем, что соединение формулы I и/или одну из биологически совместимых солей этого соединения в соответствующей дозировке соединяют с, по меньшей мере, одним, твердым, жидким или полужидким наполнителем или вспомогательным средством. 8. Фармацевтическая композиция, обладающая действием на центральную нервную систему, включающая активный ингредиент и фармацевтически приемлемый носитель или вспомогательное средство, отличающаяся тем, что в качестве активного ингредиента используют эффективное количество производных амино(тио)эфиров или их солей. 9. Соединения формулы I по п.1 или их физиологически приемлемые соли, обладающие действием на центральную нервную систему. РИСУНКИ
|
||||||||||||||||||||||||||
