Патент на изобретение №2155751
|
||||||||||||||||||||||||||
(54) ПРОИЗВОДНЫЕ 1,4-ДИГИДРОПИРИДИНА, СМЕСЬ ИХ ИЗОМЕРОВ ИЛИ ОТДЕЛЬНЫЕ ИЗОМЕРЫ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И 2-ХЛОР-3-ЦИАНОБЕНЗАЛЬДЕГИД
(57) Реферат: Изобретение относится к новым производным 1,4-дигидропиридина ф-лы (I), где R1 и R3 обозначают C1-C8-алкил, незамещенный или замещенный C1-C6-алкоксилом или гидроксилом, или C3-C7-циклоалкил, R2 обозначает замещенный фенил, причем заместитель выбирают из группы, включающей галоген, циано, этинил, трифторметокси, метил, метилтио, трифторметил или C1-C4-алкоксил. Соединения ф-лы (I) являются Ca2+-антагонистами с избирательностью для Ca2+-каналов L типа центральной нервной системы и могут быть использованы для получения лекарственных средств для лечения центральных дегенеративных заболеваний. 3 с. и 4 з.п.ф-лы, 10 табл. 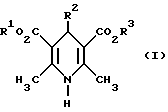
Изобретение относится к новым производным пиридина, обладающим биологической активностью, более конкретно к производным 1,4-дигидропиридина в форме рацемата или энантиомеров, промежуточному продукту для их получения и фармацевтической композиции, обладающей антагонистической активностью в отношении катионов кальция. Известны производные 1,4-дигидропиридина (см. заявки EP-A 0007293, EP-A 0088940, EP-A 0534520, EP-A 0525568, EP-A 0595164, US 3932646, US 3966946, DE-A 2815578, DE-A 2508181, JP-A 60-94963 и Pharmacol. 1987, 10, стр. 60 – 65). Известно применять в качестве антагониста катионов кальция производное 1,4-дигидропиридина под названием “нимодипин” (= сложный изопропиловый и 2-метоксиэтиловый эфир 1,4-дигидро-2,6- диметил-4-(3-нитрофенил)-3,5-пиридин-карбоновой кислоты (см. заявку DE 2815578, A 61 K 31/445, 18.10.1979). Задачей изобретения является расширение арсенала производных 1,4-дигидропиридина, обладающих биологической активностью, в частности антагонистической в отношении катионов кальция активностью. Поставленная задача предлагаемыми производными 1,4- дигидропиридина общей формулы формулы (I) 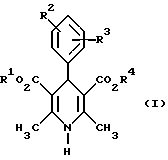 в форме рацемата или энантиомеров, где указанные заместители имеют значения, представленные в таблице А. Предпочтительными производными 1,4-дигидропиридина общей формулы (I) являются соединения, выбранные из группы, включающей (  )изопропил-(2-метоксиэтил)-4-(2-фтор-фенил)-1,4-дигидро- 2,6-диметилпиридин-3,5-дикарбоксилат )изопропил-(2-метоксиэтил)-4-(2-фтор-фенил)-1,4-дигидро- 2,6-диметилпиридин-3,5-дикарбоксилат(+) изопропил-(2-метоксиэтил)-4-(2-фтор-фенил)-1,4-дигидро- 2,6-диметилпиридин-3,5-дикарбоксилат (-) изопропил-(2-метоксиэтил)-4-(2-фтор-фенил)-1,4-дигидро-2,6- диметилпиридин-3,5-дикарбоксилат (  )изопропил-(2-метоксиэтил)-4-(2,3-дифтор-фенил)-1,4- дигидро-2,6-диметилпиридин-3,5-дикарбоксилат )изопропил-(2-метоксиэтил)-4-(2,3-дифтор-фенил)-1,4- дигидро-2,6-диметилпиридин-3,5-дикарбоксилат(+)изопропил-(2-метоксиэтил)-4-(2,3-дифтор-фенил)-1,4-дигидро- 2,6-диметилпиридин-3,5-дикарбоксилат (-)изопропил-(2-метоксиэтил)-4-(2,3-дифтор-фенил)-1,4-дигидро- 2,6-диметилпиридин-3,5-дикарбоксилат (  )изопропил-(2-метоксиэтил)-4-(2,5-дифтор-фенил)-1,4-дигидро- 2,6-диметилпиридин-3,5-дикарбоксилат )изопропил-(2-метоксиэтил)-4-(2,5-дифтор-фенил)-1,4-дигидро- 2,6-диметилпиридин-3,5-дикарбоксилат(+)изопропил-(2-метоксиэтил)-4-(2,5-дифтор-фенил)-1,4-дигидро- 2,6-диметилпиридин-3,5-дикарбоксилат (-)изопропил-(2-метоксиэтил)-4-(2,5-дифтор-фенил)-1,4-дигидро- 2,6-диметилпиридин-3,5-дикарбоксилат (  )изопропил-(2-метоксиэтил)-4-(2,6-дифтор-фенил)-1,4-дигидро- 2,6-диметилпиридин-3,5-дикарбоксилат )изопропил-(2-метоксиэтил)-4-(2,6-дифтор-фенил)-1,4-дигидро- 2,6-диметилпиридин-3,5-дикарбоксилат(+)изопропил-(2-метоксиэтил)-4-(2,6-дифтор-фенил)-1,4-дигидро- 2,6-диметилпиридин-3,5-дикарбоксилат (-)изопропил-(2-метоксиэтил)-4-(2,6-дифтор-фенил)-1,4-дигидро- 2,6-диметилпиридин-3,5-дикарбоксилат (  )изопропил-(2-метоксиэтил)-4-(2,5-дихлор-фенил)-1,4-дигидро- 2,6-диметилпиридин-3,5-дикарбоксилат )изопропил-(2-метоксиэтил)-4-(2,5-дихлор-фенил)-1,4-дигидро- 2,6-диметилпиридин-3,5-дикарбоксилат(+)изопропил-(2-метоксиэтил)-4-(2,5-дихлор-фенил)-1,4-дигидро- 2,6-диметилпиридин-3,5-дикарбоксилат (-)изопропил-(2-метоксиэтил)-4-(2,5-дихлор-фенил)-1,4-дигидро- 2,6-диметил-пиридин-3,5-дикарбоксилат (  )изопропил-(2-метоксиэтил)-4-(2-хлор-6-фтор-фенил)- 1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат )изопропил-(2-метоксиэтил)-4-(2-хлор-6-фтор-фенил)- 1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат(+)изопропил-(2-метоксиэтил)-4-(2-хлор-6-фтор-фенил)- 1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат (-)изопропил-(2-метоксиэтил)-4-(2-хлор-6-фтор-фенил)- 1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат (  )изопропил-(2-метоксиэтил)-4-(2-фтор-3-трифторметилфенил)- 1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат )изопропил-(2-метоксиэтил)-4-(2-фтор-3-трифторметилфенил)- 1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат(+)изопропил-(2-метоксиэтил)-4-(2-фтор-3-трифторметилфенил)- 1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат (-)изопропил-(2-метоксиэтил)-4-(2-фтор-3-трифторметилфенил)- 1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат (  )изопропил-(2-метоксиэтил)-4-(3-хлор-2-циано-фенил)- 1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат )изопропил-(2-метоксиэтил)-4-(3-хлор-2-циано-фенил)- 1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат(+)изопропил-(2-метоксиэтил)-4-(3-хлор-2-циано-фенил)- 1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат (-)изопропил-(2-метоксиэтил)-4-(3-хлор-2-циано-фенил)- 1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат (  )изопропил-(2-метоксиэтил)-4-(2-циано-фенил)- 1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат )изопропил-(2-метоксиэтил)-4-(2-циано-фенил)- 1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат(+)изопропил-(2-метоксиэтил)-4-(2-циано-фенил)-1,4-дигидро- 2,6-диметилпиридин-3,5-дикарбоксилат (-)изопропил-(2-метоксиэтил)-4-(2-циано-фенил)-1,4-дигидро- 2,6-диметилпиридин-3,5-дикарбоксилат (  )трет. -бутил-(2-метоксиэтил)-4-(3-циано-фенил)-1,4- дигидро-2,6-диметилпиридин-3,5-дикарбоксилат )трет. -бутил-(2-метоксиэтил)-4-(3-циано-фенил)-1,4- дигидро-2,6-диметилпиридин-3,5-дикарбоксилат(+)трет. -бутил-(2-метоксиэтил)-4-(3-циано-фенил)-1,4-дигидро- 2,6-диметилпиридин-3,5-дикарбоксилат (-)трет. -бутил-(2-метоксиэтил)-4-(3-циано-фенил)-1,4-дигидро- 2,6-диметилпиридин-3,5-дикарбоксилат (  )циклогептил-(2-метоксиэтил)-4-(3-циано-фенил)-1,4-дигидро- 2,6-диметилпиридин-3,5-дикарбоксилат )циклогептил-(2-метоксиэтил)-4-(3-циано-фенил)-1,4-дигидро- 2,6-диметилпиридин-3,5-дикарбоксилат(+)циклогептил-(2-метоксиэтил)-4-(3-циано-фенил)-1,4-дигидро- 2,6-диметилпиридин-3,5-дикарбоксилат (-)циклогептил-(2-метоксиэтил)-4-(3-циано-фенил)-1,4-дигидро- 2,6-диметилпиридин-3,5-дикарбоксилат (+)циклопентил-(2-метоксиэтил)-4-(2-хлор-3-циано-фенил)-1,4-дигидро- 2,6-диметилпиридин-3,5-дикарбоксилат (+)циклопентил-(2-метоксиэтил)-4-(2-хлор-3-циано-фенил)-1,4-дигидро- 2,6-диметилпиридин-3,5-дикарбоксилат (-)циклопентил-(2-метоксиэтил)-4-(2-хлор-3-циано-фенил)-1,4-дигидро- 2,6-диметилпиридин-3,5-дикарбоксилат (  )циклопентил-(2-метоксиэтил)-4-(2-фтор-3-трифторметил-фенил)- 1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат )циклопентил-(2-метоксиэтил)-4-(2-фтор-3-трифторметил-фенил)- 1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат(+)циклопентил-(2-метоксиэтил)-4-(2-фтор-3-трифторметил-фенил)- 1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат (-)циклопентил-(2-метоксиэтил)-4-(2-фтор-3-трифторметил-фенил)- 1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат (  )(2-метоксиэтил)-(метил)-4-(2-фтор-3-трифторметил-фенил)- 1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат )(2-метоксиэтил)-(метил)-4-(2-фтор-3-трифторметил-фенил)- 1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат(+)(2-метоксиэтил)-(метил)-4-(2-фтор-3-трифторметил-фенил)- 1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат (-)(2-метоксиэтил)-(метил)-4-(2-фтор-3-трифторметил-фенил)-1,4- дигидро-2,6-диметилпиридин-3,5-дикарбоксилат (  )циклопентил-(2-метоксиэтил)-4-(2-циано-3-хлор-фенил)- 1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат )циклопентил-(2-метоксиэтил)-4-(2-циано-3-хлор-фенил)- 1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат(+)циклопентил-(2-метоксиэтил)-4-(2-циано-3-хлор-фенил)-1,4-дигидро- 2,6-диметилпиридин-3,5-дикарбоксилат и (-)циклопентил-(2-метоксиэтил)-4-(2-циано-3-хлор-фенил)-1,4-дигидро- 2,6-диметилпиридин-3,5-дикарбоксилат. В частности предпочитаются сложный изопропиловый и 2- метоксиэтиловый эфиры 4-(2-хлор-3-циано-фенил)-1,4-дигидро-2,6- диметилпиридин-3,5-дикарбоновой кислоты в виде рацемата (+)- или (-)-энантиомера. Дополнительным объектом изобретения является фармацевтическая композиция, обладающая антагонистической активностью в отношении катионов кальция, которая помимо, по меньшей мере, одного инертного, фармацевтически приемлемого носителя содержит в качестве активного вещества соединение общей формулы (II) 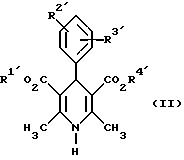 где R1′ и R4′ одинаковы или различны и означают неразветвленный или разветвленный алкил с 1-8 атомами углерода, незамещенный или замещенный неразветвленным или разветвленным алкоксилом с 1-6 атомами углерода или гидроксилом, или циклоалкил с 3-7 атомами углерода, R2′ и R3′ одинаковы или различны и означают галоген, циано, этинил, трифторметокси, метил, метилтио, трифторметил или неразветвленный или разветвленный алкоксил с 1-4 атомами углерода, или R2′ или R3′ означает водород, смесь его изомеров или его отдельный изомер в эффективном количестве. Производные 1,4-дигидропиридина общей формулы (I) можно получать за счет того, что [А] альдегиды общей формулы (III) 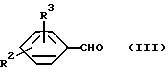 где R2 и R3 имеют вышеуказанное значение, сначала подвергают взаимодействию со сложными эфирами ацетуксусной кислоты формулы (IV) H3C-CO-CH2-CO2R1 (IV) где R имеет вышеуказанное значение, в случае необходимости с выделением соответствующих илиденовых соединений общей формулы (V) 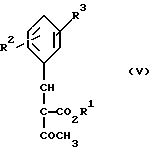 где R1 – R3 имеют вышеуказанное значение, и затем подвергают взаимодействию или с соединениями общей формулы (VI) CH3-CO-CH2-CO2R4 (VI) где R4 имеет вышеуказанное значение, в среде инертных растворителей, в присутствии аммиака или аммониевых солей, или непосредственно с производными энаминокарбоновой кислоты общей формулы (VII) 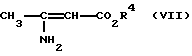 где R4 имеет вышеуказанное значение, или [Б] альдегиды общей формулы (III) подвергают сначала взаимодействию с соединением общей формулы (VI), в случае необходимости с выделением илидиеновых соединений общей формулы (VIII) 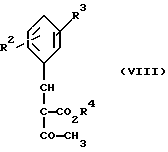 где R2, R3, и R4 имеют вышеуказанные значения, и затем с соединениями общей формулы (III) в среде инертных растворителей, в присутствии аммиака или аммониевых солей, или же непосредственно с производными энаминокарбоновой кислоты общей формулы (IX) 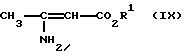 где R1 имеет вышеуказанное значение, или [В] соединения общей формулы (X) 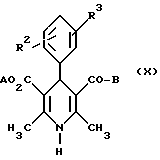 где R2 и R3 имеют вышеуказанное значение, A имеет указанные для радикала R1 и R4 значения, B вместе с карбонильной группой образует реакционноспособное производное карбоновой кислоты, подвергают взаимодействию с соединениями общей формулы (XI) R5-OH (XI) где R5 имеет указанное для радикала R1 или R4 значения, в среде инертных растворителей в присутствии основания, и в случае получения чистых сложноэфирных энантиомеров чистые энантиомерные карбоновые кислоты подвергают взаимодействию с соответствующими спиртами, в случае необходимости, через предварительную стадию реакционноспособного производного кислоты. 2-хлор-3-циано-бензальдегид, подпадающий под вышеприведенную общую формулу (III), представляет собой новый промежуточный продукт, являющийся дальнейшим объектом изобретения. Вышеописанные способы поясняются следующей реакционной схемой: [А] 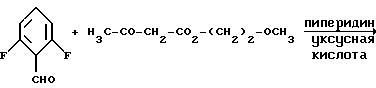 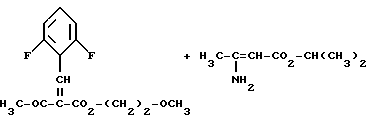 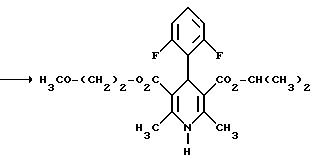 [Б] 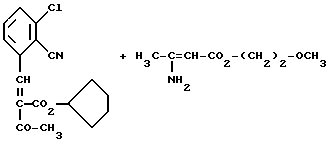 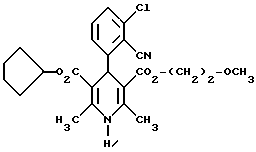 [В] 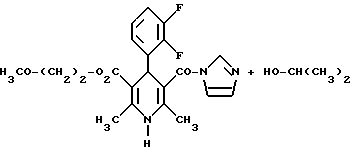 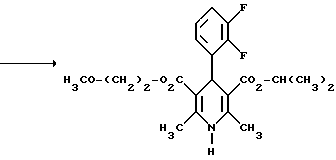 По вышеописанным способам [А] – [В] можно также получать соединения общей формулы (III). При этом в качестве растворителей для способов [А] и [Б] пригодны все инертные органические растворители, которые в условиях реакции не изменяются. К ним предпочтительно принадлежат спирты, такие как, например, метанол, этанол, пропанол или изопропанол, или простые эфиры, такие как, например, простой диэтиловый эфир, диоксан, тетрагидрофуран, простой гликольдиметиловый эфир, или простой диэтиленгликольдиметиловый эфир, ацетонитрил, или амиды, такие как, например, триамид гексаметилфосфорной кислоты или диметилформамид, или уксусная кислота или галогенированные углеводороды, такие как, например, метиленхлорид, четыреххлористый углерод, или углеводороды, такие как, например, бензол или толуол. Кроме того, можно также использовать смеси упомянутых растворителей. Предпочтительно используют изопропанол, этанол, тетрагидрофуран, метанол, диоксан и диметилформамид. В качестве растворителя для способа [В] пригодны вышеупомянутые растворители за исключением спиртов и уксусной кислоты. В качестве оснований обычно пригодны циклические амины, такие как, например, пиперидин, три- и диалкиламины с 1-3 атомами углерода, такие как, например, ди- и триэтиламин или пиридин или диметиламинопиридин. Предпочтительными являются в зависимости от соответствующих процессов пиперидин, диметиламинопиридин и пиридин. В качестве вспомогательных веществ предпочтительно используют агенты конденсации, которые могут также представлять собой основания. Предпочтительными являются обычные агенты конденсации, такие как, например, карбодиимиды, такие как, например, N,N’- диэтил-, N,N’-диизопропил- и N,N’-дициклогексилкарбодиимид, гидрохлорид N-(3-диметиламиноизопропил)-N’-этилкарбодиимида, или карбонильные соединения, такие как, например, карбонилдиимидазол, или соединения 1,2-оксазолия, такие как, например, 3-сульфонат 2-этил-5-фенил-1,2-оксазолия или перхлорат 2-трет.-бутил-5-метилизоксазолия, или ациламино-соединения, такие как, например, 2-этокси-1-этоксикарбонил-1,2- дигидрохинолин, или ангидрид пропанфосфоновой кислоты, или изобутилхлороформат, или гексафторфосфонат бензотриазолилокси-трис(диметиламино)фосфония. Предпочтительно используют N’,N’- дициклогексилкарбодиимид и карбонилдиимидазол. В качестве оснований для активации карбоновых кислот обычно пригодны карбонаты щелочных металлов, такие как, например, карбонат натрия или калия, или органические основания, такие как, например, триэтиламин, N-этилморфолин, N-метилпиперидин или диизопропилэтиламин, или диметиламинопиридин, 1,8- диазабицикло[5,4,0]-ундец-7-ен или 1,5-диазабицикло-[4,3,0]нон-5-ен. Предпочтительно используют диметиламинопиридин. Основание обычно используют в количестве 0,01 моль – 1 моль, предпочтительно 0,05 моль – 0,1 моль, каждый раз в пересчете на 1 моль соединения общих формул (III) и (X). Вспомогательные вещества обычно используют в количестве 1 – 3 моль, предпочтительно 1-1,5 моль, каждый раз в пересчете на 1 моль соединений общих формул (III) и (X). Температура реакций для способов [А] и [Б] могут колебаться в широких пределах. Обычно работают при температуре от – 20 до 200oC, предпочтительно при 0 – 110oC, в частности при температуре кипения соответствующего растворителя. Реакции можно проводить при атмосферном давлении, однако также при повышенном или пониженном давлении (например, при 0,5-3 бар). Обычно работают при атмосферном давлении. При проведении способов соотношение принимающих участие в реакции веществ является любым. Однако обычно работают при молярном количестве реагентов. Для активации карбоновой кислоты можно использовать обычные реагенты как неорганические галогениды, например, тионилхлорид, трихлорид фосфора или пятихлористый фосфор, или карбонилдиимидазол, карбодиимиды как, например, циклогексилкарбодиимид, или п-толуолсульфонат 1-циклогексил-3-[2- (N-метилморфолино)-этил]-карбодиимида, N-оксифталимид или N- оксибензтриазол. Кроме того, чистые энантиомерные формы получают, например, тем, что смеси диастереомеров соединений общей формулы (I), в которой R1 или R2 означает энантиомерный хиральный спирт, разделяют обычными методами, затем получают чистые энантиомерные карбоновые кислоты и затем переводят в чистые энантиомерные дигидропиридины, при необходимости, путем этерификации с соответствующими спиртами. В качестве хиральных сложноэфирных остатков пригодны все сложные эфиры чистых энантиомерных спиртов, таких как, например, фенилэтанол, молочная кислота, сложный эфир молочной кислоты, миндальная кислота, сложный эфир миндальной кислоты, 2-аминоспирты, производные сахара, производные оксиаминокислот и многие другие чистые энантиомерные спирты. Разделение диастереомеров осуществляют в общем или путем фракционной кристаллизации, путем колоночной хроматографии или путем распределения по Крэгу. Необходимо в каждом конкретном случае решать, который метод является наиболее выгодным. Иногда целесообразно использовать комбинацию индивидуальных аметодов. Этерификацию чистых энантиомерных дигидропиридинов предпочтительно проводят в среде простых эфиров, таких как, например, диэтиловый эфир или тетрагидрофуран, диметилформамид, метиленхлорид, хлороформ, ацетонитрил или толуол. Соединения общих формул (III), (IV), (VI), (VII), (IX) и (XI) известны или их можно получать известными методами. Реакционноспособные производные кислот общей формулы (X) частично известны и их можно получать известными приемами. Большинство соединений общих формул (V) и (VIII) известно или их можно получать известными методами. Как уже указывалось выше, предлагаемая фармацевтическая композиция обладает антагонистической в отношении катионов кальция активного, в частности обладает избирательностью для Ca2+-каналов L типа центральной системы. Избирательность превышает избирательность известного церебрально активного Ca2+-антагонистического дигидропиридина, торгового продукта нимодипин, о чем свидетельствуют результаты следующего опыта, который проводился аналогично методике, описанной Д. Рампе и др. в Can. J. Physiol. Pharmacol. 65 (1987), стр. 1452-1453. Опыт Исследовалось сродство радиоактивно меченных дигидропиридинов к связыванию с сайтами в ткани сердца и головного мозга крыс. В качестве ткани применялись синаптосомы из сердечной и мозговой ткани. Инкубации проводились при 37oC в доведенной до pH 7,4 физиологической солевой среде, содержащей 132 ммоль хлористого натрия, 5 ммоль хлористого калия, 1,2 ммоль хлористого кальция, 1,3 ммоль хлористого магния, 10 ммоль глюкозы, 25 ммоль трис-буфера. Определяли показатель связывания Кi исследуемых соединений в нмоль и избирательность связывания с помощью компьютерной программы. Результаты опыта сведены в таблице 1 (см. в конце описания). Активные вещества формулы (I) обычно содержатся в предлагаемой композиции в концентрации 0,1 – 99,5 вес. %, предпочтительно 0,5 – 95 вес.%. Кроме активных веществ формулы (I) фармацевтическая композиция может также содержать и другие фармацевтические активные вещества. Предлагаемую фармацевтическую композицию получают известными приемами. Для достижения желаемых результатов в общем выгодно давать активные вещества формулы (I) в общем количестве примерно 0,01 – 100 мг, предпочтительно примерно 1 – 50 мг/кг веса тела в сутки, при необходимости в виде нескольких отдельных доз. Однако, в случае необходимости, может быть целесообразным отклоняться от указанного количества, а именно в зависимости от вида и веса подлежащего лечению пациента, от индивидуального поведения пациента относительно лекарственного средства, вида и степени болезни, вида препарата и дачи и момента или промежутков дачи средства. Приведенные в нижеследующих примерах значения Rf, если ничего другого не указано, определяли посредством тонкослойной хроматографии на силикагеле (алюминиевая пленка, силикагель марки 60 F 254 фирмы Е. Мерк, DE). Выявление пятен вещества осуществляли при помощи УФ-света и/или путем опрыскивания 1%-ным раствором перманганата калия или раствора молибдатофосфорной кислоты. Флеш-хроматографию проводили на силикагеле марки 60 (величиной зерен 0,040 – 0,064 мм) фирмы Е. Мерк, DE. Элюация градиентом растворителя означает: начинают чистым, неполярным компонентом смеси растворителей, к которому примешивают полярный компонент в повышающихся количествах до тех пор, пока не будет элюироваться желаемый продукт (контроль при помощи тонкослойной хроматографии). При выделении всех целевых продуктов растворитель отгоняют при давлении около 0,1 Торр. Пример 1 4-(2-фторфенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоновая кислота в виде сложного изопропилового и сложного 2-метоксиэтилового эфиров 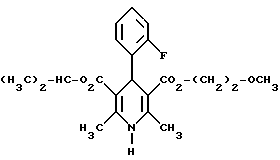 4,0 г (около 15 ммоль) сложного 2-летоксиэтилового эфира 2- ацетил-3-(2-фтор-фенил)-2-пропеновой кислоты и 2,2 г (15 ммоль) сложного изопропилового эфира 3-амино-2-бутеновой кислоты в 100 мл изопропанола нагревают с обратным холодильником в течение ночи. После того как проверка тонкослойной хроматографией на двуокиси кремния с применением в качестве элюента смеси толуола и сложного этилового эфира уксусной кислоты в соотношении 5: 1 подтверждает полную конверсию, реакционную смесь сгущают, смешивают с толуолом, снова сгущают и затем очищают путем фильтрации на силикагеле, причем в качестве растворителя используют смесь толуола и сложного этилового эфира уксусной кислоты в соотношениях 100:1 – 5:1. Получают кристаллизующее желтое масло, которое перекристаллизовывают при температуре около -15oC из метанола. Получают 2,8 г (48%) вышеприведенного соединения. Температура плавления: 99 – 100oC. Пример 2 (-)-4-(3-цианофенил)-1,4-дигидро-2,6-диметилпиридина-3,5- дикарбоновая кислота в виде сложного циклогептилового и сложного 2-метокси-этилового этилового эфиров 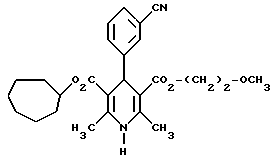 5,0 г (14 ммоль) сложного 2-метоксиэтилового эфира (-)-4- (3-цианофенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоновой кислоты (полученного путем разделения хроматографией рацемической монокарбоновой кислоты на хиральных неподвижных фазах) перемешивают в 50 мл тетрагидрофурана на молекулярном сите с порами величиной 4 Е в течение 30 минут. Затем добавляют 2,3 г (14 ммоль) карбонилдиимидазола и нагревают с обратным холодильником в течение одного часа, фильтруют с молекулярного сита и сгущают. Остаток смешивают с 30 мл циклопентанола и после добавления N,N- диметил-4-аминопиридина при помощи шпателя нагревают до температуры 100oC в течение 6 часов. После повторной хроматографии на силикагеле с применением в качестве элюента толуола, смеси сложного этилового эфира уксусной кислоты и дихлорметана, смеси изопропанола и циклогексана, и сложного этилового эфира уксусной кислоты и кристаллизации из смеси простого диизопропилового эфира и циклогексана получают 1,0 г (16%) вышеприведенного соединения в виде белых кристаллов. Точка плавления: 98 – 99oC.  2D0 = -24,2 (с=0,9, CHCl3).
Сведенные в таблице 2 соединения получают аналогично примерам 1 и 2, или за счет того, что рацемические продукты подвергают хроматографическому разделению на хиральных неподвижных фазах (хиралцел и хиралпак, дайцел) на чистые энантиомерные целевые продукты.
Пример 33 2D0 = -24,2 (с=0,9, CHCl3).
Сведенные в таблице 2 соединения получают аналогично примерам 1 и 2, или за счет того, что рацемические продукты подвергают хроматографическому разделению на хиральных неподвижных фазах (хиралцел и хиралпак, дайцел) на чистые энантиомерные целевые продукты.
Пример 334-(2,4-дифторфенил)-1,4-дигидро-2,6-диметилпиридин-3,5- дикарбоновая кислота в виде сложного изопропилового и 2- метоксиэтилового эфиров 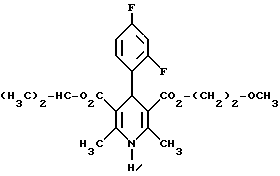 5,0 г (около 18 ммоль) сложного 2-метоксиэтилового эфира 2- ацетил-3-(2,4 дифторфенил)-2-пропеновой кислоты и 2,5 г (18 ммоль) сложного изопропилового эфира 3-амино-2-бутеновой кислоты в 50 мл изопропанола нагревают с обратным холодильником в течение ночи. После того, как проверка тонкослойной хроматографией на двуокиси кремния с применением в качестве элюента смеси толуола и сложного этилового эфира уксусной кислоты в соотношении 5:1 подтверждает полную конверсию, реакционную смесь сгущают, смешивают с толуолом, снова сгущают и затем очищают путем кристаллизации из небольшого количества метанола. Получают 2,8 г (39%) вышеприведенного соединения. Точка плавления: 123 – 126oC. Аналогично примерам 1, 2 и 33 получают соединения, сведенные в таблицах 3 – 7. Пример 89 (-)-4-(3-цианофенил)-1,4-дигидро-2,6-диметилпиридин-3,5- дикарбоновая кислота в виде сложного метилового и сложного 2- метоксиэтилового эфиров 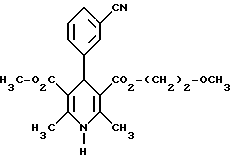 3,6 г (10 ммоль) сложного 2-метоксиэтилового эфира (-)-4-(3- цианофенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоновой кислоты перемешивают в 40 мл тетрагидрофурана на молекулярном сите с порами величиной 4 Я в течение 30 минут. Затем добавляют 1,6 г (10 ммоль) карбонилдиимидазола и нагревают до температуры 60oC в течение 30 минут, фильтруют с молекулярного сита и сгущают. Остаток смешивают с 40 мл метанола и нагревают до температуры 80oC в течение 6 часов. После повторной хроматографии на силикагеле с применением в качестве элюента смесей толуола и сложного этилового эфира уксусной кислоты в соотношениях 1:0 – 3:1 получают 1,4 г маслянистого вещества, которое путем растирания вместе с диэтиловым эфиром доводят до кристаллизации. Таким образом получают 1,1 г (30%) бесцветных кристаллов с точкой плавления 103 – 104oC.  2D0 = 7,0(с-= 1,2; CHCl3).
Сведенные в таблице 8 соединения получают аналогично примеру 89 или за счет того, что рацемические продукты подвергают разделению хроматографией на хиральных неподвижных фазах (хиралцел и хиралпак, дайцел) на чистые энантиомерные целевые продукты (обозначенные A*): 2D0 = 7,0(с-= 1,2; CHCl3).
Сведенные в таблице 8 соединения получают аналогично примеру 89 или за счет того, что рацемические продукты подвергают разделению хроматографией на хиральных неподвижных фазах (хиралцел и хиралпак, дайцел) на чистые энантиомерные целевые продукты (обозначенные A*):Пример 95 4-(2-фтор-3-трифторметилфенил)-1,4-дигидро-2,6-диметилпиридин- 3,5-дикарбоновая кислота в виде сложного ди-2-метоксиэтилового эфира  К раствору 3,0 г (15,6 ммоль) 2-фтор-3-трифторметилбензилальдегида в 50 мл диоксана добавляют 5 мл 25%-го раствора аммиака и 5,0 г (31,2 ммоль) сложного 2-метоксиэтилового эфира ацетуксусной кислоты и нагревают с обратным холодильником до тех пор, пока проверка тонкослойной хроматографией на силикагеле с применением в качестве элюента смеси толуола и сложного этилового эфира уксусной кислоты в соотношении 5:1 не подтверждает полную конверсию. Затем сгущают, два раза смешивают с толуолом и снова сгущают. Кристаллизацией из толуола получают 1,4 г (19%) вышеприведенного соединения с точкой плавления 148oC. Аналогично примеру 95 получают соединения, сведенные в таблице 9. Сведенные в таблице 10 соединения получают аналогично примеру 89 из соответствующего имидазолида. Пример 107 Сложный изопропиловый и 2-метоксиэтиловый эфиры 4-(2-хлор-3- циано-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоновой кислоты в виде рацемата 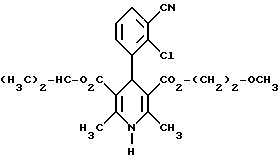 18,6 г (60,5 ммоль) сложного 2-метоксиэтилового эфира 2- ацетил-3-(2-хлор-3-циано)-2-пропеновой кислоты и 8,7 г (60,5 ммоль) сложного изопропилового эфира амино-2-бутеновой кислоты в 250 мл изопропанола нагревают с обратным холодильником в течение 4 часов. После сгущения получают твердое вещество, которое размешивают вместе с 18,1 г простого диэтилового эфира. Затем смешивают с 180 мл толуола и 180 мл циклогексана при температуре кипения. После охлаждения до комнатной температуры получают кристаллы, которые сушат при температуре 80oC в камерной сушилке с циркуляцией воздуха. Выход: 17,6 г (67%). Т.пл.: 148 – 149oC. Примеры 108 и 109 Сложный изопропиловый и 2-метоксиэтиловый эфиры 4-(2-хлор-3-циано- фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоновой кислоты в виде (+)-энантиомера Сложный изопропиловый и 2-метоксиэтиловый эфиры 4-(2-хлор-3-циано-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоновой кислоты в виде (-)-энантиомера 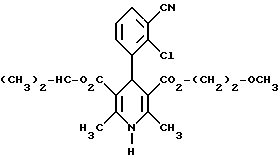 Чистые энантиомеры рацемата примера 107 можно получать хроматографией на хиральных колонках (силикагель марки хирацел OD-H, растворитель 95% н-гептана и 5% смеси 1% воды и 0,2% трифторуксусной кислоты в этаноле). Пример 108 Т.пл.: 138-140oC  2D0 = +13,9(c=1,CHCl3).
Пример 109 2D0 = +13,9(c=1,CHCl3).
Пример 109Т.пл.: 138-140oC  2D0 = -12,1 (с = 0,9, CHCl3) 2D0 = -12,1 (с = 0,9, CHCl3)Новый 2-хлор-3-циано-бензальдегид получают следующим образом. Пример 110 2-хлор-3-циано-бензальдегид 180 г 2-хлор-3-циано-бензальбромида растворяют в 1,5 л 95%-ого этанола и нагревают до температуры 60oC. При этой температуре быстро прикапывают раствор 186 г (1,1 моль) нитрата серебра в 380 мл воды, который предварительно смешивают с 750 мл этанола. После прикапывания дополнительно размешивают в течение 1 часа и затем смешивают с 50 мл насыщенного раствора хлористого натрия. После охлаждения отфильтровывают от солей серебра и фильтрат сгущают. Остаток смешивают с метиленхлоридом и очищают путем фильтрации на содержащей силикагель колонке, причем в качестве элюента используют дихлорметан. После сгущения продукта получают 88 г (81%) вышеуказанного соединения. Т.пл.: 86-89oC. 1H-ЯМР (CHCl3):  = 7,55 ч/млн. (т, 1H); 7,95 (дд, 1H); 8,20 (дд, 1H); (с, 1H).
Нижеследующие примеры поясняют предлагаемую фармацевтическую композицию.
Пример А = 7,55 ч/млн. (т, 1H); 7,95 (дд, 1H); 8,20 (дд, 1H); (с, 1H).
Нижеследующие примеры поясняют предлагаемую фармацевтическую композицию.
Пример А5 мг соединения примера 108 растворяют в 25 мг глицерина и 380 мг полиэтиленгликоля с молярной массой 400 и раствор разбавляют 40 мг воды. Полученный раствор загружают в выполненные из мягкой желатины продолговатые капсулы размером 8. Пример Б 30 мг соединения примера 109 смешивают с 90 мг поливинилпирролидона с молярной массой 25000, 49 мг микрокристаллической целлюлозы, 1 мг стеарата магния, и полученную смесь переводят в таблетку диаметром 8 мм. Соединения общих формул (I) и (II) относятся к категории малотоксичных веществ. Формула изобретения
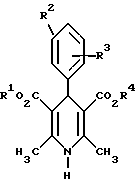 где указанные заместители имеют следующие значения: 2. Производные 1,4-дигидропиридина общей формулы I по п.1, выбранные из группы, включающей (  ) изопропил-(2-метоксиэтил)-4-(2-фтор-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат, ) изопропил-(2-метоксиэтил)-4-(2-фтор-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат,(+) изопропил-(2-метоксиэтил)-4-(2-фтор-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат, (-) изопропил-(2-метоксиэтил)-4-(2-фтор-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат, (  ) изопропил-(2-метоксиэтил)-4-(2,3-дифтор-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат, ) изопропил-(2-метоксиэтил)-4-(2,3-дифтор-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат,(+) изопропил-(2-метоксиэтил)-4-(2,3-дифтор-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат, (-) изопропил-(2-метоксиэтил)-4-(2,3-дифтор-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат, (  ) изопропил-(2-метоксиэтил)-4-(2,5-дифтор-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат, ) изопропил-(2-метоксиэтил)-4-(2,5-дифтор-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат,(+) изопропил-(2-метоксиэтил)-4-(2,5-дифтор-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат, (-) изопропил-(2-метоксиэтил)-4-(2,5-дифтор-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат, (  ) изопропил-(2-метоксиэтил)-4-(2,6-дифтор-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат, ) изопропил-(2-метоксиэтил)-4-(2,6-дифтор-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат,(+) изопропил-(2-метоксиэтил)-4-(2,6-дифтор-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат, (-) изопропил-(2-метоксиэтил)-4-(2,6-дифтор-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат, (  ) изопропил-(2-метоксиэтил)-4-(2,5-дихлор-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат, ) изопропил-(2-метоксиэтил)-4-(2,5-дихлор-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат,(+) изопропил-(2-метоксиэтил)-4-(2,5-дихлор-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат, (-) изопропил-(2-метоксиэтил)-4-(2,5-дихлор-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат, (  ) изопропил-(2-метоксиэтил)-4-(2-хлор-6-фтор-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат, ) изопропил-(2-метоксиэтил)-4-(2-хлор-6-фтор-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат,(+) изопропил-(2-метоксиэтил)-4-(2-хлор-6-фтор-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат, (-) изопропил-(2-метоксиэтил)-4-(2-хлор-6-фтор-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат, (  ) изопропил-(2-метоксиэтил)-4-(2-фтор-3-трифторметилфенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат, ) изопропил-(2-метоксиэтил)-4-(2-фтор-3-трифторметилфенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат,(+) изопропил-(2-метоксиэтил)-4-(2-фтор-3-трифторметилфенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат, (-) изопропил-(2-метоксиэтил)-4-(2-фтор-3-трифторметилфенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат, (  ) изопропил-(2-метоксиэтил)-4-(3-хлор-2-циано-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат, ) изопропил-(2-метоксиэтил)-4-(3-хлор-2-циано-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат,(+) изопропил-(2-метоксиэтил)-4-(3-хлор-2-циано-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат, (-) изопропил-(2-метоксиэтил)-4-(3-хлор-2-циано-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат, (  ) изопропил-(2-метоксиэтил)-4-(2-циано-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат, ) изопропил-(2-метоксиэтил)-4-(2-циано-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат,(+) изопропил-(2-метоксиэтил)-4-(2-циано-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат, (-) изопропил-(2-метоксиэтил)-4-(2-циано-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат, (  ) трет. -бутил-(2-метоксиэтил)-4-(3-циано-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат, ) трет. -бутил-(2-метоксиэтил)-4-(3-циано-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат,(+) трет. -бутил-(2-метоксиэтил)-4-(3-циано-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат, (-) трет. -бутил-(2-метоксиэтил)-4-(3-циано-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат, (  ) циклогептил-(2-метоксиэтил)-4-(3-циано-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат, ) циклогептил-(2-метоксиэтил)-4-(3-циано-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат,(+) циклогептил-(2-метоксиэтил)-4-(3-циано-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат, (-) циклогептил-(2-метоксиэтил)-4-(3-циано-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат, (  ) циклопентил-(2-метоксиэтил)-4-(2-хлор-3-циано-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат, ) циклопентил-(2-метоксиэтил)-4-(2-хлор-3-циано-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат,(+) циклопентил-(2-метоксиэтил)-4-(2-хлор-3-циано-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат, (-) циклопентил-(2-метоксиэтил)-4-(2-хлор-3-циано-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат, (  ) циклопентил-(2-метоксиэтил)-4-(2-фтор-3-трифторметил-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат, ) циклопентил-(2-метоксиэтил)-4-(2-фтор-3-трифторметил-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат,(+) циклопентил-(2-метоксиэтил)-4-(2-фтор-3-трифторметил-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат, (-) циклопентил-(2-метоксиэтил)-4-(2-фтор-3-трифторметил-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат, (  ) (2-метоксиэтил)-(метил)-4-(2-фтор-3-трифторметил-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат, ) (2-метоксиэтил)-(метил)-4-(2-фтор-3-трифторметил-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат,(+) (2-метоксиэтил)-(метил)-4-(2-фтор-3-трифторметил-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат, (-) (2-метоксиэтил)-(метил)-4-(2-фтор-3-трифторметил-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат, (  ) циклопентил-(2-метоксиэтил)-4-(2-циано-3-хлор-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат, ) циклопентил-(2-метоксиэтил)-4-(2-циано-3-хлор-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат,(+) циклопентил-(2-метоксиэтил)-4-(2-циано-3-хлор-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат, (-) циклопентил-(2-метоксиэтил)-4-(2-циано-3-хлор-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоксилат. 3. Производное 1,4-дигидропиридина общей формулы I по п.1, представляющее собой сложный изопропиловый и 2-метоксиэтиловый эфиры 4-(2-хлор-3-циано-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоновой кислоты в виде рацемата. 4. Производное 1,4-дигидропиридина общей формулы I по п.1, представляющее собой сложный изопропиловый и 2-метоксиэтиловый эфиры 4-(2-хлор-3-циано-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоновой кислоты в виде (+)-энантиомера. 5. Производное 1,4-дигидропиридина общей формулы I по п.1, представляющее собой сложный изопропиловый и 2-метоксиэтиловый эфиры 4-(2-хлор-3-циано-фенил)-1,4-дигидро-2,6-диметилпиридин-3,5-дикарбоновой кислоты в виде (-)-энантиомера. 6. 2-Хлор-3-циано-бензальдегид формулы 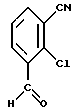 представляющий собой промежуточный продукт для получения производных 1,4-дигидропиридина общей формулы I по п.1. 7. Фармацевтическая композиция, обладающая антагонистической активностью в отношении катионов кальция, содержащая активное вещество на основе производных дигидропиридина и по меньшей мере один инертный, фармацевтически пригодный носитель, отличающаяся тем, что она в качестве активного вещества содержит соединение общей формулы II 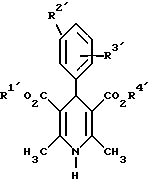 где R1‘ и R4‘ одинаковы или различны и означают неразветвленный или разветвленный алкил с 1 – 8 атомами углерода, незамещенный или замещенный неразветвленным или разветвленным алкоксилом с 1 – 6 атомами углерода или гидроксилом, или циклоалкил с 3 – 7 атомами углерода; R2′ и R3′ одинаковы или различны и означают галоген, циано, этинил, трифторметокси, метил, метилтио, трифторметил или неразветвленный, или разветвленный алкоксил с 1 – 4 атомами углерода, или R2′ или R3′ означает водород, смесь его изомеров или его отдельный изомер в эффективном количестве. РИСУНКИ
PC4A – Регистрация договора об уступке патента Российской Федерации на изобретение
Прежний патентообладатель:
(73) Патентообладатель:
Дата и номер государственной регистрации перехода исключительного права: 10.08.2009 № РД0053499
Извещение опубликовано: 20.09.2009 БИ: 26/2009
|
||||||||||||||||||||||||||
