|
|
(21), (22) Заявка: 2004106699/13, 09.03.2004
(24) Дата начала отсчета срока действия патента:
09.03.2004
(43) Дата публикации заявки: 20.08.2005
(45) Опубликовано: 27.03.2006
(56) Список документов, цитированных в отчете о
поиске:
POLLEY A., SEIGNER E., GANAL M.W. “Identification of sex in hop (Humulus lupulus) using molecular markers” Genome, 1997, v.40, p.p.357-351.
US 6180345, 30.01.2001.
SU 510203 A, 15.04.1976.
Адрес для переписки:
127550, Москва, ул. Тимирязевская, 49, ФГОУ ВПО МСХА им. К.А. Тимирязева, патентный отдел, НИЧ
|
(72) Автор(ы):
Данилова Татьяна Викторовна (RU),
Карлов Геннадий Ильич (RU)
(73) Патентообладатель(и):
Федеральное государственное образовательное учреждение высшего профессионального образования “Московская сельскохозяйственная академия им. К.А. Тимирязева” (RU)
|
(54) СПОСОБ МОЛЕКУЛЯРНОГО МАРКИРОВАНИЯ ПОЛА ХМЕЛЯ ОБЫКНОВЕННОГО (HUMULUS LUPULUS L)
(57) Реферат:
Изобретение относится к области молекулярной биологии, в частности при селекции хмеля для определения пола растений на стадии проростков. Определяют пол гибридных растений хмеля на стадии сеянцев с помощью молекулярного маркирования, где используют две комбинации олигонуклеотидных праймеров для проведения полимеразной цепной реакции, которые обеспечивают амплификацию специфичных для мужских растений фрагментов ДНК. Изобретение повышает эффективность селекции и позволяет сократить затраты труда, средств, площадей и времени. 3 ил., 1 табл. 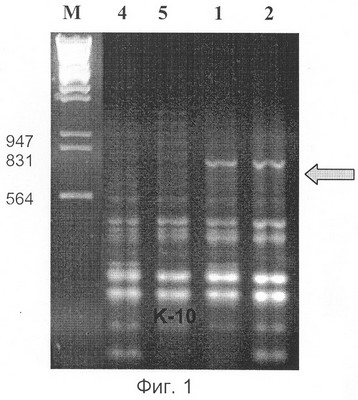
Предлагаемое изобретение относится к области молекулярной биологии и может быть использовано в селекции хмеля для определения пола растений хмеля на стадии проростков. Хмель обыкновенный, Humulus lupulus L. (Cannabiaceae) – многолетняя двудомная лиана. Шишки хмеля (соплодия), образующиеся на женских растениях, являются важнейшим сырьем для пивоварения, применяется в медицине, парфюмерной и хлебопекарной промышленности. В производственных целях возделывают женские растения хмеля, которые размножают вегетативно. Мужские растения используют только в селекции для проведения гибридизации.
Известные способы определения пола растений хмеля:
1. По морфологии мужских и женских цветков.
При высоком уровне питания и выращивании в теплице сеянцы зацветают в первый год жизни (Либацкий Е.П. Хмелеводство. – М.: Колос, 1993. -287с.). Однако для экономии материальных ресурсов и затрат труда желательно, чтобы пол сеянцев был определен на ранних этапах их развития, и для дальнейшего выращивания и оценки были отобраны только женские растения.
2. С помощью молекулярных маркеров (Polley A., Seigner E., Ganal M.W. Identification of sex in hop (Humulus lupulus) using molecular markers. Genome, 1997, v.40, p.p.357-351). Маркер, полученный этими исследователями, разработан на основе RAPD – анализа. Он был опробован на небольшом количестве образцов хмеля немецкого происхождения. По сведениям CERENAK, Andreja, JAVORNIK, Branka (Application of male STS marker in hop (Humulus lupulus L.) breeding. Proceedings of the Scientific Commission, Pulawy, Poland, 27-30 July 1999. [S.1.]: International Hop Growers’ Convention, 1999, p.39-42), данный маркер не пригоден для ряда сортов.
Наиболее близким по технической сущности к заявляемому изобретению относится способ, предложенный в вышеуказанной статье Polley A., Seigner E., Ganal M.W. Identification of sex in hop (Humulus lupulus) using molecular markers. Genome, 1997, v.40, p.p.357-351. Пол растений предлагается определятся с помощью молекулярных маркеров, разработанных на основе сиквенса специфичных для мужских растений хмеля продуктов полимеразной цепной реакции (ПЦР) со случайными праймерами (RAPD).
Предлагаемая авторами пара олигонуклеотидных праймеров
5′- ACAGAGTACAACTCAGAAACAAACC-3′
5′-AAGGTCGCACAATGACCG-3′
обеспечивает амплификацию в процессе ПЦР специфичного для мужских растений фрагмента ДНК, который выявляется с помощью электрофореза в агарозном геле. В указанной статье авторы приводят следующие методики:
Выделение ДНК:
1. 9 г свежих листьев хмеля замораживали в жидком азоте и измельчали до порошкообразного состояния.
2. Добавляли к измельченным листьям 19 мл экстрагирующего буфера (Буфер содержит 100 мМ ацетата натрия, 50 мМ ЭДТА, 500 мМ NaCl, 2% поливинил пиролидона, 1,4% SDS, 60 мМ цистеина, рН 5,5).
3. Смесь инкубировали 30 мин при 65°С.
4. Дважды проводили очистку смесью хлороформ / изоамиловый спирт (24:1).
5. Преципитация ДНК этанолом.
6. Осажденную ДНК растворяли в буфере, содержащем 10 мМ Tris и 1 мМ ЭДТА рН 8.
Условия проведения ПЦР с STS праймерами:
Начальная денатурация: 3 мин, 94°С.
35-45 циклов:
1 мин 94°С,
1 мин 65°С,
2 мин 72°С.
Конечный синтез: 7 мин, 72°С.
Предлагаемый нами способ определения пола у растений хмеля также основан на применении молекулярного маркирования. Маркер разработан на основе ISSR-ПЦР анализа (Inter simple sequence repeats или межмикросателлитный анализ) при исследовании молекулярно-генетического полиморфизма сортов и мужских образцов хмеля. Праймеры были получены после выделения и секвенирования (определения нуклеотидной последовательности) специфичных для мужских растений продуктов ПНР, полученных с двумя микросателлитными праймерами. На фиг.1 стрелкой указан специфичный для мужских растений фрагмент ДНК размером около 700 пн (1,2 – фореграммы мужских растений, 4,5 – женских растений хмеля), полученный с микросателлитным праймером [AC]8YG. На фиг.2 стрелкой указан специфичный для мужских растений фрагмент ДНК размером около 500 пн (обозначения те же, что на фиг.1), полученный с микросателлитным праймером [CA]8GT.
Предлагаемые нами молекулярные маркеры (две комбинации олигонуклеотидных праймеров) пригодны для определения пола у широкого спектра сортообразцов хмеля. Они были опробованы на 33 мужских линиях и 53 сортобразцах (женских растениях) хмеля. Были испытаны образцы местных популяций, сорта хмеля различного эколого-географического происхождения, в том числе российские, некоторые европейские и американские сорта (см. прилагаемую таблицу). Во всех случаях пол растений был определен правильно.
Заявляемое решение направлено на решение задачи – повышение эффективности селекции хмеля за счет сокращения затрат труда, средств, площадей (в теплицах или в поле) и времени, требуемых на возделывание мужских гибридных растений хмеля до начала цветения, когда появляется возможность их отобрать. Хмель является двудомным растением. В результате гибридизации селекционер получает, как правило, 50% мужских и 50% женских растений. Селекционную ценность представляют женские растения хмеля. Если селекционное учреждение имеет возможность возделывать гибридные растения в теплице, то они зацветают через год, если гибридные сеянцы высаживают в поле, то большинство растений зацветает на второй год. Таким образом, в течение одного года в теплице или двух лет в поле приходится выращивать около 50% балластных растений. Молекулярное маркирование позволяет определить пол растения хмеля на стадии сеянцев. Для этого требуется растительный материал (молодой лист сеянца хмеля), сухая масса которого не превышает 25 мг.
Для решения указанной задачи предлагаются две комбинации олигонуклеотидных праймеров, обеспечивающих амплификацию специфичных для мужских растений фрагментов ДНК:
11 OF 5′ GGG ACT CGG TAA CAC AGA AAG GCA
110R 5′ AGC CCC ACC TAC ACC ACG АСА АСС
(амплификация фрагмента ДНК длиной 542 пар нуклеотидов)
422F 5′ CAG TGT TTC TCT CGG GTT CTC TTG
422R 5′ ААС CAC АСА TAA TTC CCA TCT TGC
(амплификация фрагмента ДНК длиной 387 пар нуклеотидов)
Для предлагаемых комбинаций праймеров: 110F, R и 422F,R были подобраны условия проведения ПЦР, обеспечивающие хорошо воспроизводимую амплификацию специфичного фрагмента у мужских растений хмеля, проявляющегося при форезе в виде яркой полосы. На фиг.3 стрелками указаны специфичные для мужских растений (обозначены цифрами 1, 2, 3) фрагменты ДНК размером около 542пн и 387пн, полученные с комбинациями праймеров 110F,R и 422F,R соответственно. У женских растений (обозначены цифрами 4, 5, 6) указанные фрагменты ДНК не амплифицируются.
Для определения пола растений необходимо:
1) выделить ДНК,
2) провести ПЦР,
3) провести форез в агарозном геле.
Выделение ДНК (метод SDS).
1. Смешать измельченный образец (10-20 мг высушенных лиофилизацией листьев хмеля) с 600 мкл SDS-буфера (100 мМ Трис-PH, рН 8, 50 мМ Na2EDTA, 500 мМ NaCI, 1,25% SDS, 2% поливинил пиролидона, непосредственно перед использованием добавить в буфер 40-50 мг Na2S2O5 на каждые 10 мл). Пробирки инкубировать 45 мин в водяной бане при 60°С, переворачивая каждые 15 мин.
2. Добавить 1 объем смеси хлороформ / изоамиловый спирт (24:1), перемешивать 10-15 мин, затем центрифугировать 10 мин при 10000 об/мин.
3. К надосадочной жидкости, перенесенной в новую пробирку, добавить 0,7 объема изопропанола, центрифугировать 10 мин при 10000 об/мин.
4. ДНК промыть в течение 30 мин в 500 мкл 76% этанола с 0,2М NaAc, затем 5 мин – в 100 мкл 70% этанола. Высушенную ДНК растворить в H2O mQ.
Условия проведения ПЦР
Полимеразная цепная реакция проводилась в амплификаторе Терцик МС2 (АО ДНК-технология, Москва). Реакционная смесь для ПЦР объемом 25 мкл включает: Taq-буфер (Силекс М) (70 мМ Трис-HCl, рН 8,6 (25°С), 0,001% Тритон X 100, 16,6 мМ (NH4)2SO4, 2,5 мМ MgCl2),
0,25 мМ каждого dNTP (Силекс М),
0,5 мкМ каждого праймера (ЗАО Синтол),
100-150 нг ДНК, 1 ед. Taq-полимеразы (Силекс М),
2% Formamide (Serva).
В пробирки поверх раствора добавить 25 мкл минерального масла.
| Циклы ПЦР: |
|
| начальная денатурация: 94°С |
5 мин |
| 30 циклов: |
|
| 94°С |
1 мин |
| 110F, R-58° 422F,R-60°C |
1,5 мин |
| 72°С |
45 сек |
| конечный синтез: 72°С |
7 мин |
Для фореза можно использовать 1.5% агарозный гель и 0,5х Трис-борат буфер (0,089М Трис, 0,089М борная кислота, 0,002М ЭДТА).
Таким образом, способ молекулярного маркирования позволяет определять пол гибридных растений хмеля на стадии сеянцев, что повышает эффективность селекции за счет сокращения затрат труда, средств, площадей (в теплицах или в поле) и времени (1-2 года), требуемых на возделывание мужских гибридных растений хмеля до начала цветения, когда появляется возможность их отбраковки.
Таблица 1
Перечень и происхождение сортов и линий хмеля, использованных для тестирования молекулярных маркеров пола. |
| №п/п |
№ДНК |
Название образца |
Место оригинального происхождения |
Родословная |
| 1 |
21 |
Аполлон |
Югославия |
Brewer’s Gold (Англия) × 3/3 (югославский дикорастущий) |
| 2 |
22 |
Коно |
Бельгия |
Возможно, происходит от Brewer’s Gold |
| 3 |
26 |
Полюншер |
Австрия |
– |
| 4 |
27 |
Порфир 16 |
Украина |
– |
| 5 |
114 |
Клон 18 |
Украина, УИСХ |
Индивидуальный отбор из сортосмеси Житомирской области чешского происхождения |
| 6 |
112 |
Орловский |
Россия |
– |
| 7 |
30 |
Нордгаард 978 |
Дания |
– |
| 8 |
127 |
Крылатский (1992) |
Россия, Моск. обл., РНИСХ |
Гибрид 38-4 от свободного опыления сорта Мурановский (Россия, РНИХС) |
| 9 |
25 |
Лейт Кластер |
США |
Гибрид от свободного опыления европейского English cluster с дикорастущим американским хмелем |
| 10 |
28 |
Сполэчны |
Украина |
– |
| 11 |
120 |
Э 88/20 |
Россия, Чувашия |
Образец из местной популяции |
| 12 |
124 |
Цивильский 1996 |
Россия, Чувашия, НИПТИХ |
Надеждинский (гибридный сорт получен в РНИСХ) × 14-13 (происходит из гибридной комбинации Серебрянка × Смолистый (свободное опыление)) |
| 13 |
121 |
Сумерь 1993 |
Россия, Моск. обл., РНИСХ |
Гибрид 38-11 от свободного опыления гибрида 14-38(Россия, РНИХС), происхождение которого не указывается |
| 14 |
23 |
К 692266 |
Япония |
– |
| 15 |
128 |
ЧА89/19 |
Алтай |
Образец из местной популяции |
| 16 |
29 |
Заклад |
Украина |
– |
| 17 |
122 |
Подвязный(1990) |
Россия, Моск. обл., РНИСХ |
Гибрид 14-17 от свободного опыления бельгийского сорта Юроп |
| 18 |
111 |
Ранний 1972 |
Россия, Моск. обл., РНИСХ |
Индивидуальный отбор из сортосмеси Кировской области |
| 19 |
115 |
Чувашский местный |
Россия, Чувашия |
Образец из местной популяции |
| 20 |
113 |
Литовский местный |
Литва |
– |
| 21 |
116 |
Гуслицкий |
Россия |
Местный стародавний сорт Московской области |
| 22 |
118 |
Жатецкий поздний |
Чехословакия |
– |
| 23 |
123 |
Э 88/12 |
Россия, Чувашия |
Образец из местной популяции |
| 24 |
125 |
Михайловский 2000 |
Россия, Чувашия, НИПТИХ |
Истринский 16 (МОВИР) × 24-10 (Ранний × свободное опыление) |
| 25 |
126 |
Дружный 1996 |
Россия, Чувашия, НИПТИХ |
Смолистый × 14-13 ((Серебрянка × Смолистый) × свободное опыление) |
| 26 |
119 |
Свалеф |
Швеция |
– |
| 27 |
109 |
Смолистый 1985 |
РНИХС |
Гибрид 11-36 Шпальтский (Германия) × 58-32 (Уштецкий (Чехия) × 20-4 × 7-33 (происхождение не уточняется) |
| 28 |
110 |
Истринский 15 1980 |
МОВИР |
Заацер (Чехия) × (Клон 18 × дикорастущий из Тибета) |
| 29 |
20 |
Ахилл |
Словения |
Brewer’s Gold × 3/3 |
| 30 |
133 |
Northern Brewer |
Германия |
Canterbury Golding × OB21 (от Brewer’s Gold) |
| 31 |
134 |
Oswald clone 114 |
Германия |
– |
| 32 |
135 |
Original Saazer |
Чехия |
Местный сорт |
| 33 |
136 |
US Hallertauer |
США |
– |
| 34 |
137 |
Fuggle |
Англия |
Местный сорт |
| 35 |
138 |
Spalter |
Германия |
Местный сорт |
| 36 |
139 |
Hallertauer mittelfrueh |
Германия |
Местный сорт |
| 37 |
140 |
Hersbrucker |
Германия |
Местный сорт |
| 38 |
141 |
Perle |
Германия |
Northern Brewer × 63/5/27M (Hallertauer Mfr, Spalter, Saazer) |
| 39 |
142 |
Oswald clone |
Германия |
– |
| 40 |
143 |
Spalter В 1914 |
Германия |
– |
| 41 |
144 |
US Tettnanger 1 |
США |
– |
| 42 |
145 |
Saazer |
Чехия |
Местный сорт |
| 43 |
147 |
Tettnanger |
Германия |
Местный сорт |
| 44 |
149 |
Liberty |
США |
Hallertauer Mfr.(2n=4x=40) × 64035M(67% Hallertauer Mfr, 17% German hop, 16%. неизвестно) |
| 45 |
150 |
Taurus |
Германия |
82/39/37 × 85/54/15М |
| 46 |
151 |
Hersbruecker spat |
Германия |
Местный сорт |
| 47 |
152 |
Brewer’s Gold |
Англия |
ВВ1 (дикорастущий хмель из Манитобы, Канада) × свободное опыление |
| 48 |
154 |
Magnum |
Германия |
Galena × 75/5/3 немецкого происхождения |
| 49 |
155 |
Wye Challenger |
Англия |
17/54/2 × 1/61/57М |
| 50 |
156 |
Density |
Англия |
Keyworth’s Midseason (происходит от Y90 – дикорастущий из Нью Мексико) × мужское растение английского происхождения |
| 51 |
157 |
Olympic |
США |
(Brewer’s Gold2 × Fuggle-Fuggle S) × (Brewer’s Gold2 × East Kent Golding – Bavarian Seedling) |
| 52 |
158 |
Cascade |
США |
[(Fuggle × (Серебрянка × Fuggle)] × свободное опыление |
| 53 |
159 |
Galena |
США |
Brewer’s Gold × свободное опыление |
| «-» родословная неизвестна |
| Мужские растения |
| №п/п |
№ДНК |
Название образна |
Место оригинального происхождения |
Родословная |
| Материнская форма-сорт |
Отцовская форма и ее происхождение |
| 1 |
31 |
2-6 |
НИПТИХ |
Истринский 15 |
ПМФ23 (Истринский 15 × от комбинации сорта Смолистый) |
| 2 |
32 |
3-9 |
НИПТИХ |
Аниевский (местный сорт) |
ПМФ64 (Кругляк Серяк × от Смолистый) |
| 3 |
33 |
9-3 |
НИПТИХ |
Сумерь |
ПМФ24 (Истринский 15 × от Серебрянка) |
| 4 |
34 |
1-4 |
НИПТИХ |
Гибрид 5642 (Украина) |
ПМФ24 (Ф-102 (Литва) × от Серебрянка) |
| 5 |
35 |
5-5 |
НИПТИХ |
Роудницкий(Чехия) |
ПМФ23 (Истринский 15 × от Смолистый) |
| 6 |
36 |
5-24 |
НИПТИХ |
-“- |
-“- |
| 7 |
37 |
3-1 |
НИПТИХ |
Подвязный |
ПМФ2 (Гуслицкий × от Урожайный) |
| 8 |
38 |
2-7 |
НИПТИХ |
Югославский красностебельный |
ПМФ37 (Серебрянка Калистовская × от Смолистый) |
| 9 |
39 |
2-20 (?2-26) |
НИПТИХ |
-“- |
-“- |
| 10 |
40 |
6-7 |
НИПТИХ |
Густяк (старинный местный сорт) |
ПМФ58 (Смолистый × от Смолистый) |
| 11 |
41 |
7-1 |
НИПТИХ |
Сумерь |
ПМФ68 (Фредос, Бельгия × от Урожайный) |
| 12 |
42 |
7-2 |
НИПТИХ |
-“- |
-“- |
| 13 |
43 |
8-5 |
НИПТИХ |
Подвязный |
ПМФ57 (Смолистый × от Урожайный) |
| 14 |
44 |
8-7 |
НИПТИХ |
-“- |
-“- |
| 15 |
45 |
8-9 |
НИПТИХ |
-“- |
-“- |
| 16 |
46 |
8-10 |
НИПТИХ |
-“- |
-“- |
| 17 |
47 |
9-13 |
НИПТИХ |
Лейт Кластер (США) |
Свободное опыление |
| 18 |
48 |
11-11 |
НИПТИХ |
Сумерь |
-“- |
| 19 |
49 |
11-17 |
НИПТИХ |
-“- |
-“- |
| 20 |
50 |
12-2 |
НИПТИХ |
Истринский 15 |
-“- |
| 21 |
58 |
13-9 |
НИПТИХ |
-“- |
-“- |
| 22 |
59 |
13-11 |
НИПТИХ |
-“- |
-“- |
| 23 |
60 |
14-9 |
НИПТИХ |
Чувашский местный |
-“- |
| 24 |
61 |
15-1 |
НИПТИХ |
Смолистый |
-“- |
| 25 |
64 |
17-5 |
НИПТИХ |
Дружный |
-“- |
| 26 |
68 |
17-18 |
НИПТИХ |
-“- |
-“- |
| 27 |
76 |
1-34 |
НИПТИХ |
Югославский красностебельный |
-“- |
| 28 |
77 |
1-35 |
НИПТИХ |
-“- |
-“- |
| 29 |
78 |
1-36 |
НИПТИХ |
-“- |
-“- |
| 30 |
79 |
2-7 |
НИПТИХ |
Подвязный |
-“- |
| 31 |
80 |
8-19 |
НИПТИХ |
-“- |
-“- |
| 32 |
|
WH |
Университет Хоенхайм, Штуттгарт |
Дикорастущий из Германии |
| 33 |
|
Воронеж 12 |
Воронежская область |
Дикорастущий из Воронежской области |
Формула изобретения
Способ молекулярного маркирования пола хмеля обыкновенного (Humulus lupulus L), включающий проведение полимеразной цепной реакции (ПЦР), отличающийся тем, что используют комбинацию олигонуклеотидных праймеров 5′ GGG ACT CGG TAA CAC AGA AAG GCA и 5′-AGC CCC ACC TAC ACC ACG ACA ACC, которая обеспечивает синтез специфичного для мужских растений хмеля фрагмента ДНК размером 542 пн, и комбинацию олигонуклеотидных праймеров 5’CAG TGT TTC TCT CGG GTT CTC TTG и 5′ AAC CAC ACA TAA TTC CCA TCT TGC, которая обеспечивает синтез специфичного для мужских растений хмеля фрагмента ДНК размером 387 пн.
РИСУНКИ
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 10.03.2007
Извещение опубликовано: 27.06.2008 БИ: 18/2008
|
|