|
|
(21), (22) Заявка: 2001116126/13, 08.11.1999
(24) Дата начала отсчета срока действия патента:
08.11.1999
(30) Конвенционный приоритет:
09.11.1998 US 60/107,646
(43) Дата публикации заявки: 10.06.2003
(45) Опубликовано: 27.03.2006
(56) Список документов, цитированных в отчете о
поиске:
WO 9733978 A, 18.09.1997. WO 9639487 A, 12.12.1996. US 5405772 A, 11.04.1995. WO 9804681 A, 05.02.1998. WO 9832333 A, 30.07.1998.
(85) Дата перевода заявки PCT на национальную фазу:
09.06.2001
(86) Заявка PCT:
EP 99/08482 (08.11.1999)
(87) Публикация PCT:
WO 00/27996 (18.05.2000)
Адрес для переписки:
129010, Москва, ул. Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. Е.Е.Назиной
|
(72) Автор(ы):
КАНЧЕДДА Раньери (IT),
ДОЦИН Беатриче (IT)
(73) Патентообладатель(и):
КОНСОРЦИО ПЕР ЛА ДЖЕСТИОНЕ ДЕЛЬ ЧЕНТРО ДИ БИОТЕКНОЛОДЖИЕ АВАНЦАТЕ (IT),
ИСТИТУТО НАЦЬОНАЛЕ ПЕР ЛА РИЧЕРКА СУЛЬ КАНКРО (IT)
|
(54) БЕССЫВОРОТОЧНАЯ СРЕДА ДЛЯ КУЛЬТУРЫ КЛЕТОК, ИСПОЛЬЗУЕМЫХ ДЛЯ РЕКОНСТРУКЦИИ КОСТНЫХ И ХРЯЩЕВЫХ СЕГМЕНТОВ (ВАРИАНТЫ)
(57) Реферат:
Изобретение относится к биотехнологии. Предложена бессывороточная среда для роста и пролиферации культуры клеток, используемых для реконструкции костных и хрящевых сегментов определенного состава (варианты). Изобретение позволяет получать клетки и использовать их для трансплантации. 2 н. и 4 з.п. ф-лы, 1 ил., 2 табл. 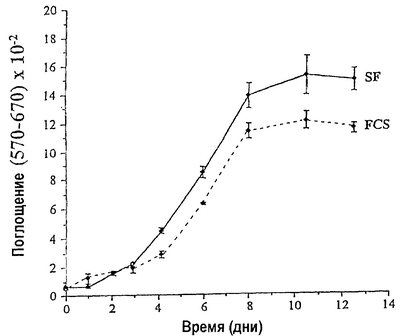
Предшествующий уровень техники
Трансплантация кости и хряща абсолютно необходима при реконструкции костных и хрящевых сегментов в пластической хирургии, травматологической хирургии или после удаления новообразований и т.д. Обычно для этой цели использовался материал человеческого (аутологичный от доноров или от трупов) или животного происхождения. В связи с возросшей потребностью клиницистов в тканях для трансплантации, расширяющейся областью в мире биомедицинских наук является возросшая потребность в микробиологической безопасности при трансплантации тканей, достижения в изучении клеточной биологии, клеточной дифференциации и тканевой инженерии, концепция реконструкции тканей из аутологичных или аллогенных клеток, выращенных in vitro. Клеточные источники для восстановления костей скелета включают хондроциты и клетки, относящиеся к линии дифференцировки хондроцитов, и мезенхимальные стволовые клетки, причем первые из них специфичны для хряща, а последние обладают многообразными свойствами и поэтому есть возможность их использования для замещения кости, хряща и других тканей.
Мезенхимальные стволовые клетки (МСК) обнаруживаются в костном мозге, а также в крови, дерме и надкостнице. Хотя эти клетки обычно присутствуют в костном мозге с низкой частотой, эти клетки можно выделить, очистить и размножить в культуре, например, как описано в патенте США №5486359.
Обычно размножение хондроцитов и МСК in vitro происходит в культуральной среде с добавками бычьей сыворотки или оптимально аутологичной сыворотки от пациента. Однако присутствие в культурах хондроцитов и МСК сыворотки животных или аутологичной сыворотки имеет определенные недостатки и ограничения с точки зрения возможностей лечебного применения этих культур.
Например, сыворотка не является физиологической жидкостью, с которой большинство клеток тесно контактируют в ткани in vivo. Это особенно справедливо для хондроцитов, которые in vivo залиты в свою бессосудистую матрицу и в своем собственном росте и дифференциации зависят от различных факторов роста и цитокинов, действующих скорее аутокринным/панакринным образом, чем диффузией из отдаленного тока крови. Кроме того, часто существует высокая изменчивость между партиями сыворотки животных. Обширный скрининг сыворотки, требуемый для отбора партии, наиболее репрезентативной с точки зрения индуктивных воздействий in vivo, может потребовать больших затрат времени и средств. Получение аутологичной сыворотки от пациентов также связано с длительными затратами времени, и ее поставка ограничена. Сыворотка животного происхождения может, кроме того, содержать неизвестные патогены с последующим риском заражения пациента.
Таким образом, желательны замещающие сыворотку среды для культивирования клеток, которые можно применять in vivo в лечебных целях.
Сущность изобретения
Настоящее изобретение предоставляет заместитель сыворотки для культивирования клеток in vitro с использованием хорошо определенных факторов, способных поддерживать жизнеспособность, пролиферацию и дифференциацию клеток также эффективно, как среда, содержащая сыворотку.
В предпочтительном варианте клетки представляют суставные хондроциты или мезенхимальные стволовые клетки.
В одном аспекте изобретение включает композицию для размножения хондроцитов, включающую минимально незаменимую среду, фактор роста, альбумин, стероид, антиоксидант, источник железа, жирную кислоту и/или источник липида и инсулин. В особенно предпочтительном варианте реализации бессывороточная ростовая среда для хондроцитов включает FGF-2 в качестве фактора роста, линолевую кислоту в качестве источника липида/жирной кислоты, аскорбиновую кислоту и  -меркаптоэтанол в качестве антиоксидантов, голо- и апотрансферрин в качестве источника железа и дексаметазон в качестве стероида. Необязательные ингредиенты могут включать холестерин, металлические микроэлементы, такие как селен, и витамины, такие как биотин и пантотенат натрия. -меркаптоэтанол в качестве антиоксидантов, голо- и апотрансферрин в качестве источника железа и дексаметазон в качестве стероида. Необязательные ингредиенты могут включать холестерин, металлические микроэлементы, такие как селен, и витамины, такие как биотин и пантотенат натрия.
В другом аспекте изобретение включает композицию для поддержания мезенхимальных стволовых клеток, включающую фактор роста, альбумин, стероид, антиоксидант, источник железа, жирную кислоту и/или источник липида, один или несколько витаминов, один или несколько металлических микроэлементов, и фактор роста IGF-1 в комбинации с минимально незаменимой средой. В особенно предпочтительном варианте реализации бессывороточная ростовая среда для мезенхимальных стволовых клеток включает FGF-2, LIF и SCF в качестве факторов роста, пантотенат натрия и биотин в качестве витаминов и селен в качестве металлического микроэлемента.
Краткое описание чертежей
На чертеже показано сравнение кинетики роста суставных хондроцитов в среде, содержащей FCS и в бессывороточной среде настоящего изобретения.
Подробное описание изобретения
Настоящее изобретение предоставляет бессывороточные композиции, подходящие для роста и пролиферации хондроцитов и мезенхимальных стволовых клеток. Композиция может включаться в основную минимально незаменимую среду, такую как модифицированная по Coon среда Ham F-12, следующие компоненты в качестве замещения сыворотки:
i) один или несколько факторов роста или белков, которые вызывают переход клеток, находящихся в состоянии покоя, в состояние деления и/или дифференцировки, такие как инсулин, FGF-2, PDGFbb, EGF, LIF и SCF и IGF-1;
ii) один или несколько стероидов, таких как дексаметазон;
iii) один или несколько источников липидов и жирных кислот, необходимых для биосинтеза клеточных мембран, таких как холестерин и линолевая кислота; и
iv) источник железа, такой как трансферрин.
FGF-2, PDGFbb и EGF являются мощными митогенами для клеток мезенхимального происхождения. Известно, что дексаметазон in vitro удерживает клетки в фазе циклического развития.
Бессывороточная среда настоящего изобретения может, кроме того, включать:
i) альбумин (предпочтительно видов млекопитающих), который функционирует в качестве неспецифического носителя;
ii) один или несколько антиоксидантов, таких как  -меркаптоэтанол; -меркаптоэтанол;
iii) добавку для транспорта коферемента при реакциях переноса карбоксильной группы, такую как биотин;
iv) микроэлементы, такие как дополнительный источник металла, необходимого для переноса электронов, и множество металлоферментов и белков, таких как селен;
v) витамины, такие как биотин и пантотенат; и
vi) аскорбиновую кислоту для облегчения организации внеклеточной матрицы.
Инсулин и дексаметазон добавляются в средних концентрациях, обычно указанных в литературе.
IGF-I, LIF и SCF присутствуют в концентрациях в диапазоне от около 5 до около 10 нг/мл; предпочтительно в концентрации 5 нг/мл. Все другие компоненты включены в диапазоне концентрации, обычно используемой в исследованиях культуры клеток.
В предпочтительном варианте реализации композиции, подходящей для роста и пролиферации хондроцитов, определенные компоненты включают EGF, PDGFbb и FGF-2, аскорбиновую кислоту, линолевую кислоту, сывороточный альбумин человека (HSA),  -меркаптоэтанол, дексаметазон, инсулин, человеческий голо- и апотрансферрин. В этом варианте реализации FGF-2, PDGFbb и EGF присутствуют в концентрациях в диапазоне от около 1 до около 10 нг/мл. В предпочтительном варианте реализации FGF-2 PDGFbb и EGF присутствуют в концентрациях от 1 до 2 нг/мл. -меркаптоэтанол, дексаметазон, инсулин, человеческий голо- и апотрансферрин. В этом варианте реализации FGF-2, PDGFbb и EGF присутствуют в концентрациях в диапазоне от около 1 до около 10 нг/мл. В предпочтительном варианте реализации FGF-2 PDGFbb и EGF присутствуют в концентрациях от 1 до 2 нг/мл.
В предпочтительном варианте реализации композиции, подходящей для роста и пролиферации мезенхимальных стволовых клеток, определенные компоненты включают: EGF, PDGFbb и FGF-2, LIF, SCF, IGF-I, аскорбиновую кислоту, холестерин, HSA,  -меркаптоэтанол, дексаметазон, человеческий голо- и апотрансферрин, селен, биотин, пантотенат натрия. FGF-2, PDGFbb и EGF присутствуют в концентрациях в диапазоне от около 5 нг/мл до около 10 нг/мл каждого фактора. Предпочтительными концентрациями FGF-2, PDGFbb и EGF являются 10 нг/мл. Было обнаружено, что один FGF-2 является самым активным фактором для поддержания остеохондрогенного потенциала у МСК. -меркаптоэтанол, дексаметазон, человеческий голо- и апотрансферрин, селен, биотин, пантотенат натрия. FGF-2, PDGFbb и EGF присутствуют в концентрациях в диапазоне от около 5 нг/мл до около 10 нг/мл каждого фактора. Предпочтительными концентрациями FGF-2, PDGFbb и EGF являются 10 нг/мл. Было обнаружено, что один FGF-2 является самым активным фактором для поддержания остеохондрогенного потенциала у МСК.
ПРИМЕР 1
Суставной хрящ брали из коленного сустава молодых взрослых людей-доноров. Сначала образцы очищали от любых прикрепленных мышечных соединительных или подхрящевых костных тканей, измельчали на фрагменты размером 1-3 мм и полоскали в физиологическом растворе с фосфатным буфером (PBS). Затем высвобождали одиночные хондроциты с помощью повторного ферментативного расщепления при 37°С с 0,25% трипсина, 400 ЕД/мл коллагеназы I, 1000 ЕД/мл коллагеназы II и 1 мг/мл гиалуронидазы. Затем трипсин блокировали и удаляли с помощью быстрых и обильных промываний в PBS, содержащем ингибитор трипсина соевых бобов. Клетки высевали на чашки в зависимых от якорной подложки условиях в модифицированную по Coon среду Ham F-12 или с 10% плодной телячьей сывороткой (FCS, контрольная культура), или со следующими определенными компонентами: EGF, PDGFbb и FGF-2, аскорбиновая кислота, линолевая кислота, сывороточный альбумин человека (HSA),  -меркаптоэтанол, дексаметазон, инсулин, человеческий голо- и апотрансферрин. Ниже в табл.1 показаны предпочтительные количества каждого компонента. Для способствования прилипанию клеток в бессывороточных условиях чашки предварительно покрывали 2% желатином. -меркаптоэтанол, дексаметазон, инсулин, человеческий голо- и апотрансферрин. Ниже в табл.1 показаны предпочтительные количества каждого компонента. Для способствования прилипанию клеток в бессывороточных условиях чашки предварительно покрывали 2% желатином.
Инсулин можно не замещать IGF-I в среде для хондроцитов. Инсулин был предпочтительно в концентрации 5 мкг/мл. Обычными способами, но необязательно, могут быть включены селен, биотин, пантотенат натрия и холестерин.
ТАБЛИЦА 1
Добавка в среду для бессывороточного размножения человеческих хондроцитов |
| ИНГРЕДИЕНТ |
КОНЦЕНТРАЦИЯ |
| (Основная среда: модифицированная по Coon Среда Ham F-12) |
| FGF-2 |
1-10 нг/мл |
| PDGFbb |
1-10 нг/мл |
| EGF |
1-10 нг/мл |
| Инсулин |
5 мкг/мл |
| Дексаметазон |
10-8 М |
| Аскорбиновая кислота |
50 мкг/мл |
| Трансферрин |
20-50 мкг/мл |
| HSA |
1% |
| Линолевая кислота |
6 мкМ |
 -меркаптоэтанол -меркаптоэтанол |
5×10-5 М |
ПРИМЕР 2
Образец костного мозга, взятый из гребня подвздошной кости пациента, дважды промывали PBS. Клетки с ядрами подсчитывали с использованием красителя метил фиолетового и высевали на чашки в количестве 5×106 клеток в виде не фракционированного костного мозга на 10 см чашки для культуры ткани. Для отбора и размножения клетки сохраняли в модифицированной по Coon среде Ham F-12 (F-12) с добавлением или 10% FCS и 1 нг/мл FGF-2 (контрольная культура), или следующих определенных компонентов: EGF, PDGFbb, FGF-2, LIF, SCF, IGF-I, аскорбиновая кислота, холестерин, HSA,  -меркаптоэтанол, дексаметазон, инсулин, человеческий голо- и апотрансферрин, селен, биотин и пантотенат натрия. Ниже в табл.2 показаны предпочтительные количества каждого компонента. Для способствования прилипанию МСК клетки сначала высевали на чашки на 48 ч в среде F12 с добавлением 10% человеческой сыворотки и 1 нг/мл FGF-2. Затем среду удаляли и клетки обильно промывали PBS и оставляли еще на 24-48 ч в среде F12 без каких-либо добавок. Затем для способствования пролиферации клеток добавляли определенную смесь факторов. -меркаптоэтанол, дексаметазон, инсулин, человеческий голо- и апотрансферрин, селен, биотин и пантотенат натрия. Ниже в табл.2 показаны предпочтительные количества каждого компонента. Для способствования прилипанию МСК клетки сначала высевали на чашки на 48 ч в среде F12 с добавлением 10% человеческой сыворотки и 1 нг/мл FGF-2. Затем среду удаляли и клетки обильно промывали PBS и оставляли еще на 24-48 ч в среде F12 без каких-либо добавок. Затем для способствования пролиферации клеток добавляли определенную смесь факторов.
Один FGF-2 был самым активным фактором для поддержания остеохондрогенного потенциала в мезенхимальных стволовых клетках. Для поддержания жизнеспособности клеток предпочтительно добавлялись селен, биотин и пантотенат натрия. Наблюдалось, что LIF и SCF улучшали степень клеточной пролиферации, особенно в комбинации с IGF-I.
ТАБЛИЦА 2
Добавка в среду для бессывороточного размножения МСК |
| ИНГРЕДИЕНТ |
КОНЦЕНТРАЦИЯ |
| (Основная среда: модифицированная по Coon Среда Ham F-12) |
| Сывороточный альбумин человека |
1-2% |
| Трансферрин (апо/голо) |
20-50 мкг/мл |
| Аскорбиновая кислота |
50 мкг/мл |
 -меркаптоэтанол -меркаптоэтанол |
5×10-5 М |
| Холестерин |
30 мкг/мл |
| Селен |
30 нМ |
| Биотин |
33 мкм |
| Пантотенат Na |
17 мкМ |
| EGF/PDGF/FGF-2 |
1-10 нг/мл |
| Дексаметазон |
10-8 М |
| IGF-I |
5 нг/мл |
| LIF |
5 нг/мл |
| SCF |
5 нг/мл |
Исследования показали, что PDGFbb сам по себе увеличивает остеогенный потенциал МСК при включении на фазе пролиферации. Было обнаружено, что этот эффект усиливался с помощью комбинирования PDGFbb с FGF-2.
ПРИМЕР 3
Кинетика роста хондроцитов
В 0-й д. 5×103 клеток первого пассажа высевали в каждую лунку 24-луночной планшеты в присутствии FCS. После прилипания FCS удаляли и клетки обильно промывали PBS и оставляли на 2-3 д. в F12 без добавок для истощения остаточных следов сыворотки. Затем повторно вызывали пролиферацию с помощью добавления или 10% FCS, или смеси определенных компонентов, установленных для хондроцитов. Количество клеток оценивали в различные дни посредством окрашивания красителем тиазолилом синим (МТТ). Вкратце, удаляли культуральную среду и замещали 0,5 мл среды без добавок; затем в каждую анализируемую культуру добавляли 25 мкл МТТ (Sigma, St. Louis, МО) маточного раствора (5 мг/мл). Через 3 ч инкубации среду удаляли и превращенный краситель солюбилизировали абсолютным этанолом. Поглощение превращенного красителя измеряли при длине волны 570 нм с вычитанием фона при 670 нм.
Полученные данные (см. чертеж) ясно показывают, что определенная среда вызывает пролиферацию хондроцитов со скоростью и степенью, сравнимыми с таковыми, полученными в присутствии FCS.
ПРИМЕР 4
Потенциал дифференциации хондроцитов, размножившихся в бессывороточных условиях, исследовали и in vitro, и in vivo. Для анализа in vitro размножившиеся клетки переносили в зависимые от якорной подложки условия и поддерживали в виде осадочной культуры в течение 2-4 нед. в бессывороточной среде, которая, как ранее было показано Johnstone et al. (Johnstone, В., Hering, T.M., Caplan, A.I., Goldberg, V.M. and Yoo, J.U. Exp. Cell. Res. 238, 265-272, 1998), вызывает хондрогенез размножившихся в сыворотке МСК.
Для анализа in vivo размножившиеся клетки имплантировали на 2-8 нед. бестимусным мышам или в виде плотной клеточной суспензии, или после заливки в фибриновый гель (Tissucol). Ко времени анализов образцы фиксировали в формалине, заливали в парафин и делали срезы. Серийные срезы обрабатывали для гистологического (толуидиновый синий и алциановый синий) анализа и иммуногистохимии со специфичными по отношению коллагена антителами.
Результаты показали, что в отличие от хондроцитов, размножившихся в присутствии FCS, хондроциты, размножившиеся в бессывороточных условиях, непосредственно реформировали хрящевую структуру и in vitro, и in vivo, которая метахроматически окрашивалась толуидином синим и давала положительную реакцию на алциановый синий и коллаген II типа и преимущественно отрицательную на коллаген I типа. Напротив, в случае размножения в FCS наблюдалось тотальное отсутствие полного хондрогенеза и in vitro, и in vivo; в некоторых осадочных культурах максимум наблюдалось незначительное метахроматическое окрашивание, но в них всегда отсутствовали хорошо очерченные лакуны и хорошо организованный внеклеточный матрикс.
Эти данные иллюстрируют большое преимущество бессывороточной системы, которая обеспечивает возможность хондрогенеза, не требуя дополнительного культивирования в присутствии опухолевого фактора роста бета (TGF- ) или других факторов (индуцирующие условия Johnstone). Это может быть вызвано тем обстоятельством, что хондроциты в природе не вступают в контакт с сывороткой, которая может содержать элементы, ингибирующие хондрогенез. ) или других факторов (индуцирующие условия Johnstone). Это может быть вызвано тем обстоятельством, что хондроциты в природе не вступают в контакт с сывороткой, которая может содержать элементы, ингибирующие хондрогенез.
ПРИМЕР 5
Остеогенный потенциал МСК после размножения в определенных бессывороточных условиях исследовали in vivo с помощью имплантации размножившихся клеток бестимусным мышам после адсорбции на коллатрансплантат.
Исследовали несколько комбинаций условий для образования кости in vivo. Для всех комбинаций факторов среда содержала модифицированную по Coon среду Ham F-12, дексаметазон, FGF-2, PDGFbb, EGF, трансферрин, холестерин, сывороточный альбумин человека, биотин, селен, пантотенат Na и аскорбиновую кислоту (концентрации, как в табл.2). Исследовали следующие комбинации: 1) инсулин; 2) IGF-I; 3) инсулин и LIF; 4) инсулин и SCF; 5) инсулин, LIF и SCF; 6) IGF-I и LIF; 7) IGF-I и SCF; и 8) IGF-I, LIF и SCF.
После 8 нед. имплантации образцы декальцифицировали, заливали и обрабатывали для гистологического исследования, как описано выше. Срезы окрашивали гематоксилин-эозином. Все условия размножения позволили МСК реформировать костную ткань in vivo; однако количество образованной кости изменялось в зависимости от условий. Среди испытанных комбинаций комбинация IGF-I, LIF и SCF обеспечила оптимальную среду для размножения.
Формула изобретения
1. Бессывороточная среда для роста и пролиферации культуры клеток, используемых для реконструкции костных и хрящевых сегментов, отличающаяся тем, что для культуры хондроцитов среда включает FGF-2 в количестве 1-10 нг/мл, линолевую кислоту 6 мкМ, аскорбиновую кислоту 50 мкг/мл,  -меркаптоэтанол 5×10-5 М, трансферрин 20-50 мкг/мл, дексаметазон 10-8 М. -меркаптоэтанол 5×10-5 М, трансферрин 20-50 мкг/мл, дексаметазон 10-8 М.
2. Среда по п.1, дополнительно включающая EGF в количестве 1-10 нг/мл, PDGFbb 1-10 нг/мл, инсулин 5 мкг/мл, сывороточный альбумин человека 1%.
3. Среда по п.1 или 2, дополнительно включающая минимально незаменимую среду, такую, как модифицированная по Coon среда Ham F-12.
4. Бессывороточная среда для роста и пролиферации культуры клеток, используемых для реконструкции костных и хрящевых сегментов, отличающаяся тем, что для культуры мезенхимальных стволовых клеток, среда включает FGF-2 в количестве 1-10 нг/мл, LIF и SCF по 5 нг/мл, пантотенат натрия 17 мкМ, биотин 33 мкм, селен 30 нМ.
5. Среда по п.4, дополнительно включающая EGF, PDGFbb по 1-10 нг/мл, IGF-I 5 нг/мл, аскорбиновую кислоту 50 мкг/мл, холестерин 30 мкг/мл, сывороточный альбумин человека 1-2%,  -меркаптоэтанол 5×10-5 М, дексаметазон 10-8 М, трансферрин 20-50 мкг/мл. -меркаптоэтанол 5×10-5 М, дексаметазон 10-8 М, трансферрин 20-50 мкг/мл.
6. Среда по п.4 или 5, дополнительно включающая минимально незаменимую среду, такую, как модифицированная по Coon среда Ham F-12.
РИСУНКИ
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 09.11.2007
Извещение опубликовано: 27.07.2010 БИ: 21/2010
|
|