Патент на изобретение №2272838
|
||||||||||||||||||||||||||||||||||||||||||||
(54) ШТАММ БАКТЕРИИ BACILLUS MACERANS BS-04 – ПРОДУЦЕНТ ПЕКТИНАЗ, ПРОТЕАЗЫ, КСИЛАНАЗЫ И АМИЛАЗЫ
(57) Реферат:
Изобретение относится к отрасли микробиологической промышленности, в частности к производству ферментов, и представляет собой новый штамм Bacillus macerans BS-04 – продуцент пектиназ, протеазы, ксиланазы и амилазы. Данный штамм позволяет получить широкий комплекс ферментов и характеризуется коротким циклом роста с повышенным накоплением биомассы. 1 табл.
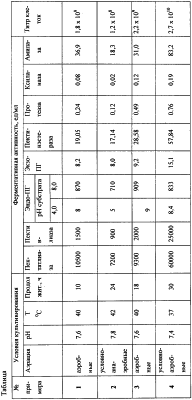
Изобретение представляет собой новый штамм Bacillus macerans BS-04 и относится к отрасли микробиологической промышленности, производящей ферментные препараты, и может быть использовано при получении ферментсодержащих лекарственных средств, применяемых для лечения и профилактики заболеваний, связанных с нарушениями процессов пищеварения; и при получении препаратов, применяемых с целью увеличения выхода и улучшения качества овощных и фруктовых соков и пюре, плодово-ягодного осветленного вина, эфирных и растительных масел, чая, при обработке трудноусвояемых растительных кормов и получении биологических добавок для сельского хозяйства. Известен Clostridium pectinofermentas шт. 15 – анаэробный продуцент мацерирующих ферментов, предназначенных для применения в льноперерабатывающей промышленности (1). Clostridium pectinofermentas шт. 15 синтезирует в процессе глубинного культивирования пектат-трансэлиминазу (0,55 ед/мл), экзо-полигалактуроназу (2,5 ед/мл), пектинэстеразу (0,13 ед/мл), ксиланазу (0,96 ед/мл) и не синтезирует эндо-полигалактуроназу и целлюлазу. Существенным недостатком указанного штамма является низкий уровень биосинтеза ферментов. Известен штамм Bacillus circulans шт.31 ЦМПМ В-1741 – продуцент мацерирующих ферментов (2). Bacillus circulans шт.31 является факультативным анаэробом. Оптимальные условия культивирования: рН среды 8,1-8,3; температура 37-42°С; время культивирования 36 ч. Продуцент синтезирует пектолитические ферменты: пектат-трансэлиминазу от 2 до 10 ед/мл, эндо-полигалактуроназу – 25 ед/мл. Существенными недостатками штамма Bacillus circulans шт.31 являются: низкая активность синтезируемых ферментов и длительный период культивирования продуцента. Известен штамм бактерии Bacillus circulans ВКМП-В-5622 – продуцент комплекса пектолитических ферментов и ксиланазы (3). Штамм синтезирует ферменты: пектат-трансэлиминазу – на среде, содержащей свекловичный жом, от 3800 до 6700 ед/мл; а на среде, содержащей картофельный крахмал от 10000 до 25000 ед/мл; эндо-полигалактуроназу от 32,57 до 87,7 ед/мл; экзо-полигалактуроназу от 12,0 до 36,77 ед/мл и ксиланазу до 30,8 ед/мл. Штамм культивируют в течение 10-18 ч при рН среды 7,8-8,6 и температуре 36-45°С. Наиболее близким аналогом (прототипом) к заявляемому штамму является штамм Bacillus macerans ЦМПМ В-2692 – продуцент пектолитических ферментов (4), который в условиях глубинного культивирования образует эндо-полигалактуроназу с активностью 6,7 ед/мл, экзо-полигалактуроназу с активностью 5,3 ед/мл и пектат-трансэлиминазу с активностью 9000 ед/мл. Культивирование продуцента осуществляют при температуре 32-35°С, рН 6,8-7,2 в течение 18-20 ч. Существенным недостатком указанного штамма является недостаточно высокая активность пектат-трансэлиминазы и узкий комплекс синтезируемых ферментов. Целью настоящего изобретения является получение высокоактивного штамма факультативно-анаэробной бактерии Bacillus macerans BS-04 – способного синтезировать широкий комплекс ферментов, обладающего повышенным синтезом пектиназ, а именно, пектат- и пектинлиаз, эндо- и экзо-полигалактуроназ, пектинэстеразы; и дополнительным синтезом протеазы, ксиланазы, амилазы, и характеризующегося коротким циклом роста с повышенным накоплением биомассы. Заявляемый штамм Bacillus macerans BS-04 выделен в результате многократного рассева исходного штамма Bacillus macerans ЦМПМ В-2692 и выделения моноспоровых вариантов. Штамм Bacillus macerans BS-04 имеет следующие культурально-морфологические и физиологические признаки. Культурально-морфологические признаки Клетки прямые, палочковидные, 2,0-5,0×0,9-1,0 мкм, подвижные, грамположительные, встречаются в длинных и коротких цепочках. Споры эллипсоидальные, без экзоспориума, 2,0-2,4×1,0-1,2 мкм, расположены центрально или субтерминально. На картофельном агаре: – на первые сутки рост хороший, колонии светло-бежевые, круглые, середина шершавая, матовая, края неровные, блестящие, размер колоний от 1 до 4 мм в диаметре. Пигмент в среду не диффундирует; – на вторые сутки колонии светло-бежевые, круглые, середина шершавая, матовая, края неровные, блестящие, размер колоний от 1 до 6 мм в диаметре; – на шестые сутки колонии от светло-бежевого до бежевого цвета, блестящие, однородные, круглые, края неровные, размер колоний от 1 до 6 мм в диаметре. На сусло-агаре: – на первые сутки колонии светло-бежевые с более светлой и плотной серединой, матовые, шершавые, края ровные, размер от 0,5 мм до 5 мм; – на вторые сутки колонии светло-бежевые с более плотной выпуклой, блестящей, непрозрачной серединой, края колонии матовые, шершавые, непрозрачные, неровные, размер колоний от 1 мм до 10 мм; – на третьи сутки колонии светло-бежевые с более светлой и плотной, чуть выпуклой серединой. Все колонии блестящие, полупрозрачные, края неровные. Размер колоний от 1 мм до 11 мм. На среде Чапека с глюкозой: – на первые сутки колонии однородные, выпуклые молочно-белого цвета, блестящие, прозрачные, края ровные, размер колоний от 0,5 мм до 1,5 мм; – на вторые сутки колонии неоднородные светло-бежевого цвета, середина блестящая в виде пуговки, края неровные, матовые, шершавые, размер колоний от 1 мм до 4 мм; – на третьи сутки колонии неоднородные светло-бежевого цвета, середина блестящая в виде пуговки, края неровные, матовые, шершавые, размер колоний от 1 мм до 7 мм; – на шестые сутки колонии неоднородные, края неровные, матовые, шершавые; середина блестящая в виде пуговки, непрозрачная, размер колоний 0,2-1,2 мм, цвет светло-бежевый. На среде Чапека с крахмалом: – на первые сутки размер колоний 0,01-0,5 мм, колонии блестящие, непрозрачные, однородные, выпуклые, цвет белый, края неровные; – на третьи сутки размер колоний 0,5-2,0 мм, колонии блестящие, непрозрачные, однородные, выпуклые, цвет молочно-белый, края неровные; – на четвертые сутки колонии 0,5-2,5 мм, блестящие, выпуклые, непрозрачные, цвет молочно-белый, центр более плотный (точечное уплотнение), края неровные глубоко изрезанные; – на шестые сутки колонии от 0,5 до 5 мм, непрозрачные, блестящие, неоднородные с точечным уплотнением в центре, края матовые, неровные. На мясопептонном агаре: – рост слабый, колонии точечные, бежевые. Физиолого-биохимическая характеристика штамма Отношение к углеводам: усваивает глюкозу, сахарозу, ксилозу, арабинозу, мальтозу и маннит с образованием кислоты и газа, гидролизует крахмал. Образует каталазу, ацетон, кристаллические декстрины. Нитраты редуцирует в нитриты. Фенилаланин не дезаминирует, тирозин не расщепляет. Аммиак и сероводород не образует. Гиппураты не гидролизует. Желатин разжижает на 1 см в верхней части. Молоко пептонизирует с образованием сгустка и газа. Растет на среде с 0,001% лизоцимом, не растет на среде с 5% хлористым натрием. Хорошо растет на ломтиках моркови, картофеля, репы, капусты белокочанной, кабачка, тыквы, яблока (некислых сортов) и груши с полной мацерацией субстрата. На среде с 1% азотнокислым натрием в анаэробных условиях отмечается задержка спорообразования. Отношение к кислороду – факультативный анаэроб. Минимальная температура роста +10°С, максимальная +45°С, оптимальная 37-42°С, рН 7,4-7,8. Время культивирования в аэробных условиях 10-18 ч, в условно-анаэробных – 18-30 ч. Продуцент подвержен сезонным влияниям, поэтому в весенний и осенний периоды наблюдается снижение ферментативной активности на 10-15%. Активность пектин- и пектатлиаз (на соответствующих субстратах) определяли путем спектрофотометрирования ненасыщенных продуктов реакции пектолиза, имеющих максимальную оптическую плотность при длине волны 235 нм по ТУ оп.5800665-2-91. За единицу активности принято такое количество фермента, которое за 1 ч при 40°С вызывает образование ненасыщенных продуктов реакции, увеличивающих оптическую плотность на 0,1. Эндо-полигалактуроназную активность (эндо-ПГ) определяли вискозиметрическим методом по ГОСТ 20264.3-81, экзо-полигалактуроназную активность (экзо-ПГ) определяли титрометрическим методом по увеличению восстанавливающих групп по ГОСТ 264.3-81, пектинэстеразную активность определяли по ГОСТ 20264.3-81, протеолитическую активность (щелочная протеаза) определяли, используя в качестве субстрата казеинат натрия по ГОСТ 20264.2-74, ксиланазную активность определяли по ТУ 9291-035-34588571-2001, амилазную активность определяли по ГОСТ 20264.4-89. Определение накопления биомассы (титр клеток) определяли методом предельных разведений. Определение мацерирующей способности проводили по тесту, основанному на определении изменения массы растительного субстрата в результате действия ферментов культуральной жидкости заявляемого продуцента. Степень мацерации растительных субстратов определяли по уменьшению массы обработанного ферментом субстрата по сравнению к контрольным вариантам и выражали в процентах. Примеры культивирования штамма Bacillus macerans BS-04 Пример №1 Культуру выращивали на среде, г/л:
Питательную среду разливали по 100 мл в качалочные колбы вместимостью 750 мл и стерилизовали при избыточном давлении 0,1 МПа в течение 45 мин. В качестве посевного материала использовали споры штамма Bacillus macerans BS-04, которые образуются на поверхности скошенного картофельного агара после инокулирования и выращивания в течение 48 ч при 40°С. Смывом с 1 косяка засевали 3 колбы в количестве 3% к объему питательной среды. Культивирование проводили в аэробных условиях на качалке с частотой вращения 180-200 об/мин при рН среды 7,6, температуре 40°С и в течение 10 ч. Пример №2 Культивирование проводили на среде в соответствии с примером №1, за исключением аэрации, температуры и рН среды. Выращивание проводили в условно-анаэробных условиях. С этой целью использовали круглые плоские колбы с узким горлом. Питательную среду наливали в количестве 0,5 объема колбы. Культивирование проводили при рН среды 7,8, температуре 42°С, в течение 24 ч без перемешивания. Пример №3 Культивирование проводили в течение 18 ч в условиях, соответствующих условиям примера №1. Состав питательной среды отличался от состава примера №1 дополнительным содержанием 1% казеина и 1% кормовых дрожжей “Биотрин”. Пример №4 Продуцент выращивали на среде, г/л:
Картофельный крахмал, входящий в состав питательной среды, предварительно осахаривали амилосубтилином ГЗх с АС 550 ед/г. Питательную среду по 300 мл разливали в колбы вместимостью 2 л и стерилизовали при 1,5 МПа. Культивирование осуществляли в условно-аэробных условиях при рН 7,4, температуре 37°С без перемешивания в течение 30 ч. По окончании культивирования продуцента проводили определение активностей ферментов в супернатанте, полученном из культуральной жидкости при центрифугировании при 5000 об/мин в течение 10 мин. Данные по результатам опытов представлены в таблице. Использование предлагаемого штамма Bacillus macerans BS-04 по сравнению с прототипом имеет следующие преимущества: 1. Повышенный синтез пектатлиазы до 60000 ед/мл (в прототипе до 9000 ед/мл), пектинлиазы до 25000 ед/мл (в прототипе – отсутствует). 2. Более высокий уровень синтеза эндо-полигалактуроназной активности: при рН субстрата 4,0 – до 9 ед/мл, а при рН субстрата 8,0 до 909 ед/мл (в прототипе – 6,7 ед/мл). 3. Более высокий уровень синтеза экзо-полигалактуроназной активности до 15,1 ед/мл (в прототипе – 5,3 ед/мл). 4. Синтез пектинэстеразной активности достигает 57,84 ед/мл (в прототипе – отсутствует). 5. Кроме вышеуказанных пектиназ штамм дополнительно синтезирует: щелочную протеазу (до 0,76 ед/мл), ксиланазу (до 0,19 ед/мл) и амилазу (до 83,2 ед/мл). 6. Повышенное накопление биомассы (титр клеток) достигает 2,7×1010 (в прототипе данные отсутствуют). Таким образом, предлагаемый штамм имеет значительные преимущества по сравнению с прототипом, что позволит при его промышленном использовании получать высокоактивные препараты с широким комплексом ферментов для медицинской и пищевой промышленности, а также для сельского хозяйства. Список литературы 1. Г.Б. Бравова и др. Труды ферментного отделения ВНИИсинтезбелок, т.1, СЭНТИ, 1972 г. 2. АС СССР №1349250 “Bacillus circulans шт.31 ЦМПМ В-1741 – продуцент мацерирующих ферментов”, 1985 г. 3. Патент РФ №2072691 “Штамм бактерий Bacillus circulans – продуцент комплекса пектолитических ферментов и ксиланазы”, приоритет 1994 г. 4. АС СССР №1162224 “Штамм Bacillus macerans ЦМПМ В-2692 – продуцент пектолитических ферментов”, 1984 г.
Формула изобретения
Штамм Bacillus macerans BS-04 – продуцент пектиназ, протеазы, ксиланазы и амилазы.
|
||||||||||||||||||||||||||||||||||||||||||||