|
|
(21), (22) Заявка: 2002130278/13, 17.04.2001
(24) Дата начала отсчета срока действия патента:
17.04.2001
(30) Конвенционный приоритет:
13.04.2000 (пп.1-19) EP 00201343.1
(43) Дата публикации заявки: 10.08.2004
(45) Опубликовано: 27.03.2006
(56) Список документов, цитированных в отчете о
поиске:
WO 9815633 А, 22.09.1998. US 5763254, 09.06.1998. RU 9402628 А1, 10.03.1997.
(85) Дата перевода заявки PCT на национальную фазу:
13.11.2002
(86) Заявка PCT:
NL 01/00301 (17.04.2001)
(87) Публикация PCT:
WO 01/79507 (25.10.2001)
Адрес для переписки:
129010, Москва, ул. Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. Е.Е.Назиной
|
(72) Автор(ы):
ЭМАЛФАРБ Марк Аарон (US),
ПЮНТ Петер Ян (NL),
ВАН ЗЕЙЛ Корнелия Мария Йоханна (NL)
(73) Патентообладатель(и):
ЭМАЛФАРБ Марк Аарон (US)
|
(54) НОВЫЕ РЕГУЛИРУЮЩИЕ ЭКСПРЕССИЮ ПОСЛЕДОВАТЕЛЬНОСТИ И ПРОДУКТ ЭКСПРЕССИИ В ОБЛАСТИ ГИФОМИЦЕТОВ
(57) Реферат:
Изобретение относится к биотехнологии и представляет собой фермент гликозилгидролазу (варианты), продуцируемый гифомицетами, в частности Chrysosporium lucknowense, а также нуклеиновокислотный конструкт для экспрессии гликозилгидролазы. Заявленное изобретение позволяет получать гликозилгидролазу культивированием гриба Chrysosporium в оптимальных условиях, обеспечивающих экспрессию и выделение фермента с высокой степенью эффективности. 15 н. и 4 з.п. ф-лы, 2 ил., 4 табл. 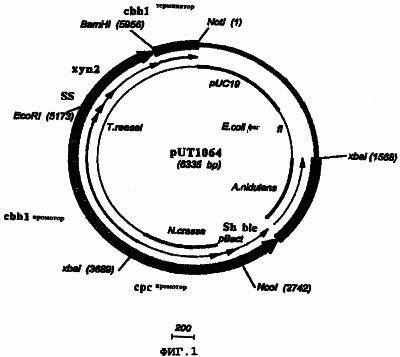
Область изобретения
Настоящее изобретение относится к новым ферментам, продуцируемым гифомицетами, особенно штаммами рода Chrysosporium, и кодирующим последовательностям и последовательностям, регулирующим экспрессию указанных ферментов. Настоящее изобретение является продолжением изобретения, описанного в международной патентной заявке WO 00/20555 (PCT/NL99/00618), зарегистрированной 6 октября 1999 года, не опубликованной до даты приоритета настоящей заявки. Описание последней включено в данный текст в качестве ссылки.
Предпосылки к созданию изобретения
Ряд хозяев, предназначенных для генной экспрессии, и способы трансформации описаны в некоторых публикациях предыдущего уровня техники. Часто упоминаются бактерии, например Escherichia coli. Однако Е.coli является микроорганизмом, не способным секретировать ряд белков или полипептидов, и поэтому нежелательным в качестве клетки-хозяина для продуцирования белка или полипептида в промышленном масштабе. Еще одним недостатком Е.coli, который относится к бактериям в целом, является то, что прокариоты не осуществляют дополнительные модификации, требуемые для многочисленных белков или полипептидов эукариот, чтобы продуцироваться в активной форме. Гликозилирование белков и соответствующий “фолдинг” белков являются примерами процессинга, который необходим для продуцирования белка или полипептида в активной форме. Для того, чтобы достичь такого процессинга, иногда используют клетки млекопитающих; однако недостаток таких клеток заключается в том, что их зачастую трудно поддерживать и для роста требуется дорогостоящая среда. Поэтому такие трансформационные системы являются нецелесообразными для продуцирования белков или полипептидов на промышленном уровне. Они могут быть экономически эффективными для дорогостоящих фармацевтических соединений, требующихся в относительно небольших количествах, но, конечно, не для промышленных ферментов.
Был разработан ряд грибных экспрессирующих систем, в том числе грибов Aspergillus niger, Aspergillus awamori, Aspergillus nidulans, Trichoderma reesei. Ряд других был предложен, но по разным причинам они не нашли широкого признания или применения. В общем, идеальный хозяин должен удовлетворять широкому ряду критериев:
– Идеальный хозяин должен легко подвергаться ферментации с использованием недорогой среды.
– Идеальный хозяин должен использовать среду эффективно.
– Идеальный хозяин должен продуцировать полипептид или белок с высоким выходом, т.е. применение идеального хозяина должно привести к высокому отношению белка к биомассе.
– Идеальный хозяин должен быть способен эффективно секретировать белок или полипептид.
– Идеальный хозяин должен быть таким, чтобы имелась возможность легко выделить и очистить желаемый белок или полипептид.
– Идеальный хозяин должен продуцировать желаемый белок или полипептид, который продуцируется в активной форме, не требуя дополнительных стадий активации или модификации.
– Идеальный хозяин должен быть легко трансформирован.
– Идеальный хозяин должен предоставить широкий спектр регулирующих экспрессию элементов, которые следует использовать, чтобы обеспечить легкость применения и универсальность.
– Идеальный хозяин должен предоставить возможность использования легко выбираемых маркеров, которые являются недорогими для употребления.
– Идеальный хозяин должен продуцировать стабильные трансформанты.
– Идеальный хозяин должен позволить культивирование при условиях, не причиняющих вред белковому или полипептидному продукту, например низкая вязкость, небольшой сдвиг.
Международная патентная заявка WO 96/02563 и патенты США 5602004, 5604129 и 5695985 No.vo No.rdisk описывают отрицательные стороны систем Aspergillus и Trichoderma и предполагают, что условия культивирования других грибов могут быть более подходящими для продуцирования белка в большом масштабе. Единственными примерами, предусматривающими трансформированные в той или иной степени культуры, являются штаммы Myceliophthore thermophila, Acremonium alabamense, Thielavia terrestris и Sporotrichum cellulophilum. Показано, что штамм Sporotrichum лизирует и продуцирует зеленый пигмент в таких условиях ферментации, которые не приводят к аналогичным результатам в отношении других штаммов. Как сообщают, что неспорулирующий штамм Thielavia terrestris является микроорганизмом, отобранным на основании его морфологических свойств. Однако показано, что эффективность протопласта Thielavia и Acremonium (где используемый штамм Acremonium представляет собой неполное состояние используемого штамма Thielavia), является низкой и что гигромицин не пригоден в качестве селекционного маркера. Был предложен широкий ряд других штаммов, которые являются потенциально пригодными по морфологическим характеристикам, но трансформация для них не описана. Предложенными штаммами являются Corynascus, Thermoascus, Chaetomium, CteNo.myces, Scytalidium и Talaromyces. Трансформированные клетки-хозяева рассматривают как клетки, единственно продуцирующие низкие уровни внесенной ксиланазы Humicola, причем штамм Thielavia продуцирует наименьшее количество; однако эта информация является неоднозначной, и фактически можно сделать предположение, что штамм Thielavia является наилучшим воплощением. Номенклатура данной ссылки основана на названиях АТСС промышленных грибов 1994 года. Таким образом очевидно, что высокая степень гетерологичной экспрессии не была достинута и, действительно, положительная корреляция между предположенной морфологией и степенью экспрессии не могла быть получена. Если какую-либо корреляцию и можно установить, то она, самое вероятное, будет отрицательной. Согласно классификации грибов АТСС 1996 года Sporotrichum thermophilum АТСС 20493 является штаммом Myceliophthora thermophila. До настоящего времени штамм все еще идентифицируют как Myceliophthora thermophila. Невозможность прогнозирования в данной области вытекает из указанных недавних описаний.
Международная патентная заявка WO 97/26330 No.vo No.rdisk предлагает способ получения родительских клеток гифомицетов, обладающих повышенной способностью продуцировать гетерологичный полипептид. Способ включает в себя сначала обнаружение специфически измененной морфологии с последующей оценкой того, продуцирует ли трансформант более гетерологичный полипептид, чем родительские клетки. Способ иллюстрируют только в отношении штаммов Fusarium A3/5 и Aspergillus oryzae. Полагают, что способ применим к Aspergillus, Trichoderma, Thielavia, Fusarium, Neurospora, Acremonium, Tolyplocadium, Humicola, Scytalidium, Myceliophthora или Mucor. Как указано выше, невозможность прогнозирования в данной области, а также невозможность прогнозирования способа цитированной заявки не дает возможности разработать общую методологию, применение которой обеспечит ожидаемый успех.
В международной патентной заявке WO 00/20555 описана альтернативная грибная экспрессирующая система, отличающаяся простотой использования вышеупомянутых штаммов Aspergilli и Trichoderma, отвечающих указанным выше требованиям. Новая система предоставляет дополнительные преимущества, заключающиеся в том, что скорости трансформации указанной системы выше скоростей трансформации часто используемой системы Trichoderma reesei. Кроме того, культуральные условия предоставляют дополнительные преимущества для продуцирования полипептидного продукта.
Подробное описание изобретения
Итак, авторы описывают ряд интересных с точки зрения промышленного производства ферментов, продуцируемых штаммами Chrysosporium, а также приводят полную информацию о последовательностях. Также авторы описывают промоторные системы, производимые штаммами Chrysosporium и используемые для экспрессии гомологичных и гетерологичных генов.
В частности, настоящее изобретение касается гликозилгидролаз семейств 7 (например, целлобиогидролаз) и 10 (например, ксиланаз) и глицеральдегидфосфатдегидрогеназ, идентифицируемых по их аминокислотной последовательности, а также пептидов, производных указанных ферментативных белков, и последовательностей нуклеиновых кислот, кодирующих указанные пептиды и белки, а также, в частности, регулирующих последовательностей, родственных данным генам.
В частности, изобретение относится к изолированным или рекомбинантным ферментативным белкам или их активным частям из трех указанных выше классов, включая их мутанты, имеющих, по крайней мере, определенную степень идентичности последовательности, как указано в дальнейшем описании и в формуле изобретения, а также к последовательностям нуклеиновых кислот, кодирующим вышеупомянутые белки или их части, и/или к последовательностям нуклеиновых кислот, регулирующим их экспрессию. Указанными ферментами, особенно, являются: (1) гликозилгидролаза из семейства 7 (целлобиогидролаза, СВН1), содержащая аминокислотную последовательность, идентичную, по крайней мере, на 75%, предпочтительно, по крайней мере, на 80% или даже, по крайней мере, на 85% последовательности аминокислот SEQ ID No. 2; (2) гликозилгидролаза из семейства 10 (эндоксиланаза XYL1), содержащая аминокислотную последовательность, идентичную, по крайней мере, на 70%, предпочтительно, по крайней мере, на 75% или даже, по крайней мере, на 80% последовательности аминокислот SEQ ID No.4; и (3) глицеральдегидфосфатдегидрогеназа (GPD1), содержащая аминокислотную последовательность, идентичную, по крайней мере, на 86%, предпочтительно, по крайней мере, на 90% или даже, по крайней мере, на 93% последовательности аминокислот SEQ ID No.6. Полипептиды и последовательности нуклеиновых кислот, кодирующие данные полипептиды, содержащие, по крайней мере, 20, предпочтительно, по крайней мере, 30 смежных аминокислот SEQ ID No.2, 4 и 6, являются предпочтительной частью изобретения. Соответствующие нуклеотидные последовательности отражены в SEQ ID No.1 (cbh 1), 3 (xyl 1) и 5 (gpd 1) соответственно.
Рекомбинантные ферменты могут представлять собой, по существу, полный белок или усеченный белок, обладающий, по крайней мере, частью ферментативной активности. Такая усеченная часть может быть каталитическим доменом или составлять, по крайней мере, приблизительно 75% его аминокислот. В качестве примера каталитический домен СВН1 согласно изобретению содержит аминокислоты 20-495 аминокислотной последовательности SEQ ID No.2, и каталитический домен XYL1 согласно изобретению содержит аминокислоты 54-384 аминокислотной последовательности SEQ ID No.4. Каталитический домен может быть связан или не связан с сигнальной последовательностью, происходящей из другого белка, и/или с углевод-связывающим доменом из другого ферментативного белка. В качестве альтернативы целлюлозо-связывающий домен ферментов согласно изобретению (СВР1 и XYL1) может быть конденсированным с каталитическими доменами других ферментативных белков.
Последовательности нуклеиновых кислот согласно изобретению могут быть полными белок-кодирующими областями или олигонуклеотидами или предпочтительно последовательностями, регулирующими экспрессию. Олигонуклеотиды могут быть использованы также в качестве зондов для идентификации генов, соответствующих, но неидентичных генам SEQ ID No.1, 3 и 5; данные гены, которые удовлетворяют определенному в описании критерию идентичности, выраженной в процентах, а также кодирующие и некодирующие их части и их продукты экспрессии составляют часть изобретения. Олигонуклеотиды представляют собой предпочтительно 15-75 нуклеотидов, самое предпочтительное 20-50 нуклеотидов в длину.
Изобретение также относится к экспрессирующим системам (кассетам), содержащим либо регулирующую экспрессию область (включая промотор) любого из трех классов белков, конденсированную с геном, кодирующим другой интересующий белок, либо кодирующую область любого из данных белков, конденсированную с другой областью, регулирующей экспрессию, или также содержащим как область, регулирующую экспрессию, так и белок-кодирующую область указанных новых белков. Регулирующая экспрессию область содержит, по крайней мере, 60%, предпочтительно, по крайней мере, 70%, более предпочтительно, по крайней мере, 75% или даже 80% 5′-некодирующей области SEQ ID No.1, 3 и 5, и/или, по крайней мере, 20, особенно, по крайней мере, 40 смежных нуклеотидов из указанных 5′-некодирующих областей. Терминирующие последовательности, аналогичным образом произведенные из 3′-некодирующих последовательностей генов согласно изобретению, также применяют в экспрессирующих кассетах, причем терминирующие последовательности комбинируют либо с гомологичными, либо с гетерологичными генами.
Полинуклеотиды и олигонуклеотиды согласно изобретению могут иметь минимум идентичности последовательностей с соответствующими последовательностями SEQ ID No.1, 3 или 5, или, в качестве альтернативы, гибридизироваться в жестких условиях с указанными данными последовательностями. Жесткие условия гибридизации являются такими, которые указаны в данной области, например гибридизация в 6×SSC (20×SSC на 1000 мл; 175,3 г NaCl, 107,1 г цитрата натрия. 5Н2O, рН 7,0), 0,1% SDS, 0,05% пирофосфата натрия, 5* раствор Denhardt и 20 мкг/мл денатурированной ДНК семени сельди при 56°С в течение 18-24 часов с последующими двумя 30-минутными промывками в 5×SSC, 0,1% SDS при 56°С и с двумя 30-минутными промывками в 2×SSC, 0,1% SSC при 56°С.
Указанные экспрессирующие системы могут находиться в хозяине Chrysosporium, таком как Chrysosporium luckNo.wense, или в другом хозяине, отличном от грибов, или предпочтительно в грибах. Примерами других грибов-хозяев являются другие виды Chrysosporium или штаммы, виды Fusarium, Aspergillus и т.д. Такой хозяин может быть преимущественно хозяином, который не сам по себе, по сути или в результате условий культивирования, продуцирует белок, соответствующий интересующему белку с тем, чтобы упростить получение интересующего белка.
Когда в описании и прилагаемой формуле изобретения ссылаются на «полипептиды», или «пептиды», или «полипептиды, представляющие интерес», или «пептиды, представляющие интерес» как на продукты экспрессирующей системы согласно изобретению, то указанный термин также включает в себя белки, т.е. полипептиды, имеющие особую функцию, и/или вторичную, и/или третичную структуру. Когда ссылаются на процент идентичности аминокислот, то такая идентичность относится к полному белку или к его специфической части, характеризованной начальным и конечным числом аминокислот, как определено с помощью обычно применяемого BLAST алгоритма.
В экспрессирующей системе грибов, описанной в международной патентной заявке WO 00/20555, рН культуральной среды может быть нейтральным или щелочным, чтобы больше не подвергать продуцируемый белок или полипептид агрессивному и потенциально инактивирующему действию кислого рН. Также возможно культивировать при кислом рН, таком как рН 4, в случаях, когда белок или полипептид лучше подходит к кислой среде. Подходящим рН культур может быть рН между 4,0-10,0. Однако предпочтение отдают рН в области между нейтральным рН и щелочным рН, поскольку хозяйский штамм лучше растет при таком рН, например между 6 и 9. Рост при щелочном рН, который может составлять от рН 8 и выше и даже может быть таким высоким, как рН 10, рассматривают как хорошую альтернативу для таких случаев. Кроме того, температура культивирования таких хозяйских штаммов должна быть благоприятной для сохранения стабильности некоторых типов продуцируемого полипептида. Подходящей температурой культивирования является температура 23-43°С. Ясно, что такие условия представляют особый интерес для продуцирования полипептидов млекопитающих. Выбранная температура будет зависеть от эффективности затрат культивирования и от чувствительности полипептида или культивируемого штамма.
Кроме того, было установлено, что отношение биомассы к вязкости и количество продуцированного белка являются чрезвычайно благоприятными для хозяина Chrysosporium. Сравнительные исследования проводили с Trichoderma longibrachiatum (прежде штамм, известный как Trichoderma reesei) и с Aspergillus niger. Штамм Trichoderma longibrachiatum давал 2,5-5 г/л биомассы, штамм Aspergillus niger давал 5-10 г/л биомассы и штамм Chrysosporium давал 0,5-1 г/л биомассы в их соответствующих оптимальных условиях культивирования. Такая продукция превышала в 5-10 раз продукцию коммерчески используемых штаммов. Цель изобретения направлена на экспрессирующие системы, содержащие последовательность нуклеиновых кислот, кодирующую гетерологичный белок или полипептид, причем указанная последовательность нуклеиновых кислот связана с регулирующей экспрессию областью, описанной ниже, и необязательно с последовательностью, кодирующей сигнальную последовательность, способствующую секреции, и/или последовательностью, кодирующей белок-носитель. Предпочтительно рекомбинантный штамм согласно изобретению будет секретировать представляющий интерес полипептид. Такой подход позволяет избежать необходимости дезинтеграции клетки с целью выделения интересующего полипептида и снизить до минимума риск деградации экспрессированного продукта другими компонентами хозяйской клетки.
Штамм Chrysosporium может быть определен морфологически в соответствии с описанием, данным в Barnett and Hunter 1972, Illustrated Genera of Imperfect Fungi, 3rd Edition of Burgess Publishing Company. Другие источники, описывающие детали касательно классификации грибов рода Chrysosporium, хорошо известны, например, Sutton Classification (Van Oorschot, C.A.N. (1980) “A revision of Chrysosporium and allied genera” in Studies in Mycology No.20 of the CBS in Baarn, The Netherlands p.1-36). CBS является одним из депозитарных институтов Будапештского соглашения. Согласно исследованиям род Chrysosporium приходится на семейство Moniliaceae, которое принадлежит к отряду Hyphomycetales. Следующие штаммы определяют как Chrysosporium, но название Chrysosporium не ограничивается указанными штаммами: С.botryoides, С.carmichaelii, C.crassitunicatum, C.europae, C.evolceannui, C.farinicola, C.fastidium, C.filiforme, C.georgiae, C.globiferum, C.globiferum вариант articulatum, C.globiferum вариант niveum, C.hirundo, C.hispanicum, C.holmii, C.indicum, C.iNo.ps, C.keratiNo.philum, C.kreiselii, C.kuzurovianum, C.ligNo.rum, C.lobatum, C.luckNo.wense, C.luckNo.wense Gard 27 К, C.medium, C.medium вариант spissescens, C.mephiticum, C.merdarium, C.merdarium вариант roseum, C.miNo.r, C.pannicola, C.parvum, C.parvum вариант crescens, C.pilosum, C.pseudomerdarium, C.pyriformis, C.queenslandicum, C.sigleri, C.sulfureum, C.synchronum, C.tropicum, C.undulatum, C.vallenarense, C.vespertilium, C.zonatum.
C.luckNo.wense составляет один из видов Chrysosporium, который вызывает особый интерес в связи с тем, что он имеет готовый природный высокий продуцент целлюлазных белков (WO 98/15633) и родственный патент США 5811381). Характеристиками Chrysosporium luckNo.wense являются:
Колонии достигают 55 мм в диаметре на глюкозном агаре Sabourand в течение 14 дней, имеют оттенок кремового цвета, на вид войлокообразные и пушистые; плотные и 3-5 мм высотой; края являются четкими, правильными и бахромчатыми; изменяют цвет от бледно-желтого до кремового. Гифы гиалиновые, гладкостенные и тонкостенные, мало разветвленные. Гифы над поверхностью являются, главным образом, плодовитыми и разделенными перегородками, приблизительно 1-3,5 мкм в ширину. Погруженные гифы являются неплодородными, приблизительно 1-4,5 мкм в ширину, с утонченными гифами, которые часто скручены. Конидии являются терминальными и боковыми, главным образом, прикрепленными или на коротких, часто конических выступах или коротких побочных ответвлениях. Конидии являются одиночными, но близко расположены друг от друга, 1-4 конидии, развивающиеся на одной клетке, относящейся к гифам, субгиалиновые, в некоторой степени тонкостенные и гладкостенные, главным образом, субсферические, также булавовидные или яйцевидные с уменьшением к основанию, 1-ячеистые, 2,5-11×1,5-6 мкм, с широкими базальными рубцами (1-2 мкм). Интеркалярные конидии отсутствуют. Хламидоспоры отсутствуют. АТСС 44006, CBS 251.72, CBS 143.77 и CBS 272.77 являются примерами Chrysosporium luckNo.wense штаммов, и другие примеры описаны в международной патентной заявке WO 98/15633 (патент США 5811381).
Кроме того, был выделен штамм из данного вида с большей способностью к продуцированию целлюлаз. Данный штамм был назван С1 посредством записи, вытекающей из его сущности, и был депонирован в Международном Депозитарии Всероссийской Коллекции микроорганизмов Российской Академии Наук, улица Бахрушина 8, Москва, Россия 113184 29 августа 1996, в качестве депозита согласно Будапештскому соглашению и ему был дан входящий номер VKM F-3500D. Он был назван Chrysosporium luckNo.wense Gard 27K. Характеристики С1 штамма следующие:
Колонии вырастали размером приблизительно до 55-66 мм диаметром на картофельно-декстрозном агаре в течение 7 дней; были бело-кремового цвета, на вид войлочнообразные, 2-3 мкм высотой у центра; края определенные, регулярные, бахромчатые; изменяли цвет до бледно-кремового. Гифы гиалиновые, гладкостенные и тонкостенные, мало разветвленные. Гифы над поверхностью являются плодовитыми, разделенными перегородками, 2-3 мкм в ширину. Погруженные гифы являются неплодородными. Конидии являются терминальными и боковыми; прикрепленные или на коротких побочных ответвлениях отсутствуют; являются отдельными, но близко расположены друг от друга, гиалиновые, тонкостенные и гладкостенные, субсферические, также булавовидные или яйцевидные с уменьшением к основанию, 1-ячеистые, 4-10 мкм. Хламидоспоры отсутствуют. Интеркалярные конидии отсутствуют.
Способ выделения штамма С1 описан в международной патентной заявке WO 98/15633, патентах США 5811381 и 6015707. Также под определение Chrysosporium включены штаммы, выведенные из предшественников Chrysosporium, включающих такие, которые мутированы в некоторой степени либо в естественных условиях, либо путем индуцированного мутагенеза. Мутанты Chrysosporium могут быть получены путем индуцированного мутагенеза, особенно путем комбинации облучения и химического мутагенеза.
Например, штамм С1 был мутирован путем обработки ультрафиолетовым светом с получением штамма UV13-6. Данный штамм был впоследствии мутирован с помощью N-метил-N‘-нитро-N-нитрозогуанидина с получением штамма NG7C-19. Последний штамм, в свою очередь, был подвергнут мутации посредством обработки ультрафиолетовым светом, что привело к штамму UV 18-25. В течение указанного процесса мутации морфологические характеристики изменялись до некоторой степени в культуре в жидкости или на чашках, а также под микроскопом. С каждым последующим мутагенезом культуры становятся на вид менее пушистыми и войлочнообразными на чашках, что, как описано, является характерным для Chrysosporium, до тех пор, пока колонии не становятся плоскими и не приобретают тусклый внешний вид. Коричневый пигмент, наблюдаемый со штаммом дикого типа в некоторых средах, был менее распространенным в мутантных штаммах. В жидкой культуре мутант UV 18-25 был заметно менее вязким, чем штамм С1 дикого типа и мутанты UV 13-6 и NG7C-19. В то время как все штаммы сохраняли общие характеристики Chrysosporium, обнаруженные под микроскопом, мицелий становился уже с каждой последующей мутацией, и в отношении штамма UV 18-25 можно было наблюдать явное разделение мицелия. Вероятно, что указанное разделение мицелия является причиной снижения вязкости, связанной с культурами UV 18-25. Способность штаммов к споруляции уменьшается с каждой мутагенной стадией. Исходя из вышеописанного, следует, что в отношении штамма, который принадлежит к роду Chrysosporium, имеется некоторое отклонение от морфологического определения, данного выше. На каждой стадии мутации продукция целлюлазы и внеклеточного белка также увеличивается, в то время как несколько мутаций приводят к уменьшению экспрессии протеазы. Критерии, с помощью которых таксономия грибов может быть определена, доступны, например, из CBS, VKMF и ATCC. Штаммы, обозначенные как Chrysosporium штамм С1, штамм UV 13-6, штамм NG7C-19 и штамм UV 18-25, депонированы в соответствии с Будапештским соглашением во Всероссийской коллекции (VKM) депозитарного института в Москве. Штамм дикого типа С1 был депонирован под номером VKM F-3500 D, дата депозита 29-08-1996, C1 UV 13-6 мутант был депонирован как VKM F-3632 D (02-09-1998), C1 NG7c-19 мутант был депонирован как VKM F-3633 D (02-09-1998) и C1 UV 18-25 мутант был депонирован как VKM F-3631 D (02-09-1998).
Предпочтительным является использование нетоксичных штаммов Chrysosporium, из которых некоторое количество известно в данной области, как штаммы, осуществляющие продуцирование в большом масштабе с наименьшим риском по отношению к окружающей среде и способствующие упрощению способов продуцирования с сопутствующим снижением себестоимости.
Областью, регулирующей экспрессию, является последовательность ДНК, узнаваемая хозяйским штаммом Chrysosporium, предназначенным для экспрессии. Она содержит промоторную последовательность, связанную с последовательностью нуклеиновых кислот, которая кодирует экспрессируемый полипептид. Промотор связан таким образом, что расположение по отношению к кодону инициации последовательности, которая должна экспрессировать, способствует экспрессии. Промоторная последовательность может быть конститутивной или индуцибельной. Любая последовательность или ее комбинация, регулирующая экспрессию, способная осуществить экспрессию полипептида из штамма Chrysosporium, предусмотрена. Регулирующая экспрессию последовательность является подходящей регулирующей экспрессию областью из грибов, например регулирующей областью аскомицетов. Подходящей регулирующей экспрессию областью грибов является регулирующая область из любого из следующих родов грибов: Aspergillus, Trichoderma, Chrysosporium, Hansenula, Mucor, Pichia, Neurospora, Tolypocladium, Rhizomucor, Fusarium, Penicillium, Saccaromyces, Talaromyces или их альтернативные половые формы, подобно Emericella, Hypocrea, например, промотор целлобиогидролазы из Trichoderma, промотор глюкламилазы из Aspergillus, промотор глицеральдегидфосфатдегидрогеназы из Aspergillus, промотор алкогольдегидрогеназы А и алкогольдегидрогеназы R из Aspergillus, промотор ТАКА амилазы из Aspergillus, промотор фосфоглицерата и промоторы, контролирующие переключение путей экспрессии, из Neurospora, промотор аспартильной протеиназы из Rhizomucor miehei, промотор липазы из Rhizomucor miehei и промотор бета-галактозидазы из Penicillium canescens. Последовательность, регулирующая экспрессию, находящаяся в штамме такого же рода, что и хозяйский штамм, является чрезвычайно подходящей, так как она, вероятно, специфическим образом адаптирована к специфическому хозяину. Таким образом, предпочтительной последовательностью, регулирующей экспрессию, является последовательность из штамма Chrysosporium.
Предпочтительно, когда применяют регулирующую экспрессию область, осуществляющую высокую экспрессию в выбранном хозяине. Предпочтительно, когда регулирующая экспрессию область произведена из Chrysosporium согласно изобретению. Кроме того, регулирующая высокую экспрессию область может быть произведена из гетерологичного хозяина, который хорошо известен в данной области. Специфические примеры белков, которые, как известно, экспрессируются в больших количествах, и, таким образом, предоставление подходящих последовательностей, регулирующих экспрессию, не ограничивается гидрофобином, протеазой, амилазой, ксиланазой, пектиназой, эстеразой, бета-галактозидазой, целлюлазой (например, эндоглюканазой, целлобиогидролазой) и полигалактуроназой. Высокая продукция была отмечена как в твердом состоянии, так и в условиях погружения при ферментации. Способы оценки наличия или продуцирования таких белков хорошо известны в данной области. Каталоги Sigma и Megazyme, например, предоставляют многочисленные примеры. Фирма Megazyme расположена Bray Business Park, Bray, County Wicklow в Ирландии. Фирма Sigma Aldrich имеет много филиалов по всему миру, например USA P.O. Box 14508 St. Louis Missouri. Что касается целлюлазы, авторы ссылаются на коммерчески доступные способы анализа, такие как анализы CMCase, эндовискозиметрический способ анализа, способы анализа авицелазы, способ анализа бета-глюканазы, способ анализа RBBCMCase, способ анализа целлазима C. Также способ анализа ксиланазы является коммерчески доступным (например, DNS Megazyme). Альтернативные способы анализа хорошо известны специалисту в данной области и могут быть найдены в обычной литературе, касающейся предмета обсуждения, и такая информация включена в данный текст в виде ссылки. В качестве примера авторы ссылаются на “Methods in Enzymology” Volume 1, 1955 и volumes 297-299, 1998. Подходящим является то, что промоторная последовательность Chrysosporium применяется с целью обеспечения хорошего узнавания последовательности хозяином.
Авторы обнаружили, что гетерологичные последовательности, регулирующие экспрессию, функционируют в Chrysosporium также эффективно, как и нативные последовательности Chrysosporium. Полученные результаты позволяют использовать хорошо известные конструкции и векторы в трансформации Chrysosporium, а также предоставляют другие многочисленные возможности для конструирования векторов, достигающих экспрессии с хорошей скоростью в данном новом экспрессирующем и секретирующем хозяине. Например, можно использовать стандартный способ трансформации Aspergillus, описанный, например, Christiansen et al. in Bio/TechNo.1., 6:1419-1422 (1988). Другие публикации, описывающие детально трансформационные векторы Aspergillus, включают в себя, например, патенты США 4816405, 5198345, 5503991, 5364770 и 5578463, европейский патент ЕР-В-215594 (также для Trichoderma), и их содержание включено в данный текст в виде ссылки. Поскольку для штаммов Chrysosporium показаны чрезвычайно высокие скорости экспрессии, то области, регулирующие экспрессию таких белков, являются особенно предпочтительными. Авторы ссылаются на специфические примеры ранее описанных депозитных штаммов Chrysosporium.
Нуклеиновокислотный конструкт, который содержит область нуклеиновых кислот, регулирующую экспрессию, из Chrysosporium, предпочтительно из Chrysosporium LuckNo.wense или из производного штамма, является предпочтительным аспектом изобретения, как и мутантный штамм Chrysosporium, содержащий такую конструкцию, связанную с геном, кодирующим экспрессируемый полипептид. Такая конструкция нуклеиновых кислот будет представлять собой область из Chrysosporium, регулирующую экспрессию, ассоциированную с экспрессией целлюлазы или ксиланазы, предпочтительно с экспрессией целлобиогидролазы или с экспрессией глицеральдегидфосфатдегидрогеназы, как будет описано ниже. Последовательность нуклеиновых кислот согласно изобретению может быть получена подходящим образом из такого штамма Chrysosporium, который был ранее определен в описании. Способы, с помощью которых промоторные последовательности могут быть определены, являются многочисленными и хорошо известными в данной области. Эксперименты, связанные с делецией нуклеазой области в обратном направлении ATG кодона у начала соответствующего гена, дадут такую последовательность. Кроме того, например, анализ консенсусных последовательностей может привести к открытию интересующего гена. Используя методы гибридизации и амплификации, специалист в данной области сможет легко получить соответствующие промоторные последовательности.
Промоторные последовательности С1 эндоглюканаз были идентифицированы таким методом, путем клонирования соответствующих генов. Согласно изобретению предпочтительным промотором является промотор целлобиогидролазы (СВН1) 55 кДа, промоторы ксиланазы (Xyll) 30 кДа и промотор глицеральдегидфосфатдегидрогеназы, поскольку указанные ферменты экспрессируются на высоком уровне с помощью их собственных промоторов. Соответствующие промоторные последовательности идентифицированы прямым методом с помощью клонирования, как описано в международной патентной заявке WO 00/20555, используя информацию о последовательности, данную в SEQ ID No.1 (для СВН1) и SEQ ID No.3 (для Xyll) соответственно. Промоторы гидролизующих углеводы ферментов из Chrysosporium, особенно С1 промоторы, можно успешно использовать для экспрессии желаемых полипептидов в организме хозяина, особенно грибов или другого хозяйского организма микробного происхождения. Промоторные последовательности, имеющие, по крайней мере, 65%, предпочтительно, по крайней мере, 70%, самое предпочтительное, по крайней мере, 75% нуклеотидных последовательностей, идентичных последовательности, данной в SEQ ID No.s 1, 3 и 5, или имеющие идентичные последовательности, найденные для других генов Chrysosporium, являются частью настоящего изобретения.
Что касается особых аспектов, связанных с рекомбинантным штаммом и последовательностью нуклеиновых кислот согласно изобретению, авторы также ссылаются на примеры. Авторы также обращаются к рекомбинантным штаммам, разработанным на предыдущем уровне техники, для которых описаны промоторные последовательности с высокой экспрессией, в частности такие, которые обеспечивают высокую экспрессию в грибах, например такие, как описаны для Aspergillus и Trichoderma. Данные, полученные на предыдущем уровне техники, свидетельствуют о том, что ряд регулирующих экспрессию областей был применен для Aspergillus, например, в патентах США 5252726 No.vo и 5705358 Unilever. Содержание данных публикаций предыдущего уровня техники включено в текст в виде ссылки.
Ген гидрофобина является геном грибов, который проявляет высокую экспрессию. Таким образом, полагают, что промоторная последовательность гена гидрофобина, предпочтительно из Chrysosporium, может быть использована подходящим образом в качестве регулирующей экспрессию последовательности в соответствующем аспекте изобретения. Генные последовательности Trichoderma reesei и Trichoderma harzianum для гидрофобина описаны, например, на предыдущем уровне техники, а также генная последовательность для Aspergillus fumigatus и Aspergillus nidulans, и соответствующая информация о последовательности включены в данный текст в виде ссылки (MuNo.z et al., Curr. Genet. 1997, 32 (3):225-230; Nakari-Setala T. Et al., Eur. J. Biochem. 1996 15:235 (1-2):248-255, M. Parta et al. Infect. Inimun. 1994 62 (10): 4389-4395 и Stringer M.A. et al. Mol. Microbiol. 1995 16(1):33-44). Используя указанную информацию о последовательности, специалист в данной области сможет получить регулирующие экспрессию последовательности генов гидрофобина из Chrysosporium без кропотливого эксперимента после стандартного метода, как предложено уже выше. Рекомбинантный штамм Chrysosporium согласно изобретению может содержать гидрофобин-регулирующую область, связанную с последовательностью, кодирующей интересующий полипептид.
Кроме того, регулирующая экспрессию последовательность может содержать энхансер или сайпексер. Указанные гены хорошо известны из предыдущего уровня техники и обычно расположены на некотором расстоянии от промотора. Также регулирующие экспрессию последовательности могут содержать промоторы с активатор-связывающими сайтами и репрессор-связывающими свитами. В некоторых случаях такие сайты могут быть модифицированы, чтобы элиминировать указанный тип регуляции. Промоторы гифомицетов, в которых присутствуют creA сайты, описаны. Такие creA сайты могут подвергаться мутации, чтобы убедиться, что подавление глюкозы, которое в нормальных условиях является результатом наличия немутированных сайтов, элиминировано. Международная патентная заявка WO 94/13820 Gist-Brocades иллюстрирует указанный подход. Данные промоторы могут быть использованы с их creA сайтами или без них. Мутанты, в которых creA сайты мутированы, могут быть использованы в качестве регулирующих экспрессию последовательностей в рекомбинантном штамме согласно изобретению, и последовательность нуклеиновых кислот, которую она регулирует, затем может быть экспрессирована в присутствии глюкозы. Такие промоторы Chrysosporium обеспечивают дерепрессию аналогично тому способу, который описан в международной патентной заявке WO 97/09438. Идентичность creA сайтов известна из предыдущего уровня техники. В качестве альтернативы, возможно, применять промотор с creA-связывающими сайтами, которые не были мутированы в хозяйском штамме, с мутацией в другом месте в репрессионной системе, например, в самом сгеА гене, так что штамм может, несмотря на присутствие creA-связывающих участков, продуцировать белок или полипептид в присутствии глюкозы.
Терминаторные последовательности являются регулирующими экспрессию последовательностями, и они связаны с 3‘-концом последовательности, подлежащей экспрессии. Вероятно, любой терминатор грибов является функциональным в хозяйском штамме Crysosporiurn согласно изобретению. Примерами являются A.nidulans терминатор trpC (1), A.niger терминатор альфа-глюкозидазы (2), А.niger терминатор глюкоамилазы (3), Mucor miehei терминатор карбоксильной протеазы (патент США 5578463) и терминатор Trichoderma reesei целлобиогидролазы. В естественных условиях терминаторные последовательности Crysosporium будут функционировать в Crysosporium и будут подходящими, например, как СВН1 терминатор.
Подходящий рекомбинантный штамм Crysosporium, который применяют согласно изобретению, содержит экспрессирующую последовательность нуклеиновых кислот, связанную с последовательностью, кодирующую аминокислотную последовательность, определенную как сигнальная последовательность. Сигнальная последовательность является аминокислотной последовательностью, которая в случае связывания ее с аминокислотной последовательностью экспрессированного полипептида обусловливает его секрецию из хозяина-гриба. Такая сигнальная последовательность может быть последовательностью, нормально связанной с гетерологичным полипептидом, или может быть нативной последовательностью хозяина. Также она может быть несвойственной как хозяину, так и полипептиду. Последовательность нуклеиновых кислот, кодирующая сигнальную последовательность, должна быть расположена в рамке, чтобы допустить трансляцию сигнальной последовательности и гетерологичного полипептида. Рассматривается любая сигнальная последовательность, способная осуществить секрецию полипептида из штамма Crysosporium. Такая сигнальная последовательность является подходящей сигнальной последовательностью из грибов, предпочтительно сигнальной последовательностью из аскомицетов.
Подходящие примеры сигнальных последовательностей могут быть получены из дрожжей вообще или из любого из следующих родов грибов: Aspergillus, Trichoderma, Crysosporium, Pichia, Neurospora, Rhizomucor, Hansenula, Humicola, Mucor, Tolypocladium, Fusarium, Peniclllum, Saccharomyces, Talaromyces или их альтернативные половые формы, подобные Emericella, Hypocrea. Особенно применимые сигнальные последовательности часто природно связаны со следующими белками: целлобиогидролазой, эндоглюканазой, бета-галактозидазой, ксиланазой, пектиназой, эстеразой, гидрофобином, протеазой или амилазой. Кроме того, примеры включают амилазу или глюкоамилазу из Aspergillus или Humicola (4), ТАКА амилазу из Aspergillus oryzae, альфа-амилазу из Aspergillus niger, карбоксипептидазу из Mucor (патент США 5578463), липазу или протеиназу из Rhizomucor miehei, целлобиогидролазу из Trichoderma (5), бета-галактозидазу из Penicillum canescens и фактор скрещивания альфа из Saccharomyces.
В качестве альтернативы сигнальная последовательность может быть произведена из гена амилазы или субтилизина штамма Bacillus. Сигнальная последовательность из того же рода, что и хозяйский штамм, является чрезвычайно подходящей, поскольку она, вероятно, специфически приспособлена к специфическому хозяину, таким образом, предпочтительно, когда сигнальная последовательность является сигнальной последовательностью из Crysosporium, особенно штамма Crysosporium C1, штамма UV 13-6, штамма NG7C-19 и штамма UV 18-25, на которые ссылались выше. Сигнальные последовательности из гифамицетов, дрожжей и бактерий являются пригодными. Сигнальные последовательности не из грибов также рассматриваются, как пригодные, в частности, из бактерий, растений и млекопитающих.
Рекомбинантный хозяин, который применяют согласно любому из аспектов изобретения, также может содержать выбираемый маркер. Такой выбираемый маркер будет легко осуществлять отбор трансформированных или трансфицированных клеток. Выбираемый маркер часто кодирует генный продукт, обеспечивающий специфический тип устойчивости, не присущий нетрансформированному штамму. Указанная устойчивость может быть устойчивостью к тяжелым металлам, антибиотикам и биоцидам вообще. Прототроф также является пригодным выбираемым маркером неантибиотического вида. Неантибиотические выбираемые маркеры могут быть предпочтительными в тех случаях, когда белок или интересующий полипептид нужно использовать в пищевом продукте или фармацевтических препаратах с целью ускорения или замедления проверки сложной регуляции такого продукта. Очень часто для таких маркеров используют указание GRAS (общепринято безопасным). Ряд таких маркеров доступен специалисту в данной области. Например, FDA (Департамент по контролю за качеством пищевых продуктов, медикаментов и косметических средств) предоставляет перечень таких маркеров. Самыми общепринятыми маркерами являются выбираемые маркеры, отобранные из группы, обеспечивающей устойчивость к лекарственному средству или облегчающей пищевой дефект, например из группы, включающей в себя amdS (ацетамидазу), hph (гигромицинфосфотрансферазу), pyrG (оротидин-5′-фосфатдекарбоксилазу), trpC (антранилатсинтазу), argB (орнитинкарбамоилтрансферазу), sC (сульфатаденилтрансферазу), bar (фосфинотрицинацетилтрансферазу), устойчивый к глюфозинату ген, niaD (нитратредуктазу), ген, устойчивый к блеомицину, точнее Sh Ble, устойчивый к сульфонилмочевине ген, например мутированный ген ilv1 ацетолактатсинтазы. Отбор также может быть осуществлен посредством котрансформации, где отобранный маркер находится на отдельном векторе или где маркер находится на том же фрагменте нуклеиновых кислот, что и полипептид-кодирующая последовательность интересующего полипептида.
Употребляемый в тексте термин «гетерологичный полипептид» означает белок или полипептид, который в норме не экспрессируется или не секретируется хозяйским штаммом Crysosporium, используемым для экспресии согласно изобретению. Полипептид может быть растительного или животного (позвоночное или беспозвоночное) происхождения, например из млекопитающего, рыбы, насекомого или микроорганизма, с условием, что он не находится в хозяйском штамме. Млекопитающее может включать человека. Микроорганизм включает в себя вирусы, бактерии, архебактерии и грибы, т.е. гифомицеты и дрожжи. Bergey’s Manual for Bacterial DetermiNo.logy предоставляет соответствующий перечень бактерий и архебактерий. Для фармацевтических целей очень часто предпочтение отдается человеческим белкам, таким образом, рекомбинантный хозяин согласно изобретению, представляющий собой предпочтительный аспект, будет таким хозяином, у которого полипептид имеет человеческое происхождение. Для таких целей, как пищевая продукция, подходящий гетерологичный полипептид будет животного, растительного или водорослевого происхождения. Поэтому такие аспекты также рассматриваются как подходящие примеры изобретения. Альтернативные аспекты, которые также используются, включают в себя гетерологичный полипептид любого из бактериального, дрожжевого, вирусного, архебактериального или грибного происхождения. Самым предпочтительным в качестве источника являются грибы.
Подходящий аспект изобретения будет включать в себя гетерологичную последовательность нуклеиновых кислот с применением адаптированного кодона. Такая последовательность кодирует нативную аминокислотную последовательность хозяина, из которого она произведена, но имеет отличную последовательность нуклеиновых кислот, т.е. имеет такую последовательность нуклеиновых кислот, в которой определенные кодоны заменены другими кодонами, кодирующими одну и ту же аминокислоту, но которые легче использовать хозяйским штаммом, применяемым для экспрессии. Данный подход сможет привести к большей экспрессии гетерологичной последовательности нуклеиновых кислот. Указанный подход является общей практикой для специалиста в данной области. Применение адаптированного кодона можно осуществить на основе известного использования кодона грибов по отношению к негрибному кодону. Такой подход может быть точнее приложен к применению кодона самого штамма Chrysosporium. Сходства заключаются в том, что применение кодона, наблюдаемое в штаммах Trichoderma, Humicola и Aspergillus, способствует обмену последовательностей таких организмов без адаптации используемого кодона. Детали доступны опытному специалисту относительно применения кодона указанных грибов и включены в данный текст в виде ссылки.
Изобретение не ограничивается вышеупомянутыми рекомбинантными штаммами Chrysosporium, но также охватывает рекомбинантный штамм Chrysosporium, содержащий последовательность нуклеиновых кислот, кодирующую гомологичный белок для штамма Chrysosporium, причем указанная последовательность нуклеиновых кислот связана с регулирующей экспрессию областью, и указанный рекомбинантный штамм экспрессирует больше указанного белка, чем соответствующий нерекомбинантный штамм при тех же условиях. В случае гомологичного полипептида, представляющего такой интерес, предпочтительным является нейтральный или щелочной фермент, подобный гидролазе, протеазе или углевод-разрушающему ферменту, как было описано ранее. Полипептид также может быть кислым. Предпочтительно, когда рекомбинантный штамм будет экспрессировать полипептид в больших количествах, чем нерекомбинантный штамм. Все комментарии, касающиеся гетерологичного полипептида, являются правомерными (mutatis mutandis) для гомологичного полипептида целлюлазы.
Таким образом, изобретение также касается генно-инженерным способом полученных микробных штаммов, у которых внесенная последовательность может быть от Chrysosporium. Однако такой штамм может отличаться от нативных штаммов благодаря, например, гетерологичным последовательностям, присутствующим в последовательности нуклеиновых кислот, которую используют для трансформации или трансфекции Chrysosporium, благодаря тому факту, что множественные копии последовательности, кодирующей интересующий полипептид, присутствуют, или благодаря тому факту, что они экспрессируются в количестве, превышающем количество немодифицированного штамма при идентичных условиях, или благодаря тому факту, что экспрессия имеет место при нормальных неэкспрессирующих условиях. Последний случай имеет место, если индуцибельный промотор регулирует интересующую последовательность в противоположность нерекомбинантному штамму, или если другой фактор индуцирует экспрессию, что представляет собой случай в немодифицированном штамме. Изобретение направлено на штаммы, произведенные инженерным способом или с помощью классических генетических методов или с помощью генно-инженерной методологии.
Экспрессирующие системы и содержащие их хозяйские штаммы согласно изобретению могут содержать последовательность нуклеиновых кислот, кодирующую гетерологичный белок, выбранный из углевод-деградирующих ферментов (целлюлаз, ксиланаз, маннаназ, маннозидаз, пектиназ, амилаз, например глюкоамилаз,  -амилаз, -амилаз,  – и – и  -галактозидаз, -галактозидаз,  – и – и  -глюкозидаз, -глюкозидаз,  -глюканаз, хитиназ, хитаназ), протеаз (эндопротеаз, аминопротеаз, амино- и карбоксипептидаз, кератиназ), других гидролаз (липаз, эстераз, фитаз), оксидоредуктаз (каталаз, глюкозооксидаз) и трансфераз (трансгликозилаз, трансглутаминаз, изомераз и инвертаз). -глюканаз, хитиназ, хитаназ), протеаз (эндопротеаз, аминопротеаз, амино- и карбоксипептидаз, кератиназ), других гидролаз (липаз, эстераз, фитаз), оксидоредуктаз (каталаз, глюкозооксидаз) и трансфераз (трансгликозилаз, трансглутаминаз, изомераз и инвертаз).
Самыми интересными продуктами, продуцируемыми согласно изобретению, являются целлюлазы, ксиланазы, пектиназы, липазы и протеазы, причем целлюлазы и ксиланазы расщепляют бета-1,4-связи, и целлюлазы включают в себя эндоглюканазы, целлобиогидролазы и бета-глюкозидазы. Указанные белки являются чрезвычайно пригодными в различных промышленных способах, известных в данной области. В отношении целлюлаз авторы ссылаются, например, на международную патентную заявку WO 98/15633, описывающую применение целлобиогидролаз и эндоглюканаз. Содержание указанной заявки включено в данный текст в виде ссылки.
Рекомбинант согласно изобретению может содержать последовательность нуклеиновых кислот, кодирующую полипептид, представляющий интерес, который инактивирован или нестабилен при кислом значении рН, т.е. рН ниже 6, даже ниже рН 5,5, более подходяще даже ниже рН 5 и даже ниже рН 4. Данный факт представляет собой особенно интересный аспект, поскольку обычно описанные экспрессирующие системы грибов не культивируют в условиях рН от нейтрального до щелочного, но культивируют при кислом рН. Таким образом, система согласно изобретению обеспечивает безопасную грибную экспрессирующую систему для белков или полипептидов, которые инактивируются или становятся нестабильными при кислом рН.
Точнее сказать, рекомбинантный штамм, определенный в любом из аспектов согласно изобретению, где последовательность нуклеиновых кислот, кодирующая интересующий полипептид, кодирует белок или полипептид, проявляющий оптимальную активность и/или стабильность при рН выше 5, предпочтительно при нейтральном или щелочном рН (т.е. выше 7) и/или при рН выше 6, рассматривают как предпочтительный аспект изобретения. Особенно предпочтительными аспектами являются такие аспекты, где наблюдается более 50%, более 70% и даже более 90% оптимальных активностей при таких значениях рН. Полипептид, экспрессированный в условиях культивирования, необязательно должен быть активным в условиях культивирования, действительно, он может быть пригодным для культивирования его в условиях, при которых он является неактивным, поскольку его активная форма может быть вредной для хозяина. Однако что же требуется для того, чтобы белок или полипептид были стабильны в условиях культивирования. Стабильность может быть термостабильностью. Также она может быть стабильностью против специфических композиций или химических веществ, таких, которые, например, находятся в композициях или способах производства или применения полипептида или белка, представляющего интерес. LAS в детергентных композициях, содержащих целлюлазы или липазы, и так далее, являет собой пример химического вещества, которое часто оказывает вредное воздействие на белки. Периоды времени использования могут варьировать в заявках от короткого периода до продолжительного периода, поэтому стабильность может иметь место в пределах изменяющейся продолжительности времени, изменяясь от заявки к заявке. Квалифицированный специалист способен подобрать корректные условия, применимые к данному случаю. Он может использовать ряд коммерчески доступных способов анализа для определения оптимальных активностей различных ферментативных продуктов. Например, каталоги Sigma и Megazyme предоставляют такую возможность. Специфические примеры тестов упомянуты ранее в описании. Производители обеспечивают рекомендации по применению.
Штамм Chrysosporium можно использовать подходящим образом, чтобы трансформировать или трансфицировать последовательностью, которая должна экспрессировать, и такой штамм продуцирует относительно мало биомассы. Авторы обнаружили, что штаммы Chrysosporium, продуцирующие биомассу в количестве от двух до пяти раз меньше, чем продуцирование биомассы штаммом Trichoderma reesei, когда культивируют до вязкости 200-600 сПз в конце ферментации, и продуцирующие биомассу от 10 до 20 раз меньше, чем продуцирование биомассы штаммом Aspergillus niger, когда культивируют до вязкости 1500-2000 сПз при соответствующих условиях, т.е. их соответствующие оптимальные условия культивирования могут обеспечить высокий уровень экспрессии. Такой уровень экспрессии значительно превосходит уровень экспрессии двух коммерческих, стандартных штаммов, отличающихся низким уровнем биомассы и низкой вязкостью. Полученные данные свидетельствуют о том, что выход экспрессии таких штаммов Chrysosporium будет значительно выше, чем из штаммов Aspergillus niger и Trichoderma reesei. Такой трансформированный или трансфицированный штамм Chrysosporium представляет собой предпочтительный аспект изобретения.
Авторы обнаружили, что уровень биомассы для штамма Chrysosporium C1(18-25) составляет 0,5-1,0 г/л, в противоположность уровню биомассы для штамма Trichoderma reesei, составляющего 2,5-5,0 г/л, и для штамма Aspergillus niger, составляющего 5-10 г/л, при вышеописанных условиях. В примерах авторы детально описывают данный способ.
В соответствующем аспекте рекомбинантный штамм Chrysosporium продуцирует белок или полипептид, по крайней мере, в количестве, эквивалентном продукции в молях на литр целлюлазы штаммом UV 13-6 или С-19, и самое предпочтительное, по крайней мере, эквивалентном или выше продукции штамма UV 18-25 при соответствующих или идентичных условиях, т.е. при их соответствующих оптимальных условиях культивирования.
Авторы также обнаружили, что скорости экспрессии и секреции являются очень высокими, когда используют штамм Chrysosporium, показывающий морфологию мицелия штамма UV 18-25, т.е. фрагментированного короткого мицелия. Таким образом, рекомбинантный штамм согласно изобретению предпочтительно будет демонстрировать такую морфологию. Однако изобретение также охватывает нерекомбинантные штаммы или иначе модифицированные штаммы Chrysosporium, проявляющие новые характеристики. Кроме того, изобретение охватывает рекомбинантный штамм Chrysosporium в любом из аспектов, описанных согласно изобретению, который проявляет сниженную споруляцию в сравнении со штаммом С1, предпочтительно ниже, чем со штаммом UV13-6, предпочтительно ниже, чем со штаммом NG7C-19, предпочтительно ниже, чем со штаммом UV18-25 при равных условиях ферментации. Также изобретение охватывает рекомбинантный штамм Chrysosporium в любом из аспектов, описанных согласно изобретению, который демонстрирует, по крайней мере, отношение количества белковой продукции к биомассе в сравнении с С1, предпочтительно в сравнении с отношением для любого из штаммов UV13-6, NG7C-19 и UV18-25 при равных условиях ферментации. Изобретение также охватывает нерекомбинантные штаммы или иначе модифицированные штаммы Chrysosporium, проявляющие новые характеристики как таковые или в комбинации с каким-либо из других аспектов.
Другой привлекательный аспект изобретения также охватывает штамм Chrysosporium, вязкость которого при культивировании является ниже, чем вязкость штамма NG7C-19, предпочтительно ниже, чем вязкость штамма UV18-25 при соответствующих или идентичных условиях ферментации. Изобретение также охватывает нерекомбинантные штаммы или иначе модифицированные штаммы Chrysosporium, проявляющие указанные новые характеристики как таковые или в комбинации с какими-либо другими аспектами. Авторы показали, что вязкость культуры UV18-25 является ниже, чем 10 сПз в противоположность вязкости Trichoderma reesei, которая составляет величину порядка 200-600 сПз, а вязкость Asperglllus niger составляет величину порядка 1500-2000 сПз при соответствующих каждому штамму оптимальных культуральных условиях в конце ферментации. Способ такого определения представлен в примерах.
Во многих случаях вязкость может быть определена путем визуального мониторинга. Текучесть вещества может меняться в большой степени, поскольку оно может быть почти твердым, соусоподобным или жидким. Вязкость также можно легко определить с помощью ротационной вискозиметрии Брукфильда, с помощью использования пробирок для оценки кинематической вязкости, с помощью шарикового вискозиметра или вискозиметра типа чаши. Выходы из такой культуры с низкой вязкостью являются выше, чем из коммерческих, известных культур с более высокой вязкостью на единицу времени и на клетку.
Обработка таких культур с низкой вязкостью согласно изобретению является благоприятной, в частности, когда культуры постепенно увеличиваются. Обработку штаммов Chrysosporium с низкой вязкостью успешно осуществляют в культурах объемом вплоть до 150000 литров. Таким образом, любой объем культуры вплоть до 150000 литров составляет пригодный аспект изобретения. Любой другой обычный объем культуры при ферментации должен быть достигнут с использованием штаммов согласно изобретению. Следует отметить, что зондовлемы могут возникнуть в результате образования агрегатов при крупномасштабном производстве, имеющих мицелии, которые являются также плотными и/или неровно распределенными. В результате среды не могут быть эффективно утилизированы в процессе культивирования, что приводит к неэффективному производственному процессу, в частности при условиях крупномасштабных ферментаций, т.е. объемом свыше 150000 литров. Аэрация и перемешивание в таких условиях становятся зондовлематичными, приводя к кислородному голоданию и нехватке питательных веществ и в результате к снижению концентрации продуцируемой биомассы и снижению выхода полипептида в течение культивирования, и/или могут привести к увеличению времени ферментации. Кроме того, высокая вязкость и большой сдвиг являются нежелательными в коммерческих ферментационных процессах, и в имеющихся коммерческих способах они являются ограничивающими продукцию факторами. Все указанные отрицательные аспекты могут быть преодолены с помощью хозяйского штамма Chrysosporium согласно изобретению, который демонстрирует свои характеристики, превосходящие характеристики штаммов Trichoderma reesei, Aspergillus niger и Aspergillus oryzae, которые являются коммерчески используемыми в этом отношении, т.е. указанный штамм достигает наилучших уровней белковой продукции и характеристик вязкости и показателей биомассы.
Штамм Chrysosporium согласно любому из вышеупомянутых аспектов изобретения, причем указанный штамм, осуществляющий продуцирование одного или более ферментов грибов, выбранных из углевод-деградирующих ферментов, протеаз, других гидролаз, оксидоредуктаз и упомянутых выше трансфераз, рассматривают как особенно пригодный аспект изобретения. Продуктами, представляющими большой интерес, являются, в особенности, целлюлазы, ксиланазы, пектиназы, липазы и протеазы. Кроме того, пригодным аспектом изобретения является штамм Chrysosporium, осуществляющий продуцирование одного или более ферментов грибов, которые проявляют оптимальную стабильность и/или активность в нейтральной или щелочной среде, предпочтительно оптимальную стабильность и/или активность в щелочной среде, причем указанный фермент выбирают из углевод-деградирующих ферментов, гидролаз и протеаз, предпочтительно гидролаз и углевод-деградирующих ферментов. В случае нерекомбинантного штамма Chrysosporium, такие ферменты являются отличными от целлюлаз, как описано в международной патентной заявке WO 98/15633. Ферментами, представляющими особый интерес, являются ксиланазы, протеазы, эстеразы, альфа-галактозидазы, бета-галактозидазы, бета-глюканазы и пектинаэы. Ферменты не ограничиваются вышеперечисленными ферментами. Замечания относительно стабильности и активности, приведенные в описании ранее, также имеют силу в изобретении.
Изобретение также охватывает способ продуцирования полипептида, представляющего интерес, причем указанный способ включает в себя культивирование хозяйского штамма (например, штамма грибов, таких как из рода Chrysosporium, Aspergillus, Trichoderma, Hansenula, Mucor, Pichia, Neurospora, Tolypocladium, Rhizomucor, Fusarium, Penicillum или бактериального штамма или другого микробного штамма) в любом из аспектов согласно изобретению при условиях, способствующих экспрессии и предпочтительно секреции полипептида, и впоследствии выделению продуцируемого полипептида, представляющего интерес.
В тех случаях, когда упоминают белок или полипептид, то их варианты и мутанты, например мутанты природных белков с замещением, вставкой или делецией, проявляющие активность немутантов, также предположено включить. То же самое является действительным в отношении соответствующих последовательностей нуклеиновых кислот. Способы, такие как генная перестановка, белковая инженерия и направленная эволюция с помощью сайтнаправленного мутагенеза и случайный мутагенез являются способами, способствующими получению таких полипептидов, вариантов или мутантов. Патенты США 5223409, 5780279 и 5770356 описывают условия осуществления направленной эволюции. Используя данный способ, библиотека случайно мутированных генных последовательностей, созданная, например, согласно генным перестановкам посредством склонного к ошибке метода PCR, имеется в любом типе клеток. Каждый ген имеет область секреции и область иммобилизации, связанную с ней таким образом, что полученный белок секретируется и останавливается закрепленным к поверхности хозяина. Далее создаются такие условия, которые неизбежно приводят к биологической активности данного полипептида. Такое происходит по отношению к ряду циклов, в конце концов приводя к конечному гену с желаемыми характеристиками. Другими словами, ускоренный способ направленной эволюции. Патент США также описывает способ получения ДНК, РНК, пептидов, полипептидов или белка с помощью синтетического полинуклеотида, соединяющего случайно произведенные последовательности, введение его в хозяина с последующим отбором хозяйской клетки с соответствующими предопределенными характеристиками.
Другое применение способа настоящего изобретения заключается в способе «направленной эволюции», где производятся новые последовательности ДНК, кодирующие белок, кодируемые белки экспрессируются в хозяйской клетке, и указанные последовательности, кодирующие белки, имеющие желаемые характеристики, мутированы и вновь экспрессированы. Способ повторяют для ряда циклов до тех пор, пока не будет получен белок с желаемыми характеристиками. Генная перестановка, белковая инженерия, склонный к ошибкам метод PCR, сайтнаправленный мутагенез и комбинаторный и беспорядочный мутагенез являются примерами способов, с помощью которых новые последовательности ДНК, кодирующие экзогенные белки, могут быть произведены. Патенты США 5223409, 5780279 и 5770356 описывают способы осуществления направленной эволюции. См. также Kuchner and ArNo.ld, Trends in BiotechNo.logy, 15:523-530 (1997); Schmidt-Dannert and ArNo.ld, Trends in Biotech., 17:135-136 (1999); ArNo.ld and Volkov, Curr. Opin. Chem. Biol., 3:54-59 (1999); Zhao et al., Manual of Industrial Microbiology and BiotechNo.logy, 2nd Ed., (Demain and Davies, eds.) pp.597-604, ASM Press, Washington DC, 1999; ArNo.ld and Wintrode, Encyclopedia of Bioprocess TechNo.logy: Fermentation, Biocatalysis, and Bioseparation, (Flickinger and Drew, eds.) pp.971-987, John Wiley & Sons, New York, 1999; and Minshull and Stemmer, Curr. Opin. Chem. Biol. 3:284-290.
Применение комбинаторного мутагенеза описано Ни et al., Biochemistry, 1998 37:10006-10015. Патент США 5763192 описывает способ получения новых белок-кодирующих последовательностей ДНК с помощью случайно генерированных синтетических последовательностей, внесения их в хозяина и отбора хозяйских клеток с желаемой характеристикой. Способы, осуществляющие искусственную рекомбинацию гена (ДНК перестановку), включают в себя беспорядочную примированную рекомбинацию (Z.Shao, et al., Nucleic Acids Res., 26:681-683 (1998)), способ ступенчатой встройки (Н.Zhao et al., Nature Biotech., 16:258-262 (1998)), гетеродуплексную рекомбинацию (A.Volkov et al., Nucleic Acids Res., 27:e18 (1999)). Склонный к ошибкам метод PCR является другим подходом (Song and Rhee, Appl. Environ. Microbiol. 66:890-894 (2000)).
Существует два широко практикуемых способа выполнения стадии отбора в способе направленной эволюции. В одном способе активность интересующего белка тем или иным образом становится существенной для выживания хозяйских клеток. Например, если желаемая активность является целлюлазной активностью при рН 8, целлюлазный ген должен быть подвергнут мутации и внесен в хозяйские клетки. Трансформанты растут с целлюлозой как единственным источником углерода, и рН увеличивается постепенно до тех пор, пока уцелевшими остается мало клеток. Мутантный целлюлазный ген из выживших клеток, который, по-видимому, кодирует активную целлюлазу при относительно высоком рН, подвергают другому циклу мутации, и способ повторяют до тех пор, пока не будут получены трансформанты, которые растут на целлюлозе при рН 8. Аналогично могут быть выведены термостабильные варианты ферментов с помощью циклов генной мутации и культивирования хозяйских клеток при высоких температурах (Liao et al., Proc. Natl. Acad. Sci. USA 83:576-580 (1986); Giver et al., Proc. Natl. Acad. Sci. USA 95:12809-12813 (1998).
В качестве альтернативы массовому параллелизму подход «выживание наиболее приспособленных» представляет собой серийный скрининг. При таком подходе индивидуальные трансформанты подвергаются скринингу традиционными способами, такими как наблюдение очищенных или окрашенных зон вокруг колоний, растущих на среде с индикатором, колориметрический или флуорометрический энзиматический анализ, иммунный анализ, анализ связывания, и т.д. См., например, Joo et al., Nature 399:670-673 (1999), где цитохром Р450 монооксигеназа, не требующая NADH в качестве кофактора, была выявлена посредством циклов мутации и скрининга; May et al., Nature Biotech. 18:317-320 (2000), где гидантоиназа реверсированной стереоселективности была выявлена подобным образом, и Miyazaki et al., J.Mol. Biol. 297:1015-1026 (2000), где термостабильный субтилизин был выявлен.
Чтобы получить требуемую информацию о последовательности, можно использовать способы стандартного клонирования и выделения белка или полипептида. Части известных последовательностей могут быть использованы в качестве зондов для выделения других гомологичных последовательностей в других родах или штаммах. Последовательность нуклеиновых кислот, кодирующая отдельный активный фермент, может быть использована, чтобы произвести скрининг, например, библиотеки Chrysosporium. Квалифицированный специалист в данной области будет решать, какие условия гибридизации являются соответствующими. Обычные способы гибридизации конструкций из библиотек и способы клонирования описаны в Sambrook et al. (Eeds) (1989) In “Molecular Cloning. A Laboratory Manual” Cold Spring Harbor, Press Plainview, New York, and Ausubel er al (Eeds) “Current Protocols in Molecular Biology” (1987) John Wiley and Sons, New York. Соответствующую информацию можно получить из последних справочников и патентов, а также из различных коммерчески доступных наборов в данной области.
В альтернативном аспекте указанный способ включает в себя культивирование штамма согласно изобретению при условиях, способствующих экспрессии и предпочтительно секреции белка, или полипептида, или их предшественника, и выделение продуцируемого полипептида и, необязательно, предшественник подвергается дополнительным стадиям выделения и очистки с целью получения полипептида, представляющего интерес. Такой способ может подходящим образом включать в себя стадию расщепления предшественника до полипептида или интересующего предшественника. Стадию расщепления можно осуществлять с помощью Кех-2-подобной протеазы, протеазы, расщепляющей любые спаренные основные аминокислоты, или Кех-2, например, когда расщепляемый протеазой участок связывается с секретируемым белком-носителем и искомым полипептидом. Квалифицированный специалист в данной области сможет легко обнаружить последовательности Кех-2-подобной протеазы, так как детали обобщающей типичной последовательности являются доступными, и ряд альтернативных последовательностей уже описан, например, для фурина.
Подходящим фактором в способе продуцирования полипептида согласно любому из аспектов изобретения является то, что культивирование выполняют при рН выше 5, предпочтительно при рН 5-10, более предпочтительно при рН 6-9. В таком способе подходящим фактором является то, что культивирование осуществляют при температуре между 25-43°С, предпочтительно при 30-40°C. Штаммом, применяемым в способе согласно изобретению, является очень подходящий рекомбинантный штамм Chrysosporium или другой грибной или негрибной штамм. В таком случае способ согласно изобретению может включать в себя стадию получения рекомбинантного штамма согласно изобретению. Выбор соответствующих условий будет зависеть от природы экспрессированного полипептида, и такой выбор находится в сфере деятельности квалифицированного специалиста в данной области.
Способ получения рекомбинантного штамма согласно изобретению также является одной из целей изобретения. Способ заключает в себе надежное внедрение последовательности нуклеиновых кислот, кодирующей гетерологичный или гомологичный полипептид, в подходящий хозяйский штамм, причем указанная последовательность нуклеиновых кислот связана с регулирующей экспрессию областью, кроме того, указанное внедрение осуществляют способом, известным, по существу, для трансформации гифомицетов. Как указано выше, многочисленные публикации на эту тему являются доступными, и небольшая выборка из этих публикаций сделана. Имеющейся информации достаточно для того, чтобы квалифицированный специалист смог выполнить способ без чрезмерного напряжения. Способ заключает в себе внедрение последовательности нуклеиновых кислот, содержащей любые элементы нуклеиновых кислот, описанные в различных аспектах рекомбинантного штамма согласно изобретению, как таковой или в комбинации.
В качестве примера внедрение можно осуществлять с помощью способа трансформации протопласта. Способ описан в примерах. Альтернативные способы трансформации протопласта или сферопласта известны и могут быть применены, как описано в публикациях на предыдущем уровне техники для других гифомицетов. Подробности таких способов можно найти во многих цитированных публикациях, и они включены в данный текст в виде ссылки. Способ согласно изобретению включает в себя применение нерекомбинантного штамма в качестве исходного материала для внедрения желаемой последовательности, кодирующей полипептид, представляющий интерес.
Целью изобретения также является способ продуцирования фермента штаммом Chrysosporium, где указанный способ включает в себя культивирование Chrysosporium или другого штамма в культуральной среде или на среде при рН выше 5, предпочтительно при рН 5-10, более предпочтительно при рН 6-9, самое предпочтительное при рН 6-7,5, 7,5-9, приведенных в качестве примеров нейтральных и щелочных диапазонов рН.
В общих чертах изобретение охватывает способ продуцирования ферментов, проявляющих оптимальную активность и/или стабильность в нейтральной или щелочной среде, предпочтительно оптимальную активность и/или стабильность в щелочной среде. Предпочтительные области рН для оптимальной активности, а также методы анализа, с помощью которых определяют указанные параметры, приведены ранее в описании. Фермент следует выбирать из углевод-деградирующих ферментов, протеаз, других гидролаз, оксидоредуктаз и трансфераз, как описано выше, причем указанный способ включает в себя культивирование хозяйской клетки, трансформированной или трансфицированной соответствующей последовательностью нуклеиновых кислот, кодирующей фермент. Таким подходящим ферментом является фермент Chrysosporium. Подходящий способ, такой как данный, заключает в себе продуцирование целлюлазы, ксиланазы, пектиназы, липазы и протеазы, где целлюлаза и ксиланаза расщепляют  -1,4-связи, и целлюлаза включает в себя эндоглюканазу, целлобиогидролазу и -1,4-связи, и целлюлаза включает в себя эндоглюканазу, целлобиогидролазу и  -глюкозидазу. Способ согласно изобретению может включать в себя культивирование любого хозяина Chrysosporium согласно изобретению, содержащего последовательность нуклеиновых кислот, кодирующую вышеупомянутые ферменты. Подходящее продуцирование нерекомбинантными хозяевами Chrysosporium согласно изобретению направлено на продуцирование углевод-деградирующих ферментов, гидролаз и протеаз. В таком случае ферментом является другой, чем целлюлаза, фермент. Способы выделения аналогичны тем способам, которые описаны в международной патентной заявке WO 98/15633 и включены в текст в виде ссылки. -глюкозидазу. Способ согласно изобретению может включать в себя культивирование любого хозяина Chrysosporium согласно изобретению, содержащего последовательность нуклеиновых кислот, кодирующую вышеупомянутые ферменты. Подходящее продуцирование нерекомбинантными хозяевами Chrysosporium согласно изобретению направлено на продуцирование углевод-деградирующих ферментов, гидролаз и протеаз. В таком случае ферментом является другой, чем целлюлаза, фермент. Способы выделения аналогичны тем способам, которые описаны в международной патентной заявке WO 98/15633 и включены в текст в виде ссылки.
Ферменты, продуцируемые согласно изобретению, также охвачены изобретением. Ферменты, происходящие из Chrysosporium, которые могут быть выделены из нерекомбинантных штаммов Chrysosporium согласно изобретению, также охвачены изобретением. Они проявляют вышеупомянутые характеристики стабильности и активности. Подходящим фактором является то, что они стабильны в присутствии LAS. В частности, заявленными являются протеазы с pI 4-9,5, протеазы с молекулярной массой 25-95 кДа, ксиланазы с pI между 4,0 и 9,5, ксиланазы с молекулярной массой между 25 и 65 кДа, эндоглюканазы с pI между 3,5 и 6,5, эндоглюканазы с молекулярной массой 25-55 кДа, целлобиогидролазы с pI 4-5, целлобиогидролазы с молекулярной массой 45-75 кДа, например с молекулярной массой 55 кДа и pI 4,4, полигалактуроназы с pI 4,0-5,0, полигалактуроназы с молекулярной массой 60-70 кДа, например 65 кДа, эстеразы с pI 4-5 и эстеразы с молекулярной массой 95-105 кДа с вышеуказанными характеристиками стабильности и активности. Молекулярные массы (MW) ферментов определены с помощью ЭФ в ПААГ в присутствии додецилсульфата натрия. Нерекомбинантный, т.е. нативный фермент, отличный от целлюлазы, описан в международной патентной заявке WO 98/15633. Ферменты с комбинациями величин pI и молекулярных масс, упомянутые выше, также охвачены изобретением.
Изобретение также касается (сверх)продуцирования небелковых продуктов мутантными (рекомбинантными) штаммами согласно изобретению. Такие небелковые продукты включают в себя первичные метаболиты, такие как органические кислоты, аминокислоты, и вторичные метаболиты, такие как антибиотики, например пенициллины и цефалоспорины и другие терапевтические препараты. Такие продукты являются результатом комбинаций биохимических путей метаболизма, вовлекая некоторые представляющие интерес гены грибов. Первичные и вторичные метаболиты грибов и способы продуцирования указанных метаболитов в грибах хорошо известны в данной области. Примеры продуцирования первичных метаболитов описаны Mattey M., The Production of Organic Acids, Current Reviews in BiotechNo.logy, 12, 87-132 (1992). Примеры продуцирования вторичных метаболитов описаны Penalva et al. The Optimization of Penicillin Biosynthesis in Fungi, Trends in BiotechNo.logy, 16, 483-489 (1998).
ПРИМЕРЫ
СРАВНИТЕЛЬНЫЕ ПРИМЕРЫ ТРАНСФОРМАЦИИ CHRYSOSPORIUM, TRICHODERMA И TOLYPOCLADIUM GEODES
Два нетрансформированных штамма Chrysosporium C1 и один контрольный штамм Trichoderma reesei тестировали на двух средах (Gs рН 6,8 и Pridham agar, PA, рН 6,8). Для того, чтобы проверить уровень устойчивости к антибиотикам, споры собирали с PDA чашек на 7-ой день. Отобранные чашки инкубировали при 32°С и оценивали после 2, 4 и 5 дней. Полученные данные показали, что C1 штаммы NG7C-19 и UV18-25 имеют четкий низкий базальный уровень устойчивости как к флеомицину, так и к гигромицину. Указанный уровень устойчивости к антибиотикам сравнивали с уровнем для контрольного штамма Т. reesei, который обычно применяют в лаборатории. Полученные результаты показали, что эти два стандартных выбираемых маркера грибов можно использовать для штаммов Chrysosporium. С другими стандартными выбираемыми маркерами грибов зондовлем не должно быть.
Отбор Sh-ble (флеомицин-устойчивых) трансформированных штаммов Chrysosporium был успешно проведен при уровне устойчивости 50 мкг/мл. Такой уровень отбора был использован для Т.reesei, таким образом показывая, что дифференциальный отбор может быть легко произведен в Chrysosporium. Такие замечания справедливы для трансформированных штаммов с уровнем устойчивости к гигромицину, составляющим 150 мкг/мл.
Способ трансформации протопласта был использован для Chrysosporium на основании общепринятой технологии трансформации грибов. Все споры с одной 90 мм PDA чашки помещали в 8 мл IC1 и переносили в колбу с 50 мл IC1 среды для инкубации в течение 15 часов при 35°С и перемешивании при 200 оборотов в минуту. После этого культуру центрифугировали, осадок промывали в MnP, доставляли обратно в 10 мл раствора MnP и 10 мг/мл Caylase С3 и инкубировали в течение 30 минут при 35°С с перемешиванием (150 оборотов в минуту).
Раствор фильтровали и фильтрат подвергали центрифугированию в течение 10 минут при 3500 оборотов в минуту. Осадок промывали 10 мл MnPCa2+. Смесь центрифугировали в течение 10 минут при 25°C. Затем добавляли 50 микролитров холодного MPC. Смесь держали на льду в течение 30 минут, после чего добавляли 2,5 мл PMC. После 15 минут при комнатной температуре обработанные протопласты смешивали с 3 мл MnR Soft и немедленно помещали на чашку с MnR, содержащую флеомицин или гигромицин в качестве агента, применяемого для отбора. После инкубации в течение 5 дней при 30°С трансформанты анализировали (клоны становились видимыми после 48 часов). Эффективность трансформации определяли, используя 10 микрограмм эталонной плазмиды pAN8-119. Результаты представлены в следующей таблице 1.
Таблица 1
Эффективность трансформации (используя 10 мкг эталонной плазмиды pAN8-1) |
| |
Т.reesei |
NG7C-19 |
UV18-25 |
| Жизнеспособность |
106/200 мкл |
5·106/200 мкл |
5·106/200 мкл |
| Трансформанты на 200 мкл |
2500 |
104 |
104 |
| Трансформанты на 106 жизнеспособных клеток |
2500 |
2000 |
2000 |
Жизнеспособность трансформантов Chrysosporium была выше, чем трансформантов Trichoderma. Трансформируемость штаммов была соизмеримой и, таким образом, число полученных в одном эксперименте трансформантов было в 4 раза выше для Chrysosporium, чем для T.reesei. Таким образом, трансформационная система Chrysosporium не только равна общепринятой системе Т.reesei, но даже превосходит ее. Полученный результат может оказаться особенно полезным для векторов, которые являются менее эффективными в отношении трансформации, чем pAN8-1. Примерами таких менее эффективных для трансформации векторов являются векторы белок-носителей для продуцирования негрибных белков, которые обычно производят в 10 раз меньше трансформантов.
Ряд других трансформирующих и экспрессирующих векторов был сконструирован с гомологичными Chrysosporium белок-кодирующими последовательностями и также с гетерологичными белок-кодирующими последовательностями для использования в экспериментах по трансформации Chrysosporium.
Примеры экспрессирующих систем включают в себя Chrysosporium промоторный фрагмент ксиланазы Xyll, связанный с сигнальной последовательностью ксиланазы в рамке с открытой рамкой считывания ксиланазы, за которой следует терминаторная последовательность ксиланазы. Отбор трансформанта выполняли путем использования котрансформации с выбираемым вектором.
Другим примером является Chrysosporium luckNo.wense промотор целлобиогидролазы, связанный с Penicillium сигнальной последовательностью эндоглюканазы 3 в рамке с открытой рамкой считывания Penicillium эндоглюканазы 3, за которой следует Chrysosporium терминаторная последовательность целлобиогидролазы. Кроме того, этот вектор несет вторую экспрессирующую кассету с отборочным маркером, т.е. геном ацетамидазы S (AmdS ген).
Следующий пример представляет собой Chrysosporium промотор глицеральдегид-3-фосфатдегидрогеназы 1, связанный с Aspergillus niger сигнальной последовательностью глюкоамилазы и открытой рамкой считывания глюкоамилазы, соединенной с открытой рамкой считывания человеческого интерлейкина 6. Кроме того, этот вектор несет вторую экспрессирующую кассету с отборочным маркером, т.е. AmdS геном.
Еще одним примером является Aspergillus nidulans промотор глицеральдегид-3-фосфатдегидрогеназы А, связанный с открытой рамкой считывания эндоглюканазы 5, за которой следует Aspergillus nidulans терминаторная последовательность.
ПРИМЕРЫ ГЕТЕРОЛОГИЧНОЙ И ГОМОЛОГИЧНОЙ ЭКСПРЕССИИ ТРАНСФОРМАНТОВ CHRYSOSPORIUM
Штаммы C1 (NG7C-19 и/или UV18-25) были тестированы в отношении их способности секретировать различные гетерологичные белки: бактериальный белок (флеомицин-устойчивый белок, Sh ble, Streptoalloteichus hindustanus), белок грибов (ксиланаза II, XYN2, Trichoderma reesei) и белок человека (человеческий лизоцим, HLZ).
C1 секреция штаммом грибов Trichoderma reesei ксиланазы II (XYN2).
C1 штамм UV18-25 трансформировали плазмидами pUT1064 и pUT1065.
Плазмида pUT1064 представляет собой две следующие экспрессирующие кассеты грибов:
Первая кассета способствует отбору флеомицин-устойчивых трансформантов:
– промотор гена I (срс-1), контролирующий переключение путей14 у Neurospora crassa
– флеомицин-устойчивый ген Sh ble4 Streptoalloteichus hindustanus
– терминатор триптофансинтазы (trpC) Aspergillus nidulans5
Вторая кассета представляет собой кассету продуцирования ксиланазы:
– промотор cbh1 штамма TR2 T.reesei15
– ген хуn2 штамма TR2 Т.reesei (включая его сигнальную последовательность)16
– терминатор cbh1 штамма TR2 Т.reesei15
Вектор также несет Е.Coli ориджин репликации из плазмиды pUC196. Детализированная карта плазмиды представлена на фигуре 1.
Плазмида pUT1065 представляет собой следующую экспрессирующую кассету грибов:
– промотор глицеральдегид-3-фосфатдегидрогеназы (gpdA) A.nidulans2
– синтетическая сигнальная последовательность целлобиогидролазы 1 (cbh1) Т. reesei1,3
– флеомицин-устойчивый ген Sh ble S.hindustanus4, используемый как белок-носитель10
– линкерный пептид (SGERK), характеризующий участок расщепления КЕХ2-подобной протеазы1
– T.reesei штамма TR2xyn2 ген (без сигнальной последовательности)16
– терминатор триптофан-синтазы (trpC) A.nidulans5
Вектор также несет ген бета-лактамазы (bla) и ориджин репликации Е.coli из плазмиды pUC186. Детализированная карта плазмиды представлена на фигуре 2.
С1 протопласты были трансформированы плазмидой pUT1064 или pUT1065, следуя той же процедуре, которая уже была описана в вышеуказанном примере. Комбинированный белок в плазмиде pUT1065 (Sh ble::XYN2) является функциональным в отношении устойчивости к флеомицину, таким образом способствуя легкому отбору С1 трансформантов. Кроме того, уровень устойчивости к флеомицину приблизительно коррелирует с уровнем хуn2 экспрессии. В pUT1064, xyn2 был клонирован с его собственной сигнальной последовательностью.
Продуцирование ксиланазы С1 трансформантами (флеомицин-устойчивые клоны) анализировали с помощью определения активности ксиланазы следующим образом: Первичные трансформанты переносили на чашки с GS + флеомицин (5 мкг/мл) (контроль устойчивости) и также на чашки с XYLAN (оценка активности ксиланазы путем визуализации очищенной зоны17). Клоны выращивали в течение 5 дней при 32°C. Каждый подтвержденный клон субклонировали на чашках с XYLAN. Два субклона на трансформант использовали для инокуляции PDA чашек, чтобы получить споры для инициации жидкой культуры. Жидкие культуры в IC1 + 5 г/л К.фталата выращивали в течение 5 дней при 27°С (перемешивание при 180 оборотов в минуту). Затем культуры центрифугировали (5000 g, 10 минут). В данных образцах измеряли ксиланазную активность методом, использующим DNS согласно Miller et al.19
Таблица 2
Уровни продуцирования активной XYN2 в С1 (лучшие способы) |
| |
Концентрация активной ксиланазы II в культуральной среде |
Удельная активность ксиланазы II в культуральной среде |
| Нетрансформированный штамм UV18-25 |
3,9 ед/мл |
3,8 ед/мг целых протопластов |
| UV18-25::1064 клон 7-1 |
4,7 ед/мл |
4,7 ед/мг целых протопластов |
| UV18-25::1064 клон 7-2 |
4,4 ед/мл |
4,3 ед/мг целых протопластов |
| UV18-25::1065 клон 1-1 |
29,7 ед/мл |
25,6 ед/мг целых протопластов |
| UV18-25::1065 клон 1-2 |
30,8 ед/мл |
39,4 ед/мг целых протопластов |
Полученные данные показывают, что:
1) Точки от 1 до 4 из примера 2 подтверждены.
2) С1 можно использовать в качестве хозяина для секреции гетерологичного белка грибов.
Приложение к примерам: Среды
Среда для трансформации:
| Основание Mandels: |
MnP среда |
|
| КН2PO4 |
2,0 г/л |
Основание Mandels с |
| (NH4)2SO4 |
1,4 г/л |
Пептоном 1 г/л |
| MgSO4·7H2O |
0,3 г/л |
MES 2 г/л |
| CaCl2 |
0,3 г/л |
Сахарозой 100 г/л |
| Олигоэлементы |
1,0 г/л |
Доведение рН до 5 |
| MnR |
MnP Са2+ |
|
| MnP + сахароза |
130 г/л |
MnP среда + |
| Дрожжевой экстракт |
2,5 г/л |
CaCl2·2Н2O 50 мМ |
| Глюкоза |
2,5 г/л |
Доведение рН до 6,5 |
| Агар |
15 г/л |
|
| MnR Soft: |
MnR с 7,5 г/л агара только |
| МРС: |
|
|
| CaCl2 |
50 мМ |
pH 5,8 |
| MOPS |
10 мМ |
|
| PEG |
40% |
|
| Для отбора и культуры |
|
| GS: |
|
|
| Глюкоза |
10 г/л |
|
| Biosoyase |
5 г/л |
[Merieux] |
| Агар |
15 г/л |
рН должен быть 6,8 |
| PDA: |
|
|
| Декстрозный агар из картофеля |
39 г/л |
[Difco] рН должен быть 5,5 |
| MPG: |
|
|
| Основание Mandels с К.фталатом |
5 г/л |
|
| Глюкозой |
|
|
| Дрожжевым экстрактом |
5 г/л |
|
Среда для регенерации (MnR), снабженная 50 мкг/мл флеомицина или 100-150 мкг/мл гигромицина, используется для отбора трансформантов. GS среда, снабженная 5 мкг/мл флеомицина, используется для подтверждения степени устойчивости к антибиотику.
PDA является полной средой для быстрого роста и хорошей споруляции. Жидкие среды инокулируют 1/20-ой суспензией спор (все споры из одной 90 мм PDA чашки в 5 мл 0,1% твина). Такие культуры выращивали при 27°С в колбах с перемешиванием (200 оборотов в минуту).
ВЫДЕЛЕНИЕ И ХАРАКТЕРИСТИКА С1 ГЕНОВ И ГЕННЫЕ ЭКСПРЕССИРУЮЩИЕ ПОСЛЕДОВАТЕЛЬНОСТИ СВН1, XYL1 И GPD
Конструкция BlueSTAR генной библиотеки UV18-25
Хромосомную ДНК UV18-25 частично гидролизовали с помощью Sau3A, фрагменты 12-15 кб выделяли и встраивали в BamHI сайт клонирующего вектора BlueSTAR. Упаковка 20% смеси, подвергаемой встраиванию, привела к генной библиотеке 4,6×104 независимых клонов. Эта библиотека была размножена и хранилась при 4°С и -80°C. Остаток смеси, подвергаемой встраиванию, также хранили при 4°С.
Скрининг генной библиотеки UV18-25 для выделения генов cbhl, xyll и gpdl
Для выделения разных генов в целом ±7,5×104 индивидуальных BlueSTAR фагов на зондову гибридизовали с удвоением. Гибридизацию проводили с PCR фрагментами cbh1 и xyl1 (как описано в международной патентной заявке WO 00/20555) при гомологичных условиях (65°С; 0,2×SSC) и с gpd1 геном A. niger при гетерологичных условиях (53°С; 0,5×SSC). Ряд положительных сигналов приведен в таблице 3. Положительные клоны повторно подвергали скринингу, и для каждого клона два индивидуальных фага использовали для дальнейших экспериментов. ДНК различных клонов анализировали с помощью рестрикционного метода, чтобы определить число различных клонов, выделенных из каждого гена (результаты приведены в таблице 3). Поскольку для каждого из трех генов было выделено 4-6 различных клонов, авторы сделали заключение, что первичная генная библиотека (±4-5×104 клонов) представляет приблизительно 5-кратный геном UV18-25. На основании указанных результатов было сделано заключение, что полный геном UV18-25 представлен в 9×103 клонах. Учитывая средний геномный инсерционный сегмент размером 13 кб, было показано, что размер генома составляет ±120 Мб, что в 3 раза больше размера генома Aspergillus.
С помощью PCR реакций со специфическими праймерами для гена, присутствующего на плазмиде (на основании раннего определения последовательности из выделенных PCR фрагментов), и Т7 и Т3 праймером, присутствующим в полилинкере pBlueSTAR, авторы смогли определить локализацию генов в ряде клонов. Из каждого гена плазмиду использовали для определения последовательности гена.
Таблица 3
Скрининг 7,5×104 фагов генной библиотеки UV18-25 с PCR фрагментами UV18-25 для cbh1 гена и xyl1 гена (гомологичные условия) и с gpdA геном A.niger (гетерологичные условия). Выделение ДНК и рестрикционный анализ использовали для определения числа различных клонов.
| Ген |
Положительный сигнал в первом скрининге |
Положительный сигнал во втором скрининге |
Различные клоны |
Клон, используемый для секвенирования |
| Cbhl |
8 |
7 |
4 |
РСВН7 |
| Xyll |
9 |
6 |
5 |
РХу15 |
| Gpdl |
12 |
12 |
6 |
PGPD4 |
Анализ последовательности клонированных генов
Для cbh1, xyl1 и gpd1 гена результаты определения последовательности представлены в виде последовательностей SEQ ID No.2, 4 и 6. Некоторые свойства белков представлены в таблице 4. Следует отметить, что положение начала трансляции и интронов основано на гомологии с генами из того же семейства (т.е. теоретическая генетика).
СВН1
Исходя из аминокислотных последовательностей СВН1, авторы заключили, что белок имеет размер приблизительно 63 кДа и что целлюлозо-связывающий домен (CBD) присутствует на С-концевой части молекулы белка. Неожиданным оказалось то, что авторы не обнаружили доказательства присутствия CBD в выделенном 55 кДа главном белке. Однако присутствие выделенных пептидов из этого 55 кДа главного белка в кодированном СВН1 белке (SEQ ID No.1, 2) подтвердило, что 55 кДа белок кодирован клонированным геном. Возможное объяснение полученных результатов заключается в том, что 55 кДа белок является усеченным вариантом СВН1 белка с отсутствующим доменом CBD.
Целлобиогидролаза СВН1 проявляла активность по отношению к MUF-целлобиозиду, MUF-лактозиду, FP и авицелу, также по отношению к п-нитрофенил  -глюкозиду, целлобиозе и п-нитрофениллактозиду. Активность фермента по отношению к MUF-целлобиозиду ингибировалась целлобиозой с константой ингибирования 0,4 мМ. Константа Михаэлиса по отношению к MUF-целлобиозиду составляла 0,14 мМ, по отношению к MUF-лактозиду составляла 4 мМ и по отношению к CMC составляла 3,6 г/л. Оптимум рН составлял от 4,5 до 7. 50% максимальной активности по отношению к CMC и 80% активности по отношению к RBB-CMC сохранялось при рН 8. 70-80% активности в области рН 5-8 сохранялось в течение 25 часов инкубации. Температурный оптимум составлял 60-70°C. СВН1 является членом семейства 7 целлобиогидролаз. Соответствующий промотор СВН, который является предпочтительным аспектом изобретения, указан в последовательности SEQ ID No.1. -глюкозиду, целлобиозе и п-нитрофениллактозиду. Активность фермента по отношению к MUF-целлобиозиду ингибировалась целлобиозой с константой ингибирования 0,4 мМ. Константа Михаэлиса по отношению к MUF-целлобиозиду составляла 0,14 мМ, по отношению к MUF-лактозиду составляла 4 мМ и по отношению к CMC составляла 3,6 г/л. Оптимум рН составлял от 4,5 до 7. 50% максимальной активности по отношению к CMC и 80% активности по отношению к RBB-CMC сохранялось при рН 8. 70-80% активности в области рН 5-8 сохранялось в течение 25 часов инкубации. Температурный оптимум составлял 60-70°C. СВН1 является членом семейства 7 целлобиогидролаз. Соответствующий промотор СВН, который является предпочтительным аспектом изобретения, указан в последовательности SEQ ID No.1.
Xyl1
Исходя из аминокислотных последовательностей Xyl1, авторы заключили, что здесь также присутствует CBD домен, в указанном белке у N-концевого участка (т.е. непосредственно присоединен к участку или при участке, расположенном на расстоянии в менее, чем 5 аминокислот от сигнальной последовательности). Из литературы известно только несколько ксиланаз с CBD доменом (Fusarium oxysporum, Humicola grisea Neocallimastix patriciarum). Определенный размер Xyl1 белка составляет 43 кДа и несколько пептидов, выделенных из 30 кДа ксиланазы, происходят из этого белка (SEQ ID No.3, 4). Несколько выделенных пептидов не могли обнаружить в кодированной последовательности. Полученный результат может указывать на то, что альтернативные ксиланазе белки присутствуют в UV18-25. В проведенных ранее анализах доказательство присутствия CBD в таком 30 кДа белке не было найдено. Основываясь на полученных результатах, авторы предположили, что CBD белка отщепляется при протеолизе. Это предположение будет анализировано в дальнейшем (путем определения активностей, N-концевых последовательностей и размеров различных белков в разных С1 штаммах: С1 дикого типа, NG7C, UV13-6, UV18-25 мутантах протеазы UV18-25). Авторы анализируют также более детально влияние присутствия или отсутствия CBD на ферментативные активности. Авторы рассматривают возможность повышенной экспрессии генов с полной длиной в различных С1 хозяевах.
Присутствие целлюлозо-связывающего домена (CBD) является особенной чертой данного фермента. Единственный другой известный гликолитический фермент (ксиланаза) семейства 10, имеющий N-концевой CBD, представляет собой XylF Fusarium oxysporum. Домен CBD у Xyl1 белка Chrysosporium luckNo.wens имеет последовательность: WGQCG GQGWT GPTTC VSGAV COFVN DWYSQ CV (аминокислоты 22-53 последовательности SEQ ID No.4). Эта последовательность не соответствует CBD консенсусной последовательности, описанной в патенте США 5763254 (No.vo). Указанная консенсусная последовательность из патента США 5763254 представляет собой: W/Y-G/A-Q-C-G G-Q/I/N-G/N-W/F/Y-S/T/N/Q G-P/A/C-T/R/K-T/C/N-C X-X-G/P-S/T/F/L/A- -Т/К С-V/T/R/E/K-K/Q/A-Q/D/A-W/F/Y-Y-Y/S/H/A-Q C-L/I/Q/V/T, где W/Y означает или W, или Y и т.д., Х означает любую аминокислоту, и – означает отсутствие. Четыре различия у самой дегенеративной консенсусной последовательности присутствуют в Xyl1, которые подчеркнуты в последовательности 7 выше. Таким образом, изобретение относится к ксиланазам, имеющим N-концевой CBD домен, отличный от этого консенсусного CBD, и другой, чем у ксиланазы Fusarium oxysporum. Более предпочтительно, ксиланаза согласно изобретению содержит домен CBD, включающий, по крайней мере, 55%, особенно, по крайней мере, 65%, предпочтительно, по крайней мере, 75% последовательности, идентичной последовательности 7 выше. Предпочтительно CBD содержит одну из аминокислот Phe, Туг и Trp у положения 23, или, по крайней мере, одну из четырех аминокислот Val у положения 20, Gln у положения 22, Phe у положения 23 и Val у положения 24. Предпочтительные последовательности содержат Cys-Xaa-Phe, Xaa-Phe-Val, Cys-Xaa-Phe-Val, Cys-Gln-Phe, Val-Cys-Xaa-Phe, Gln-Phe-Val, Gln-Trp-Val, Gln-Tyr-Val, Val-Cys-Gln, Val-Cys-Gln-Phe и Val-Cys-Xaa-Phe-Val, где Хаа является любой аминокислотой или предпочтительно Val, Thr, Arg, Glu, Gln или Lys, или самое предпочтительное Gln или Glu.
Ксиланаза не проявляет MUF целлобиазной активности и, таким образом, является истинной ксиланазой. Она обладает высокой активностью в широком диапазоне рН 5-8, сохраняя 65% максимальной активности при рН 9-10; она является членом семейства ксиланазы F. Соответствующий промотор ксиланазы, который является предпочтительным аспектом изобретения, показан в последовательности SEQ ID No.3. Константа Михаэлиса по отношению к ксилану березы составляет 4,2 г/л для 30 кДа ксиланазы. Температурный оптимум был высоким и равнялся 70°С для ксиланазы.
Gpd1
Последовательность ДНК С-концевой части gpd1 гена не определяли. Промоторные последовательности указанного гена являются предпочтительным аспектом настоящего изобретения и изображены в последовательности SEQ ID No.5.
Уровень экспрессии четырех генов Chrysosporium изучали методом нозерн-блоттинга. Различные штаммы C.luckNo.wense выращивали в обогащенной среде, содержащей pharmedia с целлюлозой и лактозой (среда 1), или обогащенной среде, содержащей pharmedia и глюкозу (среда 2) при 33°C. После 48 часов мицелий собирали и выделяли РНК. РНК гибридизовали с 4 различными зондми: EG5, EG6, Xyl1 и СВН. После обработки нозерн-блоты удаляли и гибридизовали вновь с зондом для рибосомальной L3 в качестве контроля в отношении количества мРНК на блоте. Большинство штаммов показали очень высокий ответ на СВН и высокий ответ на Xyl1 в среде 1; в среде 2 половина штаммов показала высокий ответ на все гены, и другая половина показала низкий ответ. Порядок уровня экспрессии был выведен из полученных данных как СВН> Xyl1> EG5> EG6.
Белок Xyl1 C.luckNo.wense является на 67% идентичным (на 72% гомологичный) его самому близкому гомологу в Genbank DATABASE (Таблица 4). Заслуживает внимание значительная гомология СВН1 белка с его родственным гомологом Humicola grisea (74% идентичности/82% гомологии). Также отмечено, что во всех случаях самые близкие гомологи происходят из грибов Fusarium, Humicola или других грибов PyreNo.mycetous (Sordariamycetous) (Таблица 4), в то время как Chrysosporium принадлежит к грибам Plectomycetous (Eurotiomycetous) согласно NCBI базе данных (Таблица 4). Таким образом, изобретение также относится к гликанолитическим ферментам, особенно целлобиогидролазам и ксиланазам, содержащим CBD, произведенным из грибов plectomycetous.
Таблица 4
Структурные и сравнительные данные СВН1, Xyl1 и GPD1 согласно изобретению |
| |
Семейство гликозидаз |
Выделен из С1 |
Количество аминокислот |
Интроны |
Замечания |
Родственные последовательности (% идентичности/% гомологии) |
| СВН1 |
7 |
70 кДа
55 кДа |
526
(63 кДа) |
1 |
CBD |
Humicola grisea (74/82) (СВН1:Р15828) Fusarium oxysporum (58/68) (СВН:Р46238) Neurospora crassa (60/69) (СВН1:Р38676) |
| XYL1 |
10 |
30 кДа |
333
(43 кДа) |
3 |
CBD |
Fusarlum oxysporum (67/72) (XylF:P46239) Penicillium simplissicum) (63/72) (XylF:P56588) Aspergillus aculeatus
(61/70) (XylF:059859) |
| GPD1 |
– |
– |
Неполное |
2+? |
– |
Podospora anserina (85/89) (GPD:P32637) Neurospora crassa (80/86) (GPD:U67457) Cryphonectria parasitica
(80/85) (GPD:P19089) |
Описание фигур
Фигура 1 представляет собой карту pUT1064
Фигура 2 представляет собой карту pUT1065
Формула изобретения
1. Белок, соответствующий гликозилгидролазе Chrysosporium семейства 7, проявляющий по меньшей мере 75%-ную идентичность аминокислотной последовательности (определено с помощью алгоритма BLAST) по отношению к SEQ ID NO:2 и сохраняющий по меньшей мере часть активности гликозилгидролазы семейства 7, или часть белка, содержащая по меньшей мере 20 смежных аминокислот, идентичных соответствующей части аминокислотной последовательности 1-246 или 394-526 SEQ ID NO:2, и сохраняющая по меньшей мере часть активности гликозилгидролазы семейства 7.
2. Белок, соответствующий гликозилгидролазе Chrysosporium семейства 10, проявляющий по меньшей мере 70%-ную идентичность аминокислотной последовательности (определено с помощью алгоритма BLAST) по отношению к SEQ ID NO:4 и сохраняющий по меньшей мере часть активности гликозилгидролазы семейства 10, или часть белка, содержащая по меньшей мере 20 смежных аминокислот, идентичных соответствующей части аминокислотной последовательности 1-133 или 252-383 SEQ ID NO:4, и сохраняющая по меньшей мере часть активности гликозилгидролазы семейства 10.
3. Белок, соответствующий гликозилгидролазе Chrysosporium семейства 10, проявляющий по меньшей мере 65%-ную идентичность аминокислотной последовательности (как определено с помощью алгоритма BLAST) по отношению к SEQ ID NO:4 и сохраняющий по меньшей мере часть активности гликозилгидролазы семейства 10, или часть белка, содержащая по меньшей мере 20 смежных аминокислот, идентичных соответствующей части аминокислотной последовательности 1-383 SEQ ID NO:4, и сохраняющая по меньшей мере часть активности гликозилгидролазы семейства 10.
4. Белок, соответствующий гликозилгидролазе Chrysosporium семейства 10 и содержащий связывающий целлюлозу домен, проявляющий по меньшей мере 55%-ную идентичность аминокислотной последовательности по отношению к аминокислотам 22-53 SEQ ID NO:4 и/или содержащий по меньшей мере 20 смежных аминокислот из аминокислотной последовательности 20-53 SEQ ID NO:4 и/или содержащий одну из аминокислот F, W и Y в положении, соответствующем положению 44 SEQ ID NO:4, и сохраняющий по меньшей мере часть активности гликозилгидролазы семейства 10.
5. Белок по п.1, отличающийся тем, что способен гидролизовать  -глюкозидные связи. -глюкозидные связи.
6. Белок по п.2, 3 или 4, отличающийся тем, что способен гидролизовать  -ксилозидные связи. -ксилозидные связи.
7. Нуклеиново-кислотный конструкт для экспрессии белка, содержащий последовательность нуклеиновой кислоты, кодирующую белок по любому из пп.1-4, функционально связанную с регулирующей экспрессию последовательностью нуклеиновой кислоты.
8. Нуклеиново-кислотный конструкт для экспрессии белка, содержащий регулирующую экспрессию последовательность нуклеиновой кислоты, функционально связанную с последовательностью нуклеиновой кислоты, кодирующей белок по любому из пп.1-4, содержащую по меньшей мере 70% нуклеотидов, содержащихся в 5′-некодирующей области последовательности нуклеиновой кислоты SEQ ID NO:1 или 3, и дополнительно характеризующуюся способностью, находясь в микроорганизме-хозяине, вызывать экспрессию указанного белка.
9. Нуклеиново-кислотный конструкт для экспрессии белка, содержащий регулирующую экспрессию область нуклеиновой кислоты, полученную из Chrysosporium, содержащуюся в 5′-некодирующей области последовательности нуклеиновой кислоты SEQ ID NO:1 или 3, функционально связанную с последовательностью нуклеиновой кислоты, кодирующей белок по любому из пп.1-4.
10. Штамм Chrysosporium lucknowense Cl (VKM F-3500 D), трансформированный нуклеиново-кислотным конструктом по любому из пп.7-9 и способный экспрессировать белок по пп.1-6.
11. Способ продуцирования белка с помощью штамма гриба по п.10, причем указанный способ предусматривает культивирование штамма гриба в условиях, обеспечивающих экспрессию и выделение белка.
12. Олигонуклеотидный зонд, содержащий по меньшей мере 15 смежных нуклеотидов последовательности нуклеиновой кислоты SEQ ID NO:1 или 3, или его комплемент.
13. Олигонуклеотидный зонд по п.12, где зонд состоит из 20-50 нуклеотидов.
14. Олигонуклеотидный зонд по п.12 или 13, где зонд помечен определяемой меткой.
15. Белок, обладающий целлобиогидролазной активностью и содержащий аминокислоты 20-495 SEQ ID NO:2.
16. Белок, обладающий ксиланазной активностью и содержащий аминокислоты 54-384 SEQ ID NO:4.
17. Белок, обладающий целлюлозосвязывающей активностью и содержащий аминокислоты 496-526 SEQ ID NO:2 или аминокислоты 22-53 SEQ ID NO:4, слитые с каталитическим доменом.
18. Последовательность нуклеиновой кислоты, кодирующая аминокислоты 20-495 SEQ ID NO:2.
19. Последовательность нуклеиновой кислоты, кодирующая аминокислоты 54-384 SEQ ID NO:4.
РИСУНКИ
PC4A – Регистрация договора об уступке патента Российской Федерации на изобретение
(73) Патентообладатель(и):
ЭМАЛФАРБ, Марк, Аарон (US)
(73) Патентообладатель:
Дайадик Интернэшнл (ЮЭсЭй), Инк. (US)
Дата и номер государственной регистрации перехода исключительного права: 14.05.2009 № РД0050158
Извещение опубликовано: 20.06.2009 БИ: 17/2009
|
|