Патент на изобретение №2272645
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) СПОСОБ ЛЕЧЕНИЯ ЦМВ-ИНФЕКЦИИ У ДЕТЕЙ РАННЕГО ВОЗРАСТА
(57) Реферат:
Изобретение относится к медицине, к педиатрии и инфекционным болезням, и может быть использовано для лечения ЦМВ-инфекции у детей раннего возраста. Вводят подкожно ронколейкин в дозе 250000 ЕД по схеме: через два дня на третий, курсом четыре инъекции, при необходимости курс повторяют до исчезновения клинических симптомов. Данное изобретение способствует наиболее полной санации организма, за счет подавления репликации вируса в крови; уменьшению и в ряде случаев нивелированию проявлений экстрапирамидного синдрома, уменьшению гепатомегалии, нормализации функции иммунной системы. 8 табл.
(56) (продолжение): CLASS=”b560m”cytomegalovirus (CMV) infection in immunocompetent pediatric patients/ Int J Infect Dis. 2003 Dec; 7(4):278-81.
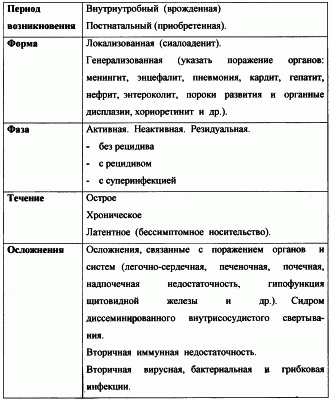
Изобретение относится к способам терапевтического лечения цитомегаловирусной (ЦМВ) инфекции у детей раннего возраста и может быть использовано в противовирусной и иммунозаместительной терапии с использованием противовирусных и иммуномодулирующих препаратов. ЦМВ-инфекция характеризуется чрезвычайным многообразием клинических проявлений и однотипной морфологической картиной, специфичность которой определяют своеобразные клетки с включениями, похожими на “совиный глаз” (цитомегалические клетки), лимфогистиоцитарные инфильтраты в органах. Общепринятой классификации ЦМВ-инфекции на сегодняшний день не существует. Имеется несколько ее вариантов. Наиболее приемлемой для практического врача является классификация, предложенная А.П.Казанцевым и Н.И.Поповой (1980):
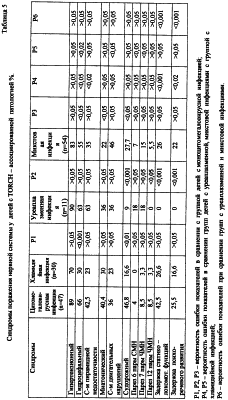
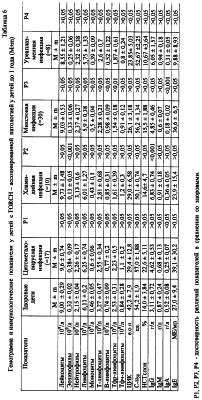
Коллективом авторов Ижевской государственной медицинской академии предложена новая классификация [Ожегов А.М. и др., 2000], которая предусматривает: Локализованная форма в виде сиалоаденита в абсолютном большинстве случаев встречается при постнатальной инфекции. По данным П.А.Самохина (1997), у 4% детей с врожденной цитомегалией наблюдаются локализованные формы инфекции. Острая врожденная ЦМВ-инфекция. Врожденная ЦМВ-инфекция проявляется в течение 2-3 недель жизни ребенка, при появлении симптомов болезни после 3-й недели жизни можно думать о постнатальном инфицировании. У части детей инфекция сопровождается симптомами эмбриофетопатии и врожденных пороков развития (пороки сердца, подковообразная почка, атрезия внутри – и внепеченочных желчных путей, пахово-мошоночная и пупочная грыжа, деформация ушных раковин, высокое небо и др.), что свидетельствует о врожденной ЦМВ-инфекции. При моноцитомегаловирусной (МЦМВ)-инфекции, дети рождаются недоношенными (10%) и в состоянии гипоксии с оценкой по шкале Апгар менее 7 баллов (25,8%). В структуре полиорганной патологии у детей ведущее место занимает поражение нервной системы (100%), которое характеризуется формированием гипертензионного (89%), гидроцефального (66%), миатонического (40,4%) синдромов, синдрома двигательных нарушений (36%), судорожного синдрома (46,8%). У детей с врожденной ЦМВ-инфекцией наблюдаются нервно-психические нарушения в виде задержки речевого развития (68%), негативизма (45%), гипермоторного поведения (41%), гипомоторного поведения (36%), задержки психического развития (32%), эмоциональной лабильности (55%), нарушения сна (59%), синдрома дефицита внимания (27%), аутизма (14%), истероидных реакций (18%), вредных привычек (14%). Нейросонографическое исследование выявляет усиление пульсации головного мозга (58%), расширение межполушарной щели (54%), гиперэхогенные зоны в таламусе (40%), субэпиндемальные кисты (29%), перивентрикулярную лейкомаляцию (25%), дилятацию III желудочка (25%), дилятацию передних рогов боковых желудочков (32%), расширение сосудистого сплетения (13%), лейкомаляцию в корковом веществе (8%). Сочетанная патология нервной системы и печени выявляется у 76,6% детей. Гипербилирубининемия в периоде новорожденности развивается у 29,7% детей, при этом желтуха может иметь стойкий характер. Гепатомегалия наблюдается у 59,5% пациентов, диффузные изменения печени по данным ультразвукового исследования органов брюшной полости отмечаются у 55%. При биохимическом исследовании крови выявляется повышение уровня аланиновой и аспарагиновой аминотрансфераз у 27,6% детей. Острая инфекция может протекать под маской гемолитической болезни новорожденного. Дебют мочевого синдрома при ЦМВ-инфекции в возрасте до 1 месяца отмечается у 17% детей, до трех месяцев жизни – у 45%, до 6 месяцев – у 16%, до 12 месяцев – у 11%, т.е. на первом году у 89% детей прослеживается ранняя манифестация мочевого синдрома. Мочевой синдром преимущественно проявляется лейкоцитурией (87,5%) и оксалурией (37%). У 100% девочек мочевой синдром сопровождается клинической картиной вульвита, вульвовагинита, наличием синехий малых половых губ различной степени. Клиника острой формы ЦМВ-инфекции характеризуется тяжестью поражения с выраженными симптомами токсикоза, увеличением печени и селезенки, геморрагическим синдромом, поражением нервной системы, изменениями в формуле крови с развитием тромбоцитопении. Дети рождаются с малой массой тела, угнетенными рефлексами, расстройством актов сосания и глотания, часто регистрируются поражения ЧМН, судороги, нижний парапарез. Анемия развивается у 44,6% детей с ЦМВ-инфекцией. При врожденной репликативной форме ЦМВ-инфекции отмечается истощение запасного депо Fe, о чем свидетельствует снижение уровня сывороточного ферритина крови. При врожденной ЦМВ-инфекции уменьшается транспортный фонд Fe по показателю сывороточного железа. Все дети с врожденной ЦМВ-инфекцией имеют признаки дисплазии соединительной ткани – переразгибание суставов, плоскостопие, голубые склеры, сандалевидная щель, вирусная девиация мизинца, высокое небо, расширенное переносье, диспластичный рост зубов. Одним из наиболее частых проявлений врожденной ЦМВ-нфекции является пневмония, которая имеет интерстициальный характер и сопровождается вовлечением мелких бронхов и бронхиол с развитием перибронхита. Цитомегаловирус обладает тропизмом к пневмоцитам второго типа, вызывая нарушение продукции сурфактанта, метаплазию эпителия, синдром дыхательных расстройств и в последующем хронизацию процесса. Симптомы ЦМВ-пневмонии могут выявляться с первых дней или недель жизни в виде кашля, субфебрильной температуры, скудных физикальных данных, одышки. У детей возникают частые респираторные заболевания (29,7%) и бронхообструктивный синдром (20,6%). Органы желудочно-кишечного тракта являются наиболее уязвимыми барьерами на пути проникновения цитомегаловируса в организм ребенка. При этом чаще всего поражается тонкая кишка, затем толстая, пищевод, двенадцатиперстная кишка и желудок. Патоморфологически могут иметь место катарально-инфильтративный, продуктивно-атрофический, язвенно-некротический и продуктивно-язвенный процессы. Поражение желудочно-кишечного тракта проявляется упорным энтероколитом, как правило, с безуспешным лечением традиционными методами, стойким дисбактериозом у 65,9% детей с высевом условно-патогенной флоры. Имеют место тяжелые формы инфекции с развитием инфекционно-токсического шока и синдрома внутрисосудистого диссеминированного свертывания. Механизм действия противовирусных химиопрепаратов заключается в избирательном подавлении отдельных этапов репродукции вирусов без существенного нарушения жизнедеятельности клеток макроорганизмов. Аномальные нуклеозиды, к которым относятся ацикловир, ганцикловир, валтрекс и фамвир после проникновения в клетки, зараженные вирусом герпеса и активно синтезирующие вирус-специфические ферменты, фосфолизируются под действием вирусных тимидинкиназ до их монофосфатов. В неинфицированных клетках фосфорилирования аномальных аналогов нуклеозидов практически не происходит. Затем клеточные ферменты фосфорилируют монофосафты препаратов до дифосфатов и фармакологически активных трифосфатных производных. Фармакологическая активность трифосфатных производных препаратов обусловлена двумя механизмами: терминацией цепи ДНК и ингибированием вирусной ДНК – полимеразы. ЦМВ не обладает тимидинкиназой, но имеет ген UL97, продукт которого (фосфотрансфераза) ответственен за фосфорилирование ганцикловира до его монофосфата. В настоящее время накоплен опыт лечения ЦМВ-инфекции препаратами иммуноглобулинового ряда (цилотект, пентаглобин), интерферонами (виферон) и индукторами интерферона (неовир, циклоферон), противовирусными препаратами (валтрекс, ацикловир), гипериммунными препаратами (цитотект). В комплекс патогенетической терапии ЦМВ-инфекции включают противовирусный препарат Фамвир в дозе 125 мг/сут, 7 дней. Клинический осмотр после указанной терапии показывает стойкое исчезновение эпипароксизмов, анизокорин, восстановление статиколокомоторных функций. (Машковский М.Д. Лекарственные средства. 4.2. М.,2001 с.239-240, 260, 333). Прототип. Известна вириоционная цитомегаловирусная вакцина (пат. РФ №2181295, А 61 К 39/12, 39/245), содержащая инактивированную суспензию цитомегаловируса, полиоксидоний, гиалуроновую кислоту и суппозиторную основу (кондитерский жир, парацин, эмульгатор). Известно использование аминопуриновых противовирусных соединений для лечения и профилактики латентных инфекций, вызванных вирусом герпеса (пат. РФ №2181049, А 61 К 31/521). Известно использование противовирусных и иммуномодулированных препаратов для лечения рецидивирующих генитальных герпесов (пат. РФ №2179849, А 61 К 31/19, 35/74). Больным назначают валтрекс по 0,5 г 2 раза в сутки или неовир по 250 мг внутримышечно, 10 инъекций, 10 инъекций в два этапа. Известен противовирусный фармацевтический состав (пат. РФ №2179851, А 61 К 31/522), содержащий в качестве активного вещества ацикловир, в качестве вспомогательных веществ спирт, воду и консервант, а также производные целлюлозы и моно или дисахарид или их смеси. Известные противовирусные и иммуномоделирующие средства имеют существенные недостатки, а именно: для некоторых средств характерен довольно узкий спектр противовирусной активности (иногда в пределах одного штамма вирусов); формирование резистентных штаммов, что сводит на нет эффективность терапии; интерфероны (ИФН), индукторы ИФН, иммуномодуляторы в силу ряда причин (токсичность, недостаточная эффективность, побочные эфекты) не могут быть использованы для лечения детей раннего возраста. Технической задачей изобретения является повышение эффективности терапевтического лечения ЦМВ-инфекций у детей раннего возраста и устранение побочных эффектов при использовании противовирусных и иммуномоделирующих средств. Для решения поставленной задачи предлагается способ лечения ЦМВ-инфекций у детей раннего возраста, включающий клинический осмотр пациентов, клинико-лабораторные обследования пациентов, определение параметров, связанных функциональным действием, а именно параметров иммунодиагностики, иммунного профиля, эндокринного профиля, иммуногенетического профиля, невропатологического профиля, мониторирование за эффектом терапии, использование противовирусных и иммуномоделирующих средств, отличающихся тем, что в качестве противовирусного и иммуномоделирующего средства используют ронколейкин, который вводят подкожно в дозе 25000 ЕД по схеме через два дня на третий курсом четыре инъекции, при необходимости курс повторяют до исчезновения клинических симптомов. В табл.1 показана оценка иммунологических показателей у детей при назначении фамвира. В табл.2 показана оценка иммунологических показателей и уровня цитокинов при назначении ронколейкина. В табл.3 показана оценка синдромов поражения нервной системы у детей, рожденных от матерей с хламидийной и уреаплазменой инфекциями. В табл.4 показана оценка синдромов поражения нервной системы у детей с максимальной и минимальной индикацией ЦМВ в моче. В табл.5 показана оценка синдромов поражения нервной системы у детей с TORCH-ассоциированной патологией. В табл.6 показана гемограмма и иммунологические показатели у детей с TORCH – ассоциированной патологией у детей до одного года. В табл.7 – то же, у детей старше одного года. В табл.8 – показатели иммунофенотипирования лимфоцитов у детей с TORCH-ассоциированной патологией. Ронколейкин – инъекционная лекарственная форма рекомбинантного интерлейкина-2 (ИЛ-2) человека. Отечественный препарат разработан фирмой BIOTEX (директор-академик биотехнической Академии России М.Н Смирнов). Активная субстанция Ронколейкина представлена рекомбинантным дрожжевым ИЛ-2, который является полипептидом и состоит из 133 аминокислот с молекулярным весом 15,4 кДа. Препарат получают методами современной белковой химии из клеток продуцента, которым является рекомбинантный штамм непатогенных пекарских дрожжей вида Saccharomyces cerevisia, в генетический аппарат которого встроен ген человеческого ИЛ-2. В качестве наполнителей использованы додецилсульфат натрия (солюбизатор) и В-маннит (стабилизатор) – (Летягина О.В., Егорова В.Н. “Ронколейкин” – л., 1998, 48с.). ИЛ-2 продуцируется субпопуляцией Т-лимфоцитов (Тхелперы I) в ответ на антигенную стимуляцию. Синтезированный ИЛ-2 воздействует на Т-лимфоциты, усиливая их пролиферацию и последующий синтез интерлейкина-2. ИЛ-2 направленно влияет на рост, дифференцировку и активизацию Т- и В-лимфоцитов, моноцитов, макрофагов, олигодендроглиальных клеток и эпидермальных клеток Ларгенганса. ИЛ-2 стимулирует цитологическую активность натуральных киллеров и цитотоксических Т-лимфоцитов, представляющих важную роль в противоцитомегаловирусной защите организма. Расширение спектра лизирующего действия эффекторных клеток обуславливает элиминацию патогенных микроорганизмов и инфицированных клеток. Биологические эффекты ИЛ-2 опосредуются его связыванием со специфическими рецепторами, представленными на различных клеточных мишенях. Ронколейкин обладает выраженной иммуностимулирующей активностью, направленной на усиление противовирусного, противобактериального и противоопухолевого иммунитета и находит широкое применение в иммунотерапии септических, инфекционных и онкологических заболеваний человека, связанных с иммунодефицитом. Ронколейкин апробирован в терапии ЦМВ-инфекции у 15 детей в возрасте от 1,2 мес до 1 года. Препарат вводился в дозе 250000 ЕД подкожно, по схеме через два дня на третий, курс составил 4 инъекции. Клинический осмотр пациентов и мониторирование за эффектом терапии выполнены перед лечением, при каждой постановке инъекции, после окончания курса терапии через 1 месяц. Дети осмотрены невропатологом с проведением нейросонографического исследования на УЗИ аппарате “Aloka SSD-1700”. Антитела классов IgM, IgG к цитомегаловирусу выявляли иммуноферментным методом (ИФА) с помощью тест-систем фирмы “Вектор-Бест” (г.Новосибирск) на аппарате “StatFax 300+”. Индикацию ДНК-цитомегаловируса методом цепной полимеразной реакции (ЦПР) в крови и моче до начала лечения и через 2-4 дня после окончания курса терапии выполняли наборами “АмплиСенс-ЦМВ” (г.Москва) на аппарате “Терцик МС2”. Исследование уровня цитокинов в сыворотке крови проводили до начала лечения и через 2-4 дня после курса ронколейкина наборами ООО “Прокон” (г.Санкт-Петербург) на аппарате “StatFax”, с определением IL2, IL6, IFNa, IFN Иммунологические исследования выполняли до начала лечения и через 2-4 дня после окончания терапии с оценкой поверхностных структур лимфоцитов методом иммунофенотипирования с применением моноклональных антител к фенотипическим маркерам лимфоцитов CD3, CD4, CD8, CD19, CD16/56 – антигенам на проточном цитометре Bekton Dickensen. Уровень иммуноглобулинов IgM, IgG, IgA изучали методом радиальной иммунодиффузии в агаровом геле, предложенный G.Manchihi et al. (1965), содержание циркулирующих иммунных комплексов методом преципитации в растворе полиэтиленгликоля (ПЭГ-6000) по V.Haskova в модификации Ю.А.Гриневич (1981). Результаты оценивали в единицах экстинции. Определение уровня комплектарной активности сыворотки крови проводили методом титрирования по 50% гемолизу эритроцитов барана (Л.С.Резникова, 1967). Результаты оценивали в условных единицах гемолитической активности. Изучение окислительно-восстановительных процессов нейтрофилов выполняли с помощью реакции восстановления нитросинего тетразолия (А.Н.Маянский, 1981). Для оценки поглотительной и переваривающей фукнции сегментоядерных нейтрофилов использовали метод изучения фагоцитоза по Берману В.М. – Славской Е.М. в модификации Олейниковой Е.А. (Олейникова Е.А., Эберт Л.Я., 1981) с оценкой активности фагоцитоза (АФ), фагоцитарного индекса (ФИ), фагоцитарного числа (ФЧ), завершенности (ЗФ) и эффективности (ЭФ) фагоцитоза. ЦМВ-инфекция у детей подтверждена определением ДНК-итомегаловируса в крови и/или моче методом ЦПР. Специфические иммуноглобулины М к цитомегаловирусу не выявлены. Специфические анти-ЦМВ IgG до начала терапии были положительными у 60% детей, из них у 55% после окончания лечения IgG стали отрицательными и снижение титра антител в 2-8 раз отмечено у 22% детей. Одновременно наблюдалась отрицательная динамика в виде нарастания титра IgG в 2 раза у 11% детей, отсутствие сдвигов в уровне антител зарегистрировано у 11%, обнаружение позитивного результата анти-ЦМВ IgG после терапии установлено у 13% пациентов при отрицательном результате до начала терапии. До начала терапии ронколейкином ДНК-ЦМВ в крови методом ЦПР определено у 47% обследованных, в моче – у 73%, в моче и крови одновременно – у 20% детей. После курса терапии ронколейкином наблюдалось подавление репликации вируса и ДНК-ЦМВ в крови методом ЦПР у всех детей (100%). После окончания терапии ронколейкином исчезновение ДНК-ЦМВ в моче методом ЦПР установлено у 27% детей, индикация ДНК-ЦМВ сохранялась без динамики – у 47% и появление позитивного результата после курса лечения прослежено у 7% пациентов. Клинически после курса иммунотерапии ронколейкином в неврологическом статусе отмечена положительная динамика в виде уменьшения проявлений синдрома пирамидной недостаточности у 67%, миатонического синдрома у 25%, синдрома нервно-рефлекторной возбудимости у 100%, синдрома двигательных нарушений у 70%, синдрома вегето-висцеральных дисфункций у 100%, диссомнии у 100%, улучшение эмоционального тонуса у 100% детей. Положительная динамика по экстрапирамидному синдрому выявлена у 83% детей, из них – нивелирование данного синдрома отмечено у 33% и уменьшение проявлений у 50% детей. Назначение препарата у ребенка с тяжелой генерализованной формой ЦМВ-инфекции привело к снижению частоты экипароксизмов и восстановлению частоты через 2 недели после окончания терапии, у одного ребенка выявлено стойкое урежение частоты приступов. Клинически уменьшение гепатомегалии выявлено у 87% детей, спленомегалии у 100%. Анемия 1 степени у 43% детей после окончания терапии сохранялась без динамики. Контрольную группу по уровню цитокинов составили 17 здоровых детей в возрасте до 1 года. Иммунофенотипирование лимфоцитов и их субпопуляций у детей с ЦМВ-инфекцией до назначения терапии показало снижение содержания CD19-CD4 – лимфоцитов. В гуморальном звене иммунитета наблюдалось снижение продукции иммуноглобулинов IgA, селективный дефицит IgA После курса терапии ронколейкином выявлено повышение содержания в крови лейкоцитов, нейтрофилов, лимфоцитов, NK-клеток по сравнению с группой здоровых детей. В гуморальном звене иммунитета сохранялось снижение продукции иммуноглобулинов IgA и селективный дефицит IgA Мониторирование уровня IFNa в сыворотке крови детей с ЦМВ-инфекцией, получавших ронколейкин, показало более высокое значение его содержания по сравнению с показателями в группе здоровых детей. Данную закономерность подтверждает увеличение показателей IFNa после применения ронколейкина у 42% детей по сравнению с исходными данными, регистрируемыми у 8% детей (р<0,05). При использовании непараметрических методов статистики (U-критерий Манна-Уитни) установлено повышение уровня IL-6 через 2-4 дня после окончания лечения ронколейкином (р<0,05). Оценка стартовых показателей цитокинов показала снижение содержания IL-6 у 50% пациентов с генерализованной формой ЦМВ-инфекции до начала иммунотерапии ронколейкином. После назначения ронколейкина курсом №4 подкожно, с интервалом в 2 дня у 100% детей отмечено восстановление уровня IL-6 до показателей контрольной группы (р<0,02). Изучение корреляционных взаимосвязей показателей иммунофенотипирования лимфоцитов с уровнем содержания цитокинов при врожденной ЦМВ-инфекции у детей до начала иммунотерапии ронколейкином выявило наличие корреляций между популяцией CD4-оимфоцитов, реализующих Thl-ответ, и IFN Характеризуя гуморальное звено иммунитета, отмечены кооперативные взаимосвязи между популяцией СД19-клеток и CD3-лимфоцитами (r=0,4967, р<0,05). Об участии IL-2 в антителообразовании косвенно свидетельствует наличие корреляции показателя IL-2 с продукцией IgG (r=0,5566, р<0,05) и IgM (р=0,8598, р<0,001). Прослежена отчетливая взаимосвязь между уровнем TNF в сыворотке крови больных детей и содержанием специфических IgG к ЦМВ-вирусу (r=0,6722, р<0,01). После курса иммунотерапии ронколейкином отмечена активация цитотоксических CD8-лимфоцитов у 27% больных, косвенно подтвержденная появлением взаимосвязей CD8 цитоксических лимфоцитов с IFN Известно, что основными продуцентами IFN Клинико-иммунологическую эффективность применения ронколейтина доказывает подавление репликации цитомегаловируса в крови у всех больных, получивших иммунотерапию. Таким образом, резюмируя результаты клинической апробации препарата ронколейтин в разовой дозе 250000 ЕД (курсовая доза 1 млн. ЕД) у детей раннего возраста с генерализованной формой ЦМВ-инфекции при подкожном назначении с интервалом в 2 дня №4 нами получен у большинства пациентов отличный (20%) и хороший (53%) клинический эффект. При этом следует отметить, что у 27% детей достигнут только удовлетворительный результат.
Формула изобретения
Способ лечения цитомегаловирусной инфекции у детей раннего возраста, включающий клинический осмотр пациентов, клинико-лабораторные обследования пациентов, определение информационно-значимых параметров, связанных функциональным действием, а именно: параметров иммунодиагностики, иммунного профиля, эндокринного профиля, иммуногенетического профиля, невропатологического профиля, мониторирование за эффектом терапии, использование противовирусных и иммуномоделирующих лекарственных средств, отличающийся тем, что в качестве противовирусного и иммуномоделирующего лекарственного средства используют ронколейкин, который вводят подкожно в дозе 250000 ЕД по схеме: через два дня на третий, курсом четыре инъекции, при необходимости курс повторяют до исчезновения клинических симптомов.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


 , TNF.
, TNF. 0,01 г/л отмечен в 27% детей.
0,01 г/л отмечен в 27% детей. и CD3-лимфоцитами (r=0,5670, р<0,05), IFN
и CD3-лимфоцитами (r=0,5670, р<0,05), IFN