|
|
(21), (22) Заявка: 2004111994/15, 20.04.2004
(24) Дата начала отсчета срока действия патента:
20.04.2004
(43) Дата публикации заявки: 10.10.2005
(45) Опубликовано: 27.03.2006
(56) Список документов, цитированных в отчете о
поиске:
Плясунова О.А., Егоричева И.Н., Федюк Н.В. и др. Изучение анти-ВИЧ Активности  -глицирризиновой кислоты. Вопросы Вирусологии. 1992, № 5-6, с.235-238. RU 2016572 С1, 30.07.1994. RU 2024547 С1, 15.12.1994. John M. et al. Randomized, controlled, 48-week study of switching stavudine and/or protease inhibitors to combivir/abacavir to prevent or -глицирризиновой кислоты. Вопросы Вирусологии. 1992, № 5-6, с.235-238. RU 2016572 С1, 30.07.1994. RU 2024547 С1, 15.12.1994. John M. et al. Randomized, controlled, 48-week study of switching stavudine and/or protease inhibitors to combivir/abacavir to prevent or
Адрес для переписки:
630559, Новосибирская обл., Новосибирский р-н, пгт. Кольцово, ГНЦ ВБ “Вектор”, патентный отдел, Ю.Н. Мистюрину
|
(72) Автор(ы):
Плясунова Ольга Александровна (RU),
Покровский Андрей Георгиевич (RU),
Балтина Лидия Ашрафовна (RU),
Толстиков Генрих Александрович (RU)
(73) Патентообладатель(и):
Государственный научный центр вирусологии и биотехнологии “Вектор” (ГНЦ ВБ “Вектор”) (RU)
|
(54) СИНЕРГИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ИНГИБИРОВАНИЯ ВИЧ
(57) Реферат:
Изобретение относится к химико-фармацевтической промышленности и касается синергетической композиции, содержащей азидотимидин и пента-О-никотинат глицирризиновой кислоты – ниглизин, в концентрациях, физиологически достижимых в крови: для азидотимидина – 0,0037-0,0254 мкМ, для ниглизина – 0,0052-9,64 мкМ. Применение данной композиции позволяет эффективно подавлять репродукцию ВИЧ-1, при этом существенно снижаются затраты на лечение. Композиция обладает высокой биодоступностью и высокой эффективностью. 6 табл., 1 ил. 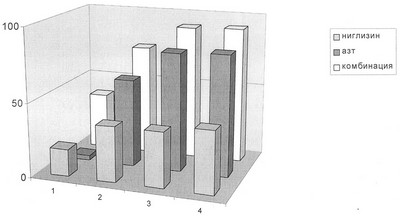
(56) (продолжение):
CLASS=”b560m”reverse lipoatrophy in HIV-infected patients. J. Acquir. Immune Defic. Syndr. 2003, 33 (1): 29-33.
Изобретение относится к вирусологии и медицине, а именно к разработке композиционных препаратов на основе азидотимидина и производных глицирризиновой кислоты, способных эффективно ингибировать репродукцию вируса иммунодефицита человека при низких физиологических концентрациях входящих в них отдельных компонентов.
В условиях распространения эпидемии СПИДа проблема лечения этого опасного заболевания остается одной из актуальных проблем современной медицины. На протяжении уже почти 15 лет в клинической практике для лечения ВИЧ-инфекции широко используется азидотимидин (АЗТ) – эффективный ингибитор вирусной обратной транскриптазы [1]. В последние годы в связи с быстро развивающейся в организме ВИЧ-инфицированных пациентов резистентностью вируса к азидотимидину [2], а также из-за высокой токсичности препарата (в том числе митохондриальной токсичности) [3, 4] его применение ограничено. А монотерапия АЗТ в настоящее время не рекомендована Всемирной организацией здравоохранения, поскольку приводит к появлению устойчивых к препарату мутантов вируса.
В настоящее время в большинстве случаев азидотимидин применяют в качестве составляющего в так называемых «коктейлях» в сочетании с 2-4 другими препаратами [5, 6], воздействующими на другие мишени цикла репродукции вируса. Как правило, это ингибиторы протеазы ВИЧ или ненуклеозидные ингибиторы обратной транскриптазы ВИЧ. Несмотря на эффективность некоторых таких «коктейлей», актуальным остается поиск новых сочетаний-комбинаций азидотимидина с препаратами другой природы и иного механизма действия, достаточно эффективных и дешевых в производстве, пригодных для лечения ВИЧ-инфекции.
Одним из таких доступных и дешевых препаратов является глицирризиновая кислота (ГК), механизм действия которой некоторые авторы связывают с ингибированием протеинкиназы, обеспечивающей фосфорилирование Т4 рецептора, необходимого для связывания вируса [7], другие – с непосредственным блокированием связывания вируса с клеткой [8]. Хотя механизм анти-ВИЧ действия ГК остается невыясненным до конца, ясно одно, что она ингибирует репродукцию вируса на ранних стадиях инфекции [9] в отличие от азидотимидина.
Исследование «лечебного» действия ГК на модели хронической ВИЧ-инфекции в моноцитах человека линии U937 при длительном культивировании в ее присутствии показало, что ГК эффективно ингибирует продукцию вируса на первых 4-х пассажах, а далее до 20-го пассажа лишь на 60% снижает вируспродукцию по сравнению с контролем [10]. Использование комбинации АЗТ и ГК (1:1000) оказалось более эффективным: к 20-му пассажу вирусспецифический белок р24 не выявлялся [10].
Исследование противовирусной активности целого ряда производных ГК продемонстрировало эффективность их анти-ВИЧ действия в культуре клеток [11-13]. Ранее было показано, что моноаммониевая соль глицирризиновой кислоты (глицирам) не является антагонистом по отношению к азидотимидину и в сочетании с ним эффективно блокирует репродукцию ВИЧ в культуре клеток как при острой, так и при хронической инфекции при соотношении АЗТ:глицирам=1:10000 [9, прототип]. Однако эффективные концентрации АЗТ и глицирама являются довольно высокими и неприемлемы на уровне организма.
Технической задачей изобретения является разработка высокоэффективных анти-ВИЧ композиций на основе азидотимидина и производных глицирризиновой кислоты, обладающих синергическим эффектом входящих в него компонентов при физиологически допустимых концентрациях последних в крови.
Поставленная задача решается путем подбора и исследования противовирусной активности различных комбинаций АЗТ и нового отечественного препарата пента-О-никотината глицирризиновой кислоты (ниглизина) – эффективного ингибитора ВИЧ [14]. При подборе комбинаций компонентов новой синергической композиции необходимо учитывать фармакокинетику азидотимидина и глицирризиновой кислоты, согласно которой концентрации АЗТ не должны превышать 0,05-0,1 мкг/мл, а ГК – 2-10 мкг/мл, что соответствует реальным концентрациям этих соединений в крови [15].
В результате этого исследования показано, что АЗТ и ниглизин в комбинациях 1:20, 1:50, 1:100, 1:200 и 1:2000 проявляют выраженный синергический эффект (табл.1). Важно отметить, что если для АЗТ 50%-ные ингибирующие дозы в этих комбинациях варьируют незначительно (от 0,0056 до 0,014 мкМ) и мало отличаются от таковой для индивидуального препарата, то в случае ниглизина они существенно снижаются по мере уменьшения его доли в комбинации (от 2,076 до 0,0519 мкМ).
Таблица 1
Количественные характеристики ингибирования ВИЧ-1EVK комбинациями АЗТ и ниглизина |
| Комбинация |
ID50, мкМ |
FIC |
| АЗТ |
Ниглизин |
| Штамм ВИЧ-1EVK |
| Индивидуальный препарат |
0,0254 |
9,64 |
– |
| АЗТ:ниглизин=1:20 |
0,0124 |
0,052 |
0,491 |
| АЗТ:ниглизин=1:50 |
0,0142 |
0,148 |
0,574 |
| АЗТ:ниглизин=1:200 |
0,01 |
0,386 |
0,614 |
| АЗТ:ниглизин=1:2000 |
0,0056 |
2,076 |
0,435 |
| АЗТ-резистентный мутант ВИЧ-1 |
| Индивидуальный препарат |
4,49 |
0,134 |
– |
| АЗТ:ниглизин=1:100 |
0,0037 |
0,074 |
0,553 |
| * – комбинационный индекс (the fractional inhibition concentration), определенный согласно [16]. |
Таким образом, используя комбинации АЗТ с ниглизином, можно существенно снизить эффективные концентрации индивидуальных препаратов от 0,0254 до 0,0142 мкМ, что соответствует 0,0038 мкг/мл, и ниже (до 0,0037 мкМ) для АЗТ и от 9,64 до 0,052 мкМ (0,07 мкг/мл) для ниглизина, что значительно ниже физиологически достижимых в крови и нетоксичных концентраций этих соединений.
В экспериментах исследовалась противовирусная активность ниглизина и его комбинаций с АЗТ в отношении АЗТ-резистентного мутанта ВИЧ-1, полученного в культуре клеток и характеризующегося снижением чувствительности к АЗТ в 160 раз и наличием точечных мутаций в гене pol Asp67 Asn; Lys70 Asn; Lys70 Arg; Leu214 Arg; Leu214 Phe, ответственных за резистентность [17]. Phe, ответственных за резистентность [17].
Ниглизин оказался более эффективным в отношении АЗТ-резистентного мутанта (ID50=0,134 мкМ), чем в отношении «дикого» штамма (ID50=9,64 мкМ). Определенный для комбинации АЗТ:ниглизин=1:100 комбинационный индекс FIC составил 0,553 (<1), что свидетельствует о синергическом противовирусном действии этой комбинации в отношении АЗТ-резистентного мутанта. Причем 50%-ные ингибирующие дозы препаратов в смеси были существенно ниже, чем для индивидуальных соединений: для АЗТ – 0,0037 мкМ, а для ниглизина – 0,052 мкМ.
Эффективность сочетанного анти-ВИЧ действия АЗТ и ниглизина как в отношении «дикого» штамма, так и АЗТ-резистентного мутанта свидетельствует о перспективности использования подобных композиций для лечения ВИЧ-инфекции.
Изобретение иллюстрируется следующей диаграммой.
Фиг.1. Эффективность ингибирования ВИЧEVK композицией АЗТ и ниглизина 1:50 в культуре клеток МТ-4.
| |
АЗТ (мкг/мл) |
Ниглизин (мкг/мл) |
Композиция 1:50 (мкг/мл) |
| 1 – |
0,001 |
0,05 |
0,001:0,05 |
| 2 – |
0,01 |
0,5 |
0,01:0,5 |
| 3 – |
0,1 |
5 |
0,1:5 |
| 4 – |
1 |
50 |
1:50 |
Для лучшего понимания сущности изобретения ниже следуют примеры его конкретного выполнения.
Пример 1. Оценка анти-ВИЧ активности композиции азидотимидина и ниглизина 1:50.
Анти-ВИЧ-1 активность композиции изучают на высокочувствительной к вирусу иммунодефицита человека культуре клеток МТ-4. Клетки МТ-4 заражают стоком вируса (штамм ВИЧ-lEVK [18]) с множественностью заражения 0,2-0,5 инфекционных единиц на клетку и инкубируют при 37°С в течение 1 часа (адсорбция вируса). Суспензию инфицированных клеток разводят ростовой питательной средой RPMI-1640, содержащей 10% сыворотки плода коровы фирмы “ICN” (США), 0,06% L-глутамина, 100 мкг/мл гентамицина и 60 мкг/мл линкомицина, до посевной концентрации 0,5×106 клеток/мл и вносят в лунки 96-луночного культурального планшета. Затем в лунки вносят аликвоты последовательных разведений азидотимидина в среде без добавок до конечных концентраций от 0,1 нг/мл до 1,0 мкг/мл (по три лунки на каждую концентрацию), аликвоты последовательных разведений ниглизина в ДМСО до конечных концентраций от 0,05 до 100 мкг/мл (по три лунки на каждую концентрацию) и смесь аликвот последовательных разведений азидотимидина и ниглизина, конечные концентрации азидомидина в которых от 1,0 нг/мл до 1,0 мкг/мл, а ниглизина – от 0,05 до 50 мкг/мл (по три лунки на каждый вариант). Экспериментальные (с препаратом) и контрольные (без препарата) инфицированные клетки и контрольные неинфицированные клетки (без препарата) культивируют при 37°С и 5% CO2 в течение 4 суток. По окончании инкубации подсчитывают долю жизнеспособных клеток в камере Горяева после окрашивания 0,4%-ным раствором трипанового синего и контролируют уровень накопления вирусспецифического белка р24 иммуноферментным методом, как описано в [19].
Экпериментальные данные приведены на Фиг.1. На основе полученных в эксперименте количественных данных строят дозозависимые кривые, из которых определяют ингибирующие дозы ((ID50) – концентрацию соединения, на 50% снижающую накопление вирусного антигена р24 по сравнению с контролем) для индивидуальных соединений и для каждого соединения в смеси. Полученные таким образом количественные характеристики используют далее для расчета комбинационного индекса (FIC), определяемого согласно [16] по формуле:
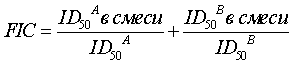
где А – азидотимидин, В – ниглизин.
Количественные данные ингибирования репродукции вируса композицией и индивидуальными соединениями представлены в табл.2. Комбинационный индекс равен 0,574 (<1), что свидетельствует о синергетическом анти-ВИЧ действии азидотимидина и ниглизина в соотношении 1:50.
Таблица 2
Количественные характеристики ингибирования вич-1EVK композицией АЗТ и ниглизина (1:50) |
| Препарат |
ID50, мкМ |
FIC |
| Индивидуальная |
В смеси |
0,574 |
| АЗТ |
0,0254 |
0,0142 |
| Ниглизин |
9,64 |
0,148 |
Пример 2. Оценка анти-ВИЧ активности композиции азидотимидина и ниглизина 1:20.
Анти-ВИЧ-1 активность композиции изучают на высокочувствительной к вирусу иммунодефицита человека культуре клеток МТ-4. Клетки МТ-4 заражают, разводят ростовой питательной средой до посевной концентрации и вносят в лунки культурального планшета, как описано в примере 1. Затем в лунки вносят аликвоты последовательных разведений азидотимидина в среде без добавок до конечных концентраций от 0,1 нг/мл до 1,0 мкг/мл (по три лунки на каждую концентрацию), аликвоты последовательных разведений ниглизина в ДМСО до конечных концентраций от 0,02 до 100 мкг/мл (по три лунки на каждую концентрацию) и смесь аликвот последовательных разведений азидотимидина и ниглизина, конечные концентрации азидомидина, в которых от 1,0 нг/мл до 1,0 мкг/мл, а ниглизина – от 0,02 до 20 мкг/мл (по три лунки на каждый вариант). Экспериментальные (с препаратом) и контрольные (без препарата) инфицированные клетки и контрольные неинфицированные клетки (без препарата) культивируют при 37°С и 5% СО2 в течение 4 суток. По окончании инкубации подсчитывают долю жизнеспособных клеток в камере Горяева после окрашивания 0,4%-ным раствором трипанового синего и контролируют уровень накопления вирусспецифического белка р24 иммуноферментным методом, как описано в [19]. На основе полученных в эксперименте количественных данных строят дозозависимые кривые, из которых определяют ингибирующие дозы (ID50) и рассчитывают комбинационный индекс (FIC), как описано выше в примере 1. Количественные данные ингибирования репродукции вируса композицией и индивидуальными соединениями представлены в табл.3. Комбинационный индекс равен 0,56 (<1), что свидетельствует о синергетическом анти-ВИЧ действии азидотимидина и ниглизина в соотношении 1:20.
Таблица 3
Количественные характеристики ингибирования ВИЧ-1EVK композицией АЗТ и ниглизина (1:20) |
| Препарат |
ID50, мкМ |
FIC |
| индивидуальная |
в смеси |
0,491 |
| АЗТ |
0,0254 |
0,01235 |
| Ниглизин |
9,64 |
0,0519 |
Пример 3. Оценка анти-ВИЧ активности композиции азидотимидина и ниглизина 1:100 в отношении АЗТ-резистентного мутанта ВИЧ-1.
Анти-ВИЧ-1 активность композиции изучают на высокочувствительной к вирусу иммунодефицита человека культуре клеток МТ-4. Клетки МТ-4 заражают АЗТ-резистентным мутантом ВИЧ-1 с множественностью заражения 0,2-0,5 инфекционных единиц на клетку и инкубируют при 37°С в течение 1 часа (адсорбция вируса). Суспензию инфицированных клеток разводят ростовой питательной средой до посевной концентрации и вносят в лунки культурального планшета, как описано в примере 1. Затем в лунки вносят аликвоты последовательных разведений азидотимидина в среде без добавок до конечных концентраций от 0,1 нг/мл до 0,1 мкг/мл (по три лунки на каждую концентрацию), аликвоты последовательных разведений ниглизина в ДМСО до конечных концентраций от 0,1 до 100 мкг/мл (по три лунки на каждую концентрацию) и смесь аликвот последовательных разведений азидотимидина и ниглизина, конечные концентрации азидомидина в которых от 0,1 нг/мл до 0,1 мкг/мл, а ниглизина – от 1 до 100 мкг/мл (по три лунки на каждый вариант). Экспериментальные (с препаратом) и контрольные (без препарата) инфицированные клетки и контрольные неинфицированные клетки (без препарата) культивируют при 37°С и 5% СО2 в течение 4 суток. По окончании инкубации подсчитывают долю жизнеспособных клеток в камере Горяева после окрашивания 0,4%-ным раствором трипанового синего и контролируют уровень накопления вирусспецифического белка р24 иммуноферментным методом, как описано в [19]. На основе полученных в эксперименте количественных данных строят дозозависимые кривые, из которых определяют ингибирующие дозы (ID50) и рассчитывают комбинационный индекс (FIC), как описано выше в примере 1. Количественные данные ингибирования репродукции АЗТ-резистентного мутанта ВИЧ-1 композицией и индивидуальными соединениями представлены в табл.4. Комбинационный индекс равен 0,553 (<1), что свидетельствует о синергическом анти-ВИЧ действии азидотимидина и ниглизина в таком соотношении 1:100.
Таблица 4
Количественные характеристики ингибирования АЗТ-резистентного мутанта ВИЧ-1 комбинацией АЗТ и ниглизина (1:100) |
| Препарат |
ID50, мкМ |
FIC |
| индивидуальная |
в смеси |
0,553 |
| АЗТ |
4,49 |
0,0037 |
| Ниглизин |
0,134 |
0,074 |
Количественные характеристики ингибирования ВИЧ-1EVK и АЗТ-резистентного мутанта ВИЧ-1 композициями АЗТ и ниглизина приведены в итоговой Таблице 1.
Пример 4. Оценка анти-ВИЧ активности композиции азидотимидина и ниглизина 1:200.
Анти-ВИЧ-1 активность композиции изучают на высокочувствительной к вирусу иммунодефицита человека культуре клеток МТ-4. Клетки МТ-4 заражают, разводят ростовой питательной средой до посевной концентрации и вносят в лунки культурального планшета, как описано в примере 1. Затем в лунки вносят аликвоты последовательных разведений азидотимидина в среде без добавок до конечных концентраций от 0,5 нг/мл до 0,5 мкг/мл (по три лунки на каждую концентрацию), аликвоты последовательных разведений ниглизина в ДМСО до конечных концентраций от 0,1 до 200 мкг/мл (по три лунки на каждую концентрацию) и смесь аликвот последовательных разведений азидотимидина и ниглизина, конечные концентрации азидомидина в которых от 0,5 нг/мл до 0,5 мкг/мл, а ниглизина – от 0,1 до 100 мкг/мл (по три лунки на каждый вариант). Экспериментальные (с препаратом) и контрольные (без препарата) инфицированные клетки и контрольные неинфицированные клетки (без препарата) культивируют при 37° и 5% СО2 в течение 4 суток. По окончании инкубации подсчитывают долю жизнеспособных клеток в камере Горяева после окрашивания 0,4%-ным раствором трипанового синего и контролируют уровень накопления вирусспецифического белка р24 иммуноферментным методом, как описано в [19]. На основе полученных в эксперименте количественных данных строят дозозависимые кривые, из которых определяют ингибирующие дозы (ID50) и рассчитывают комбинационный индекс (FIC), как описано выше в примере 1. Количественные данные ингибирования репродукции вируса композицией и индивидуальными соединениями представлены в табл.5. Комбинационный индекс равен 0,614 (<1), что свидетельствует о синергетическом анти-ВИЧ действии азидотимидина и ниглизина в соотношении 1:200.
Таблица 5
Количественные характеристики ингибирования ВИЧ-1EVK композицией АЗТ и ниглизина (1:200) |
| Препарат |
ID50, мкм |
FIC |
| индивидуальная |
в смеси |
0,614 |
| АЗТ |
0,0254 |
0,01 |
| Ниглизин |
9,64 |
0,386 |
Пример 5. Оценка анти-ВИЧ активности композиции азидотимидина и ниглизина 1:2000.
Анти-ВИЧ-1 активность композиции изучают на высокочувствительной к вирусу иммунодефицита человека культуре клеток МТ-4. Клетки МТ-4 заражают, разводят ростовой питательной средой до посевной концентрации и вносят в лунки культурального планшета, как описано в примере 1. Затем вносят в лунки аликвоты последовательных разведений азидотимидина в среде без добавок до конечных концентраций от 0,5 нг/мл до 0,5 мкг/мл (по три лунки на каждую концентрацию), аликвоты последовательных разведений ниглизина в ДМСО до конечных концентраций от 0,1 до 200 мкг/мл (по три лунки на каждую концентрацию) и смесь аликвот последовательных разведений азидотимидина и ниглизина, конечные концентрации азидомидина в которых от 0,5 нг/мл до 0,1 мкг/мл, а ниглизина – от 1 до 200 мкг/мл (по три лунки на каждый вариант). Экспериментальные (с препаратом) и контрольные (без препарата) инфицированные клетки и контрольные неинфицированные клетки (без препарата) культивируют при 37°С и 5% СО2 в течение 4 суток. По окончании инкубации подсчитывают долю жизнеспособных клеток в камере Горяева после окрашивания 0,4%-ным раствором трипанового синего и контролируют уровень накопления вирусспецифического белка р24 иммуноферментным методом, как описано в [19]. На основе полученных в эксперименте количественных данных строят дозозависимые кривые, из которых определяют ингибирующие дозы (ID50) и рассчитывают комбинационный индекс (FIC), как описано выше в примере 1.
Количественные данные ингибирования репродукции вируса композицией и индивидуальными соединениями представлены в табл.6. Комбинационный индекс равен 0,435 (<1), что свидетельствует о синергетическом анти-ВИЧ действии азидотимидина и ниглизина в таком соотношении 1:2000.
Таблица 6
Количественные характеристики ингибирования ВИЧ-1EVK комбинацией АЗТ и ниглизина (1:2000) |
| Препарат |
ID50, мкм |
FIC |
| индивидуальная |
в смеси |
0,435 |
| АЗТ |
0,0254 |
0,0056 |
| Ниглизин |
9,64 |
2,076 |
Таким образом впервые показано, что предлагаемые композиции ниглизина с АЗТ способны эффективно подавлять репродукцию как «дикого» штамма, так и АЗТ-устойчивого мутанта ВИЧ-1 в культуре чувствительных к вирусу клеток, проявляя при этом синергический эффект. Учитывая, что ниглизин является эффективным индуктором интерферона-гамма [20], можно надеяться существенно усилить его терапевтический потенциал при лечении ВИЧ-инфекции. Это позволяет рекомендовать такого рода композиции («коктейли») для разработки новых эффективных отечественных средств лечения ВИЧ-инфекции, которые могут существенно (примерно в 50 раз) снизить затраты общества и самих больных на лечение.
Список литературы
1. Машковский М.Д. Лекарственные средства: в 2-х т. Т.2. Изд. 14-е, Москва: ООО «Новая волна». – 2000.
12. Патент РФ №2199547, кл. С 07 J 63/00, опубликован БИ №6 за 2003 г.
13. Патент РФ №2198177, кл. С 07 J 63/00, опубликован БИ №4 за 2003 г.
14. Авторское свидетельство СССР №1804848, кл. А 61 К 31/705, опубликовано БИ №12, за 1993 г.
20. Заявка на патент РФ №2003134868 (037495), приоритет от 01.12.2003 г. “Индуктор гамма-интерферона”.
Формула изобретения
Синергическая композиция для ингибирования ВИЧ, характеризующаяся тем, что она содержит азидотимидин и пента-О-никотинат глицирризиновой кислоты – ниглизин, в концентрациях, физиологически достижимых в крови: для азидотимидина 0,0037-0,0254 мкМ, для ниглизина 0,0052-9,64 мкМ.
РИСУНКИ
TK4A Поправки к публикациям сведений об изобретениях в бюллетенях “Изобретения (заявки и патенты)” и “Изобретения. Полезные модели”
Напечатано: (73) Государственный научный центр вирусологии и биотехнологии «Вектор» (RU)
Следует читать: (73) Федеральное государственное учреждение науки «Государственный научный центр вирусологии и биотехнологии «Вектор» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (RU)
Номер и год публикации бюллетеня: 9-2006
Код раздела: FG4A
Извещение опубликовано: 20.11.2009 БИ: 32/2009
|
|