|
|
(21), (22) Заявка: 2003106431/04, 01.08.2001
(24) Дата начала отсчета срока действия патента:
01.08.2001
(30) Конвенционный приоритет:
16.08.2000 (пп.1-16) US 60/225,590
(43) Дата публикации заявки: 10.08.2004
(45) Опубликовано: 20.03.2006
(56) Список документов, цитированных в отчете о
поиске:
WO 99/46202 A2, 26.08.1999.
WO 99/27890 A1, 10.06.1999.
RU 2242229 C2, 20.12.2004.
(85) Дата перевода заявки PCT на национальную фазу:
17.03.2003
(86) Заявка PCT:
US 01/24540 (01.08.2001)
(87) Публикация PCT:
WO 02/14323 (21.02.2002)
Адрес для переписки:
119034, Москва, Пречистенский пер., 14, стр.1, 4-й эт., В.Н.Дементьеву
|
(72) Автор(ы):
ДИМАРКО Джон Д. (US),
ГУГУТАС Джек З. (US),
ВИТЕЗ Имре М. (US),
ДАВИДОВИЧ Марта (US),
ГАЛЕЛЛА Майкл (US),
МЭЛЛОЙ Тимоти М. (US),
ГУО Зхенронг (US),
ФАВРО Дени (US)
(73) Патентообладатель(и):
БРИСТОЛ-МАЕРС СКВИББ КОМПАНИ (US)
|
(54) ПОЛИМОРФНЫЕ МОДИФИКАЦИИ АНАЛОГА ЭПОТИЛОНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ
(57) Реферат:
Настоящее изобретение относится к кристаллическим полиморфным модификациям сильнодействующего аналога эпотилона Формы А и Формы В, представленного формулой I
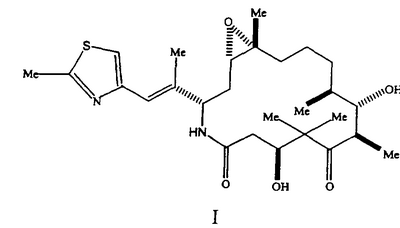
Предложено кристаллическое вещество, представляющее собой смесь Формы А и Формы В аналогов эпотилона. Предложены варианты способа получения кристаллической полиморфной модификации, представляющей собой Форму А. Также предложена фармацевтическая композиция, ингибирующая ангиогенез, содержащая активный ингредиент, представляющий собой кристаллическую полиморфную модификацию аналога эпотилона Формы А, Формы В или кристаллическую полиморфную модификацию аналога эпотилона формулы I, по существу свободной от аморфной составляющей, и фармацевтически приемлемый носитель. Также предложен способ лечения рака, включающий введение нуждающемуся в лечении млекопитающему эффективного количества кристаллической полиморфной модификации аналога эпотилона. Технический результат – кристаллические полиморфные модификации сильнодействующего аналога эпотилона формулы I, характеризующиеся улучшенными свойствами для применения в терапии разновидностей рака. 10 н. и 6 з.п.ф-лы, 9 ил., 7 табл. 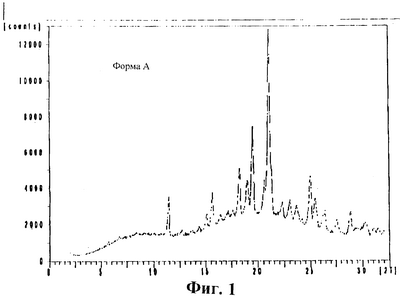
Область, к которой относится изобретение
Настоящее изобретение относится к кристаллическим полиморфным модификациям сильнодействующего аналога эпотилона, который характеризуется улучшенными свойствами.
Предпосылки создания изобретения
Эпотилоны представляют собой макролидные соединения, которые находят применение в области фармации. Например, найдено, что эпотиолоны А и В, имеющие структуру:
проявляют свойство стабилизировать микроканальцы, сходное с действием паклитакселя (TAXOL®), и, следовательно, обладают цитотоксической активностью против быстро разрастающихся клеток, таких как опухолевые клетки, или против другого гиперпролиферативного клеточного заболевания, см. Hofle., et at, 5, 13/14, 1567-1569 (1996); Международная заявка WO 93/10121, опубликованная 27 мая 1993 года; и Международная заявка WO 97/19086, опубликованная 29 мая 1997 года.
Синтезированы различные аналоги эпотилона, и, вероятно, их можно использовать для лечения многих разновидностей рака и других аномальных пролиферативных заболеваний. Такие аналоги описаны в Hofle., et al., Id.; Nicolaou, K.C., et al., Angew. Chem. Int. Ed. Engl., Vol.36, No 19, 2097-2103 (1997); и Su, D.-S., et al., Angew. Chem. Int. Ed. Engl., Vol.36, No 19, 2093-2097 (1997).
Особенно предпочтительным аналогом эпотилона, который, как обнаружено, обладает более высокой активностью, является [1S-[1R ,3R ,3R (E),7R (E),7R ,10S ,10S ,11R ,11R ,12R ,12R ,16S ,16S ]]-7,11-дигидрокси-8,8,10,12,16-пентаметил-3-[1-метил-2-(2-метил-4-тиазолил)этенил]-4-аза-17-оксабицикло[14.1.0]гептадекан-5,9-дион. Согласно настоящему изобретению, созданы две кристаллические формы данного аналога эпотилона. Эти полиморфные модификации, которые обозначены Форма А и В, соответственно, являются новыми кристаллическими формами и идентифицируются ниже, в данном описании. ]]-7,11-дигидрокси-8,8,10,12,16-пентаметил-3-[1-метил-2-(2-метил-4-тиазолил)этенил]-4-аза-17-оксабицикло[14.1.0]гептадекан-5,9-дион. Согласно настоящему изобретению, созданы две кристаллические формы данного аналога эпотилона. Эти полиморфные модификации, которые обозначены Форма А и В, соответственно, являются новыми кристаллическими формами и идентифицируются ниже, в данном описании.
Краткое описание чертежей
На Фигуре 1 представлена порошковая рентгенограмма (дебаеграмма) (CuK  =1,5406 =1,5406  при комнатной температуре) Формы А аналога эпотилона по изобретению. при комнатной температуре) Формы А аналога эпотилона по изобретению.
На Фигуре 2 изображена порошковая рентгенограмма (дебаеграмма)(CuK  =1,5406 =1,5406  при комнатной температуре) Формы В аналога эпотилона по изобретению. при комнатной температуре) Формы В аналога эпотилона по изобретению.
На Фигуре 3 изображена дебаеграмма Форм А и В (CuK  =1,5406 =1,5406 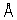 при комнатной температуре) аналога эпотилона по изобретению. при комнатной температуре) аналога эпотилона по изобретению.
На Фигуре 4 сравниваются моделированная и действительная порошковые рентгенограммы (дебаеграммы) Форм А и В аналога эпотилона по изобретению.
На Фигуре 5 дан спектр комбинационного рассеяния (Рамановский) Формы А аналога эпотилона по изобретению.
На Фигуре 6 дан спектр комбинационного рассеяния (Рамановский) Формы В аналога эпотилона по изобретению.
На Фигуре 7 дан спектр комбинационного рассеяния (Рамановский) смеси Форм А и В аналога эпотилона по изобретению.
На Фигуре 8 изображена конформация Формы А аналога эпотилона по изобретению.
На Фигуре 9 изображена конформация Формы В аналога эпотилона по изобретению.
Сущность изобретения
В соответствии с настоящим изобретением созданы две кристаллические полиморфные модификации аналога эпотилона, представленные формулой I.
Найдено, что одна из этих полиморфных модификаций, обозначенная как Форма А, имеет особенно предпочтительные свойства. Данное изобретение относится к кристаллическим полиморфам Форме А и Форме В, а также к их смесям. Помимо этого, данное изобретение относится к применению этих кристаллических форм в терапии разновидностей рака и других пролиферативных заболеваний, а также к содержащим их фармацевтическим композициям.
Подробное описание изобретения
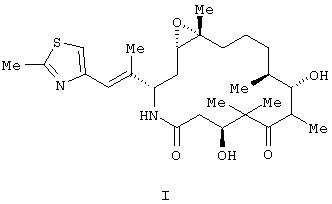
Согласно данному изобретению, предлагаются (созданы) полиморфы (полиморфные модификации) аналога эпотилона, представленной Формулой I.
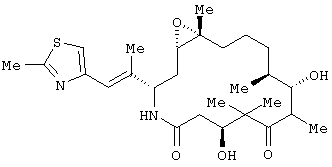
Аналог эпотилона, изображенный формулой I, химически представляет собой [1S-[1R ,3R ,3R (E),7R (E),7R ,10S ,10S ,11R ,11R ,12R ,12R ,16S ,16S ]]-7,11-дигидрокси-8,8,10,12,16-пентаметил-3-[1-метил-2-(2-метил-4-тиазолил)этенил]-4-аза-17-оксабицикло [14.1.0]гептадекан-5,9-дион. Полиморфные модификации аналога, представленного приведенной выше формулой I, являются агентами, стабилизирующими микроканальцы. Следовательно, они пригодны для лечения многих видов рака и других пролиферативных заболеваний, включая, но без ограничения, следующие: ]]-7,11-дигидрокси-8,8,10,12,16-пентаметил-3-[1-метил-2-(2-метил-4-тиазолил)этенил]-4-аза-17-оксабицикло [14.1.0]гептадекан-5,9-дион. Полиморфные модификации аналога, представленного приведенной выше формулой I, являются агентами, стабилизирующими микроканальцы. Следовательно, они пригодны для лечения многих видов рака и других пролиферативных заболеваний, включая, но без ограничения, следующие:
– рак, включая рак мочевого пузыря, молочной железы, толстой кишки, почек, печени, легких, яичников, поджелудочной железы, желудка, шеи, щитовидной железы и кожи, включая плоскоклеточный рак;
– опухоли кроветворной ткани лимфоидного происхождения, включая лейкоз, острый лимфолейкоз, острый лимфобластный лейкоз, В-клеточную лимфому, Т-клеточную лимфому, лимфому Ходжкина, не-ходжкинскую лимфому, лейкозный ретикулоэндотелиоз и лимфому Беркитта;
– опухоли кроветворной ткани миелоидного происхождения, включая острые и хронические миелоидные лейкозы и промиелоидный лейкоз;
– опухоли мезенхимного происхождения, включая фибросаркому и рабдомиосаркому;
– другие опухоли, включая меланому, семиному, эмбриональный рак, нейробластому и глиому;
– опухоли центральной и периферической нервной системы, включая астроцитому, нейробластому, глиому и невриномы;
– опухоли мезенхимного происхождения, включая фибросаркому, рабдомиосаркому и остеогенную саркому; и
– другие опухоли, включая меланому, ксеродерму пигментную, кератоакантому, семиному, фолликулярный рак щитовидной железы и эмбриональный рак (тератокарциному).
Полиморфы по изобретению также ингибируют ангиогенез, тем самым воздействуют на рост опухолей и обеспечивают терапию опухолей и нарушений, связанных с опухолями. Такие антиангиогенные свойства также можно применять для лечения других состояний, реагирующих на антиангиогенные агенты, включая, но без ограничения, некоторые формы слепоты, вызванной сетчаточной васкуляризацией, артрит, в особенности, воспалительный артрит, рассеянный склероз, повторный стеноз и псориаз.
Полиморфные модификации аналога, изображенного формулой I, индуцируют или ингибируют апоптоз, процесс физиологической клеточной гибели, решающий для нормального развития и гомеостаза. Изменения путей алоптоза вносят вклад в патогенез многих заболеваний человека. Полиморфы по изобретению, в качестве модуляторов апоптоза, применимы при лечении различных заболеваний человека с аберрациями апоптоз, включая, но без ограничения, рак и предраковые патологические изменения, заболевания, связанные с реакцией иммунной системы, вирусные инфекции, дегенеративные заболевания опорно-двигательного аппарата и болезнь почек.
Не связывая себя каким-либо механизмом или морфологией, можно сказать, что такие кристаллические формы эпотилона, изображенные формулой I, можно также применять для лечения иных состояний, нежели рак или другие пролиферативные заболевания. Такие состояния включают, но без ограничения, вирусные инфекции, такие как вирус герпеса, поксвирус, вирус Эпстайна-Барра, Синдбис вирус и аденовирус; аутоиммунные заболевания, такие как системная красная волчанка, опосредуемый иммунной системой гломерулонефрит, ревматоидный артрит, псориаз, воспалительные заболевания кишечника и аутоиммунный сахарный диабет; нейродегенеративные нарушения, такие как болезнь Альцгеймера, слабоумие, связанное со СПИД’м, болезнь Паркинсона, боковой амиотрофический склероз, пигментный ретинит, атрофия спинного мозга и мозжечковая дегенерация; СПИД; миелодиспластические синдромы; апластическая анемия; ишемические повреждения, обусловленные инфарктом миокарда; удар и повреждение, вызванное ишемической реперфузией; рестеноз; аритмия; атеросклероз; заболевания печени, вызванные отравлением токсином или алкогольным отравлением; гематологические заболевания, такие как хроническая анемия и гипопластическая анемия; дегенеративные заболевания опорно-двигательного аппарата, такие как остеопороз и артрит; чувствительный к аспирину риносинусит; муковисцидоз; рассеянный склероз; заболевания почек; и боли при раке.
Эффективное количество полиморфных модификаций по изобретению, в частности, Формы А, может быть определено рядовым специалистом в данной области и включает примерные дозировки для человека 0,05-200 мг/кг/день, которые можно вводить в виде однократной дозы или в виде отдельных небольших доз, например, 1-4 раза в день. Предпочтительно, когда полиморфы по изобретению вводят в дозировках менее 100 мг/кг/день в виде однократной дозы или в виде 2-4 разделенных доз. Следует отдавать себе отчет, что уровень конкретной дозы и частота приема доз любым конкретным субъектом может варьироваться и зависит от ряда факторов, включая активность конкретного применяемого соединения, метаболическую стабильность и продолжительность действия этого соединения, вида, возраста, веса тела, общего состояния здоровья, пола и диеты субъекта, способа и времени применения, скорости выделения, комбинации лекарственных препаратов и тяжести конкретного состояния. Полиморфные модификации по изобретению, предпочтительно, вводят парентерально, однако, в данном описании охватываются другие способы применения, как понимают специалисты в области онкологии. Предпочтительные субъекты терапии включают животных, наиболее предпочтительно, млекопитающие, такие как человек, и домашние животные, такие как собаки, кошки и т.п., в случае вышеуказанных нарушений.
Препараты аналогов эпотилона, изображенных формулой I, описаны в международной заявке WO 99/27890, в которой указанный аналог эпотилона получают в виде масла, которое можно хроматографировать и очищать, получая аморфный порошок.
В соответствии с настоящим изобретением в том, что относится к аналогам, изображенным формулой I, эпотилон В реагирует с азидным донорным агентом и буферизующим агентом в присутствии палладиевого катализатора и восстановителя, образуя интермедиат, представленный формулой

Затем интермедиат претерпевает макролактонизацию, образуя аналог, представленный формулой I. В настоящее время найдено, что этот аналог, в кристаллическом виде, состоит из смеси Форм А и В, как подробно представлено в данном описании. Аморфную форму аналога эпотилона формулы I можно суспендировать (растворить) в подходящем растворителе, предпочтительно, в смешанном растворителе, таком как этилацетат/хлористый метилен/триэтиламин, очистить, например, гель-фильтрацией через слой силикагеля, и кристаллизовать при охлаждении до температуры, примерно, 5°С, образуется кристаллическое вещество, которое представляет собой смесь Формы А и Формы В. На стадии очистки с применением смеси растворителей, содержащей такой компонент как хлористый метилен, удаляются остатки растворителей, применяемых при синтезе, которые могут мешать процессу кристаллизации.
Как правило, смешение очищаемого вещества с ограниченным количеством этилацетата и нагревание образующейся суспензии, примерно, до 75°-80°С вызывает образование Формы А. Под ограниченным количеством понимают, около 8-16 мл, предпочтительно, около 8-12 мл, этилацетата на грамм очищенного материала. По мере нагревания раствора образуется тонкая суспензия, которая, как было найдено, содержит преимущественно Форму В. Примерно, при 75°С суспензия густеет, при этом, как было найдено, образуется Форма А. Суспензию выдерживают при 75-80°С, примерно, в течение часа, чтобы быть уверенными в полноте образования Формы А, в это время к суспензии добавляют циклогексан в отношении к этилацетату, примерно, 1:2-2:2, предпочтительно, около 1:2, и смесь оставляют охлаждаться до комнатной температуры, при этой температуре ее перемешивают в течение, примерно, 12-96 часов. Затем смесь охлаждают, примерно, до 5°С, примерно, через 2 часа при этой температуре выпадают кристаллы аналога эпотилона Формы А. Форму А получают с хорошим выходом и с высокой степенью чистоты.
Альтернативные методики получения Формы А включают добавление зародышевых кристаллов. В приведенном ниже описании используют зародышевые кристаллы Формы А, но можно также применять зародышевые кристаллы Формы В или их смеси. По одной такой методике очищаемое вещество растворяют в ограниченном количестве этилацетата, как описано выше, и нагревают, примерно, при 75°С, добавляют зародышевые кристаллы и смесь выдерживают, примерно, 30 минут. Затем по каплям добавляют указанное выше количество циклогексана, поддерживая температуру около 70°С. Смесь охлаждают до 20°С и перемешивают при этой температуре 18 часов, после чего охлаждают до 5°С и механически отделяют, например, фильтрованием, белые кристаллы Формы А.
По второй методике начальный раствор вещества в этилацетате нагревают до 75°С, по меньшей мере, один час, пока не образуется раствор. Раствор охлаждают, примерно, до 50°С в течение, примерно двух часов, добавляя зародышевые кристаллы Формы А, когда температура достигнет, примерно, 60°С. Кристаллы начинают выпадать, примерно, при 55°С. Температуру снова снижают, примерно, до 20°С в течение еще двух часов, причем из этих двух часов в течение одного часа по каплям прибавляют циклогексан, как описано выше. Образовавшуюся суспензию дополнительно охлаждают в течение двух часов до -10°С и выдерживают при этой температуре еще один час. Затем суспензию фильтруют, получают белые кристаллы Формы А.
Еще по одной методике вещество растворяют (суспендируют) в большем количестве, например, по меньшей мере, примерно, в 40 мл/г этилацетата и образующуюся суспензию нагревают, примерно, при 80°С до тех пор, пока не образуется раствор, а затем охлаждают, примерно, до 70°С в течение, примерно, одного часа. Зародышевые кристаллы Формы А добавляют, когда температура достигнет, примерно, 70°С. Затем в течение еще трех часов температуру понижают, примерно, до 30°С. Кристаллы начинают выпадать, примерно, при 65°С. Температуру понижают до -10°С еще в течение трех часов, из которых в течение тридцати минут по каплям прибавляют циклогексан в количестве, указанном выше. Температуру -10°С поддерживают еще в течение часа. Образующуюся суспензию фильтруют, получают кристаллы Формы А. Выход и чистота Формы А, полученной по этой методике, считаются очень хорошими.
Форму В данных аналогов эпотилона (по изобретению), изображенную Формулой I, получают, создавая суспензию сырого вещества в большем количестве этилацетата, т.е. около 40-50 мл на г, и нагревая при 70-80°С в течение часа, при этом образуется раствор, который затем выдерживают при этой температуре около тридцати минут. Раствор охлаждают, примерно, до 30°С в течение, примерно, двух часов, кристаллы начинают выпадать, примерно, при 38°С. Затем температуру понижают, примерно, до -10°С в течение одного часа, причем, в течение тридцати минут из этого часа по каплям прибавляют нужное количество циклогексана. Конечную суспензию выдерживают при -10°С еще в течение двух часов и фильтруют, получая белые кристаллы Формы В.
По методике, альтернативной вышеописанной, сырой продукт суспендируют в аналогичном количестве этилацетата и нагревают, примерно, до 78°С до растворения, затем выдерживают при этой температуре около тридцати минут. Раствор охлаждают, примерно, до 10°С в течение, примерно, двух часов и добавляют зародышевые кристаллы Формы А, когда температура достигнет, примерно, 10°С. Температуру снова понижают в течение двух часов до -10°С, причем в течение тридцати минут из этого времени по каплям прибавляют нужное количество циклогексана. Температуру -10°С выдерживают в течение двух часов. Конечную суспензию фильтруют, получают белые кристаллы Формы В.
Еще по одной альтернативной методике очищаемый материал смешивают с другим растворителем, предпочтительно, с толуолом, в количестве около 10-20 мл на г, и нагревают до 75-80°С в течение 30 мин, а затем охлаждают до 20°С и перемешивают при этой температуре в течение 18 часов. Белые кристаллы Формы В выделяют из суспензии механическим путем. Выход и чистота Формы В, полученной по этой методике, считаются очень хорошими.
На Фигурах 1-3 представлены дебаеграммы (порошковые рентгенограммы) Форм А и В аналога по изобретению и их смеси, соответственно. На Фиг.4 сравниваются дебаеграммы Форм А и В, моделированные, исходя из монокристаллических структур, с действительными дебаеграммами каждой из этих Форм. Рентгенограммы получают на приборе Philips Xpert с генераторным источником 44 кВ и 40 мА и  (Cu-К (Cu-К )=1,5406 )=1,5406  при комнатной температуре. Результаты, показанные ниже, на Фигурах 1-4, а также в Таблицах 1 и 2, в которых суммированы данные, позволяют четко установить, что Формы А и В аналога эпотилона по изобретению имеют различные кристаллические структуры. В Таблицах интенсивности пиков от 1 до 12 классифицируются как очень слабые, от 13 до 32 – как слабые, от 33 до 64 – как средние, от 65 до 87 – как интенсивные и от 88 до 100 – как очень интенсивные. при комнатной температуре. Результаты, показанные ниже, на Фигурах 1-4, а также в Таблицах 1 и 2, в которых суммированы данные, позволяют четко установить, что Формы А и В аналога эпотилона по изобретению имеют различные кристаллические структуры. В Таблицах интенсивности пиков от 1 до 12 классифицируются как очень слабые, от 13 до 32 – как слабые, от 33 до 64 – как средние, от 65 до 87 – как интенсивные и от 88 до 100 – как очень интенсивные.
Таблица 1
Значения для Формы А |
Положение пика (два тета) (Cu-К  =1,5406 =1,5406  при комнатной температуре при комнатной температуре |
Относительная интенсивность пика |
Положение пика (два тета) |
Относительная интенсивность пика |
| 5,69 |
Очень слабая |
21,06 |
Очень высокая |
| 6,76 |
Очень слабая |
21,29 |
Слабая |
| 8,38 |
Очень слабая |
22,31 |
Слабая |
| 11,43 |
Слабая |
23,02 |
Слабая |
| 12,74 |
Очень слабая |
23,66 |
Слабая |
| 13,62 |
Очень слабая |
24,18 |
Очень слабая |
| 14,35 |
Очень слабая |
24,98 |
Слабая |
| 15,09 |
Очень слабая |
25,50 |
Слабая |
| 15,66 |
Слабая |
26,23 |
Очень слабая |
| 16,43 |
Очень слабая |
26,46 |
Очень слабая |
| 17,16 |
Очень слабая |
27,59 |
Очень слабая |
| 17,66 |
Очень слабая |
28,89 |
Очень слабая |
| 18,31 |
Слабая |
29,58 |
Очень слабая |
| 19,03 |
Слабая |
30,32 |
Очень слабая |
| 19,54 |
Средняя |
31,08 |
Очень слабая |
| 20,57 |
Слабая |
31,52 |
Очень слабая |
Таблица 2
Значения для Формы В |
Положение пика (два тета) (Cu-К  =1,5406 =1,5406  при комнатной температуре при комнатной температуре |
Относительная интенсивность пика |
Положение пика (два тета) |
Относительная интенсивность пика |
| 6,17 |
Очень слабая |
21,73 |
Средняя |
| 10,71 |
Очень слабая |
22,48 |
Очень сильная |
| 12,33 |
Слабая |
23,34 |
Средняя |
| 14,17 |
Слабая |
23,93 |
Средняя |
| 14,93 |
Средняя |
24,78 |
Средняя |
| 15,88 |
Средняя |
25,15 |
Слабая |
| 16,17 |
Средняя |
25,90 |
Слабая |
| 17,11 |
Средняя |
26,63 |
Средняя |
| 17,98 |
Слабая |
27,59 |
Очень слабая |
| 19,01 |
Очень сильная |
28,66 |
Слабая |
| 19,61 |
Средняя |
29,55 |
Слабая |
| 20,38 |
Средняя |
30,49 |
Слабая |
| 21,55 |
Средняя |
31,22 |
Слабая |
На Фигурах 5-7 показаны спектры комбинационного рассеяния (Рамановские спектры) Форм А, В аналога по изобретению и их смеси, соответственно. Спектры также показывают наличие двух различных кристаллических форм, в частности, полосы при 3130 см-1 и 3115 см-1.
Различающиеся физические характеристики двух полиморфных форм показаны ниже, в Таблице 3. Калориметрические измерения в растворах осуществляют в этаноле при 25°С с помощью Thermometrics Microcalorimeter. Растворимость также определяют при 25°С. На основании ряда данных, в частности, теплоты растворения, очевидно, что Форма А более стабильна и, следовательно, Форма А является предпочтительной.
| Таблица 3 |
| Характеристика |
Форма А |
Форма В |
| Растворимость в воде |
0,1254 |
0,1907 |
| Растворимость в 3% полисорбате (водном) |
0,2511 |
0,5799 |
| Теплота растворения |
20,6 кДж/мол |
9,86 кДж/мол |
Форма А и Форма В аналогов эпотилона, изображаемых формулой I, см. выше, можно дополнительно характеризовать параметрами элементарной ячейки, полученными ренттеноструктурным анализом монокристалла, см. ниже. Подробный расчет элементарных ячеек можно найти в Главе 3 (Chapter 3) Stout and Jensen, X-ray structure Determination: A Practical Guide. MacMillian Co., New York, NY(1968).

Различия между Формами А и В аналога эпотилона по изобретению далее иллюстрируются на примере конформаций в твердом состоянии, как показано на Фиг.8 и Фиг.9, соответственно, полученных на основе координат атомов, представленных далее в Таблицах 4-7.
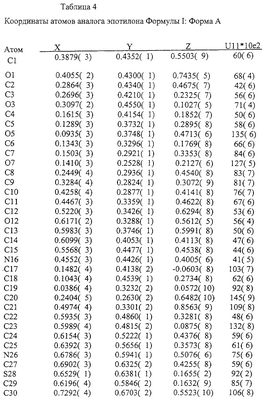
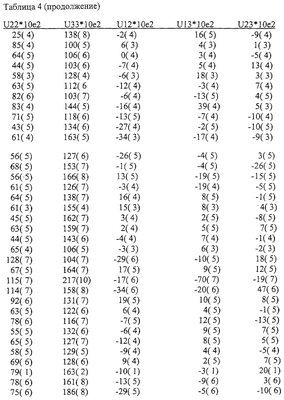 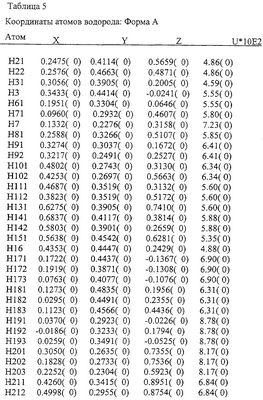 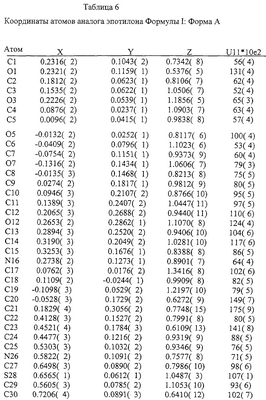 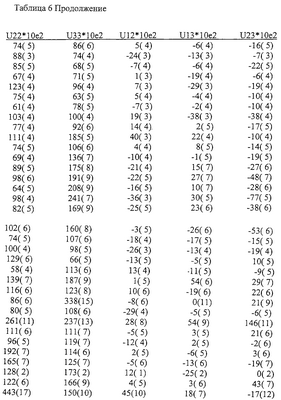 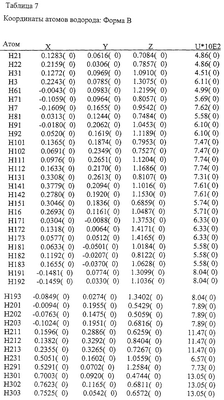
На основе приведенных выше данных делается заключение, что Формы А и В представляют собой уникальные (разные) кристаллические объекты.
Следующие не ограничивающие (объем изобретения) примеры служат для иллюстрации практического воплощения изобретения.
Пример 1
[1S-[1R ,3R ,3R (E),7R (E),7R ,10S ,10S ,11R ,11R ,12R ,12R ,16S ,16S ]]-7,11-Дигидрокси-8,8,10,12,16-пентаметил-3-[1-метил-2-(2-метил-4-тиазолил)этенил]-4-аза-17-оксабицикло [14.1.0]гептадекан-5,9-дион. ]]-7,11-Дигидрокси-8,8,10,12,16-пентаметил-3-[1-метил-2-(2-метил-4-тиазолил)этенил]-4-аза-17-оксабицикло [14.1.0]гептадекан-5,9-дион.
В круглодонную колбу на 125 мл с рубашкой, снабженную механической мешалкой, помещают эпотилон-В (5,08 г), тетрабутиламмонийазид (Bu4NN3) (3,55 г; 1,25 эквивалента), тетрагидрофуран (ТГФ) (15 мл) и N,N-диметилформамид (ДМФА) (15 мл). Через смесь в течение 15 минут барботируют азот. Во вторую колбу помещают тетрагидрофуран (70 мл), затем триметилфосфин (РМе3) (1,56 мл; 1,5 эквивалента), затем аддукт трис(дибензилиденацетон)-дипалладий(0)-хлороформ (Pd2(dba)3CHCl3) (0,259 г; 0,025 эквивалента). Каталитическую смесь перемешивают 20 минут при комнатной температуре, затем прибавляют к смеси с эпотилоном-В. Объединенную смесь перемешивают 4,5 часа при 30°С. Полностью прореагировавшую реакционную смесь фильтруют для удаления твердого хлористого аммония (NH4Cl). Фильтрат содержит тетрабутиламмониевую соль ( S, S, R, R, S, S, S,2R,3S)-3-[(2S,3Е)-2-амино-3-метил-4-(2-метил-4-тиазолил)-3-бутенил]- S,2R,3S)-3-[(2S,3Е)-2-амино-3-метил-4-(2-метил-4-тиазолил)-3-бутенил]- , , -дигидрокси- -дигидрокси- , , , , , , ,2-пентаметил- ,2-пентаметил- -оксооксиранундекановой кислоты (1:1) с площадью пика в ВЭЖХ 94,1%. -оксооксиранундекановой кислоты (1:1) с площадью пика в ВЭЖХ 94,1%.
В колбу на 500 мл помещают гидрохлорид 1-[3-(диметиламино)пропил]-3-этилкарбодиимида (EDCI) (3,82 г; 2 эквивалента), 1-гидрокси-7-бензотриазол гидрат (HOBt) (1,68 г; 1,1 эквивалента), карбонат калия (1,38 г; 1 эквивалент), N,N-диметилформамид (ДМФА) (40 мл) и тетрагидрофуран (ТГФ) (160 мл). Смесь нагревают до 35°С и по каплям, в течение трех часов прибавляют полученный выше фильтрат. Затем эту смесь перемешивают еще в течение 1 часа при 35°С. Отгонкой растворителей в вакууме доводят объем реакционной смеси, примерно, до 80 мл. Образовавшийся раствор распределяют (распределительная экстракция) между 100 мл этилацетата и 100 мл воды. Затем водный слой повторно экстрагируют 100 мл этилацетата. Объединенные органические вытяжки промывают 50 мл воды и 20 мл рассола. Образующийся раствор продукта фильтруют через слой Zeta Plus®, а затем упаривают, получая масло. Сырой продукт в виде масла растворяют в хлористом метилене (20 мл) и промывают водой для удаления следов растворителей для синтеза, упаривают и получают твердое вещество. Сырой твердый продукт хроматографируют на силикагеле 60 (35 мл силикагеля на грамм продукта при теоретическом выходе) элюентом, содержащим 88% хлористого метилена (СН2Cl2), 10%-30% этилацетата (EtOAc) и 2% триэтиламина (Et3N). Фракции анализируют методом ВЭЖХ, наиболее чистые объединяют и упаривают, получая очищенный продукт. Образующийся твердый продукт, примерно, 2 г, суспендируют в этилацетате (32 мл) в течение 40 минут при 75°С, затем медленно прибавляют циклогексан (С6Н12) (16 мл) и смесь медленно охлаждают до 5°С. Очищенный твердый продукт отфильтровывают через бумажный фильтр, промывают холодной смесью этилацетат/циклогексан и сушат. Получают 1,72 г (выход 38%) продукта, [1S-[1R ,3R ,3R (E),7R (E),7R ,10S ,10S ,11R ,11R ,12R ,12R ,16S ,16S ]]-7,11-дигидрокси-8,8,10,12,16-пентаметил-3-[1-метил-2-(2-метил-4-тиазолил)этенил]-4-аза-17-оксабицикло [14.1.0]гептадекан-5,9-диона, чистота 99,2% (ВЭЖХ), в виде твердого вещества белого цвета. ]]-7,11-дигидрокси-8,8,10,12,16-пентаметил-3-[1-метил-2-(2-метил-4-тиазолил)этенил]-4-аза-17-оксабицикло [14.1.0]гептадекан-5,9-диона, чистота 99,2% (ВЭЖХ), в виде твердого вещества белого цвета.
Пример 2
[1S-[1R ,3R ,3R (E),7R (E),7R ,10S ,10S ,11R ,11R ,12R ,12R ,16S ,16S ]]-7,11-Дигидрокси-8,8,10,12,16-пентаметил-3-[1-метил-2-(2-метил-4-тиазолил)этенил]-4-аза-17-оксабицикло [14.1.0]гептадекан-5,9-дион, Форма А. ]]-7,11-Дигидрокси-8,8,10,12,16-пентаметил-3-[1-метил-2-(2-метил-4-тиазолил)этенил]-4-аза-17-оксабицикло [14.1.0]гептадекан-5,9-дион, Форма А.
В трехгорлую колбу на 250 мл помещают 0,61 г заглавного соединения, которое было очищено (гель-фильтрация через слой силикагеля, элюент EtOAc/гексан/Et3N, чистота (ВЭЖХ) 96,88%), и этилацетат (28 мл, 46 мл/1 г). Образующуюся суспензию нагревают до 75°С. Твердое вещество полностью растворяется после 60-минутного нагревания при 75°С. Полученный раствор в течение 120 минут охлаждают от 75°С до 50°С, при 60°С вводят зародышевые кристаллы Формы А. Кристаллы появляются при 55°С. Затем температуру понижают до 20°С в течение 120 минут, при этом в течение 60 минут по каплям к смеси прибавляют циклогексан (35 мл, 57 мл/1 г). Полученную суспензию в течение 120 минут охлаждают до -10°С и выдерживают еще 60 минут. Суспензию фильтруют и полученные белые кристаллы сушат, получают 0,514 г заглавного соединения, Форма А, с выходом 84,3% и чистотой 99,4% (ВЭЖХ).
Форма А – Альтернативная методика
В трехгорлую колбу на 250 мл помещают 0,51 г заглавного соединения, которое было очищено (гель-фильтрация через слой силикагеля, элюент EtOAc/гексан/Et3N, чистота (ВЭЖХ) 96%), и этилацетат (8,5 мл; 16,7 мл/1 г). Образующуюся суспензию нагревают до 80°С. Полученный раствор в течение 60 минут охлаждают от 80°С до 70°С, при 70°С вводят зародышевые кристаллы Формы А. Затем в течение 180 минут понижают температуру до 30°С. Кристаллы появляются при 65°С. Затем температуру раствора еще понижают до -10°С в течение 180 минут, при этом в течение 30 минут по каплям к смеси прибавляют циклогексан (10,2 мл; 20 мл/1 г). Полученную суспензию выдерживают в охлажденном состоянии еще 60 минут. Суспензию фильтруют и полученные белые кристаллы сушат, получают 0,43 г заглавного соединения, Форма А, с выходом 84,3% и чистотой 99,7% (ВЭЖХ).
Форма А – альтернативная методика
В трехгорлую колбу на 500 мл помещают 18,3 г смеси Форм А и В, которая была очищена (гель-фильтрация через слой силикагеля, элюент EtOAc/хлористый метилен/Et3N, чистота (ВЭЖХ) 99%), и этилацетат (183 мл; 10 мл/1 г). Образующуюся суспензию нагревают до 75°С, вводят зародышевые кристаллы Формы А и выдерживают при этой температуре 30 минут. По каплям, поддерживая температуру 70°С, к смеси прибавляют циклогексан (90,2 мл; 5 мл/1 г). По окончании прибавления температуру понижают до 20°С и смесь выдерживают при перемешивании еще 18 часов, затем температуру понижают до 5°С и выдерживают при ней 5 часов. Суспензию фильтруют и полученные белые кристаллы сушат, получают 16,1 г заглавного соединения, Форма А, с выходом 88% и чистотой 99,49% (ВЭЖХ).
Пример 3
[1S-[1R ,3R ,3R (E),7R (E),7R ,10S ,10S ,11R ,11R ,12R ,12R ,16S ,16S ]]-7,11-Дигидрокси-8,8,10,12,16-пентаметил-3-[1-метил-2-(2-метил-4-тиазолил)этенил]-4-аза-17-оксабицикло [14.1.0]гептадекан-5,9-дион, Форма В. ]]-7,11-Дигидрокси-8,8,10,12,16-пентаметил-3-[1-метил-2-(2-метил-4-тиазолил)этенил]-4-аза-17-оксабицикло [14.1.0]гептадекан-5,9-дион, Форма В.
В трехгорлую колбу на 250 мл помещают 0,108 г заглавного соединения, не очищенного, как в Примере 2, N,N-диметилформамид (0,0216) и этилацетат (5 мл, 46 мл/1 г). Образующуюся суспензию нагревают до 80°С и перемешивают в течение 30 минут для растворения всех твердых веществ. Полученный раствор охлаждают с 80°С до 30°С в течение 120 минут, кристаллы появляются при 38°С. В течение 30 минут к смеси по каплям прибавляют циклогексан (7,5 мл; 69,5 мл/1 г), при этом в течение 60 минут температуру понижают до -10°С и выдерживают при ней 120 минут. Суспензию отфильтровывают и полученные кристаллы сушат, получают 0,082 г заглавного соединения. Форма В, с выходом 76% и чистотой 99,6% (ВЭЖХ).
Форма В – Альтернативная методика
В трехгорлую колбу на 250 мл помещают 0,458 г заглавного соединения, не очищенного, как в Примере 2, и содержащего 6% N,N-диметилформамида, и этилацетат (10 мл, 21,8 мл/1 г). Образующуюся суспензию нагревают до 78°С и перемешивают в течение 3 0 минут для растворения всех твердых веществ. Полученный раствор охлаждают с 78°С до 10°С в течение 120 минут. При 10°С вводят зародышевые кристаллы Формы А. В течение 60 минут к смеси по каплям прибавляют циклогексан (20 мл; 43,7 мл/1 г), при этом в течение 120 минут температуру понижают до -10°С и выдерживают при этой температуре еще 120 минут. Суспензию отфильтровывают и полученные кристаллы сушат, получают 0,315 г заглавного соединения. Форма В, с выходом 68,8% и чистотой 98,2% (ВЭЖХ).
Форма В – Альтернативная методика
В колбу Уитона (Wheaton) на 5 мл помещают 250 мг не очищенного, как в Примере 2, заглавного соединения, и толуол (3,75 мл; 15 мл/г), образующуюся смесь нагревают до 75°С и выдерживают в течение 30 минут. Полученную суспензию охлаждают до 20°С и выдерживают при этой температуре 18 час при перемешивании. Суспензию фильтруют и полученные белые кристаллы сушат, получают 150 мг заглавного соединения, Форма В, с 60%-ным выходом и чистотой 99,2% (ВЭЖХ).
Было установлено, что подходящей средой для приготовления раствора для лиофилизации предлагаемых соединений является смесь mpem-бутанола и воды для инъекций. Эта смесь должна содержать по меньшей мере 50 об.%, предпочтительно от примерно 50 до примерно 80 об.% трет-бутанола, чтобы предотвратить разложение предлагаемых аналогов эпотилона. Далее, из-за исключительно плохой смачиваемости предлагаемых аналогов эпотилона исходный раствор следует сделать более эффективным, используя смесь по меньшей мере примерно 60 об. %, предпочтительно от примерно 60% до примерно 95 об. % трет-бутанола и воды. После образования раствора можно добавить необходимое количество воды или смеси mpem-бутанол-вода для достижения конечной концентрации, необходимой для лиофилизации, какуказано выше.
Неожиданно было обнаружено, что стабильность предлагаемых аналогов эпотилона можно значительно повысить путем приготовления раствора при температуре ниже обычной, предпочтительно от примерно 5°С до примерно 15°С, более предпочтительно при примерно 5°С. Далее, как процесс приготовления раствора, так и последующую лиофилизацию следует проводить в таких сосудах, чтобы аналоги эпотилона были защищены от света. Также полезно проводить лиофилизацию сравнительно малыми порциями, чтобы аналоги эпотилона контактировали с водной средой минимально короткое время.
Первую стадию сушки при лиофилизации раствора, приготовленного как описано выше, проводят при температуре от примерно -10°С до примерно -40°С, предпочтительно примерно -25°С, в высоком вакууме, т.е. от примерно 50 миллиторр до примерно 300 миллиторр, предпочтительно примерно 200 миллиторр, в течение длительного времени, т.е. от примерно 24 час до примерно 96 час, предпочтительно примерно 48 час. Лиофилизация в этом температурном интервале приводит к аморфному продукту, который нужен для внутривенного вливания. Специалистам будет понятно, что для подтверждения аморфной структуры лиофилизированного продукта можно использовать обычные методы, такие как порошковую рентгеновскую дифракцию.
Остаточные растворители удаляют из продукта на второй стадии сушки, которую проводят при сравнительно низкой температуре, т.е. от примерно 10°С до примерно 30°С, предпочтительно примерно 25°С, в высоком вакууме, т.е. от примерно 50 миллиторр до примерно 300 миллиторр, предпочтительно примерно 150 60 миллиторр, в течение длительного времени, т.е. от примерно 24 час до примерно 96 час, предпочтительно примерно 48 час. миллиторр, в течение длительного времени, т.е. от примерно 24 час до примерно 96 час, предпочтительно примерно 48 час.
Неожиданно было обнаружено, что стабильность описанных здесь лиофилизированных аналогов эпотилона не повышается в присутствии эксципиентов, обычно используемых для таких назначений, как лактоза, манит, декстран и т.п. Некоторые из этих эксципиентов могут в действительности отрицательно влиять на стабильность лиофилизированного продукта (лиофила). Следовательно, аналоги эпотилона в соответствии с настоящим изобретением лиофилизируют в чистом виде, т.е. без какого-либо эксципиента.
Лиофилизированные аналоги эпотилона, представленные формулами I и II, переводят в раствор с помощью смеси равных частей по объему спирта и неионного поверхностно-активного вещества, предпочтительно поверхностно-активного вещества на основе полиоксиэтилированного касторового масла. Лиофилизированный продукт и растворитель расфасовывают отдельно в светозащитные ампулы. Чтобы минимизировать количество поверхностно-активного вещества в приготавливаемом растворе, используют только такое количество растворителя, которое необходимо для достижения концентрации от примерно 2 мг/мл до примерно 4 мг/мл аналога эпотилона. После растворения лекарства полученный раствор до инъекции разбавляют далее подходящим парентеральным разбавителем. Такие разбавители хорошо известны специалистам. Однако целесообразно упаковывать аналоги эпотилона вместе с третьей ампулой, содержащей достаточное количество парентерального разбавителя, чтобы получить необходимую концентрацию для введения. Предпочтительным разбавителем является лактатный раствор Рингера для инъекций. Предпочтительно, чтобы при конечной концентрации для введения содержалось от примерно 0,1 мг/мл до примерно 0,9 мг/мл аналога эпотилона.
Конечное разбавление аналога эпотилона можно осуществить с такой же эффективностью с помощью других препаратов, например, 5% декстрозы для инъекций, лактатный раствор Рингера для инъекций и декстроза для инъекций, стерильная вода для инъекций и т.п.Однако из-за узкого интервала рН 6,0-7,5 предпочтительным является лактатный раствор Рингера для инъекций. В 100 мл раствора лактатного раствора Рингера для инъекций содержится 0,6 г хлорида натрия, 0,31 г лактата натрия, 0,03 г хлорида калия и 0,02 г хлорида кальция · 2Н2O.
Приготовленный препарат, т.е. раствор аналога эпотилона в растворителе из спирта и поверхностно-активного вещества можно хранить в течение примерно 24 час до тех пор, пока потребуется разбавить его для введения. Было найдено, что случаи аллергических реакций, обусловленных присутствием в препарате поверхностно-активного вещества, сводятся к минимуму путем поддержания его концентрации на минимальном уровне, необходимом для растворения аналога эпотилона. Кроме того, частота таких реакций такая же, как и при парентеральном введении других фармацевтических препаратов, например, циклоспорина. Наблюдаемый уровень аллергических реакций при применении настоящего препарата значительно ниже, чем установленный для некоторых других онкологических лекарств типа паклитаксела.
Пример 4
9,86 г [1S-[1R ,3R ,3R (Е),7R (Е),7R ,10S ,10S ,11R ,11R ,12R ,12R ,16S ,16S ]]-7,11-дигидрокси-8,8,10,12,16-пентаметил-3-[1-метил-2-(2-метил-4-тиазолил)этенил]-4-аза-17-оксабицикло[14.1.0]гептадекан-5,9-диона в виде порошка смачивали/частично растворяли в 600 мл смеси 9:1 mpem-бутанола и воды для инъекций, которая была предварительно охлаждена до 5°С. После полного смачивания порошка его растворяли путем добавления 600 мл смеси 1:9 трет-бутанола и воды для инъекций и 766 мл смеси 1:1 mpem-бутанола и воды для инъекций, которая также была предварительно охлаждена до 5°С; таким образом, конечный растворитель представлял собой смесь 1:1. Растворение проводили в условиях защиты от света. ]]-7,11-дигидрокси-8,8,10,12,16-пентаметил-3-[1-метил-2-(2-метил-4-тиазолил)этенил]-4-аза-17-оксабицикло[14.1.0]гептадекан-5,9-диона в виде порошка смачивали/частично растворяли в 600 мл смеси 9:1 mpem-бутанола и воды для инъекций, которая была предварительно охлаждена до 5°С. После полного смачивания порошка его растворяли путем добавления 600 мл смеси 1:9 трет-бутанола и воды для инъекций и 766 мл смеси 1:1 mpem-бутанола и воды для инъекций, которая также была предварительно охлаждена до 5°С; таким образом, конечный растворитель представлял собой смесь 1:1. Растворение проводили в условиях защиты от света.
Полученный раствор сразу лиофилизировали в лиофилизаторе Virtis INOTOP при -16°С в защищенных от света условиях в течение 48 час. Полученный лиофилизированный продукт (лиофил) затем сушили при 15°С в высоком вакууме в течение 48 час. В ходе этих операций не наблюдали заметного разложения лекарства. Лиофил фасовали в стерильных условиях в 30 мл ампулы, каждая из которых содержала 10 мг лекарства и стандартный избыток на потери в ампуле/игле/шприце.
Лиофил смешивают с 5,5 мл смеси 1:1 по объему спирта и Cremophor EL®, который обычно входит в комплект лекарства в отдельной ампуле, для достижения конечной концентрации лекарства 2 мг/мл. После растворения путем осторожного вращения ампулы полученный раствор разбавляют до концентрации 0,2 мг/мл добавлением 9 мл лактатного раствора Рингера для инъекций на каждый миллилитр приготовленного лекарственного продукта.
Следующий пример иллюстрирует применение аналога эпотилона согласно настоящему изобретению.
Пример 5
24 раковых больных (12 мужчин и 12 женщин) получали аналог эпотилона согласно изобретению, чтобы оценить максимальную переносимую дозу (MTD), дозу предельной токсичности (DLT), фармакокинетику и фармакодинамику, а также оценить противоопухолевую активность соединения. Средний возраст (диапазон) пациентов составлял 57 (34-74) лет. Пять пациентов имели рак груди, пять пациентов – рак головы и шеи, два пациента имели саркому, два пациента – рак толстой кишки, два пациента имели меланому, два пациента имели рак пищевода, один пациент имел рак почки, один пациент имел цервикальный рак, один пациент – рак щитовидной железы и один пациент – рак заднепроходного канала. 21 пациент получал до этого химиотерапию (18 пациентов получали нейротоксические препараты и 18 пациентов получали радиотерапию). Среднее число предварительных курсов химиотерапии, включая адъювант (диапазон), составляло 2(1-3).
Пациентам вводили соединение перорально один раз в сутки (при дозах 20 мг/м2 и выше) с последующей 30-минутной IV инфузией соединения еженедельно, начиная с 7 дня. Пациентам вводили соединение в дозах 1; 2,5; 5; 10; 20; 25 и 30 мг/м2. За пациентами следили в ходе курса лечения на предмет предельно токсичной дозы (DLT). Результаты исследования показали, что соединение можно вводить еженедельно в дозах до 30 мг/м2 без обнаружения сильного отравления.
Во втором исследовании всем раковым больным (пяти мужчинам и семи женщинам) вводили соединение перорально один раз в день с последующей 30-минутной IV инфузией соединения еженедельно, начиная с седьмого дня, в дозе 25 мг/м2 для оценки нейротоксичности соединения. Средний возраст (диапазон) пациентов составлял 51 (30-65) год. Четыре пациента имели рак толстой кишки, три пациента – рак груди, два пациента – меланому, один пациент – рак почки, один пациент – саркому и один пациент – рак яичников. Десять пациентов получали предварительно химиотерапию (шесть пациентов получали нейротоксические препараты и 18 пациентов радиотерапию). Среднее число предварительных курсов химиотерапии, включая адъювант (диапазон), составляло 2 (0-3). Это исследование показало, что соединение можно назначать пациентам, которые ранее получали химиотерапию, включающую применение нейротоксических противораковых препаратов. Однако предпочтительно пациентам, которые ранее получали химиотерапию, включающую применение нейротоксических противораковых препаратов, давать кумулятивную дозу соединения, не превышающую примерно 200 мг/м2 на цикл. Кроме того, исследование показало, что пациенты с опухолью груди и толстой кишки, которые предварительно подвергались химиотерапевтическому лечению, реагировали на лечение соединением. В частности, пациенты с раком груди, получавшие ранее лечение адриамицином и таксотером с циклофосфамидом, 5-фторурацилом и метотрексатным адъювантом; или адриамицином, циклофосфамидом, 5-фторурацилом по поводу метастазирующего рака, реагировали на лечение соединением. Пациенты с метастазирующим раком толстой кишки, подвергавшиеся ранее лечению таксолом и карборлатином; 5-фторурацилом и лейковорином; или иринотеканом, также реагировали на лечение соединением согласно настоящему изобретению.
Формула изобретения
1. Кристаллическая полиморфная модификация аналога эпотилона формулы I
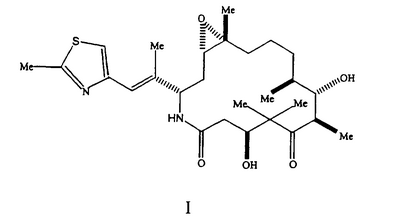
представляющая собой Форму А, характеризующуюся:
параметрами элементарной ячейки, приблизительно равными следующим:
| Размеры ячейки |
а=14.152(6)Å |
| |
b=30.72(2)Å |
| |
с=6,212(3) Å |
| |
Объем=2701(4)А3 |
| Пространственная группа |
P212121 |
| |
Орторомбическая |
| Молекулы/элементарная ячейка |
4 |
| Плотность(вычисленная) (г/см3) |
1.247 |
| Температура плавления |
182-185°С (разложение); и |
характеристические пики в дебаеграмме с величинами два тета (Cu K I=1.5406 при 22°С): 5,69; 6,76; 8,38; 11,43; 12,74; 13,62; 14,35; 15,09; 15,66; 16,43; 17,16; 17,66; 18,31; 19,03; 19,54; 20,57; 21,06; 21,29; 22,31; 23,02; 23,66; 24,18; 24,98; 25,50; 26,23; 26,46; 27,59; 28,89; 29,58; 30,32; 31,08 и 31,52. I=1.5406 при 22°С): 5,69; 6,76; 8,38; 11,43; 12,74; 13,62; 14,35; 15,09; 15,66; 16,43; 17,16; 17,66; 18,31; 19,03; 19,54; 20,57; 21,06; 21,29; 22,31; 23,02; 23,66; 24,18; 24,98; 25,50; 26,23; 26,46; 27,59; 28,89; 29,58; 30,32; 31,08 и 31,52.
2. Кристаллическая полиморфная модификация аналога эпотилона по п.1, характеризующаяся дебаеграммой, в основном такой, как дебаеграмма, показанная на фиг. 1, и спектром комбинационного рассеяния (Рамановский спектр), в основном таким, как спектр, показанный на фиг. 5.
3. Кристаллическая полиморфная модификация аналога эпотилона по п.1, характеризующаяся растворимостью в воде, равной 0,1254, растворимостью в 3%-ном водном растворе полисорбата 80, равной 0,2511, температурой плавления с разложением, равной 182-185 °С, и теплотой растворения 20,6 кДж/мол.
4. Кристаллическая полиморфная модификация аналога эпотилона формулы I
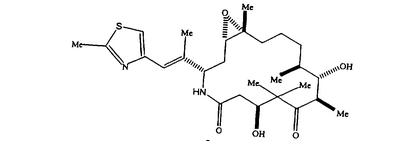
представляющая собой Форму В, характеризующуюся:
параметрами элементарной ячейки, приблизительно равными следующим:
| Размеры ячейки |
а=16.675(2)Å |
| |
b=28.083(4)Å |
| |
с=6,054 (1)Å |
| |
Объем=2835(1)А3 |
| Пространственная группа |
P212121 |
| |
Орторомбическая |
| Молекулы/элементарная ячейка |
4 |
| Плотность(вычисленная) (г/см3) |
1.187 |
| Температура плавления |
191-199°С (разложение); и |
характеристические пики в дебаеграмме с величинами два тета (Cu K I=1.5406 при 22°С): 6,17; 10,72; 12,33; 14,17; 14,93; 15,88; 16,17; 17,11; 17,98; 19,01; 19,61; 20,38; 21,55; 21,73; 22,48; 23,34; 23,93; 24,78; 25,15; 25,90; 26,63; 27,59; 28,66; 29,55; 30,49 и 31,22. I=1.5406 при 22°С): 6,17; 10,72; 12,33; 14,17; 14,93; 15,88; 16,17; 17,11; 17,98; 19,01; 19,61; 20,38; 21,55; 21,73; 22,48; 23,34; 23,93; 24,78; 25,15; 25,90; 26,63; 27,59; 28,66; 29,55; 30,49 и 31,22.
5. Кристаллическая полиморфная модификация аналога эпотилона по п.4, характеризующаяся дебаеграммой, в основном такой, как дебаеграмма, показанная на фиг. 2, и спектром комбинационного рассеяния (Рамановский спектр), в основном таким, как спектр, показанный на фиг. 6.
6. Кристаллическая полиморфная модификация аналога эпотилона по п.4, характеризующаяся растворимостью в воде, равной 0,1907, растворимостью в 3%-ном водном растворе полисорбата 80, равной 0,5799, температурой плавления с разложением, равной 191-199°С, и теплотой растворения 9,86 кДж/мол.
7. Кристаллическое вещество, представляющее собой смесь Формы А и Формы В аналогов эпотилона по пп.1-4, предназначенное для изготовления лекарственных средств против рака.
8. Способ получения кристаллической полиморфной модификации, которая представляет собой Форму А аналога эпотилона по п.1, заключающийся в нагревании суспензии указанного аналога формулы I примерно в 8-16 мл этилацетата на грамм указанного аналога примерно до 75°С, выдерживании при этой температуре в течение 1 ч, добавлении циклогексана в примерном отношении к этилацетату 1:2-2:2, самопроизвольном охлаждении смеси до комнатной температуры при перемешивании в течение около 12-96 ч, дальнейшем охлаждении примерно до 5°С в течение 2 ч и выделении из реакционной смеси кристаллической Формы А.
9. Способ получения кристаллической полиморфной модификации, которая представляет собой Форму А аналога эпотилона по п.1, заключающийся в нагревании суспензии указанного аналога формулы I примерно в 8-16 мл этилацетата на грамм указанного аналога примерно до 75°С, введении в нее зародышевых кристаллов и выдерживании смеси около 30 мин, добавлении циклогексана в примерном отношении к этилацетату 1:2-2:2, самопроизвольном охлаждении смеси до комнатной температуры при перемешивании в течение около 12-96 ч, дальнейшем охлаждении примерно до 5°С в течение примерно 2 ч и выделении из реакционной смеси кристаллической Формы А.
10. Способ получения кристаллической полиморфной модификации, которая представляет собой Форму А аналога эпотилона по п.1, заключающийся в нагревании суспензии указанного аналога формулы I примерно в 8-16 мл этилацетата на грамм указанного аналога до образования раствора, охлаждании указанного раствора около 2 ч примерно до 50°С, прибавляя зародышевые кристаллы, когда температура достигнет около 60°С, охлаждении раствора примерно до 30°С в течение примерно 3 ч, понижении далее температуры раствора до -10°С в течение примерно 3 ч, из них в течение 1 ч к реакционной смеси по каплям прибавляют циклогексан в соотношении к этилацетату 1:2-2:2, выдерживании полученной смеси при температуре -10°С в течение примерно 1 ч и выделении из нее кристаллической Формы А.
11. Кристаллическая полиморфная модификация аналога эпотилона формулы I, по существу свободная от аморфной составляющей.
12. Кристаллическая полиморфная модификация аналога эпотилона формулы I, имеющая чистоту по меньшей мере около 98,2 %.
13. Кристаллическая полиморфная модификация аналога эпотилона по п.12, имеющая чистоту по меньшей мере около 99,2 %.
14. Кристаллическая полиморфная модификация аналога эпотилона по п.12, имеющая чистоту по меньшей мере около 99,4 %.
15. Фармацевтическая композиция, ингибирующая ангиогенез, содержащая активный ингредиент, отличающаяся тем, что в качестве активного ингредиента содержит кристаллическую полиморфную модификацию аналога эпотилона по любому из по пп.1-7 или 11-14 и фармацевтически приемлемый носитель.
16. Способ лечения рака, заключающийся во введении нуждающемуся в лечении млекопитающему эффективного количества кристаллической полиморфной модификации аналога эпотилона по любому из по пп.1-7 или 11-14.
РИСУНКИ
|
|