Патент на изобретение №2272033
|
||||||||||||||||||||||||||
(54) СПОСОБ ПОЛУЧЕНИЯ БЕРАПРОСТА И ЕГО СОЛЕЙ
(57) Реферат:
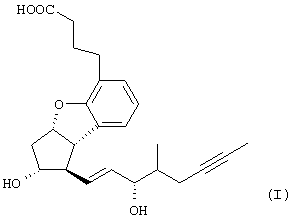
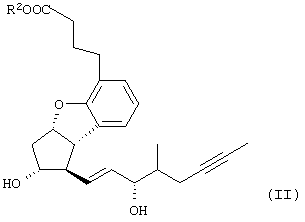
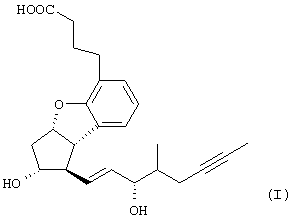
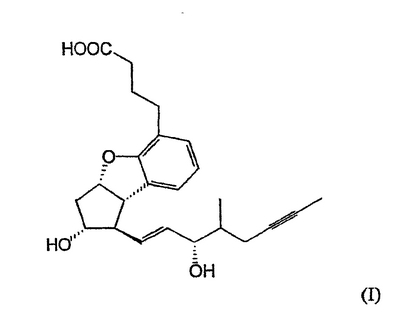
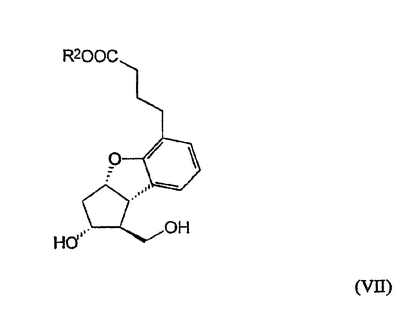
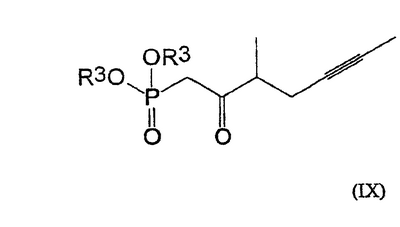
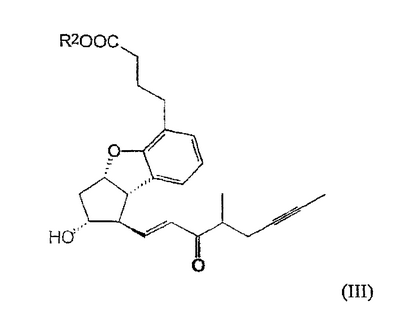
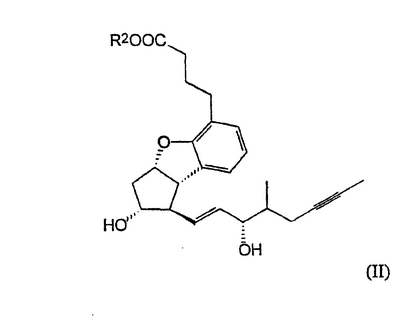
Изобретение относится к способу получения берапроста формулы I или его солей, в частности, его натриевой соли, а также промежуточным соединениям формулы V и IV: где R1 и R2 имеют значения, указанные в описании. Технический результат – новый способ получения берапроста, позволяющий повысить выход целевого продукта и упростить процесс. 4 н. и 10 з.п. ф-лы.
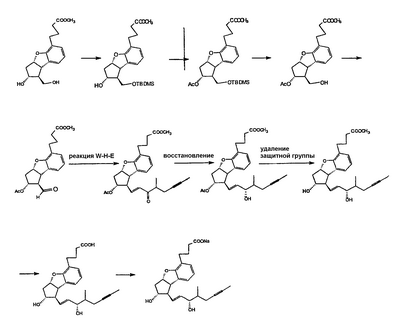
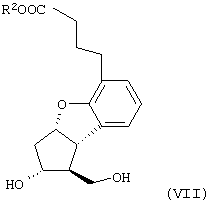
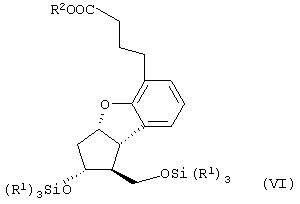
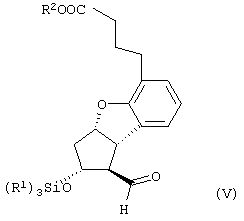
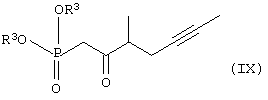
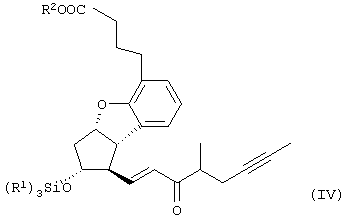
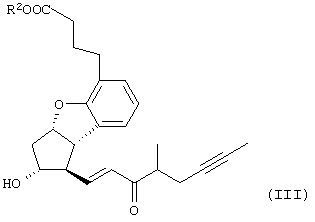
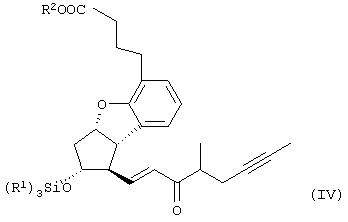
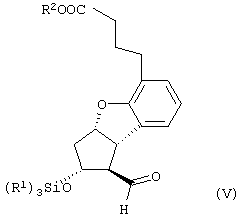
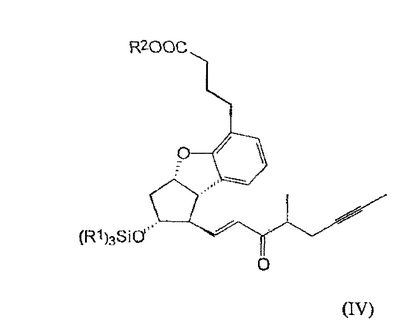
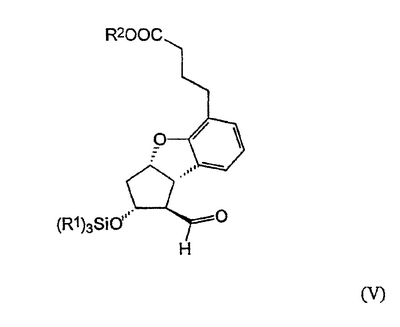
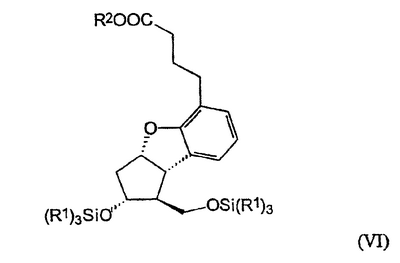
Настоящее изобретение относится к новому способу получения берапроста формулы (I) и его солей и к новым промежуточным продуктам общих формул (IV), (V) и (VI) применяемым в новом синтезе, где R1 представляет собой метильную или этильную группы, R2 представляет собой алкильную группу с прямой или разветвленной цепью, содержащую 1-4 атомов углерода. Соли берапроста формулы (I), в частности, натриевая соль, являются производными простациклина для перорального применения, которые эффективно применяются для лечения хронического заболевания периферических сосудов, артериального тромбоза и легочной гипертензии. Активный фармацевтический ингредиент формулы (I) и его соли, применяемые в коммерческих фармацевтических композициях, представляют собой рацемические соединения, содержащие четыре стереоизомера. Синтез соединения формулы (I) и его солей описан в опубликованной заявке на европейский патент № 084856A, в опубликованной заявке на японский патент № 59-134787A и в публикации Tetrahedron 55, стр. 2449-2474 (1999), а краткое описание синтеза приведено на схеме 1. На схеме 1 обозначение TBDMS представляет собой трет-бутилдиметилсилильную группу, Ac означает ацетильную группу, W-H-E-реакция означает реакцию Виттига-Хорнера-Эммонса. Из схемы 1 и известного уровня техники можно заметить, что путь синтеза в соответствии с уровнем техники в данной области довольно длинный, а получаемый при этом выход продукта невысокий. Задачей настоящего изобретения является разработка более короткого синтеза целевого продукта с более высоким выходом. Неожиданно было обнаружено, что защита первичной гидроксильной группы чувствительной к кислоте защитной группой и защита вторичной гидроксильной группы чувствительной к основанию защитной группой необязательна, и соответственно последующее удаление защитной группы с первичной гидроксильной группы, если применять одну, специально выбранную защитную группу, которая в то же время делает возможным селективное окисление. Удаление описанной выше защитной группы перед восстановлением оксо-группы в положении 15 и тщательный выбор восстановителя увеличивают стереоселективность восстановления и выход синтеза в целом. Согласно настоящему изобретению, соединение общей формулы (VII) где R2 представляет собой алкильную группу с прямой или разветвленной цепью, содержащую 1-4 атомов углерода, взаимодействует с соединением общей формулы (VIII), где R1 представляет собой метильную или этильную группу, X представляет собой атом хлора, брома или йода, CF3SO2-O-группу, азидо-, циано- или -О-С(СН3)=СН-С(О)-СН3-группу или другую группу, такую как аллильную группу или -С(OCH3)=C(CH3)-CH3, 1-имидазолильную или трихлорацетильную группы, или -NH-Si(CH3)3, -Si(CH3)3, -S-Si-(CH3)3, -O-Si(CH3)3 группы, описанную в следующей литературе: Silylating Agents, Fluka Chemie AG, Second Edition, Edited by Dr.Gert van Look (1995) ISBN 3-905617-08-0; полученное соединение общей формулы (VI), где значения Rl и R2 определены выше, окисляется до альдегида общей формулы (V), где значения R1 и R2 определены выше; полученный выше альдегид после выделения или без выделения взаимодействует с фосфонатом общей формулы (IX) где R3 представляет собой алкильную группу с прямой или разветвленной цепью, содержащую 1-4 атомов углерода; с последующим снятием защиты у полученного соединения общей формулы (IV), где значения Rl и R2 определены выше, путем удаления защитной группы в положении 11 и последующим восстановлением полученного таким образом соединения общей формулы (III) где значение R2 определено выше, полученное соединение общей формулы (II) где значение R2 определено выше, подвергают гидролизу и выделяют кислоту формулы (I), которую при взаимодействии с основанием переводят в ее соль и соль выделяют, или полученную кислоту формулы (I) переводят в ее соль без предварительного выделения кислоты и полученную таким образом соль выделяют. Во время осуществления описанного выше способа соединение общей формулы (VII) взаимодействует с соединением общей формулы (VIII) пригодным для введения триэтилсилильной или триметилсилильной группы, где Rl означает метильную или этильную группу, X представляет атом хлора, брома, йода, CF3-SO2-O-, азидо-, циано- или -О-С(СН3)=СН-С(О)-СН3-группу или другую группу, такую как аллильную группу или -С(OCH3)=C(CH3)-CH3, 1-имидазолильную или трихлорацетильную группы, или -NH-Si(CH3)3, -Si(CH3)3, -S-Si-(CH3)3, -O-Si(CH3)3 группы, описанную в следующей литературе: Silylating Agents, Fluka Chemie AG, Second Edition, Edited by Dr.Gert Van Look (1995) ISBN 3-905617-08-0; предпочтительны триметилсилилгалогениды или триэтилсилилгалогениды, в частности, хлориды или специфические производные, перечисленные выше. Полученные дисилилированные диолы общей формулы (VI) можно окислить до альдегидов общей формулы (V) преимущественно смесью диметилсульфоксида, оксалилхлорида и триэтиламина. Альдегиды общей формулы (V) взаимодействуют с фосфонатами общей формулы (IX) в условиях реакции Виттига-Хорнера-Эммонса (Chem. Rev. 89, стр. 863-927 (1989)) с образованием соединений общей формулы (IV). После удаления триэтилсилильной или триметилсилильной защитной группы, предназначенной для защиты вторичной гидроксильной группы в соединениях общей формулы (IV), в кислой среде получают соединения енонольного типа общей формулы (III). Стереоселективное восстановление соединений общей формулы (III) проводят, предпочтительно используя диизобутилалюминий-2,6-ди-трет-бутил-4-метилфеноксид, и получают соединения формулы (II), гидролиз которых в основной среде приводит к берапросту формулы (I). Соли соединения формулы (I) можно получить при взаимодействии указанного соединения с основаниями. Образование соли можно проводить после выделения берапроста формулы (I) или без его выделения. Для получения натриевой соли берапроста в качестве основания наиболее предпочтительно применяют гидроксид натрия. Соединения общей формулы (VII) и фосфонаты общей формулы (IX), применяемые в способе, соответствующем настоящему изобретению, можно получить так, как описано, например, в публикации Tetrahedron 55, стр. 2449-2474 (1999). Соединения общей формулы (VIII) относятся к коммерчески доступным соединениям. Настоящее изобретение более подробно будет описано с помощью следующих примеров, не ограничивающих формулу изобретения. Пример 1 Соединение общей формулы (VI), где Rl представляет этильную группу, а R2 представляет метильную группу 1,84 г (6 ммоль) диола общей формулы (VII), где R2 представляет метильную группу, растворяют в 10 мл пиридина. Раствор перемешивают и добавляют 2,35 мл (14 ммоль) триэтилсилилхлорида. Перемешивание продолжают в течение 30 минут и затем реакционную смесь выливают в смесь, состоящую из 50 мл воды и 20 мл гексана. Водную фазу экстрагируют гексаном (2×10 мл) и объединенный раствор в гексане промывают 30 мл 1 М водного раствора NaHSO4, 30 мл воды, 30 мл 1 M раствора NaHCO3, 2×30 мл воды, затем насыщенным раствором NaCl. Гексановый раствор сушат над Na2SO4 в течение одного часа и затем упаривают. Указанное в заголовке соединение получают в виде бесцветного маслянистого вещества. Выход: 3,08 г (96%). Rf-ТСХ (гексан:этилацетат 3:1)=0,60, (TCX означает тонкослойную хроматографию). Rf-TCX (гексан:этилацетат 10:1)=0,32. 1H ЯМР (400 мГц, C6D6), 13C ЯМР (100 МГц, C6D6), Пример 2 Соединение общей формулы (V), где R1 представляет этильную группу, R2 представляет метильную группу 0,27 мл (3 ммоль) оксалилхлорида растворяют в 3 мл дихлорметана и охлаждают смесь до -60°C. К полученному раствору при -60°C по каплям добавляют 0,44 мл (6,2 ммоль) диметилсульфоксида, растворенного в 3 мл дихлорметана. После перемешивания в течение 5 минут к смеси добавляют 1,07 г (2 ммоль) соединения общей формулы (VI), полученного по примеру 1, растворенного в 2 мл дихлорметана. Смеси дают нагреться до -35°C и перемешивают ее при указанной температуре в течение 30 минут. Реакционную смесь охлаждают до -60°C и добавляют 1,42 мл (10 ммоль) триэтиламина. Смесь перемешивают в течение 15 минут и при комнатной температуре добавляют 10 мл воды и 7 мл 10 М водного раствора NaHSO4. Водную фазу дважды экстрагируют 5 мл дихлорметана. Объединенную органическую фазу промывают 10 мл 1 М водного раствора NaHCO3, 10 мл воды и 10 мл насыщенного раствора NaCl. Органическую фазу сушат над Na2SO4, упаривают в вакууме, получая при этом указанное в заголовке соединение в виде желтого маслянистого вещества, которое после очистки или без очистки можно применять на стадии следующей реакции. Выход: 0,83 г (99%). Rf-ТСХ (гексан:простой диизопропиловый эфир 1:1)=0,44, Rf-ТСХ (гексан:этилацетат 3:1)=0,52 1H ЯМР (400 МГц, C6D6), 13C ЯМР (100 МГц, C6D6), Пример 3 Соединение общей формулы (IV), где R1 представляет этильную группу, R2 представляет метильную группу 92 мг Масляной дисперсии (60%) гидрида натрия (2,3 ммоль) суспендируют в 2 мл толуола, 0,51 мл (2,2 ммоль) фосфоната общей формулы (IX), где R3 представляет метильную группу, растворяют в 1 мл толуола и добавляют к смеси при 15°C в атмосфере азота. Смесь перемешивают в течение 20 минут при 15°C, и затем полученный раствор, содержащий натриевую соль фосфоната, добавляют по каплям к 0,83 г (2 ммоль) полученного по примеру 2 неочищенного альдегида общей формулы (V), растворенного в 2 мл толуола при -10°C. После перемешивания в течение двух часов к реакционной смеси добавляют 10 мл воды и 2 мл 1М водного раствора NaHSO4 и перемешивают в течение двух минут. Водную фазу дважды экстрагируют 5 мл толуола, а объединенный раствор в толуоле экстрагируют 10 мл воды, 10 мл 1М водного раствора NaHCO3, 10 мл воды и 10 мл насыщенного раствора NaCl. Раствор сушат над Na2SO4, упаривают в вакууме, получая при этом указанное в заголовке соединение в виде желтого маслянистого вещества, которое можно применять на стадии следующей реакции без очистки. Выход: 1,2 г (>99%) Rf-ТСХ (гексан:простой диизопропиловый эфир 1:1)=0,49 Rf-ТСХ (гексан:этилацетат 3:1)=0,54 1H ЯМР (400 МГц, C6D6), 13C ЯМР (100 МГц, C6D6), Пример 4 Соединение общей формулы (III), где R2 представляет метильную группу 1,2 г (2 ммоль) неочищенного силиленона общей формулы (IV), полученного в примере 3, растворяют в 20 мл метанола и добавляют к нему 0,15 мл (1,8 ммоль) концентрированной соляной кислоты. Смесь перемешивают в течение 5 минут при 25°C и добавляют к ней 0,16 г (1,9 ммоль) твердого NaHCO3. Полученную смесь перемешивают в течение 10 минут при 25°C и затем упаривают в вакууме. Остаток растворяют в толуоле, неорганические соли отфильтровывают, а фильтрат упаривают. Сырой продукт очищают колоночной хроматографией, получая при этом указанное в заголовке соединение в виде бледно-желтого маслянистого вещества. Выход: 0,46 г (56%) Rf-ТСХ (простой диизопропиловый эфир:этилацетат:уксусная кислота 50:50:1,5)=0,50. 1H ЯМР (400 МГц, CDCl3), 13C ЯМР (100 МГц, CDCl3), Пример 5 Соединение общей формулы (II), где R2 означает метильную группу 5,14 г (22 ммоль) 2,6-ди-т-бутил-4-метилфенола растворяют в 50 мл дистиллированного толуола в атмосфере азота. К полученному раствору добавляют по каплям 1,55 г (11 ммоль) диизобутилалюминийгидрида, растворенного в 8 мл дистиллированного толуола. Реакционную смесь перемешивают в течение одного часа при 0°C, затем охлаждают до -78°C. К полученному реагенту диизобутилалюминий-2,6-ди-т-бутил-4-метилфеноксиду при -78°C медленно по каплям добавляют 0,45 г (1,1 ммоль) соединения общей формулы (III), полученного по примеру 4 и растворенного в 4 мл дистиллированного толуола. Реакционную смесь перемешивают в течение ночи при -50°C, а затем гасят 27 мл 2М водного раствора соляной кислоты. После перемешивания в течение 30 минут фазы разделяют, водную фазу дважды промывают 15 мл толуола, объединенную органическую фазу промывают 20 мл насыщенного раствора NaCl, 15 мл 1М водного раствора NaHCO3 и 2×20 мл насыщенного раствора NaCl. Органическую фазу сушат над Na2SO4 и упаривают в вакууме. Указанное в заголовке соединение получают после очистки остатка хроматографией в виде бесцветного маслянистого вещества. Выход: 0,25 г (55%) Rf-ТСХ (простой диизопропиловый эфир: этилацетат: уксусная кислота 50:50:1,5)=0,24 Rf-ТСХ (толуол:диоксан:уксусная кислота 20:10:1)=0,50 1H ЯМР (400 МГц, CDCl3), Пример 6 Берапрост формулы (I) 0,246 г (0,6 ммоль) соединения общей формулы (II), полученного в примере 5, растворяют в 1 мл метанола и к полученному раствору медленно по каплям добавляют 1 мл 1М водного раствора гидроксида натрия. После перемешивания в течение часа метанол отгоняют из реакционной смеси в вакууме. Водный остаток разбавляют 10 мл воды, экстрагируют простым метил-трет-бутиловым эфиром и объединенную органическую фазу промывают насыщенным раствором NaCl, сушат над Na2SO4 и упаривают. Остаток после упаривания кристаллизуют из смеси этилацетат-гексан, получая при этом указанное в заголовке соединение в чистом виде в виде бесцветных кристаллов. Выход: 0,21 г (87%) Rf-ТСХ (толуол-диоксан-уксусная кислота 20:10:1)=0,41 Температура плавления: 98-112°C. 1H ЯМР (400 МГц, CDCl3), 13C ЯМР (100 МГц, CDCl3), Пример 7 Натриевая соль берапроста (натриевая соль соединения формулы (I)) 0,199 г берапроста растворяют в 2 мл метанола, к полученному раствору добавляют 0,5 мл 1М водного раствора гидроксида натрия и после перемешивания растворитель выпаривают в вакууме, получая при этом указанную в заголовке соль в виде бесцветных кристаллов. Выход: 0,21 г (100%). Температура плавления: >205°C. 1H ЯМР (400 МГц, DMSO-d6), Во время проведения описанной выше процедуры тонкослойной хроматографии (ТСХ) применяли пластины MERCK Kieselgel 60 F254, толщина слоя составляет 0,2 мм, длина пластин 5 см. Схема 1
Формула изобретения
1. Способ получения соединения формулы (I) и его солей, в частности, его натриевой соли, отличающийся тем, что соединение общей формулы (VII) где R2 представляет собой алкильную группу с прямой или разветвленной цепью, содержащую 1-4 атома углерода, взаимодействует с соединением общей формулы (VIII) где R1 представляет собой метильную или этильную группу; Х представляет атом хлора, брома или йода, CF3SO2-O-группу, азидо-, циано- или -O-С(СН3)=СН-С(O)-СН3-группу, аллильную группу или -С(ОСН3)=С(СН3)-СН3, 1-имидазолильную или трихлорацетильную группы, или -NH-Si(СН3)3, -Si(СН3)3, -S-Si-(СН3)3, -O-Si(СН3)3 группы, полученное соединение общей формулы (VI) где значения R1 и R2 определены выше, окисляется до альдегида общей формулы (V) где значения R1 и R2 определены выше, полученный выше альдегид после выделения или без выделения взаимодействует с фосфонатом общей формулы (IX) где R3 представляет собой алкильную группу с прямой или разветвленной цепью, содержащую 1-4 атомов углерода, с последующим снятием защиты у полученного соединения общей формулы (IV) где значения R1 и R2 определены выше, путем удаления защитной группы в положении 11 и восстановлением полученного соединения общей формулы (III) где значение R2 определено выше, далее полученное соединение общей формулы (II) где значение R2 определено выше, подвергают гидролизу и выделяют кислоту формулы (I), которую при взаимодействии с основанием переводят в ее соль и соль выделяют, или полученную кислоту формулы (I) переводят в ее соль без предварительного выделения кислоты и полученную таким образом соль выделяют. 2. Способ по п.1, отличающийся тем, что применяется соединение общей формулы (VIII), где R1 представляет этил, а Х представляет атом хлора, брома или йода, циано-, азидо-, CF3-SO2-O- или -O-С(СН3)=СН-С(O)-СН3-группу. 3. Способ по п.1, отличающийся тем, что соединение общей формулы (VI) окисляется до соединения общей формулы (V) смесью диметилсульфоксида, оксалилхлорида и триэтиламина. 4. Способ по п.1, отличающийся тем, что альдегид общей формулы (V) и фосфонат общей формулы (IX) взаимодействуют при условиях реакции Виттига-Хорнера-Эммонса. 5. Способ по п.1, отличающийся тем, что защитную группу гидроксильной группы в положении 11 в случае соединения общей формулы (IV) удаляют в кислой среде. 6. Способ по п.1, отличающийся тем, что восстановление соединения общей формулы (III) проводят диизобутилалюминий-2,б-ди-трет-бутил-4-метилфеноксидом. 7. Способ по п.1, отличающийся тем, что соединение общей формулы (II) подвергают гидролизу в основной среде. 8. Способ по п.1, отличающийся тем, что кислоту формулы (I) переводят в ее натриевую соль и полученную соль выделяют. 9. Соединения общей формулы (VI) где R1 представляет метильную или этильную группу; R2 представляет алкильную группу с прямой или разветвленной цепью, содержащей 1-4 атомов углерода. 10. Соединение по п.9, где R1 представляет собой этильную группу, а R2 представляет собой метильную группу. 11. Соединения общей формулы (V) где R1 представляет метальную или этильную группу; R2 представляет алкильную группу с прямой или разветвленной цепью, содержащей 1-4 атомов углерода. 12. Соединение по п.11, где R1 представляет собой этильную группу, а R2 представляет собой метильную группу. 13. Соединения общей формулы (IV) где R1 представляет метильную или этильную группу; R2 представляет алкильную группу с прямой или разветвленной цепью, содержащей 1-4 атомов углерода. 14. Соединение по п.13, где R1 представляет собой этильную группу, а R2 представляет собой метильную группу.
PD4A – Изменение наименования обладателя патента Российской Федерации на изобретение
(73) Новое наименование патентообладателя:
Адрес для переписки:
Извещение опубликовано: 10.10.2009 БИ: 28/2009
|
||||||||||||||||||||||||||


 H (м.д.): 0,54кв., 0,63кв. [12H; J=7,9 Гц; Si(CH2CH3)3]; 0,95т, 1,02т [18H; J=7,9 Гц; Si(CH2CH3)3]; 2,05м, 2,06м [3H; 10-H, 3-H2]; 2,16м, 2,22м, 2,25м [4H; 12-H, 2-H2, 10-H]; 2,70м [2H; 4-H2]; 3,32с [3H; OCH3]; 3,51дд [1H; J=8,8, 7,0 Гц; 8-H]; 3,63м [2H; 13-H2]; 4,01тд [1H; J=7,4, 5,8 Гц; 11-H]; 4,85ддд [1H; J=9,1, 7,2, 5,4 Гц; 9-H]; 6,85т [1H; J=7,3 Гц; 2′-H]; 6,93д [1H; J=7,3 Гц; 1′-H]; 7,19д [1H; J=7,3 Гц; 3′-H].
H (м.д.): 0,54кв., 0,63кв. [12H; J=7,9 Гц; Si(CH2CH3)3]; 0,95т, 1,02т [18H; J=7,9 Гц; Si(CH2CH3)3]; 2,05м, 2,06м [3H; 10-H, 3-H2]; 2,16м, 2,22м, 2,25м [4H; 12-H, 2-H2, 10-H]; 2,70м [2H; 4-H2]; 3,32с [3H; OCH3]; 3,51дд [1H; J=8,8, 7,0 Гц; 8-H]; 3,63м [2H; 13-H2]; 4,01тд [1H; J=7,4, 5,8 Гц; 11-H]; 4,85ддд [1H; J=9,1, 7,2, 5,4 Гц; 9-H]; 6,85т [1H; J=7,3 Гц; 2′-H]; 6,93д [1H; J=7,3 Гц; 1′-H]; 7,19д [1H; J=7,3 Гц; 3′-H]. 1 Гц; 13-H].
1 Гц; 13-H].