|
|
(21), (22) Заявка: 2003107572/04, 20.08.2001
(24) Дата начала отсчета срока действия патента:
20.08.2001
(30) Конвенционный приоритет:
21.08.2000 EP 00117918.3
(43) Дата публикации заявки: 10.08.2004
(45) Опубликовано: 20.03.2006
(56) Список документов, цитированных в отчете о
поиске:
RU 2126404 C1, 20.09.1999. RU 2152930 C2, 20.07.2000. EP 0824098 A1, 18.02.1998. WO 95/25721 A1, 28.09.1995.
(85) Дата перевода заявки PCT на национальную фазу:
21.03.2003
(86) Заявка PCT:
EP 01/09561 (20.08.2001)
(87) Публикация PCT:
WO 02/16321 (28.02.2002)
Адрес для переписки:
101000, Москва, М.Златоустинский пер., 10, кв.15, “ЕВРОМАРКПАТ”, пат.пов. И.А.Веселицкой, рег. № 11
|
(72) Автор(ы):
АЛАНЕН Александер (FR),
БЮТТЕЛЛЬМАНН Бернд (DE),
ФИШЕР Хольгер (CH),
ЭТС-НЕДАР Мари-Поль (FR),
ХУВИЛЕР Йёрг (CH),
ЙЭШКЕ Георг (CH),
ПИНАР Эмманюэль (FR),
ВИЛЕ Рене (CH)
(73) Патентообладатель(и):
Ф.ХОФФМАНН-ЛЯ РОШ АГ (CH)
|
(54) ПРОИЗВОДНЫЕ 3-ГИДРОКСИПИПЕРИДИНА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ
(57) Реферат:
Изобретение относится к новым производным 3-гидроксипиперидина
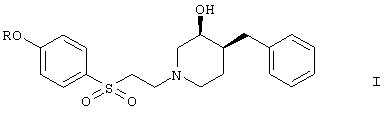
общей формулы (I)
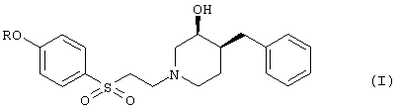
где R означает (a) -C(O)(CH2)nC(O)ОН,
(б) 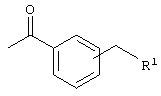 , где R1 означает -N(R2)(R3) и R2 и R3 каждый означает водород, низший алкил или циклический третичный амин; (в) -Р(O)(ОН)2 или (г) -С(O)(СН2)nNHC(O)(CH2)nN(R2)(R3), n означает целое число 1-4. Указанные соединения могут применяться в качестве пролекарств для получения лекарственных средств для лечения заболеваний, связанных с блокаторами подтипа рецепторов NMDA. 2 н. и 8 з.п. ф-лы, 1 табл. , где R1 означает -N(R2)(R3) и R2 и R3 каждый означает водород, низший алкил или циклический третичный амин; (в) -Р(O)(ОН)2 или (г) -С(O)(СН2)nNHC(O)(CH2)nN(R2)(R3), n означает целое число 1-4. Указанные соединения могут применяться в качестве пролекарств для получения лекарственных средств для лечения заболеваний, связанных с блокаторами подтипа рецепторов NMDA. 2 н. и 8 з.п. ф-лы, 1 табл.
Изобретение относится к соединениям общей формулы
где
R означает
(a) -C(O)(CH2)nC(O)ОН,
(б) 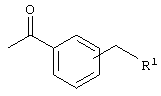 , где R1 означает -N(R2)(R3) и R2 и R3 каждый означает независимо друг от друга водород или (низш.)алкил, или означает циклический третичный амин, необязательно замещенный (низш.)алкилом, , где R1 означает -N(R2)(R3) и R2 и R3 каждый означает независимо друг от друга водород или (низш.)алкил, или означает циклический третичный амин, необязательно замещенный (низш.)алкилом,
(в) -Р(O)(ОН)2 или
(г) означает -C(O)(CH2)nNHC(O)(CH2)nN(R2)(R3); и
n означает 1, 2, 3 или 4;
и их фармацевтически приемлемым кислотно-аддитивным солям. Было найдено, что данные соединения формулы I могут применяться в качестве пролекарств соединений формулы
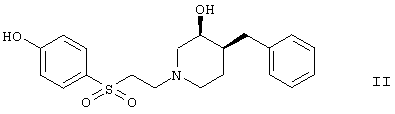
которые являются селективными блокаторами подтипа рецепторов NMDA (N-метил-D-аспартата).
В большинстве случаев пролекарство представляет собой фармакологически неактивное производное молекулы родительского препарата, которому в организме необходима спонтанная или энзиматическая трансформация, чтобы высвободить активный препарат, и которое обладает улучшенными свойствами доставки по сравнению с молекулой родительского препарата. Было показано, что молекула с оптимальной структурной конфигурацией и оптимальными физико-химическими свойствами для выявления требуемого терапевтического ответа на своем сайте-мишени необязательно обладает лучшей молекулярной формой и свойствами ее доставки в точку ее окончательного действия. Обычно только малая часть введенных доз достигает области мишени, и, поскольку большинство агентов взаимодействует также с сайтами, не являющимися мишенями, неэффективная доставка может приводить к нежелательным побочным эффектам. Данный факт различий в транспорте и характеристиках эффекта in situ для многих лекарственных молекул является основной причиной, по которой биообратимая химическая модификация лекарств, т.е. образование пролекарств, является способом, с помощью которого часто можно достичь существенного улучшения общей эффективности препаратов. Пролекарства создают для преодоления фармацевтически и фармакокинетически ориентированных проблем, связанных с родительской лекарственной молекулой, которые в ином случае ограничили бы клиническую полезность препарата.
В последние годы использовалось несколько типов биообратимых производных для применения в создании пролекарств. Наиболее известно использование сложных эфиров в качестве пролекарства для препаратов, содержащих карбоксильную или гидроксильную группу. Кроме того, хорошо известными являются пролекарства на основе производных пептидов, 4-имидазолидинонов и тому подобные, описанные в Drugs of the Future, 1991, 16 (5), 443-458, или на основе N-оксидов, описанные, например, в US 5691336.
Однако преимущество пролекарства состоит в его физических свойствах, таких как повышенная растворимость в воде для парентерального введения при физиологических значениях рН, по сравнению с родительским препаратом или оно усиливает всасывание из пищеварительного тракта, или оно может повышать устойчивость при длительном хранении.
Соединения формулы II имеют ограниченную растворимость в воде при физиологическом значении рН, не допускающую введение больших доз, Поэтому выгодно найти производные соединений формулы II, делающие их пригодными для парентерального и внутримышечного введения.
Показано, что соединения формулы I удовлетворяют всем требованиям хорошего пролекарства. А именно, были продемонстрированы повышение растворимости до десятикратной при физиологическом значении рН по сравнению с родительским соединением, устойчивость в растворе при комнатной температуре в течение 48 ч и быстрый гидролиз в плазме.
Как упоминалось ранее, соединения формулы II являются селективными блокаторами рецепторов N-метил-D-аспартата (NMDA), которые выполняют ключевую функцию в модуляции нейронной активности и пластичности, что делает их основными участниками в опосредовании процессов, лежащих в основе эволюции ЦНС, включая обучаемость, формирование и функционирование памяти.
При патологических состояниях острой и хронической форм нейродегенерации повышенная активация рецепторов NMDA является ключевым событием запуска механизма нейронной клеточной смерти. Рецепторы NMDA состоят из членов двух семейств на основе субъединиц, а именно NR-1 (8 различных вариантов сплайсинга) и NR-2 (A-D), происходящего от различных генов. Члены двух семейств на основе субъединиц демонстрируют разное распределение в различных областях мозга. Гетеромерные комбинации членов NR-1 с различными субъединицами NR-2 приводят к рецепторам NMDA, обладающим различными фармакологическими свойствами. Возможные терапевтические показания для специфических блокаторов подтипа рецепторов NMDA включают острые формы нейродегенерации, вызванной, например, ударом или мозговой травмой; хронические формы нейродегенерации, такие как болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона или (ALS) боковой амиотрофический склероз; нейродегенерацию, ассоциированную с бактериальной или вирусной инфекциями, заболевания, такие как шизофрения, возбуждение, депрессия и острая/хроническая боль.
Объектом настоящего изобретения являются новые соединения формулы I, их применение в качестве пролекарств в лечении или профилактике заболеваний, вызванных повышенной активацией соответствующих подтипов рецепторов NMDA, которые включают острые формы нейродегенерации, вызываемой, например, ударом или мозговой травмой; хронические формы нейродегенерации, такие как болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона или (ALS) боковой амиотрофический склероз; нейродегенерацию, ассоциированную с бактериальной или вирусной инфекциями, и заболевания, такие как шизофрения, возбуждение, депрессия и острая/хроническая боль, применение данных соединений для получения соответствующих лекарственных средств, способы получения этих новых соединений и содержащих их лекарственных средств.
Подобное соединение формулы II описано в международной заявке WO 95/25721, где общая формула не содержит гидроксильной группы в пиперидиновом кольце. Описано, что эти соединения обладают активностью в отношении глутаматного рецептора или рецептора АМРА для лечения заболеваний, которые связаны с этими рецепторами. Кроме того, подобные соединения описаны в европейском патенте ЕР 824098, в них пиперидиновое кольцо замещено в положении 4 гидроксильной группой. Описано, что данные соединения обладают активностью в отношении рецептора NMDA и применимы для лечения острых форм нейродегенерации, вызванной, например, ударом или мозговой травмой, и хронических форм нейродегенерации, таких как болезнь Альцгеймера, болезнь Паркинсона, ALS (боковой амиотрофический склероз), нейродегенерации, ассоциированной с бактериальной или вирусной инфекцией, и острой/хронической боли.
Кроме того, известно из WO 00/75109, что соединение формулы II является хорошим специфическим блокатором подтипа рецепторов NMDA, обладающим нейрозащитным действием in vivo, менее активным в качестве блокатора кальциевых каналов hERG, и, таким образом, значительно менее вероятно, что оно обладает проаритмической активностью у человека.
Наиболее предпочтительным показанием по настоящему изобретению является лечение или предотвращение удара.
Следующие значения общих терминов, использованных в настоящем описании, применяются независимо от того, употребляются ли термины, о которых идет речь, как таковые или в сочетании.
Термин «(низш.)алкил», как он использован в контексте, означает линейную или разветвленную группу, содержащую 1-7 атомов углерода, например метил, этил, пропил, изопропил, н-бутил, изобутил, трет.-бутил и тому подобное. Предпочтительными (низш.)алкильными группами являются группы с 1-4 атомами углерода.
Термин «циклический третичный амин» означает, например, пиррол-1-ил, имидазол-1-ил, пиперидин-1-ил, пиперазин-1-ил или морфолин-4-ил. Предпочтительным является пиперазин-1-ил или морфолин-4-ил.
Термин «физиологическое значение рН» означает рН примерно 7, предпочтительно 7,4.
Предпочтительными примерами являются соединения, в которых R означает -С(O)(СН2)nС(O)ОН и n означает 2, например, следующее соединение:
моно-{(3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]фениловый}эфир янтарной кислоты.
Другими предпочтительными соединениями являются соединения, в которых R означает
и R1 означает морфолинил, 4-метилпиперазинил или -N(R2)(R3) и R2/R3 каждый независимо друг от друга означает водород или (низш.)алкил.
Примерами таких соединений являются:
(3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]фениловый эфир 4-морфолин-4-илметилбензойной кислоты,
(3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]фениловый эфир 4-(4-метилпиперазин-1-илметил)бензойной кислоты,
(3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]фениловый эфир 3-(4-метилпиперазин-1-илметил)бензойной кислоты,
(3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]фениловый эфир 3-морфолин-4-илметилбензойной кислоты,
(3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]фениловый эфир 4-аминометилбензойной кислоты,
(3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]фениловый эфир 3-метиламинометилбензойной кислоты или
(3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]фениловый эфир 4-метиламинометилбензойной кислоты.
Предпочтительными примерами являются дополнительные соединения, в которых R означает -Р(O)(ОН)2, например следующее соединение:
моно{(3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]фениловый}эфир фосфорной кислоты.
Данные соединения формулы I и их фармацевтически приемлемые соли могут быть получены способами, известными специалистам, например описанными ниже способами, которые включают
(а) взаимодействие соединения формулы
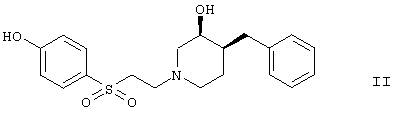
с
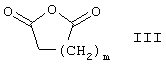
с образованием соединения формулы
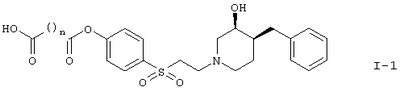
где m означает 1-3 и n означает 2-4, или
(б) взаимодействием соединения формулы II с (BnO)2Р(Н)O/CCl4/DMAP/основанием Хюнига и гидрированием полученного соединения в соединение формулы
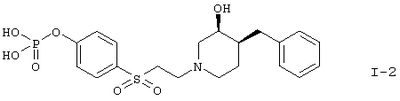
или
(в) взаимодействием соединения формулы II с соединением формулы
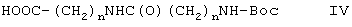
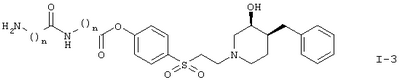
с отщеплением Вос-группы и образованием соединения формулы
(г) взаимодействием соединения формулы II с соединением формулы
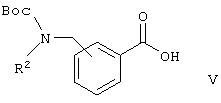
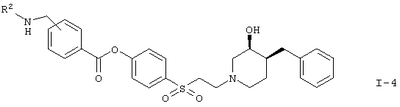
с отщеплением Вос-группы при действии TFA (трифторуксусной кислоты) с образованием соединения формулы
(д) взаимодействием соединения формулы
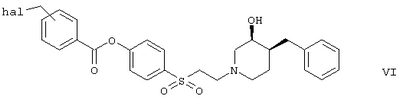
с морфолином или 4-метилпиперазином с образованием соединения формулы
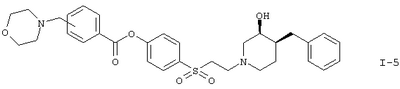
или
и при необходимости превращение полученного соединения в фармацевтически приемлемую кислотно-аддитивную соль.
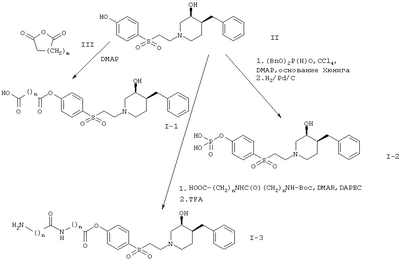
По данному способу соединение формулы I может быть получено, например, в соответствии с вариантом (а) реакции следующим образом.
К раствору соединения формулы II в растворителе, таком как метиленхлорид, прибавляют янтарную кислоту или эквивалентное соединение формулы III и DMAP (4-диметиламинопиридин). Реакционную смесь нагревают при кипении в течение нескольких часов с целью получения требуемого соединения формулы I-1.
В соответствии с вариантом (б) способа соединение, описанное в примере 11, например дибензиловый эфир, (3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]фениловый эфир фосфорной кислоты гидрируют при комнатной температуре обычным способом с целью получения соединения формулы I-2.
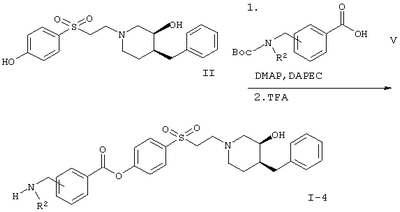
Вариант (в) способа описывает методику получения соединения формулы I-3. Способ осуществляют взаимодействием соединения формулы II с соединением формулы IV, например с 3-(3-трет.-бутоксикарбониламинопропиониламино)-пропионовой кислотой в присутствии DMAP (4-диметиламинопиридина) и DAPEC (гидрохлорида N-(3-диметиламинопропил)-N-этилкарбодиимида) при температуре примерно 0°С. Затем реакционную смесь обрабатывают TFA (трифторуксусной кислотой).
Кроме того, в соответствии с вариантом (г) реакции получают соединение формулы I-4. Реакцию осуществляют взаимодействием соединения формулы II с соединением формулы V, например с 3-[(трет.-бутоксикарбонилметиламино)метил]-бензойной кислоты, в присутствии DMAP (4-диметиламинопиридина) и DAPEC (гидрохлорида N-(3-диметиламинопропил)-N-этилкарбодиимида) и впоследствии с TFA (трифторуксусной кислотой).
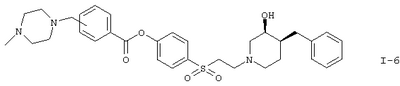
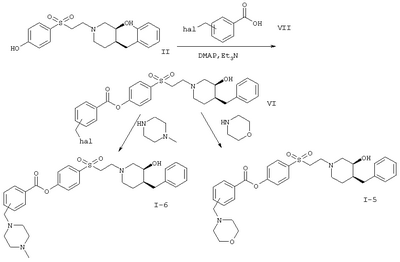
Вариант (д) способа описывает получение соединений формул I-5 или I-6. Соединение формулы VI, например (3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]фениловый эфир 4-хлорметилбензойной кислоты, обрабатывают морфолином или 4-метилпиперазином в растворителе, таком как метиленхлорид.
Образование соли проводят при комнатной температуре в соответствии с методиками, которые по существу являются известными и знакомы любому специалисту в этой области. Принимаются во внимание не только соли с неорганическими кислотами, но также и соли с органическими кислотами. Примерами таких солей являются гидрохлориды, гидробромиды, сульфаты, нитраты, цитраты, ацетаты, малеаты, сукцинаты, метансульфонаты, п-толуолсульфонаты и тому подобное.
Следующие далее схемы 1-3 иллюстрируют способ получения пролекарств формулы I более подробно. Исходное соединение формулы II (родительское соединение) может быть получено в соответствии со схемами 4-6. Соединения, представленные на этих схемах, являются известными или могут быть получены известными способами, например, в соответствии со способами, описанными в WO 00/75109.
На схемах использована следующая аббревиатура:
| DAPEC |
Гидрохлорид N-(3-диметиламинопропил)-N-этилкарбодиимида |
| DMAP |
4-Диметиламинопиридин |
| TFA |
Трифторуксусная кислота |
Схема 1
n означает 2-4 и m означает 1-3
Схема 2
hal означает галоид, такой как хлор или бром.
Схема 3
R2 означает водород или (низш.)алкил
Схема 4
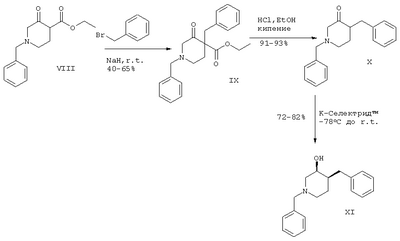
r.t. – комнатная температура
Схема 5
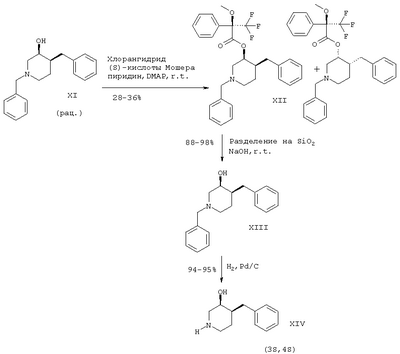
r.t. – комнатная температура
Схема 6
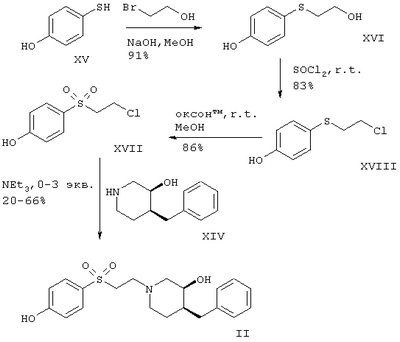
r.t. – комнатная температура
Как упоминалось ранее, соединения формулы I и их фармацевтически приемлемые аддитивные соли могут применяться в качестве пролекарств родительских соединений формулы II, которые обладают ценными фармакологическими свойствами.
Данные соединения исследованы в соответствии с тестом, приведенным ниже.
Доказательство возможности применения соединений формулы I в качестве пролекарств их родительских соединений формулы II представлено в приведенном ниже описании.
Превращение пролекарств в соответствующие родительские соединения происходит благодаря гидролитическому механизму, и в литературе имеются хорошо известные доказательства того, что подобная реакция проходит in vivo, поэтому было принято решение изучать стабильность как в плазме, так и в крови.
Описание исследования
Образцы плазмы и крови от различных особей с добавленными эквимолярными количествами (26,7 мкМ) пролекарства и родительского соединения в ДМСО инкубировали в течение различных интервалов времени (до 120 мин) при 37°С. Реакцию останавливали осаждением белка перхлорной кислотой (0,5 М) с последующим центрифугированием (5 мин при 15000 g). Было найдено, что эта методика достаточно достоверна, по крайней мере, когда анализ препарата проводят сразу после инкубации.
Концентрации образовавшегося родительского препарата в супернатанте определяли жидкостной хроматографией с масс-спектрометрией: родительское соединение вместе с его гекса-13С-меченым внутренним стандартом обогащали на улавливающей колонке стандартного внутреннего диаметра (Lichrospher 100, RP18, 5 мкм, 4×4 мм, Merck) и разделяли в изократическом режиме на аналитической колонке с уменьшенным внутренним диаметром (Symmetry Shield, RP8, 3,5 мкм, 2,1×50 мм, Waters) с помощью смеси муравьиной кислоты и метанола в качестве мобильной фазы. Весь элюент (200 мкл/мин) с аналитической колонки без разделения пропускали через турбоинтерфейс ионной форсунки. Мониторинг отобранных ионов (SIM) в режиме образования отрицательных ионов использовали для одноступенчатого квадрупольного масс-спектрометрического детектирования. Результаты выражали в процентах превращения в родительское соединение, принимая данные для родительского препарата за 100%.
В следующей таблице приведены результаты упомянутого выше исследования.
| Соединение по примеру № |
Растворимость (мкг/мл, при рН7) |
Растворимость (мкг/мл, при рН4) |
Стабильность (2 ч), плазма крыс |
Стабильность (2 ч), плазма человека |
| 1 |
7689 |
1800 |
<10% |
10% |
| 2 |
>37600 |
594 |
41% |
35% |
| 6 |
89 |
8500 |
|
|
| 7 |
|
6706 |
98% |
91% |
| 9 |
|
86600 |
100% |
100% |
| 10 |
|
26100 |
100% |
100% |
| Соединение формулы II (родительское соединение) |
47 |
7750 (рН 4,8) |
|
|
Цель подхода к созданию пролекарства состоит в повышении растворимости при рН 7,4 (физиологическое значение рН) по сравнению с родительским соединением (соединение формулы II), чтобы избежать осаждения в плазме и локальной непереносимости в месте инъекции. Повышение растворимости при физиологическом значении рН было четко достигнуто для соединения 1 и 2 и в меньшей степени для соединения 6. Соединения 7, 9 и 10 были неустойчивы при рН 7,4 в течение 24 ч, поэтому их растворимость могла быть измерена только при рН 4,0. Эти данные позволяют предположить более высокую, чем у родительского соединения, растворимость при рН 7,4 соединений 9 и 10. Растворимость соединения 7 при рН 4,0 подобна растворимости родительского соединения, но из-за наличия дополнительного заряда при рН 7,4 (для производного бензиламина вычисленное значение рКа 8,96) можно предположить более высокую растворимость при данном значении рН.
Термин «стабильность (2 ч) в плазме крысы или человека» 100% означает, что пролекарство в плазме через 2 ч полностью превратилось в родительское соединение.
По данным исследования соединения формулы I могут функционировать в качестве пролекарств своих родительских соединений формулы II.
Соединения формулы I, а также их фармацевтически приемлемые кислотно-аддитивные соли могут применяться в качестве лекарственных средств, например, в форме фармацевтических препаратов. Фармацевтические препараты могут вводиться перорально, например, в форме таблеток, таблеток с нанесенным покрытием, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Однако введение может проводиться ректально, например, в форме суппозиториев или парентерально, например, в форме инъекционных растворов.
Соединения формулы I и их фармацевтически приемлемые кислотно-аддитивные соли могут подвергаться обработке с фармацевтически инертными неорганическими или органическими наполнителями для получения таблеток, таблеток с нанесенным покрытием, драже и твердых желатиновых капсул. В качестве таких наполнителей, например, для таблеток, драже и твердых желатиновых капсул могут использоваться лактоза, кукурузный крахмал или его производные, тальк, стеариновая кислота или ее соли и т.д.
Соответствующими наполнителями для мягких желатиновых капсул являются растительные масла, воск, жиры, полутвердые и жидкие полиолы и т.д.
Соответствующими наполнителями для приготовления растворов и сиропов являются, например, вода, полиолы, сахароза, инвертный сахар, глюкоза и т.д.
Соответствующими наполнителями для инъекционных растворов являются, например, вода, спирты, полиолы, глицерин, растительные масла и т.д.
Соответствующими наполнителями для суппозиториев являются, например, природные или затвердевшие масла, воск, жиры, полужидкие или жидкие полиолы и т.д.
Кроме того, фармацевтические препараты могут содержать консерванты, солюбилизаторы, стабилизаторы, смачивающие агенты, эмульгаторы, подсластители, красители, ароматизаторы, соли для изменения осмотического давления, буферы, маскирующие агенты или антиоксиданты. Они могут также содержать и другие терапевтически ценные вещества.
Дозирование может изменяться в широких диапазонах и, безусловно, будет соответствовать индивидуальным требованиям в каждом особом случае. Как правило, в случае перорального введения суточная доза примерно 10-1000 мг на пациента соединения формулы I должна быть приемлемой, хотя при необходимости может превышать верхний предел.
Следующие далее примеры 1-17 иллюстрируют настоящее изобретение, не ограничивая его. Все температуры даны в градусах Цельсия.
Получение соединений формулы I, исходя из соединений формулы II, характеризуется в общем виде при описании вариантов а-д способа изобретения и на схемах 1-3. На этот раз получение пролекарств более подробно описывается в примерах 1-10. Примеры 11-17 описывают получение промежуточных соединений.
Пример 1
Моно{(3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]-фениловый)эфир янтарной кислоты
К раствору 1,0 г (2,66 ммоля) (3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]фенола в 25 мл метиленхлорида прибавляли 320 мг (3,2 ммоля) янтарной кислоты и 390 мг (3,2 ммоля) 4-диметиламинопиридина, реакционную смесь нагревали при кипении в течение 20 ч. Реакционную смесь концентрировали до объема 10 мл и очищали хроматографией на силикагеле, получая 100 мг (0,21 ммоль 7,4%) моно-{(3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]фенилового} эфира янтарной кислоты в виде бесцветного масла.
МС, m/z: 476,2 (М+H)+.
Пример 2
Моно {(3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]-фениловый}эфир фосфорной кислоты
Раствор 1,20 г (1,73 ммоля) дибензилового эфира, (3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]фенилового эфира фосфорной кислоты в 40 мл метанола и 6 мл воды гидрировали при комнатной температуре (20 бар, 5 ч). Реакционную смесь концентрировали до объема 20 мл и прибавляли 500 мл воды. Реакционную смесь фильтровали, и катализатор промывали водой. Фильтрат концентрировали при пониженном давлении до осаждения продукта. Затем смесь охлаждали до 0°С и по каплям прибавляли 200 мл метанола. Через 2 ч твердое вещество отделяли фильтрованием, промывали охлажденным метанолом и сушили при 60°С в высоком вакууме, получая (0,83 ммоля, 48%) моно-{(3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]фенилового} эфира фосфорной кислоты в виде бесцветных кристаллов.
МС, m/z: 454,4 (М-Н)+.
Пример 3
(3S,4S)-4-[2-(4-Бензил-3-гидроксипиперидин-1-ил)этансульфонил]фениловый эфир 4-морфолин-4-илметилбензойной кислоты
К раствору 200 мг (0,38 ммоля) (3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]фенилового эфира 4-хлорметилбензойной кислоты в 10 мл метиленхлорида прибавляли 53 мкл (0,38 ммоля) триэтиламина и 33 мкл (0,38 ммоля) морфолина. Через 16 ч реакционную смесь очищали хроматографией на силикагеле, получая 70 мг (0,12 ммоля, 32%) (3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]фенилового эфира 4-морфолин-4-илметилбензойной кислоты в виде бесцветного твердого вещества.
МС, m/z: 579,1 (M+H)+.
Следуя общей методике примера 3, получали соединения примеров 4-6.
Пример 4
(3S,4S)-4-[2-(4-Бензил-3-гидроксипиперидин-1-ил)этансульфонил]фениловый эфир 4-(4-метилпиперазин-1-илметил)бензойной кислоты
Заглавное соединение получали из (3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]фенилового эфира 4-хлорметилбензойной кислоты и 4-метилпиперазина с выходом 27% в виде бесцветного масла.
МС, m/z: 592,2 (М+Н)+.
Пример 5
Гидрохлорид (1:3) (3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]фенилового эфира 3-(4-метилпиперазин-1-илметил)бензойной кислоты
Заглавное соединение получали из (3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]фенилового эфира 3-хлорметилбензойной кислоты и 4-метилпиперазина с последующим прибавлением HCl с выходом 80% в виде бесцветного твердого вещества.
МС, m/z: 592,2 (М+H)+.
Пример 6
Гидрохлорид (1:2) (3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]фенилового эфира 3-морфолин-4-илметилбензойной кислоты
Заглавное соединение получали из (3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]фенилового эфира 3-хлорметилбензойной кислоты и морфолина с последующим прибавлением HCl с выходом 18% в виде бесцветного твердого вещества.
MC, m/z: 579,1 (М+Н)+.
Пример 7
Гидрохлорид (1:2) (3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]фенилового эфира 4-аминометилбензойной кислоты
Раствор 200 мг (3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]фенилового эфира 4-(трет.-бутоксикарбониламинометил)-бензойной кислоты в 3,8 мл трифторуксусной кислоты перемешивали при 0°С в течение 1 ч. Растворитель удаляли при пониженном давлении, неочищенный продукт разбавляли диэтиловым эфиром и прибавляли 3 капли насыщенного раствора хлористого водорода в диэтиловом эфире. Фильтрация дала 120 мг (0,22 ммоля, 67%) гидрохлорида (1:2) (3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]-фенилового эфира 4-аминометилбензойной кислоты в виде бесцветных кристаллов.
МС, m/z: 509,4 (M+H)+.
Следуя общей методике примера 7, получали соединения примеров 8-10.
Пример 8
Гидрохлорид (1:1) (3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]фенилового эфира 3-(3-аминопропиониламино)пропионовой кислоты
Заглавное соединение получали из (3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]фенилового эфира 3-(3-трет.-бутоксикарбониламинопропионил-амино)пропионовой кислоты с выходом 13% в виде бесцветного твердого вещества.
MC, m/z: 518,2(M+H)+.
Пример 9
Гидрохлорид (1:2) (3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]фенилового эфира 3-метиламинометилбензойной кислоты
Заглавное соединение получали из (3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]фенилового эфира 3-(3-трет.-бутоксикарбонилметиламинометил)-бензойной кислоты с выходом 93% в виде бесцветного твердого вещества.
МС, m/z: 523,2 (М+H)+.
Пример 10
Гидрохлорид (1:2) (3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]фенилового эфира 4-метиламинометилбензойной кислоты
Заглавное соединение получали из (3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]фенилового эфира 4-(трет.-бутоксикарбонилметиламинометил)-бензойной кислоты с выходом 94% в виде бесцветного твердого вещества.
МС, m/z: 523,2 (M+H)+.
Пример 11
Дибензиловый эфир (3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]фениловый эфир фосфорной кислоты
К раствору 500 мг (1,33 ммоля) (3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил] фенола в 20 мл ацетонитрила прибавляли 0,64 мл (6,7 ммоля) четыреххлористого углерода, 16,3 мг (0,13 ммоля) 4-диметиламинопиридина и 0,48 мл (2,9 ммоля) N,N-диизопропилэтиламина. Реакционную смесь перемешивали в течение 15 мин при комнатной температуре и прибавляли по каплям 0,43 мл (1,9 ммоля) дибензилфосфита. Через 20 мин прибавляли 20 мл насыщенного раствора бикарбоната натрия, водную фазу экстрагировали этилацетатом (3×30 мл), объединенные органические слои промывали водой, сушили над сульфатом магния, фильтровали, растворитель упаривали при пониженном давлении. Очистка технического продукта хроматографией на силикагеле (этилацетат/гексан 2:1) дала 700 мг (11 ммолей, 83%) дибензилового эфира, (3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]фенилового эфира фосфорной кислоты в виде бесцветного твердого вещества.
МС, m/z: 635,7(M+H)+.
Пример 12
(3S,4S)-4-[2-(4-Бензил-3-гидроксипиперидин-1-ил)этансульфонил]фениловый эфир 4-(трет.-бутоксикарбониламинометил)бензойной кислоты
К раствору 500 мг (1,33 ммоля) (3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил] фенола в 10 мл метиленхлорида прибавляли 368 мг (1,46 ммоля) 4-(трет.-бутоксикарбониламинометил)бензойной кислоты, 16,3 мг (0,133 ммоля) 4-диметиламинопиридина и 511 мг (2,6 ммоля) гидрохлорида N-(3-диметиламино-пропил)-N-этилкарбодиимида, реакционную смесь перемешивали при 0°С. Через 1 ч прибавляли 0,5 н. хлористоводородную кислоту, и водный слой экстрагировали метиленхлоридом. Объединенные органические слои промывали раствором 0,5 н. хлористоводородной кислоты и насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали, растворитель удаляли при пониженном давлении, получая неочищенный продукт. Кристаллизация из диэтилового эфира дала 280 мг (0,460 ммоля, 35%) (3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]фенилового эфира 4-(трет.-бутоксикарбониламинометил)-бензойной кислоты в виде бесцветных кристаллов.
МС. m/z: 609,4 (М+Н)+.
Следуя общей методике примера 12, получали соединения примеров 13-15.
Пример 13
(3S,4S)-4-[2-(4-Бензил-3-гидроксипиперидин-1-ил)этансульфонил]фениловый эфир 3-(3-трет.-бутоксикарбониламинопропиониламино)пропионовой кислоты
Заглавное соединение получали из (3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]фенола и 3-(3-трет.-бутоксикарбониламинопропиониламино)-пропионовой кислоты с выходом 13% в виде бесцветного твердого вещества.
МС, m/z: 681,2 (M+H)+.
Пример 14
(3S,4S)-4-[2-(4-Бензил-3-гидроксипиперидин-1-ил)этансульфонил]фениловый эфир 3-[(трет.-бутоксикарбонилметиламино)метилбензойной кислоты
Заглавное соединение получали из (3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]фенола и 3-[(трет.-бутоксикарбонилметиламино)метил]бензойной кислоты с выходом 70% в виде бесцветной смолы.
МС, m/z: 623,2 (М+Н)+.
Пример 15
(3S,4S)-4-[2-(4-Бензил-3-гидроксипиперидин-1-ил)этансульфонил]фениловый эфир 4-[(трет.-бутоксикарбонилметиламино)метилбензойной кислоты
Заглавное соединение получали из (3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]фенола и 4-[(трет.-бутоксикарбонилметиламино)метил]бензойной кислоты с выходом 99% в виде светло-коричневого масла.
МС, m/z: 623,2 (М+H)+.
Пример 16
(3S,4S)-4-[2-(4-Бензил-3-гидроксипиперидин-1-ил)этансульфонил]фениловый эфир 4-хлорметилбензойной кислоты
К раствору 500 мг (1,33 ммоля) (3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]фенола в 10 мл метиленхлорида прибавляли 20 мг (0,16 ммоля) 4-диметиламинопиридина, 162 мг (1,60 ммоля) триэтиламина и 302 мг (1,60 ммоля) хлорангидрида 4-хлорметилбензойной кислоты. Через 1 ч прибавляли воду, водную фазу экстрагировали метиленхлоридом (3×20 мл). Объединенные органические слои сушили над сульфатом магния, фильтровали и удаляли растворитель при пониженном давлении. Технический продукт очищали хроматографией на силикагеле, получая 280 мг (0,53 ммоля, 40%) (3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]фенилового эфира 4-хлорметилбензойной кислоты в виде бесцветной пены.
МС, m/z: 528,2 (М+Н)+.
Следуя общей методике примера 16, получали соединение примера 17.
Пример 17
(3S,4S)-4-[2-(4-Бензил-3-гидроксипиперидин-1-ил)этансульфонил]фениловый эфир 3-хлорметилбензойной кислоты
Заглавное соединение получали из (3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]фенола и хлорангидрида 3-хлорметилбензойной кислоты с выходом 80% в виде бесцветного твердого вещества.
МС, m/z: 528,1 (М+H)+.
Пример А
Таблетки следующего состава получали обычным способом.
| |
мг/таблетку |
| Пролекарство |
5 |
| Лактоза |
45 |
| Кукурузный крахмал |
15 |
| Микрокристаллическая целлюлоза |
34 |
| Стеарат магния |
1 |
| Масса таблетки |
100 |
Пример Б
Получали капсулы следующего состава.
| |
мг/капсулу |
| Пролекарство |
10 |
| Лактоза |
155 |
| Кукурузный крахмал |
30 |
| Тальк |
5 |
| Масса наполнителя капсулы |
200 |
Активное вещество, лактозу и кукурузный крахмал сначала перемешивали в смесителе, затем в измельчающем устройстве. Смесь возвращали в смеситель, добавляли к ней тальк и тщательно перемешивали. Смесью механически заполняли твердые желатиновые капсулы.
Пример В
Получали суппозитории следующего состава.
| |
|
мг/суппозиторий |
| Пролекарство |
|
15 |
| Масса суппозитория |
|
1285 |
| |
Итого |
1300 |
Массу суппозитория расплавляли в стеклянном или стальном сосуде, тщательно смешивали и охлаждали до 45°С. После этого прибавляли к ней тонко измельченное активное вещество и перемешивали до окончательного образования дисперсии. Смесь выливали в формы соответствующего размера, оставляли для охлаждения, затем суппозитории извлекали из форм и упаковывали по отдельности в вощеную бумагу или металлическую фольгу.
Формула изобретения
1. Соединения общей формулы
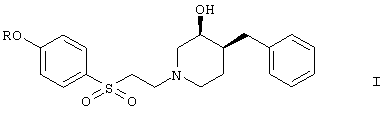
где R означает
(a) -C(O)(CH2)nC(O)ОН,
(б) 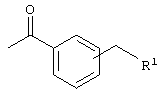
где R1 означает -N(R2)(R3) и R2/R3 каждый означает независимо друг от друга водород или (низш.)алкил, или означает циклический третичный амин, необязательно замещенный (низш.)алкилом,
(в) -Р(O)(ОН)2 или
(г) -C(O)(CH2)(CH2)nNHC(O)(CH2)nN(R2)(R3); и
n означает 1, 2, 3 или 4;
и их фармацевтически приемлемые кислотно-аддитивные соли.
2. Соединение формулы I по п.1, где R означает -С(O)(СН2)nС(O)ОН, и n означает 2.
3. Соединение по п.2, которое означает моно{(3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]фениловый}эфир янтарной кислоты.
4. Соединение формулы I по п.1, где
R означает  и и
R означает морфолинил, 4-метилпиперазинил или -N(R2)(R3), и R2/R3 каждый означает независимо друг от друга водород или (низш.)алкил.
5. Соединение по п.4, которое означает (3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]фениловый эфир 4-морфолин-4-илметилбензойной кислоты, (3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]фениловый эфир 4-(4-метилпиперазин-1-илметил)бензойной кислоты, (3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]фениловый эфир 3-(4-метилпиперазин-1-илметил)бензойной кислоты, (3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]фениловый эфир 3-морфолин-4-илметилбензойной кислоты, (3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]фениловый эфир 4-аминометилбензойной кислоты, (3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]фениловый эфир 3-метиламинометилбензойной кислоты или (3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]фениловый эфир 4-метиламинометилбензойной кислоты.
6. Соединение формулы I по п.1, где R означает -Р(O)(ОН)2.
7. Соединение по п.6, которое означает моно{(3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]фениловый}эфир фосфорной кислоты.
8. Соединение формулы I по п.1, где R означает -C(O)(CH2)2NHC(O)(CH2)2NH2.
9. Соединение по п.8, которое означает (3S,4S)-4-[2-(4-бензил-3-гидроксипиперидин-1-ил)этансульфонил]фениловый эфир 3-(3-аминопропионил-амино)пропионовой кислоты.
10. Фармацевтическая композиция для получения лекарственного средства, используемого для лечения заболеваний, связанных с блокаторами подтипа рецепторов NMDA и содержащее одно или несколько соединений формулы I, по любому из пп.1-9, и фармацевтически приемлемые наполнители.
|
|