|
|
(21), (22) Заявка: 2001132893/15, 31.05.2000
(24) Дата начала отсчета срока действия патента:
31.05.2000
(30) Конвенционный приоритет:
04.06.1999 US 60/137,815
(43) Дата публикации заявки: 10.08.2003
(45) Опубликовано: 10.03.2006
(56) Список документов, цитированных в отчете о
поиске:
WO 9527481 N, 19.10.1995. RU 2127586 C1, 20.03.1999. RU 96102844 A, 20.05.1998. SU 1158030 A3, 23.05.1985.
(85) Дата перевода заявки PCT на национальную фазу:
04.12.2001
(86) Заявка PCT:
US 00/15383 (31.05.2000)
(87) Публикация PCT:
WO 00/74650 (14.12.2000)
Адрес для переписки:
127055, Москва, а/я 11, пат.пов. Н.К.Попеленскому
|
(72) Автор(ы):
БРОДБЕК Кевин Дж. (US),
ПРЕСТРЕЛСКИ Стивен Дж. (US),
ПУШПАЛА Шамим Дж. (US)
(73) Патентообладатель(и):
ЭЛЗЭ КОПЭРЕЙШН (US)
|
(54) ИМПЛАНТИРУЕМАЯ КОМПОЗИЦИЯ (ВАРИАНТЫ) И СПОСОБ ЕЕ ПРИГОТОВЛЕНИЯ
(57) Реферат:
Изобретение относится к области медицины и фармакологии и касается имплантируемой композиции, содержащей биосовместимый носитель и частицы, включающие в себя прессованную смесь активного вещества и гидрофобного агента, выбранного из C16-C24 жирных кислот, сложных эфиров жирных кислот и их фармацевтически приемлемых солей, а также их смесей, при этом частицы диспергированы в носителе, а также способа ее приготовления. Композиция обеспечивает контролируемый выход активного вещества. 3 н. и 28 з.п. ф-лы, 6 ил., 1 табл. 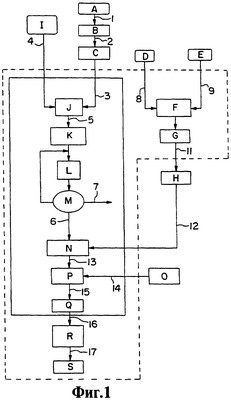
Область техники, к которой относится изобретение
Данное изобретение относится в основном к имплантируемым композициям, которые обеспечивают контролируемый выход полезного вещества. В частности, данное изобретение касается композиций носителя, такого как гель, и полезного вещества, в которых взаимодействие полезного вещества с компонентами геля или водной средой применения или растворимость в них может модулироваться объемными характеристиками геля и микросредой, ассоциированной с полезным веществом. Изобретение касается также способов приготовления композиций, соответствующих изобретению.
Уровень техники
Было описано множество систем для доставки лекарственных веществ и других полезных веществ из имплантируемых полимерных материалов. Репрезентативные патенты, относящиеся к данным системам, включают, например, Патент США No. 5085866, описывающий систему для пероральной имплантации. В Патенте США No. 5019400 описано получение микросфер с контролируемым выходом; Патент США No. 4938763 и выделенный из него Патент США No. 5278201 описывают образующиеся in-situ твердые биодеградируемые имплантаты; в Патенте США 5599552 раскрывают термопластичные и термореактивные полимерные композиции, в которых используют растворители, представленные от смешивающихся с водой до диспергирующихся в воде, такие как N-метил-2-пирролидон, что в результате приводит к образованию растворов полимеров, способных быстро поглощать воду из окружающей ткани; Патент США No. 5242910 описывает композицию с задержанным выходом, содержащую лекарственные вещества для лечения заболевания периодонта; Патент США No. 5620700 представляет матрицу, содержащую полимер и лекарственное вещество, необязательно включающую пластификаторы в количестве до приблизительно 30 мас.%, для местного применения лекарственного вещества в полости периодонта, и в Патенте США No. 5556905 описывают деградируемые термопластичные композиции, которые модифицированы пластификаторами, состоящими из различных частичных сложных эфиров лимонной кислоты.
Хорошо известно, что в имплантируемых системах часто имеются трудности в плане доставки активного вещества, особенно активного вещества, который обладает высокой растворимостью в воде, контролируемым образом в течение периода, следующего сразу за имплантацией, часто приводя к нежелательному эффекту “взрыва”, при котором высвобождается слишком много активного вещества сразу после имплантации. В области техники описаны различные композиции и способы, касающиеся данной проблемы.
Патент США No. 5759563 описывает жидкие доставляющие системы, которые могут быть использованы для образования твердых структур, в которых активное вещество инкорпорировано в компонент, обеспечивающий контролируемый выход, который затем растворяют или диспергируют в жидком компоненте или нагружают им жидкий компонент. Как описано, компонент, обеспечивающий контролируемый выход, может включать микроструктуры, макроструктуры, конъюгаты, комплексы или соли с низкой растворимостью в воде. Компонент, обеспечивающий контролируемый выход, как полагают, обеспечивает дополнительное время для выхода активного вещества, что дает возможность сделать твердый препарат без исходной потери значительной части активного вещества. Среди различных описанных компонентов, обеспечивающих контролируемый выход, в патенте раскрыто, что активное вещество может быть введено в виде конъюгата в молекулу-носитель путем ковалентного связывания активного вещества с молекулой-носителем, которая, как правило, будет представлять собой полимер, но может быть маленькой органической молекулой, такой как стеариновая кислота, которая присоединяется посредством сложноэфирной или амидной связи. В Примере 2 данного патента порошок ганиреликса ацетата получают из полисебациновой кислоты, расплавленной при 80°С для получения порошка, который, как считают, снижает “взрыв” при выходе ганиреликса ацетата относительно наблюдаемого при простом растворении ганиреликса ацетата в растворе полимолочной кислоты/N-метил-2-пирролидона.
Патент США No. 5162057 представляет покрывающие агенты для твердых препаратов, которые состоят из сложных эфиров полиглицерина и жирных кислот или содержат их. Кроме того, в патенте описано, что покрывающий агент может содержать смягчающие компоненты, такие как липиды или воски, включая в числе прочих жирные кислоты, такие как стеариновая кислота и пальмитиновая кислота, или их соли. Описано, что покрытие выполняют способом покрытия на поддоне или, альтернативно, в форме эмульсии путем расплавления и смешивания агента с другими добавками или путем нагревания с последующим смешиванием с водой для обеспечения эмульгирования. Эмульсию распыляют на поверхности твердого препарата и сушат для получения покрытого препарата.
Патент США No. 4341759 описывает покрытую частицу, имеющую снижающуюся концентрацию активного агента в направлении к поверхности частицы. В патенте описаны неактивные липофильные субстанции, такие как воски, жирные кислоты и их сложные эфиры и спирты жирных кислот, включая стеариновую кислоту, глицерилмоностеарат и цетиловый спирт для контроля скорости выхода. Покрытие описано, как нанесенное в поддоне для нанесения покрытия или в устройстве с псевдоожиженным слоем.
В Патенте США No. 4351825 описывают производство таблеток с контролируемым выходом, в которых активный агент получают в гранулированной композиции, затем смешивают с контролирующими агентами, такими как сложный эфир жирных кислот с большой молекулой, и прессуют в таблетки. Контролирующие агенты описаны, как имеющие липидную природу и присутствующие в пространствах между гранулами активного агента для того, чтобы контролировать проникновение воды в таблетку.
В статье Mesiha и соавт. “Гипогликемический эффект пероральных препаратов инсулина, содержащих Brij 35, 52, 58 или 92 и стеариновую кислоту” (“Hypoglycaemic effect of oral insulin preparations containing Brij 35, 52, 58 or 92 and stearic acid”, J. Pharm. Pharmacol., 33: 733-734, (1981)), описан расплав стеариновой кислоты со стимулятором поглощения Brij и инсулином, приготовленный при 85°С. В статье обсуждается, что мицеллы эмульгированной стеариновой кислоты могут переносить инсулин через слизистую мембрану и что гранулированные препараты стеариновой кислоты с Brij, будучи гидрофобными, могут повышать стабильность инсулина.
В статье Foldvari M. и Moreland A. “Клинические наблюдения, полученные при лечении инфекции генитального вируса папилломы инкапсулированным в липосомы интерфероном- для наружного применения” (“Clinical Observations With Topical Liposome-Encapsulated Interferon Alpha For The Treatment Of Genital Papillomavirus Infections”), Journal of Liposome Research, 7 (1): 155-126, (1977)) описана инкапсуляция для наружного применения” (“Clinical Observations With Topical Liposome-Encapsulated Interferon Alpha For The Treatment Of Genital Papillomavirus Infections”), Journal of Liposome Research, 7 (1): 155-126, (1977)) описана инкапсуляция  -интерферона-2b в многослойные липосомы, состоящие из соевого фосфатидилхолина:холестерина: стеариновой кислоты в молярном соотношении 2:1:1,4 способом выпаривания растворителя. -интерферона-2b в многослойные липосомы, состоящие из соевого фосфатидилхолина:холестерина: стеариновой кислоты в молярном соотношении 2:1:1,4 способом выпаривания растворителя.
В предшествующем уровне техники описаны различные соли жирных кислот и сложные эфиры жирных кислот, как используемые в случаях применения задержанной доставки. Например, Патент США No. 4851220 представляет маслянистый гель, который может включать гелирующие агенты, такие как сложные эфиры моно-жирной кислоты алюминия. В Патенте США No. 4650665 описана предпочтительная основа из стеарата кальция, декстрана и касторового масла. Патент США No. 5474980 представляет композиции для введения полипептидов, которые включают биосовместимое масло, приготовленное из сложных эфиров различных жирных кислот, например триглицеридов или смесей триглицеридов и жирных кислот (предпочтительно только в минорных пропорциях, например, меньше, чем приблизительно 10% свободной жирной кислоты). Патент США No. 5628993 описывает парентеральный фармацевтический препарат, образованный из основы, содержащей пептид или белок, и полиглицеринового сложного диэфира насыщенной жирной кислоты, такой как пальмитиновая кислота и стеариновая кислота.
Высокоэффективная система контроля взрывного выхода полезного вещества из имплантата описана в родственной заявке Serial No. 08/993208, поданной 18 декабря 1997 г. Данные системы основаны на композициях полимер/растворитель, которые образуют гель и контролируют скорость входа воды в объем полимерной системы, снижая таким образом взрывной выход полезного вещества, который в противном случае мог бы произойти под воздействием среды применения. Несмотря на эффективность данных систем и положительные результаты, достигнутые путем контроля объемных характеристик полимерной основы, было обнаружено, что дополнительные улучшения контролируемого выхода активного вещества могут быть достигнуты путем смешивания данных систем с полезным веществом, которое присутствует в контролируемой микросреде в геле, как описано в данном контексте.
Сущность изобретения
Изобретение представляет имплантируемые композиции, содержащие прессованные частицы полезного вещества, диспергированные в носителе, и способы их изготовления. Прессование снижает соотношение площади поверхности и массы частиц и снижает скорость растворения, дисперсию или диффузию полезного вещества при воздействии жидкостей тела в среде применения. Практическая реализация данного изобретения снижает взрывной выход полезного вещества, минимизируя таким образом потенциальные побочные эффекты и повышая способность носителя к нагрузке полезным веществом так, что доставка полезного вещества при проведении одной имплантации может продолжаться в течение длительного периода времени. Это позволяет проводить меньше имплантаций, когда должно осуществляться введение полезного вещества в течение длительного периода времени, который может выражаться в месяцах и даже годах.
В одном аспекте композиция, соответствующая изобретению, содержит носитель, например биосовместимый и биоразрушаемый вязкий гель, и частицы, содержащие прессованное полезное вещество, при этом частицы диспергированы в носителе. Частицы могут быть образованы из прессованного полезного вещества в виде монокомпонента или в смеси с фармацевтически приемлемыми инертными ингредиентами. Носитель может содержать биосовместимый полимер и быть смешанным с подходящими растворителями, как описано в данном контексте, с образованием геля.
В другом аспекте композиция, соответствующая изобретению, содержит носитель, например вязкий гель, и частицы, содержащие прессованное полезное вещество, при этом частицы диспергированы в носителе и прессованные частицы получают в смеси с агентами, которые модулируют скорость растворения полезного вещества при помещении в среду применения, или из прессованного полезного вещества в виде монокомпонента при том, что модулятор скорости растворения растворен или диспергирован в носителе, и (необязательно) с другими фармацевтически приемлемыми инертными ингредиентами. Носитель является биосовместимым и может быть биоразрушаемым.
В еще одном аспекте композиция, соответствующая данному изобретению, содержит носитель, например вязкий гель, и частицы, содержащие прессованную смесь полезного активного вещества и агента, характеризующегося низкой растворимостью в воде, при этом частицы диспергированы в носителе. Агент, характеризующийся низкой растворимостью в воде, может быть гидрофобным. Носитель является биосовместимым и может быть биоразрушаемым.
В одном аспекте гидрофобный агент может быть выбран из фармацевтически приемлемого масла, жира, жирной кислоты, сложного эфира жирной кислоты, воска или их производного и демонстрирует гидрофобное свойство. Предпочтительно, когда гидрофобный агент в композиции содержит C16-С24 жирную кислоту или ее сложный эфир или фармацевтически приемлемую соль или смеси вышеупомянутых материалов. Гидрофобный агент композиции может содержать смесь стеариновой кислоты и пальмитиновой кислоты. Обычно промышленно выпускаемую стеариновую кислоту добавляют в виде смеси стеариновой кислоты и пальмитиновой кислоты, в которой стеариновая кислота и пальмитиновая кислота, вместе взятые, составляют по меньшей мере 90 мас.% жирных кислот гидрофобного агента и стеариновая кислота составляет по меньшей мере 40 мас.% жирных кислот гидрофобного агента. В более очищенной форме стеариновая кислота и пальмитиновая кислота, вместе взятые, составляют по меньшей мере 96 мас.% жирных кислот гидрофобного агента и стеариновая кислота составляет по меньшей мере 90 мас.% жирных кислот гидрофобного агента. Имеющаяся в продаже стеариновая кислота другой степени очистки состоит из приблизительно 90 мас.% стеариновой кислоты, и остаток представлен в основном пальмитиновой кислотой.
В другом аспекте изобретения прессованные частицы вышеописанной композиции содержат порошок. Порошок может быть доведен до такого размера, что 90% или более частиц проходит через сито с меш (числом ячеек/единицу длины) 50 и остается на сите с меш 400. Часто частицы выбирают на основе того, что они проходят через сито с меш 70 и остаются на сите с меш 400. Ссылки на размер меш в данном случае и далее во всем описании соответствуют стандарту США.
Полезное вещество может быть водорастворимым или нерастворимым в воде и может быть представлено маленькой молекулой или большой молекулой. Однако преимущества изобретения могут быть наиболее эффективно реализованы в случае водорастворимых полезных веществ. В основном преимущества изобретения будут реализованы в случае нерастворимого в воде полезного вещества, если бы полезное вещество в противном случае взаимодействовало с компонентами носителя, такими как полимер или растворитель, как правило, присутствующие в вязком гелевом носителе, или с водной средой применения.
Изобретение представляет конкретный способ применения композиций, в которых полезное вещество выбрано из ДНК, кДНК, биологически активных макромолекул, белков, пептидов и полипептидов. Примерами некоторых из данных полезных веществ являются человеческий гормон роста,  -, -,  – или – или  -интерферон, эритропоэтин, глюкагон, кальцитонин, гепарин, интерлейкины, такие как интерлейкин-1, интерлейкин-2, интерлейкин-11 и интерлейкин-12, фактор VIII, фактор IX, лютеинизирующий гормон, релаксин, фолликул-стимулирующий гормон, предсердный натрийуретический фактор или филграстим. -интерферон, эритропоэтин, глюкагон, кальцитонин, гепарин, интерлейкины, такие как интерлейкин-1, интерлейкин-2, интерлейкин-11 и интерлейкин-12, фактор VIII, фактор IX, лютеинизирующий гормон, релаксин, фолликул-стимулирующий гормон, предсердный натрийуретический фактор или филграстим.
В другом аспекте изобретения композиция содержит полимер, выбранный из группы, состоящей из полилактидов, полигликолидов, поликапролактонов, полиангидридов, полиаминов, полиуретанов, полиэфирамидов, полиортоэфиров, полидиоксанонов, полиацеталей, поликеталей, поликарбонатов, полиортокарбонатов, полифосфазенов, сукцинатов, полияблочной кислоты, полиаминокислот, поливинилпирролидона, полиэтиленгликоля, полигидроксицеллюлозы, хитина, хитозана и их сополимеров, терполимеров и смесей.
В еще одном аспекте полимер может быть смешан с растворителем или системой растворителей, которая ограничивает объем поглощения воды имплантатом. Такие растворители и системы растворителей идентифицированы в данном контексте и могут включать сложные алкиловые или аралкиловые эфиры бензойной кислоты. В предпочтительных в настоящее время системах композиция содержит сополимер лактида и гликолевой кислоты (“PLGA”) и растворитель бензилбензоат или этилбензоат, в котором диспергированы частицы прессованной смеси стеариновой кислоты и полезного вещества.
В другом аспекте изобретения продолжительность выхода полезного вещества может быть удобным образом модифицирована путем соответствующего выбора растворителя для полимера. Например, в случае PLGA с человеческим гормоном роста бензилбензоат может обеспечить продолжительность выхода порядка одного месяца или более, а этилбензоат может обеспечить продолжительность выхода порядка одной недели.
В еще одном аспекте изобретение представляет композицию, содержащую биоразрушаемый носитель, включающий полимер, выбранный из полилактидов, полигликолидов, поликапролактонов, полиангидридов, полиаминов, полиуретанов, полиэфирамидов, полиортоэфиров, полидиоксанонов, полиацеталей, поликеталей, поликарбонатов, полиортокарбонатов, полифосфазенов, сукцинатов, полияблочной кислоты, полиаминокислот, поливинилпирролидона, полиэтиленгликоля, полигидроксицеллюлозы, хитина, хитозана и их сополимеров, терполимеров и смесей, и растворитель, выбранный из алкилового или аралкилового сложного эфира бензойной кислоты и частиц, содержащих прессованную смесь полезного вещества и агента, характеризующегося низкой растворимостью в воде, выбранного из группы, состоящей из фармацевтически приемлемого масла, жира, жирной кислоты, сложного эфира жирной кислоты, воска, их производного или смеси вышеперечисленных материалов, при этом частицы диспергированы в геле.
Предпочтительно, когда гидрофобный агент в композиции содержит C16-C24 жирную кислоту или сложный эфир или их фармацевтически приемлемую соль или смеси вышеперечисленных материалов. Наиболее предпочтительно, когда гидрофобный агент композиции содержит смесь стеариновой кислоты и пальмитиновой кислоты. Обычно промышленно выпускаемую стеариновую кислоту добавляют в виде смеси стеариновой кислоты и пальмитиновой кислоты, в которой стеариновая кислота и пальмитиновая кислота, вместе взятые, составляют по меньшей мере 90 мас.% жирных кислот гидрофобного агента и стеариновая кислота составляет по меньшей мере 40 мас.% жирных кислот гидрофобного агента. В более очищенной форме стеариновая кислота и пальмитиновая кислота, вместе взятые, составляют по меньшей мере 96 мас.% жирных кислот гидрофобного агента и стеариновая кислота составляет по меньшей мере 90 мас.% жирных кислот гидрофобного агента. Частицы вышеописанной композиции могут содержать порошок. Порошок может проходить через сито с меш 50 и предпочтительно, когда 90% и более частиц, содержащих порошок, проходят через сито с меш 70 и остаются на сите с меш 400.
В дополнительном аспекте изобретения представлен процесс приготовления композиций, соответствующих данному изобретению, предусматривающий прессование гранулированного или порошкового полезного вещества, необязательно смешанного с модулятором скорости растворения или агентом, характеризующимся низкой растворимостью в воде с целью получения после гранулирования прессованных частиц, содержащих активное вещество и необязательные ингредиенты. Прессование может быть осуществлено уплотнением одного полезного вещества или уплотнением смеси, в частности, может быть выполнено путем таблетирования, уплотнения валиком или экструзией через головку подходящего размера при давлениях, достаточно высоких для уплотнения материала и получения уплотненной массы. Затем уплотненную массу перемалывают или измельчают с образованием частиц прессованного материала, например гранул или частиц, измельченных до размера образования порошка. Прессованные частицы диспергируют в биосовместимом носителе с образованием имплантируемой композиции, соответствующей изобретению.
Вышеизложенное, а также другие объекты, признаки и преимущества данного изобретения будут легче пониматься после чтения следующего детального описания в сочетании с чертежами.
Перечень чертежей
На фиг.1 представлена технологическая схема, иллюстрирующая основной процесс получения композиций, соответствующих данному изобретению.
На фиг.2 представлен график, иллюстрирующий за период, измеряющийся часами, профили выхода in vitro лизоцима, полученные в емкости для растворения по USP (Фармакопея США) в среде фосфатного буфера, при 100 об/мин для трех различных композиций имплантатов, содержащих полимерный гель PLGA, в котором лизоцим присутствует в виде монокомпонента в полимерном геле (обозначено квадратами), лизоцим присутствует в виде прессованной смеси со стеариновой кислотой (обозначено треугольниками) и лизоцим присутствует в виде прессованной смеси с пальмитиновой кислотой (обозначено кругами) соответственно.
На фиг.3 представлен график, иллюстрирующий за период, измеряющийся минутами, профили выхода in vitro лизоцима, полученные в емкости для растворения по USP в среде фосфатного буфера, при 100 об/мин для трех различных композиций имплантатов, содержащих полимерный гель PLGA, в котором лизоцим присутствует в виде монокомпонента в полимерном геле (обозначено ромбами), лизоцим присутствует в виде прессованной смеси со стеариновой кислотой (обозначено квадратами) и лизоцим присутствует в виде прессованной смеси с пальмитиновой кислотой (обозначено кругами) соответственно.
На фиг.4 представлен график, иллюстрирующий за период, измеряющийся минутами, профили выхода in vitro лизоцима, полученные в емкости для растворения по USP в среде фосфатного буфера, при 100 об/мин для трех различных композиций имплантатов, содержащих полимерный гель PLGA, в котором лизоцим присутствует в виде монокомпонента в полимерном геле (обозначено черными кругами, верхняя кривая), лизоцим присутствует в виде прессованной смеси с миристиновой кислотой в соотношении 1:1 (обозначено частично закрашенными кругами), лизоцим присутствует в виде прессованной смеси со стеариновой кислотой в соотношении 1:1 (обозначено ромбами) и лизоцим присутствует в виде прессованной смеси с пальмитиновой кислотой в соотношении 1:1 (обозначено квадратами) соответственно.
На фиг.5 представлен график, иллюстрирующий выход in vivo из репрезентативной инъекционной депо-формы, как измеряют в сыворотке крыс, двух различных препаратов человеческого гормона роста (“hGH”)/стеариновой кислоты (1:1, hGH:стеариновая кислота, обозначено квадратами и 1:2 ПОН:стеариновая кислота, обозначено треугольниками) по сравнению с выходом частиц hGH в виде монокомпонента (обозначено кругами).
На фиг.6 представлен график, иллюстрирующий выход in vivo, как измеряют в сыворотке крыс, частиц человеческого гормона роста, которые получены в виде прессованных частиц со стеариновой кислотой в соответствии с описанием, приведенным в данном контексте, из геля PLGA, содержащего 2-N-метилпирролидон (обозначено ромбами), триацетин (обозначено квадратами), этилбензоат (обозначено кругами) и бензилбензоат (обозначено треугольниками) соответственно.
Сведения, подтверждающие возможность осуществления изобретения
Данное изобретение направлено на усовершенствованные композиции, используемые для системного или местного введения полезного вещества субъекту путем имплантации данному субъекту имплантируемой системы, содержащей композиции, соответствующие изобретению, и на способы приготовления данных композиций.
Определения.
Термин “AUC” означает площадь под кривой, полученной на основании проведенного у субъекта анализа in vivo при построении графика концентрации полезного вещества в плазме крови субъекта относительно времени, которую измеряют от времени имплантации композиции до времени “t” после имплантации. Время t будет соответствовать периоду доставки полезного вещества в организм субъекта.
Термин “полезное вещество” означает вещество, которое оказывает желательный полезный, часто фармакологический эффект при введении человеку или животному, либо в виде монокомпонента, либо в комбинации с другими фармакологическими наполнителями или инертными ингредиентами.
Термин “коэффициент взрывного выхода” означает касательно определенной композиции, предназначенной для системной доставки полезного вещества, частное, образующееся при делении (i) AUC, вычисленной для заданного периода времени после имплантации композиции субъекту, разделенной на число часов в заданном периоде на (ii) AUC, вычисленной для периода времени доставки полезного вещества, разделенной на число часов в полной продолжительности периода доставки. В целях ссылки на численные значения коэффициентов взрывного выхода, упоминаемых в данном контексте, заданный период будет составлять 24 часа. Однако известно, что в других вариантах применения продолжительность заданного периода может зависеть от природы полезного вещества и терапевтического применения, так что заданный период может быть коротким, но измеряемым периодом непосредственно после имплантации или представлять собой более длительный период. Однако в большинстве вариантов применения не предполагают, что более длительный период будет продолжаться более 96 часов.
Термин “прессованный” означает, касательно материала или смеси материалов, что материал или смесь материалов прессуют или уплотняют так, что его объемная плотность после прессования или уплотнения превышает значения, которые были до прессования или уплотнения. Прессование или уплотнение удобно осуществлять путем таблетирования или гранулирования вышеупомянутой смеси с использованием принятых процессов или путем уплотнения валиком или путем экструзии вышеупомянутых материалов с использованием принятых процессов.
Термин “прессованные частицы” означает касательно полезного вещества или смеси полезного вещества и модулятора скорости растворения, или смеси полезного вещества и агента, характеризующегося низкой растворимостью в воде, что частицы получены из прессованных или уплотненных частиц полезного вещества или прессованной или уплотненной смеси частиц полезного вещества и модулятора скорости растворения, или прессованной или уплотненной смеси полезного вещества и агента, характеризующегося низкой растворимостью в воде, соответственно. Прессованные частицы могут быть получены путем гранулирования из большей по размеру прессованной или уплотненной массы, такой, которая образуется при таблетировании, гранулировании, уплотнении роликом или путем операции экструзии, при измельчении массы с целью образования частиц, которые могут быть гранулами или порошком. Для целей данного изобретения частицы, как правило, имеют максимальный размер или класс крупности между от приблизительно 0,1 мкм до приблизительно 500 мкм, более часто от 5 мкм до приблизительно 400 мкм. Термин “гранулы” в основном будет относиться к частицам, имеющим средний размер, превышающий размер, характерный для порошка. Термин “частицы” включает гранулы и порошок.
Выражение “диспергированный” предназначено для того, чтобы охватывать все значения, связанные с обнаружением присутствия прессованных частиц полезного вещества или смеси полезного вещества и модулятора скорости растворения или смеси полезного вещества и агента, характеризующегося низкой растворимостью в воде, в носителе и включает дисперсию, суспензию и т.п.
Термин системный” означает касательно доставки или введения полезного вещества субъекту, что полезное вещество определяется на биологически значимом уровне в плазме крови субъекта.
Термин “местный” означает, касательно доставки или введения полезного вещества субъекту, что полезное вещество доставляется в ограниченную область тела субъекта, но не определяется на биологически значимом уровне в плазме крови субъекта.
Термин “гель” или “гелевый носитель”, который в данном контексте может быть использован взаимозаменяемо, означает композицию, образованную смесью полимера и растворителя в отсутствие полезного вещества, и охватывает, например, растворы полимеров, гидрогели, эмульсии, желатины и т.п.
Термин “пролонгированный период” означает период времени, в течение которого происходит выход полезного вещества из имплантата, соответствующего изобретению, который будет, как правило, составлять приблизительно одну неделю или более и предпочтительно приблизительно 30 дней или более, но может составлять 3 месяца или более.
Термин “исходный взрывной выход” означает касательно определенной композиции, соответствующей изобретению, частное, образующееся при делении (i) количества (по массе) полезного вещества, высвободившегося из композиции в заданный исходный период времени после имплантации, обыкновенно, в период времени от времени сразу после имплантации до периода времени до 96 часов на (ii) общее количество полезного вещества, которое должно доставляться из имплантированной композиции. Понятно, что исходный взрывной выход может варьировать в зависимости от формы и площади поверхности имплантата. Соответственно, проценты и показатели взрывного выхода, связанные с исходным взрывным выходом, описанные в данном контексте, предназначены для применения в отношении композиций, тестируемых в форме, полученной в результате выхода композиции из стандартного шприца.
Термин “стеариновая кислота” как используют в данном описании, пока по контексту на требуется иначе, означает выпускаемые в промышленности смеси стеариновой кислоты (С18H36О2) и пальмитиновой кислоты (С16Н32О2,) которые продаются в качестве стеариновой кислоты. Предпочтительно, когда содержание стеариновой кислоты в смеси является не ниже, чем 40%, и суммы двух кислот не ниже, чем 90% от смеси. Стеариновую кислоту, как правило, производят путем гидрогенизации хлопкового и других растительных масел или путем гидролиза жира при высоком давлении и высокой температуре, получая вышеупомянутую смесь.
Термин “субъект” означает касательно применения композиции, соответствующей изобретению, животное или человека.
Поскольку все растворители по меньшей мере на молекулярном уровне будут растворимыми в воде (т.е. смешивающимися с водой) до некоторой очень ограниченной степени, термин “несмешивающийся”, как используют в данном контексте, означает, что 7% или менее от массы растворителя является растворимым в воде или смешивающимся с водой. Для целей данного описания предполагают, что значения растворимости растворителя в воде определяют при 20°С. Поскольку в общем известно, что значения растворимости в том виде, как они опубликованы, не всегда могут быть определены в одних и тех же условиях, пределы растворимости, приведенные в данном контексте как процент массы, смешивающейся или растворимой в воде, могут не быть абсолютными в качестве части интервала или верхнего предела. Например, если верхний предел растворимости растворителя в воде представлен в данном контексте как “7 мас.%” и никаких дальнейших ограничений относительно растворителя не делают, то растворитель “триацетин”, который обладает указанной растворимостью в воде 7,17 г в 100 мл воды, рассматривают как включенный в предел 7%. Предел растворимости в воде меньше, чем 7 мас.%, как используют в данном контексте, не включает растворитель триацетин или растворители, обладающие растворимостью в воде, равной или большей, чем у триацетина.
Данное изобретение содержит биоразрушаемый и биосовместимый носитель, например вязкий гель, и частицы, содержащие прессованное полезное вещество, при этом частицы диспергированы в носителе. Частицы могут быть образованы из полезного вещества в виде монокомпонента или в смеси с фармацевтически приемлемыми инертными ингредиентами. Кроме того, перед прессованием полезное вещество может быть смешано с модулятором скорости растворения или агентом, обладающим низкой растворимостью в воде, таким как гидрофобный агент. Биоразрушаемый носитель может содержать полимер, как описано в данном контексте, и быть смешанным с подходящими растворителями, как описано в данном контексте, для образования вязкого геля, такого как те гели, которые ограничивают объем поглощения воды.
Прессование полезного вещества в таблетки и последующее измельчение приводит к получению частиц полезного вещества, в которых соотношение площади поверхности и массы меньше, чем в случае, когда частицы полезного вещества получают принятыми способами, такими как распылительная сушка, осаждение из раствора и т.п. Хотя снижение отношения площади поверхности к массе не может значительно снизить скорость поглощения воды, последующее растворение или диспергирование полезного вещества в исследованиях растворения in vitro, смешивание таким образом прессованных частиц с вязкими полимерными гелями, как описано в данном контексте, дает значительное снижение поглощения воды частицами по сравнению с непрессованными частицами в данных гелях.
Например, хотя непрессованные частицы hGH, образованные путем распылительной сушки, со средним диаметром частиц порядка 5 мкм могут растворяться в анализе растворения по USP в период времени порядка секунд, прессованные частицы такого же или близкого диапазона размеров могут растворяться за период порядка минут. В вязких полимерных гелях, образованных с использованием несмешивающихся растворителей, как описано в данном контексте, прессованные частицы hGH могут сохранять свою целостность и продолжать процесс растворения и диффузии из имплантата в течение периода, исчисляющегося днями или неделями. Пониженное поглощение воды в микросреде, окружающей частицы полезного вещества, модулирует или устраняет взрывной выход и создает возможность пролонгированного выхода полезного вещества из имплантата.
В целях описания способ приготовления композиций, соответствующих изобретению, будет проиллюстрирован смесями полезного вещества и одного или более агентов, проявляющих низкую растворимость в воде, таких как гидрофобные агенты. Прессованные частицы полезного вещества в виде монокомпонента, которые могут содержать фармацевтически приемлемый наполнитель, или необязательно в смеси с модулятором скорости растворения могут быть получены таким же образом, как с гидрофобными агентами за исключением устранения стадий, включающих гидрофобные агенты, в случае использования полезного вещества в виде монокомпонента. Если частицы содержат смесь полезного вещества и модуляторов скорости растворения, замена модулятора скорости гидрофобным агентом в описанном процессе, как правило, будет приводить к получению необходимого материала для дальнейшей обработки. Обычно после этого прессованные таблетки полезного вещества как в виде монокомпонента, так и в виде смеси получают принятыми способами таблетирования, таблетки измельчают или перемалывают и полученные в результате частицы разделяют по размеру с помощью сита для просеивания с целью получения частиц размера, лежащего и интервалах, описанных в других разделах данного описания. После разделения по размеру частицы смешивают с гелем и в предпочтительном варианте осуществления набирают в шприцы.
Альтернативно полезное вещество либо в виде монокомпонента, либо в виде вышеописанных смесей может быть уплотнено с помощью уплотнителя с валиком, а затем измельчено или размолото до получения частиц подходящего размера.
Соответственно, в одном варианте осуществления изобретения прессованные частицы, содержащие прессованную смесь полезного вещества и агента, характеризующегося низкой растворимостью в воде, диспергируют в имплантируемом носителе. Прессованные частицы удобно получать путем изначального таблетирования или гранулирования смеси полезного вещества и агента, характеризующегося низкой растворимостью в воде. Не будучи абсолютным требованием, является предпочтительным, когда два компонента будут тщательно перемешаны до значительной степени гомогенности, такой, что концентрация различных компонентов является в основном одинаковой во всей смеси. Для получения желательной степени перемешивания полезное вещество и агент, характеризующийся низкой растворимостью в воде, могут быть измельчены до состояния порошка, если они уже не находятся в данном состоянии, перед тем, как их смешивают.
После перемешивания смесь частиц прессуют в форме таблетки или гранулы или уплотняют валиком, или экструдируют с формированием прессованной массы, которая имеет плотность, превышающую плотность агрегации частиц смеси до стадии прессования. Удобно, когда смесь полезного вещества и агента, характеризующегося низкой растворимостью в воде, таблетируют с помощью принятого пресса для таблетирования, такого, как прессы, хорошо известные в промышленном производстве фармацевтических препаратов. Для производства в маленьких объемах может быть использован простой ручной пресс Carver. При большем объеме производства могут быть использованы автоматизированные прессы. Ряд промышленно выпускаемых прессов для таблетирования описан в Справочнике по фармацевтическим наукам Ремингтона (Remington’s Pharmaceutical Sciences), 18-oe издание, с.1647-1653 (1990), Mack Publishing Company, Easton, Pennsylvania, и включает такие прессы, как выпускаемые фирмами Stokes-Pennwalt, Manesty и др. Затем таблетированную смесь измельчают или перемалывают с образованием прессованных частиц смеси, которые могут быть просеяны через сито для сортировки с целью получения прессованных частиц желаемого диапазона размеров частиц. Как описано в других источниках, уплотняющие устройства с валиками и экструдеры могут быть использованы также для получения прессованных изделий, которые можно измельчить и перемолоть и разделить по размеру с целью получения частиц для дисперсии в носителе. Коммерческие уплотняющие устройства производятся фирмами Alexander Werk, Remsheid, Germany и Gerteis, Jona, Switzerland.
В случае полезных веществ, которые могут быть чувствительными к нагреванию, таких как белки или пептиды, которые могут быть подвержены денатурации в условиях повышенной в течение продолжительного времени температуры, выдерживаемое время прессования является относительно коротким. Следовательно, любое повышение температуры прессованной композиции во время таблетирования композиции ограничено коротким периодом времени. Кроме того, штамп и ударная сила пресса обеспечивают достаточное поглощение тепла для рассеивания тепла, которое могло бы в противном случае оказать вредное воздействие на полезное вещество. Даже при наличии подъема температуры он будет временным и не окажет вредное воздействие на полезное вещество, например белок, пептид или другую субстанцию, которая может быть чувствительной к температуре.
Затем прессованные частицы диспергируют в носителе, таком как биосовместимый полимер, который может быть биоразрушаемым. Носитель может быть твердым или полутвердым, который хирургическим путем имплантируют субъекту, или может быть приготовлен носитель для имплантации путем инъекции в виде жидкости, которая отверждается in situ, или в виде геля. В целях поддержания дисперсии частиц в носителе в случае имплантации путем инъекции применение вязкого геля является предпочтительным.
Агенты, характеризующиеся низкой растворимостью в воде и используемые в данном изобретении, могут включать анионные, катионные, амфотерные и неионные поверхностно-активные вещества, которые имеют растворимость в воде меньше, чем растворимость в воде полезного вещества, и другие гидрофобные материалы, которые не взаимодействуют вредным образом с полезным веществом и являются совместимыми с прессованием в смеси с полезным веществом. Пригодные агенты могут быть выбраны из таких поверхностно-активных веществ, которые описаны в Справочнике по фармацевтическим наукам Ремингтона (Remington’s Pharmaceutical Sciences), supra, с.267-268. В настоящее время предпочтительные агенты включают С16-С24 жирные кислоты с длинной цепью, сложные эфиры данных жирных кислот с длинной цепью, их фармацевтически приемлемые соли и смеси. Особенно предпочтительными являются стеариновая кислота, пальмитиновая кислота и миристиновая кислота, их сложные эфиры и фармацевтически приемлемые соли и смеси вышеописанных материалов. Другие агенты, которые придают гидрофобность прессованным частицам, содержащим полезное вещество, могут включать коллаген, воска, липиды, липосомы и полимерные материалы.
Модуляторы скорости растворения могут быть заменены в смеси частиц агентами, характеризующимися низкой растворимостью в воде, и отбор данного модулятора(ов) может зависеть от физико-химических характеристик полезного вещества. В некоторых условиях может быть желательным распределение модулятора скорости растворения в биоразрушаемом носителе, в котором диспергированы прессованные частицы.
Модуляторы скорости растворения были описаны в родственной заявке и опубликованных патентах и литературе и включают, например, катионы металлов, такие как описаны в Патенте США 5656297, и агенты, описанные в Патенте США 5674534, которые включены в данном контексте в виде ссылки. Кроме того, модуляторы скорости растворения могут включать материалы, которые создают эффект исключения объема и/или улавливают воду в микросреде вокруг частиц. Поскольку данные материалы притягивают воду, важно выбрать материалы, которые имеют сетевой улавливающий эффект, чтобы в микросреду вокруг частиц не проходило большее количество воды, чем имелось бы в отсутствие улавливающего материала. Как правило, это может быть определено на основании оценки общего поглощения воды смесью гелевого носителя и частиц полезного вещества, которая содержит или не содержит улавливающий материал. Данные модуляторы могут быть выбраны из моно-, ди- трикарбоновых кислот, полученных из них сложных эфиров, солей и спиртов, водорастворимых полимеров, таких как полиэтиленгликоль и полоксамеры. Могут быть использованы полиэтиленгликоли, имеющие молекулярную массу между 3000-10000 Д, но в основном предпочтительными являются более высокомолекулярные материалы. Данные модуляторы могут быть смешаны с полезным веществом известными способами, например, путем распылительной сушки, лиофилизации и покрытия на поддоне, перед стадией уплотнения.
Полезное вещество может быть любой физиологически или фармакологически активной субстанцией, необязательно в комбинации с фармацевтически приемлемыми носителями и дополнительными ингредиентами, такими как антиоксиданты, стабилизирующие агенты, компоненты, усиливающие проницаемость и т.д., которые не оказывают существенного вредного воздействия на положительные результаты, которые могут быть получены с помощью данного изобретения. Полезное вещество может быть любым из веществ, которые, как известно, доставляются в тело человека или животного и которые преимущественно растворимы в воде, а не в растворителе, в котором растворяется полимер. Данные вещества включают лекарственные агенты, медицинские средства, витамины, питательные вещества и т.п. Типы веществ, которые соответствуют данному описанию, включают низкомолекулярные соединения, биологически активные макромолекулы, белки, пептиды, генетический материал, питательные вещества, витамины, пищевые добавки, половые стерилянты (стерилизующие агенты), ингибиторы оплодотворения и стимуляторы оплодотворения.
Лекарственные вещества, которые могут быть доставлены с помощью данного изобретения, включают лекарственные вещества, которые действуют на периферические нервы, адренергические рецепторы, холинергические рецепторы, скелетные мышцы, сердечно-сосудистую систему, гладкую мускулатуру, систему кровообращения, синоптические участки, участки соединения нейрорецепторов, эндокринную и гормональную системы, иммунную систему, репродуктивную систему, скелетную систему, системы физиологически активных вещества, пищеварительную и выделительную системы, гистаминную систему и центральную нервную систему. Подходящие вещества могут быть выбраны, например, из ДНК, кДНК, белков, ферментов, гормонов, полинуклеотидов, нуклеопротеинов, полисахаридов, гликопротеинов, липопротеинов, полипептидов, стероидов, анальгетиков, местных анестезирующих средств, антибиотических веществ, противовоспалительных кортикостероидов, глазных лекарственных веществ и системных аналогов данных веществ.
Примеры лекарственных веществ, которые могут быть доставлены с помощью композиции, соответствующей данному изобретению, включают, но без ограничения перечисленным прохлорперцина эдисилат, сульфат двухвалентного железа, аминокапроновую кислоту, мекамиламина гидрохлорид, прокаинамида гидрохлорид, амфетамина сульфат, метамфетамина гидрохлорид, бензамфетамина гидрохлорид, изопротеренола сульфат, фенметразина гидрохлорид, бетанехола хлорид, метахолина хлорид, пилокарпина гидрохлорид, атропина сульфат, скополамина бромид, изопропамида иодид, тридигексетила хлорид, фенформина гидрохлорид, метилфенидата гидрохлорид, теофиллина холинат, цефалексина гидрохлорид, дифенидол, меклицина гидрохлорид, прохлорперазина малеат, фенокисбензамин, тиэтилперцина малеат, анизиндон, дифенадион, эритритила тетраитрат, дигоксин, изофлурофат, ацетазоламид, метазоламид, бензофлуметиазид, хлоропромаид, толазамид, хлормадинона ацетат, фенагликодол, аллопуринол, алюминия аспирин, метотрексат, ацетилсульфизоксазол, эритромицин, гидрокортизон, гидрокортикостерона ацетат, кортизона ацетат, дексаметазон и его производные, такие как бетаметазон, триамкинолон, метилтестостерон, 17-S-эстрадиол, этинилэстрадиол, этинилэстрадиола 3-метиловый эфир, преднизолон, 17 -гидроксипрогестерона ацетат, 19-нор-прогестерон, норгестрел, норэтиндрон, норэтистерон, нортиедерон, прогестерон, норгестерон, норэтинодрел, аспирин, индометацин, напроксен, фенопрофен, сулиндак, индопрофен, нитроглицерин, изосорбида динитрат, пропранолол, тимолол, атенолол, алпренолол, циметидин, клонидин, имипрамин, леводопа, хлорпромазин, метилдопа, дигидроксифенилаланин, теофиллин, кальция глюконат, кетопрофен, ибупрофен, цефалексин, эритромицин, галоперидол, зомепирак, лактат двухвалентного железа, винкамин, диазепам, феноксибензамин, дилтиазем, милринон, мандол, кванбенз, гидрохлоротиазид, ранитидин, флурбипрофен, фенуфен, флупрофен, толметин, аклофенак, мефенамик, флуфенамик, дифуинал, нимодипин, нитрендипин, низолдипин, никардипин, фелолдипин, лидофлазин,тиапамил, галлопамил, амлодипин, миофлазин, лизинолприл, эналаприл, эналаприлат, каптоприл, рамиприл, фамотидин, низатидин, сукралфат, этинтидин, тетратолол, миноксидил, хлордиазепоксид, диазепам, амитриптилин и имипрамин. -гидроксипрогестерона ацетат, 19-нор-прогестерон, норгестрел, норэтиндрон, норэтистерон, нортиедерон, прогестерон, норгестерон, норэтинодрел, аспирин, индометацин, напроксен, фенопрофен, сулиндак, индопрофен, нитроглицерин, изосорбида динитрат, пропранолол, тимолол, атенолол, алпренолол, циметидин, клонидин, имипрамин, леводопа, хлорпромазин, метилдопа, дигидроксифенилаланин, теофиллин, кальция глюконат, кетопрофен, ибупрофен, цефалексин, эритромицин, галоперидол, зомепирак, лактат двухвалентного железа, винкамин, диазепам, феноксибензамин, дилтиазем, милринон, мандол, кванбенз, гидрохлоротиазид, ранитидин, флурбипрофен, фенуфен, флупрофен, толметин, аклофенак, мефенамик, флуфенамик, дифуинал, нимодипин, нитрендипин, низолдипин, никардипин, фелолдипин, лидофлазин,тиапамил, галлопамил, амлодипин, миофлазин, лизинолприл, эналаприл, эналаприлат, каптоприл, рамиприл, фамотидин, низатидин, сукралфат, этинтидин, тетратолол, миноксидил, хлордиазепоксид, диазепам, амитриптилин и имипрамин.
Кроме того, примерами являются белки и пептиды, которые включают без ограничения перечисленным морфогенные белки костей, инсулин, колхицин, глюкагон,тиреостимулирующий гормон, гормоны паращитовидной железы и гипофиза, кальцитонин, ренин, пролактин, кортикотропин, тиреотропный гормон, фолликул-стимулирующий гормон, хорионический гонадотропин, гонадотропин-рилизинг гормон, бычий соматотропин, свиной соматотропин, окситоцин, вазопрессин, GRF (рилизинг-фактор гормона роста), соматостатин, липрессин, панкреозимин, лютеинизирующий гормон, LHRH (рилизинг-гормон лютеинизирующего гормона), агонисты и антагонисты LHRH, лейпролид, интерфероны, такие как интерферон  -2а, интерферон -2а, интерферон  -2b и консенсусный интерферон, и гормоны роста, такие как человеческий гормон роста и его производные, такие как метионин-человеческий гормон роста и десфенилаланин-человеческий гормон роста, бычий гормон роста и свиной гормон роста, ингибиторы оплодотворения, такие как простагландины, стимуляторы оплодотворения, факторы роста, такие как инсулиноподобный фактор роста, факторы свертывания, человеческий рилизинг-фактор гормона поджелудочной железы, аналоги и производные данных соединений и фармацевтически приемлемые соли данных соединений и их аналоги и производные. -2b и консенсусный интерферон, и гормоны роста, такие как человеческий гормон роста и его производные, такие как метионин-человеческий гормон роста и десфенилаланин-человеческий гормон роста, бычий гормон роста и свиной гормон роста, ингибиторы оплодотворения, такие как простагландины, стимуляторы оплодотворения, факторы роста, такие как инсулиноподобный фактор роста, факторы свертывания, человеческий рилизинг-фактор гормона поджелудочной железы, аналоги и производные данных соединений и фармацевтически приемлемые соли данных соединений и их аналоги и производные.
Данное изобретение имеет конкретное применение для доставки полезных веществ, выбранных из ДНК, кДНК, биологически активных макромолекул, белков, пептидов и полипептидов. Примерами некоторых из данных полезных веществ являются человеческий гормон роста,  -, -,  – или – или  -интерферон, эритропоэтин, глюкагон, кальцитонин, гепарин, интерлейкины, такие как интерлейкин-1, интерлейкин-2, интерлейкин-11 и интерлейкин-12, фактор VIII, фактор IX, лютеинизирующий гормон, релаксин, фолликул-стимулирующий гормон, предсердный натрийуретический фактор или филграстим. -интерферон, эритропоэтин, глюкагон, кальцитонин, гепарин, интерлейкины, такие как интерлейкин-1, интерлейкин-2, интерлейкин-11 и интерлейкин-12, фактор VIII, фактор IX, лютеинизирующий гормон, релаксин, фолликул-стимулирующий гормон, предсердный натрийуретический фактор или филграстим.
Данное изобретение также находит применение в сочетании с химиотерапевтическими веществами для местной доставки данных веществ с целью избежания или снижения до минимума системных побочных эффектов. Гели, соответствующие данному изобретению, которые содержат химиотерапевтические агенты, могут быть инъецированы непосредственно в ткань опухоли для задержанной доставки химиотерапевтического агента в течение времени. В некоторых случаях, в частности после резекции опухоли, гель может быть имплантирован непосредственно в получившуюся полость или может быть нанесен на оставшуюся ткань в виде покрытия. В случаях, когда гель имплантируют после хирургической операции, возможно использовать гели, имеющие более высокую вязкость, поскольку они не должны проходить через иглу маленького диаметра. Репрезентативные химиотерапевтические агенты, которые могут бытьдоставлены всоответствии с практической реализацией данного изобретения, включают, например, карбоплатин, цисплатин, паклитаксел, BCNU (дихлорэтилнитромочевина), винкристин, камптотецин, этопозид, цитокины, рибозимы, интерфероны, олигонуклеотиды и олигонуклеотидные последовательности, которые ингибируют трансляцию или транскрипцию опухолевых генов, функциональные производные вышеуказанных материалов и в основном известные химиотерапевтические агенты, такие, как описаны в Патенте США 5651986. Данная заявка имеет особое применение в задержанной доставке водорастворимых химиотерапевтических агентов, таких как, например, цисплатин и карбоплатин, и водорастворимых производных паклитаксела. Те характеристики изобретения, которые снижают до минимума взрывной эффект, являются особенно полезными при применении водорастворимых полезных веществ всех видов, но в особенности тех соединений, которые имеют клиническое применение и являются эффективными, но могут иметь вредные побочные эффекты.
В той мере, в которой они не упоминались выше, могут быть также использованы полезные вещества, описанные в вышеуказанном Патенте США No. 5242910. Одним из определенных преимуществ данного изобретения является то, что материалы, такие как белки, что показано на примере фермента лизоцима, а также кДНК и ДНК, инкорпорированные в векторы как вирусной, так и невирусной природы, которые трудно микроинкапсулировать или обработать с получением микросфер, могут быть введены в композиции, соответствующие данному изобретению без получения уровня деградации, обусловленного обработкой высокими температурами и денатурирующими растворителями, часто присутствующими в других технологиях обработки.
Полезное вещество может быть получено в виде порошка или, если оно представлено жидкостью, оно может быть инкорпорировано в пористую твердую частицу, такую как безводный фосфат кальция, который имеется в продаже под торговым названием Fujicalin фирмы Fuji Chemical Industries (U.SA) Inc., Engelwood, New Jersey, или порошок алюмометасиликата магния, имеющийся в продаже под торговым названием Neusilin фирмы Fuji Chemical Industry Co., Ltd., Toyam, Japan.
Частицы полезного вещества, пригодные для сжатия, имеют средний размер частиц от приблизительно 0,1 до приблизительно 200 мкм, предпочтительно от приблизительно 1 до приблизительно 100 мкм и часто от 1 до 50 мкм и наиболее предпочтительно 2-10 мкм. Для получения частиц полезных веществ различных размеров могут быть использованы принятые процессы лиофилизации с применением соответствующих циклов замораживания и сушки.
Имплантируемый носитель для полезного вещества может быть получен в виде геля. Гель может быть вязким и образованным из полимера. Гель может быть образован из компонентов так, что объем поглощения воды в имплантате также является ограниченным. Предпочтительная система носителя включает такие системы, которые были детально описаны в одновременно рассматриваемой заявке Serial No. 08/993208, поданной 18 декабря 1997 г. и соответствующей ей заявке РСТ, имеющей номер международной публикации WO 98/26359 и дату международной публикации 2 июля 1998 г. Опубликованная заявка может быть отнесена к деталям систем объемных полимеров, которые являются особенно эффективными в сочетании с данным изобретением. Однако могут быть также использованы другие полимерные системы.
Полимер, растворитель и другие агенты, соответствующие изобретению, должны быть биосовместимыми; это означает, что они не должны вызывать нежелательное раздражение или некроз в среде применения. Средой применения является жидкая окружающая среда, которая может содержать подкожный или внутримышечный участок или полость тела человека или животного.
Полимеры, которые могут быть использованы в изобретении, могут быть биоразрушаемыми и могут включать без ограничения перечисленным полилактиды, полигликолиды, поликапролактоны, полиангидриды, полиамины, полиуретаны, полиэфирамиды, полиортоэфиры, полидиоксаноны, полиацетали, поликетали, поликарбонаты, полиортокарбонаты, полифосфазены, сукцинаты, полияблочную кислоту, полиаминокислоты, поливинилпирролидон, полиэтиленгликоль, полигидроксицеллюлозу, хитин, хитозан и их сополимеры, терполимеры и смеси.
Предпочтительные в настоящее время полимеры представляют собой полилактиды, что означает полимер на основе молочной кислоты, который может базироваться только на молочной кислоте или может быть сополимером на основе молочной кислоты и гликолевой кислоты, которые могут включать маленькие количества других сомономеров, существенно не влияющих на положительные результаты, которые могут быть достигнуты в соответствии с данным изобретением. Как используют в данном контексте, термин “молочная кислота” включает изомеры L-молочную кислоту, D-молочную кислоту, DL-молочную кислоту и лактид, тогда как термин “гликолевая кислота” включает гликолид. Наиболее предпочтительными являются сополимеры лактида и гликолида, обычно обозначаемые PLGA. Полимер может иметь соотношение мономеров молочной кислоты/гликолевой кислоты от приблизительно 100:0 до приблизительно 15:85, предпочтительно от приблизительно 60:40 до приблизительно 75:25, и особенно эффективный сополимер имеет соотношение мономеров молочной кислоты/гликолевой кислоты приблизительно 50:50.
Полимер на основе молочной кислоты имеет среднечисленную молекулярную массу от приблизительно 1000 до приблизительно 120000, предпочтительно от приблизительно 5000 до приблизительно 30000, как определено с помощью газовой хроматографии. Как указано в вышеупомянутом Патенте США No. 5242910, полимер может быть получен согласно описанию, приведенному в Патенте США No. 4443340. Альтернативно, полимер на основе молочной кислоты может быть получен непосредственно из молочной кислоты или смеси молочной кислоты и гликолевой кислоты (с использованием или без использования дополнительного сомономера) в соответствии с описанием, приведенным в Патенте США No. 5310865. Содержание всех данных патентов введено в виде ссылки.
Подходящие полимеры на основе молочной кислоты производятся в промышленности. Например, сополимеры, содержащие 50:50 молочной кислоты: гликолевой кислоты, имеющие молекулярные массы 5000, 10000, 30000 и 100000, предпочтительно приблизительно от 8000 до 13000 и наиболее предпочтительно приблизительно 10000, а также широкий круг концевых групп для изменения чувствительности к гидролизу и последующему разрыву полимерной цепи имеются в фирме Boehringer Ingelheim (Petersburg, VA). Дополнительные полимеры включают, например, сополимер D,L-лактида и гликолида 50:50 RESOMER® L104, PLGA-L104, кодовый номер 33007, сополимер D,L-лактида и гликолида 50:50 RESOMER® RG206, PLGA-206, кодовый номер 8815, сополимер D,L-лактида и гликолида 50:50 RESOMER® RG502, PLGA-502, код 0000366, сополимер D,L-лактида и гликолида 50:50 RESOMER® RG502H, PLGA-502H, кодовый номер 260187, сополимер D,L-лактида и гликолида 50:50 RESOMER® RG503, PLGA-503, кодовый номер 0080765, сополимер D,L-лактида и гликолида 50:50 RESOMER® RG506, PLGA-506, кодовый номер 95051, сополимер D,L-лактида и гликолида 50:50 RESOMER® RG755, PLGA-755, кодовый номер 95037 (Boehringer Ingelheim Chemicals, Inc., Petersburg, VA).
Биосовместимый полимер присутствует в композиции геля в количестве, лежащем в интервале от приблизительно 5 до приблизительно 80 мас.%, предпочтительно от приблизительно 30 до приблизительно 70 мас.% и часто от 40 до 60% от массы вязкого геля, где вязкий гель содержит объединенные количества биосовместимого полимера и растворителя. Растворитель будет добавляться к полимеру в количествах, описанных в данном контексте, для получения имплантируемого или инъекционного вязких гелей.
Растворитель должен быть биосовместимым и предпочтительно должен образовывать вязкий гель с полимером и ограничивать поступление воды в имплантат. Растворитель может быть представлен одним растворителем или смесью растворителей, проявляющих вышеописанные свойства. Термин “растворитель”, пока специально не указано иначе, означает один растворитель или смесь растворителей. В данном изобретении может быть использован широкий круг растворителей. Могут быть использованы водорастворимые растворители, включая хорошо-, умеренно- или плохо растворимые, а также растворители, которые имеют настолько ограниченную растворимость, что могут рассматриваться как нерастворимые или не смешивающиеся с водой. Поскольку данное изобретение создает микросреду, окружающую полезное вещество, которая имеет тенденцию задерживать поглощение воды вблизи полезного вещества и им самим, могут быть использованы растворители для полимера, которые растворяются в воде, несмотря на то, что ранее данные растворители не могли быть предпочтительными. Данные растворители могут включать, например, но без ограничения перечисленным, триацетин, диацетин, трибутирин, сложные эфиры лимонной кислоты, такие как триэтилцитрат, трибутилцитрат, ацетилтриэтилцитрат и ацетилтрибутилцитрат, триэтилглицериды, триэтилфосфат, диэтилфталат, диэтилтартрат, минеральное масло, полибутен, кремнийорганическую жидкость, глицерин, этиленгликоль, полиэтиленгликоль, октанол, этиллактат, пропиленгликоль, пропиленкарбонат, этиленкарбонат, бутиролактон, этиленоксид, пропиленоксид, N-метил-2-пирролидон, 2-пирролидон, глицеролформаль, метилацетат, этилацетат, метилэтилкетон, диметилформамид, диметилсульфоксид, тетрагидрофуран, капролактам, децилметилсульфоксид, олеиновую кислоту и 1-додецилазацикло-гептан-2-он и их смеси.
В настоящее время предпочтительно контролировать объем поглощения воды имплантатом путем использования растворителей, которые существенно ограничивают поглощение воды имплантатом. Некоторые растворители могут характеризоваться как не смешивающиеся с водой, т.е. имеющие растворимость в воде меньше, чем 7 мас.%. Предпочтительно, когда растворители имеют растворимость в воде пять процентов или меньше, более предпочтительно растворимость в воде три процента или меньше и даже более предпочтительно растворимость в воде один процент или меньше. Наиболее предпочтительно, когда растворимость растворителя в воде равна или меньше 0,5 мас.%.
Растворители, имеющие вышеупомянутые параметры растворимости, могут быть выбраны из сложных эфиров низшего алкила и аралкила и ариловых кислот, таких как бензойная кислота, фталевые кислоты, салициловая кислота, сложные эфиры низших алкилов и лимонной кислоты, такие как триэтилцитрат и трибутилцитрат и т.п., а также арил-, аралкил- и низших алкилкетонов. Среди предпочтительных растворителей находятся растворители, имеющие растворимость, лежащую в вышеуказанном диапазоне, выбранные из (i) соединений, имеющих следующие структурные формулы:
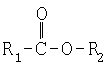
и (i)
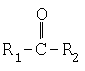
в которых R1 – арил или аралкил, R2 – низший алкил или аралкил и R1 и R2 необязательно являются одинаковыми или разными при условии, что, если каждое из R1 и R2 представлено низшим алкилом, то общее число атомов углерода в R1 вместе с R2 составляет 4 или больше, и (ii) сложного эфира низшего алкила и аралкила и фталевой кислоты, изофталевой кислоты и терефталевой кислоты и (iii) сложного эфира низшего алкила и аралкила и лимонной кислоты. Для целей данного изобретения низкий алкил означает углеводороды с неразветвленной или разветвленной цепью, имеющие 1-6 атомов углерода, необязательно замещенные немешающими заместителями; аралкил означает низший алкилфенил, например бензил, фенетил, 1-фенилпропил, 2-фенилпропил и т.п., где структура алкила содержит 1-6 атомов углерода, и арил означает фенил, необязательно замещенный немешающими заместителями. Многие из растворителей, используемых в изобретении, выпускаются в промышленности (Aldrich Chemicals, Sigma Chemicals) или могут быть приготовлены путем обычной этерификации соответствующих арилалкановых кислот с использованием галидов кислот и (необязательно) катализаторов этерификации, таких, как описаны Патенте США No. 5556905, который включен в данном контексте в виде ссылки, и, в случае кетонов, путем окисления соответствующих исходных вторичных спиртов.
Известные в области техники производные бензойной кислоты, из которых могут быть выбраны растворители, имеющие необходимую растворимость, включают 1,4-циклогекасандиметанолдибензоат, диэтиленгликольдибензоат, полипропиленгликольдибензоат, пропиленгликольдибензоат, смесь диэтиленгликольбензоата и дипропиленгликольбензоата, полиэтиленгликоль (200) дибензоат, изодецилбензоат, неопентилгликольдибензоат, глицерилтрибензоат, пентаэритритолтетрабензоат, кумилфенилбензоат, триметилпентандиолдибензоат.
Известные в области техники производные фталевой кислоты, из которых могут быть выбраны растворители, имеющие необходимую растворимость, включают алкилбензилфталат, бис-кумилфенилизофталат, дибутоксиэтилфталат, диметилфталат, диэтилфталат, дибутилфталат, диизобутилфталат, бутилоктилфталат, диизогептилфталат, диизоноилфталат, нонилундецилфталат, диоктилфталат, диизооктилфталат, дикаприлфталат, смесь спиртов фталата, ди-(2-этилгексил)фталат, линейный гептилнонилфталат, линейный гептилнонилундецилфталат, линейный нонилфталат, линейный нонилундецилфталат, линейный диноилдидецилфталат (диизодецилфталат), диундецилфталат, дитридецилфталат, ундецилдодецилфталат, децилтридецилфталат, смесь (50/50) диоксил и дидецилфталатов, бутилбензилфталат и дициклогексилфталат.
Предпочтительные растворители включают сложные эфиры низших алкилов и аралкилов и ариловых кислот, описанных выше. Репрезентативные кислоты представлены бензойной кислотой и фталевыми кислотами, такими как фталевая кислота, изофталевая кислота и терефталевая кислота. Наиболее предпочтительными растворителями являются производные бензойной кислоты, и они включают без ограничения перечисленным метилбензоат, этилбензоат, н-пропилбензоат, изопропилбензоат, бутилбензоат, изобутилбензоат, втор-бутилбензоат, трет-бутилбензоат, изоамилбензоат и бензилбензоат, при этом бензилбензоат является наиболее особенно предпочтительным. Предпочтительными смесями растворителей являются смеси, в которых бензилбензоат представляет собой основной растворитель, и смеси, образованные бензилбензоатом и либо триацетином, либо трибутилцитратом, триэтилцитратом или N-метил-2-пирролидоном. Предпочтительные смеси представлены смесями, в которых бензилбензоаты присутствуют в количестве 50% по массе или больше, более предпочтительно 60% или больше и наиболее предпочтительно 80% или больше от общего количества присутствующего растворителя. Особенно предпочтительными смесями являются смеси 80/20 по массе бензилбензоата/триацетина и бензилбензоата/N-метил-2-пирролидона.
Дополнительные растворители могут включать диэтилтартрат, диэтилмалеат, метилсалицилат, р-анизальдегид, фенилацетат, бензилсалицилат, бензилацетат, метилфенилацетат, анизол и диэтилмалонат.
Было обнаружено, что вышеописанные растворители, имеющие смешиваемость с водой меньше, чем 7 мас.%, могут быть смешаны с одним или более дополнительных смешивающихся растворителей (“многокомпонентные растворители”). Многокомпонентные растворители, совместимые и смешивающиеся с основным растворителем, могут иметь более высокую смешиваемость с водой, и полученные смеси могут все еще значительно ограничивать поглощение воды имплантатом. Данные смеси будут называться “многокомпонентные смеси растворителей”. Эффективные многокомпонентные смеси растворителей могут обладать растворимостью в воде, превышающей растворимость основных растворителей как таковых, как правило, от 0,1 мас.% и до 50 мас.% включительно, предпочтительно до 30 мас.% включительно и наиболее предпочтительно до 10 мас.% включительно, не оказывая вредного воздействия на ограничение поглощения воды, которое проявляют имплантаты, соответствующие изобретению. Особенно предпочтительными являются многокомпонентные смеси растворителей, имеющие растворимость в воде от приблизительно 0,1% до 7% по массе.
Многокомпонентные растворители, используемые в многокомпонентных смесях растворителей, представляют собой такие растворители, которые смешиваются с основным растворителем или смесью растворителей и включают без ограничения перечисленным триацетин, диацетин, трибутирин, триэтилцитрат, трибутилцитрат, ацетилтриэтилцитрат, ацетилтрибутилцитрат, триэтилглицериды, триэтилфосфат, диэтилфталат, диэтилтартрат, минеральное масло, полибутен, креминийорганическую жидкость, глицерин, этиленгликоль, полиэтилденгликоль, октанол, этиллактат, пропиленгликоль, пропиленкарбонат, этиленкарбонат, бутиролактон, этиленоксид, пропиленоксид, N-метил-2-пирролидон, 2-пирролидон, глицеролформаль, метилацетат, этилацетат, метилэтилкетон, диметилформамид, диметилсульфоксид, тетрагидрофуран, капролактам, децилметилсульфоксид, олеиновую кислоту и 1-додецилазацикло-гептан-2-он и их смеси.
В особенно предпочтительном варианте осуществления растворитель выбран из сложных эфиров низшего алкила и аралкила бензойной кислоты и полимер представляет собой полимер на основе молочной кислоты, наиболее предпочтительно PLGA, имеющий среднечисленную молекулярную массу между приблизительно от 8000 до приблизительно 13000, предпочтительно до 10000. В настоящее время наиболее предпочтительными растворителями являются бензилбензоат и сложные эфиры низших алкилов и бензойной кислоты, особенно этилбензоат. Гели на основе PLGA/бензилбензоата имеют периоды доставки порядка месяца или более длительного срока. Периоды доставки порядка одной недели наблюдаются при использовании гелей на основе PLGA/этилбензоата, гелей на основе бензилбензоата и этилбензоата, имеющих практически одинаковые композиции за исключением отличия по растворителю. Изменение периода доставки является полезным инструментом для практикующего врача. Например, гели PLGA/этилбензоат/человеческий гормон роста (“hGH”), приготовленные в соответствии с процедурами, описанными в данном контексте, обеспечивают доставку hGH в течение приблизительно одной недели. Характер доставки может быть полезным при лечении педиатрических пациентов, когда желателен тщательный мониторинг роста пациента и введение hGH может быть прекращено или начато при необходимости и без неудобства, причиняемого ежедневными инъекциями. Сложные эфиры бензойной кислоты могут быть использованы в виде монокомпонента или в смеси с другими смешивающимися растворителями, например триацетином, как описано в данном контексте.
Имплантаты предпочтительно готовят из вязких гелей, в которых прессованные частицы полезного вещества, смеси полезного вещества и модулятора скорости растворения или смеси полезного вещества и агента, характеризующегося низкой растворимостью в воде, диспергированы практически во всем объеме, и данные композиции используют как для системного, так и для местного введения независимо от того, принимается ли во внимание важность исходного взрывного выхода. Как правило, прессованные частицы будут вводиться в гелевый носитель в концентрации 0,1-50 мас.%, предпочтительно в концентрации 1-20 мас.%. Кроме того, применение сложных эфиров бензойной кислоты обеспечивает повышенный контроль перемещения воды, приводя к повышенной стабильности полезного вещества. Низкой уровень поглощения воды, т.е. ограниченное движение воды в гелевую композицию после имплантации, позволяет субъекту, реализующему изобретение на практике, ограничить диффузионный перенос полезного вещества и усилить контроль профиля доставки полезного вещества путем контроля характеристик биоэрозии полимера. Предпочтительные композиции позволяют нагрузить полимер полезным веществом на уровнях, которые превышают требующиеся для насыщения воды полезным веществом, что таким образом облегчает достижение нулевого уровня выхода полезного вещества, если это желательно. Кроме того, предпочтительные композиции могут обеспечить получение вязких гелей, которые имеют температуру стеклования ниже, чем 37°С, так что гель сохраняется в нежестком состоянии в период времени после имплантации, составляющий 24 часа или более.
Растворитель или смесь растворителей способны растворять полимер с образованием вязкого геля, который может поддерживать прессованные частицы полезного вещества, диспергированные в нем, и изолировать от среды применения до высвобождения. Композиции, соответствующие данному изобретению, обеспечивают образование имплантатов, имеющих низкий коэффициент взрывного выхода. Поглощение воды в микросреде полезного вещества можно контролировать, используя прессованные частицы полезного вещества, как описано в данном контексте, и в микросреде имплантата путем использования растворителя или многокомпонентной смеси растворителей, которые солюбилизируют или пластифицируют полимер, но существенно ограничивают объем поглощения воды имплантатом.
Желательный предел количества полезного вещества, высвобождающегося в первые 24 часа, которое является либо желательным, либо необходимым, будет зависеть от таких условий, как общая продолжительность периода доставки, терапевтическое окно полезного вещества, потенциальное вредное последствие, обусловленное передозировкой, стоимость полезного вещества и тип ожидаемого эффекта, например, системный или местный. Предпочтительно, когда 20% или менее полезного вещества будет высвобождаться в первые 24 часа после имплантации, где процент основывается на общем количестве полезного вещества, которое должно быть доставлено в течение периода доставки. Как правило, могут переноситься более высокие проценты высвобождения, если продолжительность периода доставки является относительно более короткой, например меньше 7-14 дней, или если полезное вещество имеет широкое терапевтическое окно при меньшей вероятности появления побочных эффектов, или если полезное вещество имеет местное действие.
Композиции, соответствующие данному изобретению, предназначенные для системной доставки, могут служить для получения гелевой композиции, имеющей коэффициент взрывного выхода 8 или меньше, предпочтительно 6 или меньше, более предпочтительно 4 или меньше и наиболее предпочтительно 2 или меньше. Композиции, предназначенные для местной доставки полезного вещества, получают таким же образом, так соединения, предназначенные для системного применения. Однако, поскольку местная доставка полезного вещества субъекту не будет в результате приводить к определяемым уровням полезного вещества в плазме, данные системы должны характеризоваться процентом полезного вещества, высвободившегося за определенный исходный период, а не коэффициентом взрывного выхода, как описано в данном контексте. Наиболее типичным является, когда период будет представлен первыми 24 часами после имплантации и процент будет равен количеству массы полезного вещества, предназначенного для доставки в течение периода доставки, умноженному на число 100. Композиции, соответствующие данному изобретению, могут иметь исходные взрывные выходы 20% или менее, предпочтительно 15% или меньше, более предпочтительно 10% или меньше для большинства применений. Системы имплантатов, имеющие исходные взрывные выходы 5% или меньше, часто являются предпочтительными.
Растворитель или смесь растворителей, как правило, присутствует в количестве от приблизительно 95 до приблизительно 20 мас.% вязкого геля, т.е. объединенной массы полимера и растворителя. Он может присутствовать предпочтительно в количестве от приблизительно 70 до приблизительно 30 мас.% и часто 60-40 мас.% вязкого геля, т.е. объединенной массы полимера и растворителя. Вязкий гель, образованный смешиванием полимера и растворителя, как правило, имеет вязкость от приблизительно 100 до приблизительно 200000 Па·с, предпочтительно от приблизительно 500 до приблизительно 5000 Па·с, измеренных при скорости сдвига 1,0 сек.-1 и 25°С при использовании вискозиметра Haake через приблизительно 1-2 дня после окончания перемешивания.
Перемешивание полимера с растворителем может достигаться с помощью принятого оборудования с низким уровнем сдвига, таким как двойная планетарная мешалка Ross в течение от приблизительно 10 минут до приблизительно 12 часов, часто в течение приблизительно 1-4 часов, хотя компетентный специалист в данной области может выбрать более короткие и длительные периоды в зависимости от конкретных физических характеристик приготавливаемой композиции. Может быть использовано осторожное нагревание смеси полимер/растворитель, например, до приблизительно 40°С с целью уменьшения времени растворения полимера.
Поскольку часто бывает желательным введение имплантата в виде инъекционной композиции, противоположное мнение при получении имплантатов, представленных вязкими гелями, состоит в том то, композиция полимер/растворитель/полезное вещество имеет достаточно низкую вязкость, чтобы дать возможность протолкнуть ее через маленький диаметр, например, иглы 18-20 размера. При необходимости доведение вязкости геля для инъекций может быть осуществлено с помощью эмульгаторов, таких как описаны в данном контексте. Кроме того, данные композиции должны обладать адекватной стабильностью в плане размеров, чтобы сохранять локализацию и чтобы их можно было удалить, если это необходимо. Конкретные гелевые или подобные гелевым композиции, соответствующие данному изобретению, удовлетворяют таким требованиям.
Если полимерная композиция предназначена для введения в виде инъекционного геля, уровень растворимости полимера должен будет уравновешиваться вязкостью полученного геля, чтобы обеспечить выход геля из иглы с применением умеренного усилия и приемлемый потенциальный эффект взрывного выхода. Гели с высокой вязкостью обеспечивают доставку полезного вещества без проявления сильного эффекта взрывного выхода, но создают трудности при прохождении геля через иглу. В данных случаях в композицию может быть (необязательно) добавлен эмульгирующий агент. Кроме того, поскольку вязкость в основном уменьшаться по мере повышения температуры композиции, при ряде применений может быть целесообразным снижение вязкости геля путем нагревания с целью получения композиции, легко вводимой инъекционным путем. Дополнительно или альтернативно гель может быть перемешан перед инъекцией с целью создания сдвигающего усилия (разжижения) в геле и снижения вязкости, которая может возрастать при хранении.
Характеристики разжижения гелевых депо-композиций, соответствующих данному изобретению, обычно являются удовлетворительными и, как правило, позволяют легко инъецировать гели животным, включая человека, при использовании игл стандартного размера без необходимости применения чрезмерного давления при введении.
Эмульгирующий агент, если его используют, как правило, присутствует в количестве, находящемся в интервале от приблизительно 5 до приблизительно 80%, предпочтительно от приблизительно 20 до приблизительно 60% и часто от 30 до 50% от массы, основываясь на количестве инъекционной депо-композиции геля, куда входят объединенные количества полимера, растворителя, эмульгирующего агента и полезного вещества. Эмульгирующие агенты включают, например, растворители, которые не полностью смешиваются с полимерным растворителем или смесью растворителей. Иллюстративными эмульгирующими агентами являются вода, спирты, многоатомные спирты, сложные эфиры, карбоновые кислоты, кектоны, альдегиды и их смеси. Предпочтительными эмульгирующими агентами являются вода, спирты, пропиленгликоль, этиленгликоль, глицерин, вода и их растворы и смеси. Особенно предпочтительными являются вода, этанол и изопропиловый спирт, а также их растворы и смеси. Тип эмульгирующего агента влияет на размер диспергированных капель. Например, с этанолом будут образовываться капли, имеющие средние диаметры, которые могут быть порядка в десять раз крупнее, чем капли, полученные с изотоническим солевым раствором, содержащим 0,9 мас.% хлорида натрия при 21°С.
Поскольку системы имплантатов, соответствующие данному изобретению, предпочтительно образуются в виде вязких гелей, средства для введения имплантатов не ограничиваются инъекций, хотя данный способ доставки часто может быть предпочтительным. Если имплантат будет вводиться как остающийся в организме продукт, он может быть сделан так, чтобы соответствовать полости тела, имеющейся после окончания хирургической операции, или может быть использован в виде текучего геля путем нанесения геля с помощью тампона или шпателя на оставшуюся ткань или кость. Данные способы применения могут обеспечить введение полезного вещества в гель в концентрациях, превышающих обычно имеющиеся в инъекционных композициях.
Для образования суспензии или дисперсии частиц полезного вещества в вязком геле, образованном из полимера и растворителя, может быть использовано любое принятое устройство с низким уровнем сдвига, такое как двойная планетарная мешалка Ross, при комнатной температуре. Таким образом может быть достигнуто эффективное распределение полезного вещества практически без разложения полезного вещества.
Полезное вещество, как правило, растворяют или диспергируют в композиции в количестве от приблизительно 1 до приблизительно 50 мас.%, предпочтительно в количестве от приблизительно 5 до приблизительно 30% и часто 10-20 мас.% от общего количества полимера, растворителя и полезного вещества. В зависимости от количества полезного вещества, присутствующего в композиции, можно получить различные профили выхода и коэффициенты взрывного выхода. В частности, для данного полимера и растворителя путем подбора количеств данных компонентов и количества полезного вещества можно получить профиль выхода, который более зависит от разложения полимера, чем от диффузии полезного вещества из композиции и наоборот. В этом плане при более низких уровнях нагрузки полезного вещества в основном получают профиль выхода, отражающий разложение полимера, где скорость выхода повышается стечением времени. При более высоких уровнях нагрузки получают профиль выхода, представляющий диффузию полезного вещества, где скорость выхода со временем снижается. При промежуточных уровнях нагрузки получают комбинированные профили выхода так, что, если желательно, может быть получена практически постоянная скорость выхода. С целью минимизации взрывного выхода предпочтительной является нагрузка полезного вещества порядка 30% или меньше от массы всей гелевой композиции, т.е. полимера, растворителя и полезного вещества, и нагрузка 20% или меньше является более предпочтительной.
Скорости выхода и нагрузка полезного вещества будут подбираться так, чтобы обеспечить терапевтически эффективную доставку полезного вещества в течение предназначенного задержанного периода доставки. Полезное вещество может присутствовать в полимерном геле в концентрациях, которые превышают концентрацию насыщения полезного вещества в воде, образуя резервуар лекарственного вещества, из которого выходит полезное вещество. Поскольку скорость выхода полезного вещества зависит от определенных условий, таких как применяемое полезное вещество, могут быть получены скорости выхода порядка от приблизительно 0,01 мкг/день до приблизительно 100 мг/день, предпочтительно от приблизительно 0,1 до приблизительно 10 мг/день в течение от приблизительно 7 до приблизительно 90 дней. Большие количества могут быть доставлены, если доставка должна происходить в течение более коротких периодов. В основном более высокая скорость доставки возможна, если может переноситься более сильный взрывной выход. В случаях, когда гелевую композицию имплантируют хирургическим путем или используют как “остающуюся в организме” депо-форму, когда для лечения болезненного состояния или иного состояния одновременно проводится хирургическое вмешательство, возможно получить более высокие дозы, которые будут нормально вводиться при инъекции имплантата. Кроме того, доза полезного вещества может контролироваться подведением объема имплантируемого геля или инъекции инъекционного геля.
Другие компоненты, такие как полиэтиленгликоль, гигроскопические агенты, стабилизирующие агенты, образующие поры агенты и др., могут присутствовать в гелевой композиции в той степени, в которой они являются желательными и обеспечивают полезные свойства композиции. Различные стабилизирующие агенты описаны в Патентах США NoNo 5654010 и 5656297, которые введены в данном контексте в виде ссылки. Хотя в основном предполагается, что при практической реализации данного изобретения для полезного вещества в композиции не будут требоваться стабилизирующие агенты, могут быть случаи, когда данные агенты могут быть эффективными при использовании в комбинации с компонентами композиций, соответствующих данному изобретению.
Агенты, образующие поры, включают биосовместимые материалы, которые растворяются, диспергируются или разлагаются при контактировании с жидкостями тела с образованием пор или каналов в полимерной основе. Как правило, в качестве порообразующих материалов удобно использовать органические и неорганические материалы, которые являются водорастворимыми, такие как сахара (например, сахароза, декстроза), водорастворимые соли (например, хлорид натрия, фосфат натрия, хлорид калия и карбонат натрия), водорастворимые растворители, такие как N-метил-2-пирролидон и полиэтиленгликоль, а также водорастворимые полимеры (например, карбоксиметилцеллюлоза, гидроксипроприлцеллюлоза и т.п.). Данные материалы могут присутствовать в количествах, варьирующих от приблизительно 0,1% до приблизительно 100% от массы полимера, но, как правило, будут составлять меньше 50% и (более типично) меньше 10-20% от массы полимера.
Для детального понимания различных аспектов данного изобретения можно сделать ссылку на фиг.1, где приведена технологическая схема приготовления композиций, соответствующих изобретению. Процессы, соответствующие изобретению, будут подробно описаны касательно hGH (человеческого гормона роста) или лизоцима в качестве полезных веществ, стеариновой кислоты в качестве агента, характеризующегося низкой растворимостью в воде, и PLGA в качестве биосовместимого агента как репрезентативных примеров. Однако следует понимать, что процессы в общем применимы для получения композиций, соответствующих данному изобретению, с использованием других материалов, как описано в данном контексте, с соответствующей модификацией, что будет очевидно компетентному специалисту в данной области.
Технологическая схема процесса, представленная на фиг.1, намечает различные стадии, которые могут быть включены в производство конечного продукта, т.е. предварительно наполненных шприцев, содержащих инъекционную депо-композицию гидрофобного геля/активного вещества/полимера. Технологическую схему можно читать в сочетании со следующим описанием.
Количество гидрофобного агента, например стеариновой кислоты, соответствующее размеру изготавливаемой партии, хранящейся в пункте А, переносят на стадии 1 в измельчающее или перемалывающее устройство в пункте В. Измельчение является необязательной стадией, которая может не требоваться в зависимости от размера частиц гидрофобного агента, который получают в качестве исходного материала. Измельченный гидрофобный агент затем переносят на стадии 2 в пункт стерилизации С, где распыленный гидрофобный агент стерилизуют, используя принятое оборудование для стерилизации облучением. Может быть использовано гамма-излучение, испускаемое кобальтом-60 или цезием-137. Было обнаружено, что доза облучения приблизительно 16 килогрэй (кГр) от источника кобальта-60 является достаточной.
Порошок стерилизованного гидрофобного агента переносят на стадии 3 в камеру для смешивания в пункте J, на котором принимают также стерилизованное активное вещество, например человеческий гормон роста или лизоцим из пункта I на стадии 4. Смешивание может проводиться вручную при маленьких количествах или с помощью V-смесителя или другого принятого устройства для смешивания при больших количествах. Затем перемешанную смесь белка/гидрофобного агента переносят на стадии 5 в пункт уплотнения К, в котором порошковую смесь уплотняют путем таблетирования, уплотнения с помощью валика или экструзии с помощью обычного оборудования, как представлено в других разделах данного описания. Потом уплотненный материал переносят в измельчитель или устройство для перемалывания в пункте L, где его измельчают с получением частиц и просеивают через сита в пункте М. В основном для приготовления композиции диспергированных частиц/полимера используют те частицы, которые проходят через сито с меш 70 и остаются на сите с меш 400. Частицы, собранные на сите с меш 70, могут быть возвращены в измельчитель в пункте L, а частицы, проходящие через сито с меш 400, переносят в пункт 7 для удаления или повторного использования. Разделенные по размеру собранные частицы переносят на стадии 6 в емкость для перемешивания в пункте N, в который подают также стерилизованную смесь полимера и растворителя, приготовленные, как указано ниже.
Количество растворителя, например бензилбензоата, хранящегося в пункте D, и количество полимера, например PLGA, хранящегося в пункте Е, переносят на стадиях 8 и 9 соответственно в емкость для смешивания в пункте F. Емкость для смешивания может быть представлена любым подходящим принятым устройством для смешивания, таким как V-смеситель или смеситель Wharing. Исходное перемешивание, как правило, проводят при комнатной температуре в течение периода, исчисляющегося часами, как описано в данном контексте в других разделах. Исходно перемешанный материал может быть перенесен в смеситель с контролируемой температурой в пункте G, если перемешивание продолжается при повышенной температуре, например при 35°С – 40°С, до образования гомогенной массы из раствора полимера. Смешанный гель из полимера/растворителя переносят на стадии 11 в пункт Н, где его стерилизуют так, как описано в данном контексте для гидрофобного агента, и переносят на стадии 12 в емкость для смешивания в пункте N. Здесь полимер/растворитель и частицы белка/гидрофобного агента смешивают до получения однородной дисперсии частиц в композиции полимерного носителя.
Стерильные шприцы из пункта О переносят в область асептического производства на стадии 14 в пункт Р, где шприцы асептически наполняют желаемым объемом композиции белка/гидрофобного агента/полимерного геля. Наполненные шприцы переносят на стадии 15 в пункт первичной упаковки Q, а затем упакованные шприцы переносят из области асептического производства на стадии 16 в пункт вторичной упаковки и маркировки R. Маркированные и упакованные партиями шприцы переносят на стадии 17 в конечный пункт S для хранения и транспортировки.
При конкретном применении основного процесса соответствующее количество стеариновой кислоты (Sigma – Aldrich Chemical Company) измельчают или перемалывают до порошка, используя ступку с пестиком, или автоматизированный измельчитель, или мельницу, если ее не получают в подходящем порошкообразном состоянии, которое позволит гомогенно перемешать стеариновую кислоту с полезным веществом. Частицы стеариновой кислоты меньшего размера, как правило, способствуют лучшему перемешиванию с полезным веществом. Предпочтительно, когда стеариновая кислота, которая представляет собой смесь стеариновой кислоты и пальмитиновой кислоты, имеет содержание стеариновой кислоты не менее 40% и сумма двух кислот составляет не менее 90 мас.%. Предпочтительными являются более высокие проценты содержания стеариновой кислоты в смесях стеариновой кислоты/пальмитиновой кислоты. Порошок стеариновой кислоты стерилизуют, используя кобальт-60 в дозе 16 кГр при мощности 1 килогрэй/час (кГр/час). Альтернативно стеариновую кислоту можно стерилизовать расплавлением с последующей микрофильтрацией.
Гелевый носитель может быть приготовлен, как описано в Примере 1 ниже, и простерилизован перед смешиванием с прессованными частицами стеариновой кислоты/hGH. Лиофилизированные частицы hGH и лизоцима могут быть приготовлены, как описано в Примерах 2 и 3 ниже, соответственно. Как правило, равные по массе количества белка и стеариновой кислоты, например 10% от массы всей композиции для каждого из компонентов, смешивают в виде сухих порошков. Смешивание можно проводить вручную, при маленьких количествах или с помощью V-смесителя или другого принятого смесителя для больших количеств. Затем смесь полезного вещества и стеариновой кислоты гранулируют с помощью пресса Carver при давлении 68950-82740 кПа (10000-12000 фунт/дюйм2) с использованием штампа диаметром 13 мм в течение 5 минут. Вместо пресса Carver можно использовать другие принятые прессы для таблетирования для операции большего масштаба.
После прессования смеси белка/стеариновой кислоты ее гранулируют или перемалывают в порошок с помощью ступки и пестика или принятого перемалывающего устройства для больших объемов. Гранулированную смесь просеивают через сито с размером ячеек 212 мкм и собирают на сите с размером ячеи 53 мкм. Данные размеры соответствуют в основном ситу #70 и ситу #400. Частицы, которые проходят через сито с меш 400, удаляют или используют повторно.
В другом процессе стеариновая кислота может быть добавлена к раствору полезного вещества, например к раствору hGH, прошедшему диафильтрацию, приготовленному в Примере 2, перед стадией лиофилизации с целью получения лиофилизированных частиц смеси полезного вещества/стеариновой кислоты.
Прессованные частицы смеси полезного вещества/стеариновой кислоты, собранные с сита с меш 400, перемешивают с гелевым носителем в смесителе Lightning с верхней мешалкой в течение 5-10 минут или пока смесь не приблизится или не достигнет гомогенности. В данное время временные рамки не представляются важными и будут зависеть отчасти от устройства используемого смесителя. Например, если используют смеситель Ross или двойной планетарный смеситель для более масштабных операций, может потребоваться больше времени для перемешивания.
После перемешивания прессованных частиц полезного вещества/стеариновой кислоты с гелевым носителем объединенную смесь вводят в стерилизованные шприцы в асептических условиях наполнения с целью получения конечного продукта, который, будучи упакованным для сохранения стерильности, может быть непосредственно использован без дальнейшей стерилизации в области введения.
При использовании соотношений и материалов, описанных в следующих примерах продукт, содержащий вязкий гель, в котором диспергированы прессованные частицы полезного вещества/стеариновой кислоты, может быть непосредственно инъецирован в область применения в теле субъекта. Альтернативно, имплантаты, содержащие вязкий гель, или более жесткие имплантаты, образованные с использованием меньших количеств растворителей, могут быть получены вне тела субъекта и имплантированы с использованием хирургических процедур соответствующим образом.
Пример 1 – Приготовление гелевого носителя
На весах Mettler PJ3000 с верхней загрузкой делают скидку на массу стеклянной емкости. В данную емкость взвешивают сополимер D,L-лактида и гликолида 50:50 RESOMER® RG502 (PLGA-502). Делают скидку на массу стеклянной емкости, содержащей PLGA-502, и добавляют соответствующий растворитель. Количества, выражаемые в процентах, для различных комбинаций полимера/растворителя приводят в таблице ниже. Смесь полимер/растворитель вручную перемешивают с помощью шпателя с квадратным концом из нержавеющей стали, что приводит к образованию липкой янтарного цвета пастообразной субстанции, содержащей белые частицы полимера. Емкость, содержащую смесь полимера/растворителя, запечатывают и помещают в инкубатор с контролируемой температурой и равновесием при 37°С-39°С. Смесь полимера/растворителя удаляют из инкубатора, когда она принимает вид прозрачного гомогенного геля янтарного цвета. Интервалы периодов инкубирования могут составлять от 1 до 4 дней в зависимости от растворителя и типа полимера и соотношений растворителя и полимера. Дополнительные гелевые депо-носители готовят из следующих полимеров: сополимер D,L-лактида и гликолида 50:50 RESOMER® L104, PLGA-L104, кодовый номер 33007, сополимер D,L-лактида и гликолида 50:50 RESOMER® RG206, PLGA-206, кодовый номер 8815, сополимер D,L-лактида и гликолида 50:50 RESOMER® RG502, PLGA-502, код 0000366, сополимер D,L-лактида и гликолида 50:50 RESOMER® RG502H, PLGA-502H, кодовый номер 260187, сополимер D,L-лактида и гликолида 50:50 RESOMER® RG503, PLGA-503, кодовый номер 0080765, сополимер D,L-лактида и гликолида 50:50 RESOMER® RG506, PLGA-506, кодовый номер 95051, сополимер D,L-лактида и гликолида 50:50 RESOMER® RG755, PLGA-755, кодовый номер 95037 (Boehringer Ingelheim Chemicals, Inc., Petersburg, VA), а также следующие растворители или смеси: глицерилтриацетат (Eastman Chemical Co., Kingsport,,TN), бензилбензоат (“ВВ”), этилбензоат (“ЕВ”), метилбензоат (“MB”), триацетин (“ТА”) и триэтилцитрат (“ТС”) (Aldrich Chemical Co., St Louis, МО). При использовании комбинаций растворителей, например 20% триацетина и 80% бензилбензоата, смесь растворителей добавляют непосредственно к предварительно взвешенному сухому полимеру. Типичные молекулярные массы полимеров лежат в интервале 14400-39700 (МW (молекулярная масса)) [6400-12200 (Мn) (среднечисленная молекулярная масса))]. Репрезентативные гелевые носители описаны в таблице ниже.
Пример 2 – Приготовление частиц hGH
Частицы человеческого гормона роста (hGH) (необязательно содержащие ацетат цинка) готовят следующим образом.
Раствор hGH (5 мг/мл) в воде (BresaGen Corporation, Adelaide, Australia) концентрируют до 10 мг/мл, используя устройство для диафильтрации с переключением концентрирования/диализа. Раствор hGH, прошедший диафильтрацию, затем промывают 5-ю объемами раствора трис- или фосфатного буфера (рН 7,6). Затем получают частицы hGH путем распылительной сушки или лиофилизации с использованием принятых технологий. Растворы фосфатного буфера (5 или 40 мМ), содержащие hGH (5 мг/мл) (и необязательно различные уровни ацетата цинка (0-30 мМ), когда готовят комплексированные с Zn частицы), сушат распылением, используя комплект для сушки Yamato Mini Spray при следующих параметрах:
| Параметр распылительной сушки |
Установка |
| Распыляемый воздух |
13,8 кПа (2 фунт/дюйм2) |
| Температура на входе |
120°С |
| Диск аспиратора |
7,5 |
| Насос для раствора |
2-4 |
| Главный воздушный клапан |
276-310 кПа (40-45 фунт/дюйм2) |
Получают частицы hGH, имеющие размер в интервале 2-100 мкм. Лиофилизированные частицы получают из растворов в трис-буфере (5 или 50 мМ, рН 7,6), содержащих hGH (5 мг/мл), используя лиофильную сушку Durastop  P в соответствии со следующими циклами замораживания и сушки: P в соответствии со следующими циклами замораживания и сушки:
| Цикл замораживания |
Снижение температуры со скоростью 2,5°С/мин до -30°С и выдерживание в течение 30 мин |
| Снижение со скоростью 2,5°С/мин от -30°С до -50°С и выдерживание в течение 60 мин |
| Цикл сушки |
Повышение температуры со скоростью 0,5°С/мин до 10°С и выдерживание в течение 960 мин |
| Повышение температуры со скоростью 0,5°С/мин до 20°С и выдерживание в течение 480 мин |
| Повышение температуры со скоростью 0,5°С/мин до 25°С и выдерживание в течение 300 мин |
| Повышение температуры со скоростью 0,5°С/мин до 30°С и выдерживание в течение 300 мин |
| Снижение температуры со скоростью 0,5°С/мин до 5°С и выдерживание в течение 5000 мин |
Получают частицы hGH, имеющие размер в интервале 2-100 мкм.
Пример 3
Частицы лизоцима получают путем распылительной сушки 50% сахарозы и 50% куриного лизоцима (по сухой массе), используя процедуру, описанную в Примере 2. Данные частицы смешивают со стеариновой кислотой, пальмитиновой кислотой и миристиновой кислотой соответственно способом, описанным выше для получения прессованных частиц, содержащих смесь лизоцима и соответствующей жирной кислоты, с размером частиц между приблизительно 40 мкм и 200 мкм. Две партии со стеариновой кислотой имеют средние размеры частиц 65 мкм и 85 мкм соответственно две партии с пальмитиновой кислотой имеют средние размеры частиц 80 мкм и 76 мкм соответственно, и партия с миристиновой кислотой имеет средний размер частиц 74 мкм.
| Гелевые носители |
| Растворитель/полимер |
Растворитель |
Полимер |
Количество растворителя |
Количество полимера |
Масса геля |
Соотношение |
| 50/50 |
ВВ |
PLGA-502 |
5 г |
5 г |
10 г |
1,0 |
| 50/50 |
Смесь |
PLGA-502 |
5 г |
5 г |
10 г |
1,0 |
| |
ТА/ВВ |
|
|
|
|
|
| 60/40 |
Смесь |
PLGA-502 |
6 г |
4 г |
10 г |
1,5 |
| |
ТА/ВВ |
|
|
|
|
|
| 70/30 |
Смесь |
PLGA-502 |
7 г |
3 г |
10 г |
2,3 |
| |
ТА/ВВ |
|
|
|
|
|
| 80/20 |
Смесь |
PLGA-502 |
8 г |
2 г |
10 г |
4,0 |
| |
ТА/ВВ |
|
|
|
|
|
| Растворитель/полимер |
Растворитель |
Полимер |
Количество растворителя |
Количество полимера |
Масса геля |
Соотношение |
| 50/50 |
ЕВ |
PLGA-502 |
5 г |
5 г |
10 г |
1,0 |
| 50/50 |
Смесь |
PLGA-502 |
5 г |
5 г |
10 г |
1,0 |
| |
ТА/ВВ |
|
|
|
|
|
| 50/50 |
ВВ |
PLGA-502 |
25 г |
25 г |
50 г |
1,0 |
| 55/45 |
ВВ |
PLGA-502 |
27,5 г |
22,5 г |
50 г |
1,2 |
| 50/50 |
ВВ |
PLGA-502 |
50 г |
50 г |
100 г |
1,0 |
| 50/50 |
Смесь |
PLGA-502 |
50 г |
50 г |
100 г |
1,0 |
| |
ТА/ВВ |
|
|
|
|
|
| 50/50 |
ВВ |
PLGA- |
5 г |
5 г |
10 г |
1,0 |
| |
|
502Н |
|
|
|
|
| 50/50 |
ВВ |
PLGA-503 |
50 г |
50 г |
100 г |
1,0 |
Нагрузка лекарственного вещества
Прессованные частицы, содержащие полезное вещество/стеариновую кислоту, приготовленные, как указано выше, добавляют в гелевый носитель в количестве 10-20 мас.% и перемешивают вручную, пока сухой порошок не увлажнится полностью. Затем смесь частиц/геля молочного светло-желтого цвета тщательно перемешивают с использованием принятой технологии смешивания, используя механическую мешалку Caframo с присоединенным металлическим шпателем с квадратным концом. Конечные гомогенные гелевые препараты переносят в одноразовые шприцы по 3, 10 и 30 см3 для хранения или применения.
Репрезентативное число имплантируемых гелей готовят в соответствии с предшествующими процедурами и тестируют на выход полезного вещества in vitro как функции времени, а также в исследованиях in vivo на крысах с целью определения выхода полезного вещества по определению концентраций полезного вещества в плазме крови как функции времени.
Как можно видеть из фиг.2, лизоцим, который не присутствует в гелевом носителе в виде прессованной смеси со стеариновой или пальмитиновой кислотой, высвобождается из геля значительно быстрее и в большей степени при измерении в емкости для растворения по USP (Фармакопея США), содержащей фосфатный буфер, при 100 об/мин. Процент лизоцима в непрессованном состоянии, который высвобождается, на 3-4 порядка превышает процент, высвобождающийся из гелевых носителей, которые содержат частицы, образованные из прессованной смеси лизоцима и стеариновой кислоты и пальмитиновой кислоты соответственно. Положительные эффекты прессованных частиц также демонстрируют в тесте на растворение самих частиц, как показано на фиг.3, на которой проиллюстрировано практически полное растворение частиц лизоцима, которые присутствуют не в форме прессованных частиц со стеариновой кислотой или пальмитиновой кислотой. Аналогичные результаты иллюстрируют на фиг.4 для непрессованных частиц лизоцима и прессованных частиц лизоцима со стеариновой кислотой, миристиновой кислотой и пальмитиновой кислотой.
Высвобождение in vivo лизоцима из гелей PLGA 502/бензилбензоата (50-50), приготовленных, как описано выше, и содержащих 10 мас.% лиофилизированных частиц hGH, и прессованных частиц hGH/стеариновой кислоты, где стеариновая кислота присутствует в одном случае в количестве, равном hGH по массе (обозначаемом, как “низкий уровень”), и в другом случае в количестве, превышающем в два раза массу hGH (обозначаемом, как “высокий уровень”), иллюстрируют на фиг.5. Построен график концентрации hGH в сыворотке крови крысы (нормализованной относительно массы тела) относительно времени после имплантации в днях. Как показано, непрессованные частицы hGH демонстрируют очень высокий исходный “взрывной выход” hGH после имплантации, такой сильный, что большая часть белка высвобождается из имплантата в течение одного дня после имплантации. Полной противоположностью являются оба препарата hGH со стеариновой кислотой, которые проявляют очень низкий исходный выход белка и обеспечивают задержанный выход hGH из имплантата в течение более чем 14 дней.
Фиг.6 иллюстрирует положительные эффекты комбинации стеариновой кислоты в отношении контроля микросреды вокруг частицы hGH и микросреды, окружающей имплантат PLGA, при использовании сложного эфира бензойной кислоты, а именно этилбензоата и бензилбензоата, ингибируя таким образом сильное поглощение имплантатом воды после имплантации. Как легко можно заметить, выход hGH из прессованных частиц hGH/стеариновой кислоты в имплатате из PLGA-502, приготовленном с этилбензоатом или бензилбензоатом в качестве растворителей для полимера, демонстрирует низкий исходный выход и задержанное высвобождение hGH в течение времени.
Данное изобретение описывается и характеризуется одним или более следующих технических признаков и/или характеристик, либо индивидуально, либо в комбинации с одним или более других признаков или характеристик: композиция, содержащая биосовместимый носитель и частицы, содержащие прессованную смесь активного вещества и (необязательно) агента, модулирующего скорость растворения или агента, характеризующегося низкой растворимостью в воде, при этом частицы диспергированы в носителе; композиция, содержащая биосовместимый носитель и частицы, содержащие прессованную смесь активного вещества и агента, модулирующего скорость растворения, при этом частицы диспергированы в носителе; композиция, содержащая биосовместимый носитель и частицы, содержащие прессованную смесь активного вещества и агента, характеризующегося низкой растворимостью в воде, при этом частицы диспергированы в носителе; композиция, в которой агент, характеризующийся низкой растворимостью в воде, является гидрофобным, а носитель представляет собой биосовместимый гель; композиция, в которой гидрофобный агент содержит фармацевтически приемлемое масло, жир, жирную кислоту, сложный эфир жирной кислоты, воск или его производное, которое проявляет гидрофобные свойства; композиция, в которой гидрофобный агент содержит С16-С24 жирную кислоту или ее сложный эфир или фармацевтически приемлемую соль или смесь любых из вышеупомянутых материалов; композиция, в которой гидрофобный агент содержит смесь стеариновой кислоты и пальмитиновой кислоты, композиция, в которой стеариновая кислота и пальмитиновая кислота вместе составляют по меньшей мере 90% от массы жирных кислот гидрофобного агента и стеариновая кислота составляет по меньшей мере 40% от массы жирных кислот гидрофобного агента; композиция, в которой стеариновая кислота и пальмитиновая кислота вместе составляют по меньшей мере 96% от массы жирных кислот гидрофобного агента и стеариновая кислота составляет по меньшей мере 90% от массы жирных кислот гидрофобного агента; композиция, в которой частицы содержат порошок; композиция, в которой порошок имеет такой размер частиц, при котором 90% частиц проходит через сито с меш (числом ячеек/единицу длины) 50 и остается на сите с меш 400; композиция, в которой порошок имеет такой размер частиц, при котором порошок проходит через сито с меш 70 и остается на сите с меш 400; композиция, в которой частицы имеют размер между 0,1-500 мкм; композиция, в которой частицы имеют размер между 30-400 мкм; композиция, в которой активное вещество является водорастворимым; композиция, в которой активное вещество выбрано из группы, состоящей из ДНК, кДНК, белков, пептидов и их фрагментов и производных; композиция, в которой носитель содержит полимер, выбранный из группы, состоящей из полимолочной кислоты, полигликолевой кислоты и сополимера лактида и гликолевой кислоты, и растворитель, содержащий алкильный или аралкильный сложный эфир бензойной кислоты; композиции, в которой активное вещество представляет собой человеческий гормон роста,  -, -,  – или – или  -интерферон, эритропоэтин, глюкагон, кальцитонин, гепарин, интерлейкин-1, интерлейкин-2, фактор VIII, фактор IX, лютеинизирующий гормон, релаксин, фолликул-стимулирующий гормон, предсердный натрийуретическкий фактор или филграстим; композиция, в которой полимер представляет собой сополимер лактида и гликолевой кислоты и растворитель представляет собой бензилбензоат; композиция, в которой полимер представляет собой сополимер лактида и гликолевой кислоты и растворитель представляет собой этилбензоат; композиция, содержащая биоразрушаемый гель, содержащий полимер, выбранный из полимолочной кислоты, полигликолевой кислоты и сополимер лактида и гликолевой кислоты, растворитель, выбранный из алкильного или аралкильного сложного эфира бензойной кислоты, и частицы, содержащие прессованную смесь активного вещества и агента, характеризующегося низкой растворимостью в воде, выбранного из группы, состоящей из фармацевтически приемлемого масла, жира, жирной кислоты, сложного эфира жирной кислоты, воска, их производного или смеси вышеперечисленных материалов, при этом частицы диспергированы в геле; способ получения имплантируемого носителя с диспергированным в нем активным веществом, который предусматривает образование прессованной массы активного вещества, необязательно смешанной с модулятором скорости растворения или агентом, характеризующимся низкой растворимостью в воде, измельчение массы с образованием прессованных частиц, содержащих активное вещество, необязательно смешанное с модулятором скорости растворения или агентом, характеризующимся низкой растворимостью в воде, и диспергирование прессованных частиц в носителе; способ, в котором активное вещество является водорастворимым и агент, характеризующийся низкой растворимостью в воде, является гидрофобным; способ, в котором активное вещество представляет собой белок или полипептид, а гидрофобный агент является стеариновой кислотой, пальмитиновой кислотой или миристиновой кислотой; способ, в котором белок представлен человеческим фактором роста, а гидрофобный агент является стеариновой кислотой; способ, в котором активное вещество выбрано из группы, состоящей из кДНК, ДНК, белок, пептидов и их фрагментов и производных; способ, в котором активное вещество выбрано из человеческого гормона роста, -интерферон, эритропоэтин, глюкагон, кальцитонин, гепарин, интерлейкин-1, интерлейкин-2, фактор VIII, фактор IX, лютеинизирующий гормон, релаксин, фолликул-стимулирующий гормон, предсердный натрийуретическкий фактор или филграстим; композиция, в которой полимер представляет собой сополимер лактида и гликолевой кислоты и растворитель представляет собой бензилбензоат; композиция, в которой полимер представляет собой сополимер лактида и гликолевой кислоты и растворитель представляет собой этилбензоат; композиция, содержащая биоразрушаемый гель, содержащий полимер, выбранный из полимолочной кислоты, полигликолевой кислоты и сополимер лактида и гликолевой кислоты, растворитель, выбранный из алкильного или аралкильного сложного эфира бензойной кислоты, и частицы, содержащие прессованную смесь активного вещества и агента, характеризующегося низкой растворимостью в воде, выбранного из группы, состоящей из фармацевтически приемлемого масла, жира, жирной кислоты, сложного эфира жирной кислоты, воска, их производного или смеси вышеперечисленных материалов, при этом частицы диспергированы в геле; способ получения имплантируемого носителя с диспергированным в нем активным веществом, который предусматривает образование прессованной массы активного вещества, необязательно смешанной с модулятором скорости растворения или агентом, характеризующимся низкой растворимостью в воде, измельчение массы с образованием прессованных частиц, содержащих активное вещество, необязательно смешанное с модулятором скорости растворения или агентом, характеризующимся низкой растворимостью в воде, и диспергирование прессованных частиц в носителе; способ, в котором активное вещество является водорастворимым и агент, характеризующийся низкой растворимостью в воде, является гидрофобным; способ, в котором активное вещество представляет собой белок или полипептид, а гидрофобный агент является стеариновой кислотой, пальмитиновой кислотой или миристиновой кислотой; способ, в котором белок представлен человеческим фактором роста, а гидрофобный агент является стеариновой кислотой; способ, в котором активное вещество выбрано из группы, состоящей из кДНК, ДНК, белок, пептидов и их фрагментов и производных; способ, в котором активное вещество выбрано из человеческого гормона роста,  -, -,  – или – или  -интерферона, эритропоэтина, глюкагона, кальцитонина, гепарина, интерлейкина-1, интерлейкина-2, фактора VIII, фактора IX, лютеинизирующего гормона, релаксина, фолликул-стимулирующего гормона, предсердного натрийуретического фактора или филграстима. -интерферона, эритропоэтина, глюкагона, кальцитонина, гепарина, интерлейкина-1, интерлейкина-2, фактора VIII, фактора IX, лютеинизирующего гормона, релаксина, фолликул-стимулирующего гормона, предсердного натрийуретического фактора или филграстима.
Вышеописанные примеры вариантов осуществления предназначены для того, чтобы проиллюстрировать во всех отношениях, а не ограничить данное изобретение. Таким образом данное изобретение имеет много вариантов при детальном исполнении, которые могут быть получены компетентным в данной области специалистом из описания, содержащегося в данном контексте. Все такие варианты и модификации рассматриваются, как входящие в объем и сущность данного изобретения.
Формула изобретения
1. Имплантируемая композиция, отличающаяся тем, что она содержит биосовместимый носитель и частицы, включающие в себя прессованную смесь активного вещества и гидрофобного агента, выбранного из группы, состоящей из C16-C24 жирных кислот, сложных эфиров жирных кислот и их фармацевтически приемлемых солей, а также смесей указанных веществ, причем частицы диспергированы в носителе.
2. Композиция по п.1, отличающаяся тем, что в качестве биосовместимого носителя она содержит биосовместимый гель.
3. Композиция по п.1, отличающаяся тем, что в качестве гидрофобного агента она содержит смесь стеариновой кислоты и пальмитиновой кислоты.
4. Композиция по п.3, отличающаяся тем, что стеариновая кислота и пальмитиновая кислота вместе составляют по меньшей мере 90 мас.% жирных кислот гидрофобного агента, а стеариновая кислота составляет по меньшей мере 40 мас.% жирных кислот гидрофобного агента.
5. Композиция по п.4, отличающаяся тем, что стеариновая кислота и пальмитиновая кислота вместе составляют по меньшей мере 96 мас.% жирных кислот гидрофобного агента, а стеариновая кислота составляет по меньшей мере 90 мас.% жирных кислот гидрофобного агента.
6. Композиция по п. 1, отличающаяся тем, что частицы составляют порошок.
7. Композиция по п.1, отличающаяся тем, что порошок имеет такой размер частиц, при котором 90% частиц проходит через сито с ситовым размером 50 меш и остается на сите с ситовым размером 400 меш.
8. Композиция по п.1, отличающаяся тем, что в качестве активного вещества она содержит водорастворимое вещество.
9. Композиция по п.8, отличающаяся тем, что активное вещество выбрано из группы, состоящей из ДНК, кДНК, белков, пептидов и их фрагментов и производных.
10. Композиция по п.8, отличающаяся тем, что носитель представляет собой полимер, выбранный из группы, состоящей из полимолочной кислоты, полигликолевой кислоты и сополимера лактида и гликолевой кислоты, и растворитель, содержащий алкильный или аралкильный сложный эфир бензойной кислоты.
11. Композиция по п.10, отличающаяся тем, что активное вещество выбрано из группы, состоящей из человеческого гормона роста,  -, -,  – или – или  -интерферона, эритропоэтина, глюкагона, кальцитонина, гепарина, интерлейкина-1, интерлейкина-2, фактора VIII, фактора IX, лютеинизирующего гормона, релаксина, фолликулстимулирующего гормона, предсердного натрийуретического фактора или филграстима. -интерферона, эритропоэтина, глюкагона, кальцитонина, гепарина, интерлейкина-1, интерлейкина-2, фактора VIII, фактора IX, лютеинизирующего гормона, релаксина, фолликулстимулирующего гормона, предсердного натрийуретического фактора или филграстима.
12. Композиция по п.11, отличающаяся тем, что полимер представлен сополимером лактида и гликолевой кислоты, а растворитель представлен бензилбензоатом.
13. Композиция по п.12, отличающаяся тем, что полимер представлен сополимером лактида и гликолевой кислоты, а растворитель представлен этилбензоатом.
14. Имплантируемая композиция, отличающаяся тем, что она содержит биоразрушаемый гель, включающий в себя полимер, выбранный из группы, состоящей из полимолочной кислоты, полигликолевой кислоты и сополимера лактида и гликолевой кислоты, растворитель, выбранный из группы, состоящей из алкильного или аралкильного сложного эфира бензойной кислоты, и частицы, диспергированные в биоразрушаемом геле, причем частицы включают в себя прессованную смесь активного вещества и гидрофобного агента, выбранного из группы, состоящей из C16-C24 жирных кислот, сложных эфиров жирных кислот и их фармацевтически приемлемых солей, а также смесей указанных веществ.
15. Композиция по п.14, отличающаяся тем, что в качестве гидрофобного агента она содержит смесь стеариновой кислоты и пальмитиновой кислоты.
16. Композиция по п.15, отличающаяся тем, что стеариновая кислота и пальмитиновая кислота вместе составляют по меньшей мере 90 мас.% жирных кислот гидрофобного агента, а стеариновая кислота составляет по меньшей мере 40 мас.% жирных кислот гидрофобного агента.
17. Композиция по п.16, отличающаяся тем, что стеариновая кислота и пальмитиновая кислота вместе составляют по меньшей мере 96 мас.% жирных кислот гидрофобного агента, а стеариновая кислота составляет по меньшей мере 90 мас.% жирных кислот гидрофобного агента.
18. Композиция по п.17, отличающаяся тем, что частицы составляют порошок.
19. Композиция по п.18, отличающаяся тем, что порошок имеет средний размер частиц от приблизительно 30 до приблизительно 500 мкм.
20. Композиция по п.19, отличающаяся тем, что в качестве активного вещества она содержит водорастворимое вещество.
21. Композиция по п.20, отличающаяся тем, что активное вещество выбрано из группы, состоящей из ДНК, кДНК, белков, пептидов и их фрагментов и производных.
22. Композиция по п.20, отличающаяся тем, что в качестве геля она содержит сополимер лактида и гликолевой кислоты.
23. Композиция по п.20, отличающаяся тем, что активное вещество выбрано из группы, состоящей из человеческого гормона роста,  -, -,  – или – или  -интерферона, эритропоэтина, глюкагона, кальцитонина, гепарина, интерлейкина-1, интерлейкина-2, фактора VIII, фактора IX, лютеинизирующего гормона, релаксина, фолликул-стимулирующего гормона, предсердного натрийуретического фактора или филграстима. -интерферона, эритропоэтина, глюкагона, кальцитонина, гепарина, интерлейкина-1, интерлейкина-2, фактора VIII, фактора IX, лютеинизирующего гормона, релаксина, фолликул-стимулирующего гормона, предсердного натрийуретического фактора или филграстима.
24. Композиция по п.23, отличающаяся тем, что в качестве растворителя она содержит бензилбензоат, а в качестве активного вещества – человеческий гормон роста.
25. Композиция по п.23, отличающаяся тем, что в качестве растворителя она содержит этилбензоат, а в качестве активного вещества – человеческий гормон роста.
26. Способ приготовления имплантируемой композиции, содержащей биоразрушаемый носитель с диспергированным в нем активным веществом, отличающийся тем, что формируют прессованную массу смеси активного вещества и гидрофобного агента, выбранного из группы, состоящей из С16-С24 жирных кислот, сложных эфиров жирных кислот и их фармацевтически приемлемых солей, а также смесей указанных веществ, измельчают массу с образованием прессованных частиц смеси активного вещества и гидрофобного агента и диспергируют прессованные частицы в носителе.
27. Способ по п.26, отличающийся тем, что в качестве активного вещества выбирают водорастворимое вещество.
28. Способ по п.27, отличающийся тем, что активное вещество выбирают из группы, состоящей из белка и полипептида, а гидрофобный агент выбирают из группы, состоящей из стеариновой кислоты, пальмитиновой кислоты или миристиновой кислоты.
29. Способ по п.28, отличающийся тем, что в качестве белка выбирают человеческий гормон роста, а в качестве гидрофобного агента выбирают стеариновую кислоту.
30. Способ по п.27, отличающийся тем, что активное вещество выбирают из группы, состоящей из кДНК, ДНК, белков, пептидов и их фрагментов и производных.
31. Способ по п.27, отличающийся тем, что активное вещество выбирают из группы, состоящей из человеческого гормона роста,  -, -,  – или – или  -интерферона, эритропоэтина, глюкагона, кальцитонина, гепарина, интерлейкина-1, интерлейкина-2, фактора VIII, фактора IX, лютеинизирующего гормона, релаксина, фолликулстимулирующего гормона, предсердного натрийуретического фактора или филграстима. -интерферона, эритропоэтина, глюкагона, кальцитонина, гепарина, интерлейкина-1, интерлейкина-2, фактора VIII, фактора IX, лютеинизирующего гормона, релаксина, фолликулстимулирующего гормона, предсердного натрийуретического фактора или филграстима.
РИСУНКИ
|
|