|
|
(21), (22) Заявка: 2004109560/15, 31.03.2004
(24) Дата начала отсчета срока действия патента:
31.03.2004
(43) Дата публикации заявки: 10.10.2005
(45) Опубликовано: 27.02.2006
(56) Список документов, цитированных в отчете о
поиске:
ТОРОПОВА Б.Г. и др. Иммуноферментый анализ фактора Виллебранда с использованием моноклональных антител. Лабораторное дело, 1990, №12, с.52-55. LAMME S The use of monoclonal antibodies in measuring factor VIII/von Willebrand factor, Scand J Clin Lab Invest. 1985 Feb; 45(1):17-26. LINDAHL TL A new flow cytometric method for measurement of von
Адрес для переписки:
193318, Санкт-Петербург, ул. Подвойского, 14, корп.1, кв.741, пат.пов. В.А.Кузнецову, рег.№124
|
(72) Автор(ы):
Власик Татьяна Николаевна (RU),
Мазуров Алексей Владимирович (RU),
Хаспекова Светлана Георгиевна (RU),
Янушевская Елена Вадимовна (RU)
(73) Патентообладатель(и):
Общество с ограниченной ответственностью “Фирма МонА” (RU),
Государственное учреждение Российский кардиологический научно-производственный комплекс Министерства здравоохранения РФ (РКНПК МЗ РФ) (RU)
|
(54) СПОСОБ ИММУНОФЕРМЕНТНОГО АНАЛИЗА ДЛЯ ОПРЕДЕЛЕНИЯ ФАКТОРА ВИЛЛЕБРАНДА, МОНОКЛОНАЛЬНОЕ АНТИТЕЛО К ФАКТОРУ ВИЛЛЕБРАНДА (ВАРИАНТЫ) И ШТАММ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК ЖИВОТНЫХ MUS. MUSCULUS L. – ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К ФАКТОРУ ВИЛЛЕБРАНДА (ВАРИАНТЫ)
(57) Реферат:
Изобретение относится к иммуноферментному анализу и моноклональным антителам и может быть использовано для анализа фактора Виллебранда. Сущность изобретения состоит в том, что проводят иммуноферментный анализ, в котором в качестве иммобилизующего антитела используют моноклональное антитело 5С3, а в качестве детектирующего реагента смесь меченных биотином моноклональных антител 2Н2 и 7D12. Изобретение также относится к моноклональным антителам, продуцируемым штаммом гибиридомных культивируемых клеток Mus musculus L. и направленных против фактора Виллебранда, и к штаммам гибридных культивируемых клеток Mus musculus L., продуцирующих указанные моноклональные антитела. Техническим результатом является создание высокочувствительного способа определения фактора Виллебранда. 7 н. и 2 з.п. ф-лы, 1 табл., 2 ил. 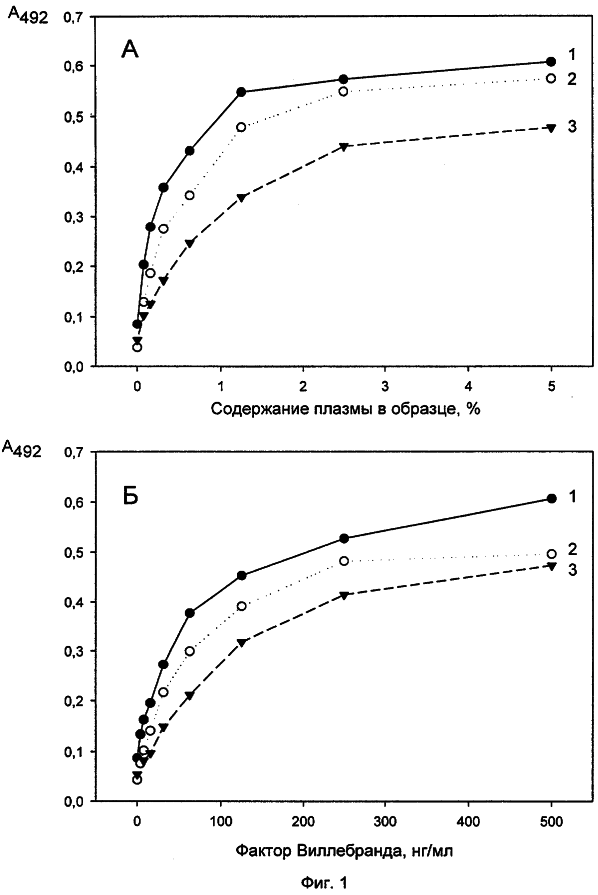
(56) (продолжение):
CLASS=”b560m”Willebrand factor activity. Scand J Clin Lab Invest. 2003; 63(3):217-23. RU 2223785 C2, 20.02.2004. SU 1693046 A1, 23.11.1991.
Изобретение относится к области биотехнологии, а именно к способам иммуноферментного анализа (ИФА) и моноклональным антителам (моноАТ) для их осуществления, в частности к системам для анализа фактора Виллебранда (ФИ), и технологии их получения.
Фактор Виллебранда (ФВ) – мультимерный гликопротеин (ГП) плазмы крови (0,5-20×106 Д), играющий существенную роль в процессах остановки кровотечения (гемостаза), а именно в реакциях сосудисто-тромбоцитарного и плазменно-коагуляционного звеньев гемостаза. [Баркаган З.С. Геморрагические заболевания и синдромы., М., 1988. с.216-234; Папаян Л.П. Современные проблемы клинической коагулологии., Л., 1985., с.21-27; Zimmerman T.S., Ruggeri Z.M. Hum. Path., 1987, 18:140-152]. Этот белок синтезируется в сосудистом эндотелии и мегакариоцитах костного мозга. Синтезированный белок содержится во внутриклеточных гранулах эндотелиальных клеток и тромбоцитов (образующихся из мегакариоцитов) и секретируется из них в плазму крови.
Одной из главной функцией ФВ является обеспечение адгезии (прикрепления) тромбоцитов к поврежденным участкам сосудистой стенки. ФВ выполняет роль молекулярного клея, взаимодействуя одновременно с субэндотелиальными структурами сосуда и своим главным рецептором на поверхности тромбоцитов – ГП Ib. На поверхности активированных тромбоцитов ФВ способен также связываться с другим рецептором – ГП IIb-IIIa. Благодаря этому взаимодействию он, наряду с фибриногеном, участвует в образовании молекулярных связей между активированными тромбоцитами, т.е. в их агрегации.
Участие ФВ в коагуляционном звене гемостаза обеспечивается его способностью образовывать в плазме комплекс с коагуляционным фактором VIII, в котором ФВ выполняет роль белка-носителя и обеспечивает меньшему по размеру фактору VIII стабильность при циркуляции в кровотоке, увеличивая время его жизни в сосудистом русле и способствуя его транспортировке в места повреждения сосудов.
Наследственные нарушения, выражающиеся в снижении количества или изменении функциональных свойств ФВ, носят названия болезни Виллебранда. Это заболевание представляет собой одну из наиболее часто встречающихся патологий системы гемостаза. [См. обзоры: Баркаган З.С. Геморрагические заболевания и синдромы., М., 1988, с.216-234; Шиффман Ф.Д. Патофизиология крови, «Издательство Бином» – «Невский диалект», М.-СПб., 2000, с.233-8; Sandler J.E., Davie E.W. Von Willebrand factor and von Willebrand disease. In “The Molecular basis of Blood Disease”, eds. Stamatoyannopoulos S., Majerus P.W., Perlmutter R.M., Varmus H. W.B. Saunders Company., Philadelphia, London, New York, St. Louis, Sydney, Toronto., 2001, p.697-718; Ruggeri Z.M. Thromb. Haemost, 1999, 82:576-84]. Главными проявлениями снижения уровня и/или функциональной активности ФВ у больных болезнью Виллебранда являются выраженные нарушения показателей, характеризующих состоятельность тромбоцитарно-сосудистого гемостаза (увеличение времени кровотечения, снижение адгезии тромбоцитов и их агрегации в присутствии антибиотика ристоцитина), а также профузными кровотечениями из слизистых из-за дефекта образования первичной тромбоцитарной пробки. Наблюдения за больными болезнью Виллебранда показали также, что у них может быть снижена активность фактора VIII в связи с количественными и/или качественными дефектами белка-носителя – ФВ. Клинически это проявляется кровотечениями, которые напоминают таковые у больных гемофилией А, имеющих истинный дефект синтеза фактора VIII.
Известно также, что повышенный уровень ФВ может быть фактором риска тромботических обострений ишемической болезни сердца, таких как инфаркт миокарда и нестабильная стенокардия [Thompson S.G., et al. N. Engl. J. Med., 1995, 332:635-41; Воскобой И.В. и др. Кардиология, 2002, 42:4-11]. Повышение содержания ФВ в плазме крови является одним из маркеров активации и/или повреждения эндотелиальных клеток и тромбоцитов, что расценивается как один из существенных факторов, провоцирующих развитие тромботических осложнений при сердечно-сосудистых заболеваниях.
Исходя из вышеизложенного, определение уровня плазменного ФВ имеет важное значение для диагностики болезни Виллебранда и дифференциации некоторых форм этого заболевания с гемофилией А, а также для прогноза развития тромбозов. В связи с этим представляется актуальным создание систем для количественного определения ФВ в плазме крови.
В настоящее время для определения ФВ используется широкий круг методов. Так, содержание ФВ в плазме можно определить, измеряя его так называемую ристоцитин-кофакторную активность, т.е. способность этого белка вызывать агрегацию тромбоцитов за счет взаимодействия с ГП Ib в присутствии антибиотика ристоцитина. В различных вариантах этого метода используют нативные или фиксированные тромбоциты и различные способы измерения агрегации. Кроме того, для определения ФВ используют различные иммунохимические методы, такие как ракетный электрофорез по Laurell и варианты радиоиммунного и иммуноферментного анализа с применением поликлональных и моноклональных антител (моноАТ) [Шиффман Ф.Д. Патофизиология крови, «Издательство Бином» – «Невский диалект», М.-СПб., 2000, с.233-8: Sandier J.E., Davie E.W. Von Willebrand factor and von Willebrand disease in “The Molecular basis of Blood Disease”, Eds. Stamatoyannopoulos S., Majerus P.W., Perimutter R.M., Varmus H. W.B. Saunders Company., Philadelphia, London, New York, St. Louis, Sydney, Toronto., 2001, p.697-718].
Определение ристоцитин-кофакторной активности представляет собой трудоемкий метод, требующий получения донорских тромбоцитов, применения специальной аппаратуры для измерения их агрегации и не позволяющий проводить одновременное тестирование большого количества образцов. Кроме того, данный способ существенно ниже по чувствительности большинства иммунохимических методов, причем получаемые с его помощью результаты позволяют судить скорее об активности ФВ (способности связываться с ГП Ib), а не о его концентрации. Поэтому при вариантах болезни Виллебранда с нарушением функции этого белка данный способ можно применять только в сочетании с иммунохимическими методами.
За последние годы разработан ряд методов исследования ФВ, основанных на взаимодействии растворимого антигена со специфическими антителами и преципитации образующегося комплекса. В частности, были предложены иммуноэлектрофоретический и иммунодиффузионный методы, недостатками которых являются продолжительность исследования (до нескольких дней), сложная оценка результатов и самое главное низкая чувствительность (предел выявления ФВ 5-10% от нормальных значений в плазме крови). Иммунорадиометрический и иммуноферментный методы лишены этих недостатков и позволяют улавливать ничтожное содержание белка ФВ – менее 1% от его количества в плазме здоровых доноров [Casonato A., Girolami A. Folia haemat (Lps.), 1986, 113:670-684; Sandier J.E., Davie E.W. Von Willebrand factor and von Willebrand disease in “The Molecular basis of Blood Disease”, Eds. Stamatoyannopoulos S., Majerus P.W., Perimutter R.M., Varmus H. W.B. Saunders Company., Philadelphia, London, New York, St. Louis, Sydney, Toronto., 2001, p.697-718]. Однако из них наиболее эффективным и удобным является иммуноферментный анализ (ИФА), т.к. он менее трудоемок и в отличие от радиоиммунных методов не требует использования радиоактивно меченных реагентов.
Наиболее близким к заявляемому способу по технической сущности и достигаемому эффекту является способ определения ФВ методом ИФА на основе использования моноАТ из гибридомного штамма 380 Ф2. [Торопова В.Г. и др. Лаб. дело, 1990, 12:52-55]. Предлагаемый способ ИФА включает в себя фиксацию в лунках пластикового планшета поликлональных кроличьих антител к ФВ производства «Dakopetts» (Дания), их отмывания фосфатно-солевым буферным раствором, последовательного внесения в лунки исследуемой плазмы в различных разведениях, мышиных моноАТ к ФВ (в виде культуральной жидкости штамма 380 Ф2) и пероксидазного конъюгата (антитела к IgG мыши, меченные пероксидазой хрена), инкубирования планшета и определения активности пероксидазы, входящей в состав конъюгата, с помощью хромогенного субстрата при длине волны 490 нм. Контроль неспецифического связывания проводится с нормальными мышиными иммуноглобулинами. Недостатками метода является использование поликлональных антител, т.к. свойства поликлональных антител от партии к партии могут варьировать. Кроме того, при использовании моноАТ удается не только повысить воспроизводимость метода, но и избежать трудоемкой и дорогостоящей процедуры аффинной очистки специфических поликлональных антител из сыворотки.
Наряду с упомянутыми в предыдущей работе известны и другие моноАТ к ФВ. В частности, известны моноАТ MA-82D1E1 и MA-82D6A3, способные селективно реагировать с ФВ [Tornai I. et al. Haemostasis, 1991, 21:125-134]. МоноАТ были получены традиционными способами и очищены из асцитной жидкости мышей линии BALB/c, после выращивания в брюшной полости клеток-продуцентов, с помощью аффинной хроматографии на белок А-Сефарозе. Показано, что в ходе ИФА они оказались более перспективными, чем поликлональные антитела, однако их характеристики в работе подробно не описаны. Также близкими антителами и штаммами к заявляемым являются моноАТ MAb 53 и MAb D7 [Bradley L. et al., Clin. Chem., 1984, 30: р.87-92), которые были получены методом, включающим в себя иммунизацию FVIIIR:Ag (factor VIII related antigen – ранее применяемое название антигена ФВ) мышей линии BALB/c, гибридизацию клеток селезенки иммунных мышей, отбор и клонирование гибридомомных клеток продуцирующих антитела MAb D7 и MAb 53. Подробное описание штаммов-продуцентов и очищенных моноАТ к ФВ в данной работе отсутствует.
Задачей, решаемой в рамках настоящего патента, являлось создание более эффективного способа определения ФВ методом ИФА. Было высказано предположение, что чувствительность способа может быть существенно увеличена при использовании для определения ФВ одновременно трех моноАТ к нему – одного для иммобилизации и двух меченных биотином для детекции иммобилизованного антигена. Для этого все три используемых антитела не должны конкурировать друг с другом за связывание с определяемым антигеном – ФВ.
Предлагаемый при этом способ заключается в том, что в качестве иммобилизующего ФВ антитела используют моноАТ 5СЗ, а в качестве детектирующего реагента – смесь меченных биотином моноАТ 2Н2 и 7D12.
Использование смеси указанных моноАТ (2Н2 и 7D12) для детекции иммобилизованного ФВ позволяет повысить чувствительность метода. Однако принципиально возможно в ряде случаев, не требующих высокой чувствительности определения, использовать в качестве детектирующего реагента каждое из этих антител по отдельности.
Применяемые при использовании способа моноАТ 5С3, 2Н2 и 7D12 были получены на основе мышиных гибридомных клеточных штаммов 5С3 (№РККК (П) 684Д), 2Н2 (№РККК (П) 683 Д) и 7D12 (№РККК (П) 685 Д) соответственно.
Основными свойствами моноАТ 5СЗ являются:
– относится к классу IgGI;
– связывается с ФВ;
– не конкурирует за связывание с ФВ с моноАТ 2Н2 и 7D12.
Основными свойствами моноАТ 2Н2 являются:
– относится к классу IgG2b;
– связывается с ФВ,
– не конкурирует за связывание с ФВ с моноАТ 5С3 и 7D12.
Основными свойствами моноАТ 7D12 являются:
– относится к классу IgGI:
– связывается с ФВ:
– не конкурирует за связывание с ФВ с моноАТ 2Н2 и 53З.
Способность вышеуказанных моноАТ к связыванию с ФВ и отсутствие конкуренции между ними за связывание с этим антигеном (см. пример 1) позволило использовать все три антитела для создания системы ИФА для определения ФВ. Антитело 5С3 использовали в качестве иммобилизующего, а меченные биотином антитела 2Н2 и 7D12 – в качестве детектирующих. Применение смеси двух антител (2Н2 и 7D12) для детекции иммобилизованного ФВ позволило повысить чувствительность ИФА (см. пример 2). Предлагаемый метод позволяет определять ФВ в плазме больных болезнью Виллебранда с целью диагностики этой патологии (см. пример 3).
Для получения вышеописанных моноАТ использовали штаммы гибридных культивируемых клеток животных Mus. Musculus 5C3, 2Н2 и 7D12 соответственно.
Все штаммы являются продуктами слияния клеток мышиной миеломы X-63.Ag8.653 (субклон Р3О1 и клеток селезенки мыши, иммунизированной очищенным ФВ. Иммунизацию мышей проводили по следующей схеме: 25 мкг ФВ внутрибрюшинно в полном адъюванте Фрейнда: через 2 недели – внутрибрюшинно 25 мкг ФВ в адъюванте Фрейнда, через 2 недели – внутрибрюшинно 25 мкг ФВ, через 2 недели (за 3 дня до гибридизации) – внутривенно 5 мкг ФВ. Слияние и клонирование осуществляли по методу Келера и Мильштайна [Kohler G., Milstein С. Nature, 1975, 256:495-7]. Слияние проводили с помощью полиэтиленгликоля ПЭГ-1500, а селекцию гибридных клеток – с помощью селективной среды ГАТ (гипоксантин – аминоптерин – тимидин).
Штаммы характеризуются следующими свойствами.
Штамм гибридных культивируемых клеток животных Mus. Musculus 5С3.
Линия 5С3 – продукт слияния клеток миеломы X.63.Ag8.653 (субклон P3O1) и клеток селезенки мыши BALB/c, иммунизированной ФВ. Слияние проведено с помощью полиэтиленгликоля ПЭГ-1500. Селекция гибридных клеток проведена с помощью селективной среды ГАТ (гипоксантин – аминоптерин – тимидин). Штамм прошел 3 клонирования, позитивных клонов не менее 100%. В настоящее время после последнего клонирования штамм прошел 3 пассажа.
СТАНДАРТНЫЕ УСЛОВИЯ КУЛЬТИВИРОВАНИЯ: Среда RPMI-1640 с 20% эмбриональной коровьей сыворотки, 4 мМ L-глютамина, 1 мМ пирувата натрия, 100 ед/мл пенициллина и 100 мкг/мл стрептомицина.
КУЛЬТУРАЛЬНЫЕ СВОЙСТВА: Для выращивания штамма можно использовать культуральные флаконы. Во флакон площадью 25 см2 в 5 мл среды засевают 1×106 клеток. Пассаж производится при достижении плотности культуры – 1×106 клеток на 1 мл среды. Для выращивания клеток в брюшной полости мышей пригодны мыши BALB/c. За 10 дней до инъекции штамма мышам внутрибрюшинно вводят 0,5 мл пристана. Штамм инъецируют внутрибрюшинно по 1-5×106 клеток на мышь. Асцитную жидкость отбирают через 10-12 дней при максимальном объеме асцита.
КАРИОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА ШТАММА: Модальное число хромосом 66. Маркерных хромосом не выявлено.
КОНТАМИНАЦИИ: Бактерии и грибы в культуре не обнаружены при длительном наблюдении. Тест на микоплазму отрицателен.
БИОСИНТЕЗ ПОЛЕЗНОГО ПРОДУКТА: Секреция моноАТ 5С3 in vitro составляет 5-10 мкг/мл, в асцитной жидкости 2-5 мг/мл при определении по связыванию с иммобилизованным на пластике ФВ (см. ниже – отбор моноАТ).
КРИОКОНСЕРВИРОВАНИЕ: Клетки штамма ресуспендируют в эмбриональной коровьей сыворотке, содержащей 10% диметилсульфоксида в концентрации 3×106 клеток в 1 мл, разливают в пластиковые ампулы при 4°С, помещают в низкотемпературный холодильник при -70°С на 24 часа и затем переносят в жидкий азот. Клетки быстро размораживают при 37°С, разводят в 10 мл среды без сыворотки, осаждают центрифугированием, ресуспендируют в 5 мл той же среды, содержащей 20% сыворотки, и переносят в культуральный флакон. Жизнеспособность клеток, определенная по включению трипанового синего, составляет более 80%.
Штамм депонирован в коллекции РККК – №РККК (П) 684Д.
Штамм гибридных культивируемых клеток животных Mus. Musculus 2Н2.
Линия 2Н2 – продукт слияния клеток П X.63.Ag8.653 (субклон Р3О1 и клеток селезенки мыши BALB/c, иммунизированной ФВ. Слияние проведено с помощью полиэтиленгликоля ПЭГ-1500. Селекция гибридных клеток проведена с помощью селективной среды ГАТ (гипоксантин – аминоптерин – тимидин). Штамм прошел 3 клонирования, позитивных клонов не менее 100%. В настоящее время после последнего клонирования штамм прошел 3 пассажа.
СТАНДАРТНЫЕ УСЛОВИЯ КУЛЬТИВИРОВАНИЯ: Среда RPMI-1640 с 20% эмбриональной коровьей сыворотки, 4 мМ L-глютамина, 1 мМ пирувата натрия, 100 ед/мл пенициллина и 100 мкг/мл стрептомицина.
КУЛЬТУРАЛЬНЫЕ СВОЙСТВА: Для выращивания штамма можно использовать культуральные флаконы. Во флакон площадью 25 см2 в 5 мл среды засевают 1×106 клеток. Пассаж производится при достижении плотности культуры – 1×106 клеток на 1 мл среды. Для выращивания клеток в брюшной полости мышей пригодны мыши BALB/c. За 10 дней до инъекции штамма мышам внутрибрюшинно вводят 0,5 мл пристана. Штамм инъецируют внутрибрюшинно по 1-5×106 клеток на мышь. Асцитную жидкость отбирают через 10-12 дней при максимальном объеме асцита.
КАРИОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА ШТАММА: Модальное число хромосом 66. Маркерных хромосом не выявлено.
КОНТАМИНАЦИИ: Бактерии и грибы в культуре не обнаружены при длительном наблюдении. Тест на микоплазму отрицателен.
БИОСИНТЕЗ ПОЛЕЗНОГО ПРОДУКТА: Секреция моноАТ 2Н2 in vitro составляет 5-10 мкг/мл, в асцитной жидкости 2-5 мг/мл при определении по связыванию с иммобилизованным на пластике ФВ (см. ниже – отбор моноАТ).
КРИОКОНСЕРВИРОВАНИЕ: Клетки штамма ресуспендируют в эмбриональной коровьей сыворотке, содержащей 10% диметилсульфоксида в концентрации 3×106 клеток в 1 мл, разливают в пластиковые ампулы при 4°С, помещают в низкотемпературный холодильник при -70°С на 24 часа и затем переносят в жидкий азот. Клетки быстро размораживают при 37°С, разводят в 10 мл среды без сыворотки, осаждают центрифугированием, ресуспендируют в 5 мл той же среды, содержащей 20% сыворотки, и переносят в культуральный флакон. Жизнеспособность клеток, определенная по включению трипанового синего, составляет более 80%.
Штамм депонирован в коллекции РККК – №РККК (П) 683 Д.
Штамм гибридных культивируемых клеток животных Mus. Musculus 7D12.
Линия 7D12 – продукт слияния клеток миеломы X-63.Ag8.653 (субклон Р3О1 и клеток селезенки мыши BALB/c, иммунизированной ФВ. Слияние проведено с помощью полиэтиленгликоля ПЭГ-1500. Селекцию гибридных клеток проведена с помощью селективной среды ГАТ (гипоксантин – аминоптерин – тимидин). Штамм прошел 3 клонирования, позитивных клонов не менее 100%. В настоящее время после последнего клонирования штамм прошел 3 пассажа.
СТАНДАРТНЫЕ УСЛОВИЯ КУЛЬТИВИРОВАНИЯ: Среда RPMI-1640 с 20% эмбриональной коровьей сыворотки, 4 мМ L-глютамина, 1 мМ пирувата натрия, 100 ед/мл пенициллина и 100 мкг/мл стрептомицина.
КУЛЬТУРАЛЬНЫЕ СВОЙСТВА: Для выращивания штамма можно использовать культуральные флаконы. Во флакон площадью 25 см2 в 5 мл среды засевают 1×106 клеток. Пассаж производится при достижении плотности культуры – 1×106 клеток на 1 мл среды. Для выращивания клеток в брюшной полости мышей пригодны мыши BALB/c. За 10 дней до инъекции штамма мышам внутрибрюшинно вводят 0,5 мл пристана. Штамм инъецируют внутрибрюшинно по 1-5×106 клеток на мышь. Асцитную жидкость отбирают через 10-12 дней при максимальном объеме асцита.
КАРИОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА ШТАММА: Модальное число хромосом 66. Маркерных хромосом не выявлено.
КОНТАМИНАЦИИ: Бактерии и грибы в культуре не обнаружены при длительном наблюдении. Тест на микоплазму отрицателен.
БИОСИНТЕЗ ПОЛЕЗНОГО ПРОДУКТА: Секреция моноАТ 7D12 in vitro составляет 5-10 мкг/мл, в асцитной жидкости 3-6 мг/мл при определении по связыванию с иммобилизованным на пластике ФВ (см. ниже – отбор моноАТ).
КРИОКОНСЕРВИРОВАНИЕ: Клетки штамма ресуспендируют в эмбриональной коровьей сыворотке, содержащей 10% диметилсульфоксида в концентрации 3×106 клеток в 1 мл, разливают в пластиковые ампулы при 4°С, помещают в низкотемпературный холодильник при -70°С на 24 часа и затем переносят в жидкий азот. Клетки быстро размораживают при 37°С, разводят в 10 мл среды без сыворотки, осаждают центрифугированием, ресуспендируют в 5 мл той же среды, содержащей 20% сыворотки, и переносят в культуральный флакон. Жизнеспособность клеток, определенная по включению трипанового синего, составляет более 80%.
Штамм депонирован в коллекции РККК – №РККК (П) 685Д.
Отбор специфических моноАТ, связывающихся с ФВ, проводили с помощью ИФА. Для этого дно полистироловых 96-луночных планшетов покрывали очищенным ФВ – 5 мкг/мл ФВ в фосфатно-солевом буфере (ФСБ), рН 7,4, по 100 мкл на лунку, 1 час при 37°С. Не связавшийся с пластиком белок отмывали ФСБ, содержащим 0,05% Твин 20 (ФСБ/Твин), и блокировали места неспецифического связывания 1% бычьим сывороточным альбумином (БСА) в ФСБ/Твине – 150 мкл на лунку, 1 час при 37°С. Затем в лунки вносили по 50-100 мкл культуральной среды, содержащей продукты секреции гибридных клеток (моноАТ), инкубировали 30 мин при комнатной температуре, промывали лунки ФСБ/Твином, вносили в них меченные пероксидазой антитела козы против IgG мыши (BioRad, США) (по 100 мкл на лунку в 1% БСА/ФСБ/Твине, в разведении, предложенном изготовителем) и инкубировали 30 мин при комнатной температуре. Лунки промывали ФСБ/Твином и регистрировали связывание антител с помощью хромогенного субстрата (100 мкг/мл орто-фенилендиамина, 0,006% перекиси водорода, в цитратном буфере, рН 4,5, по 100 мкл на лунку). Реакцию останавливали добавлением 50 мкл 50% серной кислоты и регистрировали оптическую плотность в лунках при длине волны 492 нм (А492).
Для получения препаративных количеств антител 5С3, 2Н2 и 7D12 клетки соответствующих штаммов-продуцентов культивируют в брюшной полости мышей линии BALB/c. За 10 дней до инъекции клеток мышам вводят внутрибрюшинно по 0,5 мл пристана. Клетки вводят внутрибрюшинно по 1-5×106 на мышь. Асцитную жидкость отбирают через 10-12 дней при максимальном объеме асцита. Выделение моноАТ из асцитной жидкости проводят путем преципитации сульфатом аммония и последующей очистки с помощью ионообменной хроматографии на ToyoPearl DEAE 650-М.
Указанные штаммы и продуцируемые ими моноАТ являются частью заявляемого метода, объединены с ним единым изобретательским замыслом и направлены на решение единой задачи – создание ИФА для определения ФВ. Это позволяет рассматривать указанные изобретения как составные части единой группы изобретений.
Сущность указанной группы изобретений иллюстрируется следующими примерами.
Пример 1. Получение очищенных моноАТ 5С3, 2Н2 и 7D12, их связывание с ФВ и отсутствие конкуренции между ними за связывание с антигеном.
Получение препаративных количеств антител. Клетки штаммов 5С3, 2Н2 и 7D12 вводили внутрибрюшинно мышам линии BALB/c в количестве 5×106 на 1 мышь. За 10 дней до введения клеток мышам внутрибрюшинно вводили по 0,5 мл пристана. Асцитную жидкость отбирали через 10-12 дней после введения клеток при максимальном объеме асцита. Очистку антител из асцитной жидкости проводили с помощью солевого осаждения сульфатом аммония и последующей хроматографии на ToyoPearl-DEAE 650-М (Tosoh Biosep, США). К одному объему асцитной жидкости добавляли капельно 1 объем насыщенного раствора сульфата аммония и перемешивали в течение 1 час при комнатной температуре. Преципитат осаждали при 10000 g в течение 20 мин, растворяли в 10 мМ фосфатном буфере, рН 8,1 и диализовали против 10-кратного объема того же буфера (3 смены по 5 час при 4°С). После диализа и осаждения нерастворимого материала (10000 g, 15 мин, при 4°С) раствор антител наносили на колонку с DEAE-Toyo Soda-650 M (не более 10 мг на 1 мл сорбента), промывали колонку буфером нанесения (2 объема колонки) и элюировали антитела линейным градиентом фосфатного буфера 10-150 мМ, рН 8,1 (общий объем элюента – 10 объемов колонки). Белок во фракциях определяли по поглощению при длине волны 280 нм. Фракции, содержащие белок, тестировали на наличие антител с помощью ИФА, используя иммобилизованный на пластике ФВ (см. выше, отбор моноАТ). Фракции, содержащие антитела, объединяли, диализовали против 10-кратного объема фосфатно-солевого буфера (ФСБ), содержащего 0,15 М NaCI, 10 мМ фосфат натрия, рН 7,4 (3 смены по 5 час при 4°С). После диализа осаждали нерастворимый материал (10000 g, 15 мин при 4°С) и определяли содержание белка в растворе антител. Антитела в аликвотах по 1-2 мл хранили при -70°С.
Мечение антител биотином. Очищенные моноАТ 2Н2 и 7D12 метили биотином с помощью N-сукцинимидбиотина (Sigma, США). Антитела (2-3 мг в 1-2 мл ФСБ) диализовали против 100-кратного объема 100 мМ карбонатного буфера, рН 8,0 (2 смены по 5 час при 4°С). После диализа к раствору антител добавляли N-сукцинимдбиотина (свежеприготовленный раствор в ДМСО) в молярном соотношении антитело:N-сукцинимидбиотин – 1:40 (объем добавляемого раствора N-сукцинимидбиотина не более 1/20 объема раствора антител) и инкубировали 40 мин при 4°С и постоянном перемешивании). После инкубации антитела диализовали против 100-кратного объема ФСБ, рН 7,4 (2 смены по 5 час при 4°С). К меченным биотином антителам добавляли азид натрия (конечная концентрация 0,05%) и хранили при 4°С в течение 2-3 месяцев.
Исследование конкуренции между антителами 5С3, 2Н2 и 7D12 за связывание с ФВ. Немеченые антитела 5С3 и 2Н2 в концентрации 5 мкг/мл в ФСБ, рН 7,4 вносили в лунки 96-луночных полистироловых планшетов (по 100 мкл в лунку) и инкубировали 1 час при 37°С. Несорбированные антитела отмывали ФСБ/Твином и блокировали неспецифические места связывания 1% БСА/ФСБ/Твином (по 150 мкл на лунку, 1 час при 37°С). После этого вносили в лунки пул плазм здоровых доноров (получение пула – см. ниже, пример 3) в различных разведениях (фиг.1А) или очищенный ФВ в различных концентрациях (фиг.1Б) в 1% БСА/ ФСБ/Твине (по 100 мкл на лунку), инкубировали 30 мин при комнатной температуре и отмывали несвязавшийся с антителами ФВ ФСБ/Твином. Затем меченное биотином антитело 2Н2 вносили в лунки с сорбированным антителом 5С3, а меченное биотином антитело 7D12 – в лунки с сорбированными антителами 5С3 и 2Н2 (меченные биотином антитела добавляли в концентрации 10 мкг/мл в 1% БСА в ФСБ/Твине по 100 мкл на лунку), инкубировали 30 мин при комнатной температуре и отмывали несвязавшиеся меченые антитела ФСБ/Твином. После этого в лунку добавляли по 100 мкл стрептавидин-пероксидазы (ИМТЕК, Москва), в 1% БСА/ФСБ/Твине в разведении, предложенном изготовителем (по 100 мкл на лунку) инкубировали 30 мин при комнатной температуре и промывали лунки ФСБ-Твином. Связывание антител регистрировали с помощью хромогенного субстрата, как описано выше (см. раздел отбор моноАТ). Полученные результаты приведены на фиг.1, где на фиг.1А представлены результаты, полученные при титровании плазмы, а на фиг.1Б – при титровании очищенного ФВ (на обоих фиг. – кривые 1 -5С3 сорбированное + 2Н2-биотин, кривые 2 – 5С3 сорбированное + 7D12-биотин, кривые 3 – 2Н2 сорбированное + 7D12-биотин). Как видно из приведенных графиков, меченное биотином антитело 7D12 эффективно связывается с ФВ, иммобилизованным как с помощью антитела 5С3, так и 2Н2, а меченное биотином антитело 2Н2 с ФВ, иммобилизованным с помощью антитела 7D12. Сходные результаты были получены при использовании плазмы крови в качестве источника ФВ и очищенного ФВ. Эти результаты указывают на то, что все три антитела не конкурируют друг с другом за связывание с ФВ, т.е. направлены против разных эпитопов в молекуле антигена.
Пример 2. Иммуноферментный анализ проводили по методике примера 1, используя для иммобилизации ФВ антитело 5С3, а для детекции: (1) смесь двух меченных биотином антител, 2Н2 (5 мкг/мл) и 7D12 (5 мкг/мл), (2) меченное биотином моноАТ 2Н2 (10 мкг/мл), (3) меченное биотином моноАТ 7D12 (10 мкг/мл). В качестве источника ФВ использовали пул плазм здоровых доноров (получение – см. ниже, пример 3). На фиг.2 представлены результаты определения ФВ при использовании для детекции смеси двух моноАТ (кривая 1 -2Н2-биотин (5 мкг/мл) + 7D12-биотин (5 мкг/мл)) или каждого антитела по отдельности (кривая 2 – 2Н2-биотин (10 мкг/мл) и кривая 3 – 7D12-биотин (10 мкг/мл)). Как видно из этого чертежа определение ФВ с помощью двух меченых антител повышает чувствительность метода приблизительно в 2 раза по сравнению с определением, которое проводилось с использованием только одного меченого антитела, несмотря на то, что общая концентрация антител во всех случаях была одинаковой.
Таким образом, из приведенных данных следует возможность использования для определения ФВ как смеси меченных биотином двух моноАТ, 2Н2 и 7D12, так и каждого из этих антител по отдельности (что в некоторых случаях является достаточным и в то же время экономически более выгодно).
Пример 3. Определение ФВ в плазмах здоровых доноров и пациентов с болезнью Виллебранда.
Получение плазмы здоровых доноров и пациентов с болезнью Виллебранда. Кровь здоровых доноров и пациентов с болезнью Виллебранда (все пациенты находились на наблюдении в Гематологическом научном центре РАМН) собирали, используя в качестве антикоагулянта 5% ЭДТА (рН 7,4) в соотношении кровь:антикоагулянт – 9:1. Для получения плазмы кровь центрифугировали при 1500 g, 20 мин при комнатной температуре. Отбирали плазму, которую для полного удаления тромбоцитов повторно центрифугировали в микроцентрифуге при 10000 g, 5 мин при 4°С. Плазму разделяли на аликвоты по 0,1-0,2 мл и замораживали при -70°С. Непосредственно перед определением ФВ плазму быстро размораживали при 37°С в водяном термостате. Плазмы, полученные от 12 здоровых доноров, были объединены в общий пул и после этого разделены на аликвоты и заморожены.
Определение ФВ с помощью ИФА. ИФА проводили по методике примера 1, используя для иммобилизации антигена моноАТ 5С3, а для детекции – смесь двух меченных биотином антител – 2Н2 и 7D12. Для построения калибровочной кривой использовали очищенный ФВ. Определяли содержание ФВ в пуле плазм здоровых доноров, которое принимали за 100%, и плазмах 4 больных с болезнью Виллебранда.
Измерение ристоцитин-кофакторной активности исследованных плазм. Отмытые от плазмы тромбоциты здорового донора получали по методике ([Виноградов Д.В. и соавт. Биохимия, 1991, 56, с.787-97) и суспендировали в концентрации 5×108 мл. В кювету агрегометра (Биола, Москва) вносили по 150 мкл отмытых тромбоцитов и 150 мкл плазмы в различных разведения и затем 1,5 мг/мл (конечная концентрация) ристоцитина (Ренам, Москва). Агрегацию регистрировали по изменению светопропускания суспензии тромбоцитов в течение 3 мин 37°С и при перемешивании со скоростью 800 об/мин. Ристоцитин-кофакторную активность в каждой пробе оценивали по максимальному уровню светопропускания в процессе регистрации агрегации. Для построения калибровочной кривой использовали пул плазм здоровых доноров в различных разведениях, ристоцитин-кофакторную активность в котором принимали за 100%. Таким образом, было проведено определение ристоцитин-кофакторной активности в плазмах 4 пациентов с болезнью Виллебранда, у которых также было определено содержание ФВ с помощью ИФА. Сравнение результатов измерения ФВ с помощью ИФА и ристоцитин-кофакторной активности у пациентов с болезнью Виллебранда приведено в таблице.
| Результаты измерения ФВ с помощью ИФА и измерения ристоцитин-кофакторной активности у пациентов с болезнью Виллебранда. |
| Образец плазмы |
ФВ (ИФА) |
Ристоцитин-кофакторная активность, % |
| мкг/мл |
% |
| Пул плазм доноров |
14,0 |
100 |
100 |
| Больная М. (БВ* 1 типа) |
7,7 |
55 |
50 |
| Больная Ф. (БВ 3 типа) |
1,0 |
7 |
18 |
| Больная Л. (БВ 3 типа) |
2,1 |
15 |
12 |
| Больная О. (БВ 3 типа) |
0,14 |
1 |
13 |
| * БВ – болезнь Виллебранда. |
Из приведенных данных видно, что как содержание ФВ, измеренное с помощью ИФА, так и ристоцитин-кофакторная активность были снижены у всех 4 больных с болезнью Виллебранда. У 2 больных болезнью Виллебранда 1 типа содержание ФВ и ристоцитин-кофакторная активность были снижены приблизительно на 50% по сравнению с пулом плазм здоровых доноров, а у 3 больных с болезнью Виллебранда 3 типа эти показатели были ниже 20%. Нужно отметить, что у двоих пациентов (Ф. и О.) концентрация ФВ была снижена в большей степени, чем ристоцитин-ковакторная активность, что, возможно, обусловлено появлением в кровотоке крупных мультимеров этого белка, в результате чего у этих больных снижение количества ФВ может сочетаться с повышением его функциональной активности [Шиффман Ф.Д. Патофизиология крови, «Издательство Бином» – «Невский диалект», М.-СПб., 2000, с.233-238].
Полученные результаты указывают на возможность применения разработанного ИФА для диагностики болезни Виллебранда и на целесообразность сочетания этого метода с определением ристоцитин-кофакторной активности.
Формула изобретения
1. Иммуноферментный метод определения фактора Виллебранда, включающий в себя сорбцию антител к фактору Виллебранда в лунки планшета, отмывку несорбировавшихся антител буферным раствором, внесение в лунки анализируемую пробу, содержащую фактор Виллебранда, иммобилизацию фактора Виллебранда, внесение в пробы детектирующего реагента на основе антител, обработку проб хромогенным субстратом и измерение результатов с помощью спектроскопии, отличающийся тем, что в качестве иммобилизующего антитела используют моноклональное антитело 5С3, а в качестве детектирующего реагента смесь меченных биотином моноклональных антител 2Н2 и 7D12.
2. Способ по п.1, отличающийся тем, что в качестве детектирующего реагента используют меченное биотином антитело 2Н2.
3. Способ по п.1, отличающийся тем, что в качестве детектирующего реагента используют меченное биотином антитело 7D12.
4. Моноклональное антитело 5С3, характеризующееся тем, что продуцируется штаммом гибиридомных культивируемых клеток Mus musculus L. 5C3, относится к классу IgG1, направлено против фактора Виллебранда и не конкурирует за связывание с фактором Виллебранда с антителами 2Н2 и 7D12.
5. Моноклональное антитело 2Н2, характеризующееся тем, что продуцируется штаммом гибиридомных культивируемых клеток Mus musculus L. 2H2, относится к классу IgG2b, направлено против фактора Виллебранда и не конкурирует за связывание с фактором Виллебранда с антителами 5С3 и 7D12.
6. Моноклональное антитело 7D12, характеризующееся тем, что продуцируется штаммом гибиридомных культивируемых клеток Mus musculus L. 7D12 относится к классу IgG1, направлено против фактора Виллебранда и не конкурирует за связывание с фактором Виллебранда с антителами 5С3 и 2Н2.
7. Штамм гибридных культивируемых клеток Mus musculus L. 5C3, депонированный в РККК (№РККК (П) 684Д), используемый как продуцент моноклонального антитела 5C3 против фактора Виллебранда.
8. Штамм гибридных культивируемых клеток Mus musculus L. 2H2, депонированный в РККК (№РККК (П) 683Д), используемый как продуцент моноклонального антитела 2H2 против фактора Виллебранда.
9. Штамм гибридных культивируемых клеток Mus musculus L. 7D12, депонированный в РККК (№РККК (П) 685Д), используемый как продуцент моноклонального антитела 5C3 против фактора Виллебранда.
РИСУНКИ
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 01.04.2006
Извещение опубликовано: 27.04.2007 БИ: 12/2007
NF4A Восстановление действия патента СССР или патента Российской Федерации на изобретение
Дата, с которой действие патента восстановлено: 20.12.2008
Извещение опубликовано: 20.12.2008 БИ: 35/2008
|
|