|
(21), (22) Заявка: 2004130506/13, 18.10.2004
(24) Дата начала отсчета срока действия патента:
18.10.2004
(45) Опубликовано: 27.02.2006
(56) Список документов, цитированных в отчете о
поиске:
LEUNG DW et al. A restriction enzyme from Fusobacterium nucleatum 4H which recognizes GCNGC, Nucleic Acids Res. 1979 Jan; 6(1) p.17-25. HENNECKE F et.al. The vsr gene product of E.coli K-12 is a strand- and sequence-specific DNA mismatch endonuclease. Nature. 1991 Oct. 24; 353(6346), p.776-8. RU 2115728 С1, 20.07.1998. SU 1449583 A1, 07.01.1989. RU 2073717 С1, 20.02.1997. EP 0466332, 15.01.1992.
Адрес для переписки:
630117, г.Новосибирск, а/я 5, Л.Я. Кучумовой
|
(72) Автор(ы):
Дегтярев Сергей Харитонович (RU),
Чмуж Елена Васильевна (RU),
Абдурашитов Мурат Абдурашитович (RU),
Каширина Юлия Геннадьевна (RU),
Дедков Владимир Сергеевич (RU),
Томилова Юлия Эдуардовна (RU),
Мезенцева Нина Владимировна (RU),
Гончар Данила Александрович (RU)
(73) Патентообладатель(и):
Общество с ограниченной ответственностью “СибЭнзайм” (RU)
|
(54) ШТАММ БАКТЕРИЙ BACILLUS SUBTILIS – ПРОДУЦЕНТ ЭНДОНУКЛЕАЗЫ РЕСТРИКЦИИ Bisi
(57) Реферат:
Изобретение относится к биотехнологии и генной инженерии и касается получения нового штамма, используемого для выделения новой эндонуклеазы рестрикции BisI, которая может быть использована для выявления модифицированной ДНК. Штамм Bacillus subtilis 230, выделенный из почвы в результате поиска продуцентов рестриктаз, обеспечивает получение эндонуклеазы рестрикции BisI, узнающей и расщепляющей обе цепи нуклеотидной последовательности ДНК, содержащей хотя бы одно С5-метилцитозиновое основание в сайте узнавания 5′-GCNGC-3′. 3 ил., 1 табл. 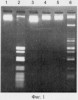
Изобретение относится к биотехнологии и касается получения нового штамма, используемого для выделения новой эндонуклеазы рестрикции, узнающей и расщепляющей последовательность нуклеотидов на двуцепочечной ДНК, при условии, что хотя бы одно из цитозиновых оснований узнаваемой последовательности метилировано в положении 5 (С5-метилцитозин): 5′-GCNGC-3′
3′-CGNCG-5′.
Эндонуклеаза рестрикции (рестриктаза), обладающая данной специфичностью, может быть использована для работ по выявлению и расщеплению метилированных участков ДНК, в частности ДНК эукариотических организмов, содержащей С5-метилцитозин.
Известен штамм Escherichia coli К MG1655, продуцирующий vsr-белок, узнающий и расщепляющий только одну (неметилированную) последовательность нуклеотидов из цепей двунитевой ДНК:
5′-CmC(А/Т)GG-3′
3′-GG(А/Т)СС-5′, где mC – С5-метилцитозин [Hennecke F., Kolmar H., Brundl К., Fritz H. – J. Nature – 1991, v.253, p.776-778].
Недостатком известного штамма является то, выделяемый из него vsr-белок расщепляет только одну из цепей двунитевой ДНК (неметилированную).
Известен штамм Diplococcus pneumoniae, продуцирующий рестриктазу DpnI, которая узнает и расщепляет метилированную нуклеотидную последовательность 5′-GmATC-3′, где mA – N6-метиладенин [Lacks S., Greenberg В.J. Biol. Chem. – 1975, v.250, p.4060-4066].
Недостатком известного штамма является то, что выделяемая из него рестриктаза не способна узнавать сайты, содержащие С5-метилцитозиновые основания.
Наиболее близким к заявляемому штамму – прототипом, является штамм Fusobacterium nucleatum, продуцирующий рестриктазу Fnu4HI, узнающую и расщепляющую последовательность нуклеотидов 5′-GCNGC-3′, не содержащую метилированных оснований [Leung D.W., Lui A.C.P., Merilees H., McBride B.C., Smith M. Nucleic Acids Res. – 1979, v.6, p.17-25].
Недостатком данного штамма является то, что продуцируемая им рестриктаза не способна узнавать и расщеплять сайты узнавания, содержащие С5-метилцитозиновые основания.
Технической задачей изобретения является получение бактериального штамма, продуцирующего эндонуклеазу рестрикции, которая узнает и расщепляет обе цепи нуклеотидной последовательности ДНК, содержащей ходя бы одно С5-метилцитозиновое основание в сайте узнавания 5′-GCNGC-3′.
Поставленная техническая задача достигается получением штамма Bacillus subtilis 230 – продуцента эндонуклеазы рестрикции BisI.
Предлагаемый штамм выделен из природного материала (почвы) в результате целенаправленного систематического поиска.
Полученный штамм Bacillus subtilis 230 депонирован в Коллекции культур микроорганизмов НПО “СибЭнзим” под регистрационным номером 1М38, а продуцируемая им рестриктаза, узнающая и расщепляющая только молекулы ДНК, которые содержат метилированные цитозиновые основания, названа BisI.
Штамм Bacillus subtilis 230 характеризуется следующими признаками:
Культурально-морфологические признаки. На среде Лурия-Бертрани (ЛБ) образует светло-серые, непрозрачные, зернистые, слегка выпуклые колонии с ровными краями. Клетки подвижные, палочковидные, размером 0,6-0,8×1,5-2,5 мкм, часто формирующие цепочки. Образуют эллиптические центрально-расположенные эндоспоры без разбухания спорангия.
Оптимальная температура роста 30°С, рН 7,0-7,2.
Физиолого-биохимические признаки. Не способны к анаэробному росту. Каталазоположительные. Реакция Фогес-Проскауэра положительная. Гидролизуют крахмал и казеин, не деградируют тирозин. Образуют кислоты из D-глюкозы, D-ксилозы, D-маннитола и L-арабинозы.
Хранение штамма осуществляется в лиофильно высушенном состоянии или в растворе 30% глицерина при температуре -60°С.
Для культивирования штамма применяют среду следующего состава (г/л): пептон – 10, дрожжевой экстракт – 5, NaCl – 5, вода дистиллированная – остальное. Культивирование проводят при 30°С с аэрацией до достижения стационарной стадии роста.
Выход целевого фермента составляет 30 ед/г сырой биомассы с удельной активностью 200 ед/мл.
Полученная эндонуклеаза рестрикции BisI характеризуется следующими свойствами:
– узнает и расщепляет последовательность нуклеотидов 5′-GCNGC-3′, в которой хотя бы одно из цитозиновых оснований метилировано в положении 5 (С5-метилцитозин);
– расщепляет связи между вторым цитозиновым остатком (С) и следующим нуклеотидом (N) в обеих цепях вышеприведенной метилированной последовательности;
– не расщепляет эту же последовательность, не содержащую С5-метилцитозиновых оснований (неметилированную);
– оптимальная температура действия 33-40°С;
– оптимальное значение рН для действия фермента 8,5-9,5;
– оптимальная концентрация соли при расщеплении ДНК – 100-200 мМ KCl;
– для активации BisI требуются ионы Mg2+, оптимальная концентрация – 10-20 мМ.
Определяющим отличием предлагаемого штамма от штамма Fusobacterium nucleatum является то, что первый продуцирует одну рестриктазу, которая узнает и расщепляет обе цепи нуклеотидной последовательности ДНК, содержащей ходя бы одно С5-метилцитозиновое основание в сайте узнавания 5′-GCNGC-3′. Таким образом, рестриктаза BisI представляет собой новый, не имеющий аналогов, фермент рестрикции.
Поскольку предлагаемый штамм получен впервые и для выделения рестриктазы, узнающей и расщепляющей вышеназванную последовательность нуклеотидов никогда не использовался, можно сделать вывод о соответствии предлагаемого штамма критериям изобретения “новизна” и “изобретательский уровень”.
Изобретение иллюстрируется примерами конкретного выполнения.
Пример 1.
Выращивание штамма и выделение фермента.
Для получения биомассы клетки штамма-продуцента переносят на агаризованную среду ЛБ в чашку Петри и инкубируют в течение ночи при 30°С. Свежевыращенные колонии переносят стерильной бактериологической петлей в колбы, содержащие жидкую питательную среду ЛБ и культивируют на качалках при 30°С при перемешивании – 150 об/мин, до достижения стационарной фазы роста. Клетки осаждают центрифугированием при 5000 об/мин при 4°С. Выход биомассы составляет 5 г/л среды. Дезинтеграцию, выделение и очистку фермента проводят по известной методике [Bickle T.A., Pirotta V., Imber R. Nucl. Fcids Res. 1977, v.4, p.2561-2572].
Пример 2.
Определение специфичности эндонуклеазы рестрикции BisI.
Специфичность фермента определяют по картинам специфического расщепления различных ДНК (фиг.1 и 2). В качестве субстратов для выявления расщепления используют ДНК бактериофагов лямбда и Т7, различные плазмидные ДНК, а также синтетические олигонуклеотидные ДНК-дуплексы, содержащие или не содержащие метилированные основания (С5-метилцитозин или А6-метиладенин). После инкубации в оптимальных условиях в течение 1 часа продукты реакции разделяют путем электрофореза в геле. Расщепление субстратов происходит только в случае присутствия в них последовательности 5′-GCNGC-3′, в которой хотя бы одно из цитозиновых оснований модифицировано до С5-метилцитозина.
На фиг.1 представлена электрофореграмма продуктов расщепления ДНК плазмид pUC19 и pFsp4HI эндонуклеазами рестрикции BisI и Fsp4HI. Дорожки 1-3 – ДНК pUC19, линеаризованная эндонуклеазой рестрикции BamHI; 4-6 – ДНК pFsp4HI, линеаризованная эндонуклеазой рестрикции BamHI. Дорожки 2 и 5 – ДНК обработана рестриктазой Fsp4HI; 3 и 6 – ДНК обработана рестриктазой BisI.
Поскольку плазмида pUC19 не содержит метилированных оснований в последовательности 5′-GCNGC-3′, она расщепляется эндонуклеазой рестрикции Fsp4HI (изошизомер эндонуклеазы рестрикции Fnu4HI) и не расщепляется рестриктазой BisI. Плазмида pFsp4HI содержит метилированную последовательность 5′-GCNGC-3′, поскольку включает в себя ген ДНК-метилтрансферазы Fsp4HI, осуществляющей данную модификацию ДНК. Из фиг.1 видно, что она расщепляется эндонуклеазой рестрикции BisI, но не расщепляется эндонуклеазой рестрикции Fsp4HI.
На фиг.2 представлена электрофореграмма продуктов расщепления радиоактивно меченных синтетических олигонуклеотидных дуплексов эндонуклеазами рестрикции BisI и Fsp4HI. Последовательности олигонуклеотидов приведены в таблице.
| Таблица. |
| Название |
Последовательность олигонуклеотида |
| L7 |
5′ GAGTTTAGCGGCTATCGATCT 3′ |
| L8 |
5′ AGATCGATAGCCGCTAAACTC 3′ |
| L9 |
5′ GAGTTTAG(m5C)GGCTATCGATCT 3′ |
| L10 |
5′ AGATCGATAG(m5C)CGCTAAACTC 3′ |
| L11 |
5′ GAGTTTAG(m5C)AGCTATCGATCT 3′ |
| L12 |
5′ AGATCGATAG(m5C)TGCTAAACTC 3′ |
Описание дорожек на электрофореграмме, изображенной на фиг.2:
1 – исходный дуплекс L7*/L8;
2 – дуплекс L7*/L8, расщепленный Fsp4HI;
3 – дуплекс L7*/L8 после инкубации с BisI;
4 – исходный дуплекс L9*/L10;
5 – дуплекс L9*/L10 после инкубации с Fsp4HI;
6 – дуплекс L9*/L10, расщепленный BisI;
7 – исходный дуплекс L11*/L12;
8 – дуплекс L11*/L12 после инкубации с Fsp4HI;
9 – дуплекс L11*/L12, расщепленный BisI.
Олигонуклеотиды, меченные радиоактивной меткой по 5′-концу, помечены знаком *.
Как видно из фиг.2, эндонуклеаза рестрикции BisI расщепляет дуплексы L9*/L10 и L11*/L12, содержащие метилированную последовательность 5′-GCNGC-3′, но не расщепляет дуплекс L7*/L8, который содержит такую же неметилированную последовательность.
Таким образом, эксперименты, проводимые с олигонуклеотидными дуплексами различного нуклеотидного состава, содержащими сайты узнавания BisI и Fsp4HI, подтверждают вывод о том, что для расщепления рестриктазой BisI ДНК требуется присутствие в ней последовательности 5′-GCNGC-3′, содержащей С5-метилцитозиновые основания.
Пример 3.
Определение позиций расщепления ДНК эндонуклеазой рестрикции BisI.
Определение позиций расщепления ДНК эндонуклеазой рестрикции BisI осуществляли путем сравнения длины фрагментов, образуемых при расщеплении олигонуклеотидных дуплексов эндонуклеазами рестрикции BisI и Fsp4HI (фиг.3). Последовательности олигонуклеотидов приведены в таблице. Олигонуклеотиды, меченные радиоактивной меткой по 5′-концу, помечены знаком *.
Описание дорожек на электрофореграмме, изображенной на фиг.3:
1 – исходный дуплекс L8*/L7;
2 – дуплекс L8*/L7, обработанный экзонуклеазой ExoIII;
3 – дуплекс L8*/L7, расщепленный Fsp4HI;
4 – дуплекс L10*/L9, расщепленный BisI;
5 – дуплекс L10*/L9, обработанный экзонуклеазой ExoIII;
6 – исходный дуплекс L10*/L9;
7 – исходный дуплекс L7*/L8;
8 – дуплекс L7*/L8, обработанный экзонуклеазой ExoIII;
9 – дуплекс L7*/L8, расщепленный Fsp4HI;
10 – дуплекс L9*/L10 расщепленный BisI;
11 – дуплекс L9*/L10, обработанный экзонуклеазой ExoIII;
12 – исходный дуплекс L9*/L10.
В качестве маркера длин фрагментов использовали продукты частичного расщепления этих же дуплексов экзонуклеазой ExoIII. Из фиг.3 видно, что фрагменты (продукты расщепления ДНК) на 3 и 4 и на 9 и 10 дорожках имеют одинаковую длину, что свидетельствует о совпадении позиций расщепления эндонуклеазами рестрикции BisI и Fsp4HI. Поскольку известно, что Fsp4HI расщепляет связи между вторым цитозиновым остатком и следующим нуклеотидом в сайте узнавания на обеих цепях, то из приведенной электрофореграммы следует, что эндонуклеаза рестрикции BisI расщепляет ДНК относительно сайта узнавания таким же образом.
Выход эндонуклеазы рестрикции BisI определяют по электрографической картине расщепления ДНК линеаризованной плазмиды pFsp4HI. За единицу активности принимают минимальное количество фермента, необходимое для полного расщепления 1 мкг ДНК линеаризованной плазмиды pFsp4HI в течение 1 часа при температуре 37°С. Выход фермента составляет 30 ед/г сырой биомассы, удельная активность 200 ед/мл.
Фермент хранится при – 20°С в глицерине.
Таким образом, получен новый штамм, продуцирующий эндонуклеазу рестрикции BsiI, узнающую и расщепляющую обе цепи нуклеотидной последовательности, обязательно содержащей С5-метилцитозиновые основания в обеих цепях двунитевой ДНК.
Формула изобретения
Штамм бактерий Bacillus subtilis ККМ НПО “СибЭнзим” 1М38 – продуцент эндонуклеазы рестрикции, узнающей и расщепляющей обе цепи нуклеотидной последовательности ДНК, содержащей хотя бы одно С5-метилцитозиновое основание в сайте узнавания 5′-GCNGC-3′.
РИСУНКИ
|