|
|
(21), (22) Заявка: 2004110414/13, 30.03.2004
(24) Дата начала отсчета срока действия патента:
30.03.2004
(43) Дата публикации заявки: 20.11.2004
(45) Опубликовано: 27.02.2006
(56) Список документов, цитированных в отчете о
поиске:
RU 2205872 С2, 10.06.2003. US 6060051, 09.05.2000. US 5264363, 23.11.1993. IT 1243392, 10.06.1994. US 6291426, 18.09.2001.
Адрес для переписки:
450054, г.Уфа, пр-кт Октября, 69, Институт биологии УНЦ РАН, А.И. Мелентьеву
|
(72) Автор(ы):
Мелентьев Александр Иванович (RU),
Кузьмина Людмила Юрьевна (RU),
Яковлева Ольга Валериевна (RU),
Курченко Владимир Петрович (BY)
(73) Патентообладатель(и):
Институт биологии Уфимского научного центра РАН (RU)
|
(54) ШТАММ БАКТЕРИЙ B. SUBTILIS – ПРОДУЦЕНТ СУРФАКТИНА
(57) Реферат:
Изобретение относится к области биотехнологии и может быть использовано для получения биогенного поверхностно-активного вещества сурфактина, обладающего множественной биологической активностью. Штамм Bacillus subtilis 0017 выделен из образца типичного чернозема Республики Башкортостан и поддерживается в коллекции микроорганизмов Института биологии Уфимского научного центра РАН. Регистрационный номер в коллекции – 0017. Штамм превосходит по уровню накопления сурфактина известные природные штаммы. 1 табл., 4 ил.
Изобретение относится к области биотехнологии и может быть использовано для получения биогенного поверхностно-активного вещества сурфактина, обладающего множественной биологической активностью. Его практическое применение возможно в нефтедобывающей промышленности для увеличения извлечения нефти из нефтеносных пластов [1], при очистке емкостей от остатков нефти, очистки загрязненной углеводородами почвы, для стабилизации и дестабилизации эмульсий [2, 3], а также в качестве биологически активного компонента фармпрепаратов.
Это вещество, согласно описанию Kakinuma et al. [4, 5], представляет собой смесь циклических гексапептидов, замкнутых в кольцо через  -гидрокси жирную кислоту с углеродной цепью из 13-15 атомов: -гидрокси жирную кислоту с углеродной цепью из 13-15 атомов:
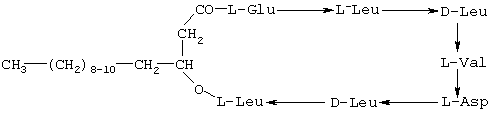
Сурфактин обладает множественной биологической активностью. Он способен лизировать эритроциты [6] и протопласты бактерий [7]. Кроме того, сурфактин ингибирует реакцию фибриноген-тромбин, замедляя образование фибрина [8]. Это свойство определяет его как возможный компонент при создании противокоагулирующих средств для профилактики тромбозов и для предотвращения болезней типа инфаркта миокарда, легочной эмболии и т.д.
Сурфактин проявляет антихолестеразную активность, снижая уровень холестерина в плазме и печени [9], обладает противоопухолевой [10], фунгицидной и антибиотической активностями [11]. Данный липопетид проявляет бактериостатические свойства даже при концентрациях 5-10 ppm.
Сурфактин является сильным поверхностно-активным соединением, при концентрации 0,05% поверхностное натяжение воды снижается с 72 мН/м до 27 мН/м [8].
Множественность полезных физико-химических, биологических и физиологических свойств этого вещества свидетельствует о том, что оно может широко использоваться в фармацевтике, технических и природоохранных областях.
Arima, К et al. [8] описал метод получения сурфактина, основанный на использовании природных штаммов бактерий B.subtilis ATCC 21331 или АТСС 21332. Однако эти штаммы обеспечивали выход не более 0.05-0.1 г/л сырого продукта и 0.04-0.05 г/л очищенного вещества, что экономически оказалось невыгодно.
Для повышения выхода сурфактина в процессах ферментации были предложены решения, основанные на подборе состава питательных сред, изменении технологических схем или на получении мутантных штаммов уже известного продуцента B.subtilis ATCC 21332.
Путем добавления в базовую питательную среду гидролизата торфа Sheppard J. and Mulligan С. [12] добились выхода 0,16 г/л сурфактина, используя известный продуцент.
Cooper D.G. et al., [13] предложили технологию получения сурфактина с помощью известного штамма B.subtilis ATCC 21332, основанную на непрерывном отборе пены из ферментера. Реализация данного решения позволила достичь выхода сурфактина 0,7-0,8 г/л.
Mulligan et al. [14] путем ультрафиолетового облучения известного продуцента B.subtilis ATCC 21332 получили мутант B.subtilis ATCC 53813, в 3,4 раза превосходящий исходный по продуктивности.
Carrera et al. [15, 16], используя в качестве мутагена N-метил-N’-нитро-N-нитрозогуанидин, получили из известного B.subtilis ATCC 21332 новый мутант B.subtilis ATCC 55033, обеспечивающий выход от 1,2 до 2,0 г/л сурфактина с чистотой 99%.
Ohno et al. [17] с помощью рекомбинантной плазмиды рС112 получили штамм Bacillus subtilis MI 113, превосходящий по продуктивности дикий штамм в 1,5 раза. Однако накопление сурфактина при глубинном культивировании не превышало 0,4 г/л, но при твердофазной ферментации этого рекомбинантного штамма на среде с коагулятом сои “Okara” в качестве субстрата продуктивность возросла до 2,0 г/кг сырого веса среды [18].
Основным недостатком известных рекомбинантных штаммов является недостаточная стабильность плазмид, несущих ген, регулирующий биосинтез сурфактина. К другим недостаткам следует отнести законодательные ограничения на применение генетически модифицированных микроорганизмов в природных условиях и фармацевтике, существующие в большинстве развитых стран.
В научных публикациях имеются данные о природных (“диких”) штаммах B.subtilis S 499 (продуктивность 110 мг/л) [19] и B.subtilis RB 14 (продуктивность 250 мг/л) [17], однако, их недостатком является сопродукция антибиотика итурина, который крайне сложно отделить от целевого продукта.
Цель настоящего изобретения – получение природного, генетически неизмененного штамма почвенных бактерий, превосходящего по уровню накопления сурфактина известные природные (“дикие”) штаммы.
Поставленная цель достигается предлагаемым штаммом Bacillus subtilis ИБ-17, выделенным из образца почвы типичного чернозема, отобранного на территории республики Башкортостан (Российская Федерация). Штамм поддерживается в Коллекции микроорганизмов лаборатории прикладной микробиологии Института биологии Уфимского научного центра РАН. Номер штамма в коллекции 0017 (ИБ-17).
Культурально-морфологические признаки. Спорообразующие, грамотрицательные, палочковидные подвижные клетки размером 0,9-1,7 на 5,6-9,9 мкм. Спорангий не раздувают, расположены субцентрально. На среде с мясопептонным агаром на 1 сутки образует колонии: овальные, диаметром 1,0-1,5 мм, плоские, непрозрачные, блестящие, кремового цвета. На седьмые сутки роста около 80% колоний разрастаются в размерах до 4-8 мм и приобретают неправильную форму за счет вторичного веерообразного разрастания исходной колонии. У колонии края приобретают ярко выраженный лопастной вид с незначительным бортиком по краям, где сохраняется исходный цвет и непрозрачность. Тогда как сама колония становится полупрозрачной, структура ее не однородная, в центре крупнозернистая с включением не прозрачных глыбок.
Физиологические признаки. Отношение к кислороду – строгий аэроб. Светонезависим. Хорошо растет в интервале температур от 30 до 45°С. Минимальная температура 10°С, максимальная 50°С. Растет в интервале рН от 4,5 до 9,0, оптимально – при рН 7,5. Галотолерантность характеризуется ростом при 7% NaCl. При сбраживании сахаров газа не образует. Гидролизует крахмал. Реакция Фогес-Проскауэра (образование ацетилметилкарбинола) положительная. Индол не образует. Дезаминирование фенилаланина не происходит. Разлагает тирозин и использует цитрат. Проявляет гемолитическую активность –  гемолиз, кислород независимый. гемолиз, кислород независимый.
По совокупности физиолого-биохимических признаков штамм принадлежит к семейству Bacillaceae и относится к роду Bacillus, виду subtilis [20].
Состав среды для культивирования, мас.%: крахмал – 1; пептон – 0,5; дрожжевой экстракт – 0,3; кукурузный экстракт – 0,3; К2HPO4 – 0,2; (NH4)2SO4 – 0,2; вода водопроводная – до 100. Штамм хранится на косяках картофельного агара или в лиофильно высушенном состоянии.
Образование заявляемым штаммом поверхностно-активного вещества – сурфактина характеризуется следующими примерами.
Пример 1. Поверхностно-активные свойства. Предлагаемый штамм Bacillus subtilis ИБ-17 выращивают в колбах объемом 250 мл со 100 мл питательной среды на качалке УВМТ-12 при 37°С и n=160 мин-1 в жидкой питательной среде следующего состава, г/л дистиллированной воды:
| Картофельный крахмал |
10,0 |
| Кукурузный экстракт |
1,5 |
| (NH4)2HPO4 |
2,0 |
| К2HPO4 |
2,0 |
| (NH4)2SO4 |
2,0 |
| СаСО3 |
5,0 |
| начальное рН |
8,2 |
Через 8, 10, 24, 30, 48, 72, 96, 120 часов от начала культивирования отбирают пробы для определения биомассы (г/л), оптической плотности (D630), рН. Поверхностное натяжение определяют методом отрыва кольца после отделения биомассы центрифугированием при n=4000 мин-1. Результаты, свидетельствующие о динамике роста и снижении поверхностного натяжения в процессе культивирования штамма Bacillus subtilis ИБ-17, представлены на рисунке 1. Снижение поверхностного натяжения с 72 мН/м до 27 мН/м характерно для сурфактинов.
Пример 2. Биологическая активность. Предлагаемый штамм Bacillus subtilis ИБ-17 выращивают как в примере 1 в течение 72 ч. Биомассу отделяют центрифугированием при n=4000 мин-1. Супернатант закисляют 2N HCl до рН 2,0 и оставляют на ночь при +4°С для формирования осадка. Осадок отделяют центрифугированием при n=4000 мин-1. Осадок трижды экстрагируют 10 мл метанола при комнатной температуре в течение 1,5 ч. Экстракты объединяют, добавляют 1 г активированного угля, встряхивают 15 мин на ротационном шейкере. Осветленный центрифугированием экстракт выпаривают в тигле при 60°С досуха и перерастворяют в 10 мл дистиллированной воды. Полученный раствор вносят в лунки чашек Петри агара с эритроцитами и сусло-агара, предварительно инокулированного пекарскими дрожжами Saccharomyces cervisiae. Чашки с эритроцитами выдерживают в течение 12 ч при температуре 10°С, затем 6 ч при комнатной температуре и определяют зоны гемолиза. Чашки с пекарскими дрожжами инкубируют в термостате при 28°С в течение 48 ч и измеряют зоны ингибирования роста дрожжей вокруг лунок. Результаты представляют в таблице:
| Концентрация вещества, мкг/мл |
Диаметр зоны гемолиза, мм |
Диаметр зоны ингибирования роста дрожжей, мм |
| 200 |
7,6±0,2 |
0,0 |
| 400 |
9,0±0,2 |
0,0 |
| 1000 |
11,2±0,3 |
0,0 |
Из литературных источников известно, что гемолиз эритроцитов одно из основных свойств сурфактинов, в то же время сурфактин не ингибирует рост дрожжевых клеток. Отсутствие ингибирования роста Saccharomyces cervisiae в данном случае свидетельствует об отсутствии сопродукции итурина [21].
Пример 3. ИК-спектроскопия. Культуру выращивают и выделяют сурфактин как в примере 2. Раствор сурфактина в дистиллированной воде высушивают лиофильно и полученный порошок диспергируют в вазелиновом масле и подвергают анализу на инфракрасном спектрофотометре Specord (Carl Zeiss Jena, ГДР) М-80. Данные спектра поглощения (фиг.2) свидетельствуют о наличии следующих полос: пептидных связей (1648 см-1); аминогрупп (1568 см-1), а также карбоксильных групп (1420 см-1) и сложноэфирных связей (1248 см-1, 1080 см-1), что характерно для молекул липопептидов.
Пример 4. Аминокислотный анализ. Культуру выращивают и выделяют вещество как в примере 2 и высушивают как в примере 3. Навеску сухого вещества (около 10 мг) помещают в стеклянную ампулу, добавляют 10 мл 6N HCl, запаивают и выдерживают в течение 24 часов при 110°С для гидролиза. Гидролизат анализируют с помощью Автоматического анализатора аминокислот ААА 339 М (Mikrotechna, Чехия). Данные аминокислотного анализа (фиг.3) свидетельствуют о наличии четырех доминирующих аминокислот: Аспарагиновой кислоты, Глутаминовой кислоты, Валина и Лейцина в соотношении 1:1:1:4, что свойственно сурфактину.
Пример 5. Хромато-масс-спектрометрия. Культуру Bacillus subtilis ИБ-17 выращивают как в примере 1. Биомассу отделяют центрифугированием при n=4000 мин-1. Супернатант закисляют 2N HCl до рН 2,0 и оставляют на ночь при +4°С для формирования осадка. Осадок отделяют центрифугированием при n=4000 мин-1. Осадок трижды экстрагируют 10 мл метанола при комнатной температуре в течение 1,5 ч. Экстракты объединяют, добавляют 1 г активированного угля, встряхивают 15 мин на ротационном шейкере. Осветленный центрифугированием экстракт выпаривают в тигле при 60°С досуха. Навеску полученного вещества перерастворяют в метаноле до концентрации 3,0 мг/мл и анализируют на масс-спектрометре, используя масс-детектор “Waters Micromass ZQ 2000” с электроспрей ионизацией (ESI). Условия детектирования положительно заряженных ионов следующие:
напряжение на капилляре – 3,0 кВ;
напряжение на конусе – 60 В,
напряжение на экстракторе – 5 В;
температура испарения – 150°С;
температура источника – 70°С;
расход азота при испарении – 150 л/ч;
расход азота на конусе – 50 л/ч.
В результате анализа вещества получают спектр заряженных частиц, характеризующийся кластером интенсивных пиков в интервале 1032-1150 m/z, характерным для изоформ сурфактина (фиг.4).
Пример 6. Продуктивность штамма. Предлагаемый штамм Bacillus subtilis ИБ-17 выращивают как в примере 1 в течение 72 ч и отделяют биомассу центрифугированием. Супернатант закисляют 2N HCl до рН 2,0 и оставляют на ночь при +4°С для формирования осадка. Осадок отделяют центрифугированием при n=4000 мин-1. Осадок трижды экстрагируют 10 мл метанола при комнатной температуре в течение 1,5 ч. Экстракты объединяют, добавляют 1 г активированного угля, встряхивают 15 мин на ротационном шейкере, фильтруют через капроновый мембранный фильтр с диаметром пор 0,2 мкм. Фильтрат анализируют методом высокоэффективной жидкостной хроматографии на приборе ГПЦ (Чехия) с ультрафиолетовым детектором при 205 нм. Условия разделения: подвижная фаза – ацетонитрил: 1%-ный раствор уксусной кислоты – 4:1; скорость потока 1,5 мл/мин; колонка Zorbax ODS (4,6 мм×25 см).
Содержание сурфактина в культуральной жидкости рассчитывают исходя из калибровочной кривой, построенной на основе растворов коммерческого препарата сурфактина (Sigma-Aldrich Co) чистотой 98,0%.
Выход сурфактина при данных условиях культивирования Bacillus subtilis ИБ-17 составляет 1798±87 мг/л.
Источники, принятые во внимание
14. Pat. 5037758 USA, C12N 001/20 Enhanced production of biosurfactant through the use of a mutated В subtilis strain. /Mulligan C.N., Chow T.Y./ Publ. August 6, 1991.
15. Pat. 5227294 USA, C12P 021/02; C12P 001/125 Method of producing surfactin with the use of mutant of Bacillus subtilis. / Carrera P., Cosmina P., Grandi G./ Publ. July 13, 1993.
16. Pat. 5264363 USA, C12R 001/125; C12P 021/04 Mutant of Bacillus subtilis. / Carrera P., Cosmina P., Grandi G./ Publ. November 23, 1993.
20. Bergey’s manual of systematic bacteriology/ – Baltimore: Willliams & Wilkins Co., 1986, – V.2, – P.1104-1141.
21. Feignier С., Besson F., Geoges M. Studies on lipopeptide biosynthesis by Bacillus subtilis: Isolation and characterization of iturin–, surfactin+
Формула изобретения
Штамм бактерий Bacillus subtilis №0017 (Коллекция микроорганизмов Института биологии УНЦ РАН) – продуцент сурфактина.
РИСУНКИ
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 31.03.2008
Извещение опубликовано: 27.03.2010 БИ: 09/2010
|
|