|
|
(21), (22) Заявка: 2003112610/04, 04.10.2001
(24) Дата начала отсчета срока действия патента:
04.10.2001
(30) Конвенционный приоритет:
10.10.2000 (пп.1-11) GB 0024795.7
(43) Дата публикации заявки: 20.02.2005
(45) Опубликовано: 27.02.2006
(56) Список документов, цитированных в отчете о
поиске:
RU 2130453 C1, 20.05.1999. RU 2142946 С1, 20.12.1999. RU 2142455 С1, 10.12.1999.
(85) Дата перевода заявки PCT на национальную фазу:
12.05.2003
(86) Заявка PCT:
EP 01/11474 (04.10.2001)
(87) Публикация PCT:
WO 02/30907 (18.04.2002)
Адрес для переписки:
101000, Москва, М.Златоустинский пер., 10, кв.15, “ЕВРОМАРКПАТ”, пат.пов. Н.Н.Пивницкой
|
(72) Автор(ы):
ДАЙМОК Брайан Уилльям (GB),
ДЖОНС Филип Стивен (GB),
МЕРРЕТТ Джон Герберт (GB),
ПАРРАТТ Мартин Джон (GB)
(73) Патентообладатель(и):
Ф.ХОФФМАНН-ЛЯ РОШ АГ (CH)
|
(54) ПРОИЗВОДНЫЕ ПИРАЗОЛА ДЛЯ ЛЕЧЕНИЯ ВИРУСНЫХ ЗАБОЛЕВАНИЙ
(57) Реферат:
Изобретение относится к производным пиразола формулы I-A
где R1 означает (С1-С12)алкил, который необязательно может быть замещен 1-3 заместителями, выбранными из фтора, хлора и брома, (С3-С8)циклоалкил, фенил, пиридил или (С1-С4)алкил, замещенный фенилом; R2′ означает необязательно замещенный фенил, где фенил может быть замещен 1-2 заместителями, выбранными из (С1-С4)алкила, (С1-С4)алкоксила, гидроксила, фтора, хлора, брома, циангруппы и нитрогруппы; R3 означает (С1-С12)алкил или (С1-С4)алкокси-(С1-С4)алкил; А’ означает (С1-С4)алкил, замещенный необязательно замещенным фенилом или необязательно замещенным 4-пиридилом, где фенил или 4-пиридил могут быть замещены 1-2 заместителями, выбранными из (С1-С4)алкила, (С1-С4)алкоксила, гидроксила, фтора, хлора, брома, циангруппы и NRR’, где R и R’ независимо друг от друга означают водород или (С1-С4)алкил, или А’ означает группу формулы СН2-U-гетероциклил, где U представляет O, S или NR”, где R” означает водород или (С1-С4)алкил и где гетероциклил означает пиридил или пиримидинил, который необязательно замещен 1-2 заместителями, выбранными из (С1-С4)алкила, фтора, хлора, брома, циангруппы, нитрогруппы и NRR’, где R и R’ независимо друг от друга означают водород или (С1-С4)алкил, или А’ означает группу формулы СН(ОН)фенил, или А’ означает группу CH=CHW, где W означает фенил; Х означает S или О, и их фармацевтически приемлемым солям. Эти соединения являются ингибиторами обратной транскриптазы вируса иммунодефицита человека (ВИЧ) и, следовательно, могут применяться при лечении заболевания, опосредованного ВИЧ. Объектом изобретения также является фармацевтическая композиция для применения при лечении заболеваний, опосредованных ВИЧ. 2 н. и 9 з.п. ф-лы, 6 табл.
Изобретение относится к новым и известным производным пиразола, к способу их получения, к фармацевтическим композициям и к применению таких соединений в медицине, в особенности, при лечении вирусных заболеваний. В частности, эти соединения являются ингибиторами обратной транскриптазы вируса иммунодефицита человека, то есть ингибиторами фермента, вовлеченного в репликацию вируса. Следовательно, соединения по настоящему изобретению могут быть с успехом применены в качестве терапевтических средств для лечения заболеваний, опосредованных вирусом иммунодефицита человека (ВИЧ).
Заболевание, синдром приобретенного иммунного дефицита (СПИД), является конечным результатом инфицирования определенными ретровирусами, вирусом иммунодефицита человека типа-1 (ВИЧ-1) или типа-2 (ВИЧ-2). Некоторые важные точки в цикле жизни вируса были определены как возможные мишени для терапевтического воздействия. Ингибирование одной из них, транскрипции вирусной РНК в вирусную ДНК (обратная транскриптаза, RT), обеспечило ряд современных вариантов терапии, применяемых при лечении СПИД. Ингибирование обратной транскриптазы обеспечило первый тип лечения ВИЧ-инфекции с помощью 3′-азидо-3′-дезокситимидина (АЗТ). С тех пор были задействованы несколько ингибиторов, в общих чертах, представляющих два класса: аналоги нуклеозидов и ненуклеозиды. В качестве примера последних было обнаружено, что некоторые бензоксазиноны, например эфавиренц, полезны для ингибирования обратной транскриптазы ВИЧ. Однако постоянной проблемой является развитие вирусных штаммов, устойчивых к существующим ингибиторам обратной транскриптазы. Поэтому важной целью является разработка соединений, эффективных против устойчивых штаммов.
Производные пиразола описаны в литературе для различного применения (например, в агрохимии или для лечения связанных со стрессом заболеваний).
В европейском патенте ЕР 0627423 описываются производные пиразола и их применение в качестве бактерицидов для сельскохозяйственных садовых растений.
Патент US 6005109 описывает производные пиразола и их применение для лечения заболеваний, связанных со стрессом.
Но еще не были описаны в литературе производные пиразола для лечения заболеваний, опосредованных вирусом иммунодефицита человека (ВИЧ).
Целью настоящего изобретения является обеспечение производными пиразола, которые являются сильнодействующими ингибиторами обратной транскриптазы вируса иммунодефицита человека, фермента, вовлеченного в репликацию вируса, и которые соответственно обладают способностью быть эффективными в качестве противовирусных лекарственных средств.
Представленное изобретение описывает применение соединений формулы I
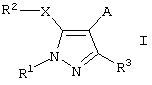
где R1 означает необязательно замещенный (С1-С12)алкил, (С3-С8)циклоалкил, ацил, (С1-С4)алкилсульфонил, необязательно замещенный фенилсульфонил, арил, гетероциклил или (С1-С4)алкил, замещенный необязательно замещенным фенилом;
R2 означает арил или необязательно замещенный фенил;
R3 означает (С1-С12)алкил или (С1-С4)алкокси-(С1-С4)алкил;
А означает группу, выбранную из СН2-(арил-/С1-С4/алкиламино), СН2-(арил-/С1-С4/алкокси), СН2-(гетероциклил-/С1-С4/алкокси), (С1-С4)алкила, замещенного необязательно замещенным арилом или необязательно замещенным гетероциклилом, или
А означает группу формулы СН2-U-гетероциклил,
где U представляет О, S или NR”, где R” означает водород или (C1-С4)алкил, или
А означает группу формулы CH(V)Z,
где V является ОН или F и
где Z представляет арил или гетероциклил, или
А означает группу формулы CH=CHW,
где W означает необязательно замещенный арил или необязательно замещенный гетероциклил;
Х означает S или О,
для лечения заболеваний, опосредованных вирусом иммунодефицита человека (ВИЧ), или для получения лекарственного средства для такого лечения.
Термин “алкил”, как он используется в контексте, означает необязательно замещенный углеводородный остаток с прямой или разветвленной цепью, содержащий от 1 до 12 атомов углерода, как, например, метил, этил, н-пропил, изопропил, н-бутил, 1-втор-бутил, изобутил, трет-бутил, пентил, гексил, гептил, октил, нонил, децил, ундецил, додецил, включая их различные изомеры. Предпочтительно термин “алкил” означает необязательно замещенный углеводородный остаток с прямой или разветвленной цепью, содержащий от 1 до 7 или от 1 до 6 атомов углерода. Наиболее предпочтительно термин “алкил” означает необязательно замещенный углеводородный остаток с прямой или разветвленной цепью, содержащий от 1 до 4 атомов углерода.
Подходящие заместители для алкильной цепи могут быть выбраны из одного или нескольких заместителей, таких, как арил, гетероциклил, алкоксил, гидроксил или галоген. Термины “арил”, “гетероциклил”, “алкоксил” и “галоген” определены ниже. Предпочтительными заместителями для алкильной цепи являются 1-5 заместителей, выбранных из фтора, хлора и брома, более предпочтительны 1-5 фторсодержащих заместителей и наиболее предпочтительны 1-3 фторсодержащих заместителя.
В том случае, когда более одного заместителя связано с алкильной группой, эти заместители могут быть одинаковыми или могут отличаться друг от друга.
Арил (определенный ниже) в качестве заместителя для алкильной группы может также быть замещен 1-5 заместителями, выбранными из (С1-С4)алкила, (С1-С4)алкоксила, гидроксила, фтора, хлора или брома. Более предпочтительно арил замещается 1-3 заместителями, выбранными из метила, этила, метоксигруппы, этоксигруппы, гидроксила, фтора, хлора или брома.
Гетероциклил (определенный ниже) в качестве заместителя для алкильной группы может также быть замещен 1, 2, 3 или 4 (когда химически возможно) заместителями, выбранными из (С1-С4)алкила, (С1-С4)алкоксила, гидроксила, фтора, хлора или брома. Более предпочтительно гетероциклил замещается 1-2 заместителями, выбранными из метила, этила, метоксигруппы, этоксигруппы, гидроксила, фтора, хлора или брома.
Алкил в R1 является предпочтительно необязательно замещенным углеводородным остатком с прямой или разветвленной цепью, содержащим от 1 до 7, от 1 до 6 или от 1 до 4 атомов углерода, как установлено выше. Подходящие заместители для алкильной группы выбираются из арила, гетероциклила или галогена. Предпочтительными заместителями для алкильной цепочки являются 1-5 заместителей, выбранных из фтора, хлора и брома, более предпочтительными являются 1-5 фторсодержащих заместителей и наиболее предпочтительно 1-3 фторсодержащих заместителя. Более предпочтительным алкилом в R1 является метил, этил, н-пропил, изопропил, н-бутил, 1-втор-бутил, изобутил, трет-бутил, пентил, гексил, гептил, включая их различные изомеры, трифторметил или 2,2,2-трифторэтил. Наиболее предпочтительным алкилом в R1 является метил, этил, н-пропил, изопропил, н-бутил, 1-втор-бутил, изобутил, трет-бутил, пентил, гексил, гептил.
Алкил в R3 предпочтительно означает незамещенный углеводородный остаток с прямой или разветвленной цепью, содержащий от 1 до 7 атомов углерода, и наиболее предпочтительны метил, этил, н-пропил, изопропил, н-бутил, 1-втор-бутил, изобутил, трет-бутил, пентил, гексил, гептил, включая их различные изомеры. Более предпочтительным алкилом в R3 является незамещенный углеводородный остаток с прямой или разветвленной цепью, содержащий от 1 до 4 атомов углерода.
Термин “циклоалкил”, как он используется в контексте, означает необязательно замещенную циклоалкильную группу, содержащую от 3 до 8 атомов углерода, например циклопропил, циклобутил, циклопентил, циклогексил, циклогептил или циклооктил, которая может быть также сконденсирована с необязательно замещенным насыщенным, частично ненасыщенным или ароматическим моноциклическим, бициклическим или трициклическим гетероциклом или карбоциклом, например с фенилом.
Подходящие заместители для циклоалкила могут быть выбраны из одного или нескольких, указанных для алкила.
Циклоалкил в R1 означает, как определено выше, предпочтительно незамещенную циклоалкильную группу, содержащую от 3 до 6 углеродных атомов, как, например, циклопропил, циклобутил, циклопентил или циклогексил. Более предпочтительно циклоалкил в R1 означает циклопентил или циклогексил.
Термин “алкоксил”, как он используется в контексте, означает необязательно замещенную алкилоксигруппу с прямой или разветвленной цепью, содержащую от 1 до 7 углеродных атомов, где представляющая “алкил” часть является такой, как определено выше. Примерами алкоксигрупп являются метокси-, этокси-, н-пропилокси-, изопропилокси-, н-бутилокси-, 1-втор-бутилокси-, изобутилокси-, трет-бутилокси-, пентилокси-, гексилокси-, гептилоксигруппы, включая их различные изомеры.
Подходящие заместители для алкоксигруппы выбираются из арила, гидроксила, галогена или аминогруппы.
Термин “алкоксиалкил”, как он используется в контексте, означает алкоксигруппу, содержащую от 1 до 4 атомов углерода, как определено выше, которая связана с алкильной группой, содержащей от 1 до 4 атомов углерода (предпочтительно 1-2 атома углерода), как определено выше. Примерами являются метоксиметил, метоксиэтил, метоксипропил, этоксиметил, этоксиэтил, этоксипропил, пропилоксипропил, метоксибутил, этоксибутил, пропилоксибутил, бутилоксибутил, трет-бутилоксибутил, включая их различные изомеры. Предпочтительной алкоксиалкильной группой в рамках данного изобретения является (С1-С2)алкокси-(С1-С2)алкил.
Алкоксиалкил в R3 предпочтительно означает метоксиметил, метоксиэтил, этоксиметил или этоксиэтил.
Термин “ацил”, как он используется в контексте, означает группу формулы С(=O)Н, С(=O)алкил или С(=O)фенил, где алкил означает необязательно замещенный углеводородный остаток с прямой или разветвленной цепью, содержащий от 1 до 4 атомов углерода. Наиболее предпочтительными ацильными группами являются С(=O)Н, С(=O)алкил или С(=O)фенил, где алкил является незамещенным углеводородным остатком с прямой или разветвленной цепью, содержащим от 1 до 4 атомов углерода.
Ацил в R1 означает независимо друг от друга предпочтительно метоксикарбонил (ацетил), этилкарбонил (пропионил), пропилкарбонил, бутилкарбонил или фенилкарбонил (бензоил).
Термин “алкилсульфонил”, как он используется в контексте, означает группу формулы S(=O)2(алкил), где алкил означает необязательно замещенный углеводородный остаток с прямой или разветвленной цепью, содержащий от 1 до 4 атомов углерода, предпочтительно означает незамещенный углеводородный остаток с прямой или разветвленной цепью, содержащий от 1 до 4 атомов углерода. Более предпочтительными алкилсульфонильными группами являются метилсульфонил, этилсульфонил, н-пропилсульфонил, изопропилсульфонил, н-бутилсульфонил, 1-втор-бутилсульфонил, изобутилсульфонил или трет-бутилсульфонил.
Алкилсульфонил в R1 означает предпочтительно метилсульфонил, этилсульфонил, н-пропилсульфонил, изопропилсульфонил, н-бутилсульфонил, 1-втор-бутилсульфонил, изобутилсульфонил или трет-бутилсульфонил.
Термин “арил”, как он используется в контексте, означает необязательно замещенный фенил и нафтил, оба необязательно сконденсированные по бензольному кольцу с необязательно замещенным насыщенным, частично ненасыщенным или ароматическим моноциклическим, бициклическим или трициклическим гетероциклом или карбоциклом, например с циклогексилом или циклопентилом.
Подходящие заместители для арила могут быть выбраны из 1, 2, 3, 4 или 5, предпочтительно из 1, 2 или 3 остатков из тех, которые указаны для алкила, предпочтительно выбраны из (С1-С4)алкила, (С1-С4)алкоксила, гидроксила, фтора, хлора, брома, циангруппы, нитрогруппы, S-(С1-С4)алкила и NRR’, где R и R’ означают независимо друг от друга водород или (С1-С4)алкил. Заместители для арила могут быть также выбраны из (С1-С4)алкила, (С1-С4)алкоксила, гидроксила, фтора, хлора или брома.
В случае, когда более одного заместителя соединено с арильной группой, эти заместители могут быть одинаковыми или могут отличаться друг от друга.
Арил в R1 предпочтительно означает фенил, 2-хлорфенил, 3-хлорфенил, 4-хлорфенил, 1-фторфенил, 2-фторфенил или 3-фторфенил. Наиболее предпочтительно арил в R1 означает фенил.
Арил в R2 означает предпочтительно фенил или нафтил.
Необязательно замещенный фенил в R2 может быть фенилом, замещенным 1-5 заместителями, предпочтительно 1, 2 или 3 остатками, выбранными из (C1-С4)алкила, (С1-С4)алкоксила, гидроксила, фтора, хлора, брома, циангруппы и нитрогруппы. Заместители для фенила в R2 могут также быть выбраны из (C1-С4)алкила, (С1-С4)-алкоксила, гидроксила, фтора, хлора или брома. Примерами необязательно замещенного фенила являются фенил, 2-метилфенил, 3-метилфенил, 4-метилфенил, 2,3-диметилфенил, 2,4-диметилфенил, 2,5-диметилфенил, 2,6-диметилфенил, 3,4-диметилфенил, 3,5-диметилфенил, 3,6-диметилфенил, 2-метоксифенил, 3-метоксифенил, 4-метоксифенил, 2,3-диметоксифенил, 2,4-диметоксифенил, 2,5-диметоксифенил, 2,6-диметоксифенил, 3,4-диметоксифенил, 3,5-диметоксифенил, 3,6-диметоксифенил, 2-гидроксифенил, 3-гидроксифенил, 4-гидроксифенил, 2,3-дигидроксифенил, 2,4-дигидроксифенил, 2,5-дигидроксифенил, 2,6-дигидроксифенил, 3,4-дигидроксифенил, 3,5-дигидроксифенил, 3,6-дигидроксифенил, 2-фторфенил, 3-фторфенил, 4-фторфенил, 2,3-дифторфенил, 2,4-дифторфенил, 2,5-дифторфенил, 2,6-дифторфенил, 3,4-дифторфенил, 3,5-дифторфенил, 2,3,4-трифторфенил, 3,4,5-трифторфенил, 2,3,4,5,6-пентафторфенил, 2-хлорфенил, 3-хлорфенил, 4-хлорфенил, 2,3-дихлорфенил, 2,4-дихлорфенил, 2,5-дихлорфенил, 2,6-дихлорфенил, 3,4-дихлорфенил, 3,5-дихлорфенил, 2,3,4-трихлорфенил, 3,4,5-трихлорфенил, 2,3,4,5,6-пентахлорфенил, 2-бромфенил, 3-бромфенил, 4-бромфенил, 2,3-дибромфенил, 2,4-дибромфенил, 2,5-дибромфенил, 2,6-дибромфенил, 3,4-дибромфенил, 3,5-дибромфенил, 3,6-дибромфенил, 2-цианфенил, 3-цианфенил, 4-цианфенил, 2,3-дицианфенил, 2,4-дицианфенил, 2,5-дицианфенил, 2,6-дицианфенил, 3,4-дицианфенил, 3,5-дицианфенил, 3,6-дицианфенил, 2-нитрофенил, 3-нитрофенил, 4-нитрофенил, 2,3-динитрофенил, 2,4-динитрофенил, 2,5-динитрофенил, 2,6-динитрофенил, 3,4-динитрофенил, 3,5-динитрофенил, 3,6-динитрофенил, 1-хлор-2-метоксифенил, 1-хлор-3-метоксифенил, 1-хлор-4-метоксифенил, 1-хлор-5-метоксифенил, 2-хлор-1-метоксифенил, 2-хлор-3-метоксифенил, 2-хлор-4-метоксифенил, 2-хлор-5-метоксифенил, 3-хлор-1-метоксифенил, 3-хлор-2-метоксифенил, 3-хлор-4-метоксифенил, 3-хлор-5-метоксифенил. Более предпочтительными примерами необязательно замещенного фенила являются фенил, 2-метоксифенил, 3-метоксифенил, 4-метоксифенил, 2-хлорфенил, 3-хлорфенил, 4-хлорфенил, 2,3-дихлорфенил, 2,4-дихлорфенил, 2,5-дихлорфенил, 2,6-дихлорфенил, 3,4-дихлорфенил, 3,5-дихлорфенил, 2,3,4-трихлорфенил, 3,4,5-трихлорфенил или 2,3,4,5,6-пентахлорфенил. Наиболее предпочтительными примерами необязательно замещенного фенила являются фенил, 4-метоксифенил, 3-хлорфенил или 3,5-дихлорфенил.
Термин “необязательно замещенный фенилсульфонил”, как он используется в контексте, означает группу формулы S(=O)2(фенил), где фенил необязательно замещен 1-5 заместителями, предпочтительно 1, 2 или 3 остатками, выбранными из (С1-С4)алкила, (С1-С4)алкоксила, гидроксила, фтора, хлора или брома. Примерами необязательно замещенного фенила являются такие, как упомянуто выше, предпочтительно фенилсульфонил.
Термин “(С1-С4)алкил, замещенный необязательно замещенным арилом (предпочтительно фенилом)”, как он используется в контексте, означает (C1-С4)алкил, как определено выше, который замещен арильной группой (предпочтительно фенильной группой) или замещенной арильной группой (предпочтительно замещенной фенильной группой), которая замещена 1, 2, 3, 4 или 5, предпочтительно 1, 2 или 3, остатками заместителей, выбранных из (C1-С4)алкила, (С1-С4)алкоксила, гидроксила, фтора, хлора, брома, циангруппы, S-(С1-С4)алкила и NRR’, где R и R’ независимо друг от друга означают водород или (С1-С4)алкил. Заместители для замещенного арила (предпочтительно фенила) могут также быть выбраны из (С1-С4)алкила, (С1-С4)алкоксила, гидроксила, фтора, хлора, брома и циангруппы или заместители могут необязательно быть выбраны из (С1-С4)алкила, (С1-С4)алкоксила, гидроксила, фтора, хлора или брома. В случае, когда более одного заместителя соединено с арильной группой (предпочтительно с фенильной группой), эти заместители могут быть одинаковыми или могут отличаться друг от друга. Предпочтительные заместители для замещенного арила (предпочтительно фенила) выбираются из метила, этила, метоксигруппы, этоксигруппы, гидроксила, фтора, хлора, брома или заместители выбираются из метила, этила, метоксигруппы, этоксигруппы, гидроксила, фтора, хлора, брома, циангруппы, аминогруппы, метиламино- и диметиламиногруппы. В рамках данного изобретения “(С1-С2)алкил, замещенный необязательно замещенным фенилом” предпочтителен. Примерами являются фенилметил (бензил), фенилэтил, фенилпропил, фенилбутил, толилметил, толилэтил, толилпропил, толилбутил, 2,3-диметилфенилметил, 2,4-диметилфенилметил, 2,5-диметилфенилметил, 2,6-диметилфенилметил, 3,4-диметилфенилметил, 3,5-диметилфенилметил, 3,6-диметилфенилметил, метоксифенилметил, метоксифенилэтил, метоксифенилпропил, метоксифенилбутил, диметоксифенилметил, диметоксифенилэтил, диметоксифенилпропил, диметоксифенилбутил, 2-гидроксифенилметил, 3-гидроксифенилметил, 4-гидроксифенилметил, 2,3-дигидроксифенилметил, 2,4-дигидроксифенилметил, 2,5-дигидроксифенилметил, 2,6-дигидроксифенилметил, 3,4-дигидроксифенилметил, 3,5-дигидроксифенилметил, 3,6-дигидроксифенилметил, 2-гидроксифенилэтил, 3-гидроксифенилэтил, 4-гидроксифенилэтил, 2-гидроксифенилпропил, 3-гидроксифенилпропил, 4-гидроксифенилпропил, 2-гидроксифенилбутил, 3-гидроксифенилбутил, 4-гидроксифенилбутил, 2-фторфенилметил, 3-фторфенилметил, 4-фторфенилметил, 2,3-дифторфенилметил, 2,4-дифторфенилметил, 2,5-дифторфенилметил, 2,6-дифторфенилметил, 3,4-дифторфенилметил, 3,5-дифторфенилметил, 3,6-дифторфенилметил, 2-фторфенилэтил, 3-фторфенилэтил, 4-фторфенилэтил, 2-хлорфенилметил, 3-хлорфенилметил, 4-хлорфенилметил, 2,3-дихлорфенилметил, 2,4-дихлорфенилметил, 2,5-дихлорфенилметил, 2,6-дихлорфенилметил, 3,4-дихлорфенилметил, 3,5-дихлорфенилметил, 3,6-дихлорфенилметил, 2-хлорфенилэтил, 3-хлорфенилэтил, 4-хлорфенилэтил, 2-бромфенилметил, 3-бромфенилметил, 4-бромфенилметил, 2,3-дибромфенилметил, 2,4-дибромфенилметил, 2,5-дибромфенилметил, 2,6-дибромфенилметил, 3,4-дибромфенилметил, 3,5-дибромфенилметил, 3,6-дибромфенилметил, 2-бромфенилэтил, 3-бромфенилэтил, 4-бромфенилэтил, 2-цианфенилметил, 3-цианфенилметил, 4-цианфенилметил, 2,3-дицианфенилметил, 2,4-дицианфенилметил, 2,5-дицианфенилметил, 2,6-дицианфенилметил, 3,4-дицианфенилметил, 3,5-дицианфенилметил, 3,6-дицианфенилметил, 2-диметиламинофенилметил, 3-диметиламинофенилметил, 4-диметиламинофенилметил, 2,3-ди-диметиламинофенилметил, 2,4-ди-диметиламинофенилметил, 2,5-ди-диметиламинофенилметил, 2,6-ди-диметиламинофенилметил, 3,4-ди-диметиламинофенилметил, 3,5-ди-диметиламинофенилметил или 3,6-ди-диметиламинофенилметил.
Для R1 (С1-С4)алкил, замещенный необязательно замещенным фенилом, является таким, как определено выше, предпочтительно фенилметилом (бензилом).
(С1-С4)Алкилы, замещенные необязательно замещенным фенилом, для заместителя А являются такими, как определено выше, предпочтительно они означают фенилметил (бензил), 4-метилфенилметил, 4-метоксифенилметил, 4-нитрофенилметил, 4-фторфенилметил, 4-хлорфенилметил, 4-бромфенилметил, фенилэтил, 4-метилфенилэтил, 4-метоксифенилэтил, 4-нитрофенилэтил, 4-фторфенилэтил, 4-хлорфенилэтил, 4-бромфенилэтил, фенилпропил, фенилбутил, 2-цианфенилметил, 3-цианфенилметил, 4-цианфенилметил, 2,3-дицианфенилметил, 2,4-дицианфенилметил, 2,5-дицианфенилметил, 2,6-дицианфенилметил, 3,4-дицианфенилметил, 3,5-дицианфенилметил, 3,6-дицианфенилметил, 2-диметиламинофенилметил, 3-диметиламинофенилметил, 4-диметиламинофенилметил, 2,3-ди-диметиламинофенилметил, 2,4-ди-диметиламинофенилметил, 2,5-ди-диметиламинофенилметил, 2,6-ди-диметиламинофенилметил, 3,4-ди-диметиламинофенилметил, 3,5-ди-диметиламинофенилметил или 3,6-ди-диметиламинофенилметил. Более предпочтительными примерами являются фенилметил (бензил), фенилэтил, 2-цианфенилметил, 3-цианфенилметил, 4-цианфенилметил, 2-диметиламинофенилметил, 3-диметиламинофенилметил или 4-диметиламинофенилметил.
Арил в СН(ОН)-арил для заместителя А является таким, как определено выше, предпочтительно фенилом, нафтилом или необязательно замещенной фенильной группой. Подходящие заместители для арила могут быть выбраны из 1, 2, 3, 4 или 5 заместителей, таких, как (С1-С4)алкил, (С1-С4)алкоксил, гидроксил, фтор, хлор или бром, предпочтительно из 1, 2 или 3 остатков, как метил, этил, метоксигруппа, этоксигруппа, гидроксил, фтор, хлор или бром. Предпочтительным арилом в СН(ОН)-ариле для заместителя А является фенил.
Арил в СН(F)-ариле для заместителя А является таким, как обозначено выше, предпочтительно это фенил, нафтил или необязательно замещенная фенильная группа. Подходящие заместители для арила могут быть выбраны из 1, 2, 3, 4 или 5 заместителей в виде (С1-С4)алкила, (С1-С4)алкоксила, гидроксила, фтора, хлора или брома, предпочтительно это 1, 2 или 3 остатка в виде метила, этила, метоксигруппы, этоксигруппы, гидроксила, фтора, хлора или брома. Предпочтительным арилом в СН(F)-ариле для заместителя А является фенил.
Арил в СН=СН-ариле для заместителя А является таким, как определено выше, предпочтительно фенилом или необязательно замещенной фенильной группой. Этендиильная группа (-СН=СН-) может иметь (Е)- или (Z)-конфигурацию. Обе изомерные формы этих соединений охватываются настоящим изобретением. Предпочтительной конфигурацией этендиильной группы в рамках изобретения является (Е)-конфигурация. Подходящие заместители для арила могут быть выбраны из 1, 2, 3, 4 или 5 заместителей, таких, как (С1-С4)алкил, (С1-С4)алкоксил, гидроксил, фтор, хлор или бром, предпочтительно это 1, 2 или 3 остатка в виде метила, этила, метоксигруппы, этоксигруппы, гидроксила, фтора, хлора или брома. Предпочтительным арилом в СН=СН-ариле для заместителя А является фенил, 4-метилфенил, 4-метоксифенил, 4-фторфенил или 4-хлорфенил. Наиболее предпочтительным арилом в СН=СН-ариле для заместителя А является фенил.
Термин “арилалкокси”, как он используется в контексте, означает арил или необязательно замещенную арильную группу, как определено выше, связанную с алкоксигруппой, содержащей от 1 до 4 атомов углерода, как определено выше. Предпочтительными примерами являются фенилметилоксигруппа (фенилметокси- или бензилоксигруппа), 4-метилфенилметоксигруппа, 4-метоксифенилметоксигруппа, 4-фторфенилметоксигруппа или 4-хлорфенилметоксигруппа. Наиболее предпочтительным примером является фенилметилоксигруппа.
Термин “арилалкиламино”, как он используется в контексте, означает группу формулы N(R)-(С1-С4)алкиларил, где арил или необязательно замещенная арильная группа, как определено выше, соединена с алкильной группой, содержащей от 1 до 4 атомов углерода, которая связана с аминогруппой. Аминогруппа также замещена R, где R означает водород или незамещенный углеводородный остаток с прямой или разветвленной цепью, содержащий от 1 до 4 атомов углерода. Примером является фенилметиламино(метил) (бензиламинометил).
Термин “гетероциклил”, как он используется в контексте, означает необязательно замещенный ароматический или неароматический моноциклический или бициклический гетероцикл, который содержит один или несколько гетероатомов, выбранных из азота, кислорода и серы. Также включены в рамки представленного изобретения гетероциклические соединения с оксо(=O)-группой. Примерами подходящих гетероциклов являются фурил, 1-пирролил, 2-пирролил, 1-тиофенил, 2-тиофенил, 2-пиридинил (2-пиридил), 3-пиридинил (3-пиридил), 4-пиридинил (4-пиридил), 1H-пиридин-2-он, 1Н-пиридин-4-он, 3Н-пиримидин-4-он, пиридазин (1,2-диазин), пиримидин (1,3-диазин), пиразин (1,4-диазин), оксазол или изоксазол (изо-оксазол).
Подходящие заместители для гетероциклила могут быть выбраны из 1, 2, 3 или 4 (когда химически возможно), более предпочтительно из 1, 2 или 3, наиболее предпочтительно из 1 или 2 заместителей, выбранных из (C1-С4)алкила, фтора, хлора, брома, циангруппы, нитрогруппы и NRR’, где R и R’ независимо друг от друга означают водород или (С1-С4)алкил. Заместители для замещенного гетероциклила могут быть также выбраны из (С1-С4)алкила, (C1-С4)алкоксила, гидроксила, циангруппы, фтора, хлора и брома или заместители могут необязательно быть выбраны из (С1-С4)алкила, (С1-С4)алкоксила, гидроксила, фтора, хлора и брома. В том случае, когда более чем один заместитель соединен с гетероциклильной группой, такие заместители могут быть одинаковыми или отличаются друг от друга. Для всех приведенных примеров для “гетероциклила” эти заместители могут находиться в любом химически возможном положении. Например, метилпиридил означает, что метильный заместитель может быть присоединен по 3, 4, 5 или 6 положению 2-пиридила, или по 2, 4, 5 или 6 положению 3-пиридила, или по 2, 3, 5 или 6 положению 4-пиридила.
Термин “(С1-С4)алкил, замещенный необязательно замещенным гетероциклилом”, как используется в контексте для заместителя А, означает (С1-С4)алкил, как определено выше, который замещен гетероциклильной группой или замещенной гетероциклильной группой, которая замещена 1, 2, 3 или 4 (когда химически возможно), более предпочтительно 1, 2 или 3, наиболее предпочтительно 1 или 2 заместителями, выбранными из (С1-С4)алкила, (C1-С4)алкоксила, гидроксила, фтора, хлора, брома, циангруппы, S-(С1-С4)алкила и NRR’, где R и R’ независимо друг от друга означают водород или (С1-С4)алкил. Заместители для замещенного гетероциклила могут также быть выбраны из (C1-С4)алкила, (С1-С4)алкоксила, гидроксила, фтора, хлора и брома. В рамках данного изобретения предпочтительны алкил с 1 атомом углерода, (C1-С2)- и (С3-С4)алкил, замещенный необязательно замещенным гетероциклилом. Примерами являются фурилметил, фурилэтил, фурилпропил, фурилбутил, метилфурилметил, метилфурилэтил, диметилфурилметил, этилфурилметил, метоксифурилметил, метоксифурилэтил, диметоксифурилметил, гидроксифурилметил, гидроксифурилэтил, дигидроксифурилметил, фторфурилметил, дифторфурилметил, хлорфурилметил, хлорфурилэтил, дихлорфурилметил, бромфурилметил, дибромфурилметил, пирролилметил, пирролилэтил, пирролилпропил, пирролилбутил, метилпирролилметил, метилпирролилэтил, диметилпирролилметил, этилпирролилметил, метоксипирролилметил, метоксипирролилэтил, диметоксипирролилметил, гидроксипирролилметил, гидроксипирролилэтил, дигидроксипирролилметил, фторпирролилметил, дифторпирролилметил, хлорпирролилметил, хлорпирролилэтил, дихлорпирролилметил, бромпирролилметил, дибромпирролилметил, тиофенилметил (2-тиофенилметил, 3-тиофенилметил), тиофенилэтил, тиофенилпропил, тиофенилбутил, метилтиофенилметил, метилтиофенилэтил, диметилтиофенилметил, этилтиофенилметил, метокситиофенилметил, метокситиофенилэтил, диметокситиофенилметил, гидрокситиофенилметил, гидрокситиофенилэтил, дигидрокситиофенилметил, фтортиофенилметил, дифтортиофенилметил, хлортиофенилметил, хлортиофенилэтил, дихлортиофенилметил, бромтиофенилметил, дибромтиофенилметил, пиридинилметил (2-пиридинилметил, 3-пиридинилметил, 4-пиридинилметил), пиридинилэтил, пиридинилпропил, пиридинилбутил, 3-метил-2-пиридинилметил, 4-метил-2-пиридинилметил, 5-метил-2-пиридинилметил, 6-метил-2-пиридинилметил, 2-метил-3-пиридинилметил, 4-метил-3-пиридинилметил, 5-метил-3-пиридинилметил, 6-метил-3-пиридинилметил, 2-метил-4-пиридинилметил, 3-метил-4-пиридинилметил, 5-метил-4-пиридинилметил, 6-метил-4-пиридинилметил, 3-метокси-2-пиридинилметил, 4-метокси-2-пиридинилметил, 5-метокси-2-пиридинилметил, 6-метокси-2-пиридинилметил, 2-метокси-3-пиридинилметил, 4-метокси-3-пиридинилметил, 5-метокси-3-пиридинилметил, 6-метокси-3-пиридинилметил, 2-метокси-4-пиридинилметил, 3-метокси-4-пиридинилметил, 5-метокси-4-пиридинилметил, 6-метокси-4-пиридинилметил, 3-фтор-2-пиридинилметил, 4-фтор-2-пиридинилметил, 5-фтор-2-пиридинилметил, 6-фтор-2-пиридинилметил, 2-фтор-3-пиридинилметил, 4-фтор-3-пиридинилметил, 5-фтор-3-пиридинилметил, 6-фтор-3-пиридинилметил, 2-фтор-4-пиридинилметил, 3-фтор-4-пиридинилметил, 5-фтор-4-пиридинилметил, 6-фтор-4-пиридинилметил, 3-хлор-2-пиридинилметил, 4-хлор-2-пиридинилметил, 5-хлор-2-пиридинилметил, 6-хлор-2-пиридинилметил, 2-хлор-3-пиридинилметил, 4-хлор-3-пиридинилметил, 5-хлор-3-пиридинилметил, 6-хлор-3-пиридинилметил, 2-хлор-4-пиридинилметил, 3-хлор-4-пиридинилметил, 5-хлор-4-пиридинилметил, 6-хлор-4-пиридинилметил, 3-бром-2-пиридинилметил, 4-бром-2-пиридинилметил, 5-бром-2-пиридинилметил, 6-бром-2-пиридинилметил, 2-бром-3-пиридинилметил, 4-бром-3-пиридинилметил, 5-бром-3-пиридинилметил, 6-бром-3-пиридинилметил, 2-бром-4-пиридинилметил, 3-бром-4-пиридинилметил, 5-бром-4-пиридинилметил, 6-бром-4-пиридинилметил, 3-циан-2-пиридинилметил, 4-циан-2-пиридинилметил, 5-циан-2-пиридинилметил, 6-циан-2-пиридинилметил, 2-циан-3-пиридинилметил, 4-циан-3-пиридинилметил, 5-циан-3-пиридинилметил, 6-циан-3-пиридинилметил, 2-циан-4-пиридинилметил, 3-циан-4-пиридинилметил, 5-циан-4-пиридинилметил, 6-циан-4-пиридинилметил, 3-(метилтио)-2-пиридинилметил, 4-(метилтио)-2-пиридинилметил, 5-(метилтио)-2-пиридинилметил, 6-(метилтио)-2-пиридинилметил, 2-(метилтио)-3-пиридинилметил, 4-(метилтио)-3-пиридинилметил, 5-(метилтио)-3-пиридинилметил, 6-(метилтио)-3-пиридинилметил, 2-(метилтио)-4-пиридинилметил, 3-(метилтио)-4-пиридинилметил, 5-(метилтио)-4-пиридинилметил, 6-(метилтио)-4-пиридинилметил, 2-хлор-3-метил-4-пиридинилметил, 2-хлор-5-метил-4-пиридинилметил, 2-хлор-6-метил-4-пиридинилметил, 3-хлор-5-метил-4-пиридинилметил, 3-хлор-6-метил-4-пиридинилметил, 5-хлор-6-метил-4-пиридинилметил, метилпиридинилэтил, диметилпиридинилметил, этилпиридинилметил, метоксипиридинилметил, метоксипиридинилэтил, диметоксипиридинилметил, гидроксипиридинилметил, гидроксипиридинилэтил, дигидроксипиридинилметил, фторпиридинилметил, дифторпиридинилметил, хлорпиридинилметил, хлорпиридинилэтил, дихлорпиридинилметил, бромпиридинилметил, дибромпиридинилметил, индолилметил, индолилэтил, индолилпропил, индолилбутил, метилиндолилметил, метилиндолилэтил, диметилиндолилметил, этилиндолилметил, метоксииндолилметил, метоксииндолилэтил, диметоксииндолилметил, гидроксииндолилметил, гидроксииндолилэтил, дигидроксииндолилметил, фториндолилметил, дифториндолилметил, хлориндолилметил, хлориндолилэтил, дихлориндолилметил, броминдолилметил, диброминдолилметил, 2-бромпиримидин-4-ил, 5-бромпиримидин-4-ил, 6-бромпиримидин-4-ил, оксазолилметил, 3-метилоксазолилметил, 4-метилоксазолилметил, 5-метилоксазолилметил, 3,5-диметилоксазолилметил, 3,4-диметилоксазолилметил, 4,5-диметилоксазолилметил или изоксазолилметил. Предпочтительными примерами являются фурилметил, фурилэтил, пирролилметил, пирролилэтил, пиридинилметил (2-пиридинилметил, 3-пиридинилметил, 4-пиридинилметил), 4-пиридинилэтил, индолилметил, индолилэтил, 2-бромпиримидин-4-ил, 5-бромпиримидин-4-ил, 6-бромпиримидин-4-ил, тиофенилметил (2-тиофенилметил, 3-тиофенилметил), тиофенилэтил, 6-бромпиримидин-4-ил, оксазолилметил, 3-метилоксазолилметил, 4-метилоксазолилметил, 5-метилоксазолилметил, 3,5-диметилоксазолилметил, 3,4-диметилоксазолилметил, 4,5-диметилоксазолилметил, изоксазолилметил, 3-метокси-4-пиридинилметил, 2-фтор-4-пиридинилметил, 2-хлор-4-пиридинилметил, 3-хлор-4-пиридинилметил, 5-бром-3-пиридинилметил, 3-циан-2-пиридинилметил, 2-(метилтио)-3-пиридинилметил, 3-хлор-5-метил-4-пиридинилметил и наиболее предпочтительными примерами являются 4-пиридинилметил и 4-пиридинилэтил.
Формула “СН2-U-гетероциклил”, как она используется в контексте для заместителя А, означает гетероциклильную группу, как определено выше, которая соединена с группой “U”, которая означает О, S или NR”, где R” означает водород или (С1-С4)алкил. Составляющая “гетероциклил-U” связана с метильной группой. Вышеупомянутая гетероциклильная группа необязательно замещена 1-4, предпочтительно 1-3, более предпочтительно 1-2 заместителями, выбранными из (С1-С4)алкила, фтора, хлора, брома, циангруппы, нитрогруппы и NRR’, где R и R’ независимо друг от друга означают водород или (С1-С4)алкил. Предпочтительными примерами составляющей “гетероциклил-U” являются 4-пиридилокси-, 3-пиридилокси-, 2-пиридилокси-, 2-нитро-3-пиридилокси-, 2-амино-3-пиридилокси-, 4-метил-3-пиридилокси-, 5-хлор-3-пиридилокси-, 2-амино-6-метил-1,3-пиримидин-4-илоксигруппа, 4-пиридилмеркапто-, 3-пиридилмеркапто-, 2-пиридилмеркаптогруппа, 4-пиридиламино-, 3-пиридиламино- или 2-пиридиламиногруппа.
Гетероциклил в СН(ОН)-гетероциклиле для заместителя А является таким, как определено выше, предпочтительно это фурил, 1-пирролил, 2-пирролил, 2-пиридинил, 3-пиридинил или 4-пиридинил, или необязательно замещенная гетероциклильная группа. Подходящие заместители для гетероциклила могут быть выбраны из 1, 2, 3 или 4 (когда химически возможно) заместителей из (C1-С4)алкила, (С1-С4)алкоксила, гидроксила, фтора, хлора или брома, предпочтительно из 1 или 2 заместителей, таких, как метил, этил, метоксигруппа, этоксигруппа, гидроксил, фтор, хлор или бром. Предпочтительными гетероциклильными остатками в СН(ОН)-гетероциклиле для заместителя А являются 2-пиридинил, 3-пиридинил или 4-пиридинил.
Гетероциклил в СН(F)-гетероциклиле для заместителя А является таким, как определено выше, предпочтительно это фурил, 1-пирролил, 2-пирролил, 2-пиридинил, 3-пиридинил или 4-пиридинил, или необязательно замещенная гетероциклильная группа. Подходящие заместители для гетероциклила могут быть выбраны из 1, 2, 3 или 4 (когда химически возможно) заместителей из (C1-С4)алкила, (С1-С4)алкоксила, гидроксила, фтора, хлора или брома, предпочтительно из 1 или 2 заместителей, таких, как метил, этил, метоксигруппа, этоксигруппа, гидроксил, фтор, хлор или бром. Предпочтительным гетероциклильным остатком в СН(Р)-гетероциклиле для заместителя А является 4-пиридинил.
Гетероциклил в СН=СН-гетероциклиле для заместителя А является таким, как определено выше, предпочтительно это пиридинил или необязательно замещенная пиридинильная группа. Этилендиильная группа (-СН=СН-) может иметь (Е)- или (Z)-конфигурацию. Обе изомерные формы таких соединений охватываются настоящим изобретением. Предпочтительной конфигурацией этилендиильной группы в рамках данного изобретения является (Е)-конфигурация. Подходящие заместители для гетероциклила могут быть выбраны из 1, 2, 3 или 4 (когда химически возможно) заместителей из (С1-С4)алкила, (C1-С4)алкоксила, гидроксила, фтора, хлора или брома, предпочтительно из 1 или 2 заместителей, таких, как метил, этил, метоксигруппа, этоксигруппа, гидроксил, фтор, хлор или бром. Предпочтительным гетероциклильным остатком в СН=СН-гетероциклиле для заместителя А является пиридинил, 4-метилпиридинил, 4-метоксипиридинил, 4-фторпиридинил или 4-хлорпиридинил. Наиболее предпочтительным гетероциклильным остатком в СН=СН-гетероциклиле для заместителя А является пиридинил.
Термин “гетероциклилалкокси”, как он используется в контексте, означает арил или необязательно замещенную гетероциклильную группу, как определено выше, которая связана с алкоксигруппой, содержащей от 1 до 4 атомов углерода, как определено выше. Предпочтительными примерами являются 4-пиридилметилоксигруппа (4-пиридилметоксигруппа), 3-пиридилметилоксигруппа (3-пиридилметоксигруппа), 2-пиридилметилоксигруппа (2-пиридилметоксигруппа).
Термин “галоген” означает фтор, хлор, бром и иод. Более предпочтительно галоген означает фтор, хлор или бром и наиболее предпочтительно галоген означает фтор или хлор.
В рамках данного изобретения термин “X” означает S или О, предпочтительно S.
Любая функциональная (то есть, реакционноспособная) группа, присутствующая в боковой цепи, может быть защищена с помощью защитной группы, являющейся известной как таковой, например, описанной в книге “Защитные группы в органическом синтезе”, 2-ое издание, T.W.Greene и P.G.M.Wuts, John Wiley & Sons, Нью-Йорк, штат Нью-Йорк, 1991. Например, аминогруппа может быть защищена трет-бутоксикарбонилом (ВОС) или бензилоксикарбонилом (Z).
Соединения по этому изобретению могут содержать один или несколько асимметрических атомов углерода и могут поэтому существовать в виде рацематов или рацемических смесей, отдельных энантиомеров, диастереомерных смесей и индивидуальных диастереомеров. Кроме того, если соединение по изобретению содержит олефиновую двойную связь, то можно говорить о (Е)-или (Z)-конфигурации. Также каждый хиральный центр может характеризоваться (R)- или (S)-конфигурацией. Все эти изомерные формы таких соединений охватываются настоящим изобретением.
Соединения формулы I, которые являются кислотами, могут образовывать фармацевтически приемлемые соли с основаниями, как, например, гидроокиси щелочных металлов, например гидроокись натрия и гидроокись калия, гидроокиси щелочноземельных металлов, например гидроокись кальция, гидроокись бария и гидроокись магния и им подобные, с органическими основаниями, например с N-этилпиперидином, дибензиламином и им подобными. Соединения формулы I, являющиеся основными, могут образовывать фармацевтически приемлемые соли с неорганическими кислотами, например с галоидводородными кислотами, как, например, соляная кислота и бромистоводородная кислота, с серной кислотой, азотной кислотой и фосфорной кислотой и им подобными, и с органическими кислотами, например с уксусной кислотой, муравьиной кислотой, винной кислотой, янтарной кислотой, фумаровой кислотой, малеиновой кислотой, яблочной кислотой, салициловой кислотой, лимонной кислотой, метансульфокислотой и п-толуолсульфокислотой, и им подобными. Образование и выделение таких солей может быть осуществлено согласно способам, известным в данной области.
Предпочтительным вариантом осуществления изобретения является применение соединений формулы I
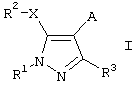
где R1 означает необязательно замещенный (С1-С12)алкил, (С3-С8)циклоалкил, ацил, (С1-С4)алкилсульфонил, необязательно замещенный фенилсульфонил, арил, гетероциклил или (С1-С4)алкил, замещенный необязательно замещенным фенилом,
где (С1-С12)алкил может быть замещен 1-5 заместителями, выбранными из фтора, хлора и брома, и
где фенил может быть замещен 1-5 заместителями, выбранными из (C1-С4)алкила, (С1-С4)алкоксила, гидроксила, фтора, хлора, брома и циангруппы;
R2 означает замещенный фенил,
где фенил может быть замещен 1-5 заместителями, выбранными из (C1-С4)алкила, (С1-С4)алкоксила, гидроксила, фтора, хлора, брома, циангруппы и нитрогуппы;
R3 означает (С1-С12)алкил или (С1-С4)алкокси-(С1-С4)алкил;
А означает группу, выбранную из СН2-(арил-/С1-С4/алкиламино), СН2-(арил-/С1-С4/алкокси), СН2-(гетероциклил-/С1-С4/алкокси), (С1-С4)алкила, замещенного необязательно замещенным арилом или необязательно замещенным гетероциклилом,
где арил может быть замещен 1-5 заместителями или гетероциклил замещен 1-4 заместителями и заместители выбираются из (С1-С4)алкила, (C1-С4)алкоксила, гидроксила, фтора, хлора, брома, циангруппы, S-(C1-С4)алкила и NRR’, где R и R’ означают независимо друг от друга водород или (С1-С4)алкил, или
А означает группу формулы СН2-U-гетероциклил,
где U представляет О, S или NR”, где R” означает водород или (C1-С4)алкил, и где гетероциклил необязательно замещен 1-4 заместителями, выбранными из (С1-С4)алкила, фтора, хлора, брома, циангруппы, нитрогруппы и NRR’, где R и R’ независимо друг от друга означают водород или (С1-С4)алкил, или
А означает группу формулы CH(V)Z,
где V означает ОН или F и
где Z означает арил или гетероциклил, или
А означает группу формулы CH=CHW,
где W означает необязательно замещенный арил или необязательно замещенный гетероциклил и
где арил может быть замещен 1-5 заместителями или гетероциклил может быть замещен 1-4 заместителями и заместители выбираются из (C1-С4)алкила, (С1-С4)-алкоксила, гидроксила, циангруппы, фтора, хлора и брома;
Х означает S или О;
для лечения заболеваний, опосредованных вирусом иммунодефицита человека (ВИЧ), или для получения лекарственного средства для такого лечения.
Другими предпочтительными вариантами осуществления изобретения является применение соединений формулы I, где
R1 означает необязательно замещенный (С1-С12)алкил, (С3-С8)циклоалкил, арил, гетероциклил или (С1-С4)алкил, замещенный фенилом,
где (С1-С12)алкил может быть замещен 1-5 фторсодержащими заместителями, предпочтительно, когда
R1 означает необязательно замещенный (С1-С7)алкил, (С3-С8)циклоалкил, арил, гетероциклил или (С1-С4)алкил, замещенный фенилом,
где (С1-С7)алкил может быть замещен 1-3 фторсодержащими заместителями,
более предпочтительно, когда
R1 означает необязательно замещенный (С1-С7)алкил, (С3-С6)циклоалкил, фенил, пиридил или бензил,
где (С1-С7)алкил может быть замещен 1-3 фторсодержащими заместителями,
наиболее предпочтительно, когда
R1 означает (С1-С7)алкил;
R2 означает замещенный фенил, замещенный 1-5 заместителями, выбранными из
(С1-С4)алкила, (С1-С4)алкоксила, фтора, хлора, брома, циангруппы и нитрогуппы,
предпочтительно, когда
R2 означает замещенный фенил, замещенный 1-3 заместителями, выбранными из
(С1-С4)алкила, (С1-С4)алкоксила, фтора, хлора, брома, циангруппы и нитрогуппы,
более предпочтительно, когда
R2 означает замещенный фенил, замещенный 1-3 заместителями, выбранными из
(С1-С2)алкила, фтора, хлора и циангруппы,
наиболее предпочтительно, когда
R2 означает замещенный фенил, замещенный 1-3 заместителями, выбранными из хлора и циангруппы;
R3 означает (С1-С12)алкил или (С1-С4)алкокси-(С1-С4)алкил, предпочтительно, когда
R3 означает (С1-С7)алкил или (С1-С4)алкокси-(С1-С2)алкил, более предпочтительно, когда
R3 означает (С1-С7)алкил или (С1-С2)алкокси-(С1-С2)алкил,
наиболее предпочтительно, когда
R3 означает (C1-С7)алкил;
А означает группу, выбранную из СН2-(арил-/С1-С4/алкокси), СН2-(гетероциклил-/С1-С4/алкокси), (С1-С4)алкила, замещенного необязательно замещенным фенилом или необязательно замещенным гетероциклилом, где фенил может быть замещен 1-5 заместителями или гетероциклил замещен 1-4 заместителями и заместители выбираются из (С1-С4)алкила, (С1-С4)алкоксила, гидроксила, фтора, хлора, брома, циангруппы, S-(C1-С4)алкила и NRR’, где R и R’ означают независимо друг от друга водород или (С1-С4)алкил, или
А означает группу формулы СН2-U-гетероциклил,
где U представляет О, S или NR”, где R” означает водород или (С1-С4)алкил и где гетероциклил необязательно замещен 1-4 заместителями, выбранными из (С1-С4)алкила, фтора, хлора, брома, циангруппы, нитрогруппы и NRR’, где R и R’ независимо друг от друга означают водород или (С1-С4)алкил, или
А означает группу формулы СН(V)гетероциклил,
где V означает ОН или F, или
А означает группу формулы CH=CHW,
где W означает необязательно замещенный арил, замещенный 1-5 заместителями, и заместители выбираются из (С1-С4)алкила, (C1-С4)алкоксила, гидроксила, циангруппы, фтора, хлора и брома, предпочтительно, когда
А означает группу, выбранную из СН2-(фенил-/С1-С2/алкокси), СН2-(пиридил-/С1-С2/алкокси), (С1-С2)алкила, замещенного необязательно замещенным фенилом или необязательно замещенным гетероциклилом, где фенил может быть замещен 1-3 заместителями или гетероциклил замещен 1-2 заместителями и заместители выбираются из (С1-С4)алкила, (С1-С4)алкоксила, гидроксила, фтора, хлора, брома, циангруппы, S-(C1-С4)алкила и NRR’, где R и R’ независимо друг от друга означают водород или (С1-С4)алкил, или
А означает группу формулы СН2-U-гетероциклил,
где U представляет О, S или NR”, где R” означает водород или (С1-С4)алкил и где гетероциклил необязательно замещен 1-2 заместителями, выбранными из (С1-С4)алкила, фтора, хлора, брома, циангруппы, нитрогруппы и NRR’, где R и R’ независимо друг от друга означают водород или (С1-С4)алкил, или
А означает группу формулы СН(F)гетероциклил,
более предпочтительно, когда
А означает группу, выбранную из СН2-(фенил-/С1-С2/алкокси), СН2-(пиридил-/С1-С2/алкокси), (С1-С2)алкила, замещенного необязательно замещенным фенилом или необязательно замещенным гетероциклилом,
где фенил может быть замещен 1-3 заместителями или гетероциклил замещен 1-2 заместителями и заместители выбираются из (С1-С2)алкила, (С1-С2)алкоксила, гидроксила, фтора, хлора, брома, циангруппы, S-(C1-С2)алкила и NRR’, где R и R’ независимо друг от друга означают водород или (С1-С2)алкил, или
А означает группу формулы CH(F)Z,
где Z означает гетероциклил,
наиболее предпочтительно, когда
А означает группу, выбранную из СН2-(фенил-/С1-С2/алкокси), СН2-(пиридил-/С1-С2/алкокси), (С1-С2)алкила, замещенного необязательно замещенным гетероциклилом,
где гетероциклил замещен 1-2 заместителями и заместители выбираются из (С1-С2)алкила, (С1-С2)алкоксила, гидроксила, фтора, хлора, брома, циангруппы, S-(С1-С2)алкила и NRR’, где R и R’ независимо друг от друга означают водород или (С1-С2)алкил;
Х означает S или О,
для лечения заболеваний, опосредованных вирусом иммунодефицита человека (ВИЧ), или для получения лекарственного средства для такого лечения.
Другими предпочтительными вариантами осуществления изобретения является применение соединений формулы I, где
R1 означает (С1-С4)алкил,
предпочтительно, когда
R1 означает этил или изопропил;
R2 означает замещенный фенил, замещенный 1-3 хлорсодержащими заместителями,
предпочтительно, когда
R2 означает 3,5-дихлорфенил;
R3 означает (С1-С4)алкил,
предпочтительно, когда
R3 означает метил;
А означает группу в виде (С1-С2)алкила, замещенного необязательно замещенным гетероциклилом,
где гетероциклил замещен 1-2 заместителями и заместители выбираются из (С1-С2)алкила и хлора,
предпочтительно, когда
А означает группу в виде (С1-С2)алкила, замещенного необязательно замещенным гетероциклилом,
где гетероциклил замещен 1-2 заместителями и заместители выбираются из (С1-С2)алкила и хлора;
Х означает S или О.
Более предпочтительным вариантом осуществления изобретения является применение соединений формулы I, где Х означает S.
Также частью представленного изобретения является применение соединений формулы I

где R1 означает (С1-С12)алкил, (С3-С8)циклоалкил, ацил, (С1-С4)алкилсульфонил, необязательно замещенный фенилсульфонил, арил или (С1-С4)алкил, замещенный необязательно замещенным фенилом,
где фенил может быть замещен 1-5 заместителями, выбранными из (C1-С4)алкила, (С1-С4)алкоксила, гидроксила, фтора, хлора и брома;
R2 означает арил или необязательно замещенный фенил,
где фенил может быть замещен 1-5 заместителями, выбранными из (C1-C4)алкила, (С1-С4)алкоксила, гидроксила, фтора, хлора и брома;
R3 означает (С1-С12)алкил или (С1-С4)алкокси-(С1-С4)алкил;
А означает группу, выбранную из СН2-(арил-/С1-С4/алкиламино), СН2-(арил-/С1-С4/алкокси), (С1-С4)алкила, замещенного необязательно замещенным арилом или необязательно замещенным гетероциклилом,
где арил может быть замещен 1-5 заместителями или гетероциклил замещен 1-4 заместителями и заместители выбираются из (С1-С4)алкила, (C1-С4)алкоксила, гидроксила, фтора, хлора и брома, или
А означает группу формулы CH(OH)Z,
где Z означает арил или гетероциклил, или
А означает группу формулы CH=CHW,
где W представляет необязательно замещенный арил или необязательно замещенный гетероциклил, и
где арил может быть замещен 1-5 заместителями или гетероциклил может быть замещен 1-4 заместителями и заместители выбираются из (С1-С4)алкила, (С1 -С4 )алкоксила, гидроксила, фтора, хлора и брома;
Х означает S или О;
для лечения заболеваний, опосредованных вирусом иммунодефицита человека (ВИЧ), или для получения лекарственного средства для такого лечения.
Более предпочтительные варианты осуществления изобретения для применения соединения формулы I для лечения заболеваний, опосредованных вирусом иммунодефицита человека (ВИЧ), или для получения лекарственного средства для такого лечения представлены в таблице 1.
| Таблица 1 |
| СТРУКТУРА |
СИСТЕМАТИЧЕСКОЕ НАЗВАНИЕ |
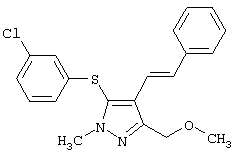 |
5-(3-Хлорфенилтио)-3-метоксиметил-1-метил-4-стирил-1H-пиразол |
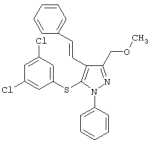 |
(Е)-5-(3,5-Дихлорфенилтио)-3-(метоксиметил)-1-фенил-4-стирил-1Н-пиразол |
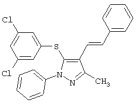 |
5-(3,5-Дихлорфенилтио)-3-метил-1-фенил-4-стирил-1Н-пиразол |
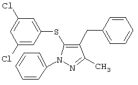 |
4-Бензил-5-(3,5-дихлорфенилтио)-3-метил-1-фенил-1Н-пиразол |
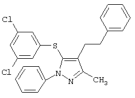 |
5-(3,5-Дихлорфенилтио)-3-метил-4-(2-фенилэтил)-1-фенил-1Н-пиразол |
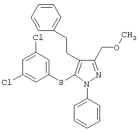 |
5-(3,5-Дихлорфенилтио)-3-(метоксиметил)-1-фенил-4-(2-фенилэтил)-1Н-пиразол |
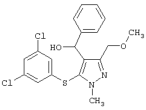 |
[5-(3,5-Дихлорфенилтио)-3-(метоксиметил)-1-метил-1Н-пиразол-4-ил]фенилметанол |
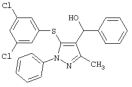 |
[5-(3,5-Дихлорфенилтио)-3-метил-1-фенил-1H-пиразол-4-ил]фенилметанол |
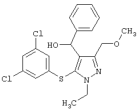 |
[5-(3,5-Дихлорфенилтио)-1-этил-3-(метоксиметил)-1Н-пиразол-4-ил]фенилметанол |
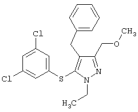 |
4-Бензил-5-(3,5-дихлорфенилтио)-1-этил-3-(метоксиметил)-1Н-пиразол |
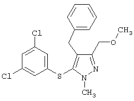 |
4-Бензил-5-(3,5-дихлорфенилтио)-3-метоксиметил-1-метил-1Н-пиразол |
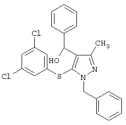 |
5-(3,5-Дихлорфенилтио)-3-метил- (RS)-фенил-1Н-пиразол-4-метанол (RS)-фенил-1Н-пиразол-4-метанол |
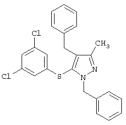 |
1,4-Дибензил-5-(3,5-дихлорфенилтио)-3-метил-1Н-пиразол |
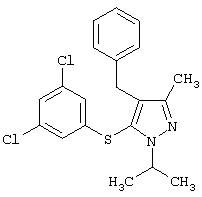 |
4-Бензил-5-(3,5-дихлорфенилтио)-1-изопропил-3-метил-1H-пиразол |
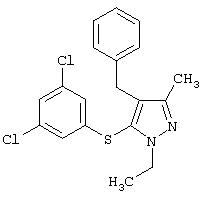 |
4-Бензил-5-(3,5-дихлорфенилтио)-1-этил-3-метил-1Н-пиразол |
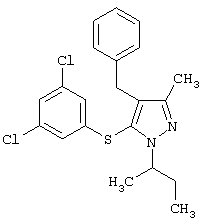 |
4-Бензил-1-втор-бутил-5-(3,5-дихлорфенилтио)-3-метил-lH-пиразол |
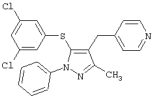 |
4-[5-(3,5-Дихлорфенилтио)-3-метил-1-фенил-4-[(4-пиридил)метил]-1Н-пиразол |
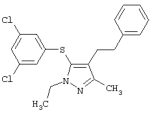 |
5-(3,5-Дихлорфенилтио)-1-этил-3-метил-4-(2-фенилэтил)-1Н-пиразол |
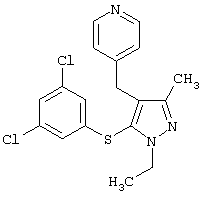 |
4-[5-(3,5-Дихлорфенилтио)-1-этил-3-метил-[(4-пиридил)метил]-1Н-пиразол |
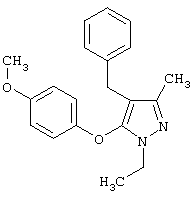 |
4-Бензил-1-этил-5-(4-метоксифенокси)-3-метил-1Н-пиразол |
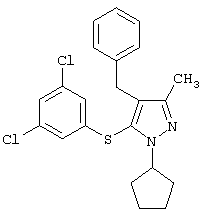 |
4-Бензил-1-циклопентил-5-(3,5-дихлорфенилтио)-3-метил-1Н-пиразол |
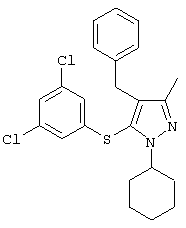 |
4-Бензил-1-циклогексил-5-(3,5-дихлорфенилтио)-3-метил-1Н-пиразол |
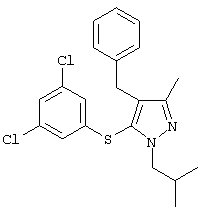 |
4-Бензил-5-(3,5-дихлорфенилтио)-1-изобутил-3-метил-1Н-пиразол |
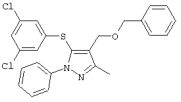 |
4-Бензилоксиметил-5-(3,5-дихлорфенилтио)-3-метил-1-фенил-1Н-пиразол |
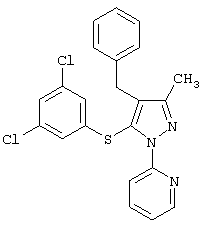 |
2-[4-Бензил-5-(3,5-дихлорфенилсульфанил)-3-метилпиразол-1-ил]пиридин |
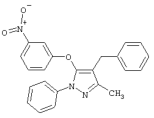 |
4-Бензил-3-метил-5-(3-нитрофенокси)-1-фенил-1Н-пиразол |
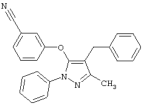 |
3-(4-Бензил-5-метил-2-фенил-2Н-пиразол-3-илокси)бензонитрил |
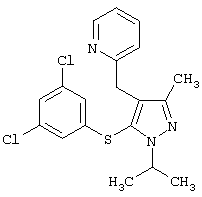 |
2-[5-(3,5-Дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметил]пиридин |
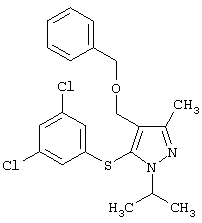 |
4-Бензилоксиметил-5-(3,5-дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол |
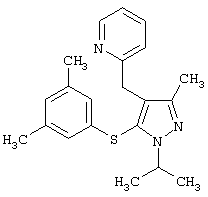 |
2-[5-(3,5-Диметилфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметил]пиридин |
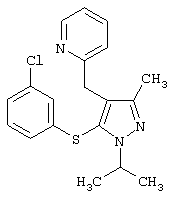 |
2-[5-(3-Хлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметил]пиридин |
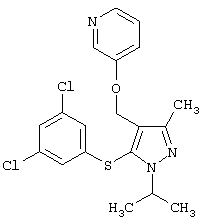 |
2-[5-(3,5-Дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметокси]пиридин |
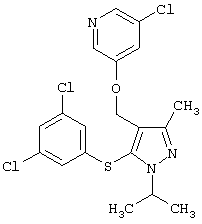 |
3-Хлор-5-[5-(3,5-дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметокси]пиридин |
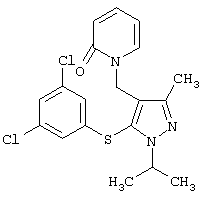 |
1-[5-(3,5-Дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметил]-1Н-пиридин-2-он |
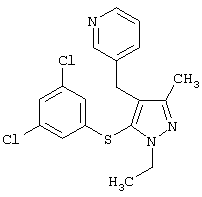 |
3-[5-(3,5-Дихлорфенилсульфанил)-1-этил-3-метил-1Н-пиразол-4-илметил]пиридин |
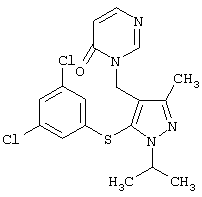 |
3-[5-(3,5-Дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметил]-3Н-пиримидин-4-он |
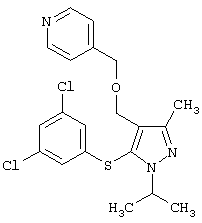 |
4-[5-(3,5-Дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметоксиметил]пиридин |
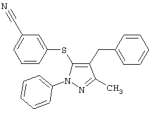 |
3-(4-Бензил-5-метил-2-фенил-2Н-пиразол-3-илсульфанил)бензонитрил |
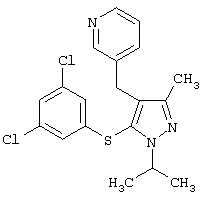 |
3-[5-(3,5-Дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметил] пиридин |
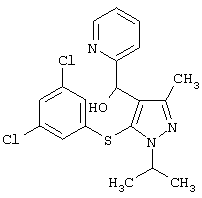 |
[5-(3,5-Дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-ил]пиридин-2-илметанол |
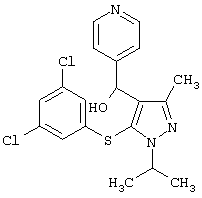 |
[5-(3,5-Дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-ил]пиридин-4-илметанол |
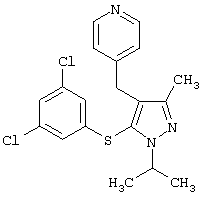 |
4-[5-(3,5-Дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметил]пиридин |
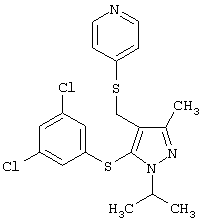 |
4-[5-(3,5-Дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметилсульфанил]пиридин |
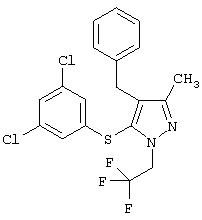 |
4-Бензил-5-(3,5-дихлорфенилсульфанил)-3-метил-1-(2,2,2-трифторэтил)-1Н-пиразол |
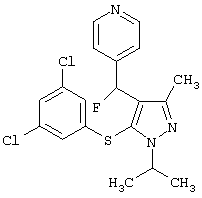 |
4-{[5-(3,5-Дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-ил]фторметил}пиридин |
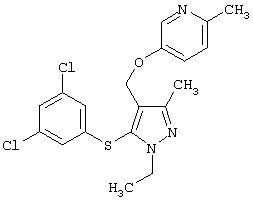 |
5-[5-(3,5-Дихлорфенилсульфанил)-1-этил-3-метил-1Н-пиразол-4-илметокси]-2-метилпиридин |
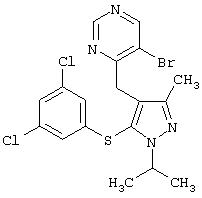 |
5-Бром-4-[5-(3,5-дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметил]пиримидин |
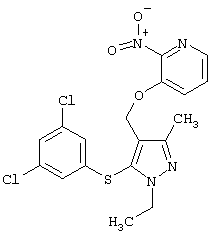 |
3-[5-(3,5-Дихлорфенилсульфанил)-1-этил-3-метил-1Н-пиразол-4-илметокси]-2-нитропиридин |
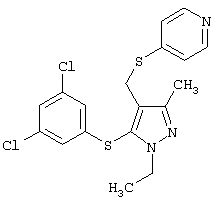 |
4-[5-(3,5-Дихлорфенилсульфанил)-1-этил-3-метил-1Н-пиразол-4-илметилсульфанил]пиридин |
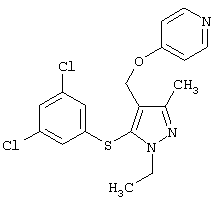 |
4-[5-(3,5-Дихлорфенилсульфанил)-1-этил-3-метил-1Н-пиразол-4-илметокси]пиридин |
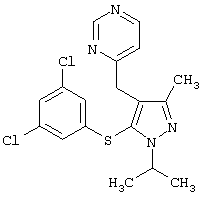 |
4-[5-(3,5-Дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметил]пиримидин |
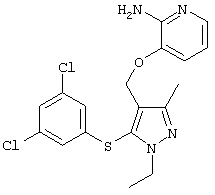 |
3-[5-(3,5-Дихлорфенилсульфанил)-1-этил-3-метил-1Н-пиразол-4-илметокси]пиридин-2-иламин |
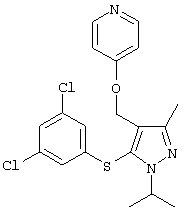 |
4-[5-(3,5-Дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметокси]пиридин |
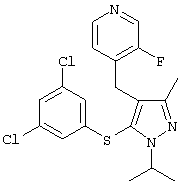 |
4-[5-(3,5-Дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметил]-3-фторпиридин |
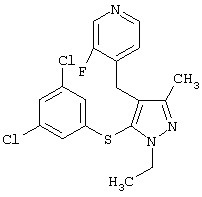 |
4-[5-(3,5-Дихлорфенилсульфанил)-1-этил-3-метил-1Н-пиразол-4-илметил]-3-фторпиридин |
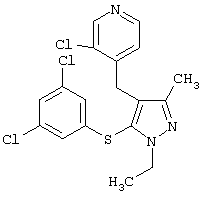 |
3-Хлор-4-[5-(3,5-дихлорфенилсульфанил)-1-этил-3-метил-1Н-пиразол-4-илметил]пиридин |
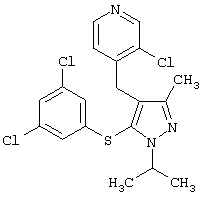 |
3-Хлор-4-[5-(3,5-дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметил]пиридин |
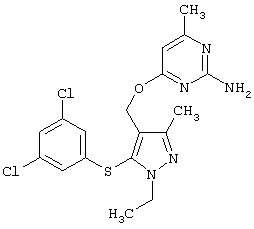 |
4-[5-(3,5-Дихлорфенилсульфанил)-1-этил-3-метил-1Н-пиразол-4-илметокси]-6-метилпиримидин-2-иламин |
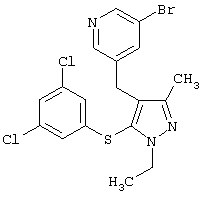 |
3-Бром-5-[5-(3,5-дихлорфенилсульфанил)-1-этил-3-метил-1Н-пиразол-4-илметил]пиридин |
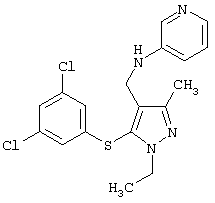 |
[5-(3,5-Дихлорфенилсульфанил)-1-этил-3-метил-1Н-пиразол-4-илметил]пиридин-3-иламин |
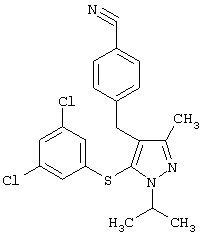 |
4-[5-(3,5-Дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметил]бензонитрил |
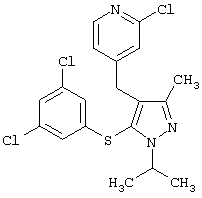 |
2-Хлор-4-[5-(3,5-дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметил]пиридин |
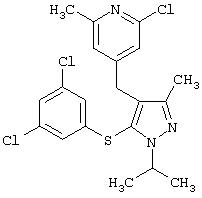 |
2-Хлор-4-[5-(3,5-дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметил]-6-метилпиридин |
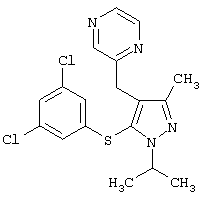 |
2-[5-(3,5-Дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметил]пиразин |
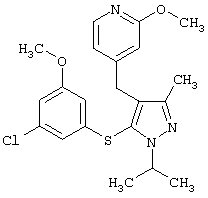 |
4-[5-(3-Хлор-5-метоксифенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметил]-2-метоксипиридин |
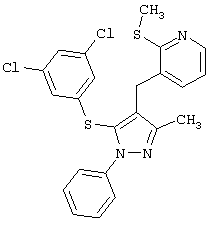 |
3-[[5-(3,5-Дихлорфенилтио)-3-метил-1-фенил-1Н-пиразол-4-ил]метил]-2-(метилтио)пиридин |
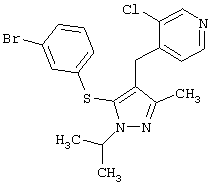 |
4-[5-(3-Бромфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметил]-3-хлорпиридин |
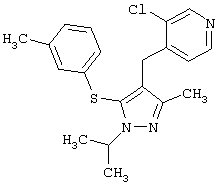 |
3-Хлор-4-(1-изопропил-3-метил-5-м-толилсульфанил-1Н-пиразол-4-илметил)пиридин |
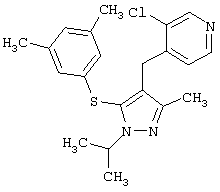 |
3-Хлор-4-[5-(3,5-диметилфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметил]пиридин |
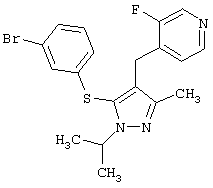 |
4-[5-(3-Бромфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметил]-3-фторпиридин |
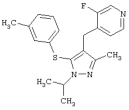 |
3-Фтор-4-(1-изопропил-3-метил-5-м-толилсульфанил-1Н-пиразол-4-илметил)пиридин |
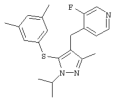 |
4-[5-(3,5-Диметилфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметил]-3-фторпиридин |
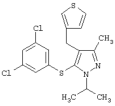 |
5-(3,5-Дихлорфенилсульфанил)-1-изопропил-3-метил-4-тиофен-3-илметил-1Н-пиразол |
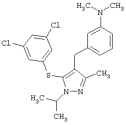 |
{3-[5-(3,5-Дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметил]фенил}диметиламин |
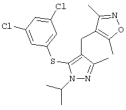 |
4-[5-(3,5-Дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметил]-3,5-диметилизоксазол |
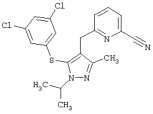 |
6-[5-(3,5-Дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметил]пиридин-2-карбонитрил |
Частью данного изобретения являются также новые производные пиразола, способ их получения, фармацевтические композиции и применение таких соединений в медицине. В частности, эти соединения являются ингибиторами обратной транскриптазы вируса иммунодефицита человека, то есть ингибиторами фермента, вовлеченного в репликацию вируса.
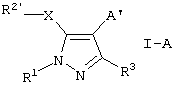
Новыми соединениями по данному изобретению являются соединения формулы I-A
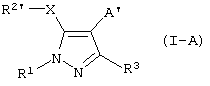
где R1 означает необязательно замещенный (С1-С12)алкил, (С3-С8)циклоалкил, ацил, (С1-С4)алкилсульфонил, необязательно замещенный фенилсульфонил, арил, гетероциклил или (С1-С4)алкил, замещенный фенилом,
где (С1-С12)алкил может быть замещен 1-5 заместителями, выбранными из фтора, хлора и брома, и
где фенил может быть замещен 1-5 заместителями, выбранными из (C1-С4)алкила, (С1-С4)алкоксила, гидроксила, фтора, хлора, брома и циангруппы;
R2′ означает необязательно замещенный фенил,
где фенил может быть замещен 1-5 заместителями, выбранными из (C1-C4)алкила, (С1-С4)алкоксила, гидроксила, фтора, хлора, брома, циангруппы и нитрогруппы;
R3 означает (С1-С12)алкил или (С1-С4)алкокси-(С1-С4)алкил;
А’ означает группу, выбранную из СН2-(арил-/С1-С4/алкиламино), СН2-(арил-/С1-С4/алкокси), СН2-(гетероциклил-/С1-С4/алкокси), (С1-С4)алкила, замещенного необязательно замещенным арилом или необязательно замещенным 4-пиридилом,
где арил может быть замещен 1-5 заместителями или 4-пиридил замещен 1-4 заместителями и заместители выбираются из (С1-С4)алкила, (C1-С4)алкоксила, гидроксила, фтора, хлора, брома, циангруппы, S-(C1-С4)алкила и NRR’, где R и R’ означают независимо друг от друга водород или (С1-С4)алкил, или
А’ означает группу формулы СН2-U-гетероциклил,
где U представляет О, S или NR”, где R” означает водород или (С1-С4)алкил и где гетероциклил необязательно замещен 1-4 заместителями, выбранными из (С1-С4)алкила, фтора, хлора, брома, циангруппы, нитрогруппы и NRR’, где R и R’ означают независимо друг от друга водород или (С1-С4)алкил,
или
А’ означает группу формулы СН(ОН)арил, или
А’ означает группу формулы CH=CHW,
где W означает необязательно замещенный арил или необязательно замещенный гетероциклил, и
где арил может быть замещен 1-5 заместителями или гетероциклил может быть замещен 1-4 заместителями и заместители выбираются из (С1-С4)алкила, (С1-С4)алкоксила, гидроксила, циангруппы, фтора, хлора и брома;
Х означает S или О,
их гидролизуемые сложные или простые эфиры и их фармацевтически приемлемые соли.
Термины, используемые для заместителей новых производных пиразола, являются такими, как установлено выше.
Другими вариантами осуществления изобретения являются новые соединения формулы I-A, где
R1 означает необязательно замещенный (С1-С12)алкил, (С3-С8)циклоалкил, арил, гетероциклил или (С1-С4)алкил, замещенный фенилом,
где (С1-С12)алкил может быть замещен 1-5 фторсодержащими заместителями, предпочтительно, когда
R1 означает необязательно замещенный (С1-С7)алкил, (С3-С8)циклоалкил, арил, гетероциклил или (С1-С4)алкил, замещенный необязательно замещенным фенилом,
где (С1-С7)алкил может быть замещен 1-3 фторсодержащими заместителями,
более предпочтительно, когда
R1 означает необязательно замещенный (С1-С7)алкил, (С3-С8)циклоалкил,
фенил, пиридил или бензил,
где (С1-С7)алкил может быть замещен 1-3 фторсодержащими заместителями,
наиболее предпочтительно, когда
R1 означает (С1-С7)алкил;
R2′ означает замещенный фенил, замещенный 1-5 заместителями, выбранными из (С1-С4)алкила, (С1-С4)алкоксила, фтора, хлора, брома, циангруппы и нитрогруппы,
предпочтительно, когда
R2′ означает замещенный фенил, замещенный 1-3 заместителями, выбранными из (С1-С4)алкила, (С1-С4)алкоксила, фтора, хлора, брома, циангруппы и нитрогуппы,
более предпочтительно, когда
R2′ означает замещенный фенил, замещенный 1-3 заместителями, выбранными из (С1-С2)алкила, фтора, хлора и циангруппы,
наиболее предпочтительно, когда
R2′ означает замещенный фенил, замещенный 1-3 заместителями, выбранными из хлора и циангруппы;
R3 означает (С1-С12)алкил или (С1-С4)алкокси-(С1-С4)алкил,
предпочтительно, когда
R3 означает (С1-С7)алкил или (С1-С4)алкокси-(С1-С2)алкил,
более предпочтительно, когда
R3 означает (С1-С7)алкил или (С1-С2)алкокси-(С1-С2)алкил,
наиболее предпочтительно, когда
R3 означает (С1-С7)алкил;
А’ означает группу, выбранную из СН2-(фенил-/С1-С4/алкокси), СН2-(пиридил-/С1-С4/алкокси), (С1-С4)алкила, замещенного необязательно замещенным арилом или необязательно замещенным 4-пиридилом,
где арил может быть замещен 1-5 заместителями или 4-пиридил замещен 1-4 заместителями и заместители выбираются из (С1-С4)алкила, (C1-С4)алкоксила, гидроксила, фтора, хлора, брома, циангруппы, S-(C1-С4)алкила и NRR’, где R и R’ означают независимо друг от друга водород или (С1-С4)алкил, или
А’ означает группу формулы СН2-U-гетероциклил,
где U представляет О, S или NR”, где R” означает водород или (С1-С4)алкил и где гетероциклил необязательно замещен 1-4 заместителями, выбранными из (С1-С4)алкила, фтора, хлора, брома, циангруппы, нитрогруппы и NRR’, где R и R’ означают независимо друг от друга водород или (С1-С4)алкил, или
А’ означает группу формулы СН(ОН)арил, или
А’ означает группу формулы CH=CHW,
где W представляет необязательно замещенный арил, замещенный 1-5 заместителями и заместители выбираются из (С1-С4)алкила, (C1-С4)алкоксила, гидроксила, циангруппы, фтора, хлора и брома,
предпочтительно, когда
А’ означает группу, выбранную из СН2-(фенил-/С1-С4/алкокси), СН2-(пиридил-/С1-С4/алкокси), метила, замещенного необязательно замещенным фенилом или необязательно замещенным 4-пиридилом, где фенил может быть замещен 1-3 заместителями или 4-пиридил замещен 1-2 заместителями и заместители выбираются из (С1-С4)алкила, (C1-С4)алкоксила, гидроксила, фтора, хлора, брома, циангруппы, S-(C1-С4)алкила и NRR’, где R и R’
означают независимо друг от друга водород или (С1-С4)алкил, или
А’ означает группу формулы СН2-U-гетероциклил,
где U представляет О, S или NR”, где R” означает водород или (С1-С4)алкил, и где гетероциклил необязательно замещен 1-2 заместителями, выбранными из (С1-С4)алкила, фтора, хлора, брома, циангруппы, нитрогруппы и NRR’, где R и R’ означают независимо друг от друга водород или (С1-С4)алкил,
более предпочтительно, когда
А’ означает группу, выбранную из СН2-(фенил-/С1-С2/алкокси), СН2-(пиридил-/С1-С2/алкокси), метила, замещенного необязательно замещенным фенилом или необязательно замещенным 4-пиридилом,
где фенил может быть замещен 1-3 заместителями или 4-пиридил замещен 1-2 заместителями и заместители выбираются из (С1-С2)алкила, (C1-С2)алкоксила, гидроксила, фтора, хлора, брома, циангруппы, S-(C1-С2)алкила и NRR’, где R и R’ независимо друг от друга означают водород или (С1-С2)алкил,
наиболее предпочтительно, когда
А’ означает группу, выбранную из СН2-(арил-/С1-С2/алкокси), СН2-(гетероциклил-/С1-С2/алкокси), метила, замещенного необязательно замещенным 4-пиридилом,
где 4-пиридил замещен 1-2 заместителями и заместители выбираются из (C1-С2)алкила, (С1-С2)алкоксила, гидроксила, фтора, хлора, брома, циангруппы, S-(С1-С2)алкила и NRR’, где R и R’ независимо друг от друга означают водород или (С1-С2)алкил;
Х означает S или О;
их гидролизуемые сложные или простые эфиры и их фармацевтически приемлемые соли.
Другим предпочтительным вариантом осуществления изобретения являются новые соединения формулы I-A, где
R1 означает (С1-С4)алкил;
R2′ означает замещенный фенил, замещенный 1-3 хлорсодержащими заместителями;
R3 означает (С1-С4)алкил;
А’ означает метильную группу, замещенную необязательно замещенным 4-пиридилом, где 4-пиридил замещен 1-2 заместителями и заместители выбираются из (С1-С2)алкила и хлора;
Х означает S или О;
их гидролизуемые сложные или простые эфиры и их фармацевтически приемлемые соли.
Дальнейшим предпочтительным вариантом осуществления изобретения являются новые соединения формулы I-A, где
R1 означает (С1-С12)алкил, (С3-С8)циклоалкил, ацил, (С1-С4)алкилсульфонил, необязательно замещенный фенилсульфонил, арил или (С1-С4)алкил, замещенный необязательно замещенным фенилом,
где фенил может быть замещен 1-5 заместителями, выбранными из (C1-С4)алкила, (С1-С4)алкоксила, гидроксила, фтора, хлора или брома;
R2′ означает необязательно замещенный фенил,
где фенил может быть замещен 1-5 заместителями, выбранными из (C1-C4)алкила, (С1-С4)алкоксила, гидроксила, фтора, хлора или брома;
R3 означает (С1-С12)алкил или (С1-С4)алкокси-(С1-С4)алкил;
А’ означает группу, выбранную из СН2-(арил-/С1-С4/алкиламино), СН2-(арил-/С1-С4/алкокси), (С1-С4)алкила, замещенного необязательно замещенным арилом или необязательно замещенным 4-пиридилом,
где арил может быть замещен 1-5 заместителями или 4-пиридил замещен 1-4 заместителями и заместители выбираются из (С1-С4)алкила, (C1-С4)алкоксила, гидроксила, фтора, хлора или брома, или
А’ означает группу формулы CH(OH)Z’,
где Z’ означает арил, или
А’ означает группу формулы CH=CHW,
где W означает необязательно замещенный арил или необязательно замещенный гетероциклил, и
где арил может быть замещен 1-5 заместителями или гетероциклил может быть замещен 1-4 заместителями и заместители выбираются из (С1-С4)алкила, (С1-С4)алкоксила, гидроксила, фтора, хлора или брома;
Х означает S или О;
их гидролизуемые сложные или простые эфиры и их фармацевтически приемлемые соли.
Предпочтительным вариантом осуществления изобретения являются новые соединения формулы I-A, где
А’ означает группу, выбранную из СН2-(арил-/С1-С4/алкиламино), СН2-(арил-/С1-С4/алкокси), СН2-(гетероциклил-/С1-С2/алкокси), (С1-С4)алкила, замещенного необязательно замещенным арилом,
где арил может быть замещен 1-5 заместителями и заместители выбираются из (С1-С4)алкила, (С1-С4)алкоксила, гидроксила, фтора, хлора, брома, циангруппы, S-(С1-С4)алкила и NRR’, где R и R’ независимо друг от друга означают водород или (С1-С4)алкил, или
А’ означает группу формулы СН2-U-гетероциклил,
где U представляет О, S или NR”, где R” означает водород или (С1-С4)алкил, и где гетероциклил необязательно замещен 1-4 заместителями, выбранными из (С1-С4)алкила, фтора, хлора, брома, циангруппы, нитрогруппы и NRR’, где R и R’ означают независимо друг от друга водород или (С1-С4)алкил,
или
А’ означает группу формулы СН(ОН)арил, или
А’ означает группу формулы CH=CHW,
где W означает необязательно замещенный арил или необязательно замещенный гетероциклил; и
где арил может быть замещен 1-5 заместителями или гетероциклил может быть замещен 1-4 заместителями и заместители выбираются из (С1-С4)алкила, (С1-С4)алкоксила, гидроксила, циангруппы, фтора, хлора и брома;
Х означает S или О,
их гидролизуемые сложные или простые эфиры и их фармацевтически приемлемые соли.
Особенно предпочтительным вариантом осуществления изобретения являются новые соединения формулы I-A, где
Х означает S.
Более предпочтительными вариантами осуществления изобретения являются новые соединения формулы I-A, представленные в таблице 1 (см. выше).
Производные пиразола, обеспечиваемые настоящим изобретением, полезны при терапевтическом лечении организма человека или животного, а конкретно эти соединения являются ингибиторами обратной транскриптазы – фермента вируса иммунодефицита человека. Соответственно, представленные производные пиразола являются терапевтически активными веществами при лечении заболеваний, опосредованных вирусом иммунодефицита человеак (ВИЧ), и могут быть применены в качестве лекарственных средств для лечения подобных заболеваний.
Они могут быть применены в качестве лекарственных средств, особенно, для лечения вирусных заболеваний, опосредованных иммунитетом состояний или заболеваний, бактериальных заболеваний, паразитарных заболеваний, воспалительных заболеваний, гиперпролиферативных сосудистых заболеваний, опухолей и рака.
В частности, соединения по настоящему изобретению и содержащие их фармацевтические композиции пригодны в качестве химиотерапевтических средств, ингибиторов репликации вирусов и модуляторов иммунной системы и могут быть применены для лечения заболеваний, опосредованных вирусом иммунодефицита человека (ВИЧ), других вирусных заболеваний, как, например, ретровирусные инфекции (либо только одни, либо в комбинации с другими противовирусными средствами, как, например, интерферон или его производные, как, например, конъюгаты с полиэтиленгликолем).
Они могут применяться только одни или в комбинации с другими терапевтически активными средствами, например с иммунодепрессантом, химиотерапевтическим средством, противовирусным средством, антибиотиком, антипаразитарным средством, противовоспалительным средством, противогрибковым средством и/или средством против сосудистой гиперпролиферации.
Соединения, всякий раз, когда они получены способами по настоящему изобретению, также являются объектом настоящего изобретения.
Соединения по настоящему изобретению могут быть получены, как показано на следующих далее реакционных схемах. Реакции могут быть проведены общепринятым способом, известным специалистам в данной области. Исходные соединения, требуемые для приготовления соединений формулы I, являются коммерчески доступными или могут быть легко получены согласно способам, известным в данной области.
В представленной спецификации “охватывает” означает “включает” и “охватывающий” означает “включающий”.
Реакционная схема 1:
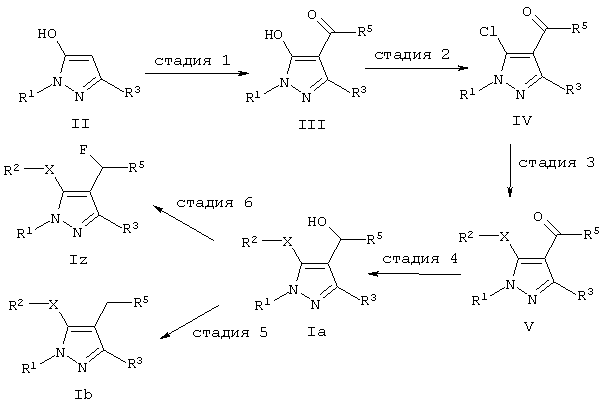
где R1, R2, R3 и X являются такими, как определено для соединений формулы I, и R5 означает арил или гетероциклил.
В реакционной схеме 1 первая стадия реакции проводится таким образом, что производные 5-гидроксипиразола формулы II (коммерчески доступные или синтезируемые обычным способом, известным специалистам в данной области, как описано, например, в международной заявке на патент WO 9842678 или J. DeRuiter и др., J. Heterocyclic Chem., 1987, 24, 149) подвергаются реакции с R5COCl (коммерчески доступным или синтезированным согласно способам, известным из учебников по органической химии, например из учебника J. March (1992), “Advanced Organic Chemistry: Reactions, Mechanisms and Structure”, 4-e изд., John Wiley & Sons), где R5 является таким, как указано выше, в подходящем растворителе, получают производное 5-гидроксипиразола формулы III, замещенное по положению 4 заместителем с оксогруппой. Реакцию удобно проводить в условиях, известных для реакций ацилирования, например в инертном растворителе, как, например, простые эфиры, например безводный тетрагидрофуран, диэтиловый эфир, дибутиловый эфир, диоксан, предпочтительно диоксан, или смесь упомянутых растворителей, при температуре реакции от комнатной температуры до температуры кипения реакционной смеси в присутствии катализатора, как, например, гидроокись кальция, карбонат калия, хлористый алюминий, трехфтористый бор, хлорное железо (3), четыреххлористое олово или хлористый цинк, предпочтительно гидроокись кальция.
На второй стадии реакции осуществляют хлорирование по замещенному гидроксильной группой положению 5 соединений формулы III с помощью хлорирующего агента, как, например, (COCl)2, HCl, PCl5, PCl3, SOCl2 или POCl3, и получают производные 5-хлорпиразола формулы IV. Реакцию удобно проводить в атмосфере инертного газа, например в атмосфере азота или аргона, при температуре реакции от комнатной до температуры кипения реакционной смеси. Предпочтительно реакцию проводят в присутствии POCl3 при температуре реакции примерно от 50°С до примерно 180°С. Необязательно реакция может быть проведена в органическом растворителе, как, например, галогенированные углеводороды (например, дихлорметан или трихлорметан), углеводороды (например, циклогексан, метилциклогексан, декалин, бензол, толуол, о-ксилол, м-ксилол или п-ксилол), или в смесях упомянутых растворителей.
На третьей стадии реакции соединение формулы IV подвергают реакции с R2SH или с R2ОН (оба реагента коммерчески доступны или могут быть синтезированы способами, известными из учебников по органической химии, например из учебника J. March (1992), “Advanced Organic Chemistry: Reactions, Mechanisms and Structure”, 4-е изд., John Wiley & Sons), где R2 является таким, как определено для соединений формулы I, получают производное пиразола формулы V. Реакцию осуществляют в подходящем растворителе в присутствии основания, как, например, n-BuLi, гидрид натрия, триалкиламин, как, например, триметиламин или триэтиламин, карбонат калия, карбонат натрия, карбонат магния, карбонат кальция, предпочтительно карбоната калия. Реакцию обычно проводят в атмосфере инертного газа, как, например, в атмосфере азота или аргона, при температуре от 0°С до температуры кипения реакционной смеси, предпочтительно при температуре примерно между 10 и 180°С. Подходящими растворителями для реакции являются тетрагидрофуран или полярные апротонные растворители, как, например, диметилсульфоксид (ДМСО), диметилацетамид или N,N-диметилформамид (ДМФА), предпочтительно ДМФА.
На четвертой стадии реакции оксогруппу соединения формулы V восстанавливают для получения соответствующего гидроксилсодержащего соединения формулы Ia. Реакцию обычно проводят с основанием, как, например, боргидрид натрия, боргидрид лития, или предпочтительно с боргидридом натрия в органическом растворителе, например в спиртовых растворителях, как, например, метанол, этанол, пропанол, бутанол, октанол или циклогексанол, предпочтительно в метаноле или в простых эфирах (например, в тетрагидрофуране, диэтиловом эфире, дибутиловом эфире, диоксане или диглиме) при температуре от 0°С до температуры кипения реакционной смеси, предпочтительно при температуре реакции примерно между 5 и 80°С. Реакцию восстановления проводят так, как описано в учебниках по органической химии, например в учебнике J. March (1992), “Advanced Organic Chemistry: Reactions, Mechanisms and Structure”, 4-е изд., John Wiley & Sons).
На пятой стадии реакции оксиметильную группу соединения формулы Ia восстанавливают далее до соответствующей метиленовой группы и получают соединение формулы Ib. Реакцию удобно проводить в присутствии триалкилсилана, как, например, триметилсилан, триэтилсилан или трипропилсилан, предпочтительно триэтилсилана, растворенного в минеральных кислотах, как, например, трифторуксусная кислота (ТФК), или в кислотах Льюиса, как, например, четыреххлористое олово (описано D.L.Comins и др. в Tet. Lett., 1986, 27, 1869), при температуре реакции от 0 до 80°С, предпочтительно при температуре между примерно 5 и 50°С.
Реакция восстановления может быть также проведена в присутствии иодистого натрия, триметилсилилхлорида и бромистого водорода или, как описано в учебниках по органической химии, например, в учебнике J. March (1992), “Advanced Organic Chemistry: Reactions, Mechanisms and Structure”, 4-e изд., John Wiley & Sons). Когда гидроксильная группа превращается в уходящую группу, как, например, мезилат или сульфонат, предпочтительно мезилат, реакция затем может быть проведена в присутствии цинка и уксусной кислоты (описано J.Е.Lynch и др., в J. Org. Chem., 1997, 62, 9223-9228).
Необязательно оксопроизводное соединения формулы V непосредственно восстанавливают в соответствующее метиленовое производное формулы Ib. Такими способами для прямого восстановления являются, например, восстановление по Клемменсену, восстановление по Вольфу-Кижнеру, гидрогенолиз тиоацеталей или восстановление с применением триалкилсилана, как, например, триметилсилана, триэтилсилана или трипропилсилана, предпочтительно триэтилсилана, растворенного в минеральных кислотах, как, например, трифторуксусная кислота (ТФК).
На шестой стадии реакции оксиметильную группу соединения формулы Ia превращают в соответствующую фторметиленовую группу для получения соединения формулы Iz. Реакцию проводят путем обработки соединения формулы Ia подходящим фторирующим агентом, как, например, диалкиламиносератрифторид (R7)2NSF3 формулы XIV, где R7 может быть (C1-С4)алкилом (например, этилом) или (R7)2N может быть циклической аминогруппой (например, морфолином). Фторирующий агент является коммерчески доступным (например, диэтиламиносератрифторид ДАСТ) или может быть синтезирован согласно известным в данной области способам. Реакция фторирования может быть осуществлена, как описано в учебниках по органической химии, например в учебнике J. March (1992), “Advanced Organic Chemistry: Reactions, Mechanisms and Structure”, 4-е изд., John Wiley & Sons).
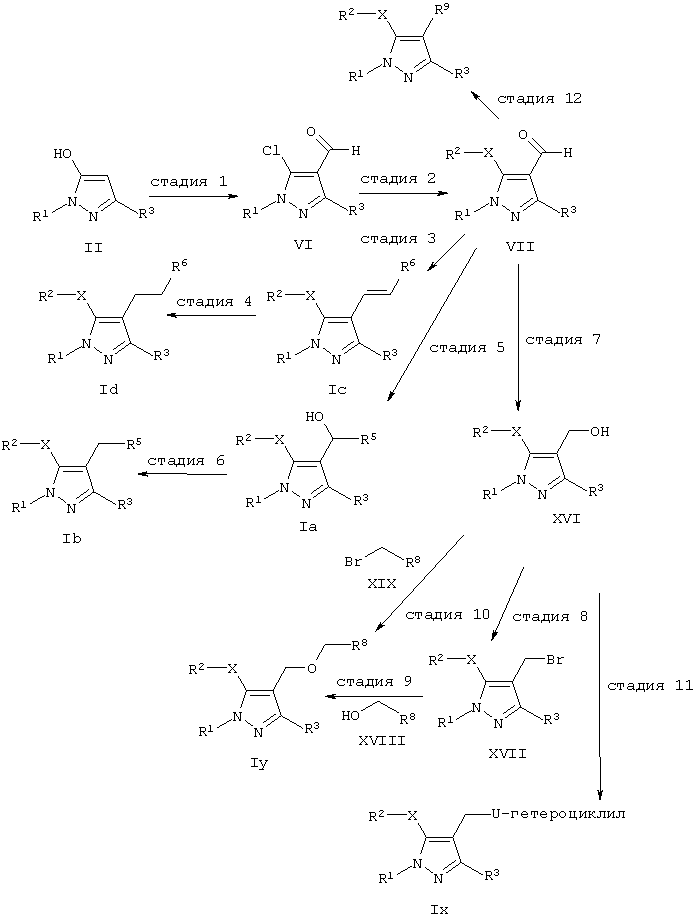
Реакционная схема 2:
где R1, R2, R3, U и X являются такими, как определено для соединений формулы I, R5, R6 и R8 означают арил или гетероциклил и R9 означает СН2-(арил/C1-С4/алкиламино).
В реакционной схеме 2 первая стадия реакции осуществляется таким образом, что производные 5-гидроксипиразола формулы II (коммерчески доступные или синтезируемые обычным способом, известным специалистам в данной области, как описано, например, в международной заявке на патент WO 9842678 или J. DeRuiter и др., J. Heterocyclic Chem., 1987, 24, 149) превращают в производные 4-карбальдегид-5-хлорпиразола формулы VI. Реакцию, которая включает обмен гидроксил/хлор в положении 5 и введение группы С(=O)Н в положение 4 пиразола, обычно проводят с применением дизамещенного формамида, как, например, N,N-диметилформамид, N,N-метилфенилформамид или N,N-дифенилформамид, в присутствии хлорокиси фосфора в соответствии с реакцией Вильсмайера. Реакцию проводят в инертной атмосфере, как, например, в атмосфере азота или аргона, при температуре от комнатной до температуры кипения реакционной смеси, предпочтительно при температуре примерно между 50 и 150°С. Необязательно реакция может быть проведена в инертном органическом растворителе, как, например, простые эфиры (например, тетрагидрофуран, диэтиловый эфир, дибутиловый эфир или диоксан), в полярных апротонных растворителях, как, например, диметилсульфоксид (ДМСО) или N,N-диметилацетамид, в галогенированных углеводородах (например, дихлорметан или трихлорметан), в углеводородах (например, циклогексан, метилциклогексан, декалин, бензол, толуол, о-ксилол, м-ксилол или п-ксилол) или в смесях упомянутых растворителей. Реакция хлорирования может также быть проведена в соответствии со способом, описанным для реакционной схемы 1 (стадия 2), при применении таких хлорирующих агентов, как (COCl)2, HCl, PCl5, PCl3, SOCl2. Введение группы С(=O)Н (реакция формилирования) в производное пиразола может быть также осуществлено согласно способам, известным из учебников по органической химии (J. March (1992), “Advanced Organic Chemistry: Reactions, Mechanisms and Structure”, 4-e изд., John Wiley & Sons). Такими способами являются, например, реакция Фриделя-Крафтса, реакция Вильсмайера-Хаака, реакция Гаттермана, реакция Гаттермана-Коха, реакция Губена-Хёша или реакция Раймера-Тимана.
На второй стадии реакции соединение формулы VI взаимодействует с R2SH или с R2ОН (оба реагента являются коммерчески доступными или могут быть синтезированы согласно способам, известным из учебников по органической химии, например из учебника J. March (1992), “Advanced Organic Chemistry: Reactions, Mechanisms and Structure”, 4-е изд., John Wiley & Sons), где R2 является таким, как определено для соединений формулы I, для получения производного пиразола формулы VII. Реакцию осуществляют согласно способу, описанному для реакционной схемы 1 (стадия 3).
На третьей стадии реакции соединение формулы VII по альдегидной группе взаимодействует по реакции Виттига-Хорнера с диалкилфосфонатом формулы (EtO)2P(=O)(CH2)nR6, где n является числом 1, 2 или 3, с образованием олефинового соединения формулы Ic. Реакция проводится аналогично способу, описанному в литературе, например, в присутствии сильного основания, как, например, н-бутиллитий или предпочтительно гидрид натрия, в органическом растворителе, например в безводных простых эфирах, как, например, диэтиловый эфир, дибутиловый эфир, диоксан, предпочтительно в безводном тетрагидрофуране в атмосфере инертного газа, например в атмосфере азота или аргона, при температуре реакции от 0 до 80°С, предпочтительно при температуре между примерно 5 и 50°С. Необязательно олефиновое соединение формулы Ic может быть получено с помощью других реакций сочетания, например по реакции Виттига.
На четвертой стадии реакции олефиновую группу соединения формулы Ic гидрируют в соответствующее соединение формулы Id. Реакцию проводят способами, подобными описанным в литературе, например, в атмосфере водорода в присутствии катализатора гидрогенизации в подходящем растворителе при температуре от 0 до 80°С, предпочтительно при температуре между примерно 5 и 50°С. Давление водорода может быть между примерно 0 атм и примерно 100 атм, предпочтительно между примерно 0 атм и примерно 50 атм и наиболее предпочтительно между примерно 0 атм и примерно 20 атм. Катализатором гидрирования, применяемым для этой реакции, может быть любой из обычно известных катализаторов, как, например, благородные металлы (например, платина, палладий или родий), на носителях, как, например, активированный уголь или окись алюминия, или обычно описываемый в учебниках по органической химии, например J. March (1992), “Advanced Organic Chemistry: Reactions, Mechanisms and Structure”, 4-е изд., John Wiley & Sons). Предпочтительными катализаторами гидрирования являются палладий на активированном угле или никелевый катализатор Ренея. Подходящими растворителями для реакций гидрирования являются органические растворители, как, например, спирты (например, метанол, этанол, пропанол, бутанол, октанол или циклогексанол), простые эфиры (например, тетрагидрофуран, диэтиловый эфир, дибутиловый эфир или диоксан), кетоны (например, ацетон, бутанон или циклогексанон), полярные апротонные растворители, как, например, диметилсульфоксид (ДМСО) или N,N-диметилацетамид, сложные эфиры (например, этилацетат), галогенированные углеводороды (например, дихлорметан или трихлорметан), углеводороды (например, циклогексан, метилциклогексан, декалин, бензол, толуол, о-ксилол, м-ксилол или п-ксилол) или смеси упомянутых растворителей. Предпочтительными растворителями являются сложные эфиры, наиболее предпочтительным растворителем является этилацетат.
На пятой стадии реакции пиразол формулы VII подвергается дериватизации с помощью реагента Гриньяра R5MgHal формулы XV, где R5 означает арил или гетероциклил, как определено для соединений формулы I, и Hal означает хлор, бром или иод, предпочтительно хлор (коммерчески доступного или синтезированного согласно учебникам по органической химии, например, J. March (1992), “Advanced Organic Chemistry: Reactions, Mechanisms and Structure”, 4-е изд., John Wiley & Sons), для получения соответствующего оксиметильного производного пиразола формулы Ia. Реакция дериватизации обычно осуществляется в инертном растворителе, например в простых эфирах, как, например, тетрагидрофуран, диэтиловый эфир, дибутиловый эфир, диоксан, диглим, или в смеси упомянутых растворителей, предпочтительно в тетрагидрофуране, при температуре примерно между -10 и 60°С, предпочтительно при температуре примерно между 0 и 40°С, более предпочтительно при комнатной температуре. Обычно реакция дериватизации может быть также проведена, как описывается в учебниках по органической химии, например в учебнике J. March (1992), “Advanced Organic Chemistry: Reactions, Mechanisms and Structure”, 4-е изд., John Wiley & Sons. Вместо реагента Гриньяра R5MgHal формулы XV может быть также применен реагент формулы LiR5.
На шестой стадии реакции восстановление проводится, как описано в реакционной схеме 1 (стадия 5), или может быть также проведено в присутствии Р2I4, как описано в европейском патенте ЕР 0627423.
Для синтеза соединений формулы I, где R1, R2, R3 и Х являются такими, как по пункту 1, и А означает СН2-(арил-/С1-С4/алкокси) или СН2-(гетероциклил-/С1-С4/алкокси), соединения формулы VII превращают путем восстановления и последующей реакции этерификации в соответствующие соединения формулы I, где R1, R2, R3 и Х являются такими, как по пункту 1, и А означает СН2-(арил-/С1-С4/алкокси) или СН2-(гетероциклил-/С1-С4/алкокси). Обе реакции известны из учебников по органической химии, например из учебника J. March (1992), “Advanced Organic Chemistry: Reactions, Mechanisms and Structure”, 4-е изд., John Wiley & Sons. Например, соединения формулы VII сначала восстанавливают с помощью подходящего восстановителя (например, боргидрида натрия в спиртовом растворителе, как, например, метанол) в соответствующее производное спирта и затем подвергают реакции с арил-(С1-С4)алкилгалогенидом или гетероциклил-(С1-С4)алкилгалогенидом в основных условиях (например, гидрид натрия в полярном апротонном растворителе, как, например, диметилформамид) для получения соответствующих соединений формулы I, где R1, R2, R3 и Х являются такими, как по пункту 1, и А означает СН2-(арил-/С1-С4/алкокси) или СН2-(гетероциклил-/С1-С4/алкокси).
Вышеупомянутая реакция описывается более подробно на стадиях 7-9.
На седьмой стадии реакции альдегид формулы VII восстанавливают в присутствии восстанавливающего средства для получения соответствующего оксиметильного производного формулы XVI. Восстанавливающими средствами, обычно используемыми для этой реакции, предпочтительно являются боргидрид натрия или другие восстановители, как, например, боргидрид лития, триацетоксиборгидрид натрия, водород вместе с катализатором, или восстанавливающие средства, известные в данной области и применяемые согласно известным способам, описанным в учебниках по органической химии, например в J. March (1992), “Advanced Organic Chemistry: Reactions, Mechanisms and Structure”, 4-е изд., John Wiley & Sons. Реакцию восстановления обычно проводят в органическом растворителе, например в спиртовых растворителях, как, например, метанол, этанол, пропанол, бутанол, октанол или циклогексанол, предпочтительно в метаноле или этаноле, или в простых эфирах, как, например, тетрагидрофуран, диэтиловый эфир, дибутиловый эфир, диоксан или диглим, предпочтительно в тетрагидрофуране, или в смеси упомянутых растворителей, как, например, метанол и тетрагидрофуран или этанол и тетрагидрофуран. Реакция проводится при температуре примерно между -10 и 60°С, предпочтительно при комнатной температуре. Реакция восстановления может быть также осуществлена, как описано в учебниках по органической химии, например в J. March (1992), “Advanced Organic Chemistry: Reactions, Mechanisms and Structure”, 4-е изд., John Wiley & Sons.
На восьмой стадии реакции оксиметильную группу соединения формулы XVI превращают в соответствующую бромметильную группу и получают бромметилпроизводное формулы XVII, это осуществляют в соответствии со стандартными методиками согласно способам, известным из учебников по органической химии, например из учебника J. March (1992), “Advanced Organic Chemistry: Reactions, Mechanisms and Structure”, 4-е изд., John Wiley & Sons. Возможный способ получения бромпроизводного формулы XVII заключается в применении тетрабромметана в присутствии трифенилфосфина в дихлорметане при комнатной температуре.
На девятой стадии реакции бромид формулы XVII подвергают реакции с арилметанолом или гетероциклилметанолом HOCH2R8 формулы XVIII с целью получения соответствующего производного пиразола формулы Iy. Реакция обычно проводится согласно способам, известным из учебников по органической химии, например из J. March (1992), “Advanced Organic Chemistry: Reactions, Mechanisms and Structure”, 4-е изд., John Wiley & Sons. Реакцию осуществляют, например, в присутствии основания, как, например, гидрид натрия, гидрид лития, карбонат калия или триэтиламин, в подходящем органическом растворителе, как, например, тетрагидрофуран (ТГФ), или в полярных апротонных растворителях, подобных диметилсульфоксиду (ДМСО), N,N-диметилацетамиду или N,N-диметилформамиду (ДМФА), предпочтительно в ДМФА или ТГФ, при температуре примерно между -10 и 60°С, предпочтительно при комнатной температуре.
На десятой стадии реакции производное оксиметилпиразола формулы XVI при взаимодействии с бромидом BrCH2R8 непосредственно превращают в соответствующее производное пиразола формулы Iy. Реакцию проводят в соответствии со стандартными методиками согласно способам, известным из учебников по органической химии, например из J. March (1992), “Advanced Organic Chemistry: Reactions, Mechanisms and Structure”, 4-е изд., John Wiley & Sons. Возможный способ получения производного пиразола формулы Iy заключается в реакции оксиметильного производного пиразола формулы XVI с арилметилбромидом или гетероциклилметилбромидом формулы XIX в присутствии основания. Реакция может предпочтительно осуществляться в органическом растворителе, как, например, полярные апротонные растворители, подобные N,N-диметилацетамиду или N,N-диметилформамиду (ДМФА), дихлорметан или тетрагидрофуран, при использовании основания, как, например, гидрид натрия, гидрид лития, гидрид калия, карбонат лития, карбонат натрия, карбонат калия, или органических аминов, как, например, триэтиламин, морфолин или N-алкилморфолин, как, например, N-метилморфолин, при температуре примерно между -10 и 60°С, предпочтительно при комнатной температуре.
На одиннадцатой стадии реакции производное оксиметилпиразола формулы XVI превращается по реакции Мицунобу в соответствующие соединения формулы Ix. Реакция известна специалистам в данной области (D.L. Hughes, Organic Preparations and Procedures International, 1996, 28, 127; Mitsunobu, Synthesis 1981, 1). Реакцию проводят в присутствии триалкил- или триарилфосфина, как, например, трифенилфосфин, и реагента формулы RC(O)N=NC(O)R [R=алкокси- или диалкиламиногруппа], как, например, диэтилазодикарбоксилат. Реакцию проводят в подходящем органическом растворителе, как, например, дихлорметан, тетрагидрофуран (ТГФ), или в полярных апротонных растворителях, подобных N,N-диметилацетамиду или N,N-диметилформамиду (ДМФА), предпочтительно в ДМФА или ТГФ, при температуре между примерно -10 и 60°С, предпочтительно при комнатной температуре.
Соединения формулы Ix, где U означает S, синтезируют, исходя из бромметильного промежуточного соединения XVII, применяя реакцию алкилирования с использованием меркаптогетероцикла (тиогетероцикл формулы Het-SH). Эту реакцию осуществляют согласно стандартным методикам в соответствии со способами, известными из учебников по органической химии, например из J. March (1992), “Advanced Organic Chemistry: Reactions, Mechanisms and Structure”, 4-е изд., John Wiley & Sons. Реакцию предпочтительно проводят в органическом растворителе, как, например, полярные апротонные растворители, как N,N-диметилацетамид или N,N-диметилформамид (ДМФА), в дихлорметане или тетрагидрофуране, используя основание, как, например, гидрид натрия, гидрид лития, гидрид калия, карбонат лития, карбонат натрия, карбонат калия или органические амины, как, например, триэтиламин, морфолин или N-алкилморфолин, как, например, N-метилморфолин, при температуре реакции между примерно -10 и 60°С, предпочтительно при комнатной температуре.
На двенадцатой стадии реакции соединение формулы VII превращают с помощью реакции восстановительного аминирования в соответствующие соединения формулы Iw, где R1, R2, R3 и Х являются такими, как по пункту 1, и R9 означает СН2-(арил-/С1-С4/алкиламино). Реакция восстановительного аминирования известна из учебников по органической химии, например из учебника J. March (1992), “Advanced Organic Chemistry: Reactions, Mechanisms and Structure”, 4-е изд., John Wiley & Sons. Например, соединение формулы VII реагирует с производным ариламина, образуя соответствующее производное имина, и последующая реакция восстановления с помощью, например, NaBH(OAc)3 приводит к соединениям формулы Iw, где R1, R2, R3 и Х являются такими, как по пункту 1, и R9 означает СН2-(арил-/С1-С4/алкиламино). Вторичный амин необязательно может быть проалкилирован с помощью (C1-C4)алкилгалогенида в соответствующие (С1-С4)алкилированные соединения формулы Iw. Реакция алкилирования известна из учебников по органической химии, например из J. March (1992), “Advanced Organic Chemistry: Reactions, Mechanisms and Structure”, 4-е изд., John Wiley & Sons.
Реакционная схема 3:
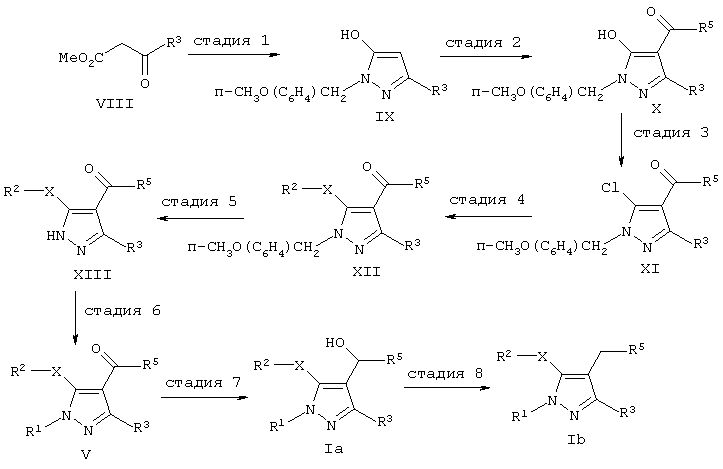
где R1, R2, R3 и Х являются такими, как установлено для соединений формулы I, и R5 означает арил или гетероциклил.
По реакционной схеме 3 первая стадия реакции осуществляется таким образом, что п-СН3О(С6Н4)СН2NHNH2·2HCl (получение см. пример 3) подвергают реакции с соединениями формулы VIII для получения производных пиразола формулы IX. Реакцию обычно проводят в присутствии основания, например карбоната калия, карбоната натрия, карбоната магния, карбоната кальция, гидроокиси калия, гидроокиси натрия, гидроокиси магния, гидроокиси кальция, триметиламина, триэтиламина, три(н-пропил)амина, три(изопропил)амина, предпочтительно триалкиламина, в подходящем растворителе, как, например, галогенированные углеводороды (например, дихлорметан или трихлорметан) или углеводороды (например, циклогексан, метилциклогексан, декалин, бензол, толуол, о-ксилол, м-ксилол или п-ксилол), предпочтительно в толуоле. Реакцию проводят при температуре от комнатной до температуры кипения реакционной смеси, предпочтительно при температуре между примерно от 50 и 150°С.
На второй стадии реакции соединение формулы IX реагирует с R5COCl (комерчески доступным или синтезированным в соответствии со способами, известными из учебников по органической химии, например из J. March (1992), “Advanced Organic Chemistry: Reactions, Mechanisms and Structure”, 4-е изд., John Wiley & Sons), где R5 является таким, как определено выше, в подходящем растворителе, получают производное пиразола формулы X, замещенное по 4-му положению заместителем с оксогруппой. Реакция проводится в таких же условиях, которые описаны для реакционной схемы 1 (стадия 1).
На третьей стадии реакции осуществляют хлорирование по положению 5 соединений формулы X, имеющих гидроксильную группу в этом положении, с помощью хлорирующего агента, как, например, (COCl)2, HCl, PCl5, PCl3, SOCl2 или POCl3, получают производные 5-хлорпиразола формулы XI. Реакция обычно может быть проведена с применением POCl3 при температуре примерно между 0°С и температурой кипения реакционной смеси, предпочтительно между примерно 5 и 100°С. Реакция необязательно может проводиться в атмосфере инертного газа, как, например, в атмосфере азота или аргона, и в органическом растворителе, как, например, простые эфиры (например, тетрагидрофуран, диэтиловый эфир, дибутиловый эфир или диоксан), галогенированные углеводороды (например, дихлорметан или трихлорметан), углеводороды (например, циклогексан, метилциклогексан, декалин, бензол, толуол, о-ксилол, м-ксилол или п-ксилол), или в смеси упомянутых растворителей.
На четвертой стадии реакции соединение формулы XI подвергают взаимодействию с R2SH или с R2ОН (оба реагента являются коммерчески доступными или могут быть синтезированы в соответствии со способами, известными из учебников по органической химии, например из J. March (1992), “Advanced Organic Chemistry: Reactions, Mechanisms and Structure”, 4-е изд., John Wiley & Sons), где R2 является таким, как определено для соединений формулы I, получают производное пиразола формулы XII. Реакцию проводят в подходящем растворителе в присутствии основания, как, например, н-BuLi, гидрид натрия, триалкиламин, как, например, триметиламин или триэтиламин, карбонат калия, карбонат натрия, карбонат магния, карбонат кальция, предпочтителен карбонат калия. Реакцию проводят в подходящем растворителе в присутствии основания, как, например, гидрид натрия, триалкиламин, как, например, триметиламин или триэтиламин, карбонат калия, карбонат натрия, карбонат магния, карбонат кальция, предпочтителен карбонат калия. Реакцию обычно проводят при температуре от 0°С до температуры кипения реакционной смеси, предпочтительно при температуре реакции между комнатной и примерно 180°С. Подходящими растворителями для реакции являются тетрагидрофуран или полярные апротонные растворители, как, например, диметилсульфоксид (ДМСО), диметилацетамид или N,N-диметилформамид (ДМФА), предпочтителен ДМФА.
На пятой стадии реакции соединение формулы XII подвергается реакции с трифторуксусной кислотой для удаления 4-метоксибензильной группы пиразольного производного и для получения незащищенного производного пиразола формулы XIII. Реакция может также быть проведена в минеральных кислотах, как, например, соляная кислота, в подходящем растворителе, как, например, диоксан, диэтиловый эфир, этилацетат или метанол. Реакцию удобно проводить при температуре от комнатной до температуры кипения реакционной смеси, предпочтительно при температуре между 40°С и примерно 150°С. Реакция необязательно может быть проведена в инертной атмосфере, как, например, в атмосфере азота или аргона, и в органическом растворителе, как, например, спирты (например, метанол, этанол, пропанол, бутанол, октанол или циклогексанол), простые эфиры (например, тетрагидрофуран, диэтиловый эфир, дибутиловый эфир или диоксан), кетоны (например, ацетон, бутанон или циклогексанон), сложные эфиры (например, этилацетат), галогенированные углеводороды (например, дихлорметан или трихлорметан), углеводороды (например, циклогексан, метилциклогексан, декалин, бензол, толуол, о-ксилол, м-ксилол или п-ксилол) или смесь упомянутых растворителей.
На шестой стадии реакции соединение формулы XIII подвергается взаимодействию с алкилирующим агентом формулы R1L, где L означает уходящую группу, как, например, хлор, бром, иод, мезилат или тозилат, для получения N-замещенного производного пиразола формулы V. Реакция обычно проводится в подходящем растворителе, в атмосфере инертного газа, как, например, в атмосфере азота или аргона, в присутствии сильного основания, как, например, гидрид натрия или гидрид лития, предпочтительно гидрида натрия. Температура реакции предпочтительно является температурой от 0°С до температуры кипения реакционной смеси, предпочтительно реакцию проводят при температуре между 10°С и примерно 150°С. Подходящими растворителями для реакции являются безводные полярные апротонные растворители, как, например, тетрагидрофуран, диметилсульфоксид (ДМСО), диметилацетамид или N,N-диметилформамид (ДМФА), предпочтительно ДМФА.
На седьмой стадии реакции оксогруппу соединения формулы V восстанавливают для получения соответствующего соединения с гидроксильной группой формулы Ia. Реакцию проводят в условиях, подобных описанным для реакционной схемы 1 (стадия 4).
На восьмой стадии оксиметильную группу соединения формулы Ia далее восстанавливают в соответствующую метиленовую группу и получают соединение формулы Ib. Реакцию проводят в таких же условиях, что описаны для реакционной схемы 1 (стадия 5).
Синтез соединений формулы I, где R1 означает ацил, (C1-С4)алкилсульфонил или необязательно замещенный фенилсульфонил, R2, R3 и Х являются такими, как определено для соединений формулы I, и R5 означает арил или гетероциклил, предпочтительно осуществляют таким образом, что соединения формулы XIII подвергают ацилированию или сульфонилированию для получения соответствующих соединений формулы I, где R1 означает ацил, (С1-С4)алкилсульфонил или необязательно замещенный фенилсульфонил. Реакции ацилирования или сульфонилирования известны из учебников по органической химии, например из J. March (1992), “Advanced Organic Chemistry: Reactions, Mechanisms and Structure”, 4-е изд., John Wiley & Sons. Дальнейшие стадии реакции проводятся в соответствии с реакцией, описанной в реакционной схеме 3.
Как указано выше, соединения формулы I и их гидролизуемые сложные или простые эфиры или фармацевтически приемлемые соли являются ингибиторами фермента, обратной транскриптазы, вируса иммунодефицита человека как in vitro, так и in vivo, и могут быть применены для борьбы с заболеваниями или для предотвращения заболеваний, опосредованных вирусом иммунодефицита человека (ВИЧ).
Активность соединений формулы I для лечения заболеваний, опосредованных вирусом иммунодефицита человека (ВИЧ), может быть продемонстрирована с помощью следующих аналитических методик.
Методика анализа: анализ обратной транскриптазы (RT) ВИЧ-1: определение IC50 ингибитора
Анализ обратной транскриптазы ВИЧ-1 проводили в 96-ячеечных планшетах (Millipore filtermat NOB50), применяя очищенный рекомбинантный фермент и поли(rA)/олиго(dT)16-матрицу как затравку в общем объеме 50 мкл. Компонентами для анализа были 50 мМ трис/HCl, 50 мМ NaCl, 1 мМ этилендиаминтетрауксусная кислота (ЭДТК), 6 мМ MgCl2, 5 мкМ dTTP, 0,1 мкКи [3Н] dTTP, 5 мкг/мл поли(rA), предварительно гибридизованной с 2,5 мкг/мл олиго(dT)16, и ингибиторы в таком диапазоне концентраций, чтобы конечная концентрация составляла 10% в ДМСО. Реакции инициировали, прибавляя 5 нМ обратную транскриптазу ВИЧ-1, и после инкубирования при 37°С в течение 30 минут реакции останавливали при прибавлении 50 мкл охлажденной до температуры льда 20%-ной трихлоруксусной кислоты (ТХУК) и оставляли осаждаться при 4°С в течение 30 минут. Осадки с планшета собирали с помощью вакуума и последовательно промывали 2×200 мкл 10%-ной ТХУК и 2×200 мкл 70%-ного этанола. Наконец, планшеты сушили и рассчитывали радиоактивность в Wallac Microbeta 1450 после прибавления 15 мкл сцинтилляционной жидкости в каждую ячейку. Значения IC50 (концентраций, вызывающих 50%-ное ингибирование) рассчитывали по кривой зависимости % ингибирования от десятичного логарифма концентраций ингибитора.
Методика анализа противовирусной активности
Противовирусную активность в отношении ВИЧ определяли, используя адаптацию методики Pauwels и др. {Pauwels и др., 1988, J. Virol Methods 20:309-321}. Методика основывается на способности соединений защищать ВИЧ-инфицированные Т-лимфобластоидные клетки (клетки МТ4) от некроза клеток, опросредованного инфекцией. Граничную точку анализа рассчитывали как концентрацию соединения, при которой жизнеспособность клеток культуры сохранялась на 50% (“концентрация, вызывающая 50%-ное ингибирование”, IC50) Жизнеспособность клеток культуры определяли с помощью поглощения растворимого бромида 3-[4,5-диметилтиазол-2-ил]-2,5-дифенилтетразолия (МТТ) желтого цвета и его восстановления в нерастворимую соль с формазаном пурпурного цвета. После солюбилизации использовали спектрофотометрические методы для измерения количества формазанового продукта.
Клетки МТ4 готовили так, чтобы они были в логарифмической фазе роста и чтобы в общей сложности 2×10 клеток, инфицированных штаммом НХВ2 вируса иммунодефицита человека при множественности 0,0001 инфекционных единиц вируса на клетку, содержалось в общем объеме от 200 до 500 мкл. Клетки инкубировали с вирусом в течение одного часа при 37°С до удаления вируса. Клетки затем промывали в забуференном 0,01 М фосфатом физиологическом растворе, рН 7,2, прежде, чем их заново суспендировали в культуральной среде для инкубирования в культуре с серийными разведениями исследуемого соединения. Была использована культуральная среда RPMI 1640 без фенолового красного, дополненная пенициллином, стрептомицином, L-глутамином и 10%-ной околоплодной сывороткой теленка (GM10).
Исследуемые соединения готовили в виде 2 мМ растворов в диметилсульфоксиде (ДМСО). Затем готовили 4 копии серийных 2-кратных разведений в GM10 и количества в 50 мкл помещали в 96-ячеечные планшеты сверх конечного наномолярного предела концентраций 625-1,22. Пятьдесят микролитров GM10 и 3,5×104 инфицированных клеток прибавляли затем в каждую ячейку. Готовили также контрольные культуры, не содержащие клеток (слепой опыт), содержащие неинфицированные клетки (100% жизнеспособность; 4 копии) и инфицированные клетки без соединения (полный некроз клеток, опосредованный вирусом; 4 копии). Культуры затем инкубировали при 37°С в течение 5 дней в атмосфере влажного воздуха с 5% углекислого газа.
Готовили свежий раствор 5 мг/мл МТТ в забуференном 0,01 М фосфатом физиологическом растворе, рН 7,2, и прибавляли 20 мкл к каждой культуре. Культуры затем инкубировали, как ранее, в течение 2 часов. Затем смешивали их, отбирая пипеткой и выпуская из нее, и 170 мкл тритона Х-100 в подкисленном изопропаноле (10% об./об. тритона Х-100 в смеси 1:250 концентрированной соляной кислоты в изопропаноле). Когда формазановый слой был полностью солюбилизирован при дальнейшем смешении, измеряли поглощение (ОП) культур при длине волны 540 и 690 нм (показания при 690 нм использовали в качестве контрольных проб для артефактов между ячейками). Процент защиты для каждой обработанной культуры затем рассчитывали из уравнения:

Значения IC50 могут быть получены из графиков процента защиты в зависимости от десятичного логарифма концентрации лекарственного средства.
В обоих анализах активность соединений формулы I, выраженная значением IC50, лежит в пределах примерно от 0,5 до 10000 нМ или от 0,5 до примерно 5000 нМ, предпочтительные соединения характеризуются диапазоном активности примерно от 0,5 до 750 нМ, более предпочтительно примерно от 0,5 до 300 нМ и наиболее предпочтительно примерно от 0,5 до 50 нМ.
| Таблица 2 |
| Структура |
RT IC50 [нМ] |
ВИЧ IC50 [нМ] |
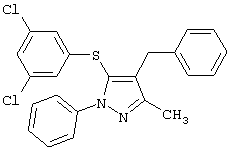 |
2060 |
403 |
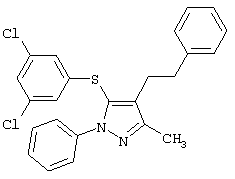 |
3420 |
592 |
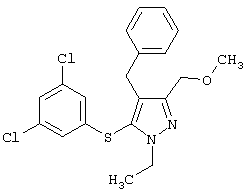 |
8040 |
453 |
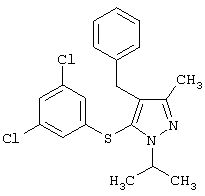 |
270 |
24 |
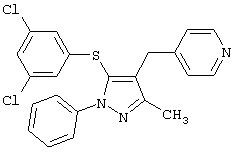 |
105 |
36 |
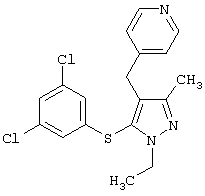 |
84 |
9 |
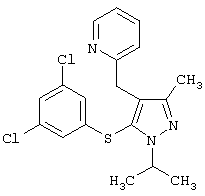 |
1070 |
75 |
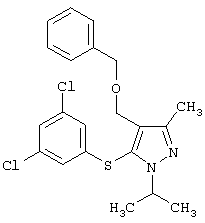 |
349 |
100 |
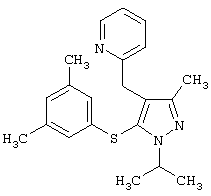 |
950 |
64 |
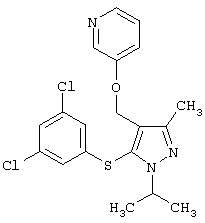 |
313 |
110 |
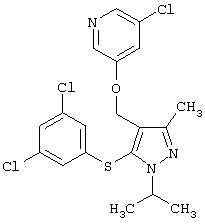 |
650 |
203 |
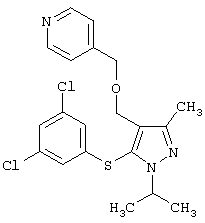 |
112 |
3,6 |
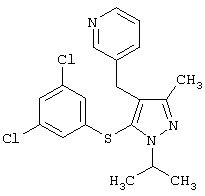 |
572 |
14,6 |
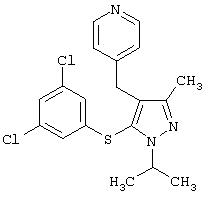 |
76 |
2,7 |
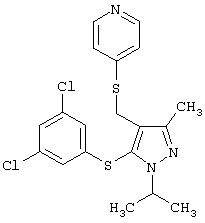 |
292 |
34,1 |
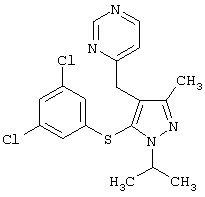 |
456 |
13,5 |
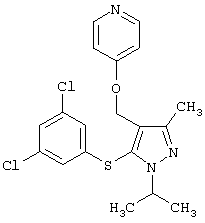 |
252 |
20 |
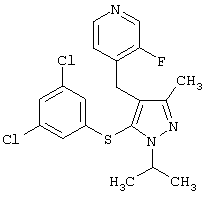 |
373 |
11,1 |
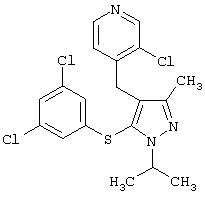 |
177 |
51,7 |
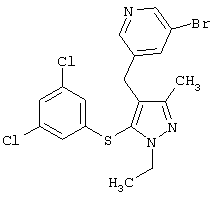 |
398 |
124 |
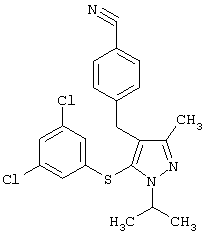 |
176 |
11,9 |
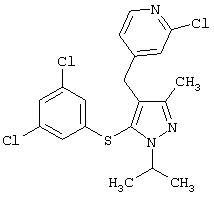 |
109 |
15 |
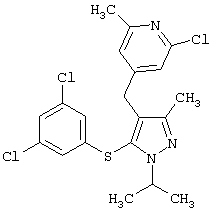 |
880 |
28 |
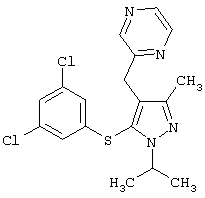 |
270 |
13,9 |
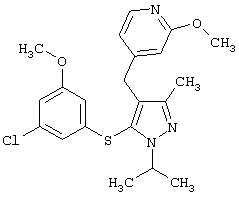 |
298 |
31,5 |
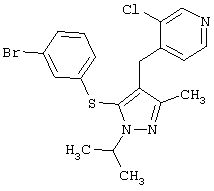 |
5200 |
– |
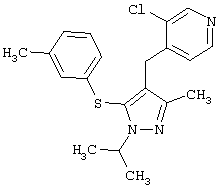 |
1082 |
– |
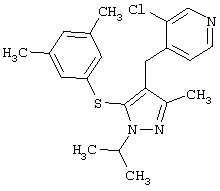 |
607 |
– |
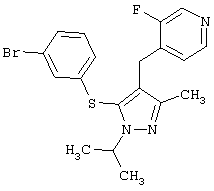 |
463 |
19 |
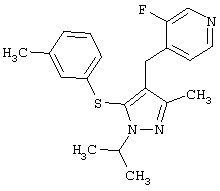 |
480 |
19 |
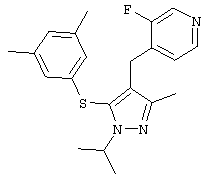 |
90 |
8,1 |
Производные пиразола, обеспечиваемые представленным изобретением, полезны для терапевтического лечения организма человека или животного, особенно они полезны в качестве ингибиторов обратной транскриптазы, фермента вируса иммунодефицита человека. Соответственно, представленные производные пиразола являются терапевтически активными веществами при лечении заболеваний, опосредованных вирусом иммунодефицита человека (ВИЧ), и могут быть применены в качестве лекарственных средств для лечения таких заболеваний.
Они могут быть применены в качестве лекарственных средств главным образом для лечения вирусных заболеваний, обусловленных иммунитетом состояний или заболеваний, бактериальных заболеваний, паразитарных заболеваний, воспалительных заболеваний, гиперпролиферативных сосудистых заболеваний, опухолей и рака.
В частности, соединения по настоящему изобретению и содержащие их фармацевтические композиции полезны в качестве химиотерапевтических средств, ингибиторов репликации вирусов и модуляторов иммунной системы и могут быть применены для лечения заболеваний, обусловленных вирусом иммунодефицита человека (ВИЧ), других вирусных заболеваний, как, например, ретровирусные инфекции (или только они одни, или в комбинации с другими противовирусными средствами, как, например, интерферон или его производные, как, например, конъюгаты с полиэтиленгликолем).
Эти соединения могут быть использованы сами по себе или в комбинации с другими терапевтически активными средствами, например с иммунодепрессантом, с химиотерапевтическим средством, с противовирусным средством, с антибиотиком, с антипаразитарным средством, с противовоспалительным средством, с противогрибковым средством и/или со средством против гиперпролиферации сосудов.
Соединения согласно изобретению могут быть использованы в качестве лекарственных средств, например в виде фармацевтических препаратов, которые содержат их или их соли в смеси с фармацевтическим органическим или неорганическим носителем, который годится для парентерального введения или введения в тонкий кишечник, как, например, вода, желатина, аравийская камедь, лактоза, крахмал, стеарат магния, тальк, растительные масла, полиалкиленгликоли, вазелин и т.д. Фармацевтические препараты могут быть представлены в твердой форме, например в виде таблеток, драже, суппозиториев, капсул, или в жидкой форме, например в виде растворов, суспензий или эмульсий. Они могут быть стерилизованы и/или могут содержать адъюванты, как, например, консерванты, стабилизаторы, смачивающие или эмульгирующие средства, соли для изменения осмотического давления, обезболивающие средства или буферы. Соединения формулы I и их соли предпочтительно предусматриваются для перорального введения и для этой цели из них готовят соответствующую готовую лекарственную форму.
Количество соединения формулы I, требуемое для лечения вирусных заболеваний, особенно заболеваний, обусловленных вирусом иммунодефицита человека (ВИЧ), или других вирусных заболеваний, зависит от ряда факторов, включающих тяжесть заболевания и подлинность, пол и массу реципиента, и находится полностью на усмотрении лечащего врача. В общем, однако, подходящая эффективная доза находится в пределах от 0,1 до 100 мг на килограмм массы тела реципиента в день, предпочтительно в пределах от 0,5 до 50 мг на килограмм массы тела в день и наиболее предпочтительно в пределах от 1,0 до 30 мг на килограмм массы тела в день. Оптимальная доза составляет примерно от 5 до 25 мг на килограмм массы тела в день. Желательная доза предпочтительно представлена в виде одной, двух, трех, четырех, пяти, шести или более субдоз, вводимых через определенные интервалы в течение дня, предпочтительно это одна, две, три, четыре или пять субдоз и наиболее предпочтительно одна, две или три субдозы. Эти субдозы могут быть введены в виде лекарственных форм со стандартными дозами, например, содержащих от 1 до 1500 мг, предпочтительно от 100 до 1400 мг, наиболее предпочтительно от 400 до 1000 мг активного ингредиента в лекарственной форме со стандартной дозой.
Дозировки соединений общей формулы I и их фармацевтически совместимых солей с основаниями могут варьироваться в широких пределах и в каждом отдельном случае, конечно, подбираются в соответствии с индивидуальными требованиями и с возбудителем заболевания, с которым предстоит бороться.
Как указывалось ранее, лекарственные средства, содержащие соединение общей формулы I или его фармацевтически совместимую соль, также являются объектом настоящего изобретения, кроме того, также и способ получения таких лекарственных средств, который характеризуется тем, что объединяют одно или более соединений общей формулы I или их фармацевтически совместимые соли и, если желательно, одно или несколько других терапевтически ценных веществ в галеновую форму для введения.
Предпочтительно вводить соединение формулы I в виде фармацевтической готовой формы. Готовые лекарственные формы по настоящему изобретению включают как минимум один активный ингредиент формулы I вместе с одним или несколькими фармацевтически приемлемыми наполнителями и необязательно одно или несколько других терапевтических средств. Готовыми лекарственными формами для перорального введения могут быть капсулы, крахмальные облатки или таблетки, каждая из которых содержит заданное количество активного(ых) ингредиента(ов), такие формы могут быть получены любым способом, хорошо известным в фармации. Так же, как и активный ингредиент(ы), формы для перорального применения могут содержать связывающее вещество (например, повидон, желатину, гидроксипропилметилцеллюлозу), смазывающее вещество, инертный растворитель, консервант, вещество, способствующее размельчению (например, крахмал-гликолят натрия, повидон с поперечной сшивкой, натрийкарбоксиметилцеллюлоза с поперечной сшивкой), или диспергирующее средство. Готовые лекарственные формы для перорального применения могут также включать забуферивающие средства для нейтрализации кислотности в желудке.
Используемые в следующих примерах сокращения имеют следующие значения:
| MS |
масс-спектроскопия (МС) |
| ES |
электрораспыление |
| EI |
электронный удар |
| NMR |
спектроскопия ядерного магнитного резонанса (ЯМР) |
| DMF |
N,N-диметилформамид (ДМФА) |
| DMSO |
диметилсульфоксид (ДМСО) |
| rt |
комнатная температура |
| min |
минута(ы) |
| h |
час(ы) |
Все температуры приведены в градусах по Цельсию (°С).
Описанные ЯМР-спектры были сняты на спектрометре Bruker DRX 400 МГц при температуре 300 К.
Масс-спектры, обозначенные “(М+; EI)”, снимались в условиях ионизации электронным ударом (EI) на приборе THERMOQUEST MAT95 S при температуре ионного источника 200°С. Другие масс-спектры снимались при ионизации электрораспылением (ESI) на одном из следующих приборов:
а) THERMOQUEST SSQ 7000 [растворитель 0,085% трифторуксусная кислота (ТФК) в 90% ацетонитриле/воде; скорость потока 100 микролитров в минуту; капилляр 250°С; напряжение распыления 5 кВ; газовый слой 5,625 кг/см2] или
б) система жидкостная хроматография-масс-спектрометрия (ЖХ-МС) (жидкостной хроматограф, соединенный с масс-спектрометром) THERMOQUEST TSQ 7000 ELECTROSPRAY или MICROMASS PLATFORM ELECTROSPRAY [растворитель 0,1% ТФК в воде или 0,085% ТФК в 90% ацетонитриле/воде или 0,085% ТФК в ацетонитриле].
Соединения, всякий раз, когда их получают способами по настоящему изобретению, также являются объектом настоящего изобретения.
Следующие примеры иллюстрируют настоящее изобретение:
Пример 1
4-Бензил-5-(3,5-дихлорфенилтио)-3-метил-1-фенил-1H-пиразол
Раствор, содержащий 80 мг [5-(3,5-дихлорфенилтио)-3-метил-1-фенил-1Н-пиразол-4-ил]фенилметанола и 64 мкл триэтилсилана в 2 мл трифторуксусной кислоты, перемешивали 15 ч при комнатной температуре. Смесь концентрировали, разбавляли 10 мл насыщенного раствора бикарбоната натрия и дважды экстрагировали 10 мл дихлорметана. Объединенные экстракты сушили над сульфатом магния, фильтровали и упаривали. Остаток очищали с помощью флэш-хроматографии на силикагеле, используя для элюирования этилацетат/уайт-спирит 40-60°С (1:10), получали 60 мг 4-бензил-5-(3,5-дихлорфенилтио)-3-метил-1-фенил-1H-пиразола в виде бесцветной смолы. МС (EI) m/z 424 [М]+. 1Н-ЯМР (ДМСО-d6): 2,26 (s, 3Н), 3,88 (s, 2Н), 6,77 (d, 2H), 7,13 (m, 3Н), 7,20 (m, 2H), 7,32 (t, 1H), 7,35-7,48 (m, 5H).
Исходное вещество [5-(3,5-дихлорфенилтио)-3-метил-1-фенил-1H-пиразол-4-ил]фенилметанол получали следующим образом.
(А) Раствор, содержащий 2,0 г 4-бензоил-3-метил-1-фенил-2-пиразолин-5-она (коммерчески доступного, например, от фирмы Aldrich 15,660-4) в 4 мл хлорокиси фосфора, перемешивали в атмосфере азота при 100°C в течение 30 минут. Смесь выливали в 40 мл насыщенного раствора бикарбоната натрия и экстрагировали три раза 30 мл дихлорметана. Объединенные экстракты сушили над сульфатом магния, фильтровали и упаривали, получали 2,0 г (5-хлор-3-метил-1-фенил-1Н-пиразол-4-ил)фенилметанона в виде масла желтого цвета, которое использовали без дополнительной очистки.
(Б) Раствор, содержащий 2,0 г (5-хлор-3-метил-1-фенил-1Н-пиразол-4-ил)фенилметанона, 2,0 г 3, 5-дихлортиофенола и 1,7 г карбоната калия в 50 мл N,N-диметилформамида, перемешивали при 60°С в течение 19 часов. Смесь распределяли между 100 мл воды и 100 мл дихлорметана. Органический слой сушили над сульфатом магния, фильтровали и упаривали. Остаток очищали с помощью флэш-хроматографии на силикагеле, используя метанол/дихлорметан для элюирования, получали 2,2 г [5-(3,5-дихлорфенилсульфанил)-3-метил-1-фенил-1Н-пиразол-4-ил]фенилметанона в виде масла желтого цвета. Масс-спектр (ES) m/z 439 [М+Н]+, 480 [M+H+CH3CN]+.
(В) Раствор 100 мг [5-(3,5-дихлорфенилтио)-3-метил-1-фенил-1Н-пиразол-4-ил]фенилметанона и 23 мг боргидрида натрия в 5 мл метанола перемешивали 17 часов при комнатной температуре. Смесь разбавляли 4 мл воды и экстрагировали 4 раза диэтиловым эфиром. Объединенные экстракты сушили над сульфатом магния, фильтровали и упаривали. Остаток очищали с помощью флэш-хроматографии на силикагеле, используя для элюирования этилацетат/уайт-спирит 40-60°С, получали 84 мг [5-(3,5-дихлорфенилтио)-3-метил-1-фенил-1Н-пиразол-4-ил]фенилметанола в виде бесцветной смолы. Масс-спектр (EI) m/z 440 [М]+.
Примеры 2-11
Соединения, представленные в таблице 3, получали способом, аналогичным описанному в примере 1.
| Таблица 3 |
| При-мер |
Структура |
Название |
МС (ES) (М+Н)+ |
| 2 |
 |
[5-(3,5-Дихлорфенилтио)-3-(метоксиметил)-1-метил-1Н-пиразол-4-ил]фенилметанол |
408 (М+; EI) |
| 3 |
 |
5-(3,5-Дихлорфенилтио)-3-метил-1-фенил-1Н-пиразол-4-ил]фенилметанол |
440 (М+; EI) |
| 4 |
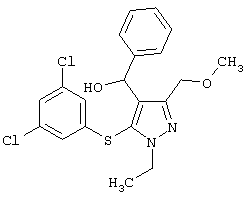 |
[5-(3,5-Дихлорфенилтио)-1-этил-3-(метоксиметил)-1Н-пиразол-4-ил]фенилметанол |
422 (М+; EI) |
| 5 |
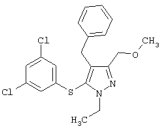 |
4-Бензил-5-(3,5-дихлорфенилтио)-1-этил-3-(метоксиметил)-1Н-пиразол |
406 (M+; EI) |
| 6 |
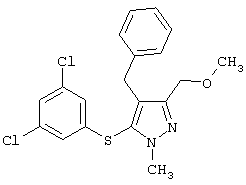 |
4-Бензил-5-(3,5-дихлорфенилтио)-3-метоксиметил-1-метил-1Н-пиразол |
322 (М+; EI) |
| 7 |
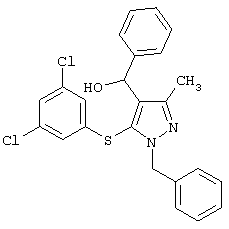 |
[5-(3,5-Дихлорфенилтио)-3-метил-1Н-пиразол-4-ил]фенилметанол |
455 |
| 8 |
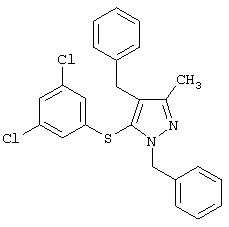 |
1,4-Дибензил-5-(3,5-дихлорфенилтио)-3-метил-1Н-пиразол |
439 |
| 9 |
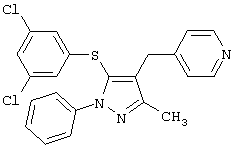 |
4-[5-(3,5-Дихлорфенилтио)-3-метил-1-фенил-4-[(4-пиридил)метил]-1Н-пиразол |
426 |
| 10 |
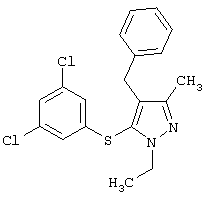 |
4-Бензил-5-(3,5-дихлорфенилтио)-1-этил-3-метил-1Н-пиразол |
376 (M+; EI) |
| 11 |
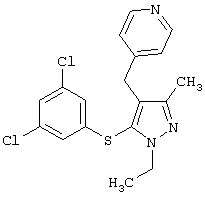 |
4-[5-(3,5-Дихлорфенилтио)-1-этил-3-метил-[(4-пиридил)метил]-1Н-пиразол |
377 (М+; EI) |
Пример 12
5-(3,5-Дихлорфенилтио)-3-метил-4-(2-фенилэтил)-1-фенил-1Н-пиразол
Суспензию, содержащую 95 мг 5-(3,5-дихлорфенилтио)-3-метил-1-фенил-4-стирил-1H-пиразола и 75 мг 10% палладия на активированном угле в 10 мл этилацетата, перемешивали в атмосфере водорода (1 атм) при комнатной температуре в течение 40 часов. Суспензию фильтровали через целит® и фильтрат упаривали, получали 89 мг 5-(3,5-дихлорфенилтио)-3-метил-4-(2-фенилэтил)-1-фенил-1H-пиразола в виде бесцветной смолы. Масс-спектр (EI) m/z 438 [М]+. 1H-ЯМР (ДМСО-d6): 2,14 (s, 3H), 2,68 (t, 2H), 2,77 (t, 2H), 6,85 (d, 2Н), 7, 09 (d, 2H), 7,16 (t, 1H), 7,24 (t, 2H), 7,33-7,48 (m, 6H).
Исходное вещество – 5-(3,5-дихлорфенилтио)-3-метил-1-фенил-4-стирил-1Н-пиразол – получали, как указано ниже.
(A) Раствор, содержащий 1,0 г 5-метил-2-фенил-2Н-пиразол-3-ола (коммерчески доступного, например, от фирмы Aldrich M7,080-0) и 2,1 мл хлорокиси фосфора в 10 мл безводного N,N-диметилформамида, перемешивали под азотом при 100°С в течение 4 часов. Смесь выливали в 70 мл насыщенного раствора бикарбоната натрия и трижды экстрагировали 60 мл дихлорметана. Объединенные экстракты сушили над сульфатом магния, фильтровали и упаривали. Остаток очищали с помощью хроматографии на силикагеле, используя для элюирования дихлорметан/метанол, получали 177 мг 5-хлор-3-метил-1-фенил-1Н-пиразол-4-карбальдегида в виде игольчатых кристаллов желтого цвета.
(Б) Раствор, содержащий 175 мг 5-хлор-3-метил-1-фенил-1Н-пиразол-4-карбальдегида, 142 мг 3,5-дихлортиофенола и 132 мг карбоната калия в 5 мл безводного N,N-диметилформамида, перемешивали в атмосфере азота 2 часа при 60°С. Смесь разбавляли 10 мл воды и экстрагировали три раза 8 мл дихлорметана. Объединенные экстракты сушили над сульфатом магния, фильтровали и упаривали. Остаток очищали с помощью флэш-хроматографии на силикагеле, используя для элюирования дихлорметан, получали 164 мг 5-(3,5-дихлорфенилтио)-3-метил-1-фенил-1H-пиразол-4-карбальдегида в виде масла желтого цвета. Масс-спектр (EI) m/z 362 [M]+.
(B) Раствор, содержащий 164 мг 5-(3,5-дихлорфенилтио)-3-метил-1-фенил-1H-пиразол-4-карбальдегида, 103 мг диэтилбензилфосфоната и 27 мг гидрида натрия (60% в минеральном масле) в 5 мл безводного тетрагидрофурана, перемешивали в атмосфере азота 16 часов при комнатной температуре. Растворитель выпаривали и остаток очищали с помощью флэш-хроматографии на силикагеле, используя для элюирования этилацетат/уайт-спирит 40-60°С (1:10), получали 162 мг 5-(3,5-дихлорфенилтио)-3-метил-1-фенил-4-стирил-1Н-пиразола в виде твердого вещества бледно-желтого цвета. Масс-спектр (EI) m/z 436 [M]+.
Примеры 13-17
Соединения, приведенные в таблице 4, получали способом, аналогичным описанному в примере 12.
| Таблица 4 |
| При-мер |
Структура |
Название |
МС (ES) (М+Н)+ |
| 13 |
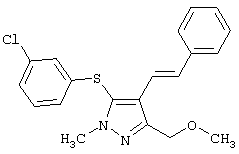 |
5-(3-Хлорфенилтио)-3-метоксиметил-1-метил-4-стирил-1Н-пиразол |
371 |
| 14 |
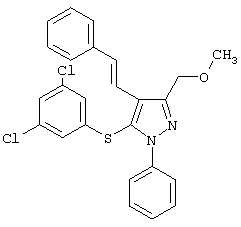 |
(Е)-5-(3,5-Дихлорфенилтио)-3-(метоксиметил)-1-фенил-4-стирил-1Н-пиразол |
467 |
| 15 |
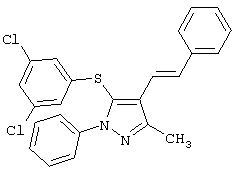 |
5-(3,5-Дихлорфенилтио)-3-метил-1-фенил-4-стирил-1Н-пиразол |
436 (М+: El) |
| 16 |
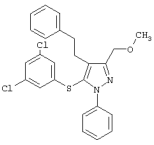 |
5-(3,5-Дихлорфенилтио)-3-(метоксиметил)-1-фенил-4-(2-фенилэтил)-1Н-пиразол |
469 |
| 17 |
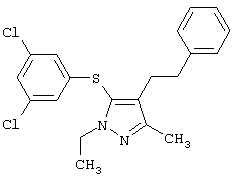 |
5-(3,5-Дихлорфенилтио)-1-этил-3-метил-4-(2-фенилэтил)-1Н-пиразол |
390 (M+; El) |
Пример 18
4-Бензил-5-(3,5-дихлорфенилтио)-1-изопропил-3-метил-1Н-пиразол
Раствор, содержащий 30 мг [5-(3,5-дихлорфенилтио)-1-изопропил-3-метил-1Н-пиразол-4-ил]фенилметанола в 1 мл трифторуксусной кислоты, обрабатывали 14 мкл триэтилсилана. Смесь перемешивали при комнатной температуре 15 минут. Растворитель выпаривали в вакууме и затем остаток распределяли между диэтиловым эфиром/насыщенным раствором бикарбоната натрия и трижды экстрагировали. Объединенные экстракты промывали соляным раствором, затем сушили над безводным сульфатом магния, фильтровали и упаривали. Остаток очищали с помощью флэш-хроматографии на силикагеле, используя для элюирования диэтиловый эфир/гексан (1:7), получали 15 мг бесцветной смолы. Масс-спектр (ES) m/z 391 [М+Н]+. 1H-ЯМР (ДМСО-d6): 1,27 (d, 6H), 2,20 (s, 3Н), 3,79 (s, 2Н), 4,67 (m, 1Н), 6,82 (d, 2H), 7,05 (d, 2H), 7,09 (t, 1H), 7,17 (t, 2H), 7,38 (t, 1H).
Исходное вещество [5-(3,5-дихлорфенилтио)-1-изопропил-3-метил-1Н-пиразол-4-ил]фенилметанол получали, как описано далее.
(A) Раствор, содержащий 7,9 мл гидразингидрата в 80 мл этанола, обрабатывали 3,7 мл 4-метоксибензилхлорида и нагревали 2,0 часа при 90°С. Растворитель выпаривали в вакууме и затем полученный в результате остаток растворяли в 30 мл этанола. Раствор подкисляли 30 мл 5 н. соляной кислоты при 0°С и выпадал осадок белого цвета. Твердое вещество белого цвета отфильтровывали и сушили, получали 2,75 г дигидрохлорида (4-метоксибензил)гидразина (PMBNHNH2·2HCl), который использовали без дополнительной очистки.
(Б) Раствор, содержащий 2,75 г дигидрохлорида (4-метоксибензил)гидразина в 50 мл толуола, обрабатывали 1,7 мл триэтиламина при комнатной температуре и затем перемешивали 5 минут. Затем смесь обрабатывали 1,32 мл метилового эфира ацетоуксусной кислоты и нагревали при 100°С в течение 15 минут. Растворитель выпаривали в вакууме и затем остаток распределяли между дихлорметаном/10%-ной лимонной кислотой, и экстрагировали три раза. Объединенные экстракты промывали соляным раствором, затем сушили над безводным сульфатом магния, фильтровали и упаривали, получали твердое вещество желтого цвета. Твердое вещество очищали с помощью флэш-хроматографии на силикагеле, используя для элюирования метанол/дихлорметан (1:49), получали 2,3 г 2-(4-метоксибензил)-5-метил-2Н-пиразол-3-ола в виде твердого вещества белого цвета. Масс-спектр (ES) m/z 219 [М+H]+.
(B) Раствор, содержащий 1,0 г 2-(4-метоксибензил)-5-метил-2Н-пиразол-3-ола в 30 мл диоксана, обрабатывали 679 мг гидроокиси кальция и 800 мкл бензоилхлорида, затем нагревали 2 часа при 110°С. К смеси прибавляли 20 капель воды и смесь нагревали еще 2 часа. Растворитель выпаривали в вакууме и остаток распределяли между дихлорметаном/10%-ной лимонной кислотой. Органическую фазу промывали соляным раствором, затем сушили над безводным сульфатом магния, фильтровали и упаривали до получения масла желтого цвета. Масло дважды очищали с помощью флэш-хроматографии на силикагеле, используя сначала для элюирования метанол/дихлорметан (1:49), получали твердое вещество красного цвета, затем элюировали этилацетатом/гексаном (от 1:1 до 2:1) и получали 400 мг [5-гидрокси-1-(4-метоксибензил)-3-метил-1Н-пиразол-4-ил]фенилметанона в виде смолы желтого цвета. Масс-спектр (ES) m/z 323 [М+Н]+.
(Г) Раствор, содержащий 400 мг [5-гидрокси-1-(4-метоксибензил)-3-метил-1Н-пиразол-4-ил]фенилметанона в 5 мл хлорокиси фосфора, нагревали 30 минут при 40°С. Смесь выливали в охлажденный до температуры льда насыщенный раствор бикарбоната натрия и экстрагировали три раза дихлорметаном. Объединенные экстракты промывали соляным раствором, затем сушили над безводным сульфатом магния, фильтровали и упаривали. Остаток очищали с помощью флэш-хроматографии на силикагеле, используя диэтиловый эфир/гексан (1:3) для элюирования, получали 170 мг [5-хлор-1-(4-метоксибензил)-3-метил-1Н-пиразол-4-ил]фенилметанона в виде смолы желтого цвета. Масс-спектр (ES) m/z 341 [М+Н]+.
(Д) Раствор, содержащий 170 мг [5-хлор-1-(4-метоксибензил)-3-метил-1Н-пиразол-4-ил]фенилметанона в 10 мл N,N-диметилформамида, обрабатывали 83 мг карбоната калия и 107 мг 3,5-дихлортиофенола. Смесь нагревали 4 часа при 100°С. Смесь обрабатывали еще 83 мг карбоната калия и 107 мг 3,5-дихлортиофенола. Смесь затем нагревали при 50°С в течение 64 часов. Смесь затем опять обрабатывали 83 мг карбоната калия и 107 мг 3,5-дихлортиофенола. Затем смесь нагревали 2 часа при 100°С. Растворитель удаляли в вакууме и остаток распределяли между дихлорметаном/ водой, промывали соляным раствором, затем сушили над безводным сульфатом магния, фильтровали и упаривали. Остаток очищали с помощью флэш-хроматографии на силикагеле, используя диэтиловый эфир/петролейный эфир (от 1:4 до 1:3), получали 140 мг [5-(3,5-дихлорфенилтио)-1-(4-метоксибензил)-3-метил-1Н-пиразол-4-ил]фенилметанона в виде бесцветного масла. Масс-спектр (ES) m/z 483 [М+Н]+.
(Е) Обрабатывали 140 мг [5-(3,5-дихлорфенилтио)-1-(4-метоксибензил)-3-метил-1Н-пиразол-4-ил]фенилметанона 4 мл трифторуксусной кислоты. Раствор затем кипятили с обратным холодильником 2 часа. Растворитель выпаривали в вакууме. Остаток затем распределяли между дихлорметаном/насыщенным раствором бикарбоната натрия, промывали соляным раствором, затем сушили над безводным сульфатом магния, фильтровали и упаривали, получали 75 мг [5-(3,5-дихлорфенилтио)-3-метил-1Н-пиразол-4-ил]фенилметанона в виде твердого вещества желтого цвета, которое использовали без дополнительной очистки. Масс-спектр (ES) m/z 363 [М+Н]+.
(Ж) Раствор, содержащий 75 мг [5-(3,5-дихлорфенилтио)-3-метил-1Н-пиразол-4-ил]фенилметанона в 2 мл безводного N,N-диметилформамида (ДМФА), обрабатывали при комнатной температуре в атмосфере азота 12 мг гидрида натрия. Смесь затем перемешивали 2 минуты. К смеси прибавляли 25 мкл 2-иодпропана. Смесь затем перемешивали 20 минут. К смеси прибавляли 2 мл воды и затем смесь экстрагировали три раза этилацетатом. Объединенные экстракты промывали соляным раствором, затем сушили над безводным сульфатом магния, фильтровали и упаривали. Остаток очищали с помощью флэш-хроматографии на силикагеле, используя для элюирования диэтиловый эфир/гексан (1:7), получали 32 мг [5-(3,5-дихлорфенилтио)-1-изопропил-3-метил-1Н-пиразол-4-ил]фенилметанона в виде бесцветного масла. Масс-спектр (ES) m/z 405 [М+Н]+.
(З) Раствор, содержащий 32 мг [5-(3,5-дихлорфенилтио)-1-изопропил-3-метил-1Н-пиразол-4-ил]фенилметанона в 2 мл метанола, обрабатывали 6 мг боргидрида натрия при комнатной температуре в атмосфере азота. Смесь затем перемешивали при комнатной температуре в течение ночи. К смеси прибавляли 2 мл воды и затем экстрагировали три раза диэтиловым эфиром. Объединенные экстракты промывали соляным раствором, затем сушили над безводным сульфатом магния, фильтровали и упаривали, получали 30 мг [5-(3,5-дихлорфенилтио)-1-изопропил-3-метил-1Н-пиразол-4-ил]фенилметанола в виде твердого вещества белого цвета, которое использовали без дополнительной очистки. Масс-спектр (ES) m/z 407 [М+Н]+.
Примеры 19-22
Соединения, приведенные в таблице 5, получали способом, аналогичным описанному в примере 18.
| Таблица 5 |
| При-мер |
Структура |
Название |
МС (ES) (М+Н)+ |
| 19 |
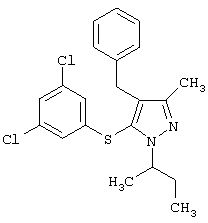 |
4-Бензил-1-втор-бутил-5-(3,5-дихлорфенилтио)-3-метил-1H-пиразол |
405 |
| 20 |
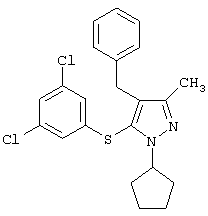 |
4-Бензил-1-циклопентил-5-(3,5-дихлорфенилтио)-3-метил-1Н-пиразол |
417 |
| 21 |
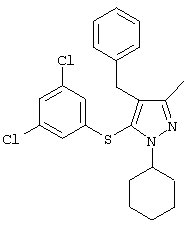 |
4-Бензил-1-циклогексил-5-(3,5-дихлорфенилтио)-3-метил-1Н-пиразол |
431 |
| 22 |
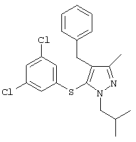 |
4-Бензил-5-(3,5-дихлорфенилтио)-1-изобутил-3-метил-1Н-пиразол |
405 |
Пример 23
4-Бензил-1-этил-5-(4-метоксифенокси)-3-метил-1Н-пиразол
Раствор, содержащий 54 мг [1-этил-5-(4-метоксифенокси)-3-метил-1Н-пиразол-4-ил]фенилметанола и 28 мкл триэтилсилана в 2 мл трифторуксусной кислоты, перемешивали 22 часа при комнатной температуре. Смесь концентрировали и прибавляли насыщенный раствор бикарбоната натрия (6 мл). Смесь экстрагировали три раза 8 мл дихлорметана. Объединенные экстракты сушили над сульфатом магния, фильтровали и упаривали. Остаток очищали с помощью флэш-хроматографии на силикагеле, используя для элюирования этилацетат/петролейный эфир (Ткип 40-60°С) (1:4), получали 33 мг 4-бензил-1-этил-5-(4-метоксифенокси)-3-метил-1Н-пиразола в виде масла желтого цвета. Масс-спектр (ES) m/z 323 [М+Н]+, 364 [М+Н+СН3CN]+. 1H-ЯМР (ДМСО-d6): 1,19 (t, 3Н), 2,20 (s, 3Н), 3,46 (s, 2H), 3,70 (s, 3Н), 3,80 (q, 2H), 6,82-6,89 (m, 4H), 7,01 (d, 2H), 7,12 (t, 1H), 7,20 (t, 2H).
Исходное вещество [1-этил-5-(4-метоксифенокси)-3-метил-1Н-пиразол-4-ил]фенилметанол получали следующим образом.
(А) Суспензию 3,9 г этилового эфира щавелевокислого гидразина и 3,6 мл триэтиламина в 80 мл толуола перемешивали при комнатной температуре 15 минут. Прибавляли 2,8 мл метилового эфира ацетоуксусной кислоты и смесь доводили до азеотропного состава в течение 1,5 часов. Смесь упаривали и остаток очищали с помощью флэш-хроматографии на силикагеле, используя для элюирования дихлорметан/метанол (97:3), получали 3,1 г 2-этил-5-метил-2Н-пиразол-3-ола в виде твердого вещества оранжевого цвета.
(Б) Суспензию 1,4 г 2-этил-5-метил-2Н-пиразол-3-ола, 1,6 г гидроокиси кальция и 1,3 мл хлористого бензоила в 70 мл 1,4-диоксана перемешивали при 110°С в течение 3,5 часов. Прибавляли 1 мл воды и смесь перемешивали при 110°С в течение 2 часов. Прибавляли 25 мл 2 н. соляной кислоты. Смесь перемешивали при комнатной температуре 16 часов и три раза экстрагировали 60 мл этилацетата. Объединенные экстракты сушили над сульфатом магния, фильтровали и упаривали, получали 3,1 г (1-этил-5-гидрокси-3-метил-1Н-пиразол-4-ил)фенилметанона в виде масла желтого цвета, которое использовали без дополнительной очистки. Масс-спектр (ES) m/z 231 [М+Н]+, 272 [M+H+CH3CN]+.
(В) Раствор 2,6 г (1-этил-5-гидрокси-3-метил-1Н-пиразол-4-ил)фенилметанона в 4 мл хлорокиси фосфора перемешивали при 80°С в течение 1,5 часов. Смесь выливали в 300 мл насыщенного раствора бикарбоната натрия и экстрагировали три раза 70 мл дихлорметана. Объединенные экстракты сушили над сульфатом магния, фильтровали и упаривали. Остаток очищали с помощью флэш-хроматографии на силикагеле, используя для элюирования этилацетат/петролейный эфир (Ткип 40-60°С) (1:4), получали 1,74 г (5-хлор-1-этил-3-метил-1Н-пиразол-4-ил)фенилметанона в виде жидкости бледно-желтого цвета. Масс-спектр (ES) m/z 249 [М+Н]+, 290 [M+H+CH3CN]+.
(Г) Смесь 129 мг (5-хлор-1-этил-3-метил-1Н-пиразол-4-ил)фенилметанона, 141 мг 4-метоксифенола и 33 мг гидрида натрия (60% в минеральном масле) в 3 мл безводного N,N-диметилформамида перемешивали в атмосфере азота при 110°С в течение 5 часов. Прибавляли воду (8 мл) и смесь экстрагировали три раза 10 мл дихлорметана. Объединенные экстракты сушили над сульфатом магния, фильтровали и упаривали. Остаток очищали с помощью флэш-хроматографии на силикагеле, используя для элюирования этилацетат/петролейный эфир (Ткип 40-60°С) (1:3), получали 100 мг [1-этил-5-(4-метоксифенокси)-3-метил-1Н-пиразол-4-ил]фенилметанона в виде масла желтого цвета. Масс-спектр (ES) m/z 337 [М]+, 378 [M+H+CH3CN]+.
(Д) Раствор 77 мг [1-этил-5-(4-метоксифенокси)-3-метил-1Н-пиразол-4-ил]фенилметанона и 119 мг боргидрида натрия в 5 мл метанола перемешивали при комнатной температуре 24 часа. Прибавляли 20 мл воды и смесь экстрагировали три раза 15 мл диэтилового эфира. Объединенные экстракты сушили над сульфатом магния, фильтровали и упаривали, получали 54 мг [1-этил-5-(4-метоксифенокси)-3-метил-1Н-пиразол-4-ил]фенилметанола в виде бесцветной смолы, которую использовали без дальнейшей очистки. Масс-спектр (ES) m/z 339 [М+Н]+. 380 [M+H+CH3CN]+.
Пример 24
4-Бензилоксиметил-5-(3,5-дихлорфенилтио)-3-метил-1-фенил-1Н-пиразол
Раствор, содержащий 115 мг [5-(3,5-дихлорфенилтио)-3-метил-1-фенил-1Н-пиразол-4-ил]метанола, 54 мг бромистого бензила и 38 мг гидрида натрия (60% в минеральном масле) в 3 мл безводного N,N-диметилформамида, перемешивали в атмосфере азота при 100°С в течение 2 часов. Прибавляли 10 мл воды и смесь экстрагировали три раза 8 мл дихлорметана. Объединенные экстракты сушили над сульфатом магния, фильтровали и упаривали. Остаток дважды очищали с помощью флэш-хроматографии на силикагеле, используя для элюирования этилацетат/петролейный эфир (Ткип 40-60°С) (1:4), а затем дихлорметан, получали 35 мг 4-бензилоксиметил-5-(3,5-дихлорфенилтио)-3-метил-1-фенил-lH-пиразола в виде бесцветной смолы. Масс-спектр (ES) m/z 455 [М+Н]+, 496 [M+H+CH3CN]+. 1Н-ЯМР (ДМСО-d6): 2,36 (s, 3Н), 4,47(s, 2H), 4,49 (s, 2H), 6,96 (d, 2H), 7,24-7,47 (m, 11H).
Исходное вещество [5-(3,5-дихлорфенилтио)-3-метил-1-фенил-1H-пиразол-4-ил]метанол получали следующим образом.
Смесь 1,35 г 5-(3,5-дихлорфенилтио)-3-метил-1-фенил-1Н-пиразол-4-карбоксальдегида и 0,84 г боргидрида натрия в 10 мл метанола перемешивали при комнатной температуре в течение 30 минут. Прибавляли воду (10 мл) и смесь экстрагировали четыре раза 15 мл диэтилового эфира. Объединенные экстракты сушили над сульфатом магния, фильтровали и упаривали, получали 670 мг [5-(3,5-дихлорфенилсульфанил)-3-метил-1-фенил-1Н-пиразол-4-ил]метанола в виде пасты серого цвета, которую использовали без дальнейшей очистки. Масс-спектр (ES) m/z 365 [М+Н]+, 406 [М+Н+СН3CN]+.
Пример 25
2-[5-(3,5-Дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметокси]пиридин
К раствору 75 мг [5-(3,5-дихлорфенил)-1-изопропил-3-метил-1Н-пиразол-4-ил]метанола в 8 мл тетрагидрофурана прибавляли 24 мг 3-гидроксипиридина, 71 мг трифенилфосфина и 43 мкл диэтилазодикарбоксилата. Реакционную смесь перемешивали при комнатной температуре 3 часа. Дополнительно прибавляли 24 мг 3-гидроксипиридина, 71 мг трифенилфосфина и 43 мкл диэтилазодикарбоксилата и реакционную смесь перемешивали в течение ночи при комнатной температуре. Растворитель выпаривали и остаток распределяли между дихлорметаном и водой. Водную фазу экстрагировали три раза 10 мл дихлорметана. Объединенные экстракты сушили над сульфатом магния, фильтровали и упаривали. Остаток очищали дважды с помощью флэш-хроматографии на силикагеле, используя для элюирования диэтиловый эфир/гексан (1:2, затем 2:1), получали 100 мг 2-[5-(3,5-дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметокси] пиридина в виде смолы желтого цвета. Масс-спектр (ES) m/z 408 [М+Н]+.
Исходное вещество [5-(3,5-дихлорфенил)-1-изопропил-3-метил-1Н-пиразол-4-ил]метанол получали следующим образом.
(А) Смесь 1,27 г 5-гидрокси-1-изопропил-3-метил-1H-пиразола, 3,4 мл хлорокиси фосфора и 5,2 мл диметилформамида нагревали при 100°С в атмосфере азота в течение 1 часа. Затем реакционной смеси давали охладиться до комнатной температуры и затем распределяли между 20 мл насыщенного раствора бикарбоната натрия и 20 мл дихлорметана. Водную фазу дважды экстрагировали 20 мл дихлорметана. Объединенные экстракты сушили над сульфатом магния, фильтровали и упаривали. Остаток желтого цвета очищали с помощью флэш-хроматографии на силикагеле, используя для элюирования этилацетат/диэтиловый эфир (1:5, затем 1:4), получали 213 мг (5-хлор-1-изопропил-3-метил-1Н-пиразол-4-ил)карбальдегида в виде твердого вещества белого цвета. Масс-спектр (ES) m/z 228 [M+H+MeCN]+.
(Б) К раствору 213 мг (5-хлор-1-изопропил-3-метил-1Н-пиразол-4-ил)карбальдегида в 3 мл N,N-диметилформамида прибавляли 245 мг 3,5-дихлортиофенола и 190 мг карбоната калия. Реакционную смесь нагревали 2 часа при 60°С, затем прибавляли еще 125 мг 3,5-дихлортиофенола и 95 мг карбоната калия. Смесь нагревали при 60°С еще 1 час, затем охлаждали до комнатной температуры в течение ночи. Растворитель выпаривали и остаток распределяли между 20 мл дихлорметана и 20 мл воды. Водную фазу дважды экстрагировали 10 мл дихлорметана и объединенные экстракты промывали соляным раствором, сушили, фильтровали и упаривали, получали масло желтого цвета, которое очищали с помощью флэш-хроматографии на силикагеле, используя для элюирования диэтиловый эфир/гексан (1:7, затем 1:5), получали 317 мг [5-(3,5-дихлорфенил)-1-изопропил-3-метил-1Н-пиразол-4-ил]карбальдегида в виде твердого вещества белого цвета. Масс-спектр (ES) m/z 329 [М+Н]+.
(В) К раствору 1,07 г [5-(3,5-дихлорфенил)-1-изопропил-3-метил-1Н-пиразол-4-ил]карбальдегида в 30 мл метанола при комнатной температуре прибавляли порциями 740 мг боргидрида натрия. Реакционную смесь перемешивали при комнатной температуре 5 часов, затем смешивали с 5 мл воды. Водную фазу экстрагировали три раза 10 мл этилацетата и объединенные экстракты промывали соляным раствором, сушили, фильтровали и упаривали, получали [5-(3,5-дихлорфенил)-1-изопропил-3-метил-1Н-пиразол-4-ил]метанол в виде бесцветного масла. Масс-спектр (ES) m/z 331 [М+Н]+.
Пример 26
1-[5-(3,5-Дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметил]-1Н-пиридин-2-он
К раствору 119 мг [5-(3,5-дихлорфенил)-1-изопропил-3-метил-1Н-пиразол-4-ил]метанола в 5 мл дихлорметана прибавляли 43 мг 2-гидроксипиридина, 113 мкл трибутилфосфина и 78 мг TMAD. Реакционную смесь перемешивали при комнатной температуре в течение 2 часов, затем растворитель выпаривали. Остаток очищали с помощью флэш-хроматографии на силикагеле, используя для элюирования диэтиловый эфир/бензин (1:5 до 3:1), получали 317 мг 1-[5-(3,5-дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметил]-1Н-пиридин-2-она в виде бесцветной смолы. Масс-спектр (ES) m/z 329 [М+Н]+.
Пример 27
4-[5-(3,5-Дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметоксиметил]пиридин
К раствору 100 мг [5-(3,5-дихлорфенил)-1-изопропил-3-метил-1H-пиразол-4-ил]метанола в 3 мл N,N-диметилформамида прибавляли 24 мг гидрида натрия (60%-ная дисперсия в масле). Смесь перемешивали 5 минут, затем прибавляли 96 мг гидробромида 4-бромметилпиридина. Реакционную смесь перемешивали при комнатной температуре 1 час, затем смешивали с 5 мл воды. Водную фазу экстрагировали три раза 10 мл дихлорметана и объединенные экстракты промывали соляным раствором, сушили, фильтровали и упаривали, получали масло красного цвета, которое очищали с помощью флэш-хроматографии на силикагеле, используя для элюирования этилацетат/гексан (1:2, затем 1:1), получали 62 мг 4-[5-(3,5-дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметоксиметил]пиридина в виде бесцветной смолы. Масс-спектр (ES) m/z 422 [М+Н]+, 463 [M+H+MeCN]+.
Пример 28
4-[[5-(3,5-Дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-ил]гидроксиметил]пиридин
Обрабатывали 593 мг гидробромида 4-бромпиридина 15 мл 5%-ного водного раствора бикарбоната натрия и экстрагировали три раза 20 мл диэтилового эфира, объединенные экстракты промывали соляным раствором, сушили, фильтровали и упаривали, получали бесцветное масло, которое растворяли в 3 мл тетрагидрофурана. К этому раствору в атмосфере азота при комнатной температуре прибавляли 1,52 мл 3,0 М раствора изопропилмагнийхлорида в диэтиловом эфире. Реакционную смесь перемешивали при комнатной температуре 1,5 часа, затем прибавляли раствор 1,0 г [5-(3,5-дихлорфенил)-1-изопропил-3-метил-1Н-пиразол-4-ил]карбальдегида в 10 мл тетрагидрофурана. Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем прибавляли 20 мл воды. Водную фазу экстрагировали три раза 10 мл дихлорметана и объединенные экстракты промывали соляным раствором, сушили, фильтровали и упаривали, получали масло желтого цвета, которое очищали с помощью флэш-хроматографии на силикагеле, используя для элюирования этилацетат/гексан (1:2, затем 2:1), получали 835 мг 4-[[5-(3,5-дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-ил]гидроксиметил]пиридина в виде бесцветной смолы. Масс-спектр (ES) m/z 408 [M+H]+, 449 [M+H+MeCN]+.
Пример 29
4-[5-(3,5-Дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметил]пиридин
Раствор 466 мг тетраиодида фосфора в 15 мл бензола нагревали при 80°С в течение 15 минут. К этому раствору прибавляли по каплям раствор 400 мг 4-[[5-(3,5-дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-ил]гидроксиметил]пиридина в 10 мл бензола. Смесь затем нагревали 1 час при 80°С, затем оставляли смесь охлаждаться до комнатной температуры. Затем прибавляли 8 мл 10%-ного водного раствора бисульфита натрия и двухфазную смесь перемешивали 1 час. Водную фазу экстрагировали три раза 30 мл этилацетата и объединенные экстракты промывали соляным раствором, сушили, фильтровали и упаривали, получали остаток желтого цвета, который очищали с помощью флэш-хроматографии на силикагеле, используя для элюирования этилацетат/гексан (1:1, затем 2:1), получали 238 мг 4-[5-(3,5-дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметил] пиридина в виде твердого вещества белого цвета. Масс-спектр (ES) m/z 392 [М+Н]+, 433 [M+H+MeCN]+.
Пример 30
4-[[5-(3,5-Дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-ил]фторметил]пиридин
К раствору 200 мг 4-[[5-(3,5-дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-ил]гидроксиметил]пиридина в 5 мл дихлорметана с температурой -78°С прибавляли 68 мкл трехфтористой диэтиламиносеры. Реакционную смесь перемешивали 1 час при -78°С, затем прибавляли насыщенный водный раствор бикарбоната натрия. Водную фазу экстрагировали три раза 10 мл дихлорметана и объединенные экстракты промывали соляным раствором, сушили, фильтровали и упаривали, получали смолу синего цвета, которую очищали с помощью флэш-хроматографии на силикагеле, используя для элюирования диэтиловый эфир/гексан (1:2, затем 1:1), получали 118 мг 4-[[5-(3,5-дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-ил]фторметил]пиридина в виде бесцветного масла. Масс-спектр (ES) m/z 410 [М+Н]+, 451 [M+H+MeCN]+.
Пример 31
4-[5-(3,5-Дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметил]-3-фторпиридин
Раствор 278 мг тетраиодида фосфора в 10 мл толуола нагревали при 80°С в течение 20 минут. К этому раствору прибавляли по каплям раствор 259 мг 4-[[5-(3,5-дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-ил]гидроксиметил]-3-фторпиридина в 5 мл бензола. Смесь затем нагревали при 80°С в течение 20 минут, затем смесь оставляли охлаждаться до комнатной температуры. Затем прибавляли 10 мл 10%-ного водного раствора бисульфита натрия и двухфазную смесь перемешивали 1 час. Водную фазу экстрагировали три раза 20 мл этилацетата и объединенные экстракты промывали соляным раствором, сушили, фильтровали и упаривали, получали масло желтого цвета, которое очищали с помощью флэш-хроматографии на силикагеле, используя для элюирования диэтиловый эфир/гексан (1:1, затем 2:1), получали 35 мг 4-[5-(3,5-дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметил]-3-фторпиридина в виде твердого вещества бледно-желтого цвета. Масс-спектр (ES) m/z 410 [М+Н]+, 451 [M+H+MeCN]+.
Исходное вещество 4-[5-(3,5-дихлорфенилсульфанил)-1-изопропил-3-гидроксиметил-1Н-пиразол-4-илметил]-3-фторпиридин получали следующим образом.
К раствору 65 мкл 3-фторпиридина в 2,5 мл безводного тетрагидрофурана с температурой -78°С прибавляли 381 мкл 2 М раствора диизопропиламида лития в гептане/тетрагидрофуране/этилбензоле. Смесь перемешивали при -78°С в течение 1 часа, затем обрабатывали по каплям раствором 250 мг [5-(3,5-дихлорфенил)-1-изопропил-3-метил-1Н-пиразол-4-ил]карбальдегида в 2 мл безводного тетрагидрофурана. Реакционную смесь перемешивали 30 минут, затем ей давали нагреться до комнатной температуры, после чего реакцию прекращали прибавлением воды. Водную фазу экстрагировали три раза 20 мл диэтилового эфира и объединенные экстракты промывали соляным раствором, сушили, фильтровали и упаривали, получали масло желтого цвета, которое очищали с помощью флэш-хроматографии на силикагеле, используя для элюирования этилацетат/гексан (1:3, затем 1:1), получали 259 мг 4-[5-(3,5-дихлорфенилсульфанил)-1-изопропил-3-гидроксиметил-1Н-пиразол-4-илметил]-3-фторпиридина в виде бесцветного масла. Масс-спектр (ES) m/z 426 [M+H]+, 467 [M+H+MeCN]+.
Пример 32
[5-(3,5-Дихлорфенилсульфанил)-1-этил-3-метил-1Н-пиразол-4-илметил]пиридин-3-иламин
Смесь 227 мг 4-бромметил-5-(3,5-дихлорфенилсульфанил)-1-этил-3-метил-1H-пиразола, 62 мг 3-аминопиридина и 36 мг гидрида натрия (60% в минеральном масле) в 3 мл безводного N,N-диметилформамида перемешивали в атмосфере азота при 110°С в течение 15 минут. Прибавляли воду (10 мл) и смесь экстрагировали три раза 8 мл дихлорметана. Объединенные экстракты сушили над сульфатом магния, фильтровали и упаривали. Остаток очищали с помощью флэш-хроматографии на силикагеле, используя для элюирования дихлорметан/метанол, получали 17 мг [5-(3,5-дихлорфенилсульфанил)-1-этил-3-метил-1Н-пиразол-4-илметил]пиридин-3-иламина в виде смолы коричневого цвета. 1H-ЯМР (ДМСО-d6): 1,19 (t, 3Н), 2,27 (s, 3Н), 4,05-4,11 (m, 4H), 6,03 (t, 1H), 6,87 (d, 1H), 6,99 (m, 1H), 7,04 (d, 2H), 7,44 (t, 1H), 7,72 (dd, 1H), 7,94 (d, 1H).
Исходное вещество – 4-бромметил-5-(3,5-дихлорфенилсульфанил)-1-этил-3-метил-1H-пиразол – получали следующим образом.
(А) Суспензию 23 г этилового эфира щавелевокислого гидразина и 22 мл триэтиламина в 500 мл толуола перемешивали при комнатной температуре 15 минут. Прибавляли 17 мл метилового эфира ацетоуксусной кислоты и смесь доводили до азеотропного состава в течение 1,5 часов. Смесь упаривали и остаток очищали с помощью флэш-хроматографии на силикагеле, используя для элюирования дихлорметан/метанол (97:3), получали 19 г 2-этил-5-метил-2Н-пиразол-3-ола в виде твердого вещества оранжевого цвета.
(Б) К 28,7 мл безводного N,N-диметилформамида при 0°С медленно прибавляли 80,7 мл хлорокиси фосфора, затем 15,6 г 2-этил-5-метил-2Н-пиразол-3-ола. Смесь перемешивали в атмосфере азота при 80°С в течение 1 часа, выливали в 700 мл воды при 0°С, затем экстрагировали шесть раз 350 мл диэтилового эфира. Объединенные экстракты сушили над сульфатом магния, фильтровали и упаривали, получали 9,3 г 5-хлор-1-этил-3-метил-1Н-пиразол-4-карбальдегида в виде жидкости оранжевого цвета, который использовали без дополнительной очистки.
(В) Смесь 9,2 г 5-хлор-1-этил-3-метил-1Н-пиразол-4-карбальдегида, 14,3 г 3,5-дихлортиофенола и 11,8 г карбоната калия в 40 мл безводного N,N-диметилформамида перемешивали в атмосфере азота при 100°С в течение 18 часов. Прибавляли воду (200 мл) и смесь экстрагировали три раза 100 мл дихлорметана. Объединенные экстракты сушили над сульфатом магния, фильтровали и упаривали. Остаток очищали с помощью флэш-хроматографии на силикагеле, используя для элюирования дихлорметан/ петролейный эфир (Ткип 40-60°С), получали 12, 2 г 5-(3,5-дихлорфенилсульфанил)-1-этил-3-метил-1Н-пиразол-4-карбальдегида в виде твердого вещества оранжевого цвета. Масс-спектр (ES) m/z 356 [M+CH3CN+H]+.
(Г) Смесь 1,1 г 5-(3,5-дихлорфенилсульфанил)-1-этил-3-метил-1Н-пиразол-4-карбальдегида и 0,53 г боргидрида натрия в 25 мл безводного метанола перемешивали в атмосфере азота при комнатной температуре 15 минут. Прибавляли воду (25 мл) и смесь экстрагировали три раза 20 мл диэтилового эфира. Объединенные экстракты сушили над сульфатом магния, фильтровали и упаривали. Остаток очищали с помощью флэш-хроматографии на силикагеле, используя для элюирования этилацетат/петролейный эфир (Ткип 40-60°С) (1:3), получали 902 мг [5-(3,5-дихлорфенилсульфанил)-1-этил-3-метил-1Н-пиразол-4-ил]метанола в виде масла желтого цвета. Масс-спектр (ES) m/z 317 [М+Н]+.
(Д) Смесь 460 мг [5-(3,5-дихлорфенилсульфанил)-1-этил-3-метил-1Н-пиразол-4-ил]метанола, 481 мг четырехбромистого углерода и 380 мг трифенилфосфина в 20 мл дихлорметана перемешивали при комнатной температуре 24 часа. Растворитель выпаривали. Остаток очищали с помощью флэш-хроматографии на силикагеле, используя для элюирования этилацетат/петролейный эфир (Ткип 40-60°С) (1:4), получали 392 мг 4-бромэтил-5-(3,5-дихлорфенилсульфанил)-1-этил-3-метил-1Н-пиразола в виде масла бледно-желтого цвета. Масс-спектр (ES) m/z 317 [М-Br+Н2О]+.
Соединения, приведенные в таблице 6, были получены способом, аналогичным описанному выше.
| Таблица 6 |
| При-мер |
Структура |
Название |
МС ES (М+Н)+ |
| |
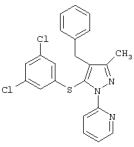 |
2-[4-Бензил-5-(3,5-дихлорфенилсульфанил)-3-метилпиразол-1-ил]пиридин |
427 |
| |
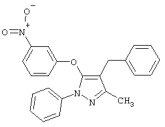 |
4-Бензил-3-метил-5-(3-нитрофенокси)-1-фенил-1Н-пиразол |
386 |
| |
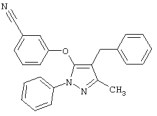 |
3-(4-Бензил-5-метил-2-фенил-2Н-пиразол-3-илокси)бензонитрил |
366 |
| |
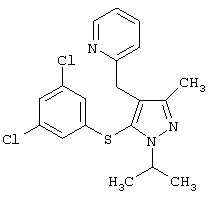 |
2-[5-(3,5-Дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметил]пиридин |
393 |
| |
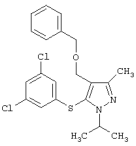 |
4-Бензилоксиметил-5-(3,5-дихлорфенилсульфанил)-1-изопропил-3-метил-1H-пиразол |
422 |
| |
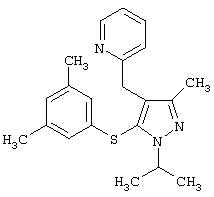 |
2-[5-(3,5-Диметилфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметил]пиридин |
352 |
| |
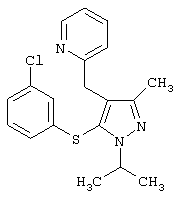 |
2-[5-(3-Хлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметил]пиридин |
359 |
| 25 |
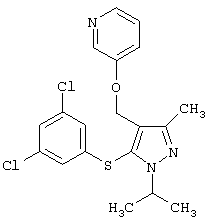 |
2-[5-(3,5-Дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметокси]пиридин |
409 |
| |
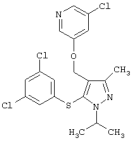 |
3-Хлор-5-[5-(3,5-дихлорфенилсульфанил)-1-изопропил-3-метил-1H-пиразол-4-илметокси]пиридин |
443 |
| 26 |
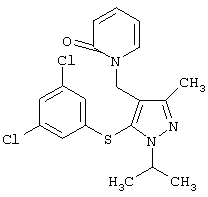 |
1-[5-(3,5-Дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметил]-1Н-пиридин-2-он |
409 |
| |
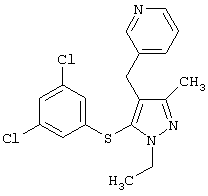 |
3-[5-(3,5-Дихлорфенилсульфанил)-1-этил-3-метил-1Н-пиразол-4-илметил]пиридин |
379 |
| |
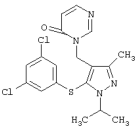 |
3-[5-(3,5-Дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметил]-3Н-пиримидин-4-он |
379 |
| 27 |
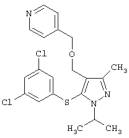 |
4-[5-(3,5-Дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметоксиметил]пиридин |
423 |
| |
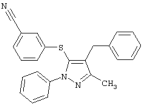 |
3-(4-Бензил-5-метил-2-фенил-2Н-пиразол-3-илсульфанил)бензонитрил |
382 |
| |
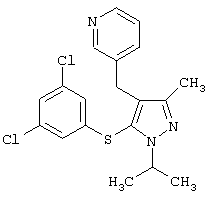 |
3-[5-(3,5-Дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметил]пиридин |
393 |
| |
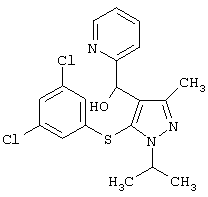 |
[5-(3,5-Дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-ил]пиридин-2-илметанол |
409 |
| |
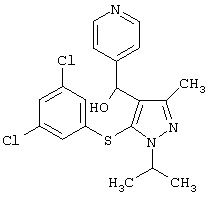 |
[5-(3,5-Дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-ил]пиридин-4-илметанол |
|
| 29 |
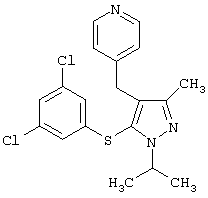 |
4-[5-(3,5-Дихлорфенилсульфанил)-1-изопропил-3-метил-1H-пиразол-4-илметил]пиридин |
392 |
| |
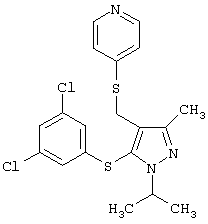 |
4-[5-(3,5-Дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметилсульфанил]пиридин |
|
| |
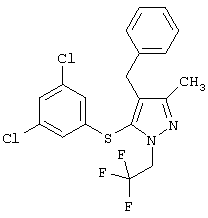 |
4-Бензил-5-(3,5-дихлорфенилсульфанил)-3-метил-1-(2,2,2-трифторэтил)-1Н-пиразол |
|
| 30 |
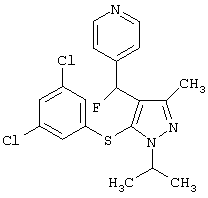 |
4-{[5-(3,5-Дихлорфенилсульфанил)-1-изопропил-3-метил-1H-пиразол-4-ил]фторметил}пиридин |
410 |
| |
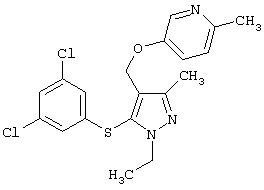 |
5-[5-(3,5-Дихлорфенилсульфанил)-1-этил-3-метил-1Н-пиразол-4-илметокси]-2-метилпиридин |
|
| |
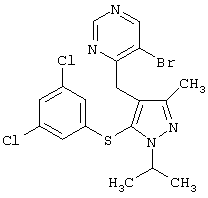 |
5-Бром-4-[5-(3,5-дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметил]пиримидин |
|
| |
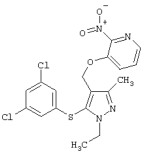 |
3-[5-(3,5-Дихлорфенилсульфанил)-1-этил-3-метил-1Н-пиразол-4-илметокси]-2-нитропиридин |
|
| |
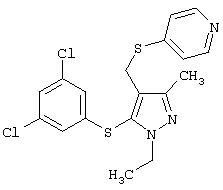 |
4-[5-(3,5-Дихлорфенилсульфанил)-1-этил-3-метил-1Н-пиразол-4-илметилсульфанил]пиридин |
411 |
| |
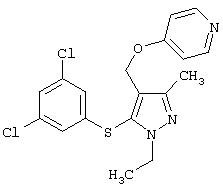 |
4-[5-(3,5-Дихлорфенилсульфанил)-1-этил-3-метил-1Н-пиразол-4-илметокси]пиридин |
395 |
| |
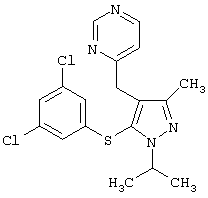 |
4-[5-(3,5-Дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметил]пиримидин |
394 |
| |
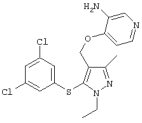 |
3-[5-(3,5-Дихлорфенилсульфанил)-1-этил-3-метил-1Н-пиразол-4-илметокси]пиридин-2-иламин |
410 |
| |
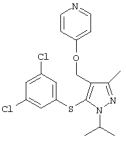 |
4-[5-(3,5-Дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметокси]пиридин |
409 |
| 31 |
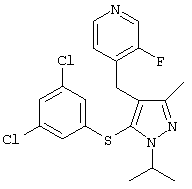 |
4-[5-(3,5-Дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметил]-3-фторпиридин |
411 |
| |
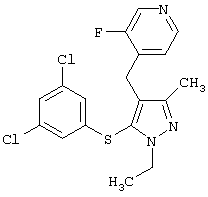 |
4-[5-(3,5-Дихлорфенилсульфанил)-1-этил-3-метил-1Н-пиразол-4-илметил]-3-фторпиридин |
397 |
| |
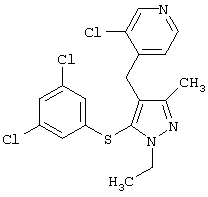 |
3-Хлор-4-[5-(3,5-дихлорфенилсульфанил)-1-этил-3-метил-1Н-пиразол-4-илметил]пиридин |
413 |
| |
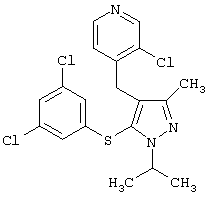 |
3-Хлор-4-[5-(3,5-дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметил]пиридин |
427 |
| |
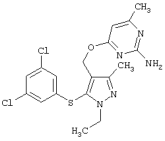 |
4-[5-(3,5-Дихлорфенилсульфанил)-1-этил-3-метил-1Н-пиразол-4-илметокси]-6-метилпиримидин-2-иламин |
425 |
| |
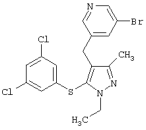 |
3-Бром-5-[5-(3,5-дихлорфенилсульфанил)-1-этил-3-метил-1Н-пиразол-4-илметил]пиридин |
458 |
| 32 |
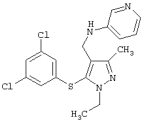 |
[5-(3,5-Дихлорфенилсульфанил)-1-этил-3-метил-1Н-пиразол-4-илметил]пиридин-3-иламин |
394 |
| |
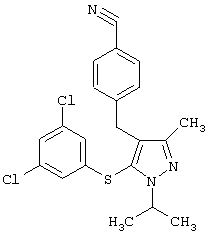 |
4-[5-(3,5-Дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметил]бензонитрил |
417 |
| |
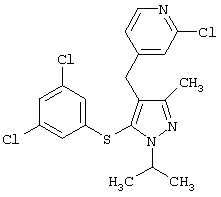 |
2-Хлор-4-[5-(3,5-дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметил]пиридин |
427 |
| |
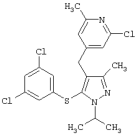 |
2-Хлор-4-[5-(3,5-дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметил]-6-метилпиридин |
441 |
| |
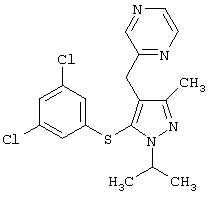 |
2-[5-(3,5-Дихлорфенилсульфанил)-1-изопропил-3-метил-1H-пиразол-4-илметил]пиразин |
394 |
| |
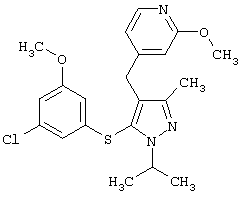 |
4-[5-(3-Хлор-5-метоксифенилсульфанил)-1-изопропил-3-метил-1H-пиразол-4-илметил]-2-метоксипиридин |
419 |
| |
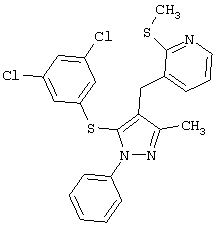 |
3-[[5-(3,5-Дихлорфенилтио)-3-метил-1-фенил-1H-пиразол-4-ил]метил]-2-(метилтио)пиридин |
473 |
| |
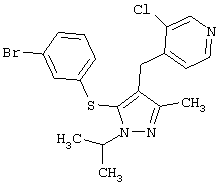 |
4-[5-(3-Бромфенилсульфанил)-1-изопропил-3-метил-1H-пиразол-4-илметил]-3-хлорпиридин |
437 |
| |
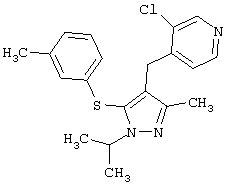 |
3-Хлор-4-(1-изопропил-3-метил-5-м-толилсульфанил-1Н-пиразол-4-илметил)пиридин |
373 |
| |
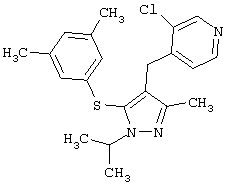 |
3-Хлор-4-[5-(3,5-диметилфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметил]пиридин |
387 |
| |
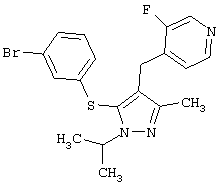 |
4-[5-(3-Бромфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметил]-3-фторпиридин |
421 |
| |
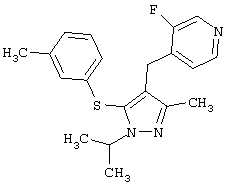 |
3-Фтор-4-(1-изопропил-3-метил-5-м-толилсульфанил-1H-пиразол-4-илметил)пиридин |
356 |
| |
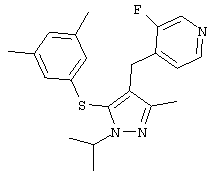 |
4-[5-(3,5-Диметилфенилсульфанил)-1-изопропил-3-метил-1H-пиразол-4-илметил]-3-фторпиридин |
370 |
| |
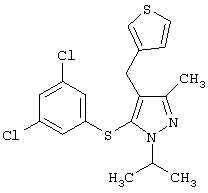 |
5-(3,5-Дихлорфенилсульфанил)-1-изопропил-3-метил-4-тиофен-3-илметил-1Н-пиразол |
398 |
| |
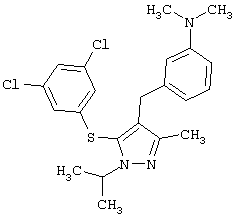 |
{3-[5-(3,5-Дихлорфенилсульфанил)-1-изопропил-3-метил-1H-пиразол-4-илметил]фенил}диметиламин |
435 |
| |
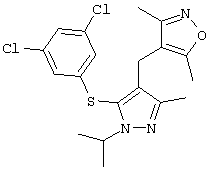 |
4-[5-(3,5-Дихлорфенилсульфанил)-1-изопропил-3-метил-1H-пиразол-4-илметил]-3,5-диметилизоксазол |
411 |
| |
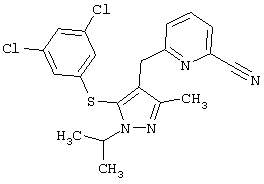 |
6-[5-(3,5-Дихлорфенилсульфанил)-1-изопропил-3-метил-1Н-пиразол-4-илметил]пиридин-2-карбонитрил |
418 |
Формула изобретения
1. Соединения формулы I-A
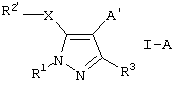
где R1 означает (С1-С12)алкил, который необязательно может быть замещен 1-3 заместителями, выбранными из фтора, хлора и брома, (С3-С8)циклоалкил, фенил, пиридил, или (С1-С4)алкил, замещенный фенилом;
R2 означает необязательно замещенный фенил, где фенил может быть замещен 1-2 заместителями, выбранными из (С1-С4)алкила, (С1-С4)алкоксила, гидроксила, фтора, хлора, брома, циангруппы и нитрогруппы;
R3 означает (С1-С12)алкил или (С1-С4)алкокси(С1-С4)алкил;
А’ означает (С1-С4)алкил, замещенный необязательно замещенным фенилом или необязательно замещенньм 4-пиридилом, где фенил или 4-пиридил могут быть замещены 1-2 заместителями, выбранными из (С1-С4)алкила, (С1-С4)алкоксила, гидроксила, фтора, хлора, брома, циангруппы и NRR’, где R и R’ независимо друг от друга означают водород или (С1-С4)алкил; или
А’ означает группу формулы CH2-U-гетероциклил, где U представляет О, S или NR”, где R” означает водород или (С1-С4)алкил и где гетероциклил означает пиридил или пиримидинил, который необязательно замещен 1-2 заместителями, выбранными из (С1-С4)алкила, фтора, хлора, брома, циангруппы, нитрогруппы и NRR’, где R и R’ независимо друг от друга означают водород или (С1-С4)алкил; или
А’ означает группу формулы СН(ОН)фенил; или
А’ означает группу CH=CHW, где W означает фенил;
Х означает S или О;
и их фармацевтически приемлемые соли.
2. Соединения формулы I-A по п.1, где R1 означает необязательно замещенный (С1-С12)алкил, (С3-С8)циклоалкил, фенил, пиридил или (С1-С4)алкил, замещенный фенилом, где (С1-С12)алкил может быть замещен 1-3 атомами фтора; R2 означает фенил, замещенный 1-2 заместителями, выбранными из (С1-С4)алкила, (С1-С4)алкоксила, фтора, хлора, брома, циангруппы и нитрогруппы; R3 означает (С1-С12)алкил или (С1-С4)алкокси-(С1-С4)алкил; А’ означает (С1-С4)алкил, замещенный необязательно замещенным фенилом или необязательно замещенным 4-пиридилом, где фенил или 4-пиридил могут быть замещены 1-2 заместителями, выбранными из (С1-С4)алкила, (С1-С4)алкоксила, гидроксила, фтора, хлора, брома, циангруппы и NRR’, где R и R’ означают независимо друг от друга водород или (С1-С4)алкил; или А’ означает группу формулы СН2-U-гетероциклил, где U представляет О, S или NR”, где R” означает водород или (С1-С4)алкил, и где гетероциклил обозначает пиридил или пиримидил, необязательно замещенный 1-2 заместителями, выбранными из (С1-С4)алкила, фтора, хлора, брома, циангруппы, нитрогруппы и NRR’, где R и R’ означают независимо друг от друга водород или (С1-С4)алкил; или А’ означает группу формулы СН(ОН)фенил; или А’ означает группу формулы CH=CHW, где W означает необязательно замещенный фенил; Х означает S или О.
3. Соединения формулы I-A по п.1 или 2, где R1 означает (С1-С7)алкил, который необязательно может быть замещен 1-3 атомами фтора, (С3-С8)циклоалкил, фенил, пиридил или (С1-С4)алкил, замещенный фенилом;
R2 означает фенил, замещенный 1-2 заместителями, выбранными из (С1-С4)алкила,
(С1-С4)алкоксила, фтора, хлора, брома, циангруппы и нитрогруппы;
R3 означает (С1-С7)алкил или (С1-С4)алкокси-(С1-С4)алкил;
А’ означает метил, замещенный необязательно замещенным фенилом или необязательно замещенным 4-пиридилом,
где фенил или 4-пиридил могут быть замещены 1-2 заместителями, выбранными из
(С1-С4)алкила, (С1-С4)алкоксила, гидроксила, фтора, хлора, брома, циангруппы и
NRR’, где R и R’ независимо друг от друга означают водород или (С1-С4)алкил; или А’ означает группу формулы СН2-U-гетероциклил, где U означает О, S или NR”, где R” означает водород или (С1-С4)алкил, и где гетероциклил обозначает пиридил или пиримидил, который необязательно замещен 1-2 заместителями, выбранными из (С1-С4)алкила, фтора, хлора, брома, циангруппы, нитрогруппы и NRR’, где R и R’ независимо друг от друга означают водород или (С1-С4)алкил;
Х означает S или О.
4. Соединения формулы I-A по любому из пп.1-3, где
R1 означает необязательно замещенный (С1-С7)алкил, (С3-С8)пиклоалкил, фенил, пиридил или бензил,
где (С1-С7)алкил может быть замещен 1-3 атомами фтора;
R2 означает фенил, замещенный 1-2 заместителями, которые могут быть выбраны из (С1-С2)алкила, фтора, хлора и циангруппы;
R3 означает (С1-С7)алкил или (С1-С2)алкокси-(С1-С2)алкил;
А’ означает метил, замещенный необязательно замещенным фенилом или
необязательно замещенным 4-пиридилом, где фенил или 4-пиридил может быть замещен 1-2 заместителями, выбранными из
(С1-С2)алкила, (С1-С2)алкоксила, гидроксила, фтора, хлора, брома, циангруппы, и
NRR’, где R и R’ независимо друг от друга означают водород или (С1-С2)алкил;
Х означает S или О.
5. Соединение формулы I-A по любому из пп.1-4, где
R1 означает (С1-С7)алкил;
R2 означает фенил, замещенный 1-2 заместителями, выбранными из хлора и циангруппы;
R3 означает (С1-С7)алкил;
А’ означает метил, замещенный необязательно замещенным 4-пиридилом, где 4-пиридил замещен 1-2 заместителями, выбранными из (С1-С2)-алкила,
(С1-С2)алкоксила, гидроксила, фтора, хлора, брома, циангруппы и NRR’,
где R и R’ независимо друг от друга означают водород или (С1-С2)алкил;
Х означает S или О.
6. Соединения формулы I-A по любому из пп.1-5, где
R1 означает (С1-С4)алкил;
R означает фенил, замещенный 1-2 атомами хлора;
R3 означает (С1-С4)алкил;
А’ означает метил, замещенный необязательно замещенным 4-пиридилом, где 4-пиридил замещен 1-2 заместителями, и заместители выбираются из (С1-С2)-алкила и хлора;
Х означает S или О.
7. Соединения формулы I-A по п.1, где
А’ означает (С1-С4)алкил, замещенный необязательно замещенным фенилом,
где фенил может быть замещен 1-2 заместителями, выбранными из (С1-С4)алкила, (С1-С4)алкоксила, гидроксила, фтора, хлора, брома, циангруппы, и NRR’, где R и R’ независимо друг от друга означают водород или (С1-С4)алкил; или
А’ означает группу формулы СН2-U-гетероциклил,
где U означает О, S или NR”, где R” означает водород или (С1-С4)алкил, и
где гетероциклил обозначает пиридил или пиримидил, который необязательно замещен 1-2 заместителями, выбранными из (С1-С4)алкила, фтора, хлора, брома, циангруппы, нитрогруппы и NRR’, где R и R’ независимо друг от друга означают водород или (С1-С4)алкил; или
А’ означает группу формулы СН(ОН)фенил; или
А’ означает группу формулы CH=CHW,
где W означает фенил;
Х означает S или О;
и их фармацевтически приемлемые соли.
8. Соединения формулы I-A по п.1
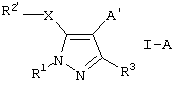
где R1 означает (С1-С12)алкил, (С3-С8)циклоалкил, фенил или (С1-С4)алкил, замещенный фенилом;
R2 означает необязательно замещенный фенил, где фенил может быть замещен 1-2 заместителями, выбранными из (С1-С4)-алкила, (С1-С4)алкоксила, гидроксила, фтора, хлора или брома;
R3 означает (С1-С12)алкил или (С1-С4)алкокси-(С1-С4)алкил;
А’ означает (С1-С4)алкил, замещенный необязательно замещенным фенилом или необязательно замещенньм 4-пиридилом, где фенил или 4-пиридил может быть замещен 1-2 заместителями, выбранными из (С1-С4)алкила, (С1-С4)алкоксила, гидроксила, фтора, хлора или брома; или
А’ означает группу формулы СН(ОН)фенил;
или
А’ означает группу формулы CH=CHW, где W представляет фенил;
Х означает S или О;
и их фармацевтически приемлемые соли.
9. Соединения формулы I-A по любому из пп.1-8, где Х означает S.
10. Соединение по любому из пп.1-9 для применения при лечении заболевания, опосредованного вирусом иммунодефицита человека (ВИЧ).
11. Фармацевтическая композиция для применения при лечении заболеваний, опосредованных вирусом иммунодефицита человека (ВИЧ), включающая фармацевтически эффективное количество соединения или его фармацевтически приемлемой соли по любому из пп.1-9 и, если желательно, фармацевтически инертный носитель.
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 05.10.2009
Извещение опубликовано: 20.09.2010 БИ: 26/2010
|
|