|
|
(21), (22) Заявка: 2004113570/13, 30.04.2004
(24) Дата начала отсчета срока действия патента:
30.04.2004
(43) Дата публикации заявки: 10.10.2005
(45) Опубликовано: 20.02.2006
(56) Список документов, цитированных в отчете о
поиске:
RU 2175015 C1, 20.10.2001. RU 2182708 С2, 20.05.2002. RU 2218414 С2, 10.12.2003. WO 93/06241 A1, 01.04.1993. WO 96/00298 A1, 04.01.1996. US 6642000 В1, 04.11.2003. US 6706479 В2, 16.03.2004. RU 2206575 С2, 20.06.2003.
Адрес для переписки:
103735, Москва, ул. Ильинка, 5/2, ООО “Союзпатент”, пат.пов. А.П.Агурееву
|
(72) Автор(ы):
Мирзабеков Андрей Дарьевич (умер),
Грядунов Дмитрий Александрович (RU),
Михайлович Владимир Михайлович (RU),
Заседателев Александр Сергеевич (RU),
Романов Георгий Александрович (RU),
Кузнецов Владимир Васильевич (RU),
Цыдендамбаев Владимир Дылыкович (RU),
Митрохин Игорь Анатольевич (RU),
Крылова Елена Михайловна (RU)
(73) Патентообладатель(и):
ИНСТИТУТ МОЛЕКУЛЯРНОЙ БИОЛОГИИ им. В.А. ЭНГЕЛЬГАРДТА РОССИЙСКОЙ АКАДЕМИИ НАУК (RU),
ИНСТИТУТ ФИЗИОЛОГИИ РАСТЕНИЙ им. К.А. ТИМИРЯЗЕВА РОССИЙСКОЙ АКАДЕМИИ НАУК (RU)
|
(54) СПОСОБ ИДЕНТИФИКАЦИИ ТРАНСГЕННЫХ ПОСЛЕДОВАТЕЛЬНОСТЕЙ ДНК В РАСТИТЕЛЬНОМ МАТЕРИАЛЕ И ПРОДУКТАХ НА ЕГО ОСНОВЕ, НАБОР ОЛИГОНУКЛЕОТИДОВ И БИОЧИП ДЛЯ ОСУЩЕСТВЛЕНИЯ ЭТОГО СПОСОБА
(57) Реферат:
Изобретение относится к молекулярной биологии и генной инженерии и предназначено для выявления типичных маркерных чужеродных последовательностей ДНК, используемых при модификации растений, в трансгенном растительном материале и продуктах на его основе. Идентификация маркерных последовательностей ДНК в растительном материале и получаемых из него продуктах включает проведение мультиплексной полимеразной цепной реакции на основе выделенной из анализируемого материала ДНК и последующую гибридизацию флуоресцентно меченых продуктов этой реакции на специализированных биочипах. Регистрацию результатов гибридизации осуществляют с помощью аппаратно-программного комплекса «Чипдетектор-03», что дает возможность идентифицировать в тестируемом материале наличие конкретных чужеродных генов и их регуляторных зон и количественно интерпретировать получаемые результаты. Метод пригоден для массового скрининга растительного сырья и получаемых из него продуктов. 3 н. и 2 з.п. ф-лы, 5 ил., 2 табл. 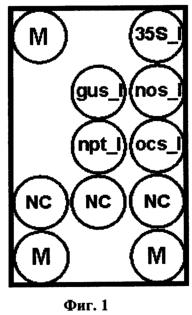
Область техники
Изобретение относится к области генной инженерии растений, молекулярной биологии, биобезопасности, фитобиотехнологии и защите окружающей среды, в частности к способам выявления и идентификации типичных инсерций ДНК, используемых при генетической трансформации растений, в генетически модифицированном растительном материале и продуктах на его основе. Изобретение включает специфический набор олигонуклеотидных зондов, структуру биочипа, методику подготовки образца растительной ДНК к процедуре гибридизации на биочипе, способы регистрации и интерпретации результатов.
Уровень техники
Для обнаружения трансгенных компонентов растительного происхождения известен способ использования антител для идентификации чужеродных белков (Stave J.W. Food Control, 1999, vol.10, pp.367-374).
Этим способом можно выявлять присутствие чужеродных белков лишь заведомо известной природы, причем на каждый возможный трансгенный белок нужно наработать свой тип антител. Белки сами по себе, как правило, нестабильны и в ходе обработки сырья при изготовлении пищевых продуктов могут легко менять конформацию и целостность, становясь вследствие этого недоступными для обнаружения с помощью антител. Чувствительность способа выявления чужеродных белков на основе антител не всегда достаточна для надежного обнаружения малых количеств белка в трансгенных продуктах.
Другим известным способом обнаружения трансгенных компонентов растительного происхождения является анализ ДНК с применением метода полимеразной цепной реакции (ПНР), в частности, для идентификации в составе ДНК промотора 35S вируса мозаики цветной капусты и nos-терминатора агробактерии A.tumefaciens (Lipp M., Brodmann P., Pietsch К., Pauwels J., Anklam E. Journal of AOAC International, 1999, vol.82, №4, pp.923-928).
Метод, основанный на выявлении в испытуемых пробах трансгенной ДНК, более чувствителен и надежен, чем метод анализа белков, т.к. ДНК как биополимер более стабильна по сравнению с белком. Кроме того, появляется возможность выявлять не только экспрессирующиеся участки генома, но и вспомогательные, такие как промоторы и терминаторы транскрипции.
Однако получившая распространение методика на основе тестирования одного промотора (35S) и одного терминатора (nos) с помощью традиционной ПЦР (Lipp M. et al., 1999) имеет ряд недостатков и на сегодняшний день малоэффективна, т.к. значительная доля (до 30-50%) трансгенных растений создается с применением иных промоторов и терминаторов. Кроме того, использование фрагментов ДНК фитопатогенов как маркеров может приводить к ложно-позитивным результатам в случае, если исходные растения были заражены соответствующими вирусами и/или бактериями. Выявляемые с помощью традиционной ПЦР фрагменты ДНК имеют длину около 200 пар оснований (Lipp M. et al., 1999), что означает, что в случае распада ДНК, например, при термической обработке исходного сырья, до фрагментов меньшей длины данный метод идентификации трансгенов оказывается непригодным. Также серьезным недостатком метода традиционной ПЦР является визуальный характер оценки результатов, что может приводить к их ложной интерпретации и не позволяет определять количественные соотношения. Следует отметить, что описанная методика ПЦР, использующая в качестве ДНК-мишеней две детерминанты трансгенности, малоперспективна, т.к. намечается отказ от применения в практике генетической инженерии растений регуляторных фрагментов ДНК из патогенных микроорганизмов.
Раскрытие изобретения.
Задачей настоящего изобретения является создание нового метода идентификации генетически модифицированных растений и продуктов на их основе, для устранения недостатков известных методов.
Эта задача решается новым способом обнаружения последовательностей трансгенной ДНК в растительном материале и продуктах на основе этого материала. В заявленном методе предложено использование мультиплексной ПЦР для одновременной амплификации фрагментов генов и регуляторных элементов, используемых при трансформации ДНК растений. Присутствие или отсутствие набора трансгенных последовательностей ДНК определяют с помощью гибридизации на специально подобранных олигонуклеотидах-зондах, иммобилизованных на изготовленных для этой цели биочипах. Метод включает также способы регистрации и интерпретации результатов анализа.
Сущность изобретения
Сущность изобретения заключается в новом подходе для обнаружения генетических детерминант трансгенности в растительном материале и продуктах на его основе, с использованием олигонуклеотидного биочипа. Метод основан на мультиплексной ПЦР с использованием специфичных праймеров, комплементарных последовательностям исследуемых генов и регуляторных элементов, с последующей гибридизацией этих фрагментов на биочипе, содержащем оригинальный набор дифференцирующих олигонуклеотидов.
Применение указанных праймеров позволяет амплифицировать фрагменты небольшого размера – около 100 п.о. – трансгенной ДНК, если таковая присутствует в геноме испытуемого источника. Получаемые одноцепочечные флуоресцентно меченые фрагменты ДНК способны вступать в специфическое гибридизационное взаимодействие с олигонуклеотидами, иммобилизованными на биочипе. Известный порядок расположения олигонуклеотидов на биочипе дает возможность установить, какие именно маркерные гены и регуляторные элементы входят в состав трансгенной ДНК. Разработанные условия гибридизации обеспечивают высокую степень дифференциации между теми ячейками биочипа, где произошла гибридизация, и теми, где специфических гибридов не возникло. Дизайн праймеров и олигонуклеотидов обеспечивает абсолютную специфичность их взаимодействия с искомыми трансгенными последовательностями ДНК. При этом иммобилизованный олигонуклеотид имеет иную последовательность, чем праймеры для амплификации, что исключает возможность гибридизации в ячейке какой-либо случайно амплифицированной флуоресцентно меченой ДНК. Визуальная регистрация результатов гибридизации дополнена количественной регистрацией на основе специально приспособленной компьютерной программы, позволяющей точно определить степень превышения сигнала над уровнем фона.
Принципиальная схема обнаружения фрагментов трансгенной ДНК
К выделенной из образца ДНК добавляют несколько пар праймеров, специфичных к консервативным областям маркерных генов и регуляторных участков ДНК, обычно используемых при трансформации растений. Проводят реакцию мультиплексной ПЦР в выбранном режиме. Накопление флуоресцентно меченых одноцепочечных ПЦР-продуктов достигается за счет избытка в каждой из пар одного из праймеров, содержащего на 5′-конце флуоресцентную метку. Полученные продукты ПЦР гибридизуют на биочипе с иммобилизованными зондами, комплементарными последовательностям фрагментов детектируемых генов и/или регуляторных элементов.
Биочипы представляют собой массив микроячеек гидрогеля, закрепленных на поверхности стекла. В ячейках иммобилизован набор олигонуклеотидов, гомологичных фрагментам трансгенных последовательностей ДНК. Каждая из ячеек содержит индивидуальный ковалентно иммобилизованный олигонуклеотид, причем иммобилизованные олигонуклеотиды имеют иную последовательность, чем праймеры на те же гены. Помимо этого, на биочипе расположены ячейки с неспецифическими олигонуклеотидами, выполняющие роль отрицательного контроля гибридизации, а также ячейки, маркированные флуоресцентным красителем и предназначенные для правильной ориентации биочипа. Позиция на биочипе всех ячеек, как опытных, так и контрольных, строго детерминирована. Поверхность биочипа, на которой расположены микроячейки, закрыта пластиковьм корпусом гибридизационной камеры, которая вместе со стеклом образует замкнутое пространство, служащее для проведения гибридизации. Корпус камеры снабжен отогнутым краем для удаления камеры после проведения гибридизации и двумя отверстиями для внесения образца, которые герметизируются при помощи липкой ленты.
Изучаемые фрагменты ДНК образуют совершенные стабильные гибридизационные дуплексы только с соответствующими (полностью комплементарными) олигонуклеотидами. Со всеми остальными олигонуклеотидами изучаемые фрагменты ДНК могут формировать лишь нестабильные несовершенные дуплексы. Дифференциацию совершенных и несовершенных дуплексов выполняют путем сравнения интенсивностей флуоресценции ячеек, в которых образовались дуплексы. Интенсивность сигнала в ячейке, в которой образовался совершенный гибридизационный дуплекс, во много раз выше, чем в ячейке, где мог формироваться лишь несовершенный дуплекс. При этом детерминированный порядок расположения олигонуклеотидов в ячейках биочипа дает возможность установить, какие именно маркерные гены и регуляторные элементы входят в состав трансгенной ДНК. Результаты гибридизации могут быть интерпретированы однозначно как визуально, так и с помощью программы “Imageware”, входящей в состав аппаратно-программного комплекса “Чипдетектор-03” для анализа флуоресцентных изображений, получаемых на биочипах.
Таким образом, одним из аспектов изобретения является набор специфических олигонуклеотидов, приведенных в таблице 1, используемых в качестве праймеров для ПЦР в способе идентификации трансгенных последовательностей ДНК в растительном материале и продуктах на основе такого материала.
Еще одним аспектом изобретения является биочип, представляющий собой микроматрицу с ячейками, одни из которых содержат иммобилизованные олигонуклеотиды-зонды, другие – олигонуклеотиды для контроля на процедуру тестирования, а третьи – флуоресцентные красители для правильной ориентации биочипа при регистрации результатов, отличающийся тем, что в качестве зондов использованы олигонуклеотиды, приведенные в таблице 2, комплементарные фрагментам типичных маркерных и вспомогательных последовательностей ДНК, используемых при генетической трансформации растений.
Следующим аспектом изобретения является способ идентификации трансгенных последовательностей ДНК в растительном материале и продуктах на основе такого материала, включающий анализ ДНК при помощи полимеразной цепной реакции (ПЦР) и регистрацию результатов анализа, отличающийся тем, что: а) ПЦР проводят на препарате ДНК в виде мультиплексной реакции с получением флуоресцентно меченого продукта, при этом используют специфические пары праймеров, один из которых флуоресцентно мечен и присутствует в избытке по отношению ко второму немеченому праймеру; б) результаты ПЦР анализируют с помощью гибридизации на биочипе и в) результаты анализа регистрируют с помощью алпаратно-программного комплекса, позволяющего отображать флуоресценцию ячеек биочипа на экране компьютера, количественно определять флуоресцентный сигнал в любой точке биочипа, определять отношение флуоресцентного сигнала к фону в каждой ячейке биочипа и соответственно соотношение флуоресцентных сигналов в ячейках.
В способе согласно изобретению регистрация результатов гибридизации по п.3(в) может быть выполнена с помощью аппаратно-программного комплекса “Чипдетектор-03”, который позволяет преобразовать полученные результаты в цифровом формате и производить последующую математическую обработку.
Кроме того, в способе по изобретению при необходимости усиления гибридизационного сигнала реакцию ПЦР по п.3(а) можно проводить в две стадии, сначала как симметричную мультиплексную ПЦР, а затем как асимметричную мультиплексную ПЦР с включением флуоресцентно меченых праймеров.
Сопоставительный анализ с прототипом позволяет сделать вывод, что заявленный способ отличается от вышеописанного метода идентификации двух регуляторных элементов трансгенной ДНК с помощью традиционной ПЦР по нескольким параметрам. Во-первых, заявленный способ позволяет существенно увеличить число детектируемых мишеней и, в то же время, снизить трудоемкость благодаря использованию мультиплексной ПЦР. Во-вторых, процедура гель-электрофореза прототипа, связанная с применением токсических веществ и ручного труда, заменена в заявленном способе на гибридизацию на биочипе, практически не требующую трудовых затрат и участия персонала. В-третьих, размеры амплифицируемых фрагментов в заявленном способе существенно меньше, чем в прототипе, что позволяет анализировать существенно более деградированную ДНК. В-четвертых, применение в заявленном способе регистрации результатов с помощью специального аппаратно-программного комплекса “Чипдетектор-03” позволяет установить уровень интенсивности флуоресцентного сигнала в каждой ячейке и однозначно интерпретировать результаты гибридизации.
Краткое описание чертежей
Фиг.1. Схема биочипа для идентификации трансгенных растительных объектов.
Фиг.2. Результат гибридизации на биочипе. Обнаружение маркерных генов npt и gus, промоторов nos и 35S в образце ДНК из картофеля сорта Desiree.
Фиг.3. Результат гибридизации на биочипе. Обнаружение маркерного гена npt, промотора nos, терминатора ocs в образце ДНК из трансгенного табака.
Фиг.4. Результат гибридизации на биочипе. Обнаружение маркерного гена npt в образце ДНК из продукта питания.
Фиг.5. Результат гибридизации на биочипе образца ДНК из нетрансформированного растения.
Осуществление изобретения
Заявленный способ осуществляют следующим образом. Непосредственно перед испытанием готовят смесь в микропробирках для проведения мультиплексной ПЦР, в состав которой входят: реакционный буфер для ПЦР; смесь дезоксинуклеотид-трифосфатов в концентрации 200 мкМ каждого; несколько пар праймеров в количестве 5-10 пмолей для флуоресцентно меченых праймеров и 0,5-2 пмолей для немеченых праймеров; 12,5 единиц активности термостабильной Taq ДНК-полимеразы, а также испытуемая суммарная ДНК в количестве 1-3 мкг на пробу. Состав праймеров представлен в таблице 1. Микропробирки помещают в программируемый термостат-термоциклер и проводят реакцию ПЦР в следующем режиме: денатурация при 95°С – 30 с (в первом цикле – 5 мин), отжиг при 60(±5)°С – 30 с, элонгация при 72°С – 30 с (в последнем цикле – 5 мин), всего порядка 35-45 циклов.
Для проведения гибридизации аликвоту образца, полученного в результате ПЦР, смешивают с буфером гибридизации с доведением компонентов последнего до следующих концентраций: GuSCH – 1 M, HEPES, pH 7,5-50 мМ, EDTA – 5 мМ. Полученную смесь помещают на биочип, герметично закрывают гибридизационной камерой и проводят гибридизацию при 37°С в течение 14-18 часов. После гибридизации биочип трижды ополаскивают дистиллированной водой при 25°С и высушивают.
Регистрацию гибридизационной картины осуществляют, используя аппаратно-программный комплекс “Чипдетектор” с программой Imageware.
Изготовление олигонуклеотидного биочипа для обнаружения маркерных генов и регуляторных участков ДНК, используемых при трансформации растений
Олигонуклеотиды синтезируют на автоматическом синтезаторе (типа 394 DNA/RNA synthesizer. Applied Biosystems, США) и содержат спейсер со свободной аминогруппой 3′-Amino-Modifier C7 CPG 500 (Glen Research, США) для последующей иммобилизации в гель или 5′-Amino-Modifier C6 (Glen Research, США) для введения флуоресцентной метки. Введение флуоресцентной метки Су-5 («Биочип-ИМБ», Россия) осуществляют в соответствии с рекомендациями производителя.
Гелевые ячейки биочипа наносят на стеклянную подложку в виде капель с максимальной аккуратностью и воспроизводимостью с помощью роботов (Rubina A.Y. et al. Anal Biochem., 2004, vol.325(1), pp.92-106). Каждая сформированная ячейка представляет собой полусферу диаметром 200-250 мкм и периодом около 300 мкм и содержит иммобилизованный олигонуклеотид-зонд, комплементарный последовательности гена или регуляторного элемента (промотора или терминатора), используемых при генетической модификации растений.
Структура биочипа
Биочип содержит пять иммобилизованных олигонуклеотидов-зондов, список которых представлен в таблице 2, три маркерные точки для правильного позиционирования (захвата изображения), выполняемого программой ‘Imageware’, и три ячейки, содержащие неспецифичные к исследуемым геномам олигонуклеотиды, выполняющие роль отрицательного контроля. Расположение иммобилизованных на микрочипе олигонуклеотидов показано на фиг.1.
Последовательности иммобилизованных олигонуклеотидов приведены в Табл.2.
Регистрацию гибридизационной картины осуществляют, используя аппаратно-программный комплекс “Чипдетектор-03”.
Интерпретация результатов гибридизации осуществляется путем сравнения интенсивности флуоресцентного сигнала в ячейках 35S_I, gus_I, nos_I, npt_I, ocs_I с интенсивностью сигнала в ячейках NC (фиг.1), служащих отрицательным контролем. Если отношение хотя бы одного из этих сигналов превышало пороговое значение, определяемое для каждой из анализируемых ячеек и задаваемое в программе “Imageware”, то следует заключение о том, что исследуемый образец является трансгенным, т.е. содержит чужеродную ДНК.
Примеры
Пример 1.
Анализ присутствия чужеродных последовательностей в ДНК из трансгенного картофеля.
ДНК из трансформированного картофеля сорта Desiree выделяли стандартным методом и использовали в описанной выше процедуре тестирования. Использовали праймеры и иммобилизованные олигонуклеотиды для маркерных генов npt II и gus, a также для промотора 35S вируса мозаики цветной капусты, промотора nos и терминатора ocs агробактерии A.tumefaciens.
Подготовка проб для проведения гибридизации на микрочипе методом мультиплексной ПЦР
В 27 мкл ПЦР-смеси вносили 3 мкл раствора ДНК, выделенного из изучаемого образца. Состав ПЦР-смеси:
1×ПЦР-буфер: 50 мМ KCl, 10 мМ Tris-HCl (рН 9.0 при 25°С), 0.1% Triton® X-100 (Силекс, Россия)
2 мМ MgCl2 (Силекс, Россия)
200 мкМ каждого dNTP (Силекс, Россия)
12.5 ед. термостабильной Taq ДНК-полимеразы (Силекс, Россия)
1 мкл смеси праймеров (таблица 1).
Амплификацию проводили на программируемом термоциклере “Терцик” (ДНК-Технология, Россия) со следующим режимом: 95°С – 30 с, 62°С – 30 с, 72°С – 30 с; 43 цикла (в первом цикле время денатурации увеличивали до 5 мин, в последнем – время достройки до 5 мин).
На фиг.2 представлена картина гибридизации на биочипе флуоресцентно меченых продуктов ПЦР. Видно, что четыре ячейки дают сильный флуоресцентный сигнал, во много раз превышающий фоновую флуоресценцию ячеек отрицательного контроля NC. Флуоресцирующие ячейки содержат последовательности генов npt II и gus, а также промоторов 35S и nos. Ячейка, соответствующая терминатору ocs, сохранила фоновую флуоресценцию. Результат данного тестирования можно однозначно интерпретировать как положительный, т.е. выявляющий трансгенную природу данного растительного образца. Это же тестирование устанавливает, что в растительный геном внедрены маркерные гены npt II и gus, а также промоторы 35S и nos.
Пример 2.
Анализ присутствия чужеродных последовательностей в ДНК из трансгенного табака. Испытание проводили аналогично описанному в примере 1.
На фиг.3 представлена картина гибридизации на биочипе флуоресцентно меченых продуктов ПЦР.
Видно, что три ячейки дают сильный флуоресцентный сигнал, во много раз превышающий фоновую флуоресценцию ячеек отрицательного контроля NC. Флуоресцирующие ячейки содержат последовательности гена npt II, терминатора ocs, a также промотора nos. Ячейки, содержащие олигонуклеотиды, комплементарные фрагментам ocs и 35S, сохранили фоновую флуоресценцию.
Результат данного тестирования можно однозначно интерпретировать как положительный, т.е. выявляющий трансгенную природу данного растительного образца. Это же тестирование устанавливает, что в растительный геном внедрены ген npt II, а также промотор nos, терминатор ocs.
Пример 3.
Анализ присутствия чужеродных последовательностей ДНК из продукта питания (паштет “Популярный”, Черкизовский завод). Испытание проводили аналогично описанному в примере 1. Картина гибридизации на биочипе флуоресцентно меченых продуктов ПЦР представлена на фиг.4.
Флуоресцентный сигнал наблюдается только в ячейке, содержащей олигонуклеотид, комплементарный последовательности фрагмента гена npt II. Во всех остальных анализируемых ячейках биочипа интенсивность сигнала близка к значению интенсивности в ячейках отрицательного контроля. Следовательно, исследуемый продукт питания содержит генетически модифицированный растительный компонент, что устанавливается по наличию гена npt II.
Пример 4.
Анализ присутствия чужеродных последовательностей ДНК нетрансформированного растения. Испытание проводили аналогично описанному в примере 1. Картина гибридизации на биочипе флуоресцентно меченых продуктов ПЦР представлена на фиг.5.
Результаты показывают, что ни одна из опытных ячеек не дает флуоресцентного сигнала, достоверно превышающего сигнал контрольных ячеек. Это свидетельствует о нетрансгенной природе испытуемой ДНК.
Главным преимуществом предлагаемого метода является одновременный анализ присутствия в испытуемой ДНК сразу большого числа различных генов и их регуляторных областей, обычно используемых при получении трансгенных растений. Это позволяет не только надежно дискриминировать трансгенные и нетрансгенные образцы ДНК, но и однозначно определить, какие конкретно маркерные гены присутствуют в трансгенном материале. При этом большое число детектируемых последовательностей не делает процедуру более сложной в исполнении, т.к. стадия ПЦР-амплификации фрагментов ДНК и стадия гибридизации на микрочипе выполняются в один прием независимо от числа испытуемых последовательностей. Большое число тестируемых последовательностей ДНК делает маловероятными ложноотрицательные результаты, т.к. вероятность обнаружить хотя бы один фрагмент чужеродной ДНК приближается здесь к 100%. Важно также то, что у трансгенных растений имеется, как правило, несколько разных встроенных в геном последовательностей. Поэтому в случае присутствия трансгенного материала в исходном образце флуоресцентный сигнал будет чаще всего наблюдаться сразу в нескольких ячейках с зондами, специфичными к различным мишеням, каждая из которых служит независимым подтверждением положительного результата тестирования, что снижает вероятность ложноположительных результатов.
Приведенные примеры иллюстрируют преимущества предлагаемого изобретения для идентификации трансгенных компонентов лишь отчасти, т.к. эти преимущества не ограничены приведенными примерами и обусловлены возможностью постоянно дополнять состав биочипа по мере освоения генной инженерией новых регуляторных участков ДНК и маркерных генов для создания трансгенных растений.
Для достижения высокой надежности предложенного способа дополнительно осуществлены следующие меры. Во-первых, иммобилизованные зонды соответствуют внутренней части амплифицируемых специфичных фрагментов ДНК-мишеней. Это исключает возможность неспецифической гибридизации какой-либо случайно амплифицированной ДНК. Во-вторых, в структуру самого биочипа введены ячейки, выполняющие роль отрицательного контроля. В-третьих, длины амплифицируемых фрагментов ДНК составляют около 100 п.о., что дает возможность выявлять трансгенные последовательности даже в сильно деградированных до длин 150-200 н.о. образцах ДНК. Кроме того, в процессе тестирования каждой серии образцов предусмотрено использование положительного и отрицательного контролей сравнения – образцов ДНК, выделенной из охарактеризованных трансгенного и нетрансгенного растений.
Высокие чувствительность и специфичность метода обусловлены тем, что он объединяет преимущества двух наиболее чувствительных и специфичных способов анализа генома: полимеразной цепной реакции (ПЦР) и специфической гибридизации. ПЦР увеличивает концентрацию искомых последовательностей ДНК в миллион и более раз, что вполне достаточно для достоверной и количественной детекции флуоресцентного сигнала. Исходя из этого, для надежного выявления трансгенов в исходной ДНК достаточно наличия всего 105-106 одинаковых трангенных последовательностей, что соответствует примерно 1-10 фг, т.е. 10-15-10-14 г их ДНК. Подобная чувствительность соответствует одной из самых высоких для известных в настоящее время методов обнаружения трансгенов.
Предлагаемый способ высокотехнологичен и не требует значительных трудовых затрат. Компоненты для ПЦР могут быть приготовлены заранее в одной смеси, а сама реакция ПЦР занимает не более 1,5 часа. Гибридизация на биочипе проходит без участия персонала и может проводиться и в нерабочее время, т.е. в течение ночи. Отмывка чипа после гибридизации и анализ флуоресценции ячеек на аппаратно-программном комплексе “Чипдетектор-03” требуют минимума трудовых затрат и могут быть проведены в течение минуты. Срок хранения биочипов с прогибридизовавшимся флуоресцентно меченым материалом составляет несколько лет, при этом повторная регистрация флуоресценции может быть проведена в любой момент. Комплекс “Чипдетектор-03” позволяет сохранять в памяти компьютера как изображения, так и цифровые значения интенсивностей флуоресцентного сигнала.
Таким образом, удобство и быстрота тестирования, а также объективность анализа позволяют проводить испытание большого количества образцов ДНК параллельно в строго идентичных условиях, не требуя ни на одной из стадий высококвалифицированного персонала. При этом сохраняется сколь угодно долго возможность повторного анализа биочипа после гибридизации.
Предлагаемый способ не представляет опасности для здоровья персонала и для окружающей среды, он не связан с применением токсических или радиоактивных соединений. В связи с тем, что в процессе тестирования используются лишь микрообъемы жидких сред, не возникает проблемы с утилизацией или захоронением отходов.

Таблица 2.
Список олигонуклеотидов, иммобилизованных на биочипе |
SEQ ID
No: |
Название олигонуклеотида |
Детектируемая мишень |
Последовательность олигонуклеотида [5′-NH2-(B)n] |
| 11 |
35S_I |
35S-промотор |
5′ GCC ATC ATT GCG ATA AAG G |
| 12 |
gus_I |
ген gus |
5′ CTG GTA TCA GCG CGA A |
| 13 |
nos_I |
промотор nos |
5′ GCT AAG CAC ATA CGT CAG AA |
| 14 |
npt_I |
ген nptII |
5′ GGC AGC GCG GCT ATC |
| 15 |
ocs_I |
терминатор ocs |
5′ TTC TGT TGT GCA CGT TGT A |
Формула изобретения
1. Способ идентификации трансгенных последовательностей ДНК в растительном материале и продуктах на основе такого материала, включающий анализ ДНК при помощи полимеразной цепной реакции (ПЦР) и регистрацию результатов анализа, отличающийся тем, что а) ПЦР проводят на препарате ДНК в виде мультиплексной реакции с получением флуоресцентно меченного продукта, при этом используют специфические пары праймеров, один из которых флуоресцентно мечен и присутствует в избытке по отношению ко второму немеченому праймеру; б) результаты ПЦР анализируют с помощью гибридизации на биочипе и в) результаты анализа регистрируют с помощью аппаратно-программного комплекса, позволяющего отображать флуоресценцию ячеек биочипа на экране компьютера, количественно определять флуоресцентный сигнал в любой точке биочипа, определять отношение флуоресцентного сигнала к фону в каждой ячейке биочипа и соответственно соотношение флуоресцентных сигналов в ячейках.
2. Способ по п.1, отличающийся тем, что регистрацию результатов гибридизации по п.3(в) проводят с помощью аппаратно-программного комплекса «Чипдетектор-03», что позволяет преобразовать полученные результаты в цифровом формате и производить последующую математическую обработку.
3. Способ по п.1, отличающийся тем, что для усиления гибридизационного сигнала реакцию ПЦР по п.3(а) проводят в две стадии, сначала как симметричную мультиплексную ПЦР, а затем как асимметричную мультиплексную ПЦР с включением флуоресцентно меченных праймеров.
4. Набор специфических олигонуклеотидов, приведенных в таблице 1, используемых в качестве праймеров для ПЦР в способе идентификации трансгенных последовательностей ДНК в растительном материале и продуктах на основе такого материала, охарактеризованном в п.1.
5. Биочип, представляющий собой микроматрицу с ячейками, одни из которых содержат иммобилизованные олигонуклеотиды-зонды, другие – олигонуклеотиды для контроля на процедуру тестирования, а третьи – флуоресцентные красители для правильной ориентации биочипа при регистрации результатов, отличающийся тем, что в качестве зондов использованы олигонуклеотиды, приведенные в таблице 2, комплементарные фрагментам типичных маркерных и вспомогательных последовательностей ДНК, выявляемых способом, охарактеризованном в п.1.
РИСУНКИ
|
|