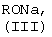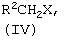Патент на изобретение №2270195
|
||||||||||||||||||||||||||
(54) СПОСОБ ПОЛУЧЕНИЯ 5-АМИНО-3-[N-АЦИЛ-N-АЛКИЛАМИНО]-1-ФЕНИЛ-1,2,4-ТРИАЗОЛОВ И 5-АМИНО-3-[N-СУЛЬФОНИЛ-N-АЛКИЛАМИНО]-1-ФЕНИЛ-1,2,4-ТРИАЗОЛОВ
(57) Реферат:
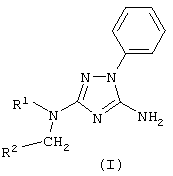
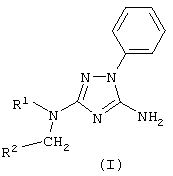
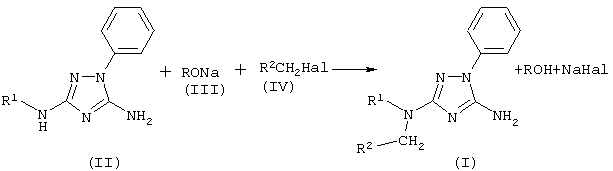
Описывается способ получения новых производных 1,2,4-триазола общей формулы I: где R1 – R3CO или R3SO2 группа; R2 – Н, метил, группу СН2=СН-, фенил, R3 – метил, фенил, 4-МеС6Н4, заключающийся в том, что к раствору 5-амино-3-[N-R1]-амино-1-фенил-1,2,4-триазола в диметилсульфоксиде, или диметилформамиде, или N-метилпирролидоне прибавляют соответствующий алкилгалогенид в присутствии алкоголята натрия. Описываемый способ может быть использован для синтеза лекарственных и биологически активных веществ из дешевого и доступного сырья без применения сложных технологических операций.
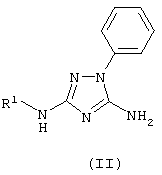
Изобретение относится к области получения органических веществ и может быть использовано в производстве лекарственных и биологически активных соединений. Известен способ получения N-этил-п-толуолсульфанилидов алкилированием п-толуолсульфанилида этиловым эфиром п-толуолсульфокислоты в водном растворе NaOH [Вейганд-Хильгетаг. Методы эксперимента в органической химии. М.: Химия, – 1969, с.360]. Основным недостатком этого метода является гидролиз ацильной или сульфонильной группы и образование трудноразделимой смеси при алкилировании алкилгалолгенидами 5-амино-3-[N-ациламино]-1-фенил-1,2,4-триазолов или 5-амино-3-[N-сульфонил]-1-фенил-1,2,4-триазолов. Задачей изобретения является разработка способа получения 5-амино-3-[N-ацил-N-алкиламино]-1-фенил-1,2,4-триазолов и 5-амино-3-[N-сульфонил-N-алкиламино]-1-фенил-1,2,4-триазолов общей формулы (I) из дешевого и доступного сырья без применения сложных технологических операций. Поставленная задача достигается за счет алкилирования 5-амино-3-[N-ациламино]-1-фенил-1,2,4-триазолов или 5-амино-3-[N-сульфонил]-1-фенил-1,2,4-триазолов (II) алкилгалогенидами (IV) в присутствии алкоголята натрия (III). В предлагаемом способе получения 5-амино-3-[N-ацил-N-алкиламино]-1-фенил-1,2,4-триазолов и 5-амино-3-(N-сульфонил-N-алкиламино]-1-фенил-1,2,4-триазолов общей формулы (I) к 5-амино-3-[N-ациламино]-1-фенил-1,2,4-триазолу или 5-амино-3-[N-сульфонил]-1-фенил-1,2,4-триазолу общей формулы (II) в диметилсульфоксиде, или диметилформамиде, или N-метилпирролидоне прибавляют алкоголят натрия (III) и алкилгалогенид (IV) при мольном соотношении (II):(III):(IV)=1:1-2:1-2 при температуре 0-25°С. Через 4 часа растворитель отгоняют в вакууме, к остатку добавляют воду, выпавший осадок отфильтровывают и перекристаллизовывают. Исследования показали, что в качестве апротонных полярных растворителей можно использовать диметилсульфоксид, диметилформамид, N-метилпирролидон. В других апротонных полярных растворителях (ацетоне, ацетонитриле, тетрагидрофуране, диметоксиэтане) образуется трудноразделимая смесь соединений, что, вероятно, обусловлено плохой растворимостью натриевых солей соединений (II), образующихся в качестве промежуточных продуктов реакции. В качестве алкоголятов натрия (III) можно использовать метилат, этилат, изопропилат, третбутилат натрия. Использование других алкоголятов натрия нецелесообразно вследствие их высокой стоимости. Алкилгалогенидами (IV) могут быть первичные алкилхлориды, алкилбромиды и алкилиодиды. Использование алкилфторидов не целесообразно вследствие их высокой стоимости и низкой реакционной способности. Мольное соотношение (II):(III):(IV)=1:1-2:1-2 является оптимальным. Изменение мольного соотношения приводит либо к неполному протеканию реакции и неудовлетворительной чистоте целевых соединений (I), либо перерасходу реагентов, что экономически не оправдано. Повышение температуры более 25°С вызывает уменьшение выхода целевых соединений (I) вследствие протекания побочных реакций. Снижение температуры менее 0°С приводит к значительному уменьшению скорости реакции и к увеличению продолжительности синтеза, что технологически не целесообразно. Пример 1 К раствору 1 г (0,0046 моль) 5-амино-3-ацетамидо-1-фенил-1,2,4-триазола в 10 мл диметилсульфоксида (ДМСО) прибавляют 0.5 г (0.0092 моль) метилата натрия в 1 мл метанола и затем по каплям при перемешивании и температуре 0-10°С приливают 1.44 г (0.0092 моль) метилиодида в течение 40 минут. Перемешивание продолжают 4 часа, затем ДМСО отгоняют в вакууме. К остатку добавляют воду, полученный осадок отфильтровывают и перекристализовывают из этанола. Получают 0.87 г (82%) 5-амино-3-(N-ацетил-N-метиламино)-1-фенил-1,2,4-триазола. tпл=199-202°C. Спектр ЯМР 1H, Найдено (%): С 57.46, Н 5.66, N 30.35. C11H13N5O. Вычислено (%): С 57.13, Н 5.67, N 30.28. Пример 2 К раствору 1 г (0,0046 моль) 5-амино-3-ацетамидо-1-фенил-1,2,4-триазола в 10 мл диметилсульфоксида (ДМСО) прибавляют 0.47 г (0.0069 моль) этилата натрия в 2 мл этанола и затем по каплям при перемешивании и температуре 10-25°С приливают 1.08 г (0.0069 моль) этилиодида в течение 40 минут. Перемешивание продолжают 4 часа, затем ДМСО отгоняют в вакууме. К остатку добавляют воду и полученный осадок отфильтровывают. Получают 0.9 г (80%) 5-амино-3-(N-ацетил-N-этиламино)-1-фенил-1,2,4-триазола. tпл=173-175°C (из этилацетата). Спектр ЯМР 1H, Найдено (%): С 58.85, Н 6.06, N 28.20. C12H15N5O. Вычислено (%): С 58.76, Н 6.16, N 28.55. Пример 3 К раствору 1 г (0,0046 моль) 5-амино-3-ацетамидо-1-фенил-1,2,4-триазола в 10 мл диметилсульфоксида (ДМСО) прибавляют 0.57 г (0.0069 моль) изопропилата натрия в 2 мл изопропанола и затем по каплям при перемешивании и температуре 0-10°С приливают 1.16 г (0.0069 моль) аллилбромида в течение 40 минут. Перемешивание продолжают 4 часа, затем ДМСО отгоняют в вакууме. К остатку добавляют воду и полученный осадок отфильтровывают. Получают 0.33 г (28%) 5-амино-3-(N-аллил-N-ацетиламино)-1-фенил-1,2,4-триазола. tпл=165-166°C (из бензола). Спектр ЯМР 1Н, Найдено (%): С 60.71, Н 5.88, N 27.20. C13H15N5O. Вычислено (%): С 60.69, Н 5.88, N 27.22. Пример 4 К раствору 1 г (0.0046 моль) 5-амино-3-ацетамидо-1-фенил-1,2,4-триазола в 10 мл диметилсульфоксида (ДМСО) прибавляют 0.57 г (0.0069 моль) изопропилата натрия в 2 мл изопропанола и затем по каплям при перемешивании и температуре 20-25°С приливают 0.87 г (0.0069 моль) бензилхлорида в течение 40 минут. Перемешивание продолжают 4 часа, затем ДМСО отгоняют в вакууме. К остатку добавляют воду и полученный осадок отфильтровывают. Получают 0.88 г (62%) 5-амино-3-(N-ацетил-N-бензиламино)-1-фенил-1,2,4-триазола. tпл=194-196°С (из метанола). Спектр ЯМР 1Н, Найдено (%): С 66.44, Н 5.61, N 22.74. C17H17N5O. Вычислено (%): С 66.43, Н 5.58, N 22.79. Пример 5 К раствору 1 г (0.003 моль) 5-амино-3-n-толуолсульфамидо-1-фенил-1,2,4-триазола в 10 мл N-метилпирролидона прибавляют 0.24 г (0.0035 моль) метилата натрия в 1.5 мл метанола, затем по каплям при перемешивании и температуре 5-10°С приливают 0.44 г (0.0035 моль) бензилхлорида в течение 30 минут. Перемешивание продолжают 3 часа, затем растворитель отгоняют в вакууме. К остатку добавляют воду и полученный осадок отфильтровывают. Получают 0.88 г (70%) 5-амино-3-(N-n-толуолсульфонил-N-бензиламино)-1-фенил-1,2,4-триазола. tпл=170-172°С (из этанола). Спектр ЯМР 1Н, Найдено (%): С 69.95, Н 5.07, N 16.63. C22H21N5O2S. Вычислено (%): С 69.99, Н 5.05, N 16.69. Пример 6 К раствору 1 г (0.0036 моль) 5-амино-3-бензамидо-1-фенил-1,2,4-триазола в 10 мл диметилформамида прибавляют 0.28 г (0.0041 моль) метилата натрия в 1.5 мл метанола и затем по каплям при перемешивании и температуре 5-10°С приливают 0.58 г (0.0041 моль) метилиодида в течение 30 минут. Перемешивание продолжают 2.5 часа, затем растворитель отгоняют в вакууме. К остатку добавляют воду и полученный осадок отфильтровывают. Получают 0.64 г (61%) 5-амино-3-(N-бензоил-N-метиламино)-1-фенил-1,2,4-триазола. tпл=208-210°C (из этанола). Спектр ЯМР 1Н, Найдено (%): С 65.48, Н 5.17, N 23.74. C16H15N5O. Вычислено (%): С 65.52, Н 5.15, N 23.88.
Формула изобретения
Способ получения 5-амино-3-[N-ацил-N-алкиламино]-1-фенил 1,2,4-триазолов и 5-амино-3-[N-сульфонил-N-алкиламино]-1-фенил-1,2,4-триазолов общей формулы (I) где R1 представляет собой R3CO или R3SO2 группу; R2 представляет собой независимо Н, метил, группу CH2=CH-, фенил; R3 представляет собой метил, фенил, 4-МеС6Н4, отличающийся тем, что к раствору 5-амино-3-[N-ацил]-амино-1-фенил-1,2,4-триазола или 5-амино-3-[N-сульфонил]-амино-1-фенил-1,2,4-триазола общей формулы (II) где R1 имеет указанные значения, в диметилсульфоксиде, или диметилформамиде, или N-метилпирролидоне прибавляют алкоголят общей формулы (III) где R представляет собой метальный, этильный, изопропильный или трет-бутильный радикал, и алкилгалогенид общей формулы (IV) где R2 имеет указанные значения, Х представляет собой Cl, Br, I, при мольном соотношении (II):(III):(IV)=1:1-2:1-2 и температуре 0-25°С.
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 22.06.2006
Извещение опубликовано: 20.11.2007 БИ: 32/2007
|
||||||||||||||||||||||||||

 , м.д. (ДМСО-d6) 2.2 с (3Н, СН3), 3.2 с (3Н, СН3), 6.4 с (2Н, NH2), 7.3-7.6 м (5Н, аром.).
, м.д. (ДМСО-d6) 2.2 с (3Н, СН3), 3.2 с (3Н, СН3), 6.4 с (2Н, NH2), 7.3-7.6 м (5Н, аром.).