Патент на изобретение №2155190
|
||||||||||||||||||||||||||
(54) ИММУНОСТИМУЛЯТОРНЫЕ МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА
(57) Реферат: Изобретение относится к иммунологии и может быть использовано для получения моноклональных антител, обладающих иммуностимуляторным действием. Гибридому CNCM 1-1397 получают путем иммунизации мышей мембранным препаратом клеток Daudi с последующим выделением спленоцитов и их слиянием с клетками миеломы. Гибридома продуцирует моноклональные антитела, оказывающие иммуностимулирующее действие и способные связывать клетки CD3. Изобретение позволяет разработать противоопухолевый препарат, который может быть использован для лечения и профилактики рака. 3 с. и 1 з.п. ф-лы, 10 ил., 12 табл. Изобретение относится к области иммунотерапии и более конкретно касается антител, полезных в рамках такой терапии для различных показаний, например в лечении рака. Ниже представлен список литературы, касающийся уровня техники, который является существенным для последующего описания: 1. Clark, E.A., and Ledbetter, J.A. Amplification of the immune response by agonistic antibodies, Immunol., Today, 7,267-270, 1986. 2. Meuer, S.C., Huspey, R.E., Cantrell, D.A., Hodgdon, J.C., Schlomman, S. F. , Smith, K.A., and Reinberg, E.L., Triggering of the T3-T1 antigen-receptor complex results in clonal T cell proliferation through an interleukin-2 dependen autocine pathway, Proc. Natl. Acad. Sci., (USA), 31, 1509-1513, 1984. 3. Van Wauve, J.P., De Mey, J.R., and Gooser, J.G., OKT3: monoclonal anti-human T lymphocyte antibody and mitogenic properties, J. Immunol., 124, 2708-2713, 1984. 4. Jung, G. , Martin, D. E., and Muller-Eberhard, J.H., Induction of cytotoxocity in human peripheral blood mononuclear cells by monoclonal antibody OKT3, J. Immunol., 139, 639-644, 1987. 5. Van Lier, R., Blocmena, E., Brouwer, M., Van Heim, J., Weinreich, S., and Aarden, L, Srudied on the monocyte dependence on T-cell proliferation induced by monoclonal antibodies directed against region 1 and 11 of CD2 antigen, Immunology, 67, 333-338, 1989. 6. Ellenhorn, J.D., Hirsch, R., Schreiber, H., and Bluestone, J.A., In vivo administration of anti- CD3 prevents malignant progressor tumor growth, Science (Washington DC), 242, 569-571, 1988. 7. Gallinger, S., Hoskins, D.W., Mullen, J.B.M., Wong, A.H.C., and Roder, J.C., Comparison of cellular immunotherapies and anti-CD3 in the treatment of MCA-38-Ld experimental hepatic metastases in C57BL/6 mice. Cancer Res., 50, 2476-2480, 1990. 8. Ledbetter, J.A., Martin, P.J., Spooner, C.E., Wofsy, D., Tsu, T.T., Beatty, P. G. , and Gladstone, P., Antibodies to Tp67 and Tp44 augment and sustain proliferation responses of activated T cells. J.lmmunol., 135, 2331-2336, 1985. 9. Moretta, A., Goggi, A., Pende, D., Tripodi, G., Orento, A., Pella, N. , Augugliarro, R., Bottino, C., Ciccone, E., and Moretta, I., CD69-mediated pathway of lymphocyte activation: anti-CD69 monoclonal antibodies trigger the cytolitic activity of differen Lymphoid effector cells with the exception of cytolytic T lymphocyte expressing Tcell receptor  / / , J.Exp.Med., 174, 1393- 1398, 1991.
10. Van Lier, R.A., Brouwer, M., and Aarden, L.A., Signals involved in T cell activation. T cell proliferation induced through the synergistic action of anti-CD28 and anti-CD2 monoclonal antibodies, Eur.J.lmmunol., 13, 167-172, 1988.
11. Jenkins, M. K., Taylor, P.S., Norton, S.D., and Urdahl, K.B., CD28 delivers a costimulatory signal involved in antigen-specific IL-2 production by human T cells., J.lmmunol., 147, 2461-2466, 1991.
12. Townsend, S. E. , and Allison, J.P., Tumor rejection after direct costimulation of CD8+T cells by B7-transfected melanoma cells, Science (Waschington DC), 259, 368-370, 1993.
13. Hardy, В., Dotan, D., and Novogrodsky, A., A monoclonal antibody to human В lymphoblastoid cells activated human and murine T lymphocytes, Cell Immunol., 118, 22-29, 1989.
Подтверждение здесь любой приведенной выше ссылки позволяет читателю получить оценку уровня техники. Подтверждение не должно, однако, толковаться как указание на то, что эти ссылки в любом случае являются уместными для признания патентоспособности изобретения, как оно определено в приложенной формуле изобретения.
Подтверждение вышеприведенных ссылок будет осуществляться с помощью указания номера из приведенного выше списка.
Рак в различных формах является главной причиной смерти населения. У одной трети всего населения Соединенных штатов проявляется рак и 20% населения умирает от рака (494000 в 1988 г.).
Наиболее широко используемое терапевтическое лечение рака представляет оперативное вмешательство, облучение и химиотерапию. В последние годы также было предложено другое терапевтическое лечение, основанное на использовании модификаторов биологической восприимчивости (BRM). Использованные BRM включают в основном цитокины (например, интерлейкин-2 (IL-2) и интерферон- , J.Exp.Med., 174, 1393- 1398, 1991.
10. Van Lier, R.A., Brouwer, M., and Aarden, L.A., Signals involved in T cell activation. T cell proliferation induced through the synergistic action of anti-CD28 and anti-CD2 monoclonal antibodies, Eur.J.lmmunol., 13, 167-172, 1988.
11. Jenkins, M. K., Taylor, P.S., Norton, S.D., and Urdahl, K.B., CD28 delivers a costimulatory signal involved in antigen-specific IL-2 production by human T cells., J.lmmunol., 147, 2461-2466, 1991.
12. Townsend, S. E. , and Allison, J.P., Tumor rejection after direct costimulation of CD8+T cells by B7-transfected melanoma cells, Science (Waschington DC), 259, 368-370, 1993.
13. Hardy, В., Dotan, D., and Novogrodsky, A., A monoclonal antibody to human В lymphoblastoid cells activated human and murine T lymphocytes, Cell Immunol., 118, 22-29, 1989.
Подтверждение здесь любой приведенной выше ссылки позволяет читателю получить оценку уровня техники. Подтверждение не должно, однако, толковаться как указание на то, что эти ссылки в любом случае являются уместными для признания патентоспособности изобретения, как оно определено в приложенной формуле изобретения.
Подтверждение вышеприведенных ссылок будет осуществляться с помощью указания номера из приведенного выше списка.
Рак в различных формах является главной причиной смерти населения. У одной трети всего населения Соединенных штатов проявляется рак и 20% населения умирает от рака (494000 в 1988 г.).
Наиболее широко используемое терапевтическое лечение рака представляет оперативное вмешательство, облучение и химиотерапию. В последние годы также было предложено другое терапевтическое лечение, основанное на использовании модификаторов биологической восприимчивости (BRM). Использованные BRM включают в основном цитокины (например, интерлейкин-2 (IL-2) и интерферон- (INF- (INF- ), активированные моноядерные клетки (например, лимфокинактивированные клетки-килеры (LAK)) и антитела. BRM действуют как непосредственно на опухоль, так и опосредованно за счет усиления неспецифического или специфического иммунологического и цитотоксического механизмов.
До настоящего времени не был получен значительный клинический успех с использованием BRM, в основном из-за их токсичности и побочных эффектов. Была предложена также активная иммунизация по отношению к раковой опухоли, но она оказалась неэффективной. Кроме того, были оценены несколько моноклональных антител (mAbs) для использования в диагнозах и терапии рака, но пока нет доказательств того, что mAbs следует принять эффективным в рамках стандартной терапевтической процедуры у раковых пациентов.
Были найдены различные mAbs, способные прикрепляться к детерминантам на поверхности Т-клеток с идуцированием пролиферации, активации или дифференциации этих клеток(1). Было продемонстрировано, что прикрепление mAbs, направленных против комплекса CD3/TCR, на Т-клетки(2-4), прикрепление mAbs направленных на CD2(5) рецепторный антиген на T-клетки, а также прикрепление обоих приведенных выше типов антител к T-клеткам, приводит к пролиферации T клетки, экспрессии рецептора IL-2 и продуцированию IL-2 в T клетках, приводя к усилению цитолитических процессов в этих клетках. Было показано, что анти CD3 mAbs инициирует противоопухолевую активность in vivo у модельных животных(6-7).
Были предложены также другие различные mAbs, направленные против антигенов T-лимфоцитов, которые после прикрепления к клеткам вызывали их активацию, такую как mAbs, направленный против CD5(8), против CD69(9) и против CD28(10, 11). Сообщали, что анти-CD28 mAbs уменьшали скорость роста миеломы мыши, хотя они не были успешными в полном излечении опухолей у мышей(12).
Было показано, что mAbs, направленный против линии лимфобластоидных B клеток человека, называемых “Daudi”, стимулировал лимфоциты мыши и периферические T клетки(13) человека.
Настоящее изобретение первым из его аспектов обеспечивает моноклональное иммуностимуляторное антитело, которое прикрепляется к лимфобластоидным В клеткам и индуцирует пролиферацию и активацию лимфоцитов периферической крови, моноклональное антитело, которое характеризуется тем, что когда оно вводится животному носителю опухоли, оно вызывает противоопухолевый эффект.
Противоопухолевый эффект представляет биологический эффект, который может быть продемонстрирован путем уменьшения размера опухоли, снижения количества метастаз, увеличения вероятности жизни или улучшения различных биологических симптомов, связанных с раковым состоянием. Противоопухолевый эффект может быть также доказан с помощью способности mAbs в первую очередь предотвращать появления опухоли. С помощью этих свойств mAbs изобретения также может быть использован как при лечении острого состояния рака, так и при профилактике рака.
Моноклональные антитела изобретения могут быть получены путем первичной иммунизации животного иммуногеном, который представляет B лимфобластоидные клетки, лизированные B лимфобластоидные клетки или их мембранные препараты. Вслед за иммунизацией и развитием иммунной реакции у иммунизованных животных выделяют B лимфоциты у животного, выращивают линии и селектируют для таких клеток с секреторными антителами, которые прикреплятся к иммуногену. Селектированные mAbs подвергают затем дальнейшей селекции для получения таких клеток, которые способны индуцировать пролиферацию и активацию лимфоцитов периферической крови.
Для того, чтобы получить mAbs изобретения, выбирают антитела, как описано выше, и затем их еще подвергают дальнейшей селекции для получения таких антител, которые способны вызывать противоопухолевый эффект. Для того, чтобы выбрать такие антитела, обычно может быть использовано раковое модельное животное. Иногда эффект может быть также испытан на различных моделях in vitro. Такая модель может быть, например, любым лабораторным животным, у которого был индуцирован рак. Особенно уместными конкретно при выборе мыши для терапевтического использования у людей являются модели, которые позволяют развиваться опухолям, возникающим у человека. Примеры модельных животных последнего типа представляют иммуносогласованные мыши, например мышь SCID (с тяжелым комбинированным иммунодифицитом) или голая мышь, которой были введены или имплантированы раковые клетки или ткани, полученные от раковых пациентов (человека). В такой селекции способность mAbs уменьшать размер опухоли, увеличивать время выживания и т.д. определяют по сравнению с контролем (аналогичным животным носителем опухоли, но не подвергнутым лечению mAb или подвергнутым лечению не соответствующим mAb).
Селекция может также включать испытание способности mAb’s в соответствующей модели в предотвращении проявления рака. Например, животные, имеющие генетическое предрасположение для развития рака, могут быть подвергнуты введению mAb, и затем распространение и выживание в группе животных, подвергнутых лечению mAb, может быть сравнено с контрольной группой, в остальном подвергнутой лечению и уходу в той же степени. Вместо того, чтобы использовать животных, имеющих генетическое предрасположение для развития рака, способность mAb предотвращать рак может быть испытана у других различных животных, подвергнутых лечению mAb до экспериментального введения злокачественных клеток животному.
Для того, чтобы достигнуть такого противоопухолевого эффекта, в организм следует вводить эффективное количество mAb изобретения. Термин “эффективное количество” должен быть понят как количество mAb, требуемое для достижения терапевтического эффекта. Эффективное количество, требуемое для достижения терапевтического конечного результата, может зависеть от ряда факторов, включающих, например, тип опухоли и тяжесть состояния пациента (т.е. раковое состояние), и вводится ли mAb совместно с другим агентом, который действует вместе с mAb дополнительным или синергетическим образом (относительно такого совместного введения, смотри ниже).
Получение линии иммортализованных клеток, секретирующей mAbs изобретения, может быть проведено с помощью ряда способов per se, таких как слиянием с линией иммортализованных клеток с получением гибридомы; путем EBV трансформации; путем гинетической инженерии линии клеток, например CHO линии клеток, которая может быть достигнута с помощью различных способов известных per se; и т.д. В общем, способ получения линий секретирующих клеток иммортализованных моноклональных антител сегодня является рутинной процедурой, известной специалисту в этой области, и описание его выходит за рамки настоящего описания.
Обычно там, где mAb предназначается для лечения человека, иммуноген будет человеческого происхождения. Однако иногда присутствуют образцы перекрестной отвечаемости, и их также возможно периодически использовать у людей, получивших mAb с последующей иммунизацией нечеловеческим иммуногеном, как например, полученным от примата.
Антитела изобретения должны пониматься как включающие моноклональные антитела, которые могут быть lgG или lgM антителами, могут быть Fab фрагментами таких антител, F(ab’)2 фрагментами, одноцепочечными антителами и им подобными. Кроме того, антитела полученные от нечеловеческого источника, например мышей, могут быть “очеловечены” с помощью различных способов генной инженерии (“очеловеченное” антитело представляет антитело, в котором большинство сегментов были заменены сегментами человеческого происхождения).
Антитела в соответствии с изобретением, в то время как являются полезными для различных терапевтических показаний, используют в соответствии с предпочтительным вариантом изобретения для лечения рака. Было найдено, что моноклональное антитело в соответствии с изобретением является активным в снижении онкогенности различных опухолей.
Характерная линия клеток гибридомы в соответствии с настоящим изобретением расположена в Национальной коллекции культур и организмов (CNCM), Institute pasteur, 25, Rue du Docteur Roux, 75724, Paris, Cedex 15, под номером 1-1397, 28 января 1994. На клетки этой линии здесь иногда ссылаются как на “ВАТ-1 клетки” и на соответствующее моноклональное антитело здесь ссылаются иногда как на “ВАТ-1 mAb”.
Использование моноклонального антитела, имеющего характеристики ВАТ-1 mAb, особенно самого ВАТ-1 mAb, является предпочтительным вариантом изобретения.
ВАТ-1 моноклональное антитело было выбрано, исходя из его способности к прикреплению к клеткам Daudi В лимфобластоидной линии человека. Было найдено, что ВАТ-1 mAb должен привязываться к белковым веществам (названным ниже как “ВАТ-1 связывающий протеин”), имеющим кажущуюся молекулярную массу 48-50К Дальтон, как она определена с помощью SDS-PAGE.
ВАТ-1 связывающий протеин представляет другой аспект настоящего изобретения. ВАТ-1 связывающий протеин может быть выделен с помощью различных методов известных per se, путем использования mAbs изобретения. ВАТ-1 связывающий протеин может быть затем использован для иммунизации животных, от которых может быть затем получен mAbs изобретения.
Настоящее изобретение обеспечивает также фармацевтическую композицию, включающую в качестве активного ингредиента эффективное количество mAb изобретения и физиологически приемлемый носитель.
Дальнейший аспект изобретения представляет способ лечения заболевания или нарушения, конкретно рака, включающий введение субъекту, нуждающему в таком лечении эффективного количества mAb изобретения. Введение mAb обычно проводят путем парентерального введения, например внутривенно (I.v.), интраперитонеально (I.p.) или внутримышечно (i.m.). Носителем для введения может быть любой носитель, известный per se, например солевой раствор или любой другой пригодный физиологический раствор.
Было найдено, что mAb изобретения, как уже отмечалось выше, является активным в снижении онкогенности различных опухолей. Эффективность mAb изобретения в снижении онкогенности коррелирует с его способностью к снижению цитотоксической активности лимфоцитов. Для того, чтобы повысить эту активность, предпочтительным иногда является введение mAb изобретения вместе с другими агентами, которые могут действовать дополнительным или синергетическим образом с mAb. Примеры включают различные цитокины, такие как IL-1 (Интерлейкин- 1), IL-2, IL-6 и IFN- ), активированные моноядерные клетки (например, лимфокинактивированные клетки-килеры (LAK)) и антитела. BRM действуют как непосредственно на опухоль, так и опосредованно за счет усиления неспецифического или специфического иммунологического и цитотоксического механизмов.
До настоящего времени не был получен значительный клинический успех с использованием BRM, в основном из-за их токсичности и побочных эффектов. Была предложена также активная иммунизация по отношению к раковой опухоли, но она оказалась неэффективной. Кроме того, были оценены несколько моноклональных антител (mAbs) для использования в диагнозах и терапии рака, но пока нет доказательств того, что mAbs следует принять эффективным в рамках стандартной терапевтической процедуры у раковых пациентов.
Были найдены различные mAbs, способные прикрепляться к детерминантам на поверхности Т-клеток с идуцированием пролиферации, активации или дифференциации этих клеток(1). Было продемонстрировано, что прикрепление mAbs, направленных против комплекса CD3/TCR, на Т-клетки(2-4), прикрепление mAbs направленных на CD2(5) рецепторный антиген на T-клетки, а также прикрепление обоих приведенных выше типов антител к T-клеткам, приводит к пролиферации T клетки, экспрессии рецептора IL-2 и продуцированию IL-2 в T клетках, приводя к усилению цитолитических процессов в этих клетках. Было показано, что анти CD3 mAbs инициирует противоопухолевую активность in vivo у модельных животных(6-7).
Были предложены также другие различные mAbs, направленные против антигенов T-лимфоцитов, которые после прикрепления к клеткам вызывали их активацию, такую как mAbs, направленный против CD5(8), против CD69(9) и против CD28(10, 11). Сообщали, что анти-CD28 mAbs уменьшали скорость роста миеломы мыши, хотя они не были успешными в полном излечении опухолей у мышей(12).
Было показано, что mAbs, направленный против линии лимфобластоидных B клеток человека, называемых “Daudi”, стимулировал лимфоциты мыши и периферические T клетки(13) человека.
Настоящее изобретение первым из его аспектов обеспечивает моноклональное иммуностимуляторное антитело, которое прикрепляется к лимфобластоидным В клеткам и индуцирует пролиферацию и активацию лимфоцитов периферической крови, моноклональное антитело, которое характеризуется тем, что когда оно вводится животному носителю опухоли, оно вызывает противоопухолевый эффект.
Противоопухолевый эффект представляет биологический эффект, который может быть продемонстрирован путем уменьшения размера опухоли, снижения количества метастаз, увеличения вероятности жизни или улучшения различных биологических симптомов, связанных с раковым состоянием. Противоопухолевый эффект может быть также доказан с помощью способности mAbs в первую очередь предотвращать появления опухоли. С помощью этих свойств mAbs изобретения также может быть использован как при лечении острого состояния рака, так и при профилактике рака.
Моноклональные антитела изобретения могут быть получены путем первичной иммунизации животного иммуногеном, который представляет B лимфобластоидные клетки, лизированные B лимфобластоидные клетки или их мембранные препараты. Вслед за иммунизацией и развитием иммунной реакции у иммунизованных животных выделяют B лимфоциты у животного, выращивают линии и селектируют для таких клеток с секреторными антителами, которые прикреплятся к иммуногену. Селектированные mAbs подвергают затем дальнейшей селекции для получения таких клеток, которые способны индуцировать пролиферацию и активацию лимфоцитов периферической крови.
Для того, чтобы получить mAbs изобретения, выбирают антитела, как описано выше, и затем их еще подвергают дальнейшей селекции для получения таких антител, которые способны вызывать противоопухолевый эффект. Для того, чтобы выбрать такие антитела, обычно может быть использовано раковое модельное животное. Иногда эффект может быть также испытан на различных моделях in vitro. Такая модель может быть, например, любым лабораторным животным, у которого был индуцирован рак. Особенно уместными конкретно при выборе мыши для терапевтического использования у людей являются модели, которые позволяют развиваться опухолям, возникающим у человека. Примеры модельных животных последнего типа представляют иммуносогласованные мыши, например мышь SCID (с тяжелым комбинированным иммунодифицитом) или голая мышь, которой были введены или имплантированы раковые клетки или ткани, полученные от раковых пациентов (человека). В такой селекции способность mAbs уменьшать размер опухоли, увеличивать время выживания и т.д. определяют по сравнению с контролем (аналогичным животным носителем опухоли, но не подвергнутым лечению mAb или подвергнутым лечению не соответствующим mAb).
Селекция может также включать испытание способности mAb’s в соответствующей модели в предотвращении проявления рака. Например, животные, имеющие генетическое предрасположение для развития рака, могут быть подвергнуты введению mAb, и затем распространение и выживание в группе животных, подвергнутых лечению mAb, может быть сравнено с контрольной группой, в остальном подвергнутой лечению и уходу в той же степени. Вместо того, чтобы использовать животных, имеющих генетическое предрасположение для развития рака, способность mAb предотвращать рак может быть испытана у других различных животных, подвергнутых лечению mAb до экспериментального введения злокачественных клеток животному.
Для того, чтобы достигнуть такого противоопухолевого эффекта, в организм следует вводить эффективное количество mAb изобретения. Термин “эффективное количество” должен быть понят как количество mAb, требуемое для достижения терапевтического эффекта. Эффективное количество, требуемое для достижения терапевтического конечного результата, может зависеть от ряда факторов, включающих, например, тип опухоли и тяжесть состояния пациента (т.е. раковое состояние), и вводится ли mAb совместно с другим агентом, который действует вместе с mAb дополнительным или синергетическим образом (относительно такого совместного введения, смотри ниже).
Получение линии иммортализованных клеток, секретирующей mAbs изобретения, может быть проведено с помощью ряда способов per se, таких как слиянием с линией иммортализованных клеток с получением гибридомы; путем EBV трансформации; путем гинетической инженерии линии клеток, например CHO линии клеток, которая может быть достигнута с помощью различных способов известных per se; и т.д. В общем, способ получения линий секретирующих клеток иммортализованных моноклональных антител сегодня является рутинной процедурой, известной специалисту в этой области, и описание его выходит за рамки настоящего описания.
Обычно там, где mAb предназначается для лечения человека, иммуноген будет человеческого происхождения. Однако иногда присутствуют образцы перекрестной отвечаемости, и их также возможно периодически использовать у людей, получивших mAb с последующей иммунизацией нечеловеческим иммуногеном, как например, полученным от примата.
Антитела изобретения должны пониматься как включающие моноклональные антитела, которые могут быть lgG или lgM антителами, могут быть Fab фрагментами таких антител, F(ab’)2 фрагментами, одноцепочечными антителами и им подобными. Кроме того, антитела полученные от нечеловеческого источника, например мышей, могут быть “очеловечены” с помощью различных способов генной инженерии (“очеловеченное” антитело представляет антитело, в котором большинство сегментов были заменены сегментами человеческого происхождения).
Антитела в соответствии с изобретением, в то время как являются полезными для различных терапевтических показаний, используют в соответствии с предпочтительным вариантом изобретения для лечения рака. Было найдено, что моноклональное антитело в соответствии с изобретением является активным в снижении онкогенности различных опухолей.
Характерная линия клеток гибридомы в соответствии с настоящим изобретением расположена в Национальной коллекции культур и организмов (CNCM), Institute pasteur, 25, Rue du Docteur Roux, 75724, Paris, Cedex 15, под номером 1-1397, 28 января 1994. На клетки этой линии здесь иногда ссылаются как на “ВАТ-1 клетки” и на соответствующее моноклональное антитело здесь ссылаются иногда как на “ВАТ-1 mAb”.
Использование моноклонального антитела, имеющего характеристики ВАТ-1 mAb, особенно самого ВАТ-1 mAb, является предпочтительным вариантом изобретения.
ВАТ-1 моноклональное антитело было выбрано, исходя из его способности к прикреплению к клеткам Daudi В лимфобластоидной линии человека. Было найдено, что ВАТ-1 mAb должен привязываться к белковым веществам (названным ниже как “ВАТ-1 связывающий протеин”), имеющим кажущуюся молекулярную массу 48-50К Дальтон, как она определена с помощью SDS-PAGE.
ВАТ-1 связывающий протеин представляет другой аспект настоящего изобретения. ВАТ-1 связывающий протеин может быть выделен с помощью различных методов известных per se, путем использования mAbs изобретения. ВАТ-1 связывающий протеин может быть затем использован для иммунизации животных, от которых может быть затем получен mAbs изобретения.
Настоящее изобретение обеспечивает также фармацевтическую композицию, включающую в качестве активного ингредиента эффективное количество mAb изобретения и физиологически приемлемый носитель.
Дальнейший аспект изобретения представляет способ лечения заболевания или нарушения, конкретно рака, включающий введение субъекту, нуждающему в таком лечении эффективного количества mAb изобретения. Введение mAb обычно проводят путем парентерального введения, например внутривенно (I.v.), интраперитонеально (I.p.) или внутримышечно (i.m.). Носителем для введения может быть любой носитель, известный per se, например солевой раствор или любой другой пригодный физиологический раствор.
Было найдено, что mAb изобретения, как уже отмечалось выше, является активным в снижении онкогенности различных опухолей. Эффективность mAb изобретения в снижении онкогенности коррелирует с его способностью к снижению цитотоксической активности лимфоцитов. Для того, чтобы повысить эту активность, предпочтительным иногда является введение mAb изобретения вместе с другими агентами, которые могут действовать дополнительным или синергетическим образом с mAb. Примеры включают различные цитокины, такие как IL-1 (Интерлейкин- 1), IL-2, IL-6 и IFN- (Интерферон- (Интерферон- ).
mAb изобретения может быть полезным в терапии других чем рак различных заболеваний, где активность или другие эффекты mAb на цитотоксическую активность иммунной системы могут оказывать терапевтический эффект, такой как, например, на ранних стадиях HIV инфекции (вирус, вызывающий синдром приобретенного иммунного дефицита, СПИД (AIDS)), при различных иммунных нарушениях, или в некоторых случаях гинетического или приобретенного иммунного дефицитов.
При лечении рака антитело может быть введено либо вслед за обнаружением первичных или вторичных опухолей у пациента, либо в качестве профилактической терапии пациенту, обладающему высоким риском развития различных форм рака, таких как индивидуальное облучение или таких как гинетическое предрасположение. Аналогично, у пациентов с СПИД, mAb может быть введен инфицированным пациентам, у которых пока не появилось никаких симптомов заболевания, или пациентам с ранними стадиями инфекции HIV.
В дальнейшем, изобретение будет проиллюстрировано различными примерами, описывающими эксперименты, демонстрирующие противораковую терапевтическую активность. Однако должно быть понятно, что это предназначается только для иллюстративных целей и не должно рассматриваться как ограничение.
Фиг. 1 показывает данные проточного цитометрического анализа прикрепления ВАТ моноклональных антител (mAbs) к очищенным T-лимфоцитам человека. Прикрепление ВАТ антител оценивали с помощью второго антитела, несущего флуоресцентную метку, антитела анти-мыши- флуоресцинизоцианат (FITC)-баран.
Фиг. 1a – вариант фона без ВАТ антитела.
Фиг. 1b – антитело анти-CD3.
Фиг. 1c – ВАТ-1.
Фиг. 1d – BAT-5.
Фиг. 1e – ВАТ-2.
Фиг. 1f – ВАТ-4.
Фиг. 2 показывает данные проточного цитометрического анализа моноцитов периферической крови человека (РВМ) (левая часть) и T-клеток Jurkat (правая часть) дважды меченных первоначально антителом, которое является либо ВАТ mAb, либо анти-CD3 mAb и второй раз lgG антителом анти-мыши меченным FITC.
Фиг. 2A – неподвижные (ungated) клетки.
Фиг. 2A(a) – РВМ клетки, которым было введено ВАТ mAb.
Фиг. 2A(b) – РВМ клетки, которым было введено анти-CD3 mAb.
Фиг. 2A(c) – Jurkat T-клетки, которым было введено ВАТ mAb.
Фиг. 2A(d) – Jurkat T-клетки, которым было введено анти-CD3.
Фиг. 2B – подвижные клетки.
Фиг. 2B(а) – РВМ клетки, продвинувшиеся к малым (R1) или большим клеткам (R2).
Фиг. 2B(b) – (R1) клетки, которым было введено ВАТ mAb.
Фиг. 2B(c) – (R1) клетки, которым было введено анти-CD3.
Фиг. 2B(d) – (R2) клетки, которым было введено ВАТ mAb.
Фиг. 2B(e) – (R2) клетки, которым было введено анти-CD3.
Фиг. 3 показывает данные проточного цитометрического анализа поверхности экспрессии ВАТ связывающего протеина и CD3 на РВМ человека, дважды меченнные антителом ВАТ mAb, меченным флуоресцином (FITC), и антителом анти-CD3, меченным PE.
Фиг. 3A – неподвижные клетки.
Фиг. 3A(a)-Becton-Dickinson simultest контроль, использованный в качестве отрицательного контроля.
Фиг. 3A(b)-один РЕ-анти-CD3.
Фиг. 3A(c)-один FITC-BAT mAb.
Фиг. 3F(d) – антитело, дважды меченное FITC-BAT mAb и РЕ-анти- CD3.
Фиг. 3B – подвижные клетки.
Фиг. 3B(а) – клетки РВМ, продвинувшиеся к малым (R1) и большим (R2) клеткам.
Фиг. 3B(b) – (R1) клетки, дважды меченные FITC-BAT mAb и РЕ-анти-CD3.
Фиг. 3B(c) – (R2) клетки, дважды меченные FITC-BAT mAb и РЕ-анти-CD3.
Фиг. 4 показывает данные анализа Western Blot прикрепления BAT-1 антител к различным лизатам клеток Daudi.
Фиг. 4(1) – лизаты из клеток Daudi (которым ничего не было введено).
Фиг. 4(2) – лизаты, в которые введена нейроминидаза (0.2 ед./мл).
Фиг. 4(3) – лизаты, в которые введена нейроминидаза (0.4 ед./мл).
Фиг. 4(4) – лизаты, в которые введен Endo Hf (100 ед./мкг).
Фиг. 5 дает графическое представление результатов введения [3H]тимидина в клетки, культивированные в течение 6 дней в присутствии повышающихся концентраций набора ВАТ ).
mAb изобретения может быть полезным в терапии других чем рак различных заболеваний, где активность или другие эффекты mAb на цитотоксическую активность иммунной системы могут оказывать терапевтический эффект, такой как, например, на ранних стадиях HIV инфекции (вирус, вызывающий синдром приобретенного иммунного дефицита, СПИД (AIDS)), при различных иммунных нарушениях, или в некоторых случаях гинетического или приобретенного иммунного дефицитов.
При лечении рака антитело может быть введено либо вслед за обнаружением первичных или вторичных опухолей у пациента, либо в качестве профилактической терапии пациенту, обладающему высоким риском развития различных форм рака, таких как индивидуальное облучение или таких как гинетическое предрасположение. Аналогично, у пациентов с СПИД, mAb может быть введен инфицированным пациентам, у которых пока не появилось никаких симптомов заболевания, или пациентам с ранними стадиями инфекции HIV.
В дальнейшем, изобретение будет проиллюстрировано различными примерами, описывающими эксперименты, демонстрирующие противораковую терапевтическую активность. Однако должно быть понятно, что это предназначается только для иллюстративных целей и не должно рассматриваться как ограничение.
Фиг. 1 показывает данные проточного цитометрического анализа прикрепления ВАТ моноклональных антител (mAbs) к очищенным T-лимфоцитам человека. Прикрепление ВАТ антител оценивали с помощью второго антитела, несущего флуоресцентную метку, антитела анти-мыши- флуоресцинизоцианат (FITC)-баран.
Фиг. 1a – вариант фона без ВАТ антитела.
Фиг. 1b – антитело анти-CD3.
Фиг. 1c – ВАТ-1.
Фиг. 1d – BAT-5.
Фиг. 1e – ВАТ-2.
Фиг. 1f – ВАТ-4.
Фиг. 2 показывает данные проточного цитометрического анализа моноцитов периферической крови человека (РВМ) (левая часть) и T-клеток Jurkat (правая часть) дважды меченных первоначально антителом, которое является либо ВАТ mAb, либо анти-CD3 mAb и второй раз lgG антителом анти-мыши меченным FITC.
Фиг. 2A – неподвижные (ungated) клетки.
Фиг. 2A(a) – РВМ клетки, которым было введено ВАТ mAb.
Фиг. 2A(b) – РВМ клетки, которым было введено анти-CD3 mAb.
Фиг. 2A(c) – Jurkat T-клетки, которым было введено ВАТ mAb.
Фиг. 2A(d) – Jurkat T-клетки, которым было введено анти-CD3.
Фиг. 2B – подвижные клетки.
Фиг. 2B(а) – РВМ клетки, продвинувшиеся к малым (R1) или большим клеткам (R2).
Фиг. 2B(b) – (R1) клетки, которым было введено ВАТ mAb.
Фиг. 2B(c) – (R1) клетки, которым было введено анти-CD3.
Фиг. 2B(d) – (R2) клетки, которым было введено ВАТ mAb.
Фиг. 2B(e) – (R2) клетки, которым было введено анти-CD3.
Фиг. 3 показывает данные проточного цитометрического анализа поверхности экспрессии ВАТ связывающего протеина и CD3 на РВМ человека, дважды меченнные антителом ВАТ mAb, меченным флуоресцином (FITC), и антителом анти-CD3, меченным PE.
Фиг. 3A – неподвижные клетки.
Фиг. 3A(a)-Becton-Dickinson simultest контроль, использованный в качестве отрицательного контроля.
Фиг. 3A(b)-один РЕ-анти-CD3.
Фиг. 3A(c)-один FITC-BAT mAb.
Фиг. 3F(d) – антитело, дважды меченное FITC-BAT mAb и РЕ-анти- CD3.
Фиг. 3B – подвижные клетки.
Фиг. 3B(а) – клетки РВМ, продвинувшиеся к малым (R1) и большим (R2) клеткам.
Фиг. 3B(b) – (R1) клетки, дважды меченные FITC-BAT mAb и РЕ-анти-CD3.
Фиг. 3B(c) – (R2) клетки, дважды меченные FITC-BAT mAb и РЕ-анти-CD3.
Фиг. 4 показывает данные анализа Western Blot прикрепления BAT-1 антител к различным лизатам клеток Daudi.
Фиг. 4(1) – лизаты из клеток Daudi (которым ничего не было введено).
Фиг. 4(2) – лизаты, в которые введена нейроминидаза (0.2 ед./мл).
Фиг. 4(3) – лизаты, в которые введена нейроминидаза (0.4 ед./мл).
Фиг. 4(4) – лизаты, в которые введен Endo Hf (100 ед./мкг).
Фиг. 5 дает графическое представление результатов введения [3H]тимидина в клетки, культивированные в течение 6 дней в присутствии повышающихся концентраций набора ВАТMabs: BAT-1(- 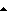 -), BAT-2 (-X-), BAT-3 (- -), BAT-2 (-X-), BAT-3 (- -), BAT-5 (-*-), BAT-6 (- -), BAT-5 (-*-), BAT-6 (-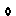 -), BAT-7 -), BAT-7  .
Фиг. 6 дает графическое представление экспериментов, в которых индукция цитотоксической активности была испытана в РВМ культивированных в течение различных интервалов времени 2.5 мкг/мл ВАТ Mabs. В качестве клеток-мишеней были использованы НТ- 29 (слева) клетки или RC-29 (справа) клетки. Отношение эффектора к мишени составляло 20:1 Контроль (-O-), BAT-1 (- .
Фиг. 6 дает графическое представление экспериментов, в которых индукция цитотоксической активности была испытана в РВМ культивированных в течение различных интервалов времени 2.5 мкг/мл ВАТ Mabs. В качестве клеток-мишеней были использованы НТ- 29 (слева) клетки или RC-29 (справа) клетки. Отношение эффектора к мишени составляло 20:1 Контроль (-O-), BAT-1 (- -), BAT-2 (-X-), BAT-3 (- -), BAT-2 (-X-), BAT-3 (-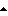 -).
Фиг. 7 показывает легкие, от C57BL мышей, инокулированных клетками миеломы В-16. Верхний ряд показывает легкие мышей, инокулированных только клетками, спустя 24 дня после инокуляции. Нижний ряд показывает легкие мышей инокулированных клетками В-16, как указано выше, с последующим введением через 14 суток внутривенно 10 мкг ВАТ-1 Mabs, спустя 24 часа после инокуляции.
Фиг. 8 является графическим представлением суммарных экспериментальных данных, представленных на фиг. 7, показывающим количество метастаз в легких мышей, которые были инокулированы опухолевыми клетками, являющимися либо клетками миеломы В-16, либо клетками карциномы легкого 3LL Lewis или клетками фибросаркомы МСА 105, спустя месяц после инокуляции. Результаты являются суммой 3-4 экспериментов, проведенных с каждым типом опухоли. Мыши, которым не вводили (-) антитело, или мыши, которым вводили (+) ВАТ-1 (10 мкг/мышь) через 2 недели после введения опухолевых клеток. Метастазы ( -).
Фиг. 7 показывает легкие, от C57BL мышей, инокулированных клетками миеломы В-16. Верхний ряд показывает легкие мышей, инокулированных только клетками, спустя 24 дня после инокуляции. Нижний ряд показывает легкие мышей инокулированных клетками В-16, как указано выше, с последующим введением через 14 суток внутривенно 10 мкг ВАТ-1 Mabs, спустя 24 часа после инокуляции.
Фиг. 8 является графическим представлением суммарных экспериментальных данных, представленных на фиг. 7, показывающим количество метастаз в легких мышей, которые были инокулированы опухолевыми клетками, являющимися либо клетками миеломы В-16, либо клетками карциномы легкого 3LL Lewis или клетками фибросаркомы МСА 105, спустя месяц после инокуляции. Результаты являются суммой 3-4 экспериментов, проведенных с каждым типом опухоли. Мыши, которым не вводили (-) антитело, или мыши, которым вводили (+) ВАТ-1 (10 мкг/мышь) через 2 недели после введения опухолевых клеток. Метастазы ( ): метастазы отсутствуют (о).
Фиг. 9 показывает легкие, полученные от мышей, инокулированных клетками карциномы легкого 3LL Lewis. Аналогично фиг. 7 верхний ряд показывает легкое, инокулированное только клетками опухоли, и нижний ряд показывает легкие мышей, инокулированных внутривенно 14 дней спустя 10 мкг BAT-1 mAbs.
Фиг. 10 показывает эксперимент, аналогичный тому, что показан на фиг. 9, где клетки опухоли представляют клетки фибробластомы МСА 105.
Продуцирование моноклональных антител.
BALB/c мыши были иммунизованы мембранным препаратом клеток Daudi. Мембраны из клеток Daudi были приготовлены с помощью метода глицериновая нагрузка-гипотонический шок (Jett, M. , Seed,T.M., and Jamieson. G.A., J. Biol. Chem. 252: 2134 (1977). 50-80 ): метастазы отсутствуют (о).
Фиг. 9 показывает легкие, полученные от мышей, инокулированных клетками карциномы легкого 3LL Lewis. Аналогично фиг. 7 верхний ряд показывает легкое, инокулированное только клетками опухоли, и нижний ряд показывает легкие мышей, инокулированных внутривенно 14 дней спустя 10 мкг BAT-1 mAbs.
Фиг. 10 показывает эксперимент, аналогичный тому, что показан на фиг. 9, где клетки опухоли представляют клетки фибробластомы МСА 105.
Продуцирование моноклональных антител.
BALB/c мыши были иммунизованы мембранным препаратом клеток Daudi. Мембраны из клеток Daudi были приготовлены с помощью метода глицериновая нагрузка-гипотонический шок (Jett, M. , Seed,T.M., and Jamieson. G.A., J. Biol. Chem. 252: 2134 (1977). 50-80  106 клеток, суспендированных в PBS и инкубированных при 37oC постепенно нагружали 30% глицерина. Через 5 минут инкубации на льду их центрифугировали и ресуспендировали в холодный Трис лизатный буфер (содержащий 10 ммоль/л Трис-HCl, 1 ммоль/л MgCl2, 1 ммоль/л CaCl2, pH 7.4), перемешивали в течение 5 минут при 4oC и центрифугировали при 700 g. Супернатант удаляли и центрифугировали при 3300 g (в течение 10 минут при 4oC). Дебрис промывали вновь и два супернатанта, содержащих мембранную фракцию, собирали. 260 мкл мембранного препарата (3 мг/мл) эмульгировали 260 мкл адьюванта compele Freund и проводили интраперитонеальную инъекцию мышам BALB/c. Спустя три недели удаляли селезенки мышей. Спленоциты подвергали слиянию с линией клеток миеломы NS-0 при отношении 10:1. Слияние проводили, используя полиэтиленгликоль, и гибридомы выращивали в селективной среде согласно Kohler and Milstein (Kohler.G. and Milstein.C., Nature (London) 256: 495 (1975)).
Твердофазный иммуноферментный анализ (ELISA) использовали для определения супернатантов из растущих гибридом (Glassy, M.C. and Surh, C.D., J. lmmunol. Method, 81:115 (1985)), которые прикреплены к клеткам Daudi. Положительные супернатанты гибридом выбирали по их способности индуцировать пролиферацию РВМ человека, используя анализ поглощения [3H]тимидина. Положительные клоны субклонировали с помощью ограниченного разбавления, повторно испытывали и подвергали распластыванию и росту в культуре.
mAbs очищали от среды для культивирования осаждением 50% раствором сульфата аммония с последующим интенсивным диализом по отношению к PBS. Дальнейшую очистку проводили с помощью аффинной хроматографии на колонках с Сефарозой (торговая марка Pharmacia, Sweden) с прикрепленным антителом анти-мыши.
Среда для культивирования.
Все клетки суспендировали в RPMI 164 среде, дополненной 10% фетальной телячьей сывороткой (FCS), Na-пируватом (1.1 мг/мл), L-глутаматом (0.3 мг/мл) и антибиотиками (пеницилином 200 мг/мл и стрептомицином 10 мкг/мл), и инкубировали во влажном инкубаторе с 5% CO2.
IL-2 использованные единицы составляли единицы Cetus (1 единица Cetus равна 3 Международным единицам).
Клеточные препараты.
Моноядерные клетки периферической крови человека (РВМ) получали от взрослых здоровых доноров с помощью фиколл-гипакового центрифугирования (Гистопак, торговая марка Sigma, St. Louis, Missouri, USA). РВМ подвергали элиминации моноцитов с помощью колонок с Сефадексом (торговая марка Pharmacia, Sweden) G10. Т-клетки выделяли с помощью розеткообразного структурного метода SRBC. Элиминацию CD3 положительных клеток и Leu 19 положительных клеток проводили за счет иммуномагнитной техники. Культуры РВМ, инкубированные в течение 5-6 суток ВАТ mAbs, или контрольные культуры промывали три раза PBS. Антитела, неконъюгированные либо к CD3, либо к Leu19(CD56), добавляли к клеткам в полную RPMI среду и инкубировали в течение 1 часа при 4oC. Магнитный бисер, покрытый антителом антимыши, добавляли в течение 30 минут. Клетки, прикрепленные к бисеру, удаляли с помощью магнита, а неприкрепленные клетки окрашивали и анализировали на цитотоксическую активность с помощью проточного цитометрического анализа.
Реакция цитотоксичности.
Реакции цитотоксичности проводили следующим образом: 2-4 106 клеток, суспендированных в PBS и инкубированных при 37oC постепенно нагружали 30% глицерина. Через 5 минут инкубации на льду их центрифугировали и ресуспендировали в холодный Трис лизатный буфер (содержащий 10 ммоль/л Трис-HCl, 1 ммоль/л MgCl2, 1 ммоль/л CaCl2, pH 7.4), перемешивали в течение 5 минут при 4oC и центрифугировали при 700 g. Супернатант удаляли и центрифугировали при 3300 g (в течение 10 минут при 4oC). Дебрис промывали вновь и два супернатанта, содержащих мембранную фракцию, собирали. 260 мкл мембранного препарата (3 мг/мл) эмульгировали 260 мкл адьюванта compele Freund и проводили интраперитонеальную инъекцию мышам BALB/c. Спустя три недели удаляли селезенки мышей. Спленоциты подвергали слиянию с линией клеток миеломы NS-0 при отношении 10:1. Слияние проводили, используя полиэтиленгликоль, и гибридомы выращивали в селективной среде согласно Kohler and Milstein (Kohler.G. and Milstein.C., Nature (London) 256: 495 (1975)).
Твердофазный иммуноферментный анализ (ELISA) использовали для определения супернатантов из растущих гибридом (Glassy, M.C. and Surh, C.D., J. lmmunol. Method, 81:115 (1985)), которые прикреплены к клеткам Daudi. Положительные супернатанты гибридом выбирали по их способности индуцировать пролиферацию РВМ человека, используя анализ поглощения [3H]тимидина. Положительные клоны субклонировали с помощью ограниченного разбавления, повторно испытывали и подвергали распластыванию и росту в культуре.
mAbs очищали от среды для культивирования осаждением 50% раствором сульфата аммония с последующим интенсивным диализом по отношению к PBS. Дальнейшую очистку проводили с помощью аффинной хроматографии на колонках с Сефарозой (торговая марка Pharmacia, Sweden) с прикрепленным антителом анти-мыши.
Среда для культивирования.
Все клетки суспендировали в RPMI 164 среде, дополненной 10% фетальной телячьей сывороткой (FCS), Na-пируватом (1.1 мг/мл), L-глутаматом (0.3 мг/мл) и антибиотиками (пеницилином 200 мг/мл и стрептомицином 10 мкг/мл), и инкубировали во влажном инкубаторе с 5% CO2.
IL-2 использованные единицы составляли единицы Cetus (1 единица Cetus равна 3 Международным единицам).
Клеточные препараты.
Моноядерные клетки периферической крови человека (РВМ) получали от взрослых здоровых доноров с помощью фиколл-гипакового центрифугирования (Гистопак, торговая марка Sigma, St. Louis, Missouri, USA). РВМ подвергали элиминации моноцитов с помощью колонок с Сефадексом (торговая марка Pharmacia, Sweden) G10. Т-клетки выделяли с помощью розеткообразного структурного метода SRBC. Элиминацию CD3 положительных клеток и Leu 19 положительных клеток проводили за счет иммуномагнитной техники. Культуры РВМ, инкубированные в течение 5-6 суток ВАТ mAbs, или контрольные культуры промывали три раза PBS. Антитела, неконъюгированные либо к CD3, либо к Leu19(CD56), добавляли к клеткам в полную RPMI среду и инкубировали в течение 1 часа при 4oC. Магнитный бисер, покрытый антителом антимыши, добавляли в течение 30 минут. Клетки, прикрепленные к бисеру, удаляли с помощью магнита, а неприкрепленные клетки окрашивали и анализировали на цитотоксическую активность с помощью проточного цитометрического анализа.
Реакция цитотоксичности.
Реакции цитотоксичности проводили следующим образом: 2-4  106 клеток мишеней смешивали с 200 мк Ci51Cr-хромата в течение 1 часа в среде, свободной от сыворотки. Клетки три раза промывали полной средой и наконец ресуспендировали в RPMI-10% FCS и высевали 104 клеток в лунку. Эффекторные клетки культивировали, лимфоциты, приготовленные из нормальной периферической крови, инкубировали в течение различных промежутков времени различными mAbs, изотопным контрольным lgG или IL-2. До анализа клетки три раза промывали средой RPMI, окрашивали для визуализации клеток, используя 1%-ный раствор трипанового голубого, смешивали с клетками мишенями при различных отношениях эффектор-мишень в микрометрических планшетах с круглым дном и инкубировали в течение 3 часов при 15-35oC в 5% CO2;. Супернатанты культур собирали и подвергали подсчету в 106 клеток мишеней смешивали с 200 мк Ci51Cr-хромата в течение 1 часа в среде, свободной от сыворотки. Клетки три раза промывали полной средой и наконец ресуспендировали в RPMI-10% FCS и высевали 104 клеток в лунку. Эффекторные клетки культивировали, лимфоциты, приготовленные из нормальной периферической крови, инкубировали в течение различных промежутков времени различными mAbs, изотопным контрольным lgG или IL-2. До анализа клетки три раза промывали средой RPMI, окрашивали для визуализации клеток, используя 1%-ный раствор трипанового голубого, смешивали с клетками мишенями при различных отношениях эффектор-мишень в микрометрических планшетах с круглым дном и инкубировали в течение 3 часов при 15-35oC в 5% CO2;. Супернатанты культур собирали и подвергали подсчету в  -сцинтиляционном счетчике. Максимальное высвобождение изотопа (MR) получают с помощью инкубирования клеток-мишеней с тритоном (торговая марка Sigma, St. Louis, Missouori, USA) x-100. Спонтанное высвобождение (SR) измеряют с помощью инкубации мишеней одной средой. Процентное содержание лизированных клеток рассчитывают с помощью выражения (ER-SR/MR-SR) -сцинтиляционном счетчике. Максимальное высвобождение изотопа (MR) получают с помощью инкубирования клеток-мишеней с тритоном (торговая марка Sigma, St. Louis, Missouori, USA) x-100. Спонтанное высвобождение (SR) измеряют с помощью инкубации мишеней одной средой. Процентное содержание лизированных клеток рассчитывают с помощью выражения (ER-SR/MR-SR) 100, где ER представляет экспериментальное высвобождение эффектора.
Индукция цитотоксичности в субпопуляциях лимфоцитов человека.
РВМ клетки (4 100, где ER представляет экспериментальное высвобождение эффектора.
Индукция цитотоксичности в субпопуляциях лимфоцитов человека.
РВМ клетки (4 106/мл) культивировали в течение 6 дней в присутствии ВАТ mAbs. После этого клетки промывали три раза и клетки CD3 и Leu19 элиминировали с помощью магнитного бисера, покрытого фрагментом f(ab’)2 анти-мыши и испытывали на цитотоксичность по отношению к клеткам К562 и клеткам Daudi.
Проточная цитометрия.
Клеточную поверхность антигенов определяли с помощью проточной цитометрии, используя FACS 440 (Becton-Dickinson). Для каждого анализа использовали 106 клеток. Клетки окрашивали за счет последовательного инкубирования с оптимальной концентрацией мышиного mAb к CD3 человека, IL-2 рецептору или mAb ВАТ 1-9, которые продуцировали. Фрагмент F(ab’)2 анти-мыши, меченный FITC барана, использовали в качестве второго антитела в этом непрямом процессе получения линии. Каждую инкубацию проводили в PDS pH 7.4, содержащем 1% BSA и 0.5% азида Na в течение 30 минут при 4oC и впоследствии трижды промывали тем же самым буфером. Анализировали 104 окрашенных клеток.
Определение ВАТ mAb связывающей детерминанты (нант).
Определение ВАТ mAb связывающей детерминанты (нант) на лизатах B лимфобластоидных клеток Daudi проводили с использованием анализа Western Blot. Кратко, 50 106/мл) культивировали в течение 6 дней в присутствии ВАТ mAbs. После этого клетки промывали три раза и клетки CD3 и Leu19 элиминировали с помощью магнитного бисера, покрытого фрагментом f(ab’)2 анти-мыши и испытывали на цитотоксичность по отношению к клеткам К562 и клеткам Daudi.
Проточная цитометрия.
Клеточную поверхность антигенов определяли с помощью проточной цитометрии, используя FACS 440 (Becton-Dickinson). Для каждого анализа использовали 106 клеток. Клетки окрашивали за счет последовательного инкубирования с оптимальной концентрацией мышиного mAb к CD3 человека, IL-2 рецептору или mAb ВАТ 1-9, которые продуцировали. Фрагмент F(ab’)2 анти-мыши, меченный FITC барана, использовали в качестве второго антитела в этом непрямом процессе получения линии. Каждую инкубацию проводили в PDS pH 7.4, содержащем 1% BSA и 0.5% азида Na в течение 30 минут при 4oC и впоследствии трижды промывали тем же самым буфером. Анализировали 104 окрашенных клеток.
Определение ВАТ mAb связывающей детерминанты (нант).
Определение ВАТ mAb связывающей детерминанты (нант) на лизатах B лимфобластоидных клеток Daudi проводили с использованием анализа Western Blot. Кратко, 50  106 клеток/мл суспендировали в PBS, постепенно нагруженный 30% глицерина, и мембраны отделяли за счет последующего центрифугирования.
Образцы мембранных препаратов отделяли с помощью SDS-PAGE (12%) (метода электрофореза в полиакриламидном геле с додецилсульфатом натрия) и переносили в нитроцеллюлозный планшет, который погружали в 1% раствор молока низкой жирности в PBS. Определение ВАТ mAb связывающего протеина в нитроцеллюлозных планшетах проводили за счет инкубирования планшета с ВАТ mAb в течение 2 часов при комнатной температуре, с последующим инкубированием в течение 30 минут с пероксидазой хрена конъюгированной фрагментом (Fab’)2 антитела 70 IgG анти-мыши. Затем клетки промывали и окрашенные полосы определяли O-дианизидным субстратом.
Модели мышиной опухоли.
Были использованы три модели мышиной опухоли. B16 миелома, карцинома легкого Lewis (3LL) и фиброкарцинома, индуцированная метилхолантреном (МСА 105). 50-200 106 клеток/мл суспендировали в PBS, постепенно нагруженный 30% глицерина, и мембраны отделяли за счет последующего центрифугирования.
Образцы мембранных препаратов отделяли с помощью SDS-PAGE (12%) (метода электрофореза в полиакриламидном геле с додецилсульфатом натрия) и переносили в нитроцеллюлозный планшет, который погружали в 1% раствор молока низкой жирности в PBS. Определение ВАТ mAb связывающего протеина в нитроцеллюлозных планшетах проводили за счет инкубирования планшета с ВАТ mAb в течение 2 часов при комнатной температуре, с последующим инкубированием в течение 30 минут с пероксидазой хрена конъюгированной фрагментом (Fab’)2 антитела 70 IgG анти-мыши. Затем клетки промывали и окрашенные полосы определяли O-дианизидным субстратом.
Модели мышиной опухоли.
Были использованы три модели мышиной опухоли. B16 миелома, карцинома легкого Lewis (3LL) и фиброкарцинома, индуцированная метилхолантреном (МСА 105). 50-200  106 клеток впрыскивали внутривенно (i.v.) мышам C57BL (8-недельного возраста). Спустя две недели вводили ВАТ-1 (внутривенно), 1-10 мкмг/мышь и спустя 10 дней мышей умерщвляли и подсчитывали метастазы легкого.
Пример 1.
а. Характеристики связывания.
Девять моноклональных антител (mAbs), обозначенных ВАТ 1-9, полученных с помощью иммунизации B лимфобластоидных клеток, выбирали сначала для прикрепления к клеткам Daudi и затем для индуцирования пролиферации лимфоцитов периферической крови человека. Изотопы ВАТ mAbs определяли с помощью ELISA и анализа Ochterlony. Было найдено, что ВАТ 1, 2, 3, 6, 7 и 9 представляют класс IgG1, тогда как ВАТ 4 и 5 представляют класс IgM. ВАТ 8 был IgG2a.
Прикрепление вышеуказанных mAbs к очищенным периферическим T клеткам человека анализировали с помощью FACS, используя непрямое иммунофлуоресцентное окрашивание. Фиг. 1 демонстрирует данные анализа FACS такого эксперимента. Как можно видеть, ВАТ mAbs прикрепляется к CD3-T клеткам периферической крови. Количественное содержание этого прикрепления изменяется от ВАТ-2 44%, BAT-5 38%, BAT-1 32% до некоторого ослабления прикрепления у ВАТ-4 (13%). Очищенные В лимфоциты периферичекой крови от тех же самых доноров крови не прикрепляли эти mAbs (данные не показаны).
b. Прикрепление ВАТ-1 mAb к субпопуляциям лимфоцитов человека.
Как видно из фиг. 2, дальнейший анализ FACS показывает, что ВАТ-1 прикрепляет CD3+PBM человека так же, как и линию T-клеток Jurkat. Кроме того, было даже подтверждено, прикрепление ВАТ-1 к CD3+PBM клеткам, с использованием анализа FACS дважды меченных клеток (фиг. 3).
Как видно из таблицы 1, приведенной в конце описания, ВАТ-1 в дополнение к прикреплению его к CD3 несущим клеткам прикрепляется также к Leu 19/NK клеткам.
c. Прикрепление ВАТ mAbs к различным типам клеток.
Было определено прикрепление ВАТ mAbs к различным типам клеток. Как можно видеть из таблицы 2, приведенной в конце описания, ВАТ mAbs прикрепляется к К562, линии клеток эритролейкемии и MCF7, линии клеток карциномы молочной железы человека, в дополнение к их прикреплению к PBL, Daudi и линии Т клеток Jukart. Мера прикрепления изменяется среди ВАТ mAbs и испытанных типов клеток. mAbs 2-9 прикреплялись к клеткам почечной карциномы мыши (MR28) только с очень низкой эффективностью. Только ВАТ-8 прикреплялся к MEL клеткам (клеткам мышиной эритролейкемии), и также с очень низкой эффективностью.
Пример 2 106 клеток впрыскивали внутривенно (i.v.) мышам C57BL (8-недельного возраста). Спустя две недели вводили ВАТ-1 (внутривенно), 1-10 мкмг/мышь и спустя 10 дней мышей умерщвляли и подсчитывали метастазы легкого.
Пример 1.
а. Характеристики связывания.
Девять моноклональных антител (mAbs), обозначенных ВАТ 1-9, полученных с помощью иммунизации B лимфобластоидных клеток, выбирали сначала для прикрепления к клеткам Daudi и затем для индуцирования пролиферации лимфоцитов периферической крови человека. Изотопы ВАТ mAbs определяли с помощью ELISA и анализа Ochterlony. Было найдено, что ВАТ 1, 2, 3, 6, 7 и 9 представляют класс IgG1, тогда как ВАТ 4 и 5 представляют класс IgM. ВАТ 8 был IgG2a.
Прикрепление вышеуказанных mAbs к очищенным периферическим T клеткам человека анализировали с помощью FACS, используя непрямое иммунофлуоресцентное окрашивание. Фиг. 1 демонстрирует данные анализа FACS такого эксперимента. Как можно видеть, ВАТ mAbs прикрепляется к CD3-T клеткам периферической крови. Количественное содержание этого прикрепления изменяется от ВАТ-2 44%, BAT-5 38%, BAT-1 32% до некоторого ослабления прикрепления у ВАТ-4 (13%). Очищенные В лимфоциты периферичекой крови от тех же самых доноров крови не прикрепляли эти mAbs (данные не показаны).
b. Прикрепление ВАТ-1 mAb к субпопуляциям лимфоцитов человека.
Как видно из фиг. 2, дальнейший анализ FACS показывает, что ВАТ-1 прикрепляет CD3+PBM человека так же, как и линию T-клеток Jurkat. Кроме того, было даже подтверждено, прикрепление ВАТ-1 к CD3+PBM клеткам, с использованием анализа FACS дважды меченных клеток (фиг. 3).
Как видно из таблицы 1, приведенной в конце описания, ВАТ-1 в дополнение к прикреплению его к CD3 несущим клеткам прикрепляется также к Leu 19/NK клеткам.
c. Прикрепление ВАТ mAbs к различным типам клеток.
Было определено прикрепление ВАТ mAbs к различным типам клеток. Как можно видеть из таблицы 2, приведенной в конце описания, ВАТ mAbs прикрепляется к К562, линии клеток эритролейкемии и MCF7, линии клеток карциномы молочной железы человека, в дополнение к их прикреплению к PBL, Daudi и линии Т клеток Jukart. Мера прикрепления изменяется среди ВАТ mAbs и испытанных типов клеток. mAbs 2-9 прикреплялись к клеткам почечной карциномы мыши (MR28) только с очень низкой эффективностью. Только ВАТ-8 прикреплялся к MEL клеткам (клеткам мышиной эритролейкемии), и также с очень низкой эффективностью.
Пример 2Анализ ВАТ mAb связывающего сайта и очистка ВАТ-1 связывающего протеина. Для того, чтобы определить молекулярный вес мембранного протеина, который взаимодействует с ВАТ-1 mAbs, мембранный препарат клеток Daudi солюбилизировали и протеин отделяли с помощью SDS-PAGE. Перенесенные на нитроцеллюлозные планшеты инкубировали ВАТ-1 mAb и полосы регистрировали с помощью дальнейшей инкубирации антителом пероксидазы хрена, конъюгированным с (Fab’)2 IgG анти-мыши, и регистрировали, используя O-дианизидиновый субстрат. Было найдено, что молекулярный размер ВАТ-1 связывающего протеина составляет 48-50 кДа (фиг.4). ВАТ mAb связывающий протеин очищали, используя ВАТ mAb, конъюгированный к Сефарозе (торговая марка Pharmacia, Sweden). Этот связывающий протеин может быть также приготовлен за счет клонирования, используя приемы молекулярной биологии. Введение ВАТ-1 in vivo мышам приводило к индуцированию ВАТ антител. Пример 3. Функциональные характеристики ВАТ mAbs. а. ВАТ mAbs, индуцированный введением тимидина. Клетки периферической крови человека культивировали в течение 6 дней в присутствии увеличивающихся концентраций набора ВАТ mAbs и проводили импульсное мечение [3H]тимидином в течение 20 часов до сбора клеток. Как видно из фиг. 5, постепенное увеличение концентрации ВАТ mAbs приводит в результате к скромному, но значительному увеличению введения [3H] тимидина в РВМ клетки. Однако высокая доза антититела вызывает снижение поглощения клетками. В контрольных экспериментах антитела, меченные изотопом, не увеличивают [3H]тимидин в PBL клетках, указывая на то, что агонистическое влияние ВАТ mAbs зависит от его связывающих специфических свойств. Например, mAb изотопа IgG, который был выращен в нашей лаборатории, по отношению к овариановым клеткам карциномы не вызывал увеличения поглощения [3H]тимидина, в противоположность ВАТ 1, 2, 3, 6, 7 и 9 mAbs, которые также принадлежат к IgG1 классу. b. Индуцирование цитотоксичности ВАТ mAbs в РВМ человека. Культуры моноядерных клеток периферической крови человека, инкубированные ВАТ mAbs в течение различных промежутков времени, испытывали на их способность к лизированию линии опухолевых клеток. Как видно из таблицы 3, приведенной в конце описания, клетки РВМ человека, инкубированные в течение одной недели пробами ВАТ mAbs, обладали цитотоксичностью по отношению к К562, эритролейкемии человека (NK чувствительным) и RC-29, линии клеток почечной карциномы (NK резистентной). Исследовали кинетику повышения цитотоксической активности РВМ человека, которая была стимулирована ВАТ mAbs. Как видно из фиг. 6 максимальную цитотоксичность по отношению к колонии клеток карциномы человека (НТ-29) и почечных клеток карциномы (RC-29) достигали после 7 суток инкубации РВМ человека ВАТ mAbs. с. Характеристики субпопуляции лимфоцита, включенного в ВАТ-индуцированную цитотоксичность. Для того, чтобы оценить, увеличивается ли цитотоксическая активность РВМ человека, индуцированная с помощью ВАТ mAbs, благодаря активации NK клеток, T клеток или тех и других, NK и T клетки очищали и определяли их цитотоксичность, индуцированную ВАТ. Для очистки NK и T клеток Leu 19 и CD3 моноклональные антитела инкубировали клетками РВМ человека с последующей инкубацией магнитным бисером покрытым анти-мышь IgG. Это приводило к элиминации субпопуляций клеток, которые прикреплены к соответствующему антителу. Как видно из таблицы 4, приведенной в конце описания, количество литических единиц увеличивается и в случае элиминации культур клеток CD3 и в случае элиминации культур клеток Leu 19. В этих экспериментах были использованы ВАТ 6 и 8 и клетки-мишени были клетками эритролейкемии человека (К562) и лимфомы человека (Daudi). Пример 4 Синергизм между BAT mAb и IL-2 в индуцировании цитотоксичности. Индуцирование цитотоксичности в РВМ человека изучали при инкубации клеток РВМ комбинацией ВАТ mAb и IL-2. IL-2 при субоптимальных концентрациях (1 U/мл) добавляли вместе с повышающимися концентрациями ВАТ-2 mAb. Цитотоксичность определяли спустя одну неделю в культуре по отношению к линиям опухолевых клеток К562 и НТ29. Как показано в таблице 5, приведенной в конце описания, низкие концентрации ВАТ-2 действуют синергетически с IL-2 в индуцировании цитотоксичности клеток РВМ по отношению к обоим типам клеток мишеней. Ранее было показано, что INF-  усиливает экспрессию антигенов класса МНС-1. Поэтому введение INF- усиливает экспрессию антигенов класса МНС-1. Поэтому введение INF- сопровождается, вероятно, потенциальным анти-опухолевым эффектом ВАТ, который требует вмешательства за счет цитотоксических клеток, направленных против различных опухолевых клеток (несущих антигены класса МНС).
Пример 5 сопровождается, вероятно, потенциальным анти-опухолевым эффектом ВАТ, который требует вмешательства за счет цитотоксических клеток, направленных против различных опухолевых клеток (несущих антигены класса МНС).
Пример 5Иммуностимуляторные эффекты BAT-1 мыши: а. Исследования in vitro. mAb BAT-1 демонстрирует стимуляторные свойства у мышиных спленоцитов, подобные тем, какие наблюдают в PBL: человека. Они включают: (i) Повышенную пролиферацию спленоцита in vitro, как она определена с помощью введения 3H тимидина (таблица 6); (ii) Синергетический стимуляторный эффект за счет инкубации спленоцитов комбинацией ВАТ-1 и IL-2 (таблица 6); (iii) Повышенную цитотоксичность в мышиной культуре спленоцитов в присутствии ВАТ-1 и дальнейшее повышение цитотоксичности при инкубации в присутствии IL-2 (таблица 7). C57BL мышиные спленоциты, инкубированные в течение 5 дней in vitro различными концентрациями BAT-1 и в комбинации с интерлейкином-2 (1u и 10 u на мл). Индуцирование цитотоксичности в C57BL культурах спленоцитов, инкубированных в течение 5 дней in vitro в присутствии различных концентраций ВАТ-1 и в комбинации с низкими дозами интерлейкина-2. Отношение эффектора к мишени равно 50:1 Мышиные опухолевые клетки-мишени, которые были восприимчивы к умерщвляющему эффекту ВАТ-1 активированными спленоцитами, включают: В16 миелому, карциному легкого Lewis (3LL), фибросаркому (MCA 105), почечную клеточную карциному (MR 28) и лимфому (YAC) (таблица 8). Цитотоксичность определяли при отношении эффектор/мишень 60:1. b. Исследования in vitro. Как показано в таблице 9, приведенной в конце описания , ВАТ-1 проявляет иммуностимуляторные эффекты при введении in vitro. Они включают: (i) Стимулирование включения [3H]тимидина в спленоциты от мыши, которой вводили ВАТ-1 за 10 дней до этого (таблица 9A). Максимальное стимулирование (10-кратное) достигали при введении ВАТ с дозами 10 мкг/мышь. (ii) Индуцирование цитотоксичности в спленоцитах от мыши, которой вводили ВАТ-1 (таблица 9B). ВАТ-1 введенный в различных дозах за 10 дней до анализа на цитотоксичность, индуцировал цитотоксичность по отношению к клеткам миеломы мыши (B16-F10), ренальным клеткам карциномы (bR-28) и клеткам лимфомы (YAC). Максимальный эффект достигали при введении ВАТ в дозе 10 мкг/мышь. Мышам C57BL и BALB/c была введена инъекция внутривенно ВАТ mAb в различных концентрациях. 10 дней спустя определяли цитотоксичность и включение [3H]тимидина в выделенных спленоцитах. Спленоциты от мыши C57BL были испытаны на B16 клетки-мишени миеломы и от мыши BALB/c были испытаны на MR-28 и YAC клетках (отношение эффектор: мишень 50:1). Каждая группа содержала от 6 до 16 мышей в 3-4 раздельных экспериментах. Цитотоксичность и включение [3H] тимидина для каждой мыши были определены три раза и значения расчитаных результатов выражали как значение  стандартная ошибка n мышей, даны p-величины, представляющие разницу между контролем и данными для животных, которым вводили ВАТ.
Пример 6 стандартная ошибка n мышей, даны p-величины, представляющие разницу между контролем и данными для животных, которым вводили ВАТ.
Пример 6Иммунотерапевтический эффект ВАТ-1 по отношению к опухолям мыши. Как видно из таблицы 10, введение ВАТ-1 мышам, инокулированным меланомой, на 14 сутки после инокуляции опухолевых клеток снижает количество метастаз легкого в легких у мышей, у которых присутствовали опухоли В16, 3LL и МСА. a1. Устранение с помощью ВАТ-1 метастаз легкого у мышей с B16 инокулированной миеломой, используя установленную модель метастаз легкого. C57BL мышам была проведена инъекция (внутривенная) 50  103 клеток миеломы B16 (таблица 10). Как видно на фиг. 7, верхний ряд, на 24 день после инъекции развивается большое число метастаз в легких (практически достигается слияние).
В противоположность этому, как видно на фиг. 7, нижний ряд, легкое мыши, которой была проведена инъекция ВАТ-1 (10 мкг/мышь) через две недели после инокуляции миеломой B16, практически свободно от метастаз.
Фиг. 8 суммирует результаты шести раздельных экспериментов, проведенных в подобных условиях, как указано выше.
a2. Противоопухолевый эффект ВАТ-1 mAb. инъекцию которого проводили в различное время, относительно инокуляции B16 опухоли.
Как видно из таблицы 11, мыши, которым были проведены инъекции клеток миеломы и затем через 10-14 дней спустя был введен ВАТ-1 mAb, были свободны от метастаз и имели нормальные веса легких. Заметное снижение количества метастаз в легких мышей, хотя и не полное, было замечено через 5 дней после инокуляции и только через 19 дней после введения опухоли. Инъекция ВАТ-1 в тот же день, что и инокуляции опухолевых клеток не оказывала терапевтического эффекта.
б. Устранение метастаз легкого с помощью ВАТ у мышей Lewis, которым инокулирована карцинома легкого (3LL), используя установленную модель метастаз легкого.
Экспериментальные условия были аналогичны условиям, описанным для миеломы B16 (смотри выше), за исключением того, что проводили инъекцию 2 103 клеток миеломы B16 (таблица 10). Как видно на фиг. 7, верхний ряд, на 24 день после инъекции развивается большое число метастаз в легких (практически достигается слияние).
В противоположность этому, как видно на фиг. 7, нижний ряд, легкое мыши, которой была проведена инъекция ВАТ-1 (10 мкг/мышь) через две недели после инокуляции миеломой B16, практически свободно от метастаз.
Фиг. 8 суммирует результаты шести раздельных экспериментов, проведенных в подобных условиях, как указано выше.
a2. Противоопухолевый эффект ВАТ-1 mAb. инъекцию которого проводили в различное время, относительно инокуляции B16 опухоли.
Как видно из таблицы 11, мыши, которым были проведены инъекции клеток миеломы и затем через 10-14 дней спустя был введен ВАТ-1 mAb, были свободны от метастаз и имели нормальные веса легких. Заметное снижение количества метастаз в легких мышей, хотя и не полное, было замечено через 5 дней после инокуляции и только через 19 дней после введения опухоли. Инъекция ВАТ-1 в тот же день, что и инокуляции опухолевых клеток не оказывала терапевтического эффекта.
б. Устранение метастаз легкого с помощью ВАТ у мышей Lewis, которым инокулирована карцинома легкого (3LL), используя установленную модель метастаз легкого.
Экспериментальные условия были аналогичны условиям, описанным для миеломы B16 (смотри выше), за исключением того, что проводили инъекцию 2  105 клеток 3LL. Фиг. 9, верхний ряд, показывает легкие от мышей, инокулированных 3LL с многочисленными метастазами. Фиг. 9, нижний ряд, показывает легкие от мышей, которые были инокулированы клетками опухоли с последующим введением через 14 дней ВАТ-1, которые как видно почти свободны от метастаз.
с. Устранение метастаз легкого у мышей, которым инокулирована МСА фибросаркома (МСА 105), испольуя установленную модель метастаз легкого.
Экспериментальные условия были аналогичны условиям, описанным для модели карциномы легкого 3LL Lewis. Фиг. 10, верхний ряд, показывает легкие от мышей, инокулированных МСА 105 с многочисленными метастазами. Фиг. 10, нижний ряд, показывает легкие от мышей, которые были инокулированы клетками опухоли с последующим введением ВАТ-1, которые, как видно, почти свободны от метастаз.
Пример 7.
Лечение с помощью ВАТ-1 мышей, у которых присутствуют опухоли В16 и 3LL.
Мыши, инокулированные клетками миеломы В 16 или клетками 3LL, как описано выше, погибали в течение 25-35 дней после инокуляции опухоли. В противоположность этому, как видно из фиг. 11, все мыши, которые были подвергнуты инъекции ВАТ-1 (10 мкг/мышь) через 14 дней после инокуляции опухоли, жили свыше 100 дней. Большинство животных, за которыми следили вплоть до 5 месяцев, не обнаруживали симптомов болезни и при патологических исследованиях не обнаруживалось метастаз.
Пример 8 105 клеток 3LL. Фиг. 9, верхний ряд, показывает легкие от мышей, инокулированных 3LL с многочисленными метастазами. Фиг. 9, нижний ряд, показывает легкие от мышей, которые были инокулированы клетками опухоли с последующим введением через 14 дней ВАТ-1, которые как видно почти свободны от метастаз.
с. Устранение метастаз легкого у мышей, которым инокулирована МСА фибросаркома (МСА 105), испольуя установленную модель метастаз легкого.
Экспериментальные условия были аналогичны условиям, описанным для модели карциномы легкого 3LL Lewis. Фиг. 10, верхний ряд, показывает легкие от мышей, инокулированных МСА 105 с многочисленными метастазами. Фиг. 10, нижний ряд, показывает легкие от мышей, которые были инокулированы клетками опухоли с последующим введением ВАТ-1, которые, как видно, почти свободны от метастаз.
Пример 7.
Лечение с помощью ВАТ-1 мышей, у которых присутствуют опухоли В16 и 3LL.
Мыши, инокулированные клетками миеломы В 16 или клетками 3LL, как описано выше, погибали в течение 25-35 дней после инокуляции опухоли. В противоположность этому, как видно из фиг. 11, все мыши, которые были подвергнуты инъекции ВАТ-1 (10 мкг/мышь) через 14 дней после инокуляции опухоли, жили свыше 100 дней. Большинство животных, за которыми следили вплоть до 5 месяцев, не обнаруживали симптомов болезни и при патологических исследованиях не обнаруживалось метастаз.
Пример 8Заимствованный перенос спленоцитов от мышей, которым вводили ВАТ-1 mAb. Спленоциты от мышей, которым вводили один BAT-1 mAb, или сначала проводили инъекции клеток миеломы В16 и затем вводили ВАТ- 1 mAb, переносили мышам-реципиентам. Мыши-реципиенты были инокулированы либо клетками миеломы В16, либо опухолевыми клетками 3LL. Как видно из таблицы 12, приведенной в конце описания, заимсвованный перенос спленоцитов от мыши, которой вводили ВАТ-1 mAb, индуцировал регрессию опухоли у мышей, которые имели опухоль, получая перенесенные спленоциты. Наиболее эффективного лечения достигали, когда 103 спленоцитов мышей, которые одновременно были инокулированы и клетками миеломы В16 и через 14 дней, инъекцией ВАТ-1 были заимствованно перенесены мышам-реципиентам несущим опухоль. Как видно из таблицы 12, в этом случае, имело место полное отсутствие опухолевых клеток миеломы у реципиентов, несущих опухоль В16, и заметная регрессия опухоли у реципиентов, несущих опухоль 3LL, как представлено количеством метастаз и весом легкого. Эти результаты показывают, что одни спленоциты от мышей, инокулированных B16 и введением ВАТ-1, обладают противоопухолевым эффектом по отношению к обоим типам опухолей и B16, и 3LL. Поэтому вероятно, что ВАТ-1 усиливает неспецифические клеточные эффекторные механизмы. Кроме того, присутствие опухолей приводит к потенциальному усилению ВАТ-1 индуцированной генерации таких эффекторных клеток. Формула изобретения
РИСУНКИ
|
||||||||||||||||||||||||||
