Патент на изобретение №2155188
|
||||||||||||||||||||||||||
(54) ПРОИЗВОДНЫЕ НАФТАЛИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ
(57) Реферат: (57) Описываются новые производные нафталина общей формулы (I) в которой R1 представляет собой карбоксильную или защищенную карбоксильную группу, R2 представляет собой водород, гидроксильную или защищенную гидроксильную группу, R3 представляет собой водород, гидроксильную группу, защищенную гидроксильную группу, низший алкил или галоген, R4 представляет собой водород или галоген, А1 представляет собой низший алкилен, А2 представляет собой связь или низший алкилен, R5 представляет собой группу, где R6 представляет собой моно(или ди- или три-)арил(низший)алкил, и Z представляет собой N или СН) или -А3-Q (R7) (R8), где значения А3, Q, R7 и R8 указаны в п. 1 формулы изобретения. Соединения обладают фармакологической активностью такой как ингибирующей, гипотензивной и являются агонистами простагландинов I2. Описываются также фармацевтические композиции на их основе. 2 c. и 4 з. п. ф-лы. 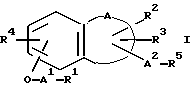 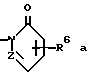
Изобретение относится к новым производным нафталина и их фармацевтически приемлемым солям, которые являются полезными в качестве лекарственных средств. Известны некоторые производные нафталина, такие, какие описаны, например, в европейском патенте 05422032A. Настоящее изобретение относится к новым производным нафталина. Точнее, настоящее изобретение относится к новым производным нафталина и их фармацевтически приемлемым солям, которые обладают фармакологической активностью, такой как ингибирующая активность, гипотензивная активность или подобная активность, и являются агонистами простагландинов I2, к способам их получения, к фармацевтическим композициям, содержащим упомянутые вещества, и к применению их для производства лекарственных препаратов. Соответственно, предметом настоящего изобретения являются новые и полезные производные нафталина и их фармацевтически приемлемые соли. Другой целью настоящего изобретения является способ получения производных нафталина и их солей. Еще одним предметом настоящего изобретения является фармацевтическая композиция, содержащая, в качестве активного ингредиента, упомянутые производные нафталина или их фармацевтически приемлемые соли. Еще одной целью настоящего изобретения является применение производных нафталина и их фармацевтически приемлемых солей в производстве лекарственных препаратов для лечения и/или профилактики закупорки артерии, заболеваний мозговых сосудов, цирроза печени, артериосклероза, ишемической болезни сердца, рестеноза после чреcкожной люминальной коронарной ангиопластики, гипертензии или подобных заболеваний. Производные нафталина настоящего изобретения могут быть представлены следующей формулой (I) 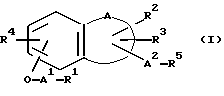 в которой R1 представляет собой карбоксильную или защищенную карбоксильную группу, R2 представляет собой водород, гидроксильную или защищенную гидроксильную группу, R3 представляет собой водород, гидроксильную группу, защищенную гидроксильную группу, низший алкил или галоген, R4 представляет собой водород или галоген, A1 представляет собой низший алкилен, A2 представляет собой связь или низший алкилен, R5 представляет собой 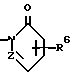 где R6 представляет собой моно (или ди- или три-) арил (низший) алкил и Z представляет собой N или CH или 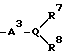 где -A3 представляет собой  или или 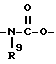 , ,где R9 представляет собой водород или низший алкил, Q представляет собой N или CH, R7 представляет собой арил, R8 представляет собой арил и 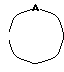 представляет собой представляет собой 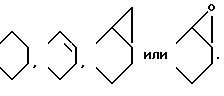 В соответствии с настоящим изобретением, новые производные нафталина (1) могут быть получены способами, которые иллюстрируются схемами (способы 1 – 6), представленными в конце текста. Здесь R1, R2, R3, R4, R5, R7, R8, R9, A1, A2, Q и  имеют установленные выше значения, имеют установленные выше значения,X1 представляет собой кислотный остаток, Ra1 представляет собой защищенную карбоксильную группу, X2 представляет собой галоген, X3 представляет собой галоген, X4 представляет собой галоген и R9a представляет собой низший алкил. Некоторые из исходных соединений являются новыми соединениями и могут быть получены способами, которые иллюстрируются схемами (способы А-T), представленными в конце текста. Здесь R1, R2, R3, R4, R5, R6, R7, R8, R9, A1, A2, Z, Q, X1, X3 или  имеют установленные выше значения, имеют установленные выше значения,R10 представляет собой водород или группу, защищающую гидроксильную группу, R11 представляет собой отщепляющуюся группу, R12 представляет собой карбоксильную или защищенную карбоксильную группу, A4 представляет собой связь или C1-5-алкилен, Ra13 представляет собой галоген, R13 представляет собой водород или галоген, X5 представляет собой галоген, R10a представляет собой группу, защищающую гидроксильную группу, X6 представляет собой кислотный остаток, X7 представляет собой галоген, R14 представляет собой низший алкил, или арил, который может иметь подходящий заместитель (заместители), R15 представляет собой низший алкил, X8 представляет собой галоген, Ra4 представляет собой галоген и R16 является группой, защищающей аминогруппу. Подходящие фармацевтически приемлемые соли целевого соединения (1) являются обычными нетоксичными солями и включают соли металлов, такие как соли щелочных металлов (например, натриевые соли, калиевые соли, и т.п.) и соли щелочноземельных металлов (например, кальциевые соли, магниевые соли, и т.п. ), соли аммония, соли органических оснований (например, соли триметиламина, соли триэтиламина, соли пиридина, соли пикорлина, соли дициклогексиламина, соли N,N-дибензилэтилендиамина, и т.п.), соли органических кислот (например, ацетаты, малеаты, тартраты, метансульфонаты, бензолсульфонаты, формиаты, толуолсульфонаты, трифторацетаты, и т. п. ), соли неорганических кислот (например, гидрохлориды, гидробромиды, сульфаты, фосфаты, и т.п.), соли с аминокислотами (например, с аргинином, аспарагиновой кислотой, глутаминовой кислотой, и т.п.) и так далее. Подходящие примеры и иллюстрации различных определений, которые включаются в объем настоящего изобретения в вышеприведенных и последующих разделах настоящего описания, подробно поясняются далее. Термин “низший” предназначается для обозначения от 1 до 6 атомов углерода, если нет других указаний. Подходящие “арил” и “арильная группа” в термине “моно(или ди- или три-) арил (низший) алкил” могут включать фенил, нафтил и подобные группы. Подходящий “низший алкилен” может включать линейный или разветвленный алкилен, содержащий от 1 до 6 атомов углерода, такой как метилен, этилен, триметилен, тетраметилен, пентаметилен, гексаметилен, или подобные группы, предпочтительно алкилен, содержащий от 1 до 3 атомов углерода. Подходящий C1-5-алкилен” может включать линейный или разветвленный алкилен, содержащий от 1 до 5 атомов углерода, такой как метилен, этилен, триметилен, тетраметилен, пентаметилен, или подобные группы. Подходящие “низший алкил” и “низшая алкильная группа” в термине “моно (или ди- или три-) арил (низший) алкил” могут включать линейный или разветвленный алкил, содержащий от 1 до 6 атомов углерода, такой как метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, трет-пентил, гексил, или подобные группы, предпочтительно алкил, содержащий от 1 до 4 атомов углерода. Подходящая “защищенная карбоксильная группа” может представлять собой эстерифицированную карбоксильную группу и подобные группы. Подходящими примерами сложноэфирной группы, эстерифицированной карбоксильной группы могут быть группы, такие как сложный низший алкиловый эфир (например, метиловый эфир, этиловый эфир, пропиловый эфир, изопропиловый эфир, бутиловый эфир, изобутиловый эфир, трет-бутиловый эфир, пентиловый эфир, гексиловый эфир и т.п.), который может содержать по крайней мере один подходящий заместитель, например алканоилокси (низший) алкиловый сложный эфир (например, ацетоксиметиловый эфир, пропионилоксиметиловый эфир, бутирилоксиметиловый эфир, валерилоксиметиловый эфир, пивалоилоксиметиловый эфир, гексаноилоксиметиловый эфир, 1 (или 2)- ацетоксиэтиловый эфир, 1 (или 2, или 3)-ацетоксипропиловый эфир, 1 (или 2, или 3, или 4)-ацетоксибутиловый эфир, 1 (или 2)- пропионилоксиэтиловый эфир, 1 (или 2, или 3)-пропионилоксипропиловый эфир, (1 или 2)-бутирилоксиэтиловый эфир, 1 (или 2)- изобутирилоксиэтиловый эфир, 1 (или 2)-пивалоилоксиэтиловый эфир, 1 (или 2)-гексаноилоксиэтиловый эфир, изобутирилоксиметиловый эфир, 2-этилбутирилоксиметиловый эфир, 3,3-диметилбутирилоксиметиловый эфир, 1 (или 2)-пентаноилоксиэтиловый эфир, и т.п.), низший алкилсульфонил(низший)алкиловый сложный эфир (например, 2- мезилэтиловый эфир, и т.п.), моно(или ди, или три)-галоген (низший) алкиловый сложный эфир (например, 2-иодэтиловый эфир, 2,2,2- трихлорэтиловый эфир, и т.п.), низший алкоксикарбонилокси(низший)алкиловый сложный эфир (например, метоксикарбонилоксиметиловый эфир, этоксикарбонилоксиметиловый эфир, 2-метоксикарбонилоксиэтиловый эфир, 1- этоксикарбонилоксиметиловый эфир, 1- изопропоксикарбонилоксиэтиловый эфир, и т.п.), фталидилиден (низший) алкиловый сложный эфир или (5-(низший алкил)-2-оксо-1,3- диоксол-4-ил) (низший) алкиловый сложный эфир (например, (5-метил-2-оксо-1,3-диоксол-4-ил) метиловый эфир, (5-этил-2-оксо-1,3-диоксол-4-ил) метиловый эфир, (5-пропил-2-оксо-1,3-диоксол-4-ил)этиловый эфир, и т.п.), низший алкениловый сложный эфир (например, виниловый эфир, аллиловый эфир и т.п.), низший алкиниловый сложный эфир (например, этиниловый эфир, пропиниловый эфир, и т.п.), ар(низший)алкиловый сложный эфир, который может содержать по крайней мере один подходящий заместитель, такой как моно(или ди или три)-фенил (низший) алкиловый эфир, который может содержать по крайней мере один подходящий заместитель (например, бензиловый эфир, 4-метоксибензиловый эфир, 4-нитробензиловый эфир, фенетиловый эфир, тритиловый эфир, бензгидриловый эфир, бис (метоксифенил) метиловый эфир, 3,4-диметоксибензиловый эфир, 4-гидрокси-3,5-ди-трет-бутилбензиловый эфир, и т.п.), ариловый сложный эфир, который может содержать по крайней мере один подходящий заместитель (например, фениловый эфир, 4-хлорфениловый эфир, толиловый эфир, трет-бутилфениловый эфир, ксилиловый эфир, мезитиловый эфир, кумениловый эфир, и т.п.), фталидиловый сложный эфир, и подобные эфиры. Подходящий “кислотный остаток” может включать галоген (например, хлор, бром, иод, и т.п.), сульфонилоксигруппу (например, метилсульфонилоксигруппу, фенилсульфонилоксигруппу, толилсульфонилоксигруппу, и т.п.), и подобные группы. Подходящая “защищенная гидроксильная группа” может представлять собой ацилоксигруппу и подобные группы. Подходящая “ацильная группа” в термине “ацилоксигруппа” может включать алифатическую ацильную группу и ацильную группу, содержащую ароматическое или гетероциклическое кольцо. Также подходящими примерами упомянутой ацильной группы могут являться низший алканоил (например, формил, ацетил, пропионил, бутирил, изобутирил, валерил, изовалерил, оксалил, сукцинил, пивалоил, и т.п.), низший алкоксикарбонил (например, метоксикарбонил, этоксикарбонил, пропоксикарбонил, 1-циклопропилэтоксикарбонил, изопропоксикарбонил, бутоксикарбонил, трет-бутоксикарбонил, пентилоксикарбонил, гексилоксикарбонил, и т.п.), низший алкансульфонил (например, мезил, этансульфонил, пропансульфонил, изопропансульфонил, бутансульфонил, и т.п.), аренсульфонил (например, бензолсульфонил, тозил, и т.п.), ароил (например, бензоил, толуил, ксилоил, нафтоил, фталоил, инданкарбонил, и т.п.), ар(низший) алканоил (например, фенилацетил, фенилпропионил, и т.п.), ар(низший) алкоксикарбонил (например, бензилоксикарбонил, фенетилоксикарбонил, и т.п.), и подобные группы. Подходящий “галоген” может представлять собой хлор, бром, йод и фтор. Подходящий “отщепляющейся группой” может являться низшая алкоксигруппа (например, метокси-, этокси-, пропокси-, изопропокси-, бутоксигруппа и т.п. ), и подобные группы. Подходящий заместитель в определении “арил, который может содержать подходящий заместитель (заместители) ” может включать низший алкил, примеры которого приводятся выше, и подобные группы. Подходящая “группа, защищающая аминогруппу” может представлять собой ацильную группу, примеры которой приводятся выше, моно(или ди- или три-) арил (низший) алкил и подобные группы. Подходящая “группа, защищающая гидроксильную группу” может представлять собой низший алкил, примеры которого приводятся выше, силил, который может иметь от одного до трех подходящих заместителей, и подобные группы. Подходящий “заместитель” в определении “силил, который может иметь от одного до трех подходящих заместителей” может представлять собой низший алкил, примеры которого приводятся выше, арил, примеры которого приводятся выше, и подобные группы. Предпочтительными вариантами целевого соединения (1) являются соединения, в которых R1 представляет собой карбоксильную или защищенную карбоксильную группу (предпочтительнее – эстерифицированную карбоксильную группу, наиболее предпочтительно – низший алкоксикарбонил, R2 представляет собой водород, гидроксильную или защищенную гидроксильную группу (предпочтительнее – ацилоксигруппу), R3 представляет собой водород, гидроксильную группу, защищенную гидроксильную группу (предпочтительнее – ацилоксигруппу), низший алкил или галоген, R4 представляет собой водород или галоген, A1 представляет собой низший алкилен (предпочтительно – C1-3-алкилен, наиболее предпочтительно – метилен), A2 представляет собой связь или низший алкилен (предпочтительно C1-3-алкилен, наиболее предпочтительно – метилен или этилен), R5 представляет собой 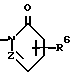 (где R6 представляет собой диарил (низший) алкил (предпочтительнее – дифенил (низший) алкил, наиболее предпочтительно – дифенилметил), и Z представляет собой N или CH), или 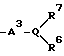 (где -A3 представляет собой 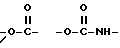 или 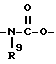 (где R9 представляет собой водород или низший алкил), Q представляет собой N или CH, R7 представляет собой арил (предпочтительнее – фенил), и R8 представляет собой арил (предпочтительнее – фенил), и 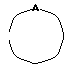 представляет собой представляет собой 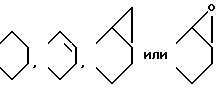 Способы получения целевых и исходных соединений настоящего изобретения подробнее поясняются далее. Способ 1 Соединение (I) или его соль могут быть получены путем взаимодействия соединения (II) или его соли с соединением (III) или его солью. Эту реакцию обычно осуществляют в растворителе, таком как ацетонитрил, бензол, N, N-диметилформамид, тетрагидрофуран, метиленхлорид, этиленхлорид, хлороформ, диэтиловый эфир, или в любом другом растворителе, который не оказывает вредного влияния на реакцию. Температура реакции не является критическим параметром, и реакцию обычно осуществляют в условиях от охлаждения до нагревания. Реакцию обычно осуществляют в присутствии основания. Подходящим основанием может являться неорганическое основание, такое как гидроксид щелочного металла (например, гидроксид натрия, гидроксид калия, и т. п. ), гидроксид щелочноземельного металла (например, гидроксид магния, гидроксид кальция, и т.п.), карбонат щелочного металла (например, карбонат натрия, карбонат калия, и т.п.), бикарбонат щелочного металла (например, бикарбонат натрия, бикарбонат калия, и т.п.), карбонат щелочноземельного металла (например, карбонат магния, карбонат кальция и т.п.) или подобное соединение, и органическое основание, такое как три (низший) алкиламин (например, триметиламин, триэтиламин, диизопропилэтиламин, и т. п. ), ди(низший)алкиланилин (например, диметиланилин, и т.п.), пиридин или подобное соединение. Способ 2 Соединение (1б) или его соль могут быть получены, когда соединение (1а) или его соль подвергают реакции элиминирования группы, защищающей карбоксильную группу. Подходящим способом осуществления такой реакции может являться обычный способ, такой как гидролиз, восстановление, и подобные способы. (I) Гидролиз Гидролиз осуществляют, предпочтительно, в присутствии основания или кислоты, в том числе кислоты Льюиса. Подходящим основанием может являться неорганическое основание и органическое основание, такое как щелочной металл (например, натрий, калий, и т.п. ), гидроксид или карбонат или бикарбонат щелочного металла, триалкиламин (например, триметиламин, триэтиламин, и т. п.), пиколин, 1,5-диазабицикло[4.3.0] нон-5-ен, 1,4-диазабицикло[2.2.2] октан, 1,8-диазабицикло[5.4.0] ундек-7-ен, или подобное соединение. Подходящей кислотой может являться органическая кислота (например, муравьиная кислота, уксусная кислота, пропионовая кислота, трихлоруксусная кислота, трифторуксусная кислота, и т.п.) и неорганическая кислота (например, хлористоводородная кислота, бромистоводородная кислота, серная кислота, хлористый водород, бромистый водород, и т.п.). Элиминирование с применением кислоты Льюиса, такой как тригалогенуксусная кислота (например, трихлоруксусная кислота, трифторуксусная кислота, и т.п.) или подобного, осуществляют, предпочтительно, в присутствии катионулавливающих агентов (например, анизола, фенола, и т.п.). Реакцию обычно осуществляют в растворителе, таком как вода, спирт (например, метанол, этанол, и т.п.), метиленхлорид, тетрагидрофуран, 1,2-диметоксиэтан, диоксан, в их смесях, или в любом другом растворителе, который не оказывает вредного влияния на реакцию. Жидкие основания или кислота также могут использоваться в качестве растворителей. Температура реакции не является критическим фактором, и реакцию обычно осуществляют в условиях от охлаждения до нагревания. (II) Восстановление Восстановление осуществляют обычным способом, в том числе химическим восстановлением и каталитическим восстановлением. Подходящими восстановителями, которые используются при химическом восстановлении, являются комбинация металла (например, олова, цинка, железа, и т.п.) и органической или неорганической кислоты (например, муравьиной кислоты, п-толуолсульфоновой кислоты, хлористоводородной кислоты, бромистоводородной кислоты, и т.п.). Подходящими катализаторами, которые применяют при каталитическом восстановлении, являются обычные катализаторы, такие как платиновые катализаторы (например, платиновая пластина, губчатая платина, платиновая чернь, коллоидная платина, оксид платины, платиновая проволока, и т.п.), палладиевые катализаторы (например, губчатый палладий, палладиевая чернь, оксид палладия, палладий-на-угле, коллоидный палладий, палладий на сульфате бария, палладий на карбонате бария, и т.п.), никелевые катализаторы (например, восстановленный никель, оксид никеля, никель Ренея, и т.п.), кобальтовые катализаторы (например, восстановленный кобальт, кобальт Ренея, и т.п.), железные катализаторы (например, восстановленное железо, железо Ренея, и т.п.), медные катализаторы (например, восстановленная медь, медь Ренея, медь Ульмана, и т.п. ), и подобные катализаторы. Восстановление обычно осуществляют в обычном растворителе, который не оказывает вредного влияния на реакцию, таком как вода, метанол, этанол, пропанол, N,N-диметилформамид, тетрагидрофуран, или в их смесях. Кроме того, в случае, когда вышеупомянутые кислоты, которые используются при химическом восстановлении, представляют собой жидкости, они также могут использоваться в качестве растворителей. Температура реакции такого восстановления не является критическим фактором, и реакцию обычно осуществляют в условиях от охлаждения до нагревания. Способ 3 Соединение (1в) или его соль могут быть получены путем взаимодействия соединения (IV) или его соли с соединением (V) или его солью. Эту реакцию обычно осуществляют в растворителе, таком как ацетонитрил, бензол, N, N-диметилформамид, тетрагидрофуран, метиленхлорид, этиленхлорид, хлороформ, диэтиловый эфир, или в любом другом растворителе, который не оказывает вредного влияния на реакцию. Температура реакции не является критическим параметром, и реакцию обычно осуществляют в условиях от охлаждения до нагревания. Реакцию обычно осуществляют в присутствии основания. Подходящее основание может являться основанием из числа упомянутых в способе 1. Жидкое основание также может использоваться в качестве растворителя. Способ 4 Соединение (1г) или его соль могут быть получены путем взаимодействия соединения (VI) или его соли с соединением (VII) или его солью. Эту реакцию обычно осуществляют в растворителе, таком как ацетонитрил, бензол, N, N-диметилформамид, тетрагидрофуран, метиленхлорид, этиленхлорид, хлороформ, диэтиловый эфир, или в любом другом растворителе, который не оказывает вредного влияния на реакцию. Температура реакции не является критическим фактором, и реакцию обычно осуществляют в условиях от охлаждения до нагревания. Реакцию обычно осуществляют в присутствии основания. Подходящее основание может являться основанием из числа упомянутых в способе 1. Способ 5 Соединение (1д) или его соль могут быть получены путем взаимодействия соединения (VIII) или его соли с соединением (IX) или его реакционноспособным производным по карбоксильной группе, или с его солью. Подходящим реакционноспособным производным по карбоксильной группе соединения (IX) может являться галоидангидрид, ангидрид кислоты, активированный амид, активированный сложный эфир и подобные соединения. Подходящим примером может являться хлорангидрид, азид кислоты, смешанный ангидрид с такой кислотой, как замещенная фосфорная кислота (например, диалкилфосфорная кислота, фенилфосфорная кислота, дифенилфосфорная кислота, дибензилфосфорная кислота, галогенированная фосфорная кислота, и т.п.), дилкилфосфористая кислота, сернистая кислота, тиосерная кислота, алкансульфоновая кислота (например, метансульфоновая кислота, этинсульфоновая кислота, и т.п.), серная кислота, алкилугольная кислота, алифатическая карбоновая кислота (например, пиваловая кислота, пентановая кислота, изопентановая кислота, 2-этилмасляная кислота или трихлоруксусная кислота, и т.п.), или ароматическая карбоновая кислота (например, бензойная кислота, и т.п.), симметричный ангидрид кислоты, амид, активированный имидазолом, 4-замещенным имидазолом, диметилпиразолом, триазолом или тетразолом, или активированный сложный эфир (например, цианометиловый эфир, метоксиметиловый эфир, диметилиминометиловый 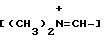 эфир, виниловый эфир, пропаргиловый эфир, п-нитрофениловый эфир, 2,4-динитрофениловый эфир, трихлорфениловый эфир, пентахлорфениловый эфир, мезилфениловый эфир, фенилазофениловый эфир, фениловый тиоэфир, п-нитрофениловый тиоэфир, п-крезиловый тиоэфир, карбоксиметиловый тиоэфир, пираниловый эфир, пиридиловый эфир, пиперидиловый эфир, 8-хинолиловый тиоэфир, и т.п.), или сложный эфир с N-гидроксисоединением (например, с N,N-диметилгидроксиламином, 1-гидрокси-2-(1H)-пиридином, N-гидроксисукцинимидом, N-гидроксибензотриазолом, N-гидроксифталимидом, 1-гидрокси-6-хлор-1H-бензотриазолом, и т. п. ) и т.п. Такие реакционноспособные производные могут быть выбраны, необязательно, среди соединений, соответствующих используемым соединениям типа (IX).
Реакцию обычно осуществляют в традиционном растворителе, таком как вода, ацетон, диоксан, ацетонитрил, хлороформ, метиленхлорид, этиленхлорид, тетрагидрофуран, этилацетат, N, N-диметилформамид, пиридин, или в любых других органических растворителях, которые не оказывают вредного влияния на реакцию. Эти обычные растворители также могут использоваться в смеси с водой.
Когда соединение (IX) используют в реакции в форме свободной кислоты или в форме ее соли, реакцию осуществляют, предпочтительно, в присутствии обычных конденсирующих агентов, таких как N,N’-дициклогексилкарбодиимид, N-циклогексил- N’-морфолиноэтилкарбодиимид, или подобных соединений.
Реакцию также можно осуществлять в присутствии неорганического или органического основания, такого как бикарбонат щелочного металла, три (низший) алкиламин, пиридин, N-(низший) алкилморфолин, N,N-ди(низший) алкилбензиламин, или подобного соединения. Температура реакции не является критическим параметром, и реакцию обычно осуществляют в условиях от охлаждения до нагревания.
Способ 6 эфир, виниловый эфир, пропаргиловый эфир, п-нитрофениловый эфир, 2,4-динитрофениловый эфир, трихлорфениловый эфир, пентахлорфениловый эфир, мезилфениловый эфир, фенилазофениловый эфир, фениловый тиоэфир, п-нитрофениловый тиоэфир, п-крезиловый тиоэфир, карбоксиметиловый тиоэфир, пираниловый эфир, пиридиловый эфир, пиперидиловый эфир, 8-хинолиловый тиоэфир, и т.п.), или сложный эфир с N-гидроксисоединением (например, с N,N-диметилгидроксиламином, 1-гидрокси-2-(1H)-пиридином, N-гидроксисукцинимидом, N-гидроксибензотриазолом, N-гидроксифталимидом, 1-гидрокси-6-хлор-1H-бензотриазолом, и т. п. ) и т.п. Такие реакционноспособные производные могут быть выбраны, необязательно, среди соединений, соответствующих используемым соединениям типа (IX).
Реакцию обычно осуществляют в традиционном растворителе, таком как вода, ацетон, диоксан, ацетонитрил, хлороформ, метиленхлорид, этиленхлорид, тетрагидрофуран, этилацетат, N, N-диметилформамид, пиридин, или в любых других органических растворителях, которые не оказывают вредного влияния на реакцию. Эти обычные растворители также могут использоваться в смеси с водой.
Когда соединение (IX) используют в реакции в форме свободной кислоты или в форме ее соли, реакцию осуществляют, предпочтительно, в присутствии обычных конденсирующих агентов, таких как N,N’-дициклогексилкарбодиимид, N-циклогексил- N’-морфолиноэтилкарбодиимид, или подобных соединений.
Реакцию также можно осуществлять в присутствии неорганического или органического основания, такого как бикарбонат щелочного металла, три (низший) алкиламин, пиридин, N-(низший) алкилморфолин, N,N-ди(низший) алкилбензиламин, или подобного соединения. Температура реакции не является критическим параметром, и реакцию обычно осуществляют в условиях от охлаждения до нагревания.
Способ 6Соединение (1ж) или его соль могут быть получены путем взаимодействия соединения (1е) или его соли с соединением (X) или его солью. Эту реакцию можно осуществлять в соответствии со способом, описанным ниже в примере 20, или подобным способом. Способ А Соединение (XIII) или его соль могут быть получены путем взаимодействия соединения (XI) или его соли с соединением (XII) или его солью. Эта реакция может быть осуществлена в соответствии со способом, описанным ниже в препаративном примере 31, или подобным способом. Способ Б Соединение (XV) или его соль могут быть получены, когда соединение (XIV) или его соль подвергают реакции восстановления. Эта реакция может быть осуществлена в соответствии со способом, описанным ниже в препаративном примере 32, или подобным способом. Способ В Соединение (XVII) или его соль могут быть получены, когда соединение (XVI) или его соль подвергают реакции дегидратации. Эта реакция может быть осуществлена в соответствии со способом, описанным ниже в препаративном примере 33, или подобным способом. Способ Г Соединение (XIX) или его соль могут быть получены, когда соединение (XVIII) или его соль подвергают реакции окисления. Эта реакция может быть осуществлена в соответствии со способами, описанными ниже в препаративных примерах 34 и 35, или подобным способом. Способ Д Соединение (XX) или его соль могут быть получены, когда соединение (XV) или его соль подвергают реакции галоидирования. Эта реакция может быть осуществлена в соответствии со способом, описанным ниже в препаративном примере 40-(1), или подобным способом. Способ Е Соединение (XXII) или его соль могут быть получены, когда соединение (XXI) или его соль подвергают реакции восстановления. Эта реакция может быть осуществлена в соответствии со способами, описанными ниже в препаративных примерах 1, 11, 13 и 40-(2), или подобным способом. Способ Ж Соединение (XXV) или его соль могут быть получены путем взаимодействия соединения (XXIII) или его соли с соединением (XXIV) или его солью. Эта реакция может быть осуществлена в соответствии со способами, описанными ниже в препаративных примерах 2 и 46, или подобным способом. Способ 3 Соединение (II) или его соль могут быть получены, когда соединение (XXXXIV) или его соль подвергают реакции элиминирования группы, защищающей гидроксильную группу. Реагент, который используют в этой реакции, может включать галогентриалкилсилан (например, иодтриметилсилан, и т.п.), тиоалкоксид щелочного металла (например, тиоэтоксид натрия, и т.п.), сульфид щелочного металла (например, сульфамид натрия, и т.п.), дифенилфосфид щелочного металла (например, дифенилфосфид лития, и т. п.), галогенид алюминия (например, хлорид алюминия, бромид алюминия, и т.п.), тригалогенид бора (например, трихлорид бора, трибромид бора, и т.п.), гидрохлорид пиридина, галогенид алкилмагния (например, метилмагнийиодид, и т.п.), галогенид лития (например, хлорид лития, и т.п.), галогенид тетраалкиламмония (например, тетрабутиламмонийфторид, и т.п.), сочетание метионина и сульфоновой кислоты (например, метансульфоновую кислоту, и т.п.), и подобные соединения. Реакцию обычно осуществляют в традиционном растворителе, таком как вода, спирт (например, метанол, этанол, изопропиловый спирт, и т.п.), тетрагидрофуран, диоксан, дихлорметан, этиленхлорид, хлороформ, N,N-диметилформамид, N, N-диметилацетамид, или в любом другом органическом растворителе, который не оказывает вредного влияния на реакцию. Температура реакции не является критическим параметром, и реакцию обычно осуществляют в условиях от охлаждения до нагревания. Способ И Соединение (XXVIII) или его соль могут быть получены путем взаимодействия соединения (XXVI) или его соли с соединением (XXVII) или его солью. Эта реакция может быть осуществлена в соответствии со способами, описанными ниже в препаративных примерах 8, 17 и 19, или подобным способом. Соединение (XXVII) или его соль могут быть получены в соответствии со способом, описанным ниже в препаративном примере 7, или подобным способом. Способ Й Соединение (XXX) или его соль могут быть получены из соединения (XXIX) или его соли в соответствии со способом, описанным ниже в препаративном примере 54, или подобным способом. Способ К Соединение (XXXI) или его соль могут быть получены, когда соединение (XV) или его соль подвергают реакции восстановления. Эта реакция может быть осуществлена по методу, подобному методу в вышеуказанном способе 2, и, следовательно, реагенты, которые используют, и условия реакции (например, растворитель, температура реакции, и т.п.) могут соответствовать приведенным в способе 2. Способ Л Соединение (XXXIII) или его соль могут быть получены путем взаимодействия соединения (XXIII) или его соли с соединением (XXXII) или его солью. Эту реакцию обычно осуществляют в растворителе, таком как ацетонитрил, бензол, N, N-диметилформамид, тетрагидрофуран, метиленхлорид, этиленхлорид, пиридин, хлороформ, диэтиловый эфир, или в любом другом растворителе, который не оказывает вредного влияния на реакцию. Температура реакции не является критическим фактором, и реакцию обычно осуществляют в условиях от охлаждения до нагревания. Реакцию обычно осуществляют в присутствии основания. Подходящим основанием может являться основание из числа упомянутых в способе 1. Способ М Соединение (XXXVI) или его соль могут быть получены путем взаимодействия соединения (XXXIV) или его соли с соединением (XXXV) или его солью. Эта реакция может быть осуществлена в соответствии со способом, описанным ниже в препаративном примере 38, или подобным способом. Способ H Соединение (XXXXV) или его соль могут быть получены, когда соединение (XXIII) или его соль подвергают реакции галоидирования. Эта реакция может быть осуществлена в соответствии со способами, описанными ниже в препаративных примерах 14 и 15, или подобным способом. Способ О Соединение (XXXVIII) или его соль могут быть получены, когда соединение (XXXVII) или его соль подвергают реакции галоидирования. Эта реакция может быть осуществлена в соответствии со способом, описанным ниже в препаративном примере 21, или подобным способом. Способ П Соединение (XXXX) или его соль могут быть получены путем взаимодействия соединения (XXXIX) или его соли с соединением (IX) или его реакционноспособным производным по карбоксильной группе, или с его солью. Эта реакция может быть осуществлена по методу, подобному методу в вышеупомянутом способе 5, и, следовательно, реагенты, которые используют, и условия реакции (например, растворитель, температура реакции, и т.п.) могут соответствовать приведенным в способе 5. Способ P Соединение (IV) или его соль могут быть получены путем взаимодействия соединения (XXXXI) или его соли с соединением (III) или его солью. Эта реакция может быть осуществлена по методу, подобному методу в вышеупомянутом способе 1 и, следовательно, реагенты, которые используют, и условия реакции (например, растворитель, температура реакции, и т.п.) могут соответствовать приведенным в способе 1. Способ С Соединение (VI) или его соль могут быть получены путем взаимодействия соединения (IV) или его соли с соединением (XXXXII). Эту реакцию обычно осуществляют в растворителе, таком как ацетонитрил, бензол, N, N-диметилформамид, тетрагидрофуран, метиленхлорид, этиленхлорид, хлороформ, диэтиловый эфир, или в любом другом растворителе, который не оказывает вредного влияния на реакцию. Температура реакции не является критическим фактором, и реакцию обычно осуществляют в условиях от охлаждения до нагревания. Реакцию обычно осуществляют в присутствии основания. Подходящим основанием может являться основание из числа упомянутых в способе 1. Способ Т Соединение (VIII) или его соль могут быть получены, когда соединение (XXXXIII) или его соль подвергают реакции элиминирования группы, защищающей аминогруппу. Эта реакция может быть осуществлена по методу, подобному методу в вышеупомянутом способе 2, и, следовательно, реагенты, которые используют, и условия реакции (например, растворитель, температура реакции, и т.п.) могут соответствовать приведенным в способе 2. Целевое соединение (1) настоящего изобретения и его фармацевтически приемлемые соли обладают фармакологической активностью, такой как активность ингибирования агрегации тромбоцитов, сосудорасширяющим действием, антигипертензивным действием или подобной активностью, и являются агонистами простагландина I2, и, следовательно, могут использоваться для лечения и/или предупреждения закупорки артерии (например, хронической артериальной обструкции, и т.п.), заболеваний сосудов головного мозга, язвы желудка, гепатита, печеночной недостаточности, цирроза печени, артериосклероза, имешмической болезни сердца, рестеноза после чрескожной транслюминальной коронарной ангиопластики, гипертензии, воспаления, сердечной недостаточности, заболеваний почек (например, почечной недостаточности, нефрита, и т.п.), осложнений при диабете (например, диабетической нефропатии, диабетической ретинопатии, и т. п. ), расстройства периферического кровообращения, и т.п., и также могут использоваться для защиты органов после пересадки. Чтобы показать пригодность целевого соединения (1), далее приводятся фармакологические данные характерных соединений (1). I) Ингибирование агрегации тромбоцитов человека, индуцируемой АДР (I) Проверяемое соединение (1) Натриевая соль [5-(карбоксиметокси)-2-гидрокси-1,2,3,4- тетрагидро-2-нафтил]метил-N,N-дифенилкарбамата (2) 2-[(1,2,3,4-Тетрагидро-5-карбоксиметокси-2-нафтил)метил]- 6-дифенилметил-З(2H)-пиридазинон (II) Метод испытания Получают человеческую кровь от здоровых добровольцев и смешивают ее с 1/10, по объему, 3,8% цитрата натрия, pH 7,4. Кровь с цитратом центрифугируют при 150 х g в течение 10 минут и удаляют богатую тромбоцитами плазму (PRP). Оставшуюся кровь центрифугируют еще в течение 10 минут при 1500 х g и получают плазму, обедненную тромбоцитами (PRP), которую используют в качестве стандарта для агрегации тромбоцитов. Исследование агрегации осуществляют, используя 8-канальный агрегометр HEMATRACER 801 (NBS, Япония). Смешивают 25 мкл раствора образца и 225 мкл PRP и перемешивают при 1000 об/мин в течение 2 минут при 37oC. Агрегацию индуцируют раствором АДР при конечной концентрации 2,5 мкл. (III) Результаты испытаний Проверяемое соединение – Ингибирование (%) (1) (1,0  10-7 М) – 97 10-7 М) – 97 1,2 1,2(2) (1,0  10-6 М) – 100 10-6 М) – 100  0,4 – среднее 0,4 – среднее  ст.откл.
II) Влияние на среднее артериальное кровяное давление у крыс, находящихся в сознании ст.откл.
II) Влияние на среднее артериальное кровяное давление у крыс, находящихся в сознании(I) Проверяемое соединение Натриевая соль [5-(карбоксиметокси)-2-гидрокси- 1,2,3,4-тетрагидро-2-нафтил]метил-N,N-дифенилкарбамата (II) Метод испытаний Крысам Sprage. Dawley в возрасте 8-9 недель дают наркоз эфиром. В бедренные артерии крыс вставляют полиэтиленовые катетеры, наполненные раствором гепарина, и измеряют среднее кровяное давление. Среднее кровяное давление измеряют датчиком кровяного давления и регистрируют на полиграфе. Проверяемое соединение, растворенное в этаноле, полиэтиленгликоле и дистиллированной воде (1: 1:1), вводят через полиэтиленовый катетер, вставленный в бедренную вену, в объеме 1 мл/кг. Внутривенное гипотензивное действие проверяемого соединения выражают в виде максимального понижения (R макс). Вкратце, R макс выражают как максимальное изменение давления, в %, по сравнению со средним кровяным давлением до введения проверяемого соединения. (III) Результаты испытаний Проверяемое соединение – R макс (%) 10 мкг/кг – 27,5 III) Анализ рецепторного связывания (I) Проверяемое соединение Натриевая соль (2R)-[5-(карбоксиметокси)-2-гидрокси-1,2,3,4- тетрагидро-2-нафтил]метил-N,N-дифенилкарбамата (II) Метод испытаний Клонируют кДHК человеческого IP-рецептора и экспрессируют в COS7, используя вектор pCDM8, способом, подобным способу, описанному в литературе [J. Biol. Chem., Vol. 269, N 16, pp. 12173-12178 (1994); Circulation, Vol. 90, N 4, pp. 1643-1647 (1994); FEBS Letters 344 (1994) 74-78]. После трансфекции клетки, которые экспрессируют человеческий IP-рецептор, собирают скребком для клеток при 4oC и хранят при 80oC. Состав буфера для анализа следующий: 20 мМ MES (pH 6,0), 10 мМ MgCl2, 1 мМ ЭДТК и 0,1 мМ PMSF. Оттаивают замороженные клетки и аликвоты (4,5  105 клеток) инкубируют в течение 60 минут при встряхивании при 30oC в пластмассовых пробирках в 100 мкл буфера для анализа с 10 нМ [3H]-илопроста (iliprost) в присутствии или в отсутствие проверяемого соединения (1 105 клеток) инкубируют в течение 60 минут при встряхивании при 30oC в пластмассовых пробирках в 100 мкл буфера для анализа с 10 нМ [3H]-илопроста (iliprost) в присутствии или в отсутствие проверяемого соединения (1 10-6 М).
Чтобы определить неспецифическое связывание, добавляют илопрост при концентрации 10 мкМ. Каждый анализ выполняют два раза. Реакционную смесь фильтруют через стеклянный фильтр Whatman GF/C, чтобы остановить реакцию. После промывания фильтра охлажденным льдом буфером для анализа проверяют счетчиком радиоактивность фильтра. Неспецифическое связывание вычитают из общего связывания и получают специфическое связывание. Действие проверяемого соединения выражают в % ингибирования специфического связывания [3H]-илопроста.
(III) Результаты испытаний 10-6 М).
Чтобы определить неспецифическое связывание, добавляют илопрост при концентрации 10 мкМ. Каждый анализ выполняют два раза. Реакционную смесь фильтруют через стеклянный фильтр Whatman GF/C, чтобы остановить реакцию. После промывания фильтра охлажденным льдом буфером для анализа проверяют счетчиком радиоактивность фильтра. Неспецифическое связывание вычитают из общего связывания и получают специфическое связывание. Действие проверяемого соединения выражают в % ингибирования специфического связывания [3H]-илопроста.
(III) Результаты испытанийИнгибирование (%): 96,5 Фармацевтическая композиция настоящего изобретения может применяться в форме фармацевтического препарата, например, в твердой, полутвердой или жидкой форме (например, таблетки, пилюли, пастилки, капсулы, суппозитории, кремы, мази, аэрозоли, порошки, растворы, эмульсии, суспензии, и т.п.), которая в качестве активного компонента содержит целевое соединение (1) или его фармацевтически приемлемую соль, и является пригодной для ректального введения, введения через легкие (начальная или буккальная ингаляция), назального, окулярного, наружного (местного), перорального или парентерального (в том числе, подкожного, внутривенного и внутримышечного) введения или для инсуффляции. Фармацевтическая композиция настоящего изобретения может содержать различные органические или неорганические носители, которые обычно используются для фармацевтических целей, такие как эксципиент (например, сахароза, крахмал, маннит, сорбит, лактоза, глюкоза, целлюлоза, тальк, фосфат кальция, карбонат кальция, и т.п.), связующее (например, целлюлоза, метилцеллюлоза, гидроксипропилцеллюлоза, полипропилпирролидон, желатин, аравийская камедь, полиэтиленгликоль, сахароза, крахмал, и т.п.), дезинтегратор (например, крахмал, карбоксиметилцеллюлоза, гидроксипропилкрахмал, натрийгликолькрахмал, бикарбонат натрия, фосфат кальция, цитрат кальция и т.п.), смазка (например, стеарат магния, тальк, лаурилсульфат натрия, и т.п.), корригент (например, лимонная кислота, ментол, глицин, апельсиновые порошки, и т.п.), консервант (например, бензоат натрия, бисульфит натрия, метилпарабен, пропилпарабен, и т. п. ), стабилизатор (например, лимонная кислота, цитрат натрия, уксусная кислота, и т.п.), суспендирующий агент (например, метилцеллюлоза, поливинилпирролидон, стеарат алюминия, и т. п.), диспергатор, водный разбавитель (например, воду), воск-основу (например, масло какао, полиэтиленгликоль, белый вазелин, и т.п.). Эффективный ингредиент может вводиться, как правило, стандартной дозой от 0,01 мг/кг до 50 мг/кг 1-4 раза в сутки. Однако вышеупомянутая дозировка может быть увеличена или уменьшена в соответствии с возрастом, массой, состоянием пациента или со способом введения. Следующие далее препаративные примеры и примеры даются только с целью более подробного пояснения настоящего изобретения. Препаративный пример 1 Суспензию этил-(5-метокси-1,2,3,4-тетрагидро-1-нафтил)ацетата (1,02 г) и алюмогидрида лития (0,20 г) в тетрагидрофуране (15 мл) перемешивают при 0oC в течение 2,5 часов. Раствор выливают в холодную 1N соляную кислоту, затем получающуюся в результате смесь фильтруют через целит и экстрагируют этилацетатом. Экстракт промывают солевым раствором, сушат над сульфатом натрия и упаривают в вакууме, получают 2-(5-метокси-1,2,3,4-тетрагидро-1-нафтил)этанол в виде бесцветного масла (0,85 г). ЯМР (CDCl3,  ): 1,66-2,07(7H, м), 2,49-2,76(2H,м), 2,92-2,99(1H,м), 3,77(2H, т, J = 6,8 Гц), 3,81(3H,с), 6,67(1H,д, J= 8,0 Гц,), 6,81(1H,д, J= 7,7 Гц), 7,11(1H, дд, J = 8,0, 7,7 Гц).
(+) APCI М.-с. m/z: 207 (М++1) ): 1,66-2,07(7H, м), 2,49-2,76(2H,м), 2,92-2,99(1H,м), 3,77(2H, т, J = 6,8 Гц), 3,81(3H,с), 6,67(1H,д, J= 8,0 Гц,), 6,81(1H,д, J= 7,7 Гц), 7,11(1H, дд, J = 8,0, 7,7 Гц).
(+) APCI М.-с. m/z: 207 (М++1)Препаративный пример 2 Смесь (1, 2, 3, 4-тетрагидро-5-метокси-2-нафтил) метанола (192 мг) и N, N- дифенилкарбамоилхлорида (348 мг) в пиридине (180 мг) перемешивают при 100oC в течение 2 часов, охлаждают до комнатной температуры, и распределяют между этилацетатом и 1N соляной кислотой. Органический слой последовательно промывают солевым раствором, водным раствором бикарбоната натрия и солевым раствором, сушат над сульфатом магния и упаривают в вакууме. Остаток обрабатывают диэтиловым эфиром, и получают (1,2,3,4-тетрагидро-5-метокси- 2-нафтил)метил-N,N-дифенилкарбамат (218 мг) в виде бледно-фиолетового порошка. Т.пл. 143,5-146oC ИК (вазел.масло): 1710, 1260 см-1 ЯМР (CDCl3,  ): 1,22-1,43(1H, м), 1,8-2,05(2H, м), 2,35-2,6(2H,м), 2,65-2,9(2H, м), 3,80(3H, с), 4,06-4,23(2H, м), 6,65(1H, д, J = 7,9 Гц), 6,65(1H, д, J= 7,9 Гц), 7,11(1H,т, J= 7,9 Гц), 7,16-7,38(10H,м).
(+) APCI М.-с. m/z: 388 (М++1).
Препаративный пример 3 ): 1,22-1,43(1H, м), 1,8-2,05(2H, м), 2,35-2,6(2H,м), 2,65-2,9(2H, м), 3,80(3H, с), 4,06-4,23(2H, м), 6,65(1H, д, J = 7,9 Гц), 6,65(1H, д, J= 7,9 Гц), 7,11(1H,т, J= 7,9 Гц), 7,16-7,38(10H,м).
(+) APCI М.-с. m/z: 388 (М++1).
Препаративный пример 3По способу, подобному способу препаративного примера 2, получают 2-(5-метокси-1,2,3,4-тетрагидро-1-нафтил)этил-N,N-дифенилкарбамат. Т.пл. 97oC ИК (вазел.масло): 1710 см-1 ЯМР (CDCl3,  ): 1,68-2,01(6H,м), 2,46-2,74(3H,м), 3,79(3H,с), 4,26(2H, т, J= 6,4 Гц), 6,58(1H, д, J= 7,7 Гц), 6,64(1H, д, J= 8,0 Гц), 7,05(1H,дд, J = 8,0, 7,7 Гц), 7,16-7,38 (10H, м).
(+) APCМ.-с. m/z: 402 (М++1).
Препаративный пример 4 ): 1,68-2,01(6H,м), 2,46-2,74(3H,м), 3,79(3H,с), 4,26(2H, т, J= 6,4 Гц), 6,58(1H, д, J= 7,7 Гц), 6,64(1H, д, J= 8,0 Гц), 7,05(1H,дд, J = 8,0, 7,7 Гц), 7,16-7,38 (10H, м).
(+) APCМ.-с. m/z: 402 (М++1).
Препаративный пример 4Суспензию (1,2,3,4-тетрагидро-5-метокси-2-нафтил)-метил-N,N- дифенилкарбамата (1,93 н) и DL-метионина (7,43 г) в метансульфоновой кислоте (47,9 мг) перемешивают при комнатной температуре в течение 22 часов, и затем выливают в воду со льдом. Получающуюся в результате смесь экстрагируют этилацетатом. Экстракт последовательно промывают солевым раствором (дважды), водным раствором бикарбоната натрия и солевым раствором, сушат над сульфатом магния, и упаривают в вакууме. Остаток хроматографируют на силикагеле (толуол – этилацетат), и получают (1,2,3,4-тетрагидро-5-гидрокси-2-нафтил) метил-N,N-дифенилкарбамат (82 мг) в виде желтого твердого вещества. Т.пл. 96-98oC ИК (вазел.масло): 3330, 1675, 1585 см-1 ЯМР (CDCl3,  ): 1,25-1,47(1H,м), 1,85-2,05(2H,м), 2,42- 2,59(2H,м), 2,66-2,84(2H, м), 4,07-4,23(2H,м), 5,05(1H,с), 6,58(1H, д, J= 7,7 Гц), 6,62 (1H, д, J= 7,7 Гц), 6,96 (1H, т, J= 7,7 Гц), 7,15-7,68 (10H, м).
(+) APCI M.-c. m/z: 374 (M++1) Элементный анализ. Для C24H23NO3 ): 1,25-1,47(1H,м), 1,85-2,05(2H,м), 2,42- 2,59(2H,м), 2,66-2,84(2H, м), 4,07-4,23(2H,м), 5,05(1H,с), 6,58(1H, д, J= 7,7 Гц), 6,62 (1H, д, J= 7,7 Гц), 6,96 (1H, т, J= 7,7 Гц), 7,15-7,68 (10H, м).
(+) APCI M.-c. m/z: 374 (M++1) Элементный анализ. Для C24H23NO3вычислено: C-77,19, H-6,21, N-3,75 найдено: C 77,31, H-6,29, N-3,67. Препаративный пример 5 Суспензию 2- (5-метокси-1,2,3,4-тетрагидро-1-нафтил)этил- N,N-дифенилкарбамата (0,93 г) и DL-метионина (3,50 г) в метансульфоновой кислоте (15 мл) перемешивают при комнатной температуре в течение 16 часов, и затем выливают в воду со льдом. Получающуюся в результате смесь экстрагируют этилацетатом. Экстракт последовательно промывают 5% соляной кислотой и солевым раствором, сушат над сульфатом натрия, и упаривают в вакууме, и получают сырой 2-(5-гидрокси-1,2,3,4-тетрагидро-1-нафтил)этил-N, N-дифенилкарбамат (0,77 г). Пример 1 Суспензию (1,2,3,4-тетрагидро-5-гидрокси-2- нафтил)метил-N, N-дифенилкарбамата (67 мг), этилбромацетата (33 мг) и карбоната калия (37 мг) в N, N-диметилформамиде (1,0 мл) перемешивают при комнатной температуре в течение 5,5 часов, и затем смесь экстрагируют этилацетатом. Экстракт промывают водой и солевым раствором (дважды), сушат над сульфатом магния и упаривают в вакууме. Остаток хроматографируют на силикагале (толуол – этилацетат), и получают [5-(этоксикарбонилметокси)-1,2,3,4- тетрагидро-2-нафтил]метил-N,N-дифенилкарбамат (61 мг) в виде масла. ИК (пленка): 1755, 1710, 1585, 1200 см-1 (+) APCI M.-c. m/z: 460 (M++1). Пример 2 По способу, подобному способу примера 1, получают 2-[5-(этоксикарбонилметокси)-1,2,3,4-тетрагидро-1-нафтил]этил- N,N-дифенилкарбамат. ИК (пленка): 1760-1700 (широкий) см-1 ЯМР (CDCl3,  ): 1,29(3H, т, J= 7,1 Гц), 1,57- 2,00(6H,м), 2,48-2,76(3H, м), 4,18-4,31(4H,м), 4,60(2H,c), 6,50(1H, д, J= 8,0 Гц), 6,61(1H, д, J= 7,7 Гц), 7,01(1H, дд, J = 8,0, 7,7 Гц),7,05- 7,38(10H, с).
(+) APCI М.-с. m/z: 474 (М++1).
Пример 3 ): 1,29(3H, т, J= 7,1 Гц), 1,57- 2,00(6H,м), 2,48-2,76(3H, м), 4,18-4,31(4H,м), 4,60(2H,c), 6,50(1H, д, J= 8,0 Гц), 6,61(1H, д, J= 7,7 Гц), 7,01(1H, дд, J = 8,0, 7,7 Гц),7,05- 7,38(10H, с).
(+) APCI М.-с. m/z: 474 (М++1).
Пример 3Раствор [5-(этоксикарбонилметокси)-1,2,3,4-тетрагидро-2-нафтил] метил-N, N-дифенилкарбамата (59 мг) и 1N раствора гидроксида натрия (0,15 мл) в этаноле (1,5 мл) перемешивают при комнатной температуре в течение 1 часа и нейтрализуют 1N соляной кислотой (0,15 мл), и затем экстрагируют этилацетатом. Экстракт промывают солевым раствором, сушат над сульфатом магния и упаривают в вакууме. Остаток превращают в порошок из н-гексана, и получают [5-(карбоксиметокси)-1,2,3,4- тетрагидро-2-нафтил]метил-N,N-дифенилкарбамат (47 мг) в виде бесцветного порошка. Т.пл. 137-141,5oC ИК (вазел.масло): 1740, 1705, 1580, 1250 см-1 ЯМР (ДМСО-d6,  ): 1,2-1,35(1H, м), 1,75-2,0(2H,м), 2,27-2,83(4H,м), 4,06(2H, шд., J= 5,8 Гц), 4,64(2H,с), 6,59(1H, д, J= 7,8 Гц), 6,63(1H, д, J= 7,8 Гц), 7,01(1H, т, J= 7,8 Гц), 7,23- 7,43(10H,м), 12,95(1H,шс).
(+) APCI M.-c. m/z: 432 (М++1).
Пример 4 ): 1,2-1,35(1H, м), 1,75-2,0(2H,м), 2,27-2,83(4H,м), 4,06(2H, шд., J= 5,8 Гц), 4,64(2H,с), 6,59(1H, д, J= 7,8 Гц), 6,63(1H, д, J= 7,8 Гц), 7,01(1H, т, J= 7,8 Гц), 7,23- 7,43(10H,м), 12,95(1H,шс).
(+) APCI M.-c. m/z: 432 (М++1).
Пример 4Раствор 2-[5-(этоксикарбонилметокси)-1,2,3,4- тетрагидро-1-нафтил] этил-N, N-дифенилкарбамата (0,83 г) и 1N раствора гидроксида натрия (2,1 мл) в диоксане (5 мл) перемешивают при комнатной температуре в течение 30 минут и промывают эфиром. Образующийся в результате водный слой подкисляют 10% соляной кислотой и экстрагируют этилацетатом. Экстракт промывают солевым раствором, сушат над сульфатом натрия и упаривают в вакууме. Остаток превращают в порошок из 2-пропанола, и получают 2-[5-(карбоксиметокси)-1,2,3,4-тетрагидро-1-нафтил] этил-N, N-дифенилкарбамат (0,46 г) в виде бесцветного порошка. Т.пл. 145oC ИК (вазел.масло): 1730, 1695 см-1 ЯМР (ДМСО-d6,  ): 1,60-1,91(6H,м), 2,42-2,60(3H,м), 3,57(1H, широкий), 4,15(2H, т, J= 6,2 Гц), 4,61(2H,с), 6,54(1H, д, J= 7,7 Гц), 6,57(1H, д, J= 8,1 Гц), 6,99(1H, дд, J= 8,1, 7,7 Гц), 7,20-7,41(10H,м).
(+) APCI М.-с. m/z: 446 (М++1).
Пример 5 ): 1,60-1,91(6H,м), 2,42-2,60(3H,м), 3,57(1H, широкий), 4,15(2H, т, J= 6,2 Гц), 4,61(2H,с), 6,54(1H, д, J= 7,7 Гц), 6,57(1H, д, J= 8,1 Гц), 6,99(1H, дд, J= 8,1, 7,7 Гц), 7,20-7,41(10H,м).
(+) APCI М.-с. m/z: 446 (М++1).
Пример 5Раствор 2-[5-(карбоксиметокси)-1,2,3,4-тетрагидро- 1-нафтил]этил-N,N-дифенилкарбамата (0,12 г) и 1N раствора гидроксида натрия (0,265 мл) в этаноле упаривают в вакууме. Остаток превращают в порошок из этанола, и получают натриевую соль 2-[5-(карбоксиметокси)-1,2,3,4-тетрагидро-1- нафтил] этил-N,N-дифенилкарбамата (0,11 г) в виде бесцветного порошка. Т.пл. 200-215oC ИК (вазел. масло): 1700, 1610 см-1 ЯМР (CD3OD,  ): 1,67-2,01(6H, м), 2,57-2,85(3H,м), 4,18-4,26(2H,м), 4,35(2H, с), 6,49(1H, д, J = 7,7 Гц), 6,56(1H, д, J = 8,1 Гц), 6,94(1H, дд, J= 8,1, 7,7 Гц), 7,20-7,40(10H,м).
FAB M.-c. m/z: 468 (M+) ): 1,67-2,01(6H, м), 2,57-2,85(3H,м), 4,18-4,26(2H,м), 4,35(2H, с), 6,49(1H, д, J = 7,7 Гц), 6,56(1H, д, J = 8,1 Гц), 6,94(1H, дд, J= 8,1, 7,7 Гц), 7,20-7,40(10H,м).
FAB M.-c. m/z: 468 (M+)Пример 6 К раствору [5-(этоксикарбонилметокси)-2-гидрокси- 1,2,3,4-тетрагидро-2-нафтил] метил-N,N-дифенилкарбамата (570 мг) в этаноле (20 мл) добавляют 1N раствора гидроксида натрия (1,2 мл). После перемешивания в течение 4 часов при комнатной температуре удаляют растворитель в вакууме, и получают натриевую соль [5-(карбоксиметокси)-2-гидрокси-1,2,3,4-тетрагидро-2- нафтил] метил-N,N-дифенилкарбамата (500 мг). ИК (вазел.масло): 3300-3400, 1700, 1580 см-1 ЯМР (D2O,  ): 1,2-1,6(2H,м), 2,1-2,6(4H,м), 3,72(1H, д, J= 11,0 Гц), 3,85(1H, д, J= 11,0 Гц), 4,13(2H,с), 6,29(2H,м), 6,4-7,0 (12H,м).
FAB М.-c. m/z: 470 (М++1).
Препаративный пример 6 ): 1,2-1,6(2H,м), 2,1-2,6(4H,м), 3,72(1H, д, J= 11,0 Гц), 3,85(1H, д, J= 11,0 Гц), 4,13(2H,с), 6,29(2H,м), 6,4-7,0 (12H,м).
FAB М.-c. m/z: 470 (М++1).
Препаративный пример 6К раствору (5-метокси-1,2,3,4-тетрагидро-2-нафтил)метанола (1,00 г) в сухом пиридине (10 мл) при охлаждении на ледяной бане добавляют п-толуолсульфонилхлорид (1,15 г). Смесь перемешивают в течение 1 дня при комнатной температуре и распределяют между этилацетатом и водой. Органический слой отделяют, промывают водой (дважды), 1N соляной кислотой и солевым раствором, сушат над сульфатом магния и упаривают в вакууме. Остаток очищают колоночной хроматографией на силикагеле (н-гексан : этилацетат = 10:1), и получают (5-метокси-1,2,3,4-тетрагидро-2-нафтил)метил-п-толуолсульфонат (1,70 г) в виде белого порошка. Т.пл. 81-82oC ИК (вазел.масло): 1590, 1370, 1260, 1180, 790, 770, 720 см-1 M.-c. (+ APCI): 347 (M++1). ЯМР (CDCl3,  ): 1,10-1,50(1H,м), 1,80-2,20(2H,м), 2,20- 2,60(2H,м), 2,45(3H,c), 2,60-2,95(2H,м), 3,79(3H,c), 3,99(2H, д, J= 6,6 Гц), 6,64(1H, д, J= 7,9 Гц), 6,64(1H, д, J = 7,9 Гц), 7,07 (1H, дд, J = 7,9 Гц, 7,9 Гц), 7,34(2H, д, J= 8,2 Гц), 7,79(2H, д, J= 8,2 Гц).
Препаративный пример 7 ): 1,10-1,50(1H,м), 1,80-2,20(2H,м), 2,20- 2,60(2H,м), 2,45(3H,c), 2,60-2,95(2H,м), 3,79(3H,c), 3,99(2H, д, J= 6,6 Гц), 6,64(1H, д, J= 7,9 Гц), 6,64(1H, д, J = 7,9 Гц), 7,07 (1H, дд, J = 7,9 Гц, 7,9 Гц), 7,34(2H, д, J= 8,2 Гц), 7,79(2H, д, J= 8,2 Гц).
Препаративный пример 7Раствор 1,1-дифенилацетона (25 мг) и моногидрата глиоксиловой кислоты (41,6 г) в 1,2-диметоксиэтане (75 мл) кипятят с обратным холодильником в течение 3 суток. Раствор распределяют между этилацетатом и водой. Органический слой промывают водой (дважды) и упаривают в вакууме. Остаток обрабатывают этилацетатом и раствором аммиака (200 мл), и водный слой отделяют. К водному слою добавляют гидразингидрат (22,6 г), и смесь перемешивают в течение 2 часов при 100oC. После охлаждения реакционную смесь экстрагируют этилацетатом. Экстракт сушат над сульфатом магния и упаривают в вакууме. Остаток перекристаллизовывают из этилацетата, и получают 6-дифенилметил-3(2H)-пиридазинон (6,26 г) в виде белого порошка. Т.пл. 161-162oC. ИК (вазел.масло): 3300-2800, 1660, 1600, 760, 740, 700 см-1 ЯМР (CDCl3,  ): 5,44(1H,с), 6,88(1H, д, J= 9,8 Гц), 7,10-7,40(11H, м), 11,29(1H, шс).
М.-с. (+ APCI): 263 (М++1).
Элементный анализ. Для C17H14N2O ): 5,44(1H,с), 6,88(1H, д, J= 9,8 Гц), 7,10-7,40(11H, м), 11,29(1H, шс).
М.-с. (+ APCI): 263 (М++1).
Элементный анализ. Для C17H14N2Oвычислено: C 77,84, H-5,38, N-10,68 найдено: C-77,76, H-5,39, N-10,66. Препаративный пример 8 Суспензию 6-дифенилметил-3(2H)-пиридазинона (0,58 г) и гидрида натрия (60%, 110 мг) в сухом N,N-диметилформамиде (7 мл) перемешивают при 0oC в течение 30 минут. К суспензии при комнатной температуре добавляют по каплям раствор (5-метокси-1,2,3,4-тетрагидро-2-нафтил)метил-п-толуолсульфоната (0,77 г) в сухом N,N-диметилформамиде (5 мл). Смесь перемешивают в течение 6 часов, и выливают ее в 1N соляную кислоту со льдом, и экстрагируют этилацетатом. Экстракт отделяют, промывают водой (дважды) и солевым раствором, сушат над сульфатом магния и упаривают в вакууме. Остаток очищают колоночной хроматографией на силикагеле (н-гексан:этилацетат = 5:1  3:1), и получают 2-[(1,2,3,4-тетрагидро-5-метокси-2-нафтил)метил] -6-дифенилметил- 3(2H)-пиридазинон (0,61 г) в виде бледно-желтого масла.
ИК (пленка): 1660, 1590, 770, 730, 700 см-1 3:1), и получают 2-[(1,2,3,4-тетрагидро-5-метокси-2-нафтил)метил] -6-дифенилметил- 3(2H)-пиридазинон (0,61 г) в виде бледно-желтого масла.
ИК (пленка): 1660, 1590, 770, 730, 700 см-1ЯМР (CDCl3,  ): 1,35-1,55(1H, м), 1,80-2,00(1H,м), 2,25-3,00(5H,м), 3,80(3H, c), 4,05-4,25(2H,м), 5,45(1H,c), 6,1(1H, д, J= 6,9 Гц), 6,64(1H, д, J= 6,9 Гц), 6,87(1H, д, J= 9,5 Гц), 7,00-7,35(12H,м).
М.-с. (+ APCI): 437 (М++1).
Препаративный пример 9 ): 1,35-1,55(1H, м), 1,80-2,00(1H,м), 2,25-3,00(5H,м), 3,80(3H, c), 4,05-4,25(2H,м), 5,45(1H,c), 6,1(1H, д, J= 6,9 Гц), 6,64(1H, д, J= 6,9 Гц), 6,87(1H, д, J= 9,5 Гц), 7,00-7,35(12H,м).
М.-с. (+ APCI): 437 (М++1).
Препаративный пример 9К раствору 2-[(1,2,3,4-тетрагидро-5-метокси-2-нафтил)метил] -6-дифенилметил-3(2H)-пиридазинона (0,60 г) в сухом дихлорметане (5 мл), при охлаждении на ледяной бане, добавляют по каплям 1N раствор трибромида бора в дихлорметане (1,5 мл). Смесь перемешивают при той же температуре в течение 2,5 часов. Смесь выливают в 1N соляную кислоту и экстрагируют этилацетатом. Экстракт отделяют, промывают солевым раствором, сушат над сульфатом магния и упаривают в вакууме. Остаток очищают колоночной хроматографией на силикагеле (н- гексан : этилацетат = 1:1), и получают 2-[(1,2,3,4-тетрагидро-5- гидрокси-2-нафтил)метил] -6-дифенилметил-3(2H)-пиридазинон (0,44 г) в виде бледно-желтого масла. ИК (пленка): 3000-3500, 1650, 770, 700 см-1 ЯМР (CDCl3,  ): 1,35-1,66(1H,м), 1,80-2,00(1H,м), 2,25- 2,90(5H,м), 4,00-4, 30(2H,м), 5,47(1H,c), 6,55-6,65(2H,м), 6,90- 7,35(14H,м).
M.c.-c. (+ APCI): 423 (М++1).
Пример 7 ): 1,35-1,66(1H,м), 1,80-2,00(1H,м), 2,25- 2,90(5H,м), 4,00-4, 30(2H,м), 5,47(1H,c), 6,55-6,65(2H,м), 6,90- 7,35(14H,м).
M.c.-c. (+ APCI): 423 (М++1).
Пример 7Суспензию 2-[(1,2,3,4-тетрагидро-5-гидрокси-2- нафтил)метил]-6-дифенилметил-3(2H)-пиридазинона (425 мг), этилбромацетата (184 мг) и карбоната калия (152,9 мг) в ацетонитриле (15 мл) кипятят с обратным холодильником в течение 6 часов. После охлаждения выпавшее в осадок твердое вещество отфильтровывают, и фильтрат упаривают в вакууме. Остаток очищают колоночной хроматографией на силикагеле (н-гексан : этилацетат = 1:1), и получают 2-[(1,2,3,4-тетрагидро-5-этоксикарбонилметокси- 2-нафтил)метил] -6-дифенилметил-3(2H)-пиридазинон (0,43 г) в виде бледно-желтого масла. ИК (пленка): 1750, 1660, 1580, 760, 720, 700 см-1 ЯМР (CDCl3,  ): 1,35-1,60(1H,м), 1,29(3H, т, J= 7,1 Гц), 1,80-2,00(1H, м), 2,20-3,20(5H, м), 4,15-4,20(2H,м), 4,25(2H, к, J= 7,1 Гц), 4,61(2H,с), 5,45(1H,с), 6,51(1H, д,J= 7,8 Гц), 6,64(1H, д, J= 7,8 Гц), 6,86(1H, д,J= 9,5 Гц), 7,08(1H, дд, J= 7,8 Гц, 7,8 Гц), 7,10-7,35(11H,м).
М.-с. (+ APCI): 509 (М++1).
Пример 8 ): 1,35-1,60(1H,м), 1,29(3H, т, J= 7,1 Гц), 1,80-2,00(1H, м), 2,20-3,20(5H, м), 4,15-4,20(2H,м), 4,25(2H, к, J= 7,1 Гц), 4,61(2H,с), 5,45(1H,с), 6,51(1H, д,J= 7,8 Гц), 6,64(1H, д, J= 7,8 Гц), 6,86(1H, д,J= 9,5 Гц), 7,08(1H, дд, J= 7,8 Гц, 7,8 Гц), 7,10-7,35(11H,м).
М.-с. (+ APCI): 509 (М++1).
Пример 8Раствор 2-[(1,2,3,4-тетрагидро-5-этоксикарбонилметокси-2-нафтил) метил] -6-дифенилметил-3(2H)-пиридазинона (0,43 г) в 1,2-диметоксиэтане (9,0 мл) и 1,0N водном растворе гидроксида натрия (0,85 мл) перемешивают при комнатной температуре в течение 5 часов. Раствор упаривают в вакууме, и остаток экстрагируют этилацетатом и 1N соляной кислотой. Органический слой отделяют и промывают водой и солевым раствором, сушат над сульфатом магния и упаривают в вакууме. Остаток кристаллизуют из н-гексана, этилацетата и эфира, и получают 2-[(1,2,3,4-тетрагидро-5-карбоксиметокси-2-нафтил)метил] -6- дифенилметил-3(2H)-пиридазинон (330 мг) в виде белого порошка. Т.пл. 176-178oC ИК (вазел.масло): 2600-2200, 1740, 1640, 770, 700 см-1 ЯМР (ДМСО-d6,  ): 1,20-1,45(1H,м), 1,70-1,90(1H,м), 2,10- 2,90(5H,м), 3,90-4,10(2H, м), 4,65(2H,c), 5,57(1H,c), 6,55- 6,65(2H,м), 6,90-7,05(2H,м), 7,20-7,35(11H,м), 12,96(1H,шс).
М.-с. (+ APCI): 481 (М++1).
Препаративный пример 10 ): 1,20-1,45(1H,м), 1,70-1,90(1H,м), 2,10- 2,90(5H,м), 3,90-4,10(2H, м), 4,65(2H,c), 5,57(1H,c), 6,55- 6,65(2H,м), 6,90-7,05(2H,м), 7,20-7,35(11H,м), 12,96(1H,шс).
М.-с. (+ APCI): 481 (М++1).
Препаративный пример 10Смесь (1R,2S)-метил-[1-гидрокси-5-метокси-1,2,3,4-тетрагидро-2- нафтил] формиата (2,22 г) и 10% палладия-на-угле в метаноле (50 мл) перемешивают в атмосфере водорода (2-3 атм) при комнатной температуре в течение 22 часов. Катализатор отфильтровывают, и фильтрат упаривают в вакууме. Остаток очищают колоночной хроматографией на силикагеле (н-гексан:этилацетат = 4:1), и получают (S)-метил-(5-метокси-1,2,3,4-тетрагидро-2-нафтил) формиат в виде бесцветного масла (1,66 г). ЯМР (CDCl3,  ): 1,70-1,90(1H, м), 2,15-2,30(1H,м), 2,50-3,00(5H,м), 3,74(3H,c), 3,81(3H,c), 6,60-6,75(2H,м), 7,05- 7,15(1H,м).
М.-с. (+ APCI): 221 (М++1).
Препаративный пример 11 ): 1,70-1,90(1H, м), 2,15-2,30(1H,м), 2,50-3,00(5H,м), 3,74(3H,c), 3,81(3H,c), 6,60-6,75(2H,м), 7,05- 7,15(1H,м).
М.-с. (+ APCI): 221 (М++1).
Препаративный пример 11К смеси алюмогидрида лития (0,28 г) с сухим тетрагидрофураном (ТГФ) (5 мл) при -60oC в атмосфере азота добавляют по каплям раствор (S)-метил-[5-метокси-1,2,3,4-тетрагидро-2-нафтил] формиата (1,65 г) в ТГФ (7 мл). Через 1 час к реакционной смеси при -60oC добавляют по каплям смесь 1N раствора соляной кислоты (5 мл) и ТГФ (5 мл). Реакционную смесь обрабатывают этилацетатом и водой. Органический слой отделяют, промывают 1N соляной кислотой, раствором гидрокарбоната натрия и солевым раствором, сушат над сульфатом магния и упаривают в вакууме, получают (5-метокси-1,2,3,4-тетрагидро-2-нафтил) метанол в виде белого порошка (1,23 г). [  ]3D0 = -71,98 ]3D0 = -71,98 (C=1,26, CH2Cl2) (C=1,26, CH2Cl2)ЯМР (CDCl3,  ): 1,25-2,20(4H, м), 2,40-2,65(2H,м), 2,80-3,00(2H,м), 3,62(2H, д, J= 6,3 Гц), 3,81(3H,с), 6,6(1H, д,J= 7,9 Гц), 6,72(1H, д,J= 7,9 Гц), 7,08(1H, дд, J = 7,9 Гц, 7,9 Гц).
Препаративный пример 12 ): 1,25-2,20(4H, м), 2,40-2,65(2H,м), 2,80-3,00(2H,м), 3,62(2H, д, J= 6,3 Гц), 3,81(3H,с), 6,6(1H, д,J= 7,9 Гц), 6,72(1H, д,J= 7,9 Гц), 7,08(1H, дд, J = 7,9 Гц, 7,9 Гц).
Препаративный пример 12По способу, подобному способу препаративного примера 6, получают (S)-(5-метокси-1,2,3,4-тетрагидро-2-нафтил)метил метансульфонат. [  ]2D5 = -45,70 ]2D5 = -45,70 (C= 1,00, CH2Cl2) (C= 1,00, CH2Cl2)ИК (пленка): 1580, 1340, 1180 см-1 ЯМР (CDCl3,  ): 1,30-1,60(1H, м), 1,90-2,30(2H,м), 2,45-2,70(2H,м), 2,80-3,00(2H, м), 3,03(3H, c), 3,81(3H, c), 4,20(2H,д, J= 6,5 Гц), 6,60-6,75(2H,м), 7,00- 7,25(1H,м).
М.-с. (+ APCl): 271 (M++1).
Препаративный пример 13 ): 1,30-1,60(1H, м), 1,90-2,30(2H,м), 2,45-2,70(2H,м), 2,80-3,00(2H, м), 3,03(3H, c), 3,81(3H, c), 4,20(2H,д, J= 6,5 Гц), 6,60-6,75(2H,м), 7,00- 7,25(1H,м).
М.-с. (+ APCl): 271 (M++1).
Препаративный пример 13К раствору метил-(5-метокси-3,4-дигидро-2-нафтил)формиата (0,75 г) в толуоле (10 мл) при 4oC  6oC в атмосфере азота добавляют по каплям раствор диизобутилалюмогидрида (1,02N в толуоле (6,7 мл)). Реакционную смесь перемешивают при таких же условиях в течение 2,5 часов. Смесь выливают в насыщенный раствор хлорида аммония, и органический слой отделяют, промывают солевым раствором, сушат над сульфатом магния и упаривают в вакууме. Получают сырой (5-метокси-3,4-дигидро-2-нафтил)метанол в виде бесцветного масла (0,66 г).
ИК (пленка): 3700-3100, 1580 см-1 6oC в атмосфере азота добавляют по каплям раствор диизобутилалюмогидрида (1,02N в толуоле (6,7 мл)). Реакционную смесь перемешивают при таких же условиях в течение 2,5 часов. Смесь выливают в насыщенный раствор хлорида аммония, и органический слой отделяют, промывают солевым раствором, сушат над сульфатом магния и упаривают в вакууме. Получают сырой (5-метокси-3,4-дигидро-2-нафтил)метанол в виде бесцветного масла (0,66 г).
ИК (пленка): 3700-3100, 1580 см-1ЯМР (CDCl3,  ): 2,28(2H, т,J= 8,5 Гц), 2,85(2H, т, J= 8,5 Гц), 3,83(3H, с), 4,22(2H, д, J= 4,7 Гц), 6,42(1H, т,J= 1,5 Гц), 6,60-6,80(2H,м), 7,05-7,15(1H,м).
М.-с. (+ APCI): 173 (М++1) ): 2,28(2H, т,J= 8,5 Гц), 2,85(2H, т, J= 8,5 Гц), 3,83(3H, с), 4,22(2H, д, J= 4,7 Гц), 6,42(1H, т,J= 1,5 Гц), 6,60-6,80(2H,м), 7,05-7,15(1H,м).
М.-с. (+ APCI): 173 (М++1)Препаративный пример 14 Четырехбромистый углерод (1,00 г х 4) при комнатной температуре добавляют порциями к раствору (3,4-дигидро-5-метокси-2-нафтил) метанола (2,00 г) и трифенилфосфина (4,14 г) в дихлорметане (40 мл). Реакционную смесь перемешивают в течение 2 суток и упаривают в вакууме. К остатку добавляют гексан и диэтиловый эфир, белый порошок отфильтровывают, и фильтрат упаривают в вакууме. Получают сырой 3-бромметил-1,2-дигидро-8-метоксинафталин в виде бледно-желтого масла. Препаративный пример 15 К раствору 2-(5-метокси-1,2,3,4-тетрагидро-1-нафтил)этанола (0,20 г) и трифенилфосфина (0,42 г) в дихлорметане (10 мл) при 5oC добавляют тетрабромметан (0,90 г). Раствор перемешивают при 5oC в течение 1,5 часов и упаривают в вакууме. К остатку добавляют этилацетат, и отфильтровывают нерастворимые вещества. Раствор в этилацетате упаривают в вакууме. Остаток хроматографируют на силикагеле (н-гексан), и получают 2-(5-метокси-1,2,3,4-тетрагидро-1-нафтил)этилбромид (0,18 г) в виде бесцветного масла. ЯМР (CDCl3,  ): 1,64-1,85(4H,м), 2,03- 2,29(2H,м), 2,57-2,76(2H,м), 2,98-3,02(1H, м), 3,45-3,60(2H, м), 3,81(3H, с), 6,68(1H, д, J= 7,9 Гц), 6,80(1H, д, J= 7,9 Гц), 7,20(1H, дд,J= 7,9, 7,9 Гц).
М.-с. (APCI) m/z: 269, 271 (М++1).
Препаративный пример 16 ): 1,64-1,85(4H,м), 2,03- 2,29(2H,м), 2,57-2,76(2H,м), 2,98-3,02(1H, м), 3,45-3,60(2H, м), 3,81(3H, с), 6,68(1H, д, J= 7,9 Гц), 6,80(1H, д, J= 7,9 Гц), 7,20(1H, дд,J= 7,9, 7,9 Гц).
М.-с. (APCI) m/z: 269, 271 (М++1).
Препаративный пример 16(S)-2-[(1,2,3,4-тетрагидро-5-метокси-2-нафтил)метил] -6-дифенилметил-3(2H)-пиридазинон получают из (S)-(5-метокси-1,2, 3,4-тетрагидро-2-нафтил)метилметансульфоната по способу, подобному способу препаративного примера 8. [  ]3D0 = -29,76 ]3D0 = -29,76 (C=0,86, CH2Cl2) (C=0,86, CH2Cl2)ЯМР (CDCl3,  ): 1,35-1,55(1H, м), 1,80-2,00(1H,м), 2,25-3,00(5H,м), 3,80(3H,c), 4,05-4,25(2H,м), 5,45(lH,c), 6,61(1H, д, J= 6,9 Гц), 6,64(1H, д, J= 6,9 Гц), 6,87(1H, д, J = 9,5 Гц), 7,00-7,35(12H,м).
М.-с. (+ APCI): 437 (М++1).
Препаративный пример 17 ): 1,35-1,55(1H, м), 1,80-2,00(1H,м), 2,25-3,00(5H,м), 3,80(3H,c), 4,05-4,25(2H,м), 5,45(lH,c), 6,61(1H, д, J= 6,9 Гц), 6,64(1H, д, J= 6,9 Гц), 6,87(1H, д, J = 9,5 Гц), 7,00-7,35(12H,м).
М.-с. (+ APCI): 437 (М++1).
Препаративный пример 17К раствору трет-бутоксида калия (0,39 г) и 18-краун-6 (0,08 г) в сухом N, N-диметилформамиде (4 мл) при комнатной температуре добавляют 6-дифенилметил-3(2H)-пиридазинон (0,83 г). Через 10 минут к раствору добавляют 3-бромметил-1,2-дигидро-8-метоксинафталин (0,80 г), и смесь перемешивают при той же температуре в течение ночи. Реакционную смесь выливают в этилацетат и 1N соляную кислоту, и органический слой отделяют, промывают его водой, водным раствором гидрокарбоната натрия и солевым раствором, сушат над сульфатом магния и упаривают в вакууме. Остаток очищают колоночной хроматографией на силикагеле (н-гексан: этилацетат = 1:1), и получают 2-[(3,4-дигидро-5-метокси-2-нафтил)метил]-6- дифенилметил-3(2H)-пиридазинон (0,55 г). ИК (CH2Cl2): 1670, 1600 см-1 ЯМР (CDCl3,  ): 2,22(2H, т,J= 8,0 Гц), 2,77(2H, т, J= 8,0 Гц), 3,82(3H, с), 4,84(2H,с), 5,44(1H,с), 6,26(1H,с), 6,22(1H, д, J= 8,3 Гц), 6,73(1H, д, J= 7,5 Гц), 6,86(1H, д, J=9,6 Гц), 7,00-7,33(12H,м).
М.-с. (+APCI): 435 (М++1).
Препаративный пример 18 ): 2,22(2H, т,J= 8,0 Гц), 2,77(2H, т, J= 8,0 Гц), 3,82(3H, с), 4,84(2H,с), 5,44(1H,с), 6,26(1H,с), 6,22(1H, д, J= 8,3 Гц), 6,73(1H, д, J= 7,5 Гц), 6,86(1H, д, J=9,6 Гц), 7,00-7,33(12H,м).
М.-с. (+APCI): 435 (М++1).
Препаративный пример 18Перечисленные далее соединения получают по способу, подобному способу препаративного примера 17. (1) 1-[(3,4-Дигидро-5-метокси-2-нафтил)метил]-5-дифенилметил- 2(1H)-пиридон. ИК (CH2Cl2): 1670, 1600 см-1 ЯМР (CDCl3,  ): 2,16(2H, т,J=8,2 Гц), 2,75(2H, т, J=8,2 Гц), 3,83(3H, с), 4,62(2H, с), 5,23(1H,с), 6,15(1H,с), 6,55-6,60(2H,м), 6,70-6,85(2H,м), 7,05-7,35(12H,м).
М.-с. (+APCI): 434 (М++1).
(2) 1-[(3,4-Дигидро-5-метокси-2-нафтил)метил]-3-дифенилметил-2 (1H)-пиридон ): 2,16(2H, т,J=8,2 Гц), 2,75(2H, т, J=8,2 Гц), 3,83(3H, с), 4,62(2H, с), 5,23(1H,с), 6,15(1H,с), 6,55-6,60(2H,м), 6,70-6,85(2H,м), 7,05-7,35(12H,м).
М.-с. (+APCI): 434 (М++1).
(2) 1-[(3,4-Дигидро-5-метокси-2-нафтил)метил]-3-дифенилметил-2 (1H)-пиридонИК (CH2Cl2): 1650, 1600 см-1 ЯМР (CDCl3,  ): 2,18(2H,т, J=8,2Гц), 2,79(2H,т, J=8,2 Гц), 3,81(3H,с), 4,71(2H, с), 5,82(1H,с), 6,11(1H, т, J=6,8 Гц), 6,24(1H,с), 6,60-6,90(3H,м), 7,05-7,35(12H,м).
М.-с. (+ APCI): 434 (М++1) ): 2,18(2H,т, J=8,2Гц), 2,79(2H,т, J=8,2 Гц), 3,81(3H,с), 4,71(2H, с), 5,82(1H,с), 6,11(1H, т, J=6,8 Гц), 6,24(1H,с), 6,60-6,90(3H,м), 7,05-7,35(12H,м).
М.-с. (+ APCI): 434 (М++1)Препаративный пример 19 К раствору 6-дифенилметил-3(2H)-пиридазинона (0,22 г) и трет-бутоксида калия (0,20 г) в N,N-диметилформамиде (2 мл) при комнатной температуре добавляют раствор 2-(5-метокси-1,2,3,4-тетрагидро-1-нафтил)этилбромида (0,18 г) в N,N-диметилформамиде (3 мл). Реакционную смесь перемешивают в течение 2 часов при той же температуре, и обрабатывают ее водой и этилацетатом. Органический слой промывают водой (3 раза) и солевым раствором, сушат над сульфатом натрия и упаривают в вакууме. Остаток хроматографируют на силикагеле (н-гексан – этилацетат), и получают 2-[2-(5-метокси-1,2,3,4-тетрагидро-1-нафтил)этил]-6-дифенилметил- 3(2H)-пиридазинон (0,25 г) в виде масла. ЯМР (CDCl3,  ): 1,65-2,05(4H, м), 2,10-2,28(1H,м), 2,50-2,85(3H,м), 3,80(3H,c), 4,07-4,33(3H,м), 5,46(1H,c), 6,64(1H, д,J=8,5 Гц), 6,69(1H, д,J= 9,4 Гц), 6,84(1H,д, J=9,4 Гц), 7,02-7,36(12H,м).
М.-с. (APCI) m/z: 451 (М++1).
Препаративный пример 20 ): 1,65-2,05(4H, м), 2,10-2,28(1H,м), 2,50-2,85(3H,м), 3,80(3H,c), 4,07-4,33(3H,м), 5,46(1H,c), 6,64(1H, д,J=8,5 Гц), 6,69(1H, д,J= 9,4 Гц), 6,84(1H,д, J=9,4 Гц), 7,02-7,36(12H,м).
М.-с. (APCI) m/z: 451 (М++1).
Препаративный пример 20Перечисленные далее соединения получают по способу, подобному способу препаративного примера 9. (1) (S)-2-[(1,2,3,4-Тетрагидро-5-гидрокси-2-нафтил)метил]-6- дифенилметил-3(2H)-пиридазинон. [  ]2D5 = -30,28 ]2D5 = -30,28 (C=1,04, CH2Cl2) (C=1,04, CH2Cl2)ИК (пленка): 3500-3000, 1650, 770, 700 см-1 ЯМР (CDCl3,  ): 1,35-1,60(1H, м), 1,80-2,00(1H,м), 2,25-2,90(5H,м), 4,00-4,30(2H,м), 5,47(1H,c), 6,55-6,65(2H,м), 6,90- 7,35(14H,м).
М.-с. (+APCI): 423 (M++1).
(2) 2-[(3,4-Дигидро-5-гидрокси-2-нафтил)метил] -6- дифенилметил-3(2H)-пиридазинон.
Т.пл. 174-176oC ): 1,35-1,60(1H, м), 1,80-2,00(1H,м), 2,25-2,90(5H,м), 4,00-4,30(2H,м), 5,47(1H,c), 6,55-6,65(2H,м), 6,90- 7,35(14H,м).
М.-с. (+APCI): 423 (M++1).
(2) 2-[(3,4-Дигидро-5-гидрокси-2-нафтил)метил] -6- дифенилметил-3(2H)-пиридазинон.
Т.пл. 174-176oCИК (вазел.масло): 3200, 1650 см-1 ЯМР (ДМСО-d6,  ): 2,09(2H, т, J= 8,2 Гц), 2,62(2H, т, J= 8,2 Гц), 4,72(2H, с), 5,56(1H,с), 6,09(1H,с), 6,45(1H, д, J= 7,2 Гц), 6,65(1H, д, J= 7,2 Гц), 6,85- 6,95(2H,м), 7,15-7,40(11H,м), 9,23(1H,с).
М.-с. (+ APCI): 421 (М++1).
(3) 1-[(3,4-Дигидро-5-гидрокси-2-нафтил)метил] -6- дифенилметил-3(2H)-пиридон.
Т.пл. 178-180oC.
ИК (вазел.масло): 3150, 1650 см-1 ): 2,09(2H, т, J= 8,2 Гц), 2,62(2H, т, J= 8,2 Гц), 4,72(2H, с), 5,56(1H,с), 6,09(1H,с), 6,45(1H, д, J= 7,2 Гц), 6,65(1H, д, J= 7,2 Гц), 6,85- 6,95(2H,м), 7,15-7,40(11H,м), 9,23(1H,с).
М.-с. (+ APCI): 421 (М++1).
(3) 1-[(3,4-Дигидро-5-гидрокси-2-нафтил)метил] -6- дифенилметил-3(2H)-пиридон.
Т.пл. 178-180oC.
ИК (вазел.масло): 3150, 1650 см-1ЯМР (CDCl3,  ): 2,15(2H, т, J=8,2 Гц), 2,70(2H, т, 7= 8,2 Гц), 4,62(2H, с), 5,26(1H, с), 6,11(1H, с), 6,54(1H, д, J= 7,3 Гц), 6,65-6,75(2H,м), 6,85(1H, д,J= 2,5 Гц), 6,95-7,33(13H,м).
М.-с. (+ APCI): 420 (М++1).
(4) 1-[(3,4-Дигидро-5-гидрокси-2-нафтил)метил]-3-дифенилметил-2 (1H)-пиридон.
Т.пл. 196-197oC.
ИК (вазел.масло): 3250, 1640 см-1 ): 2,15(2H, т, J=8,2 Гц), 2,70(2H, т, 7= 8,2 Гц), 4,62(2H, с), 5,26(1H, с), 6,11(1H, с), 6,54(1H, д, J= 7,3 Гц), 6,65-6,75(2H,м), 6,85(1H, д,J= 2,5 Гц), 6,95-7,33(13H,м).
М.-с. (+ APCI): 420 (М++1).
(4) 1-[(3,4-Дигидро-5-гидрокси-2-нафтил)метил]-3-дифенилметил-2 (1H)-пиридон.
Т.пл. 196-197oC.
ИК (вазел.масло): 3250, 1640 см-1ЯМР (ДМСО-d6,  ): 2,10(2H, т, J= 8,3 Гц), 2,64(2H, т, J= 8,3 Гц), 4,63(2H, с), 5,65(1H,с), 5,96(1H,с), 6,24(1H, т, J= 6,8 Гц), 6,42 (1H, д,J= 7,2 Гц), 6,64 (1H, д, J = 7,5 Гц), 6,85-7,35(12H,м), 7,55-7,60(1H,м), 9,24(1H,с).
М.-с. (+APCI): 420 (М++1).
Препаративный пример 21 ): 2,10(2H, т, J= 8,3 Гц), 2,64(2H, т, J= 8,3 Гц), 4,63(2H, с), 5,65(1H,с), 5,96(1H,с), 6,24(1H, т, J= 6,8 Гц), 6,42 (1H, д,J= 7,2 Гц), 6,64 (1H, д, J = 7,5 Гц), 6,85-7,35(12H,м), 7,55-7,60(1H,м), 9,24(1H,с).
М.-с. (+APCI): 420 (М++1).
Препаративный пример 21Смесь (1,2,3,4-тетрагидро-5-гидрокси-2-нафтил)метил-N, N- дифенилкарбамата (100 г) и N-хлорсукцинимида (35,8 мг) в 1,4-диоксане (1,5 мл) перемешивают при 100oC в течение 5 часов, охлаждают до комнатной температуры, и обрабатывают этилацетатом и солевым раствором. Органический слой промывают солевым раствором, сушат над сульфатом магния и упаривают в вакууме. Остаток хроматографируют на силикагеле (толуол – этилацетат), и получают (6- или 8-хлор-1,2,3,4-тетрагидро-5-гидрокси-2-нафтил) метил-N,N-дифенилкарбамат (62 мг) в виде бесцветного твердого вещества. Т.пл. 138-144oC. ИК (вазел.масло): 3320, 1675, 1575, 1220 см-1 ЯМР (CDCl3,  ): 1,20-1,41(1H,м), 1,85-2,1(2H,м), 2,18-2,32(1H,м), 2,42- 2,56(1H, м), 2,74-2,94(2H, м), 4,07-4,28(2H,см), 4,91(1H,с), 6,54(1H, д, J= 8,5 Гц), 7,05 (1H, д, J= 8,5 Гц), 7,16-7,39(10H,м).
(+) APCI М.-с. m/z: 408 (M++1).
Препаративный пример 22 ): 1,20-1,41(1H,м), 1,85-2,1(2H,м), 2,18-2,32(1H,м), 2,42- 2,56(1H, м), 2,74-2,94(2H, м), 4,07-4,28(2H,см), 4,91(1H,с), 6,54(1H, д, J= 8,5 Гц), 7,05 (1H, д, J= 8,5 Гц), 7,16-7,39(10H,м).
(+) APCI М.-с. m/z: 408 (M++1).
Препаративный пример 22Раствор диэтилазодикарбоксилата (871 мг) в тетрагидрофуране (4 мл) при перемешивании при комнатной температуре постепенно добавляют к раствору (1,2,3,4-тетрагидро-5-метокси-2-нафтил)метанола (961 мг), фталимида (736 мг) и трифенилфосфина (1,31 г) в тетрагидрофуране (10 мл), и получающуюся в результате смесь перемешивают при той же температуре в течение 24 часов. Реакционную смесь упаривают в вакууме, и остаток хроматографируют на силикагеле (толуол). Элюат упаривают в вакууме, и остаток порошкуют с н-гексаном, получают N-[(1,2,3,4-тетрагидро-5-метокси-2-нафтил)метил] фталимид (888 мг) в виде бесцветного порошка. Т.пл. 143-144oC ИК (вазел.масло): 1770, 1705, 1580, 1260 см-1 ЯМР (CDCl3,  ): 1,33-1,55(1H, м), 1,93-2,03(1H,м), 2,15-2,25(1H,м), 2,35-2,63(2H, м), 2,75-2,97(2H, м), 3,71(2H, д, J= 7,1 Гц), 3,79(3H,с), 6,62-6,69(2H,м), 7,06(1H, т, J= 7,9 Гц), 7,68-7,77(2H,м), 7,82-7,90(2H,м).
(+) APCI М.-с. m/z: 322 (М++1).
Препаративный пример 23 ): 1,33-1,55(1H, м), 1,93-2,03(1H,м), 2,15-2,25(1H,м), 2,35-2,63(2H, м), 2,75-2,97(2H, м), 3,71(2H, д, J= 7,1 Гц), 3,79(3H,с), 6,62-6,69(2H,м), 7,06(1H, т, J= 7,9 Гц), 7,68-7,77(2H,м), 7,82-7,90(2H,м).
(+) APCI М.-с. m/z: 322 (М++1).
Препаративный пример 23По способу, подобному способу препаративного примера 4, получают N-[(1,2,3,4-тетрагидро-5-гидрокси-2-нафтил)метил]фталимид. ИК (вазел.масло): 3310, 1765, 1690, 1585 см-1 ЯМР (ДМСО-d6,  ): 1,38(1H,м), 1,91(1H,м), 2,05(1H,м), 2,34-2,5(2H,м), 2,69-2,77(2H,м), 3,58(2H, д,J= 7,0 Гц), 6,47(1H, д,J= 7,4 Гц), 6,56(1H, д,J= 7,4 Гц), 6,86(1H, т,J = 7,4 Гц), 7,81-7,93(4H,м), 9,15(1H,с).
(+) APCI М.-с. m/z: 308 (М++1).
Препаративный пример 24 ): 1,38(1H,м), 1,91(1H,м), 2,05(1H,м), 2,34-2,5(2H,м), 2,69-2,77(2H,м), 3,58(2H, д,J= 7,0 Гц), 6,47(1H, д,J= 7,4 Гц), 6,56(1H, д,J= 7,4 Гц), 6,86(1H, т,J = 7,4 Гц), 7,81-7,93(4H,м), 9,15(1H,с).
(+) APCI М.-с. m/z: 308 (М++1).
Препаративный пример 24Раствор N-[(1,2,3,4-тетрагидро-5-гидрокси-2-нафтил)метил] фталимида (634 мг) и моногидрата гидразина (309 мг) в этаноле (14 мл) кипятят с обратным холодильником в течение 3 часов, охлаждают до комнатной температуры и упаривают в вакууме. Остаток хроматографируют на оксиде алюминия (метиленхлорид – метанол), и получают-6-(аминометил)-5,6,7,8-тетрагидро-1- нафтол (281 мг) в виде бесцветного порошка. Т.пл. 183-192oC ИК (вазел.масло): 3350-3100, 2750-2300, 1580 см-1 ЯМР (ДМСО-d6,  ): 1,11-1,32(1H,м), 1,58(1H,м), 1,91- 1,97(1H,м), 2,23- 2,45(2H, м), 2,68-2,80(2H,м), 3,1(3H,ш), 6,49(1H,д, J=7,6 Гц), 6,55(1H, д,J= 7,8 Гц), 6,85(1H, т, J=7,7 Гц).
(+) APCI М.-с. m/z: 178 (М++1) ): 1,11-1,32(1H,м), 1,58(1H,м), 1,91- 1,97(1H,м), 2,23- 2,45(2H, м), 2,68-2,80(2H,м), 3,1(3H,ш), 6,49(1H,д, J=7,6 Гц), 6,55(1H, д,J= 7,8 Гц), 6,85(1H, т, J=7,7 Гц).
(+) APCI М.-с. m/z: 178 (М++1)Препаративный пример 25 Раствор 4-нитрофенилхлорформиата (2,02 г) в дихлорметане (15 мл) при охлаждении льдом и перемешивании добавляют по каплям к раствору бензгидрола (1,84 г) и пиридина (1,19 г) в дихлорметане (18 мл). Получающуюся в результате смесь некоторое время перемешивают при той же температуре, и оставляют ее стоять при комнатной температуре в течение 3 суток. Реакционную смесь последовательно промывают водой со льдом, 1N соляной кислотой со льдом и солевым раствором со льдом, сушат над сульфатом магния и упаривают в вакууме. Остаток хроматографируют на силикагеле (толуол – этилацетат), и получают бензгидрил(4-нитрофенил) карбонат (3,32 г) в виде бесцветных кристаллов. Т.пл. 53-59oC ИК (пленка): 1770, 1520, 1345, 1260-1180 см-1 ЯМР (CDCl3,  ):6,81(1H,с), 7,30-7,47(12H,м), 8,25(2H, д, J = 9,2 Гц).
(+) APCI М.-.с m/z: 167.
Препаративный пример 26 ):6,81(1H,с), 7,30-7,47(12H,м), 8,25(2H, д, J = 9,2 Гц).
(+) APCI М.-.с m/z: 167.
Препаративный пример 26Раствор 6-аминометил-5,6,7,8-тетрагидро-1-нафтола (23 мг) и 4-нитрофенил(бензгидрил) карбоната (45 мг) в N,N-диметилформамиде (0,5 мл) перемешивают при 50oC в течение 2 часов, охлаждают до комнатной температуры и экстрагируют этилацетатом. Экстракт последовательно промывают водой, водным раствором бикарбоната натрия (три раза) и солевым раствором, сушат над сульфатом магния и упаривают в вакууме. Остаток хроматографируют на силикагеле (толуол – этилацетат), и получают бензгидрил-N-[(1,2,3,4-тетрагидро-5-гидрокси- 2-нафтил)метил]карбамат (40 мг) в виде масла. ИК (пленка): 3350, 1695 см-1 ЯМР (CDCl3,  ): 1,35-1,45(1H,м),1,94(2H,м), 2,45- 2,6(2H,м), 2,76-2,86(2H, м), 3,22(2H, т, J = 6,3 Гц), 5,04(1H,м), 6,58(1H, д,J=7,9 Гц), 6,64(1H, д,J=7,6Гц), 6,81(1H,с), 6,97(1H,т,J=7,8Гц), 7,15-7,35(11H,м).
(+) APCI М.-.с m/z: 167.
Препаративный пример 27 ): 1,35-1,45(1H,м),1,94(2H,м), 2,45- 2,6(2H,м), 2,76-2,86(2H, м), 3,22(2H, т, J = 6,3 Гц), 5,04(1H,м), 6,58(1H, д,J=7,9 Гц), 6,64(1H, д,J=7,6Гц), 6,81(1H,с), 6,97(1H,т,J=7,8Гц), 7,15-7,35(11H,м).
(+) APCI М.-.с m/z: 167.
Препаративный пример 27(6RS)-5,6,7,8-Тетрагидро-6-[((1S)-1-фенилэтил)амино] -1-нафтол получают из гидрохлорида (2RS)-1,2,3,4-тетрагидро-5-метокси-N- ((1S)-1-фенилэтил)-2-нафтиламина по способу, подобному способу препаративного примера 9. ИК (пленка): 3500-3350, 1585 см-1 ЯМР (CDCl3,  ): 1,38(3H, д,J=6,6 Гц), 1,5-2,2(3H,м), 2,45-2,65(2H,м), 2,75-2,85(2H,м), 4,05(1H, к, J=6,6 Гц), 6,4-7,35(9H,м).
(+) APCI М.-с. m/z: 268 (М++1).
Препаративный пример 28 ): 1,38(3H, д,J=6,6 Гц), 1,5-2,2(3H,м), 2,45-2,65(2H,м), 2,75-2,85(2H,м), 4,05(1H, к, J=6,6 Гц), 6,4-7,35(9H,м).
(+) APCI М.-с. m/z: 268 (М++1).
Препаративный пример 28Раствор (6RS)-5,6,7,8-тетрагидро-6-[((1S)-1-фенилэтил)амино] -1-нафтола (267 мг) в диметилсульфоксиде (3 мл) при комнатной температуре, в атмосфере азота и при перемешивании, в течение 15 минут добавляют по каплям к суспензии 60% гидрида натрия (44 мг, промыт н-гексаном) в диметилсульфоксиде (0,5 мл), смесь перемешивают при 50oC в течение 10 минут, и охлаждают до комнатной температуры. Добавляют этилбромацетат (167 мг) в диметилсульфоксиде (1 мл), и получающуюся в результате смесь перемешивают при той же температуре в течение 2 часов. Реакционную смесь выливают в воду со льдом и экстрагируют этилацетатом. Экстракт промывают дважды солевым раствором, сушат над сульфатом натрия и упаривают в вакууме. Остаток хроматографируют на силикагеле (дихлорметан – этанол), и получают этил-[(6RS)-5,6,7,8-тетрагидро- 6-[((1S)-фенилэтил)амино] -1-нафтилокси]ацетат (243 мг) в виде коричневого масла. ИК (пленка): 3320, 1755, 1730 (плечо), 1585, 1195 см-1 ЯМР (CDCl3,  ): 1,25(3H, т,J= 7,1 Гц), 1,37(3H, д, J=6,6 Гц), 1,48(3H, шм), 2,09(1H, шм), 2,48-3,02(4H,м), 4,04(1H, к, J=6,6 Гц), 4,25(2H, к,J=7,1 Гц), 4,58(2H,с), 6,49(1H, д,J= 8,0 Гц), 6,67(1H, д,J=8,0 Гц), 7,01(1H, т, J= 8,0 Гц), 7,20- 7,33(5H,м).
(+) APCI М.-.с: 354(М++1) ): 1,25(3H, т,J= 7,1 Гц), 1,37(3H, д, J=6,6 Гц), 1,48(3H, шм), 2,09(1H, шм), 2,48-3,02(4H,м), 4,04(1H, к, J=6,6 Гц), 4,25(2H, к,J=7,1 Гц), 4,58(2H,с), 6,49(1H, д,J= 8,0 Гц), 6,67(1H, д,J=8,0 Гц), 7,01(1H, т, J= 8,0 Гц), 7,20- 7,33(5H,м).
(+) APCI М.-.с: 354(М++1)Препаративный пример 29 Этил-[(6RS)-5,6,7,8-тетрагидро-6-[((1S)-1-фенилэтил)амино] – 1-нафтилокси] ацетат (185 мг) превращают в гидрохлорид обычным способом, используя 4N раствор хлористого водорода в этилацетате. Смесь гидрохлорида, 10% палладия-на-угле (50% влажн., 100 мг) и формиата аммония (330 мг) в этаноле (40 мл) перемешивают при кипячении с обратным холодильником в течение 30 минут, и фильтруют горячую реакционную смесь. Фильтрат упаривают в вакууме, и остаток обрабатывают этилацетатом и водным раствором бикарбоната натрия. Этилацетатный слой сушат над сульфатом натрия и упаривают в вакууме, получают этил-[(6RS)-6-амино-5,6,7,8-тетрагидро-1-нафтилокси] ацетат (95 мг) в виде масла. ИК (пленка): 3600-3150, 1750, 1730 (плечо), 1580, 1195 см-1 ЯМР (CDCl3,  ): 1,30(3H, т, J=7,1 Гц), 1,46- 1,66(3H,м), 2,01(1H,м), 2,48-2,78(2H, м), 2,92-3,16(3H, м), 4,26(2H, к, J= 7,1 Гц), 4,62(2H,с), 6,53(1H, д,J= 8,0 Гц), 6,74(1H, д,J=7,6 Гц), 7,05 (1H, т, J= 7,8 Гц).
Препаративный пример 30 ): 1,30(3H, т, J=7,1 Гц), 1,46- 1,66(3H,м), 2,01(1H,м), 2,48-2,78(2H, м), 2,92-3,16(3H, м), 4,26(2H, к, J= 7,1 Гц), 4,62(2H,с), 6,53(1H, д,J= 8,0 Гц), 6,74(1H, д,J=7,6 Гц), 7,05 (1H, т, J= 7,8 Гц).
Препаративный пример 30Суспензию (5-гидрокси-1,2,3,4-тетрагидро-1-нафтил)метанола (0,20 г), этилбромацетата (0,15 мл), иодида калия (каталитическое количество) и карбоната калия (0,20 г) в ацетонитриле (10 мл) перемешивают при кипячении с обратным холодильником в течение 2,5 часов. Удаляют растворитель, и остаток обрабатывают эфиром и 1N соляной кислотой. Органический слой промывают водой и солевым раствором, сушат над сульфатом натрия и упаривают в вакууме. Остаток хроматографируют на силикагеле (н- гексан-этилацетат), и получают (5-этоксикарбонилметокси- 1,2,3,4-тетрагидро-1-нафтил)метанол (0,29 г) в виде масла. ИК (пленка): 3400, 1730 см-1 ЯМР (CDCl3,  ): 1,44(3H, т, J=5,4 Гц), 1,80- 1,95(4H,м), 2,63-2,98(3H, м), 3,80(2H, дд,J=5,4, 5,4 Гц), 4,26(2H, к, J =7,1 Гц), 4,62(2H,с), 6,56(1H, д, J = 7,9 Гц), 6,89(1H, д, J=7,9 Гц), 7,09(1H, дд, J= 7,9, 7,9 Гц).
М.-с. APCI m/z: 265 (М++1), 247 (М++1 – H2O).
Препаративный пример 31 ): 1,44(3H, т, J=5,4 Гц), 1,80- 1,95(4H,м), 2,63-2,98(3H, м), 3,80(2H, дд,J=5,4, 5,4 Гц), 4,26(2H, к, J =7,1 Гц), 4,62(2H,с), 6,56(1H, д, J = 7,9 Гц), 6,89(1H, д, J=7,9 Гц), 7,09(1H, дд, J= 7,9, 7,9 Гц).
М.-с. APCI m/z: 265 (М++1), 247 (М++1 – H2O).
Препаративный пример 31К раствору диэтилкарбоната (10,3 мл) и гидрида натрия (4,2 г, 60%, в масле) в толуоле (300 мл) при 100oC добавляют 5-трет-бутилдифенилсилилокси-1-оксо-1,2,3,4-тетрагидронафталин (17 г). Смесь перемешивают при той же температуре в течение 4 часов, и затем охлажденный раствор промывают насыщенным раствором NaHCO3 и солевым раствором. Растворитель из осушенного раствора испаряют в вакууме, и остаток очищают хроматографией на силикагеле, получают 5-трет-бутилдифенилсилилокси-2-этоксикарбонил-1-оксо- 1,2,3,4-тетрагидронафталин (20 г). ИК (чистый): 1730, 1680 см-1 ЯМР (CDCl3,  ): 1,11(9H, с), 1,25(3H, т, J= 7 Гц), 2,3-2,7 (2H,м), 2,8-3,4(2H, м), 3,60(1H, дд, J= 5,2, 10,4 Гц), 4,28(2H, к, J= 7 Гц), 6,4-6,8(2H,м), 7,2-7,8(11H,м).
М.-с. m/z: 473 (М++1).
Препаративный пример 32 ): 1,11(9H, с), 1,25(3H, т, J= 7 Гц), 2,3-2,7 (2H,м), 2,8-3,4(2H, м), 3,60(1H, дд, J= 5,2, 10,4 Гц), 4,28(2H, к, J= 7 Гц), 6,4-6,8(2H,м), 7,2-7,8(11H,м).
М.-с. m/z: 473 (М++1).
Препаративный пример 32К раствору 5-трет-бутилдифенилсилилокси-2-этоксикарбонил-1-оксо- 1,2,3,4-тетрагидронафталина (17 г) в смеси этанола (100 мл) и тетрагидрофурана (100 мл) при 0oC добавляют NaBH4 (1,4 г). После перемешивания смеси в течение 6 часов при комнатной температуре растворитель удаляют в вакууме. Остаток растворяют в смеси этилацетата и воды, и органический раствор промывают 1N раствором HCl, насыщенным раствором NaHCO3 и солевым раствором. Растворитель из осушенного раствора удаляют в вакууме, и остаток очищают хроматографией на силикагеле, получают 1- гидрокси-2-этоксикарбонил-5-трет-бутилдифенилсилилокси-1,2,3,4- тетрагидронафталин (7,9 г). ИК (чистый): 3450, 1730 см-1 ЯМР (CDCl3,  ): 1,10(9H, с), 1,26(3H, т, J= 7 Гц), 2,2-2,5 (2H,м), 2,5-3,4(4H, м), 4,16(2H, к, J= 7 Гц), 5,02(1H,м), 6,2-6,4(1H,м), 6,7-7,0(2H, м), 7,2-7,8(10H,м).
Препаративный пример 33 ): 1,10(9H, с), 1,26(3H, т, J= 7 Гц), 2,2-2,5 (2H,м), 2,5-3,4(4H, м), 4,16(2H, к, J= 7 Гц), 5,02(1H,м), 6,2-6,4(1H,м), 6,7-7,0(2H, м), 7,2-7,8(10H,м).
Препаративный пример 33К раствору 1-гидрокси-2-этоксикарбонил-5-трет-бутил- дифенилсилилокси-1,2,3,4-тетрагидронафталина (5,9 г) в толуоле (100 мл) добавляют KHS04 (2,0 г). Смесь перемешивают в течение 1 часа при кипячении с обратным холодильником, и затем охлажденный раствор промывают насыщенным раствором NaHCO3 и солевым раствором. Растворитель из осушенного раствора удаляют в вакууме, и остаток очищают хроматографией на силикагеле, получают 2-этоксикарбонил-5-трет-бутилдифенилсилилокси-3,4-дигидронафталин (7,4 г). ИК (чистый): 1700 см-1 ЯМР (CDCl3,  ): 1,11(9H, с), 1,35(3H, т,J= 7 Гц), 2,5 – 2,7(2H,м), 3,03(2H, т, J= 8,8 Гц), 4,27(2H, к,J= 7 Гц), 6,3-6,5(1H,м), 6,7-6,8(2H,м), 7,1-7,8(11H,м).
М.-с. m/z: 457 (M++1).
Препаративный пример 34 ): 1,11(9H, с), 1,35(3H, т,J= 7 Гц), 2,5 – 2,7(2H,м), 3,03(2H, т, J= 8,8 Гц), 4,27(2H, к,J= 7 Гц), 6,3-6,5(1H,м), 6,7-6,8(2H,м), 7,1-7,8(11H,м).
М.-с. m/z: 457 (M++1).
Препаративный пример 34Раствор AD-mix-  (торговое наименование Aldrich) (9,2 г) в смеси трет-бутилового спирта (30 мл) и воды (30 мл) перемешивают в течение 1 часа, и затем к раствору при комнатной температуре добавляют метансульфонамид (0,62 г) и 2-этоксикарбонил-5-трет-бутилдифенилсилилокси-3,4-дигидронафталин (3,0 г). После перемешивания в течение 20 часов при этой же температуре добавляют сульфит натрия (9,0 г), и смесь перемешивают в течение 30 минут. Смесь обрабатывают этилацетатом и водой. Органический слой промывают 1N раствором HCl, насыщенным раствором NaHCO3 и солевым раствором, сушат над MgSO4 и упаривают в вакууме. Остаток очищают хроматографией на силикагеле, и получают (1S, 2R)-1,2-дигидрокси-2-этоксикарбонил-5-трет-бутилдифенилсилилокси- (торговое наименование Aldrich) (9,2 г) в смеси трет-бутилового спирта (30 мл) и воды (30 мл) перемешивают в течение 1 часа, и затем к раствору при комнатной температуре добавляют метансульфонамид (0,62 г) и 2-этоксикарбонил-5-трет-бутилдифенилсилилокси-3,4-дигидронафталин (3,0 г). После перемешивания в течение 20 часов при этой же температуре добавляют сульфит натрия (9,0 г), и смесь перемешивают в течение 30 минут. Смесь обрабатывают этилацетатом и водой. Органический слой промывают 1N раствором HCl, насыщенным раствором NaHCO3 и солевым раствором, сушат над MgSO4 и упаривают в вакууме. Остаток очищают хроматографией на силикагеле, и получают (1S, 2R)-1,2-дигидрокси-2-этоксикарбонил-5-трет-бутилдифенилсилилокси-1,2,3,4-тетрагидронафталин (3,1 г). ИК (чистый): 3450, 1705 см-1. ЯМР (CDCl3,  ): 1,09(9H, с), 1,25(3H, т, J= 7 Гц), 2,1-2,3(2H,м), 2,50(1H, д, J= 10,8 Гц), 2,9- 3,2(2H,м), 3,58(1H,с), 4,35(2H, к, J= 7,0 Гц), 5,03(1H, д, J= 10,8 Гц), 6,32(1H, д, J= 8,0 Гц), 6,80(1H, т, J= 8,0 Гц), 7,14(1H, д, J= 8,0 Гц), 7,3-7,8(10H, м).
М.-с. m/z: 470 (М+-17).
ВЭЖX: chiralcel AD, 5% изопропанола в гексане, 12,9 мл/мин.
Препаративный пример 35 ): 1,09(9H, с), 1,25(3H, т, J= 7 Гц), 2,1-2,3(2H,м), 2,50(1H, д, J= 10,8 Гц), 2,9- 3,2(2H,м), 3,58(1H,с), 4,35(2H, к, J= 7,0 Гц), 5,03(1H, д, J= 10,8 Гц), 6,32(1H, д, J= 8,0 Гц), 6,80(1H, т, J= 8,0 Гц), 7,14(1H, д, J= 8,0 Гц), 7,3-7,8(10H, м).
М.-с. m/z: 470 (М+-17).
ВЭЖX: chiralcel AD, 5% изопропанола в гексане, 12,9 мл/мин.
Препаративный пример 35По способу, подобному способу препаративного примера 34, используя вместо AD-mix-  AD-mix- AD-mix-  (торговое наименование Aldrich), получают (1R, 2S)-1,2-дигидрокси-2- этоксикарбонил-5-трет- бутилдифенилсилилокси-1,2,3,4-тетрагидронафталин (3,1 г).
ВЭЖХ: chiralcel AD, 5% изопропанола в гексане, 11,00 мл/мин.
Препаративный пример 36 (торговое наименование Aldrich), получают (1R, 2S)-1,2-дигидрокси-2- этоксикарбонил-5-трет- бутилдифенилсилилокси-1,2,3,4-тетрагидронафталин (3,1 г).
ВЭЖХ: chiralcel AD, 5% изопропанола в гексане, 11,00 мл/мин.
Препаративный пример 36К раствору 2-метоксикарбонил-5-метокси-1-оксо-1,2,3,4- тетрагидронафталина (3,9 г) в тетрагидрофуране (50 мл) при 0oC и в атмосфере N2, добавляют NaH (0,73 г, 60%, в масле) и затем метилиодид (3 мл). После перемешивания в течение 1 часа при комнатной температуре раствор выливают в смесь этилацетата и воды. Органический слой промывают 1N раствором HCl, насыщенным раствором NaHCO3 и солевым раствором, сушат над MgSO4 и упаривают в вакууме. Остаток очищают хроматографией на силикагеле, и получают 2-метил- 2-метоксикарбонил-5-метокси-1-оксо-1,2,3,4-тетрагидронафталин (4,0 г). ИК (чистый): 1720, 1680 см-1 ЯМР (CDCl3,  ): 1,49(3H,с), 1,9-2,1(1H,м), 2,4- 3,0(3H,м), 3,66(3H,м), 3,88(3H, м), 7,01(1H, д,J= 8 Гц), 7,26(1H, т, J= 8,0 Гц), 7,68(1H, д,J = 8 гц).
М.-с. m/z: 249 (М++1).
Препаративный пример 37 ): 1,49(3H,с), 1,9-2,1(1H,м), 2,4- 3,0(3H,м), 3,66(3H,м), 3,88(3H, м), 7,01(1H, д,J= 8 Гц), 7,26(1H, т, J= 8,0 Гц), 7,68(1H, д,J = 8 гц).
М.-с. m/z: 249 (М++1).
Препаративный пример 37К раствору 2-метил-2- метоксикарбонил-5-метокси-1-оксо-1,2,3,4-тетрагидронафталина (2,0 г) в трифторуксусной кислоте (20 мл) при комнатной температуре добавляют триэтилсилан (2,0 мл). После перемешивания в течение 6 часов при комнатной температуре раствор выливают в смесь этилацетата и воды. Органический слой промывают 1N раствором HCl, насыщенным раствором NaHCO3 и солевым раствором, сушат над MgSO4 и упаривают в вакууме. Остаток очищают хроматографией на силикагеле, и получают 2-метил-2-метоксикарбонил-5-метокси-1,2,3,4-тетрагидронафталин (4,0 г). ИК (чистый): 1720 см-1 ЯМР (CDCl3,  ): 1,25(3H,с), 1,6-2,3(2H,м), 2,5- 2,8(3H,м), 3,20(1H, д, J= 16 Гц), 3,66(3H, м), 3,80(3H,м), 6,64(1H, д, J= 8 Гц), 6,70(1H, д, J=8 Гц), 7,08(1H, т, J= 8 Гц).
М.-с. m/z: 235 (М++1).
Препаративный пример 38 ): 1,25(3H,с), 1,6-2,3(2H,м), 2,5- 2,8(3H,м), 3,20(1H, д, J= 16 Гц), 3,66(3H, м), 3,80(3H,м), 6,64(1H, д, J= 8 Гц), 6,70(1H, д, J=8 Гц), 7,08(1H, т, J= 8 Гц).
М.-с. m/z: 235 (М++1).
Препаративный пример 38К раствору этилового эфира диэтилфосфорной кислоты (19 г) в диметоксиэтане (200 мл) при 0oC и в атмосфере N2 добавляют NaH (3,4 г, 60%, в масле). После перемешивания в течение 30 минут к смеси добавляют 5-трет-бутилдифенилсилилокси-1-оксо-1,2,3, 4-тетрагидронафталин (20 г). После перемешивания в течение 12 часов при 80oC раствор выливают в смесь этилацетата и воды. Органический слой промывают 1N раствором HCl, насыщенным раствором NaHCO3 и солевым раствором, сушат над MgSO4 и упаривают в вакууме. Остаток растворяют в смеси толуола (100 мл) и 1,8-диазабицикло[5.4.0]-7-ундецена (17 мл), и смесь перемешивают в течение 3 суток при 100oC. Раствор промывают 1N раствором HCl, насыщенным раствором NaHCO3 и солевым раствором, сушат над MgSO4 и упаривают в вакууме. Остаток очищают хроматографией на силикагеле, и получают 5-трет-бутилдифенилсилилокси-1-этоксикарбонилметил- 3,4-дигидронафталин (20,3 г). ИК (чистый): 1740 см-1 ЯМР (CDCl3,  ): 1,10(9H, м), 1,25(3H, т, J= 7 Гц), 2,2-2,4(2H,м), 2,99(2H, т, J= 8,2 Гц), 3,40(2H,с), 4,17(2H, к, J= 7 Гц), 6,00(1н,м), 6,3- 6,5(1H,м), 6,6-6,8(2H,м), 7,3-7,8 (10H,м).
М.-с. m/z: 471 (М++1).
Препаративный пример 39 ): 1,10(9H, м), 1,25(3H, т, J= 7 Гц), 2,2-2,4(2H,м), 2,99(2H, т, J= 8,2 Гц), 3,40(2H,с), 4,17(2H, к, J= 7 Гц), 6,00(1н,м), 6,3- 6,5(1H,м), 6,6-6,8(2H,м), 7,3-7,8 (10H,м).
М.-с. m/z: 471 (М++1).
Препаративный пример 39К раствору диизопропиламина (17 мл) в ТГФ (тетрагидрофуран) (210 мл) при -78oC в атмосфере N2 добавляют н-бутиллитий (67 мл, 1,6N в гексане). Раствор перемешивают в течение 30 минут при 0oC и затем охлаждают до -78oC. К раствору добавляют этилацетат (12 г), и смесь перемешивают в течение 30 минут при той же температуре. Получают Li-енолятный раствор. Охлаждают до -78oC раствор 5-трет- бутилдифенилсилилокси-1-оксо-1,2,3,4-тетрагидронафталина (10 г) в ТГФ (50 мл), добавляют вышеупомянутый раствор Li-енолята (35 мл), и все перемешивают в течение 1 часа при той же температуре. Смесь выливают в смесь этилацетата и воды. Органический слой промывают 1N раствором HCl, насыщенным раствором NaHCO3 и солевым раствором, сушат над MgSO4 и упаривают в вакууме. Остаток очищают хроматографией на силикагеле, и получают 1- гидрокси-1-этоксикарбонилметил-5-трет-бутилдифенилсилилокси- 1,2,3,4-тетрагидронафталин (8,0 г). ИК (чистый): 3400, 1705 см-1 ЯМР (CDCl3,  ): 1,10 (9H,c), 1,27(3H, т, J= 7 Гц), 1,6-2,2 (4H,м), 2,7-3,0(4H,м), 4,20(2H, к, J = 7 Гц), 6,30(1H, д, J= 8 Гц), 6,77(1H, т, J= 8 гц), 7,10(1H, д, J= 8 Гц), 7,2-7,8(10H,м).
М.-с. m/z: 471 (М+-17) ): 1,10 (9H,c), 1,27(3H, т, J= 7 Гц), 1,6-2,2 (4H,м), 2,7-3,0(4H,м), 4,20(2H, к, J = 7 Гц), 6,30(1H, д, J= 8 Гц), 6,77(1H, т, J= 8 гц), 7,10(1H, д, J= 8 Гц), 7,2-7,8(10H,м).
М.-с. m/z: 471 (М+-17)Препаративный пример 40 (1) К раствору (1S,2R)-1,2-дигидрокси-2-этоксикарбонил-5-трет- бутилдифенилсилилокси-1,2,3,4-тетрагидронафталина (1,8 г) в CH2Cl2 (20 мл) при комнатной температуре добавляют трифенилфосфин (2,9 г) и CBr4 (4,9 г). После перемешивания в течение 1 часа к раствору добавляют этилацетат (200 мл). После фильтрации маточную жидкость промывают водой, насыщенным раствором NaHCO3 и солевым раствором. Растворитель из осушенного раствора испаряют в вакууме, и получают остаток. (2) Полученный выше остаток очищают хроматографией на силикагеле. Полученное масло растворяют в тетрагидрофуране (30 мл), и при 0oC добавляют LiAlH4 (420 мг). Смесь перемешивают в течение 2 часов при той же температуре, гасят 1N раствором HCl и обрабатывают этилацетатом и водой. Органический слой промывают водой, насыщенным раствором NaHCO3 и солевым раствором. Осушенный растворитель упаривают в вакууме, и остаток очищают хроматографией на силикагеле, получают (2R)-2- гидрокси-2-гидроксиметил-5-трет-бутилдифенилсилилокси-1,2,3,4- тетрагидронафталин (1,8 г). ИК (чистый): 3500, 1600 см-1 ЯМР (CDCl3,  ): 1,10(9H,с), 1,8-2,0(4H,м), 2,85(2H,с), 3,00(2H, т, J = 7,0 Гц), 3,59(2H,м), 6,29(1H, д, J= 8,0 Гц), 6,6- 6,8(2H,м), 7,3-7,8(10H,м).
М.-с. m/z: 397 (М+-35).
Препаративный пример 41 ): 1,10(9H,с), 1,8-2,0(4H,м), 2,85(2H,с), 3,00(2H, т, J = 7,0 Гц), 3,59(2H,м), 6,29(1H, д, J= 8,0 Гц), 6,6- 6,8(2H,м), 7,3-7,8(10H,м).
М.-с. m/z: 397 (М+-35).
Препаративный пример 41По способу, подобному способу препаративного примера 40, получают (2S)-2-гидрокси-2-гидроксиметил-5-трет-бутилдифенилсилилокси- 1,2,3,4-тетрагидронафталин. Препаративный пример 42 По способу, подобному способу препаративного примера 40, получают 5-трет-бутилдифенилсилилокси-1-(2-гидроксиэтил)-3,4- дигидронафталин. ИК (чистый): 3400-3300 см-1 ЯМР (CDCl3,  ): 1,06(3H,с), 2,2-2,4(2H,м), 2,6-3,0(4H,м), 3,76(2H, т, J= 6,4 Гц), 5,96(1H,м), 6,36(1H, д,J=8,0 Гц), 6,7-6,9(2H,м), 7,2-7,8(10H,м).
М.-с. m/z: 429 (М++1).
Препаративный пример 43 ): 1,06(3H,с), 2,2-2,4(2H,м), 2,6-3,0(4H,м), 3,76(2H, т, J= 6,4 Гц), 5,96(1H,м), 6,36(1H, д,J=8,0 Гц), 6,7-6,9(2H,м), 7,2-7,8(10H,м).
М.-с. m/z: 429 (М++1).
Препаративный пример 43К раствору 5-трет-бутилдифенилсилилокси-2-гидроксиметил-3,4- дигидронафталина (1,0 г) в бензоле (10 мл) при 0oC в атмосфере N2 добавляют диэтилцинк (7,2 мл, 1М раствор в гексане) и дииодметан (1,2 мл). После перемешивания в течение 4 часов при комнатной температуре раствор выливают в смесь этилацетата и воды. Органический слой промывают 1N раствором HCl, насыщенным раствором NaHCO3 и солевым раствором, сушат над MgSO4 и упаривают в вакууме. Остаток очищают хроматографией на силикагеле, и получают 5-трет-бутилдифенилсилилокси-1,2-метилен-2-гидроксиметил-1,2,3,4- тетрагидронафталин. Препаративный пример 44 По способу, подобному способу препаративного примера 43, получают 1,2-метилен-1-(2-гидроксиэтил) -5-трет-бутилдифенилсилилокси-1,2,3,4-тетрагидронафталин. ИК (чистый): 3400-3300, 1700 см-1 ЯМР (CDCl3,  ): 0,7-0,9(2H,м), 1,08(9H,c), 1,2- 1,5(2H,м), 1,7-2,5(3H, м), 2,6-2,9(1H, м), 3,1-3,3(1H, м), 3,7- 3,9(2H,м), 6,27(1H, д, J= 8 Гц), 6,72(1H, т, J= 8 Гц), 6,99(1H, д,J= 8 Гц), 7,2-7,8(10H,м).
М.-с. m/z: 443 (М++1).
Препаративный пример 45 ): 0,7-0,9(2H,м), 1,08(9H,c), 1,2- 1,5(2H,м), 1,7-2,5(3H, м), 2,6-2,9(1H, м), 3,1-3,3(1H, м), 3,7- 3,9(2H,м), 6,27(1H, д, J= 8 Гц), 6,72(1H, т, J= 8 Гц), 6,99(1H, д,J= 8 Гц), 7,2-7,8(10H,м).
М.-с. m/z: 443 (М++1).
Препаративный пример 45К раствору 5-трет-бутилдифенилсилилокси-1-(2-гидроксиэтил)-3,4- дигидронафталина (1,0 г) в CH2Cl2 (30 мл) при 0oC добавляют Na2CO3 (290 г) и м-хлорпербензойную кислоту (750 мг). После перемешивания в течение 2 часов растворитель удаляют в вакууме. Остаток экстрагируют этилацетатом. Смесь промывают 1N раствором HCl, насыщенным раствором NaHCO3 и солевым раствором, сушат над MgSO4 и упаривают в вакууме. Остаток растворяют в тетрагидрофуране (20 мл), и при 0oC добавляют LiAlH4 (200 мг). После перемешивания в течение 2 часов реакцию гасят насыщенным раствором калийнатрийтартрата. После фильтрации растворитель удаляют, и остаток очищают хроматографией, получают (цис)-5-трет- бутилдифенилсилилокси-1-(2-гидроксиэтил)-1,2,3,4-тетрагидронафталин (1,9 г). ИК (чистый): 3300 см-1 ЯМР (CDCl3,  ): 1,10(9H,с), 1,8-2,3(4H,м), 2,8- 3,2(3H,м), 3,6-4,2(3H, м), 6,2-6,4(1H,м), 6,6-6,8(2H,м), 7,0- 7,8 (10H,м).
М.-с. m/z: 429 (М+-17).
Препаративный пример 46 ): 1,10(9H,с), 1,8-2,3(4H,м), 2,8- 3,2(3H,м), 3,6-4,2(3H, м), 6,2-6,4(1H,м), 6,6-6,8(2H,м), 7,0- 7,8 (10H,м).
М.-с. m/z: 429 (М+-17).
Препаративный пример 46Смесь (2R) -2-гидрокси-2-гидроксиметил-5-трет- бутилдифенилсилилокси-1,2,3,4-тетрагидронафталина (1,4 г) и N,N -дифенилкарбамоилхлорида (3 г) в пиридине (15 мл) перемешивают при 100oC в течение 12 часов, охлаждают до комнатной температуры, и обрабатывают этилацетатом и 1N HCl. Органический слой промывают 1N раствором HCl, насыщенным раствором NaHCO3 и солевым раствором. Осушенный растворитель испаряют в вакууме, и остаток очищают хроматографией на силикагеле, получают (2R)-2-гидрокси-2-(N, N- дифенилкарбамоилоксиметил)-5-трет-бутилдифенилсилилокси-1,2,3,4- тетрагидронафталин (1,3 г). ИК (чистый): 3400, 1700 см-1 ЯМР (CDCl3,  ): 1,10(9H,с), 1,8-2,0(3H,м), 2,6- 3,1(4H,м), 4,16(2H,с), 6,25(1H, д, J= 8,0 Гц), 6,53(1H, д,J= 8 Гц), 6,68(1H,т, J= 8 Гц), 7,2-7,8(20H,м).
М.-с. m/z: 628 (М++1).
ВЭЖХ: chiralcel OD, 10% изопропанола в гексане, 12,0 мл/мин.
Препаративный пример 47 ): 1,10(9H,с), 1,8-2,0(3H,м), 2,6- 3,1(4H,м), 4,16(2H,с), 6,25(1H, д, J= 8,0 Гц), 6,53(1H, д,J= 8 Гц), 6,68(1H,т, J= 8 Гц), 7,2-7,8(20H,м).
М.-с. m/z: 628 (М++1).
ВЭЖХ: chiralcel OD, 10% изопропанола в гексане, 12,0 мл/мин.
Препаративный пример 47Перечисленные далее соединения получают способами, подобными способу препаративного примера 46. (1) (2S)-2-Гидрокси-2-(N, N-дифенилкарбамоилоксиметил)-5- трет-бутилдифенилсилилокси-1,2,3,4-тетрагидронафталин. ВЭЖХ: chiralcel OD, 10% изопропанола в гексане, 10,1 мл/мин. (2) (цис)-1-Гидрокси-2-(N,N-дифенилкарбамоилоксиметил) -5-трет-бутилдифенилсилилокси-1,2,3,4-тетрагидронафталин. ЯМР (CDCl3,  ): 1,08(9H,с), 1,6- 2,1(3H,м), 2,5- 3,2(2H,м), 4,0-4,2(1H, м), 4,4-4,8(2H,м), 6,32(1H, д, J = 8 Гц), 6,6-6,9(2H,м), 7,1-7,8(20H,м).
М.-с. m/z: 610 (М+-1) ): 1,08(9H,с), 1,6- 2,1(3H,м), 2,5- 3,2(2H,м), 4,0-4,2(1H, м), 4,4-4,8(2H,м), 6,32(1H, д, J = 8 Гц), 6,6-6,9(2H,м), 7,1-7,8(20H,м).
М.-с. m/z: 610 (М+-1)(3) (транс)-1-Гидрокси-2-(N,N-дифенилкарбамоилоксиметил) -5-трет-бутилдифенилсилилокси-1,2,3,4-тетрагидронафталин. ЯМР (CDCl3,  ): 1,08(9H,с), 1,4-2,1(3H,м), 2,6- 3,1(2H,м), 4,13(1H, дд, J= 11,2, 5,2 Гц), 4,48(1H, д, J= 8 Гц), 4,62(1H, дд, J= 11,2, 4,4 Гц), 6,30(1H, д, J= 8 Гц), 6,77(1H, т, J= 8 Гц), 7,08(1H, д, J= 8 Гц), 7,1-7,8 (20H,м).
М.-с. m/z: 610 (М+-1).
(4) 5-трет-Бутилдифенилсилилокси-1,2-метилен-2-(N, N- дифенилкарбамоилоксиметил)-1,2,3,4-тетрагидронафталин.
ИК (чистый): 1700 см-1 ): 1,08(9H,с), 1,4-2,1(3H,м), 2,6- 3,1(2H,м), 4,13(1H, дд, J= 11,2, 5,2 Гц), 4,48(1H, д, J= 8 Гц), 4,62(1H, дд, J= 11,2, 4,4 Гц), 6,30(1H, д, J= 8 Гц), 6,77(1H, т, J= 8 Гц), 7,08(1H, д, J= 8 Гц), 7,1-7,8 (20H,м).
М.-с. m/z: 610 (М+-1).
(4) 5-трет-Бутилдифенилсилилокси-1,2-метилен-2-(N, N- дифенилкарбамоилоксиметил)-1,2,3,4-тетрагидронафталин.
ИК (чистый): 1700 см-1ЯМР (CDCl3,  ): 0,8-1,2(2H,м), 1,6-1,9(2H,м), 2,0- 2,3(1H,м), 3,1-3,4(1H, м), 4,20(1H, д,J= 11,2 Гц), 4,30(1H, д, J= 11,2 Гц), 6,25(1H, д,J=8 Гц), 6,6-7,0(2H,м), 7,1- 7,8 (20H,м).
(5) 5-трет-Бутилдифенилсилилокси-1,2-метилен-[2-(N, N- дифенилкарбамоилокси)этил]-1,2,3,4-тетрагидронафталин.
ИК (чистый): 1700 см-1 ): 0,8-1,2(2H,м), 1,6-1,9(2H,м), 2,0- 2,3(1H,м), 3,1-3,4(1H, м), 4,20(1H, д,J= 11,2 Гц), 4,30(1H, д, J= 11,2 Гц), 6,25(1H, д,J=8 Гц), 6,6-7,0(2H,м), 7,1- 7,8 (20H,м).
(5) 5-трет-Бутилдифенилсилилокси-1,2-метилен-[2-(N, N- дифенилкарбамоилокси)этил]-1,2,3,4-тетрагидронафталин.
ИК (чистый): 1700 см-1ЯМР (CDCl3,  ): 0,6-0,9(2H,м), 1,08(9H,с), 1,2-2,5(5H,м), 2,6-3,1(2H, м), 4,0-4,4(2H,м), 6,24(1H, д, J=8 Гц), 6,65(1H,т, J= 8 Гц), 6,96(1H, д, J= 8 Гц), 7,1- 7,8 (20H,м).
(6) 1-[2-(N, N-Дифенилкарбамоилокси)этил-]-5- трет-бутилдифенилсилилокси-3,4-дигидронафталин.
ИК (чистый): 1705 см-1 ): 0,6-0,9(2H,м), 1,08(9H,с), 1,2-2,5(5H,м), 2,6-3,1(2H, м), 4,0-4,4(2H,м), 6,24(1H, д, J=8 Гц), 6,65(1H,т, J= 8 Гц), 6,96(1H, д, J= 8 Гц), 7,1- 7,8 (20H,м).
(6) 1-[2-(N, N-Дифенилкарбамоилокси)этил-]-5- трет-бутилдифенилсилилокси-3,4-дигидронафталин.
ИК (чистый): 1705 см-1ЯМР (CDCl3,  ): 1,10(9H,с), 2,1-2,3(2H,м), 2,72 (2H, т, J= 6,6 Гц), 2,90(2H, т, J= 8,0 Гц), 4,30(2H, т, J= 7,0 Гц), 5,78(1H,т, J= 4,4 Гц), 6,33(1H, д, J= 8 Гц), 6,6- 6,9(2H,м), 7,1-7,8(20H,м).
М.-с. m/z: 624 (М++1).
(7) (цис)-5-трет-Бутилдифенилсилилокси-1, 2-метилен-[2- (N,N-дифенилкарбамоилокси)этил]-2-гидрокси-1,2,3,4- тетрагидронафталин.
ИК (чистый): 1700 см-1 ): 1,10(9H,с), 2,1-2,3(2H,м), 2,72 (2H, т, J= 6,6 Гц), 2,90(2H, т, J= 8,0 Гц), 4,30(2H, т, J= 7,0 Гц), 5,78(1H,т, J= 4,4 Гц), 6,33(1H, д, J= 8 Гц), 6,6- 6,9(2H,м), 7,1-7,8(20H,м).
М.-с. m/z: 624 (М++1).
(7) (цис)-5-трет-Бутилдифенилсилилокси-1, 2-метилен-[2- (N,N-дифенилкарбамоилокси)этил]-2-гидрокси-1,2,3,4- тетрагидронафталин.
ИК (чистый): 1700 см-1ЯМР (CDCl3,  ): 1,10(9H,с), 1,6-2,3(4H,м), 2,7-3,2(3H,м), 4,0-4,4(3H, м), 6,25(1H, д, J= 8 Гц), 6,49(1H, д, J= 8 Гц), 6,66 (1H, т, J = 8 Гц), 7,1-7,2(20H,м).
Препаративный пример 48 ): 1,10(9H,с), 1,6-2,3(4H,м), 2,7-3,2(3H,м), 4,0-4,4(3H, м), 6,25(1H, д, J= 8 Гц), 6,49(1H, д, J= 8 Гц), 6,66 (1H, т, J = 8 Гц), 7,1-7,2(20H,м).
Препаративный пример 48Способами, подобными способам препаративных примеров 13 и 46, из 2-этоксикарбонил-5-трет-бутилдифенилсилилокси-3,4-дигидронафталина получают 2-(N, N-дифенилкарбамоилоксиметил)-5-трет- бутилдифенилсилилокси-3,4-дигидронафталин. ИК (чистый): 1710 см-1 ЯМР (CDCl3,  ): 1,10(9H,м), 2,23(2H, т,J= 8,4 Гц), 2,97(2H, т, J=8,4 Гц), 4,77(2H, с), 6,23(1H, с), 6,31(1H, д, J= 8 Гц), 6, 50 (1H, д, J = 6,8 Гц), 6,68(1H, т, J = 8 Гц), 7,2-7,8(20H,м).
Препаративный пример 49 ): 1,10(9H,м), 2,23(2H, т,J= 8,4 Гц), 2,97(2H, т, J=8,4 Гц), 4,77(2H, с), 6,23(1H, с), 6,31(1H, д, J= 8 Гц), 6, 50 (1H, д, J = 6,8 Гц), 6,68(1H, т, J = 8 Гц), 7,2-7,8(20H,м).
Препаративный пример 49Способами, подобными способам препаративных примеров 1 и 46, из 2-метоксикарбонил-2-метил-5-метокси-1,2,3,4-тетрагидронафталина получают 2-(N,N-дифенилкарбамоилоксиметил)-2-метил-5-метокси- 1,2,3,4-тетрагидронафталин. ИК (чистый): 1700 см-1 ЯМР (CDCl3,  ): 0,83(9H, с), 1,4(2H,м), 2,2-2,8(4H,м), 3,80(3H,м), 3,90(1H, д, J= 10,4 Гц), 4,00(1H, д, J= 10,4 Гц), 6,59(lH, д, J= 8 Гц), 6,63(1H, д, J= 8 Гц), 7,08(1H, т, J= 8 Гц), 7,1-7,5(10H,м).
М.-с. m/z: 402 (М++1).
Препаративный пример 50 ): 0,83(9H, с), 1,4(2H,м), 2,2-2,8(4H,м), 3,80(3H,м), 3,90(1H, д, J= 10,4 Гц), 4,00(1H, д, J= 10,4 Гц), 6,59(lH, д, J= 8 Гц), 6,63(1H, д, J= 8 Гц), 7,08(1H, т, J= 8 Гц), 7,1-7,5(10H,м).
М.-с. m/z: 402 (М++1).
Препаративный пример 50Способами, подобными способам препаративных примеров 1 и 46, из 1-этоксикарбонилметил-1- гидрокси-5-трет-бутилдифенилсилилокси-1,2,3,4-тетрагидронафталина получают 1-[2-(N,N-дифенилкарбамоилокси)этил]-1-гидрокси-5- трет-бутилдифенилсилилокси-1,2,3,4-тетрагидронафталин. ИК (чистый): 3450, 1710 см-1 ЯМР (CDCl3,  ): 1,09(9H,с), 1,6-2,2(6H,м), 2,7- 3,0(2H,м), 4,33(2H, т, J= 6,6 Гц), 6,26(1H, д, J= 8 Гц), 6,78(1H, т, J= 8 Гц), 6,78(1H, т, J= 8 Гц), 6,96(1H, д, J= 8 Гц), 7,1-7,8(20H,м).
М.-с. m/z: 626 (М+-17) ): 1,09(9H,с), 1,6-2,2(6H,м), 2,7- 3,0(2H,м), 4,33(2H, т, J= 6,6 Гц), 6,26(1H, д, J= 8 Гц), 6,78(1H, т, J= 8 Гц), 6,78(1H, т, J= 8 Гц), 6,96(1H, д, J= 8 Гц), 7,1-7,8(20H,м).
М.-с. m/z: 626 (М+-17)Препаративный пример 51 По способу, подобному способу примера 21, из 5-трет-бутилдифенилсилилокси-1-[2-(N, N- дифенилкарбамоилокси)этил]- 3,4-дигидронафталина получают 5-трет-бутилдифенилсилилокси-1,2-дигидрокси-1-[2-(N, N -дифенилкарбамоилокси)этил]-1,2,3,4-тетрагидронафталина. ИК (чистый): 3500-3400, 1700 см-1 ЯМР (CDCl3,  ): 1,09(9H,м), 1,7-2,2(4H,м), 2,6-3,1(2H,м), 3,8-4,0(1H, м), 4,1-4,4(2H, м), 6,32(1H, д, J= 8 Гц), 6,77(1H, т, J= 8 Гц), 7,01(1H, д, J= 8 Гц), 7,1-7,8 (20H,м).
Препаративный пример 52 ): 1,09(9H,м), 1,7-2,2(4H,м), 2,6-3,1(2H,м), 3,8-4,0(1H, м), 4,1-4,4(2H, м), 6,32(1H, д, J= 8 Гц), 6,77(1H, т, J= 8 Гц), 7,01(1H, д, J= 8 Гц), 7,1-7,8 (20H,м).
Препаративный пример 52Раствор 5-трет-бутилдифенилсилилокси-1,2-дигидрокси-1-[2-(N, N-дифенилкарбамоилокси)этил] -1,2,3,4-тетрагидронафталина (2,0 г) и п-толуолсульфоновой кислот (20 мг) в толуоле (40 мл) перемешивают в течение 30 минут при кипячении с обратным холодильником. Смесь промывают 1N раствором HCl, насыщенным раствором NaHCO3 солевым раствором, сушат над MgSO4 и упаривают в вакууме. Остаток очищают хроматографией на силикагеле, и получают 5-трет-бутилдифенилсилилокси-1-[2-(N, N- дифенилкарбамоилокси) этил] -2-оксо-1,2,3,4-тетрагидронафталин (1,0 г). ИК (чистый):1800, 1705 см-1 ЯМР (CDCl3,  ): 1,12(9H,с), 2,0-2,6(4H,м), 2,7- 3,0(1H,м), 3,1-3,4(2H, м), 4,0-4,2(2H,м), 6,40(1H, д, J= 8 Гц), 6,48(1H, д, J= 8 Гц), 6,76(1H, т,J= 8 Гц), 7,1-7,8 (20H,м).
М.-с. m/z: 638 (М++1).
Препаративный пример 53 ): 1,12(9H,с), 2,0-2,6(4H,м), 2,7- 3,0(1H,м), 3,1-3,4(2H, м), 4,0-4,2(2H,м), 6,40(1H, д, J= 8 Гц), 6,48(1H, д, J= 8 Гц), 6,76(1H, т,J= 8 Гц), 7,1-7,8 (20H,м).
М.-с. m/z: 638 (М++1).
Препаративный пример 53К раствору 5-трет- бутилдифенилсилилокси-1-[2-(N,N-дифенилкарбамоилокси)этил] -2-оксо-1,2,3,4-тетрагидронафталина (0,9 г) в ТГФ (тетрагидрофуран) (20 мл) при 0oC в атмосфере N2 добавляют метилмагнийбромид (2,0 мл, 1М раствор в ТГФ). После перемешивания в течение 1 часа при комнатной температуру раствор выливают в смесь этилацетата и воды. Органический слой промывают 1N раствором HCl, насыщенным раствором NaHCO3 и солевым раствором, сушат над MgSO4 и упаривают в вакууме. Остаток очищают хроматографией на силикагеле, и получают 5-трет-бутилдифенилсилилокси-1-[2-(N, N-дифенилкарбамоилокси)этил] -2-гидрокси-2-метил-1,2,3,4-тетрагидронафталин (0,6 г). ИК (чистый): 3400, 1705 см-1 ЯМР (CDCl3,  ): 1,11(9H,с), 1,22(3H,с), 1,6 – 2,6(5H,м), 2,6-3,2(2H,м), 4,0-4,2(2H, м), 6,27(1H, д, J= 8 Гц), 6,39(1H, д, J= 8 Гц), 6,65(1H, т, J= 8 Гц), 7,1-7,8 (20H,м).
М.-с. m/z: 638 (М+-18).
Препаративный пример 54 ): 1,11(9H,с), 1,22(3H,с), 1,6 – 2,6(5H,м), 2,6-3,2(2H,м), 4,0-4,2(2H, м), 6,27(1H, д, J= 8 Гц), 6,39(1H, д, J= 8 Гц), 6,65(1H, т, J= 8 Гц), 7,1-7,8 (20H,м).
М.-с. m/z: 638 (М+-18).
Препаративный пример 54К раствору 1-[2-(N,N-дифенилкарбамоилокси)этил]-5-трет- бутилдифенилcилилoкcи-3,4-дигидронафталина (2,0 г) в ТГФ (тетрагидрофуран) (20 мл) при 0oC в атмосфере N2 добавляют ВH3 (4,8 мл, 1М раствор в ТГФ). После перемешивания в течение 12 часов при комнатной температуре к раствору добавляют 2N раствор NaOH (1,5 мл) и H2O2 (1,0 мл, 35% раствор), и перемешивают в течение 4 часов. Смесь выливают в смесь этилацетата и воды. Органический слой промывают 1N раствором HCl, насыщенным раствором NaHCO3 и солевым раствором, сушат над MgSO4 и упаривают в вакууме. Остаток очищают хроматографией на силикагеле, и получают (транс)-1-[2-(N, N-дифенилкарбамоилокси)этил]-2- гидрокси-5-трет-бутилдифенилсилилокси-1,2,3,4-тетрагидронафталин (1,1 г). ИК (чистый): 3400, 1700 см-1 ЯМР (CDCl3,  ): 1,10(9H,с), 1,7-2,1(4H,м), 2,7- 3,0(3H,м), 3,9-4,0(1H, м), 4,1- 4,3(2H,м), 6,24(1H, д, J= 8 Гц), 6,49(1H, д,J=8 Гц), 6,67(1H, т, J= 8 Гц), 7,1-7,8 (20H,м).
М.-с. m/z: 642 (М++1).
Препаративный пример 55 ): 1,10(9H,с), 1,7-2,1(4H,м), 2,7- 3,0(3H,м), 3,9-4,0(1H, м), 4,1- 4,3(2H,м), 6,24(1H, д, J= 8 Гц), 6,49(1H, д,J=8 Гц), 6,67(1H, т, J= 8 Гц), 7,1-7,8 (20H,м).
М.-с. m/z: 642 (М++1).
Препаративный пример 55Раствор метил-[5-метокси-1-оксо- 1,2,3,4-тетрагидро-2-нафтил] формиата (2,50 г), D-10-камфорсульфоновой кислоты (124 мг), [RuCl2(S)-binap]2 NEt3 (90 мг) [см. Tetrahedron Lettets, Vol. 35, N 26, pp. 4559-4562, 1994], этилацетата (23,8 мл) и метанола (1,25 мл) перемешивают в атмосфере водорода (90 атм) при 50oC в течение 40 часов. Реакционную смесь упаривают в вакууме, и остаток очищают колоночной хроматографией на силикагеле (н-гексан:этилацетат = 4:1), получают (1R,2S)-метил-[1-гидрокси-5-метокси-1,2,3,4- тетрагидро-2-нафтил]формиат (2,47 г) в виде белого порошка. Т.пл. 87-88oC. Пример 9 Перечисленные далее соединения получают по способу, подобному способу примера 7. (1) (S)-2-[1,2,3,4-Тетрагидро-5-этоксикарбонилметокси-2-нафтил) метил] -6-дифенилметил-3(2H)-пиридазинон. [  ]2D6 = -20,63 ]2D6 = -20,63 (C=0,95, CH2Cl2) (C=0,95, CH2Cl2)ИК (пленка): 1750, 1660, 1580, 760, 720, 700 см-1 ЯМР (CDCl3,  ): 1,35-1,60(1H,м), 1,29(3H, т, J= 7,1 Гц), 1,80-2,00(1H, м), 2,20-3,20(5H, м), 4,15-4,20(2H,м), 4,25(2H, к, J= 7,1 Гц), 4,61(2H,с), 5,45(1H, с), 6,51(1H, д, J= 7,8 Гц), 6,64(1H, д, J= 7,8 Гц), 6,86(1H, д, J= 9,5 Гц), 7,08(1H, дд, J= 7,8 Гц, 7,8 Гц), 7,10-7,35(11H,м).
(2) 2-[(3,4-Дигидро-5-этоксикарбонилметокси-2-нафтил)метил] – 6-дифенилметил-3(2H)-пиридазинон.
ИК (пленка): 1740, 1660, 1600 см-1.
ЯМР (CDCl3, ): 1,35-1,60(1H,м), 1,29(3H, т, J= 7,1 Гц), 1,80-2,00(1H, м), 2,20-3,20(5H, м), 4,15-4,20(2H,м), 4,25(2H, к, J= 7,1 Гц), 4,61(2H,с), 5,45(1H, с), 6,51(1H, д, J= 7,8 Гц), 6,64(1H, д, J= 7,8 Гц), 6,86(1H, д, J= 9,5 Гц), 7,08(1H, дд, J= 7,8 Гц, 7,8 Гц), 7,10-7,35(11H,м).
(2) 2-[(3,4-Дигидро-5-этоксикарбонилметокси-2-нафтил)метил] – 6-дифенилметил-3(2H)-пиридазинон.
ИК (пленка): 1740, 1660, 1600 см-1.
ЯМР (CDCl3,  ): 1,30(3H, т, J=7,1 Гц), 2,23(2H, т, J= 8,3 Гц), 2,86(2H, т, J= 8,3 Гц), 4,26(2H, к, J= 7,1 Гц), 4,62(2H,с), 4,84(2H,с), 5,44(1H,с), 6,26(1H,с), 6,50-6,70(2H,м), 6,85-6,90(1H,м), 7,00-7,35(12H,м).
М.-с. (+ APCI): 507 (М++1).
(3) 1-[(3,4-Дигидро-5-этоксикарбонилметокси-2-нафтил)метил] – 5-дифенилметил-2(1H)-пиридон.
ИК (пленка): 1750, 1660, 1600 см-1 ): 1,30(3H, т, J=7,1 Гц), 2,23(2H, т, J= 8,3 Гц), 2,86(2H, т, J= 8,3 Гц), 4,26(2H, к, J= 7,1 Гц), 4,62(2H,с), 4,84(2H,с), 5,44(1H,с), 6,26(1H,с), 6,50-6,70(2H,м), 6,85-6,90(1H,м), 7,00-7,35(12H,м).
М.-с. (+ APCI): 507 (М++1).
(3) 1-[(3,4-Дигидро-5-этоксикарбонилметокси-2-нафтил)метил] – 5-дифенилметил-2(1H)-пиридон.
ИК (пленка): 1750, 1660, 1600 см-1ЯМР (CDCl3,  ): 1,30(3H, т, J= 7,1 Гц), 2,17(2H, т, J= 8,1 Гц), 2,85(2H, т, J= 8,1 Гц), 4,27(2H, к, J= 7,1 Гц), 4,62(2H,с), 5,23(1H,с), 6,14(1H,с), 6,50-6,70(3H,м), 6,80- 6,85(1H,м), 7,05-7,35(12H,м).
М.-с. (+ APCI): 506 (М++1).
(4) 1-[(3,4-Дигидро-5-этоксикарбонилметокси-2-нафтил)метил] – 3-дифенилметил-2(1H)-пиридон.
ИК (пленка): 1750, 1660, 1600 см-1 ): 1,30(3H, т, J= 7,1 Гц), 2,17(2H, т, J= 8,1 Гц), 2,85(2H, т, J= 8,1 Гц), 4,27(2H, к, J= 7,1 Гц), 4,62(2H,с), 5,23(1H,с), 6,14(1H,с), 6,50-6,70(3H,м), 6,80- 6,85(1H,м), 7,05-7,35(12H,м).
М.-с. (+ APCI): 506 (М++1).
(4) 1-[(3,4-Дигидро-5-этоксикарбонилметокси-2-нафтил)метил] – 3-дифенилметил-2(1H)-пиридон.
ИК (пленка): 1750, 1660, 1600 см-1ЯМР (CDCl3,  ): 1,29(3H, т, J= 7,1 Гц), 2,20(2H, т, J= 8,6 Гц), 2,89(2H, т, J= 8,6 Гц), 4,25(2H, к, J= 7,1 Гц), 4,61(2H,с), 4,71(2H,с), 5,30(1H, с), 5,82(1H, с), 6,12(1H, т, J= 6,8 Гц), 6,60-6,70(3H,м), 7,00-7,35(12H,м).
М.-с. (+ APCI): 506 (М++1).
Пример 10 ): 1,29(3H, т, J= 7,1 Гц), 2,20(2H, т, J= 8,6 Гц), 2,89(2H, т, J= 8,6 Гц), 4,25(2H, к, J= 7,1 Гц), 4,61(2H,с), 4,71(2H,с), 5,30(1H, с), 5,82(1H, с), 6,12(1H, т, J= 6,8 Гц), 6,60-6,70(3H,м), 7,00-7,35(12H,м).
М.-с. (+ APCI): 506 (М++1).
Пример 10Перечисленные далее соединения получают по способу, подобному способу примера 1. (1) [1,2,3,4-Тетрагидро-5-(метоксикарбонилметокси)-2-нафтил) метил]-N, N-дифенилкарбамат. Т.пл. 89,5-91oC ИК (вазел.масло): 1765, 1710, 1590, 1205 см-1 ЯМР (CDCl3,  ): 1,23-1,44(1H,м), 1, 86-2,01(2H,м), 2,35- 2,75(3H,м), 2,90-2,99(1H,м), 3,79(3H,c), 4,07-4,23(2H,м), 4,62(2H,с), 6,51(1H, д, J= 8,0 Гц), 6,69(1H, д, J= 7,6 Гц), 7,03(1H, т, J= 7,8 Гц), 7,16-7,38(10H,м).
(+) APCI М.-с. m/z: 446 (М++1).
(2) [6- или 8-Хлор-1,2,3,4-тетрагидро-5-(метоксикарбонилметокси)- 2-нафтил)метил]-N,N-дифенилкарбамат.
ИК (пленка): 1755, 1705 см-1 ): 1,23-1,44(1H,м), 1, 86-2,01(2H,м), 2,35- 2,75(3H,м), 2,90-2,99(1H,м), 3,79(3H,c), 4,07-4,23(2H,м), 4,62(2H,с), 6,51(1H, д, J= 8,0 Гц), 6,69(1H, д, J= 7,6 Гц), 7,03(1H, т, J= 7,8 Гц), 7,16-7,38(10H,м).
(+) APCI М.-с. m/z: 446 (М++1).
(2) [6- или 8-Хлор-1,2,3,4-тетрагидро-5-(метоксикарбонилметокси)- 2-нафтил)метил]-N,N-дифенилкарбамат.
ИК (пленка): 1755, 1705 см-1ЯМР (CDCl3,  ): 1,25-1,36(1H, м), 1,8-2,05(2H,м), 2,18-2,33(1H,м), 2,4-2,65(1H, м), 2,82-3,02(2H, м), 3,79(3H,c), 4,07-4,27(2H,м), 4,61(2H,с), 6,48(1H, д, J= 8,7 Гц), 7,12(1H, д, J= 8,7 Гц), 7,16-7,39(10H,м).
(+) APCl М.-с. m/z: 480 (М++1).
(3) Бензгидрил-N-[1,2,3,4-Тетрагидро-5-(метоксикарбонилметокси)- 2-нафтил)метил]карбамат.
Т.пл. 101-102oC ): 1,25-1,36(1H, м), 1,8-2,05(2H,м), 2,18-2,33(1H,м), 2,4-2,65(1H, м), 2,82-3,02(2H, м), 3,79(3H,c), 4,07-4,27(2H,м), 4,61(2H,с), 6,48(1H, д, J= 8,7 Гц), 7,12(1H, д, J= 8,7 Гц), 7,16-7,39(10H,м).
(+) APCl М.-с. m/z: 480 (М++1).
(3) Бензгидрил-N-[1,2,3,4-Тетрагидро-5-(метоксикарбонилметокси)- 2-нафтил)метил]карбамат.
Т.пл. 101-102oCИК (вазел.масло): 3350, 3320, 1765, 1680, 1250, 1215 см-1 ЯМР (CDCl3,  ): 1,35-1,43(1H,м), 1,94(2H,м), 2,36- 2,59(2H,м), 2,78-3,03(2H, м), 3,22(2H, т, J= 6,4 Гц), 3,79(3H,с), 4,63(2H,с), 4,99(1H,м), 6,51(1H, д, J= 8,0 Гц), 6,71(1H, д, J= 7,6 Гц), 6,81(1H,с), 7,03(1H, т, J= 7,9 Гц), 7,15-7,35(10H,м).
(+) APCI М.-с. m/z: 167.
Пример 11 ): 1,35-1,43(1H,м), 1,94(2H,м), 2,36- 2,59(2H,м), 2,78-3,03(2H, м), 3,22(2H, т, J= 6,4 Гц), 3,79(3H,с), 4,63(2H,с), 4,99(1H,м), 6,51(1H, д, J= 8,0 Гц), 6,71(1H, д, J= 7,6 Гц), 6,81(1H,с), 7,03(1H, т, J= 7,9 Гц), 7,15-7,35(10H,м).
(+) APCI М.-с. m/z: 167.
Пример 11К раствору (2R)-2-гидрокси-2-(N,N-дифенилкарбамоилоксиметил)- 5-трет-бутилдифенилсилилокси-1,2,3,4-тетрагидронафталина (1,9 г) в ТГФ (тетрагидрофуран) (20 мл) добавляют тетрабутиламмонийфторид (5 мл 1N раствор в ТГФ). После перемешивания в течение 1 часа при комнатной температуре раствор экстрагируют этилацетатом. Смесь промывают водой и солевым раствором. Растворитель из осушенного органического слоя испаряют в вакууме. Полученное масло растворяют в N,N-диметилформамиде (10 мл), и затем при комнатной температуре добавляют K2CO3 (1,0 г) и этилбромацетат (0,6 мл). Смесь перемешивают в течение 2 часов при той же температуре и обрабатывают этилацетатом и водой. Органический слой промывают водой, насыщенным раствором NaHCO3 и солевым раствором. Растворитель из осушенного раствора испаряют в вакууме, и остаток очищают хроматографией на силикагеле. Получают (2R)-2-гидрокси-2- (N, N-дифенилкарбамоилоксиметил)-5-этоксикарбонилметокси-1,2,3,4- тетрагидронафталин (1,1 г). ИК (чистый): 3400, 1720, 1700 см-1 ЯМР (CDCl3,  ): 1,25(3H, т, J= 7 Гц), 1,6-2,0(2H,м), 2,6-3,0(4H,м), 4,10(2H, с), 4,14(2H, к, J= 7 Гц), 4,60(2H, с), 6,52(1H, д, J= 8 Гц,), 6,66(1H, д, J=8 Гц), 7,10(1H, т, J= 8 Гц), 7,2-7,5(10H,м).
М.-с. m/z: 476 (М++1) ): 1,25(3H, т, J= 7 Гц), 1,6-2,0(2H,м), 2,6-3,0(4H,м), 4,10(2H, с), 4,14(2H, к, J= 7 Гц), 4,60(2H, с), 6,52(1H, д, J= 8 Гц,), 6,66(1H, д, J=8 Гц), 7,10(1H, т, J= 8 Гц), 7,2-7,5(10H,м).
М.-с. m/z: 476 (М++1)ВЭЖХ: chiralcel AD, 50% этанола в гексане, 12,8 мл/мин. Пример 12 Перечисленные далее соединения получают по способу, подобному способу примера 11. (1) (2S)-2-Гидрокси-2-(N, N-дифенилкарбамоилоксиметил) -5-этоксикарбонилметокси-1,2,3,4-тетрагидронафталин. ВЭЖХ: chiralcel AD, 50% этанола в гексане, 11,7 мл/мин. (2) 2-(N, N-Дифенилкарбамоилоксиметил)- 5-этоксикарбонилметилокси-3,4-дигидронафталин. ИК (чистый): 1740, 1705 см-1 ЯМР (CDCl3,  ): 1,29(3H, т, J= 7 Гц), 2,18(2H, т, J= 8,4 Гц), 2,87(2H, т, J= 8,4 Гц), 4,25(2H, к, J= 7 Гц), 4,61(2H,с), 4,75(2H,с), 6,25(1H,с), 6,5-6,7(2H,м), 7,06(1H, т, J= 8 Гц), 7,2-7,5(10H,м).
(3) (цис)-2-(N, N-Дифенилкарбамоилоксиметил)-5-этоксикарбонилметилокси- 1-гидрокси-1,2,3,4-тетрагидронафталин.
ИК (чистый): 3400, 1740, 1700 см-1 ): 1,29(3H, т, J= 7 Гц), 2,18(2H, т, J= 8,4 Гц), 2,87(2H, т, J= 8,4 Гц), 4,25(2H, к, J= 7 Гц), 4,61(2H,с), 4,75(2H,с), 6,25(1H,с), 6,5-6,7(2H,м), 7,06(1H, т, J= 8 Гц), 7,2-7,5(10H,м).
(3) (цис)-2-(N, N-Дифенилкарбамоилоксиметил)-5-этоксикарбонилметилокси- 1-гидрокси-1,2,3,4-тетрагидронафталин.
ИК (чистый): 3400, 1740, 1700 см-1ЯМР (CDCl3,  ): 1,25(3H, т, J= 7 Гц), 1,4-2,1(3H,м), 2,4-3,2(3H,м), 4,25(2H, к, J= 7 гц), 4,4-4,7(5H,м), 6,63(1H, д, J= 8 гц), 6,99(1H, д, J= 8 Гц), 7,15(1H, т, J = 8 Гц), 7,2-7,5 (10H,м).
М.-с. m/z: 458(М+-17).
(4) (транс)-2-(N, N-Дифенилкарбамоилоксиметил)-5- этоксикарбонилметилокси-1-гидрокси-1,2,3,4-тетрагидронафталин.
ИК (чистый): 3400, 1740, 1695 см-1 ): 1,25(3H, т, J= 7 Гц), 1,4-2,1(3H,м), 2,4-3,2(3H,м), 4,25(2H, к, J= 7 гц), 4,4-4,7(5H,м), 6,63(1H, д, J= 8 гц), 6,99(1H, д, J= 8 Гц), 7,15(1H, т, J = 8 Гц), 7,2-7,5 (10H,м).
М.-с. m/z: 458(М+-17).
(4) (транс)-2-(N, N-Дифенилкарбамоилоксиметил)-5- этоксикарбонилметилокси-1-гидрокси-1,2,3,4-тетрагидронафталин.
ИК (чистый): 3400, 1740, 1695 см-1ЯМР (CDCl3,  ): 1,27(3H, т, J= 7 Гц), 1,4-2,1(3H, м), 2,5-3,1(2H,м), 4,16(1H, м), 4,25(2H, к, J= 7 Гц), 4,47(1H, д, J= 8,4 Гц), 4,61(2H,с), 4,63(1H,м), 6,59(1H, д, J= 8 Гц), 7,1-7,5(12H,м).
М.-с. m/z: 458 (М+-17).
(5) 1,2-Метилен-2-(N, N-дифенилкарбамоилоксиметил)-5- этоксикарбонилметилокси-1,2,3,4-тетрагидронафталин.
ИК (чистый):1700, 1740 см-1 ): 1,27(3H, т, J= 7 Гц), 1,4-2,1(3H, м), 2,5-3,1(2H,м), 4,16(1H, м), 4,25(2H, к, J= 7 Гц), 4,47(1H, д, J= 8,4 Гц), 4,61(2H,с), 4,63(1H,м), 6,59(1H, д, J= 8 Гц), 7,1-7,5(12H,м).
М.-с. m/z: 458 (М+-17).
(5) 1,2-Метилен-2-(N, N-дифенилкарбамоилоксиметил)-5- этоксикарбонилметилокси-1,2,3,4-тетрагидронафталин.
ИК (чистый):1700, 1740 см-1ЯМР (CDCl3,  ): 0,8-1,1(2H,м), 1,25(3H, т, J= 7 гц), 1,5-2,2(3H,м), 3,1-3,3(1H, м), 4,1-4,4(4H,м), 4,69(2H,с), 6,54(1H,д, J= 8 гц), 6,85(1H, д, J= 8 Гц), 7,05(1H, т, J= 8 гц), 7,1-7,5 (10H, м).
(6) 1,2-Метилен-1-[2-(N, N-дифенилкарбамоилокси)этил] -5-этоксикарбонилметилокси-1,2,3,4-тетрагидронафталин.
ИК (чистый): 1700, 1740 см-1 ): 0,8-1,1(2H,м), 1,25(3H, т, J= 7 гц), 1,5-2,2(3H,м), 3,1-3,3(1H, м), 4,1-4,4(4H,м), 4,69(2H,с), 6,54(1H,д, J= 8 гц), 6,85(1H, д, J= 8 Гц), 7,05(1H, т, J= 8 гц), 7,1-7,5 (10H, м).
(6) 1,2-Метилен-1-[2-(N, N-дифенилкарбамоилокси)этил] -5-этоксикарбонилметилокси-1,2,3,4-тетрагидронафталин.
ИК (чистый): 1700, 1740 см-1ЯМР (CDCl3,  ): 1,6-1,9(2H,м), 1,25(3H, т, J= 8 гц), 1,2-2,2(5H,м), 2,6-3,1(2H,м), 4,0-4,4(4H,м), 4,60(2H,с), 6,50(1H, д, J= 8 Гц), 7,0-7,5(12H, м).
М.-с. m/z: 486 (М++1).
(7) 1-[2-(N, N-Дифенилкарбамоилокси)этил]-2-гидрокси-2-метил-5- этоксикарбонилметилокси-1,2,3,4-тетрагидронафталин.
ИК (чистый): 3400, 1740, 1690 см-1 ): 1,6-1,9(2H,м), 1,25(3H, т, J= 8 гц), 1,2-2,2(5H,м), 2,6-3,1(2H,м), 4,0-4,4(4H,м), 4,60(2H,с), 6,50(1H, д, J= 8 Гц), 7,0-7,5(12H, м).
М.-с. m/z: 486 (М++1).
(7) 1-[2-(N, N-Дифенилкарбамоилокси)этил]-2-гидрокси-2-метил-5- этоксикарбонилметилокси-1,2,3,4-тетрагидронафталин.
ИК (чистый): 3400, 1740, 1690 см-1ЯМР (CDCl3,  ): 1,23(3H,с), 1,4-2,0(4H,м), 2,2- 2,8(3H,м), 2,9-3,1(1H, м), 4,0- 4,4(4H,м), 4,59(2H,м), 6,52(2H, д, J= 8 Гц), 7,04(1H, т, J = 8 Гц), 7,1-7,4(10H, м).
М.-с. m/z: 486 (М+-17).
(8) (цис)-1-[2-(N, N-Дифенилкарбамоилокси)этил] -2-гидрокси- 5-этоксикарбонилметилокси-1,2,3,4-тетрагидронафталин.
ИК (чистый): 3400, 1730, 1680 см-1 ): 1,23(3H,с), 1,4-2,0(4H,м), 2,2- 2,8(3H,м), 2,9-3,1(1H, м), 4,0- 4,4(4H,м), 4,59(2H,м), 6,52(2H, д, J= 8 Гц), 7,04(1H, т, J = 8 Гц), 7,1-7,4(10H, м).
М.-с. m/z: 486 (М+-17).
(8) (цис)-1-[2-(N, N-Дифенилкарбамоилокси)этил] -2-гидрокси- 5-этоксикарбонилметилокси-1,2,3,4-тетрагидронафталин.
ИК (чистый): 3400, 1730, 1680 см-1ЯМР (CDCl3,  ): 1,25(3H, т, J= 7 Гц), 1,6 – 2,3 (5H,м), 2,6-3,0(3H,м), 4,0-4,5(5H, м), 4,61(2H, с), 6,52(1H, д, J= 8 Гц), 6,61(1H, д, J= 8 Гц), 7,03(1H, т, J= 8 Гц), 7,1-7,4 (10H,м).
М.-с. m/z: 490 (М++1).
(9) (транс)-1-[2-(N, N-Дифенилкарбамоилокси)этил]-2- гидрокси-5-этоксикарбонилметилокси-1,2,3,4-тетрагидронафталин.
ИК (чистый): 3400, 1700-1720 см-1 ): 1,25(3H, т, J= 7 Гц), 1,6 – 2,3 (5H,м), 2,6-3,0(3H,м), 4,0-4,5(5H, м), 4,61(2H, с), 6,52(1H, д, J= 8 Гц), 6,61(1H, д, J= 8 Гц), 7,03(1H, т, J= 8 Гц), 7,1-7,4 (10H,м).
М.-с. m/z: 490 (М++1).
(9) (транс)-1-[2-(N, N-Дифенилкарбамоилокси)этил]-2- гидрокси-5-этоксикарбонилметилокси-1,2,3,4-тетрагидронафталин.
ИК (чистый): 3400, 1700-1720 см-1ЯМР (CDCl3,  ): 1,25(3H, т, J= 7 Гц), 1,7-2,0(4H,м), 2,6-3,0(3H,м), 3,8-4,0(1H, м), 4,1-4,4(4H,м), 4,60(2H,с), 6,52(1H, д, J= 8 Гц), 6,61(1H, д, J= 8 Гц), 7,04(1H, т, J= 8 Гц), 7,1-7,4(10H,м).
М.-с. m/z: 490 (M++1).
(10) 1-[2-(N,N-Дифенилкарбамоилокси)этил]-1-гидрокси-5- этоксикарбонилметилокси-1,2,3,4-тетрагидронафталин.
ИК (чистый): 3450, 1720, 1705 см-1 ): 1,25(3H, т, J= 7 Гц), 1,7-2,0(4H,м), 2,6-3,0(3H,м), 3,8-4,0(1H, м), 4,1-4,4(4H,м), 4,60(2H,с), 6,52(1H, д, J= 8 Гц), 6,61(1H, д, J= 8 Гц), 7,04(1H, т, J= 8 Гц), 7,1-7,4(10H,м).
М.-с. m/z: 490 (M++1).
(10) 1-[2-(N,N-Дифенилкарбамоилокси)этил]-1-гидрокси-5- этоксикарбонилметилокси-1,2,3,4-тетрагидронафталин.
ИК (чистый): 3450, 1720, 1705 см-1ЯМР (CDCl3,  ): 1,25(3H, т, J= 7 Гц), 1,6-2,2(6H,м), 2,8-3,0(2H,м), 3,7-3,9(2H, м), 4,1-4,4(2H, м), 4,60(2H,с), 6,5-6,9(2H,м), 6,96(1H, д, J= 8 Гц), 7,1-7,4(10H,м).
M.-c. m/z: 472 (M+-17).
(11)-1-[2-(N, N-Дифенилкарбамоилокси)этил] -5-этоксикарбонилметилокси -3,4-дигидронафталин.
ИК (чистый): 1740, 1705 см-1 ): 1,25(3H, т, J= 7 Гц), 1,6-2,2(6H,м), 2,8-3,0(2H,м), 3,7-3,9(2H, м), 4,1-4,4(2H, м), 4,60(2H,с), 6,5-6,9(2H,м), 6,96(1H, д, J= 8 Гц), 7,1-7,4(10H,м).
M.-c. m/z: 472 (M+-17).
(11)-1-[2-(N, N-Дифенилкарбамоилокси)этил] -5-этоксикарбонилметилокси -3,4-дигидронафталин.
ИК (чистый): 1740, 1705 см-1ЯМР (CDCl3,  ): 1,25(3H, т, J= 7 Гц), 2,1(2H,м), 2,7-2,9(4H,м), 4,2-4,4(4H, м), 4,61(2H, с), 5,79(1H, т, J= 4,4 Гц), 6,59(1H, д, J= 8 Гц), 6,94(1H, д, J= 8 Гц), 7,01(1H, т, J= 8 Гц), 7,1-7,4(10H,м).
Пример 13 ): 1,25(3H, т, J= 7 Гц), 2,1(2H,м), 2,7-2,9(4H,м), 4,2-4,4(4H, м), 4,61(2H, с), 5,79(1H, т, J= 4,4 Гц), 6,59(1H, д, J= 8 Гц), 6,94(1H, д, J= 8 Гц), 7,01(1H, т, J= 8 Гц), 7,1-7,4(10H,м).
Пример 13К раствору 2-[2-(5-метокси-1,2,3,4-тетрагидро-1-нафтил)этил]-6-дифенилметил-3(2H)-пиридазинона (0,25 г) в метиленхлориде (10 мл) при -5oC добавляют раствор трибромида бора в метиленхлориде (1N, 0,78 мл), и раствор перемешивают при той же температуре в течение 4 часов. Реакционную смесь промывают водой и солевым раствором, сушат над сульфатом натрия и упаривают в вакууме. Остаток представляет собой сырой 2-[2-(5-гидрокси- 1,2,3,4-тетрагидро-1-нафтил)этил]-6-дифенилметил-3(2H)-пиридазинон (0,34 г). Раствор сырого 2-[2-(5-гидрокси-1,2,3,4-тетрагидро-1-нафтил)этил] -6-дифенилметил-3(2H)-пиридазинона (0,34 г), карбоната калия (0,16 г) и этилбромацетата (0,2 мл) в N,N-диметилформамиде (15 мл) перемешивают при комнатной температуре в течение 24 часов. Реакционную смесь обрабатывают этилацетатом и водой. Органический слой промывают водой и солевым раствором, сушат над сульфатом натрия и упаривают в вакууме. Остаток хроматографируют на силикагеле (н-гексан – этилацетат = 3:2), и получают 2-[2-(5-этоксикарбонилметокси-1,2,3,4-тетрагидро-1- нафтил)-этил] -6-дифенилметил-3(2H)-пиридазинон (0,17 г) в виде бледно-желтого масла. ИК (раствор в CH2Cl2): 1750, 1660, 1585 см-1 ЯМР (CDCl3,  ): 1,50-2,02(6H, м), 2,04-2,58(1H,м), 2,80-2,95(2H,м), 4,10-4,31(4H,м), 4,60(2H,c), 5,45(1H,c), 6,50(1H, д, J= 7,9 Гц), 6,72(1H, д, J= 7,9 Гц), 6,84(1H, д, J= 9,5 Гц), 6,97-7,54(12H,м).
M.-c.(APCI) m/z: 523 (M++1).
Пример 14 ): 1,50-2,02(6H, м), 2,04-2,58(1H,м), 2,80-2,95(2H,м), 4,10-4,31(4H,м), 4,60(2H,c), 5,45(1H,c), 6,50(1H, д, J= 7,9 Гц), 6,72(1H, д, J= 7,9 Гц), 6,84(1H, д, J= 9,5 Гц), 6,97-7,54(12H,м).
M.-c.(APCI) m/z: 523 (M++1).
Пример 14По способу, подобному способу примера 13, получают 2-(N,N-дифенилкарбамоилоксиметил)-2-метил-5-этоксикарбонилметилокси- 1,2,3,4-тетрагидронафталин. ИК (чистый): 1740, 1700 см-1 ЯМР (CDCl3,  ): 0,83(3H, с), 1,25(3H, т, J=7 Гц), 1,52(2H,м), 2,2-2,9(4H, м), 3,92(1H, д, J= 10,2 Гц), 4,00(1H, д, J= 10,2 Гц), 4,24(2H, к, J= 7 Гц), 4,60(2H,с), 6,50(1H, д, J= 8 Гц), 6,64(1H, д, J= 8 гц), 7,06(1H, т, J= 8 Гц), 7, 2-7, 5 (10H, м).
М.-с. m/z: 474 (М++1).
Пример 15 ): 0,83(3H, с), 1,25(3H, т, J=7 Гц), 1,52(2H,м), 2,2-2,9(4H, м), 3,92(1H, д, J= 10,2 Гц), 4,00(1H, д, J= 10,2 Гц), 4,24(2H, к, J= 7 Гц), 4,60(2H,с), 6,50(1H, д, J= 8 Гц), 6,64(1H, д, J= 8 гц), 7,06(1H, т, J= 8 Гц), 7, 2-7, 5 (10H, м).
М.-с. m/z: 474 (М++1).
Пример 15К раствору 2-(N,N-дифенилкарбамоилоксиметил)-5-трет- бутилдифенилсилилокси-1,2,3,4-тетрагидронафталина (1, 3 г) в CH2Cl2 (30 мл) при 0oC добавляют Na2CO3 (290 мг) и м-хлорпербензойную кислоту (550 мг). После перемешивания в течение 2 часов растворитель удаляют в вакууме, остаток экстрагируют этилацетатом. Смесь промывают 1N раствором HCl, насыщенным раствором NaHCO3 и солевым раствором, сушат над MgSO4 и упаривают в вакууме. Остаток очищают хроматографией на силикагеле, и получают 1,2-эпокси-2-(N,N- дифенилкарбамоилоксиметил)-5-трет-бутилдифенилсилилокси-1,2,3,4- тетрагидронафталин. Это соединение обрабатывают таким же способом, как в примере 11, и получают 1,2-эпокси-2-(N, N- дифенилкарбамоилоксиметил)-5-этоксикарбонилметилокси-1,2,3,4- тетрагидронафталин (370 мг). ИК (чистый): 1720 см-1 ЯМР (CDCl3,  ): 1,25(3H, т, J= 7 Гц), 1,6-1,9(1H,м), 2,1-2,5(2H,м), 3,0-3,2(1H, м), 3,59(1H,м), 4,23(2H, к, J= 7 Гц), 4,58(2H,с), 6,73(1H, д, J= 8 Гц), 6,93(1H, д, J= 8 Гц), 7,08(1H, т, J= 8 Гц), 7,1-7,7(10H,м).
М.-с. m/z: 474 (М++1).
Пример 16 ): 1,25(3H, т, J= 7 Гц), 1,6-1,9(1H,м), 2,1-2,5(2H,м), 3,0-3,2(1H, м), 3,59(1H,м), 4,23(2H, к, J= 7 Гц), 4,58(2H,с), 6,73(1H, д, J= 8 Гц), 6,93(1H, д, J= 8 Гц), 7,08(1H, т, J= 8 Гц), 7,1-7,7(10H,м).
М.-с. m/z: 474 (М++1).
Пример 16К раствору 5-трет-бутилдифенилсилилокси-1-[2-(N,N- дифенилкарбамоилокси)этил] -2-гидрокси-2-метил- 1,2,3,4-тетрагидронафталина (800 мг) в толуоле (20 мл) добавляют KHSO4 (100 мг). Смесь перемешивают в течение 1 часа при кипячении с обратным холодильником, и затем охлажденный раствор промывают насыщенным раствором NaHCO3 и солевым раствором. Растворитель из осушенного раствора испаряют в вакууме, и остаток растворяют в ТГФ (тетрагидрофуран) (20 мл). К раствору добавляют фторид тетрабутиламмония (2 мл, 1N раствор в ТГФ). После перемешивания в течение 1 часа при комнатной температуре раствор экстрагируют этилацетатом. Смесь упаривают в вакууме. Полученное масло растворяют в N,N -диметилформамиде (5 мл), и к раствору добавляют этилбромацетат (0,2 мл) при комнатной температуре. Смесь перемешивают в течение 2 часов при той же температуре и обрабатывают этилацетатом и водой. Органический слой промывают водой, насыщенным раствором NaHCO3 и солевым раствором. Растворитель из осушенного раствора испаряют в вакууме, и остаток очищают хроматографией на силикагеле, получают 1-[2-(N,N-дифенилкарбамоилокси)этил]-2-метил-5-этоксикарбонилметилокси- 3,4-дигидронафталин (310 мг). ИК (чистый): 1740, 1700 см-1 ЯМР (CDCl3,  ): 1,25(3H, т, J= 8 Гц), 1,89(3H,с), 1,9-2,2(1H,м), 2,8-3,3(3H, м), 3,42(1H,м), 3,8-4,1(1H,м), 4,1- 4,4(4H,м), 4,62(2H,с), 6,54(1H, д, J= 8 Гц), 6,62(1H, д, J= 8 Гц), 7,07(1H, т, J= 8 Гц), 7,1-7,5(10H,м).
М.-с. m/z: 486 (М++1).
Пример 17 ): 1,25(3H, т, J= 8 Гц), 1,89(3H,с), 1,9-2,2(1H,м), 2,8-3,3(3H, м), 3,42(1H,м), 3,8-4,1(1H,м), 4,1- 4,4(4H,м), 4,62(2H,с), 6,54(1H, д, J= 8 Гц), 6,62(1H, д, J= 8 Гц), 7,07(1H, т, J= 8 Гц), 7,1-7,5(10H,м).
М.-с. m/z: 486 (М++1).
Пример 17Смесь этил-[5,6,7,8-тетрагидро-6-(2-гидроксиэтил)-1-нафтилокси] ацетата (50 мг), N,N-дифенилкарбамоилхлорида (50 мг) и пиридина (32 мл) перемешивают при 100oC в течение 1 часа 40 минут, охлаждают до комнатной температуры и обрабатывают этилацетатом и 1N соляной кислотой. Этилацетатный слой последовательно промывают водой, водным раствором бикарбоната натрия и солевым раствором, сушат над сульфатом магния и упаривают в вакууме. Остаток хроматографируют на силикагеле (толуол-этилацетат), и получают 2-[5-(этоксикарбонилметокси)- 1,2,3,4-тетрагидро-2-нафтил]этил-N,N-дифенилкарбамат (31 мг) в виде сиропа. ИК (пенка): 1755, 1705, 1195 см-1 ЯМР (CDCl3,  ): 1,30(3H, т, J = 7,1 Гц), 1,25-1,42(1H,м), 1,61-1,70(3H, м), 1,86-1,93(1H, м), 2,29-2,64(2H, м), 2,71-2,97(2H,м), 4,20-4,32(4H,м), 4,61(2H, с); 6,51(1H, д, J= 8,0 Гц), 6,67(1H, д, J= 7,6 Гц), 7,03(1H, т, J= 7,9 Гц), 7,13-7,36(10H,м).
(+) APCI М.-с. m/z: 474 (М+1), 261.
Пример 18 ): 1,30(3H, т, J = 7,1 Гц), 1,25-1,42(1H,м), 1,61-1,70(3H, м), 1,86-1,93(1H, м), 2,29-2,64(2H, м), 2,71-2,97(2H,м), 4,20-4,32(4H,м), 4,61(2H, с); 6,51(1H, д, J= 8,0 Гц), 6,67(1H, д, J= 7,6 Гц), 7,03(1H, т, J= 7,9 Гц), 7,13-7,36(10H,м).
(+) APCI М.-с. m/z: 474 (М+1), 261.
Пример 18К раствору димера фосгена (0,027 мл) в метиленхлориде (1 мл) при -5oC добавляют раствор (5-этоксикарбонилметокси-1,2,3,4- тетрагидро-1-нафтил) метанола (0,12 г) и пиридина (0,1 мл) в метиленхлориде (2 мл), и раствор перемешивают при комнатной температуре в течение двух часов. К реакционной смеси добавляют раствор гидрохлорида 1,1-дифенилгидразина (0,10 г) и пиридина (0,05 мл) в метиленхлориде (2 мл). Раствор перемешивают при комнатной температуре в течение 3 часов, промывают 5% соляной кислотой, водой и солевым раствором, сушат над сульфатом натрия и упаривают в вакууме. Остаток хроматографируют на силикагеле (н- гексан – этилацетат), и получают 2-[(5-этоксикарбонилметокси-1, 2,3,4-тетрагидро-1-нафтил)метоксикарбонил] -1,1-дифенилгидразин (0,13 г) в виде бесцветного твердого вещества. ЯМР (CDCl3,  ): 1,29(3H, т, J= 7,1 Гц), 1,65- 2,00(3H,м), 2,44-3,22(4H, м), 4,25(2H, к, J= 7,1 Гц), 4,15- 4,44(2H,м), 4,62(2H,с), 6,56(1H, д, J = 7,8 Гц), 6,65-7,20(8H,м), 7,20-7,40(5H,м).
М.-с. (APCI) m/z: 475 (M+1).
Пример 19 ): 1,29(3H, т, J= 7,1 Гц), 1,65- 2,00(3H,м), 2,44-3,22(4H, м), 4,25(2H, к, J= 7,1 Гц), 4,15- 4,44(2H,м), 4,62(2H,с), 6,56(1H, д, J = 7,8 Гц), 6,65-7,20(8H,м), 7,20-7,40(5H,м).
М.-с. (APCI) m/z: 475 (M+1).
Пример 19Раствор этил-(6-амино-5,6,7,8-тетрагидро-1-нафтилокси)ацетата (83 мг) и 4-нитрофенил(бензгидрил) карбоната (116 мг) в N,N-диметилформамиде (2 мл) перемешивают при 50oC в течение 1 часа 30 минут, охлаждают до комнатной температуры и экстрагируют этилацетатом. Экстракт промывают пять раз водным раствором бикарбоната натрия и солевым раствором, сушат над сульфатом натрия и упаривают в вакууме. Остаток хроматографируют на силикагеле (толуол – этилацетат), и получают бензгидрил-N- [1,2,3,4-тетрагидро- 5-(этоксикарбонилметокси)-2-нафтил]карбамат (110 мг) в виде масла. ИК (пленка): 1750, 1720, 1705, 1210 см-1 ЯМР (CDCl3,  ): 1,29(3H, т, J= 7,1 Гц), 1,79(1H,м), 2,04(1H,м), 2,65(1H, дд, J= 16,4, 8,0 Гц), 2,79-2,89(2H,м), 3,11(1H, дд, J= 16,3, 4,5 Гц), 4,04(1H, м), 4,26(2H, к, J= 7,1 Гц), 4,62(2H,с), 4,91(1H,шд), 6,54(1H, д, J= 8,1 Гц), 6,71(1H, д, J= 7,6 Гц), 6,81(1H,с), 7,06(1H, т, J= 7,9 Гц), 7,15-7,35(10H,м).
(+) APCI М.-с. m/z: 167.
Пример 20 ): 1,29(3H, т, J= 7,1 Гц), 1,79(1H,м), 2,04(1H,м), 2,65(1H, дд, J= 16,4, 8,0 Гц), 2,79-2,89(2H,м), 3,11(1H, дд, J= 16,3, 4,5 Гц), 4,04(1H, м), 4,26(2H, к, J= 7,1 Гц), 4,62(2H,с), 4,91(1H,шд), 6,54(1H, д, J= 8,1 Гц), 6,71(1H, д, J= 7,6 Гц), 6,81(1H,с), 7,06(1H, т, J= 7,9 Гц), 7,15-7,35(10H,м).
(+) APCI М.-с. m/z: 167.
Пример 20К раствору бензгидрил-N-[[1,2,3,4-тетрагидро-5- (метоксикарбонилметокси)-2-нафтил]метил]карбамата (117 мг) и метилиодида (36 мг) в N, N-диметилформамиде (1,2 мл) при охлаждении льдом и перемешивании добавляют 60% гидрид натрия (10,2 мг), и смесь перемешивают при той же температуре в течение 7 часов. Затем к смеси еще добавляют 60% гидрид натрия (10,2 мг) и метилиодид (36 мг). Получающуюся в результате смесь перемешивают при комнатной температуре в течение 3 суток и экстрагируют этилацетатом. Экстракт промывают дважды солевым раствором, сушат над сульфатом магния и упаривают в вакууме. Остаток хроматографируют на силикагеле (толуол – этилацетат), и получают бензгидрил-N-метил-N-[[1,2,3,4-тетрагидро-5-(метоксикарбонилметокси)- 2-нафтил]метил]карбамат (71 мг) в виде масла. ИК (пленка): 1755, 1730 (плечо), 1690, 1200 см-1 ЯМР (CDCl3,  ): 1,25-1,45(1H,м), 1,85-2,15(2H,м), 2,35-2,8(3H,м), 2,96 и 3,08(3H,с), 3,05(1H,м), 3,3-3,5(2H), 3,79(3H,с), 4,63(2H), 6,51(1H, д, J= 7,9 Гц), 6,66(1H,м), 6,82(1H,с), 7,03(1H,м), 7,18-7,33(10H,м).
(+) APCl М.-с. m/z: 167.
Пример 21 ): 1,25-1,45(1H,м), 1,85-2,15(2H,м), 2,35-2,8(3H,м), 2,96 и 3,08(3H,с), 3,05(1H,м), 3,3-3,5(2H), 3,79(3H,с), 4,63(2H), 6,51(1H, д, J= 7,9 Гц), 6,66(1H,м), 6,82(1H,с), 7,03(1H,м), 7,18-7,33(10H,м).
(+) APCl М.-с. m/z: 167.
Пример 21К раствору 2-(N,N-дифенилкарбамоилоксиметил)- 5-этоксикарбонилметилокси-3,4-дигидронафталина (270 мг) в смеси ацетонитрила (10 мл) и воды (5 мл) при 0oC добавляют N-оксид 4-метилморфолина (0,34 мл) и O5O4 (1 мл, 2,5% раствор в трет-бутиловом спирте). После перемешивания в течение 4 часов раствор разбавляют этилацетатом. Смесь промывают 1N раствором HCl, насыщенным раствором NaHCO3 и солевым раствором, сушат над MgSO4 и упаривают в вакууме. Остаток очищают хроматографией на силикагеле, и получают 1,2-дигидрокси-2- (N, N-дифенилкарбамоилоксиметил)-5-этоксикарбонилметилокси-1,2,3,4-тетрагидронафталин. ИК (чистый): 3400, 1720 см-1 ЯМР (CDCl3,  ): 1,29(3H, т, J=7 Гц), 1,6 -2,2(2H,м), 2,68-3,2(4H,м), 4,25(2H, к, J= 7 Гц), 4,4-4,6(3H,м), 4,61(2H,с), 6,61(1H,м), 7,1-7,6(12H,м).
М.-с. m/z: 474 (М+-17).
Пример 22 ): 1,29(3H, т, J=7 Гц), 1,6 -2,2(2H,м), 2,68-3,2(4H,м), 4,25(2H, к, J= 7 Гц), 4,4-4,6(3H,м), 4,61(2H,с), 6,61(1H,м), 7,1-7,6(12H,м).
М.-с. m/z: 474 (М+-17).
Пример 22По способу, подобному способу примера 21, получают 1-[2-(N,N-дифенилкарбамоилокси)этил] -1,2-дигидрокси-5- этоксикарбонилметилокси-1,2,3,4-тетрагидронафталин. ИК (чистый): 3450, 1740, 1705 см-1 ЯМР (CDCl3,  ): 1,25(3H, т, J= 7 Гц), 1,7-2,2(4H,м), 2,68-3,0(2H,м), 2,6-3,0(2H, м), 3,82(1H, м), 4,2-4,4(4H, м), 4,59(2H,с), 6,50(1H,м), 7,1-7,4(12H,м).
М.-с. m/z: 488 (М+-17) ): 1,25(3H, т, J= 7 Гц), 1,7-2,2(4H,м), 2,68-3,0(2H,м), 2,6-3,0(2H, м), 3,82(1H, м), 4,2-4,4(4H, м), 4,59(2H,с), 6,50(1H,м), 7,1-7,4(12H,м).
М.-с. m/z: 488 (М+-17)Пример 23 К раствору 1,2-эпокси-2-(N,N-дифенилкарбамоилоксиметил)-5- этоксикарбонилметилокси-1,2,3,4-тетрагидронафталина (0,2 г) в CH2Cl2 (30 мл) при 0oC добавляют HF-пиридин (0,5 мл). После перемешивания в течение 2 часов растворитель удаляют в вакууме. Остаток экстрагируют этилацетатом. Смесь промывают 1N раствором HCl, насыщенным раствором NaHCO3 и солевым раствором, сушат над MgSO4 и упаривают в вакууме. Остаток хроматографируют на силикагеле, и получают 1-фтор-2-гидрокси-2-(N,N-дифенилкарбамоилоксиметил)- 5-этоксикарбонилметилокси-1,2,3,4-тетрагидронафталин (70 мг). ИК (чистый):1700 см-1 ЯМР (CDCl3,  ): 1,26(3H, т, J= 7 Гц), 1,5 -2,1(4H,м), 2,6-3,0(2H,м), 4,0-4,5(4H, м), 4,62(2H,м), 5,20(1H, д, J= 52 Гц), 6,69(1H,м), 7,0-7,5(12H, м).
М.-с. m/z: 494 (М++1) ): 1,26(3H, т, J= 7 Гц), 1,5 -2,1(4H,м), 2,6-3,0(2H,м), 4,0-4,5(4H, м), 4,62(2H,м), 5,20(1H, д, J= 52 Гц), 6,69(1H,м), 7,0-7,5(12H, м).
М.-с. m/z: 494 (М++1)Пример 24 К раствору 2-гидрокси-2-(N,N-дифенилкарбамоилоксиметил)-5- этоксикарбонилметилокси-1,2,3,4-тетрагидронафталина (100 мг) в CH2Cl2 (10 мл) при -78oC добавляют трифторид диэтиламиносеры (0,5 мл). После перемешивания в течение 30 минут смесь промывают насыщенным NaHCO3 и солевым раствором, сушат над MgSO4 и упаривают в вакууме. Остаток хроматографируют на силикагеле, и получают 2-фтор-2-(N, N-дифенилкарбамоилоксиметил)-5- этоксикарбонилметилокси-1,2,3,4-тетрагидронафталин (40 мг). ЯМР (CDCl3,  ): 1,25(3H, т, J= 7 Гц), 1,6-2,0(2H,м), 2,8-3,0(4H,м), 4,26(2H, к, J= 7 Гц), 4,27(2H, д, J= 22 Гц), 4,76(2H,с), 6,54(1H, д, J= 8 Гц), 6,64(1H, д, J= 8 Гц), 7,06(1H, т, J= 8 Гц), 7,1-7,5(10H,м).
M.-c. m/z: 478 (М++1).
Пример 25 ): 1,25(3H, т, J= 7 Гц), 1,6-2,0(2H,м), 2,8-3,0(4H,м), 4,26(2H, к, J= 7 Гц), 4,27(2H, д, J= 22 Гц), 4,76(2H,с), 6,54(1H, д, J= 8 Гц), 6,64(1H, д, J= 8 Гц), 7,06(1H, т, J= 8 Гц), 7,1-7,5(10H,м).
M.-c. m/z: 478 (М++1).
Пример 25По способу, подобному способу примера 24, получают 1-[2-(N,N- дифенилкарбамоилокси)этил] -2-фтор-5-этоксикарбонилметилокси- 1,2,3,4-тетрагидронафталин. ЯМР (CDCl3,  ): 1,25(3H, т, J= 7 Гц), 1,7-2,1(4H,м), 2,6-2,9(2H,м), 4,1-4,4(4H,м), 4,60(2H,с), 6,5-6,7(2H,м), 7,0-7,4(11H,м).
М.-с. m/z: 492 (М++1).
Пример 26 ): 1,25(3H, т, J= 7 Гц), 1,7-2,1(4H,м), 2,6-2,9(2H,м), 4,1-4,4(4H,м), 4,60(2H,с), 6,5-6,7(2H,м), 7,0-7,4(11H,м).
М.-с. m/z: 492 (М++1).
Пример 26Раствор 2-[(3,4-дигидро-5-этоксикарбонилметокси- 2-нафтил)метил]-6-дифенилметил-3(2H)-пиридазинона (0,20 г) и 3-хлорпероксибензойной кислоты (94 мг) в дихлорметане (5 мл) выстаивают в холодильнике (примерно -15oC) в течение ночи. Реакционную смесь упаривают в вакууме, и остаток обрабатывают этилацетатом и раствором гидрокарбоната натрия. Органический слой отделают и промывают водой, солевым раствором, сушат над сульфатом магния и упаривают в вакууме. Остаток и 10% палладий-на-угле в этилацетате (5 мл) с добавлением уксусной кислоты (одна капля) перемешивают в атмосфере водорода (1 атм) при комнатной температуре в течение 4 часов. Катализатор отфильтровывают, и фильтрат упаривают в вакууме. Остаток очищают колоночной хроматографией на силикагеле (н-гексан – этилацетат = 2:1  1:1), и получают 2-[(1,2,3,4-тетрагидро-5-этоксикарбонилметокси- 2-гидрокси-2-нафтил)метил] -6-дифенилметил-3(2H)-пиридазинон (0,08 г) в виде бледно-желтого масла.
ИК (CH2Cl2): 3600-3100, 1750, 1660 см-1 1:1), и получают 2-[(1,2,3,4-тетрагидро-5-этоксикарбонилметокси- 2-гидрокси-2-нафтил)метил] -6-дифенилметил-3(2H)-пиридазинон (0,08 г) в виде бледно-желтого масла.
ИК (CH2Cl2): 3600-3100, 1750, 1660 см-1ЯМР (CDCl3,  ): 1,29(3H, т, J= 7,1 Гц), 1,60- 2,00(2H,м), 2,75-3,00(4H, м), 4,20-4,35(4H,м), 4,61(2H,с), 5,43(1H,с), 6,53(1H, д, J= 8 Гц), 6,61(1H, д, J= 8 Гц), 6,90- 7,35 (13H, м).
М.-с. (+ APCI): 525 (М++1).
Пример 27 ): 1,29(3H, т, J= 7,1 Гц), 1,60- 2,00(2H,м), 2,75-3,00(4H, м), 4,20-4,35(4H,м), 4,61(2H,с), 5,43(1H,с), 6,53(1H, д, J= 8 Гц), 6,61(1H, д, J= 8 Гц), 6,90- 7,35 (13H, м).
М.-с. (+ APCI): 525 (М++1).
Пример 27Раствор 2-[(5-этоксикарбонилметокси-1,2,3,4- тетрагидро-1-нафтил)метоксикарбонил] -1,1-дифенилгидразина (0,17 г) и 1N водного раствора гидроксида натрия (1 мл) в диоксане (1,5 мл) перемешивают при комнатной температуре в течение 30 минут, и обрабатывают раствор 5% соляной кислотой и этилацетатом. Органический слой промывают солевым раствором, сушат над сульфатом натрия и упаривают в вакууме. Остаток промывают изопропанолом, и получают 2-[(5-карбоксиметокси-1,2,3,4-тетрагидро-1-нафтил) метоксикарбонил]-1,1-дифенилгидразин (0,08 г) в виде бесцветного порошка. ИК (вазел.масло): 3230, 1730, 1700 см-1 ЯМР (CD3OD,  ): 1,49-2,01(4H,м), 2,70-3,13(3H,м), 4,10- 4,47(2H,м), 4,48(2H,с), 6,62-7,30(14H,м).
М.-с. (APCI) m/z: 447 (М++1).
Пример 28 ): 1,49-2,01(4H,м), 2,70-3,13(3H,м), 4,10- 4,47(2H,м), 4,48(2H,с), 6,62-7,30(14H,м).
М.-с. (APCI) m/z: 447 (М++1).
Пример 28Перечисленные далее соединения получают по способам, подобным способам примеров 3, 4 и 8. (1) (S)-2-[(1,2,3,4-Тетрагидро-5-карбоксиметокси-2-нафтил)метил]- 6-дифенилметил-3(2H)-пиридазинон. [  ]2D5 = -27,6 ]2D5 = -27,6 (C=0,75, CH2Cl2) (C=0,75, CH2Cl2)Т.пл. 144-145oC ИК (вазел.масло): 2600-2200, 1740, 1640, 770, 700 см-1 ЯМР (ДМСО-d6,  ): 1,20-1,45(1H,м), 1,70-1,90(1H,м), 2,10-2,90(5H,м), 3,90-4,10(2H, м), 4,65(2H,c), 5,57(1H,c), 6,55-6,65(2H,м), 6,90-7,05(2H,м), 7,20-7,35(11H,м), 12,96(1H,шс).
М.-с. (+ APCI): 481 (М++1).
(2) 2-[(3,4-Дигидро-5-карбоксиметокси-2-нафтил)метил]- 6-дифенилметил-3(2H)-пиридазинон.
Т.пл. 156-158oC.
ИК (вазел.масло): 1710, 1630 см-1 ): 1,20-1,45(1H,м), 1,70-1,90(1H,м), 2,10-2,90(5H,м), 3,90-4,10(2H, м), 4,65(2H,c), 5,57(1H,c), 6,55-6,65(2H,м), 6,90-7,05(2H,м), 7,20-7,35(11H,м), 12,96(1H,шс).
М.-с. (+ APCI): 481 (М++1).
(2) 2-[(3,4-Дигидро-5-карбоксиметокси-2-нафтил)метил]- 6-дифенилметил-3(2H)-пиридазинон.
Т.пл. 156-158oC.
ИК (вазел.масло): 1710, 1630 см-1ЯМР (ДМСО-d6,  ): 2,12(2H, т, J= 8,9 Гц), 2,67 (2H, т, J= 8,9 Гц), 4,66(2H, с), 4,74(2H, с), 5,56(1H, с), 6,13(1H,с), 6,62(1H, д, J= 7,9 Гц), 6,71(1H, д, J= 7,9 Гц), 6,95(1H, д, J = 9,6 Гц), 7,05(1H, д, J= 7,9 Гц), 7,15-7,40(11H,м), 13,0(1H,шс).
М.-с. (+APCI): 479 (М++1).
(3) 2-[(1,2,3,4-Тетрагидро-5-карбоксиметокси-2-гидрокси-2- нафтил)метил] -6-дифенилметил-3(2H)-пиридазинон.
Т.пл. 122-123oC ): 2,12(2H, т, J= 8,9 Гц), 2,67 (2H, т, J= 8,9 Гц), 4,66(2H, с), 4,74(2H, с), 5,56(1H, с), 6,13(1H,с), 6,62(1H, д, J= 7,9 Гц), 6,71(1H, д, J= 7,9 Гц), 6,95(1H, д, J = 9,6 Гц), 7,05(1H, д, J= 7,9 Гц), 7,15-7,40(11H,м), 13,0(1H,шс).
М.-с. (+APCI): 479 (М++1).
(3) 2-[(1,2,3,4-Тетрагидро-5-карбоксиметокси-2-гидрокси-2- нафтил)метил] -6-дифенилметил-3(2H)-пиридазинон.
Т.пл. 122-123oCИК (вазел.масло): 3600-3200, 1730, 1650 см-1 ЯМР (CDCl3,  ): 1,50-1,90(2H,м), 2,50-3,00(4H,м), 3,82(2H,шс), 4,23(1H, д, J= 13,9 Гц), 4,37(1H, д, J= 13,9 Гц), 4,63(2H,с), 5,44(1H,с), 6,50-6,65(2H,м), 6,95-7,40(13H,м).
М.-с. (+APCI): 497 (М++1) ): 1,50-1,90(2H,м), 2,50-3,00(4H,м), 3,82(2H,шс), 4,23(1H, д, J= 13,9 Гц), 4,37(1H, д, J= 13,9 Гц), 4,63(2H,с), 5,44(1H,с), 6,50-6,65(2H,м), 6,95-7,40(13H,м).
М.-с. (+APCI): 497 (М++1)(4) 1-[(3,4-Дигидро-5-карбоксиметокси-2-нафтил)метил]-5- дифенилметил-2(1H)-пиридон. Т.пл. 181-182oC ИК (вазел.масло): 1730, 1650 см-1 ЯМР (ДМСО-d6,  ): 2,11(2H, т, J= 8,2 Гц), 2,72(2H, т, J= 8,3 Гц), 4,61(2H, с), 4,69(2H, с), 5,41(1H,с), 6,03(1H,с), 6,43(1H, д, J= 10,2 Гц), 6,60(1H, д, J= 7,4 Гц), 6,72(1H, д, J= 8,0 Гц), 7,00-7,35(13H,м), 12,98(1H, шс).
М.-с. (+APCI): 478 (М++1).
(5) 1-[(3,4-Дигидро-5-карбоксиметокси-2-нафтил)метил]-3- дифенилметил-2(1H)-пиридон.
Т.пл. 186-188oC.
ИК (вазел. масло): 1750, 1640 см-1 ): 2,11(2H, т, J= 8,2 Гц), 2,72(2H, т, J= 8,3 Гц), 4,61(2H, с), 4,69(2H, с), 5,41(1H,с), 6,03(1H,с), 6,43(1H, д, J= 10,2 Гц), 6,60(1H, д, J= 7,4 Гц), 6,72(1H, д, J= 8,0 Гц), 7,00-7,35(13H,м), 12,98(1H, шс).
М.-с. (+APCI): 478 (М++1).
(5) 1-[(3,4-Дигидро-5-карбоксиметокси-2-нафтил)метил]-3- дифенилметил-2(1H)-пиридон.
Т.пл. 186-188oC.
ИК (вазел. масло): 1750, 1640 см-1ЯМР (ДМСО-d6,  ): 2,13(2H, т, J= 8,2 Гц), 2,74(2H, т, J= 8,2 Гц), 4,66(2H, с), 5,65(1H,с), 5,99(1H,с), 6,25(1H, т, J= 6,8 Гц), 6,59(1H, д, J= 7,3 Гц), 6,71(1H, д, J= 8,0 Гц), 6,87(1H, J= 6,7 Гц), 7,0-7,35 (11H,м), 7,59(1H, д, J= 6,7 Гц).
(6) 2-[2-(5-Карбоксиметокси-1,2,3,4-тетрагидро-1-нафтил) этил]-6-дифенилметил-3(2H)-пиридазинон.
ЯМР (CD3OD, ): 2,13(2H, т, J= 8,2 Гц), 2,74(2H, т, J= 8,2 Гц), 4,66(2H, с), 5,65(1H,с), 5,99(1H,с), 6,25(1H, т, J= 6,8 Гц), 6,59(1H, д, J= 7,3 Гц), 6,71(1H, д, J= 8,0 Гц), 6,87(1H, J= 6,7 Гц), 7,0-7,35 (11H,м), 7,59(1H, д, J= 6,7 Гц).
(6) 2-[2-(5-Карбоксиметокси-1,2,3,4-тетрагидро-1-нафтил) этил]-6-дифенилметил-3(2H)-пиридазинон.
ЯМР (CD3OD,  ): 1,60-2,55(6H, м), 2,55-2,90(3H,м), 4,11-4,29(2H,м), 4,47(2H,с), 5,55(1H,с), 6,54-6,61(2H,м), 6,88-6,90(2H,м), 7,17-7,35(11H,м).
М.-с. (APCI) m/z: 495 (М++1).
(7) 2-[5-(Карбоксиметокси-1,2,3,4-тетрагидро- 2-нафтил]-этил-N,N-дифенилкарбамат.
Т.пл. 175-177,5oC.
ИК (вазел.масло): 2750-2250, 1765, 1675 см-1 ): 1,60-2,55(6H, м), 2,55-2,90(3H,м), 4,11-4,29(2H,м), 4,47(2H,с), 5,55(1H,с), 6,54-6,61(2H,м), 6,88-6,90(2H,м), 7,17-7,35(11H,м).
М.-с. (APCI) m/z: 495 (М++1).
(7) 2-[5-(Карбоксиметокси-1,2,3,4-тетрагидро- 2-нафтил]-этил-N,N-дифенилкарбамат.
Т.пл. 175-177,5oC.
ИК (вазел.масло): 2750-2250, 1765, 1675 см-1ЯМР (ДМСО-d6,  ): 1,24(1H,м), 1,57(3H,м), 1,79(1H,м), 2,2-2,5(2H,м), 2,65-2,85(2H,м), 4,19(2H,м), 4,65(2H,с), 6,56- 6,64(1H,м), 7,00(1H, т,J= 7,8 Гц), 7,18-7,39(10H,м).
(+ APCI) М.-с.: 446 (М++1), 233.
(8) [5-(Карбоксиметокси-2-метил-1,2,3,4-тетрагидро-2-нафтил] метил-N, N-дифенилкарбамат.
ИК (вазел.масло): 1700 см-1 ): 1,24(1H,м), 1,57(3H,м), 1,79(1H,м), 2,2-2,5(2H,м), 2,65-2,85(2H,м), 4,19(2H,м), 4,65(2H,с), 6,56- 6,64(1H,м), 7,00(1H, т,J= 7,8 Гц), 7,18-7,39(10H,м).
(+ APCI) М.-с.: 446 (М++1), 233.
(8) [5-(Карбоксиметокси-2-метил-1,2,3,4-тетрагидро-2-нафтил] метил-N, N-дифенилкарбамат.
ИК (вазел.масло): 1700 см-1ЯМР (CDCl3,  ): 0,83(3H,с), 1,44(2H,м), 2,2-2,9(4H,м), 3,92(1H, д, J= 10,6 Гц), 4,08(1H, д, J= 10,6 Гц), 4,65(2H,с), 6,53(1H, J= 8 Гц), 6,66(1H, д, J= 8 Гц), 7,06(1H, т,J= 8 Гц), 7,2-7,5(10H,м).
FAB М.-с. m/z: 446 (М++1).
Пример 29 ): 0,83(3H,с), 1,44(2H,м), 2,2-2,9(4H,м), 3,92(1H, д, J= 10,6 Гц), 4,08(1H, д, J= 10,6 Гц), 4,65(2H,с), 6,53(1H, J= 8 Гц), 6,66(1H, д, J= 8 Гц), 7,06(1H, т,J= 8 Гц), 7,2-7,5(10H,м).
FAB М.-с. m/z: 446 (М++1).
Пример 29Раствор бензгидрил-N-[[1,2,3,4-тетрагидро-5-(метокси карбонилметокси)-2-нафтил]метил]карбамата (60 мг) в смеси 1N водного раствора гидроксида натрия (0,20 мл), метанола (1 мл) и 1,2-диметоксиэтана (1 мл) перемешивают при комнатной температуре в течение 30 минут, нейтрализуют 1N соляной кислотой и экстрагируют этилацетатом. Экстракт промывают солевым раствором, сушат над сульфатом магния и упаривают в вакууме. Маслянистый остаток превращают в порошок из диизопропилового эфира, и получают бензгидрил-N-[[1,2,3,4-тетрагидро-5-(карбоксиметокси)-2-нафтил] метил]карбамат (51 мг) в виде бесцветного порошка. Т.пл. 160-161oC ИК (вазел.масло): 3350, 2800-2300, 1755, 1685 см-1 ЯМР (ДМСО-d6,  ): 1,2-1,35(1H,м), 1,84(2H,м), 2,25- 2,5(2H,м), 2,7-2,85(2H, м), 3,01(2H, м), 4,64(2H,с), 6,56- 6,67(3H,м), 7,00(1H, т, J= 7,8 Гц), 7,30-7,38(10H,м), 7,57(1H,т), 12,9(1H,ш).
(+ APCI) М.-с.: m/z 412.
Пример 30 ): 1,2-1,35(1H,м), 1,84(2H,м), 2,25- 2,5(2H,м), 2,7-2,85(2H, м), 3,01(2H, м), 4,64(2H,с), 6,56- 6,67(3H,м), 7,00(1H, т, J= 7,8 Гц), 7,30-7,38(10H,м), 7,57(1H,т), 12,9(1H,ш).
(+ APCI) М.-с.: m/z 412.
Пример 30По способу, подобному способу примера 29, получают [6- или 8-хлор-5-(карбоксиметокси)-1,2,3,4-тетрагидро-2-нафтил] метил-N,N-дифенилкарбамат. Т.пл. 138-144,5oC ИК (вазел.масло): 2700-2300, 1740, 1710 см-1 ЯМР (ДМСО-d6,  ): 1,23(1H,шм), 1,84(2H,шм), 2,12- 2,27(1H,м), 2,35-2,6(1H, м), 2,7-2,85(2H,м), 4,05-4,15(2H,м), 4,66(2H,с), 6,69(1H, д, J = 8,8 Гц), 7,15-7,42(11H,м).
(+ APCI) М.-с. m/z: 466 (М++1).
Пример 31 ): 1,23(1H,шм), 1,84(2H,шм), 2,12- 2,27(1H,м), 2,35-2,6(1H, м), 2,7-2,85(2H,м), 4,05-4,15(2H,м), 4,66(2H,с), 6,69(1H, д, J = 8,8 Гц), 7,15-7,42(11H,м).
(+ APCI) М.-с. m/z: 466 (М++1).
Пример 31К раствору (2R)-2-гидрокси-2-(N,N-дифенилкарбамоилоксиметил) -5-этоксикарбонилметокси-1,2,3,4-тетрагидронафталина (0,9 г) в этаноле (20 мл) добавляют 1N раствор NaOH (1,9 мл). После перемешивания в течение 4 часов при той же температуре растворитель удаляют в вакууме, и получают натриевую соль (2R)-[5-карбоксиметокси) -2-гидрокси-1,2,3,4-тeтpaгидpo-2-нaфтил]метил-N,N- дифенилкарбамата (0,9 г). ИК (вазел.масло): 3400, 1700, 1580 см-1 ЯМР (D2O,  ): 1,2-1,6(2H,м), 2,1-2,6(4H,м), 3,72(1H, д, J= 11,0 Гц), 3,85(1H, д, J= 11,0 Гц), 4,13(2H,с), 6,29(2H,м), 6,4-7,0(11H,м).
FAB М.-с. m/z: 470 (M++1).
ВЭЖХ: chiralcel AGP, 8% ацетонитрила в 0,02N фосфатном буфере (pH=6,0) 5,3 мл/мин.
Пример 32 ): 1,2-1,6(2H,м), 2,1-2,6(4H,м), 3,72(1H, д, J= 11,0 Гц), 3,85(1H, д, J= 11,0 Гц), 4,13(2H,с), 6,29(2H,м), 6,4-7,0(11H,м).
FAB М.-с. m/z: 470 (M++1).
ВЭЖХ: chiralcel AGP, 8% ацетонитрила в 0,02N фосфатном буфере (pH=6,0) 5,3 мл/мин.
Пример 32Перечисленные далее соединения получают способами, подобными способам примеров 6 и 31. (1) Натриевая соль бензгидрил-N-[5-(карбоксиметокси)-1,2,3,4- тетрагидрил-2-нафтил]карбамата. Т.пл. 209-223oC (разл.) ИК (вазел.масло): 3340, 1695, 1615, 1250 см-1 ЯМР (ДМСО-d6,  ): 1,57(1H, м), 1,94(1H,м), 2,51- 2,67(2H,м), 2,83-2,92(2H, м), 3,60(1H,м), 4,10(2H,с), 6,48- 6,56(2H,м), 6,69(1H,с), 6,94(1H, т, J= 7,9 Гц), 7,26-7,38(10H,м), 7,57(1H,д, J= 7,2 Гц).
FAB М.-с. m/z: 454 (М++1), 432.
(2) Натриевая соль (2S)-[5-(карбоксиметокси)-2-гидрокси-1,2,3,4- тетрагидро-2-нафтил]метил-N,N-дифенилкарбамата.
ВЭЖХ: chiralcel AGP, 8% ацетонитрила в 0,02N фосфатном буфере (pH=6,0), 7,4 мл/мин.
(3) Натриевая соль [5-(карбоксиметокси)-3,4-дигидро- 2-нафтил] метил-N, N-дифенилкарбамата.
ИК (вазел.масло): 1710 см-1 ): 1,57(1H, м), 1,94(1H,м), 2,51- 2,67(2H,м), 2,83-2,92(2H, м), 3,60(1H,м), 4,10(2H,с), 6,48- 6,56(2H,м), 6,69(1H,с), 6,94(1H, т, J= 7,9 Гц), 7,26-7,38(10H,м), 7,57(1H,д, J= 7,2 Гц).
FAB М.-с. m/z: 454 (М++1), 432.
(2) Натриевая соль (2S)-[5-(карбоксиметокси)-2-гидрокси-1,2,3,4- тетрагидро-2-нафтил]метил-N,N-дифенилкарбамата.
ВЭЖХ: chiralcel AGP, 8% ацетонитрила в 0,02N фосфатном буфере (pH=6,0), 7,4 мл/мин.
(3) Натриевая соль [5-(карбоксиметокси)-3,4-дигидро- 2-нафтил] метил-N, N-дифенилкарбамата.
ИК (вазел.масло): 1710 см-1ЯМР (ДМСО-d6,  ): 2,0-2,2(2H,м), 2,6-2,8(2H,м), 4,08(2H,с), 4,68(2H,с), 6,21(1H,с), 6,50(1H, д, J=8 Гц), 6,60(1H, д, J= 8 Гц), 6,98(1H, т, J= 8 Гц), 7,2-7,5 (10H, м).
FAB М.-с. m/z: 452 (M++1).
(4) Натриевая соль [5-(карбоксиметокси)-1,2-дигидрокси-1,2,3,4- тетрагидро-2-нафтил]метил-N,N-дифенилкарбамата.
ИК (вазел.масло): 3340, 1650-1600 см-1 ): 2,0-2,2(2H,м), 2,6-2,8(2H,м), 4,08(2H,с), 4,68(2H,с), 6,21(1H,с), 6,50(1H, д, J=8 Гц), 6,60(1H, д, J= 8 Гц), 6,98(1H, т, J= 8 Гц), 7,2-7,5 (10H, м).
FAB М.-с. m/z: 452 (M++1).
(4) Натриевая соль [5-(карбоксиметокси)-1,2-дигидрокси-1,2,3,4- тетрагидро-2-нафтил]метил-N,N-дифенилкарбамата.
ИК (вазел.масло): 3340, 1650-1600 см-1ЯМР (ДМСО-d6,  ): 1,6-1,8(2H,м), 2,5-2,8(2H,м), 4,0-4,9(5H,с), 6,53(1H, м), 6,9-7,5(12H,м).
FAB М.-с. m/z: 486 (М++1).
(5) Натриевая соль [5-(карбоксиметокси)-1,2-эпокси-1,2,3,4- тетрагидро-2-нафтил]метил-N,N-дифенилкарбамата.
ИК (вазел.масло): 1700, 1590 см-1 ): 1,6-1,8(2H,м), 2,5-2,8(2H,м), 4,0-4,9(5H,с), 6,53(1H, м), 6,9-7,5(12H,м).
FAB М.-с. m/z: 486 (М++1).
(5) Натриевая соль [5-(карбоксиметокси)-1,2-эпокси-1,2,3,4- тетрагидро-2-нафтил]метил-N,N-дифенилкарбамата.
ИК (вазел.масло): 1700, 1590 см-1ЯМР (ДМСО-d6,  ): 1,4-1,7(1H,м), 1,9-2,2(2H,м), 2,8-3,1(1H,м), 3,65(1H, с), 4,08(2H, с), 4,20(1H, д, J= 12,0 Гц), 4,52(1H, д, J= 12,0 Гц), 6,71(1H, д, J= 8,0 Гц), 6,84(1H, д, J= 8 Гц), 7,05(1H, т, J= 8 Гц), 7,2-7,5(10H,м).
FAB М.-с. m/z: 468 (М++1).
(6) Натриевая соль (транс)-[5-(карбоксиметокси)-1-гидрокси-1,2,3,4- тетрагидро-2-нафтил]метил-N,N-дифенилкарбамата.
ИК (вазел.масло): 3400-3200, 1700, 1590 см-1 ): 1,4-1,7(1H,м), 1,9-2,2(2H,м), 2,8-3,1(1H,м), 3,65(1H, с), 4,08(2H, с), 4,20(1H, д, J= 12,0 Гц), 4,52(1H, д, J= 12,0 Гц), 6,71(1H, д, J= 8,0 Гц), 6,84(1H, д, J= 8 Гц), 7,05(1H, т, J= 8 Гц), 7,2-7,5(10H,м).
FAB М.-с. m/z: 468 (М++1).
(6) Натриевая соль (транс)-[5-(карбоксиметокси)-1-гидрокси-1,2,3,4- тетрагидро-2-нафтил]метил-N,N-дифенилкарбамата.
ИК (вазел.масло): 3400-3200, 1700, 1590 см-1ЯМР (ДМСО-d6,  ): 1,2-1,5(1H, м), 1,6-1,9(2H, м), 2,2- 2,8(2H,м), 4,06(2H,с), 4,1-4,4(3H,м), 6,52(1H, д, J= 7 Гц), 6,8-7,1(2H,м), 7,1-7,5(10H, м).
FAB М.-с. m/z: 470 (М++1) ): 1,2-1,5(1H, м), 1,6-1,9(2H, м), 2,2- 2,8(2H,м), 4,06(2H,с), 4,1-4,4(3H,м), 6,52(1H, д, J= 7 Гц), 6,8-7,1(2H,м), 7,1-7,5(10H, м).
FAB М.-с. m/z: 470 (М++1)(7) Натриевая соль (цис)-[5-(карбоксиметокси)-1-гидрокси-1,2,3,4- тетрагидро-2-нафтил]метил-N,N-дифенилкарбамата. ИК (вазел.масло): 3400-3200, 1690, 1590 см-1 ЯМР (ДМСО-d6,  ): 1,4-2,0(3H,м), 2,2-2,8(2H,м), 4,10(2H,с), 4,1-4,4(3H, м), 6,58(1H, д, J= 8 Гц), 6,74(1H, д, J= 8 Гц), 7,0(1H, т, J= 8 Гц), 7,1-7,5(10H,м).
FAB М.-с. m/z: 470 (М++1).
(8) Натриевая соль [5-(карбоксиметокси)-1-фтор-2-гидрокси- 1,2,3,4-тетрагидро-2-нафтил]метил-N,N-дифенилкарбамата.
ИК (вазел.масло): 3400-3300, 1710, 1600 см-1 ): 1,4-2,0(3H,м), 2,2-2,8(2H,м), 4,10(2H,с), 4,1-4,4(3H, м), 6,58(1H, д, J= 8 Гц), 6,74(1H, д, J= 8 Гц), 7,0(1H, т, J= 8 Гц), 7,1-7,5(10H,м).
FAB М.-с. m/z: 470 (М++1).
(8) Натриевая соль [5-(карбоксиметокси)-1-фтор-2-гидрокси- 1,2,3,4-тетрагидро-2-нафтил]метил-N,N-дифенилкарбамата.
ИК (вазел.масло): 3400-3300, 1710, 1600 см-1ЯМР (ДМСО-d6,  ): 1,4-2,0(2H, м), 2,5-3,2(2H, м), 3,9- 4,5(4H,м), 5,00(1H, д, J= 52 Гц), 6,7-7,5(13H,м).
FAB М.-с. m/z: 488 (М++1).
(9) Натриевая соль [5-(карбоксиметокси)-1,2-метилен-1,2,3,4- тетрагидро-2-нафтил]метил-N,N-дифенилкарбамата.
ИК (вазел.масло): 1700, 1600 см-1 ): 1,4-2,0(2H, м), 2,5-3,2(2H, м), 3,9- 4,5(4H,м), 5,00(1H, д, J= 52 Гц), 6,7-7,5(13H,м).
FAB М.-с. m/z: 488 (М++1).
(9) Натриевая соль [5-(карбоксиметокси)-1,2-метилен-1,2,3,4- тетрагидро-2-нафтил]метил-N,N-дифенилкарбамата.
ИК (вазел.масло): 1700, 1600 см-1ЯМР (ДМСО-d6,  ): 0,8-1,4(2H,м), 1,7-2,1(3H,м), 3,0(1H,м), 4,06(2H,с), 4,10(1H, д, J= 10,8 Гц), 4,20(1H, д, J= 10,8 Гц), 6,50(1H, д, J= 8 Гц), 6,71(1H, д, J= 8 Гц), 6,93(1H, т, J= 8 Гц), 7,2-7,6(10H,м).
FAB М.-с. m/z: 466 (М++1).
(10) Натриевая соль [5-(карбоксиметокси)-2-фтор-1,2,3,4-тетрагидро- 2-нафтил]метил-N,N-дифенилкарбамата.
ИК (вазел.масло): 1700, 1600 см-1 ): 0,8-1,4(2H,м), 1,7-2,1(3H,м), 3,0(1H,м), 4,06(2H,с), 4,10(1H, д, J= 10,8 Гц), 4,20(1H, д, J= 10,8 Гц), 6,50(1H, д, J= 8 Гц), 6,71(1H, д, J= 8 Гц), 6,93(1H, т, J= 8 Гц), 7,2-7,6(10H,м).
FAB М.-с. m/z: 466 (М++1).
(10) Натриевая соль [5-(карбоксиметокси)-2-фтор-1,2,3,4-тетрагидро- 2-нафтил]метил-N,N-дифенилкарбамата.
ИК (вазел.масло): 1700, 1600 см-1ЯМР (ДМСО-d6,  ): 1,6-2,0(2H,м), 2,5-3,0(4H,м), 4,08(2H,с), 4,25(2H, д, J= 20 Гц), 6,47(1H, д, J= 8 Гц), 6,51(1H,д, J= 8 Гц), 6,97(1H, т, J= 8 Гц), 7,1-7,5(10H,м).
FAB М.-с. m/z: 472 (М++1).
(11) Натриевая соль 2-[5-(карбоксиметокси)-1,2-метилен-1,2,3,4- тетрагидро-1-нафтил]этил-N,N-дифенилкарбамата.
ИК (вазел.масло): 1705, 1600 см-1 ): 1,6-2,0(2H,м), 2,5-3,0(4H,м), 4,08(2H,с), 4,25(2H, д, J= 20 Гц), 6,47(1H, д, J= 8 Гц), 6,51(1H,д, J= 8 Гц), 6,97(1H, т, J= 8 Гц), 7,1-7,5(10H,м).
FAB М.-с. m/z: 472 (М++1).
(11) Натриевая соль 2-[5-(карбоксиметокси)-1,2-метилен-1,2,3,4- тетрагидро-1-нафтил]этил-N,N-дифенилкарбамата.
ИК (вазел.масло): 1705, 1600 см-1ЯМР (ДМСО-d6,  ): 0,5-0,8(2H, м), 1,0-2,0(5H, м), 2,5- 3,0(2H,м), 4,05(2H,с), 4,0-4,3(2H,м), 6,49(1H, д, J= 8 Гц), 6,8-7,0(2H,м), 7,1-7,5(10H, м).
FAB М.-с. m/z: 480 (М++1).
(12) Натриевая соль 2-[5-(карбоксиметокси)-2-гидрокси-2-метил- 1,2,3,4-тетрагидро-1-нафтил]этил-N,N-дифенилкарбамата.
ИК (вазел.масло): 3400, 1700, 1600 см-1 ): 0,5-0,8(2H, м), 1,0-2,0(5H, м), 2,5- 3,0(2H,м), 4,05(2H,с), 4,0-4,3(2H,м), 6,49(1H, д, J= 8 Гц), 6,8-7,0(2H,м), 7,1-7,5(10H, м).
FAB М.-с. m/z: 480 (М++1).
(12) Натриевая соль 2-[5-(карбоксиметокси)-2-гидрокси-2-метил- 1,2,3,4-тетрагидро-1-нафтил]этил-N,N-дифенилкарбамата.
ИК (вазел.масло): 3400, 1700, 1600 см-1ЯМР (ДМСО-d6,  ): 1,05(3H,с), 1,1-2,0(4H,м), 2,0- 2,4(2H,м), 2,75(1H, м), 4,07(2H, с), 4,0-4,3(2H,м), 6,18(1H, д, J= 8 Гц), 6,46(1H, д, J= 8 Гц), 6,85(1H, т, J= 8 Гц), 7,1- 7,5(10H,м).
FAB М.-с. m/z: 498 (М++1).
(13) Натриевая соль 2-[5-(карбоксиметокси)-2-метил-3,4-дигидро- 1-нафтил]этил-N,N-дифенилкарбамата.
ИК (вазел.масло): 1700, 1600 см-1 ): 1,05(3H,с), 1,1-2,0(4H,м), 2,0- 2,4(2H,м), 2,75(1H, м), 4,07(2H, с), 4,0-4,3(2H,м), 6,18(1H, д, J= 8 Гц), 6,46(1H, д, J= 8 Гц), 6,85(1H, т, J= 8 Гц), 7,1- 7,5(10H,м).
FAB М.-с. m/z: 498 (М++1).
(13) Натриевая соль 2-[5-(карбоксиметокси)-2-метил-3,4-дигидро- 1-нафтил]этил-N,N-дифенилкарбамата.
ИК (вазел.масло): 1700, 1600 см-1ЯМР (ДМСО-d6,  ): 1,68(3H,с), 2,0-3,2(4H,м), 3,2- 4,2(4H,м), 4,12(2H, с), 6,5-6,7(2H,м), 7,0-7,8(11H,м).
FAB М.-с. m/z: 480 (M++1).
(14) Натриевая соль 2-[5-(карбоксиметокси)-1,2-дигидрокси-1,2,3,4- тетрагидро-1-нафтил]этил-N,N-дифенилкарбамата.
ИК (вазел.масло): 3300, 1700, 1590 см-1 ): 1,68(3H,с), 2,0-3,2(4H,м), 3,2- 4,2(4H,м), 4,12(2H, с), 6,5-6,7(2H,м), 7,0-7,8(11H,м).
FAB М.-с. m/z: 480 (M++1).
(14) Натриевая соль 2-[5-(карбоксиметокси)-1,2-дигидрокси-1,2,3,4- тетрагидро-1-нафтил]этил-N,N-дифенилкарбамата.
ИК (вазел.масло): 3300, 1700, 1590 см-1ЯМР (ДМСО-d6,  ): 1,7-2,2(4H,м), 2,5-2,7(1H,м), 2,8-3,0(1H,м), 3,75(1H, т, J= 5,4 Гц), 4,0-4,3(2H,м), 4,38(2H,с), 6,6-6,8(1H,м), 7,0- 7,4(12H,м).
FAB М.-с. m/z: 500 (М++1) ): 1,7-2,2(4H,м), 2,5-2,7(1H,м), 2,8-3,0(1H,м), 3,75(1H, т, J= 5,4 Гц), 4,0-4,3(2H,м), 4,38(2H,с), 6,6-6,8(1H,м), 7,0- 7,4(12H,м).
FAB М.-с. m/z: 500 (М++1)(15) Натриевая соль (цис)-2-[5-(карбоксиметокси)-2-гидpoкcи- 1,2,3,4-тeтpaгидpo-1-нaфтил]этил-N,N-дифенилкарбамата. ИК (вазел.масло): 1700, 1600 см-1 ЯМР (ДМСО-d6,  ): 1,5-2,1(4H,м), 2,4-2,8(3H,м), 3,83(1H,м), 4,06(2H,с), 4,0-4,3(2H, м), 6,29(1H, д, J= 8 Гц), 6,46(1H, д, J= 8 Гц), 6,87(1H, т, J= 8 Гц), 7,1-7,5 (10H,м).
FAB М.-с. m/z: 484 (M++1) ): 1,5-2,1(4H,м), 2,4-2,8(3H,м), 3,83(1H,м), 4,06(2H,с), 4,0-4,3(2H, м), 6,29(1H, д, J= 8 Гц), 6,46(1H, д, J= 8 Гц), 6,87(1H, т, J= 8 Гц), 7,1-7,5 (10H,м).
FAB М.-с. m/z: 484 (M++1)(16) Натриевая соль (транс)-2-[5-(карбоксиметокси)-2-гидрокси- 1,2,3,4-тетрагидро-1-нафтил]этил-N,N-дифенилкарбамата. ИК (вазел.масло):1700, 1600 см-1 ЯМР (ДМСО-d6,  ): 1,5-1,9(4H,м), 2,5-2,7(3H,м), 3,73(1H,м), 4,06(2H,с), 4,0-4,3(2H, м), 6,39(1H, д, J= 8 Гц), 6,45(1H, д, J= 8 Гц), 6,87(1H, т, J= 8 Гц), 7,1-7,5 (10H,м).
FAB М.-с. m/z: 484 (M++1) ): 1,5-1,9(4H,м), 2,5-2,7(3H,м), 3,73(1H,м), 4,06(2H,с), 4,0-4,3(2H, м), 6,39(1H, д, J= 8 Гц), 6,45(1H, д, J= 8 Гц), 6,87(1H, т, J= 8 Гц), 7,1-7,5 (10H,м).
FAB М.-с. m/z: 484 (M++1)(17) Натриевая соль 2-[5-(карбоксиметокси)-2-фтор-1,2,3,4- тетрагидро-1-нафтил]этил-N,N-дифенилкарбамата. ИК (вазел.масло): 1700, 1600 см-1 ЯМР (ДМСО-d6,  ): 1,5-2,0(4H,м), 2,5-2,9(3H,м), 3,73(1H,м), 4,08(2H,с), 4,0-4,3(2H, м), 6,41(1H, д, J= 8 Гц), 6,49(1H, д, J= 8 Гц), 6,91(1H, т, J= 8 Гц), 7,1-7,5(10H,м).
FAB М.-с. m/z: 486 (М++1) ): 1,5-2,0(4H,м), 2,5-2,9(3H,м), 3,73(1H,м), 4,08(2H,с), 4,0-4,3(2H, м), 6,41(1H, д, J= 8 Гц), 6,49(1H, д, J= 8 Гц), 6,91(1H, т, J= 8 Гц), 7,1-7,5(10H,м).
FAB М.-с. m/z: 486 (М++1)(18) Натриевая соль 2-[5-(кapбoкcиметoкcи)-1-гидpoкcи-1,2,3,4- тетрагидро-1-нафтил]этил-N,N-дифенилкарбамата. ИК (вазел.масло): 3400, 1700, 1600 см-1 ЯМР (ДМСО-d6,  ): 1,4-2,0(6H,м), 2,5-2,6(2H,м), 4,0-4,2(2H,м), 4,37(2H, с), 6,58(1H, т, J= 5 Гц), 7,02(2H, д, J= 5 Гц), 7,1-7,5(10H,м).
FAB М.-с. m/z: 484 (M++1) ): 1,4-2,0(6H,м), 2,5-2,6(2H,м), 4,0-4,2(2H,м), 4,37(2H, с), 6,58(1H, т, J= 5 Гц), 7,02(2H, д, J= 5 Гц), 7,1-7,5(10H,м).
FAB М.-с. m/z: 484 (M++1)(19) Натриевая соль 2-[5-(карбоксиметокси)-3,4-дигидро-1-нафтил] этил-N, N-дифенилкарбамата. ИК (вазел.масло): 1700, 1600 см-1 ЯМР (ДМСО-d6,  ): 2,0-2,2(2H, м), 2,5-2,7(4H, м), 4,0- 4,3(4H,м), 5,75(1H, м), 6,63(1H, д, J= 8 Гц), 6,80(1H, д, J= 8 Гц), 6,98(1H, т, J= 8 Гц), 7,0-7,4(10H,м).
FAB М.-с. m/z: 466 (М++1) ): 2,0-2,2(2H, м), 2,5-2,7(4H, м), 4,0- 4,3(4H,м), 5,75(1H, м), 6,63(1H, д, J= 8 Гц), 6,80(1H, д, J= 8 Гц), 6,98(1H, т, J= 8 Гц), 7,0-7,4(10H,м).
FAB М.-с. m/z: 466 (М++1)Пример 33 Раствор бензгидрил-N-метил-N-[[1,2,3,4-тетрагидро-5- (метоксикарбонилметокси)-2-нафтил] метил] карбамата (60 мг) в 0,1N растворе гидроксида натрия (1,27 мл) и метаноле перемешивают при комнатной температуре в течение ночи и упаривают в вакууме. Остаток превращают в порошок с н-гексаном, и получают натриевую соль бензгидрид-N-метил-N-[[1,2,3,4-тетрагидро- 5-(карбоксиметокси)-2-нафтил] метил]карбамата (50 мг) в виде бледно-желтого порошка. Т.пл. 100-105oC. ИК (вазел.масло): 1695, 1605, 1200 см-1 ЯМР (ДМСО-d6,  ): 1,2(1H,шм), 1,75-2,05(2H,м), 2,25-3,1(4H,м), 2,87 и 3,08(3H,с), 3,2-3,4(2H,м), 4,06(2H,с), 6,48(2H,шд), 6,70(1H,с), 6,94(1H,шт), 7,2-7,4(10H,м).
FAB М.-с. m/z: 482 (М++1) ): 1,2(1H,шм), 1,75-2,05(2H,м), 2,25-3,1(4H,м), 2,87 и 3,08(3H,с), 3,2-3,4(2H,м), 4,06(2H,с), 6,48(2H,шд), 6,70(1H,с), 6,94(1H,шт), 7,2-7,4(10H,м).
FAB М.-с. m/z: 482 (М++1)Пример 34 Раствор [1,2,3,4-тетрагидро-5-(метоксикарбонилметокси)-2-нафтил] метил] -N, N-дифенилкарбамата (600 мг) в 1N водном растворе гидроксида натрия (2,0 мл), метаноле (7 мл) и 1,2-диметоксиэтане (7 мл) перемешивают при комнатной температуре в течение 40 минут, нейтрализуют 1N соляной кислотой, упаривают в вакууме, и остаток обрабатывают этилацетатом и водой. Органический слой промывают солевым раствором, сушат над сульфатом магния и упаривают в вакууме. Остаток промывают н-гексаном, и получают бесцветный порошок (500 мг), который растворяют в смеси этанола (20 мл), метанола (30 мл) и тетрагидрофурана (10 мл). Раствор смешивают с 1N водным раствором гидроксида натрия (1,10 мл), и смесь упаривают в вакууме. Остаток промывают н-гексаном, и получают натриевую соль [5- (карбоксиметокси)-1,2,3,4-тетрагидро-2-нафтил]метил-N,N- дифенилкарбамата (475 мг) в виде бесцветного порошка. ИК (вазел.масло): 1715, 1625, 1600 (плечо) см-1 ЯМР (ДМСО-d6,  ): 1,24(1H, м), 1,83(2H,м), 2,25- 2,81(4H,м), 4,03-4,08(4H,м), 6,45-6,52(2H,м), 6,92(1H, т, J= 7,8 Гц), 7,20-7,43(10H,м).
FAB М.-с. m/z: 454<(М++1) ): 1,24(1H, м), 1,83(2H,м), 2,25- 2,81(4H,м), 4,03-4,08(4H,м), 6,45-6,52(2H,м), 6,92(1H, т, J= 7,8 Гц), 7,20-7,43(10H,м).
FAB М.-с. m/z: 454<(М++1)Элементный анализ. Для C26H24NNaO5 вычислено: C-68,87, H-5,33, N-3,09, найдено: C-68,59, H-5,31, N-3,08. Пример 35 Смесь 1-[(3,4-дигидро-5-карбоксиметокси)-2-нафтил)метил] -5- дифенилметил-2(1H)-пиридона (100 мг) и каталитического количества 10% палладия-на-угле (50% влажн.) перемешивают при комнатной температуре в атмосфере водорода в течение 5 часов. Катализатор отфильтровывают, и фильтрат упаривают в вакууме. Остаток очищают колоночной хроматографией на силикагеле (дихлорметан: метанол = 5:1), и получают 1-[(1,2,3,4-тетрагидро-5-карбоксиметокси-2-нафтил)метил] -5-дифенилметил-2(1H)-пиридон (94,5 мг) в виде бледно-желтого порошка. Т.пл. 162-163oC ИК (вазел.масло): 1670, 1610 см-1 ЯМР (ДМСО-d6,  ): 1,10-1,40(1H, м), 1,70-4,00(8H, м), 4,28(2H,с), 5,39(1H,с), 6,35-6,55(4H,с), 6,90-7,00(1H,м), 7,10-7,50 (11H,м).
М.-с. (+ APCI): 480 (М++1) ): 1,10-1,40(1H, м), 1,70-4,00(8H, м), 4,28(2H,с), 5,39(1H,с), 6,35-6,55(4H,с), 6,90-7,00(1H,м), 7,10-7,50 (11H,м).
М.-с. (+ APCI): 480 (М++1)Пример 36 По способу, подобному способу примера 35, получают 1-[(1,2,3,4-тетрагидро-5-карбоксиметокси-2-нафтил)метил]-3-дифенилметил-2 (1H)-пиридон. Т.пл. 185-187oC. ИК (вазел.масло): 1730, 1640 см-1 ЯМР (ДМСО-d6,  ): 1,20-4,00(9H, м), 4,30(2H,с), 5,64(1H,с), 6,15-6,25(1H,с), 6,45-6,60(2H,м), 6,70-7,40(12H,м), 7,55-7,70(1H,м).
Пример 37 ): 1,20-4,00(9H, м), 4,30(2H,с), 5,64(1H,с), 6,15-6,25(1H,с), 6,45-6,60(2H,м), 6,70-7,40(12H,м), 7,55-7,70(1H,м).
Пример 37Натриевую соль 2-[5-(карбоксиметокси)-2-метил-1,2,3,4- тетрагидро-1-нафтил] этил-N,N-дифенилкарбамата получают из 2-[5-(этоксикарбонилметокси)-2-метил-3,4-дигидро-1-нафтил] этил- N,N-дифенилкарбамата по способу, подобному способу примера 31. ИК (вазел.масло): 1700, 1600 см-1 ЯМР (ДМСО-d6,  ): 0,86(3H, д, J= 6,4 Гц), 1,3- 2,9(4H,м), 4,0-4,2(4H, м), 6,33(1H, д, J= 8 Гц), 6,46(1H, д,J= 8 Гц), 6,87(1H, т,J= 8 Гц), 7,1-7,5(10H,м).
FAB м.-с. m/z: 482 (М++1) ): 0,86(3H, д, J= 6,4 Гц), 1,3- 2,9(4H,м), 4,0-4,2(4H, м), 6,33(1H, д, J= 8 Гц), 6,46(1H, д,J= 8 Гц), 6,87(1H, т,J= 8 Гц), 7,1-7,5(10H,м).
FAB м.-с. m/z: 482 (М++1)Пример 38 Раствор натриевой соли (0,2 г) (2R)-[5-(карбоксиметокси)-2- гидрокси-1,2,3,4-тетрагидро-2-нафтил] метил-N, N-дифенилкарбамата в смеси воды и этилацетата промывают 1N раствором HCl и солевым раствором. Осушенный растворитель удаляют в вакууме, и остаток перекристаллизовывают из этилового эфира, получают (2R)-[5-(карбоксиметокси)-2-гидрокси-1,2,3,4-тетрагидро-2-нафтил]метил-N,N-дифенилкарбамат (150 мг). ЯМР (CDCl3,  ): 1,6-2,0(2H,м), 2,60-3,0(4H,м), 4,15(2H,с), 4,64(2H,с), 6,54(1H, д, J= 8 Гц), 6,69(1H, д, J= 8 Гц), 7,07(1H, т, J= 8 Гц), 7,1-7,5(10H,м).
Состав порошка ): 1,6-2,0(2H,м), 2,60-3,0(4H,м), 4,15(2H,с), 4,64(2H,с), 6,54(1H, д, J= 8 Гц), 6,69(1H, д, J= 8 Гц), 7,07(1H, т, J= 8 Гц), 7,1-7,5(10H,м).
Состав порошкаСоединение примера 38 – 0,2% Лактоза – 99,2% Стеарат полиоксила 40 – 0,1% Гидроксипропилцеллюлоза – 0,5% Указанные компоненты смешивают, измельчают и дозируют в порошки известными способами. Состав таблеток Соединение примера 38 – 0,2 мг Лактоза – 95,2 мг Натрий карбоксиметилцеллюлоза – 2,2 мг Гидроксипропилцеллюлоза – 0,7 мг Стеарат полиоксила 40 – 0,7 мг Стеарат магния – 1,0 мг Вышеперечисленные компоненты смешивают и прессуют в таблетки (100 мг/табл.) известным способом. Уровень токсичности заявленных соединений. Соединение примера 38 при испытании на токсичность на крысах при оральном введении (30 мг/кг в день, 13 недель) не показало никакой токсичности. Соответственно заявленные соединения могут быть отнесены к разряду соединений с низкой токсичностью. Формула изобретения
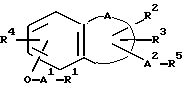 где R1 представляет собой карбоксильную или защищенную карбоксильную группу; R2 представляет собой водород, гидроксильную или защищенную гидроксильную группу; R3 представляет собой водород, гидроксильную группу, защищенную гидроксильную группу, низший алкил или галоген; R4 представляет собой водород или галоген; А1 представляет собой низший алкилен; А2 представляет собой связь или низший алкилен; -R5 представляет собой 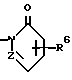 где R6 представляет собой моно (или ди- или три-)фенил-(низший)алкил; Z представляет собой N или СН, или 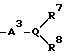 где -А3 – представляет собой  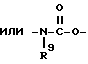 где R9 представляет собой водород или низший алкил; Q представляет собой N или СН; R7 представляет собой фенил; R8 представляет собой фенил;  представляет собой представляет собой  2. Соединение по п.1, в котором R1 представляет собой карбоксильную или этерифицированную карбоксильную группу, А1 представляет собой (С1 – С3)-алкилен, А2 представляет собой связь или (С1 – С3)-алкилен, и -R5 представляет собой 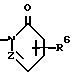 где R6 представляет собой моно дифенил(низший) алкил; Z представляет собой N или СН, или 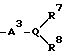 где -А3 – представляет собой  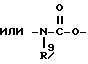 где R9 представляет собой водород или низший алкил; Q представляет собой N или СН; R7 представляет собой фенил; R8 представляет собой фенил. 3. Соединение по п. 2, в котором R1 представляет собой карбоксильную группу или низший алкоксикарбонил, R2 представляет собой водород, гидроксильную группу или ациклоксигруппу, R3 представляет собой водород, гидроксильную группу, ацилоксигруппу, низший алкил или галоген, R4 представляет собой водород или галоген, А1представляет собой метилен, А2 представляет собой связь, метилен или этилен, и -R5 представляет собой 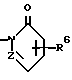 где R6 представляет собой дифенилметил; Z представляет собой N или СН, или 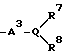 где -А3 – представляет собой  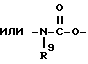 где R9 представляет собой водород или низший алкил; Q представляет собой N или СН; R7 представляет собой фенил; R8 представляет собой фенил. 4. Соединение по п.3, представляющее собой соединение формулы 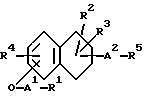 где R1 представляет собой карбоксильную группу или низший алкоксикарбонил; R2 представляет собой водород или гидроксильную группу; R3 представляет собой водород, гидроксильную группу, низший алкил или галоген; R4 представляет собой водород или галоген; А1 представляет метилен; А2 представляет собой метилен или этилен; -R5 представляет собой 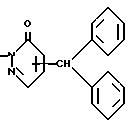 или 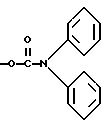 5. Соединение по п.4, выбранное из группы, в которую входят (1) натриевая соль (2R)-[5-(карбоксиметокси)-2-гидрокси-1,2,3,4-тетрагидро-2-нафтил] метил-N,N-дифенилкарамата, (2) натриевая соль (транс)-[5-(карбоксиметокси)-2-гидрокси-1,2,3,4-тетрагидро-1-нафтил] этил-N, N-дифенилкарбамата и (3) (S)-2-[(1,2,3,4-тетрагидро-5-карбоксиметокси-2-нафтил)метил] -6-дифенилметил-3-(2Н)-пиридазинон. 6. Фармацевтическая композиция, содержащая активный ингредиент в смеси с фармацевтически приемлемыми носителями, отличающаяся тем, что в качестве активного ингредиента она включает соединение по п.1 или его фармацевтически приемлемую соль. Приоритет по пунктам и признакам: 10.03.94 по п.1, где  в общей формуле I представляет собой в общей формуле I представляет собой  ; ;08.04.94 по п.1, где  в общей формуле I представляет собой в общей формуле I представляет собой  ; ;08.03.95 по п.1, где  в общей формуле I имеет другие указанные значения. в общей формуле I имеет другие указанные значения.
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 09.03.2006
Извещение опубликовано: 20.12.2007 БИ: 35/2007
|
||||||||||||||||||||||||||
