Патент на изобретение №2155187
|
||||||||||||||||||||||||||
(54) ПРОИЗВОДНЫЕ ИНДОЛА, ИХ ТАУТОМЕРЫ, СМЕСИ ИХ ИЗОМЕРОВ ИЛИ ОТДЕЛЬНЫЕ ИЗОМЕРЫ И ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ С АНТИОПУХОЛЕВОЙ ИЛИ ИНГИБИРУЮЩЕЙ ПРОТЕИН-ТИРОЗИНКИНАЗУ АКТИВНОСТЬЮ И СПОСОБ ТОРМОЖЕНИЯ ЗАВИСЯЩЕГО ОТ ПРОТЕИН-ТИРОЗИНКИНАЗЫ ЗАБОЛЕВАНИЯ ИЛИ БОРЬБЫ С АБЕРРАНТНЫМ РОСТОМ КЛЕТОК МЛЕКОПИТАЮЩЕГО ИЛИ ЧЕЛОВЕКА.
(57) Реферат: (57) Описываются новые производные индола общей формулы (I) и их таутомеры, где R1 – водород, галоген, низший алкил, гидроксил, нитро, трифторметил, группы ОСОR и ОR, в которых R означает низший алкил, при этом остаток R1 может заменять одну метиновую группу кольца аза-атомом, R2 – группы (СН2)nСООН, (СН2)nСONH2, (СН2)n СООR, (СН2)n СОNНR, (СН2)nCONRR, (СН2)nCONHCH2Ph, CONHR, CONRR, CONHPh, COPhCOOH, COPhCOOR, (СН2)n CONHPh или (СН2)n CONHPhR, в которых R имеет вышеуказанное значение, Ph означает фенил, n = 1-4, группы СОY и SO2Y, в которых Y означает фенил, незамещенный или замещенный низшим алкилом, карбоксилом или группой ОСОR, где R имеет вышеуказанное значение, R3 – водород, низший алкил, бензил, R4 -группы SH, SoX, SoQ и SeoQ’ в которых о = 1,2 или 3, Х -водород, низший алкил, бензил, Q – дальнейший 2-тиоиндолил общей формулы (I), Q – дальнейший 2-селеноиндолил общей формулы (I) при условии, что если R4 означает группу SeoQ’, то R2 означает группы – COOR5, где R5 означает водород или низший алкил, – CONHR6, где R6 означает низший алкил или (СН2)2 N-низший диалкил, или группу -CH2CH(R2‘)C(O)NHCH2Ph, где R2‘, означает амино, а Ph – фенил, при этом следующие соединения исключены из притязаний: 2-(2-тиоксо-3-индолинил)-уксусная кислота, 2-(1-метил-2-тиоксо-3-индолинил)-уксусная кислота, метил 2-(2-тиоксо-3-индолинил)ацетата, этил 2-(1-метил-2-тиоксо-3-индолинил)ацетата, дисульфид бис[метилиндолинил-3-ацетата-(2)] , дисульфид бис[индолил-3-уксусной кислоты – (2)], трисульфид бис [метилиндолил-3-ацетата-(2)] , дисульфид бис [1-метилиндолил-3-уксусной кислоты -(2)], сложный метиловый эфир 2,3-дигидро-2-тиоксо-1Н-индол-3-уксусной кислоты и сложный метиловый эфир 2-(метилтио)-1H-индол-3-уксусной кислоты, смеси их изомеров или отдельные изомеры и фармацевтически приемлемые соли. Соединение формулы (1) обладают ценными фармакологическими свойствами, в частности, они пригодны в качестве ингибитора протеин-тирозинкиназы и антиопухолевого средства. Описываются также фармацевтическая композиция на основе соединений формулы (I) способ торможения зависящего от протеин-тирозинкиназы заболевания или борьбы с аберрантным ростом клеток млекопитающего или человека. 3 c. и 1 з. п. ф-лы, 3 табл. 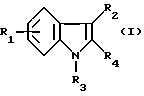
Изобретение относится к новым химическим соединениям, обладающим ценными биологическими свойствами, в частности к производным индола общей формулы (I) 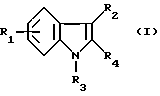 и их таутомерам, где R1 – водород, галоген, низший алкил, гидроксил, нитро, трифторметил, группы OCOR и OR, в которых R означает низший алкил, при этом остаток R1 может заменять одну метиновую группу кольца аза-атомом; R2 – группы (CH2)nCOOH, (CH2)nCONH2, (CH2)nCOOR, (CH2)nCONHR, (CH2)nCONRR, (CH2)nCONHCH2Ph, CONHR, CONRR, CONHPh, COPhCOOH, COPhCOOR, (CH2)nCONHPh или (CH2)nCONHPhR, в которых R имеет вышеуказанное значение, Ph означает фенил, а n – число 1 – 4, группы COY и SO2Y, в которых Y означает фенил, незамещенный или замещенный низшим алкилом, карбоксилом или группой OCOR, где R имеет вышеуказанное значение; R3 – водород, низший алкил, бензил; R4 – группы SH, S0X, S0Q и Se0Q’, в которых о означает число 1, 2 или 3, X – водород, низший алкил, бензил, Q – дальнейший 2-тиоиндолил общей формулы (I), Q’ – дальнейший 2-селеноиндолил общей формулы (I) при условии, что если R4 означает группу Se0Q’, то R2 означает группы -COOR5, где R5 означает водород или низший алкил, -CONHR6, где R6 означает низший алкил или (CH2)2N-низший диалкил, или группу -CH2CH(R’2), C(O)NHCH2Ph, где R’2 означает амино, а Ph – фенил, при этом следующие соединения исключены из притязаний: 2-(2-тиоксо-3-индолинил)уксусная кислота, 2-(1-метил-2-тиоксо-3- индолинил)уксусная кислота, сложный метиловый эфир 2-(2-тиоксо-3- индолинил)ацетата, сложный этиловый эфир 2-(1-метил-2-тиоксо-3- индолинил)ацетата, дисульфид бис[метилиндолинил-3-ацетата-(2)] , дисульфид бис[индолил-3-уксусной кислоты-(2)] , трисульфид бис[метилиндолил-3-ацетата-(2)], дисульфид бис[1-метилиндолил-3- уксусной кислоты-(2)] , сложный метиловый эфир 2,3-дигидро-2- тиоксо-1H-индол-3-уксусной кислоты и сложный метиловый эфир 2- (метилтио)-1H-индол-3-уксусной кислоты, смеси их изомеров или отдельным изомерам и их фармацевтически приемлемым солям. Предпочтительные соединения, подпадающие под вышеприведенную формулу (I), приводятся в п. 2 формулы изобретения. Таутомеры соединений формулы (I) имеют общие формулы (Ia) и (Ib) 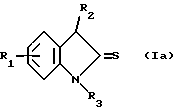 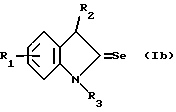 Таутомернные формы формул (Ia) и (Ib) содержат тионовые или селеновые соединения в их рацемических и оптически активных изомерных формах. Получаемые в (  )-форме тионовые и селеновые соединения можно переводить в их энантомерные оптически активные (-)- и (+)-изомеры путем известных методов, например путем фракционной кристаллизации солей оптически активных кислот, разделения изомеров путем хиральной хроматографии или путем хирального каталитического восстановления предшественников.
Новые производные индола формулы (I) и их таутомерные формы формул (Ia) и (Ib) относятся к категории среднетоксичных веществ.
Новые производные индола формулы (I), их таутомерные формы формулы (Ia) и (Ib), смеси их изомеров и отдельные изомеры или фармацевтически приемлемые соли обладают ценными фармакологическими свойствами, в частности, они пригодны в качестве ингибитора протеин-тирозинкиназы и антиопухолевого средства. Поэтому другим объектом изобретения является фармацевтическая композиция с антиопухолевой, ингибирующей протеин-тирозинкиназу активностью, содержащая по меньшей мере один фармацевтически приемлемый носитель и в качестве активного вещества производное индола общей формулы (I) или его фармацевтически приемлемую соль в эффективном количестве.
Дальнейшим объектом изобретения является способ торможения зависящего от протеин-тирозинкиназы заболевания или борьбы с аберрантным ростом клеток млекопитающего или человека путем введения млекопитающему или человеку в качестве активного вещества по меньшей мере одного соединения общей формулы (I) или его фармацевтически приемлемой соли в эффективном количестве.
Фармацевтически приемлемые соли соединений формулы (I) образуются путем взаимодействия соединений с органическими и неорганическими кислотами и/или органическими или неорганическими основаниями. В качестве пригодных для солеобразования кислот можно назвать, например, хлористоводородную кислоту, серную кислоту, фосфорную кислоту, уксусную кислоту, лимонную кислоту, щавелевую кислоту, малоновую кислоту, салициловую кислоту, яблочную кислоту, фумаровую кислоту, сукциновую кислоту, аскорбиновую кислоту, малеиновую кислоту, метансульфокислоту, 2-оксиэтансульфокислоту и т.п. В качестве пригодных для солеобразования оснований можно назвать, например, карбонат и гидроокись натрия и калия, аммиак, триэтиламин, триэтаноламин и т.п.
Соединения общей формулы (I) и их таутомерные формы формул (Ia) и (Ib) можно получать способами, представленными на реакционных схемах 1-8 (см. в конце описания).
На схеме 1 R1 – R3 имеют указанные выше для формулы (I) значения. Путем окисления 3-замещенных индолов общей формулы (II) в среде диметилсульфоксида и соляной кислоты получают 3-замещенные индолин-2-оны общей формулы (III) с большим выходом, которые обрабатывают серосодержащим соединением (предпочтительно пентасульфидом фосфора в присутствии бикарбоната или карбоната натрия) с получением 3-замещенных 2-индолинэтионов общей формулы (Ia). Эти соединения путем обработки слабыми окислителями, например хлоридом железа(III), можно переводить в соответствующие дисульфиды формулы (V), или на воздухе они подвергаются спонтанному окислению до соединений общей формулы (IV).
На схеме 2 R1 – R3 имеют указанные для формулы (I) значения. Путем обработки 3-замещенных индолов формулы (II) хлоридом серы(II) получают смесь димерных сульфидов формулы (V), в которых n’ означает число 1 – 3. Их можно разделять путем хроматографии или с использованием слабого восстановительного агента, предпочтительно борана натрия, подвергать восстановлению до 2-индолинэтионов формулы (Ia).
На схеме 3 R1 -R3 имеют указанные для формулы (I) значения, a R’ означает группы (CH2)n )-форме тионовые и селеновые соединения можно переводить в их энантомерные оптически активные (-)- и (+)-изомеры путем известных методов, например путем фракционной кристаллизации солей оптически активных кислот, разделения изомеров путем хиральной хроматографии или путем хирального каталитического восстановления предшественников.
Новые производные индола формулы (I) и их таутомерные формы формул (Ia) и (Ib) относятся к категории среднетоксичных веществ.
Новые производные индола формулы (I), их таутомерные формы формулы (Ia) и (Ib), смеси их изомеров и отдельные изомеры или фармацевтически приемлемые соли обладают ценными фармакологическими свойствами, в частности, они пригодны в качестве ингибитора протеин-тирозинкиназы и антиопухолевого средства. Поэтому другим объектом изобретения является фармацевтическая композиция с антиопухолевой, ингибирующей протеин-тирозинкиназу активностью, содержащая по меньшей мере один фармацевтически приемлемый носитель и в качестве активного вещества производное индола общей формулы (I) или его фармацевтически приемлемую соль в эффективном количестве.
Дальнейшим объектом изобретения является способ торможения зависящего от протеин-тирозинкиназы заболевания или борьбы с аберрантным ростом клеток млекопитающего или человека путем введения млекопитающему или человеку в качестве активного вещества по меньшей мере одного соединения общей формулы (I) или его фармацевтически приемлемой соли в эффективном количестве.
Фармацевтически приемлемые соли соединений формулы (I) образуются путем взаимодействия соединений с органическими и неорганическими кислотами и/или органическими или неорганическими основаниями. В качестве пригодных для солеобразования кислот можно назвать, например, хлористоводородную кислоту, серную кислоту, фосфорную кислоту, уксусную кислоту, лимонную кислоту, щавелевую кислоту, малоновую кислоту, салициловую кислоту, яблочную кислоту, фумаровую кислоту, сукциновую кислоту, аскорбиновую кислоту, малеиновую кислоту, метансульфокислоту, 2-оксиэтансульфокислоту и т.п. В качестве пригодных для солеобразования оснований можно назвать, например, карбонат и гидроокись натрия и калия, аммиак, триэтиламин, триэтаноламин и т.п.
Соединения общей формулы (I) и их таутомерные формы формул (Ia) и (Ib) можно получать способами, представленными на реакционных схемах 1-8 (см. в конце описания).
На схеме 1 R1 – R3 имеют указанные выше для формулы (I) значения. Путем окисления 3-замещенных индолов общей формулы (II) в среде диметилсульфоксида и соляной кислоты получают 3-замещенные индолин-2-оны общей формулы (III) с большим выходом, которые обрабатывают серосодержащим соединением (предпочтительно пентасульфидом фосфора в присутствии бикарбоната или карбоната натрия) с получением 3-замещенных 2-индолинэтионов общей формулы (Ia). Эти соединения путем обработки слабыми окислителями, например хлоридом железа(III), можно переводить в соответствующие дисульфиды формулы (V), или на воздухе они подвергаются спонтанному окислению до соединений общей формулы (IV).
На схеме 2 R1 – R3 имеют указанные для формулы (I) значения. Путем обработки 3-замещенных индолов формулы (II) хлоридом серы(II) получают смесь димерных сульфидов формулы (V), в которых n’ означает число 1 – 3. Их можно разделять путем хроматографии или с использованием слабого восстановительного агента, предпочтительно борана натрия, подвергать восстановлению до 2-индолинэтионов формулы (Ia).
На схеме 3 R1 -R3 имеют указанные для формулы (I) значения, a R’ означает группы (CH2)n COOH, (CH2)n COOH, (CH2)n COOX, (CH2)n COOX, (CH2)n CONHX, CONHX,в которых n” означает число 0-4, а X имеет указанные выше для формулы (I) значения. Путем обработки 2-индолинонов формулы (VI) сложными диэфирами получают соединения формулы (VII) с небольшим выходом, которые можно подвергать гидрированию в кислых условиях до 3-замещенных индолин-2-онов формулы (III). Последние можно переводить в целевые соединения путем обработки согласно схеме 1. На схеме 4 R1 – R4, R и X имеют указанные выше для формулы (I) значения, причем, однако, X не может означать водород. Замещенные на кольце оксиндолы можно получать путем обработки несущих соответствующие заместители производных орто-толуидина литиевым реагентом, используя двуокись углерода в качестве защитной группы на атоме азота, как и в качестве электрофила. 2- Индолиноны формулы (VI) обрабатывают серосодержащим соединением, предпочтительно пентасульфидом фосфора, в присутствии бикарбоната или карбоната натрия с получением 2-индолинэтионов формулы (VIII). Последние подвергают депротонированию, обычно используя гидрид натрия в среде тетрагидрофурана, и обрабатывают изоцианатом с получением 3-замещенных 2-индолэтионов формулы (Ia), где R2 означает CONHX. Данные соединения показанным на схеме 1 образом можно переводить в соответствующие дисульфиды формулы (IV). 3-Замещенные 2-индолинэтионы формулы (Ia) можно также подвергать взаимодействию с агентами алкилирования, обычно алкилгалогенидами, с получением соединений формулы (IX), где R4 означает X. Путем реакции соединения формулы (IV) с соединением формулы XSH получают смешанные дисульфиды формулы (X), где R4 означает SSX. На схеме 5 R1 и R3 имеют указанные выше для формулы (I) значения. Путем депротонирования замещенных 2-индолинэтионов общей формулы (VIII), обычно с использованием гидрида натрия в среде тетрагидрофурана, и последующей обработки ацилазидом получают 3-ацилзамещенные 2-индолинэтионы формулы (XI), в которой R5 означает фенил, незамещенный или замещенный карбоксилом или карбоксиалкилом. Соединения формулы (XI) с помощью слабого окислителя, обычно йода или перекиси водорода, переводят в дисульфиды формулы (XII). На схеме 6 R1 и R2 имеют указанные выше для формулы (I) значения, а R6 и R7 одинаковы или различны и означают водород, низший алкил или фенил, незамещенный или замещенный карбоксилом или карбоксиалкилом. 2-Хлор-1-метилиндол-3-карбонилхлорид, полученный или из индолин-2-она и карбонилхлорида, или из 2-хлор- 1-метилиндол-3-карбоновой кислоты формулы (XIII) и тионилхлорида, в среде инертного растворителя, предпочтительно 1,2-дихлорэтана или дихлорметана, и, в случае необходимости, основания, подвергают взаимодействию с аминами формулы HNR6R7 или их солями для получения амидов формулы (XIV). Данное соединение нагревают вместе с тиометилом лития в среде поляного апротонного растворителя, предпочтительно диметилацетамида, в инертных условиях для получения в качестве промежуточных соединений тиолкарбоксамидов, которые подвергают окислению, предпочтительно используя перекись водорода, с получением целевых дисульфидов формулы (IV). На схеме 7 R1, R2, R3 и R имеют указанные выше для формулы (I) значения. Путем взаимодействия хлорангидрида кислоты формулы (XV) с аминами получают амиды формулы (XVI), в которой R8 означает водород, низший алкил или фенил, незамещенный или замещенный карбоксилом или карбоксиалкилом. Соединения формулы (XVI) путем обработки литиевым реагентом и добавления метилсульфида с последующим гидролизом основанием, предпочтительно карбонатом калия, можно переводить в 2-тиоиндолы формулы (XVII). 2-Тиоиндолы формулы (XVII) путем деалкилирования, предпочтительно с использованием тиометоксида лития, и обработки слабым окислителем, предпочтительно йодом или перекисью водорода, можно переводить в желаемые дисульфиды формулы (IV). Соединения формулы (XVII) можно также подвергать алкилированию с использованием алкилгалогенида, имеющего, например, формулу R9Cl, где R9 означает низший алкил или бензил, и основания, предпочтительно карбоната калия. На схеме 8 R1 имеет указанные выше для формулы (I) значения, R6 и R7 имеют указанные выше в связи со схемой 6 значения, R’3, означает водород или низший алкил, а X’ – любой галоген, предпочтительно бром или хлор. Замещенные 2-гало-3-индолкарбоновые кислоты формулы (XX), получаемые путем окисления соответствующих замещенных 3-карбоксиальдегидов, подвергают взаимодействию с аминами формулы HNR6R7 или их солями в среде инертного растворителя, предпочтительно 1,2-дихлорэтана или дихлорметана, и в случае необходимости с основанием для получения амидов формулы (XXI). Эти соединения подвергают взаимодействию с соединением формулы MeSeLi в среде полярного апротонного растворителя, предпочтительно диметилацетамида, для получения селенкарбоксамидов в качестве промежуточных соединений, которые подвергают окислению перекисью водорода или боранатом натрия с получением целевых диселенидов формулы (XXII). Альтернативно промежуточные соединения формулы (XXI), в которой R’3 означает водород, можно подвергать взаимодействию с галоидалкиламидом или его солью, где Q означает хлор, бром или йод, предпочтительно хлор, и R8 и R9 имеют указанные выше для R3 значения, n – число 1 – 4, в среде поляного растворителя, предпочтительно ацетона, в присутствии безводного карбоната металла, предпочтительно карбоната цезия, для получения соединения формулы (XXIII) в качестве промежуточного соединения, которое описанным выше для промежуточных соединений формулы (XXI) методом переводят в диселенид формулы (XXII). Кроме того, промежуточную кислоту формулы (XX) можно переводить в сложный трет-бутиловый эфир замещенной 2-гало-3-индолкарбоновой кислоты формулы (XXIV), который описанным выше для промежуточного соединения формулы (XXI) образом можно далее подвергать взаимодействию с соединением формулы MeSeLi с получением целевого диселенида формулы (XXII), в которой R2 означает COО-трет-бутил. Как уже указывалось выше, основные соединения согласно изобретению могут образовать кислотные соли, а кислотные соединения могут образовать основные соли. Все соли охватываются изобретением, и их можно получать известными методами, например путем простого приведения в контакт кислотных и основных веществ, обычно в стехиометрическом соотношении, в водной, безводной или частично водной среде, в зависимости от конкретного случая. В зависимости от конкретного случая соли выделяют путем фильтрации, путем осаждения с последующей фильтрацией, путем упаривания растворителя или, в случае водных растворов, путем лиофилизации. Предлагаемые соединения можно переводить в форму, пригодную для их использования для терапии зависящих от протеин-тирозинкиназы заболеваний у млекопитающих или человека. К зависящим от протеин-тирозинкиназы заболеваниям относятся нарушения роста клеток (гиперпролиферация), вызываемые и/или поддерживаемые аберрантной активностью протеин-тирозинкиназы. Поэтому ингибиторы протеин-тирозинкиназы могут иметь благоприятное терапевтическое действие в борьбе против аберрантного роста клеток, например, рака разного рода, атеросклероза, роста опухолей/метастазов, диабетической ретинопатии, вирусных заболеваний, например заражения СПИД, и т.п. Зависящие от протеин-тирозинкиназы заболевания далее включают сердечно-сосудистые заболевания, связанные с аберрантной активностью протеин-тирозинкиназы. Поэтому ингибиторы протеин-тирозинкиназы могут иметь благоприятное действие при терапии таких сердечно-сосудистых заболеваний, например, рестеноза. При этом рестеноз является лишь одним примером зависящего от протеин-тирозинкиназы сердечно-сосудистого заболевания; специалисту известны другие зависящие от протеин-тирозинкиназы сердечно-сосудистые заболевания. Предлагаемые соединения дают или орально или парентерально, или путем местной аппликации, например как глазные капли, в дозах примерно от 0,1 мг до 10 мг на кг 1 веса тела пациента в сутки в виде или одной дозы, или нескольких отдельных доз. В определенных случаях может быть целесообразным дать дозы вне указанного размера. Предлагаемые соединения можно дать в виде разных препаратов, при этом соответствующее соединение может иметься в комбинации с разными фармацевтически приемлемыми инертными носителями в виде таблеток, капсул, пастилок, драже, порошков, аэрозолей, соков, сиропов, инъекционных растворов, глазных капель и т.д. К носителям относятся твердые разбавители и наполнители, стерильные водные жидкости и разные нетоксичные органические растворители. Для оральной дачи пригодны, например, таблетки, содержащие разные наполнители, как, например, цитрат натрия, карбонат кальция и фосфат кальция, наряду с разными разрыхлителями, как, например, крахмалом, в частности картофельным крахмалом или тапиокой, альгиновой кислотой, и разными комплексными силикатами, а также связывающими агентами, как, например, поливинилпирролидоном, сукрозой, желатином и акацией. Далее таблетки могут содержать смазки, как, например, стеарат магния, лаурилсульфат натрия или тальк. Подобные твердые композиции также можно заключать в капсулах из мягкого или твердого желатина. Другими предпочтительными веществами в этой связи являются лактоза и высокомолекулярные полиэтиленгликоли. Для получения водных суспензий и/или соков активное вещество можно комбинировать с разными подслащивающими, вкусовыми и/или придающими определенный цвет веществами, эмульгирующими и/или суспендирующими агентами и разбавителями, как, например, водой, этанолом, пропиленгликолем, глицерином и разными их комбинациями. Для парентеральной дачи можно использовать растворы в сезамовом или арахисовом масле или в водном пропиленгликоле, а также стерильные водные растворы соответствующих растворимых в воде вышеуказанных солей щелочных или щелочноземельных металлов. Такой водный раствор целесообразно в случае необходимости содержит буфер, и первый жидкий разбавитель целесообразно переводят в изотоническую среду, добавляя достаточное количество соли или глюкозы. Водные растворы пригодны для внутривенной, внутримышечной, подкожной и внутрибрюшинной инъекции. Все используемые в этой связи стерильные водные среды можно получать известными методами. Для местной аппликации пригодны разбавленные стерильные водные растворы, имеющие концентрацию обычно примерно 0,1-5%, это в принципе подобные вышеописанным растворам, которыми наполняют емкости, пригодные для дачи каплями в глаза. В фармацевтической композиции, содержащей соединение формулы (I) или его фармацевтически приемлемую соль, весовое соотношение носителя и активного вещества обычно составляет порядка 1:4 – 4:1, предпочтительно 1:2 – 2:1. Однако в конкретном случае соотношение зависит от растворимости активного вещества, желаемой дозы и конкретного способа дачи. В нижеследующей таблице 1 в качестве примеров приведены физические свойства 105 соединений общей формулы (I), которые можно получать вышеописанными способами. В таблице 1 использованы следующие сокращения: Me метил Et этил Ph фенил Ac ацетил p пара t-Bu трет – бутил Получение производных индола вышеприведенной формулы (I) поясняется следующими примерами. Пример 1. Получение соединений согласно таблице 1 по способу, представленному на реакционной схеме 1. Получение соединений 15, 17, 52, 54. 16,6 мл концентрированной соляной кислоты при перемешивании при комнатной температуре в течение 10 минут каплями добавляют к раствору 2,0 г 4-(3-индолил)-бутановой кислоты [соединение формулы (II), где R1, и R3 означают водород, a R2 – (CH2)3COOH] в 7,0 мл диметилсульфоксида. После реакции в течение 15 минут смесь разбавляют 80 мл воды и четыре раза экстрагируют этилацетатом, каждый раз используя 100 мл. В результате удаления растворителя получают сырую 4-(2-оксо-3- индолинил)бутановую кислоту [соединение формулы (III), где R1 и R3 означают водород, a R2 – (CH2)3COOH] в качестве зелено-коричневого твердого вещества; выход: 2,07 г, 96% теории; точка плавления (из воды): 169 – 171oC. 10 мл ацетилхлорида при перемешивании каплями добавляют к охлаждаемому льдом раствору 2,05 г полученной на предыдущей стадии сырой кислоты [соединение формулы (III), где R1 и R3 означают водород, a R2 – (CH2)3COOH] в 50 мл сухого метанола и полученную смесь размешивают при температуре 20oC в течение 18 часов. Растворитель удаляют и в результате повторного упаривания из метанола получают коричневое масло, которое растворяют в 100 мл хлороформа и дважды промывают водой, каждый раз используя 100 мл. В результате удаления растворителя получают сырой сложный метиловый эфир 4-(2-оксо-3-индолинил)бутановой кислоты [соединение формулы (III), где R1 и R3 означают водород, a R2 – (CH2)3COOMe, причем Me означает метил] в качестве масла; выход: 2,20 г. Чистое соединение в качестве желтоватого масла получают путем хроматографии на силикагеле с использованием в качестве элюента смеси этилацетата и петролейного эфира в соотношении 1:2 в качестве желтоватого масла. 1H ЯМР (CDCl3):  8,82 (1H, с, NH), 7,24 (1H, д, J=7,7 Гц, ArH), 7,21 (1H, т, J=7,8 Гц, ArH), 7,03 (1H, тд, J=7,6, 0,8 Гц, ArH), 6,91 (1H, д, J= 7,7 Гц, ArH), 3,65 (3H, с, COOCH3), 3,49 (1H, т, J=6,0 Гц, H-3), 2,34 (2H, т, J=7,5 Гц, CH2CO), 2,00, 1,72 (4H, 2хм, 3-CH2CH2).
13C ЯМР (CDCl3): 8,82 (1H, с, NH), 7,24 (1H, д, J=7,7 Гц, ArH), 7,21 (1H, т, J=7,8 Гц, ArH), 7,03 (1H, тд, J=7,6, 0,8 Гц, ArH), 6,91 (1H, д, J= 7,7 Гц, ArH), 3,65 (3H, с, COOCH3), 3,49 (1H, т, J=6,0 Гц, H-3), 2,34 (2H, т, J=7,5 Гц, CH2CO), 2,00, 1,72 (4H, 2хм, 3-CH2CH2).
13C ЯМР (CDCl3):  180,23 (с, CONH), 173,57 (с, 180,23 (с, CONH), 173,57 (с, 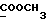 ), 141,54, 129,24 (2хс, Ar), 127,97, 124,11, 122,37, 109,80 (4хд, Ar), 51,53 (кв, ), 141,54, 129,24 (2хс, Ar), 127,97, 124,11, 122,37, 109,80 (4хд, Ar), 51,53 (кв, 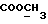 ), 45,74 (д, C3), 33,83, 29,79, 21,18 (3хт, ), 45,74 (д, C3), 33,83, 29,79, 21,18 (3хт,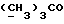 ).
C13H15NO3 ).
C13H15NO3 H2O H2OРассчитано, %: C 64,5; H 6,7; N 5,6. Найдено, %: C 64,4; H 6,5; N 5,7. Раствор 0,48 г получаемого на предыдущей стадии сырого сложного эфира [соединение формулы (III), где R1 и R3 означают водород, a R2 – (CH3)3COOMe] в 10 мл сухого диоксана обрабатывают 0,26 г пентасульфида фосфора в присутствии 0,36 г бикарбоната натрия, после чего получаемую смесь размешивают в атмосфере азота при температуре 95oC в течение часа. Полученный раствор сгущают при пониженном давлении, остаток разбавляют 100 мл дихлорметана и фильтруют. Фильтрат промывают водой, растворитель удаляют и остаток (0,55 г) подвергают хроматографии на силикагеле с использованием в качестве элюента дихлорметана с получением сырого сложного метилового эфира 4-(2-тиоксо-3-индолинил)бутановой кислоты [соединение формулы (Ia), в которой R1 и R3 означают водород, a R2 – (CH2)3COOMe] (соединение N 17); выход: 0,18 г, 35% теории; точка плавления (из смеси бензола и петролейного эфира): 109 – 110oC. 1H ЯМР (CDCl3):  10,59 (1H, с, NH), 7,31 (1H, д, J=7,4 Гц, ArH), 7,27 (1H, тд, J=7,7, 0,9 Гц, ArH), 7,14 (1H, тд, J=7,5, 0,9 Гц, ArH), 7,02 (1H, д, J= 7,7 Гц, ArH), 3,85 (1H, т, J=5,5 Гц, H-3), 3,64 (3H, с, COOCH3), 2,32 (2H, т, J=7,5 Гц, CH2CO), 2,26, 2,15, 1,67, 1,46 (4H, 4хм, 3-CH2CH2).
13C ЯМР (CDCl3): 10,59 (1H, с, NH), 7,31 (1H, д, J=7,4 Гц, ArH), 7,27 (1H, тд, J=7,7, 0,9 Гц, ArH), 7,14 (1H, тд, J=7,5, 0,9 Гц, ArH), 7,02 (1H, д, J= 7,7 Гц, ArH), 3,85 (1H, т, J=5,5 Гц, H-3), 3,64 (3H, с, COOCH3), 2,32 (2H, т, J=7,5 Гц, CH2CO), 2,26, 2,15, 1,67, 1,46 (4H, 4хм, 3-CH2CH2).
13C ЯМР (CDCl3):  207,80 (с, CSNH), 173,69 (c, 207,80 (с, CSNH), 173,69 (c, 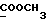 ), 143,27, 133,85 (2хс, ArH), 128,19, 124,17, 124,02, 110,12 (4хд, ArH), 57,36 (д, C-3), 51,61 (кв, ), 143,27, 133,85 (2хс, ArH), 128,19, 124,17, 124,02, 110,12 (4хд, ArH), 57,36 (д, C-3), 51,61 (кв, 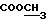 ), 33,92, 32,76, 20,41 (3хт, ), 33,92, 32,76, 20,41 (3хт, 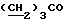 ).
C13H15NO2S ).
C13H15NO2SРассчитано, %: C 62,6; H 6,1; N 5,6; S 12,9. Найдено, %: C 62,8; H 5,9; N 5,7; S 12,9. Раствор 0,39 г соединения N 17 в метаноле оставляют стоять на воздухе в течение 13 дней, после чего удаляют растворитель. Остаток подвергают хроматографии на силикагеле с использованием в качестве элюента дихлорметана, в результате чего получают бис[метилиндолил-3-бутаноат-(2)] -дисульфид [соединение формулы (IV), где R1 и R3 означают водород, a R2 – (CH2)3COOMe] (соединение N 54); выход: 0,31 г, 80% теории; точка плавления (из смеси метанола и разбавленной соляной кислоты): 91 – 93oC. 1H ЯМР (CDCl3):  8,19 (1H, с, NH), 7,57 (1H, д, J=7,9 Гц, ArH), 7,28 (1H, д, J=8,0 Гц, ArH), 7,24 (1H, ддд, J=8,2, 7,1, 1,1 Гц, ArH), 7,12 (1H, ддд, J=8,0, 6,9, 1,4 Гц, ArH), 3,56 (3H, с, COOCH3), 2,67, 2,18 (2х2H, 2хт, J=7,4 Гц, 8,19 (1H, с, NH), 7,57 (1H, д, J=7,9 Гц, ArH), 7,28 (1H, д, J=8,0 Гц, ArH), 7,24 (1H, ддд, J=8,2, 7,1, 1,1 Гц, ArH), 7,12 (1H, ддд, J=8,0, 6,9, 1,4 Гц, ArH), 3,56 (3H, с, COOCH3), 2,67, 2,18 (2х2H, 2хт, J=7,4 Гц, 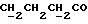 ), 1,85 (2H, квин, J=7,4 Гц, ), 1,85 (2H, квин, J=7,4 Гц, 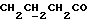 ).
13C ЯМР (CDCl3): ).
13C ЯМР (CDCl3):  174,02 (с, 174,02 (с, 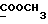 ), 137,29, 127,49, 125,99 (3хс, ArH), 124,21 (д, ArH), 123,70 (с, ArH), 119,95, 119,88, 111,08 (3хд, ArH), 51,42 (кв, ), 137,29, 127,49, 125,99 (3хс, ArH), 124,21 (д, ArH), 123,70 (с, ArH), 119,95, 119,88, 111,08 (3хд, ArH), 51,42 (кв, 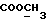 ), 33,45, 25,67, 23,95 (3хт, ), 33,45, 25,67, 23,95 (3хт, 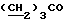 ).
C26H28N2O4S2 ).
C26H28N2O4S2Рассчитано, %: C 62,9; H 5,7; N 5,7; S 12,9, Найдено, %: C 62,6; H 6,0; N 5,5; S 13,1. Смесь 0,26 г соединения N 17 в 10 мл метанола и 0,55 г карбоната калия в 3 мл воды размешивают при комнатной температуре в течение 2 дней. Затем добавляют 100 мг борана натрия, смесь размешивают в течение 25 минут, затем разбавляют 100 мл воды и дважды экстрагируют дихлорметаном, каждый раз используя 100 мл. Водную фракцию добавлением разбавленной соляной кислоты подкисляют до значения pH 3 и трижды экстрагируют этилацетатом, каждый раз используя 100 мл. Экстракт сгущают при пониженном давлении и остаток выкристаллизовывают из смеси дихлорметана и петролейного эфира с получением 4-(2-гиоксо-3-индолинил)бутановой кислоты [соединение формулы (Ia), в которой R1 и R3 означают водород, a R2 -(CH2)3COOH] (соединение N 15); выход: 30 мг, 12% теории; точка плавления: 132-134oC. 1H ЯМР (CD3OD):  7,34 (1H, д, J=7,4 Гц, ArH), 7,26 (1H, тд, J=7,7, 1,1 Гц, ArH), 7,12 (1H, тд, J=7,5, 0,8 Гц, ArH), 7,00 (1H, д, J=7,8 Гц, ArH), 2,25 (2H, т, J=7,5 Гц, 7,34 (1H, д, J=7,4 Гц, ArH), 7,26 (1H, тд, J=7,7, 1,1 Гц, ArH), 7,12 (1H, тд, J=7,5, 0,8 Гц, ArH), 7,00 (1H, д, J=7,8 Гц, ArH), 2,25 (2H, т, J=7,5 Гц, 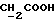 ), 2,24, 2,10, 1,55, 1,33 (4H, 4хм, 3-CH2CH).
C12H13NO2S ), 2,24, 2,10, 1,55, 1,33 (4H, 4хм, 3-CH2CH).
C12H13NO2SРассчитано, %: C 61,3; H 5,6; N 6,0; S 13,6. Найдено, %: C 61,1; H 6,2; N 6,1; S 13,5. Путем подобного гидролиза соединения N 54, осуществляемого при температуре 30oC в течение 6 часов, затем при температуре 20oC в течение одного дня получают дисульфид бис[индолил-3-бутановой кислоты-(2)] [соединение формулы (Ia), где R1 и R3 означают водород, a R2 – (CH2)3COOH] (соединение N 52); выход: 30 мг, 20% теории; точка плавления (из водного метанола): 141 – 143,5oC. 1H ЯМР (CD3OD):  7,48 (1H, дт, J=8,0, 0,8 Гц, ArH), 7,32 (1H, дт, J= 8,2, 0,7 Гц, ArH), 7,16 (1H, ддд, J=8,1, 7,1, 1,1 Гц, ArH), 7,00 (1H, ддд, J= 8,0, 7,1, 0,8 Гц, ArH), 2,42 (2H, т, J=7,6 Гц, CH2CO), 1,93 (2H, т, J=7,3 Гц, 3-CH2), 1,58 (2H, квин, J=7,5 Гц, 7,48 (1H, дт, J=8,0, 0,8 Гц, ArH), 7,32 (1H, дт, J= 8,2, 0,7 Гц, ArH), 7,16 (1H, ддд, J=8,1, 7,1, 1,1 Гц, ArH), 7,00 (1H, ддд, J= 8,0, 7,1, 0,8 Гц, ArH), 2,42 (2H, т, J=7,6 Гц, CH2CO), 1,93 (2H, т, J=7,3 Гц, 3-CH2), 1,58 (2H, квин, J=7,5 Гц, 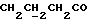 ).
13C ЯМР (CD3OD): ).
13C ЯМР (CD3OD): 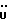 177,52 (с, COOH), 139,31, 128,69, 126,69, 124,84 (4хс, ArH), 124,67, 120,48, 120,27, 112,34 (4хд, ArH), 34,39, 27,24, 24,82 (3хт, 177,52 (с, COOH), 139,31, 128,69, 126,69, 124,84 (4хс, ArH), 124,67, 120,48, 120,27, 112,34 (4хд, ArH), 34,39, 27,24, 24,82 (3хт, 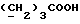 ).
C24H24N2O4S2 ).
C24H24N2O4S2 H2O H2OРассчитано, %: C 60,4; H 5,2; N 5,9; S 13,4. Найдено, %: C 60,4; H 5,4; N 5,9; S 13,6. Получение соединений NN 7, 9, 35 и 38. Путем аналогичной обработки 0,93 г сложного метилового эфира 3-(3-индолинил)- пропионовой кислоты [соединение формулы (II), где R1 и R3 означают водород, а R2 – (CH2)2COOH] в среде димитолсульфоксида и соляной кислоты с последующей этерификацией с использованием диазометана и хроматографии на силикагеле получают сложный метиловый эфир 3-(2-оксо-3-индолил)пропионовой кислоты в качестве желтого масла [соединение формулы (III), где R1) и R3 означают водород, а R2 – (CH2)2COOMe]; выход: 0,89 г, 89% теории; (согласно Julian P. L. , Printy H.C., J. Am. Chem. Soc. 1953 г., 75, стр. 5301-5305, точка плавления составляет 79-80oC.). 1H ЯМР (CDCl3): 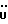 8,75 (1H, с, NH), 7,22 (2H, м, ArH), 7,03 (1H, ддд, J= 7,8, 7,1, 1,1 Гц, ArH), 6,91 (1H, дд, J=7,3, 1,3 Гц, ArH), 3,63 (3H, с, OCH3), 3,54 (1х2H, т, J=5,8 Гц, H-3), 2,61 – 2,20 (4H, м, 3-CH2CH2).
C12H13NO3 8,75 (1H, с, NH), 7,22 (2H, м, ArH), 7,03 (1H, ддд, J= 7,8, 7,1, 1,1 Гц, ArH), 6,91 (1H, дд, J=7,3, 1,3 Гц, ArH), 3,63 (3H, с, OCH3), 3,54 (1х2H, т, J=5,8 Гц, H-3), 2,61 – 2,20 (4H, м, 3-CH2CH2).
C12H13NO3Рассчитано: М+ 219,0895. Найдено: М+ 219,0898 (МС в результате электронной ионизации). Путем вышеописанной обработки 0,89 г данного сложного эфира [соединение формулы (III), где R1 и R3 означают водород, a R2 – (CH2)2COOMe] пентасульфидом фосфора и последующей хроматографии на силикагеле с использованием в качестве элюента смеси этилацетата и петролейного эфира в соотношении 3:1 получают 0,44 г масла. В результате кристаллизации из метанола получают 2,2′-дитиобис[3-(3-индолил)метилпропионат] [соединение формулы (IV), где R1 и R3 означают водород, a R2 – (CH2)2COOMe] (соединение N 38); выход: 61 мг, 6% теории; точка плавления: 162,5 – 164oC. 1H ЯМР (CDCl3): 8,21 (1H, с, NH), 7,55 (1H, дд, J=8,0, 0,7 Гц, ArH), 7,25 (2H, м ArH), 7,12 (1H, ддд, J=8,0, 5,4, 2,6 Гц, ArH), 3,56 (3H, с, OCH3), 2,98, 2,47 (2х2H 2хт, J=7,9 Гц, 3-CH2CH2). 13C ЯМР (CDCl3):  173,38 (с, COOCH3), 137,25, 127,21, 125,80 (3хс, Ar), 124,30 (д, Ar), 122,79 (с, Ar), 120,10, 119,57, 111,21 (3хд, Ar), 51,56 (кв, OCH3), 34,97 (т, CH2CO), 20,27 (т, 3-CH2).
C24H24N2O4S2 173,38 (с, COOCH3), 137,25, 127,21, 125,80 (3хс, Ar), 124,30 (д, Ar), 122,79 (с, Ar), 120,10, 119,57, 111,21 (3хд, Ar), 51,56 (кв, OCH3), 34,97 (т, CH2CO), 20,27 (т, 3-CH2).
C24H24N2O4S2Рассчитано, %: C 61,5; H 5,2; N 6,0; S 13,7. Найдено, %: C 61,4; H 5,3; N 6,1; S 13,7. В результате кристаллизации остатка маточного раствора из смеси бензола и петролейного эфира получают сложный метиловый эфир 3-(2-тиоксо-3-индолинил)пропионовой кислоты [соединение формулы (Ia), где R1 и R3 означают водород, a R2 -(CH2)2COOMe] (соединение N 9); выход: 0,24 г, 25% теории; точка плавления (из смеси дихлорметана и петролейного эфира): 96-98oC. 1H ЯМР (CDCl3):  9,83 (1H, с, NH), 7,29 (2H, м, ArH), 7,16 (1H, тд, J= 7,5, 0,9 Гц, ArH), 6,99 (1H, д, J=7,8 Гц, ArH), 3,91 (1H, т, J=5,4 Гц, H-3), 3,60 (3H, с, OCH3), 2,52 (2H, м, 3-CH2), 2,42, 2,11 (2х1H, 2хм, CH2CO).
13C ЯМР (CDCl3): 9,83 (1H, с, NH), 7,29 (2H, м, ArH), 7,16 (1H, тд, J= 7,5, 0,9 Гц, ArH), 6,99 (1H, д, J=7,8 Гц, ArH), 3,91 (1H, т, J=5,4 Гц, H-3), 3,60 (3H, с, OCH3), 2,52 (2H, м, 3-CH2), 2,42, 2,11 (2х1H, 2хм, CH2CO).
13C ЯМР (CDCl3):  207,26 (с, CSNH), 173,37 (с, COOCH3), 143,24, 133,08 (2хс, Ar), 128,43, 124,35, 124,09, 110,01 (4хд, Ar), 56,45 (д, C-3), 51,68 (кв, OCH3), 29,33, 28,19 (2хт, 3-CH2CH2).
C12H13NO2S 207,26 (с, CSNH), 173,37 (с, COOCH3), 143,24, 133,08 (2хс, Ar), 128,43, 124,35, 124,09, 110,01 (4хд, Ar), 56,45 (д, C-3), 51,68 (кв, OCH3), 29,33, 28,19 (2хт, 3-CH2CH2).
C12H13NO2SРассчитано, %: C 61,3; H 5,6; N 6,0; S 13,6. Найдено, %: C 61,4; H 5,5; N 6,0; S 13,7. Путем вышеописанного гидролиза соединения N 9 смесью метанола и воды в присутствии карбоната калия и последующей хроматографии на силикагеле с использованием в качестве элюента смеси дихлорметана, простого изопропилового эфира и петролейного эфира получают 3-(2-тиоксо-3-индолинил)пропионовую кислоту [соединение формулы (Ia), где R1 и R3 означают водород, a R2 – (CH2)2COOH] (соединение N 7); выход: 25 мг, 22% теории; точка плавления: 170 – 173oC. 1H ЯМР (CD3COCD3):  11,48 (1H, с, NH), 7,43 (1H, д, J=7,4 Гц, ArH), 7,30 (1H, т, J= 7,7Гц, ArH), 7,15 (1H, т, J=7,4 Гц, ArH), 7,11 (1H, д, J= 7,8Гц, ArH), 3,90 (1H, т, J=5,3 Гц, H-3), 2,49 (1H, м, CH2CH2CO), 2,37 (2H, м, CH2CH2CO), 2,11 (1H, м, CH2CH2CO).
13C ЯМР (CD3COCD3): 11,48 (1H, с, NH), 7,43 (1H, д, J=7,4 Гц, ArH), 7,30 (1H, т, J= 7,7Гц, ArH), 7,15 (1H, т, J=7,4 Гц, ArH), 7,11 (1H, д, J= 7,8Гц, ArH), 3,90 (1H, т, J=5,3 Гц, H-3), 2,49 (1H, м, CH2CH2CO), 2,37 (2H, м, CH2CH2CO), 2,11 (1H, м, CH2CH2CO).
13C ЯМР (CD3COCD3):  208,48 (с, CSNH), 174,14 (с, COOH), 145,18, 134,55 (2хс, Ar), 129,05, 125,08, 124,30, 110,87 (4хд, Ar), 57,18 (д, C-3), 29,86, 29,25 (2хт, 208,48 (с, CSNH), 174,14 (с, COOH), 145,18, 134,55 (2хс, Ar), 129,05, 125,08, 124,30, 110,87 (4хд, Ar), 57,18 (д, C-3), 29,86, 29,25 (2хт, 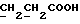 ).
C11H11NO2S ).
C11H11NO2SРассчитано, %: C 59,71; H 5,01; N 6,33. Найдено, %: C 59,49; H 4,97; N 6,15. Путем окисления воздухом соединения N 7 в метаноле при температуре 20oC в течение 12 дней и последующего растворения водой получают дисульфид бис[индолил-3-пропионовой кислоты-(2)] [соединение формулы (V), где R1 и R3 означают водород, a R2 – (CH2)2COOH] (соединение N 35); выход: 30 мг, 30% теории; точка плавления (из водного метанола): 118 – 120,5oC. 1H ЯМР (CD3OD): 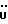 7,47 (1H, дт, J=8,0, 0,8 Гц, ArH), 7,30 (1H, дт, J= 8,1, 0,8 Гц, ArH), 7,15 (1H, ддд, J=8,1, 7,1, 1,0 Гц, ArH), 7,00 (1H, ддд, J=8,0, 7,1, 0,9 Гц, ArH), 2,74, 2,2 (2х2H, 2хт, J=8,0 Гц, 7,47 (1H, дт, J=8,0, 0,8 Гц, ArH), 7,30 (1H, дт, J= 8,1, 0,8 Гц, ArH), 7,15 (1H, ддд, J=8,1, 7,1, 1,0 Гц, ArH), 7,00 (1H, ддд, J=8,0, 7,1, 0,9 Гц, ArH), 2,74, 2,2 (2х2H, 2хт, J=8,0 Гц, 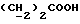 ).
13C ЯМР (CD3OD): ).
13C ЯМР (CD3OD): 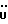 176,95 (с, COOH), 139,26, 128,26, 126,65 (3хс, Ar), 124,69 (д, Ar), 123,66 (с, Ar), 120,36, 120,20, 112,41 (3хд, Ar), 36,29, 21,22 (2хт, 176,95 (с, COOH), 139,26, 128,26, 126,65 (3хс, Ar), 124,69 (д, Ar), 123,66 (с, Ar), 120,36, 120,20, 112,41 (3хд, Ar), 36,29, 21,22 (2хт, 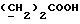 ).
C22H20N2O4S2 ).
C22H20N2O4S2 H2O H2OРассчитано, %: C 57,6; H 4,8; N 6,1; S 14,0. Найдено, %: C 57,6; H 5,0; N 6,1; S 13,9. Получение соединений NN 3 и 27. Путем взаимодействия 0,13 г сложного метилового эфира 2-(2-оксо-3-индолинил)уксусной кислоты [соединение формулы (III), где R1 и R3 означают водород, а R2– (CH2)3COOMe] с пентасульфидом фосфора получают сложный метиловый эфир 2-(2-тиоксо-3-индолинил)уксусной кислоты [соединение формулы (Ia), где R1 и R3 означают водород, a R2 -(CH2)3COOMe] (соединение N 3); выход: 50 мг, 36% теории; точка плавления (из метанола): 150 – 152oC. 1H ЯМР (CDCl3): 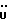 10,36 (1H, с, NH), 7,29 (1H, д, J=7,6 Гц, ArH), 7,27 (1H, т, J=7,8 Гц, ArH), 7,11 (1H, т, J=7,6 Гц, ArH), 7,00 (1H, д, J=7,8 Гц, ArH), 4,14 (1H, дд, J=8,4, 4,2 Гц, H-3), 3,72 (3H, с, COOCH3), 3,35 (1H, дд, J=17,0, 4,2 Гц, CH2CO), 2,88 (1H, дд, J=17,0, 8,5 Гц, CH2CO).
13C ЯМР (CDCl3): 10,36 (1H, с, NH), 7,29 (1H, д, J=7,6 Гц, ArH), 7,27 (1H, т, J=7,8 Гц, ArH), 7,11 (1H, т, J=7,6 Гц, ArH), 7,00 (1H, д, J=7,8 Гц, ArH), 4,14 (1H, дд, J=8,4, 4,2 Гц, H-3), 3,72 (3H, с, COOCH3), 3,35 (1H, дд, J=17,0, 4,2 Гц, CH2CO), 2,88 (1H, дд, J=17,0, 8,5 Гц, CH2CO).
13C ЯМР (CDCl3): 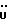 206,59 (с, CSNH), 171,53 (с, 206,59 (с, CSNH), 171,53 (с, 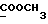 ), 143,10, 133,53 (2хс, ArH), 128,45, 124,20, 124,12, 110,07 (4хд, ArH), 53,53 (д, C3), 52,02 (кв, ), 143,10, 133,53 (2хс, ArH), 128,45, 124,20, 124,12, 110,07 (4хд, ArH), 53,53 (д, C3), 52,02 (кв, 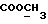 ), 37,94 (т, CH2).
C11H11NO2S ), 37,94 (т, CH2).
C11H11NO2SРассчитано, %: C 59,7; H 5,0; N 6,3; S 14,5. Найдено, %: C 59,9; H 5,3; N 6,4; S 14,4. Путем обработки воздухом раствора 0,10 г соединения N 3 в 30 мл смеси бензола и петролейного эфира в соотношении 1:1 в течение 2 дней получают дисульфид бис[метилиндолил-3-ацетата-(2)] [соединение формулы (IV), где R1 и R3 означают водород, a R2 – (CH2)3COOMe] (соединение N 27); количественный выход; точка плавления (из смеси бензола и петролейного эфира): 160 – 162oC. 1H ЯМР (CDCl3): 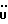 8,69 (1H, с, NH), 7,52 (1H, дд, J=8,2, 0,6 Гц, ArH), 7,21 (1H, ддд, J= 8,2, 6,6, 1,1 Гц, ArH), 7,12 (2H, м, ArH), 3,83 (2H, с, CH2CO), 3,71 (3H, с, COOCH3).
13C ЯМР (CDCl3): 8,69 (1H, с, NH), 7,52 (1H, дд, J=8,2, 0,6 Гц, ArH), 7,21 (1H, ддд, J= 8,2, 6,6, 1,1 Гц, ArH), 7,12 (2H, м, ArH), 3,83 (2H, с, CH2CO), 3,71 (3H, с, COOCH3).
13C ЯМР (CDCl3): 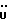 172,54 (с, 172,54 (с, 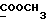 ), 137,20, 127,19, 127,03 (3хс, ArH), 124,26, 120,31, 119,45 (3хд, ArH), 116,23 (с, ArH), 111,41 (д, ArH), 52,25 (кв, OCH3), 30,51 (т, ), 137,20, 127,19, 127,03 (3хс, ArH), 124,26, 120,31, 119,45 (3хд, ArH), 116,23 (с, ArH), 111,41 (д, ArH), 52,25 (кв, OCH3), 30,51 (т, 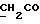 ).
C22H20N2O4S2 ).
C22H20N2O4S2Рассчитано, %: C 60,0; H 4,6; N 6,4; S 14,6. Найдено, %: C 60,0; H 4,8; N 6,3; S 14,4. Дополнительное количество соединения N 27 получают также из маточных растворов в реакции с пентасульфидом фосфора. Получение соединений NN 8, 11, 36 и 39. Раствор 0,44 г 18-краун-6, 2,20 г т-бутоксида калия и 3,24 г сложного метилового эфира 3-(3-индолил)пропионовой кислоты [соединение формулы (II), где R1 и R3 означают водород, a R2 – (CH2)2COOMe] в 20 мл сухого бензола перемешивают при температуре 20oC в течение 15 минут, затем охлаждают льдом. Добавляют раствор 3,42 г метилйодида в 10 мл бензола, после чего колбу плотно закрывают и полученную смесь размешивают при температуре 20oC в течение одного дня. Для удаления солей полученный раствор фильтруют, промывают дихлорметаном и объединенные фильтраты промывают водой, после чего удаляют растворители. В результате хроматографии на силикагеле с использованием в качестве элюента смеси дихлорметана и петролейного эфира в соотношении 1: 1 получают сложный метиловый эфир 3-(1-метил-3-индолил)пропионовой кислоты [соединение формулы (II), где R1 означает водород, R3 – метил, a R2 – (CH2)2COOMe] в качестве бесцветного масла; выход: 1,90 г, 52% теории; согласно Snyder H.R. и Eliel Е. L., J. Am. Chem. Soc., 1949 г., 71, стр. 663 – 669, точка кипения при 0,25 бар составляет 180 – 190oC. 1H ЯМР (CDCl3):  7,58 (1H, дт, J=7,7, 0,9 Гц, ArH), 7,28 (1H, дт, J= 7,9, 1,3 Гц, ArH), 7,21 (1H, ддд, J=8,1, 6,7, 1,3 Гц, ArH), 7,10 (1H, ддд, J= 7,9, 6,5, 1,5 Гц, ArH), 6,86 (1H, с, H-2), 3,73, 3,67 (2x3H, 2xc, NCH3, OCH3), 3,09, 2,70 (2x2H, 2хт, J=7,6 Гц, 3-CH2CH2).
C13H15NO2 7,58 (1H, дт, J=7,7, 0,9 Гц, ArH), 7,28 (1H, дт, J= 7,9, 1,3 Гц, ArH), 7,21 (1H, ддд, J=8,1, 6,7, 1,3 Гц, ArH), 7,10 (1H, ддд, J= 7,9, 6,5, 1,5 Гц, ArH), 6,86 (1H, с, H-2), 3,73, 3,67 (2x3H, 2xc, NCH3, OCH3), 3,09, 2,70 (2x2H, 2хт, J=7,6 Гц, 3-CH2CH2).
C13H15NO2Рассчитано: М+217,1103. Найдено: М+ 217,1101 (МС в результате электронной ионизации). Путем вышеописанного окисления 1,85 г сложного эфира [соединение формулы (II), где R1 означает водород, R3 – метил, a R2 – (CH2)2COOMe] с течение трех часов с использованием смеси диметилсульфоксида и соляной кислоты получают сырую 3-(1-метил-2-оксо-3-индолинил)пропионовую кислоту [соединение формулы (III), где R1 означает водород, R2 – метил, а R3 – (CH2)2COOH] в качестве бесцветного масла; выход: 2,08 г. 1H ЯМР (CD3OD):  7,31 (2H, м, ArH), 7,09 (1H, тд, J=8,0, 1,0 Гц, ArH), 6,98 (1H, д, J= 7,6 Гц, ArH), 3,56 (1H, т, J=6,1 Гц, H-3), 3,20 (3H, с, NCH3), 2,41 – 2,15 (4H, м, 3-CH2CH2).
13C ЯМР (CD3OD): 7,31 (2H, м, ArH), 7,09 (1H, тд, J=8,0, 1,0 Гц, ArH), 6,98 (1H, д, J= 7,6 Гц, ArH), 3,56 (1H, т, J=6,1 Гц, H-3), 3,20 (3H, с, NCH3), 2,41 – 2,15 (4H, м, 3-CH2CH2).
13C ЯМР (CD3OD):  179,64 (с, COOH), 176,55 (с, CONCH3), 145,52, 129,73 (2xc, Ar), 129,39, 125,00, 123,93, 109,64 (4хд, Ar), 45,79 (д, C-3), 31,01, 26,91 (2хт, 3-CH2CH2), 26,44 (кв, NCH3).
C12H13NO3 179,64 (с, COOH), 176,55 (с, CONCH3), 145,52, 129,73 (2xc, Ar), 129,39, 125,00, 123,93, 109,64 (4хд, Ar), 45,79 (д, C-3), 31,01, 26,91 (2хт, 3-CH2CH2), 26,44 (кв, NCH3).
C12H13NO3Рассчитано: M+ 219,0895. Найдено: M+ 219,0897 (МC в результате электронной ионизации). Полученное соединение вышеописанным образом подвергают этерификации с использованием диазометана, после чего продукт подвергают хроматографии на силикагеле с использованием в качестве элюента смеси этилацетата и петролейного эфира в соотношении 1: 2. Получают сложный метиловый эфир 3-(1-метил-2-оксо-3-индолинил)пропионовой кислоты [соединение формулы (III), где R1 означает водород, R2 – метил, a R3-(CH2)2COOMe] в качестве бесцветного масла; выход: 1,40 г, 70% теории. 1H ЯМР (CDCl3):  7,27 (2H, м, ArH), 7,06 (1H, тд, J=7,5, 0,8 Гц, ArH), 6,83 (1H, д, J=7,7 Гц, ArH), 3,62 (3H, с, OCH3), 3,50 (1H, т, J=6,0 Гц, H-3), 3,20 (3H, с, NCH3), 2,52 – 2,18 (4H, м, CH2CH2).
13C ЯМР (CDCl3): 7,27 (2H, м, ArH), 7,06 (1H, тд, J=7,5, 0,8 Гц, ArH), 6,83 (1H, д, J=7,7 Гц, ArH), 3,62 (3H, с, OCH3), 3,50 (1H, т, J=6,0 Гц, H-3), 3,20 (3H, с, NCH3), 2,52 – 2,18 (4H, м, CH2CH2).
13C ЯМР (CDCl3):  177,23 (с, CONCH3), 173,38 (с, COOCH3), 144,36 (с, Ar), 128,20 (д, Ar), 128,11 (с, Ar), 123,92, 122,48, 108,06 (3хд, Ar), 51,64 (кв, OCH3), 44,36 (д, C- 3), 30,12 (т-CH2OCO), 26,14 (кв, NCH3), 25,64 (т, 3-CH2.
C13H15NO3 177,23 (с, CONCH3), 173,38 (с, COOCH3), 144,36 (с, Ar), 128,20 (д, Ar), 128,11 (с, Ar), 123,92, 122,48, 108,06 (3хд, Ar), 51,64 (кв, OCH3), 44,36 (д, C- 3), 30,12 (т-CH2OCO), 26,14 (кв, NCH3), 25,64 (т, 3-CH2.
C13H15NO3Рассчитано: М+ 233,1052. Найдено: М+ 233,1055 (МС в результате электронной ионизации). Путем вышеописанной обработки 1,38 г данного сложного эфира [соединение формулы (III), где R1 означает водород, R2 – метил, a R3 – (CH2)2COOMe] пентасульфидом фосфора с последующей хроматографией на силикагеле с использованием в качестве элюента смеси дихлорметана и петролейного эфира в соотношении 3: 2 получают сложный метиловый эфир 3-(1-метил-2-тиоксо-3-индолинил)пропионовой кислоты [соединение формулы (Ia), где R1 означает водород, R3 – метил, a R2 – (CH2)2COOMe] (соединение N 11); выход: 1,40 г, 95% теории; точка плавления (из смеси бензола и петролейного эфира): 71 – 73oC. 1H ЯМР (CDCl3):  7,35 (2H, м, ArH), 7,19 (1H, тд, J=7,5, 0,9 Гц, ArH), 7,00 (1H, д, J= 7,7 Гц, ArH), 3,92 (1H, т, J=5,4, H-3), 3,63, 3,58 (2x3H, 2xc, NCH3, OCH3), 2,53 (2H, м, 3-CH2), 2,34, 2,03 (2х1H, 2хм, CH2CO).
13C ЯМР (CDCl3): 7,35 (2H, м, ArH), 7,19 (1H, тд, J=7,5, 0,9 Гц, ArH), 7,00 (1H, д, J= 7,7 Гц, ArH), 3,92 (1H, т, J=5,4, H-3), 3,63, 3,58 (2x3H, 2xc, NCH3, OCH3), 2,53 (2H, м, 3-CH2), 2,34, 2,03 (2х1H, 2хм, CH2CO).
13C ЯМР (CDCl3):  204,77 (с, CSNCH3), 173,32 (с, COOCH3), 145,89, 132, 37 (2xc, Ar), 128,40, 124,31, 123,99, 109,51 (4хд, Ar), 56,26 (д, C-3), 51,61 (кв, OCH3), 31,35 (кв, NCH3), 29,31, 28,46 (2хт, 3-CH2CH2).
C13H15NO2S 204,77 (с, CSNCH3), 173,32 (с, COOCH3), 145,89, 132, 37 (2xc, Ar), 128,40, 124,31, 123,99, 109,51 (4хд, Ar), 56,26 (д, C-3), 51,61 (кв, OCH3), 31,35 (кв, NCH3), 29,31, 28,46 (2хт, 3-CH2CH2).
C13H15NO2SРассчитано, %: C 62,6; H 6,1; N 5,6; S 12,9. Найдено, %: C 62,7; H 6,3; N 5,7; S 13,0. Путем окисления 0,70 г соединения N 11 в присутствии хлорида железа (III) в смеси этилацетата и дихлорметана с последующей хроматографией на силикагеле с использованием в качестве элюента дихлорметана получают 2,2′-дитиобис[3-(1-метил-3-индолил)-метилпропионат] [соединение формулы (IV), где R1 означает водород, R2 – метил, а R3 – (CH2)2COOMe] (соединение N 39); выход: 0,38 г, 54% теории; точка плавления (из смеси дихлорметана и метанола): 139 -141,5oC. 1H ЯМР (CDCl3):  7,49 (1H, д, J=8,0 Гц, ArH), 7,27 (1H, ддд, J=8,3, 6,1, 0,9 Гц, ArH), 7,25 (1H, д, J=8,1 Гц, ArH), 7,09 (1H, ддд, J=8,0, 6,1, 1,9 Гц, ArH), 3,59, 3,53 (2x3H, 2xc, NCH3, OCH3), 2,76, 2,21 (2х2H, 2хт, J= 7,8 Гц, 3-CH2CH2).
13C ЯМР (CDCl3): 7,49 (1H, д, J=8,0 Гц, ArH), 7,27 (1H, ддд, J=8,3, 6,1, 0,9 Гц, ArH), 7,25 (1H, д, J=8,1 Гц, ArH), 7,09 (1H, ддд, J=8,0, 6,1, 1,9 Гц, ArH), 3,59, 3,53 (2x3H, 2xc, NCH3, OCH3), 2,76, 2,21 (2х2H, 2хт, J= 7,8 Гц, 3-CH2CH2).
13C ЯМР (CDCl3):  173,17 (с, CCOCH3, 138,49, 127,00, 126,09 (3хс, Ar), 124,14 (д, Ar), 123,77 (с, Ar), 119,68, 119,65, 109,87 (3хд, Ar), 51,39 (кв, OCH3), 35,09 (т, CH2CO), 29,86 (кв, NCH3), 20,50 (т, 3-CH2.
C26H28N2O4S2 173,17 (с, CCOCH3, 138,49, 127,00, 126,09 (3хс, Ar), 124,14 (д, Ar), 123,77 (с, Ar), 119,68, 119,65, 109,87 (3хд, Ar), 51,39 (кв, OCH3), 35,09 (т, CH2CO), 29,86 (кв, NCH3), 20,50 (т, 3-CH2.
C26H28N2O4S2Рассчитано, %: C 62,9; H 5,7; N 5,7; S 12,9. Найдено, %: C 62,6; H 5,6; N 5,5; S 13,0. Раствор 0,53 г соединения N 11 в 10 мл этанола и 3 мл 2 н. водной гидроокиси натрия размешивают при температуре 20oC в течение 80 минут. Полученную смесь разбавляют добавлением 100 мл воды и экстрагируют 100 мл дихлорметана. Водную фракцию добавлением разбавленной соляной кислоты доводят до значения pH 2 и трижды экстрагируют этилацетатом, каждый раз используя 120 мл. Этилацетатные экстракты промывают 150 мл воды и растворитель удаляют при пониженном давлении с получением 0,48 г желтого масла, которое повторно растворяют в 7 мл метанола и 1 мл 2 н. водной гидроокиси натрия, и при температуре 20oC в течение 5 минут обрабатывают 150 мг борана натрия. После этого к смеси добавляют воду и перерабатывают описанным образом с получением 0,46 г коричневатого масла. В результате кристаллизации из смеси дихлорметана и петролейного эфира получают 3-(1-метил-2-тиоксо-3-индолинил)пропионовую кислоту [соединение, где R1 означает водород, R2 – метил, a R3 – (CH2)2COOH] (соединение N 8); выход: 0,32 г, 60% теории; точка плавления: 126 – 128,5oC. 1H ЯМР (CDCl3):  7,35 (2H, м, ArH), 7,18 (1H, тд, J=7,5, 0,9 Гц, ArH), 7,00 (1H, д, J= 7,8 Гц, ArH), 3,93 (1H, т, J=5,3 Гц, H-3), 3,63 (3H, с, NCH3), 2,51 (2H, м, 3-CH2), 2,38 (1H, ддд, J=16,1, 9,3, 6,7 Гц, CHCO), 2,06 (1H, ддд, J=16,0, 9,8, 6,1 Гц, CHCO).
13C ЯМР (CDCl3): 7,35 (2H, м, ArH), 7,18 (1H, тд, J=7,5, 0,9 Гц, ArH), 7,00 (1H, д, J= 7,8 Гц, ArH), 3,93 (1H, т, J=5,3 Гц, H-3), 3,63 (3H, с, NCH3), 2,51 (2H, м, 3-CH2), 2,38 (1H, ддд, J=16,1, 9,3, 6,7 Гц, CHCO), 2,06 (1H, ддд, J=16,0, 9,8, 6,1 Гц, CHCO).
13C ЯМР (CDCl3):  204,61 (с, CSNCH3), 178,41 (COOH), 145,88, 132,24 (2xc, Ar), 128,50, 124,38, 123,96, 109,57 (4хд, Ar), 56,05 (д, C-3), 31,37 (кв, NCH3), 29,16, 28,16 (2хт, 3-CH2CH2).
C12H13NO2S 204,61 (с, CSNCH3), 178,41 (COOH), 145,88, 132,24 (2xc, Ar), 128,50, 124,38, 123,96, 109,57 (4хд, Ar), 56,05 (д, C-3), 31,37 (кв, NCH3), 29,16, 28,16 (2хт, 3-CH2CH2).
C12H13NO2S 0,25H2O 0,25H2OРассчитано, %: C 60,1; H 5,6; N 5,8; S 13,4. Найдено, %: C 60,0; H 5,6; N 5,9; S 13,4. Путем гидролиза 0,37 г соединения N 39 в этаноле и 2 н. водной гидроокиси натрия при температуре 20oC в течение 3 часов и последующей переработки получают 0,30 г желтого масла. В результате кристаллизации из уксусной кислоты получают 2,2′- дитиобис[3-(1-метил-3-индолил)пропионовую кислоту] [соединение формулы (IV), где R1 означает водород, R3 – метил, a R2 – (CH2)2COOH] (соединение N 36); выход: 73 мг, 20% теории; точка плавления: 158,5 – 160oC. 1H ЯМР ((CD3)2CO): 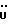 7,59 (1H, д, J=8,1 Гц, ArH), 7,39 (1H, д, J=8,0 Гц, ArH), 7,27 (1H, ддд, J=8,2, 7,1, 0,9 Гц, ArH), 7,07 (1H, ддд, J=8,1, 7,1, 0,8 Гц, ArH), 3,60 (3H, с, NCH3), 2,79, 2,31 (2х2H, 2хт, J=7,9 Гц, 3-CH2CH2).
13C ЯМР ((CD3)2CO): 7,59 (1H, д, J=8,1 Гц, ArH), 7,39 (1H, д, J=8,0 Гц, ArH), 7,27 (1H, ддд, J=8,2, 7,1, 0,9 Гц, ArH), 7,07 (1H, ддд, J=8,1, 7,1, 0,8 Гц, ArH), 3,60 (3H, с, NCH3), 2,79, 2,31 (2х2H, 2хт, J=7,9 Гц, 3-CH2CH2).
13C ЯМР ((CD3)2CO): 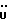 173,75 (с, COOH), 139,61, 127,54, 127,06 (3хс, Ar), 125,08 (д, Ar), 125,02 (с, ArH), 120,55, 120,53, 110,03 (3хд, Ar), 35,56 (т, CH2CO), 30,13 (кв, NCH3), 21,32 (т, 3-CH2).
C24H24N2O4S2 173,75 (с, COOH), 139,61, 127,54, 127,06 (3хс, Ar), 125,08 (д, Ar), 125,02 (с, ArH), 120,55, 120,53, 110,03 (3хд, Ar), 35,56 (т, CH2CO), 30,13 (кв, NCH3), 21,32 (т, 3-CH2).
C24H24N2O4S2Рассчитано, %: C 61,5; H 5,2; N 6,0; S 13,7. Найдено, %: C 61,5; H 5,2; N 6,1; S 13,6. Путем хроматографии маточных растворов на силикагеле с последующей обработкой бораном натрия вышеописанным образом и кристаллизацией получаемых продуктов из смеси дихлорметана и петролейного эфира также получают 3-(1-метил-2-тиоксо-3-индолинил)пропионовую кислоту (соединение N 8); выход: 0,12 г, 32% теории. Получение соединений NN 16, 18, 53 и 55. В результате N-алкилирования 2,14 г сложного метилового эфира 4-(3-индолил)бутановой кислоты [соединение формулы (II), где R1 и R3 означают водород, a R2 – (CH2)3COOMe] с использованием 0,26 г 18-краун-6, трет-бутоксида калия и метилйодида вышеописанным образом получают сложный метиловый эфир 4-(1-метил-3-индолил)бутановой кислоты [соединение формулы (II), где R1 означает водород, R2 – (CH2)3COOMe, R3-метил] в качестве коричневого масла, которое непосредственно используют для следующей реакции; выход: 0,92 г, 40% теории. 1H ЯМР (CDCl3): 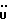 7,58 (1H, дт, J=7,9, 0,9 Гц, ArH), 7,28 (1H, д, J=8,2 Гц, ArH), 7,21 (1H, ддд, J=8,1, 7,0, 1,1 Гц, ArH), 7,09 (1H, ддд, J=8,0, 7,0, 1,0 Гц, ArH), 6,84 (1H, с, ArH), 3,74 (3H, с, NCH3), 3,66 (3H, с, COOCH3), 2,79, 2,38 (2х2H, 2хт, J=7,4 Гц, 7,58 (1H, дт, J=7,9, 0,9 Гц, ArH), 7,28 (1H, д, J=8,2 Гц, ArH), 7,21 (1H, ддд, J=8,1, 7,0, 1,1 Гц, ArH), 7,09 (1H, ддд, J=8,0, 7,0, 1,0 Гц, ArH), 6,84 (1H, с, ArH), 3,74 (3H, с, NCH3), 3,66 (3H, с, COOCH3), 2,79, 2,38 (2х2H, 2хт, J=7,4 Гц,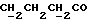 ), 2,03 (2H, квин, J=7,4 Гц, ), 2,03 (2H, квин, J=7,4 Гц, 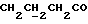 ).
13C ЯМР (CDCl3): ).
13C ЯМР (CDCl3):  174,21 (с, 174,21 (с, 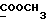 ), 137,08, 127,84 (2хс, ArH), 126,34, 121,50, 118,98, 118,62 (4хд, ArH), 114,07 (с, ArH), 109,13 (д, ArH), 51,44 (кв, ), 137,08, 127,84 (2хс, ArH), 126,34, 121,50, 118,98, 118,62 (4хд, ArH), 114,07 (с, ArH), 109,13 (д, ArH), 51,44 (кв, 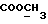 ), 33,68 (т, ), 33,68 (т, 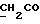 ), 32,55 (кв, NCH3), 25,58, 24,41 (2хт, 3-CH2CH2).
Найдено: М+ 231,1259 (МС в результате электронной ионизации).
4-(3-Индолил)бутановую кислоту (выход: 1,04 г, 52% теории) получают путем растворения отфильтрованных осадков с вышеописанной реакции в воде с последующим подкислением; точка плавления: 124 – 126oC.
Путем взаимодействия сложного эфира [соединение формулы (II), где R1 означает водород, R2 – (CH2)3COOMe, R3 – метил] со смесью диметилсульфоксида и соляной кислоты получают сырую 4-(1-метил-2- оксо-3-индолинил)бутановую кислоту [соединение формулы (III), где R1 означает водород, R2 – (CH2)3COOMe, R3 – метил] в качестве коричневого масла; выход: 0,84 г, 91% теории.
1H ЯМР (CDCl3): ), 32,55 (кв, NCH3), 25,58, 24,41 (2хт, 3-CH2CH2).
Найдено: М+ 231,1259 (МС в результате электронной ионизации).
4-(3-Индолил)бутановую кислоту (выход: 1,04 г, 52% теории) получают путем растворения отфильтрованных осадков с вышеописанной реакции в воде с последующим подкислением; точка плавления: 124 – 126oC.
Путем взаимодействия сложного эфира [соединение формулы (II), где R1 означает водород, R2 – (CH2)3COOMe, R3 – метил] со смесью диметилсульфоксида и соляной кислоты получают сырую 4-(1-метил-2- оксо-3-индолинил)бутановую кислоту [соединение формулы (III), где R1 означает водород, R2 – (CH2)3COOMe, R3 – метил] в качестве коричневого масла; выход: 0,84 г, 91% теории.
1H ЯМР (CDCl3):  7,28 (1H, тд, J=7,7, 0,9 Гц, ArH), 7,25 (1H, д, J=7,7 Гц, ArH), 7,06 (1H, тд, J=7,5, 0,9 Гц, ArH), 6,83 (1H, д, J=7,8 Гц, ArH), 3,47 (1H, т, J= 5,9 Гц, H-3), 3,21 (3H, с, NCH3), 2,37 (2H, т, J=7,4 Гц, CH2CO), 2,00, 1,69 (2х2H, 2хм, 3-CH2CH2).
К охлаждаемому льдом раствору 0,84 г получаемой на предыдущей стадии сырой оксокислоты [соединение формулы (III), где R1 означает водород, R3 – метил, a R2 – (CH2)3,COOMe] в 10 мл простого эфира при перемешивании каплями добавляют эфирный раствор 1,2 г диазометана (полученного из N-нитрозометилмочевины). По истечении 30 минут при температуре 20oC растворитель удаляют при пониженном давлении и остаток подвергают хроматографии на силикагеле с использованием в качестве элюента смеси этилацетата и петролейного эфира в соотношении 1: 2, в результате чего получают сложный метиловый эфир 4-(1-метил-2-оксо-3-индолинил)- бутановой кислоты [соединение формулы (III), где R1 означает водород, R3 – метил, a R2 – (CH2)3COOMe]; выход: 0,64 г, 72% теории; точка плавления (из смеси этилацетата и петролейного эфира): 69-71oC.
1H ЯМР (CDCl3): 7,28 (1H, тд, J=7,7, 0,9 Гц, ArH), 7,25 (1H, д, J=7,7 Гц, ArH), 7,06 (1H, тд, J=7,5, 0,9 Гц, ArH), 6,83 (1H, д, J=7,8 Гц, ArH), 3,47 (1H, т, J= 5,9 Гц, H-3), 3,21 (3H, с, NCH3), 2,37 (2H, т, J=7,4 Гц, CH2CO), 2,00, 1,69 (2х2H, 2хм, 3-CH2CH2).
К охлаждаемому льдом раствору 0,84 г получаемой на предыдущей стадии сырой оксокислоты [соединение формулы (III), где R1 означает водород, R3 – метил, a R2 – (CH2)3,COOMe] в 10 мл простого эфира при перемешивании каплями добавляют эфирный раствор 1,2 г диазометана (полученного из N-нитрозометилмочевины). По истечении 30 минут при температуре 20oC растворитель удаляют при пониженном давлении и остаток подвергают хроматографии на силикагеле с использованием в качестве элюента смеси этилацетата и петролейного эфира в соотношении 1: 2, в результате чего получают сложный метиловый эфир 4-(1-метил-2-оксо-3-индолинил)- бутановой кислоты [соединение формулы (III), где R1 означает водород, R3 – метил, a R2 – (CH2)3COOMe]; выход: 0,64 г, 72% теории; точка плавления (из смеси этилацетата и петролейного эфира): 69-71oC.
1H ЯМР (CDCl3):  7,28 (1H, т, J=7,8 Гц, ArH), 7,26 (1H, д, J=7,6 Гц, ArH), 7,05 (1H, тд, J=7,6, 0,7 Гц, ArH), 6,82 (1H, д, J=7,7 Гц, ArH), 3,64 (3H, с, COOCH3), 3,44 (1H, т, J=6,0 Гц, H-3), 3,20 (3H, с, NCH3), 2,33 (2H, т, J=7,5 Гц, CH2CO), 1,98, 1,68 (2х2H, 2хм, 3-CH2CH2).
13C ЯМР (CDCl3): 7,28 (1H, т, J=7,8 Гц, ArH), 7,26 (1H, д, J=7,6 Гц, ArH), 7,05 (1H, тд, J=7,6, 0,7 Гц, ArH), 6,82 (1H, д, J=7,7 Гц, ArH), 3,64 (3H, с, COOCH3), 3,44 (1H, т, J=6,0 Гц, H-3), 3,20 (3H, с, NCH3), 2,33 (2H, т, J=7,5 Гц, CH2CO), 1,98, 1,68 (2х2H, 2хм, 3-CH2CH2).
13C ЯМР (CDCl3):  177,52 (c, 177,52 (c, 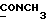 ), 173,59 (c, ), 173,59 (c, 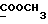 ), 144,38, 128,71 (2xc, ArH), 128,00, 123,84, 122,40, 108,02 (4хд, ArH), 51,54 (кв, ), 144,38, 128,71 (2xc, ArH), 128,00, 123,84, 122,40, 108,02 (4хд, ArH), 51,54 (кв, 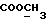 ), 45,26 (д, C-3), 33,89, 29,98 (2хт, ), 45,26 (д, C-3), 33,89, 29,98 (2хт, 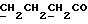 ), 26,15 (кв, NCH3), 21,30 (т, ), 26,15 (кв, NCH3), 21,30 (т, 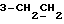 ).
C14H17О3 ).
C14H17О3Рассчитано, %: C 68,0; H 6,9; N 5,7. Найдено, %: C 67,9; H 6,7; N 5,7. 0,90 г полученного на предыдущей стадии сложного оксоэфира [соединение формулы (III), где R1 означает водород, R3 – метил, a R2 – (CH2)3COOMe] вышеописанным образом обрабатывают пентасульфидом фосфора с последующей переработкой и хроматографией на силикагеле с использованием в качестве элюента смеси дихлорметана и петролейного эфира в соотношении 3:2. Получают сложный метиловый эфир 4-(1-метил-2-тиоксо-3-индолил)бутановой кислоты [соединение формулы (Ia), где R1 означает водород, R3 – метил, a R2 – (CH2)3COOMe] (соединение N 18); выход: 1,07 г, 79% теории; точка плавления (из смеси бензола и петролейного эфира): 103 – 106oC. 1H ЯМР (CDCl3):  7,34 (2H, м, ArH), 7,19 (1H, тд, J=8,0, 0,9 Гц, ArH), 7,00 (дд, J=8,0,2,3).
C14H17NO2S 7,34 (2H, м, ArH), 7,19 (1H, тд, J=8,0, 0,9 Гц, ArH), 7,00 (дд, J=8,0,2,3).
C14H17NO2SРассчитано, %: C 63,9; H 6,5; N 5,3; S 12,2. Найдено, %: C 64,0; H 6,4; N 5,3; S 12,3. Раствор 0,47 г соединения N 18 в 7 мл этилацетата размешивают вместе с 0,43 г хлорида железа(III) при температуре 20oC в течение часа, затем перерабатывают и подвергают хроматографии на силикагеле с использованием в качестве элюента дихлорметана. Получают дисульфид бис[1-метилиндолил-3- метилбутаноата-(2)] [соединение формулы (IV), где R1 означает водород, R3 – метил, a R2 – (CH2)3COOMe] (соединение N 55); выход: 0,40 г, 85% теории; точка плавления (из смеси дихлорметана и метанола): 112 -113oC. 1H ЯМР (CDCl3):  7,52 (1H, д, J=8,0 Гц, ArH), 7,28 (1H, ддд, J=8,2, 6,0, 1,0 Гц, ArH), 7,25 (1H, д, J=8,0 Гц, ArH), 7,09 (1H, ддд, J=8,0, 6,0, 1,9 Гц, ArH), 3,59, 3,55 (2x3H, 2хс, NCH3, COOCH3), 2,42, 2,07 (2х2H, 2хт, J=7,4Гц, 7,52 (1H, д, J=8,0 Гц, ArH), 7,28 (1H, ддд, J=8,2, 6,0, 1,0 Гц, ArH), 7,25 (1H, д, J=8,0 Гц, ArH), 7,09 (1H, ддд, J=8,0, 6,0, 1,9 Гц, ArH), 3,59, 3,55 (2x3H, 2хс, NCH3, COOCH3), 2,42, 2,07 (2х2H, 2хт, J=7,4Гц, 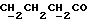 ), 1,68 (2H, квин, J=7,4 Гц, ), 1,68 (2H, квин, J=7,4 Гц, 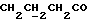 ).
13C ЯМР (CDCl3): ).
13C ЯМР (CDCl3):  173,82 (c, 173,82 (c, 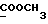 ), 138,47, 127,23, 126,43, 124,74 (4хс, ArH), 124,05, 119,90, 119,49, 109,72 (4хд, ArH), 51,35 (кв, ), 138,47, 127,23, 126,43, 124,74 (4хс, ArH), 124,05, 119,90, 119,49, 109,72 (4хд, ArH), 51,35 (кв, 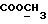 ), 33,40 (т, ), 33,40 (т, 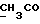 ), 29,82 (кв, NCH3), 25,83, 24,17 (2хт, 3-CH2CH2).
C28H32N2O4S2 ), 29,82 (кв, NCH3), 25,83, 24,17 (2хт, 3-CH2CH2).
C28H32N2O4S2Рассчитано, %: C 64,1; H 6,1; N 5,3; S 12,2. Найдено, %: C 63,9; H 6,4; N 5,3; S 12,1. Путем гидролиза соединения N 18 смесью воды и гидроокиси в среде этанола, последующей обработки бораном натрия и кристаллизации из смеси дихлорметана и петролейного эфира получают 4-(1-метил-2-тиоксо-3-индолил)бутановую кислоту [соединение формулы (Ia), где R1 означает водород, R3 – метил, a R2 – (CH2)3COOH] (соединение N 16); выход: 0,18 г, 44% теории; точка плавления: 144-146,5oC. 1H ЯМР (CDCl3):  7,34 (2H, м, ArH), 7,18 (1H, т, J=7,6 Гц, ArH), 7,00 (1H, д, J= 7,7Гц, ArH), 3,85 (1H, т, J=5,5 Гц, H-3), 3,63 (3H, с, NCH3), 2,34, 2,07 (2H, т, J=7,6 Гц, CH2CO), 2,28, 2,18, 1,59, 1,40 (4х1H, 4хм, 3-CH2CH2).
13C ЯМР (CDCl3): 7,34 (2H, м, ArH), 7,18 (1H, т, J=7,6 Гц, ArH), 7,00 (1H, д, J= 7,7Гц, ArH), 3,85 (1H, т, J=5,5 Гц, H-3), 3,63 (3H, с, NCH3), 2,34, 2,07 (2H, т, J=7,6 Гц, CH2CO), 2,28, 2,18, 1,59, 1,40 (4х1H, 4хм, 3-CH2CH2).
13C ЯМР (CDCl3):  205,31 (с, CSNCH3), 178,62 (с, COOH), 145,81, 133,06 (2хс, Ar), 128,20, 124,30, 123,86, 109,54 (4хд, Ar), 57,14 (д, C-3), 33,77, 33,01 (2хт, 3-CH2CH2CH2), 31,42 (кв, NCH3), 20,11 (т, 3-CH2CH2).
C13H15NO2OS 205,31 (с, CSNCH3), 178,62 (с, COOH), 145,81, 133,06 (2хс, Ar), 128,20, 124,30, 123,86, 109,54 (4хд, Ar), 57,14 (д, C-3), 33,77, 33,01 (2хт, 3-CH2CH2CH2), 31,42 (кв, NCH3), 20,11 (т, 3-CH2CH2).
C13H15NO2OS H2O H2OРассчитано, %: C 61,6; H 6,7; N 5,5; S 12,7. Найдено, %: C 61,9; H 6,3; N 5,6; S 12,8. После гидролиза 0,40 г соединения N 55 получают 0,37 г желтого масла, которое подвергают хроматографии на силикагеле с использованием в качестве элюента смеси этилацетата и петролейного эфира в соотношении 1:2, содержащей 1% уксусной кислоты, в результате чего получают 0,25 г масла. Путем последующей кристаллизации из ацетона получают 2,2′-дитиобис[4-(1-метил-3-индолил)бутановую кислоту] [соединение формулы (IV), где R1 означает водород, R3 – метил, а R2 – (CH2)3COOH] (соединение N 53); выход: 0,17 г, 42% теории; точка плавления: 106,5 – 109,5oC. 1H ЯМР (CDCl3):  7,51 (1H, д, J=8,0 Гц, ArH), 7,27 (2H, м, ArH), 7,08 (1H, ддд, J= 8,0, 6,0, 2,0 Гц, ArH), 3,55 (3H, с, NCH3), 2,44, 2,12 (2х2H, 2хт, J=7,4 Гц, 3-CH2CH2CH2CO), 1,68 (2H, квин, J=7,4 Гц, 3-CH2CH2CH2).
13C ЯМР (CDCl3): 7,51 (1H, д, J=8,0 Гц, ArH), 7,27 (2H, м, ArH), 7,08 (1H, ддд, J= 8,0, 6,0, 2,0 Гц, ArH), 3,55 (3H, с, NCH3), 2,44, 2,12 (2х2H, 2хт, J=7,4 Гц, 3-CH2CH2CH2CO), 1,68 (2H, квин, J=7,4 Гц, 3-CH2CH2CH2).
13C ЯМР (CDCl3):  179,32 (с, COOH), 138,49, 127,49, 126,43, 124,56 (4хс, Ar), 124,14, 119,86, 119,62, 109,79 (4хд, Ar), 33,37 (т, CH2CO), 29,86 (кв, NCH3), 25,59, 24,13 (2хт, 3-CH2CH2).
C26H28N2O4S2 179,32 (с, COOH), 138,49, 127,49, 126,43, 124,56 (4хс, Ar), 124,14, 119,86, 119,62, 109,79 (4хд, Ar), 33,37 (т, CH2CO), 29,86 (кв, NCH3), 25,59, 24,13 (2хт, 3-CH2CH2).
C26H28N2O4S2 2CH3COOH 2CH3COOHРассчитано, %: C 58,4; H 5,9; N 4,5; S 10,4. Найдено, %: C 58,4; H 5,9; N 4,5; S 10,6. Альтернативный способ получения соединения N 88. Путем обработки 1-метил-2-индолинтиона [соединение формулы (Ia), где R1 и R2 означают водород, R3 – метил] изоцианатом, полученным из 4-(карбометокси)фенилуксусной кислоты, получают 2,2′-дитиобис[1-метилиндолил-3-N-(4′- карбометокси)бензилкарбоксамид] (соединение N 88) [соединение формулы (IV), в которой R1 означает водород, R2 – CONHCH2Ph{4-COOMe}, R3 – метил]; выход: 38% теории; точка плавления 178 – 180oC. 1H ЯМР ((CD3)2SO):  8,18 (1H, шир, CONH), 7,88 (1H, д, J=8,1 Гц, H-4), 7,82 (2H, д, J=7,9 Гц, C-2′,6′), 7,55 (1H, д, J=8,3 Гц, H-7), 7,35 (1H, дд, J= 8,3, 7,7 Гц, H-6), 7,28 (2H, д, J=7,9 Гц, C-3′,5′), 7,20 (1H, дд, J=8,1, 7,7 Гц, H-5), 4,06 (2H, д, J=5,1 Гц, 8,18 (1H, шир, CONH), 7,88 (1H, д, J=8,1 Гц, H-4), 7,82 (2H, д, J=7,9 Гц, C-2′,6′), 7,55 (1H, д, J=8,3 Гц, H-7), 7,35 (1H, дд, J= 8,3, 7,7 Гц, H-6), 7,28 (2H, д, J=7,9 Гц, C-3′,5′), 7,20 (1H, дд, J=8,1, 7,7 Гц, H-5), 4,06 (2H, д, J=5,1 Гц, 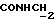 ), 3,83 (3H, с, COOCH3), 3,61 (3H, с, N-CH3).
13C ЯМР: ), 3,83 (3H, с, COOCH3), 3,61 (3H, с, N-CH3).
13C ЯМР:  165,98 165,98 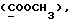 163,17 (CONH), 145,10 (с), 137,61 (с), 129,06 (д), 129,00 (с), 127,85 (с), 126,95 (д), 125,37 (с), 124,31 (д), 121,22 (д), 121,09 (д), 117,89 (с), 110,78 (д), 51,89 163,17 (CONH), 145,10 (с), 137,61 (с), 129,06 (д), 129,00 (с), 127,85 (с), 126,95 (д), 125,37 (с), 124,31 (д), 121,22 (д), 121,09 (д), 117,89 (с), 110,78 (д), 51,89 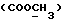 41,90 (CH2Ar), 29,94 (N-CH3).
C38H34N4O6S2 41,90 (CH2Ar), 29,94 (N-CH3).
C38H34N4O6S2 0,5H2O 0,5H2OРассчитано, %: C 63,8; H 4,9; N 7,8; S 8,9. Найдено, %: C 63,7; H 4,8; N 7,8; S 9,1. Альтернативный способ получения соединения N 93. Путем реакции 1-метил-2-индолинтиона [соединение формулы (Ia), где R1 и R2 означают водород, R3 – метил] с ацилазидом, полученным из 2-фуровой кислоты, получают 3-(2-фуроил)-1-метил-2-индолинтион [соединение формулы (Ia), где R1 означает водород, R2 – CO(2-фурил), R3 – метил]; выход: 85% теории; точка плавления: 113,5oC. 1H ЯМР ((CD3)2SO):  5,90 (1H, шир, SH), 8,28 (1H, д, J=1,6 Гц, H-5′), 7,97 (1H, д, J=8,0 Гц, H-4), 7,56 (1H, д, J=3,6 Гц, H-3′), 7,46 (1H, д, J= 8,0 Гц, H-7), 7,37 (1H, дд, J=8,0, 7,4 Гц, H-6), 7,21 (1H, дд, J=8,0, 7,4 Гц, H-5), 6,94 (1H, дд, J=3,6, 1,6 Гц, H-4′), 3,72 (3H, с, N-CH3).
13C ЯМР: 5,90 (1H, шир, SH), 8,28 (1H, д, J=1,6 Гц, H-5′), 7,97 (1H, д, J=8,0 Гц, H-4), 7,56 (1H, д, J=3,6 Гц, H-3′), 7,46 (1H, д, J= 8,0 Гц, H-7), 7,37 (1H, дд, J=8,0, 7,4 Гц, H-6), 7,21 (1H, дд, J=8,0, 7,4 Гц, H-5), 6,94 (1H, дд, J=3,6, 1,6 Гц, H-4′), 3,72 (3H, с, N-CH3).
13C ЯМР:  180,09 (CS), 160,65 (CO), 147,95 (д), 147,27 (с), 140,92 (с), 126,05 (д), 123,26 (с), 123,12 (д), 121,04 (д), 119,19 (д), 113,22 (д), 110,11 (д), 109,64 (с), 29,79 (N-CH3).
C14H11NO2S 180,09 (CS), 160,65 (CO), 147,95 (д), 147,27 (с), 140,92 (с), 126,05 (д), 123,26 (с), 123,12 (д), 121,04 (д), 119,19 (д), 113,22 (д), 110,11 (д), 109,64 (с), 29,79 (N-CH3).
C14H11NO2SРассчитано, %: C 65,3; H 4,4; N 5,7; S 12,7. Найдено, %: C 65,4; H 4,3; N 5,4; S 12,5. В результате реакции данного соединения с йодом получают 2,2′-дитиобис[3-(2-фуроил)-1-метилиндол] (соединение N 93) [соединение формулы (IV), где R1 означает водород, R2 – CO(2-фурил), R3 – метил]; выход: 85% теории; точка плавления: 175 – 176,5oC. 1H ЯМР (CDCl3):  7,47 (1H, д, J=8,1 Гц, H-4), 7,33 (1H, дд, J=1,6, 0,7 Гц, H-5′), 7,23 (1H, дд, J=8,1, 7,8 Гц, H-6), 7,21 (1H, д, J=8,1 Гц, H-7), 7,09 (1H, дд, J=8,1, 7,9 Гц, H-5), 6,63 (1H, дд, J=3,6, 0,7 Гц, H-3′), 6,23 (1H, дд, J=3,6, 1,6 Гц, H-4′), 3,73 (3H, с, N-CH3).
13C ЯМР: 7,47 (1H, д, J=8,1 Гц, H-4), 7,33 (1H, дд, J=1,6, 0,7 Гц, H-5′), 7,23 (1H, дд, J=8,1, 7,8 Гц, H-6), 7,21 (1H, д, J=8,1 Гц, H-7), 7,09 (1H, дд, J=8,1, 7,9 Гц, H-5), 6,63 (1H, дд, J=3,6, 0,7 Гц, H-3′), 6,23 (1H, дд, J=3,6, 1,6 Гц, H-4′), 3,73 (3H, с, N-CH3).
13C ЯМР:  177,09 (CO), 152,55 (с), 145,91 (д), 138,18, 131,32, 125,80 (3хс), 124,72 (д), 123,60 (с), 121,73, 121,12, 119,16, 111,91, 110,06 (5хд), 30,54 (NCH3).
C28H20N2O4S2 177,09 (CO), 152,55 (с), 145,91 (д), 138,18, 131,32, 125,80 (3хс), 124,72 (д), 123,60 (с), 121,73, 121,12, 119,16, 111,91, 110,06 (5хд), 30,54 (NCH3).
C28H20N2O4S2 0,5H2O 0,5H2OРассчитано, %: C 64,4; H 4,1; N 5,4; S 12,3. Найдено, %: C 64,7; H 4,1; N 5,6; S 12,4. Альтернативный способ получения соединения N 94. Путем обработки 1-метил-2-индолинтиона [соединение формулы (Ia), где R1 и R2 означают водород, R3 – метил)] изоцианатом, полученным из тиофен-2-карбоновой кислоты, получают 2,2′-дитиобис[N-(2-тиенил)-1-метилиндол-3-карбоксамид] (соединение N 94) [соединение формулы (IV), где R1 означает водород, R2– CONHфурил, R3 – метил]; выход: 21% теории; точка плавления: 183oC (разложение). 1H ЯМР ((CD3)2SO):  11,26 (1H, с, CONH), 7,93 (1H, д, J=8,0 Гц, H-4), 7,62 (1H, д, J=8,3 Гц, H-7), 7,34 (1H, дд, J=8,3, 7,4 Гц, H-6), 7,24 (1H, дд, J=8,0, 7,4 Гц, H-5), 7,05 (1H, дд, J=5,3, 3,6 Гц, H-4′), 6,94 (1H, д, J= 5,3 Гц, H-5′), 6,41 (1H, д, J=3,6 Гц, H-3′), 3,95 (3H, с, NCH3).
13C ЯМР: 11,26 (1H, с, CONH), 7,93 (1H, д, J=8,0 Гц, H-4), 7,62 (1H, д, J=8,3 Гц, H-7), 7,34 (1H, дд, J=8,3, 7,4 Гц, H-6), 7,24 (1H, дд, J=8,0, 7,4 Гц, H-5), 7,05 (1H, дд, J=5,3, 3,6 Гц, H-4′), 6,94 (1H, д, J= 5,3 Гц, H-5′), 6,41 (1H, д, J=3,6 Гц, H-3′), 3,95 (3H, с, NCH3).
13C ЯМР:  160,10 (CONH), 139,86 (с), 137,81 (с), 136,86 (с), 125,19 (с), 123,96 (д), 123,69 (д), 121,28 (д), 120,54 (д), 116,85 (д), 114,73 (с), 111,20 (д), 110,77 (д), 30,54 (N-CH3).
C28H22N4O2S4 160,10 (CONH), 139,86 (с), 137,81 (с), 136,86 (с), 125,19 (с), 123,96 (д), 123,69 (д), 121,28 (д), 120,54 (д), 116,85 (д), 114,73 (с), 111,20 (д), 110,77 (д), 30,54 (N-CH3).
C28H22N4O2S4 H2O H2OРассчитано, %: C 57,6; H 4,0; N 9,6. Найдено, %: C 57,6; H 4,1; N 10,0. Пример 2. Получение соединений согласно таблице 1 по способу, представленному на реакционной схеме 2. Получение соединений NN 1, 29, 30, 31. Раствор 0,50 мл очищенного хлорида серы(II) в 20 мл тетрагидрофурана каплями добавляют к размешиваемому, охлаждаемому льдом раствору 2,20 г 3-индолилуксусной кислоты [соединение формулы (II), где R1 и R3 означают водород, a R2 – CH2COOH] в 30 мл сухого тетрагидрофурана. По истечении 30 минут при температуре 20oC растворитель удаляют и остаток кристаллизуют из водной уксусной кислоты с получением 1,00 г желтого твердого вещества. Последний повторно выкристаллизовывают из водного метанола с последующей дальнейшей кристаллизацией из смеси этилацетата и бензола, в результате чего получают трисульфид бис[индолил-3-уксусной кислоты-(2)] [соединение формулы (V), где R1 и R3 означают водород, R2 – CH2COOH, n = 3] (соединение N 30) в качестве желтого порошка; выход: 80 мг, 3% теории; точка плавления: 199 – 202oC. 1H ЯМР (CD3COCD3):  10,18 (1H, с, NH), 7,59 (1H, м, ArH), 7,06 (2H, м, ArH), 6,82 (1H, м, ArH), 3,99 (2H, с, CH2CO).
13C ЯМР (CD3COCD3): 10,18 (1H, с, NH), 7,59 (1H, м, ArH), 7,06 (2H, м, ArH), 6,82 (1H, м, ArH), 3,99 (2H, с, CH2CO).
13C ЯМР (CD3COCD3):  173,30 (с, COOH), 138,82, 128,26, 127,03 (3хс, ArH), 124,76, 120,60, 120,33 (3хд, ArH), 116,97 (с, ArH), 112,16 (д, ArH), 30,89 (т, 173,30 (с, COOH), 138,82, 128,26, 127,03 (3хс, ArH), 124,76, 120,60, 120,33 (3хд, ArH), 116,97 (с, ArH), 112,16 (д, ArH), 30,89 (т, 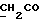 ).
C20H16N2O4S3 ).
C20H16N2O4S3Рассчитано, %: C 54,1; H 3,6; N 6,3; S 21,6. Найдено, %: C 54,1; H 3,8; N 6,0; S 21,2. Путем перегонки маточных растворов вышеописанной кристаллизации из водного метанола и повторной кристаллизации из дихлорметана получают дисульфид бис[индолил-3-уксусной кислоты-(2)] [соединение формулы (V), где R1 и R3 означают водород, R2 – CH2COOH, n = 2] (соединение N 29) в качестве желтого твердого вещества; выход: 0,19 г, 7% теории; точка плавления: 196 – 199oC. 1H ЯМР (CD3COCD3):  10,62 (1H, с, NH), 7,58 (1H, дд, J=8,1, 0,6 Гц, ArH), 7,42 (1H, дт, J=8,2, 0,8 Гц, ArH), 7,23 (1H, ддд, J=8,2, 7,1, 0,9 Гц, ArH), 7,09 (1H, ддд, J=8,0, 7,1, 0,9 Гц, ArH), 3,55 (2H, с, CH2CO).
13C ЯМР (CD3COCD3): 10,62 (1H, с, NH), 7,58 (1H, дд, J=8,1, 0,6 Гц, ArH), 7,42 (1H, дт, J=8,2, 0,8 Гц, ArH), 7,23 (1H, ддд, J=8,2, 7,1, 0,9 Гц, ArH), 7,09 (1H, ддд, J=8,0, 7,1, 0,9 Гц, ArH), 3,55 (2H, с, CH2CO).
13C ЯМР (CD3COCD3):  172,67 (с, COOH), 138,78, 128,33, 127,86 (3хс, ArH), 124,79, 120,72, 120,56 (3хд, ArH), 117,78 (с, ArH), 112,41 (д, ArH), 30,67 (т, 172,67 (с, COOH), 138,78, 128,33, 127,86 (3хс, ArH), 124,79, 120,72, 120,56 (3хд, ArH), 117,78 (с, ArH), 112,41 (д, ArH), 30,67 (т, 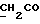 ).
C20H16N2O4S2 ).
C20H16N2O4S2Рассчитано, %: C 58,2; H 3,9; N 6,8; S 15,5. Найдено, %: C 57,6; H 4,4; N 6,6; S 15,3. В результате метилизации сырого соединения N 30 вышеописанным методом с использованием диазометана и последующей хроматографии на силикагеле получают трисульфид бис[метилиндолил-3-ацетата-(2)] [соединение формулы (V), где R1 и R3 означают водород, R2 – CH2COOMe, n = 3] (соединение N 31); выход: 0,16 г, 47% теории; точка плавления (из смеси дихлорметана и петролейного эфира): 130 – 132oC. 1H ЯМР (CDCl3): 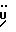 8,76 (1H, с, NH), 7,40 (1H, д, J=8,0 Гц, ArH), 6,99 (1H, ддд, J=8,0, 7,1, 0,9 Гц, ArH), 6,88 (1H, ддд, J=8,2, 7,1, 0,9 Гц, ArH), 6,41 (1H, д, J=8,2 Гц, ArH), 3,93 (2H, с, CH2CO), 3,78 (3H, с, COOCH3).
13C ЯМР (CDCl3): 8,76 (1H, с, NH), 7,40 (1H, д, J=8,0 Гц, ArH), 6,99 (1H, ддд, J=8,0, 7,1, 0,9 Гц, ArH), 6,88 (1H, ддд, J=8,2, 7,1, 0,9 Гц, ArH), 6,41 (1H, д, J=8,2 Гц, ArH), 3,93 (2H, с, CH2CO), 3,78 (3H, с, COOCH3).
13C ЯМР (CDCl3): 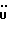 172,93 (с, 172,93 (с, 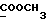 ), 137,66, 127,02, 125,80 (3хс, ArH), 124,29, 120,06, 118,46 (3хд, ArH), 114,61 (с, ArH), 111,15 (д, ArH), 52,40 (кв, ), 137,66, 127,02, 125,80 (3хс, ArH), 124,29, 120,06, 118,46 (3хд, ArH), 114,61 (с, ArH), 111,15 (д, ArH), 52,40 (кв, 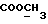 ), 30,30 (т, ), 30,30 (т, 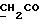 ).
C22H20N2O4S3 ).
C22H20N2O4S3Рассчитано, %: C 55,9; H 4,2; N 5,9; S 20,3. Найдено, %: C 55,6; H 4,4; N 5,8; S 19,9. Путем восстановления соединения N 29 с использованием борана натрия в присутствии карбоната калия и метанола получают 2-(2- тиоксо-3-индолинил)уксусную кислоту [соединение формулы (Ia), где R1 и R3 означают водород, а R2 – CH2COOH] (соединение N 1); выход: 58 мг, 34% теории; точка плавления (из смеси этилацетата и петролейного эфира): 166 – 168oC. 1H ЯМР ((CD3)2CO): 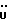 11,51 (1H, с, NH), 7,39 (1H, д, J=7,9Гц, ArH), 7,29 (1H, тд, J= 7,7, 0,8 Гц, ArH), 7,11 (2H, м, ArH), 4,02 (1H, дд, J=3,9, 8,4 Гц, H-3), 3,36 (1H, дд, J=17,2, 3,9 Гц, 3-CH), 2,83 (1H, дд, J=17,2, 8,4 Гц, 3-CH).
Получение соединений NN 4 и 28.
1,18 г сложного метилового эфира 2-(1-метил-3-индолил)уксусной кислоты [соединение формулы (II), где R1 означает водород, R2 – CH2COOMe, a R3 – метил] вышеописанным методом обрабатывают 0,25 мл хлорида серы(II) и получаемый продукт подвергают хроматографии на силикагеле с использованием в качестве первого элюента смеси дихлорметана и петролейного эфира в соотношении 2: 1, а второго элюента – дихлорметана, в результате чего получают желтое масло, из которого путем кристаллизации из смеси этилацетата и петролейного эфира получают 2,2′-монотиобис[2-(1-метил-3-индолил)метилацетат] [соединение формулы (V), где R1, означает водород, R2 – CH2COOMe, R3 – метил, n = 1]; выход: 0,17 г, 13% теории; точка плавления: 155 – 156oC.
1H ЯМР (CDCl3): 11,51 (1H, с, NH), 7,39 (1H, д, J=7,9Гц, ArH), 7,29 (1H, тд, J= 7,7, 0,8 Гц, ArH), 7,11 (2H, м, ArH), 4,02 (1H, дд, J=3,9, 8,4 Гц, H-3), 3,36 (1H, дд, J=17,2, 3,9 Гц, 3-CH), 2,83 (1H, дд, J=17,2, 8,4 Гц, 3-CH).
Получение соединений NN 4 и 28.
1,18 г сложного метилового эфира 2-(1-метил-3-индолил)уксусной кислоты [соединение формулы (II), где R1 означает водород, R2 – CH2COOMe, a R3 – метил] вышеописанным методом обрабатывают 0,25 мл хлорида серы(II) и получаемый продукт подвергают хроматографии на силикагеле с использованием в качестве первого элюента смеси дихлорметана и петролейного эфира в соотношении 2: 1, а второго элюента – дихлорметана, в результате чего получают желтое масло, из которого путем кристаллизации из смеси этилацетата и петролейного эфира получают 2,2′-монотиобис[2-(1-метил-3-индолил)метилацетат] [соединение формулы (V), где R1, означает водород, R2 – CH2COOMe, R3 – метил, n = 1]; выход: 0,17 г, 13% теории; точка плавления: 155 – 156oC.
1H ЯМР (CDCl3):  7,54 (1H, д, J=8,0 Гц, ArH), 7,22 (2H, м, ArH), 7,11 (1H, ддд, J=8,0, 4,9, 3,0 Гц, ArH), 3,96 (2H, с, 3-CH2), 3,61 (3H, с, OCH3), 3,48 (3H, с, NCH3).
13C ЯМР (CDCl3): 7,54 (1H, д, J=8,0 Гц, ArH), 7,22 (2H, м, ArH), 7,11 (1H, ддд, J=8,0, 4,9, 3,0 Гц, ArH), 3,96 (2H, с, 3-CH2), 3,61 (3H, с, OCH3), 3,48 (3H, с, NCH3).
13C ЯМР (CDCl3):  171,54 (с, COOCH3), 137,80, 126,80, 126,24 (3хс, Ar), 123,03, 119,92, 118,96 (3хд, Ar), 112,95 (с, Ar), 109,37 (д, Ar), 51,85 (кв, OCH3), 31,04 (т, 3-CH2), 30,38 (кв, NCH3).
C24H24N2O4S 171,54 (с, COOCH3), 137,80, 126,80, 126,24 (3хс, Ar), 123,03, 119,92, 118,96 (3хд, Ar), 112,95 (с, Ar), 109,37 (д, Ar), 51,85 (кв, OCH3), 31,04 (т, 3-CH2), 30,38 (кв, NCH3).
C24H24N2O4SРассчитано, %: C 66,1; H 5,5; N 6,4; S 7,3. Найдено, %: C 65,9; H 5,6; N 6,4; S 7,4. Путем дальнейшей кристаллизации фракций маточного раствора из смеси бензола и петролейного эфира получают 0,16 г (13% теории) 2,2′-дитиобис[2-(1-метил-3-индолил)метилацетата] [соединение формулы (V), где R1 означает водород, R2 – CH2COOMe, R3 – метил, n = 2] (соединение N 28); точка плавления: 130 – 132,5oC. 1H ЯМР (CDCl3):  7,51 (1H, дт, J=8,0, 0,8 Гц, ArH), 7,29 (2H, м, ArH), 7,12 (1H, ддд, J=8,0, 6,0, 2,0 Гц, ArH), 3,57 (3H, с, OCH3), 3,48 (3H, с, NCH3), 3,33 (2H, с, 3-CH2).
13C ЯМР (CDCl3): 7,51 (1H, дт, J=8,0, 0,8 Гц, ArH), 7,29 (2H, м, ArH), 7,12 (1H, ддд, J=8,0, 6,0, 2,0 Гц, ArH), 3,57 (3H, с, OCH3), 3,48 (3H, с, NCH3), 3,33 (2H, с, 3-CH2).
13C ЯМР (CDCl3):  171,44 (с, COOCH3), 138,42, 128,13, 126,38 (3хс, Ar), 124,37, 120,13, 120,08 (3хд, Ar), 117,48 (с, Ar), 109,94 (д, Ar), 51,79 (кв, OCH3), 30,57 (кв, NCH3), 29,96 (т, 3-CH2).
C24H24N2O4S2 171,44 (с, COOCH3), 138,42, 128,13, 126,38 (3хс, Ar), 124,37, 120,13, 120,08 (3хд, Ar), 117,48 (с, Ar), 109,94 (д, Ar), 51,79 (кв, OCH3), 30,57 (кв, NCH3), 29,96 (т, 3-CH2).
C24H24N2O4S2Рассчитано, %: C 61,5; H 5,1; N 6,0; S 13,7. Найдено, %: C 61,4; H 5,2; N 6,0; S 13,8. Остальной маточный раствор последовательно обрабатывают бораном натрия и хлоридом железа(III) с получением еще 0,36 г (26% теории) соединения N 28. Путем восстановления соединения N 28 бораном натрия получают сложный метиловый эфир 2-(1-метил-2-тиоксо-3-индолинил)уксусной кислоты [соединение формулы (Ia), где R1 означает водород, R2 – CH2COOMe, R3 – метил] (соединение N 4); выход: 61% теории; точка плавления (из смеси бензола и петролейного эфира): 68 – 70oC. 1H ЯМР (CDCl3): 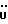 7,34 (2H, м ArH), 7,16 (1H, тд, J=7,5, 0,9 Гц, ArH), 7,01 (1H, д, J=7,8 Гц, ArH), 4,15 (1H, дд, J=8,7, 4,1 Гц, H-3), 3,71 (3H, с, OCH3), 3,65 (3H, с, NCH3), 3,40 (1H, дд, J=17,0, 4,1 Гц, 3-CH), 2,83 (1H, дд, J=17,0, 8,7 Гц, 3-CH).
13C ЯМР (CDCl3): 7,34 (2H, м ArH), 7,16 (1H, тд, J=7,5, 0,9 Гц, ArH), 7,01 (1H, д, J=7,8 Гц, ArH), 4,15 (1H, дд, J=8,7, 4,1 Гц, H-3), 3,71 (3H, с, OCH3), 3,65 (3H, с, NCH3), 3,40 (1H, дд, J=17,0, 4,1 Гц, 3-CH), 2,83 (1H, дд, J=17,0, 8,7 Гц, 3-CH).
13C ЯМР (CDCl3): 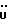 204,24 (с, CSNCH3), 171,68 (с, COOCH3), 145,74, 132,95 (2xc, Ar), 128,47, 124,40, 123,96, 109,54 (4хд, Ar), 53,41 (д, C-3), 51,96 (кв, OCH3), 38,46 (т, 3-CH2), 31,57 (кв, NCH3).
C12H13NO2S 204,24 (с, CSNCH3), 171,68 (с, COOCH3), 145,74, 132,95 (2xc, Ar), 128,47, 124,40, 123,96, 109,54 (4хд, Ar), 53,41 (д, C-3), 51,96 (кв, OCH3), 38,46 (т, 3-CH2), 31,57 (кв, NCH3).
C12H13NO2SРассчитано, %: C 61,3; H 5,6; N 6,0; S 13,6. Найдено, %: C 61,5; H 5,8; N 6,2; S 13,9. Получение соединений NN 2 и 32. Путем обработки 1-метил-3-индолилуксусной кислоты [соединение формулы (II), где R1 означает водород, R2 – CH2COOH, R3 – метил] хлоридом серы(II) с последующей хроматографией на силикагеле получают дисульфид бис[1-метилиндолил-3-уксусной кислоты-(2)] [соединение формулы (V), где R1 и R3 означают водород, R2 – CH2COOH, n = 2] (соединение N 32); выход: 0,10 г, 8% теории; точка плавления (из смеси ацетона и петролейного эфира): 190 – 192,5oC. 1H ЯМР (CD3COCD3):  7,56 (1H, дт, J=8,1, 0,9 Гц, ArH), 7,44 (1H, д, J= 8,3 Гц, ArH), 7,31 (1H, ддд, J=8,2, 7,0, 1,2 Гц, ArH), 7,11 (1H, ддд, J=8,0, 7,0, 0,9 Гц, ArH), 3,65 (3H, с, NCH3), 3,23 (2H, с, CH2CO).
13C ЯМР (CD3COCD3): 7,56 (1H, дт, J=8,1, 0,9 Гц, ArH), 7,44 (1H, д, J= 8,3 Гц, ArH), 7,31 (1H, ддд, J=8,2, 7,0, 1,2 Гц, ArH), 7,11 (1H, ддд, J=8,0, 7,0, 0,9 Гц, ArH), 3,65 (3H, с, NCH3), 3,23 (2H, с, CH2CO).
13C ЯМР (CD3COCD3):  172,21 (с, COOH), 139,52, 128,56, 127,45 (3хс, ArH), 125,21, 120,91, 120,74 (3хд, ArH), 119,38 (с, ArH), 111,04 (д, ArH), 30,81 (т, 172,21 (с, COOH), 139,52, 128,56, 127,45 (3хс, ArH), 125,21, 120,91, 120,74 (3хд, ArH), 119,38 (с, ArH), 111,04 (д, ArH), 30,81 (т, 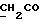 ), 30,31 (кв, NCH3).
C22H20N2O2S2 ), 30,31 (кв, NCH3).
C22H20N2O2S2Рассчитано, % 5: C 60,0; H 4,6; N 6,4; S 14,5. Найдено, %: C 59,4; H 4,9; N 6,4; S 15,0. Путем восстановления соединения N 32 бораном натрия в присутствии карбоната калия в среде метанола получают 2-(1-метил- 2-тиоксо-3-индолинил)уксусную кислоту [соединение формулы (Ia), где R1 означает водород, R2 – CH2COOH, R3 – метил] (соединение N 2); выход: 62 мг, 60% теории; точка плавления (из смеси дихлорметана и петролейного эфира): 150 – 153oC. 1H ЯМР (CDCl3):  7,37 (2H, м, ArH), 7,18 (1H, т, J=7,5 Гц, ArH), 7,02 (1H, д, J= 7,8 Гц, ArH), 4,14 (1H, д, J=8,6, 3,9 Гц, H-3), 3,65 (3H, с, NCH3), 3,48 (1H, дд, J=17,5, 4,0 Гц, 3-CH), 2,86 (1H, дд, J=17,5, 8,7 Гц, 3-CH).
13C ЯМР (CDCl3): 7,37 (2H, м, ArH), 7,18 (1H, т, J=7,5 Гц, ArH), 7,02 (1H, д, J= 7,8 Гц, ArH), 4,14 (1H, д, J=8,6, 3,9 Гц, H-3), 3,65 (3H, с, NCH3), 3,48 (1H, дд, J=17,5, 4,0 Гц, 3-CH), 2,86 (1H, дд, J=17,5, 8,7 Гц, 3-CH).
13C ЯМР (CDCl3):  203,88 (с, CSNCH3), 176,31 (с, COOH), 145,67, 132,64 (2хс, Ar), 128,57, 124,52, 124,00, 109,59 (4хд, Ar), 53,07 (д, C-3), 38,33 (т, 3-CH2, 31,59 (кв, NCH3).
Получение соединений NN 6 и 34.
1,48 г N-бензил-3-индолилацетамида [соединение формулы (II), где R1 и R3 означают водород, R2 – CH2CONHCH2Ph, при этом Ph означает фенил] вышеописанным методом обрабатывают хлоридом серы(II) и полученную смесь при температуре 20oC в течение 30 минут обрабатывают примерно 0,7 г борана натрия в 10 мл этанола, после чего разбавляют 100 мл воды, подкисляют разбавленной соляной кислотой и экстрагируют дважды в дихлорметане, каждый раз используя 100 мл, и раз в 100 мл этилацетата. Объединенные экстракты упаривают и часть получаемого продукта выкристаллизовывают из смеси этилацетата и петролейного эфира с получением сложного N-бензилового эфира (2-тиоксо-3-индолинил)ацетамида [соединение формулы (Ia), где R1 и R3 означают водород, R2 – CH2CONHCH2Ph] (соединение N 6); выход: 0,12 г, 7% теории; точка плавления: 193 – 195oC.
1H ЯМР (CD3SOCD3): 203,88 (с, CSNCH3), 176,31 (с, COOH), 145,67, 132,64 (2хс, Ar), 128,57, 124,52, 124,00, 109,59 (4хд, Ar), 53,07 (д, C-3), 38,33 (т, 3-CH2, 31,59 (кв, NCH3).
Получение соединений NN 6 и 34.
1,48 г N-бензил-3-индолилацетамида [соединение формулы (II), где R1 и R3 означают водород, R2 – CH2CONHCH2Ph, при этом Ph означает фенил] вышеописанным методом обрабатывают хлоридом серы(II) и полученную смесь при температуре 20oC в течение 30 минут обрабатывают примерно 0,7 г борана натрия в 10 мл этанола, после чего разбавляют 100 мл воды, подкисляют разбавленной соляной кислотой и экстрагируют дважды в дихлорметане, каждый раз используя 100 мл, и раз в 100 мл этилацетата. Объединенные экстракты упаривают и часть получаемого продукта выкристаллизовывают из смеси этилацетата и петролейного эфира с получением сложного N-бензилового эфира (2-тиоксо-3-индолинил)ацетамида [соединение формулы (Ia), где R1 и R3 означают водород, R2 – CH2CONHCH2Ph] (соединение N 6); выход: 0,12 г, 7% теории; точка плавления: 193 – 195oC.
1H ЯМР (CD3SOCD3):  2,64 (1H, с, NH), 8,50 (1H, т, J=5,9 Гц, 2,64 (1H, с, NH), 8,50 (1H, т, J=5,9 Гц,  ), 7,32 (2H, т, J=7,3 Гц, ArH), 7,25 (3H, м, ArH), 7,11 (1H, д, J=7,3 Гц, ArH), 7,00 (1H, т, J=8,0 Гц, ArH), 6,53 (1H, м, ArH), 4,34, 4,28 (2х1H, 2хдд, J= 15,3, 5,9 Гц, ), 7,32 (2H, т, J=7,3 Гц, ArH), 7,25 (3H, м, ArH), 7,11 (1H, д, J=7,3 Гц, ArH), 7,00 (1H, т, J=8,0 Гц, ArH), 6,53 (1H, м, ArH), 4,34, 4,28 (2х1H, 2хдд, J= 15,3, 5,9 Гц,  ), 4,04 (1H, дд, J=9,5, 4,2 Гц, H-3), 3,10 (1H, дд, J= 15,3, 4,2 Гц, CH2CO), 2,47 (1H, дд, J=15,3, 9,5 Гц, CH2CO).
13C ЯМР (CD3SOCD3): ), 4,04 (1H, дд, J=9,5, 4,2 Гц, H-3), 3,10 (1H, дд, J= 15,3, 4,2 Гц, CH2CO), 2,47 (1H, дд, J=15,3, 9,5 Гц, CH2CO).
13C ЯМР (CD3SOCD3):  206,62 (с, CSNH), 169,41 (с, CONH), 143,97, 139,24, 134,36 (3хс, ArH), 128,22 (2хд, ArH), 127,95 (д, ArH), 127,36 (2хд, ArH), 126,77, 123,91, 123,09, 110,10 (4хд, ArH), 53,94 (д, C-3), 42,27 (т, NHCH2), 39,19 (т, 206,62 (с, CSNH), 169,41 (с, CONH), 143,97, 139,24, 134,36 (3хс, ArH), 128,22 (2хд, ArH), 127,95 (д, ArH), 127,36 (2хд, ArH), 126,77, 123,91, 123,09, 110,10 (4хд, ArH), 53,94 (д, C-3), 42,27 (т, NHCH2), 39,19 (т, 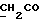 ).
C17H10N2OS ).
C17H10N2OSРассчитано, %: C 68,9; H 5,4; N 9,5; S 10,8. Найдено, %: C 68,8; H 5,8; N 9,5; S 10,7. Остаток, содержащей целевой продукт реакционной смеси (1,60 г), вышеописанным методом обрабатывают хлоридом железа(III) с последующей хроматографией на силикагеле с получением 1,40 г желтого масла. Путем кристаллизации сперва из смеси этилацетата и петролейного эфира, а затем из этилацетата получают 2,2′-дитиобис[N-бензил-2-(3- индолил)ацетамид] [соединение формулы (V), где R1 и R3 означают водород, R2 – CH2CONHCH2Ph] (соединение N 34); выход: 0,36 г, 22% теории; точка плавления: 200,5 – 203,5oC. 1H ЯМР ((CD3)2SO):  11,57 (1H, с, CSNH), 8,45 (1H, т, J=5,9 Гц, NHCH2, 7,53 (1H, д, J=8,0 Гц, ArH), 7,30 (1H, д, J=8,2Гц, ArH), 7,29-7,14 (6H, м, ArH), 7,01 (1H, т, J=7,5 Гц, ArH), 4194 (2H, д, J=5,9 Гц, NHCH2), 3,44 (2H, с, 3-CH2).
13C ЯМР ((CD3)2SO): 11,57 (1H, с, CSNH), 8,45 (1H, т, J=5,9 Гц, NHCH2, 7,53 (1H, д, J=8,0 Гц, ArH), 7,30 (1H, д, J=8,2Гц, ArH), 7,29-7,14 (6H, м, ArH), 7,01 (1H, т, J=7,5 Гц, ArH), 4194 (2H, д, J=5,9 Гц, NHCH2), 3,44 (2H, с, 3-CH2).
13C ЯМР ((CD3)2SO):  170,08 (9с, CONH), 139,36, 137,42 (2хс, Ar), 128,12, 127,13 (4хд, Ar), 127,12, 126,82 (2хс, Ar), 126,63, 123,41, 119,67, 119,09 (4хд, Ar), 116,83 (с, Ar), 111,43 (д, Ar), 42,25 (т, NHCH2), 31,73 (т, 3-CH2).
C34H30N4O2S2 170,08 (9с, CONH), 139,36, 137,42 (2хс, Ar), 128,12, 127,13 (4хд, Ar), 127,12, 126,82 (2хс, Ar), 126,63, 123,41, 119,67, 119,09 (4хд, Ar), 116,83 (с, Ar), 111,43 (д, Ar), 42,25 (т, NHCH2), 31,73 (т, 3-CH2).
C34H30N4O2S2Рассчитано, %: C 62,6; H 6,1; N 5,6; S 12,9. Найдено, %: C 62,7; H 6,3; N 5,7; S 13,0. Получение соединений NN 13 и 46. Путем этерификации 1,50 г 3-(3-индолил)пропионовой кислоты [соединение формулы (II), где R1 и R3 означают водород, R2 – (CH2)2COOH] диазометаном получают сложный метиловый эфир 3-(3-индолил)пропионовой кислоты [соединение формулы (II), где R1 и R2 означают водород, R3 – (CH2)2COOMe] в качестве коричневатого масла; выход: 1,62 г, 100%. Продукт при температуре 140oC в течение 4 часов перемешивают с 5 мл бензиламина и в результате переработки и хроматографии на силикагеле получают сложный N-бензиловый эфир 3-(3-индолил)пропанамида [соединение формулы (II), где R1 и R2 означают водород, R2 – (CH2)CONHCH2Ph]; выход: 1,81 г, 88% теории; точка плавления (из смеси этилацетата и петролейного эфира): 125 – 126,5oC. 1H ЯМР (CDCl3):  8,05 (1H, с, NH), 7,59 (1H, д, J=7,8 Гц, ArH), 7,34 (1H, д, J= 7,9 Гц, ArH), 7,24 (3H, м, ArH), 7,18 (1H, дд, J=7,9, 7,2 Гц, ArH), 7,10 (1H, дд, J=7,9, 7,2 Гц, ArH), 7,07 (2H, м, ArH), 6,93 (1H, д, J= 1,9 Гц, H-2), 5,64 (1H, т, J=5,7 Гц, NHCH2), 4,35 (2H, д, J=5,7 Гц, 2 H, NHCH2), 3,13, 2,59 (2х2H, 2хт, J=7,3 Гц, 3-CH2CH2).
13C ЯМР (CDCl3): 8,05 (1H, с, NH), 7,59 (1H, д, J=7,8 Гц, ArH), 7,34 (1H, д, J= 7,9 Гц, ArH), 7,24 (3H, м, ArH), 7,18 (1H, дд, J=7,9, 7,2 Гц, ArH), 7,10 (1H, дд, J=7,9, 7,2 Гц, ArH), 7,07 (2H, м, ArH), 6,93 (1H, д, J= 1,9 Гц, H-2), 5,64 (1H, т, J=5,7 Гц, NHCH2), 4,35 (2H, д, J=5,7 Гц, 2 H, NHCH2), 3,13, 2,59 (2х2H, 2хт, J=7,3 Гц, 3-CH2CH2).
13C ЯМР (CDCl3):  172,54 (с, CONH), 138,20, 136,35 (2хс, Ar), 128,58, 127,66 (4хд, Ar), 127,35 (д, Ar), 127,08 (с, Ar), 122,04, 121,88, 119,35, 118,68 (4хд, Ar), 113,79 (с, Ar), 111,21 (д, Ar), 43,51 (т, NHCH2), 37,42 (т, CH2CO), 21,38 (т, 3-CH2).
C18H18N2O 172,54 (с, CONH), 138,20, 136,35 (2хс, Ar), 128,58, 127,66 (4хд, Ar), 127,35 (д, Ar), 127,08 (с, Ar), 122,04, 121,88, 119,35, 118,68 (4хд, Ar), 113,79 (с, Ar), 111,21 (д, Ar), 43,51 (т, NHCH2), 37,42 (т, CH2CO), 21,38 (т, 3-CH2).
C18H18N2OРассчитано, %: C 77,7; H 6,6; N 10,1. Найдено, %: C 77,4; H 6,5; N 10,3. 1,74 г полученного на предыдущей стадии амида [соединение формулы (II), где R1 и R2 означают водород, R3 – (CH2)2CONHCH2Ph] обрабатывают дихлоридом серы(II) и полученную реакционную смесь последовательно обрабатывают бораном натрия и хлоридом железа(III) с последующей хроматографией на силикагеле с использованием в качестве элюента смеси этилацетата и петролейного эфира в соотношении 2: 1. Получают 2,2′-монотиобис[N-бензил-3-(3-индолил)пропанамид] [соединение формулы (V), где R1 и R2 означают водород, R3 – (CH2)2CONHCH2Ph, n = 1]; выход: 0,10 г, 6% теории; точка плавления (из смеси дихлорметана и петролейного эфира): 218 – 219oC. 1H ЯМР ((CD3)2SO):  11,01 (1H, с, CSNH), 8,38 (1H, т, J=5,7 Гц, NHCH2), 7,56 (1H, д, J=7,9 Гц, ArH), 7,26-7,03 (7H, 2хм, ArH), 6,97 (1H, т, J=7,5 Гц, ArH), 4,26 (2H, д, J=5,5 Гц, NHCH2), 3,22, 2,55 (2х2H, 2хт, J=7,6 Гц, 3-CH2CH2).
C36H34N4O2S 11,01 (1H, с, CSNH), 8,38 (1H, т, J=5,7 Гц, NHCH2), 7,56 (1H, д, J=7,9 Гц, ArH), 7,26-7,03 (7H, 2хм, ArH), 6,97 (1H, т, J=7,5 Гц, ArH), 4,26 (2H, д, J=5,5 Гц, NHCH2), 3,22, 2,55 (2х2H, 2хт, J=7,6 Гц, 3-CH2CH2).
C36H34N4O2S H2O H2OРассчитано, %: C 72,6; H 5,9; N 9,4, S 5,4. Найдено, %: C 72,7; H 5,9; N 9,6; S 5,7. Путем дальнейшей хроматографии с использованием в качестве элюента смеси этилацетата и петролейного эфира в соотношении 1:1 получают 1,10 г желтого масла, из которого путем выкристаллизации из смеси бензола, дихлорметана и петролейного эфира получают 2,2′-дитиобис[N-бензил-3-(3-индолил)пропанамида] [соединение формулы (V), где R1 и R2 означают водород, R3 – (CH2)2CONHCH2Ph, n = 2] (соединение N 46); выход: 0,73 г, 38% теории; точка плавления (из смеси дихлорметана и петролейного эфира): 141 – 144oC. 1H ЯМР (CDCl3):  8,47 (1H, с, CSNH), 7,51 (1H, д, J=7,9 Гц, ArH), 7,27-7,20 (4H, м, ArH), 7,13 (1H, ддд, J=8,2, 7,1, 1,1 Гц, ArH), 7,00 (3H, м, ArH), 5,01 (1H, т, J=5,7 Гц, NHCH2), 4,16 (2H, д, т, J=5,7 Гц, NHCH2), 2,88, 1,87 (2х2H, 2хт, J=7,7Гц, 3- CH2CH2).
13C ЯМР (CDCl3): 8,47 (1H, с, CSNH), 7,51 (1H, д, J=7,9 Гц, ArH), 7,27-7,20 (4H, м, ArH), 7,13 (1H, ддд, J=8,2, 7,1, 1,1 Гц, ArH), 7,00 (3H, м, ArH), 5,01 (1H, т, J=5,7 Гц, NHCH2), 4,16 (2H, д, т, J=5,7 Гц, NHCH2), 2,88, 1,87 (2х2H, 2хт, J=7,7Гц, 3- CH2CH2).
13C ЯМР (CDCl3):  171,93 (с, CONH), 138,30, 137,27 (2xc, Ar), 128,51, 127,78 (4хд, Ar), 127,30 (д, Ar), 127,07, 125,66 (2xc, Ar), 124,43 (д, Ar), 123,93 (с, Ar), 120,18, 119,94, 111,23, (3хд, Ar), 43,39 (т, NHCH2), 37,09 (т, CH2CO), 20,56 (т, 3-CH2).
C36H34N4O2S2 171,93 (с, CONH), 138,30, 137,27 (2xc, Ar), 128,51, 127,78 (4хд, Ar), 127,30 (д, Ar), 127,07, 125,66 (2xc, Ar), 124,43 (д, Ar), 123,93 (с, Ar), 120,18, 119,94, 111,23, (3хд, Ar), 43,39 (т, NHCH2), 37,09 (т, CH2CO), 20,56 (т, 3-CH2).
C36H34N4O2S2Рассчитано, %: C 69,9; H 5,5; N 9,1; S 10,3. Найдено, %: C 69,7; H 5,6; N 9,1; S 10,5. В результате восстановления соединения N 46 бораном натрия получают сложный N-бензиловый эфир 3-(2-тиоксо-3-индолинил)пропанамида [соединение формулы (Ia), где R1 и R3 означают водород, R2 – (CH2)2CONHCH2Ph] (соединение N 13); количественный выход; точка плавления (из дихлорметана): 149,5 – 151oC. 1H ЯМР ((CD3)2CO):  11,46 (1H, с, CSNH), 7,45 (1H, т, J=6,0 Гц, NHCH2), 7,42 (1H, д, J=7,9 Гц, ArH), 7,32-7,16 (6H, м, ArH), 7,13 (1H, тд, J=7,5, 0,9 Гц, ArH), 7,09 (1H, д, J=7,8 Гц, ArH), 4,37, 4,33 (2х1H, 2хдд, J=15,0, 6,0 Гц, NHCH2), 3,87 (1H, т, J=5,4 Гц, H-3), 2,56, 2,34, 2,04, (4H, 3хм, 3-CH2CH2).
13C ЯМР ((CD3)2CO): 11,46 (1H, с, CSNH), 7,45 (1H, т, J=6,0 Гц, NHCH2), 7,42 (1H, д, J=7,9 Гц, ArH), 7,32-7,16 (6H, м, ArH), 7,13 (1H, тд, J=7,5, 0,9 Гц, ArH), 7,09 (1H, д, J=7,8 Гц, ArH), 4,37, 4,33 (2х1H, 2хдд, J=15,0, 6,0 Гц, NHCH2), 3,87 (1H, т, J=5,4 Гц, H-3), 2,56, 2,34, 2,04, (4H, 3хм, 3-CH2CH2).
13C ЯМР ((CD3)2CO):  208,79 (с, CSNH), 172,23 (с, CONH), 145,20, 140,69, 134,88 (3xc, Ar), 129,14 (д, 2е, Ar), 128,93 (д, Ar), 128,33 (д, 2е, Ar), 127,62, 125,27, 124,22, 110,78 (4хд, Ar), 57,57 (д, C-3), 43,46 (т, NHCH2, 31,87, 30,09 (2хт, 3-CH2CH2).
C18H18N2OS 208,79 (с, CSNH), 172,23 (с, CONH), 145,20, 140,69, 134,88 (3xc, Ar), 129,14 (д, 2е, Ar), 128,93 (д, Ar), 128,33 (д, 2е, Ar), 127,62, 125,27, 124,22, 110,78 (4хд, Ar), 57,57 (д, C-3), 43,46 (т, NHCH2, 31,87, 30,09 (2хт, 3-CH2CH2).
C18H18N2OSРассчитано, %: C 67,7; H 6,0; N 8,8; S 10,0. Найдено, %: C 67,3; H 5,9; N 8,9; S 10,5. Получение соединения N 56. 1,10 г 3-(3-индолил)бутановой кислоты [соединение формулы (II), где R1 и R3 означают водород, R2 – (CH2)3COOH] подвергают этерификации с использованием избытка эфирного диазометана, причем получают сложный метиловый эфир 4-(3-индолил)бутановой кислоты [соединение формулы (II), где R1 и R3 означают водород, R2 – (CH2)3COOMe]; выход: 1,17 г, 100% теории; точка плавления: 73 – 75oC. Размешивают вместе с 5 мл бензиламина при температуре 150oC в течение 4 часов, затем подвергают хроматографии на силикагеле с использованием в качестве элюента смеси этилацетата и дихлорметана в соотношении 1: 4, в результате чего получают сложный N-бензиловый эфир 4-(3-индолил)бутанамида [соединение формулы (II), где R1 и R3 означают водород, R2 – (CH2)3CONHCH2Ph] ; выход: 1,43 г, 90% теории; точка плавления (из смеси дихлорметана и петролейного эфира): 123-124oC. 1H ЯМР (CDCl3):  8,05 (1H, шир с, NH), 7,58 (1H, д, J=7,9 Гц, ArH), 7,37-7,23 (6H, м, ArH), 7,18 (1H, ддд, J=8,1, 7,1, 1,0 Гц, ArH), 7,10 (1H, ддд, J=8,0, 7,0, 0,9 Гц, ArH), 6,95 (1H, д, J=1,7 Гц, H-2), 5,68 (1H, шир т, J= 5,7 Гц, 8,05 (1H, шир с, NH), 7,58 (1H, д, J=7,9 Гц, ArH), 7,37-7,23 (6H, м, ArH), 7,18 (1H, ддд, J=8,1, 7,1, 1,0 Гц, ArH), 7,10 (1H, ддд, J=8,0, 7,0, 0,9 Гц, ArH), 6,95 (1H, д, J=1,7 Гц, H-2), 5,68 (1H, шир т, J= 5,7 Гц,  ), 4,42 (1H, д, J=5,7 Гц, ), 4,42 (1H, д, J=5,7 Гц,  ), 2,82 (2H, т, J=7,3 Гц, 3-CH2), 2,27 (2H, т, J=7,5 Гц, CH2CO), 2,09 (2H, пентет, J=7,3 Гц, ), 2,82 (2H, т, J=7,3 Гц, 3-CH2), 2,27 (2H, т, J=7,5 Гц, CH2CO), 2,09 (2H, пентет, J=7,3 Гц, 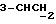 ).
13C ЯМР (CDCl3): ).
13C ЯМР (CDCl3): 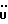 172,79 (с, CONH), 138,35, 136,33 (2xc, Ar), 128,69, 127,84 (2д, 2х2C, Ar), 127,49 (д, Ar), 127,46 (с, Ar), 121,91, 121,50, 119,83, 118,3 (4хд, Ar), 115,57 (c, Ar), 111,10 (д, Ar), 43,58 (т, NCH2), 36,15 (т, 172,79 (с, CONH), 138,35, 136,33 (2xc, Ar), 128,69, 127,84 (2д, 2х2C, Ar), 127,49 (д, Ar), 127,46 (с, Ar), 121,91, 121,50, 119,83, 118,3 (4хд, Ar), 115,57 (c, Ar), 111,10 (д, Ar), 43,58 (т, NCH2), 36,15 (т, 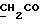 ), 26,06, 24,48 (2хт, 3-CH2CH2).
C19H20N2O ), 26,06, 24,48 (2хт, 3-CH2CH2).
C19H20N2OРассчитано, %: C 78,1; H 6,9; N 9,6. Найдено, %: C 77,8; H 6,8; N 9,7. 1,38 г полученного на предыдущей стадии амида обрабатывают дихлоридом серы(II) и полученную в результате переработки реакционную смесь обрабатывают бораном натрия. Полученное масло подвергают окислению при температуре 20oC в течение 20 минут с использованием 0,50 мл 35%-ной перекиси водорода в 10 мл метанола. Разбавляют водой, экстрагируют в дихлорметане и отгоняют, в результате чего получают масло, которое подвергают хроматографии на силикагеле с использованием в качестве элюента смеси этилацетата и петролейного эфира в соотношении 3:5. Получают 2,2′-тиобис[N-бензил-4-(3-индолил)бутанамид] [соединение формулы (V), где R1 и R3 означают водород, R2 – (CH2)3CONHCH2Ph, n = 1] ; выход: 0,14 г, 10% теории; точка плавления (из смеси дихлорметана и петролейного эфира): 105,5 – 108oC (разложение). 1H ЯМР (CDCl3):  10,25 (1H, с, NH), 7,49 (1H, д, J=8,0 Гц, ArH), 7,35-7,25 (6H, м, ArH), 7,11 (1H, ддд, J=8,2, 7,0, 1,2 Гц, ArH), 7,01 (1H, ддд, J=7,9, 7,0, 0,9 Гц, ArH), 5,75 (1H, т, J=5,6 Гц, 10,25 (1H, с, NH), 7,49 (1H, д, J=8,0 Гц, ArH), 7,35-7,25 (6H, м, ArH), 7,11 (1H, ддд, J=8,2, 7,0, 1,2 Гц, ArH), 7,01 (1H, ддд, J=7,9, 7,0, 0,9 Гц, ArH), 5,75 (1H, т, J=5,6 Гц,  ), 4,38 (2H, д, J= 5,7 Гц, ), 4,38 (2H, д, J= 5,7 Гц,  ), 3,07 (2H, т, J=7,8 Гц, 3-CH2), 2,38 (2H, т, J=6,3 Гц, CH2CO), 2,13, (2H,м, ), 3,07 (2H, т, J=7,8 Гц, 3-CH2), 2,38 (2H, т, J=6,3 Гц, CH2CO), 2,13, (2H,м, 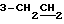 ).
13C ЯМР (CDCl3): ).
13C ЯМР (CDCl3):  173,49 (с, CONH), 138,12, 136,97 (2хс, Ar), 128,73, 127,93 (2хд, 2x2C, Ar), 127,56 (д, Ar), 127,48, 124,00 (2хс, Ar), 122,53 (д, Ar), 119,79 (с, Ar), 119,07, 118,60, 111,52 (3хд, Ar), 43,79 (т, NCH2), 35,66 (т, CH2CO), 25,77, 24,38 (2хт, 3-CH2CH2).
C38H38N4O2S 173,49 (с, CONH), 138,12, 136,97 (2хс, Ar), 128,73, 127,93 (2хд, 2x2C, Ar), 127,56 (д, Ar), 127,48, 124,00 (2хс, Ar), 122,53 (д, Ar), 119,79 (с, Ar), 119,07, 118,60, 111,52 (3хд, Ar), 43,79 (т, NCH2), 35,66 (т, CH2CO), 25,77, 24,38 (2хт, 3-CH2CH2).
C38H38N4O2SРассчитано, %: C 74,3; H 6,2; N 9,1; S 5,2; Найдено, %: C 74,2; H 6,1; N 9,1; S 5,0. Путем элюации смесью этилацетата и петролейного эфира в соотношении 1:1 получают 2,2′-дитиобис[N-бензил-4-(3-индолил)бутанамид] [соединение формулы (V), где R1 и R3 означают водород, R2 – (CH2)3CONHCH2Ph, n = 2] (соединение N 56); выход: 0,55 г, 36% теории; точка плавления (из смеси дихлорметана и бензола): 98,5 – 101oC (разложение). 1H ЯМР ((CD3)2CO):  10,48 (1H, с, NH), 7,58 (1H, д, J=8,0 Гц, ArH), 7,38 (1H, д, J=8,2 Гц, ArH), 7,37 (1H, м, 10,48 (1H, с, NH), 7,58 (1H, д, J=8,0 Гц, ArH), 7,38 (1H, д, J=8,2 Гц, ArH), 7,37 (1H, м,  ), 7,30-7,15 (6H, м, ArH), 7,03 (1H, ддд, J= 7,9, 7,3, 0,7 Гц, ArH), 4,30 (2H, д, J=6,0 Гц, ), 7,30-7,15 (6H, м, ArH), 7,03 (1H, ддд, J= 7,9, 7,3, 0,7 Гц, ArH), 4,30 (2H, д, J=6,0 Гц,  ), 2,67 (2H, т, J= 7,6 Гц, 3-CH2, 2,09 (2H, т, J=7,5 Гц, CH2CO), 1,84 (2H, пентет, J=7,5 Гц, ), 2,67 (2H, т, J= 7,6 Гц, 3-CH2, 2,09 (2H, т, J=7,5 Гц, CH2CO), 1,84 (2H, пентет, J=7,5 Гц, 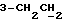 ).
13C ЯМР ((CD3)2CO): ).
13C ЯМР ((CD3)2CO):  172,93 (с, CONH), 140,80, 138,83 (2хс, Ar), 129,12 (д, 2C, Ar), 128,46 (с, Ar), 128,35 (д, 2C, Ar), 127,58 (д, Ar), 126,71, 124,54 (2xc, Ar), 124,46, 120,60, 120,13, 112,36 (4хд, Ar), 43,43 (т, NCH2), 36,34 (т, 172,93 (с, CONH), 140,80, 138,83 (2хс, Ar), 129,12 (д, 2C, Ar), 128,46 (с, Ar), 128,35 (д, 2C, Ar), 127,58 (д, Ar), 126,71, 124,54 (2xc, Ar), 124,46, 120,60, 120,13, 112,36 (4хд, Ar), 43,43 (т, NCH2), 36,34 (т, 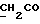 ), 27,75, 24,95 (2хт, 3-CH2CH2).
C38H38N4O2S2 ), 27,75, 24,95 (2хт, 3-CH2CH2).
C38H38N4O2S2Рассчитано, %: C 70,6; H 5,9; N 8,7; S 9,9. Найдено, %: C 70,4; H 6,0; N 8,8; S 9,8. Получение соединений NN 14 и 47. 1,28 мл 98%-ного сложного диэтилового эфира пироугольной кислоты при температуре 0oC добавляют к размешиваемому раствору 1,30 г 3-(3-индолил)пропионовой кислоты [соединение формулы (II), где R1 и R3 означают водород, R2 – (CH2)2COOH] и 1,15 мл триэтиламина в 15 мл тетрагидрофурана. По истечении 5 минут раствор насыщают газовым аммиаком, после чего смесь размешивают при температуре 20oC в течение 16 часов. Резко охлаждают добавлением воды и экстрагируют этилацетатом. В результате упаривания получают твердое вещество, которое очищают путем хроматографии на силикагеле с использованием в качестве элюента этилацетата с получением 3-(3-индолил)пропанамида [соединение формулы (II), где R1 и R3 означают водород, R2 – (CH2)2CONH2]; выход: 1,09 г, 84% теории; точка плавления (из смеси метанола и воды): 134 -136oC. 1H ЯМР ((CD3)2CO):  9,95 (1H, с, NH), 7,58 (1H, дт, J=8,2, 0,7 Гц, ArH), 7,36 (1H, дт, J=8,1, 0,8 Гц, ArH), 7,13 (1H, м, H-2), 7,08 (1H, ддд, J= 8,1, 7,0, 1,1 Гц, ArH), 7,00 (1H, ддд, J=8,0, 7,0, 1,0 Гц, ArH), 6,75, 6,12 (2хH, 2х шир с, CONH2), 3,04 (2H, м, 3-CH2), 2,05 (2H, м, 9,95 (1H, с, NH), 7,58 (1H, дт, J=8,2, 0,7 Гц, ArH), 7,36 (1H, дт, J=8,1, 0,8 Гц, ArH), 7,13 (1H, м, H-2), 7,08 (1H, ддд, J= 8,1, 7,0, 1,1 Гц, ArH), 7,00 (1H, ддд, J=8,0, 7,0, 1,0 Гц, ArH), 6,75, 6,12 (2хH, 2х шир с, CONH2), 3,04 (2H, м, 3-CH2), 2,05 (2H, м, 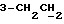 ).
13C ЯМР: ).
13C ЯМР:  174,87 (с, CONH2), 137,75, 128,44 (2xc, Ar), 122,80, 122,02 (2хд, Ar), 119,30 (2хд, Ar), 115,67 (с, Ar), 112,08 (д, Ar), 37,05 (т, 174,87 (с, CONH2), 137,75, 128,44 (2xc, Ar), 122,80, 122,02 (2хд, Ar), 119,30 (2хд, Ar), 115,67 (с, Ar), 112,08 (д, Ar), 37,05 (т, 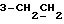 ), 21,87 (т, 3-CH2).
1,03 г полученного на предыдущей стадии амида обрабатывают хлоридом серы(П), затем получаемую в результате переработки реакционную смесь последовательно обрабатывают бораном натрия и перекисью водорода. Получаемое масло подвергают хроматографии на силикагеле с использованием в качестве элюента смеси этилацетата и петролейного эфира в соотношении 3:1 с получением 2,2′-тиобис[3-(3-индолил)пропанамида] [соединение формулы (V), в которой R1 и R3 означают водород, R2 – (CH2)2CONH2, n = 1]; выход: 0,16 г, 14% теории; точка плавления (из смеси этилацетата и петролейного эфира): 196,5 – 197,5oC.
1H ЯМР ((CD3)2SO): ), 21,87 (т, 3-CH2).
1,03 г полученного на предыдущей стадии амида обрабатывают хлоридом серы(П), затем получаемую в результате переработки реакционную смесь последовательно обрабатывают бораном натрия и перекисью водорода. Получаемое масло подвергают хроматографии на силикагеле с использованием в качестве элюента смеси этилацетата и петролейного эфира в соотношении 3:1 с получением 2,2′-тиобис[3-(3-индолил)пропанамида] [соединение формулы (V), в которой R1 и R3 означают водород, R2 – (CH2)2CONH2, n = 1]; выход: 0,16 г, 14% теории; точка плавления (из смеси этилацетата и петролейного эфира): 196,5 – 197,5oC.
1H ЯМР ((CD3)2SO):  11,02 (1H, с, NH), 7,55 (1H, д, J=8,0 Гц, ArH), 7,38 (1H, с, NH), 7,26 (1H, д, J=8,1 Гц, ArH), 7,08 (1H, ддд, J=8,0, 7,1, 0,8 Гц, ArH), 6,98 (1H, дд, J=7,8, 7,1 Гц, ArH), 6,85 (1H, с, NH), 3,16, 2,46 (2х2H, 2хт, J=7,7 Гц, 3-CH2CH2).
13C ЯМР: 11,02 (1H, с, NH), 7,55 (1H, д, J=8,0 Гц, ArH), 7,38 (1H, с, NH), 7,26 (1H, д, J=8,1 Гц, ArH), 7,08 (1H, ддд, J=8,0, 7,1, 0,8 Гц, ArH), 6,98 (1H, дд, J=7,8, 7,1 Гц, ArH), 6,85 (1H, с, NH), 3,16, 2,46 (2х2H, 2хт, J=7,7 Гц, 3-CH2CH2).
13C ЯМР:  174,26 (с, CONH2), 136,77, 126,82, 123,29 (3хс, Ar), 122,09, 118,82, 118,68 (3хд, Ar), 118,43 (с, Ar), 111,12 (д, Ar), 35,94 (т, 174,26 (с, CONH2), 136,77, 126,82, 123,29 (3хс, Ar), 122,09, 118,82, 118,68 (3хд, Ar), 118,43 (с, Ar), 111,12 (д, Ar), 35,94 (т, 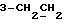 ), 20,58 (т, 3-CH2).
C22H22N4O2S ), 20,58 (т, 3-CH2).
C22H22N4O2SРассчитано, %: C 65,0; H 5,4; N 13,8; S 7,9. Найдено, %: C 64,8; H 5,7; N 13,6; S 7,7. Путем дальнейшей элюации с использованием этилацетата и смеси этилацетата и этанола в соотношении 9:1 получают 2,2′- дитиобис[3-(3-индолил)пропанамид] (соединение N 47) [соединение формулы (V), где R1 и R3 означают водород, R2 -(CH2)2CONH2, n = 2] в качестве желтого масла; выход: 0,90 г, 75% теории. Проба, выкристаллизованная из смеси метанола и разбавленной соляной кислоты, имеется в виде твердого вещества, разлагающегося выше 101oC. 1H ЯМР ((CD3)2SO):  11,37 (1H, с, NH), 7,55 (1H, д, J=8,0 Гц, ArH), 7,32 (1H, д, J=8,2 Гц, ArH), 7,16 (1H, т, J=7,6 Гц, ArH), 7,00 (1H, т, J=7,5 Гц. ArH), 6,94, 6,64 (2х1H, 2хс, CONH2), 2,72, 2,14 (2х2H, 2хм, 3-CH2CH2).
13C ЯМР: 11,37 (1H, с, NH), 7,55 (1H, д, J=8,0 Гц, ArH), 7,32 (1H, д, J=8,2 Гц, ArH), 7,16 (1H, т, J=7,6 Гц, ArH), 7,00 (1H, т, J=7,5 Гц. ArH), 6,94, 6,64 (2х1H, 2хс, CONH2), 2,72, 2,14 (2х2H, 2хм, 3-CH2CH2).
13C ЯМР:  173,48 (с, CONH2), 137,42, 126,58, 125,09 (3хс, Ar), 123,29 (д, Ar), 122,65 (с, Ar), 119,53, 118,91, 111,46 (3хд, Ar), 36,48 (т, 173,48 (с, CONH2), 137,42, 126,58, 125,09 (3хс, Ar), 123,29 (д, Ar), 122,65 (с, Ar), 119,53, 118,91, 111,46 (3хд, Ar), 36,48 (т, 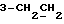 ), 20,26 (т, 3-CH2).
C22H22N4O2S2 ), 20,26 (т, 3-CH2).
C22H22N4O2S2 0,5H2O 0,5H2OРассчитано, %: C 59,1; H 5,2; N 12,5; S 14,3. Найдено, %: C 59,1; H 5,4; N 12,2; S 14,0. Путем восстановления соединения N 47 с использованием борана натрия получают 3-(2-тиоксо-3-индолинил)пропанамид (соединение N 14) [соединение формулы (Ia), где R1 и R2 означают водород, R3 – (CH2)2CONH2]; количественный выход; точка плавления (из этилацетата): 160 -163oC. 1H ЯМР ((CD3)2SO):  12,63 (1H, с, NH), 7,38 (1H, д, J=7,3 Гц, ArH), 7,27 (1H, т, J=7,6 Гц, ArH), 7,22 (1H, с, NH), 7,12 (1H, т, J=7,5 Гц, ArH), 7,00 (1H, д, J=7,7 Гц, ArH), 6,70 (1H, с, NH), 3,84 (1H, т, J=5,4 Гц, H-3), 2,38 (1H, м, 3-CH2CH2), 2,16-1,96 (1H, м, 3-CH2CH2), 1,77 (1H, ддд, J=14,6, 10,3, 4,2 Гц, 3-CH2CH2).
13C ЯМР: 12,63 (1H, с, NH), 7,38 (1H, д, J=7,3 Гц, ArH), 7,27 (1H, т, J=7,6 Гц, ArH), 7,22 (1H, с, NH), 7,12 (1H, т, J=7,5 Гц, ArH), 7,00 (1H, д, J=7,7 Гц, ArH), 6,70 (1H, с, NH), 3,84 (1H, т, J=5,4 Гц, H-3), 2,38 (1H, м, 3-CH2CH2), 2,16-1,96 (1H, м, 3-CH2CH2), 1,77 (1H, ддд, J=14,6, 10,3, 4,2 Гц, 3-CH2CH2).
13C ЯМР:  206,83 (с, CSNH), 173,37 (CONH2, 144,11, 133,81 (2хс, Ar), 127,95, 124,11, 123,21, 110,03 (4хд, Ar), 56,35 (д, C-3), 30,12, 28,32 (2хт, 3-CH2CH2).
C11H12N2OS 206,83 (с, CSNH), 173,37 (CONH2, 144,11, 133,81 (2хс, Ar), 127,95, 124,11, 123,21, 110,03 (4хд, Ar), 56,35 (д, C-3), 30,12, 28,32 (2хт, 3-CH2CH2).
C11H12N2OSРассчитано, %: C 60,0; H 5,5; N 12,7; S 14,6. Найдено,%: C 60,0; H 5,5; N 12,8; S 14,3. Получение соединения N 48. 1,08 мл 98%-ного сложного диэтилового эфира пироугольной кислоты при температуре 0oC добавляют к размешиваемому раствору 1,10 г 3-(3-индолил)пропионовой кислоты [соединение формулы (II), где R1 и R3 означают водород, R2 – (CH2)2COOH], 1,94 мл триэтиламина и 0,47 г гидрохлорида метиламина в 20 мл тетрагидрофурана. После этого смесь размешивают при температуре 20oC в течение 20 часов. Затем реакцию оканчивают добавлением воды и экстрагируют этилацетатом. В результате упаривания получают масло, которое очищают путем хроматографии на силикагеле с использованием в качестве элюента этилацетата с получением N-метил-3-(3-индолил)-пропанамида [соединение формулы (II), где R1 и R3 означают водород, R2 – (CH2)2CONHMe]; выход: 0,81 г, 69% теории; точка плавления (из смеси дихлорметана и петролейного эфира): 97,5 – 99oC. 1H ЯМР ((CD3)2CO):  9,97 (1H, с, NH), 7,56 (1H, дд, J=8,0, 0,8 Гц, ArH), 7,36 (1H, дт, J=8,1, 0,8 Гц, ArH), 7,11 (1H, м, H-2), 7,08 (1H, ддд, J=8,1, 7,0, 1,1 Гц, ArH), 6,99 (1H, ддд, J=7,8, 7,0, 1,0 Гц, ArH), 6,99 (1H, шир с, 9,97 (1H, с, NH), 7,56 (1H, дд, J=8,0, 0,8 Гц, ArH), 7,36 (1H, дт, J=8,1, 0,8 Гц, ArH), 7,11 (1H, м, H-2), 7,08 (1H, ддд, J=8,1, 7,0, 1,1 Гц, ArH), 6,99 (1H, ддд, J=7,8, 7,0, 1,0 Гц, ArH), 6,99 (1H, шир с,  ), 3,04 (2H, тд, J=7,7, 0,9 Гц, 3-CH2), 2,68 (3H, д, J=4,7 Гц, ), 3,04 (2H, тд, J=7,7, 0,9 Гц, 3-CH2), 2,68 (3H, д, J=4,7 Гц,  ), 2,51 (2H, т, J=7,7 Гц, ), 2,51 (2H, т, J=7,7 Гц, 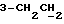 ).
13C ЯМР: ).
13C ЯМР:  173,30 (с, CONH), 137,73, 128,42 (2хс, Ar), 122,80, 122,01, 119,31 (3хд, Ar), 115,62 (с, Ar), 112,08 (д, Ar), 37,67 (т 173,30 (с, CONH), 137,73, 128,42 (2хс, Ar), 122,80, 122,01, 119,31 (3хд, Ar), 115,62 (с, Ar), 112,08 (д, Ar), 37,67 (т 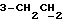 ), 26,06 (кв, NCH3), 22,08 (т, 3-CH2).
0,75 г полученного на предыдущей стадии N-метилпропанамида обрабатывают хлоридом серы(II), полученную в результате переработки реакционную смесь последовательно обрабатывают бораном натрия и перекисью водорода. Получаемое масло подвергают хроматографии на силикагеле с использованием в качестве элюента этилацетата и получают сперва 2,2′-тиобис[N-метил-3-(3- индолил)пропанамид] [соединение формулы (V), где R1 и R3 означают водород, R2 – (CH2)2CONHMe, n = 1]; выход: 0,13 г, 16% теории; точка плавления (из смеси этилацетата, бензола и петролейного эфира): 120 -123oC.
1H ЯМР (CDCl3): ), 26,06 (кв, NCH3), 22,08 (т, 3-CH2).
0,75 г полученного на предыдущей стадии N-метилпропанамида обрабатывают хлоридом серы(II), полученную в результате переработки реакционную смесь последовательно обрабатывают бораном натрия и перекисью водорода. Получаемое масло подвергают хроматографии на силикагеле с использованием в качестве элюента этилацетата и получают сперва 2,2′-тиобис[N-метил-3-(3- индолил)пропанамид] [соединение формулы (V), где R1 и R3 означают водород, R2 – (CH2)2CONHMe, n = 1]; выход: 0,13 г, 16% теории; точка плавления (из смеси этилацетата, бензола и петролейного эфира): 120 -123oC.
1H ЯМР (CDCl3):  10,50 (1H, с, NH), 7,54 (1H, д, J=7,9 Гц, ArH), 7,31 (1H, д, J=8,1 Гц, ArH), 7,14 (1H, ддд, J=8,1, 7,1, 1,0 Гц, ArH), 7,04 (1H, ддд, J=7,9, 7,0, 0,9 Гц, ArH), 5,31 (1H, шир д, J=4,9 Гц, 10,50 (1H, с, NH), 7,54 (1H, д, J=7,9 Гц, ArH), 7,31 (1H, д, J=8,1 Гц, ArH), 7,14 (1H, ддд, J=8,1, 7,1, 1,0 Гц, ArH), 7,04 (1H, ддд, J=7,9, 7,0, 0,9 Гц, ArH), 5,31 (1H, шир д, J=4,9 Гц,  ), 3,47 (2H, м, 3-CH2), 2,80 (2H, м, ), 3,47 (2H, м, 3-CH2), 2,80 (2H, м, 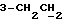 ), 2,60 (3H, д, J=4,9 Гц, ), 2,60 (3H, д, J=4,9 Гц,  ).
13C ЯМР: ).
13C ЯМР:  174,25 (с, CONH), 137,17, 126,67, 125,39 (3хс, Ar), 122,51, 118,88, 118,58 (3хд, Ar), 117,62 (с, Ar), 111,43 (д, Ar), 36,01 (т, 174,25 (с, CONH), 137,17, 126,67, 125,39 (3хс, Ar), 122,51, 118,88, 118,58 (3хд, Ar), 117,62 (с, Ar), 111,43 (д, Ar), 36,01 (т, 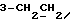 ), 26,27 (кв, NCH3), 21,02 (т, 3-CH2).
C24H26N4O2S ), 26,27 (кв, NCH3), 21,02 (т, 3-CH2).
C24H26N4O2S C6H6 C6H6Рассчитано, %: C 70,3; H 6,3; N 10,9; S 6,3. Найдено, %: C 70,1; H 6,2; N 11,0; S 6,0. Путем дальнейшей элюации с использованием этилацетата получают 2,2′-дитиобис[N-метил-3-(3-индолил)пропанамид] (соединение N 48) [соединение формулы (IV), где R1 и R3 означают водород, R2 – (CH2)2CONHMe, n = 2]; выход: 0,29 г, 34% теории; точка плавления (из смеси этилацетата, бензола и петролейного эфира); 162,5-164oC. 1H ЯМР (CD3CD):  7,50 (1H, дт, J=8,1, 0,8 Гц, ArH), 7,33 (1H, дт, J= 8,2, 0,8 Гц, ArH), 7,18 (1H, ддд, J=8,1, 7,0, 1,0 Гц, ArH), 7,02 (1H, ддд, J=8,0, 7,1, 0,8 Гц, ArH), 2,71 (2H, м, 3-CH2), 2,49 (3H, с, NCH3), 2,02 (2H, м, 7,50 (1H, дт, J=8,1, 0,8 Гц, ArH), 7,33 (1H, дт, J= 8,2, 0,8 Гц, ArH), 7,18 (1H, ддд, J=8,1, 7,0, 1,0 Гц, ArH), 7,02 (1H, ддд, J=8,0, 7,1, 0,8 Гц, ArH), 2,71 (2H, м, 3-CH2), 2,49 (3H, с, NCH3), 2,02 (2H, м, 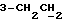 ).
13C ЯМР: ).
13C ЯМР:  175,76 (с, CONH), 139,27, 128,33, 127,01 (2xc, Ar), 124,80 (д, Ar), 123,92 (с, Ar), 120,48, 120,44, 112,48 (3хд, Ar), 38,44 (т, 175,76 (с, CONH), 139,27, 128,33, 127,01 (2xc, Ar), 124,80 (д, Ar), 123,92 (с, Ar), 120,48, 120,44, 112,48 (3хд, Ar), 38,44 (т, 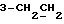 ), 26,32 (кв, NCH3), 21,95 (т, 3-CH2.
C24H26N4O2S2 ), 26,32 (кв, NCH3), 21,95 (т, 3-CH2.
C24H26N4O2S2Рассчитано, %: C 61,8; H 5,6; N 12,0; S 13,7. Найдено, %: C 61,7; H 5,7; N 12,2; S 13,7. Получение соединения N 49. 1,28 мл 98%-ного сложного диэтилового эфира пироугольной кислоты при температуре 0oC добавляют к размешиваемому раствору 1,04 г 3-(3-индолил)пропионовой кислоты [соединение формулы (II), где R1 и R3 означают водород, R2 – (CH2)2COOH] и 1,15 мл триэтиламина в 15 мл тетрагидрофурана. По истечении 5 минут раствор насыщают газовым диметиламином, после чего смесь размешивают при температуре 20oC в течение 16 часов. Перерабатывают вышеописанным образом и подвергают хроматографии на силикагеле с использованием в качестве элюента этилацетата, в результате чего получают сложный N,N-диметиловый эфир 3-(3-индолил)пропанамида [соединение формулы (II), где R1 и R3 означают водород, R2 – (CH2)2CONMe]; выход: 0,90 г, 76% теории; точка плавления (из смеси дихлорметана и петролейного эфира): 141 – 142oC. 1H ЯМР (CD3OD): 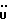 7,53 (1H, дт, J=7,9, 0,9 Гц, ArH), 7,32 (1H, дт, J= 8,1, 0,8 Гц, ArH), 7,07 (1H, ддд, J=8,1, 7,0, 1,1 Гц, ArH), 7,04 (с, H-2), 6,99 (1H, ддд, J= 7,9, 7,0, 0,9 Гц, ArH), 3,05 (2H, м, 3-CH2), 2,88, 2,86 (2х3H, 2хс, N(CH3)2), 2,73 (2H, м, 7,53 (1H, дт, J=7,9, 0,9 Гц, ArH), 7,32 (1H, дт, J= 8,1, 0,8 Гц, ArH), 7,07 (1H, ддд, J=8,1, 7,0, 1,1 Гц, ArH), 7,04 (с, H-2), 6,99 (1H, ддд, J= 7,9, 7,0, 0,9 Гц, ArH), 3,05 (2H, м, 3-CH2), 2,88, 2,86 (2х3H, 2хс, N(CH3)2), 2,73 (2H, м, 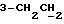 ).
13C ЯМР: ).
13C ЯМР: 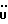 175,75 (c, 175,75 (c, 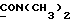 ), 138,20, 128,59 (2хс, Ar), 123,11, 122,36,119,61, 119,24 (4хд, Ar), 115,16 (с, Ar), 112,26 (д, Ar), 37,89, 35,82 (2хкв, N(CH3)2), 35,30 (т, ), 138,20, 128,59 (2хс, Ar), 123,11, 122,36,119,61, 119,24 (4хд, Ar), 115,16 (с, Ar), 112,26 (д, Ar), 37,89, 35,82 (2хкв, N(CH3)2), 35,30 (т, 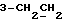 ), 22,32 (т, 3-CH2).
0,82 г полученного на предыдущей стадии диметилпропанамида обрабатывают дихлоридом серы(II) и полученную в результате переработки реакционную смесь последовательно обрабатывают бораном натрия и перекисью водорода с последующей хроматографией получаемого масла на силикагеле с использованием в качестве элюента смеси этилацетата и петролейного эфира в соотношении 3:1. Получают сперва 2,2′-тиобис[N,N-диметил-3-(3-индолил)пропанамид] [соединение формулы (V), где R1 и R3 означают водород, R2 – (CH2)2CONHMe2, n = 1]; выход: 0,12 г, 14% теории; точка плавления (из смеси этилацетата и петролейного эфира): 189 – 190oC.
1H ЯМР (CDCl3)): ), 22,32 (т, 3-CH2).
0,82 г полученного на предыдущей стадии диметилпропанамида обрабатывают дихлоридом серы(II) и полученную в результате переработки реакционную смесь последовательно обрабатывают бораном натрия и перекисью водорода с последующей хроматографией получаемого масла на силикагеле с использованием в качестве элюента смеси этилацетата и петролейного эфира в соотношении 3:1. Получают сперва 2,2′-тиобис[N,N-диметил-3-(3-индолил)пропанамид] [соединение формулы (V), где R1 и R3 означают водород, R2 – (CH2)2CONHMe2, n = 1]; выход: 0,12 г, 14% теории; точка плавления (из смеси этилацетата и петролейного эфира): 189 – 190oC.
1H ЯМР (CDCl3)):  10,72 (шир с, 1 H, NH), 7,55 (1H, д, J=7,9 Гц, ArH), 7,24 (1H, д, J=8,1 Гц, ArH), 7,10 (ддд, J=8,0, 7,1, 0,9 Гц, 1 H, ArH), 7,02 (дд, J=7,9, 7,1 Гц, 1 H, ArH), 3,47, 2,97 (2х2H, 2хм, 3-CH2CH2), 2,95, 2,91 (2х3H, 2хс, N(CH3)2).
13C ЯМР: 10,72 (шир с, 1 H, NH), 7,55 (1H, д, J=7,9 Гц, ArH), 7,24 (1H, д, J=8,1 Гц, ArH), 7,10 (ддд, J=8,0, 7,1, 0,9 Гц, 1 H, ArH), 7,02 (дд, J=7,9, 7,1 Гц, 1 H, ArH), 3,47, 2,97 (2х2H, 2хм, 3-CH2CH2), 2,95, 2,91 (2х3H, 2хс, N(CH3)2).
13C ЯМР:  173,36 (c, 173,36 (c, 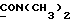 ), 137,15, 126,92, 125,55 (3хс, Ar), 122,26, 118,68, 118,58 (3хд, Ar), 118,02 (с, Ar), 111,35 (д, Ar), 37,49, 35,74 (2хкв, N(CH3)2), 32,14 (т, ), 137,15, 126,92, 125,55 (3хс, Ar), 122,26, 118,68, 118,58 (3хд, Ar), 118,02 (с, Ar), 111,35 (д, Ar), 37,49, 35,74 (2хкв, N(CH3)2), 32,14 (т, 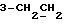 ), 20,54 (т, 3-CH2).
C26H30N4O2S ), 20,54 (т, 3-CH2).
C26H30N4O2SРассчитано, %: C 67,5; H 6,5; N 12,1; S 6,9. Найдено, %: C 67,4; H 6,6; N 12,0; S 7,2. Путем элюации этилацетатом получают 2,2′-дитиобис[N,N- диметил-3-(3-индолил)-пропанамид] (соединение N 49) [соединение формулы (V), где R1 и R3 означают водород, R2 – (CH2)CONMe2, n = 2]; выход: 0,49 г, 52% теории; точка плавления (из этилацетата): 179 – 180oC. 1H ЯМР (CD3OD):  7,45 (1H, дт, J=8,0, 0,8 Гц, ArH), 7,32 (1H, дт, J= 8,2, 0,8 Гц, ArH), 7,17 (1H, ддд, J=8,2, 7,1, 1,1 Гц, ArH), 7,01 (1H, ддд, J= 8,0, 7,1, 0,9 Гц, ArH), 2,72 (2H, м, 7,45 (1H, дт, J=8,0, 0,8 Гц, ArH), 7,32 (1H, дт, J= 8,2, 0,8 Гц, ArH), 7,17 (1H, ддд, J=8,2, 7,1, 1,1 Гц, ArH), 7,01 (1H, ддд, J= 8,0, 7,1, 0,9 Гц, ArH), 2,72 (2H, м, 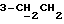 ), 2,71, 2,44 (2x3H, 2xc, ), 2,71, 2,44 (2x3H, 2xc, 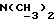 ), 2,09, (2H, м, ), 2,09, (2H, м, 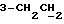 ).
13C ЯМР: ).
13C ЯМР:  174,68 (с, 174,68 (с, 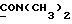 ), 139,43, 128,26, 126,61 (3хс, Ar), 124,85 (д, Ar), 123,84 (с, Ar), 120,55, 120,28, 112,51 (3хд, Ar), 37,57 (кв, NCH3), 35,69 (т, 3-CH2CH2), 35,60 (кв, NCH3), 21,49 (т, 3-CH2).
C26H30N4O2S2 ), 139,43, 128,26, 126,61 (3хс, Ar), 124,85 (д, Ar), 123,84 (с, Ar), 120,55, 120,28, 112,51 (3хд, Ar), 37,57 (кв, NCH3), 35,69 (т, 3-CH2CH2), 35,60 (кв, NCH3), 21,49 (т, 3-CH2).
C26H30N4O2S2Рассчитано, %: C 63,2; H 6,1; N 11,3; S 13,0. Найдено, %: C 63,2; H 6,2; N 11,3; S 13,1. Получение соединения N 50. Размешиваемый раствор 10,7 г сложного метилового эфира 2- ацетокси-4-бромметил-бензойной кислоты и 17,1 г гексаметилентетрамина в 150 мл хлороформа нагревают при температуре флегмы в течение 5 часов, после чего удаляют растворитель. Остаток перемешивают при температуре 20oC в течение 10 минут вместе с 60 мл метанола и 30 мл концентрированной соляной кислоты, после чего удаляют растворитель. Путем еще двухразовой обработки твердого остатка соляной кислотой и метанолом с последующим упариванием получают твердое вещество, которое промывают дихлорметаном. Затем обрабатывают насыщенным раствором бикарбоната калия. Основание экстрагируют этилацетатом и дихлорметаном и удаляют растворители. Получают 5,30 г (70% теории) сырого гидрохлорида, который осаждают из эфирного раствора основания после добавления газового хлористого водорода. Порцию указанного сырого основания очищают путем хроматографии на силикагеле с использованием в качестве элюента смеси этилацетата и петролейного эфира в соотношении 1: 2. В результате подкисления раствора очищенного основания получают чистый гидрохлорид сложного метилового эфира 4-(аминометил)-2-оксибензойной кислоты; точка плавления (из смеси дихлорметана и петролейного эфира): 225 – 227oC. 1H ЯМР ((CD3)2SO):  10,56 (1H, с, OH), 8,58 (3H, шир с, NH3+), 7,78 (1H, д, J=8,1 Гц, H-6), 7,14 (1H, с, H-3), 7,05 (1H, д, J=8,1 Гц, H-5), 4,01 (2H, шир с, 4-CH2), 3,88 (3H, с, OCH3).
13C ЯМР: 10,56 (1H, с, OH), 8,58 (3H, шир с, NH3+), 7,78 (1H, д, J=8,1 Гц, H-6), 7,14 (1H, с, H-3), 7,05 (1H, д, J=8,1 Гц, H-5), 4,01 (2H, шир с, 4-CH2), 3,88 (3H, с, OCH3).
13C ЯМР: 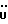 168,81 (с, 168,81 (с, 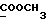 ), 159,80 (с, C-2), 141,84 (с, C-4), 130,25 (д, C-6), 119,61 (д, C-5), 117,48 (д, C-3), 112,90 (с, C-1), 52,53 (кв, OCH3), 41,63 (т, 4-CH2).
C9H11NO3 ), 159,80 (с, C-2), 141,84 (с, C-4), 130,25 (д, C-6), 119,61 (д, C-5), 117,48 (д, C-3), 112,90 (с, C-1), 52,53 (кв, OCH3), 41,63 (т, 4-CH2).
C9H11NO3 HCl HCl 0,5H2O 0,5H2OРассчитано, %: C 47,7; H 5,8; N 6,2; Cl 15,7. Найдено, %: C 47,9; H 5,8; N 6,3; Cl 15,9. Раствор 1,50 г 3-(3-индолил)пропионовой кислоты [соединение формулы (II), где R1 и R3 означают водород, R2 – (CH2)2COOH], 10 мл триэтиламина и 3,46 г сырого гидрохлорида сложного метилового эфира 4-(аминометил)-2-оксибензойной кислоты в 20 мл диметилформамида размешивают при температуре 20oC в течение 10 минут, после чего охлаждают до 0oC. Добавляют 1,47 мл 98%-ного сложного диэтилового эфира пироугольной кислоты, а затем размешивают при температуре 20oC в течение 17 часов. В результате переработки и хроматографии на силикагеле с использованием в качестве элюента смеси этилацетата и петролейного эфира в соотношении 1: 1 получают N-(3-окси-4-метоксикарбонилбензил)-3-(3- индолил)пропанамид [соединение формулы (II), где R1 и R3 означают водород, R2 – (CH2)2CONHCH2Ph{3-OH, 4-COOMe}]; выход: 1,40 г, 50% теории; точка плавления (из смеси этилацетата и петролейного эфира): 132 – 133oC. 1H ЯМР ((CD3)2SO):  10,76 (1H, шир с, NH), 10,50 (1H, с, OH), 8,41 (1H, т, J= 5,8 Гц, 10,76 (1H, шир с, NH), 10,50 (1H, с, OH), 8,41 (1H, т, J= 5,8 Гц,  ), 7,70 (1H, д, J=8,1 Гц, ArH), 7,54 (1H, д, J=7,8 Гц, ArH), 7,33 (1H, д, J=8,1 Гц, ArH), 7,10 (1H, д, J=2,2Гц, H-2), 7,06 (1H, ддд, J=8,0, 7,1, 0,9 Гц, ArH), 6,97 (1H, ддд, J=7,8, 7,0, 0,8 Гц, ArH), 6,83 (1H, д, J=1,4 Гц, ArH), 6,74 (1H, дд, J==8,2, 1,4 Гц, ArH), 4,27 (2H, д, J= 6,0 Гц, ), 7,70 (1H, д, J=8,1 Гц, ArH), 7,54 (1H, д, J=7,8 Гц, ArH), 7,33 (1H, д, J=8,1 Гц, ArH), 7,10 (1H, д, J=2,2Гц, H-2), 7,06 (1H, ддд, J=8,0, 7,1, 0,9 Гц, ArH), 6,97 (1H, ддд, J=7,8, 7,0, 0,8 Гц, ArH), 6,83 (1H, д, J=1,4 Гц, ArH), 6,74 (1H, дд, J==8,2, 1,4 Гц, ArH), 4,27 (2H, д, J= 6,0 Гц,  ), 3,88 (3H, с, OCH3), 2,96, 2,54 (2х2H, 2хт, J=7,7 Гц, 3-CH2CH2).
13C ЯМР: ), 3,88 (3H, с, OCH3), 2,96, 2,54 (2х2H, 2хт, J=7,7 Гц, 3-CH2CH2).
13C ЯМР:  172,05 (с, CONH), 169,14 (c, 172,05 (с, CONH), 169,14 (c, 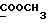 ), 160,10, 148,27, 136,22 (3хс, Ar), 129,92 (д, Ar), 126,98 (с, Ar), 122,14, 120,84, 118,30, 118,12, 118,09, 115,41 (6хд, Ar), 113,68 (с, Ar), 111,27 (д, Ar), 111,20 (с, Ar), 52,34 (кв, OCH3), 41,67 (т, NHCH2), 36,23 (т, ), 160,10, 148,27, 136,22 (3хс, Ar), 129,92 (д, Ar), 126,98 (с, Ar), 122,14, 120,84, 118,30, 118,12, 118,09, 115,41 (6хд, Ar), 113,68 (с, Ar), 111,27 (д, Ar), 111,20 (с, Ar), 52,34 (кв, OCH3), 41,67 (т, NHCH2), 36,23 (т, 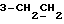 ), 21,00 (т, 3-CH2).
C20H20N2O4 ), 21,00 (т, 3-CH2).
C20H20N2O4Рассчитано, %: C 68,2; H 5,7; N 8,0. Найдено, %: C 68,3; H 5,9; N 8,0. Раствор 0,42 мл ацетилхлорида в 5 мл тетрагадрофурана при температуре 0oC добавляют к размешиваемому раствору 1,22 г полученного на предыдущей стадии пропанамида и 1,00 мл триэтиламина в 15 мл тетрагидрофурана, после чего полученную смесь размешивают при температуре 20oC в течение 18 часов. Затем реакцию прекращают добавлением 100 мл воды и трижды экстрагируют этилацетатом, каждый раз используя 100 мл. В результате упаривания и хроматографии на силикагеле с использованием в качестве элюента смеси этилацетата и петролейного эфира в соотношении 2:1 получают N-(3-ацетокси-4-метоксикарбонилбензил)-3-(3-индолил)пропанамид [соединение формулы (II), где R1 и R3 означают водород, R2 – (CH2)2CONHCH2Ph{3-OAc, 4-COOMe}, причем Ac означает ацетил] в качестве масла; выход: 1,28 г, 94% теории. 1H ЯМР (CDCl3):  8,18 (1H, шир с, NH), 7,87 (1H, д, J=8,1 Гц, ArH), 7,57 (1H, д, J=8,0 Гц, ArH), 7,31 (1H, дт, J=8,1, 0,8 Гц, ArH), 7,17 (1H, ддд, J=8,1, 7,0, 1,1 Гц, ArH), 7,09 (1H, ддд, J=7,9, 7,0, 0,9 Гц, ArH), 6,97 (1H, дд, J=8,1, 1,6 Гц, ArH), 6,84 (1H, д, J=1,5 Гц, ArH), 6,77 (1H, д, J= 2,3 Гц, H-2), 5,67 (1H, шир т, J=5,8 Гц, 8,18 (1H, шир с, NH), 7,87 (1H, д, J=8,1 Гц, ArH), 7,57 (1H, д, J=8,0 Гц, ArH), 7,31 (1H, дт, J=8,1, 0,8 Гц, ArH), 7,17 (1H, ддд, J=8,1, 7,0, 1,1 Гц, ArH), 7,09 (1H, ддд, J=7,9, 7,0, 0,9 Гц, ArH), 6,97 (1H, дд, J=8,1, 1,6 Гц, ArH), 6,84 (1H, д, J=1,5 Гц, ArH), 6,77 (1H, д, J= 2,3 Гц, H-2), 5,67 (1H, шир т, J=5,8 Гц,  ), 4,31 (2H, д, J=6,0 Гц, ), 4,31 (2H, д, J=6,0 Гц,  ), 3,87 (3H, с, COOCH3), 3,11, 2,58 (2х2H, 2хт, J=6,9 Гц, 3-CH2CH2), 2,36 (3H, с, OCOCH3).
13C ЯМР: ), 3,87 (3H, с, COOCH3), 3,11, 2,58 (2х2H, 2хт, J=6,9 Гц, 3-CH2CH2), 2,36 (3H, с, OCOCH3).
13C ЯМР:  172,84 (с, CONH), 170,14 (с, 172,84 (с, CONH), 170,14 (с, 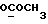 ), 164,64 (c, ), 164,64 (c, 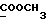 ), 150,82, 145,26, 136,33 (3хс, Ar), 132,04 (д, Ar), 126,85 (с, Ar), 125,42, 122,93, 122,31, 121,95 (4хд, Ar), 121,87 (с, Ar), 119,28, 118,52 (2хд, Ar), 114,08 (с, Ar), 111,36 (д, Ar), 52,23 (кв, OCH3), 42,62 (т, NHCH2), 37,32 (т, ), 150,82, 145,26, 136,33 (3хс, Ar), 132,04 (д, Ar), 126,85 (с, Ar), 125,42, 122,93, 122,31, 121,95 (4хд, Ar), 121,87 (с, Ar), 119,28, 118,52 (2хд, Ar), 114,08 (с, Ar), 111,36 (д, Ar), 52,23 (кв, OCH3), 42,62 (т, NHCH2), 37,32 (т, 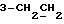 ), 21,46 (т, 3-CH2), 21,06 (кв, ), 21,46 (т, 3-CH2), 21,06 (кв, 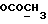 ).
C22H22N2O5 ).
C22H22N2O5Рассчитано: М+ 394,1529. Найдено: 394,1526 (МС в результате электронной ионизации). 1,47 г полученного на предыдущей стадии О-ацетата вышеописанным методом обрабатывают хлоридом серы(II) и получаемую в результате переработки реакционную смесь вышеописанным методом последовательно обрабатывают бораном натрия и перекисью водорода. Для удаления ацетатной группы получаемое масло при температуре 20oC в течение часа подвергают гидролизу смесью метанола и воды в присутствии избытка бикарбоната калия и получаемое при этом масло очищают путем хроматографии на силикагеле с использованием в качестве элюента смеси этилацетата и петролейного эфира в соотношении 1: 2, в результате чего сперва получают 2,2′-тиобис[N-(3-окси-4-метоксикарбонилбензил)- 3-(3-индолил)пропанамид] [соединение формулы (V), где R1 и R3 означают водород, R2 – (CH2)2CONHCH2Ph{ 3-OAc, 4-COOMe} , n = 1]; выход: 0,12 г, 9% теории; точка плавленая (из смеси метанола и разбавленной соляной кислоты): 109 – 112oC (разложение). 1H ЯМР (CDCl3):  10,50 (1H, с, OH), 10,17 (1H, с, NH), 7,49 (1H, д, J= 7,9 Гц, ArH), 7,31 (1H,д, J=8,2 Гц, ArH), 7,19 (1H, д, J=8,1Гц, ArH), 7,07 (1H, ддд, J=8,0, 7,1, 0,8 Гц, ArH), 6,97 (1H, ддд, J=7,8, 7,2, 0,6 Гц, ArH), 6,32 (1H, д, J=1,1 Гц, ArH), 5,98 (1H, дд, J=8,2, 1,5 Гц, ArH), 5,72 (1H, т, J=5,7 Гц, 10,50 (1H, с, OH), 10,17 (1H, с, NH), 7,49 (1H, д, J= 7,9 Гц, ArH), 7,31 (1H,д, J=8,2 Гц, ArH), 7,19 (1H, д, J=8,1Гц, ArH), 7,07 (1H, ддд, J=8,0, 7,1, 0,8 Гц, ArH), 6,97 (1H, ддд, J=7,8, 7,2, 0,6 Гц, ArH), 6,32 (1H, д, J=1,1 Гц, ArH), 5,98 (1H, дд, J=8,2, 1,5 Гц, ArH), 5,72 (1H, т, J=5,7 Гц,  ), 4,22 (2H, д, J=5,7 Гц, ), 4,22 (2H, д, J=5,7 Гц,  ), 3,86 (3H, с, OCH3), 3,50, 2,88 (2х2H, 2хм, 3-CH2CH2).
13C ЯМР: ), 3,86 (3H, с, OCH3), 3,50, 2,88 (2х2H, 2хм, 3-CH2CH2).
13C ЯМР:  173,77 (с, CONH), 170,06 (c, 173,77 (с, CONH), 170,06 (c, 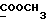 ), 161,36, 145,57, 137,16 (3хс, Ar), 130,02 (д, Ar), 126,62, 125,16 (2xc, Ar), 122,69, 119,13, 118,43 (3хд, Ar), 117,65 (с, Ar), 117,40, 115,51, 111,53 (3хд, Ar), 111,07 (с, Ar), 52,18 (кв, OCH3), 43,19 (т, NHCH2), 36,32 (т, ), 161,36, 145,57, 137,16 (3хс, Ar), 130,02 (д, Ar), 126,62, 125,16 (2xc, Ar), 122,69, 119,13, 118,43 (3хд, Ar), 117,65 (с, Ar), 117,40, 115,51, 111,53 (3хд, Ar), 111,07 (с, Ar), 52,18 (кв, OCH3), 43,19 (т, NHCH2), 36,32 (т, 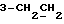 ), 21,22 (т, 3-CH2).
C40H38N4O8S ), 21,22 (т, 3-CH2).
C40H38N4O8SРассчитано, %: C 65,4; H 5,2; N 7,6; S 4,4. Найдено, %: C 65,2; H 5,1; N 7,4; S 4,4. Путем элюации смесью этилацетата и петролейного эфира в соотношении 2:3 получают 2,2′-дитиобис[N-(3-окси-4-метоксикарбонилбензил)-3-(3-индолил)пропанамид] [соединение формулы (IV), где R1 и R3 означают водород, R2 – (CH2)2CONHCH2Ph{ 3-OH, 4-COOMe} , n = 2]; выход: 0,38 г, 27% теории; точка плавления (из метанола): 183 – 185oC. 1H ЯМР (CDCl3):  10,80 (1H, с, OH), 8,65 (1H, с, NH), 7,67 (1H, д, J= 8,1 Гц, ArH), 7,52 (1H, д, J=8,0 Гц, ArH), 7,27 (1H, д, J=7,7 Гц, ArH), 7,15 (1H, ддд, J=8,1, 7,2, 0,9 Гц, ArH), 7,01 (1H, ддд, J=7,9, 7,2, 0,7 Гц, ArH), 6,55 (1H, д, J=1,5 Гц, ArH), 6,52 (1H, дд, J=8,2, 1,5 Гц, ArH), 5,10 (1H, т, J=5,9 Гц, 10,80 (1H, с, OH), 8,65 (1H, с, NH), 7,67 (1H, д, J= 8,1 Гц, ArH), 7,52 (1H, д, J=8,0 Гц, ArH), 7,27 (1H, д, J=7,7 Гц, ArH), 7,15 (1H, ддд, J=8,1, 7,2, 0,9 Гц, ArH), 7,01 (1H, ддд, J=7,9, 7,2, 0,7 Гц, ArH), 6,55 (1H, д, J=1,5 Гц, ArH), 6,52 (1H, дд, J=8,2, 1,5 Гц, ArH), 5,10 (1H, т, J=5,9 Гц,  ), 4,13 (2H, д, J=6,0 Гц, ), 4,13 (2H, д, J=6,0 Гц,  ), 3,94 (3H, с, OCH3), 2,88, 1,94 (2х2H, 2хт, J=7,7 Гц, 3-CH2CH2).
13C ЯМР: ), 3,94 (3H, с, OCH3), 2,88, 1,94 (2х2H, 2хт, J=7,7 Гц, 3-CH2CH2).
13C ЯМР:  172,12 (с, CONH), 170,39 (с, 172,12 (с, CONH), 170,39 (с, 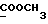 ), 161,55, 146,95, 137,29 (3хс, Ar), 130,09 (д, Ar), 127,01, 125,87 (2xc, Ar), 124,39 (д, Ar), 123,70 (с, Ar), 120,16, 119,86, 118,34, 115,69, 111,37 (5хд, Ar), 111,20 (с, Ar), 52,31 (кв, OCH3), 42,82 (т, NHCH2), 37,09 (т, ), 161,55, 146,95, 137,29 (3хс, Ar), 130,09 (д, Ar), 127,01, 125,87 (2xc, Ar), 124,39 (д, Ar), 123,70 (с, Ar), 120,16, 119,86, 118,34, 115,69, 111,37 (5хд, Ar), 111,20 (с, Ar), 52,31 (кв, OCH3), 42,82 (т, NHCH2), 37,09 (т, 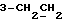 ), 20,54 (т, 3-CH2).
C40H38N4O8S2 ), 20,54 (т, 3-CH2).
C40H38N4O8S2Рассчитано, %: C 62,7; H 5,0: N 7,3; S 8,4. Найдено, %: C 62,5; H 4,9; N 7,3; S 8,4. Путем гидролиза 0,28 г вышеприведенного соединения формулы (IV) смесью метанола и воды в присутствии карбоната калия, осуществляемого вышеописанным методом в атмосфере азота при температуре 50oC в течение 5 часов, получают масло, которое подвергают хроматографии на силикагеле с использованием в качестве элюента смеси этилацетата и петролейного эфира в соотношении 1: 1, содержащей 1% уксусной кислоты, причем получают 2,2′-дитиобис[N- (4-карбокси-3-оксибензил)-3-(3-индолил)пропанамид] (соединение N 50) [соединение формулы (V), где R1 и R3 означают водород, R2 – (CH2)2CONHCH2Ph{3-OH, 4-COOH}, n = 2]; выход: 72 мг, 27% теории; точка плавления (из смеси метанола и разбавленной соляной кислоты): 160 – 163,5oC (разложение). 1H ЯМР ((CD3)2SO):  11,39 (1H, с, NH), 8,03 (1H, т, J=5,9 Гц, 11,39 (1H, с, NH), 8,03 (1H, т, J=5,9 Гц,  ), 7,65 (1H, д, J=8,1 Гц, ArH), 7,54 (1H, д, J=8,0 Гц, ArH), 7,32 (1H, д, J=8,2 Гц, ArH), 7,16 (1H, ддд, J=8,1, 7,1, 1,0 Гц, ArH), 6,99 (1H, ддд, J=7,8, 7,1, 0,7 Гц, ArH), 6,72 (1H, д, J=1,3 Гц, ArH), 6,57 (1H, дд, J=8,2, 1,4 Гц, ArH), 4,13 (2H, д, J=5,9 Гц, ), 7,65 (1H, д, J=8,1 Гц, ArH), 7,54 (1H, д, J=8,0 Гц, ArH), 7,32 (1H, д, J=8,2 Гц, ArH), 7,16 (1H, ддд, J=8,1, 7,1, 1,0 Гц, ArH), 6,99 (1H, ддд, J=7,8, 7,1, 0,7 Гц, ArH), 6,72 (1H, д, J=1,3 Гц, ArH), 6,57 (1H, дд, J=8,2, 1,4 Гц, ArH), 4,13 (2H, д, J=5,9 Гц,  ), 2,75, 2,24 (2х2H, 2хт, J=7,8 Гц, 3-CH2CH2).
13C ЯМР: ), 2,75, 2,24 (2х2H, 2хт, J=7,8 Гц, 3-CH2CH2).
13C ЯМР: 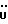 171,70 (с, CONH), 171,47 (с, COOH), 161,04, 147,83, 137,37 (3хс, Ar), 130,08 (д, Ar), 126,51, 125,11 (2хс, Ar), 123,25 (д, Ar), 122,42 (с, Ar), 119,49, 118,86, 117,73, 115,09, 111,41 (5хд, Ar), 111,21 (с, Ar), 41,67 (т, NHCH2), 36,63 (т, 171,70 (с, CONH), 171,47 (с, COOH), 161,04, 147,83, 137,37 (3хс, Ar), 130,08 (д, Ar), 126,51, 125,11 (2хс, Ar), 123,25 (д, Ar), 122,42 (с, Ar), 119,49, 118,86, 117,73, 115,09, 111,41 (5хд, Ar), 111,21 (с, Ar), 41,67 (т, NHCH2), 36,63 (т, 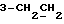 ), 20,41 (т, 3-CH2).
C38H34N4O8S2 ), 20,41 (т, 3-CH2).
C38H34N4O8S2 H2O H2OРассчитано, %: C 60,3; H 4,8; N 7,4; S 8,5. Найдено, %: C 60,2; H 4,9; N 7,1, S 8,5. Получение соединения N 51. 0,95 г 3-(3-индолил)пропионовой кислоты [соединение формулы (II), где R1 и R3 означают водород, R2 – (CH2)2COOH], обрабатывают хлоридом серы (II), затем перерабатывают и полученную смесь последовательно обрабатывают бораном натрия и перекисью водорода с получением сырой 2,2′-дитиобис[3-(3-индолил)пропионовой кислоты [соединение формулы (V), где R1 и R3 означают водород, R2 – (CH2)2COOH, n = 2] в качестве масла; выход: 1,12 г. Затем к размешиваемому раствору этого масла, 0,84 мл триэтиламина и 1,55 мл анилина в 15 мл тетрагидрофурана при температуре 0oC добавляют 1,00 мл 98%-ного сложного диэтилового эфира пироугольной кислоты, после чего полученную смесь перемешивают при температуре 20oC в течение одного дня. Затем добавляют 100 мл 0,1-молярного раствора гидроокиси калия и продолжают перемешивать в течение 30 минут для расщепления аддукта сложного диэтилового эфира пироугольной кислоты и повторного образования дисульфида. После этого смесь трижды экстрагируют дихлорметаном, каждый раз используя 100 мл. В результате упаривания получают масло, которое отчасти очищают путем хроматографии на силикагеле с использованием в качестве элюента смеси этилацетата и петролейного эфира в соотношении 2:1. Получаемый желтый дисульфид далее очищают путем хроматографии на свежем силикагеле с использованием в качестве первого элюента дихлорметана, а второго элюента – смеси хлороформа и этанола в соотношении 99:1, причем получают 2,2′-дитиобис[N-фенил-3-(3-индолил)пропанамид] (соединение N 51) [соединение формулы (V), где R1 и R3 означают водород, R2 – (CH2CONHPh, n = 2]; выход: 0,23 г, 16% теории; точка плавления (из смеси дихлорметана и бензола): 181 – 182,5oC (кристаллизованное из смеси дихлорметана и петролейного эфира вещество разлагается выше температуры 114oC). 1H ЯМР ((CD3)2CO):  10,52 (1H, с, NH), 8,88 (1H, с, NHPh), 7,64 (1H, д, J= 8,0 Гц, ArH), 7,56 (2H, дд, J=7,5, 0,9 Гц, ArH), 7,37 (1H, д, J=8,2 Гц, ArH), 7,24 (2H, дд, J=8,4, 7,5 Гц, ArH(Ph)), 7,16 (1H, ддд, J=8,1, 7,1, 1,1 Гц, ArH), 7,02 (2H, м, ArH), 3,04, 2,54 (2х2H, 2хм, 3-CH2CH2).
13C ЯМР: 10,52 (1H, с, NH), 8,88 (1H, с, NHPh), 7,64 (1H, д, J= 8,0 Гц, ArH), 7,56 (2H, дд, J=7,5, 0,9 Гц, ArH), 7,37 (1H, д, J=8,2 Гц, ArH), 7,24 (2H, дд, J=8,4, 7,5 Гц, ArH(Ph)), 7,16 (1H, ддд, J=8,1, 7,1, 1,1 Гц, ArH), 7,02 (2H, м, ArH), 3,04, 2,54 (2х2H, 2хм, 3-CH2CH2).
13C ЯМР:  171,48 (с, CONH), 140,24, 138,80 (2хс, Ar), 129,37 (2хд, Ar), 128,17, 126,81 (2xc, Ar), 124,57, 124,02 (2хд, Ar), 123,86 (с, Ar), 120,62, 120,36 (2хд, Ar), 120,23 (2х шир д, Ar), 112,38 (д, Ar), 38,97 (т, 171,48 (с, CONH), 140,24, 138,80 (2хс, Ar), 129,37 (2хд, Ar), 128,17, 126,81 (2xc, Ar), 124,57, 124,02 (2хд, Ar), 123,86 (с, Ar), 120,62, 120,36 (2хд, Ar), 120,23 (2х шир д, Ar), 112,38 (д, Ar), 38,97 (т, 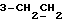 ), 21,39 (т, 3-CH2).
C34H30N4O2S2 ), 21,39 (т, 3-CH2).
C34H30N4O2S2 0,5H2O 0,5H2OРассчитано, %: C 68,1; H 5,2; N 9,4; S 10,7. Найдено, %: C 68,3; H 5,1; N 9,3; S 10,9. Пример 3. Получение соединений согласно таблице 1 по способу, представленному на реакционной схеме 3. Получение соединений NN 5 и 33. 1-Метил-2-индолинон [соединение формулы (VI), где R1 означает водород, R3 – метил] подвергают конденсации с диэтилоксалатом в среде этилата натрия и этанола, в результате чего получают сложный этиловый эфир 1-метил-изатилиденоксиуксусной кислоты [соединение формулы (VII), где R1 означает водород, R3 – метил, R2 – COOEt]; выход: 82% теории, точка плавления: 62 – 64oC. 2,30 г данного соединения подвергают гидролизу в течение одного дня в 150 мл ледяной уксусной кислоты, содержащей 1 мл концентрированной серной кислоты в присутствии 5 г 5%-ного палладия на угле в качестве катализатора. Затем реакционную смесь фильтруют на 4 г ацетата натрия, после чего растворитель удаляют при пониженном давлении. Остаток разделяют между дихлорметаном и водой и водную фазу повторно экстрагируют дихлорметаном. Экстракты дихлорметана объединяют, промывают водой, растворитель удаляют и остаток подвергают хроматографии на силикагеле с использованием в качестве элюента дихлорметана с получением сложного этилового эфира 2-(1-метил-2-оксо-3-индолинил)уксусной кислоты [соединение формулы (III), где R1, означает водород, R2 – CH2COOEt, R3 – метил] в качестве масла; выход: 1,23 г, 57% теории. 1H ЯМР (CDCl3):  7,29 (1H, т, J=7,7 Гц, ArH), 7,26 (1H, д, J=7,5 Гц, ArH), 7,03 (1H, т, J=7,5 Гц, ArH), 6,84 (1H, д, J=7,7 Гц, ArH), 4,15, 4,11 (2х1H, 2хдкв, J= 10,8, 7,1 Гц, COOCH2), 3,79 (1H, дд, J=8,0, 4,4 Гц, H-3), 3,23 (3H, с, NCH3), 3,07 (1H, дд, J=16,8, 4,4 Гц, CH2CO), 2,78 (1H, дд, J= 16,8, 8,1 Гц, CH2CO), 1,20 (3H, т, J=7,1 Гц, 7,29 (1H, т, J=7,7 Гц, ArH), 7,26 (1H, д, J=7,5 Гц, ArH), 7,03 (1H, т, J=7,5 Гц, ArH), 6,84 (1H, д, J=7,7 Гц, ArH), 4,15, 4,11 (2х1H, 2хдкв, J= 10,8, 7,1 Гц, COOCH2), 3,79 (1H, дд, J=8,0, 4,4 Гц, H-3), 3,23 (3H, с, NCH3), 3,07 (1H, дд, J=16,8, 4,4 Гц, CH2CO), 2,78 (1H, дд, J= 16,8, 8,1 Гц, CH2CO), 1,20 (3H, т, J=7,1 Гц, 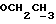 ).
13C ЯМР (CDCl3): ).
13C ЯМР (CDCl3):  176,72 (с, 176,72 (с, 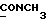 ), 171,02 ), 171,02 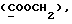 144,35 (с, ArH), 128,27 (д, ArH), 128,18 (с, ArH), 123,80, 122,45, 108,01 (3хд, ArH), 60,85 (т, OCH2), 41,83 (д, C-3), 34,94 (т, 144,35 (с, ArH), 128,27 (д, ArH), 128,18 (с, ArH), 123,80, 122,45, 108,01 (3хд, ArH), 60,85 (т, OCH2), 41,83 (д, C-3), 34,94 (т, 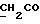 ), 26,28 (кв, NCH3), 14,05 (кв, ), 26,28 (кв, NCH3), 14,05 (кв, 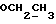 ).
Полученный на предыдущей стадии оксоацетат [соединение формулы (III), где R1 означает водород, R2 – CH2COOEt, R3 – метил] описанным выше в примере 1 методом обрабатывают пентасульфидом фосфора, после чего подвергают хроматографии на силикагеле с использованием в качестве элюента смеси дихлорметана и петролейного эфира в соотношении 3:2, причем получают сложный этиловый эфир 2-(1-метил-2-тиоксо-3-индолинил)уксусной кислоты [соединение формулы (Ia), где R1 означает водород, R2 – CH2COOEt, R3 – метил] (соединение N 5); выход: 90% теории; точка плавления (из смеси бензола и петролейного эфира): 47 – 48oC.
1H ЯМР (CDCl3): ).
Полученный на предыдущей стадии оксоацетат [соединение формулы (III), где R1 означает водород, R2 – CH2COOEt, R3 – метил] описанным выше в примере 1 методом обрабатывают пентасульфидом фосфора, после чего подвергают хроматографии на силикагеле с использованием в качестве элюента смеси дихлорметана и петролейного эфира в соотношении 3:2, причем получают сложный этиловый эфир 2-(1-метил-2-тиоксо-3-индолинил)уксусной кислоты [соединение формулы (Ia), где R1 означает водород, R2 – CH2COOEt, R3 – метил] (соединение N 5); выход: 90% теории; точка плавления (из смеси бензола и петролейного эфира): 47 – 48oC.
1H ЯМР (CDCl3):  7,35 (2H, м, ArH), 7,16 (1H, тд, J=7,5, 0,8 Гц, ArH), 7,01 (1H, дд, J= 7,7, 1,0 Гц, ArH), 4,15 (2H, кв, J=7,1 Гц, COOCH2), 4,14 (1H, м, H-3), 3,65 (3H, с, NCH3), 3,39 (1H, дд, J=17,0, 4,1 Гц, CH2CO), 2,83 (1H, дд, J=17,0, 8,6 Гц, CH2CO), 1,22 (3H, т, J=7,1 Гц, 7,35 (2H, м, ArH), 7,16 (1H, тд, J=7,5, 0,8 Гц, ArH), 7,01 (1H, дд, J= 7,7, 1,0 Гц, ArH), 4,15 (2H, кв, J=7,1 Гц, COOCH2), 4,14 (1H, м, H-3), 3,65 (3H, с, NCH3), 3,39 (1H, дд, J=17,0, 4,1 Гц, CH2CO), 2,83 (1H, дд, J=17,0, 8,6 Гц, CH2CO), 1,22 (3H, т, J=7,1 Гц, 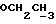 ).
13C ЯМР (CDCl3): ).
13C ЯМР (CDCl3):  204,35 (c 204,35 (c  ), 171,11 (с, ), 171,11 (с, 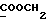 ), 145,73, 133,01 (2хс, ArH), 128,39, 124,34, 123,94, 109,46 (4хд, ArH), 60,85 (т, OCH2), 53,44 (д, C-3), 38,66 (т, ), 145,73, 133,01 (2хс, ArH), 128,39, 124,34, 123,94, 109,46 (4хд, ArH), 60,85 (т, OCH2), 53,44 (д, C-3), 38,66 (т, 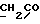 ), 31,52 (кв, NCH3), 14,13 (кв, ), 31,52 (кв, NCH3), 14,13 (кв, 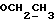 ).
C13H15NO2S ).
C13H15NO2SРассчитано, %: C 62,7; H 6,0; N 5,6; S 12,9. Найдено, %: C 62,5; H 6,2, N 5,6; S 12,8. Раствор сырого соединения N 5 в этаноле оставляют стоять на воздухе в течение двух недель, причем медленно выделяется дисульфид бис[этил-1-метилиндолил-3-ацетата-(2)] в качестве желтых иголок [соединение формулы (IV), где R1, означает водород, R2 – CH2COOEt, R3 – метил] (соединение N 33); выход: 0,18 г, 26% теории; точка плавления: 117 – 119oC. 1H ЯМР (CDCl3):  7,53 (1H, дт, J=8,0, 0,8 Гц, ArH), 7,30 (1H, ддд, J= 8,3, 6,3, 1,1 Гц, ArH), 7,27 (1H, ддд, J=8,1, 1,6, 0,7 Гц, ArH), 7,12 (1H, ддд, J=8,0, 6,2, 1,8 Гц, ArH), 3,96 (2H, кв, J=7,1 Гц, COOCH2, 3,54 (3H, с, NCH3), 3,38 (2H, с, CH2CO), 1,14 (3H, т, J=7,1 Гц, 7,53 (1H, дт, J=8,0, 0,8 Гц, ArH), 7,30 (1H, ддд, J= 8,3, 6,3, 1,1 Гц, ArH), 7,27 (1H, ддд, J=8,1, 1,6, 0,7 Гц, ArH), 7,12 (1H, ддд, J=8,0, 6,2, 1,8 Гц, ArH), 3,96 (2H, кв, J=7,1 Гц, COOCH2, 3,54 (3H, с, NCH3), 3,38 (2H, с, CH2CO), 1,14 (3H, т, J=7,1 Гц, 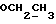 ).
13C ЯМР (CDCl3): ).
13C ЯМР (CDCl3):  171,06 (с, 171,06 (с, 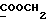 ), 138,45, 128,42, 126,47 (3хс, ArH), 124,33, 120,20, 120,07 (3хд, ArH), 117,59 (с, ArH), 109,93 (д, ArH), 60,70 (т, OCH2, 30,99 (т, ), 138,45, 128,42, 126,47 (3хс, ArH), 124,33, 120,20, 120,07 (3хд, ArH), 117,59 (с, ArH), 109,93 (д, ArH), 60,70 (т, OCH2, 30,99 (т, 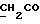 ), 29,97 (кв, NCH3), 14,13 (кв, ), 29,97 (кв, NCH3), 14,13 (кв, 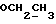 ).
C26H28N2O4S2 ).
C26H28N2O4S2Рассчитано, %: C 62,9; H 5,7; N 5,7; S 12,9. Найдено, %: C 62,7; H 5,6; N 5,6; S 13,0. Получение соединений NN 10 и 37. Согласно аналогичным реакциям 2-индолинона [соединение формулы (VI), где R1 и R3 означают водород] со сложным диэтиловым эфиром малоновой кислоты получают сложный этиловый эфир 3-(2-оксо-3-индолинил)пропионовой кислоты [соединение формулы (III), где R1 и R3 означают водород, R2 – (CH2)2COOEt], а путем реакции этого соединения с пентасульфидом фосфора описанным выше в примере 1 образом с последующей хроматографией на силикагеле с использованием в качестве элюента дихлорметана и кристаллизацией из смеси бензола и петролейного эфира в течение двух дней получают дисульфид бис[этилиндолил-3-пропионата-(2)] [соединение формулы (IV), где R1 и R3 означают водород, R2 – (CH2)2COOEt] (соединение N 37); выход: 18% теории; точка плавления: 137 – 139oC. 1H ЯМР (CDCl3): 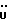 8,25 (1H, с, NH), 7,55 (1H, д, J=8,0 Гц, ArH), 7,22 (2H, м, ArH), 7,11 (1H, ддд, J=8,0, 5,0, 3,0 Гц, ArH), 4,02 (2H, кв, J=7,1 Гц, COOCH2), 2,98, 2,46 (2х2H, 2хт, J=7,9 Гц, CH2CH2CO), 1,16 (3H, т, J=7,1 Гц, 8,25 (1H, с, NH), 7,55 (1H, д, J=8,0 Гц, ArH), 7,22 (2H, м, ArH), 7,11 (1H, ддд, J=8,0, 5,0, 3,0 Гц, ArH), 4,02 (2H, кв, J=7,1 Гц, COOCH2), 2,98, 2,46 (2х2H, 2хт, J=7,9 Гц, CH2CH2CO), 1,16 (3H, т, J=7,1 Гц, 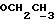 ).
13C ЯМР (COCl3): ).
13C ЯМР (COCl3): 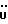 173,03 (c, 173,03 (c, 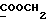 ), 137,26, 127,22, 125,83 (3хс, ArH), 124,26 (д, ArH), 122,81 (с, ArH), 120,03, 119,63, 111,19 (3хд, ArH), 60,41 (т, ), 137,26, 127,22, 125,83 (3хс, ArH), 124,26 (д, ArH), 122,81 (с, ArH), 120,03, 119,63, 111,19 (3хд, ArH), 60,41 (т, 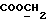 ), 35,20 (т, ), 35,20 (т, 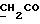 ), 20,26 (т, 3-CH2, 14,14 (кв, ), 20,26 (т, 3-CH2, 14,14 (кв, 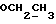 ).
C26H28N2O4S2 ).
C26H28N2O4S2Рассчитано, %: C 62,9; H 5,7; N 5,6; S 12,9. Найдено, %: C 63,3; H 5,9; N 5,7; S 13,0. Путем обработки маточных растворов бораном натрия получают сложный этиловый эфир 3-(2-тиоксо-3-индолинил)пропионовой кислоты [соединение формулы (Ia), где R1 и R3 означают водород, R2 – (CH2)2COOEt] (соединение N 10) в качестве масла; выход: 56% теории. 1H ЯМР (CDCl3):  10,40 (1H, с, NH), 7,31 (1H, д, J=7,4 Гц, ArH), 7,27 (1H, тд, J=7,8, 0,7 Гц, ArH), 7,14 (1H, тд, J=7,5, 0,7 Гц, ArH), 7,01 (1H, д, J= 7,8 Гц, ArH), 4,07, 4,03 (2х1H, 2хдкв, J=10,8, 7,1 Гц, COOCH2), 3,91 (1H, т, J=5,4 Гц, H-3), 2,52 (2H, м, 10,40 (1H, с, NH), 7,31 (1H, д, J=7,4 Гц, ArH), 7,27 (1H, тд, J=7,8, 0,7 Гц, ArH), 7,14 (1H, тд, J=7,5, 0,7 Гц, ArH), 7,01 (1H, д, J= 7,8 Гц, ArH), 4,07, 4,03 (2х1H, 2хдкв, J=10,8, 7,1 Гц, COOCH2), 3,91 (1H, т, J=5,4 Гц, H-3), 2,52 (2H, м, 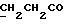 ), 2,41 (1H, ддд, J=15,8, 9,9, 5,9 Гц, CH2CO), 2,10 (1H, ддд, J=15,8, 9,1, 6,7 Гц, CH2CO), 1,20 (3H, т, J= 7,1 Гц, ), 2,41 (1H, ддд, J=15,8, 9,9, 5,9 Гц, CH2CO), 2,10 (1H, ддд, J=15,8, 9,1, 6,7 Гц, CH2CO), 1,20 (3H, т, J= 7,1 Гц, 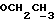 ).
13C ЯМР (CDCl3): ).
13C ЯМР (CDCl3):  207,31 (с, CSNH), 172,96 (c, 207,31 (с, CSNH), 172,96 (c, 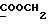 ), 143,31, 133,15 (2хс, ArH), 128,40, 124,34, 124,07, 110,04 (4хд, ArH), 60,55 (т, OCH2), 56,44 (д, C-3), 29,56, 28,16 (2хт, (CH2)2CO), 14,15 (кв, OCH2CH3).
C13H15NO2S ), 143,31, 133,15 (2хс, ArH), 128,40, 124,34, 124,07, 110,04 (4хд, ArH), 60,55 (т, OCH2), 56,44 (д, C-3), 29,56, 28,16 (2хт, (CH2)2CO), 14,15 (кв, OCH2CH3).
C13H15NO2SРассчитано, %: C 62,6; H 6,1; N 5,6; S 12,9. Найдено, %: C 62,3; H 5,9; N 5,6; S 12,6. Получение соединения N 12. Путем взаимодействия 1-метил-2-индолинона со сложным диэтиловым эфиром малоновой кислоты с последующей обработкой серосодержащим реагентом получают сложный этиловый эфир 3-(1- метил-2-тиоксо-3-индолинил)пропионовой кислоты [соединение формулы (Ia), где R1 означает водород, R2 – (CH2)2COOEt, R3 – метил] (соединение N 12); точка плавления (из смеси бензола и петролейного эфира): 61 – 63oC. 1H ЯМР (CDCl3): 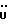 7,35 (2H, м, ArH), 7,20 (1H, т, J=7,5 Гц, ArH), 7,00 (1H, д, J= 7,8 Гц, ArH), 4,05, 4,02 (2х1H, 2хдкв, J=10,8, 7,1 Гц, COOCH2), 3,92 (1H, т, J=5,4 Гц, H-3), 3,63 (3H, с, NCH3), 2,53 (2H, тд, J=8,0, 5,4 Гц, 7,35 (2H, м, ArH), 7,20 (1H, т, J=7,5 Гц, ArH), 7,00 (1H, д, J= 7,8 Гц, ArH), 4,05, 4,02 (2х1H, 2хдкв, J=10,8, 7,1 Гц, COOCH2), 3,92 (1H, т, J=5,4 Гц, H-3), 3,63 (3H, с, NCH3), 2,53 (2H, тд, J=8,0, 5,4 Гц, 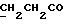 ), 2,32, 2,01 (2х1H, 2хтд, J=16,0, 8,0 Гц, ), 2,32, 2,01 (2х1H, 2хтд, J=16,0, 8,0 Гц, 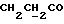 ), 1,19 (3H, т, J=7,1 Гц, ), 1,19 (3H, т, J=7,1 Гц, 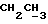 ).
13C ЯМР (CDCl3): ).
13C ЯМР (CDCl3): 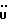 204,85 (c, 204,85 (c,  ), 172,87 (с, ), 172,87 (с, 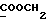 ), 145,89, 132,44 (2хс, ArH), 128,37, 124,30, 124,00, 109,49 (4хд, ArH), 60,43 (т, OCH2, 56,29 (д, C-3), 31,35 (кв, NCH3), 29,53, 28,46 (2хт, CH3CH2CO), 14,15 (кв, ), 145,89, 132,44 (2хс, ArH), 128,37, 124,30, 124,00, 109,49 (4хд, ArH), 60,43 (т, OCH2, 56,29 (д, C-3), 31,35 (кв, NCH3), 29,53, 28,46 (2хт, CH3CH2CO), 14,15 (кв, 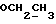 ).
C14H17NO2S ).
C14H17NO2SРассчитано, %: C 63,9; H 6,5; N 5,3; S 12,2. Найдено, %: C 64,1; H 6,7; N 5,4; S 12,0. Получение соединений NN 40 и 41. Путем аналогичной обработки 5-метил-2-индолинона [соединение формулы (VI), где R1 означает 5-метил, R3 – водород] получают дисульфид бис[этил-5-метилиндолил-3-пропионата] [соединение формулы (IV), где R1 означает 5-метил, R2 -(CH2)2COOEt, R3 – водород] (соединение N 41) в качестве желтого твердого вещества; точка плавления (из смеси бензола и петролейного эфира): 138,5 – 139oC. 1H ЯМР (CDCl3): 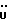 8,10 (1H, с, NH), 7,32 (1H, д, J=0,6 Гц, H-4), 7,15 (1H, д, J=8,3 Гц, H-7), 7,06 (1H, дд, J=8,3, 1,4 Гц, H-6), 4,03 (2H, кв, J= 7,2 Гц, 8,10 (1H, с, NH), 7,32 (1H, д, J=0,6 Гц, H-4), 7,15 (1H, д, J=8,3 Гц, H-7), 7,06 (1H, дд, J=8,3, 1,4 Гц, H-6), 4,03 (2H, кв, J= 7,2 Гц, 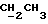 ), 3,02 – 2,85 (2H, м, CH2CH2CO2), 2,51 – 2,36 (2H, м, CH2CH2CO2), 2,43 (3H, с, ArCH3), 1,18 (3H, т, J=7,2 Гц, ), 3,02 – 2,85 (2H, м, CH2CH2CO2), 2,51 – 2,36 (2H, м, CH2CH2CO2), 2,43 (3H, с, ArCH3), 1,18 (3H, т, J=7,2 Гц, 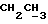 ).
13C ЯМР (CDCl3): ).
13C ЯМР (CDCl3):  173,1 (CO2Et), 135,6, 129,3, 127,4, 125,9, 122,3 (C- 2,3,5,8,9), 126,0, 119,1, 110,9 (C-4,6,7), 60,4 173,1 (CO2Et), 135,6, 129,3, 127,4, 125,9, 122,3 (C- 2,3,5,8,9), 126,0, 119,1, 110,9 (C-4,6,7), 60,4 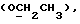 35,2 35,2 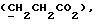 21,5 (ArCH3), 20,3 21,5 (ArCH3), 20,3 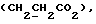 14,1 14,1 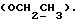 C28H32N2O4S2  0,5C6H6 0,5C6H6Рассчитано, %: C 66,1; H 6,3; N 5,0; S 11,4. Найдено, %: C 66,2; H 6,4; N 5,0; S 11,7. Путем гидролиза сложного этилового эфира (соединение N 41) получают дисульфид бис[5-метилиндолил-3-пропионовой кислоты-(2)] [соединение формулы (IV), где R1 – 5-метил, R2 – (CH)2CO2H, R3 – водород] (соединение N 40) в виде оранжево-коричневых призм; точка плавления (из смеси дихлорметана и петролейного эфира): 91,5 – 95oC. 1H ЯМР (CDCl3):  7,98 (1H, с, NH), 7,33 (1H, с, H-4), 7,14 (1H, д, J= 8,4 Гц, H-7), 7,07 (1H, дд, J=8,4, 1,3 Гц, H-6), 2,98 (2H, т, J=7,5 Гц, CH2CH2CO2), 2,56 (2H, т, J=7,5 Гц, CH2CH2CO2), 2,43 (3H, с, ArCH3).
C24H24N2O4S2 7,98 (1H, с, NH), 7,33 (1H, с, H-4), 7,14 (1H, д, J= 8,4 Гц, H-7), 7,07 (1H, дд, J=8,4, 1,3 Гц, H-6), 2,98 (2H, т, J=7,5 Гц, CH2CH2CO2), 2,56 (2H, т, J=7,5 Гц, CH2CH2CO2), 2,43 (3H, с, ArCH3).
C24H24N2O4S2Рассчитано: М+ 235,06670. Найдено: М+ 235,06639 (МC в результате электронной ионизации). Получение соединений NN 42 и 43. Путем аналогичной обработки 6-метил-2-индолинона [соединение формулы (VI), где R1 означает 6-метил, R3 – водород] получают дисульфид бис[этил-6-метилиндолил-3-пропионата] [соединение формулы (IV), где R1 – 6-метил, R2 – (CH2)2COOEt, R3 – водород] (соединение N 43) в качестве желтого твердого вещества; точка плавления: 122 – 123,5oC. 1H ЯМР (CDCl3): 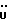 8,06 (1H, с, NH), 7,43 (1H, д, J=8,2 Гц, H-4), 7,03 – 7,00 (1H, м, H-7), 6,97 – 6,92 (1H, м, H-5), 4,02 (2H, кв, J=7,2 Гц, 8,06 (1H, с, NH), 7,43 (1H, д, J=8,2 Гц, H-4), 7,03 – 7,00 (1H, м, H-7), 6,97 – 6,92 (1H, м, H-5), 4,02 (2H, кв, J=7,2 Гц, 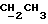 ), 2,98 – 2,91 (2H, м, CH2CH2CO), 2,48 – 2,42 (2H, м,CH2CH2CO), 2,44 (3H, с, ArHMe), 1,17 (3H, т, J=7,2 Гц, ), 2,98 – 2,91 (2H, м, CH2CH2CO), 2,48 – 2,42 (2H, м,CH2CH2CO), 2,44 (3H, с, ArHMe), 1,17 (3H, т, J=7,2 Гц, 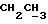 ).
13C ЯМР (CDCl3): ).
13C ЯМР (CDCl3): 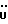 173,0 (CO2Et), 137,7, 134,3, 125,2, 125,0, 122,9 (C-2,3,6,8,9), 121,9, 119,3 (C-4,5,7), 60,3 173,0 (CO2Et), 137,7, 134,3, 125,2, 125,0, 122,9 (C-2,3,6,8,9), 121,9, 119,3 (C-4,5,7), 60,3 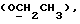 35,2 35,2 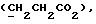 21,8 (ArCH3), 20,3 21,8 (ArCH3), 20,3 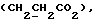 14,1 14,1 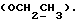 C28H32N2O4S2 Рассчитано, %: C 64,1, H 6,2; N 5,3; S 12,2. Найдено, %: C 64,1; H 6,2; N 5,4; S 12,0. Путем гидролиза данного сложного эфира получают дисульфид бис[метилиндолил-3-пропионата-(2)] (соединение N 42) [соединение формулы (IV), где R1 – 6-метил, R2 – (CH2)2COOEt, R3 – водород] в качестве желтых микрокристаллов; точка плавления (из смеси дихлорметана и петролейного эфира): 126 – 128oC. 1H ЯМР ((CD3)2CO): 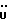 10,34 (1H, шир с, NH), 7,49 (1H, д, J=8,2 Гц, H-4), 7,19 (H, с, H-7), 6,19 (1H, дд, J=8,2, 1,2 Гц, H-5), 2,97 – 2,90 (2H, м, CHCH2CO2, 2,49 – 2,43 (2H, м, CH2CH2CO2), 2,42 (3H, с, ArCH3).
C24H24N2O4S2 10,34 (1H, шир с, NH), 7,49 (1H, д, J=8,2 Гц, H-4), 7,19 (H, с, H-7), 6,19 (1H, дд, J=8,2, 1,2 Гц, H-5), 2,97 – 2,90 (2H, м, CHCH2CO2, 2,49 – 2,43 (2H, м, CH2CH2CO2), 2,42 (3H, с, ArCH3).
C24H24N2O4S2 H2O H2OРассчитано, %: C 60,4; H 5,9; N 5,9. Найдено, %: C 60,2; H 5,3; N 5,9. Получение соединений NN 44 и 45. Путем аналогичной обработки 7-метил-2-индолинона [соединение формулы (VI), где R1 – 7-метил, R3 – водород] получают дисульфид бис[этил-7-метилиндолил-3-пропионата-(2)] [соединение формулы (IV), где R1 – 7-метил, R2 – (CH2)2COOEt, R3 – водород], (соединение N 45) в качестве желтого твердого вещества; точка плавления (из смеси бензола и петролейного эфира): 120 – 122,5oC. 1H ЯМР (CDCl3): 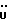 8,23 (1H, с, NH), 7,38 (1H, д, J=7,4 Гц, ArH), 7,00 (1H, т, J=7,3 Гц, H-5), 6,94 (1H, д, J=6,3 Гц, ArH), 4,02 (2H, кв, J=7,2 Гц, 8,23 (1H, с, NH), 7,38 (1H, д, J=7,4 Гц, ArH), 7,00 (1H, т, J=7,3 Гц, H-5), 6,94 (1H, д, J=6,3 Гц, ArH), 4,02 (2H, кв, J=7,2 Гц, 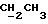 ), 3,16 (2H, т, J= 7,5 Гц, CH2CH2CO2), 2,71 (2H, т, J=7,5 Гц, CH2CH2CO2), 1,96 (3H, с, ArCH3), 1,23 (3H, т, J=7,2 Гц, ), 3,16 (2H, т, J= 7,5 Гц, CH2CH2CO2), 2,71 (2H, т, J=7,5 Гц, CH2CH2CO2), 1,96 (3H, с, ArCH3), 1,23 (3H, т, J=7,2 Гц, 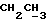 ).
13C ЯМР (CDCl3): ).
13C ЯМР (CDCl3): 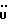 173,6 (CO2Et), 136,9, 127,0, 124,8, 122,9, 121,0 (C-2,3,7,8,9), 124,3, 120,0,117,0 (C-4,5,6), 60,6 173,6 (CO2Et), 136,9, 127,0, 124,8, 122,9, 121,0 (C-2,3,7,8,9), 124,3, 120,0,117,0 (C-4,5,6), 60,6 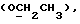 35,3 35,3 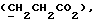 20,9, 20,9, 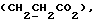 16,0 (ArCH3),14,1 16,0 (ArCH3),14,1 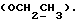 C28H32N2O4S2 Рассчитано, %: C 64,1, H 6,2; N 5,3; S 12,2. Найдено, %: C 64,2; H 6,4; N 5,4; S 12,0. Путем гидролиза сложного эфира (соединение N 45) вышеописанным методом получают дисульфид бис[7-метилиндолил-3- пропионовой кислоты-(2)] [соединение формулы (IV), где R1 – 7-метил, R2 – (CH2)2CO2H, R3 – водород], (соединение N 44) в качестве зеленых иголок; точка плавления (из смеси уксусной кислоты и петролейного эфира): 172,5 – 175oC. 1H ЯМР ((CD3)2CO):  10,37 (1H, шир с, NH), 7,45 (1H, д, J=7,0 Гц, ArH), 7,03 – 6,95 (2H, м, ArH), 3,01-2,94 (2H, м, CH2CH2CO2), 2,50 – 2,42 (2H, м, CH2CH2CO2), 2,49 (3H, с, ArCH3).
C24H24N2O4S2 10,37 (1H, шир с, NH), 7,45 (1H, д, J=7,0 Гц, ArH), 7,03 – 6,95 (2H, м, ArH), 3,01-2,94 (2H, м, CH2CH2CO2), 2,50 – 2,42 (2H, м, CH2CH2CO2), 2,49 (3H, с, ArCH3).
C24H24N2O4S2Рассчитано, %: C 61,5; H 5,2; N 6,0. Найдено, %: C 61,3; H 5,1; N 6,0. Пример 4. Получение соединений согласно таблице 1 по способу, представленному на реакционной схеме 4. Получение соединений NN 21-23 и 57. 0,70 г (6,61 ммоль) карбоната натрия в виде порошка добавляют к суспензии 2,93 г (6,61 ммоль) пентасульфида фосфора в 40 мл тетрагидрофурана и полученную смесь интенсивно перемешивают при температуре 20oC до получения гомогенной смеси и прекращения выделения газа (15 минут). Затем добавляют раствор 0,80 г (5,50 ммоль) 1-метил-2-индолинона [соединение формулы (VI), где R1 и R3 означают метил] в 10 мл тетрагидрофурана и продолжают перемешивать в течение 18 часов. Выливают в солевой раствор, после чего смесь экстрагируют этилацетатом, перерабатывают и подвергают хроматографии на силикагеле с использованием в качестве элюента смеси этилацетата и петролейного эфира в соотношении 1:4. Получают 1-метил-2-индолинтион [соединение формулы (VIII), где R1 и R3 означают метил]; выход: 0,71 г, 87% теории, точка плавления: 108 – 109oC. Затем к раствору 4,10 г полученного на предыдущей стадии 1- метил-2-индолинтиона в 150 мл тетрагидрофурана в течение 15 минут каплями добавляют охлаждаемую льдом суспензию 1,4 г 57%-ного гидрида натрия в 100 мл тетрагидрофурана. Полученную смесь размешивают в течение 30 минут, затем добавляют раствор 3,5 г фенилизоцианата в 50 мл тетрагидрофурана и продолжают перемешивать при температуре 20oC в течение 3 часов. Растворитель удаляют при пониженном давлении, остаток разлагают добавлением ледяной соляной кислоты и экстрагируют дихлорметаном. В результате удаления растворителя получают масло (6,0 г), которое выкристаллизовывают из диэтилового эфира. Путем двухразовой кристаллизации из тетрагидрофурана и диэтилового эфира получают сложный N-фениловый эфир (1-метил-2-тиоксо-3-индолинил) карбоксамида [соединение формулы (Ia), где R1 означает водород, R2 – CONHPh, R3 – метил] (соединение N 21) в качестве желтоватого твердого вещества; выход: 2,8 г, 39% теории; точка плавления: 149 – 151oC. 1H ЯМР (CDCl3):  10,36 (1H, с, NH), 7,87 (1H, д, J=7,4 Гц, ArH), 7,60 (2H, д, J=7,9 Гц, ArH), 7,41 (2H, т, J=7,5 Гц, ArH), 7,31 (2H, м, ArH), 7,11 (1H, т, J=7,3 Гц, ArH), 7,03 (1H, д, J=7,8 Гц, ArH), 3,73 (3H, с, NCH3).
C16H14N2ODS 10,36 (1H, с, NH), 7,87 (1H, д, J=7,4 Гц, ArH), 7,60 (2H, д, J=7,9 Гц, ArH), 7,41 (2H, т, J=7,5 Гц, ArH), 7,31 (2H, м, ArH), 7,11 (1H, т, J=7,3 Гц, ArH), 7,03 (1H, д, J=7,8 Гц, ArH), 3,73 (3H, с, NCH3).
C16H14N2ODSРассчитано, %: C 68,1; H 5,1; N 9,9; S 11,4. Найдено, %: C 67,8; H 5,1; N 9,8; S 11,4. Раствор 200 мг соединения N 21 в 30 мл смеси дихлорметана и метанола в соотношении 2: 1 размешивают при температуре 20oC в течение 5 дней. Затем растворители удаляют в вакууме. В результате хроматографии на силикагеле с использованием дихлорметана в качестве первого элюента и смеси хлороформа и этанола в соотношении 99: 1 в качестве второго элюента получают дисульфид бис[N-фенил-1-метилиндолил-3-карбоксамида-(2)] [соединение формулы (IV), где R1 означает водород, R2 – CONHPh, R3 – метил] (соединение N 57); выход: 0,19 г, 95% теории; точка плавления (из бензола): 187 – 188oC. 1H ЯМР (CDCl3):  8,21 (1H, с, NH), 8,01 (1H, д, J=8,1 Гц, ArH), 7,19 (1H, ддд, J= 8,1, 7,1, 0,9 Гц, ArH), 7,13 (4H, д, J=4,3 Гц, Ph), 7,09 (1H, ддд, J=8,1, 7,1, 0,9 Гц, ArH), 7,05 (1H, д, J=8,1 Гц, ArH), 6,98 (1H, квин, J=4,3 Гц, Ph), 3,77 (3H, с, NCH3).
13C ЯМР (CDCl3): 8,21 (1H, с, NH), 8,01 (1H, д, J=8,1 Гц, ArH), 7,19 (1H, ддд, J= 8,1, 7,1, 0,9 Гц, ArH), 7,13 (4H, д, J=4,3 Гц, Ph), 7,09 (1H, ддд, J=8,1, 7,1, 0,9 Гц, ArH), 7,05 (1H, д, J=8,1 Гц, ArH), 6,98 (1H, квин, J=4,3 Гц, Ph), 3,77 (3H, с, NCH3).
13C ЯМР (CDCl3):  161,57 (CO), 138,55, 137,95 (2хс), 128,64 (д), 127,41, 126,07 (2xc), 125,55, 122,28, 122,00 (4хд), 119,76 (с), 119,27, 110,14 (2хд), 30,33 (NCH3).
C32H26N4O2S2 161,57 (CO), 138,55, 137,95 (2хс), 128,64 (д), 127,41, 126,07 (2xc), 125,55, 122,28, 122,00 (4хд), 119,76 (с), 119,27, 110,14 (2хд), 30,33 (NCH3).
C32H26N4O2S2Рассчитано, %: C 68,3; H 4,6; N 10,0; S 11,4. Найдено, %: C 68,9; H 4,9; N 9,6; S 11,1. К раствору 200 мг соединения N 21 в 20 мл ацетона добавляют 0,12 г карбоната калия и 0,14 г метилйодида и полученную смесь размешивают при температуре 20oC в течение часа. Затем добавляют 100 мл дихлорметана, раствор фильтруют и растворители удаляют, в результате чего получают 0,26 г коричневого масла. Путем хроматографии на силикагеле с использованием в качестве элюента дихлорметана получают сложный N-фениловый эфир (1-метил-2- метилтио-3-индолил)карбоксамида в качестве масла [соединение формулы (IX), где R1 означает водород, R2 – CONHPh, R3 – метил, R4 – SMe] (соединение N 22); выход: 200 мг, 95% теории; путем кристаллизации из смеси метанола и дихлорметана получают белое твердое вещество с точкой плавления 116 – 118oC. 1H ЯМР (CDCl3):  9,99 (1H, с, NH), 8,58 (1H, д, J=8,0 Гц, ArH), 7,75 (2H, д, J=7,6 Гц, ArH), 7,38 (4H, м, ArH), 7,29 (1H, квин, J=4,3 Гц, ArH), 7,12 (1H, т, J=7,4 Гц, ArH), 3,95 (3H, с, NCH3), 2,47 (3H, с, SCH3).
13С ЯМР (CDCl3): 9,99 (1H, с, NH), 8,58 (1H, д, J=8,0 Гц, ArH), 7,75 (2H, д, J=7,6 Гц, ArH), 7,38 (4H, м, ArH), 7,29 (1H, квин, J=4,3 Гц, ArH), 7,12 (1H, т, J=7,4 Гц, ArH), 3,95 (3H, с, NCH3), 2,47 (3H, с, SCH3).
13С ЯМР (CDCl3):  162,59 (с, CONH), 138,80, 137,46, 131,43 (3хс, ArH), 129,03 (2хд, ArH), 127,35 (с, ArH), 124,14, 123,67, 123,02, 122,24 (4хд, ArH), 119,86 (2хд, ArH), 114,04 (с, ArH), 109,69 (д, ArH), 30,23 (кв, NCH3), 20,50 (кв, SCH3).
C17H16N2OS 162,59 (с, CONH), 138,80, 137,46, 131,43 (3хс, ArH), 129,03 (2хд, ArH), 127,35 (с, ArH), 124,14, 123,67, 123,02, 122,24 (4хд, ArH), 119,86 (2хд, ArH), 114,04 (с, ArH), 109,69 (д, ArH), 30,23 (кв, NCH3), 20,50 (кв, SCH3).
C17H16N2OSРассчитано, %: C 68,9; H 5,4; N 9,5; S 10,8. Найдено, %: C 68,6; H 5,5; N 9,4; S 10,8. К суспензии 50 мг (89 ммоль) соединения N 57 и одной капли BF3-этерата в 1 мл дихлорметана добавляют 0,02 мл (0,178 ммоль) бензилмеркаптана. Размешивают при температуре 20oC в течение 3 часов, затем полученную гомогенную смесь выливают в насыщенный водный раствор бикарбоната натрия, разбавляют дихлорметаном и перерабатывают. Получаемый при этом остаток подвергают хроматографии на силикагеле с использованием в качестве первого элюента смеси дихлорметана и петролейного эфира в соотношении 1: 1, а второго элюента – дихлорметана, причем получают сложный бензиловый эфир дисульфида [N-фенил-1-метилиндолил-3-карбоксамида-(2)] [соединение формулы (X), где R1 означает водород, R2 – CONHPh, R3 – метил, R4 – S2CH2Ph] (соединение N 23); выход: 39 мг, 54% теории; точка плавления (из смеси хлороформа и петролейного эфира): 146 – 148oC. 1H ЯМР (CDCl3):  8,95 (1H, шир с, CONH), 8,47 (1H, дд, J=7,7, 1,3 Гц, ArH-4), 7,66 (2H, дд, J=7,5, 1,2 Гц, Ph), 7,40 – 7,07 (11H, м, ArH-5,-6,-7 и Ph), 3,90 (3H, с, NMe).
13С ЯMP: 8,95 (1H, шир с, CONH), 8,47 (1H, дд, J=7,7, 1,3 Гц, ArH-4), 7,66 (2H, дд, J=7,5, 1,2 Гц, Ph), 7,40 – 7,07 (11H, м, ArH-5,-6,-7 и Ph), 3,90 (3H, с, NMe).
13С ЯMP:  162,31 162,31 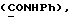 138,31 (с), 138,04 (с), 135,13 (с), 130,00 (с), 129,15, 129,06, 128,69, 127,83, 126,83 (с), 124,79, 123,94, 122,80, 122,36, 119,90, 109,92, 42,51 138,31 (с), 138,04 (с), 135,13 (с), 130,00 (с), 129,15, 129,06, 128,69, 127,83, 126,83 (с), 124,79, 123,94, 122,80, 122,36, 119,90, 109,92, 42,51 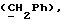 30,73 (NCH3).
C23H20N2S2O 30,73 (NCH3).
C23H20N2S2OРассчитано, %: C 68,3; H 5,0; N 6,9; S 15,9. Найдено, %: C 68,4; H 5,1; N 6,9; S 16,0. Получение соединения N 58. Аналогично из 1-этил-2-индолинтиона и фенилизоцианата получают дисульфид бис[N-фенил-1-этилиндолил-3-карбоксамида-(2)] [соединение формулы (IV), где R1 означает водород, R2 – CONHPh, R3 – этил] (соединение N 58); выход: 25% теории; точка плавления: 200 – 202oC. 1H ЯМР (CDCl3):  8,22 (1H, шир, CONH), 7,98 (1H, д, J=8,1 Гц, H-4), 7,18 (1H, т, J=8,0 Гц, H-6), 7,11 – 7,04 (6H, м, H-5 и Ph), 6,95 (1H, дд, J= 8,0, 1,0 Гц, H-7), 4,32 (2H, кв, J=7,0 Гц, 8,22 (1H, шир, CONH), 7,98 (1H, д, J=8,1 Гц, H-4), 7,18 (1H, т, J=8,0 Гц, H-6), 7,11 – 7,04 (6H, м, H-5 и Ph), 6,95 (1H, дд, J= 8,0, 1,0 Гц, H-7), 4,32 (2H, кв, J=7,0 Гц, 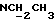 ), 1,36 (3H, т, J=7,0 Гц, ), 1,36 (3H, т, J=7,0 Гц, 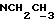 ).
13C ЯМР: ).
13C ЯМР:  161,73 (CONH), 137,91 (с), 137,44 (с), 128,55, 128,55, 128,35 (2с), 126,33 (с), 125,41, 123,47, 122,12, 122,07, 119,37, 110,19 (C-7), 38,86 161,73 (CONH), 137,91 (с), 137,44 (с), 128,55, 128,55, 128,35 (2с), 126,33 (с), 125,41, 123,47, 122,12, 122,07, 119,37, 110,19 (C-7), 38,86 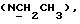 15,23 15,23 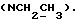 C34H30N4S2O2 Рассчитано, %: C 69,1; H 5,1; N 9,5; S 10,8. Найдено, %: C 68,9; H 5,4; N 9,5; S 10,4. Получение соединения N 59. Аналогичным образом получают 4-хлор-1-метил-2-индолинтион [соединение формулы (VIII), где R1 – 4-Cl, R3 – метил]; выход: 92% теории, точка плавления: 147,5 -149,5oC. 1H ЯМР (CDCl3):  7,29 (1H, т, J=8,0 Гц, H-6), 7,13 (1H, д, J=8,0 Гц, H-5), 6,86 (1H, д, J=8,0 Гц, H-7), 4,09 (2H, с, H-3), 3,60 (3H, с, NCH3).
13C ЯМР: 7,29 (1H, т, J=8,0 Гц, H-6), 7,13 (1H, д, J=8,0 Гц, H-5), 6,86 (1H, д, J=8,0 Гц, H-7), 4,09 (2H, с, H-3), 3,60 (3H, с, NCH3).
13C ЯМР:  200,75 (C-2), 147,65 (с), 130,04 (с), 129,52, 127,44 (с), 124,34, 107,81 (C-7), 48,42 (C-3), 31,55 (NCH3).
C9H8ClNS 200,75 (C-2), 147,65 (с), 130,04 (с), 129,52, 127,44 (с), 124,34, 107,81 (C-7), 48,42 (C-3), 31,55 (NCH3).
C9H8ClNSРассчитано, %: C 54,7; H 4,1; N 7,1; S 16,2. Найдено, %: C 54,5; H 4,3; N 7,1; S 16,0. Путем реакции данного соединения с фенилизоцианатом получают дисульфид бис[N-фенил-4-хлор-3-метилиндолил-3-карбоксамида-(2)] [соединение формулы (IV), где R1 означает 4-Cl, R2 – CONHPh, R3 – метил] (соединение N 59); выход: 21% теории; точка плавления: 225 – 228oC. 1H ЯМР (CDCl3):  8,38 (1H, шир, NH), 7,49 (1H, дд, J=7,9, 1,5 Гц, H-5), 7,12 (1H, т, J=7,9 Гц, H-6), 7,08 – 7,05 (4H, м, 8,38 (1H, шир, NH), 7,49 (1H, дд, J=7,9, 1,5 Гц, H-5), 7,12 (1H, т, J=7,9 Гц, H-6), 7,08 – 7,05 (4H, м,  ), 6,98 (1H, дд, J= 7,9, 1,5 Гц, H-7), 6,96 (1H, м, ), 6,98 (1H, дд, J= 7,9, 1,5 Гц, H-7), 6,96 (1H, м,  ), 3,77 (3H, с, N-CH3).
C32H24Cl2N4O2S2 ), 3,77 (3H, с, N-CH3).
C32H24Cl2N4O2S2Рассчитано, %: C 60,8; H 3,8; N 8,9; Cl 11,2. Найдено, %: C 60,7; H 4,1; N 8,7; Cl 11,8. Получение соединений NN 20 и 60. Аналогичным методом из 5-хлор-1-метил-2-индолитиона [соединение формулы (VIII), где R1 означает 5-Cl, R3 – метил]; точка плавления 163 – 165oC; и фенилизоцианата получают дисульфид бис[N-фенил-5-хлор-1-метилиндолил-3-карбоксамида-(2)] [соединение формулы (IV), где R1, означает 5-Cl, R2 – CONHPh, R3 – метил] (соединение N 60); выход: 27% теории; точка плавления: 214 – 216oC. 1H ЯМР (CDCl3):  8,14 (1H, шир, CONH), 7,94 (1H, д, J=l,8 Гц, H-4), 7,12 (4H, шир, ArH), 7,07 (1H, д, J=8,4 Гц, ArH), 7,01 (1H, м, ArH), 6,90 (1H, д, J=8,9 Гц, ArH), 3,76 (3H, с, NCH3).
13 ЯМР: 8,14 (1H, шир, CONH), 7,94 (1H, д, J=l,8 Гц, H-4), 7,12 (4H, шир, ArH), 7,07 (1H, д, J=8,4 Гц, ArH), 7,01 (1H, м, ArH), 6,90 (1H, д, J=8,9 Гц, ArH), 3,76 (3H, с, NCH3).
13 ЯМР:  161,06 (CONH), 137,72 (с), 136,81 (с), 128,73, 128,44 (с), 128,25 (с), 126,58 (с), 126,11, 123,76, 121,27, 119,71 (с), 118,80, 111,16 (C-7), 30,53 (NCH3).
C32H24Cl2N4O2S2 161,06 (CONH), 137,72 (с), 136,81 (с), 128,73, 128,44 (с), 128,25 (с), 126,58 (с), 126,11, 123,76, 121,27, 119,71 (с), 118,80, 111,16 (C-7), 30,53 (NCH3).
C32H24Cl2N4O2S2Рассчитано, %: C 60,8; H 3,8; N 8,9; S 10,2. Найдено, %: C 60,6; H 4,0; N 8,9; S 10,2. К размешиваемой суспензии 0,12 г (0,19 ммоль) полученного на предыдущей стадии соединения в 5 мл метанола добавляют 14 мг (0,38 ммоль) борана натрия. По истечении 15 минут раствор сгущают досуха и остаток распределяют между этилацетатом и водой. Органический раствор перерабатывают с получением твердого вещества, которое при температуре -5oC повторно выкристаллизовывают из дегазированной смеси хлороформа и бензола для получения сложного N-фенилового эфира 5-хлор-1-метил-2- тиоксокиндол-3-карбоксамида (соединение N 20) [соединение формулы (Ia), где R1 – 5-Cl, R2 – CONHPh, R3 – метил] в качестве грубых иголок; 86% теории; точка плавления: 312 – 320oC (разложение). 1H ЯМР ((CD3)2SO):  12,84 (1H, с, SH), 8,09 (1H, д, J=2,2 Гц, H-4), 7,70 (2H, д, J=8,5 Гц, H-2′,6′), 7,27 (1H, д, J=8,5, 8,2 Гц, H-3′,5′), 7,07 (1H, д, J=8,4 Гц, H-7), 6,92 (1H, т, J=8,2 Гц, H-4′), 6,86 (1H, дд, J=8,4, 2,2 Гц, H-6), 3,64 (3H, с, N-CH3).
13C ЯМР: 12,84 (1H, с, SH), 8,09 (1H, д, J=2,2 Гц, H-4), 7,70 (2H, д, J=8,5 Гц, H-2′,6′), 7,27 (1H, д, J=8,5, 8,2 Гц, H-3′,5′), 7,07 (1H, д, J=8,4 Гц, H-7), 6,92 (1H, т, J=8,2 Гц, H-4′), 6,86 (1H, дд, J=8,4, 2,2 Гц, H-6), 3,64 (3H, с, N-CH3).
13C ЯМР:  164,73 (CONH), 140,81 (с), 135,17 (с), 130,29 (с), 128,55 (д), 123,93 (с), 121,01 (д), 118,20 (д), 117,65 (д), 117,30 (д), 107,97 (д), 104,40 (с), 29,18 (N-CH3).
C16H13ClN2OS 164,73 (CONH), 140,81 (с), 135,17 (с), 130,29 (с), 128,55 (д), 123,93 (с), 121,01 (д), 118,20 (д), 117,65 (д), 117,30 (д), 107,97 (д), 104,40 (с), 29,18 (N-CH3).
C16H13ClN2OSРассчитано: M+ 318,0408, 316,0437. Найдено: M+ 318,0414, 316,0431 (масс-спектр). Получение соединения N 61. Из 7-хлор-1-метил-2-индолинтиона [соединение формулы (VIII), где R1 означает 7-Cl, R3 – метил]; точка плавления: 126 – 128oC; и фенилизоцианата аналогичным методом получают дисульфид бис[N-фенил-7-хлор-5-метилиндолил-3-карбоксамида-(2)] [соединение формулы (IV), где R1 означает 7-Cl, R2 – CONHPh, R3 – метил] (соединение N 61); выход: 27% теории; точка плавления: 232 – 234oC. 1H ЯМР (CDCl3):  18,15 (1H, шир, CONH), 7,85 (1H, д, J=8,0 Гц, H-4), 7,19 – 7,05 (5H, м, ArH), 7,00 (1H, т, J=6,6 Гц, ArH), 6,90 (1H, т, J=7,8 Гц, ArH), 4,25 (3H, с, N-CH3).
C32H24Cl2N4O2S2 18,15 (1H, шир, CONH), 7,85 (1H, д, J=8,0 Гц, H-4), 7,19 – 7,05 (5H, м, ArH), 7,00 (1H, т, J=6,6 Гц, ArH), 6,90 (1H, т, J=7,8 Гц, ArH), 4,25 (3H, с, N-CH3).
C32H24Cl2N4O2S2Рассчитано, %: C 60,8; H 3,8; N 8,9. Найдено, %: C 60,4; H 4,0; N 8,8. Получение соединения N 62. 1,4-Диметил-2-индолинтион [соединение формулы (VIII), где R1 – 4-метил, R3 – метил] ; выход: 81% теории; точка плавления: 160 – 162oC; получают аналогично методу, по которому получают и соединение N 64 (см. ниже). C10H11NS Рассчитано, %: C 67,8; H 6,3; N 7,9; S 18,1. Найдено, %: C 68,0; H 6,4; N 8,0; S 18,3. Путем реакции данного соединения с фенилизоцианатом получают дисульфид бис[N-фенил-1,4-диметилиндолил-3-карбоксамида-(2)] [соединение формулы (IV), где R1 – 4-метил, R2 – CONHPh, R3 – метил] (соединение N 62); точка плавленая: 237 -239oC. 1H ЯМР (CDCl3):  8,30 (1H, шир с, CONH), 7,14 (1H, дд, J=7,3, 7,3 Гц, H-6), 7,04 – 6,86 (7H, м, H-5,7 и 8,30 (1H, шир с, CONH), 7,14 (1H, дд, J=7,3, 7,3 Гц, H-6), 7,04 – 6,86 (7H, м, H-5,7 и  ), 3,69 (3H, с, NCH3), 2,47 (3H, с, 4-CH3).
13C ЯМР (CDCl3): ), 3,69 (3H, с, NCH3), 2,47 (3H, с, 4-CH3).
13C ЯМР (CDCl3):  164,57 164,57  138,59, 137,62, 131,51 (3хс), 128,62 (д), 127,23 (c), 125,11 (д), 124,15 (с), 123,94, 122,62 (2хд), 122,10 (c), 119,61, 107,91 (2xc), 30,26 (NCH3), 19,66 (4-CH3).
C34H30N4O2S2 138,59, 137,62, 131,51 (3хс), 128,62 (д), 127,23 (c), 125,11 (д), 124,15 (с), 123,94, 122,62 (2хд), 122,10 (c), 119,61, 107,91 (2xc), 30,26 (NCH3), 19,66 (4-CH3).
C34H30N4O2S2Рассчитано, %: C 69,1; H 5,1; N 9,5; S 10,9. Найдено, %: C 69,1; H 5,1; N 9,7; S 11,0. Получение соединения N 63. Путем описанного ниже для соединения N 64 метода получают 1,5-диметил-2-индолинтион [соединение формулы (VIII), где R1 означает 5-метил, R3 – метил]; точка плавления: 143 – 145oC. Путем реакции этого соединения с фенилизоцианатом получают дисульфид бис[N-фенил-1,5-диметилиндолил-3-карбоксамида-(2)] [соединение формулы (IV), где R1 – 5-метил, R2 – CONHPh, R3 – метил] (соединение N 63); точка плавления: 231 – 234oC. 1H ЯМР (CDCl3):  8,24 (1H, шир с, CONH), 7,78 (1H, шир, H-4), 7,19 – 7,13 (4H, м, 8,24 (1H, шир с, CONH), 7,78 (1H, шир, H-4), 7,19 – 7,13 (4H, м,  ), 7,05 – 6,90 (3H, м, H-6,7 и ), 7,05 – 6,90 (3H, м, H-6,7 и  ), 3,71 (3H, с, NCH3), 2,36 (3H, с, 5-CH3).
13C ЯМР (CDCl3): ), 3,71 (3H, с, NCH3), 2,36 (3H, с, 5-CH3).
13C ЯМР (CDCl3):  161,75 (CONH), 138,00, 137,10, 131,77, 129,01 (4xc), 128,53, 127,37 (2хд), 126,35 (с), 123,40, 121,33, 119,85, 109,85 (4хд), 30,32 (NCH3), 21,57 (5-CH3).
C34H30N4O2S2 161,75 (CONH), 138,00, 137,10, 131,77, 129,01 (4xc), 128,53, 127,37 (2хд), 126,35 (с), 123,40, 121,33, 119,85, 109,85 (4хд), 30,32 (NCH3), 21,57 (5-CH3).
C34H30N4O2S2Рассчитано, %: C 69,1; H 5,1; N 9,5; S 10,9. Найдено, %: C 69,4; H 5,2; N 9,6; S 11,2. Получение соединения N 64. К смеси 27,4 г (0,2 моль) 2,5-диметиланилина и 23,8 г (0,2 моль) бензтриазола в 300 мл этанола при размешивании медленно добавляют 16,1 г (0,2 моль) 37%-ного водного раствора формальдегида. По истечении 30 минут собирают образовавшийся твердый белый осадок и промывают этанолом, причем получают N-(1- бензтриазолилметил)-2,5-диметиланилин; выход: 33,9 г, 67% теории; точка плавления (из этанола): 147 – 149oC. 1H ЯМР (CDCl3):  6,85 – 8,10 (7H, м, ArH), 6,56 (второстепенный изомер) и 6,13 (основной изомер) (2H, 2хм, CH2), 5,08 (второстепенный) и 4,70 (основной) (1H, 2хм, NH), 2,24 (3H, с, CH3) и 2,12 (3H, с, CH3).
C15H16N4 6,85 – 8,10 (7H, м, ArH), 6,56 (второстепенный изомер) и 6,13 (основной изомер) (2H, 2хм, CH2), 5,08 (второстепенный) и 4,70 (основной) (1H, 2хм, NH), 2,24 (3H, с, CH3) и 2,12 (3H, с, CH3).
C15H16N4Рассчитано, %: C 70,6; H 5,9; N 23,5; Найдено, %: C 71,5; H 6,3; N 22,1. Суспензию 33 г (0,13 моль) данного соединения и 5 г борана натрия в 400 мл диоксана нагревают с обратным холодильником в течение 5 часов, после чего сгущают полученный раствор. Охлаждают, добавляют воду, и полученную смесь экстрагируют этилацетатом. Затем органический слой дважды промывают водным карбонатом калия и водой и сушат над сульфатом натрия. В результате удаления растворителя получают 17,6 г (99% теории) N,2,5-триметиланилина в качестве масла, которое используют непосредственно для следующей реакции. 1H ЯМР (CDCl3):  6,93 (1H, д, J=7,4 Гц, H-3), 6,49 (1H, д, J=7,6 Гц, H-4), 6,44 (1H, с, H-6), 3,72 (1H, с, NH), 2,88 (3H, с, NCH3), 2,31 (3H, с, CH3), 2,09 (3H, с, CH3).
Раствор 6,89 г (5 ммоль) 2,4,6-триметиланилина в 100 мл сухого тетрагидрофурана в атмосфере азота охлаждают до -78oC и каплями добавляют 21 мл 2,5 М раствора н-бутиллития в гексанах. Полученной смеси дают нагреваться до 0oC, затем в течение 2 – 3 минут вводят сухую газовую двуокись углерода. Избыточную двуокись углерода удаляют в вакууме и после добавления тетрагидрофурана в количестве, пополняющем потери при упаривании, раствор повторно охлаждают до -78oC. Еще раз каплями добавляют 22 мл 2,5 М раствора н-бутиллития в гексанах, после чего температуре дают медленно повышаться до -10oC, причем получают темно-красный раствор. После дальнейших 30 минут при этой температуре смесь опять охлаждают до -78oC и вводят газовую двуокись углерода, пока не исчез красный цвет. Затем реакционной смеси дают нагреваться до температуры +20oC, растворитель удаляют и добавляют 50 мл 0,1 М соляной кислоты для снятия защитной группы с азота и циклизации. Полученную смесь экстрагируют этилацетатом, последовательно промывают 0,1 М соляной кислотой, водой и разбавленным водным карбонатом натрия. После этого сушат над сульфатом натрия, растворитель удаляют в вакууме и получают масло, которое подвергают хроматографии на окиси алюминия с получением 1,6-диметил-2-индолинона [соединение формулы (VI), где R1 – 6-метил, R3 – метил]; выход: 3,37 г, 42 % теории; точка плавления (из гексана): 94,5 – 96oC.
1H ЯМР (CDCl3): 6,93 (1H, д, J=7,4 Гц, H-3), 6,49 (1H, д, J=7,6 Гц, H-4), 6,44 (1H, с, H-6), 3,72 (1H, с, NH), 2,88 (3H, с, NCH3), 2,31 (3H, с, CH3), 2,09 (3H, с, CH3).
Раствор 6,89 г (5 ммоль) 2,4,6-триметиланилина в 100 мл сухого тетрагидрофурана в атмосфере азота охлаждают до -78oC и каплями добавляют 21 мл 2,5 М раствора н-бутиллития в гексанах. Полученной смеси дают нагреваться до 0oC, затем в течение 2 – 3 минут вводят сухую газовую двуокись углерода. Избыточную двуокись углерода удаляют в вакууме и после добавления тетрагидрофурана в количестве, пополняющем потери при упаривании, раствор повторно охлаждают до -78oC. Еще раз каплями добавляют 22 мл 2,5 М раствора н-бутиллития в гексанах, после чего температуре дают медленно повышаться до -10oC, причем получают темно-красный раствор. После дальнейших 30 минут при этой температуре смесь опять охлаждают до -78oC и вводят газовую двуокись углерода, пока не исчез красный цвет. Затем реакционной смеси дают нагреваться до температуры +20oC, растворитель удаляют и добавляют 50 мл 0,1 М соляной кислоты для снятия защитной группы с азота и циклизации. Полученную смесь экстрагируют этилацетатом, последовательно промывают 0,1 М соляной кислотой, водой и разбавленным водным карбонатом натрия. После этого сушат над сульфатом натрия, растворитель удаляют в вакууме и получают масло, которое подвергают хроматографии на окиси алюминия с получением 1,6-диметил-2-индолинона [соединение формулы (VI), где R1 – 6-метил, R3 – метил]; выход: 3,37 г, 42 % теории; точка плавления (из гексана): 94,5 – 96oC.
1H ЯМР (CDCl3):  7,11 (2H, д, J=7,5 Гц, H-4), 6,85 (2H, д, J=7,5 Гц, H-5), 6,65 (1H, с, H-7), 3,47 (2H, с, CH2), 3,19 (3H, с, 1-CH3), 2,38 (3H, с, 6-CH3).
C10H11NO 7,11 (2H, д, J=7,5 Гц, H-4), 6,85 (2H, д, J=7,5 Гц, H-5), 6,65 (1H, с, H-7), 3,47 (2H, с, CH2), 3,19 (3H, с, 1-CH3), 2,38 (3H, с, 6-CH3).
C10H11NOРассчитано, %: C 74,5; H 6,9; N 8,7. Найдено, %: C 74,5; H 6,6; N 8,7. Путем обработки данного соединения пентасульфидом фосфора получают 1,6-диметил-2-индолинтион [соединение формулы (VIII), где R1 – 6-метил, R3 – метил]; точка плавления: 141 – 143oC. C10H11NS Рассчитано, %: C 67,8; H 6,3; N 7,9; S 18,1. Найдено, %: C 67,6; H 6,5; N 8,2; S 18,0. Данное соединение подвергают взаимодействию с фенилизоцианатом для получения дисульфида бис[N-фенил-1,6-диметилиндолил-3-карбоксамида- (2)] [соединение формулы (IV), где R1 – 6-метил, R2 – CONHPh, R3 – метил] (соединение N 64); точка плавления: 192 – 195oC. 1H ЯМР (CDCl3):  8,16 (1H, шир с, CONH), 7,85 (1H, д, J=8,3 Гц, H-4), 7,10 (4H, шир, 8,16 (1H, шир с, CONH), 7,85 (1H, д, J=8,3 Гц, H-4), 7,10 (4H, шир,  ), 6,98 (1H, м, ), 6,98 (1H, м,  ), 6,87 (1H, д, J=8,3 Гц, H-5), 6,73 (1H, шир, H-7), 3,71 (3H, с, NCH3), 2,35 (3H, с, 6-CH3).
13C ЯМР (CDCl3): ), 6,87 (1H, д, J=8,3 Гц, H-5), 6,73 (1H, шир, H-7), 3,71 (3H, с, NCH3), 2,35 (3H, с, 6-CH3).
13C ЯМР (CDCl3):  161,49 (CONH), 139,05, 137,98, 135,63 (3хс), 128,44 (д), 126,10 (с), 124,28 (д), 124,06 (с), 123,17, 121,61, 119,21, 109,85 (4хд), 30,17 (NCH3), 21,98 (6-CH3).
C34H30N4O2S2 161,49 (CONH), 139,05, 137,98, 135,63 (3хс), 128,44 (д), 126,10 (с), 124,28 (д), 124,06 (с), 123,17, 121,61, 119,21, 109,85 (4хд), 30,17 (NCH3), 21,98 (6-CH3).
C34H30N4O2S2Рассчитано, %: C 69,1; H 5,1; N 9,5; S 10,9. Найдено, %: C 68,9; H 5,2; N 9,6; S 11,0. Получение соединения N 65. Аналогичным образом получают 1,7-диметил-2-индолинтион [соединение формулы (VIII), где R1 – 7-метил, R3 – метил]; точка плавленая: 138 – 139oC. C10H11NS Рассчитано, %: C 67,8; H 6,3; N 7,9; S 18,1. Найдено, %: C 67,6; H 6,2; N 8,0; S 18,1. Путем реакции данного соединения с фенилизоцианатом получают дисульфид бис-[N-фeнил-1,7-димeтилиндoлил-3-кapбoкcaмидa-(2)] [соединение формулы (IV), где R1) – 7-метил, R2 – CONHPh, R3 – метил] (соединение N 65); точка плавления: 221 -223oC. 1H ЯМР (CDCl2):  8,11 (1H, шир с, CONH), 7,83 (1H, J=8,1 Гц, H-4), 7,15 – 7,07 (4H, м, 8,11 (1H, шир с, CONH), 7,83 (1H, J=8,1 Гц, H-4), 7,15 – 7,07 (4H, м,  ), 6,99 (1H, м, ), 6,99 (1H, м,  ), 6,94 (1H, дд, J=8,1, 8,1 Гц, H-5), 6,85 (1H, д, J=8,1 Гц, H-6), 4,07 (3H, с, NCH3), 2,44 (3H, с, 7-CH3).
13C ЯМР (CDCl3): ), 6,94 (1H, дд, J=8,1, 8,1 Гц, H-5), 6,85 (1H, д, J=8,1 Гц, H-6), 4,07 (3H, с, NCH3), 2,44 (3H, с, 7-CH3).
13C ЯМР (CDCl3):  161,67 (CONH), 137,95, 137,86 (2xc), 128,55, 128,31 (2хд), 126,85 (с), 123,57, 122,10 (2хд), 121,77 (с), 119,72, 119,21 (2хд), 33,36 (NCH3), 20,23 (7-CH3).
C34H30N4O2S2 161,67 (CONH), 137,95, 137,86 (2xc), 128,55, 128,31 (2хд), 126,85 (с), 123,57, 122,10 (2хд), 121,77 (с), 119,72, 119,21 (2хд), 33,36 (NCH3), 20,23 (7-CH3).
C34H30N4O2S2Рассчитано, %: C 69,1; H 5,1; N 9,5; S 10,9. Найдено, %: C 69,1; H 5,2; N 9,7; S 11,0. Получение соединения N 66. Аналогичным методом из 4-метокси-1-метил-2-индолинтиона [соединение формулы (VIII), где R1 – 4-OMe, R3 – метил]; точка плавления: 141 – 144oC; и фенилизоцианата получают дисульфид бис[N-фенил-4-метокси-1-метилиндолил-3-карбоксамида-(2)] [соединение формулы (IV), где R1 – 4-OCH3, R2 – CONHPh, R3 – метил] (соединение N 66), точка плавления: 225 – 228oC. 1H ЯМР (CDCl3):  8,85 (1H, шир с, CONH), 7,25 – 7,06 (5H, м, H-6 и 8,85 (1H, шир с, CONH), 7,25 – 7,06 (5H, м, H-6 и  ), 6,98 (1H, м, ), 6,98 (1H, м,  ), 6,82 (1H, д, J=8,3 Гц, H-7), 6,36 (1H, д, J=7,8 Гц, H-5), 3,76 (3H, с, OCH3), 3,69 (3H, с, NCH3).
13C ЯМР (CDCl3): ), 6,82 (1H, д, J=8,3 Гц, H-7), 6,36 (1H, д, J=7,8 Гц, H-5), 3,76 (3H, с, OCH3), 3,69 (3H, с, NCH3).
13C ЯМР (CDCl3):  162,36 (CONH), 152,70, 139,39, 138,73, 130,20 (4xc), 128,54, 125,39, 123,08 (3хс), 130,20 (с), 128,54, 125,39, 123,08 (3хд), 119,96 (с), 119,19 (д), 114,66 (с), 103,67, 101,55 (2хд), 22,58 (OCH3), 30,48 (NCH3).
C34H30N4O4S2 162,36 (CONH), 152,70, 139,39, 138,73, 130,20 (4xc), 128,54, 125,39, 123,08 (3хс), 130,20 (с), 128,54, 125,39, 123,08 (3хд), 119,96 (с), 119,19 (д), 114,66 (с), 103,67, 101,55 (2хд), 22,58 (OCH3), 30,48 (NCH3).
C34H30N4O4S2Рассчитано, %: C 65,6; H 4,9; N 9,0; S 10,3. Найдено, %: C 65,7; H 4,9; N 9,2; S 10,2. Получение соединения N 67. Аналогично из 5-метокси-1-метил-2-индолинтиона [соединение формулы (VIII), где R1 – 5-OMe, R3 – метил]; точка плавления: 148 – 150oC; и фенилизоцианата получают дисульфид бис[5-метокси-1-метилиндолил-3-N-фенилкарбоксамида-(2)] [соединение формулы (IV), где R1 – 5-OCH3, R2 – CONHPh, R3 – метил] (соединение N 67); точка плавления: 161 – 164oC. 1H ЯМР (CDCl3):  8,41 (1H, шир с, CONH), 7,55 (д, J=1,8 Гц, H-4), 7,18 (4H, м, 8,41 (1H, шир с, CONH), 7,55 (д, J=1,8 Гц, H-4), 7,18 (4H, м,  ), 7,00 (2H, м, H-6 и ), 7,00 (2H, м, H-6 и  ), 6,89 (1H, д, J=7,4 Гц, H-7), 3,82 (3H, с, OCH3), 3,68 (3H, с, NCH3).
13C ЯМР (CDCl3): ), 6,89 (1H, д, J=7,4 Гц, H-7), 3,82 (3H, с, OCH3), 3,68 (3H, с, NCH3).
13C ЯМР (CDCl3):  161,80 (CONH), 155,94, 137,87, 134,07 (3хс), 128,71, 123,68, 119,50, 117,48, 111,10, 102,29 (6хд), 55,63 (OCH3), 30,47 (NCH3).
C34H30N4O4S2 161,80 (CONH), 155,94, 137,87, 134,07 (3хс), 128,71, 123,68, 119,50, 117,48, 111,10, 102,29 (6хд), 55,63 (OCH3), 30,47 (NCH3).
C34H30N4O4S2Рассчитано, %: C 65,6; H 4,9; N 9,0; S 10,3. Найдено, %: C 65,3; H 5,1; N 9,2; S 10,4. Получение соединения N 68. Аналогичным методом из 6-метокси-1-метил-2-индолинтиона [соединение формулы (VIII), где R1 – 6-OMe, R3 – метил]; точка плавления: 133 – 136oC; и фенилизоцианата получают дисульфид бис[N-фенил-6-метокси-1-метилиндолил-3-карбоксамида- (2)] [соединение формулы (IV), в которой R1 – 6-OCH3, R2 – CONHPh, R3 – метил] (соединение N 68); точка плавления: 197 – 200oC. 1H ЯМР (CDCl3):  8,19 (1H, шир с, CONH), 7,91 (1H, д, J=8,9 Гц, H-4), 7,12 (4H, шир, 8,19 (1H, шир с, CONH), 7,91 (1H, д, J=8,9 Гц, H-4), 7,12 (4H, шир,  ), 6,97 (1H, м, ), 6,97 (1H, м,  ), 6,71 (1H, д, J=8,9 Гц, H-5), 6,25 (1H, шир, H-7), 3,74 (3H, с, OCH3), 3,70 (3H, с, NCH3).
13C ЯМР (CDCl3): ), 6,71 (1H, д, J=8,9 Гц, H-5), 6,25 (1H, шир, H-7), 3,74 (3H, с, OCH3), 3,70 (3H, с, NCH3).
13C ЯМР (CDCl3):  161,37 (CONH), 158,75, 139,82, 138,04, 128,65 (4xc), 128,50, 123,30, 123,12 (3хд), 120,64, 120,26 (2xc), 119,10, 113,22, 98,02 (Зхд), 55,26 (OCH3), 30,21 (NCH3).
C34H30N4O4S2 161,37 (CONH), 158,75, 139,82, 138,04, 128,65 (4xc), 128,50, 123,30, 123,12 (3хд), 120,64, 120,26 (2xc), 119,10, 113,22, 98,02 (Зхд), 55,26 (OCH3), 30,21 (NCH3).
C34H30N4O4S2Рассчитано, %: C 65,6; H 4,9; N 9,0; S 10,3. Найдено, %: C 65,5; H 4,8; N 9,2; S 10,4. Получение соединения N 69. Аналогично из 7-метокси-1-метил-2-индолинтиона [соединение формулы (VIII), где R1 – 7-OMe, R3 – метил]; точка плавления: 124 – 126oC; и фенилизоцианата получают дисульфид биc[N-фенил-7-метoкcи-1-метилиндoлил-3-кapбoкcaмидa-(2)] [соединение формулы (IV), в которой R1 – 7-OCH3, R2 – CONHPh, R3 – метил] (соединение N 69); точка плавления: 205 – 208oC. 1H ЯМР (CDCl3):  8,14 (1H, шир с, CONH), 7,57 (1H, д, J=8,2 Гц, H-4), 7,13 (4H, м, 8,14 (1H, шир с, CONH), 7,57 (1H, д, J=8,2 Гц, H-4), 7,13 (4H, м,  ), 6,96 (1H, м, ), 6,96 (1H, м,  ), 6,93 (1H, дд, J=8,2, 8,2 Гц, H-5), 6,48 (1H, д, J=8,2 Гц, H-6), 4,12 (3H, с, OCH3), 3,73 (3H, с, NCH3).
13C ЯМР (CDCl3): ), 6,93 (1H, дд, J=8,2, 8,2 Гц, H-5), 6,48 (1H, д, J=8,2 Гц, H-6), 4,12 (3H, с, OCH3), 3,73 (3H, с, NCH3).
13C ЯМР (CDCl3):  161,72 (CONH), 147,12, 137,99, 129,08 (3хс), 128,45 (д), 128,01 (с), 123,27, 122,35, 119,33, 114,13, 105,35 (5хд), 55,22 (OCH3), 33,73 (NCH3).
C34H30N4O4S2 161,72 (CONH), 147,12, 137,99, 129,08 (3хс), 128,45 (д), 128,01 (с), 123,27, 122,35, 119,33, 114,13, 105,35 (5хд), 55,22 (OCH3), 33,73 (NCH3).
C34H30N4O4S2Рассчитано, %: C 65,6; H 4,9; N 9,0; S 10,3. Найдено, %: C 64,9; H 5,0; N 9,0; S 10,4. Получение соединения N 71. Раствор 10 г (40 ммоль) 3-(метилтио)-5-(трифторметил) оксиндола в 100 мл уксусной кислоты нагревают при температуре флегмы в течение часа вместе с 13,3 г (0,2 моль) пылевидного цинка. Затем полученную смесь охлаждают и фильтруют, и осадок промывают уксусной кислотой. Объединенные фильтраты упаривают при пониженном давлении и остаток разбавляют 1 М водным аммиаком с получением 5-трифторметилоксиндола [соединение формулы (VI), где R1 – 5-CF3, R3 – водород]; выход: 7,22 г, 90% теории; точка плавления (из водного этанола): 188,5 – 191oC. 1H ЯМР (CDCl3):  8,74 (1H, с, NH), 7,52 (1H, д, J=8,2 Гц, H-6), 7,49 (1H, с, H-4), 6,97 (1H, д, J=8,2 Гц, H-7), 3,61 (2H, с, CH2).
К суспензии 5,03 г (25 ммоль) полученного на предыдущей стадии оксиндола в 100 мл воды, содержащей 1,5 г гидроокиси натрия, добавляют 4,7 г (37 ммоль) диметилсульфата. Полученную смесь нагревают при температуре 100oC в течение 10 минут, охлаждают, еще раз добавляют диметилсульфат и гидроокись натрия и еще раз коротко нагревают. После этого охлаждают и твердое вещество собирают и подвергают хроматографии на алюминии с использованием в качестве элюента смеси дихлорметана и гексана в соотношении 7:3, причем получают 1-метил-5-(трифторметил)-оксиндол [соединение формулы (VI), где R1 – 5-CF3, R3 – метил] ; выход: 3,5 г, 65% теории; точка плавления (из гексана): 127,5 – 129oC.
1H ЯМР (CDCl3): 8,74 (1H, с, NH), 7,52 (1H, д, J=8,2 Гц, H-6), 7,49 (1H, с, H-4), 6,97 (1H, д, J=8,2 Гц, H-7), 3,61 (2H, с, CH2).
К суспензии 5,03 г (25 ммоль) полученного на предыдущей стадии оксиндола в 100 мл воды, содержащей 1,5 г гидроокиси натрия, добавляют 4,7 г (37 ммоль) диметилсульфата. Полученную смесь нагревают при температуре 100oC в течение 10 минут, охлаждают, еще раз добавляют диметилсульфат и гидроокись натрия и еще раз коротко нагревают. После этого охлаждают и твердое вещество собирают и подвергают хроматографии на алюминии с использованием в качестве элюента смеси дихлорметана и гексана в соотношении 7:3, причем получают 1-метил-5-(трифторметил)-оксиндол [соединение формулы (VI), где R1 – 5-CF3, R3 – метил] ; выход: 3,5 г, 65% теории; точка плавления (из гексана): 127,5 – 129oC.
1H ЯМР (CDCl3):  7,58 (1H, д, J=8,2 Гц, H-6), 7,50 (1H, с, H-4), 6,89 (1H, д, J=8,2 Гц, H-7), 3,58 (2H, с, CH2), 3,25 (3H, с, CH3).
C10H8N4F3NO 7,58 (1H, д, J=8,2 Гц, H-6), 7,50 (1H, с, H-4), 6,89 (1H, д, J=8,2 Гц, H-7), 3,58 (2H, с, CH2), 3,25 (3H, с, CH3).
C10H8N4F3NOРассчитано, %: C 55,8; H 3,8; N 6,5. Найдено, %: C 55,5; H 3,8; N 6,5. Путем реакции данного соединения с пентасульфидом фосфора получают 1-метил-(5-трифторметил)-2-индолинтион [соединение формулы (VIII), где R1 -5-CF3, R3 – метил]; выход: 96% теории; точка плавления: 124,5 – 126oC. 1H ЯМР (CDCl3):  7,63 (1H, дд, J=8,3, 0,8 Гц, H-6), 7,54 (1H, д, J=0,8 Гц, H-4), 7,03 (1H, д, J=8,3 Гц, H-7), 4,15 (2H, с, C-3), 3,64 (3H, с, N-CH3).
13C ЯМР: 7,63 (1H, дд, J=8,3, 0,8 Гц, H-6), 7,54 (1H, д, J=0,8 Гц, H-4), 7,03 (1H, д, J=8,3 Гц, H-7), 4,15 (2H, с, C-3), 3,64 (3H, с, N-CH3).
13C ЯМР:  202,28 (C-2), 149,34 (с), 129,60 (с), 126,54 (J=32,5 Гц, C-5), 125,9 (J= 4,0 Гц), 124,21 (J=271,9 Гц, CF3), 121,00 (J=3,8 Гц), 109,28 (д), 48,75 (C-3), 31,35 (N-CH3).
C10H8F3NS 202,28 (C-2), 149,34 (с), 129,60 (с), 126,54 (J=32,5 Гц, C-5), 125,9 (J= 4,0 Гц), 124,21 (J=271,9 Гц, CF3), 121,00 (J=3,8 Гц), 109,28 (д), 48,75 (C-3), 31,35 (N-CH3).
C10H8F3NSРассчитано, %: C 51,9; H 3,5; N 6,3; S 14,1. Найдено, %: C 52,0; H 3,7; N 6,3; S 14,1. Путем реакции данного соединения с фенилизоцианатом получают 2,2′-дитиобис[N-фенил-1-метил-5-(трифторметил)индолил-3-карбоксамид] (соединение N 71) [соединение формулы (IV), где R1 – 5-CF3, R2 – CONHPh, R3 – метил]; выход: 71% теории; точка плавления: 214 – 216oC. 1H ЯМР ((CD3)2SO):  9,53 (1H, с, CONH), 8,14 (1H, шир с, H-4), 7,59 (4H, д, J=8,8 Гц, H-7), 7,53 (1H, дд, J=8,8, 1,5 Гц, H-6), 7,12 – 7,09 (4H, м, ArH), 6,97 (1H, м, ArH), 3,76 (3H, с, N-CH3).
13C ЯМР: 9,53 (1H, с, CONH), 8,14 (1H, шир с, H-4), 7,59 (4H, д, J=8,8 Гц, H-7), 7,53 (1H, дд, J=8,8, 1,5 Гц, H-6), 7,12 – 7,09 (4H, м, ArH), 6,97 (1H, м, ArH), 3,76 (3H, с, N-CH3).
13C ЯМР:  160,49 (CONH), 138,93 (с), 138,21 (с), 131,76 (с), 128,19 (д), 124,96 (J= 271,6 Гц, CF3), 124,60 (д), 119,21 (с), 119,09 (д), 118,57 (J=4,1 Гц), 30,46 (N-CH3).
C34H24F6N4O2S2 160,49 (CONH), 138,93 (с), 138,21 (с), 131,76 (с), 128,19 (д), 124,96 (J= 271,6 Гц, CF3), 124,60 (д), 119,21 (с), 119,09 (д), 118,57 (J=4,1 Гц), 30,46 (N-CH3).
C34H24F6N4O2S2Рассчитано, %: C 58,4; H 3,5; N 8,0; S 9,2. Найдено, %: C 58,5; H 3,8; N 7,9; S 9,3. Получение соединения N 72. В результате метилирования 6-хлороксиндола [соединение формулы (VI), где R1 -6-Cl, R3 – водород] вышеописанным методом с использованием диметилсульфата в присутствии гидроокиси натрия получают 6-хлор-1-метилоксиндол [соединение формулы (VI), где R1 – 6-Cl, R3 – метил]; точка плавления (из водного этанола): 119,5 – 122oC. 1H ЯМР (CDCl3):  7,15 (1H, д, J=7,8 Гц, H-4), 7,01 (1H, дд, J=7,8, 1,8 Гц, H-5), 6,82 (1H, д, J=1,7 Гц, H-7), 3,49 (2H, с, CH2), 3,19 (3H, с, CH3).
C9H8ClNO 7,15 (1H, д, J=7,8 Гц, H-4), 7,01 (1H, дд, J=7,8, 1,8 Гц, H-5), 6,82 (1H, д, J=1,7 Гц, H-7), 3,49 (2H, с, CH2), 3,19 (3H, с, CH3).
C9H8ClNOРассчитано, %: C 59,5; H 4,4; N 7,7. Найдено, %: C 59,6; H 4,6; N 7,6. Путем реакции данного соединения с пентасульфидом фосфора получают 6-хлор-1-метил-2-индолинтион [соединение формулы (VIII), где R1 – 6-Cl, R3 – метил] ; выход: 87% теории; точка плавления (из смеси этилацетата и петролейного эфира): 162 – 165oC. 1H ЯМР (CDCl3):  7,20 (1H, д, J=7,9 Гц, H-4), 7,13 (1H, дд, J=7,9, 1,7 Гц, H-5), 6,96 (1H, д, J=1,7 Гц, H-7), 4,06 (2H, с, H-3), 3,59 (3H, с, N-CH3).
13C ЯМР: 7,20 (1H, д, J=7,9 Гц, H-4), 7,13 (1H, дд, J=7,9, 1,7 Гц, H-5), 6,96 (1H, д, J=1,7 Гц, H-7), 4,06 (2H, с, H-3), 3,59 (3H, с, N-CH3).
13C ЯМР:  202,00 (C-2), 147,76 (с), 133,98 (с), 127,35 (с), 124,64 (д), 124,06 (д), 110,20 (д), 48,59 (C-3), 31,29 (N-CH3).
C9H8ClN2O 202,00 (C-2), 147,76 (с), 133,98 (с), 127,35 (с), 124,64 (д), 124,06 (д), 110,20 (д), 48,59 (C-3), 31,29 (N-CH3).
C9H8ClN2OРассчитано, %: C 54,7; H 4,1; N 7,1; S 16,2. Найдено, %: C 54,8; H 4,1; N 7,0; S 16,3. Путем реакции данного соединения с фенилизоцианатом получают дисульфид бис[N-фенил-6-хлор-1-метилиндолил-3-карбоксамид-(2)] (соединение N 72) [соединение формулы (IV), где R1 – 6-Cl, R2 – CONHPh, R3 – метил]; выход: 61% теории; точка плавления: 243 – 245oC. 1H ЯМР ((CD3)2SO):  9,43 (1H, шир, CONH), 7,77 (1H, д, J=8,6 Гц, H-4), 7,46 (1H, д, J=1,4 Гц, H-7), 7,19 – 7,09 (5H, м, ArH), 7,01 (1H, м, ArH), 3,67 (3H, с, N-CH3).
13C ЯМР: 9,43 (1H, шир, CONH), 7,77 (1H, д, J=8,6 Гц, H-4), 7,46 (1H, д, J=1,4 Гц, H-7), 7,19 – 7,09 (5H, м, ArH), 7,01 (1H, м, ArH), 3,67 (3H, с, N-CH3).
13C ЯМР:  60,66 (CONH), 138,29 (с), 138,04 (с), 129,87 (с), 129,41 (с), 128,15 (д), 123,94 (с), 122,91 (д), 122,37 (д), 121,70 (д), 119,20 (с), 119,12 (д), 110,69 (д), 30,22 (N-CH3).
C32H24Cl2N4O2S2 60,66 (CONH), 138,29 (с), 138,04 (с), 129,87 (с), 129,41 (с), 128,15 (д), 123,94 (с), 122,91 (д), 122,37 (д), 121,70 (д), 119,20 (с), 119,12 (д), 110,69 (д), 30,22 (N-CH3).
C32H24Cl2N4O2S2Рассчитано, %: C 60,9; H 3,8; N 8,9; S 10,2. Найдено, %: C 60,9; H 4,0; N 8,7; S 10,2. Получение соединения N 73. Аналогичным образом из 1-метил-5-нитро-2-оксиндола получают 1-метил-5-нитро-2-индолинтион [соединение формулы (VIII), где R1 – 5-NO2, R3 – метил]; выход: 68% теории; точка плавления (из смеси этилацетата и петролейного эфира): выше 330oC. 1H ЯМР ((CD3)2SO):  8,28 (1H, дд, J=8,7, 1,7 Гц, H-6), 8,17 (1H, д, J= 1,7 Гц, H-4), 7,41 (1H, д, J=8,7 Гц, H-7), 4,26 (2H, с, H-3), 3,60 (3H, с, N-CH3).
13C ЯМР: 8,28 (1H, дд, J=8,7, 1,7 Гц, H-6), 8,17 (1H, д, J= 1,7 Гц, H-4), 7,41 (1H, д, J=8,7 Гц, H-7), 4,26 (2H, с, H-3), 3,60 (3H, с, N-CH3).
13C ЯМР:  203,48 (C-2), 151,49 (с), 143,81 (с), 130,53 (с), 124,80 (д), 119,00 (д), 110,24 (д), 48,45 (C-3), 31,34 (N-CH3).
C9H8N2SO2 203,48 (C-2), 151,49 (с), 143,81 (с), 130,53 (с), 124,80 (д), 119,00 (д), 110,24 (д), 48,45 (C-3), 31,34 (N-CH3).
C9H8N2SO2Рассчитано: М+ 208,0306. Найдено: М+ 208,0311 (масс-спектр). Путем реакции данного соединения с фенилизоцианатом получают 2,2′-дитиобис-[N-фенил-1-метил-5-нитроиндолил-3-карбоксамид] (соединение N 73) [соединение формулы (IV), где R1 – 5-NO2, R2 – CONHPh, R3 – метил]; выход: 52% теории; точка плавления: 236 – 240oC (разложение). 1H ЯМР ((CD3)2CO):  9,68 (1H, шир, CONH), 8,64 (1H, д, J=1,6 Гц, H, H-4), 8,07 (1H, дд, J=8,8, 1,6 Гц, H-6), 7,56 (1H, д, J=8,8 Гц, H-7), 7,18 – 7,08 (4H, м, ArH), 6,98 (1H, т, J=6,8 Гц, ArH), 3,79 (3H, с, N-CH3).
13C ЯМР: 9,68 (1H, шир, CONH), 8,64 (1H, д, J=1,6 Гц, H, H-4), 8,07 (1H, дд, J=8,8, 1,6 Гц, H-6), 7,56 (1H, д, J=8,8 Гц, H-7), 7,18 – 7,08 (4H, м, ArH), 6,98 (1H, т, J=6,8 Гц, ArH), 3,79 (3H, с, N-CH3).
13C ЯМР:  160,04 (CONH), 141,96 (с), 140,17 (с), 138,22 (с), 128,24 (д), 124,35 (с), 123,09 (д), 120,25 (с), 118,90 (д), 117,76 (д), 111,64 (д), 30,70 (N-CH3).
C32H24N6O6S2 160,04 (CONH), 141,96 (с), 140,17 (с), 138,22 (с), 128,24 (д), 124,35 (с), 123,09 (д), 120,25 (с), 118,90 (д), 117,76 (д), 111,64 (д), 30,70 (N-CH3).
C32H24N6O6S2 0,2H2O 0,2H2OРассчитано, %: C 55,8; H 4,1; N 12,2. Найдено, %: C 55,5; H 3,9; N 12,0. C32H25N6S2O6 Рассчитано: [M+H]+ 653,1277. Найдено: [М+H]+ 653,1275 (МC в результате бомбардировки быстрыми атомами). Получение соединения N 74. Аналогичным методом из 5-фтор-1-метилоксиндола получают 5- фтор-1-метил-2-инолинтион [соединение формулы (VIII), где R1 означает 5-F, R3 – метил]; выход: 93% теории; точка плавления: 155 – 157oC. 1H ЯМР (CDCl3):  7,11 – 6,99 (2H, м, H-4,6), 6,88 (1H, дд, J=9,3, 4,2 Гц, H-7), 4,09 (2H, с, H-3), 3,61 (3H, с, N-CH3).
13C ЯМР: 7,11 – 6,99 (2H, м, H-4,6), 6,88 (1H, дд, J=9,3, 4,2 Гц, H-7), 4,09 (2H, с, H-3), 3,61 (3H, с, N-CH3).
13C ЯМР:  200,61 (C-2), 160,49 (J=243,6 Гц, C-5), 142,76 (с), 130,80 (J=8,6 Гц, C-3a), 114,48 (J=24,1 Гц), 112,13 (J=25,1 Гц), 109,94 (J=8,6 Гц), 48,96 (J=1,8 Гц, C-3), 31,38 (N-CH3).
C9H8FNS 200,61 (C-2), 160,49 (J=243,6 Гц, C-5), 142,76 (с), 130,80 (J=8,6 Гц, C-3a), 114,48 (J=24,1 Гц), 112,13 (J=25,1 Гц), 109,94 (J=8,6 Гц), 48,96 (J=1,8 Гц, C-3), 31,38 (N-CH3).
C9H8FNSРассчитано, %: C 59,7; H 4,5; N 7,7; S 17,7. Найдено, %: C 59,7; H 4,6; N 7,8; S 17,4. Путем взаимодействия указанного соединения с фенилизоцианатом получают 2,2′-дитиобис[N-фенил-5-фтор-1-метилиндолил-3-карбоксамид] (соединение N 74) [соединение формулы (IV), где R1 означает 5-F, R2 – CONHPh, R3 – метил]; выход: 74% теории; точка плавления: 205 – 207oC. 1H ЯМР (CDCl3):  8,17 (1H, шир, CONH), 7,64 (1H, дд, J=9,4, 2,0 Гц, Н-4), 7,17 (4H, шир д, ArH), 7,00 (1H, м, ArH), 6,95 – 6,88 (2H, м, ArH), 3,78 (3H, с, N-CH3).
13C ЯМР: 8,17 (1H, шир, CONH), 7,64 (1H, дд, J=9,4, 2,0 Гц, Н-4), 7,17 (4H, шир д, ArH), 7,00 (1H, м, ArH), 6,95 – 6,88 (2H, м, ArH), 3,78 (3H, с, N-CH3).
13C ЯМР:  161,17 (CONH), 158,97 (J=239,4 Гц, C-5), 138,02 (с), 135,71 (с), 128,69 (д), 123,69 (д), 118,87 (д), 114,66 (J=27,1 Гц), 111,14 (J=10,0 Гц), 106,92 (J=25,5 Гц), 30,61 (N-CH3).
C32H24F2N4O2S2 161,17 (CONH), 158,97 (J=239,4 Гц, C-5), 138,02 (с), 135,71 (с), 128,69 (д), 123,69 (д), 118,87 (д), 114,66 (J=27,1 Гц), 111,14 (J=10,0 Гц), 106,92 (J=25,5 Гц), 30,61 (N-CH3).
C32H24F2N4O2S2Рассчитано, %: C 64,2; H 4,0; N 9,4; S 10,7. Найдено, %: C 63,9; H 4,2; N 9,3; S 10,7. Получение соединения N 75. Аналогичным образом из 5-бром-1-метил-2-индолинтиона [соединение формулы (VIII), где R1 означает 5-Br, R3 – метил]; точка плавления: 137 – 139oC; и фенилизоцианата получают 2,2′-дитиoбиc[N-фенил-5-бpoм-1-метилиндoлил-3-кapбoкcaмид] (соединение N 75) [соединение формулы (IV), где R1 означает 5-Br, R2 – CONHPh, R3 – метил]; выход: 68% теории; точка плавления: 219 – 221oC. 1H ЯМР (CDCl3):  8,14 (1H, шир, CONH), 8,10 (1H, д, J=1,6 Гц, H-4), 7,21 – 7,12 (5H, м, ArH), 7,01 (1H, м, ArH), 6,83 (1H, шир д, J-8,2 Гц, ArH), 3,73 (3H, с, N-CH3).
13C ЯМР: 8,14 (1H, шир, CONH), 8,10 (1H, д, J=1,6 Гц, H-4), 7,21 – 7,12 (5H, м, ArH), 7,01 (1H, м, ArH), 6,83 (1H, шир д, J-8,2 Гц, ArH), 3,73 (3H, с, N-CH3).
13C ЯМР:  161,04 (CONH), 137,68 (с), 137,00 (с), 128,75 (д), 128,60 (д), 127,13 (с), 124,29 (д), 123,78 (д), 118,82 (д), 115,92 (с), 111,46 (д), 30,48 (N-CH3).
C32H24Br2N4O2S2 161,04 (CONH), 137,68 (с), 137,00 (с), 128,75 (д), 128,60 (д), 127,13 (с), 124,29 (д), 123,78 (д), 118,82 (д), 115,92 (с), 111,46 (д), 30,48 (N-CH3).
C32H24Br2N4O2S2Рассчитано, %: C 53,3; H 3,4; N 7,8; S 8,9. Найдено, %: C 53,1; H 3,5; N 7,7; S 8,9. Получение соединения N 76. Раствор 1,20 г (6,77 ммоль) 4-метокси-1-метил-2-оксиндола [соединение формулы (VI), где R1 – 4-OMe, R3 – метил] в 40 мл 48%-ного раствора бромистого водорода в ледяной уксусной кислоте нагревают с обратным холодильником в течение 6 часов, после чего выливают в воду. Осадок сырого фенола отфильтровывают, тщательно промывают водой и сушат, а затем при температуре 20oC в течение часа подвергают ацетилированию ацетангидридом в среде пиридина. Растворители удаляют в вакууме и остаток распределяют между этилацетатом и 3н. соляной кислотой. В результате хроматографии органического остатка на силикагеле с использованием в качестве элюента смеси этилацетата и петролейного эфира получают 4-ацетокси-1-метилоксиндол [соединение формулы (VI), где R1 – 4-OAc, R3 – метил]; выход: 75% теории; точка плавления: 109 – 111oC. 1H ЯМР (CDCl3): 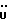 7,30 (1H, дд, J=8,2, 7,7 Гц, H-6), 6,78 (1H, д, J=8,2 Гц, H-7), 6,71 (1H, д, J=7,7 Гц, H-5), 3,41 (2H, с, H-3), 3,22 (3H, с, N-CH3), 2,32 (3H, с, OCOCH3).
13C ЯМР: 7,30 (1H, дд, J=8,2, 7,7 Гц, H-6), 6,78 (1H, д, J=8,2 Гц, H-7), 6,71 (1H, д, J=7,7 Гц, H-5), 3,41 (2H, с, H-3), 3,22 (3H, с, N-CH3), 2,32 (3H, с, OCOCH3).
13C ЯМР: 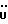 174,26 (С-2), 168,30 174,26 (С-2), 168,30 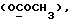 164,71 (с), 146,58 (с), 129,12, 116,62 (с), 115,83 (д), 105,90 (д), 33,74 (C-3), 26,51 (N-CH3), 20,83 164,71 (с), 146,58 (с), 129,12, 116,62 (с), 115,83 (д), 105,90 (д), 33,74 (C-3), 26,51 (N-CH3), 20,83 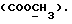 C11H11NO3 Рассчитано, %: C 64,4; H 5,4; N 6,8. Найдено, %: C 64,3; H 5,4; N 7,0. Путем взаимодействия данного соединения с пентасульфидом фосфора получают 4-ацетокси-1-метил-2-индолинтион [соединение формулы (VIII), где R1 – 4-OAc, R3 – метил]; выход: 94% теории; точка плавления: 156oC. 1H ЯМР (CDCl3):  7,35 (1H, дд, J=8,2, 7,9 Гц, H-6), 6,90 (1H, д, J=8,2 Гц, H-7), 6,86 (1H, д, J=7,9 Гц, H-5), 4,00 (2H, с, H-3), 3,61 (3H, с, N-CH3), 2,32 (3H, с, OCOCH3).
13C ЯМР: 7,35 (1H, дд, J=8,2, 7,9 Гц, H-6), 6,90 (1H, д, J=8,2 Гц, H-7), 6,86 (1H, д, J=7,9 Гц, H-5), 4,00 (2H, с, H-3), 3,61 (3H, с, N-CH3), 2,32 (3H, с, OCOCH3).
13C ЯМР:  200,75 (C-2), 168,14 200,75 (C-2), 168,14 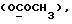 148,30 (с), 146,27 (с), 129,44 (д), 121,18 (с), 117,69 (д), 107,32 (д), 47,09 (C-3), 31,57 (N-CH3), 20,81 148,30 (с), 146,27 (с), 129,44 (д), 121,18 (с), 117,69 (д), 107,32 (д), 47,09 (C-3), 31,57 (N-CH3), 20,81 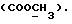 C11H11NO2S Рассчитано, %: C 59,7; H 5,0; N 6,3; S 14,5. Найдено, %: C 59,4; H 5,2; N 6,6; S 14,5. Путем реакции с фенилацетатом получают 2,2′-дитиобис[N- фенил-4-ацетокси-1-метилиндолил-3-карбоксамид] (соединение N 76) [соединение формулы (IV), где R1 означает 4-OAc, R2 – CONHPh, R3 – метил]; выход: 31% теории; точка плавления: 194oC. 1H ЯМР ((CD3)2SO):  9,92 (1H, с, CONH), 7,34 – 7,27 (4H, м, H-5,7,2′, 6′), 7,14 (2H, дд, J=7,8, 7,6 Гц, H-3′,5′), 6,98 (1H, т, J=7,8 Гц, H-5′), 6,89 (1H, дд, J=8,0, 7,8 Гц, H-5), 3,66 (3H, с, NCH3), 1,95 (3H, с, OCH3).
13C ЯMP: 9,92 (1H, с, CONH), 7,34 – 7,27 (4H, м, H-5,7,2′, 6′), 7,14 (2H, дд, J=7,8, 7,6 Гц, H-3′,5′), 6,98 (1H, т, J=7,8 Гц, H-5′), 6,89 (1H, дд, J=8,0, 7,8 Гц, H-5), 3,66 (3H, с, NCH3), 1,95 (3H, с, OCH3).
13C ЯMP:  168,57 168,57 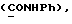 162,09 162,09 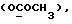 142,91 (с), 139,20 (с), 138,75 (с), 129,01 (с), 128,38 (д), 124,56 (д), 123,14 (д), 119,23 (с), 118,38 (д), 117,70 (с), 113,94 (д), 108,70 (д), 30,39 (N-CH3), 20,32 142,91 (с), 139,20 (с), 138,75 (с), 129,01 (с), 128,38 (д), 124,56 (д), 123,14 (д), 119,23 (с), 118,38 (д), 117,70 (с), 113,94 (д), 108,70 (д), 30,39 (N-CH3), 20,32 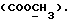 C36H30N4O6S2 Рассчитано: 679,1685. Найдено: [М+H] + 679,1705 (МC в результате бомбардировки быстрыми атомами). Получение соединения N 77. Путем деметилирования и ацетилирования 5-метокси-1-метил-2-оксиндола [соединение формулы (VI), где R1 означает 5-OMe, R3 – метил] получают 5-ацетокси-1-метил-2-оксиндол [соединение формулы (VII), где R1 означает 5-OAc, R3 – метил]; выход: 70% теории; точка плавления (из смеси этилацетата и петролейного эфира): 104 – 106oC. 1H ЯМР (CDCl3):  7,01 (1H, шир с, H-4), 7,00 (1H, дд, J=9,1, 2,4 Гц, H-6), 3,53 (2H, с, H-3), 3,20 (3H, с, N-CH3), 2,30 (3H, с, OCOCH3).
13C ЯМР: 7,01 (1H, шир с, H-4), 7,00 (1H, дд, J=9,1, 2,4 Гц, H-6), 3,53 (2H, с, H-3), 3,20 (3H, с, N-CH3), 2,30 (3H, с, OCOCH3).
13C ЯМР:  174,79 (C-2), 169,96 174,79 (C-2), 169,96 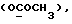 146,08 (с), 142,96 (с), 125,50 (с), 120,84 (д), 118,54 (д), 108,25 (д), 35,89 (C-3), 26,30 (N-CH3), 21,04 146,08 (с), 142,96 (с), 125,50 (с), 120,84 (д), 118,54 (д), 108,25 (д), 35,89 (C-3), 26,30 (N-CH3), 21,04 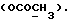 C11H11NO3 Рассчитано, %: C 64,4; H 5,4; N 6,8. Найдено, %: C 64,4; H 5,4; N 6,8. Путем взаимодействия данного соединения с пентасульфидом фосфора получают 5-ацетокси-1-метил-2-индолинтион [соединение формулы (VIII), где R1 означает 5-OAc, R3 – метил] ; выход: 86% теории; точка плавления: 134 – 135,5oC. 1H ЯМР (CDCl3):  7,06 (2H, шир с, H-4,6), 6,93 (1H, д, J=8,6 Гц, H-7), 4,08 (2H, с, H-3), 3,60 (3H, с, N-CH3), 2,31 (3H, с, OCOCH3).
13C ЯМР: 7,06 (2H, шир с, H-4,6), 6,93 (1H, д, J=8,6 Гц, H-7), 4,08 (2H, с, H-3), 3,60 (3H, с, N-CH3), 2,31 (3H, с, OCOCH3).
13C ЯМР:  200,86 (C-2), 169,62 200,86 (C-2), 169,62 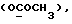 147,62 (с), 144,14 (с), 130,10 (с), 120,97 (д), 117,99 (д), 109,62 (д), 48,79 (C-3), 31,24 (N-CH3), 20,94 147,62 (с), 144,14 (с), 130,10 (с), 120,97 (д), 117,99 (д), 109,62 (д), 48,79 (C-3), 31,24 (N-CH3), 20,94 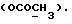 C11H11NO2S Рассчитано, %: C 59,7; H 5,0; N 6,3; S 14,5. Найдено, %: C 59,6; H 5,2; N 6,2; S 14,6. Путем реакции с фенилизоцианатом получают 2,2′-дитиобис[N- фенил-5-ацетокси-1-метилиндолил-3-карбоксамид] (соединение N 77) [соединение формулы (IV), где R1 означает 5-OAc, R2 – CONHPh, R3 – метил]; выход: 45% теории; точка плавления: 147 – 150oC. 1H ЯМР ((CD3)2SO):  9,60 (1H, шир, CONH), 7,54 (1H, д, J=1,9 Гц, H-4), 7,42 (1H, д, J=8,9 Гц, H-7), 7,23 (2H, д, J=7,8 Гц, H-2′,6′), 7,17 (2H, дд, J= 7,8, 7,1 Гц, H-3′,5′), 7,06 (1H, дд, J=8,9, 1,9 Гц, H-6), 6,98 (1H, т, J= 7,1 Гц, H-4), 3,66 (3H, с, NCH3), 2,29 (3H, с, OCOCH3).
1H ЯМР: 9,60 (1H, шир, CONH), 7,54 (1H, д, J=1,9 Гц, H-4), 7,42 (1H, д, J=8,9 Гц, H-7), 7,23 (2H, д, J=7,8 Гц, H-2′,6′), 7,17 (2H, дд, J= 7,8, 7,1 Гц, H-3′,5′), 7,06 (1H, дд, J=8,9, 1,9 Гц, H-6), 6,98 (1H, т, J= 7,1 Гц, H-4), 3,66 (3H, с, NCH3), 2,29 (3H, с, OCOCH3).
1H ЯМР:  169,52 (CONH), 161,18 169,52 (CONH), 161,18 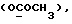 145,27 (с), 138,49 (с), 135,41 (с), 128,31 (д), 125,46 (с), 122,94 (д), 119,15 (д), 112,82 (д), 111,43 (д), 30,26 (N-CH3), 20,80 145,27 (с), 138,49 (с), 135,41 (с), 128,31 (д), 125,46 (с), 122,94 (д), 119,15 (д), 112,82 (д), 111,43 (д), 30,26 (N-CH3), 20,80 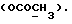 C36H30N4O6S2  0,5H2O 0,5H2OРассчитано, %: C 62,9; H 4,5; N 8,2; S 9,3. Найдено, %: C 63,1; H 4,6; N 8,2; S 9,5. Получение соединения N 78. К размешиваемой суспензии 0,25 г (0,37 ммоль) 5-ацетоксидисульфида (соединение N 91) в 15 мл метанола при температуре 20oC в течение 10 минут добавляют 0,05 г (1,32 ммоль) борана натрия. После этого добавляют 2 мл 3 н. гидроокиси калия и по истечении дальнейших 15 минут раствор разбавляют водой и экстрагируют дихлорметаном. Получаемое масло сразу растворяют в 3 мл метанола и смешивают с 0,10 мл 35%-ной перекиси водорода. Затем раствор охлаждают при температуре -30oC в течение 48 часов и путем фильтрации получают 2,2′-дитиобис(N-фенил-5-окси-1-метилиндол-3-карбоксамид) (соединение N 78) [соединение формулы (IV), где R1 означает 5-OH, R2 – CONHPh, R3 – метил]; выход: 41 мг, 19% теории; точка плавления: 185 – 187oC. 1H ЯМР ((CD3)2SO):  9,50 (1H, с, CONH), 9,15 (1H, шир, OH), 7,32 (2H, д, J= 7,8 Гц, H-2′,6′), 7,27 (1H, д, J=8,9 Гц, H-7), 7,19 (1H, д, J=2,3 Гц, H-4), 7,18 (2H, дд, J=7,8, 7,4 Гц, H-3′,5′), 6,99 (1H, т, J=7,4 Гц, H-4′), 6,83 (1H, дд, J=8,9, 2,3 Гц, H-6), 3,51 (3H, с, N-CH3).
C32H26N4O4S2 9,50 (1H, с, CONH), 9,15 (1H, шир, OH), 7,32 (2H, д, J= 7,8 Гц, H-2′,6′), 7,27 (1H, д, J=8,9 Гц, H-7), 7,19 (1H, д, J=2,3 Гц, H-4), 7,18 (2H, дд, J=7,8, 7,4 Гц, H-3′,5′), 6,99 (1H, т, J=7,4 Гц, H-4′), 6,83 (1H, дд, J=8,9, 2,3 Гц, H-6), 3,51 (3H, с, N-CH3).
C32H26N4O4S2 H2O H2OРассчитано, %: C 64,6; H 4,4; N 9,4. Найдено, %: C 62,7; H 4,6; N 9,1. Получение соединения N 79. В результате деметилирования и ацетилирования 6-метокси-1-метил-2-оксиндола [соединение формулы (VI), где R1 – 6-OMe, R3 – метил] получают 6-ацетокси-1-метил-2-оксиндол [соединение формулы (VII), где R1 означает 6-OAc, R3 – метил]; выход: 81% теории; точка плавления: 119 – 121oC. 1H ЯМР (CDCl3):  7,22 (1H, д, J=7,9 Гц, H-4), 6,74 (1H, дд, J=7,9, 2,1 Гц, H-5), 6,59 (1H, д, J=2,1 Гц, H-7), 3,49 (2H, с, H-3), 3,18 (3H, с, N-CH3), 2,31 (3H, с, OCOCH3).
13C ЯМР: 7,22 (1H, д, J=7,9 Гц, H-4), 6,74 (1H, дд, J=7,9, 2,1 Гц, H-5), 6,59 (1H, д, J=2,1 Гц, H-7), 3,49 (2H, с, H-3), 3,18 (3H, с, N-CH3), 2,31 (3H, с, OCOCH3).
13C ЯМР:  175,28 (C-2), 169,57 175,28 (C-2), 169,57  150,74 (с), 146,23 (с), 124,83 (д), 121,81 (с), 115,00 (д), 102,68 (д), 35,33 (С-3), 26,27 (N-CH3), 21,09 150,74 (с), 146,23 (с), 124,83 (д), 121,81 (с), 115,00 (д), 102,68 (д), 35,33 (С-3), 26,27 (N-CH3), 21,09  С11H11NO3 Рассчитано, %: C 64,4; H 5,4; N 6,8. Найдено, %: C 64,5; H 5,5; N 6,9. Путем взаимодействия данного соединения с пентасульфидом фосфора получают 6-ацетокси-1-метил-2-индолинтион [соединение формулы (VIII), где R1 означает 6-OAc, R3 – метил]; выход: 91% теории; точка плавления: 131 – 133oC. 1H ЯМР (CDCl3):  7,27 (1H, д, J=8,0 Гц, H-4), 6,87 (1H, дд, J=8,0, 1,9 Гц, H-5), 6,75 (1H, д, J-1,9 Гц, H=7), 4,08 (2H, с, H-3), 3,58 (с, N-CH3), 2,33 (3H, с, OCOCH3).
13C ЯМР: 7,27 (1H, д, J=8,0 Гц, H-4), 6,87 (1H, дд, J=8,0, 1,9 Гц, H-5), 6,75 (1H, д, J-1,9 Гц, H=7), 4,08 (2H, с, H-3), 3,58 (с, N-CH3), 2,33 (3H, с, OCOCH3).
13C ЯМР:  202,18 (C-2), 169,44 202,18 (C-2), 169,44  150,80 (с), 147,57 (с), 126,38 (с), 124,32 (д), 117,05 (д), 104,06 (д), 48,62 (C-3), 31,33 (N-CH3), 21,09 150,80 (с), 147,57 (с), 126,38 (с), 124,32 (д), 117,05 (д), 104,06 (д), 48,62 (C-3), 31,33 (N-CH3), 21,09  C11H11NO2S Рассчитано, %: C 59,7; H 5,0; N 6,3; S 14,5. Найдено, %: C 59,4; H 5,2; N 6,1; S 14,3. Путем реакции данного соединения с фенилизоцианатом получают 2,2′-дитиобис[N-фенил-6-ацетокси-1-метилиндолил-3-карбоксамид] (соединение N 79) [соединение формулы (IV), где R1 – 6-OAc, R2 – CONHPh, R3 – метил]; выход: 53% теории; точка плавления: 219 – 222oC. 1H ЯМР ((CD3)2SO):  9,71 (1H, шир с, CONH), 7,78 (1H, д, J=8,7 Гц, H-4), 7,27 (3H, м, H-2′,6′), 7,18 (2H, дд, J=8,2, 7,3 Гц, H-3′,5′), 6,99 (1H, т, J= 7,3 Гц, H-4′), 6,95 (1H, дд, J=8,7, 1,8 Гц, H-5), 3,60 (3H, с, NCH3), 2,32 (3H, с, OCOCH3).
13C ЯМР: 9,71 (1H, шир с, CONH), 7,78 (1H, д, J=8,7 Гц, H-4), 7,27 (3H, м, H-2′,6′), 7,18 (2H, дд, J=8,2, 7,3 Гц, H-3′,5′), 6,99 (1H, т, J= 7,3 Гц, H-4′), 6,95 (1H, дд, J=8,7, 1,8 Гц, H-5), 3,60 (3H, с, NCH3), 2,32 (3H, с, OCOCH3).
13C ЯМР:  169,31 169,31 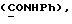 161,23 161,23 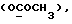 147,99 (с), 138,54 (с), 137,66 (с), 128,29 (д), 123,13 (с), 122,98 (д), 121,48 (д), 119,38 (д), 118,73 (с), 116,34 (д), 103,76 (д), 30,17 (N-CH3), 20,81 147,99 (с), 138,54 (с), 137,66 (с), 128,29 (д), 123,13 (с), 122,98 (д), 121,48 (д), 119,38 (д), 118,73 (с), 116,34 (д), 103,76 (д), 30,17 (N-CH3), 20,81 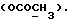 C36H30N4O6S2 Рассчитано, %: C 63,7; H 4,5; N 8,3; S 9,4. Найдено, %: C 63,7; H 4,4; N 8,2; S 9,8. Получение соединения N 80. Путем аналогичной обработки 6-ацетоксидисульфида (соединение N 79) получают 2,2′-дитиобис(6-окси-1-метил-N-фенил-1H-индол-3-карбоксамид) (соединение N 80) [соединение формулы (IV), где R1 – 6-OH, R2 – CONHPh, R3 – метил]; точка плавленая: 185 – 187oC (разложение). 1H ЯМР ((CD3)2SO):  10,01, 9,43 (2H, 2с, OH и CONH), 7,76 (1H, д, J=7,9 Гц, H-4), 7,35 (2H, д, J=7,6 Гц, H-2′,6′), 7,31 (1H, д, J=2,2 Гц, H-7), 7,10 (2H, дд, J=7,6, 7,4 Гц, 10,01, 9,43 (2H, 2с, OH и CONH), 7,76 (1H, д, J=7,9 Гц, H-4), 7,35 (2H, д, J=7,6 Гц, H-2′,6′), 7,31 (1H, д, J=2,2 Гц, H-7), 7,10 (2H, дд, J=7,6, 7,4 Гц,H-3′, 5′), 6,95 (1H, т, J=7,4 Гц, H-4′), 6,71 (1H, дд, J=7,9, 2,2 Гц, H-5), 3,58 (3H, с, NCH3). C32H26N4O4S2 Рассчитано: 595,1474. Найдено: [М+H] + 595,1483 (МC в результате бомбардировки быстрыми атомами). Получение соединения N 81. Путем деметилирования и ацетилирования 7-метокси-1-метил-2-оксиндола [соединение формулы (VI), где R1 – 7-OMe, R3 – метил] получают 7-ацетокси-1-метил-2-оксиндол [соединение формулы (VI), где R1 означает 7-OAc, R3 – метил]; выход: 68% теории; точка плавления: 95 – 97oC. 1H ЯМР (CDCl3):  7,12 (1H, дд, J=7,1, 1,0 Гц, Н-6), 7,01 (1H, дд, J= 8,4, 7,1 Гц, H-5), 6,96 (1H, дд, J=8,4, 1,0 Гц, H-4), 3,54 (2H, с, H-3), 3,34 (3H, с, N-CH3), 2,35 (3H, с, OCOCH3).
13C ЯМР: 7,12 (1H, дд, J=7,1, 1,0 Гц, Н-6), 7,01 (1H, дд, J= 8,4, 7,1 Гц, H-5), 6,96 (1H, дд, J=8,4, 1,0 Гц, H-4), 3,54 (2H, с, H-3), 3,34 (3H, с, N-CH3), 2,35 (3H, с, OCOCH3).
13C ЯМР:  174,88 (C-2), 169,57 174,88 (C-2), 169,57 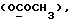 136,11 (с), 134,24 (с), 126,73 (с), 123,02 (д), 122,60 (д), 122,18 (д), 35,68 (C-3), 28,17 (N-CH3), 20,89 136,11 (с), 134,24 (с), 126,73 (с), 123,02 (д), 122,60 (д), 122,18 (д), 35,68 (C-3), 28,17 (N-CH3), 20,89 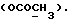 C11H11NO3 Рассчитано, %: C 64,4; H 5,4; N 6,8. Найдено, %: C 64,5; H 5,5; N 6,7. Путем реакции данного соединения с пентасульфидом фосфора получают 7-ацетокси-1-метил-2-индолинтион [соединение формулы (VIII), где R1 означает 7-OAc, R3 – метил]; выход: 85% теории; точка плавления: 133 – 135oC. 1H ЯМР (CDCl3):  7,17 (1H, д, J=7,9 Гц, H-6), 7,14 (1H, дд, J=8,0, 7,9 Гц, H-4), 7,01 (1H, д, J=8,0 Гц, H-4), 4,13 (2H, с, H-3), 3,78 (3H, с, N-CH3), 2,39 (3H, с, OCOCH3).
13C ЯМР: 7,17 (1H, д, J=7,9 Гц, H-6), 7,14 (1H, дд, J=8,0, 7,9 Гц, H-4), 7,01 (1H, д, J=8,0 Гц, H-4), 4,13 (2H, с, H-3), 3,78 (3H, с, N-CH3), 2,39 (3H, с, OCOCH3).
13C ЯМР:  202,00 (C-2), 169,22, 202,00 (C-2), 169,22, 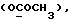 137,53 (с), 134,33 (с), 131,42 (с), 124,78 (д), 123,23 (д), 121,69 (д), 49,20 (C-3), 33,67 (N-CH3), 20,97 137,53 (с), 134,33 (с), 131,42 (с), 124,78 (д), 123,23 (д), 121,69 (д), 49,20 (C-3), 33,67 (N-CH3), 20,97 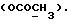 C11H11NO2S Рассчитано, %: C 59,7; H 5,0; N 6,3; S 14,5. Найдено, %: C 59,4; H 5,2; N 6,2; S 14,2. Путем реакции с фенилизоцианатом получают 2,2′-дитиобис[N- фенил-7-ацетокси-1-метилиндолил-3-карбоксамид] (соединение N 81) [соединение формулы (IV), где R1 означает 7-OAc, R2 – CONHPh, R3 – метил]; точка плавления: 212 – 214,5oC. 1H ЯМР ((CD3)2SO):  10,28 (1H, шир, CONH), 7,72 (1H, д, J=7,8 Гц, Н-4), 7,44 (2H, д, J=7,8 Гц, H-2′,6′), 7,23 (2H, дд, J=8,1, 7,8 Гц, H-3′,5′), 7,11 (1H, дд, J=7,8, 7,7 Гц, H-5), 7,01 (2H, м, H-6, H-4′), 3,68 (3H, с, N-CH3), 2,35 (3H, с, OCOCH3).
13C ЯМР: 10,28 (1H, шир, CONH), 7,72 (1H, д, J=7,8 Гц, Н-4), 7,44 (2H, д, J=7,8 Гц, H-2′,6′), 7,23 (2H, дд, J=8,1, 7,8 Гц, H-3′,5′), 7,11 (1H, дд, J=7,8, 7,7 Гц, H-5), 7,01 (2H, м, H-6, H-4′), 3,68 (3H, с, N-CH3), 2,35 (3H, с, OCOCH3).
13C ЯМР:  169,49 (CONHPh), 161,36 (OCOCH3), 138,75 (с), 135,92 (с), 129,43 (с), 128,80 (с), 128,43 (д), 128,0 (с), 123,13 (д), 121,21 (д), 119,35 (д), 118,50 (д), 118,16 (д), 31,84 (OCOCH3), 20,68 (N-CH3).
C36H30N4O6S2 169,49 (CONHPh), 161,36 (OCOCH3), 138,75 (с), 135,92 (с), 129,43 (с), 128,80 (с), 128,43 (д), 128,0 (с), 123,13 (д), 121,21 (д), 119,35 (д), 118,50 (д), 118,16 (д), 31,84 (OCOCH3), 20,68 (N-CH3).
C36H30N4O6S2 0,5H2O 0,5H2OРассчитано, %: C 62,9; H 4,5; N 8,2; S 9,3. Найдено, %: C 62,9; H 4,5; N 7,8; S 9,6. Получение соединения N 82. Соединение N 81 подвергают реакции с бораном натрия и 3 н. гидроокисью калия и в результате повторного окисления получают 2,2′-дитиобис(N-фенил-7-окси-1-метилиндол-3-карбоксамид) (соединение N 82) [соединение формулы (IV), где R1 означает 7-OH, R2 – CONHPh, R3 – метил]; выход: 81% теории; точка плавления: 207oC (разложение). 1H ЯМР ((CD3)2SO): 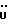 9,94, 9,63 (каждый 1H, 2c, CONH и ArOH), 7,33 (1H, д, J=8,0 Гц, H-2′,6′), 7,23 (1H, д, J=8,0 Гц, H-4), 7,18 (2H, дд, J=8,0, 8,0 Гц, H-3′,5′), 6,99 9,94, 9,63 (каждый 1H, 2c, CONH и ArOH), 7,33 (1H, д, J=8,0 Гц, H-2′,6′), 7,23 (1H, д, J=8,0 Гц, H-4), 7,18 (2H, дд, J=8,0, 8,0 Гц, H-3′,5′), 6,99(1H, т, J=8,0 Гц, H-4′), 6,91 (1H, дд, J=8,0, 7,5 Гц, H-5), 6,65 (1H, д, J=7,5 Гц, H-6), 3,89 (3H, с, N-CH3). 13C ЯМР:  161,89 (CONH), 144,46 (с), 138,72 (с), 128,30 (д), 127,74 (с), 127,57 (с), 122,98 (д), 121,76 (д), 119,46 (д), 119,36 (с), 119,32 (с), 111,57 (д), 108,85 (д), 32,84 (N-CH3).
C32H26N4O4S2 161,89 (CONH), 144,46 (с), 138,72 (с), 128,30 (д), 127,74 (с), 127,57 (с), 122,98 (д), 121,76 (д), 119,46 (д), 119,36 (с), 119,32 (с), 111,57 (д), 108,85 (д), 32,84 (N-CH3).
C32H26N4O4S2Рассчитано, %: C 64,3; H 4,4; N 9,4; S 10,8. Найдено, %: C 64,2; H 4,4; N 9,3; S 10,9. Получение соединения N 83. Аналогичным образом из 1-метил-2-индолинтиона и метилизоцианата получают дисульфид бис[N-метил-1-метилиндолил-3-карбоксамида-(2)] [соединение формулы (IV), где R1 означает водород, R2 – CONHMe, R3 – метил] (соединение N 83); выход: 18% теории; точка плавления: 162 – 165oC. 1H ЯМР (CDCl3):  8,07 (1H, д, J=8,0 Гц, H-4), 7,40 – 7,20 (3H, м, H-5, H-6, H-7), 6,31 (1H, шир, CONH), 3,82 (3H, с, NCH3), 2,13 (3H, д, J=5,0 Гц, 8,07 (1H, д, J=8,0 Гц, H-4), 7,40 – 7,20 (3H, м, H-5, H-6, H-7), 6,31 (1H, шир, CONH), 3,82 (3H, с, NCH3), 2,13 (3H, д, J=5,0 Гц, 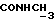 ).
13C ЯМР (CDCl3): ).
13C ЯМР (CDCl3):  173,29 (CONH), 128,34 (с), 125,28, 122,31, 122,02, 120,0 (с), 116,5 (c), 113,2 (с), 110,06, 30,26 (N-CH3), 25,68 (CONHCH3).
Альтернативный способ получения соединения N 83.
Смесь 20 г (136 ммоль) 1-метил-2-индолинона и 250 мл дихлорэтана подают в автоклав из нержавеющей стали емкостью 500 мл, который плотно закрывают. Реактор охлаждают при температуре ниже -10oC и добавляют 60 г дистиллированного фосгена. Реактор вновь плотно закрывают и при встряхивании нагревают до температуры 80oC. По истечении часа реактор охлаждают до комнатной температуры, газы удаляют и очищают азотом. Реактор открывают и полученный раствор выпускают из реактора при промывке свежим дихлорметаном. Дихлорэтановый раствор из промытого реактора сгущают с получением фиолетового твердого вещества, которое растворяют в 300 мл дихлорметана. Полученный раствор охлаждают в ледяной ванне и в охлаждаемый раствор в течение 50 минут с небольшим расходом вводят газовый безводный метиламин. Затем полученную смесь дважды промывают водой, каждый раз используя 300 мл, и солевым раствором, сушат над сульфатом натрия и сгущают до объема примерно 150 мл. Полученный раствор очищают путем флеш-хроматографии на силикагеле (размер слоя 7,5 х 13 см) с использованием в качестве элюента сперва 1,6 л дихлорметана, затем 2 л 2%-ной смеси ацетона и дихлорметана и 2 л 5%-ной смеси ацетона и дихлорметана, причем собирают фракции по 500 мл. Первые нечистые продуктсодержащие фракции объединяют, сгущают и выкристаллизовывают из смеси 40 мл этанола и 12 мл петролейного эфира с получением 2-хлор-1-метилиндол-3-N- метилкарбоксамида [соединение формулы (XIV), где R6 означает водород, R7 – метил]; выход: 3,04 г; точка плавления: 148 – 151oC. Чистые фракции продукта объединяют и сгущают, причем получают еще 16,41 г продукта в качестве желтоватого твердого вещества; точка плавления: 150 – 151oC. Общий выход: 19,45 г (64% теории).
9,30 г (41,8 ммоль) данного карбоксамида подвергают взаимодействию с 129,5 ммоль тиометила лития в среде 36 мл диметилацетамида. Нагревают при температуре 60oC в течение 7 часов, затем полученный прозрачный раствор янтарного цвета охлаждают в ледяной ванне и медленно обрабатывают 150 мл 5%-ной водной соляной кислоты. Полученную суспензию разбавляют примерно 150 мл дихлорметана и реакционную смесь размешивают в течение часа. Затем слои разделяют и водную фракцию экстрагируют еще два раза. После этого объединенные органические экстракты трижды промывают водой, каждый раз используя 200 мл, затем промывают солевым раствором, сушат над сульфатом магния и сгущают с получением остатка, который перекачивают при давлении 0,05 мм рт.ст. в течение часа, в результате чего получают оранжевое твердое вещество. Последнее суспендируют в 100 мл уксусной кислоты и 50 мл воды и при интенсивном перемешивании к суспензии добавляют 12,85 г пербората натрия. Получают густую суспензию, которую размешивают примерно 30 минут, после чего фильтруют, причем фильтрацию облегчают с использованием 10%-ной смеси метанола в воде. Твердое вещество тщательно промывают водой и диэтиловым эфиром, после чего сушат на воздухе. После дальнейшей сушки над полупятиокисью фосфора при давлении 200 мм рт.ст. при температуре 65oC в течение ночи получают чистый дисульфид бис[N-метил-1-метилиндолил-3-карбоксамида-(2)] (соединение N 83), [соединение формулы (IV), где R2 – CONHCH3]; выход: 6,38 г, 70% теории; точка плавления: 186 – 187oC.
Пример 5. Получение соединений согласно таблице 1 по способу, представленному на реакционной схеме 4.
Получение соединений NN 19 и 70.
Смесь 43,28 г (0,4 моль) 2-амино-3-метилпиридина и 47,65 г (0,4 моль) бензтриазола в 500 мл этанола в течение 5 минут обрабатывают 32,2 г (0,4 моль) 37%-ного раствора формальдегида. Полученную смесь размешивают при температуре 20oC в течение ночи, затем охлаждают и фильтруют, причем получают 2-[(1- бензтриазолил)метил] -3-метилпиридин; выход: 30 г, 31% теории. Пробу кристаллизуют из этанола; точка плавления: 175 – 177oC.
1H ЯМР (CDCl3): 173,29 (CONH), 128,34 (с), 125,28, 122,31, 122,02, 120,0 (с), 116,5 (c), 113,2 (с), 110,06, 30,26 (N-CH3), 25,68 (CONHCH3).
Альтернативный способ получения соединения N 83.
Смесь 20 г (136 ммоль) 1-метил-2-индолинона и 250 мл дихлорэтана подают в автоклав из нержавеющей стали емкостью 500 мл, который плотно закрывают. Реактор охлаждают при температуре ниже -10oC и добавляют 60 г дистиллированного фосгена. Реактор вновь плотно закрывают и при встряхивании нагревают до температуры 80oC. По истечении часа реактор охлаждают до комнатной температуры, газы удаляют и очищают азотом. Реактор открывают и полученный раствор выпускают из реактора при промывке свежим дихлорметаном. Дихлорэтановый раствор из промытого реактора сгущают с получением фиолетового твердого вещества, которое растворяют в 300 мл дихлорметана. Полученный раствор охлаждают в ледяной ванне и в охлаждаемый раствор в течение 50 минут с небольшим расходом вводят газовый безводный метиламин. Затем полученную смесь дважды промывают водой, каждый раз используя 300 мл, и солевым раствором, сушат над сульфатом натрия и сгущают до объема примерно 150 мл. Полученный раствор очищают путем флеш-хроматографии на силикагеле (размер слоя 7,5 х 13 см) с использованием в качестве элюента сперва 1,6 л дихлорметана, затем 2 л 2%-ной смеси ацетона и дихлорметана и 2 л 5%-ной смеси ацетона и дихлорметана, причем собирают фракции по 500 мл. Первые нечистые продуктсодержащие фракции объединяют, сгущают и выкристаллизовывают из смеси 40 мл этанола и 12 мл петролейного эфира с получением 2-хлор-1-метилиндол-3-N- метилкарбоксамида [соединение формулы (XIV), где R6 означает водород, R7 – метил]; выход: 3,04 г; точка плавления: 148 – 151oC. Чистые фракции продукта объединяют и сгущают, причем получают еще 16,41 г продукта в качестве желтоватого твердого вещества; точка плавления: 150 – 151oC. Общий выход: 19,45 г (64% теории).
9,30 г (41,8 ммоль) данного карбоксамида подвергают взаимодействию с 129,5 ммоль тиометила лития в среде 36 мл диметилацетамида. Нагревают при температуре 60oC в течение 7 часов, затем полученный прозрачный раствор янтарного цвета охлаждают в ледяной ванне и медленно обрабатывают 150 мл 5%-ной водной соляной кислоты. Полученную суспензию разбавляют примерно 150 мл дихлорметана и реакционную смесь размешивают в течение часа. Затем слои разделяют и водную фракцию экстрагируют еще два раза. После этого объединенные органические экстракты трижды промывают водой, каждый раз используя 200 мл, затем промывают солевым раствором, сушат над сульфатом магния и сгущают с получением остатка, который перекачивают при давлении 0,05 мм рт.ст. в течение часа, в результате чего получают оранжевое твердое вещество. Последнее суспендируют в 100 мл уксусной кислоты и 50 мл воды и при интенсивном перемешивании к суспензии добавляют 12,85 г пербората натрия. Получают густую суспензию, которую размешивают примерно 30 минут, после чего фильтруют, причем фильтрацию облегчают с использованием 10%-ной смеси метанола в воде. Твердое вещество тщательно промывают водой и диэтиловым эфиром, после чего сушат на воздухе. После дальнейшей сушки над полупятиокисью фосфора при давлении 200 мм рт.ст. при температуре 65oC в течение ночи получают чистый дисульфид бис[N-метил-1-метилиндолил-3-карбоксамида-(2)] (соединение N 83), [соединение формулы (IV), где R2 – CONHCH3]; выход: 6,38 г, 70% теории; точка плавления: 186 – 187oC.
Пример 5. Получение соединений согласно таблице 1 по способу, представленному на реакционной схеме 4.
Получение соединений NN 19 и 70.
Смесь 43,28 г (0,4 моль) 2-амино-3-метилпиридина и 47,65 г (0,4 моль) бензтриазола в 500 мл этанола в течение 5 минут обрабатывают 32,2 г (0,4 моль) 37%-ного раствора формальдегида. Полученную смесь размешивают при температуре 20oC в течение ночи, затем охлаждают и фильтруют, причем получают 2-[(1- бензтриазолил)метил] -3-метилпиридин; выход: 30 г, 31% теории. Пробу кристаллизуют из этанола; точка плавления: 175 – 177oC.
1H ЯМР (CDCl3): 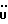 8,10 (1H, д, J=5 Гц, H-8), 8,10 и 8,00 (2H, 2д, J=8 Гц, H-4′, 7′), 7,45 и 7,33 (2H, 2т, J=8 Гц, H- 5′,6′), 7,25 (1H, д, J=7 Гц, H-4), 6,54 (1H, дд, J-7,5 Гц, H-5), 6,47 (2H, д, J=7 Гц, CH2), 5,38 (1H, т, J=7 Гц, NH), 2,07 (3H, с, CH3).
30 г (125 ммоль) сырого 2-[(1-бензтриазолил)метил]-3-метилпиридина суспендируют в 400 мл диоксана и обрабатывают 5 г (130 ммоль) бораном натрия. Полученную смесь нагревают при температуре флегмы в течение 8 часов, затем большую часть растворителя удаляют в вакууме. Остаток распределяют между толуолом и водой и органический слой промывают последовательно разбавленным раствором гидроокиси натрия и водой и сушат. В результате удаления растворителя получают 2-метиламино-3-метилпиридин в качестве масла; выход: 12,8 г, 84% теории.
1H ЯМР (CDCl3): 8,10 (1H, д, J=5 Гц, H-8), 8,10 и 8,00 (2H, 2д, J=8 Гц, H-4′, 7′), 7,45 и 7,33 (2H, 2т, J=8 Гц, H- 5′,6′), 7,25 (1H, д, J=7 Гц, H-4), 6,54 (1H, дд, J-7,5 Гц, H-5), 6,47 (2H, д, J=7 Гц, CH2), 5,38 (1H, т, J=7 Гц, NH), 2,07 (3H, с, CH3).
30 г (125 ммоль) сырого 2-[(1-бензтриазолил)метил]-3-метилпиридина суспендируют в 400 мл диоксана и обрабатывают 5 г (130 ммоль) бораном натрия. Полученную смесь нагревают при температуре флегмы в течение 8 часов, затем большую часть растворителя удаляют в вакууме. Остаток распределяют между толуолом и водой и органический слой промывают последовательно разбавленным раствором гидроокиси натрия и водой и сушат. В результате удаления растворителя получают 2-метиламино-3-метилпиридин в качестве масла; выход: 12,8 г, 84% теории.
1H ЯМР (CDCl3):  8,04 (1H, д, J=5,1 Гц, H, H-6), 7,19 (1H, д, J=7,1 Гц, H-4), 6,50 (1H, дд, J=7,1, 5,1 Гц, 5-H), 4,15 (1H, м, NH), 3,03 (3H, д, J= 4,5 Гц, CH3N), 2,06 (3H, с, CH3).
13C ЯМР (CDCl3): 8,04 (1H, д, J=5,1 Гц, H, H-6), 7,19 (1H, д, J=7,1 Гц, H-4), 6,50 (1H, дд, J=7,1, 5,1 Гц, 5-H), 4,15 (1H, м, NH), 3,03 (3H, д, J= 4,5 Гц, CH3N), 2,06 (3H, с, CH3).
13C ЯМР (CDCl3):  157,3 (C-2), 145,0 (C-8), 136,1 (C-4), 116,4 (C-3), 111,9 (C-5), 28,3 (CH2), 16,5 (CH3).
Раствор 6,1 г (50 ммоль) полученного на предыдущей стадии пиридина в 150 мл сухого тетрагидрофурана в атмосфере сухого азота охлаждают при температуре -78oC и каплями добавляют сперва 19,6 мл (50 ммоль) 2,5 М раствора н-бутиллития в гексане, а затем 32 мл (55 ммоль) 1,7 М раствора н-бутиллития в пентане. Полученной смеси дают нагреваться до -20oC и держат при этой температуре в течение 30 минут, после чего опять охлаждают до -78oC. Обрабатывают сухой газовой двуокисью углерода до исчезновения цвета. После этого нагревают до 20oC, подкисляют добавлением разбавленной соляной кислоты и растворитель удаляют в вакууме. Остаток растворяют в 100 мл этанола, содержащего 100 мг пара-толуолсульфокислоты, для циклизации нагревают при температуре флегмы в течение 3 часов и нейтрализуют добавлением водного аммиака. Затем удаляют растворитель и остаток перерабатывают в этилацетате, в результате чего получают масло, которое экстрагируют горячим гексаном. Обрабатывают активным углем и фильтруют через целит. В результате сгущения и охлаждения раствора получают 1-метил-7-аза-2-индолинон-(1,3-дигидро-1-метил-2H-пирроло-(2,3-бипиридин-2-он) [соединение формулы (VI), где R1 – 7-аза, R3 – метил]; выход: 1,2 г, 15% теории; точка плавления (из гексана): 94 – 96oC.
1H ЯМР (CDCl3): 157,3 (C-2), 145,0 (C-8), 136,1 (C-4), 116,4 (C-3), 111,9 (C-5), 28,3 (CH2), 16,5 (CH3).
Раствор 6,1 г (50 ммоль) полученного на предыдущей стадии пиридина в 150 мл сухого тетрагидрофурана в атмосфере сухого азота охлаждают при температуре -78oC и каплями добавляют сперва 19,6 мл (50 ммоль) 2,5 М раствора н-бутиллития в гексане, а затем 32 мл (55 ммоль) 1,7 М раствора н-бутиллития в пентане. Полученной смеси дают нагреваться до -20oC и держат при этой температуре в течение 30 минут, после чего опять охлаждают до -78oC. Обрабатывают сухой газовой двуокисью углерода до исчезновения цвета. После этого нагревают до 20oC, подкисляют добавлением разбавленной соляной кислоты и растворитель удаляют в вакууме. Остаток растворяют в 100 мл этанола, содержащего 100 мг пара-толуолсульфокислоты, для циклизации нагревают при температуре флегмы в течение 3 часов и нейтрализуют добавлением водного аммиака. Затем удаляют растворитель и остаток перерабатывают в этилацетате, в результате чего получают масло, которое экстрагируют горячим гексаном. Обрабатывают активным углем и фильтруют через целит. В результате сгущения и охлаждения раствора получают 1-метил-7-аза-2-индолинон-(1,3-дигидро-1-метил-2H-пирроло-(2,3-бипиридин-2-он) [соединение формулы (VI), где R1 – 7-аза, R3 – метил]; выход: 1,2 г, 15% теории; точка плавления (из гексана): 94 – 96oC.
1H ЯМР (CDCl3):  8,15 (1H, д, J=5,3 Гц, H-8), 7,48 (1H, д, J=7,2 Гц, H-4), 8,94 (1H, дд, J=7,2, 5,3 Гц, H-5), 3,53 (2H, с, CH2), 3,29 (3H, с, CH3).
13C ЯМР (CDCl3): 8,15 (1H, д, J=5,3 Гц, H-8), 7,48 (1H, д, J=7,2 Гц, H-4), 8,94 (1H, дд, J=7,2, 5,3 Гц, H-5), 3,53 (2H, с, CH2), 3,29 (3H, с, CH3).
13C ЯМР (CDCl3):  174,1 (C-2), 158,1 (C-7а), 146,6 (C-8), 131,3 (C-4), 119,0 (C-3а), 117,8 (C-5), 34,6 (CH2), 25,1 (CH3).
К интенсивно размешиваемой суспензии 0,88 г (8,10 ммоль) карбоната натрия в 30 мл тетрагидрофурана добавляют 3,80 г (8,10 ммоль) пентасульфида фосфора. По получении гомогенной смеси (примерно после 15 минут) добавляют раствор 1,00 г 1-метил-7-аза- 2-индолинона [соединение формулы (VI), где R1 – 7-аза, R3 – метил] в 10 мл тетрагидрофурана и продолжают перемешивать при температуре 20oC в течение 18 часов. Затем растворитель удаляют в вакууме и остаток распределяют между этилацетатом и водой. В результате переработки органического слоя и хроматографии на силикагеле с использованием в качестве элюента смеси этилацетата и петролейного эфира в соотношении 1:5 получают 1-метил-7-аза-2-индолинтион [соединение формулы (VIII), где R1 означает 7-аза, R3 – метил] ; выход: 0,81 г, 73% теории; точка плавления (из смеси этилацетата и петролейного эфира): 130 – 133oC.
1H ЯМР (CDCl3): 174,1 (C-2), 158,1 (C-7а), 146,6 (C-8), 131,3 (C-4), 119,0 (C-3а), 117,8 (C-5), 34,6 (CH2), 25,1 (CH3).
К интенсивно размешиваемой суспензии 0,88 г (8,10 ммоль) карбоната натрия в 30 мл тетрагидрофурана добавляют 3,80 г (8,10 ммоль) пентасульфида фосфора. По получении гомогенной смеси (примерно после 15 минут) добавляют раствор 1,00 г 1-метил-7-аза- 2-индолинона [соединение формулы (VI), где R1 – 7-аза, R3 – метил] в 10 мл тетрагидрофурана и продолжают перемешивать при температуре 20oC в течение 18 часов. Затем растворитель удаляют в вакууме и остаток распределяют между этилацетатом и водой. В результате переработки органического слоя и хроматографии на силикагеле с использованием в качестве элюента смеси этилацетата и петролейного эфира в соотношении 1:5 получают 1-метил-7-аза-2-индолинтион [соединение формулы (VIII), где R1 означает 7-аза, R3 – метил] ; выход: 0,81 г, 73% теории; точка плавления (из смеси этилацетата и петролейного эфира): 130 – 133oC.
1H ЯМР (CDCl3):  8,28 (1H, дд, J=5,2, 0,6 Гц, H-6), 7,57 (1H, дд, J= 7,3, 0,6 Гц, H-4), 7,07 (1H, дд, J=7,3, 5,2 Гц, H-5), 4,06 (2H, с, H-3), 3,66 (3H, с, N-CH3).
13C ЯМР: 8,28 (1H, дд, J=5,2, 0,6 Гц, H-6), 7,57 (1H, дд, J= 7,3, 0,6 Гц, H-4), 7,07 (1H, дд, J=7,3, 5,2 Гц, H-5), 4,06 (2H, с, H-3), 3,66 (3H, с, N-CH3).
13C ЯМР:  201,70 (C-2), 159,21 (с), 147,22 (д), 131,39 (д), 123,20 (с), 119,34 (д), 46,98 (C-3), 30,02 (N-CH3).
C8H8N2S 201,70 (C-2), 159,21 (с), 147,22 (д), 131,39 (д), 123,20 (с), 119,34 (д), 46,98 (C-3), 30,02 (N-CH3).
C8H8N2SРассчитано, %: C 58,5; H 4,9; N 17,1; S 19,5. Найдено, %: C 58,3; H 4,9; N 17,0; S 19,8. Раствор 0,70 г (4,26 ммоль) полученного на предыдущей стадии тиона в 5 мл тетрагидрофурана в атмосфере азота в течение 5 минут каплями добавляют к 0,2 г (6,11 ммоль) охлаждаемой льдом суспензии 60%-ной дисперсии гидрида натрия в масле. После прекращения выделения газа (5 минут) добавляют 0,47 мл (4,25 ммоль) фенилизоцианата и продолжают перемешивать при температуре 20oC в течение часа. Затем добавляют водную 1 н. соляную кислоту и полученную смесь экстрагируют этилацетатом. Органический слой перерабатывают и остаток подвергают хроматографии на силикагеле с использованием смеси этилацетата и петролейного эфира в соотношении 1:1 в качестве первого элюента, этилацетата в качестве второго элюента и смеси этилацетата и метанола в соотношении 10:1 в качестве третьего элюента, причем получают сложный N-фениловый эфир (1-метил-7-аза-2-тиоксо-3-индолинил)карбоксамида (соединение N 19) [соединение формулы (Ia), где R1 означает 7-аза, R2 – CONHPh, R3 – метил] в качестве флуоресцирующего зеленого твердого вещества; выход: 0,67 г, 55% теории; точка плавления (после тритурации метанолом): 162 – 164oC (разложение). 1H ЯМР ((CD3)2SO):  12,46 (1H, с, CONH), 8,68 (1H, дд, J=7,7, 1,0 Гц, H-6), 8,02 (1H, д, J=6,0 Гц, H-4), 7,72 (2H, д, 8,4 Гц, ArH), 7,36 -7,29 (4H, м, ArH), 7,01 (1H, т, J=7,3 Гц, ArH), 3,80 (3H, с, N-CH3).
13C ЯМР: 12,46 (1H, с, CONH), 8,68 (1H, дд, J=7,7, 1,0 Гц, H-6), 8,02 (1H, д, J=6,0 Гц, H-4), 7,72 (2H, д, 8,4 Гц, ArH), 7,36 -7,29 (4H, м, ArH), 7,01 (1H, т, J=7,3 Гц, ArH), 3,80 (3H, с, N-CH3).
13C ЯМР:  166,96 (C-2), 163,59 (CONH), 140,77 (с), 139,81 (с), 129,29 (д), 128,85 (д), 127,21 (с), 126,84 (д), 122,16 (д), 118,65 (д), 115,92 (д), 48,57 (C-3), 29,18 (N-CH3).
C15H13N3O2S 166,96 (C-2), 163,59 (CONH), 140,77 (с), 139,81 (с), 129,29 (д), 128,85 (д), 127,21 (с), 126,84 (д), 122,16 (д), 118,65 (д), 115,92 (д), 48,57 (C-3), 29,18 (N-CH3).
C15H13N3O2S CH3OH CH3OHРассчитано, %: C 60,9; H 5,4; N 13,3; S 10,2. Найдено, %: C 60,6; H 5,4; N 13,4; S 10,3. Раствор 0,50 г (5,00 ммоль) пербората натрия в 25 мл воды добавляют к интенсивно размешиваемой суспензии 0,50 г (176 ммоль) полученного на предыдущей стадии 7-аза-соединения (соединение N 19) в 50 мл ледяной уксусной кислоты. По истечении часа твердое вещество отфильтровывают, последовательно промывают водой и диэтиловым эфиром и сушат, в результате чего получают 2,2′- дитиобис[N-фенил-1-метил-7-азаиндолил-3-карбоксамид] [соединение формулы (IV), где R1 означает 7-аза, R2 – CONHPh, R3 – метил] (соединение N 70); выход: 100% теории, точка плавления: 197 – 198oC. 1H ЯМР ((CD3)2SO):  9,49 (1H, с, CONH), 8,36 (1H, дд, J=4,5, 1,5 Гц, H-6), 8,14 (1H, дд, J=7,9, 1,5 Гц, H-4), 7,19 (1H, дд, J=7,9, 4,5 Гц, H-5), 7,16 – 7,09 (4H, м, ArH), 6,98 (1H, м, ArH), 3,75 (3H, с, N-CH3).
13C ЯМР: 9,49 (1H, с, CONH), 8,36 (1H, дд, J=4,5, 1,5 Гц, H-6), 8,14 (1H, дд, J=7,9, 1,5 Гц, H-4), 7,19 (1H, дд, J=7,9, 4,5 Гц, H-5), 7,16 – 7,09 (4H, м, ArH), 6,98 (1H, м, ArH), 3,75 (3H, с, N-CH3).
13C ЯМР:  160,42 (CONH), 147,58 (с), 145,99 (д), 138,29 (с), 129,86 (с), 129,62 (д), 128,25 (д), 123,05 (д), 119,23 (д), 118,09 (с), 117,76 (д), 117,57 (с), 28,61 (N- CH3).
C30H24N6O2S2 160,42 (CONH), 147,58 (с), 145,99 (д), 138,29 (с), 129,86 (с), 129,62 (д), 128,25 (д), 123,05 (д), 119,23 (д), 118,09 (с), 117,76 (д), 117,57 (с), 28,61 (N- CH3).
C30H24N6O2S2 2,5H2O 2,5H2OРассчитано, %: C 59,1; H 4,8; N 13,8; S 10,5. Найдено, %: C 59,1; H 4,2; N 13,8; S 10,5. Пример 6. Получение соединений согласно таблице 1 по способу, представленному на реакционной схеме 5. Получение соединений NN 24 и 84. К размешиваемому раствору 0,45 г (3,68 ммоль) полученного из бензойной кислоты бензоилхлорида в 20 мл ацетона при температуре 0oC каплями добавляют раствор 0,26 г (3,98 ммоль) нитрида натрия в 2 мл воды. По истечении 15 минут полученный раствор распределяют между водой и бензолом и органический слой тщательно промывают бикарбонатом натрия и перерабатывают с получением сырого фенацилазида, который непосредственно используют для последующей реакции. Раствор 0,50 г (3,06 ммоль) 1-метил-2-индолинтиона в 3 мл сухого тетрагидрофурана в атмосфере азота при температуре 20oC каплями добавляют к размешиваемой суспензии 0,13 г (3,37 ммоль) 60%-ной суспензии гидрида натрия в минеральном масле в 2 мл тетрагидрофурана. После прекращения выделения газа (5 минут) каплями добавляют раствор полученного на предыдущей стадии фенацилазида в 2 мл тетрагидрофурана и полученную смесь размешивают при температуре 20oC в течение часа. Затем выливают в 6 н. соляную кислоту и экстрагируют этилацетатом. Остаток органического слоя подвергают хроматографии на силикагеле с использованием в качестве элюента сперва смеси дихлорметана и петролейного эфира в соотношении 3:7, а затем смеси дихлорметана и петролейного эфира в соотношении 2:3, причем получают 3-бензоил-1-метил-2-индолинтион (соединение N 24) [соединение формулы (XI), где R1 означает водород, R3 – метил, R5 – C6H5]; выход: 0,31 г, 38% теории; точка плавления (тритурация из метанола): 132 – 134oC. 1H ЯМР (CDCl3):  15,83 (1H, с, SH), 7,68 – 7,53 (5H, м, COPh), 7,21 (1H, дд, J=8,1, 7,3 Гц, H-5), 7,11 (1H, д, J=8,1 Гц, H-4), 6,90 (1H, дд, J= 8,0, 7,3 Гц, H-6), 6,76 (1H, д, J=8,0 Гц, H-7), 3,74 (3H, с, NCH3).
13C ЯМР (CDCl3): 15,83 (1H, с, SH), 7,68 – 7,53 (5H, м, COPh), 7,21 (1H, дд, J=8,1, 7,3 Гц, H-5), 7,11 (1H, д, J=8,1 Гц, H-4), 6,90 (1H, дд, J= 8,0, 7,3 Гц, H-6), 6,76 (1H, д, J=8,0 Гц, H-7), 3,74 (3H, с, NCH3).
13C ЯМР (CDCl3):  181,71 181,71  175,09 (C-2), 141,42 (с), 134,87 (с), 131,29, 128,85, 128,37, 125,64 (4хд), 125,22 (с), 122,81, 120,31 (2хд), 111,77 (с), 109,129 (д), 29,57 (NCH3).
C16H13NOS 175,09 (C-2), 141,42 (с), 134,87 (с), 131,29, 128,85, 128,37, 125,64 (4хд), 125,22 (с), 122,81, 120,31 (2хд), 111,77 (с), 109,129 (д), 29,57 (NCH3).
C16H13NOSРассчитано, %: C 71,9; H 4,9; N 5,2; S 12,0. Найдено, %: C 71,6; H 5,1; N 6,2; S 13,9. К раствору 0,10 г (0,37 ммоль) соединения N 24 в 20 мл дихлорметана при температуре 20oC каплями добавляют раствор 0,50 г йода в 5 мл дихлорметана, пока путем тонкослойной хроматографии не подтверждается полная конверсия (примерно 2 часа). Полученный раствор сгущают до объема примерно 1 мл и непосредственно подвергают хроматографии на силикагеле с использованием в качестве элюента дихлорметана, причем получают следы йода и исходного соединения, а при дальнейшей элюации смесью дихлорметана и метанола в соотношении 19: 1 получают дисульфид бис[3-бензоил-1-метилиндола-(2)] [соединение формулы (XII), где R1 означает водород, R3 – метил, R5 – C6H5] (соединение N 84); выход: 0,06 г, 61% теории; точка плавления (из смеси хлороформа и петролейного эфира): 199 – 202oC. 1H ЯМР (CD3SOCD3): 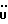 7,56 (1H, д, J=8,4 Гц, H-4), 7,50 (1H, д, J=8,1 Гц, H-7), 7,46 (дд, J=8,1, 7,4 Гц, H-6), 7,35 (1H, дд, J=8,4, 7,4 Гц, H-5), 7,19 (3H, м, H-2′,4′,6′), 6,92 (2H, д, J=7,1 Гц, H-3′,5′), 3,48 (3H, с, NCH3).
13C ЯМР (CD3SOCD3): 7,56 (1H, д, J=8,4 Гц, H-4), 7,50 (1H, д, J=8,1 Гц, H-7), 7,46 (дд, J=8,1, 7,4 Гц, H-6), 7,35 (1H, дд, J=8,4, 7,4 Гц, H-5), 7,19 (3H, м, H-2′,4′,6′), 6,92 (2H, д, J=7,1 Гц, H-3′,5′), 3,48 (3H, с, NCH3).
13C ЯМР (CD3SOCD3):  190,20 190,20  140,05, 138,03, 132,75 (3хс), 131,60, 128,48, 127,88 (3хд), 126,00 (с), 124,78, 122,27 (2хд), 122,03 (с), 121,03, 111,20 (2хд), 30,37 (NCH3).
C32H24N2O2S2 140,05, 138,03, 132,75 (3хс), 131,60, 128,48, 127,88 (3хд), 126,00 (с), 124,78, 122,27 (2хд), 122,03 (с), 121,03, 111,20 (2хд), 30,37 (NCH3).
C32H24N2O2S2Рассчитано, %: C 69,8; H 4,8; N 5,1; S 11,6. Найдено, %: C 70,3; H 4,7; N 5,2; S 11,3. Получение соединений NN 25, 26, 85 и 86. Путем аналогичной обработки 1-метил-2-индолинтиона 4-карбометоксибензоилазидом получают 3-(4′-карбометоксибензоил)-1- метил-2-индолинтион [соединение формулы (XI), где R1 означает водород, R3 – метил, R5 – MeOOCC6H4 (соединение N 26); выход: 68% теории; точка плавления: 164 – 166oC. 1H ЯМР (CDCl3):  5,85 (1H, с, SH), 8,23 (2H, д, J=8,3 Гц, H-3′,5′), 7,76 (2H, д, J=8,3 Гц, H-2′,6′), 7,23 (1H, дд, J=8,0, 7,6 Гц, H-5′), 7,12 (1H, д, J=7,6 Гц, H-4), 6,90 (1H, дд, J=8,0, 7,9 Гц, H-6), 6,69 (1H, д, J= 7,9 Гц, H-7), 3,99 (3H, с, COOCH3), 3,74 (3H, с, NCH3).
13C ЯМР (CDCl3): 5,85 (1H, с, SH), 8,23 (2H, д, J=8,3 Гц, H-3′,5′), 7,76 (2H, д, J=8,3 Гц, H-2′,6′), 7,23 (1H, дд, J=8,0, 7,6 Гц, H-5′), 7,12 (1H, д, J=7,6 Гц, H-4), 6,90 (1H, дд, J=8,0, 7,9 Гц, H-6), 6,69 (1H, д, J= 7,9 Гц, H-7), 3,99 (3H, с, COOCH3), 3,74 (3H, с, NCH3).
13C ЯМР (CDCl3):  182,07 182,07 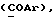 173,27 (C-2), 166,31 173,27 (C-2), 166,31 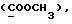 141,59, 138,92, 132,51 (3хс), 130,11, 128,54, 126,04 (3хд), 124,76 (с), 123,00, 120,26 (2хд), 119,95 (с), 109,28 (д), 52,50 141,59, 138,92, 132,51 (3хс), 130,11, 128,54, 126,04 (3хд), 124,76 (с), 123,00, 120,26 (2хд), 119,95 (с), 109,28 (д), 52,50 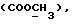 29,61 (NCH3).
C18H15NO3S 29,61 (NCH3).
C18H15NO3SРассчитано, %: C 66,4; H 4,7; N 4,3; S 9,8. Найдено, %: C 66,5; H 4,7; N 4,6; S 9,8. Путем окисления соединения N 26 йодом в среде дихлорметана получают дисульфид бис[3-(4′-карбометоксибензоил)-1-метилиндола-(2)] [соединение формулы (XII), где R1 означает водород, R3 метил, R5 – 4-MeOOCC6H4] (соединение N 86); точка плавления (из смеси хлороформа и петролейного эфира): 200 – 203oC. 1H ЯМР (CD3SOCD3):  7,74 (2H, д, J=8,4 Гц, H-3′,5′), 7,67 (1H, д, J=8,0 Гц, H-4), 7,64 (1H, д, J=8,4 Гц, H-7), 7,44 (1H, дд, J=8,4, 8,0 Гц, H-6), 7,27 (1H, дд, J= 8,0, 8,0 Гц, H-5), 6,99 (2H, д, J=8,4 Гц, H-2′,6′), 3,91 (3H, с, COOCH3), 3,51 (3H, с, NCH3).
13C ЯМР (CD3SOCD3): 7,74 (2H, д, J=8,4 Гц, H-3′,5′), 7,67 (1H, д, J=8,0 Гц, H-4), 7,64 (1H, д, J=8,4 Гц, H-7), 7,44 (1H, дд, J=8,4, 8,0 Гц, H-6), 7,27 (1H, дд, J= 8,0, 8,0 Гц, H-5), 6,99 (2H, д, J=8,4 Гц, H-2′,6′), 3,91 (3H, с, COOCH3), 3,51 (3H, с, NCH3).
13C ЯМР (CD3SOCD3):  189,31 189,31 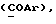 165,56 165,56 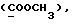 143,77, 137,98, 133,31, 131,61 (4xc), 128,50, 128,33 (2хд), 125,87 (с), 124,99, 122,62 (2хд), 121,27 (с), 121,09, 111,22 (2хд), 52,34 143,77, 137,98, 133,31, 131,61 (4xc), 128,50, 128,33 (2хд), 125,87 (с), 124,99, 122,62 (2хд), 121,27 (с), 121,09, 111,22 (2хд), 52,34 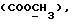 30,33 (NСH3).
C36H28N2O6S2 30,33 (NСH3).
C36H28N2O6S2Рассчитано, %: C 66,6; H 4,4; N 4,3; S 9,9. Найдено, %: C 66,2; H 4,8; N 4,4; S 9,9. Суспензию 0,1 г (0,31 ммоль) соединения N 26 в 5 мл метанола, содержащую 2 мл 3 н. гидроокиси натрия, размешивают при температуре 20oC в течение 3 часов, после чего сгущают досуха. Остаток растворяют в воде и подкисляют добавлением концентрированной соляной кислоты, в результате чего получают 3- (4′-карбоксибензоил)-1-метил-2-индолинтион [соединение формулы (XI), где R1 означает водород, R3 – метил, R5 – 4-HOOCC6H4] (соединение N 25); выход: 100% теории; точки плавления: 282oC (разложение). 1H ЯМР (CD3SOCD3/CD3COCD):  15,90 (0,3H, шир, SH), 13,00 (1H, шир с, COOH), 8,26 (2H, д, J=8,2 Гц, H-3′,5′), 8,10 (0,6H, с, SH), 7,85 (2H, д, J= 8,2 Гц, H-2′,6′), 7,40 (1H, д, J=10,8, 7,1 Гц, COOCH2), 3,92 (1H, т, J=5,4 Гц, H-3), 3,63 (3H, с, NCH3), 2,53 (2H, тд, J=8,0 Гц, H-4), 7,29 (1H, дд, J= 8,0, 8,0 Гц, H-5), 6,98 (1H, дд, J=8,0, 7,5 Гц, H-6), 6,68 (1H, д, J=7,5 Гц, H-7), 3,77 (3H, с, NCH3).
13C ЯМР (CD3SOCD3/CD3COCD3): 15,90 (0,3H, шир, SH), 13,00 (1H, шир с, COOH), 8,26 (2H, д, J=8,2 Гц, H-3′,5′), 8,10 (0,6H, с, SH), 7,85 (2H, д, J= 8,2 Гц, H-2′,6′), 7,40 (1H, д, J=10,8, 7,1 Гц, COOCH2), 3,92 (1H, т, J=5,4 Гц, H-3), 3,63 (3H, с, NCH3), 2,53 (2H, тд, J=8,0 Гц, H-4), 7,29 (1H, дд, J= 8,0, 8,0 Гц, H-5), 6,98 (1H, дд, J=8,0, 7,5 Гц, H-6), 6,68 (1H, д, J=7,5 Гц, H-7), 3,77 (3H, с, NCH3).
13C ЯМР (CD3SOCD3/CD3COCD3):  167,57, 167,50 167,57, 167,50 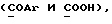 142,40, 135,64, 134,55 (3хс), 130,86, 130,18, 129,13, 126,93 (4хд), 125,17 (с), 123,81, 120,68 (2хд), 112,39 (с), 110,82 (д), 29,94 (NCH3).
C17H13NSO3 142,40, 135,64, 134,55 (3хс), 130,86, 130,18, 129,13, 126,93 (4хд), 125,17 (с), 123,81, 120,68 (2хд), 112,39 (с), 110,82 (д), 29,94 (NCH3).
C17H13NSO3 H2O H2OРассчитано, %: C 64,6; H 4,3; N 4,4; S 10,1. Найдено, %: C 64,6; H 4,4; N 4,0; S 9,6. Путем гидрирования соединения N 86 получают дисульфид бис[3-(4′-карбоксибензоил)-1-метилиндола-(2)] [соединение формулы (XII), где R1 означает водород, R3 – метил, R5 – 4-HOOCC6H4] (соединение N 85); точка плавления (из смеси хлороформа и петролейного эфира): 241 – 246oC. 1H ЯМР (CD3SOCD3):  12,62 (1H, шир, COOH), 7,89 (3H, м, H-4 и H-3′,5′), 7,74 (1H, д, J=8,5 Гц, H-7), 7,58 (3H, м, H-6 и H-2′,6′), 7,36 (1H, м, H-5), 3,66 (3H, с, NCH3).
C34H24N2O6S2 12,62 (1H, шир, COOH), 7,89 (3H, м, H-4 и H-3′,5′), 7,74 (1H, д, J=8,5 Гц, H-7), 7,58 (3H, м, H-6 и H-2′,6′), 7,36 (1H, м, H-5), 3,66 (3H, с, NCH3).
C34H24N2O6S2 0,5H2O 0,5H2OРассчитано, %: C 63,1; H 4,2. Найдено, %: C 63,1; H 5,3. Пример 7. Получение соединений согласно таблице 1 по способу, представленному на реакционной схеме 6. Получение соединения N 89. Путем реакции 2-хлор-1-метилиндол-3-карбоновой кислоты [соединение формулы (XIII)] с тионилхлоридом и гидрохлоридом сложного метилового эфира глицина получают сложный N-карбометоксиметиловый эфир 2-хлор-1-метилиндол-3-карбоксамида [соединение формулы (XIV), где R6 означает водород, R7 – CH2COOMe] ; выход: 78% теории; точка плавления (из смеси дихлорметана и петролейного эфира): 102,5 – 104oC. 1H ЯМР (CDCl3):  8,26 (1H, д, J=8,1 Гц, H-4), 7,30 – 7,23 (3H, м, H-5,6,7), 6,96 (1H, шир, CONH), 4,32 (2H, д, J=5,0 Гц, 8,26 (1H, д, J=8,1 Гц, H-4), 7,30 – 7,23 (3H, м, H-5,6,7), 6,96 (1H, шир, CONH), 4,32 (2H, д, J=5,0 Гц, 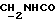 ), 3,81 (3H, с, COOCH3), 3,75 (3H, с, N-CH3).
13C ЯМР: ), 3,81 (3H, с, COOCH3), 3,75 (3H, с, N-CH3).
13C ЯМР:  170,91 170,91 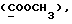 163,48 (CONH), 135,45 (с), 126,90 (с), 125,93 (с), 123,24 (д), 122,25 (д), 121,30 (д), 109,26 (д), 106,32 (с), 52,41 163,48 (CONH), 135,45 (с), 126,90 (с), 125,93 (с), 123,24 (д), 122,25 (д), 121,30 (д), 109,26 (д), 106,32 (с), 52,41 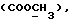 41,38 41,38 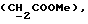 30,11 (N-CH3).
C13H13ClN2O3 30,11 (N-CH3).
C13H13ClN2O3Рассчитано, %: C 55,6; H 4,7; N 10,0. Найдено, %: C 55,3; H 4,8; N 10,2. Путем обработки полученного на предыдущей стадии соединения тиометилом лития получают 2,2′-дитиобис[N-карбоксиметил-1- метилиндолил-3-карбоксамид] (соединение N 89) [соединение формулы (IV), где R1 означает водород, R2 -CONHCH2COOH, R3 – метил] ; выход: 56% теории; точка плавления: 197oC (разложение). 1H ЯМР ((CD3)2SO):  7,98 (1H, д, J=8,1 Гц, H-4), 7,59 (1H, шир, CONH), 7,55 (1H, д, J=8,4 Гц, H-7), 7,35 (1H, дд, J=8,4, 7,5 Гц, H-6), 7,20 (1H, дд, J=8,1, 7,5 Гц, H-5), 3,68 (3H, с, N-CH3), 3,20 (2H, д, J=5,2 Гц, 7,98 (1H, д, J=8,1 Гц, H-4), 7,59 (1H, шир, CONH), 7,55 (1H, д, J=8,4 Гц, H-7), 7,35 (1H, дд, J=8,4, 7,5 Гц, H-6), 7,20 (1H, дд, J=8,1, 7,5 Гц, H-5), 3,68 (3H, с, N-CH3), 3,20 (2H, д, J=5,2 Гц, 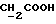 ).
13C ЯМР: ).
13C ЯМР:  171,02 (COOH), 162,57 (CONH), 137,60 (с), 125,36 (с), 124,30 (д), 121,27 (д), 121,11 (д), 117,69 (с), 110,65 (д), 40,35 (CH2), 29,87 (N-CH3).
C24H22N4O6S2 171,02 (COOH), 162,57 (CONH), 137,60 (с), 125,36 (с), 124,30 (д), 121,27 (д), 121,11 (д), 117,69 (с), 110,65 (д), 40,35 (CH2), 29,87 (N-CH3).
C24H22N4O6S2 H2O H2OРассчитано, %: C 52,9; H 4,4; N 10,3; S 11,8. Найдено, %: C 52,5; H 4,5; N 10,0; S 11,2. Получение соединения N 90. Путем реакции 2-хлор-1-метилиндол-3-карбоновой кислоты [соединение формулы (XIII)] с тионилхлоридом и N-метиланилином получают сложный N-метил-N-фениловый эфир 2-хлор-1-метилиндол-3-карбоксамида [соединение формулы (XIV), где R6 означает метил, R7 – фенил]; выход: 67% теории; точка плавления (из смеси ацетона и воды): 163oC. ‘HЯМР ((CD3)2SO): 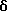 7,47 (1H, д, J=7,6 Гц, H-Ч), 7,41 (1H, д, J=8,3 Гц, H-7), 7,22 – 7,00 (7H, м, ArH), 3,63 (3H, с, N- CH3), 3,42 (3H, с, N-CH3).
13C ЯМР: 7,47 (1H, д, J=7,6 Гц, H-Ч), 7,41 (1H, д, J=8,3 Гц, H-7), 7,22 – 7,00 (7H, м, ArH), 3,63 (3H, с, N- CH3), 3,42 (3H, с, N-CH3).
13C ЯМР:  164,33 (CONMePh), 143,88 (с), 134,69 (с), 128,50 (д), 125,90 (д), 125,70 (д), 124,86 (с), 124,21 (с), 122,24 (д), 120,71 (д), 118,94 (д), 110,06 (д), 108,80 (с), 37,40 (N-CH3), 29,77 (N-CH3).
C17H15ClN2O 164,33 (CONMePh), 143,88 (с), 134,69 (с), 128,50 (д), 125,90 (д), 125,70 (д), 124,86 (с), 124,21 (с), 122,24 (д), 120,71 (д), 118,94 (д), 110,06 (д), 108,80 (с), 37,40 (N-CH3), 29,77 (N-CH3).
C17H15ClN2OРассчитано, %: C 68,3; H 5,1; N 9,4; Cl 11,9. Найдено, %: C 68,4; H 5,1; N 9,3; Cl 12,1. Путем обработки полученного на предыдущей стадии соединения тиометилом лития получают 2,2′-дитиобис[N-метил-N-фенил-1- метилиндолил-3-карбоксамид] (соединение N 90) [соединение формулы (IV), где R1 означает водород, R2 – CON(Me)Ph, R3 – метил]; выход: 53% теории; точка плавления: 158 – 163oC. 1H ЯМР ((CD3)2SO):  7,80 (1H, д, J=7,5 Гц, H-4), 7,57 (1H, д, J=7,8 Гц, H-7), 7,33 – 6,99 (7H, м, ArH), 3,86 (3H, с, N-CH3), 3,33 (3H, с, N-CH3).
13C ЯМР: 7,80 (1H, д, J=7,5 Гц, H-4), 7,57 (1H, д, J=7,8 Гц, H-7), 7,33 – 6,99 (7H, м, ArH), 3,86 (3H, с, N-CH3), 3,33 (3H, с, N-CH3).
13C ЯМР:  164,14 (CONMePh), 137,59 (с), 129,94 (с), 124,21 (с), 123,73 (с), 123,24 (д), 122,34 (д), 120,25 (д), 119,56 (д), 118,79 (д), 115,43 (с), 110,27 (д), 39,68 (N-CH3), 30,99 (N-CH3).
C34H31N4S2O2 164,14 (CONMePh), 137,59 (с), 129,94 (с), 124,21 (с), 123,73 (с), 123,24 (д), 122,34 (д), 120,25 (д), 119,56 (д), 118,79 (д), 115,43 (с), 110,27 (д), 39,68 (N-CH3), 30,99 (N-CH3).
C34H31N4S2O2Рассчитано: [М+H]+ 591,3447. Найдено: [М+H] + 591,3441 (МC в результате бомбардировки быстрыми атомами). C34H30N4S2O2 Рассчитано, %: C 69,1; H 5,1; N 9,5; S 10,9. Найдено, %: C 69,2; H 5,2; N 9,6; S 10,6. Получение соединения N 91. Путем реакции 2-хлор-1-метилиндол-3-карбоновой кислоты [соединение формулы (XIII)] с тионилхлоридом и 3-аминопропан-1,2-диолом получают N-(2,3-диоксипропил)-2-хлор-1-метилиндол-3-карбоксамид [соединение формулы (XIV), где R6 означает водород, R7 – CH2CH(OH)CH2OH] в качестве масла; выход: 46% теории. 1H ЯМР ((CD3)2SO/D2O):  7,94 (1H, д, J=7,0 Гц, H-4), 7,53 (1H, д, J=7,2 Гц, H-7), 7,38 – 7,19 (2H, м, H-5,6), 3,78 (3H, с, N-CH3), 3,68 – 3,26 (5H, м, 7,94 (1H, д, J=7,0 Гц, H-4), 7,53 (1H, д, J=7,2 Гц, H-7), 7,38 – 7,19 (2H, м, H-5,6), 3,78 (3H, с, N-CH3), 3,68 – 3,26 (5H, м, 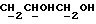 ).
13C ЯМР: ).
13C ЯМР:  162,72 (CONH), 134,94 (с), 125,94 (с), 124,79 (с), 122,52 (д), 121,15 (д), 120,05 (д), 110,17 (д), 107,09 (д), 70,17 (CHOH), 63,90 (CH2OH), 42,34 162,72 (CONH), 134,94 (с), 125,94 (с), 124,79 (с), 122,52 (д), 121,15 (д), 120,05 (д), 110,17 (д), 107,09 (д), 70,17 (CHOH), 63,90 (CH2OH), 42,34  29,97 (N-CH3).
C13H15ClN2O3 29,97 (N-CH3).
C13H15ClN2O3Рассчитано: М+ 284,0742, 282,0771. Найдено: М+ 284,0744, 282,0763 (МC). Путем обработки полученного на предыдущей стадии соединения тиометилом лития получают 2,2′-дитиобис[N-(2,3-диоксипропил)-1- метилиндолил-3-карбоксамид] (соединение N 91) [соединение формулы (IV), где R1 означает водород, R2 -CONHCH2CН(OH)CH2OH, R3 – метил] в качестве желтой пены; выход: 71% теории; точка плавления: 198oC (разложение). 1H ЯМР ((CD3)2SO/D2O):  7,89 (1H, д, J=8,1 Гц, H-4), 7,56 (1H, д, J=8,4 Гц, H-7), 7,42 (1H, дд, J=8,4, 7,3 Гц, H-6), 7,27 (1H, дд, J=8,1, 7,3 Гц, H-5), 3,75 (3H, с, N-CH3), 3,40- 3,20 (5H,м, 7,89 (1H, д, J=8,1 Гц, H-4), 7,56 (1H, д, J=8,4 Гц, H-7), 7,42 (1H, дд, J=8,4, 7,3 Гц, H-6), 7,27 (1H, дд, J=8,1, 7,3 Гц, H-5), 3,75 (3H, с, N-CH3), 3,40- 3,20 (5H,м, 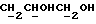 ).
13C ЯМР: ).
13C ЯМР:  162,61 (CONH), 137,70 (с), 125,21 (с), 124,40 (д), 121,34 (д), 121,27 (д), 120,81 (с), 117,85 (с), 110,88 (д), 70,17 (CHOH), 63,75 (CH2OH), 41,96 162,61 (CONH), 137,70 (с), 125,21 (с), 124,40 (д), 121,34 (д), 121,27 (д), 120,81 (с), 117,85 (с), 110,88 (д), 70,17 (CHOH), 63,75 (CH2OH), 41,96  29,95 (N-CH3).
C26H30N4O6S2 29,95 (N-CH3).
C26H30N4O6S2Рассчитано, %: C 55,9; H 5,4; N 10,0; S 11,5. Найдено, %: C 55,4; H 5,4; N 9,7; S 11,5. Получение соединения N 92. Путем реакции 2-хлор-1-метилиндол-3-карбоновой кислоты [соединение формулы (XIII)] с тионилхлоридом и 2-аминопиридином получают N-(2′-пиридил)-2-хлор-1-метилиндол-3-карбоксамид [соединение формулы (XIV), где R6 означает водород, R7 – 2-пиридил]; выход: 42% теории; точка плавления (из петролейного эфира): 123oC. 1H ЯМР (CDCl3):  8,85 (1H, с, CONH), 8,41 (1H, д, J=8,4 Гц, H-4), 8,30 (2H, м), 7,72 (1H, м), 7,28 (3H, м), 7,02 (1H, дд, J=7,2, 4,9 Гц), 3,74 (3H, с, N-CH3).
13C ЯМР: 8,85 (1H, с, CONH), 8,41 (1H, д, J=8,4 Гц, H-4), 8,30 (2H, м), 7,72 (1H, м), 7,28 (3H, м), 7,02 (1H, дд, J=7,2, 4,9 Гц), 3,74 (3H, с, N-CH3).
13C ЯМР:  161,58 (CONH), 151,85 (с), 147,92 (д), 138,27 (д), 135,46 (с), 127,22 (с), 125,84 (с), 123,45 (д), 122,48 (д), 121,16 (д), 119,47 (д), 114,25 (д), 109,44 (д), 106,59 (с), 30,21 (N-CH3).
C15H12ClN3O 161,58 (CONH), 151,85 (с), 147,92 (д), 138,27 (д), 135,46 (с), 127,22 (с), 125,84 (с), 123,45 (д), 122,48 (д), 121,16 (д), 119,47 (д), 114,25 (д), 109,44 (д), 106,59 (с), 30,21 (N-CH3).
C15H12ClN3OРассчитано, %: C 63,1; H 4,2; N 14,7. Найдено, %: C 62,9; H 4,2; N 14,4. В результате обработки полученного на предыдущей стадии соединения тиометилом лития получают 2,2′-дитиобис[N-(2′- пиридил)-1-метилиндол-3-карбоксамид] (соединение N 92) [соединение формулы (IV), где R1 означает водород, R2 – CONH-2-пиридил, R3 – метил]; выход: 68% теории; точка плавления: 270 – 272oC (разложение). 1H ЯМР ((CD3)2SO):  14,93 (1H, шир, CONH), 8,32 (1H, д, J=6,0 Гц), 8,25 (1H, дд, J= 8,3, 7,7 Гц), 8,02 (1H, дд, J=7,4, 3,7 Гц), 7,57 (1H, д, J=8,7 Гц), 7,35 (1H, т, J=6,6 Гц), 7,21 (1H, дд, J=5,1, 3,0 Гц), 7,04 (2H, м), 3,69 (3H, с, N-CH3).
13C ЯМР: 14,93 (1H, шир, CONH), 8,32 (1H, д, J=6,0 Гц), 8,25 (1H, дд, J= 8,3, 7,7 Гц), 8,02 (1H, дд, J=7,4, 3,7 Гц), 7,57 (1H, д, J=8,7 Гц), 7,35 (1H, т, J=6,6 Гц), 7,21 (1H, дд, J=5,1, 3,0 Гц), 7,04 (2H, м), 3,69 (3H, с, N-CH3).
13C ЯМР:  166,48 (с), 165,41 (CONH), 149,16 (с), 145,34 (д), 137,66 (с), 137,49 (с), 127,89 (с), 120,66 (д), 120,44 (д), 118,32 (д). 117,55 (д), 115,32 (д), 107,96 (д), 102,69 (с), 29,40 (N-CH3).
C30H24N6O2S2 166,48 (с), 165,41 (CONH), 149,16 (с), 145,34 (д), 137,66 (с), 137,49 (с), 127,89 (с), 120,66 (д), 120,44 (д), 118,32 (д). 117,55 (д), 115,32 (д), 107,96 (д), 102,69 (с), 29,40 (N-CH3).
C30H24N6O2S2 0,25H2O 0,25H2OРассчитано, %: C 63,3; H 4,3; N 14,8; S 11,3. Найдено, %: C 63,2; H 4,5; N 14,8; S 11,7. Пример 8. Получение соединений согласно таблице 1 по способу, представленному на реакционной схеме 7. Получение соединения N 95. Путем взаимодействия 3-хлоркарбонил-1-(фенилсульфонил)индола [соединение формулы (XV)] с избытком бензиламина в среде дихлорметана получают N-бензил-1-(фенилсульфонил)индол-3-карбоксамид [соединение формулы (XVI), где R8 означает CH2Ph]; точка плавления (из метанола): 188 – 189oC. 1H ЯМР (CDCl3):  8,05 (1H, с, H-2), 8,03 – 7,86 (4H, м, ArH), 7,56 – 7,26 (10H, м, Arh), 6,43 (1H, м, NH), 4,64 (2H, д, J=5,7 Гц, CH2).
C22H18N2O3S 8,05 (1H, с, H-2), 8,03 – 7,86 (4H, м, ArH), 7,56 – 7,26 (10H, м, Arh), 6,43 (1H, м, NH), 4,64 (2H, д, J=5,7 Гц, CH2).
C22H18N2O3SРассчитано, %: C 67,7; H 4,5; N 7,2; S 8,2. Найдено, %: C 67,4; H 4,8; N 7,1; S 8,2. Раствор 4,2 г (11 ммоль) полученного на предыдущей стадии N-бензил-1-(фенилсульфонил)индол-3-карбоксамида [соединение формулы (XVI), где R8 означает CH2Ph] в 200 мл сухого тетрагидрофурана при температуре -78oC обрабатывают 9,1 мл (23 ммоль) 2,5 М раствором н-бутиллития в гексанах. Размешиваемой смеси дают нагреваться до температуры -20oC в течение 15 минут, после чего вновь охлаждают до -78oC и обрабатывают 2,5 мл (28 ммоль) метилдисульфида. Затем смеси дают нагреваться до 20oC и обрабатывают добавлением 20 мл воды. Летучие компоненты удаляют при пониженном давлении и остаток экстрагируют этилацетатом. В результате обработки органического слоя получают сырой продукт, который растворяют в 300 мл метанола. Полученный раствор размешивают с раствором 6,9 г (50 ммоль) карбоната калия в 125 мл воды и в атмосфере азота нагревают при небольшом обратном потоке в течение двух часов для обеспечения полного гидролиза фенилсульфонильной группы. Затем метанол удаляют при пониженном давлении, остаток разбавляют водой и экстрагируют дихлорметаном. В результате хроматографии получаемого масла на окиси алюминия с использованием в качестве элюента дихлорметана получают N-бензил-2-(метилтио)индол-3-карбоксамид [соединение формулы (XVII), где R8 означает CH2Ph] в качестве масла; выход: 2,8 г, 88% теории. 1H ЯМР (CDCl3):  10,65 (1H, с, H-1), 8,29 (д, J=5,1 Гц, H-4), 7,87 (1H, т, J= 5,6 Гц, CONH), 7,34-7,08 (8H, м, ArH), 4,73 (2H, д, J=5,6 Гц, CH2), 2,33 (3H, с, SMe).
13C ЯМР (CDCl3): 10,65 (1H, с, H-1), 8,29 (д, J=5,1 Гц, H-4), 7,87 (1H, т, J= 5,6 Гц, CONH), 7,34-7,08 (8H, м, ArH), 4,73 (2H, д, J=5,6 Гц, CH2), 2,33 (3H, с, SMe).
13C ЯМР (CDCl3):  165,6 (C=O), 138,5, 136,4, 133,1, 110,8 (C), 128,5, 127,2, 127,1, 122,9, 121,4, 126,8, 111,2 (CH), 43,2 (CH2), 18,5 (CH3).
C17H16N2OS 165,6 (C=O), 138,5, 136,4, 133,1, 110,8 (C), 128,5, 127,2, 127,1, 122,9, 121,4, 126,8, 111,2 (CH), 43,2 (CH2), 18,5 (CH3).
C17H16N2OSРассчитано: 296,0983. Найдено: 296,0985 (МC в результате электронной ионизации). Раствор 0,85 г (2,87 ммоль) полученного на предыдущей стадии N-бензил-2-(метилтио)-индол-3-карбоксамида [соединение формулы (XVII), где R означает CH2Ph] в 5 мл диметилацетамида в атмосфере азота добавляют к размешиваемой суспензии 0,93 г (17,2 ммоль) тиометила лития в 10 мл диметилацетамида. Нагревают при температуре 80oC в течение 6 часов, затем смесь подкисляют 3 н. соляной кислотой, экстрагируют дихлорметаном и перерабатывают. Следы диметилацетамида удаляют в высоком вакууме и остаток растворяют в 15 мл метанола, после чего каплями добавляют 0,5 мл 30%-ного раствора перекиси водорода. Охлаждают при температуре -30oC в течение ночи, затем полученный осадок отфильтровывают, причем получают 2,2′-дитиобис[N- бензилиндолил)-3-карбоксамид] (соединение N 95) [соединение формулы (IV), где R1 и R3 означают водород, R2 – CONHCH2Ph] ; выход: 74% теории; точка плавления: 203 – 205oC. 1H ЯМР ((CD3)2SO):  12,97 (1H, с, NH), 8,48 (1H, т, J=5,7 Гц, 12,97 (1H, с, NH), 8,48 (1H, т, J=5,7 Гц,  ), 7,86 (1H, д, J=8,2 Гц, H-4), 7,40 (2H, д, J=8,3 Гц, H-2′,6′), 7,34 (3H, дд, J=8,3, 8,2 Гц, H-7,3′,5′), 7,25 (1H, т, J=8,2 Гц, H-4′), 7,20 -7,10 (2H, м, H-5,6), 4,56 (2H, д, J=5,7 Гц, ), 7,86 (1H, д, J=8,2 Гц, H-4), 7,40 (2H, д, J=8,3 Гц, H-2′,6′), 7,34 (3H, дд, J=8,3, 8,2 Гц, H-7,3′,5′), 7,25 (1H, т, J=8,2 Гц, H-4′), 7,20 -7,10 (2H, м, H-5,6), 4,56 (2H, д, J=5,7 Гц, 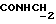 ).
13C ЯМР: ).
13C ЯМР:  164,71 (CONH), 139,77 (с), 136,69 (с), 135,30 (с), 128,16 (д), 127,15 (д), 126,56 (д), 124,44 (с), 122,63 (д), 120,78 (д), 119,25 (д), 111,60 (д), 110,54 (с), 42,62 164,71 (CONH), 139,77 (с), 136,69 (с), 135,30 (с), 128,16 (д), 127,15 (д), 126,56 (д), 124,44 (с), 122,63 (д), 120,78 (д), 119,25 (д), 111,60 (д), 110,54 (с), 42,62 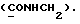 C32H26N4O2S2 Рассчитано, %: C 68,3; H 4,7; N 10,0; S 11,4. Найдено, %: C 68,0; H 4,8; N 9,9; S 11,2. Получение соединения N 96. Путем взаимодействия 3-хлоркарбонил-1-(фенилсульфонил)индола [соединение формулы (XV)] с избытком анилина получают N-фенил-1- (фенилсульфонил)индол-3-карбоксамид [соединение формулы (XVI), где R8 означает фенил]; точка плавления (из метанола): 220 – 222,5oC. 1H ЯМР (CDCl3):  8,18 (1H, с, H-2H), 8,12 (1H, д, J=7,8 Гц, H-4), 7,99 (1H, д, J=8,3 Гц, H-7), 7,91 (2H, д, J=7,9 Гц, ArH), 7,90 (1H, м, NH), 7,65 (2H, д, J=8,4 Гц, ArH), 7,57 (1H, т, J=7,8 Гц, ArH), 7,45 (2H, т, J=7,8 Гц, ArH), 7,41 – 7,33 (4H, м, ArH), 7,15 (1H, т, J=7,4 Гц, H-5).
C21H18N2O3S 8,18 (1H, с, H-2H), 8,12 (1H, д, J=7,8 Гц, H-4), 7,99 (1H, д, J=8,3 Гц, H-7), 7,91 (2H, д, J=7,9 Гц, ArH), 7,90 (1H, м, NH), 7,65 (2H, д, J=8,4 Гц, ArH), 7,57 (1H, т, J=7,8 Гц, ArH), 7,45 (2H, т, J=7,8 Гц, ArH), 7,41 – 7,33 (4H, м, ArH), 7,15 (1H, т, J=7,4 Гц, H-5).
C21H18N2O3SРассчитано, %: C 67,0; H 4,3; N 7,4; S 8,5. Найдено, %: C 66,9; H 4,4; N 7,3; S 8,5. Путем обработки данного соединения н-бутиллитием и метилдисульфидом получают 2-(метилтио)-N-фенилиндол-3-карбоксамид [соединение формулы (XVII), где R8 означает фенил] в качестве масла; выход: 81% теории. 1H ЯМР (CDCl3):  10,19 (1H, с, H-1), 9,59 (1H, с, CONH), 8,47 (1H, д, J= 6,8 Гц, H-4), 7,80 (2H, д, J=8,5 Гц, ArH), 7,43 – 7,35 (3H, м, ArH), 7,28 – 7,16 (3H, м, ArH), 2,51 (3H, с, SCH3).
13C ЯМР (CDCl3): 10,19 (1H, с, H-1), 9,59 (1H, с, CONH), 8,47 (1H, д, J= 6,8 Гц, H-4), 7,80 (2H, д, J=8,5 Гц, ArH), 7,43 – 7,35 (3H, м, ArH), 7,28 – 7,16 (3H, м, ArH), 2,51 (3H, с, SCH3).
13C ЯМР (CDCl3):  163,5 (CO), 138,2, 136,1, 132,5, 127,3, 111,2 (CH), 19,1 (CH3).
C16H14N2OS 163,5 (CO), 138,2, 136,1, 132,5, 127,3, 111,2 (CH), 19,1 (CH3).
C16H14N2OSРассчитано: 282,0827. Найдено: 282,0827 (МC в результате электронной ионизации). Путем обработки полученного на предыдущей стадии соединения тиометилом лития получают 2,2′-дитиобис[N-фенилиндолил-3-карбоксамид] (соединение N 96) [соединение формулы (IV), где R1 и R3 означают водород, R2 – CONHPh]; выход: 67% теории; точка плавления: 220 – 223oC. 1H ЯМР ((CD3)2SO):  12,73 (1H, с, NH), 9,88 (1H, с, CONH), 7,81 (1H, д, J= 7,9 Гц, H-4), 7,69 (2H, д, J=8,4 Гц, H-2′,6′), 7,46 (1H, д, J=7,7 Гц, H-7), 7,34 (2H, дд, J=8,4, 8,3 Гц, H-3′,5′), 7,24 (1H, дд, J=7,7, 7,7 Гц, H-6), 7,17 (1H, дд, J=7,9, 7,7 Гц, H-5), 7,10 (1H, дд, J=8,3 Гц, H-4′).
13C ЯМР: 12,73 (1H, с, NH), 9,88 (1H, с, CONH), 7,81 (1H, д, J= 7,9 Гц, H-4), 7,69 (2H, д, J=8,4 Гц, H-2′,6′), 7,46 (1H, д, J=7,7 Гц, H-7), 7,34 (2H, дд, J=8,4, 8,3 Гц, H-3′,5′), 7,24 (1H, дд, J=7,7, 7,7 Гц, H-6), 7,17 (1H, дд, J=7,9, 7,7 Гц, H-5), 7,10 (1H, дд, J=8,3 Гц, H-4′).
13C ЯМР:  163,27 (CONH), 138,89 (с), 136,73 (с), 133,94 (с), 128,53 (д), 125,12 (с), 123,49 (д), 123,17 (д), 120,99 (д), 120,32 (д), 119,97 (д), 112,89 (с), 111,67 (д).
C30H22N4O2S2 163,27 (CONH), 138,89 (с), 136,73 (с), 133,94 (с), 128,53 (д), 125,12 (с), 123,49 (д), 123,17 (д), 120,99 (д), 120,32 (д), 119,97 (д), 112,89 (с), 111,67 (д).
C30H22N4O2S2Рассчитано, %: C 67,4; H 4,2; N 10,5; S 12,0. Найдено, %: C 67,1; H 4,3; N 10,6; S 12,0. Получение соединения N 97. Путем взаимодействия 3-хлоркарбонил-1-(фенилсульфонил)-индола [соединение формулы (XV)] с избытком метиламина получают N-метил-1-(фенилсульфонил)-1-индол-3-карбоксамид [соединение формулы (XVI), где R8 означает метил]; точка плавления (из метанола): 192,5 -195oC. 1H ЯМР (CDCl3):  8,06 (1H, с, H-2), 8,03 – 7,84 (4H, м, ArH), 7,53 – 7,26 (5H, м, ArH), 6,37 (1H, м, NH), 2,99 (д, J=4,9 Гц, CH3).
C16H14N2O3S 8,06 (1H, с, H-2), 8,03 – 7,84 (4H, м, ArH), 7,53 – 7,26 (5H, м, ArH), 6,37 (1H, м, NH), 2,99 (д, J=4,9 Гц, CH3).
C16H14N2O3SРассчитано, %: C 61,1; H 4,5; N 8,9; S 10,2. Найдено, %: C 61,1; H 4,7; N 8,9; S 10,0. В результате обработки данного соединения н-бутиллитием и метилдисульфидом получают N-метил-2-(метилтио)индол-3- карбоксамид [соединение формулы (XVII), где R8 означает метил]; выход: 95% теории; точка плавления (из смеси гексана и дихлорметана): 138,5 – 139,5oC. 1H ЯМР (CDCl3):  10,31 (1H, с, H-1), 8,35 – 8,26 (1H, м, H-4), 7,44 (1H, т, J=4,8 Гц, NH), 7,38 – 7,30 (1H, м, ArH), 7,19 – 7,11 (2H, м, ArH), 3,06 (3H, д, J=4,8 Гц, CH3), 2,49 (3H, с, SCH3).
13C ЯМР (CDCl3): 10,31 (1H, с, H-1), 8,35 – 8,26 (1H, м, H-4), 7,44 (1H, т, J=4,8 Гц, NH), 7,38 – 7,30 (1H, м, ArH), 7,19 – 7,11 (2H, м, ArH), 3,06 (3H, д, J=4,8 Гц, CH3), 2,49 (3H, с, SCH3).
13C ЯМР (CDCl3):  166,4 (CO), 136,4, 132,4, 127,4, 111,7 (C), 123,1, 121,5, 121,2, 111,1 (CH), 26,3, 18,9 (CH3).
C11H12N2OS 166,4 (CO), 136,4, 132,4, 127,4, 111,7 (C), 123,1, 121,5, 121,2, 111,1 (CH), 26,3, 18,9 (CH3).
C11H12N2OSРассчитано, %: C 60,0; H 5,5; N 12,7; S 14,6. Найдено, %: C 59,8; H 5,7; N 12,7; S 14,5. Путем обработки данного соединения тиометилом лития получают 2,2′-дитиобис-[N-метилиндолинил-3-карбоксамид] (соединение N 97) [соединение формулы (IV), где R1, и R3 означают водород, R2 – CONHMe]; выход: 57% теории; точка плавления: 232 – 236oC (разложение). 1H ЯМР ((CD3)2SO):  12,94 (1H, с, NH), 7,85 (1H, шир, CONH), 7,81 (1H, д, J=8,0 Гц, H-4), 7,46 (1H, д, J=8,0 Гц, H-7), 7,20 (1H, дд, J=8,0, 7,7 Гц, H-6), 7,14 (1H, дд, J=8,0, 7,7 Гц, H-5), 2,88 (3H, д, J=4,5 Гц, CONHCH3).
13C ЯМР: 12,94 (1H, с, NH), 7,85 (1H, шир, CONH), 7,81 (1H, д, J=8,0 Гц, H-4), 7,46 (1H, д, J=8,0 Гц, H-7), 7,20 (1H, дд, J=8,0, 7,7 Гц, H-6), 7,14 (1H, дд, J=8,0, 7,7 Гц, H-5), 2,88 (3H, д, J=4,5 Гц, CONHCH3).
13C ЯМР: 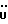 165,20 (CONH), 136,70 (с), 134,76 (с), 124,47 (с), 122,61 (д), 120,71 (д), 119,55 (д), 111,55 (с), 111,02 (с), 26,22 165,20 (CONH), 136,70 (с), 134,76 (с), 124,47 (с), 122,61 (д), 120,71 (д), 119,55 (д), 111,55 (с), 111,02 (с), 26,22  C20H18N4O2S2 Рассчитано, %: C 58,5; H 4,4; N 13,7; S 15,6. Найдено, %: C 58,4; H 4,7; N 14,6; S 15,4. Получение соединения N 98. Раствор 1,8 г (6,4 ммоль) 2-(метилтио)-N-фенил-1H-индол-3-карбоксамида [соединение формулы (XVII), где R8 означает водород] в 400 мл этанола обрабатывают 10,0 г (64 ммоль) гидрохлорида 3-(диметиламино)пропилхлорида и 13 г (96 ммоль) карбоната калия и нагревают с обратным холодильником в течение 3 часов. Затем добавляют еще по 10 эквивалентов реагентов и полученную смесь нагревают с обратным холодильником в течение еще 48 часов. Этанол удаляют при пониженном давлении и остаток разбавляют водой с получением сырого продукта, который подвергают хроматографии на окиси алюминия с использованием в качестве элюента дихлорметана, содержащего 0,2% метанола, причем получают 1-[3-(диметиламино)пропил] -2-(метилтио)-N-фенил-1H-индол-3-карбоксамид [соединение формулы (XVIII), где R8 означает водород, R9 – (CH2)3NMe2] в качестве масла; выход: 0,49 г, 21% теории. 1H ЯМР (CDCl3):  9,93 (1H, с, NH), 8,54 (1H, д, J=7,8 Гц, H-4), 7,74 (2H, д, J=8,6 Гц, H-2′,6′), 7,42 – 7,24 (5H, м, ArH), 7,11 (1H, т, J=7,4 Гц, ArH), 4,46 (2H, т, J=7,4 Гц, 1-CH2), 2,47 (3H, с, SCH3, 2,37 (2H, т, J=6,9 Гц, CH2N), 2,27 (6H, с, N(CH3)2), 1,97 (2H, дхт, J=7,4, 6,9 Гц, CH2CH2CH2).
13C ЯМР: 9,93 (1H, с, NH), 8,54 (1H, д, J=7,8 Гц, H-4), 7,74 (2H, д, J=8,6 Гц, H-2′,6′), 7,42 – 7,24 (5H, м, ArH), 7,11 (1H, т, J=7,4 Гц, ArH), 4,46 (2H, т, J=7,4 Гц, 1-CH2), 2,47 (3H, с, SCH3, 2,37 (2H, т, J=6,9 Гц, CH2N), 2,27 (6H, с, N(CH3)2), 1,97 (2H, дхт, J=7,4, 6,9 Гц, CH2CH2CH2).
13C ЯМР:  162,6 (CO), 138,8, 136,7, 131,4, 127,5, 114,1 (C), 129,0, 124,1, 123,7, 122,8, 122,1, 119,8, 110,0 (CH), 56,5, 42,0, 28,3 (CH2), 45,3 (N(CH3)2), 21,1 (SCH3).
C21H25N3O8 162,6 (CO), 138,8, 136,7, 131,4, 127,5, 114,1 (C), 129,0, 124,1, 123,7, 122,8, 122,1, 119,8, 110,0 (CH), 56,5, 42,0, 28,3 (CH2), 45,3 (N(CH3)2), 21,1 (SCH3).
C21H25N3O8Рассчитано: [M+H]+ 368,1797. Найдено: [M+H]+ 368,1812 (МC в результате бомбардировки быстрыми атомами). Данное соединение обрабатывают тиометилом лития при температуре 80oC в течение 8 часов. Добавляют воду, затем смесь промывают дихлорметаном и водную фазу тщательно нейтрализуют 3 н. соляной кислотой, после чего экстрагируют дихлорметаном. Экстракт перерабатывают с получением масла, которое растворяют в метаноле и каплями при комнатной температуре обрабатывают насыщенным раствором йода в дихлорметане до того, как при анализе тонкослойной хроматографией больше не обнаруживается исходное соединение. Реакционную смесь непосредственно адсорбируют на силикагель и подвергают хроматографии на силикагеле с использованием смеси метанола и этилацетата в соотношении 1: 9 в качестве первого элюента, а в качестве второго элюента смеси метанола и этилацетата в соотношении 1:9, содержащей небольшое количество концентрированной гидроокиси аммония, причем получают 2,2′-дитиобис[1-{3-(диметиламино)} пропил)-N-фенил-1H-индол-3-карбоксамид (соединение N 98) [соединение формулы (IV), где R1 означает водород, R2 – CONHPh, R3 – (CH2)3NMe2] в качестве желтой пены; выход: 10% теории. 1H ЯМР (CD3OD):  8,19 (1H, д, J=7,3 Гц, H-4), 7,64 (1H, д, J=7,5 Гц, H-7), 7,30 – 7,20 (3H, м, ArH), 7,10 – 6,95 (4H, м, ArH), 4,41 (2H, т, J=6,2 Гц, CH2N), 2,74 (2H, т, J=6,7 Гц, CH2NMe2), 2,64 (6H, с, N(CH3)2), 2,09 (2H, м, CH2CH2CH2).
C40H45N6O2S2 8,19 (1H, д, J=7,3 Гц, H-4), 7,64 (1H, д, J=7,5 Гц, H-7), 7,30 – 7,20 (3H, м, ArH), 7,10 – 6,95 (4H, м, ArH), 4,41 (2H, т, J=6,2 Гц, CH2N), 2,74 (2H, т, J=6,7 Гц, CH2NMe2), 2,64 (6H, с, N(CH3)2), 2,09 (2H, м, CH2CH2CH2).
C40H45N6O2S2Рассчитано: [М+H+] 705,3045. Найдено: [М+H+] 705,3035 (МC в результате бомбардировки быстрыми атомами). Пример 9. Получение соединений согласно таблице 1 по способу, представленному на реакционной схеме 8. Получение соединения N 99. К размешиваемому раствору 41 мл (558 ммоль) диметилформамида и 75 мл дихлорметана при температуре 25oC каплями добавляют раствор 133,5 г (465 ммоль) бромокиси фосфора в 100 мл дихлорметана со скоростью, обеспечивающей несильный обратный поток вследствие экзотермической реакции (примерно в течение часа). Получают густую темную суспензию, которую интенсивно размешивают в течение 10 минут, после чего в течение 20 минут каплями добавляют раствор 27,38 г (186 ммоль) 1-метил-2-индолиноно [соединение формулы (VI), где R1 означает водород, R3 – метил] в 55 мл дихлорметана. Полученную смесь нагревают с обратным холодильником в течение 3,5 часов, затем охлаждают до 25oC и надосадочную жидкость сливают и сгущают до получения вязкого красно-коричневатого масла. Данное масло объединяют с полученным твердым веществом и обрабатывают очень осторожно путем добавления порциями примерно 20 г льда, затем 112 г 50%-ного водного раствора гидроокиси натрия, причем все время температуру поддерживают примерно при 30-40oC (значение pH 3). После этого добавляют еще 20 г 50%-ной гидрооксиси натрия, затем 100 мл ледяной воды и осадок собирают путем фильтрации. Твердое вещество тщательно промывают водой, затем сушат над полупятиокисью фосфора, причем получают 42,6 г сырого бромальдегида; точка плавления: 92-97oC. Твердое вещество растворяют примерно в 65 мл дихлорметана и раствор фильтруют через 165 г флеш-силикагеля, размещенного в стеклянной воронке емкостью 600 мл. Остаток промывают дихлорметаном до полной элюации всего продукта. Объединенные продуктсодержащие фракции сгущают, причем получают 34,66 г (78% теории) почти чистого 2-бром-1-метилиндол- 3-карбоксальдегида [соединение формулы (XIX), где R1 означает водород, R’3 – метил, X’ – бром], который непосредственно используют для следующей реакции; точка плавления: 110 – 112oC. К интенсивно размешиваемому раствору 2,38 г (10 ммоль) 2-бром-1-метилиндол-3- карбоксальдегида [соединение формулы (XIX), где R1 означает водород, R’3 – метил, X’ – бром], в 10 мл 2-метил-2-бутена и 40 мл п-диоксана при температуре 25oC в течение примерно 15 минут каплями добавляют раствор 5 г (55 ммоль) хлорита натрия и 5 г (36 ммоль) гидрата фосфата натрия в 25 мл воды. Температуру раствора поддерживают при 25oC в течение 3,5 часов, затем обрабатывают еще раз по 2,5 г хлорита и фосфата. После общего реакционного времени 24 часа реакционную смесь трижды экстрагируют дихлорметаном, затем водную фазу подкисляют путем добавления водной соляной кислоты до значения pH 2 и еще раз экстрагируют. Объединенные органические экстракты промывают водой, сушат и упаривают, в результате чего получают твердый остаток, который кипятят в 2-пропаноле. После охлаждения твердое вещество собирают путем фильтрации, промывают небольшим количеством 2-пропанола и сушат, причем получают 2,21 г (87% теории) 2-бром-1- метилиндол-3-карбоновой кислоты [соединение формулы (XX), где R1 означает водород, R’3 – метил, X’ – бром] в качестве бежевого твердого вещества; точка плавления примерно 198oC (разложение); в двух порциях. Суспензию 2,54 г (10 ммоль) 2-бром-1-метилиндол-3-карбоновой кислоты [соединение формулы (XX), где R1 означает водород, R’3 – метил, X’ – бром], 2,54 г (10 ммоль) хлорангидрида бис(2-оксо-3-оксазолидинил)фосфиновой кислоты, 2,78 мл (20 ммоль) триэтиламина и 25 мл 1,2-дихлороктана нагревают при температуре флегмы в течение 1,5 часов. Реакционную смесь охлаждают и выливают в 150 мл 5%-ного водного раствора бикарбоната натрия и размешивают в течение 30 минут. Затем трижды экстрагируют дихлорметаном, объединенные органические фазы промывают водой и солевым раствором, сушат над сульфатом магния и сгущают, причем получают красное масло. Последнее переводят в порошок путем перемешивания со смесью этилацетата и гексана, твердое вещество собирают путем фильтрации и получают 0,95 г побочного продукта; точка плавления: 227 – 228oC (разложение). Фильтрат сгущают с получением вязкого масла, которое растворяют в хлороформе и адсорбируют в 9 г флеш-силикагеля, который размещают в содержащей флеш-силикагель колонке, и подвергают хроматографии с использованием в качестве элюента смеси гексанов и этилацетата в соотношении 95: 5. Продуктсодержащие фракции объединяют, сгущают и переводят в порошок путем перемешивания с изооктаном с получением 1,96 г (63% теории) сложного т-бутилового эфира 2-бром-1-метилиндол-3-карбоновой кислоты [соединение формулы (XXIV), где R1 означает водород, R2 -COO-трет-бутил, R’3 – метил] в качестве белого твердого вещества; точка плавления: 87 – 88oC. C14H16BrNO2 Рассчитано, %: C 54,21; H 5,20; N 4,52; Br 25,76. Найдено, %: C 54,28; H 5,20; N 4,49; Br 25,83. Охлажденную льдом суспензию 119 мг (1,5 ммоль) элементарного селена в 2 мл тетрагидрофурана в атмосфере азота каплями обрабатывают 1,1 мл 1,5 М раствора комплекса метиллития и бромида лития в диэтиловом эфире. Реактор открывают и путем ввода потока азота получаемую белую суспензию нагревают примерно до 85oC для отгонки диэтилового эфира и большей части тетрагидрофурана. Получаемое полутвердое вещество охлаждают в ледяной ванне и разбавляют добавлением 1,5 мл диметилацетамида и 155 мг (0,5 ммоль) сложного трет-бутилового эфира 2-бром-1-метилиндол-3-карбоновой кислоты. После этого получаемую суспензию размешивают при комнатной температуре в течение 24 часов, охлаждают до 0oC, а затем обрабатывают 2 мл разбавленной уксусной кислоты. Смесь разбавляют водой и трижды экстрагируют хлороформом, каждый раз используя 10 мл. Объединенные экстракты четыре раза промывают водой, сушат над сульфатом натрия и сгущают с получением твердого вещества золотистого цвета. Последнее суспендируют в 2,3 мл смеси уксусной кислоты и воды в объемном соотношении 2:1 , полученную суспензию обрабатывают 154 мг NaBO3  4H2О, после чего размешивают при температуре 25oC в течение 30 минут. Твердое вещество собирают путем фильтрации, промывают водой и сушат, причем получают сложный трет-бутиловый эфир 2,2′-диселенобис[1-метил-1H-индол-3-карбоновой кислоты] (соединение N 99) [соединение формулы (XXII), где R1 означает водород, R2 – COO-трет-бутил, R’3 – метил]; выход: 119 мг, 77% теории; точка плавления: 187 – 189oC.
1H ЯМР (CDCl3): 4H2О, после чего размешивают при температуре 25oC в течение 30 минут. Твердое вещество собирают путем фильтрации, промывают водой и сушат, причем получают сложный трет-бутиловый эфир 2,2′-диселенобис[1-метил-1H-индол-3-карбоновой кислоты] (соединение N 99) [соединение формулы (XXII), где R1 означает водород, R2 – COO-трет-бутил, R’3 – метил]; выход: 119 мг, 77% теории; точка плавления: 187 – 189oC.
1H ЯМР (CDCl3): 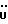 8,13 (1H, дд, J=0,7, 7,9 Гц, H-4), 7,31 – 7,19 (3H, м, ArH), 3,63 (3H, с, NCH3), 1,44 (9H, с, C(CH3)3).
C28H32N2O4Se2 8,13 (1H, дд, J=0,7, 7,9 Гц, H-4), 7,31 – 7,19 (3H, м, ArH), 3,63 (3H, с, NCH3), 1,44 (9H, с, C(CH3)3).
C28H32N2O4Se2 0,2H2O 0,2H2OРассчитано, %: C 54,06; H 5,25; N 4,50. Найдено, %: C 54,40; H 5,48; N 4,11. Получение соединения N 100. К охлаждаемому льдом раствору 4 мл трифторуксусной кислоты в атмосфере азота добавляют 420 мг (0,68 ммоль) сложного трет-бутилового эфира 2,2′-диселенобис[1- метил-1H-индол-3-карбоновой кислоты] (соединение N 85) [соединение формулы (XXII), где R1 означает водород, R2 – COO-трет-бутил, R’3 – метил]. Температуру суспензии поддерживают при 0oC в течение трех часов, затем выливают в ледяную воду. Твердое вещество собирают путем фильтрации, тщательно промывают водой и сушат с получением 361 мг продукта; точка плавления: 165oC (разложение). Твердое вещество суспендируют в 80 мл 10%-ного водного раствора гидроокиси аммония и нерастворимое удаляют путем фильтрации. Фильтрат доводят до значения pH 3 путем добавления 6 н. водной соляной кислоты и твердый осадок собирают путем фильтрации, промывают водой и сушат, причем получают 268 мг (78% теории) 2,2′-диселенобис[1-метил-1H-индол-3-карбоновой кислоты] (соединение N 100) [соединение формулы (XXII), где R1 означает водород, R2 – COOH, R’3 – метил] в качестве оранжевого твердого вещества; точка плавления: 174oC (разложение). 1H ЯМР ((CD3)2SO): 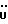 12,35 (1H, с, 12,35 (1H, с, 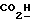 ), 8,04 (1H, д, J=7,9 Гц, H-4), 7,56 (1H, д, J=8,4 Гц, H-7), 7,31 – 7,20 (2H, м, ArH), 3,63 (3H, с, NCH3).
C20H16N2O4Se2 ), 8,04 (1H, д, J=7,9 Гц, H-4), 7,56 (1H, д, J=8,4 Гц, H-7), 7,31 – 7,20 (2H, м, ArH), 3,63 (3H, с, NCH3).
C20H16N2O4Se2 0,1H2O 0,1H2OРассчитано, %: C 47,28; H 3,21; N 5,51. Найдено, %: C 47,20; H 3,20; N 5,12. Получение соединения N 101. К суспензии 2,79 г (11 ммоль) 2-бром-1-метилиндол-3-карбоновой кислоты [соединение формулы (XX), где R1 означает водород, R’3 – метил, X’ – бром] в 13 мл 1,2-дихлорэтана при температуре 25oC каплями добавляют 2,41 мл (33 ммоль) тионилхлорида. Смесь нагревают при температуре 75oC в течение двух часов, затем полученный раствор сгущают с получением твердого вещества, которое упаривают вместе с дихлорметаном. Затем твердое вещество охлаждают льдом и быстро обрабатывают 26 мл 40%-ного водного раствора метиламина. Ванну удаляют и суспензию размешивают при температуре 25oC в течение двух часов. Твердое вещество собирают путем фильтрации, тщательно промывают водой и сушат над полупятиокисью фосфора при давлении 200 мм рт.ст. при температуре 70oC в течение 12 часов с получением 2,2 г (75% теории) продукта; точка плавления: 154 – 157oC (разложение). В результате повторной кристаллизации из метанола получают 1,91 г чистого 2-бром-1-метилиндол-3-N-метилкарбоксамида [соединение формулы (XXI), где R1 означает водород, R’3 – метил, R6 – водород, R7 – метил] в качестве бежевого твердого вещества; точка плавления: 159 – 160oC; в трех порциях. К охлаждаемому льдом раствору метилселенида лития в 2 мл диметилацетамида, полученному вышеописанным методом из 237 г (3 ммоль) элементарного селена и 2,2 мл 1,5 М раствора метиллития в диэтиловом эфире в 3 мл тетрагидрофурана, добавляют 267 мг (1,0 ммоль) 2-бром-1-метилиндол-3-N-метилкарбоксамида [соединение формулы (XXI), где R1 – водород, R’3 – метил, R6 – водород, R7 – метил]. Полученный раствор размешивают при комнатной температуре в течение 3,5 часов, охлаждают до 0oC, затем обрабатывают 5%-ной водной соляной кислотой. Реакционную смесь дважды экстрагируют дихлорметаном, каждый раз используя 10 мл, объединенные экстракты дважды промывают водой и сгущают в вакууме с получением масла, которое растворяют в метаноле. Раствор охлаждают льдом и обрабатывают 113 мкл 30%-ной водной перекиси водорода. После размешивания в течение 10 минут получаемую суспензию фильтруют и твердое вещество промывают 2-пропанолом и сушат, причем получают 183 мг (67% теории) 2,2′-диселенобис[N, 1-диметил-1H-индол-3-карбоксамида] (соединение N 101) [соединение формулы (XXII), где R1 означает водород, R2 – CONHCH3, R’3 – метил] в качестве желтого твердого вещества; точка плавления: 225 – 230oC (разложение). 1H ЯМР (CDCl3 + (CD3)2SO):  7,97 (1H, д, J=7,9 Гц, H-4), 7,39 – 7,18 (3H, м, ArH), 6,84 (1H, c, 7,97 (1H, д, J=7,9 Гц, H-4), 7,39 – 7,18 (3H, м, ArH), 6,84 (1H, c,  ), 3,85 (3H, с, индол NCH3), 2,12 (3H, д, J= 4,5 Гц, ), 3,85 (3H, с, индол NCH3), 2,12 (3H, д, J= 4,5 Гц,  ).
C22H22N4O4Se2 ).
C22H22N4O4Se2 0,9H2O 0,9H2OРассчитано, %: C 48,17; H 4,37; N 10,21. Найдено, %: C 48,20; H 4,22; N 10,28. Получение соединения N 102 (вариант способа по схеме 8). Путем взаимодействия 2-хлор-1-метилиндол-3-карбоновой кислоты [соединение формулы (XX), где R1 означает водород, R’3 – метил, X’ – хлор] с сульфонилхлоридом и реакции получаемого соединения с 3 эквивалентами N,N-диэтилэтилендиамина в дихлорметане при температуре 0oC с последующей переработкой получают 2-хлор-1- метилиндол-3-N-[2-(диэтиламино)этил]карбоксамид [соединение формулы (XXI), где R1 и R6 означают водород, R7 – (CH2)2NEt2, X’ – хлор] в качестве мягкого твердого вещества; выход: 68% теории; данное соединение используют для последующей реакции без дальнейшей очистки. Путем обработки данного соединения метилселенидом лития получают 2,2′-диселенобис[N-[2-(диэтиламино)этил] -1-метил-1H- индол-3-карбоксамид] (соединение N 102) [соединение формулы (XXII), где R1 означает водород, R2 – CONH(CH2)2NEt2, R’3 – метил] ; выход: 68% теории; точка плавления: 128 – 130oC. Путем реакции свободного основания с избытком хлористого водорода в 2-пропаноле с последующим сгущением получают масло. В результате кристаллизации при температуре 25oC указанное соединение получают в виде дигидрохлорида; 18% теории; точка плавления: 160 – 164oC. 1H ЯМР ((CD3)2SO): 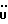 10,13 (1H, c, 10,13 (1H, c, 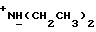 ), 8,14 – 8,11 (1H, м, ), 8,14 – 8,11 (1H, м, 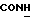 ), 7,89 (1H, д, J=8,2 Гц, H-4), 7,57 (1H, д, J=8,4 Гц, H-7), 7,34 – 7,17 (2H, м, ArH), 3,63 (3H, с, ), 7,89 (1H, д, J=8,2 Гц, H-4), 7,57 (1H, д, J=8,4 Гц, H-7), 7,34 – 7,17 (2H, м, ArH), 3,63 (3H, с, 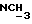 ), 3,17 – 3,14 (2H, м, ), 3,17 – 3,14 (2H, м, 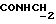 ), 3,06 – 3,00 (4H, м, ), 3,06 – 3,00 (4H, м, 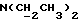 ), 2,86 (2H, т, J=6,5 Гц, ), 2,86 (2H, т, J=6,5 Гц, 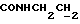 ), 1,16 (6H, т, J=7,2 Гц, ), 1,16 (6H, т, J=7,2 Гц, 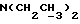 ).
C32H44N6O2Se2 ).
C32H44N6O2Se2 2,0HCl 2,0HCl  1,7H2O 1,7H2OРассчитано, %: C 47,67; H 6,18; N 10,42; Cl– 8,79. Найдено, %: C 47,71; H 6,12; N 10,35; Cl– 8,97. Получение соединения N 103. К размешиваемой механической мешалкой суспензии 15 г (83,5 ммоль) 2-хлориндол-3-карбоксальдегида [соединение формулы (XIX), где R1 и R’3 означают водород, X’ – хлор], 84 мл 2-метил-2-бутена и 200 мл п-диоксана в ледяной ванне добавляют раствор по 40 г хлорита натрия и моногидрата бифосфата натрия в 200 мл воды. Двухфазную смесь интенсивно размешивают при температуре 25oC в течение 3,5 часов. Добавляют еще по 16 г хлорита натрия и моногидрата бифосфата натрия, после чего продолжают перемешивать в течение еще 3,5 часов. Смесь разбавляют добавлением 350 мл этилацетата и 200 мл воды, затем слои разделяют, водную фазу экстрагируют 300 мл этилацетата. Объединенные органические экстракты трижды экстрагируют холодной 2%-ной водной гидроокисью натрия, каждый раз используя 200 мл. После этого основные экстракты объединяют и подкисляют добавлением 6 н. раствора соляной кислоты до значения pH 4. Твердый осадок собирают путем фильтрации, тщательно промывают водой и сушат на воздухе в течение ночи. Твердое вещество растворяют в 150 мл горячего ацетона и полученный раствор обрабатывают 65 мл гексана. Оставляют стоять при температуре 3oC в течение 20 часов, затем твердое вещество собирают путем фильтрации, промывают холодным ацетоном и сушат, в результате чего получают чистую 2-хлориндол-3-карбоновую кислоту [соединение формулы (XX), где R1 и R’3 означают водород, X’ – хлор] в качестве беловатого твердого вещества; выход: 7,71 г; точка плавления: 181,5oC (разложение). Путем дальнейшей переработки фильтрата вышеописанным методом получают вторую порцию продукта в размере 2,41 г; точка плавления: 179,5oC (разложение). Общий выход: 10,12 г, 62% теории. Xлорангидрид 2-хлориндол-3-карбоновой кислоты [соединение формулы (XX), где R1 и R’3 означают водород, X’ – хлор] получают с использованием сульфонилхлорида, а путем реакции данного соединения с насыщенным раствором безводного метиламина в тетрагидрофуране при температуре 0oC получают 2-хлориндол-3-N- метилкарбоксамид [соединение формулы (XXI), где R1, R3 и R6 означают водород, R7 – метил, X’ – хлор]; выход: 51% теории; точка плавления: 234 – 236oC. Путем взаимодействия данного соединения с метилселенидом лития получают 2,2′-диселенобис[N-метил-1H-индол-3- карбоксамид] (соединение N 103) [соединение формулы (XXII), где R1 и R3 означают водород, R2 – CONHCH3]; выход: 20% теории; точка плавления: 272 – 275oC (разложение). 1H ЯМР ((Cl3)2SO): 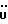 12,36 (1H, с, индол NH), 7,83 (1H, д, J=7,7 Гц, H-4), 7,79 (1H, д, J=4,1 Гц, 12,36 (1H, с, индол NH), 7,83 (1H, д, J=7,7 Гц, H-4), 7,79 (1H, д, J=4,1 Гц,  ), 7,48 (1H, д, J=7,7 Гц, H-7), 7,16 – 7,07 (2H, м, ArH), 2,90 (3H, д, J=4,1 Гц, ), 7,48 (1H, д, J=7,7 Гц, H-7), 7,16 – 7,07 (2H, м, ArH), 2,90 (3H, д, J=4,1 Гц,  ).
C20H18N4O2Se2 ).
C20H18N4O2Se2 0,9H2O 0,9H2OРассчитано, %: C 46,15; H 3,83; N 10,76. Найдено, %: C 46,08; H 3,44; N 10,45. Получение соединения N 104. Xлорангидрид 2-хлориндол-3-карбоновой кислоты [соединение формулы (XX), где R1 и R’3 означают водород, X’ – хлор] получают с использованием сульфонилхлорида. Путем реакции данного соединения с 3 эквивалентами N,N-диэтилэтилендиамина в диэтиловом эфире с последующей переработкой получают 2-хлориндол- 3-N-[2-(диэтиламино)этил] карбоксамид [соединение формулы (XXI), где R1, R’3 и R6 означают водород, R7 – (CH2)NEt2, X’ – хлор]; выход: 38% теории; точка плавления: 99 – 108oC. 1H ЯМР (CDCl3): 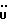 11,50 (1H, с, индол NH), 8,19 (1H, д, J=6,5 Гц, H-4), 7,33 (1H, д, J=8,4 Гц, H-7), 7,21 – 7,15 (3H, м, ArH и 11,50 (1H, с, индол NH), 8,19 (1H, д, J=6,5 Гц, H-4), 7,33 (1H, д, J=8,4 Гц, H-7), 7,21 – 7,15 (3H, м, ArH и 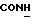 ), 3,54 (2H, кв, J= 5,3 Гц, ), 3,54 (2H, кв, J= 5,3 Гц, 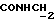 ), 2,69 (2H, т, J=6,0 Гц, ), 2,69 (2H, т, J=6,0 Гц, 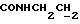 ), 2,59 (4H, кв, J= 7,2 Гц, ), 2,59 (4H, кв, J= 7,2 Гц, 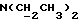 ), 1,05 (6H т, J=7,2 Гц, ), 1,05 (6H т, J=7,2 Гц, 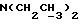 ).
Путем реакции данного соединения с метилселенидом лития получают 2,2′-диселенoбиc[N-[2-(диэтилaминo)этил] -1H-индoл-3-кapбoкcaмид] (соединение N 104) [соединение формулы (XXII), где R1 и R’3 означают водород, R2 – CONH(CH2)2NEt2]; выход: 44% теории; точка плавления: 225 – 226oC (разложение). Путем солеобразования по вышеописанному методу получают данное соединение в качестве дигидрохлорида; выход: 85% теории; точка плавления: 257 – 259oC (разложение).
1H ЯМР ((CD3)2SO): ).
Путем реакции данного соединения с метилселенидом лития получают 2,2′-диселенoбиc[N-[2-(диэтилaминo)этил] -1H-индoл-3-кapбoкcaмид] (соединение N 104) [соединение формулы (XXII), где R1 и R’3 означают водород, R2 – CONH(CH2)2NEt2]; выход: 44% теории; точка плавления: 225 – 226oC (разложение). Путем солеобразования по вышеописанному методу получают данное соединение в качестве дигидрохлорида; выход: 85% теории; точка плавления: 257 – 259oC (разложение).
1H ЯМР ((CD3)2SO):  12,75 (1H, с, индол NH), 10,08 (1H, с, 12,75 (1H, с, индол NH), 10,08 (1H, с, 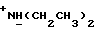 ), 8,09 (1H, т, J=5,7 Гц, ), 8,09 (1H, т, J=5,7 Гц, 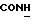 ), 7,93 (1H, д, J=8,9 Гц, H-4), 7,51 (1H, д, J= 6,8 Гц, H-7), 7,19 – 7,12 (2H, м, ArH), 3,78 – 3,73 (2H, м, ), 7,93 (1H, д, J=8,9 Гц, H-4), 7,51 (1H, д, J= 6,8 Гц, H-7), 7,19 – 7,12 (2H, м, ArH), 3,78 – 3,73 (2H, м, 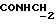 ), 3,32 (2H, т, J=6,5 Гц, ), 3,32 (2H, т, J=6,5 Гц, 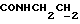 ), 3,29 – 3,20 (4H, м, ), 3,29 – 3,20 (4H, м, 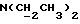 ), 1,26 (6H, т, J=7,2 Гц, ), 1,26 (6H, т, J=7,2 Гц, 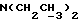 ).
C30H40N6O2Se2 ).
C30H40N6O2Se2  2,0HCl 2,0HCl  1,0H2O 1,0H2OРассчитано, %: C 47,07; H 5,79; N 10,98; Cl– 9,26. Найдено, %: C 47,01; H 5,70; N 10,56; Cl– 8,87. Получение соединения N 105. Смесь 2,09 г (10 ммоль) 2-хлориндол-3-N-метилкарбоксамида [соединение формулы (XXI), где R1 R’3 и R6 означают водород, R7 – метил, X’ – хлор], 1,72 г (10 ммоль) гидрохлорида 2-диэтиламиноэтилхлорида, 7,5 г (23 ммоль) безводного карбоната цезия, 3 г молекулярного сита  и 20 мл ацетона азота размешивают в атмосфере азота при температуре 25oC в течение 16 часов. Смесь фильтруют через целит, и фильтрат сгущают с получением твердого вещества, которое распределяют между хлороформом и водой. Органическую фазу сушат над сульфатом натрия и сгущают и получаемый при этом остаток кристаллизуют из смеси этилацетата и гексанов в соотношении 5:8. Твердое вещество собирают и сушат с получением 1,43 г (46% теории) 2-хлор-1-[2-(диэтиламино)этил]-N-метил-1H-индол-3-карбоксамида [соединение формулы (XXI), где R1 и R6 означают водород, R’3 – (CH2)2NEt2, R7 – метил, X’ – хлор]; точка плавления: 103 – 104oC.
1H ЯМР (CDCl3): и 20 мл ацетона азота размешивают в атмосфере азота при температуре 25oC в течение 16 часов. Смесь фильтруют через целит, и фильтрат сгущают с получением твердого вещества, которое распределяют между хлороформом и водой. Органическую фазу сушат над сульфатом натрия и сгущают и получаемый при этом остаток кристаллизуют из смеси этилацетата и гексанов в соотношении 5:8. Твердое вещество собирают и сушат с получением 1,43 г (46% теории) 2-хлор-1-[2-(диэтиламино)этил]-N-метил-1H-индол-3-карбоксамида [соединение формулы (XXI), где R1 и R6 означают водород, R’3 – (CH2)2NEt2, R7 – метил, X’ – хлор]; точка плавления: 103 – 104oC.
1H ЯМР (CDCl3):  8,24 (1H, д, J=8,0 Гц, H-4), 7,33 – 7,21 (3H, м, ArH), 6,35 (1H, с, 8,24 (1H, д, J=8,0 Гц, H-4), 7,33 – 7,21 (3H, м, ArH), 6,35 (1H, с,  ), 4,27 (2H, т, J=7,6 Гц, ), 4,27 (2H, т, J=7,6 Гц, 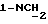 ), 3,06 (3H, д, J= 4,8 Гц, ), 3,06 (3H, д, J= 4,8 Гц, 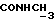 ), 2,73 (2H, т, J=7,5 Гц, ), 2,73 (2H, т, J=7,5 Гц, 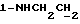 ), 2,62 – 2,55 (4H, м, ), 2,62 – 2,55 (4H, м, 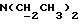 ), 1,02 (6H, т, J=7,0 Гц, ), 1,02 (6H, т, J=7,0 Гц, 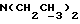 ).
Путем реакции данного соединения с метилселенидом лития получают 2,2′-диселенобис[1-[2-(диэтиламино)этил] -N-метил-1H- индол-3-карбоксамид] (соединение N 105) [соединение формулы (XXII), где R1 означает водород, R2 -CONHCH3, R’3 – (CH2)2NEt2] ; выход: 63% теории; точка плавления: 156 – 157oC.
C32H44N6O2Se2 ).
Путем реакции данного соединения с метилселенидом лития получают 2,2′-диселенобис[1-[2-(диэтиламино)этил] -N-метил-1H- индол-3-карбоксамид] (соединение N 105) [соединение формулы (XXII), где R1 означает водород, R2 -CONHCH3, R’3 – (CH2)2NEt2] ; выход: 63% теории; точка плавления: 156 – 157oC.
C32H44N6O2Se2 0,5H2O 0,5H2OРассчитано, %: C 54,01; H 6,37; N 11,81, Найдено, %: C 54,14; H 6,23; N 11,54. Нижеследующие примеры иллюстрируют возможные формы предлагаемой фармацевтической композиции. Пример 8. 5 мг активного вещества формулы (I) растворяют в 1 л дистиллированной воды для приготовления готового к применению раствора. Пример 9. 5 мг активного вещества формулы (1) растворяют в 10%-ном ДМА, содержащемся в буфере 50 ммоль молочной кислоты, pH 4,0. Получают готовый к применению раствор. БИОЛОГИЧЕСКОЕ И БИОХИМИЧЕСКОЕ ДЕЙСТВИЕ Опыт по исследованию торможения протеин-тирозинкиназы и роста клеток в тканевых культурах. В таблице 2 представлены данные по торможению протеин-тирозинкиназы рецептора фактора роста эпидермиса и по торможению роста клеток. При этом в таблице 2 под “N” указывается номер соединения согласно таблице 1, “КТ50 (ТК РФРЭ)” стоит за концентрацию активного вещества, требуемую для снижения включения P32 в ГАТ на 50% (при этом “ГАТ” стоит за полимер глицина, аланина и тирозина, а “ТК РФРЭ” означает “тирозин-киназа рецептора фактора роста эпидермиса”), “КТ50 (ТК РФРТ)” – за концентрацию активного вещества, требуемую для снижения включения P32 в субстрат глутамина и тирозина на 50% (при этом “ТК РФРТ” – тирозин-киназа фактора роста, полученного из тромбоцитов), а “КТ50 ТР” – за концентрацию активного вещества, требуемую для снижения роста клеток на 50% (“ТР” = торможение роста). Опыт по исследованию действия тирозин-киназы рецептора фактора роста эпидермиса. Мембранные пузырьки подготовляют по методу, описанному S. Cohen, H. Ushiro, C. Stoscheck и М. Chinkers (см. “A native 170,000 epidermal growth factor receptor-kinase complex from shed plasma membrane vesicles” в J. Biol. Chem. , 1982 г., 257: стр. 1523 – 1531) и до употребления хранят при температуре -90oC. При проведении опыта мембраны солюбилизуют водой, содержащей 4% Triton X-100 и 10% глицерина. Реакцию проводят в углублениях микротитерной пластинки, снабженной 96 углублениями, имеющими общую емкость 125 л. Добавляют буфер, содержащий 20 ммоль Hеpes (pH 7,4), 15 ммоль хлорида магния, 4 ммоль хлорида марганца и 0,02 % альбумина бычьей сыворотки, а затем 5-20 мг мембранного белка и 150 нг фактора роста эпидермиса. Пластинки инкубируют при комнатной температуре в течение 10 минут для активирования киназы рецептора. Затем добавляют 20 г полимера глицина, аланина и тирозина и 0,2 мкюри соединения  – [P32]-аденозинтрифосфата с исследуемым соединением или без него и инкубируют при комнатной температуре в течение 10 минут. Реакцию прекращают путем добавления 125 мл 30%-ной трихлоруксусной кислоты, осадок дважды промывают 15%-ной трихлоруксусной кислотой, каждый раз используя 200 мл, на фильтрах величиной ячеек 0,65 микрона, и фильтры подвергают считыванию путем сцинтилляционной спектрометрии.
Опыт по исследованию торможения протеин-тирозинкиназы рецептора фактора роста, полученного из тромбоцитов.
Рекомбинантным бакуловирусом, содержащим домен человеческой внутриклеточной тирозин-киназы рецептора – [P32]-аденозинтрифосфата с исследуемым соединением или без него и инкубируют при комнатной температуре в течение 10 минут. Реакцию прекращают путем добавления 125 мл 30%-ной трихлоруксусной кислоты, осадок дважды промывают 15%-ной трихлоруксусной кислотой, каждый раз используя 200 мл, на фильтрах величиной ячеек 0,65 микрона, и фильтры подвергают считыванию путем сцинтилляционной спектрометрии.
Опыт по исследованию торможения протеин-тирозинкиназы рецептора фактора роста, полученного из тромбоцитов.
Рекомбинантным бакуловирусом, содержащим домен человеческой внутриклеточной тирозин-киназы рецептора  – фактора роста, полученного из тромбоцитов, заражали клетки SF9 с тем, чтобы осуществить сверхэкспрессию белка, и клеточные лизаты использовали для проведения опыта. Cпособность протеин-тирозинкиназы к фосфорилированию субстрата глутамата и тирозина в присутствии P32-аденозинтрифосфата и ингибитора определяли путем считывания включенного в субстрат глутамата и тирозина P32 в осаждаемой трихлоруксусной кислотой массе.
В таблице 2 приведены данные по торможению протеин-тирозинкиназы рецептора фактора роста, полученного из тромбоцитов. При этом в столбце “N” приведены номера соединений согласно таблице 1.
ПОДРОБНЫЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ СОЕДИНЕНИЙ NN 21 И 57.
Действие на клетки в тканевых культурах.
Швейцарские фибробласты 3Т3, рост которых приостановили в свободной от сыворотки среде в течение 24 часов, в течение двух часов обрабатывали исследуемым соединением в разных концентрациях. После этого клетки в течение 5 минут обрабатывали индивидуальными факторами роста и белки, фосфорилированные на тирозине как реакции на митогены, обнаруживали путем Вестерн-блоттинга с использованием антител против фосфотирозина. Подобные методы использовали для опухолевых клеточных линий с той разницей, что продлили время пребывания в свободной от сыворотки среде.
При концентрации от 10 до 50 ммоль соединением N 21 подавлялись (а) опосредованное фактором роста эпидермиса фосфорилирование разных эндогенных белков, (б) автофосфорилирование рецептора фактора роста, полученного из тромбоцитов, опосредованное фактором роста, полученным из тромбоцитов, а также фосфорилирование тирозина других эндогенных протеинов, опосредованное фактором роста, полученным из тромбоцитов, и (в) фосфорилирование тирозина, опосредованное бычьим фетальным фактором роста. Соединение N 57 показывает более выраженную избирательность и подавляет лишь фосфорилирование тирозина, опосредованное бычьим фетальным фактором роста, при этом при очень низкой концентрации, составляющей лишь 2 ммоль.
Действие на опосредованный факторами роста митогенез.
Швейцарские фибробласты 3Т3, рост которых приостановили в свободной от сыворотки среде в течение 24 часов, в течение двух часов обрабатывали исследуемым соединением в разных концентрациях. После этого клетки в течение 5 минут обрабатывали индивидуальными факторами роста, и митогенез определяли путем считывания меченного тритием тимидина, включенного в ДHК.
Концентрации соединений NN 21 и 57, требуемые для торможения опосредованного разными факторами роста митогенеза на 50% (КТ 50 в мкмоль), представлены в таблице 3.
Опыт по исследованию торможения роста.
Швейцарские 3Т3 фибробласты мышей поддерживали в среде DMEM/F12 (DMEM – модифицированная по способу Дульбекко среда Игла), содержащей 10% фетальной телячьей сыворотки. В пластинки, снабженные 24 углублениями, подали по 2 мл клеток плотностью 1 – фактора роста, полученного из тромбоцитов, заражали клетки SF9 с тем, чтобы осуществить сверхэкспрессию белка, и клеточные лизаты использовали для проведения опыта. Cпособность протеин-тирозинкиназы к фосфорилированию субстрата глутамата и тирозина в присутствии P32-аденозинтрифосфата и ингибитора определяли путем считывания включенного в субстрат глутамата и тирозина P32 в осаждаемой трихлоруксусной кислотой массе.
В таблице 2 приведены данные по торможению протеин-тирозинкиназы рецептора фактора роста, полученного из тромбоцитов. При этом в столбце “N” приведены номера соединений согласно таблице 1.
ПОДРОБНЫЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ СОЕДИНЕНИЙ NN 21 И 57.
Действие на клетки в тканевых культурах.
Швейцарские фибробласты 3Т3, рост которых приостановили в свободной от сыворотки среде в течение 24 часов, в течение двух часов обрабатывали исследуемым соединением в разных концентрациях. После этого клетки в течение 5 минут обрабатывали индивидуальными факторами роста и белки, фосфорилированные на тирозине как реакции на митогены, обнаруживали путем Вестерн-блоттинга с использованием антител против фосфотирозина. Подобные методы использовали для опухолевых клеточных линий с той разницей, что продлили время пребывания в свободной от сыворотки среде.
При концентрации от 10 до 50 ммоль соединением N 21 подавлялись (а) опосредованное фактором роста эпидермиса фосфорилирование разных эндогенных белков, (б) автофосфорилирование рецептора фактора роста, полученного из тромбоцитов, опосредованное фактором роста, полученным из тромбоцитов, а также фосфорилирование тирозина других эндогенных протеинов, опосредованное фактором роста, полученным из тромбоцитов, и (в) фосфорилирование тирозина, опосредованное бычьим фетальным фактором роста. Соединение N 57 показывает более выраженную избирательность и подавляет лишь фосфорилирование тирозина, опосредованное бычьим фетальным фактором роста, при этом при очень низкой концентрации, составляющей лишь 2 ммоль.
Действие на опосредованный факторами роста митогенез.
Швейцарские фибробласты 3Т3, рост которых приостановили в свободной от сыворотки среде в течение 24 часов, в течение двух часов обрабатывали исследуемым соединением в разных концентрациях. После этого клетки в течение 5 минут обрабатывали индивидуальными факторами роста, и митогенез определяли путем считывания меченного тритием тимидина, включенного в ДHК.
Концентрации соединений NN 21 и 57, требуемые для торможения опосредованного разными факторами роста митогенеза на 50% (КТ 50 в мкмоль), представлены в таблице 3.
Опыт по исследованию торможения роста.
Швейцарские 3Т3 фибробласты мышей поддерживали в среде DMEM/F12 (DMEM – модифицированная по способу Дульбекко среда Игла), содержащей 10% фетальной телячьей сыворотки. В пластинки, снабженные 24 углублениями, подали по 2 мл клеток плотностью 1 104/мл без ингибитора или вместе с разной концентрацией ингибитора. Клетки выращивали в присутствии 5% двуокиси углерода при температуре 37oC в течение 72 часов, а затем считывали с использованием счетчика Коултера. Данные выражали как концентрацию ингибитора, требуемую для снижения роста на 50%.
Оказалось, что соединение N 21 обладает тормозящим рост действием в отношении разных человеческих опухолевых клеточных линий, а также Швейцарских 3Т3 фибробластов. Требуемая для 50%-ного торможения роста клеток концентрация соединения N 21 следующая: 104/мл без ингибитора или вместе с разной концентрацией ингибитора. Клетки выращивали в присутствии 5% двуокиси углерода при температуре 37oC в течение 72 часов, а затем считывали с использованием счетчика Коултера. Данные выражали как концентрацию ингибитора, требуемую для снижения роста на 50%.
Оказалось, что соединение N 21 обладает тормозящим рост действием в отношении разных человеческих опухолевых клеточных линий, а также Швейцарских 3Т3 фибробластов. Требуемая для 50%-ного торможения роста клеток концентрация соединения N 21 следующая:Клеточная линия – КТ50 (в мкмоль) MDA 468 груди – 43 А431 эпидермиса – 62 А549 легких – 30 MDV-7 груди – 39 MDA-231 груди – 15 Швейцарские 3Т3 фибробласты – 64 HТ-29 ободочной кишки – 55 Хотя карбоксилсодержащие соединения относятся к наиболее активным ингибиторам энзима они плохо внедряются в клетки, причем менее активные сложные эфиры включаются в клетки эффективно, и когда они находятся в цитоплазме им придается высокая активность эстеразами. Поэтому сложные эфиры наверно являются более выгодными для использования в рамках настоящего изобретения, чем карбоновые кислоты. Приведенные в таблице 2 данные показывают, что среди 2-тиоиндолов общей формулы (1), указанных в таблице 1, находятся соединения, обладающие активностью как эффективные ингибиторы протеин-тирозинкиназы и цитотоксические агенты. Формула изобретения
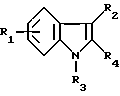 и их таутомеры, где R1 – водород, галоген, низший алкил, гидроксил, нитро, трифторметил, группы OCOR и OR, в которых R означает низший алкил, при этом остаток R1 может заменять одну метиновую группу кольца аза-атомом; R2 – группы (CH2)nCOOH, (CH2)nCONH2, (CH2)nCOOR, (CH2)nCONHR, (CH2)nCONRR, (CH2)nCONHCH2Ph, CONHR, CONRR, CONHPh, COPhCOOH, COPhCOOR, (CH2)nCONHPh или (CH2)nCONHPhR, где R имеет вышеуказанное значение, Ph означает фенил, n = 1 – 4, группы COY и SO2Y, где Y означает фенил, незамещенный или замещенный низшим алкилом, карбоксилом или группой OCOR, где R имеет вышеуказанное значение; R3 – водород, низший алкил, бензил; R4 – группы SH, S0X, S0Q и Se0Q’, где 0 = 1, 2 или 3, X – водород, низший алкил, бензил, Q – дальнейший 2-тиоиндолил общей формулы (I), Q’ – дальнейший 2-селеноиндолил общей формулы (I) при условии, что если R4 означает группу Se0Q’, то R2 означает группы -COOR5, где R5 означает водород или низший алкил, -CONHR6, где R6 означает низший алкил или (CH2)2 N – низший диалкил, или группу -CH2CH(R2′)C(O)NHCH2Ph, где R2′ означает амино, а Ph – фенил, при этом следующие соединения исключены из притязаний: 2-(2-тиоксо-3-индолинил)-уксусная кислота, 2-(1-метил-2-тиоксо-3-индолинил)-уксусная кислота, метил 2-(2-тиоксо-3-индолинил)ацетат, этил 2-(1-метил-2-тиоксо-3-индолинил)ацетата, дисульфид бис[метилиндолинил-3-ацетата-(2)], дисульфид бис[индолил-3-уксусной кислоты-(2)] , трисульфид бис[метилиндолил-3-ацетата-(2)] , дисульфид бис-[1-метилиндолил-3-уксусной кислоты-(2)] , сложный метиловый эфир 2,3-дигидро-2-тиоксо-1H-индол-3-уксусной кислоты и сложный метиловый эфир 2-(метилтио)-1H-индол-3-уксусной кислоты, смеси их изомеров или отдельные изомеры и фармацевтически приемлемые соли. 2. Производные индола общей формулы (I) по п.1, представляющие собой соединения из группы, включающей сложный метиловый эфир 2-(1-метил-2-тиоксо-3-индолинил)-уксусной кислоты, сложный N-бензиловый эфир (2-тиоксо-3-индолинил)ацетамида, 3-(2-тиоксо-3-индолинил)пропионовую кислоту, 3-(1-метил-2-тиоксо-3-индолинил)пропионовую кислоту, сложный метиловый эфир 3-(2-тиоксо-3-индолинил)пропионовой кислоты, сложный этиловый эфир 3-(2-тиоксо-3-индолинил)пропионовой кислоты, 3-(1-метил-2-тиоксо-3-индолинил)пропионат, сложный этиловый эфир 3-(1-метил-2-тиоксо-3-индолинил)пропионовой кислоты, сложный N-бензиловый эфир 3-(2-тиоксо-3-индолинил)пропанамида, 4-(2-тиоксо-3-индолинил)бутановую кислоту, 4-(1-метил-2-тиоксо-3-индолинил)бутановую кислоту, сложный метиловый эфир 4-(2-тиоксо-3-индолинил)бутановой кислоты, сложный метиловый эфир 4-(1-метил-2-тиоксо-3-индолинил)бутановой кислоты, сложный N-фениловый эфир (1-метил-2-тиоксо-3-индолинил)карбоксамида, сложный N-фениловый эфир (1-метил-2-метилтио-3-индолинил)карбоксамида, 3-бензоил-1-метил-2-индолинтион, 3-(4′-карбоксибензоил)-1-метил-2-индолинтион, 3-(4′-карбметоксибензоил)-1-метил-2-индолинтион, 3-(2-тиоксо-3-индолинил)пропионовую кислоту, 4-(2-тиоксо-3-индолинил)бутановую кислоту, сложный бензиловый эфир дисульфида [N-фенил-1-метилиндолил-3-карбоксамида(2)], трисульфид бис[индолил-3-уксусной кислоты-(2)], сложный N-бензиловый эфир (2-тиоксо-3-индолинил)ацетамида, дисульфид бис[индолил-3-пропионовой кислоты-(2)], 2,2′-дитиобис[3-(1-метил-3-индолил)пропионовую кислоту], дисульфид бис[этилиндолил-3-пропионата-(2)], 2,2′-дитиобис[метил-3-(1-метил-3-индолил)пропионат, дисульфид бис[6-метилиндолил-3-пропионовой кислоты-(2)], дисульфид бис[этил-6-метилиндолил-3-пропионата-(2)], дисульфид бис[7-метилиндолил-3-пропионовой кислоты-(2)], 2,2′-дитиобис[N-бензил-3-(3-индолил)пропанамид], 2,2′-дитиобис[4-(1-метил-3-индолил)бутановую кислоту], дисульфид бис[метил-1-метилиндолил-3-бутаноата-(2)], дисульфид бис[N-фенил-1-метилиндолил-3-карбоксамида-(2)], дисульфид бис[N-фенил-5-хлор-1-метилиндолил-3-карбоксамида-(2)], дисульфид бис[N-фенил-6-метокси-1-метилиндолил-3-карбоксамида-(2)], дисульфид бис[N-фенил-7-метокси-1-метилиндолил-3-карбоксамида-(2)], дисульфид бис[N-метил-1-метилиндолил-3-карбоксамида-(2)], дисульфид бис[N-бензил-1-метилиндолил-3-карбоксамида-(2)], дисульфид бис[N-(метилфенилсульфонил)-2-индолила], дисульфид бис[3-(4′-карбоксибензоил)-1-метилиндола-(2)], дисульфид бис[3-(4′-карбметоксибензоил)-1-метилиндола-(2)], сложный метиловый эфир 3-(1-метил-2-тиоксо-3-индолинил)пропионовой кислоты, сложный этиловый эфир 3-(1-метил-2-тиоксо-3-индолинил)пропионовой кислоты, сложный N-бензиловый эфир 3-(2-тиоксо-3-индолинил)пропанамида, 2,2′-дитиобис[метил-2-(1-метил-3-индолил)ацетат], трисульфид бис[индолил-3-уксусной кислоты-(2)], дисульфид бис[этил-1-метилиндолил-3-ацетата-(2)], 2,2′-дитиобис[N-бензил-2-(3-индолил)-ацетамид], дисульфид бис[индолил-3-пропионовой кислоты-(2)], 2,2′-дитиобис[3-(1-метил-3-индолил)пропионовую кислоту], дисульфид бис[этилиндолил-3-пропионата-(2)], 2,2′-дитиобис[метил-3-(3-индолил)-пропионат], 2,2′-дитиобис[метил-3-(1-метил-3-индолил)пропионат], дисульфид бис[5-метилиндолил-3-пропионовой кислоты-(2)], дисульфид бис[этил-5-метилиндолил-3-пропионата-(2)], дисульфид бис[6-метилиндолил-3-пропионовой кислоты-(2)], дисульфид бис[этил-6-метилиндолил-3-пропионата-(2)], дисульфид бис[7-метилиндолил-3-пропионовой кислоты-(2)], дисульфид бис[этил-7-метилиндолил-3-пропионата-(2)], 2,2′-дитиобис[N-бензил-3-(3-индолил)пропанамид], дисульфид бис[индолил-3-бутановой кислоты-(2)], 2,2′-дитиобис[4-(1-метил-3-индолил)бутановую кислоту], дисульфид бис[метил-индолил-3-бутаноата-(2)], дисульфид бис[метил-1-метилиндолил-3-бутаноата-(2)], дисульфид бис[N-фенил-1-метилиндолил-3-карбоксамида-(2)], дисульфид бис[N-фенил-1-этилиндолил-3-карбоксамида-(2)], дисульфид бис[N-фенил-4-хлор-1-метилиндолил-3-карбоксамида-(2)], дисульфид бис[N-фенил-5-хлор-1-метилиндолил-3-карбоксамида-(2)], дисульфид бис[N-фенил-7-хлор-1-метилиндолил-3-карбоксамида-(2)], дисульфид бис[N-фенил-1-метил-7-азаиндолил-3-карбоксамида-(2)], дисульфид бис[N-фенил-1,4-диметилиндолил-3-карбоксамида-(2)], дисульфид бис[N-фенил-1,5-диметилиндолил-3-карбоксамида-(2)], дисульфид бис[N-фенил-1,6-диметилиндолил-3-карбоксамида-(2)], дисульфид бис[N-фенил-1,7-диметилиндолил-3-карбоксамида-(2)], дисульфид бис[N-фенил-4-метокси-1-метилиндолил-3-карбоксамида-(2)], дисульфид бис[N-фенил-5-метокси-1-метилиндолил-3-карбоксамида-(2)], дисульфид бис[N-фенил-6-метокси-1-метилиндолил-3-карбоксамида-(2)], дисульфид бис[N-фенил-7-метокси-1-метилиндолил-3-карбоксамида-(2)], дисульфид бис[N-метил-1-метилиндолил-3-карбоксамида-(2)], дисульфид бис[N-бензил-1-метилиндолил-3-карбоксамида-(2)], дисульфид бис[(N-метилфенилсульфонил)-2-индолила], дисульфид бис[3-бензоил-1-метилиндола-(2)], дисульфид бис[3-(4′-карбоксибензоил)-1-метилиндола(2)], дисульфид бис[3-(4′-карбоксиметоксибензоил-1-метилиндола(2)], сложный трет. бутиловый эфир 2,2′-диселенобис[1-метил-1H-индол-3-карбоновой кислоты], 2,2′-диселенобис[1-метил-1H-индол-3-карбоновую кислоту], 2,2′-диселенобис[N,1-диметил-1H-индол-3-карбоксамид], 2,2′-диселенобис[N-[2-(диэтиламино)этил]-1-метил-1H-индол-3-карбоксамид] , 2,2′-диселенобис[N-метил-1H-индол-3-карбоксамид], 2,2′-диселенобис[N-[2-диэтиламино)этил]-1H-индол-3-карбоксамид], 2,2′-диселенобис[N-[2-(диэтиламино)этил]-N-метил-1H-индол-3-карбоксамид] , 2,2′-диселенобис[1-[2-(диэтиламино)этил]-N-метил-1H-индол-3-карбоксамид] , [R-(R*, R*)] -2,2′-диселенобис[  -амино-N-(фенилметил)-1H-индол-3-пропанамид], -амино-N-(фенилметил)-1H-индол-3-пропанамид],[S-(R*, R*)]-2,2′-диселенобис[  -амино-N-(фенилметил)-1H-индол-3-пропанамид], -амино-N-(фенилметил)-1H-индол-3-пропанамид],и их фармацевтически приемлемые соли. 3. Фармацевтическая композиция, обладающая антиопухолевой, ингибирующей протеин-тирозинкиназу активностью, содержащая по меньшей мере один фармацевтически приемлемый носитель и по меньшей мере одно активное вещество, отличающаяся тем, что в качестве активного вещества она содержит производное индола общей формулы (I) по п.1 или его фармацевтически приемлемую соль в эффективном количестве. 4. Способ торможения зависящего от протеин-тирозинкиназы заболевания или борьбы с аберрантным ростом клеток млекопитающего или человека путем введения млекопитающему или человеку активного вещества, отличающийся тем, что в качестве активного вещества используют по меньшей мере одно соединение общей формулы (I) по п. 1 или его фармацевтически приемлемую соль в эффективном количестве. РИСУНКИ
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 03.08.2006
Извещение опубликовано: 20.12.2007 БИ: 35/2007
|
||||||||||||||||||||||||||
