|
|
(21), (22) Заявка: 2003129187/14, 02.10.2003
(24) Дата начала отсчета срока действия патента:
02.10.2003
(43) Дата публикации заявки: 27.03.2005
(45) Опубликовано: 27.01.2006
(56) Список документов, цитированных в отчете о
поиске:
ГРУНИНА Е.А. и др. Возможность антидеструктивного действия низких доз кортикостероидов при ревматоидном артрите: предварительное сообщение. Научно-практическая ревматология. 2000, № 1, с.29-31. RU 2199320 C1, 27.02.2003. RU 2018320 C1, 30.08.1994. DE SILVA M. et al. The timing of prednisolone doseage and its effect on morning stifmess in rheumatoid
Адрес для переписки:
603005, г.Нижний Новгород, ул.Алексеевская, 1, НГМА, Учебно-лабораторный корпус, патентно-лицензионный отдел
|
(72) Автор(ы):
Грунина Елена Андреевна (RU),
Виноградова Наталья Анатольевна (RU),
Стронгин Леонид Григорьевич (RU)
(73) Патентообладатель(и):
Государственное образовательное учреждение высшего профессионального образования “Нижегородская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию” (ГОУ ВПО НижГМА Росздрава) (RU)
|
(54) СПОСОБ ПРОФИЛАКТИКИ КОСТНО-ХРЯЩЕВОЙ ДЕСТРУКЦИИ ПРИ РЕВМАТОИДНОМ АРТРИТЕ
(57) Реферат:
Изобретение относится к медицине, а именно к ревматологии. Способ включает терапию метотрексатом в дозе 7,5 мг/нед в сочетании с малыми дозами глюкокортикостероидов, до 10 мг/сут по преднизолону. Метотрексат вводят в количестве 7,5-20 мг/неделю однократно, глюкокортикостероиды – в 3 часа ночи однократно. Курс лечения проводят не менее 6 месяцев с последующим снижением дозы глюкокортикостероидов в течение 6 месяцев, вплоть до полной их отмены, с сохранением поддерживающей терапии метотрексатом. Способ позволяет достичь максимального увеличения антидеструктивного действия на любых сроках заболевания за счет предотвращения развития новых эрозий в суставах и сохранения ширины суставной щели при наиболее физиологичном режиме приема глюкокортикостероидов. 4 з.п. ф-лы, 3 табл., 12 ил. 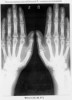
(56) (продолжение):
CLASS=”b560m”arthritis. Ann. Rheum. Dis. 1984, Dec; 43 (6): 790-3, abstr. PubMed. БАЛАБАНОВА P.M., ОЛЮНИН Ю.А. Лечение ревматоидного артрита метотрексатом. Тезисы докладов IV Всесоюзного съезда ревматологов. – Минск, 1991, с.225-226. ШЛЯПАК Е.А. и др. Метотрексат в терапии больных ревматоидным артритом. Экология и здоровье человека. Мат. межрег. науч.-практ. конф. – Ставрополь, 1998, с.130-132. Клиническая ревматология. Рук. для практ. врачей. Под ред. чл.-корр. РАМН проф. В.И.Мазурова. – СПб.: Фолиант, 2001, с.122. МАШКОВСКИЙ М.Д. Лекарственные средства. Пособие для врачей в 2 томах. – M.: ООО «Новая Волна», Изд. С.Б.Дивов, 2001, т.2, с.25-35, 82-83.
Предлагаемое изобретение относится к медицине, а именно к ревматологии, и используется для профилактики костно-хрящевой деструкции при ревматоидном артрите (РА).
Современная лекарственная терапия РА включает одновременное применение лекарственных средств двух различных классов – быстродействующих противовоспалительных препаратов (стероидных или нестероидных) и медленно действующих (базисных) препаратов, оказывающих на РА более глубокое и стабильное лечебное воздействие.
Известен способ комбинированной терапии при лечении РА с использованием противовоспалительных средств, глюкокортикоидов (ГКС) в том числе, и иммуномодулирующих, в качестве которого используют оксидевит (см. патент РФ №2038082, заявл.24.06.92, А 61 К 31/59).
Известен способ комбинированной терапии при лечении РА с использованием проспидина и метотрексата (МТ), обладающих противовоспалительным и иммуномодулирущим действием (см. патент РФ №2299329, заявл.19.09.2001, А 61 К 31/495).
Известен способ комбинированной терапии при лечении РА препаратами золота, в частности ауранофином и метотрексатом (см. Клиническая медицина, 1990, №1, с.119-124).
Препараты золота имеют достаточно большой перечень противопоказаний, при этом круг больных, способных переносить эти препараты, ограничен (более 30% больных упомянутые препараты не переносят).
В упомянутых источниках приведены данные о влиянии комбинированной терапии на клинические и лабораторные показатели больных РА и не приведены рентгенологические показатели, характеризующие костно-хрящевую деструкцию в суставах. Последнее – критерий эффективности базисной терапии, а также фактор, определяющий функциональный статус и качество жизни. Кроме того, не приведены сведения о результатах длительного наблюдения за больными. По-видимому, в описываемых способах введение противовоспалительных и иммуномодулирующих средств состоит преимущественно в облегчении симптомов заболевания и не направлено на профилактику костно-хрящевой деструкции.
Ревматоидный артрит является аутоиммунным заболеванием. Как всякий аутоиммунный самоподдерживающийся процесс, РА является хроническим прогрессирующим заболеванием, сопровождающимся воспалительными реакциями и постепенно нарастающей деструкцией мягких тканей, хряща и костей. Поскольку РА является длительным заболеванием, а не заболеванием, имеющим выраженное «начало» и «конец», важна профилактика костно-хрящевой деструкции, чтобы можно было замедлить или подавить патологический процесс. Очень важно, чтобы профилактика была начата на ранней стадии заболевания, до того, как появилось значительное повреждение кости и сустава. В начальной стадии РА отсутствуют деформации суставов, нет остеопении, так как в ранней фазе РА еще не окончательно сформировались аутоиммунные патогенетические механизмы и отсутствует паннус – морфологическая основа суставной деструкции. Поэтому активное начало профилактики на самых ранних этапах РА обосновывается стремлением возможно быстро и стабильно подавить активный иммуновоспалительный процесс и тем самым предотвратить последующую необратимую деструкцию суставов.
Известен способ профилактики костно-хрящевой деструкции при РА, включающий базисную терапию метотрексатом (МТ) в сочетании с малыми дозами глюкокортикостероидов (ГКС), до 10 мг/сутки по преднизолону, направленный на предотвращение или замедление костно-хрящевой деструкции (см. Научно-практическая ревматология, 2000, №1, с.29-31). Если противовоспалительные и иммуномодулирующие свойства ГКС известны и активно используются на протяжении более 50 лет, то антидеструктивные свойства были неожиданными.
В данном источнике приведено сообщение о возможности антидеструктивного действия низких доз ГКС, в частности преднизолона, до 10 мг/сутки на фоне базисной терапии метотрексатом, но не приведена схема лечения, направленного на профилактику костно-хрящевой деструкции в суставах, на замедление или подавление процесса. Упомянутый способ взят в качестве прототипа.
Задачей, на решение которой направлено настоящее изобретение, является разработка способа профилактики костно-хрящевой деструкции при РА, направленного на предотвращение, замедление или обратное развитие процесса деструкции.
Поставленная задача решается тем, что в известном способе профилактики костно-хрящевой деструкции при РА, включающем базисную терапию метотрексатом в сочетании с малыми дозами ГКС, до 10 мг/сутки по преднизолону, согласно изобретению, МТ вводят в количестве 7,5-20 мг/неделю однократно, а ГКС – в 3 часа ночи однократно, курс лечения проводят не менее 6 месяцев с постепенным снижением дозы ГКС в течение 6 месяцев, вплоть до полной отмены, с сохранением поддерживающей дозы МТ.
В качестве ГКС могут быть использованы бетаметазон, или метилпреднизолон, или кортизон, или триамцинолон, или дексаметазон, но предпочтительно использовать преднизолон, как наиболее легко переносимый (по крайней мере в ревматологии) ГКС, дающий наиболее стойкий и выраженный терапевтический эффект.
Женщинам предпочтительно вводить преднизолон 5-10 мг/сутки, в зависимости от веса, а мужчинам – 10 мг/сутки, так как эффективность ГКС у последних несколько ниже. Курс лечения целесообразно проводить в течение 12 месяцев, так как в течение указанного срока у большей части больных достигается лечебный эффект.
Для устранения побочного действия – тошноты и других диспептических явлений целесообразно вводить фолиевую кислоту 1 мг/сутки однократно, кроме дня приема метотрексата.
Из литературы известно, что больные, дающие минимальный ответ на ГКС и МТ в отдельности, учитывая приведенные дозы, оказались чувствительны к их комбинации (см. Я.А.Сигидин, Г.В.Лукина, Базисная (патогенетическая) терапия ревматоидного артрита – М., 2000, с.128; J.Kremer и J.Lee A long-term prospective study of the use of methotrexate in rheumatoid arthritis: update after a mean fifty-three months. Arthritis Rheum. 1988; 31: 577-584). Авторами заявляемого изобретения также показано, что прием МТ в отдельности практически не оказывает профилактического действия на подавление или замедление костно-хрящевой деструкции (см. пример 5).
Метотрексат относится к классу антиметаболитов, то есть веществ, которые химически близки естественным метаболитам организма и поэтому конкурируют с ним за участие в биохимических процессах, приводя тем самым в малых дозах к торможению клеточных и гуморальных иммунных реакций за счет угнетающего влияния на развитие лимфоцитов в фазу синтеза. Он относится к категории так называемых фазо-специфических препаратов, поскольку оказывает наиболее выраженное иммуномодулирующее действие в конкретную фазу клеточного цикла, а именно в фазу синтеза. Способность ГКС влиять на костно-хрящевую деструкцию при РА может быть обусловлена как прямым действием на факторы деструкции или регуляторные механизмы их реализации, так и опосредованным влиянием на данные факторы через иммуномодулирующее и противовоспалительное действие. ГКС оказывают прямое действие на гуморальные факторы, макрофагальную систему миграции лейкоцитов в зону воспаления. Поскольку макрофаги играют ключевую роль как в иммунных реакциях, представляя антиген лимфоидным клеткам, так и в хроническом воспалении, ГКС способны оказывать одновременное тормозящее влияние на оба патологических процесса. Таким образом, сочетанное назначение МТ и ГКС приводит к качественному синергизму вследствие влияния на различные линии иммунокомпетентных клеток (макрофагальные, лимфоидные), на их взаимодействие и на собственно воспалительный процесс, то есть на основные патогенетические факторы РА.
МТ в количестве 7,5-20 мг/неделю вводят в зависимости от предшествующего эффекта. Введение в дозе меньше 7,5 мг/неделю малоэффективно, а при дозе более 20 мг/неделю – резко возрастает вероятность токсического действия. Применение ГКС в 3 часа ночи обеспечивает более выраженное действие на длительность утренней скованности, боль в суставах, индексы Лансбюри и Ричи, утреннюю концентрацию интерлейкина-6 в сыворотке крови, чем традиционный прием низких доз ГКС в утренние часы. Прием ГКС в указанный период времени является наиболее физиологичным и действует в соответствии с эндогенным ритмом выработки ГКС. Существенным является то, что приведенную схему профилактики костно-хрящевой деструкции надо проводить не менее 6 месяцев. Именно в течение указанного промежутка времени комплексное введение МТ и ГКС в дозах, указанных выше, и при этом время приема ГКС – в 3 часа ночи, оказывают отчетливое антидеструктивное действие и у достаточной части больных достигается клинико-лабораторная и рентгенологическая ремиссия. Менее 6 месяцев – срок недостаточный для отчетливого антидеструктивного действия. Снижение дозы ГКС в течение 6 месяцев является оптимальным временем, обеспечивающим постепенность и предотвращение синдрома отмены упомянутых препаратов. Сохранение поддерживающей терапии МТ обеспечивает длительную ремиссию, до двух и более лет.
Терапевтический эффект данного метода был показан на 74 больных с достоверным, по критериям американского колледжа ревматологов, ревматоидным артритом. В зависимости от вида терапии все обследуемые больные были разделены на 2 группы.
В основную группу (38 человек) вошли пациенты, получающие МТ в дозе 5-10 мг/неделю (в среднем 7,8 мг/неделю) в сочетании с ГКС (преднизолоном) в дозе 2,5-10 мг/сутки (в среднем 6,25 мг/сутки), назначаемым в 3 часа ночи.
Контрольную группу (36 человек) составили больные, принимающие только МТ в дозе 5-10 мг/неделю (в среднем 7,8 мг/неделю), причем 31 пациент принимали препарат до начала наблюдения. Средняя продолжительность приема МТ у них к началу исследования составляла 2,9 лет, средняя доза 9,1 мг/неделю.
Использование нестероидных противовоспалительных препаратов (НПВП) разрешалось в обеих группах.
В таблице 1 приведена демографическая и клиническая характеристики включенных в исследование пациентов.
Таблица 1.
Демографическая и клиническая характеристика включенных в исследование пациентов |
| Характеристика |
Основная группа (n=38) |
Контрольная группа (n=36) |
р |
| Возраст |
47,82±10,9 |
52,22±10,3 |
0,078 |
| Длительность заболевания |
64,58±57,8 |
74,61±54,2 |
0,44 |
| Серопозитивность по ревматоидному фактору |
32 (84%) |
28 (78%) |
0,14 |
| Активность (степень) |
|
|
|
| 1 |
|
|
|
| 2 |
5 |
9 |
0,20 |
| 3 |
21 |
18 |
( 2=7,0) 2=7,0) |
| |
12 |
9 |
|
| Рентгенологическая стадия |
|
|
|
| I |
8 |
5 |
0,20 |
| II |
18 |
17 |
( 2=6,0) 2=6,0) |
| III |
12 |
14 |
|
| Функциональная |
|
|
|
| недостаточность |
|
|
|
| I |
14 |
15 |
0,16 |
| II |
24 |
21 |
( 2=2,0) 2=2,0) |
| Течение |
|
|
|
| быстро/медленно |
3/35 |
1/35 |
0,16 |
| прогрессирующее |
|
|
( 2=2,0) 2=2,0) |
Сравниваемые группы больных сопоставимы по демографической и клинической характеристикам. Группы однородны по большинству клинических и лабораторных показателей к началу терапии.
Эффективность проводимой терапии оценивалась через год у больных, получающих соответствующее лечение в течение этого времени по заданной схеме. Оценивались клинические, лабораторные и рентгенологические показатели, характеризующие активность и прогрессирование РА.
При анализе темпов нарастания рентгенологического прогрессирования в двух группах были обнаружены существенные различия (таблица 2).
Таблица 2.
Средняя разность рентгенологических показателей в основной и контрольной группах через 12 месяцев наблюдения (М±m). |
| Рентгенологические параметры |
Основная группа (n=38) |
Контрольная группа (n=36) |
p |
| Индекс Ларсена |
2,82±0,97 |
6,67±5,71 |
0,04 |
| Число эрозий |
0,53±0,06 |
2,11±1,34 |
0,003 |
| Степень сужения суставной щели в баллах |
2,55±1,49 |
4,47±2,75 |
0,08 |
У пациентов, принимающих МТ и низкие дозы ГКС, через год наблюдения степень суставной деструкции, оцененная индексами Ларсена, числом эрозий, была достоверно ниже, чем в контрольной группе. Динамика степени сужения суставной щели, отражающей деструкцию хряща, также оказалась меньше у больных основной группы по сравнению с пациентами контрольной группы. Данные результаты говорят о том, что присоединение к МТ низких доз ГКС дает более выраженный эффект на замедление рентгенологического прогрессирования по сравнению с монотерапий МТ по крайней мере на протяжении 12 месяцев.
Было отмечено, что в основной группе наблюдается высокий процент больных с уменьшением индекса Ларсена, соответствующим регрессу костно-хрящевой деструкции (11% в сравнении с 3% контрольной группы). Отсутствие динамики счета Ларсена, свидетельствующее о стабилизации процесса, также наблюдалось у большего числа пациентов основной группы (примерно в 2 раза), чем контрольной. В то же время нарастание счета Ларсена превалировало у больных, получающих монотерапию МТ (83% в сравнении с 58% основной группы).
Наши данные свидетельствуют о наличии «рентгенологической ремиссии» у 42% больных (16 человек) из основной и у 17% больных (6 человек) из контрольной группы.
Аналогичные результаты получены при анализе динамики других рентгенологических показателей (общее число эрозий, сужение суставной щели). Так, уменьшение числа эрозий наблюдалось у большего числа пациентов основной группы по сравнению с контрольной (13% по сравнению с 6% соответственно). Влияние низких доз ГКС на сужение ширины суставной щели скорее можно охарактеризовать как тормозящее (у 42% больных основной группы ширина суставной щели через год терапии была без динамики по сравнению с 14% из контрольной группы).
Увеличение показателей суставной деструкции через год наблюдения наблюдалось у большинства больных в обеих группах, однако пациентов с ухудшением было почти в 2 раза меньше в группе с сочетанной терапией по сравнению с больными, получающими монотерапию МТ.
Таким образом, в обеих сравниваемых группах были пациенты, у которых наблюдалось нарастание костно-хрящевой деструкции, но были и больные, у которых оно не происходило или подвергалось даже обратному развитию. В группе, получавшей ГКС и МТ, остановка или уменьшение таких показателей костно-хрящевой деструкции, как индекс Ларсена, число эрозий, степень сужения суставной щели происходило у значительно большего числа больных.
У 23 больных мы проследили динамику показателей рентгенологического прогрессирования через 2 года (у 17 человек из основной группы и у 6 – из контрольной). Пациенты продолжали принимать ту же терапию (таблица 3).
Таблица 3.
Динамика рентгенологических показателей в основной и контрольной группах через 12 и 24 месяца наблюдения (М±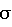 ). ). |
| Рентгенологические параметры |
Начало исследования |
Через 12 месяцев наблюдения |
Через 24 месяца наблюдения |
| Основная группа (n=17) |
Контрольная группа (n=6) |
Основная группа (n=17) |
Контрольная группа (n=6) |
Основная группа (n=17) |
Контрольная группа (n=6) |
| Индекс Ларсена |
73,2±26,5 |
72,4±31,9 |
76,0±27,9 |
78,3±19,6 |
78,5±20,1 |
83,9±17,4 |
| Число эрозий |
9,0±9,4 |
8,7±8,5 |
9,8±7,4 |
11,0±1±9,1 |
10,2±8,8 |
13,25±8,49 |
| Степень сужения суставной щели в баллах |
40,8±33,8 |
39,4±32,4 |
42,1±32,5 |
42,2±1±28,2 |
44,3±26,7 |
45,1±30,1 |
При сопоставимых (р>0,5) начальных значениях показателей суставной деструкции (индекс Ларсена, число эрозий и степень сужения суставной щели) обнаружилось, что в основной и контрольной группах имеет место нарастание костно-хрящевой деструкции через 12 и 24 месяца наблюдения. Однако темп ее нарастания у пациентов, получающих сочетанную терапию МТ и ГКС, медленнее, чем у больных, находящихся на монотерапии МТ. Это более заметно по индексу Ларсена и по счету эрозий, где эта разница статистически достоверна (р<0,05). Динамика нарастания сужения суставной щели в основной и контрольной группе через 12 и 24 месяцев стабильна и сопоставима.
Показано, что при длительном сочетанном назначении в течение года МТ и низких доз ГКС тормозится, а в ряде случаев и регрессирует суставная деструкция при РА. Данный эффект сохранялся по крайней мере в течение 2 лет. Влияние на признаки воспаления и функциональные нарушения при сочетанной терапии МТ и ГКС по сравнению с монотерапией МТ также было более выраженным. Поэтому используемая схема лечения предлагается в качестве метода профилактики костно-хрящевой деструкции суставов при ревматоидном артрите.
Клинический пример 1. Развитие ремиссии РА при лечении низкими дозами ГКС и МТ.
Больная X., 46 лет, поступила в стационар с диагнозом: РА, полиартрит, серонегативный, активность II, стадия II, функциональная недостаточность II. Давность заболевания 16 месяцев. До поступления в отделение больной проводилась только симптоматическая терапия НПВП. К началу наблюдения – выраженный суставной синдром (число болезненных суставов 17, число воспаленных суставов 5, индекс Ричи 40, интенсивность боли по визуальной аналоговой шкале 8 см), СОЭ – 37 мм/ч, циркулирующие иммунные комплексы – 176 о.е., индекс активности DAS3 = 5,153, анемия со снижением гемоглобина до 107 г/л. На рентгенограммах кистей и стоп – околосуставной остеопороз, сужение суставных щелей, эрозивный артрит. Общее число эрозий 3, индекс Ларсена 53 балла. Начата базисная терапия МТ в дозе 7,5 мг/неделю однократно в сочетании с преднизолоном в дозе 5 мг/сутки в 3 часа ночи. Через 6 месяцев терапии отмечен значительный эффект в виде уменьшения суставного синдрома (число болезненных суставов 8, число воспаленных суставов 1, индекс Ричи 13, интенсивность боли по визуальной аналоговой шкале 4 см) и лабораторной активности (СОЭ -28 мм/ч, циркулирующие иммунные комплексы 95 о.е., индекс активности DAS3 = 3,337), увеличился уровень гемоглобина до 116 г /л, степень функциональной недостаточности – 0. В течение этого периода удалось снизить дозу преднизолона с 5 до 2,5 мг/сут без развития обострения, доза МТ – без изменений. Больная принимала фолиевую кислоту в дозе 1 мг/сутки однократно, кроме дня приема МТ. Через 12 месяцев терапии достигнута клиническая ремиссия заболевания (отсутствовали боли в покое и при движении в суставах, утренняя скованность, СОЭ составляла 15 мм/ч, индекс активности DAS3 = 1,118). К этому времени индекс Ларсена составлял 53 балла, а общий счет эрозий 3. Это позволило полностью отменить ГКС. Общая продолжительность снижения дозы КС до полной отмены составила 6 месяцев. Эффект терапии сохраняется уже в течение 2 лет. Переносимость лечения хорошая. Потребности в приеме НПВП в течение периода наблюдения у пациентки нет.
Ниже представлены рентгенограммы этой больной до и после окончания исследования (фото 1, 2 – рентгенограммы кистей, фото 3, 4 – рентгенограммы стоп).
На представленных снимках отсутствует рентгенологическая прогрессия, как со стороны мелких суставов кистей, так и стоп в течение года. Имеет место стабилизация деструктивного процесса в суставах.
Клинический пример 2. Замедление темпов рентгенологического прогрессирования на фоне комбинированной терапии МТ и низких доз ГКС.
Больная С., 38 лет, поступила в клинику с диагнозом: РА, полиартрит, серопозитивный, с системными проявлениями (лихорадка, ревматоидные узелки), активность III, стадия III, функциональная недостаточность II. Давность РА 3 года. До поступления в клинику в течение года проводилась терапия МТ в дозе 7,5 мг/неделю и НПВП. К началу наблюдения – выраженный суставной синдром (число болезненных суставов 16, число воспаленных суставов 6, индекс Ричи 30, СОЭ 56 мм/ч, ревматоидный фактор – 1:1280, индекс активности DAS3 = 5,103). На рентгенограммах кистей и стоп – околосуставной остеопороз, сужение суставных щелей, эрозивный артрит. Индекс Ларсена 80 баллов, общее число эрозий 6, степень сужения суставных щелей в кистях и дистальных отделах стоп 23 балла. К проводимой терапии был добавлен преднизолон в дозе 5 мг/сутки в 3 часа ночи. Больная принимала фолиевую кислоту в дозе 1 мг/сутки однократно, кроме дня приема МТ. Через месяц лечения была купирована лихорадка, снизилась лабораторная активность заболевания (СОЭ 38 мм/ч). К 18 месяцам от начала сочетанной терапии отмечался хороший клинический эффект (число болезненных суставов 6, число воспаленных суставов 0, индекс Ричи 10, СОЭ 15 мм/ч, ревматоидный фактор 1:80, DAS3 = 2,825). Кроме того, отмечалось заживление и уменьшение в размерах двух эрозий, уменьшилась выраженность кистевидных просветлении в мелких суставах кистей, что привело к улучшению рентгенологических показателей (индекс Ларсена 75 баллов, общий счет эрозий 4, степень сужения суставных щелей 23 балла).
Как видно, присоединение небольших доз ГКС к базисной терапии МТ через 18 месяцев позволило добиться уменьшения выраженности суставного синдрома, активности заболевания, оцененной наличием системных проявлений, лабораторными параметрами и индексом активности DAS3, торможением рентгенологического прогрессирования в суставах.
Ниже представлены рентгенограммы больной до и после окончания исследования:
фото 5, 6 – заживление эрозий ладьевидной кости левого запястья;
фото 7, 8 – уменьшение выраженности кистевидных просветлении в костях запястья справа.
Клинический пример 3. Замедление темпов прогрессирования эрозивного артрита у больных РА может наблюдаться и при длительном сроке заболевания на фоне сочетанной терапии МТ и небольших доз ГКС
Больная 3., 47 лет, наблюдается в клинике с диагнозом: РА, серонегативный, активность I, стадия III, функциональная недостаточность I. Давность РА – 11 лет. В течение трех лет от момента начала заболевания больная получала НПВП, затем 8 лет – сочетанную терапию МТ 10 мг/неделю внутрь и преднизолоном 5 мг/сутки. Схема лечения МТ + ГКС оставлена на время исследования. Прием преднизолона перенесен на 3 часа ночи. Больная принимала также фолиевую кислоту в дозе 1 мг/сутки однократно, кроме дня приема МТ. Заболевание протекает с минимальной лабораторной и клинической активностью. На момент наблюдения число болезненных суставов 5, число воспаленных суставов 1, индекс Ричи 9, СОЭ 25 мм/ч, ревматоидный фактор отрицательный, DAS3 = 2,972. На рентгенограммах кистей и стоп – околосуставной остеопороз, сужение суставных щелей, эрозивный артрит. Индекс Ларсена 91, общий счет эрозий 12, степень сужения суставных щелей в кистях и дистальных отделах стоп 32 балла. Через 2 года наблюдения число болезненных суставов 6, число воспаленных суставов 0, индекс Ричи 9, СОЭ 27 мм/ч, ревматоидный фактор отрицательный, DAS3 = 2,933. индекс Ларсена 91 балл, общий счет эрозий 13, степень сужения суставных щелей в кистях и дистальных отделах стоп 32 балла. Таким образом, у больной с длительностью РА более 10 лет на фоне проводимой терапии МТ и низкими дозами ГКС отмечается минимальное рентгенологическое прогрессирование заболевания (появилась только одна эрозия при отсутствии динамики со стороны индекса Ларсена и сужения суставной щели).
Приведенный пример показывает, что замедление темпов прогрессирования эрозивного артрита у больных РА может наблюдаться и при длительном сроке заболевания на фоне сочетанной терапии МТ и небольших доз ГКС.
Ниже представлены рентгенограммы этой больной до и после окончания исследования (фото 9-12). Обнаруживается появление мелкой эрозии в области головки I пястной кости слева. В остальных суставах кистей и дистальных отделов стоп рентгенологическое прогрессирование отсутствует.
Клинический пример №4. Рентгенологическое прогрессирование на фоне монотерапии метотрексатом.
Больная Т., 48 лет, поступила в стационар с диагнозом: РА, полиартрит, серопозитивный, активность II, стадия II, функциональная недостаточность II. Давность заболевания 12 месяцев. До поступления в отделение больной проводилась только симптоматическая терапия НПВП. К началу наблюдения – выраженный суставной синдром (утренняя скованность 2 часа, число болезненных суставов 20, число воспаленных суставов 8, индекс Ричи 44, интенсивность боли по визуальной аналоговой шкале 8 см), СОЭ 38 мм/ч, ЦИК – 204 о.е., индекс активности DAS3 = 5,253, гемоглобин 110 г /л. На рентгенограммах кистей и стоп – околосуставной остеопороз, сужение суставных щелей, эрозивный артрит. Общее число эрозий 3, индекс Ларсена 53 балла. Начата базисная терапия метотрексатом в дозе 7,5 мг/неделю в таблетках. Через 6 месяцев терапии отмечен некоторый эффект в виде уменьшения суставного синдрома (утренняя скованность 40 минут, число болезненных суставов 12, число воспаленных суставов 4, индекс Ричи 20, интенсивность боли по ВАШ 5 см) и лабораторной активности (СОЭ 30 мм/ч, ЦИК – 124 о.е., индекс активности DAS3 = 4,122), увеличился уровень гемоглобина до 120 г /л, степень функциональной недостаточности I. Через 12 месяцев терапии состояние вновь ухудшилось. Утренняя скованность 2,5 часа, боли в покое и при движении в суставах, синовиты мелких суставов кистей, появился ревматоидный узелок над прокссимальным межфаланговым суставом IV пальца правой кисти, функциональная недостаточность II. СОЭ составляла 44 мм/ч, ЦИК 220 о.е., индекс активности DAS3 = 5,823. Гемоглобин 106 г/л. К этому времени индекс Ларсена составлял 64 балла, а общий счет эрозий 7. Таким образом, лечение метотрексатом в течение 12 месяцев дало временный неполный клинический и лабораторный эффект, сменившийся ухудшением, а рентгенологически выявлено прогрессирование костно-хрящевой деструкции в суставах.
Из примеров видно, что предлагаемый способ профилактики костно-хрящевой деструкции при РА обеспечивает приостановление, замедление или обратное развитие деструкции как на ранних стадиях, так и при длительном сроке заболевания.
Формула изобретения
1. Способ профилактики костно-хрящевой деструкции при ревматоидном артрите, включающий терапию метотрексатом в дозе 7,5 мг/нед в сочетании с малыми дозами глюкокортикостероидов, до 10 мг/сут по преднизолону, отличающийся тем, что метотрексат вводят в количестве 7,5-20 мг/неделю однократно, глюкокортикостероиды – в 3 часа ночи однократно, курс лечения проводят не менее 6 месяцев с последующим снижением дозы глюкокортикостероидов в течение 6 месяцев, вплоть до полной их отмены, с сохранением поддерживающей терапии метотрексатом.
2. Способ по п.1, отличающийся тем, что в качестве глюкокортикостероидов используют бетаметазон, или кортизон, или преднизолон, или триамцинолон, или дексаметазон.
3. Способ по пп.1 или 2, отличающийся тем, что в качестве глюкокортикостероидов, по существу, используют преднизолон.
4. Способ по п.1, отличающийся тем, что курс лечения, по существу, проводят в течение 12 месяцев.
5. Способ по п.1, отличающийся тем, что дополнительно вводят фолиевую кислоту 1 мг/сутки, кроме дня приема метотрексата.
РИСУНКИ
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 03.10.2005
Извещение опубликовано: 10.06.2007 БИ: 16/2007
|
|