|
|
(21), (22) Заявка: 2003129439/04, 01.10.2003
(24) Дата начала отсчета срока действия патента:
01.10.2003
(43) Дата публикации заявки: 10.04.2005
(45) Опубликовано: 20.11.2005
(56) Список документов, цитированных в отчете о
поиске:
US 3755295 A, 28.08.1973.
MOFFAT J.G. et al. Synthesis of some pyrimidine 2′-amino-2′-deoxynucleosides. J. Org. Chem. 1971, 36(2), p. 250-254: Chemical Abstracts: 74:54139.
RU 2188828 C2, 10.09.2002.
Адрес для переписки:
630559, Новосибирская обл., Новосибирский р-н, п. Кольцово, ГНЦ ВБ “Вектор”, зав. патентным отделом, Ю.Н. Мистюрину
|
(72) Автор(ы):
Покровский А.Г. (RU),
Ильичева Т.Н. (RU),
Беланов Е.Ф. (RU),
Волков Г.Н. (RU),
Куханова М.К. (RU),
Александрова Л.А. (RU)
(73) Патентообладатель(и):
Государственный научный центр вирусологии и биотехнологии “Вектор” (ГНЦ ВБ “Вектор”) (RU),
Институт молекулярной биологии им. В.А. Энгельгардта РАН (RU)
|
(54) 2 -АМИНО-2 -АМИНО-2 -ДЕЗОКСИНУКЛЕОЗИДЫ – ИНГИБИТОРЫ РЕПРОДУКЦИИ ВИРУСОВ КОРИ И МАРБУРГ -ДЕЗОКСИНУКЛЕОЗИДЫ – ИНГИБИТОРЫ РЕПРОДУКЦИИ ВИРУСОВ КОРИ И МАРБУРГ
(57) Реферат:
Изобретение относится к производным 2′-амино-2′-дезоксинуклеозидов, имеющим формулу
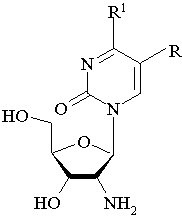
где R = Н, алкил, аминоалкил, R1 = (R2NR3), где R2 и/или R3 = Н, ОН, NH2, алкил, бензил, при условии, что R не представляет собой Н или метил, когда R2 и R3 = Н. Соединения по изобретению проявляют антивирусную активность в отношении вирусов кори и Марбург, превосходящую активность рибавирина. 4 табл., 2 ил. 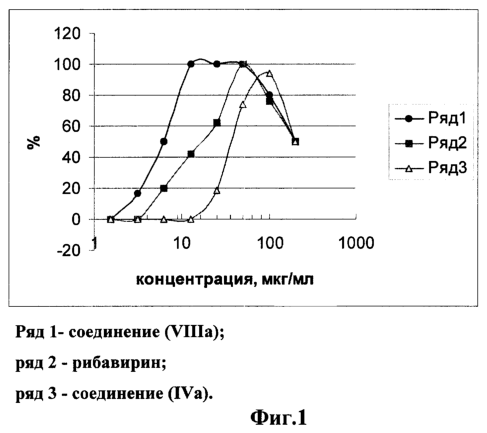
Изобретение относится к области молекулярной биологии, вирусологии и медицины, а именно к применению новых производных нуклеозидов для подавления репродукции вирусов кори и Марбург.
В настоящее время известен целый ряд соединений – аналогов нуклеотидов, обладающих противовирусной активностью, в том числе и используемых в медицинской практике. К последним относятся ацикловир, азидотимидин, рибавирин и другие препараты. Для лечения тяжелых случаев коревой инфекции применяют в основном рибавирин [1-( -d-рибофуранозил-1)-1,2,4-триазол-3-карбоксамид] [1]. Проходя через клеточные мембраны, рибавирин метаболизируется, превращаясь в моно- и трифосфат. Монофосфат является конкурентным ингибитором инозинмонофосфат дегидрогеназы, что приводит к торможению синтеза вирусных РНК и ДНК, слабо действуя на клетки хозяина. Кроме вируса кори рибавирин подавляет репродукцию вирусов гриппа типа А и В, герпеса, гепатита А и В и других [2, 3]. -d-рибофуранозил-1)-1,2,4-триазол-3-карбоксамид] [1]. Проходя через клеточные мембраны, рибавирин метаболизируется, превращаясь в моно- и трифосфат. Монофосфат является конкурентным ингибитором инозинмонофосфат дегидрогеназы, что приводит к торможению синтеза вирусных РНК и ДНК, слабо действуя на клетки хозяина. Кроме вируса кори рибавирин подавляет репродукцию вирусов гриппа типа А и В, герпеса, гепатита А и В и других [2, 3].
Однако в отношении вируса Марбург нет препаратов, обладающих противовирусной активностью.
Известны L-нуклеозиды и его фармацевтически приемлемые соли для лечения заболеваний вирусных инфекций (заявка на патент РФ №96117323, МПК С 07 Н 19/06, опубл. 10.12.1998) [4].
Однако препараты, приготовленные на основе указанных соединений, эффективны для лечения заболеваний, вызванных вирусом гепатита В и вирусом Эпштейна-Барра, и не проявляют активность в отношении вирусов кори и Марбург.
Наиболее близким техническим решением (прототипом) являются фармацевтические соединения, включающие в себя замещенные или незамещенные нуклеозиды и их аналоги, которые активны в отношении геморрагической лихорадки, вызванной вирусом Денге, и вирусной инфекции кори (Международная заявка № WO 00/15214, МПК А 61 К 31/19, опубл. 23.03.2000) [5].
Однако указанные фармацевтические соединения не проявляют активности в отношении вируса Марбург и вируса кори.
Техническим результатом предлагаемого изобретения является использование производных нуклеозидов, эффективных в отношении вирусов кори и Марбург, способных проникать внутрь клетки и обладающих избирательной активностью в подавлении репродукции указанных вирусов.
Указанный технический результат достигается тем что, ингибиторами репродукции вирусов являются производные нуклеозидов, согласно изобретению в качестве производных нуклеозидов используют пиримидиновые 2′-амино-2′-дезоксинуклеозиды с химической формулой:
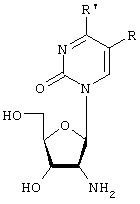
где R=H, галоид, галоидалкил, алкил, аминоалкил, арил, арилалкил и др. R1=(R2NR3), R2 или (и) R3=H, ОН, NH2, алкил, арил, арилалкил и др. Известно несколько способов синтеза пиримидиновых 2′-амино-2′-дезоксинуклеозидов, основанных на модификации углеводного остатка нуклеозида [6-9].
2′-Амино-2′-дезоксиуридин и его модифицированные по 5-положению нуклеинового основания производные были синтезированы авторами заявляемого технического решения по приведенной ниже схеме I с общим выходом 35-50%:
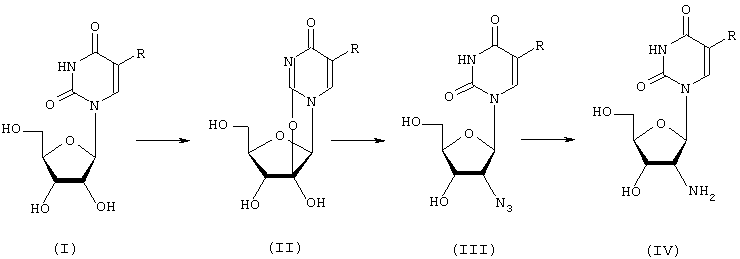
где R=H, галоид, галоидалкил, алкил, аминоалкил, арил, арилалкил и др.
На первой стадии синтеза в результате воздействия дифенилкарбоната на коммерческий уридин (I, R=H) либо на модифицированный по 5-положению нуклеинового основания уридин (I, R=галоид, алкил, аминоалкил, арил, арилалкил и др.) были синтезированы 2,2′-O-ангидропроизводные (5-R)-уридина (II). Следующая стадия синтеза – азидирование 2,2′-O-ангидро-(5-R)-уридина (II). Последней стадией синтеза было восстановление 2′-азидогруппы до аминогруппы. Выделение целевого 2′-амино-2′-дезокси-(5-R)-уридина осуществляли ионообменной хроматографией на колонке с Dowex 50 (H+) с последующей очисткой на колонке с обращеннофазовым силикагелем LiChroprep RP-8 и лиофилизацией продукта (IV).
2′-Амино-2′-дезокси-N4-(Rl,R2)-цитидин (VIII) и его модифицированные по 5-положению нуклеинового основания производные были синтезированы авторами заявляемого технического решения из соответствующих 2′-азидо-2′-дезокси-(5-R)-уридинов (III) по приведенной ниже схеме II с общим выходом 30-65%:
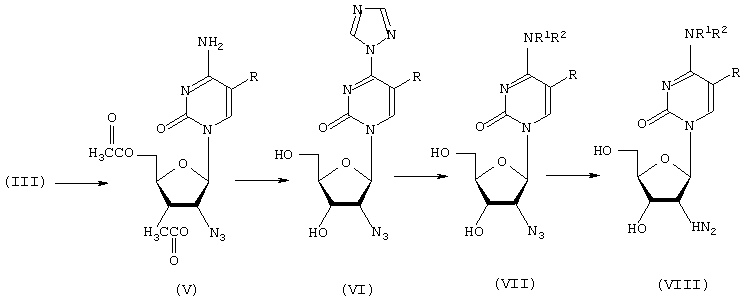
где R=H, галоид, галоидалкил, алкил, аминоалкил, арил, арилалкил и др.
R1 или (и) R2=H, ОН, NH2, алкил, арил, арилалкил и др.
Первой стадией синтеза явилось ацетилирование 2′-азидо-2′-дезокси-(5-R)-уридина (III). Полученный 3′,5′-ди-O-ацетил-2′-азидо-2′-дезокси-(5-R)-уридин (V) обрабатывали свежеприготовленным фосфо-тристриазолидом. По окончании реакции проводили замещение триазолидной группы в соединении VI на N4-(R1NR2) -группу действием NH4OH либо соответствующего амина с последующим удалением защитных групп. Последней стадией синтеза было восстановление 2′-азидогруппы в (VII) до аминогруппы. Выделение целевого 2′-амино-2′-дезокси-N4-(R1, R2)-(5-R)-цитидина (VIII) осуществляли ионообменной хроматографией на колонке с Dowex 50 (Н+) с последующей очисткой на колонке с обращеннофазовым силикагелем LiChroprep RP-8 и лиофилизацией продукта (VIII).
Структура 2′-амино-2′-дезокси-(5-R)-уридина (IV) и 2′-амино-2′-дезокси-N4-(Rl,R2)-(5-R)-цитидина (VIII) была подтверждена масс-, УФ- и ЯМР-спектрами. Чистота целевых субстанций была оценена с помощью ВЭЖХ и составляет 98%.
Ингибирование репродукции вируса кори и вируса Марбург исследовали в первично инфицированных клетках почки зеленой мартышки Vero в присутствии экспериментального препарата, конечная концентрация которого в культуральной среде составляла 0,1-400 мкг/мл, на протяжении одного пассажа – в течение 5 суток в случае вируса кори и 6 суток при исследовании вируса Марбург. Об ингибировании исследуемым соединением репродукции вируса в культуре чувствительных клеток судили по снижению вирус-индуцированного цитопатического действия в присутствии препарата по сравнению с контролем. В качестве препарата сравнения использовали рибавирин.
Противовирусную активность в отношении вируса Марбург исследовали также методом количественного определения вируса в культуре клеток Vero под полужидким агаровым покрытием.
На чертежах приведены дозозависимые кривые, иллюстрирующие ингибирующую активность заявляемых соединений. На фиг.1 приведены графики, иллюстрирующие противовирусную активность соединений (IVa), (VIIIa) и рибавирина в отношении вируса кори. На фиг.2 приведены графики, иллюстрирующие цитотоксичность и противовирусную активность соединения (VIIIa) в отношении вируса Марбург.
Ниже приведены конкретные примеры, раскрывающие сущность изобретения.
Пример 1. Синтез 2′-амино-2′-дезоксиуридина (соединение IVa, R=H)
Раствор 1,95 г (8 ммол) уридина, 1,93 г (9 ммол) дифенилкарбоната и 100 мг NaHCO3 в 5 мл абс. диметилформамида (ДМФ) нагревали при 120°С до прекращения выделения газа (5 час.), затем упарили до 1/2 объма, охладили и отфильтровали осадок 2,2′-O-ангидроуридина, промыли его 5 мл холодного метанола. Продукт суспендировали в 3 мл метанола и кипятили при перемешивании 3 часа, затем охладили, осадок отфильтровали, промыли его 5 мл холодного метанола, 5 мл эфира и высушили в вакуум-эксикаторе над КОН. Выход 2,2′-O-ангидроуридина (II) 1,4 г 78%.
К раствору 0,9 г (4 ммол) 2,2′-O-ангидроуридина (II) в 10 мл абс. ДМФ добавили 0,98 г (20 ммол.) LiN3, 0,54 г (10 ммол.) NH4Cl, 0,61 г (10 ммол.) LiCl×H2O и 0,45 мл гексаметилфосфотриамида. Смесь нагревали при перемешивании при 110°С в течение 8 час., затем упарили, к остатку добавили 9 мл МеОН и 18 мл ацетона и оставили на 18 час при 0°С. Осадок отфильтровали, промыли 10 мл смеси МеОН/ацетон (1/3), раствор упарили, остаток растворили в 3 мл ацетона и профильтровали через колонку с силикагелем в ацетоне (3×10 см). Фильтрат упарили. Густое масло растворили в 3 мл МеОН и нанесли на колонку с силикагелем (2×21 см) в хлороформе. Целевой продукт элюировали системой хлороформ-метанол 8:2. 2′-Азидо-2′-дезоксиуридин (III) получен с выходом 0,59 г (55%).
К раствору 0,54 г (2 ммол) 2′-азидо-2′-дезоксиуридина (III) в 10 мл смеси диоксан-вода (1:1) добавили трифенилфосфин 1,31 г (5 ммол.) и 2 мл 25% NH4OH. Через 18 час при 20°С смесь упарили, растворили в 50 мл воды, раствор проэкстрагировали хлороформом (2×10 мл) и нанесли на колонку с Dowex 50 (Н+) (3×10 см), которую промыли 100 мл 30% МеОН. Продукт элюировали 2% NH4OH в 30% МеОН, элюат упарили, остаток растворили в 2 мл воды и нанесли на колонку с обращеннофазовым силикагелем LiChroprep RP-8 (3×24 см). Элюировали в градиенте концентраций МеОН (0 5%) в присутствии 0,01 М NH4НСО3. Целевые фракции упарили, переупарили с водой (3×10 мл) и лиофилизовали. Выход 2′-амино-2′-дезоксиуридина (IVa) 0,39 г (80%). 5%) в присутствии 0,01 М NH4НСО3. Целевые фракции упарили, переупарили с водой (3×10 мл) и лиофилизовали. Выход 2′-амино-2′-дезоксиуридина (IVa) 0,39 г (80%).
2′-Амино-2′-дезоксиуридин (IV, R=H), 2′-amino-2′-deoxyuridine C9H13N3O5 Mr 243.2,
УФ:  max 261 ( max 261 ( 9600), [D2O; 9600), [D2O;  , м.д.; (J, Гц)]: 7,90 d (1H, J5,6 8, H-6), 5,90 d (1H, J1′,2′ 5,5, Н-1′), 5,67 d (1H, H-5), 4,31 br t (1H, J,2,3′ 5,5, J,3′,4′ 5, H-3′), 4,03 t (1H, H-2′), 3.90 m (1H, H-4′), 3,62 m (2H, H-5′). , м.д.; (J, Гц)]: 7,90 d (1H, J5,6 8, H-6), 5,90 d (1H, J1′,2′ 5,5, Н-1′), 5,67 d (1H, H-5), 4,31 br t (1H, J,2,3′ 5,5, J,3′,4′ 5, H-3′), 4,03 t (1H, H-2′), 3.90 m (1H, H-4′), 3,62 m (2H, H-5′).
Пример 2.Синтез 5-Метил-2′-амино-2′-дезоксиуридина (IVb, R=СН3)
5-Метил-2′-амино-2′-дезоксиуридин (IV, R=СН3) получен из тимидина, как в примере 1, с выходом 85%.
5-Метил-2′-амино-2′-дезоксиуридин (IV, R=СН3), УФ:  max 265 ( max 265 ( 9800), [D2O; 9800), [D2O;  , м.д.; (J, Гц)]: 7,91 s (1H, H-6), 5,92 d (1H, J1′,2′ 5,5, Н-1′), 4,35 br t (1H, J,2,3′ 5,5, J,3′,4′ 5, H-3′), 4,07 t (1H, H-2′), 3.92 m (1H, H-4′), 3,65 m (2H, H-5′), 1.89 s (3Н, СН3). , м.д.; (J, Гц)]: 7,91 s (1H, H-6), 5,92 d (1H, J1′,2′ 5,5, Н-1′), 4,35 br t (1H, J,2,3′ 5,5, J,3′,4′ 5, H-3′), 4,07 t (1H, H-2′), 3.92 m (1H, H-4′), 3,65 m (2H, H-5′), 1.89 s (3Н, СН3).
Пример 3. Синтез 5-Бром-2′-амино-2′-дезоксиуридина (IVc, R=Br)
5-Бром-2′-амино-2′-дезоксиуридин (IVc, R=Br) получен из 5-бром-2′-дезоксиуридина, как в примере 1, с выходом 68%.
5-Бром-2′-амино-2′-дезоксиуридин (IVc, R=Br) 5-Bromo-2′-amino-2′-deoxyuridine М-322.12, C9H12BrN3O5, УФ:  max 265 ( max 265 ( 9800), [D2O; 9800), [D2O;  , м.д.; (J, Гц)]:8,09 s (1H, H-6), 5,92 d (1H, J1′,2′ 5,5, Н-1′), 4,35 br t (1H, J,2,3′ 5,5, J,3′,4′ 5, H-3′), 4,07 t (1H, H-2′), 3.92 m (1H, H-4′), 3,65 m (2H, H-5′), 1.89 s (3H, СН3). , м.д.; (J, Гц)]:8,09 s (1H, H-6), 5,92 d (1H, J1′,2′ 5,5, Н-1′), 4,35 br t (1H, J,2,3′ 5,5, J,3′,4′ 5, H-3′), 4,07 t (1H, H-2′), 3.92 m (1H, H-4′), 3,65 m (2H, H-5′), 1.89 s (3H, СН3).
Пример 4. Синтез 5-Аминометил-2′-амино-2′-дезоксиуридина (IVd, R=CH2NH2)
5-Аминометил-2′-амино-2′-дезоксиуридин (IVd, R=CH2NH2) получен из 5-азидометил-2′-амино-2′-дезоксиуридина[10], как в примере 1, с выходом 63%.
5-Аминометил-2′-амино-2′-дезоксиуридин (IVd, R=CH2NH2) УФ:  max 265 ( max 265 ( 9800), [D2O, 9800), [D2O,  , м.д.; (J, Гц)]: 7,91 s (1H, H-6), 5,90 d (1H, J1′,2′ 5,5, Н-1′), 4,35 br t (1H, J,2,3′ 5,5, J,3′,4′ 5, H-3′), 4,07 t (1H, H-2′), 3.90 br q (1H,J4′,5′ 4 H-4′), 3,62 m (2Н, Н-5′), 2,77t (2H,J 6, CH2NH2). , м.д.; (J, Гц)]: 7,91 s (1H, H-6), 5,90 d (1H, J1′,2′ 5,5, Н-1′), 4,35 br t (1H, J,2,3′ 5,5, J,3′,4′ 5, H-3′), 4,07 t (1H, H-2′), 3.90 br q (1H,J4′,5′ 4 H-4′), 3,62 m (2Н, Н-5′), 2,77t (2H,J 6, CH2NH2).
Пример 5. Синтез 5-Аминометил-2′-амино-2′-дезоксиуридина (IVe, R=CH2-O(CH2)6NH2)
5-(6-аминогексилоксиметил)-2′-амино-2′-дезоксиуридин (IVe, R=CH2-O(CH2)6NH2) получен из 5-(6-азидогексилоксиметил)-2′-амино-2′-дезоксиуридина [11], как в примере 1, с выходом 65%.
5-(6-аминогексилоксиметил)-2′-амино-2′-дезоксиуридин (IVe, R=CH2-O(CH2)6NH2), УФ:  max 265 ( max 265 ( 9800), [D2O 9800), [D2O  , м.д.; (J, Гц)]: 7,89 s (1H, H-6), 5,90 d (1H, J1′,2′ 5,5, Н-1′), 4,35 br t (1H, J,2,3′. 5,5, J,3′,4′ 5, H-3′), 4,15 s (2H,5-CH2), 4,07 t (1H, H-2′), 3.90 br q (1H, J4′,5′ 4 H-4′), 3,62 m (2H, Н-5′), 3,31 t (2H, J 6,OCH2C5H10), 2,77 t (2H, J 6, CH2N), 1.41 m, 1,15 m [8Н,(CH2)4]. , м.д.; (J, Гц)]: 7,89 s (1H, H-6), 5,90 d (1H, J1′,2′ 5,5, Н-1′), 4,35 br t (1H, J,2,3′. 5,5, J,3′,4′ 5, H-3′), 4,15 s (2H,5-CH2), 4,07 t (1H, H-2′), 3.90 br q (1H, J4′,5′ 4 H-4′), 3,62 m (2H, Н-5′), 3,31 t (2H, J 6,OCH2C5H10), 2,77 t (2H, J 6, CH2N), 1.41 m, 1,15 m [8Н,(CH2)4].
Пример 6. Синтез 2′-амино-2′-дезоксицитидина (VIIIa, R=Н)
К раствору 2′-азидо-2′-дезоксиуридина (IIIa) 1,35 г (5 ммол) в 5 мл абс. пиридина добавили 1.2, мл (13,3 ммол.) уксусного ангидрида и смесь выдерживали 16 час при 20°С, затем упарили, остаток переупарили с н.бутанолом (2×5 мл) и толуолом. 3′,5′-Диацетил-2′-азидо-2′-дезоксиуридин (Va) был получен в виде маслянистого осадка с выходом 1,59 г (90%).
3′,5′-Диацетил-2′-азидо-2′-дезоксиуридин (Va, 2,46 ммол.) в 5 мл абс. ацетонитрила охладили до -10°С. Триазол (1,43 г, 20 ммол) растворили в 5 мл. абс. ацетонитрила и 2,9 мл триэтиламина (20 ммол), охладили до -10°С и добавили при перемешивании POCl3, (0,64 мл, 6,9 ммол). Реакционную смесь перемешивали 30 мин при -10°С, затем отфильтровали в колбу с (Va). Реакционную смесь перемешивали 2 час при комнатной температуре, затем добавили 0,5 мл воды, упарили, остаток растворили в этилацетате, промыли его водой, нас. NaHCO3, водой, высушили Na2SO4 и профильтровали через колонку с силикагелем в этилацетате (3×10 см). Фильтрат упарили. N4-Триазолил-3′,5′-диацетил-2′-азидо-2′-дезоксиуридин (VIa) был получен в виде маслянистого осадка с выходом 0,78 (78%).
К раствору N4-триазолил-3′,5′-диацетил-2′-азидо-2′-дезоксиуридина (VIa, 0,67 г, 1,64 ммол) в 6 мл диоксана добавили 25 ммол. соответствующего амина и оставили на 48 час при комнатной температуре, затем добавили 2 мл конц. NH4OH и оставили на 18 час при комнатной температуре. Реакционную смесь упарили, остаток растворили в 50 мл 30% МеОН и нанесли на колонку с Dowex 50 (H+) (3×10 см), которую промыли 100 мл 30% МеОН. Продукт элюировали 2% NH4OH в 30% МеОН, элюат упарили, остаток растворили в 2 мл воды и нанесли на колонку с обращеннофазовым силикагелем LiChroprep RP-8 (3×24 см). Продукт элюировали в градиенте концентраций МеОН (0 30%) в присутствии 0,01 М NH4HCO3. Целевые фракции переупаривали с водой (3×10 мл) и лиофилизовали. 2′-Азидо-2′-дезоксицитидин (VIIa) был получен с выходом 0,33 г (75%). 30%) в присутствии 0,01 М NH4HCO3. Целевые фракции переупаривали с водой (3×10 мл) и лиофилизовали. 2′-Азидо-2′-дезоксицитидин (VIIa) был получен с выходом 0,33 г (75%).
К раствору 2′-азидо-2′-дезоксицитидина (VI, 0,54 г, 2 ммол) в 10 мл смеси диоксан-вода (1:1) добавили трифенилфосфин (1,31 г, 5 ммол) и 2 мл. 25% NH4OH. Через 18 час при 20°С смесь упарили, растворили в 50 мл воды, раствор проэкстрагировали хлороформом (2×10 мл) и нанесли на колонку с Dowex 50 (Н+) (3×10 см), которую промыли 100 мл 30% МеОН. Продукт элюировали 2% NH4OH в 30% МеОН, элюат упарили, остаток растворили в 2 мл воды и нанесли на колонку с обращеннофазовым силикагелем LiChroprep RP-8 (3×24 см). Элюировали в градиенте концентраций МеОН (0 30%) в присутствии 0,01 М NH4HCO3. Целевые фракции упарили, переупарили с водой (3×10 мл) и лиофилизовали. Выход 2′-амино-2′-дезоксицитидина (VIIIa) 0,39 г (80%). 30%) в присутствии 0,01 М NH4HCO3. Целевые фракции упарили, переупарили с водой (3×10 мл) и лиофилизовали. Выход 2′-амино-2′-дезоксицитидина (VIIIa) 0,39 г (80%).
2′-Амино-2′-дезоксицитидин (VIII, R=R1=R2=H), M=242, УФ: рН 7,5:  max 271 ( max 271 ( 8200), рН 2: 8200), рН 2:  max 276 ( max 276 ( 11900), [DMSO-d6; 11900), [DMSO-d6;  , м.д.; (J, Гц)]: 7,79 d (1H, J5,6 7,5, H-6), 7,12 br s (2H, NH2), 5,79 d (1H, H-5), 5,67 d, (1H, J1′,2′ 5,5, H-1′), 4,31 br t (1H, J,2,3′ 5,5, J,3′,4′ 5, H-3′), 4,03 t (1H, H-2′), 3.90 br q (1H, J4′,5′ 4 H-4′), 3,62 m (2H, H-5′). 2′-amino-2′-deoxycytidine. , м.д.; (J, Гц)]: 7,79 d (1H, J5,6 7,5, H-6), 7,12 br s (2H, NH2), 5,79 d (1H, H-5), 5,67 d, (1H, J1′,2′ 5,5, H-1′), 4,31 br t (1H, J,2,3′ 5,5, J,3′,4′ 5, H-3′), 4,03 t (1H, H-2′), 3.90 br q (1H, J4′,5′ 4 H-4′), 3,62 m (2H, H-5′). 2′-amino-2′-deoxycytidine.
Пример 7. Синтез (5-Метил)-2′-амино-2′-дезоксицитидина (VIIIb, R=СН3, R1=R2=H))
(5-Метил)-2′-амино-2′-дезоксицитидин (VIIIb, R=СНз, R1=R2=H) получен из (5-метил)-2′-азидо-2′-дезоксиуридина (IIIb), как в примере 6, с общим выходом 52%
(5-Метил)-2′-амино-2′-дезоксицитидин (VIIIb, R=СН3, R1=R2=H), УФ: рН 7,5:  max 272 ( max 272 ( 8200), рН 2: 8200), рН 2:  max 278 ( max 278 ( 11900), [DMSO-d6; 11900), [DMSO-d6;  , м.д.; (J, Гц)]: 7,91 s (1H, H-6), 7,14 br s (2H, NH2), 5,79 d (1H, J1′,2′ 5,5, Н-1′), 4,35 br t (1H, J,2,3′ 5,5, J,3′,4′ 5, H-3′), 4,07 t (1H, Н-2′), 3.92 m (1H, 4 H-4′), 3,65 m (2H, Н-5′), 1.89 s (3Н, СН3). , м.д.; (J, Гц)]: 7,91 s (1H, H-6), 7,14 br s (2H, NH2), 5,79 d (1H, J1′,2′ 5,5, Н-1′), 4,35 br t (1H, J,2,3′ 5,5, J,3′,4′ 5, H-3′), 4,07 t (1H, Н-2′), 3.92 m (1H, 4 H-4′), 3,65 m (2H, Н-5′), 1.89 s (3Н, СН3).
Пример 8. Синтез (5-Аминометил)-2′-амино-2′-дезоксицитидина (VIIIc, R=CH2NH2, R1=R2=H)
(5-Аминометил)-2′-амино-2′-дезоксицитидин (VIIIc, R=CH2NH2, R1=R2=H) получен из (5-азидометил)-2′-азидо-2′-дезоксиуридина (IIIc), как в примере 6, с общим выходом 43%.
(5-Аминометил)-2′-амино-2′-дезоксицитидин (VIIIc, R=CH2NH2, R1=R2=H), УФ: рН 7,5:  max 274 ( max 274 ( 8200), рН 2: 8200), рН 2:  max 280 ( max 280 ( 11900), [DMSO-d6; 11900), [DMSO-d6;  , м.д.; (J, Гц)]: 7,89 s (1H, H-6), 7,14 br s (2H, NH2), 5,82 d (1H, J1′,2′ 5,5, Н-1′), 4,36 br t (1H, J,2,3′ 5,5, J3′,4′ 5, H-3′), 4,07 t (1H, H-2′), 3.90 m (1H, H-4′), 3,62 m (2H, H-5′), 2,77 t (2H, J 6, CH2NH2). , м.д.; (J, Гц)]: 7,89 s (1H, H-6), 7,14 br s (2H, NH2), 5,82 d (1H, J1′,2′ 5,5, Н-1′), 4,36 br t (1H, J,2,3′ 5,5, J3′,4′ 5, H-3′), 4,07 t (1H, H-2′), 3.90 m (1H, H-4′), 3,62 m (2H, H-5′), 2,77 t (2H, J 6, CH2NH2).
Пример 9. Синтез N4-окси-2′-амино-2′-дезоксицитидина (VIIId, R=R1=H, R2=OH)
N4-окси-2′-амино-2′-дезоксицитидин (VIIId, R=R1=H, R2=OH) получен из 2′-азидо-2′-дезоксиуридина (IIId), как в примере 6, с общим выходом 51%.
N4-окси-2′-амино-2′-дезоксицитидин (VIIId, R=R1=H, R2=ОН), УФ: рН 7,5:  max 271 ( max 271 ( 8200), рН 2: 8200), рН 2:  max 276 ( max 276 ( 11900), [DMSO-d6; 11900), [DMSO-d6;  , м.д.; (J, Гц)]: 7,79 d (1H, J5,6 7,5 H-6), 7,12 br s (2H, NH2), 5,79 d (1H, H-5), 5,67 d, (1H, J1′,2′ 5,5, Н-1′), 4,31 br t (1H, J,2,3′ 5,5, J,3′,4′ 5, H-3′), 4,03 t (1H, H-2′), 3.90 br q (1H, J4′,5′ 4 H-4′), 3,62 m (2H, H-5′). , м.д.; (J, Гц)]: 7,79 d (1H, J5,6 7,5 H-6), 7,12 br s (2H, NH2), 5,79 d (1H, H-5), 5,67 d, (1H, J1′,2′ 5,5, Н-1′), 4,31 br t (1H, J,2,3′ 5,5, J,3′,4′ 5, H-3′), 4,03 t (1H, H-2′), 3.90 br q (1H, J4′,5′ 4 H-4′), 3,62 m (2H, H-5′).
Пример 10. Синтез N4-амино-2′-амино-2′-дезоксицитидина (VIIIe, R=R1=H, R2=NH2)
N4-амино-2′-амино-2′-дезоксицитидин (VIIIe, R=R1=Н, R2=NH2) получен из 2′-азидо-2′-дезоксиуридина (IIIe), как в примере 6, с общим выходом 39%.
N4-амино-2′-амино-2′-дезоксицитидин (VIIIe, R=R1=Н, R2=NH2) М=257.25, С9Н15O4, УФ: рН 7,5:  max 271 ( max 271 ( 8200), рН 2: 8200), рН 2:  max 276 ( max 276 ( 11900), [DMSO-d6; 11900), [DMSO-d6;  , м.д.; (J, Гц)]: 7,79 d (1H, J5,6 7,5, H-6), 7,12 br s (2H, NH2), 5,79 d (1H, H-5), 5,67 d, (1H, J1′,2′ 5,5, H-1′), 4,31 br t (1H, J,2,3′ 5,5, J,3′,4′ 5, H-3′), 4,03 t (1H, H-2′), 3.90 br q (1H, J,4′,5′ 4 H-4′), 3,62 m (2H, N4-Amino-2′-amino-2′-deoxycytidine. , м.д.; (J, Гц)]: 7,79 d (1H, J5,6 7,5, H-6), 7,12 br s (2H, NH2), 5,79 d (1H, H-5), 5,67 d, (1H, J1′,2′ 5,5, H-1′), 4,31 br t (1H, J,2,3′ 5,5, J,3′,4′ 5, H-3′), 4,03 t (1H, H-2′), 3.90 br q (1H, J,4′,5′ 4 H-4′), 3,62 m (2H, N4-Amino-2′-amino-2′-deoxycytidine.
Пример 11. Синтез N4-бензил-2′-амино-2′-дезоксицитидина (VIIIf, R=R1=Н, R2=СН2С6Н5)
N4-бензил-2′-амино-2′-дезоксицитидин (VIIIf, R=R1=Н, R2=NHCH2С6Н5) получен из 2′-азидо-2′-дезоксиуридина (IIIe), как в примере 6, с общим выходом 52%.
N4-бензил-2′-амино-2′-дезоксицитидин (VIIIf, R=R1=Н, R2=NHCH2C6H5), М=332.36, C16H20N4O4, УФ: рН 7,5:  max 271 ( max 271 ( 8200), рН 2: 8200), рН 2:  max 276 ( max 276 ( 11900), [DMSO-d6; 11900), [DMSO-d6;  , м.д.; (J, Гц)]: 7,79 d (1H, J5,6 7,5, H-6), 7,25 m (5H, С6Н5) 7,12 br s (2H, NH2), 5,79 d (1H, H-5), 5,67 d, (1H, J1′,2′ 5,5, Н-1′), 4,4 s (2H, СН2С6Н5), 4,31 br t (1H, J,2,3′ 5,5, J,3′,4′ 5, H-3′), 4,03 t (1H, H-2′), 3.90 br q (1H, J4′,5′ 4 H-4′), 3,62 m (2H, H-5′). N4-Benzyl-2′-amino-2′-deoxycytidine , м.д.; (J, Гц)]: 7,79 d (1H, J5,6 7,5, H-6), 7,25 m (5H, С6Н5) 7,12 br s (2H, NH2), 5,79 d (1H, H-5), 5,67 d, (1H, J1′,2′ 5,5, Н-1′), 4,4 s (2H, СН2С6Н5), 4,31 br t (1H, J,2,3′ 5,5, J,3′,4′ 5, H-3′), 4,03 t (1H, H-2′), 3.90 br q (1H, J4′,5′ 4 H-4′), 3,62 m (2H, H-5′). N4-Benzyl-2′-amino-2′-deoxycytidine
Пример 12. Синтез N4-диэтил-2′-амино-2′-дезоксицитидина (VIIIg, R=Н, R1=R2=C2H5)
N4-диэтил-2′-амино-2′-дезоксицитидина (VIIIg, R=H, R1=R2=C2H5) получен из 2′-азидо-2′-дезоксиуридина (IIIe), как в примере 6, с общим выходом 58%.
N4-диэтил-2′-амино-2′-дезоксицитидин (VIIIg, R=Н, R1=R2=C2H5), М=298.34, C13H22N4O4, УФ: рН 7,5:  max 271 ( max 271 ( 8200), рН 2: 8200), рН 2:  max 276 ( max 276 ( 11900), [DMSO-d6; 11900), [DMSO-d6;  , м.д.; (J, Гц)]: 7,79 d (1H, J5,6 7,5, H-6), 7,12 br s (2H, NH2), 5,79 d (1H, H-5), 5,67 d, (1H, J1′,2′ 5,5, Н-1′), 4,31 br t (1H, J,2,3′ 5,5, J,3′,4′ 5, H-3′), 4,03 t (1H, H-2′), 3.50 m (5H, H-4′ + (СН2СН3)2), 3,62 m (2H, Н-5′), 1.1 s (6H, (CH2CH3)2). N4-Diethyl-2′-amino-2′-deoxycytidine. , м.д.; (J, Гц)]: 7,79 d (1H, J5,6 7,5, H-6), 7,12 br s (2H, NH2), 5,79 d (1H, H-5), 5,67 d, (1H, J1′,2′ 5,5, Н-1′), 4,31 br t (1H, J,2,3′ 5,5, J,3′,4′ 5, H-3′), 4,03 t (1H, H-2′), 3.50 m (5H, H-4′ + (СН2СН3)2), 3,62 m (2H, Н-5′), 1.1 s (6H, (CH2CH3)2). N4-Diethyl-2′-amino-2′-deoxycytidine.
Пример 13. Синтез N4-этил-2′-амино-2′-дезоксицитидина (VIIIh R=R1=H, R2=C2H5)
N4-этил-2′-амино-2′-дезоксицитидин (VIIIh R=R1=Н, R2=С2H5 получен из 2′-азидо-2′-дезоксиуридина (IIIe), как в примере 6, с общим выходом 53%. N4-этил-2′-амино-2′-дезоксицитидин (VIIIh R=R1=Н, R2=С2Н5), M=270.29, C11H18N4O4, УФ: рН 7,5:  max 271 ( max 271 ( 8200), рН 2: 8200), рН 2:  max 276 ( max 276 ( 11900), [DMSO-d6; 5, м.д.; (J, Гц)]: 7,79 d (1H, J5,6 7,5, H-6), 7,12 br s (2H, NH2), 5,79 d (1H, Н-5), 5,67 d,(1H, J1′,2′ 5,5, Н-1′), 4,3 1br t(1H, J,2,3′ 5,5, J,3′,4′ 5, H-3′), 4,03 t (1H, H-2′), 3.90 br q (1H, J4′,5′ 4 H-4′), 3,62 m (2H, H-5′ a, b), 3,21 m (2H, CH2СН3), 1,03 m (3H, СН2СН3). N4-Ethyl-2′-атто-2′-deoxycytidine. 11900), [DMSO-d6; 5, м.д.; (J, Гц)]: 7,79 d (1H, J5,6 7,5, H-6), 7,12 br s (2H, NH2), 5,79 d (1H, Н-5), 5,67 d,(1H, J1′,2′ 5,5, Н-1′), 4,3 1br t(1H, J,2,3′ 5,5, J,3′,4′ 5, H-3′), 4,03 t (1H, H-2′), 3.90 br q (1H, J4′,5′ 4 H-4′), 3,62 m (2H, H-5′ a, b), 3,21 m (2H, CH2СН3), 1,03 m (3H, СН2СН3). N4-Ethyl-2′-атто-2′-deoxycytidine.
Пример 14. Синтез N4-метил-2′-амино-2′-дезоксицитидина (VIIIi, R=R1=Н, R2=СН3)
N4-метил-2′-амино-2′-дезоксицитидина (VIIIi, R=R1=Н, R2=СН,) получен из 2′-азидо-2′-дезоксиуридина (IIIe), как в примере 6, с общим выходом 58%. N4-метил-2′-амино-2′-дезоксицитидина (VIIIi, R=R1=Н, R2=СН3), M=256.26, C10H16N4O4, УФ: рН 7,5:  max 271 ( max 271 ( 8200), рН 2: 8200), рН 2:  max 276 ( max 276 ( 11900), [DMSO-d6; 5, м.д.; (J, Гц)]: 7,79 d (1H, J5,6 7,5, H-6), 7,12 br s (2H, NH2), 5,79 d (1H, H-5), 5,67 d, (1H, J1′,2′ 5,5, Н-1′), 4,31 br t (1H, J,2,3′ 5,5, J,3′,4′ 5, H-3′), 4,03 t (1H, H-2′), 3.90 br q (1H,.J4′,5′ 4 H-4′), 3,62 m (2H, H-5′), 2,71 m (1H, CH3). N4-Methyl-2′-amino-2′-deoxycytidine. 11900), [DMSO-d6; 5, м.д.; (J, Гц)]: 7,79 d (1H, J5,6 7,5, H-6), 7,12 br s (2H, NH2), 5,79 d (1H, H-5), 5,67 d, (1H, J1′,2′ 5,5, Н-1′), 4,31 br t (1H, J,2,3′ 5,5, J,3′,4′ 5, H-3′), 4,03 t (1H, H-2′), 3.90 br q (1H,.J4′,5′ 4 H-4′), 3,62 m (2H, H-5′), 2,71 m (1H, CH3). N4-Methyl-2′-amino-2′-deoxycytidine.
Пример 15. Оценка цитотоксичности 2′-амино-2′-дезоксинуклеозидов
Цитотоксичность соединений оценивают путем добавления разведений каждого препарата в среде Игла MEM к монослою клеточной культуры Vero в лунки 96-луночного планшета (“Cel-Cult”, England) до конечных концентраций 0,1-400 мкг/мл (по три лунки на каждую дозу) с последующим культивированием при 37°С в CO2-инкубаторе в течение 5 суток. Контролем служат клетки без добавления соединения (1). Жизнеспособность клеток оценивают по оптической плотности (при 570 нм) после окрашивания раствором кристаллического фиолетового (1,3 г красителя, 50 мл этанола, до 700 мл Н2О, 300 мл 40% формалина) в течение 1,5 часов при комнатной температуре. Токсичность различных доз соединений определяют по жизнеспособности клеток относительно контроля, по полученным результатам рассчитывают дозу, на 50% снижающую жизнеспособность клеток (CD50). Данные приведены в таблице 1. Следует отметить, что 2′-амино-2′-дезоксинуклеозиды обладают слабой цитотоксичностью.
Пример 16. Исследование влияния 2′-амино-2′-дезоксинуклеозидов на репродукцию вируса кори в культуре клеток Vero
Исследование противовирусной активности экспериментальных препаратов в отношении вируса кори проводят на перевиваемой линии чувствительных клеток почки зеленой мартышки Vero. Для заражения используют супернатант инфицированных клеток, хранившийся в жидком азоте, множественность заражения составляет 0,2-0,5 инфекционных единиц на клетку. В лунки 96-луночного планшета (“Cel-Cult”, England) помещают суспензию клеток Vero с посевной концентрацией 150 тыс кл/мл, инкубируют 2 суток при 37°С в СО2-инкубаторе. После формирования монослоя из лунок планшета удаляют культуральную жидкость, вносят вирус (15 мкл) и одновременно такой же объем ростовой среды с исследуемым соединением до конечной концентрации 0,1-400 мкг/мл (по три лунки на каждую дозу). Контролями служат инфицированные клетки Vero без добавления препарата (вместо препарата вносят такое же количество среды Игла MEM без добавок) и неинфицированные клетки.
Адсорбцию вируса проводят в течение 1,5 часов при 37°С в СО2-инкубаторе. Затем в лунки вносят питательную среду Игла MEM с добавлением 2% фетальной сыворотки КРС, предварительно инактивированной прогреванием при 56°С в течение 30 минут, 300 мг/мл L-глютамина, 100 мкг/мл гентамицина, 100 мкг/мл линкомицина и исследуемым соединением до конечной концентрации 0,1-400 мкг/мл. В контрольные лунки вносят питательную среду со всеми добавками, но без препарата. Через 5 суток культивирования удаляют культуральную жидкость, вносят по 30 мкл раствора кристаллического фиолетового в каждую лунку, выдерживают 1,5 часа при комнатной температуре и измеряют оптическую плотность на спектрофотометре при длине волны 570 нм. Относительную степень защиты инфицированных клеток рассчитывают по формуле:
Защита (%)=(А-O)/(В-O)·100%,
где А – % жизнеспособности инфицированных клеток в присутствии соединения на 5 сутки культивирования, В – % жизнеспособности в контроле клеток, О – % жизнеспособности инфицированных клеток без добавления соединения (контроль вируса).
По полученным данным строят график зависимости защиты клеток от возрастающих доз соединения (для соединения VIIIa на фиг.1) и находят дозу препарата, на 50% защищающую клетки (ED50). Терапевтический индекс, или индекс селективности (IS), определяют как отношение концентрации соединения, токсичной для 50% клеток (CD50), к концентрации, на 50% защищающей клетки от гибели (ED50):
IS=CD50/ED50
В таблице 1 представлены результаты по цитотоксичностии и противокоревой активности 2′-амино-2′-дезоксинуклеозидов. Из этих данных видно, что выраженной противовирусной активностью кори обладает соединение (VIIIa), результаты исследования которого показаны в табл. 2. Соединение (IVa) обладает противокоревой активностью, сравнимой с антивирусным действием рибавирина.
Таблица 1
Данные по цитотоксичности и противовирусной активности 2′-амино-2′-дезоксинуклеозидов в отношении вируса кори |
| Соединение |
CD50,  М М |
ED50,  M M |
IS |
| IVa |
823 |
140 |
5,9 |
| IVc |
>620,9 |
не достигает |
|
| VIIIa |
846,7 |
25,4 |
33,3 |
| VIIId |
>774,6 |
не достигает |
|
| VIIIf |
>601,9 |
601,9 |
>1 |
| VIIIg |
>670,4 |
670,4 |
>1 |
| VIIIi |
>780,5 |
|
|
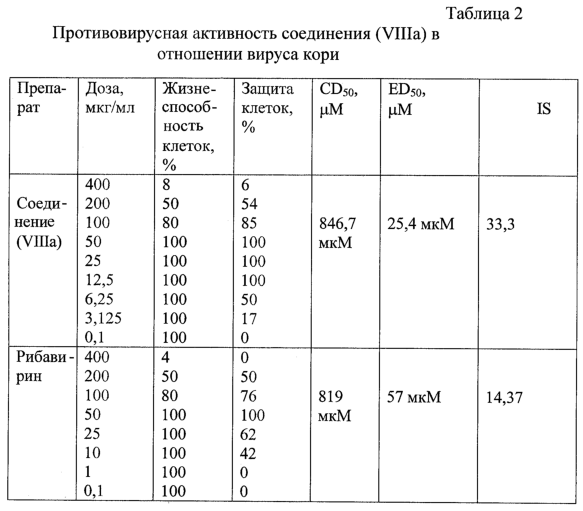
Из таблицы 2 видно, что 50% эффективная доза рибавирина равна 57 мкМ или 12,4 мкг/мл, что соответствует данным литературы [12]. 50% эффективная доза соединения (VIIIa) составила 25,4 мкМ или 6,25 мкг/мл. 50% цитотоксичные дозы, полученные для рибавирина и соединения (VIIIa), отличаются незначительно (846,7 и 823 мкМ соответственно), индексы селективности, или терапевтические индексы, равны 14,37 и 33,3 соответственно. Таким образом, противовирусное действие соединения (VIIIa) в отношении вируса кори превосходит антивирусную активностью рибавирина in vitro.
Пример 17. Исследование влияния соединения (IVa) на репродукцию вируса кори в культуре клеток Vero в комбинации с рибавирином.
Исследование противовирусной активности заявляемого соединения в комбинации с рибавирином проводят на перевиваемой линии клеток почки зеленой мартышки Vero. Для заражения используют супернатант инфицированных клеток, хранившийся в жидком азоте, множественность заражения составляет 0,2-0,5 инфекционных единиц на клетку. В лунки 96-луночного планшета (“Cel-Cult”, England) помещают суспензию клеток Vero с посевной концентрацией 150 тыс кл/мл, инкубируют 2 суток при 37°С в CO2-инкубаторе. После формирования монослоя из лунок планшета удаляют культуральную жидкость, вносят вирус (15 мкл) и сразу такой же объем ростовой среды с исследуемыми соединениями в концентрации: рибавирин – 3,125-25 мкг/мл, соединение (IVa) – 8,750-70 мкг/мл (по три лунки на каждую комбинацию доз). Контролями служат инфицированные клетки Vero без добавления препаратов (вносят такое же количество среды RPMI-1640 без добавок) и неинфицированные клетки.
Адсорбцию вируса проводят в течение 1,5 часов при 37°С в CO2-инкубаторе. Затем в лунки вносят питательную среду RPMI-1640 с добавлением 2% фетальной сыворотки КРС, предварительно инактивированной прогреванием при 56°С в течение 30 минут, 300 мг/мл L-глютамина и 100 мкг/мл гентамицина, содержащую исследуемую комбинацию соединений в нужной концентрации. В контрольные лунки вносят питательную среду со всеми добавками, но без соединений. Через 5 суток культивирования удаляют питательную среду, вносят по 30 мкл на лунку раствора генциан виолета, выдерживают 1,5 часа при комнатной температуре и измеряют оптическую плотность на спектрофотометре при длине волны 570 нм. Относительную степень защиты инфицированных клеток от гибели различными комбинациями рибавирина и соединения (IVa) рассчитывают по формуле:
Защита (%)=(А-O)/(В-O)×100,
где А – % жизнеспособности инфицированных клеток в присутствии соединений на 4 сутки культивирования, В – % жизнеспособности в контроле клеток, О – % жизнеспособности инфицированных клеток без добавления соединения (1) и (или) рибавирина (контроль вируса).
По полученным данным строят графики зависимости защиты клеток от возрастающих доз рибавирина и соединения (IVa) (фиг.2) и находят дозу рибавирина, которая в сочетании с соединением (IVa) на 50% защищает клетки от гибели, и дозу соединения (IVa), которая в сочетании с рибавирином на 50% защищает клетки от гибели (ID50). В таблице 3 представлены значения ID50, рассчитанные для разных сочетаний рибавирина и соединения (IVa).
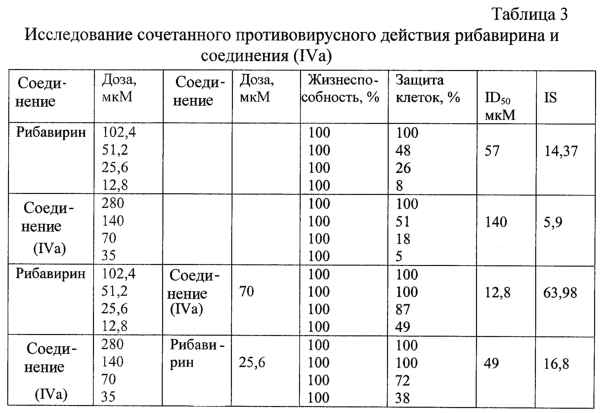
Из таблицы 3 видно, что использование в комбинации с рибавирином соединение (IVa) в концентрации 70 мкМ снижает 50% эффективную дозу рибавирина в 4,45 раза.
Пример 18. Влияние соединеия (VIIIa) на репродукцию вируса Марбург в культуре клеток Vero.
Исследование проводят с помощью количественного определения вируса в культуре клеток под полужидким агаровым покрытием.
Перевиваемую линию чувствительных клеток почки зеленой мартышки Vero вносят в пенфлаконы (посевная концентрация 200 тыс кл/мл) и инкубируют 2 суток при 37°С в атмосфере 5% CO2. После формирования монослоя из пенфлаконов удаляют культуральную жидкость, вносят вирус в дозе 5,5×104 БОЕ в объеме 0,1 мл. Адсорбцию проводят при 37°С. Затем во флаконы вносят по 2 мл полужидкого агарового покрытия (среда Игла MEM с 2% сывороки, 10% агара (2,4% гель), антибиотиками по 100 ЕД/мл и препаратом) и инкубируют 6 суток при 37°С. Контролями служат инфицированные клетки Vero без добавления препарата (контроль вируса) и неинфицированные клетки (контроль клеток). После окончания культивирования агаровое покрытие удаляют, монослой окрашивают кристаллическим фиолетовым в течение 1 часа, промывают водой и подсчитывают количество бляшек. Результаты представлены в таблице 4.
По данным, представленным в таблице 4, определяют комбинационный индекс, FIC, который равен:
FIC=ID50 вещества А в смеси/ID50 вещества А+ID50 вещества В в смеси/ID50 вещества В
Комбинационный индекс позволяет оценить характер взаимодействия препаратов в смеси: если FIC меньше 1, делают вывод о синергическом взаимодействии препаратов, если FIC больше 1, то об антагонистическом взаимодействии [13]. Комбинационный индекс для комбинации рибавирина и соединения (IVa) равен:
FIC=12,8/57+49/140=0,575, т.е. взаимодействие рибавирина и соединения (IVa) синергическое.
Таблица 4
Ингибирование репродукции вируса Марбург соединением (VIIIa) |
| Концентрация препарата, мкг/мл |
Количество бляшек |
| IMB-119 |
Контроль вируса |
Общее |
x±sx |
Общее |
x±Sx |
| 100,0 |
41 |
14,0±1,5 |
78,0 |
26,0±2,0 |
| 50,0 |
38 |
12,6±2,8 |
| 25,0 |
36 |
12,0±2,0 |
| 12,5 |
44 |
14,6±1,2 |
| 6,25 |
73 |
24,3±2,8 |
 Сумма трех измерений Сумма трех измерений |
Из представленных в таблице 4 данных видно, что ингибирование репродукции вируса Марбург не достигало 100% даже при дозе препарата 100 мкг/мл, однако концентрации соединения (VIIIa), равные 12,5 мкг/мл и выше, снижали количество вирусиндуцированных бляшек на 50%.
Таким образом, показано, что 2′-амино-2′-дезоксиуридин и 2′-амино-2′-дезоксицитидин обладают слабой цитотоксичностью в культуре клеток Vero (CD50 равны 823 и 846,7 мкМ соответственно) и выраженным противовирусным действием в отношении вируса кори (ID50 равны 140 мкг и 25,4 мкМ, соответственно). Кроме того, 2′-амино-2′-дезоксицитидин оказывает противовирусное действие в отношении вируса Марбург: в концентрации 12,5 мкг/мл и более соединение (VIIIa) снижает количество вирусиндуцированных бляшек или вирусиндуцированного цитопатического действия в культуре клеток Vero на 50%.
2′-Амино-2′-дезоксицитидин по своим противовирусным свойствам превосходит препарат сравнения рибавирин, и в связи с этим представляется перспективной разработка лекарственного препарата на основе соединения (VIIIa) для терапии инфекций, вызванных вирусами кори или Марбург.
Источники информации
4. Заявка на патент РФ №96117323, МПК С 07 Н 19/06, опубл. 10.12.1998.
5. Международная заявка WO № 00/15214, МПК А 61 К 31/19, опубл. 23.03.2000

11. Alexandrova L.A., Skoblov A.Yu., Jasko M.V., Victorova L.S., Krayevsky A.A., 2′-Deoxynucleoside 5′-triphosphates modified at  -, -,  – and – and  -phosphates as substrates for DNA polymerases, Nucl. Acids Res., 1998, 26, №3, 778-786. -phosphates as substrates for DNA polymerases, Nucl. Acids Res., 1998, 26, №3, 778-786.
Формула изобретения
2′-Амино-2′-дезоксинуклеозиды, имеющие формулу
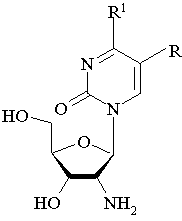
где R = Н, алкил, аминоалкил,
R1 = (R2NR3), где R2 и/или R3 = Н, ОН, NH2, алкил, бензил,
при условии, что R не представляет собой Н или метил, когда R2 и R3 = Н.
РИСУНКИ
|
|