|
|
(21), (22) Заявка: 2004115855/04, 27.05.2004
(24) Дата начала отсчета срока действия патента:
27.05.2004
(45) Опубликовано: 10.11.2005
(56) Список документов, цитированных в отчете о
поиске:
FISCHER MICHAEL ET AL.”Synthesis of substituted phenyl 2-aminopyridine-3-sulfonates”Synthesis (English), 2003, (10), p.1603-1609.
ЕР 103543 А2, 21.03.1984.
FR 88352 A, 27.01.1967.
WO 97/26294 A1, 24.07.1997.
ЕР 618209 А1, 05.10.1994.
JP 20040097492 A1, 20.05.2004.
JP 20040087577 A1, 06.05.2004.
WO 99/32495 A1, 01.07.1999.
Адрес для переписки:
142290, Московская обл., г. Пущино, мкр. В, 26, кв.39, Н.М. Шмаковой
|
(72) Автор(ы):
Дорогов М.В. (RU),
Соловьев М.Ю. (RU),
Кравченко Д.В. (RU),
Ткаченко С.Е. (RU),
Иващенко А.В. (RU)
(73) Патентообладатель(и):
Общество с ограниченной ответственностью “Исследовательский Институт Химического Разнообразия” (ООО “Исследовательский Институт Химического Разнообразия”) (RU)
|
(54) ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, ВКЛЮЧАЮЩИЕ 2-АМИНОПИРИДИН-3-СУЛЬФОНОВЫЙ ФРАГМЕНТ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ), ФОКУСИРОВАННАЯ БИБЛИОТЕКА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ
(57) Реферат:
Изобретение относится к новым гетероциклическим соединениям, включающим 2-аминопиридин-3-сульфоновый фрагмент, общей формулы 1 или их фармацевтически приемлемым солям, N-оксидам или гидратам, обладающим свойствами блокаторов глутамат-индуцированного транспорта ионов кальция, в частности нейропротекторным действием. Изобретение также относится к фокусированной библиотеке для поиска биологически активных соединений-лидеров, включающей по крайней мере одно гетероциклическое соединение общей формулы 1, и к фармацевтической композиции в форме таблеток, капсул или инъекций, помещенных в фармацевтически приемлемую упаковку, содержащей соединения изобретения в качестве активной субстанции. В соединении общей формулы 1
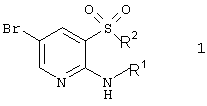
R1 представляет атом водорода; R2 представляет атом хлора, необязательно замещенную гидроксильную группу, необязательно замещенную аминогруппу, необязательно замещенный азагетероциклил; или R1 и R2 вместе с атомами азота и серы, к которым они присоединены образуют необязательно замещенный и необязательно конденсированный с другими циклами 1,1-диоксо-4Н-пиридо[2,3-е][1,2,4]тиадиазин или необязательно замещенный и необязательно конденсированный с другими циклами 5,5-диоксо-5,6,7,9-тетрагидро-5-тиа-1,6,9-триазабензоциклогептен-8-он. Изобретение также раскрывает способы получения различных соединений общей формулы 1. 6 н. и 4 з.п. ф-лы, 4 табл.
(56) (продолжение):
CLASS=”b560m”КОТОВСКАЯ С.К. и др. «Синтез и свойства пиридо-[ 2,3-е][1,2,4] тиадиазин 1,1-диоксидов» Хим. Фарм. Журнал, 1979, 13(4), 54-57).
И.С.ЧЕКМАН, И.Ф.ПОЛЯКОВА «Общая рецептура», Киев, Головное издательство издательского объединения «Вища школа», 1985 г, стр. 4,5 и стр.30-34, 16-18.
PIROTTE BERNARD et al. “3-Alkylamino-4H-pyrido[2,3-e]-1,2,4-thiadiazine 1,1-Dioxides Structurally Related to Diazoxide and Pinacidil as Potassium Channel Openers Acting on Vascular Smooth Muscle Cells: Design, Synthesis, and Pharmacological Evaluation”. (Journal of Medicinal Chemistry(English), 2000 , 43(8), 1456-1466).
PIROTTE BERNARD et al. “4H-1,2,4-Pyridothiadiazine 1,1-Dioxides and 2,3-Dihydro-4H-1,2,4-pyridothiadiazine 1,1-Dioxides Chemically Related to Diazoxide and Cyclothiazide as Powerful Positive Allosteric Modulators of (R/S)-2-Amino-3-(3-hydroxy-5-methylisoxazol-4-yl)propionic Acid Receptors: Design, Synthesis, Pharmacology, and Structure-Activity Relationships” (Journal of Medicinal Chemistry(English), 1998, 41(16), 2946-2959) .
De TULLIO PASCAL et al. ”Synthesis and biological evaluation of new 3-aralkylamino-2-aryl-2H- 1,2,4-pyridothiadiazine 1,1-dioxides as potential CCK-receptor ligands” Journal of Pharmacy and Pharmacology, (English) 1997, 49(5), 463-471.
Данное изобретение относится к синтезу новых химических веществ, поиску новых физиологически активных веществ, соединений-лидеров и лекарственных кандидатов, получаемых на основании скрининга комбинаторных или фокусированных библиотек соединений, а также к фармацевтической композиции.
Более конкретно, настоящее изобретение относится к новым гетероциклическим соединениям, включающим 2-аминопиридин-3-сульфоновый фрагмент и представляющим интерес как потенциальные физиологически активные вещества (агонисты, антагонисты и модуляторы рецепторов, ингибиторы ферментов, онколитики, антибактериальные и противопаразитарные агенты, и т.д.), к фокусированной библиотеке и фармацевтической композиции, содержащей в качестве активной субстанции новые новые гетероциклические соединения, включающие 2-аминопиридин-3-сульфоновый фрагмент.
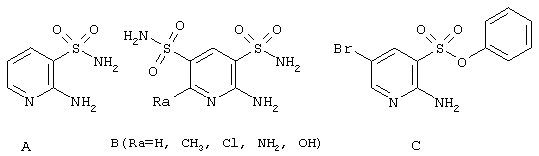
Существует большое количество физиологически активных гетероциклических соединений, включающим 2-аминопиридин-3-сульфоновый фрагмент, в том числе 2-аминопиридин-3-сульфамид [Котовская С.К. и др. Хим. Фарм. Ж., 1979, 13(4), 54-57], 2-аминопиридин-3,4-дисульфамиды [Grapoe E.J. et al. J. Med, Pharm. Chem. 1961, 4, 369-383] и фениловый эфир 2-амино-5-бромпиридин-3-сульфокислоты [Fischer, M.; Troschuetz, R. Synthesis, 2003, 10, 1603-1609], представленные ниже
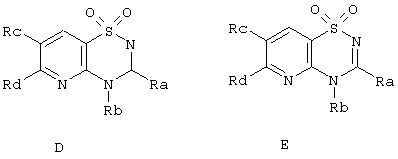
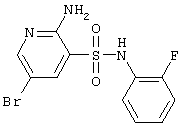
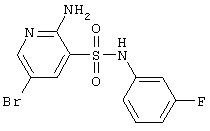
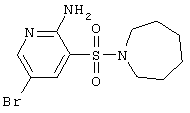
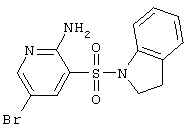
Циклизацией 2-аминопиридин-3-сульфамидов А и В альдегидами и кислотами получены соответствующие 2(4)Н-пиридо[2,3-е][1,2,4]тиадиазин 1,1-диоксиды D и Е, представленные ниже в Таблице 1.
Таблица 1
Известные 2(4)Н-пиридо[2,3-е][1,2,4]тиадиазин 1,1-диоксиды D и Е
 |
| Соед. |
Ra |
Rb |
Rc |
Rd |
Литература |
| D |
H |
Н |
н |
Н |
а |
| D |
Н |
Н |
SO2NH2 |
СН3 |
b |
| D |
H |
Н |
SO2NH2 |
NH2 |
b |
| D |
Н |
H |
SO2NH2 |
ОН |
b |
| D |
Н |
H |
SO2NH2 |
Cl |
b |
| E |
Н |
H |
Н |
H |
|
| E |
СН3 |
H |
Н |
H |
а, с |
| E |
NH2 |
H |
Н |
H |
а |
| E |
3-пиридил |
H |
H |
H |
d |
| E |
Н |
C2H5 |
SO2NH2 |
H |
е |
| E |
CH2SCH2Ph |
Н |
SO2NH2 |
H |
b |
| E |
Н |
H |
SO2NH2 |
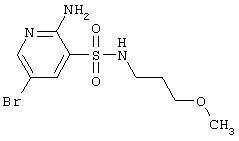
СН3 |
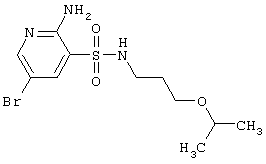
b |
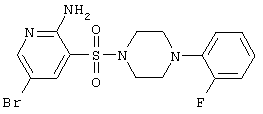
| E |
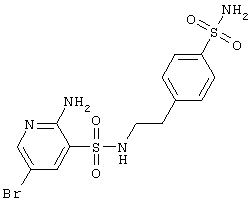
Н |
H |
SO2NH2 |
NH2 |
b |
| E |
Н |
H |
SO2NH2 |
ОН |
b |
| E |
Н |
H |
SO2NH2 |
Cl |
b |
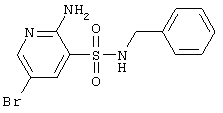
| E |
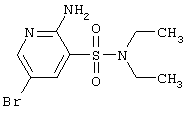
CH2SCH2Ph |
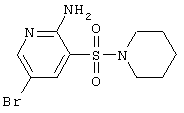
H |
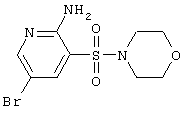
SO2NH2 |
СН3 |
b |
а Котовская С.К. и др. Хим. Форм. Ж., 1979, 13(4), 54-57.
b Grapoe E.J. et al. J. Med, Pharm. Chem., 1961, 4, 369-383.
с Tullio P. de; et al. Tetrahedron, 1995, 51(11), 3221-3234.
d Osselaere J.P. Eur. J. Med. Chem. 1974, 9, 310-312.
e Yale H.L., Sheehan, J.T. J. Org. Chem., 1961, 26, 4315-4325. |
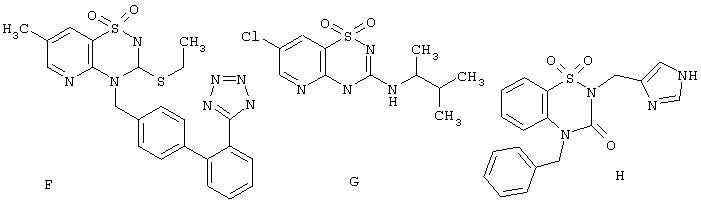
Следует отметить, что среди известных 2(4)Н-пиридо[2,3-е][1,2,4]тиадиазин 1,1-диоксидов Е имеются кардиоваскулярные и антигипертенсивные лекарства, действующие как ангиотенсивные AT1 рецептор антагонисты F [Squibb & Sons, 1995, Pat. US 5378704] и активаторы калиевых (АТР) каналов G [University of Liege, Drug Data Rep. 2000, 22(7), 600], а гетероциклы, включающие 2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-4-он-1,1-диоксидный фрагмент, являются, например, ингибиторами путей сигнальной трансдукции Н [Bristol-Meers Squibb, 1998, Pat. US 6156746].
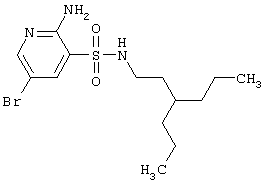
Новые гетероциклические соединения, включающие 2-аминопиридин-3-сульфоновый фрагмент и 2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-4-он-1,1-диоксидный фрагмент, представляют интерес в качестве нейропротекторов. Глутаматергическая система является основной возбуждающей нейромедиаторной системой в мозге и участвует в реализации целой серии физиологических и патологических процессов. Известно, что широкий круг неврологических заболеваний (таких, как БА, хорея Гентингтона, боковой амиотрофический склероз, а также ишемия мозга) связан с иксайтотоксическим действием нейромедиаторных возбуждающих аминокислот (ВАК) – глутамата и аспартата (Excitatory Ammo Acids and Drug Research, Ed. by M.R.Szewczak & N.J.Hrib, Alan R. Liss, Inc., New York, 1989, p.380; The NMDA Receptor, Eds. Watkins & Collngridge G., 1989, IRL Press). В соответствии с этим механизмом деполяризация мембран нейронов при длительной активации глутаматных рецепторов ЦНС, а именно рецепторов N-метил-D-аспартата (NMDA), и т.н. «non-NMDA»-рецепторов, в частности рецепторов «амино-3-гидрокси-5-метилизоксазол-4-пропионовой кислоты / каиновой кислоты» (АМРА/КА), приводит к нарушению кальциевого гомеостаза в нервных клетках и инициирует целый ряд патологических метаболических процессов (в том числе, образование свободнорадикальных метаболитов), вызывающих в конечном итоге гибель нервных клеток (D.W.Choi, Neuron, 1988, v.1, p.623-634).
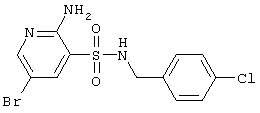
Возможность регуляции пула внутриклеточного кальция определяет большое фармакологическое значение специфических блокаторов транспорта кальция, связанного с глутаматными рецепторами ЦНС. В настоящее время ряд антагонистов NMDA- и АМРА/КА рецепторов предложен в качестве антидепрессантов [J.Maj, V.Klimek, Z.Rogoz, G.Skuza – Pol. J. Pharmacol., 1993, v.45, pp.549-553; R.Trullas, P.Skolnick – Eur. J. Pharmacol., 1990, v.185, No 1, pp.1-10], анксиолитиков [R.W.Dunn, R.Corbet, L.L.Martin, J.F.Payack, L.Laws-Ricker, C.A.Wilmot, D.K.Rush, J.F.Cornfeldt, S.Fielding – Prog. Clin. Biol. Res., 1990, v.361, (Curr. Future Trends Anticonvulsant Anxiety, Stroke Ther.), pp.495-512], противосудорожных препаратов [J.M.Ferkany, W.J.Krezotarski – Prog. Clin. Biol. Res., 1990, v.361 (Curr. Future Trends Anticonvulsant Anxiety, Stroke Ther.), pp.525-541; W.J.Schmidt, B.Zadow, B.D.Kretschmer. – Aminoacids, 1991, v.1, No 2, pp.225-237) и нейропротекторов (S.Fielding, J.Wilker, J.C.Chernack, V.Ramizer, C.A.Wilmot, M.L.Cornfeldt, K.A.Rudolphi, L.L.Martin, J F.Payck, D.K.Rush – Prog. Clin. Biol. Res., 1990, v.361, pp.495-512 (Curr. Future Trends Anticolvunsant Anxiety, Stroke Ther.); T.Nakao, A.Nishiyama, H.Tanaka, Y.Morimot, S.Takehara – Pat. Jap. 04,257,589 [92,257,589] (C 07 D 495/14) от 12.02.1991).
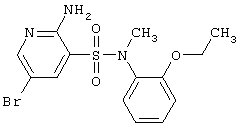
В случае БА, в частности, предполагается, что один из основных механизмов гибели нервных клеток связан со значительным возрастанием восприимчивости нейронов к иксайтотоксическому действию ВАК в результате воздействия на нервные клетки патологической формы  -амилоидного пептида, играющего ключевую роль в патогенезе БА. В результате этого нетоксические в нормальных условиях концентрации медиатора глутамата становятся в условиях развивающегося -амилоидного пептида, играющего ключевую роль в патогенезе БА. В результате этого нетоксические в нормальных условиях концентрации медиатора глутамата становятся в условиях развивающегося  -амилоидоза токсическими для нейронов и вызывают их гибель (Koh et al., Brain Res., 1990, v.533, p.315; Mattson et al., J. Neuroschi., 1992, v.12, p.376). -амилоидоза токсическими для нейронов и вызывают их гибель (Koh et al., Brain Res., 1990, v.533, p.315; Mattson et al., J. Neuroschi., 1992, v.12, p.376).
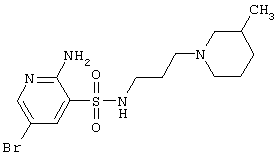
В этой связи поиск эффективных блокаторов глутамат-индуцированного транспорта ионов кальция, в частности в ряду антагонистов NMDA-рецепторов мозга, способных защищать нервные клетки от нейротоксического действия избыточных концентраций ионов кальция является оригинальным и перспективным подходом к созданию новых нейропротекторов для лечения и защиты от широкого круга нейродегенеративных заболеваний (Danysz et al., Drug, News & Perspectives, 1995, v.8, №5, p.261).
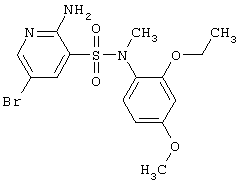
Учитывая высокий потенциал физиологической активности гетероциклических соединений, включающих 2-аминопиридин-3-сульфоновый фрагмент и 2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-4-он-1,1-диоксидный фрагмент, актуальным является разработка новых соединений этого типа, фокусированных библиотек и фармацевтических композиций, включающих этих соединения.
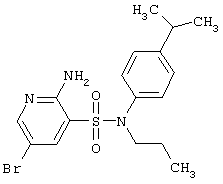
В результате проведенных исследований, направленных на поиск новых физиологически активных веществ, соединений-лидеров, изобретатели получили не известные ранее новые гетероциклические соединения, включающие 2-аминопиридин-3-сульфоновый фрагмент, которым свойственна физиологическая активность, фокусированную библиотеку и фармацевтическую композицию, включающую эти соединения.
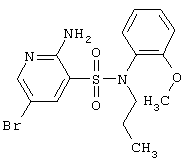
Следует отметить, что несмотря на заметное количество гетероциклических соединений, включающих 2-аминопиридин-3-сульфоновый фрагмент, опубликованных в патентной и научной литературе, некоторые из них до настоящего времени известны не были.
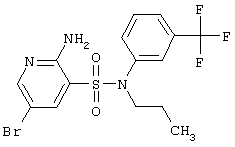
Ниже приведены определения терминов, которые использованы в описании этого изобретения:
«Комбинаторная библиотека» означает коллекцию соединений, полученных параллельным синтезом, предназначенную для поиска лида или оптимизации биологической активности лид-соединения, причем каждое соединение библиотеки соответствует общему скэффолду и библиотека является коллекцией родственных гомологов или аналогов.
«Фокусированная библиотека» означает комбинаторную библиотеку, или совокупность нескольких комбинаторных библиотек, или совокупность библиотек и веществ, специальным образом организованную с целью увеличения вероятности нахождения хитов и лидеров или с целью повышения эффективности их оптимизации. Дизайн фокусированных библиотек, как правило, связан с направленным поиском эффекторов (ингибиторов, активаторов, агонистов, антагонистов и т.п.) определенных биомишеней (ферментов, рецепторов, ионных каналов и т.п.).
«Лид-соединение» означает соединение с выдающейся активностью, относящейся к определенной болезни.
«Скэффолд» означает общую структурную формулу, или молекулярный каркас, или инвариантную область соединений, характерную для всех соединений, входящих в комбинаторную библиотеку.
«Хемотип» означает серию соединений, объединенную общей структурной формулой и обладающую определенным общим свойством, например каким-то видом физиологичекой активности. Можно сказать, например, “новый хемотип активаторов калиевых каналов”, или “известный хемотип киназных ингибиторов”, и т.д. Как правило, наличие общего структурного фрагмента у соединений в рамках одного хемотипа является необходимым и достаточным условием для наличия у них общего свойства.
«Заместитель» означает химический радикал или группу, которые присоединяются к другому радикалу, группе или к скэффолду, включая, но не ограничивая атом галогена, «инертный заместитель», нитро группа, сульфо группа, сульфамидная группа, гидроксильная группа, амино группа, карбоксиалкильная группа, алкоксикарбонильная группа, карбамоильная группа и др.
«Инертный заместитель» (“Non-interfering substituent”) означает низко- или нереакционоспособный радикал, инертный к дальнейшим превращениям и к среде, включая, но не ограничивая С1-С7 алкил, С2-С7 алкенил, С2-С7 алкинил, С1-С7 алкокси, С7-С12 аралкил, замещенный аралкил, С7-С12 гетероциклилалкил, замещенный гетероциклилалкил, С7-C12 алкарил, С3-С10 циклоалкил, С3-С10 циклоалкенил, фенил, замещенный фенил, толуил, ксиленил, бифенил, C2-С12 алкоксиалкил, С2-С10 алкилсульфинил, С2-С10 алкилсульфонил, (СН2)m-O-(C1-С7алкил), -(CH2)m-N(C1-С7алкил)n, арил, замещенный арил, замещенный алкокси, фторалкил, арилоксиалкил, гетероциклил, замещенный гетероциклил и нитроалкил, где m и n имеют значение от 1 до 7. Предпочтительными «инертными заместителями» являются C1-С7 алкил, С2-C7 алкенил, С2-С7 алкинил, C1-С7 алкокси, С7-C12 аралкил, С7-C12 алкарил, С3-С10 циклоалкил, С3-С10 циклоалкенил, фенил, замещенный фенил, (СН2)m-O-(C1-С7алкил), -(CH2)m-N(C1-С7алкил)n, арил, замещенный арил, гетероциклил и замещенный гетероциклил.
«Замещенная группа, замещенный радикал или скэффолд» означают, соответственно, группу, радикал или скэффолд, у которых имеется заместитель, включая, но не ограничивая: инертный заместитель, атом галогена, нитро группа, циано группа, сульфо группа, гидроксильная группа, амино группа, карбоксиалкильная группа, карбоксильная группа, карбамоильная группа. Например, замещенный алкил означает алкил, у которого имеется один или несколько заместителей, например гидроксиалкил или метилоксикарбонилалкил, амино-метоксикарбонил-метил, диметиламиноалкил, 2-гидрокси-2-метоксикарбонил-этил и др.; замещенная амино группа означает амино группу, у которой имеется один или два заместителя, например ациламино группа, N,N-диалкиламино группа, N-ацил-N-арил-амино группа, ацетил-метоксикарбонилметил-амино группа и др.; замещенный фенил означает фенил, у которого имеется один или несколько заместителей, например 2-метоксикарбонилфенил, 4-амино-3-метоксикарбонилфенил, 3,4-диаминофенил и др.
«Необязательно замещенная группа, необязательно замещенный радикал или скэффолд» означают, соответственно, группу, радикал или скэффолд, включающие группы, радикалы или скэффолды с заместителями и без заместителей. Например, понятие необязательно замещенная аминогруппа включает незамещенную аминогруппу и аминогруппы, содержащие любые, не противоречащие химии заместители, включая, но не ограничивая ациламино группы, N,N-диалкиламино группы, N-ацил-N-арил-амино группы, ацил-метоксикарбонилметил-амино группы и др.
«Арил» означает один или более ароматических циклов, каждый из которых включает 5 или 6 атомов углерода. «Арил» может быть конденсированным полициклом, например, как нафталин или неконденсированным, например как бифенил. «Замещенный арил» имеет один или несколько «не мешающих» заместителей.
«Галоген» означает атом фтора, хлора, брома или иода.
«Гетероцикл» означает один или несколько насыщенных или ароматических циклов с 5, 6 или 7 атомами, по крайней мере, один из которых является гетероатомом. Преимущественными гетероатомами являются сера, кислород и азот. «Гетероцикл» может быть конденсированным полициклом, например, как бензимидазол, бензоксазол. бензтиазол, хинолин, или неконденсированным, например, как бипиридил.
«Азогетероцикл» означает гетероцикл, включающий, по крайней мере, один атом азота, например, как бензимидазол, бензоксазол, бензтиазол, хинолин.
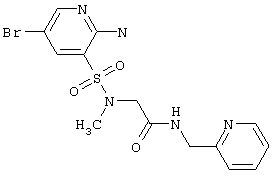
«Замещенный гетероцикл» означает гетероцикл, имеющий один или несколько «не мешающих» заместителей.
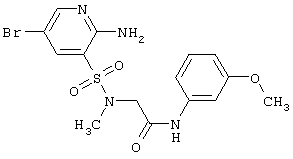
«Параллельный синтез» означает метод проведения химического синтеза комбинаторной библиотеки индивидуальных соединений.
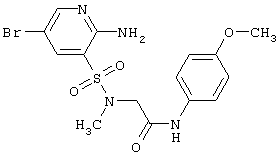
Целью настоящего изобретения являются новые гетероциклические соединения, включающие 2-аминопиридин-3-сульфоновый фрагмент.
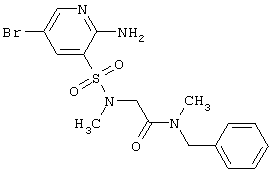
Поставленная цель достигается гетероциклическими соединениями, включающими 2-аминопиридин-3-сульфоновый фрагмент, общей формулы 1
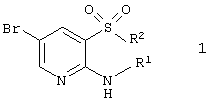
или их фармацевтически приемлемыми солями, N-оксидами или гидратами, в которых:
R1 представляет атом водорода;
R2 представляет атом хлора, необязательно замещенную гидроксильную группу необязательно замещенную амино группу необязательно замещенный азогетероцикл;
или R1 и R2 вместе с атомами азота и серы, к которым они присоединены, образуют необязательно замещенный и необязательно конденсированный с другими циклами 1,1-диоксо-4Н-пиридо[2,3-е][1,2,4]тиадиазин или необязательно замещенный и необязательно конденсированный с другими циклами 5,5-диоксо-5,6,7,9-тетрагидро-5-тиа-1,6,9-триаза-бензоциклогептен-8-он, исключая фениловый эфир 2-амино-5-бромпиридин-3-сульфокислоты.
Согласно изобретению предпочтительными гетероциклическими соединениями, включающими 2-аминопиридин-3-сульфоновый фрагмент, являются 2-аминопиридин-3-сульфокислоты и их производные общей формулы 1.1
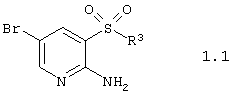
или их фармацевтически приемлемыми солями, N-оксидами или гидратами, в которых:
R2 имеет вышеуказанное значение.
Согласно изобретению предпочтительными гетероциклическими соединениями, включающими 2-аминопиридин-3-сульфоновый фрагмент, являются 1,1-диоксо-4H-пиридо[2,3-е][1,2,4]тиадиазины с необязательно замещенными аннелированными карбоциклами или гетероциклами общей формулы 1.2
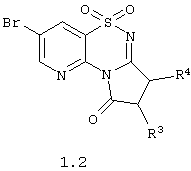
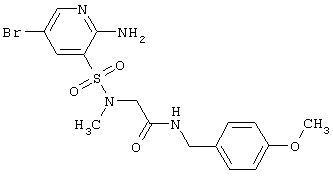
или их фармацевтически приемлемыми солями, N-оксидами или гидратами, в которых:
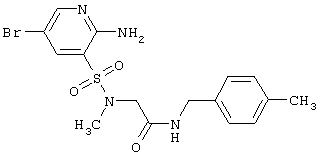
R3 и R4 независимо друг от друга представляют атом водорода, атом галогена, инертный заместитель, необязательно замещенную гидроксильную группу, необязательно замещенную аминогруппу, необязательно замещенный С1-С3алкилоксикарбонилС1-С3алкил, необязательно замещенный аминокарбонил, необязательно замещенный аминокарбонилС1-С3алкил или необязательно замещенный аминокарбонилС1-С3алкил,
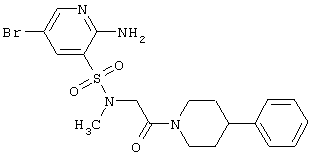
или R3 и R4 вместе с атомами углерода, к которому они присоединены, образуют необязательно замещенный и необязательно конденсированный циклоалкил или циклоакенил, необязательно замещенный арил или гетероциклил.
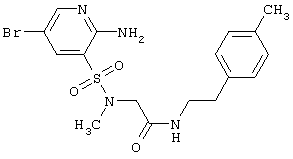
Согласно изобретению предпочтительными гетероциклическими соединениями, включающими 2-аминопиридин-3-сульфоновый фрагмент, являются 5,5-диоксо-5,6,7,9-тетрагидро-5-тиа-1,6,9-триаза-бензоциклогептен-8-оны общей формулы 1.3
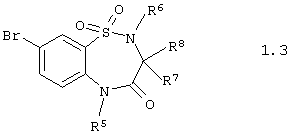
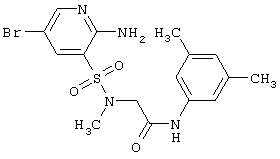
или их фармацевтически приемлемыми солями, N-оксидами или гидратами, в которых:
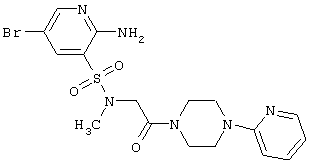
R5 и R6 независимо друг от друга представляют атом водорода или инертный заместитель, а R7 и R8 независимо друг от друга представляют атом водорода, инертный заместитель, остаток аминокислоты или необязательно замещенную этиленовую группу.
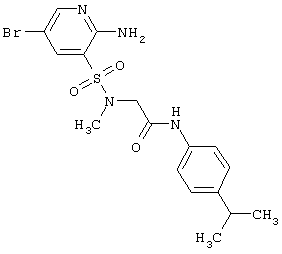
Согласно изобретению предпочтительными гетероциклическими соединениями, включающими 2-аминопиридин-3-сульфоновый фрагмент, являются амиды 3-(1,1-диоксо-1,4-дигидропиридо[2,3-е][1,2,4]тиадиазин-3-ил)-пропионовой кислоты общей формулы 1.4
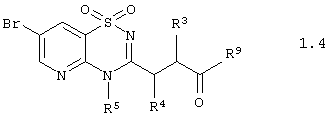
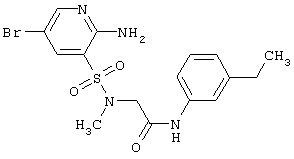
или их фармацевтически приемлемыми солями, N-оксидами или гидратами, в которых:
R3, R4 и R5 имеют вышеуказанное значение, а R9 представляет необязательно замещенную аминогруппу или необязательно замещенный азогетероцикл.
Новые 2-амино-5-бромпиридин-3-сульфамиды 1.1 получают с использованием общеизвестных способов синтеза, в частности, сульфохлорированием 2-амино-5-бромпиридина 2 и взаимодействием образующегося сульфохлорида 3 с аминами или азагетеро циклам и общей формулы 4 по приведенной ниже схеме 1:
Схема 1
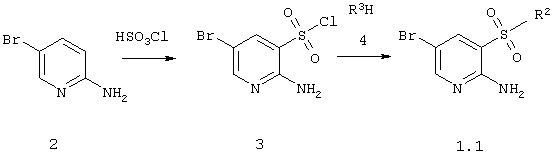
в которых R2 имеют вышеуказанное значение.
Данное изобретение относится к способу получения 7-бром-1,1-диоксо-4Н-пиридо[2,3-е][1,2,4]тиадиазинов с необязательно замещенными аннелированными карбоциклами общей формулы 1.2, который заключается во взаимодействии 2-амино-5-бромпиридин-3-сульфамида 1.1(1) с циклическими ангидридами дикарбоновых кислот общей формулы 5 по схеме 2:
Схема 2
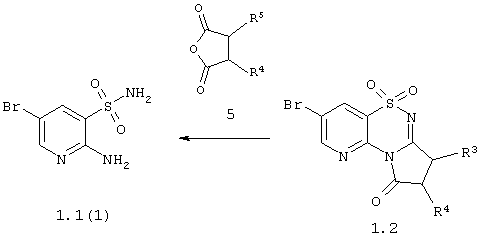
Данное изобретение относится к способу получения 3-бром-5,5-диоксо-5,6,7,9-тетрагидро-5-тиа-1,6,9-триаза-бензоциклогептен-8-оны общей формулы 13, который заключается во взаимодействии 2-амино-5-бромпиридин-3-сульфохлорида 3 с  -аминокислотами или их эфирами 6 и последующей циклизации образующихся соединений 1.1(а) по схеме 3 -аминокислотами или их эфирами 6 и последующей циклизации образующихся соединений 1.1(а) по схеме 3
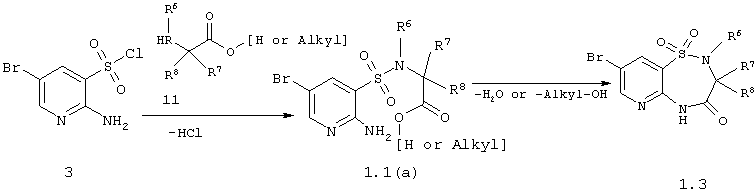
Амиды 3-(1,1-диоксо-1,4-дигидропиридо[2,3-е][1,2,4]тиадиазин-3-ил)-пропионовой кислоты общей формулы 1.4 получают исходя из 5,5-диоксо-3,5-дигидро-2Н-5-тиа-4,9,9b-триаза-циклопента[а]нафталин-1-онов общей формулы 1.2 по приведенной ниже схеме 4:
Схема 4
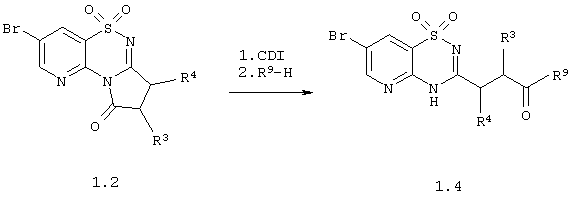
в которых R3 и R4 имеют вышеуказанное значение; R9 представляет необязательно замещенную амино группу, необязательно замещенный азогетероцикл.
Целью настоящего изобретения являются фокусированная библиотека для поиска биологически активных соединений-лидеров.
Поставленная цель достигается фокусированной библиотекой, включающей, по крайней мере, одно гетероциклическое соединение, включающее 2-аминопиридин-3-сульфоновый фрагмент, общей формулы 1 или его фармацевтически приемлемую соль, N-оксид или гидрат.
Целью настоящего изобретения являются новая фармацевтическая композиция в форме таблеток, капсул или инъекций, помещенных в фармацевтически приемлемую упаковку.
Поставленная цель достигается фармацевтической композицией, включающей по крайней мере одно гетероциклическое соединение, включающее 2-аминопиридин-3-сульфоновый фрагмент, общей формулы 1 или его фармацевтически приемлемую соль, N-оксид или гидрат.
Фармацевтически приемлемые соли соединений могут быть получены традиционным путем, например действием на соединения соответствующей кислотой или основанием. N-оксиды могут быть получены окислением соответствующих азотсодержащих соединений. Гидраты соединений могут быть получены, например, при перекристаллизации из водных растворов, или образуются спонтанно в процессе синтеза.
Ниже изобретение описывается с помощью примеров получения конкретных соединений и фокусированной библиотеки. Структуры полученных соединений подтверждались данными хроматографического и спектрального анализа.
Приведенные ниже примеры иллюстрируют, но не ограничивают данное изобретение.
Пример 1. 2-Амино-5-бромпиридин-3-сульфамид 1.1(1). Прибавляли небольшими порциями 2-амино-5-бромпиридин 2 [54 г (0,31 моль)] к охлажденной на ледяной бане хлорсульфоновой кислоте [200 мл (3 моль)]. Смесь кипятили в колбе с обратным холодильником в течение 3 ч. После охлаждения смесь выливали на 500 г мелко раздробленного льда при интенсивном перемешивании. Образовавшийся при этом желтый осадок 2-амино-5-бромпиридин-3-сульфохлорида 3 отфильтровывали, промывали холодной водой, затем петролейным эфиром и высушивали. Получали 72,4 г (86%), 2-амино-5-бромпиридин-3-сульфохлорида 3 с т.пл. 151-153°С. Полученный продукт 3 [72,4 г (0,27 моль)] суспендировали при перемешивании в 1000 мл 10% водного раствора аммиака. Через 0,5 часа суспензию концентрировали под вакуумом до объема 300 мл. Образовавшийся осадок 2-амино-5-бромпиридин-3-сульфамида 1.1(1) отфильтровывали, промывали водой и петролейным эфиром. Получали 41,5 г (61%) 2-амино-5-бромпиридин-3-сульфамида 1.1(1) (Таблица 2).
Пример 2. Общая методика синтеза замещеных 2-амино-5-бромпиридин-3-сульфамидов 1.1(2-169). Способ получения фокусированной библиотеки 2-амино-5-бромпиридин-3-сульфамидов 1.1(2-169). Раствор 0,27 г (0,003 моль) 2-амино-5-бромпиридин-3-сульфохлорида 3 в 3 мл диоксана охлаждали на ледяной бане до температуры 5°С и при интенсивном перемешивании прибавляли раствор 0,003 моль амина 4 и 0,28 г (0,0035 моль) пиридина в 2 мл диоксана. Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, а затем при температуре 50°С в течение 1 часа. Смесь оставляли на ночь при комнатной температуре. Затем смесь выливали в воду. Образовавшийся осадок очищали перекристаллизацией из пропанола-2, отфильтровывали, промывали холодной водой и высушивали. Получали фокусированную библиотеку состоящую из замещеных 2-амино-5-бромпиридин-3-сульфамидов 1.1(2-169), представленных в таблице 2.
| Таблица 2 |
| № п.п. соед. 1.1 |
Формула |
Мол. Вес. |
Аналитические данные |
| 1 |
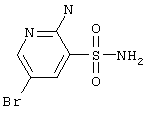 |
252,09 |
Спектр ЯМР 1Н: 6,4 (с, 2Н, NH2), 7,3 (с, 2Н, SO2NH2), 7,9 (д, 1Н, J=2,3 Hz, 4CH), 8,1 (д, 1Н, J=2,3 Hz, 6CH). LC MS, m/z 253 (M+1). |
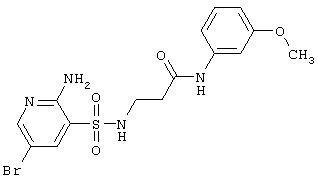
| 2 |
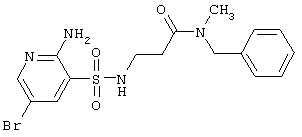
 |
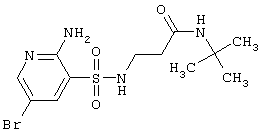
364,17 |
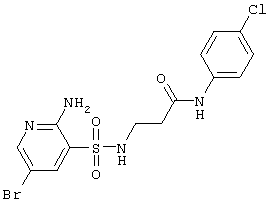
LC MS, m/z 365 (M+1) |
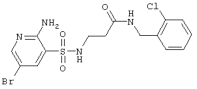
| 3 |
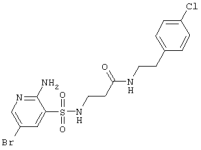
 |
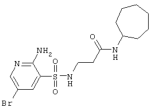
370,23 |
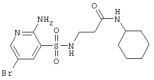
LC MS, m/z 371 (M+1) |
| 4 |
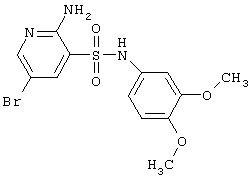 |
388,24 |
LC MS, m/z 389 (M+1) |
| 5 |
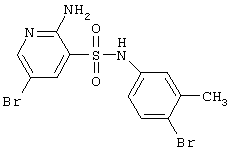 |
421,11 |
LC MS, m/z 422 (M+1) |
| 6 |
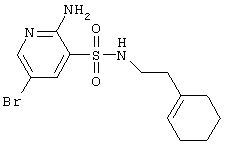 |
360,28 |
LC MS, m/z 361 (M+1) |
| 7 |
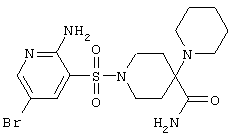 |
446,37 |
LC MS, m/z 447 (M+1) |
| 8 |
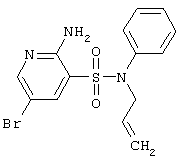 |
368,25 |
LC MS, m/z 369 (M+1) |
| 9 |
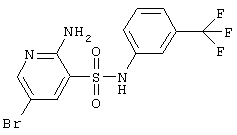 |
396,19 |
LC MS, m/z 397 (M+1) |
| 10 |
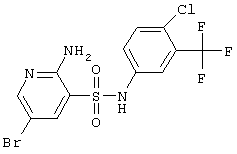 |
430,63 |
LC MS, m/z 432 (M+1) |
| 11 |
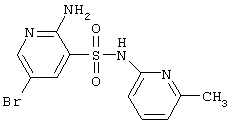 |
343,20 |
LC MS, m/z 344 (M+1) |
| 12 |
 |
329,18 |
LC MS, m/z 330 (M+1) |
| 13 |
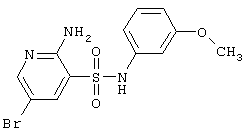 |
358,22 |
LC MS, m/z 359 (M+1) |
| 14 |
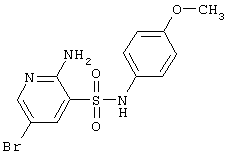 |
358,22 |
LC MS, m/z 359 (M+1) |
| 15 |
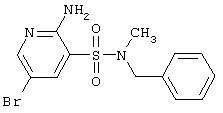 |
356,24 |
LC MS, m/z 357 (M+1) |
| 16 |
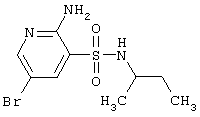 |
308,20 |
LC MS, m/z 309 (M+1) |
| 17 |
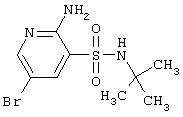 |
308,20 |
LC MS, m/z 309 (M+1) |
| 18 |
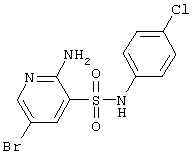 |
362,63 |
Т.пл. 196-198°С. Спектр ЯМР 1Н: 2,90 (с, 3Н, СН3),6,62(с, 2Н, NH2), 7,09 (д, 2Н, J=9,3 Hz, 2ArH), 7,18(д, 2H, J=9,3 Hz, 2АrН), 7,87 (д, 1Н, J4-6=2,3 Hz, 4CH), 8,10 (д, 1Н, J6-4=2,3 Hz, 6CH), 10,38 (c, lH, NH). LC MS, m/z 364 (М+1) |
| 19 |
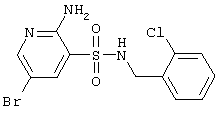 |
376,66 |
LC MS, m/z 378 (M+1) |
| 20 |
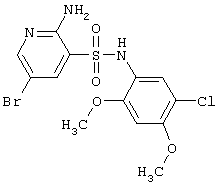 |
422,69 |
LC MS, m/z 424 (M+1) |
| 21 |
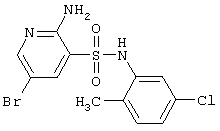 |
376,66 |
LC MS, m/z 378 (M+1) |
| 22 |
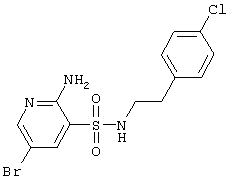 |
390,69 |
LC MS, m/z 392 (M+1) |
| 23 |
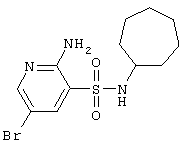 |
348,26 |
LC MS, m/z 349 (M+1) |
| 24 |
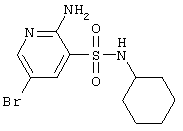 |
334,24 |
LC MS, m/z 335 (M+1) |
| 25 |
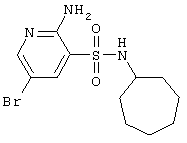 |
362,29 |
LC MS, m/z 363 (M+1) |
| 26 |
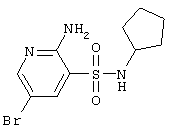 |
320,21 |
LC MS, m/z 321 (M+1) |
| 27 |
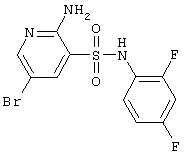 |
364,17 |
LC MS, m/z 365 (M+1) |
| 28 |
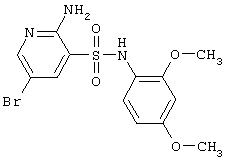 |
388,24 |
LC MS, m/z 389 (M+1) |
| 29 |
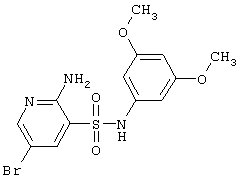 |
388,24 |
LC MS, m/z 389 (M+1) |
| 30 |
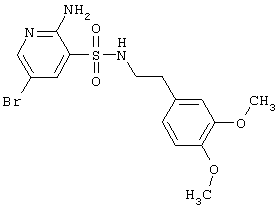 |
416,30 |
LC MS, m/z 417 (M+1) |
| 31 |
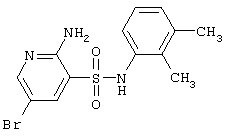 |
356,24 |
LC MS, m/z 357 (M+1) |
| 32 |
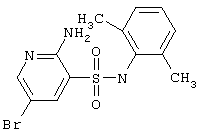 |
356,24 |
LC MS, m/z 357 (M+1) |
| 33 |
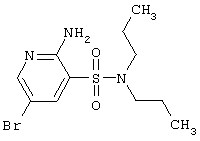 |
336,25 |
Т.пл. 137-139°С. Спектр ЯМР 1: 0,89 (т, 6Н, 2СН3), 1,55 (секст, 4Н, 2ССН2С), 3,14 (т, 4Н, CH2NCH2), 6,49 (с, 2Н, NH2), 7,86 (д, 1Н, J4-6=2,3 Hz, 4CH), 8,17 (д, lH, J6-4=2,3 Hz, 6CH). LC MS, m/z 337 (M+1) |
| 34 |
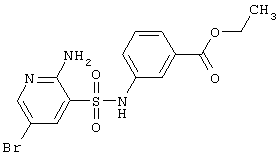 |
400,25 |
LC MS, m/z 401 (M+1) |
| 35 |
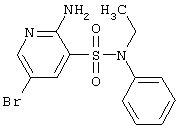 |
356,24 |
LC MS, m/z 357 (M+1) |
| 36 |
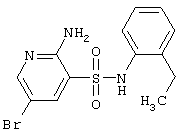 |
356,24 |
LC MS, m/z 357 (M+1) |
| 37 |
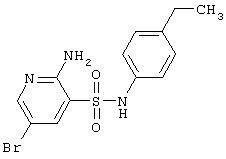 |
356,24 |
LC MS, m/z 357 (M+1) |
| 38 |
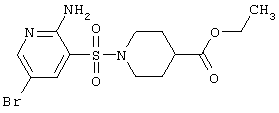 |
392,27 |
LC MS, m/z 393 (M+1) |
| 39 |
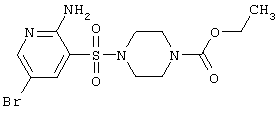 |
393,26 |
LC MS, m/z 394 (M+1) |
| 40 |
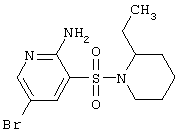 |
348,26 |
LC MS, m/z 349 (M+1) |
| 41 |
 |
346,18 |
LC MS, m/z 347 (M+1) |
| 42 |
 |
346,18 |
LC MS, m/z 347 (M+1) |
| 43 |
 |
334,24 |
LC MS, m/z 335 (M+1) |
| 44 |
 |
354,23 |
LC MS, m/z 355 (M+1) |
| 45 |
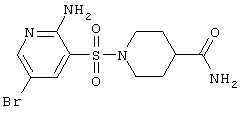 |
363,24 |
LC MS, m/z 364 (M+1) |
| 46 |
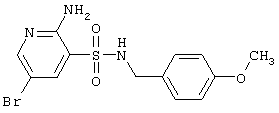 |
372,24 |
LC MS, m/z 373 (M+1) |
| 47 |
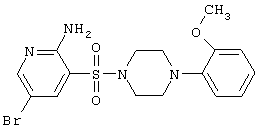 |
427,32 |
LC MS, m/z 428 (M+1) |
| 48 |
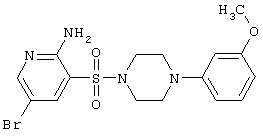 |
427,32 |
LC MS, m/z 428 (M+1) |
| 49 |
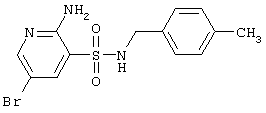 |
356,24 |
LC MS, m/z 357 (M+1) |
| 50 |
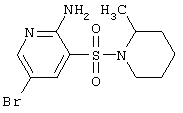 |
334,24 |
LC MS, m/z 335 (M+1) |
| 51 |
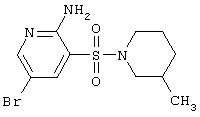 |
334,24 |
LC MS, m/z 335 (M+1) |
| 52 |
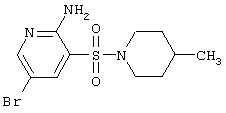 |
334,24 |
LC MS, m/z 335 (M+1) |
| 53 |
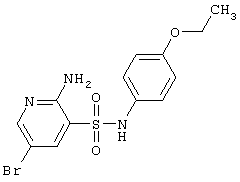 |
372,24 |
LC MS, m/z 373 (M+1) |
| 54 |
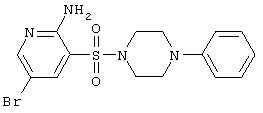 |
397,30 |
LC MS, m/z 398 (M+1) |
| 55 |
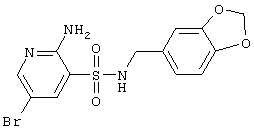 |
386,23 |
LC MS, m/z 387 (M+1) |
| 56 |
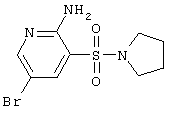 |
306,18 |
Т.пл. 166-168°С. Спектр ЯМР 1Н: 1,88 (м, 4Н, 2СН2), 3,29 (т, 4Н, CH2NCH2), 6,61 (с, 2Н, NH2), 7,86 (д, 1H,J4.6=2,3 Hz, 4CH), 8,19 (д, 1Н, J6-4=2,3 Hz, 6CH). LC MS, m/z 307 (М+1) |
| 57 |
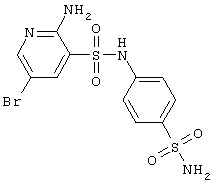 |
407,27 |
LC MS, m/z 408 (M+1) |
| 58 |
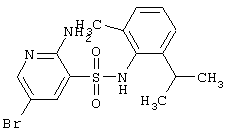 |
384,30 |
LC MS, m/z 385 (М+1) |
| 59 |
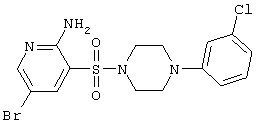 |
431,74 |
LC MS, m/z 433 (М+1) |
| 60 |
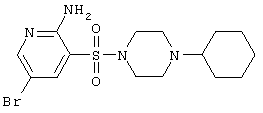 |
403,34 |
LC MS, m/z 404 (М+1) |
| 61 |
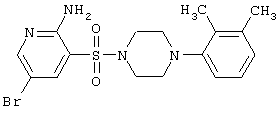 |
425,35 |
Т.пл. 171-173°С. Спектр ЯМР 1Н: 2,14 (с, 3Н, СН3), 2,24 (с, 3Н, СН3), 2,89 (м, 4Н, CH2NCH2), 3,29 (м, 4Н, CH2NCH2), 6,65 (с, 2Н, NH2), 6,84 (м, 2Н, 4′,6′СН), 6,98 (т, 1Н, 5′СН), 7,86 (д, 1Н, J4-6=2,3 Hz, 4CH), 8,24 (д, 1Н, J6-4=2,3 Hz, |
| |
|
|
6CH). LC MS, m/z 426 (M+1) |
| 62 |
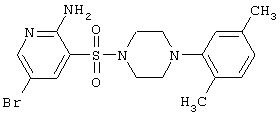 |
425,35 |
LC MS, m/z 426 (M+1) |
| 63 |
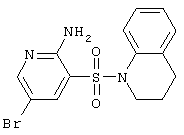 |
368,25 |
LC MS, m/z 369 (M+1) |
| 64 |
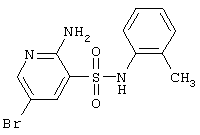 |
342,22 |
LC MS, m/z 343 (M+1) |
| 65 |
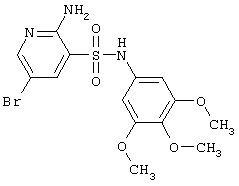 |
418,27 |
LC MS, m/z 419 (M+1) |
| 66 |
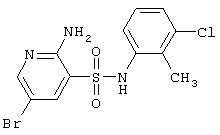 |
376,66 |
LC MS, m/z 378 (M+1) |
| 67 |
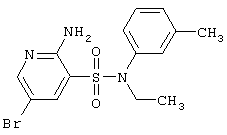 |
370,27 |
LC MS, m/z 371 (M+1) |
| 68 |
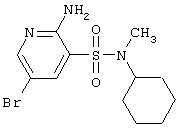 |
348,26 |
LC MS, m/z 349 (M+1) |
| 69 |
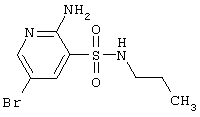 |
294,17 |
LC MS, m/z 295 (M+1) |
| 70 |
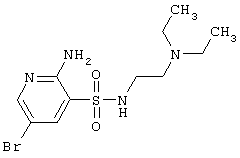 |
351,27 |
LC MS, m/z 352 (M+1) |
| 71 |
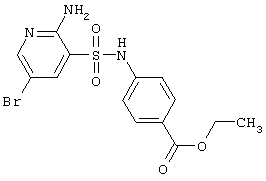 |
400,25 |
LC MS, m/z 401 (M+1) |
| 72 |
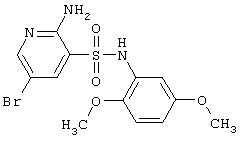 |
388,24 |
LC MS, m/z 389 (M+1) |
| 73 |
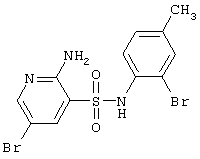 |
421,11 |
LC MS, m/z 422 (M+1) |
| 74 |
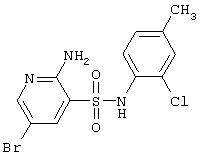 |
376,66 |
LC MS, m/z 378 (M+1) |
| 75 |
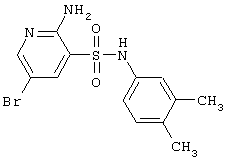 |
356,24 |
LC MS, m/z 357 (M+1) |
| 76 |
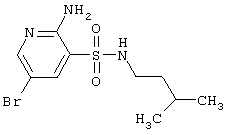 |
322,23 |
LC MS, m/z 323 (M+1) |
| 77 |
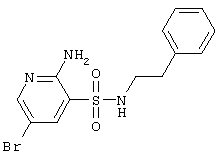 |
356,24 |
LC MS, m/z 357 (M+1) |
| 78 |
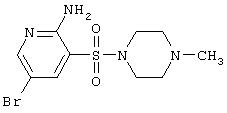 |
335,22 |
LC MS, m/z 336 (M+1) |
| 79 |
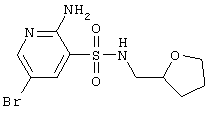 |
336,21 |
LC MS, m/z 337 (M+1) |
| 80 |
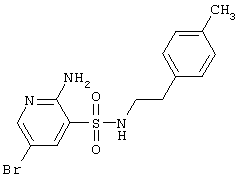 |
370,27 |
LC MS, m/z 371 (M+1) |
| 81 |
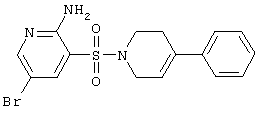 |
394,29 |
LC MS, m/z 395 (M+1) |
| 82 |
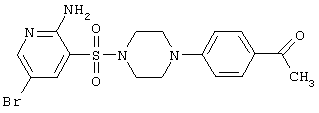 |
439,33 |
LC MS, m/z 440 (M+1) |
| 83 |
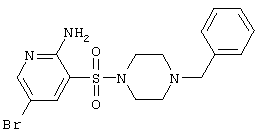 |
411,32 |
LC MS, m/z 412 (M+1) |
| 84 |
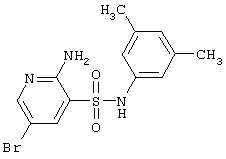 |
356,24 |
LC MS, m/z 357 (M+1) |
| 85 |
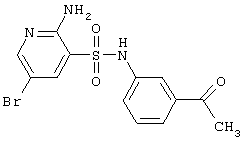 |
370,23 |
LC MS, m/z 371 (M+1) |
| 86 |
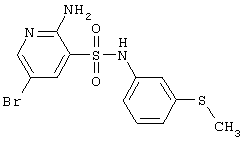 |
374,28 |
LC MS, m/z 375 (M+1) |
| 87 |
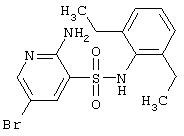 |
384,30 |
LC MS, m/z 385 (M+1) |
| 88 |
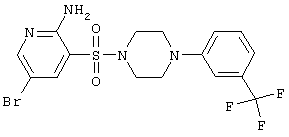 |
465,29 |
LC MS, m/z 466 (M+1) |
| 89 |
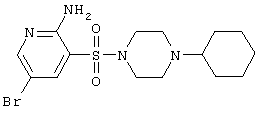 |
403,34 |
LC MS, m/z 404 (M+1) |
| 90 |
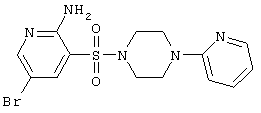 |
398,28 |
LC MS, m/z 399 (M+1) |
| 91 |
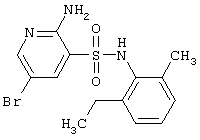 |
370,27 |
LC MS, m/z 371 (M+1) |
| 92 |
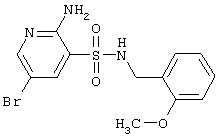 |
372,24 |
LC MS, m/z 373 (M+1) |
| 93 |
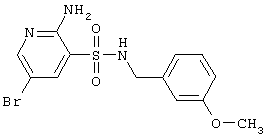 |
372,24 |
LC MS, m/z 373 (M+1) |
| 94 |
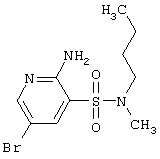 |
322,23 |
LC MS, m/z 323 (M+1) |
| 95 |
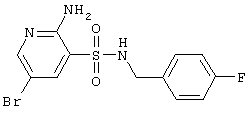 |
360,21 |
LC MS, m/z 361 (M+1) |
| 96 |
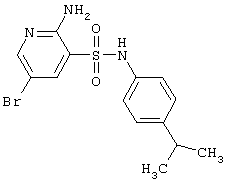 |
370,27 |
LC MS, m/z 371 (M+1) |
| 97 |
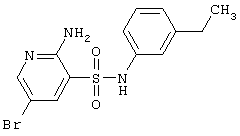 |
356,24 |
LC MS, m/z 357 (M+1) |
| 98 |
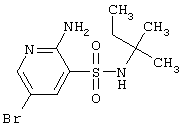 |
322,23 |
LC MS, m/z 323 (M+1) |
| 99 |
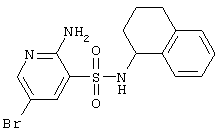 |
382,28 |
LC MS, m/z 383 (M+1) |
| 100 |
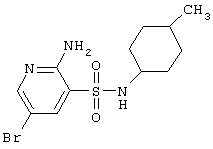 |
348,26 |
LC MS, m/z 349 (M+1) |
| 101 |
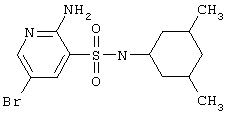 |
348,26 |
LC MS, m/z 349 (M+1) |
| 102 |
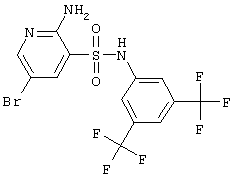 |
464,19 |
LC MS, m/z 465 (M+1) |
| 103 |
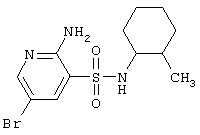 |
348,26 |
LC MS, m/z 349 (M+1) |
| 104 |
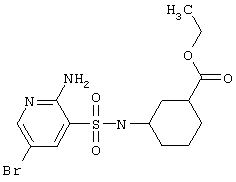 |
392,27 |
LC MS, m/z 393 (M+1) |
| 105 |
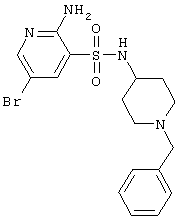 |
425,35 |
LC MS, m/z 426 (M+1) |
| 106 |
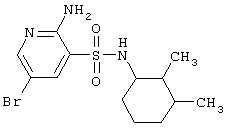 |
362,29 |
LC MS, m/z 363 (M+1) |
| 107 |
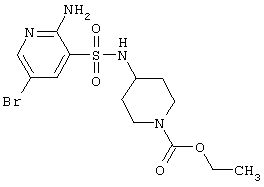 |
407,29 |
LC MS, m/z 408 (M+1) |
| 108 |
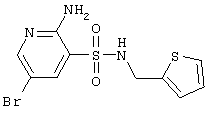 |
348,24 |
LC MS, m/z 349 (M+1) |
| 109 |
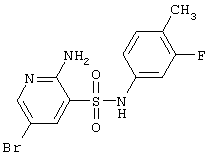 |
360,21 |
LC MS, m/z 361 (M+1) |
| 110 |
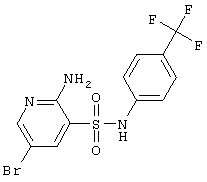 |
396,19 |
LC MS, m/z 397 (M+1) |
| 111 |
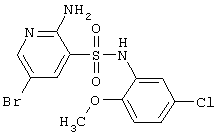 |
392,66 |
LC MS, m/z 394 (M+1) |
| 112 |
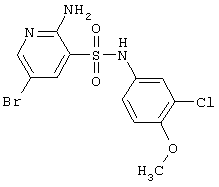 |
392,66 |
LC MS, m/z 394 (M+1) |
| 113 |
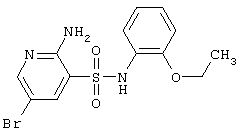 |
372,24 |
LC MS, m/z 373 (M+1) |
| 114 |
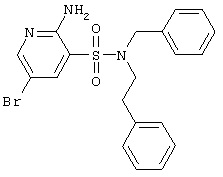 |
446,37 |
LC MS, m/z 447 (M+1) |
| 115 |
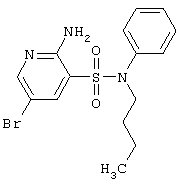 |
384,30 |
LC MS, m/z 385 (M+1) |
| 116 |
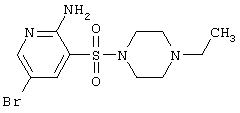 |
349,25 |
LC MS, m/z 350 (M+1) |
| 117 |
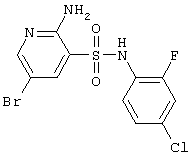 |
380,62 |
LC MS, m/z 382 (M+1) |
| 118 |
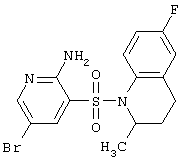 |
400,27 |
LC MS, m/z 401 (M+1) |
| 119 |
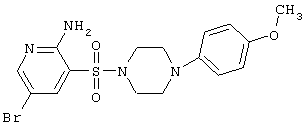 |
427,32 |
LC MS, m/z 428 (M+1) |
| 120 |
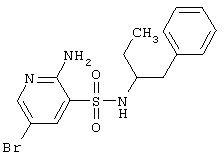 |
384,30 |
LC MS, m/z 385 (M+1) |
| 121 |
 |
324,20 |
LC MS, m/z 325 (M+1) |
| 122 |
 |
352,25 |
LC MS, m/z 353 (M+1) |
| 123 |
 |
415,29 |
LC MS, m/z 416 (M+1) |
| 124 |
 |
435,32 |
LC MS, m/z 436 (M+1) |
| 125 |
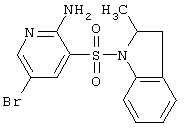 |
368,25 |
LC MS, m/z 369 (M+1) |
| 126 |
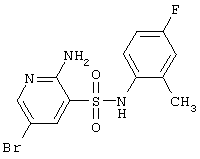 |
360,21 |
LC MS, m/z 361 (M+1) |
| 127 |
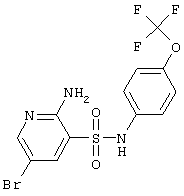 |
412,19 |
LC MS, m/z 413 (M+1) |
| 128 |
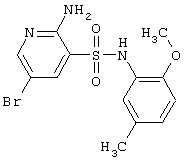 |
372,24 |
LC MS, m/z 373 (M+1) |
| 129 |
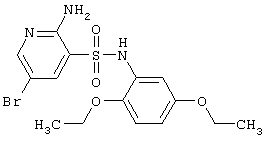 |
416,30 |
LC MS, m/z 417 (M+1) |
| 130 |
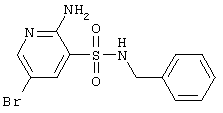 |
370,27 |
LC MS, m/z 371 (M+1) |
| 131 |
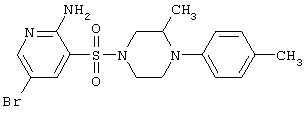 |
425,35 |
LC MS, m/z 426 (M+1) |
| 132 |
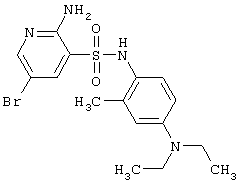 |
413,34 |
LC MS, m/z 414 (M+1) |
| 133 |
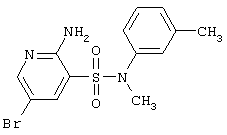 |
356,24 |
LC MS, m/z 357 (M+1) |
| 134 |
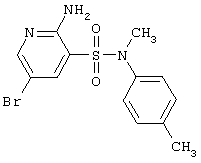 |
356,24 |
LC MS, m/z 357 (M+1) |
| 135 |
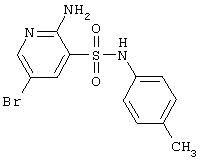 |
342,22 |
LC MS, m/z 343 (M+1) |
| 136 |
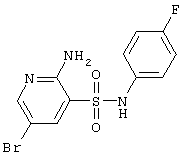 |
346,18 |
LC MS, m/z 347 (M+1) |
| 137 |
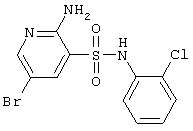 |
362,63 |
LC MS, m/z 364 (M+1) |
| 138 |
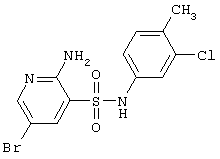 |
376,66 |
LC MS, m/z 378 (M+1) |
| 139 |
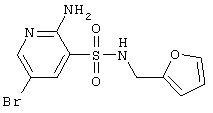 |
332,18 |
LC MS, m/z 333 (M+1) |
| 140 |
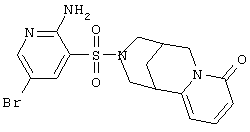 |
425,31 |
LC MS, m/z 426 (M+1) |
| 141 |
 |
342,22 |
LC MS, m/z 343 (M+1) |
| 142 |
 |
308,20 |
LC MS, m/z 309 (M+1) |
| 143 |
 |
320,21 |
LC MS, m/z 321 (M+1) |
| 144 |
 |
322,18 |
LC MS, m/z 323 (M+1) |
| 145 |
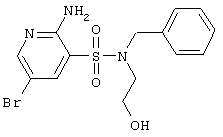 |
386,27 |
LC MS, m/z 387 (M+1) |
| 146 |
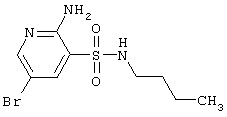 |
308,20 |
LC MS, m/z 309 (M+1) |
| 147 |
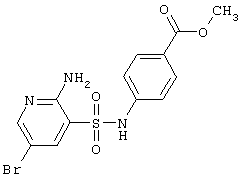 |
386,23 |
LC MS, m/z 387 (M+1) |
| 148 |
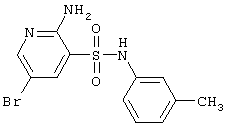 |
342,22 |
LC MS, m/z 343 (M+1) |
| 149 |
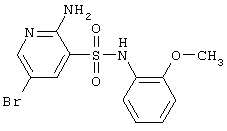 |
358,22 |
LC MS, m/z 359 (M+1) |
| 150 |
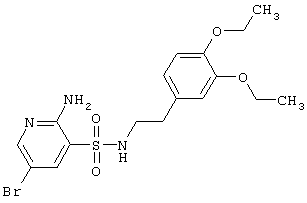 |
444,35 |
LC MS, m/z 445 (M+1) |
| 151 |
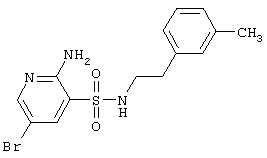 |
370,27 |
LC MS, m/z 371 (М+1) |
| 152 |
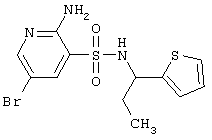 |
376,30 |
LC MS, m/z 377 (M+1) |
| 153 |
 |
379,32 |
LC MS, m/z 380 (M+1) |
| 154 |
 |
376,66 |
LC MS, m/z 378 (M+1) |
| 155 |
 |
386,27 |
LC MS, m/z 387 (M+1) |
| 156 |
 |
391,33 |
LC MS, m/z 392 (M+1) |
| 157 |
 |
402,27 |
LC MS, m/z 403 (M+1) |
| 158 |
 |
412,35 |
LC MS, m/z 413 (M+1) |
| 159 |
 |
400,30 |
LC MS, m/z 401 (M+1) |
| 160 |
 |
438,27 |
LC MS, m/z 439 (M+1) |
| 161 |
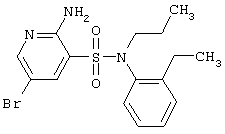 |
398,32 |
LC MS, m/z 399 (M+1) |
| 162 |
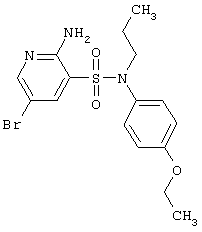 |
414,32 |
LC MS, m/z 415 (M+1) |
| 163 |
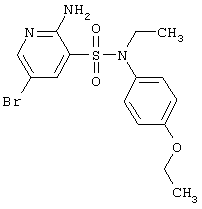 |
386,27 |
LC MS, m/z 387 (M+1) |
| 164 |
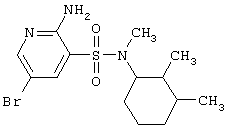 |
376,32 |
LC MS, m/z 377 (M+1) |
| 165 |
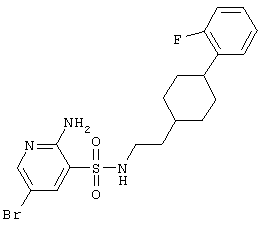 |
458,36 |
LC MS, m/z 459 (M+1) |
| 166 |
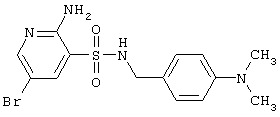 |
385,29 |
LC MS, m/z 386 (M+1) |
| 167 |
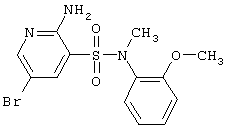 |
372,24 |
LC MS, m/z 373 (M+1) |
| 168 |
 |
402,27 |
LC MS, m/z 403 (M+1) |
| 169 |
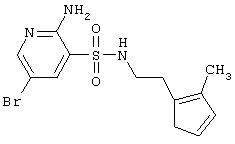 |
376,30 |
LC MS, m/z 377 (M+1) |
Пример 3. Общая методика синтеза 2-амино-5-бромпиридин-3-сульфамидоалкановых кислот 1.1(170, 171). К раствору 0,15 моль аминокислоты и 12 г (0,3 моль) NaOH в 300 мл воды при интенсивном перемешивании прибавляли 27,15 г (0,1 моль) 2-амино-5-бромпиридин-3-сульфохлорида 3. Смесь перемешивали при комнатной температуре в течение 1,5-2 часов до образования прозрачного раствора. Затем к полученному раствору прибавляли уксусную кислоту до рН = 6. Образовавшийся белый осадок отфильтровывали и перекристаллизовывали из диоксана. Получали 2-амино-5-бромпиридин-3-сульфамидоалкановых кислоты 1.1(170, 171) (Таблица 3).
Пример 4. Общая методика синтеза амидов 2-амино-5-бромпиридин-3-сульфамидоалкановых кислот 1.1(172-241). Способ получения фокусированной библиотеки амидов 2-амино-5-бромпиридин-3-сульфамидоалкановых кислот 1.1(172-241). Смесь 2-амино-5-бромпиридин-3-сульфамидоалкановой кислоты 1.1(170, 171) [0,3 г (0,001 моль)] и карбодиимидазола [0,15 г (0,0009 моль)] растворяли в 3 мл диоксана. Раствор перемешивали при температуре 40°С в течение 1,5 часов. Смесь охлаждали, затем прибавляли 0,001 моль амина 4 и перемешивали образовавшуюся смесь при температуре 50°С в течение 1 часа, а затем при температуре 80°С в течение 2 часов. Реакционную смесь оставляли на ночь при комнатной температуре. Затем смесь выливали в воду. Образовавшийся осадок отфильтровывали и перекристаллизовывали из пропанола-2. Получали фокусированную библиотеку амидов 2-амино-5-бромпиридин-3-сульфамидоалкановых кислот 1.1(172-241), представленных в таблице 3.
| Таблица 3 |
| № п.п. соед. 1.1 |
Формула |
Мол. Вес. |
Аналитические данные |
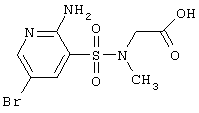
| 170 |
 |
324,15 |
Выход 25,3 г (78%), т.пл. 225-227°С. Спектр ЯМР 1Н: 2,89 (с, 3Н, NCH3), 4,00 (с, 2Н, NCH2), 6,64 (с, 2Н, NH2), 7,90 (д, 1Н, J4-6=2,3 Hz, 4CH), 8,17 (д, 1Н, J6-4=2,3 Hz, 6CH), 12,12 (с, 1Н, СООН). ИК, см-1: 3463 (NH2), 1717 (С=О), 1633 (NH2), 1322 (SO2), 1240(С-O-), 1139 (SO2). LC MS, m/z 325 (M+1) |
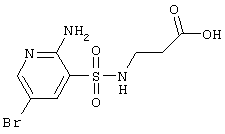
| 171 |
 |
324,15 |
Выход 27,2 г (84%), т.пл. 201-203°С. Спектр ЯМР 1H: 2,39 (т, 2Н, J=6,4 Hz, COCH2), 3,02 (к, 2Н, J=6,4 Hz, J=5,8 Hz, NCH2), 6,55 (с, 2H, NH2), 7,85 (т, 1Н, J=5,8 Hz, SO2NH), 7,91 (д, 1Н, J4-6=2,3 Hz, 4CH), 8,15 (д, 1Н, J6-4=2,3 Hz, 6CH), 12,16 (с, 1Н, COOH). LC MS, m/z 325 (M+1) |
| 172 |
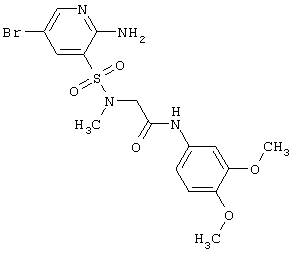 |
459,32 |
LC MS, m/z 460 (M+1) |
| 173 |
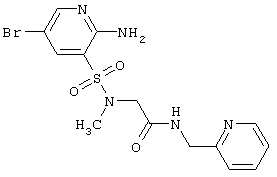 |
414,28 |
Выход 77%, т.пл. 125-127°С. Спектр ЯМР 1Н: 2,87 (с, 3Н, МСН3), 3,93 (с, 2H, NCH2CO), 4,44 (д, 2H, J=5,7 Hz, NCH2), 6,76 (с, 2H, NH2), 7,18 (т, 1Н, 4 CH), 7,30 (д, 1h, 3 CH), 7,30 (д, 1h, 3 ch), 7,68 (т. 1h, 5 ch), 7,68 (т. 1h, 5 ch), 7,95 (д, 1Н, J4-6=2,3 Hz, 4CH), 8,18 (д, 1Н, J6-4=2,3 Hz, 6CH), 8,47 (т, 1H, J=5,7 Hz, NH). LC MS, m/z 415 (M+1) ch), 7,95 (д, 1Н, J4-6=2,3 Hz, 4CH), 8,18 (д, 1Н, J6-4=2,3 Hz, 6CH), 8,47 (т, 1H, J=5,7 Hz, NH). LC MS, m/z 415 (M+1) |
| 174 |
 |
414,28 |
LC MS, m/z 415(M+1) |
| 175 |
 |
429,30 |
LC MS, m/z 430(M+1) |
| 176 |
 |
429,30 |
LC MS, m/z 430(M+1) |
| 177 |
 |
427,32 |
LC MS, m/z 428(M+1) |
| 178 |
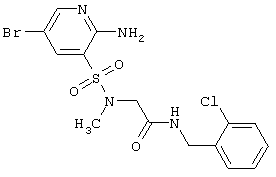 |
447,74 |
LC MS, m/z 449(M+1) |
| 179 |
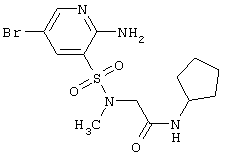
 |
419,34 |
LC MS, m/z 420(M+1) |
| 180 |
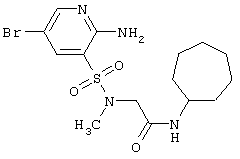
 |
433,37 |
LC MS, m/z 434(M+1) |
| 181 |
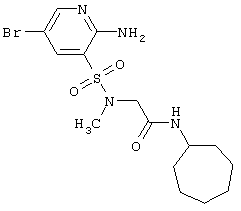
 |
391,29 |
LC MS, m/z 392 (M+1) |
| 182 |
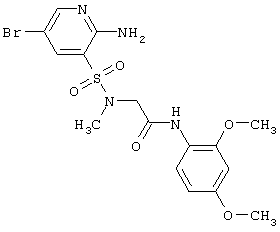 |
459,32 |
Выход 83%, т.пл. 143-145°С. Спектр ЯМР 1Н: 2,91 (с, 3Н, NCH3), 3,78 (с, 3Н, ОСН3), 3,89 (с, 3Н, ОСН3), 4,07 (с, 2Н, NCH2), 6,41 (дд, 1Н, J5′-6′=8,8 Hz, J5′-3′=1,9 Hz, 5′CH), 6,49 (д, 1H, J3′-5′=1,9 Hz, 3′CH), 6,75 (с, 2Н, NH2), 7,88 (д, 1Н, J6′-5′=8,8 Hz, 6′CH), 7,97 (д, 1Н, J4-6=2,3 Hz, 4CH), 8,20 (д, 1Н, J6-4=2,3 Hz, 6CH), 8,88 (с, 1Н, NH). LC MS, m/z 460 (M+1) |
| 183 |
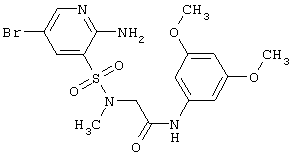 |
459,32 |
LC MS, m/z 460 (M+1) |
| 184 |
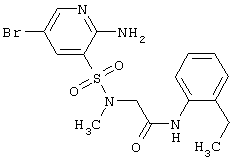 |
427,32 |
LC MS, m/z 428 (M+1) |
| 185 |
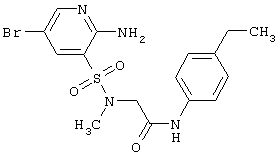 |
427,32 |
LC MS, m/z 428 (M+1) |
| 186 |
 |
443,32 |
LC MS, m/z 444 (M+1) |
| 187 |
 |
427,32 |
Выход 87%, т.пл. 180-182°С. Спектр ЯМР 1Н: 2,33 (с, 3Н, ССН3), 2,84 (с, 3Н, NCH3), 3,86 (с, 2Н, NCH2CO), 4,27 (д, 2Н, J=5,4 Hz, NCH2Ar), 6,81 (с, 2Н, NH2), 7,09 (д, 2Н, J=7,2 Hz, 2ArH), 7,15 (д, 2Н, J=7,2 Hz, 2ArH), 7,95 (д, 1Н, J4-6=2,3 Hz, 4CH), 8,19 (д, 1Н, J6-4=2,3 Hz, 6CH), 8,34 (т, 1Н, J=5,4 Hz, NH). LC MS, m/z 428 (M+1) |
| 188 |
 |
468,38 |
LC MS, m/z 469 (M+1) |
| 189 |
 |
441,35 |
LC MS, m/z 442 (M+1) |
| 190 |
 |
427,32 |
LC MS, m/z 428 (M+1) |
| 191 |
 |
469,36 |
LC MS, m/z 470 (M+1) |
| 192 |
 |
441,35 |
Выход 86%, т.пл. 161-163°С. Спектр ЯМР 1Н: 1,24 (д, 6Н, J=7,7 Hz, 2СН3), 2,86 (септ, 1Н, J=7,7 Hz, CH), 2,91 (с, 3Н, NCH3), 4,05 (с, 1Н, NCH2), 6,72 (с, 2Н, NH2), 7,09 (д, 2Н, J=7,9 Hz, 2ArH), 7,46 (д, 2Н, J=7,9 Hz, 2ArH), 7,97 (д, 1Н, J4-6=2,3 Hz, 4CH), 8,19 (д, 1Н, J6-4=2,3 Hz, 6CH), 9,73 (с, 1Н, NH). LC MS, m/z 442 (M+1) |
| 193 |
 |
427,32 |
LC MS, m/z 428 (M+1) |
| 194 |
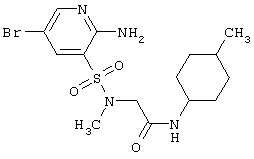 |
419,34 |
LC MS, m/z 420 (M+1) |
| 195 |
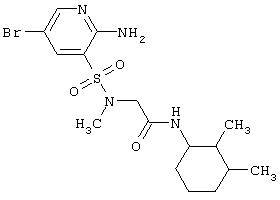 |
433,37 |
LC MS, m/z 434 (M+1) |
| 196 |
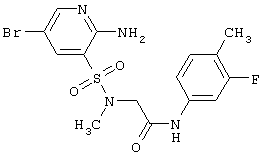 |
431,29 |
LC MS, m/z 432 (M+1) |
| 197 |
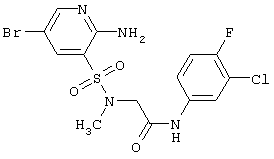 |
451,70 |
LC MS, m/z 453 (M+1) |
| 198 |
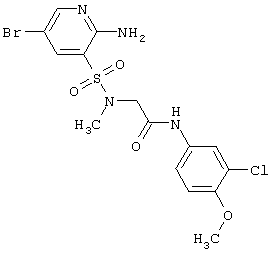 |
463,74 |
LC MS, m/z 465 (M+1) |
| 199 |
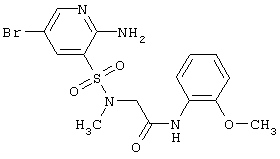 |
443,32 |
LC MS, m/z 444 (M+1) |
| 200 |
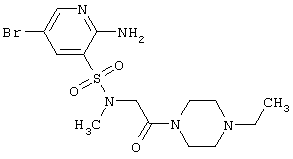 |
420,33 |
Выход 73%, т.пл. 120-122°С. Спектр ЯМР 1Н: 1,07 (т, 3Н, J=7,0 Hz, СН3), 2,39 (к, 2Н, J=7,0 Hz, NCH2C), 2,82 (с, 3Н, NCH3), 2,89 (м, 4Н, CH2NCH2), 3,48 (м, 4Н, CH2NCH2), 4,13 (с, 1Н, NCH2CO), 6,72(c, 2H, NH2), 7,93 (д, 1H, J4-6=2,3 Hz, 4CH), 8,17 (д, 1Н, J6-4=2,3 Hz, 6CH). LC MS, m/z 421 (M+1) |
| 201 |
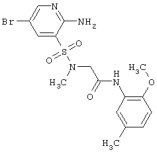 |
443,32 |
LC MS, m/z 444 (M+1) |
| 202 |
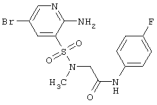 |
417,26 |
LC MS, m/z 418 (M+1) |
| 203 |
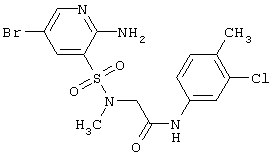 |
447,74 |
LC MS, m/z 449 (M+1) |
| 204 |
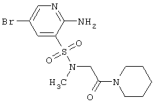 |
391,29 |
LC MS, m/z 392 (M+1) |
| 205 |
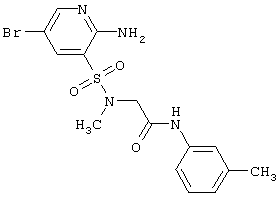 |
413,30 |
LC MS, m/z 414 (M+1) |
| 206 |
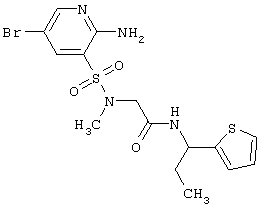 |
447,38 |
LC MS, m/z 448(M+1) |
| 207 |
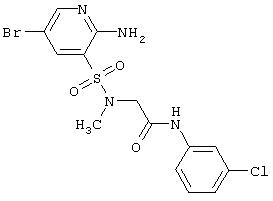 |
447,74 |
LC MS, m/z 449(M+1) |
| 208 |
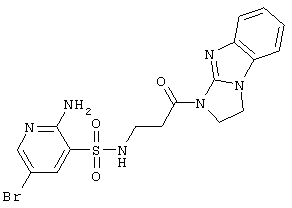 |
465,33 |
LC MS, m/z 466(M+1) |
| 209 |
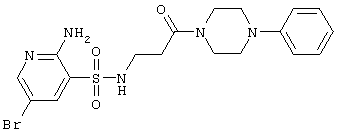 |
368,38 |
Выход 87%, т.пл. 180-182°С. Спектр ЯМР 1Н: 2,53 (т, 2Н, J=6,4 Hz, COCH2), 3,12 (к, 2Н, J=6,4 Hz, J=5,8 Hz, NCH2), 3,60 (м, 4Н, CH2NCH2), 3,69 (м, 4Н, CH2NCH2), 6,46 (с, 2Н, NH2), 6,80 (т, 1Н, 4′СН), 6,89 (д, 2Н, 2 ,6 ,6 CH), 7,20 (т, 2Н, 3 CH), 7,20 (т, 2Н, 3 ,5 ,5 СН), 7,73 (т, 1Н, J=5,8 Hz, SO2NH), 7,95 (д, 1Н, J4-6=2,3 Hz, 4СН), 8,14 (д, 1Н, J6-4=2,3 Hz, 6CH). LC MS, m/z 369 (M+1) СН), 7,73 (т, 1Н, J=5,8 Hz, SO2NH), 7,95 (д, 1Н, J4-6=2,3 Hz, 4СН), 8,14 (д, 1Н, J6-4=2,3 Hz, 6CH). LC MS, m/z 369 (M+1) |
| 210 |
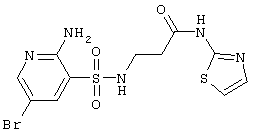 |
406,28 |
Выход 74%, т.пл. 232-234°С. Спектр ЯМР 1Н: 2,65 (т, 2Н, J=6,4 Hz, COCH2), 3,15 (к, 2Н, J=6,4 Hz, J=5,8 Hz, NCH2), 6,51 (с, 2Н, NH2), 6,92 (д, 1Н, J=3,4 Hz, 5 CH), 7,35 (д, 1H, J-3,4 Hz, 4′CH), 7,85 (т, 1Н, J=5,8 Hz, SO2NH), 7,93 (д, 1Н, J4-6=2,3 Hz, 4СН), 8,14 (д, 1H, J6-4=2,3 Hz, 6CH), 12,05 (с, 1H, NH). LC MS, m/z 407 (M+1). CH), 7,35 (д, 1H, J-3,4 Hz, 4′CH), 7,85 (т, 1Н, J=5,8 Hz, SO2NH), 7,93 (д, 1Н, J4-6=2,3 Hz, 4СН), 8,14 (д, 1H, J6-4=2,3 Hz, 6CH), 12,05 (с, 1H, NH). LC MS, m/z 407 (M+1). |
| 211 |
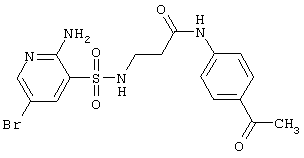 |
441,31 |
LC MS, m/z 442 (M+1) |
| 212 |
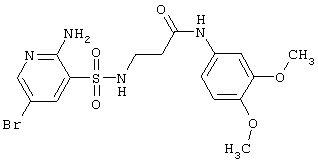 |
459,32 |
LC MS, m/z 460 (M+1) |
| 213 |
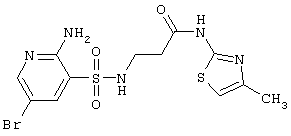 |
420,31 |
LC MS, m/z 421 (M+1) |
| 214 |
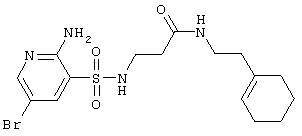 |
431,35 |
LC MS, m/z 432 (M+1) |
| 215 |
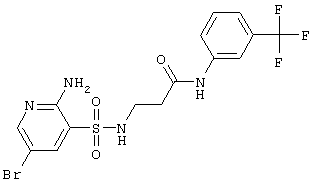 |
467,27 |
LC MS, m/z 468 (M+1) |
| 216 |
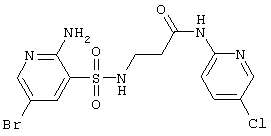 |
434,70 |
LC MS, m/z 436 (M+1) |
| 217 |
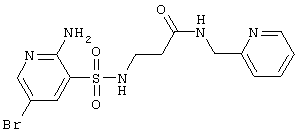 |
414,28 |
Выход 82%, т.пл. 153-155°С. Спектр ЯМР 1Н: 2,40 (т, 2Н, J=6,4 Hz, COCH2), 3,08 (к, 2Н, J=6,4 Hz, J=5,8 Hz, NCH2), 4,39 (д., 2Н, J-5,4 Hz, CONCH2), 6,51 (с, 2Н, NH2), 7,17 (т, 1H, 4′CH), 7,31 (д, 1H 3′СН), 7,68 (т, 1Н, 5′CH), 7,87 (т, 1H, J=5,8 Hz, SO2NH), 7,98 (д, 1Н, J4-6=2,3Hz, 4CH), 8,15 (д, lH, J6-4=2,3 Hz, 6CH), 8,30 (т, 1Н, J=5,4 Hz, NH), 8,47 (д, 1H, 6′CH). LC MS, m/z 415 (M+1) |
| 218 |
 |
414,28 |
LC MS, m/z 415 (M+1) |
| 219 |
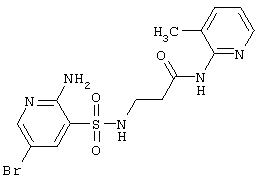 |
414,28 |
Выход 80%, т.пл. 214-216°С. Спектр ЯМР 1H: 2,21 (с, 3Н, СН3), 2,61 (т, 2Н, J=6,4 Hz, COCH2), 3,12 (к, 2Н, J=6,4 Hz, J=5,8 Hz, NCH2), 6,57 (с, 2Н, NH2), 7,10 (м, 1Н, ArH), 7,55 (д, 1Н, ArH), 7,89 (т, 1Н, J=5,8 Hz, SO2NH), 7,95 (д, 1Н, J4-6=2,3 Hz, 4CH), 8,15 (д, 1Н, J6-4=2,3 Hz, 6CH), 8,20 (д, 1Н, ArH). LC MS, m/z 415 (M+1) |
| 220 |
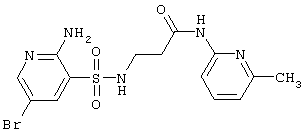 |
414,28 |
LC MS, m/z 415 (M+1) |
| 221 |
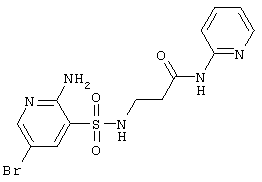 |
400,26 |
LC MS, m/z 401 (M+1) |
| 222 |
 |
429,30 |
LC MS, m/z 430 (M+1) |
| 223 |
 |
427,32 |
Выход 87%, т.пл. 158-160°С. Спектр ЯМР 1Н: 2,56 (т, 2Н, J=6,4 Hz, СОСН2), 2,89 (с, 3Н, NCH3), 3,10 (к, 2Н, J=6,4 Hz, J=5,8 Hz, NCH2), 4,52 (с, 2Н, NCH2), 6,57 (с, 2Н, NH2), 7,27 (м, 5Н, ArH), 7,82 (т, 1Н, J=5,8 Hz, SO2NH), 7,94 (д, 1H, J4-6=2,3 Hz, 4CH), 8,16 (д, 1Н, J6-4=2,3 Hz, 6CH). LC MS, m/z 428 (M+1) |
| 224 |
 |
379,28 |
LC MS, m/z 380 (M+1) |
| 225 |
 |
433,71 |
LC MS, m/z 435 (M+1) |
| 226 |
 |
447,74 |
LC MS, m/z 449 (M+1) |
| 227 |
 |
461,77 |
LC MS, m/z 463 (M+1) |
| 228 |
 |
419,34 |
LC MS, m/z 420 (M+1) |
| 229 |
 |
405,32 |
LC MS, m/z 406 (M+1) |
| 230 |
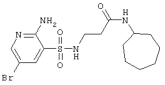 |
433,37 |
LC MS, m/z 434 (M+1) |
| 231 |
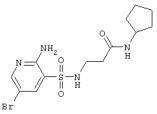 |
391,29 |
LC MS, m/z 392 (M+1) |
| 232 |
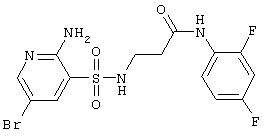 |
435,25 |
LC MS, m/z 436 (M+1) |
| 233 |
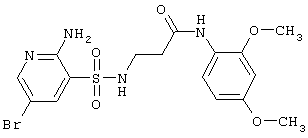 |
459,32 |
LC MS, m/z 460 (M+1) |
| 234 |
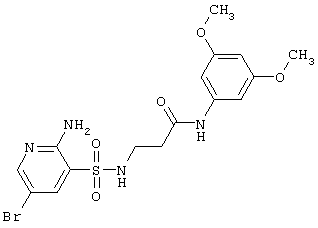 |
459,32 |
LC MS, m/z 460 (M+1) |
| 235 |
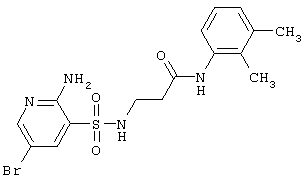 |
427,32 |
LC MS, m/z 428 (M+1) |
| 236 |
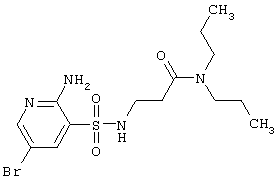 |
407,33 |
LC MS, m/z 408 (M+1) |
| 237 |
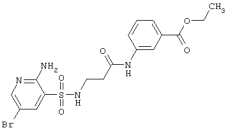 |
471,33 |
LC MS, m/z 472 (M+1) |
| 238 |
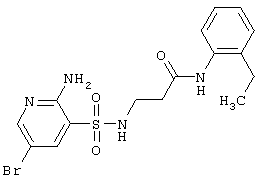 |
427,32 |
LC MS, m/z 428 (M+1) |
| 239 |
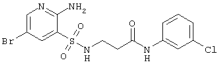 |
433,71 |
LC MS, m/z 434 (M+1) |
| 240 |
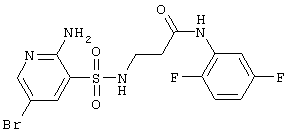 |
435,25 |
LC MS, m/z 436 (M+1) |
| 241 |
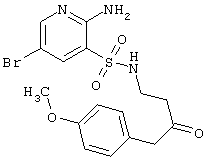 |
429,30 |
LC MS, m/z 430 (M+1) |
Пример 4. Общая методика синтеза пиридо[2,3-е][1,2,4]тиадиазин-1,1 -диоксидов 1.2. Смесь 25,2 г (0,1 моль) 2-амино-5-бромпиридин-3-сульфамида 1.1(1) и (0,2 моль) ангидрида 6 кипятили в 200 мл орто-ксилола в течение 4 часов. Реакционную смесь охлаждали и экстрагировали раствором 8 г (0,2 моль) NaOH в 200 мл воды. Слои отделяли, к водному слою прибавляли уксусную кислоту до достижения рН = 6. Образовывался белый осадок, который отфильтровывали и перекристаллизовывали из диоксана. Получали пиридо[2,3-е][1,2,4]тиадиазин-1,1-диоксиды, представленные в Таблице 4.
Пример 5. Общая методика синтеза 5,5-диоксо-5,6,7,9-тетрагидро-5-тиа-1,6,9-триаза-бензоциклогептен-8-онов 1.34. К смеси 0,01 моль кислоты 1.1 и 1,6 г (0,01 моль) КДИ прибавляли 10 мл диоксана и перемешивали при температуре 40°С в течение 1 часа, а затем при температуре 100°С в течение 3 часов. Реакционную смесь оставляли на ночь при комнатной температуре. Затем смесь выливали в 10 мл воды. Образовавшийся белый осадок отфильтровывали и перекристаллизовывали из диоксана. Получали 5,5-диоксо-5,6,7,9-тетрагидро-5-тиа-1,6,9-триаза-бензоциклогептен-8-оны 1.3 с выходом 70-95% (Таблица 4).
Пример 6. Общая методика синтеза пиридо[2,3-е][1,2,4]тиадиазин-1,1-диоксидов 1.4. К смеси 0,001 моль пиридо[2,3-е][1,2,4]тиадиазин-1,1-диоксидов 1.2 и 0,15 г (0,0009 моль) карбодиимидазола прибавляли 3 мл диоксана и перемешивали при температуре 70°С в течение 1,5 часа. Затем к смеси прибавляли 0,001 моль амина 4 и перемешивали при температуре 100°С в течение 3 часов. Смесь оставляли на ночь при комнатной температуре. Затем смесь выливали в воду. Образовавшийся осадок отфильтровывали и перекристаллизовывали из пропанола-2. Получали пиридо[2,3-е][1,2,4]тиадиазин-1,1-диоксиды 1.4, представленный в Таблице 4.
| Таблица 4 |
| № соед. |
Формула |
Мол. Вес. |
Аналитические данные |
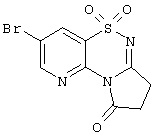
| 1.2(1) |
 |
316,13 |
Выход 59%, т.пл. 229-231°С. Спектр ЯМР 1Н: 2,69 (т, 2Н, J=7,2 Hz, СН2), 2,89 (т, 2Н, 3=1,2 Hz, COCH2), 8,33 (д, 1Н, J=2,3 Hz, 6СН), 8,67 (д, 1Н, J=2,3 Hz, 8CH). ИК, см-1: 1604 (-С(О)-Nтрет), 1291 (SO2), 1154 (SO2). Спектр ЯМР 15N,  , м.д./Int: -83,88/0,92 (1N), -152,72/12,66 (4N), -232,45/4,36 (2N), LCMS, m/z 317 (M+1) , м.д./Int: -83,88/0,92 (1N), -152,72/12,66 (4N), -232,45/4,36 (2N), LCMS, m/z 317 (M+1) |
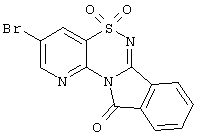
| 1.2(2) |
 |
364,18 |
LC MS, m/z 365 (M+1) |
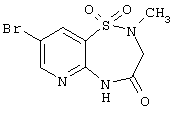
| 1.3(1) |
 |
305,14 |
Выход 92%, т.пл. 205-208°С. Спектр ЯМР 1Н: 2,9 (с, 3Н, NCH3), 4,35(с, 2Н, НСН2),8,2(д, 1Н, J4-2=2,3 Hz, 4CH), 8,6 (с, 1Н, J2-4=2,3 Hz, 2CH), 10,8 (с, 1Н, NH). ИК, см-1: 3192 (NH), 1673 (С=O), 1568 ( NH), 1356 (SO2), 1170 (SO2). LC MS, m/z 306 (М+1) NH), 1356 (SO2), 1170 (SO2). LC MS, m/z 306 (М+1) |
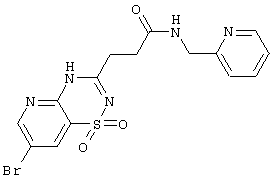
| 1.4(1) |
 |
424,28 |
Выход 51%, т.пл. 216…219°С. Спектр ЯМР 1Н: 2,72 (т, 2Н, J=7,2 Hz, CH2), 2,98 (т, 2Н, J=7,2 Hz, COCH2), 4,41 (д, 2Н, J=5,7 Hz, NCH2), 7,13 (м, 1H, HetH), 7,32 (д, 1H, HetH), 7,64 (т, 1H, HetH), 8,40 (т, 1H, 8,43 (м,1Н, HetH), 8,31 (д, 1H, J=2,3 Hz, 8CH), 8,40 (т, 1Н, J=5,7 Hz, CONH), 8,67 (д, 1Н, J=2,3 Hz, 6CH), 12,84 (c, 1H, NH). LC MS, m/z 425 (M+1) |
| 1.4(2) |
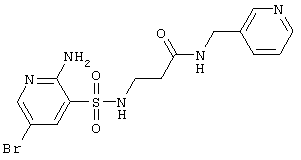
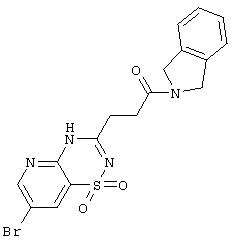 |
435,30 |
LC MS, m/z 436 (M+1) |
| 1.4(3) |
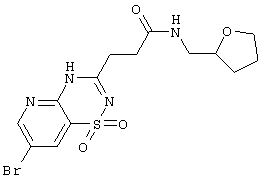 |
417,28 |
LC MS, m/z 418 (M+1) |
| 1.4(4) |
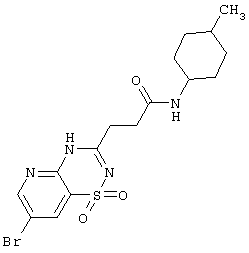 |
429,34 |
LC MS, m/z 430 (M+1) |
| 1.4(5) |
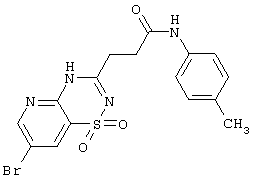 |
423,29 |
Выход 54%, т.пл. 245-248°С. Спектр ЯМР 1Н: 2,29 (с, 3Н, СН3), 2,81 (т, 2Н, J=7,2 Hz, CH2), 2,99 (т, 2Н, J=7,2 Hz, СОСН2), 7,01 (д, 2Н, J=7,9 Hz, 2ArH), 7,44 (д, 2Н, J=7,9 Hz, 2ArH), 8,33 (д, 1Н, J=2,3 Hz, 8CH), 8,68 (д, 1Н, J=2,3 Hz, 6CH), 9,78 (с, 1H, CONH), 12,87 (с, 1Н, NH). ИК, см-1: 3354 (NH), 1665 (ОС), 1530 ( NH), 1304 (SO2), 1150 (SO2). LC MS, m/z 424 (M+1) NH), 1304 (SO2), 1150 (SO2). LC MS, m/z 424 (M+1) |
| 1.4(6) |
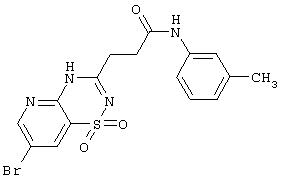 |
423,29 |
Выход 61%, т.пл. 293…6°С. Спектр ЯМР 1Н: 2,67 (т, 2Н, J=7,2 Hz, CH2), 2,74 (т, 2Н, J=7,2 Hz, COCH2), 3,32 (с, 3Н, СН2), 6,83 (д, 1H, 4′СН), 7,15 (т, 1H, 5′CH), 7,41 (д, 1H, 6 СН), 7,50 (с, 1H, 2′CH), 8,02 (д, 1H, J=2,3 Hz, 8CH), 8,53 (д, 1H, J=2,3 Hz, 6CH), 8,50 (с, 1H, CONH), 10,25 (с, 1H, NH). LC MS, m/z 424 (M+1) СН), 7,50 (с, 1H, 2′CH), 8,02 (д, 1H, J=2,3 Hz, 8CH), 8,53 (д, 1H, J=2,3 Hz, 6CH), 8,50 (с, 1H, CONH), 10,25 (с, 1H, NH). LC MS, m/z 424 (M+1) |
| 1.4(7) |
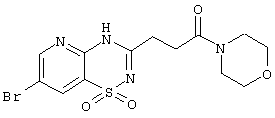 |
403,26 |
LC MS, m/z 404 (M+1) |
Пример 7. Способ получения фармацевтической композиции в форме таблеток. Смешивают 800 мг крахмала, 800 мг измельченной лактозы, 200 мг талька и 500 мг 3-(7-бром-1,1-диоксо-1,4-дигидропиридо[2,3-е][1,2,4]тиадиазин-3-ил)-1-морфолин-4-ил-пропан-1-она 1.4(7) и спресовывают в брусок. Полученный брусок измельчают в гранулы и просеивают через сита, собирая гранулы размером 14-16 меш. Полученные гранулы таблетируют в подходящую форму таблетки весом 280 мг каждая. Аналогичным образом получают фармацевтические композиции в виде таблеток, содержащие в качестве активного инградиента другие 1,3-диоксо-2,3-дигидро-1H-пирроло[3,4-с]хинолины общей формулы 1.
Пример 8. Способ получения фармацевтической композиции в форме капсул. Тщательно смешивают 3-бром-6-метил-5,5-диоксо-5,6,7,9-тетрагидро-5-тиа-1,6,9-триаза-бензоциклогептен-8-она 1.3(1) с порошком лактозы в соотношении 2:1. Полученную порошкоообразную смесь упаковывают по 300 мг в желатиновые капсулы подходящего размера.
Пример 9. Способ получения фармацевтической композиции в форме инъекций для внутримышечных, внутрибрюшинных или подкожных инъекций. Смешивают 500 мг 2-амино-5-бромпиридин-3-сульфокислоты (4-хлор-3-трифторметилфенил)-амида 1.1(10) с 300 мг хлорбутанола, 2 мл пропиленгликоля и 100 мл инъекционной воды. Полученный раствор фильтруют и помещают по 1 мл в ампулы, которые запаивают и стерилизуют в автоклаве.
Пример 10. Оценка кальций-блокаторных свойств соединений общей формулы 1. Составили фокусированную библиотеку, включающую известные антипротеазные лиганды и 253 гетероциклических соединения общей формулы 1, представленные в таблицах 2, 3 и 4. Взаимодействие соединений с системой глутамат-зависимого Са2+-захвата исследовалось на Р2-фракции синаптосом, выделенных из мозга новорожденных (8-11 дней) крыс по методике, описанной ранее [Соляков Л.С. и др., Нейрохимия, 1989, т.8, №3, с.395]. Синаптосомы помещались в инкубационный буфер А (132 мМ NaCl, 51 мМ KCl, 5 мМ HEPES) и выдерживались при температуре 0°С в течение всего эксперимента. Аликвоты синаптосом (50 мкл) помещались в среду А, содержащую исследуемые вещества и препарат 45Са2+. Захват Са2+ стимулировался введением в смесь 10 мл раствора 20 мкл глутамата. После 5-минутной инкубации при 30°С процесс прерывали путем фильтрации через GF/B-фильтры, а препарат трижды промывали холодной уксусной кислотой, после чего на сцинтилляционном счетчике “SL-4000” проводилось детектирование радиоактивной метки. Специфический захват Са2+ измерялся по следующим формулам:
K(42/21)=[(Са4-Са2)/(Са2-Ca1)]100%,
где Са2 – захват Са2+ – в присутствии глутамата только (глутамат-индуцированный захват Са2+);
Са3 – захват Са2+ – в присутствии тестируемого вещества (без глутамата);
Са4 – захват Са2+ – в присутствии и глутамата и тестируемого вещества.
В отдельных случаях специфический захват кальция оценивался также по формулам:
К(43/21)=[(Са4-Са3)/(Са2-Ca1)]100%
или К(3/1)=(Са3)/(Са1)]100%.
Установлено, что многие соединения формулы I способны эффективно ингибировать глутамат-зависимый вход кальция (IC50  10-50 10-50  M) и, следовательно, проявляют выраженный нейропротекторный эффект. M) и, следовательно, проявляют выраженный нейропротекторный эффект.
Формула изобретения
1. Гетероциклические соединения, включающие 2-аминопиридин-3-сульфоновый фрагмент, общей формулы 1
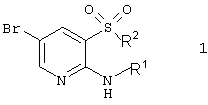
или их фармацевтически приемлемые соли, N-оксиды или гидраты,
в которой R1 представляет атом водорода;
R2 представляет атом хлора, необязательно замещенную гидроксильную группу, необязательно замещенную аминогруппу, необязательно замещенный азагетероциклил;
или R1 и R2 вместе с атомами азота и серы, к которым они присоединены, образуют необязательно замещенный и необязательно конденсированный с другими циклами 1,1-диоксо-4Н-пиридо[2,3-е][1,2,4]тиадиазин или необязательно замещенный и необязательно конденсированный с другими циклами 5,5-диоксо-5,6,7,9-тетрагидро-5-тиа-1,6,9-триазабензоциклогептен-8-он, исключая фениловый эфир 2-амино-5-бромпиридин-3-сульфокислоту.
2. Гетероциклические соединения по п.1, представляющие 2-аминопиридин-3-сульфокислоты и их производные общей формулы
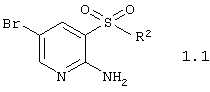
или их фармацевтически приемлемые соли, N-оксиды или гидраты,
в которой R2 имеет вышеуказанное значение.
3. Гетероциклические соединения по п.1, представляющие 1,1-диоксо-4Н-пиридо[2,3-е][1,2,4]тиадиазины с необязательно замещенными аннелированными карбоциклами общей формулы 1.2
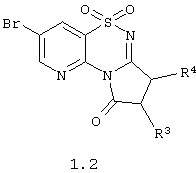
или их фармацевтически приемлемые соли, N-оксиды или гидраты,
в которой R3 и R4 независимо друг от друга представляют атом водорода, атом галогена, инертный заместитель, необязательно замещенную гидроксильную группу, необязательно замещенную аминогруппу, необязательно замещенный С1-С3алкилоксикарбонилС1-С3алкил, необязательно замещенный аминокарбонил, необязательно замещенный аминокарбонилС1-С3алкил, или необязательно замещенный аминокарбонилС1-С3алкил или
R3 и R4 вместе с атомами углерода к которому они присоединены образуют необязательно замещенный и необязательно конденсированный циклоалкил или циклоакенил, необязательно замещенный арил или гетероциклил.
4. Гетероциклические соединения по п.1, представляющие 5,5-диоксо-5,6,7,9-тетрагидро-5-тиа-1,6,9-триаза-бензоциклогептен-8-оны общей формулы 1.3
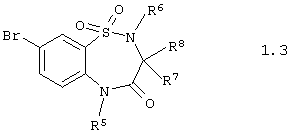
или их фармацевтически приемлемые соли, N-оксиды или гидраты,
в которой R5 и R6 независимо друг от друга представляют атом водорода или инертный заместитель,
R7 и R8 независимо друг от друга представляют атом водорода, инертный заместитель, остаток аминокислоты или необязательно замещенную этиленовую группу.
5. Гетероциклические соединения по п.1, представляющие амиды 3-(1,1-диоксо-1,4-дигидропиридо[2,3-e][1,2,4]тиадиазин-3-ил)-пропионовой кислоты общей формулы 1.4
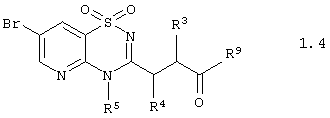
или их фармацевтически приемлемыми солями, N-оксидами или гидратами,
в которой R3, R4 и R5 имеют вышеуказанное значение,
R9 представляет необязательно замещенную аминогруппу или необязательно замещенный азагетероцикл.
6. Способ получения 1,1-диоксо-4Н-пиридо[2,3-е][1,2,4]тиадиазинов общей формулы 1.2 по п.3 взаимодействием 2-амино-5-бромпиридин-3-сульфамида формулы с циклическими ангидридами дикарбоновых кислот общей формулы 5
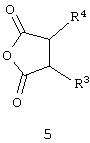
где R3 и R4 имеют значения, указанные в п.3.
7. Способ получения 3-бром-5,5-диоксо-5,6,7,9-тетрагидро-5-тиа-1,6,9-триазабензоциклогептен-8-онов общей формулы 1.3 по п.4, взаимодействием 2-амино-5-бромпиридин-3-сульфохлорида с соответствующей  -аминокислотой или ее эфиром общей формулы 6 -аминокислотой или ее эфиром общей формулы 6
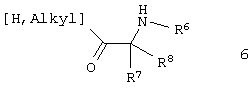
и последующей циклизацией образующихся (2-амино-5-бромпиридин-3-сульфониламино)-уксусных кислот общей формулы 1.1(а),
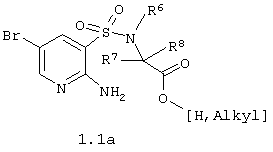
где R6, R7 и R8 имеют вышеуказанное значение.
8. Способ получения амидов 3-(1,1-диоксо-1,4-дигидропиридо[2,3-e][1,2,4]тиадиазин-3-ил)-пропионовых кислот 1.4 по п.5 последовательным действием на 5,5-диоксо-3,5-дигидро-2Н-5-тиа-4,9,9b-триазациклопента[a]нафталин-1-оны общей формулы 1.2 по п.3 карбодиимидазолом, а затем амином или необязательно замещенным азагетероциклом.
9. Фокусированная библиотека для поиска биологически активных соединений-лидеров, включающая по крайней мере одно гетероциклическое соединение общей формулы 1 по п.1.
10. Фармацевтическая композиция, обладающая свойствами блокаторов глутамат-индуцированного транспорта ионов кальция, в частности нейропротекторным действием, в форме таблеток, капсул или инъекций, помещенных в фармацевтически приемлемую упаковку, содержащая в качестве активной субстанции фармацевтически эффективное количество соединения общей формулы 1 по п.1.
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 28.05.2007
Извещение опубликовано: 27.08.2008 БИ: 24/2008
|
|