|
|
(21), (22) Заявка: 2000132044/04, 21.12.2000
(24) Дата начала отсчета срока действия патента:
21.12.2000
(30) Конвенционный приоритет:
22.12.1999 US 60/171.455
(43) Дата публикации заявки: 27.11.2002
(45) Опубликовано: 27.10.2005
(56) Список документов, цитированных в отчете о
поиске:
ЕР 0794151 А1, 10.09.1997. SU 383245 A1, 19.09.1973. US 4209423 A, 24.06.1980. ЕР 0384749 А1, 29.08.1990.
Адрес для переписки:
103064, Москва, ул. Казакова, 16, НИИР Канцелярия “Патентные поверенные Квашнин, Сапельников и партнеры”, В.П.Квашнину
|
(72) Автор(ы):
ТОЙНИССЕН Херман (DK)
(73) Патентообладатель(и):
ХАЛЬДОР ТОПСЕЭ А/С (DK)
|
(54) ВАНАДИЙФОСФАТНЫЕ СОЕДИНЕНИЯ
(57) Реферат:
Заявленное изобретение относится к ванадийфосфатному соединению  -VOHPO4*Н2О, характеризующемуся порошковой дифракцией рентгеновских лучей, показывающих моноклинную ячейку с пространственной группой P21/c, а-6,90 Å; b=7,36 Å; с=9,27 Å; -VOHPO4*Н2О, характеризующемуся порошковой дифракцией рентгеновских лучей, показывающих моноклинную ячейку с пространственной группой P21/c, а-6,90 Å; b=7,36 Å; с=9,27 Å;  =104,8°; V=455,3 Å3, где а, b, с, =104,8°; V=455,3 Å3, где а, b, с,  , V – параметры моноклинной ячейки. Изобретение также относится к ванадийфосфатному соединению (VO)3(PO4)3*5H2О, характеризующемуся порошковой дифракцией рентгеновских лучей, показывающих моноклинную ячейку с пространственной группой Р21/с, а=19,77 Å; b=7,303 Å; с-9,226 Å; , V – параметры моноклинной ячейки. Изобретение также относится к ванадийфосфатному соединению (VO)3(PO4)3*5H2О, характеризующемуся порошковой дифракцией рентгеновских лучей, показывающих моноклинную ячейку с пространственной группой Р21/с, а=19,77 Å; b=7,303 Å; с-9,226 Å;  =104,07°; V=1311,5 Å3, где а, b, с, =104,07°; V=1311,5 Å3, где а, b, с,  , V – параметры моноклинной ячейки. Задачей изобретения является представление высокоактивных предшественников ванадийфосфатных катализаторов для селективного окисления углеводородного сырья. 2 н.п., 7 табл., 1 ил. , V – параметры моноклинной ячейки. Задачей изобретения является представление высокоактивных предшественников ванадийфосфатных катализаторов для селективного окисления углеводородного сырья. 2 н.п., 7 табл., 1 ил. 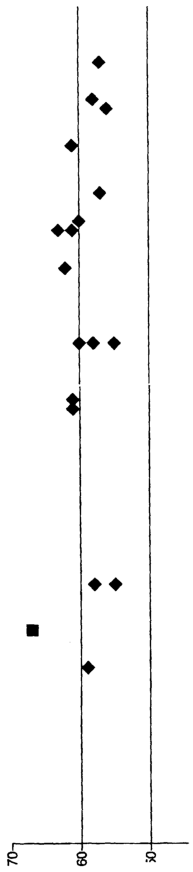
Настоящее изобретение относится к катализаторам для осуществления селективного окисления углеводородного сырья, более конкретно к ванадийфосфатным соединениям, представляющим собой предшественник ванадийфосфатных катализаторов для селективного окисления углеводородного сырья, в частности селективного окисления бутана до малеинового ангидрида. Одним из катализаторов, показывающих высокую каталитическую активность, является пирофосфат ванадия ((VO)2P2O7), который обычно получают термическим превращением VOHPO4·1/2H2O. Фосфат ванадила может быть получен с использованием известных способов, которые раскрыты в публикации G.J.Hutchings, C.J.Kiely, M.T.Sananes-SchuIz, y A.Burrows и J.C.Volta, Catalysis Today 40 (1998) 372. Первый способ представляет собой восстановление V2O5 водной HCl с последующим превращением реакцией с Н3PO4 с образованием VOHPO4·1/2H2O. Второй способ включает восстановление V2O5 изобутанолом в присутствии Н3PO4. Еще один способ относится к двухстадийному процессу, в котором VOPO4·2H2O получают из V2O5 и Н3PO4 в водной среде с стоследующим восстановлением VOPO4·2H2O до VOHPO4·1/2H2O в изобутаноле. Современный подход, включающий водные способы, включает не только HCl как восстанавливающий агент, но также, например, щавелевую кислоту (немецкая заявка на патент DE 19645066 А1), Н3РО3 (патент DD 256659 А1) и гидразин (японская заявка на патент 59132938).
Задачей изобретения является представление высокоактивных предшественников ванадийфосфатных катализаторов для селективного окисления углеводородного сырья.
Поставленная задача решается предлагаемым ванадийфосфатным соединением  -VOHPO4·2H2O, характеризующимся порошковой дифракцией рентгеновских лучей, показывающих моноклинную ячейку с пространственной группой Р21/с, а=6,90 Å; b=7,36 Å; с=9,27 Å; -VOHPO4·2H2O, характеризующимся порошковой дифракцией рентгеновских лучей, показывающих моноклинную ячейку с пространственной группой Р21/с, а=6,90 Å; b=7,36 Å; с=9,27 Å;  =104,8°; V=455,3 Å3, где а, b, с, =104,8°; V=455,3 Å3, где а, b, с,  , V – параметры моноклинной ячейки, а также ванадийфосфатным соединением (VO)3(PO4)2·5Н2O, характеризующимся порошковой дифракцией рентгеновских лучей, показывающих моноклинную ячейку с пространственной группой P21/c, а=19,77 Å; b=7,303 Å; с=9,226 Å; , V – параметры моноклинной ячейки, а также ванадийфосфатным соединением (VO)3(PO4)2·5Н2O, характеризующимся порошковой дифракцией рентгеновских лучей, показывающих моноклинную ячейку с пространственной группой P21/c, а=19,77 Å; b=7,303 Å; с=9,226 Å;  =100,07°; V=1311,5 Å3, где а, b, с, =100,07°; V=1311,5 Å3, где а, b, с,  , V – параметры моноклинной ячейки. , V – параметры моноклинной ячейки.
Предлагаемые ванадийфосфатные соединения можно использовать как таковые или же перед применением превращать до VOHPO4·1/2H2O.
Предлагаемые ванадийфосфатные соединения можно получать известными приемами. Так, например, их получают в смесях муравьиной кислоты и воды, которые способны восстанавливать ванадий (V) до ванадия (IV). В общем, использование муравьиной кислоты в получении фосфатов ванадия как катализаторов окисления известно специалистам, как раскрыто, например, в патенте US 4016105, в котором муравьиную кислоту используют в сочетании со вторичным спиртом. Другой подход раскрыт в японской заявке на патент 53060391, описывающей смеси муравьиной кислоты и воды, содержащие соединения железа (Fe), предпочтительно, в сочетании с носителем. Аналогично патенты US 4388221, 4481363, 4562269, 4599477, 4639530 и 4801567 описывают восстановление V (V) смесями муравьиной кислоты и воды, содержащими олово (Sn) (II), с целью получения нанесенных на носитель катализаторов для окисления углеводородов от С4 до С10 в малеиновый ангидрид (патенты US 4388221, 4481363, 4562269, 4639530, 4801567) или нанесенных на носитель катализаторов для окислительного дегидрогенирования моноолефинов от С4 до C8 (патент US 4599477). В патенте US 4179404 описано применение муравьиной кислоты в менее чем стехиометрическом количестве, чтобы предотвратить 100% восстановление ванадия (V) до ванадия (IV). Другая методология раскрыта в европейской заявке на патент ЕР 0071140. Получение предшественника катализатора включает две стадии: синтез фосфата ванадия (V) и последующее восстановлением V (V) до V (IV) с использованием, например, смесей муравьиной кислоты и воды, дающее смешанный ванадийфосфороксид.
В нижеследующем описываются предпочтительные способы получения предлагаемых ванадийфосфатных соединений.
Синтез предшественников VOHPO4·1/2H2O,  -VOHPO4·H2O и (VO)3(PO4)2·5Н2O. -VOHPO4·H2O и (VO)3(PO4)2·5Н2O.
Настоящее изобретение основано на том, что различные продукты могут быть выделены из реакционных смесей, содержащих соединение ванадия и соединение фосфора в растворителе муравьиная кислота – вода. Таким образом, состав реакционной смеси и особенное проведение экспериментального метода решающим образом влияют на образование продукта. Подходящими соединениями ванадия (V) в этих способах являются V2O5, соли, содержащие структуру VO3-, такие как NH4VO3, и соли, содержащие структуру VO3+ такие как VOPO4·2H2O. Однако предпочтительна V2O5. Подходящими соединениями фосфора Р (V) являются Н3PO4 и Р2O5. Однако предпочтительна Н3PO4. Могут различаться три основных способа, включающие предпочтительные исходные соединения:
Способ А. Реакционную смесь, содержащую V2O5, Н3PO4, НСООН и Н2О, нагревают с обратным холодильником до кипения определенный период времени.
Способ Б. Реакционную смесь, содержащую V2O5, НСООН и Н2О, нагревают с обратным холодильником до кипения определенный период времени; Н3PO4 добавляют позднее.
Способ В. Реакционную смесь, содержащую V2O5, НСООН и Н3PO4, нагревают с обратным холодильником до кипения определенный период времени; Н2О добавляют позднее.
В качестве основного экспериментального метода с использованием муравьиной кислоты согласно способу А реагенты смешивают при комнатной температуре и затем кипятят с обратным холодильником период времени в интервале 20-170 часов. Полученный продукт выделяют фильтрованием, промывают водой и сушат ночь при 110°С. Обзор методов получения, включающий две ссылки, представлен в Таблице 1. В ссылках вещество получали согласно методам, уже известным специалистам, то есть с использованием смеси изобутанола и бензилового спирта (R-1, ср. патент США US 4132670) и с использованием водной HCl (R-2, C.J.Kiely, A.Burrows, S.Sajip, G.J.Hutchings, M.T.Sananes, A.Tuel и J.C.Volta, J. Catal. 162 (1996) 31).
Приложенная Таблица 1 показывает полное восстановление ванадия (V) до ванадия (IV) в смесях муравьиной кислоты и воды, имеющих концентрацию муравьиной кислоты от 5% (Р-15) до 91% (Р-2, 3, 4). Неполное восстановление наблюдается в отсутствии воды (Р-1), как представляется из среднего окислительного состояния ванадия (4,52). Метод порошковой дифракции рентгеновских лучей показывает присутствие VOHPO4·1/2H2O и (VO)(VO2)2H4(PO4)2(P2O7)0,5×H2O (0,01<×<2). Последнее соединение известно специалистам (патент США 4374756) и, как запатентовано, полезно в частичном окислении углеводородов. Влияние воды на восстановление V2O5 может быть объяснено с учетом того, что на протеолитическое равновесие Н3PO4 и НСООН сильно влияет энергетически благоприятное гидратирование протонов водой (ур. 1 и 2). Повышение концентрации Н+ благоприятствует восстановлению V2O5, как это видно из уравнения окисления-восстановления (3). Ванадий присутствует как VO2 + при рН около 2,0 (C.F.Tsang, J.Kim и A.Manthiram, J. Mater. Chem. 8 (1998) 425).
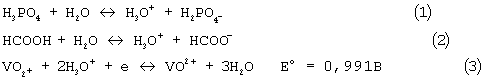
Как видно из Таблицы 1, состав реакционной смеси не только влияет на степень восстановления, но также и на кристаллизацию получаемого фосфата ванадия. Образование VOHPO4·1/2H2O наблюдается в реакционных смесях, содержащих от 35% до 91% муравьиной кислоты. Продукты анализировали методами, которые хорошо известны специалистам, то есть порошковой дифракции рентгеновских лучей, элементного анализа, спектроскопии комбинационного рассеяния и Брунауэра-Эммета-Теллера. Анализ на Р и V Р-3, 5, 6, 10 показывает приемлемое согласие с ожидаемыми величинами для VOHPO4·1/2H2O. На основе порошковой дифракции рентгеновских лучей были рассчитаны размеры кристаллитов (D001) полученных VOHPO4·1/2H2O и было найдено, что они больше 300 Å. Спектроскопия комбинационного рассеяния показывает присутствие неизвестной фазы Х в образцах Р-2, 5, 6, не наблюдаемой порошковой дифракцией рентгеновских лучей. Эта фаза, вероятно, ответственна за цвет продуктов, который был зелено-серым вместо ожидаемого голубого цвета. Продукт Р-10 был чистым VOHPO4·1/2H2O. Приготовление в 91% муравьиной кислоте, включающее способы А (Р-2), Б (Р-3) и В (Р-4), показывает, что VOHPO4·1/2H2O получают независимо от специфического метода. Специалистам будет понятно, что для практической выгоды предпочтителен только способ А, а не способы Б и В. Это явно ни ограничивает, ни исключает применение способов Б и В в большом интервале смесей муравьиной кислоты и воды. Более того, специалистам будет понятно, что в способе Б полное восстановление ванадия (V) до ванадия (IV) предшествует реакции с Н3PO4. Чтобы доказать это, был выделен и подробно охарактеризован продукт, полученный согласно способу Б после полного восстановления V (V) до V (IV) в отсутствии Н3РО4. Порошковая дифракция рентгеновских лучей показала чистую фазу, характеризующуюся моноклинной ячейкой (а=8,474 Å, b=8,385 Å, с=7,409 Å,  =90,44°) и пространственной группой Р21/с. Обзор данных порошковой дифракции рентгеновских лучей представлен в приложенной Таблице 2. =90,44°) и пространственной группой Р21/с. Обзор данных порошковой дифракции рентгеновских лучей представлен в приложенной Таблице 2.
Кроме того, элементный анализ ясно показал образование VO(HCOO)2·11/2H2O (рассчитано С 13,06%; Н 2,74%; V 27,69%, найдено С 12,8%; Н 2,84%; V 28,5%), которое известно в литературе (Gmelins Handbuch der Anorganischen Chemie, ванадий, часть Б, издательство Шпрингер, Вайнхайм, 1967, страница 345). Таким образом, очевидно, что способ Б фактически является эквивалентом способу, в котором соединение ванадия (IV) реагирует с Н3PO4 в определенной смеси муравьиной кислоты и воды. Это заключение поддерживается экспериментом, использующим “VO2“, то есть оксид, содержащий ванадий в среднем окислительном состоянии, существенно ниже 5 (V7O13, V4O9, VO2 вместо V2O5 P-18, см. ниже). Получение VOHPO4·1/2H2O также возможно в присутствии агентов кристаллизации наподобие H2SO4 (Р-7), Н3CSO3Н (Р-8) и п-толуолсульфокислоты (Р-9). Использование этих материалов хорошо известно специалистам (P.U.Wolf, U.Rodemerck, A.Brückner, M.Meisel и B.Kubias, Catal. Lett. 46 (1997) 113) и имеет существенное влияние на каталитическую активность (см. ниже). Иные продукты, отличные от VOHPO4·1/2H2O, наблюдали в реакционных смесях, содержащих 5-27% муравьиной кислоты. В 27%-ной муравьиной кислоте (Р-12) наблюдали кристаллизацию нового соединения (VO)3(PO4)2·5Н2O. Этот продукт был охарактеризован порошковой дифракцией рентгеновских лучей, показавшей моноклинную ячейку с пространственной группой P21/c (a=19,77 Å, b=7,303 Å, с=9,226 Å,  =100,07°). Обзор данных порошковой дифракции рентгеновских лучей представлен в приложенной Таблице 3. =100,07°). Обзор данных порошковой дифракции рентгеновских лучей представлен в приложенной Таблице 3.
ТГА (термогравиметрический анализ) Р-12 дает потерю массы 21,12% из-за дегидратации: 3,73% между 60 и 120°С за счет физически сорбированной воды и 17,39% между 120 и 500°С за счет кристаллизационной воды. Это объясняет, что результаты элементного анализа (Таблица 1) находятся в соответствии с составом (VO)3(PO4)2·6Н2O (расч. V 30,63%, Р 12,42%). Однако ТГА дает решающее свидетельство приписывать химический состав Р-12 химической формуле (VO)3(PO4)2·5Н2O. Хотя образование (VO)3(PO4)2·5Н2O также наблюдали в 5%-ной муравьиной кислоте (Р-15), было найдено, что на процесс кристаллизации в 27%-ной муравьиной кислоте может влиять добавление H2SO4 как агента кристаллизации. Этот процесс дает новое соединение  -VOHPO4·H2O (Р-13), которое структурно ясно отличается от модификаций VOHPO4·Н2О, описанных в литературе. В литературе указаны три типа VOHPO4·H2O, обозначенные здесь -VOHPO4·H2O (Р-13), которое структурно ясно отличается от модификаций VOHPO4·Н2О, описанных в литературе. В литературе указаны три типа VOHPO4·H2O, обозначенные здесь  I– (P.Amoros, R.Ibanez, E.Martinez-Tamayo, D.Beltran-Porter, A.Beltran-Porter, Mater.Res. Bull. 24 (1989) 1347), I– (P.Amoros, R.Ibanez, E.Martinez-Tamayo, D.Beltran-Porter, A.Beltran-Porter, Mater.Res. Bull. 24 (1989) 1347),  II– (D.Beltran-Porter, A.Beltran-Porter, P.Amoros, R.Ibanez, E.Martinez, A.Le Bail, G.Ferey и G.Villeneuve, Eur. J. Solid St. Inorg. Chem. 28 (1991) 131), и II– (D.Beltran-Porter, A.Beltran-Porter, P.Amoros, R.Ibanez, E.Martinez, A.Le Bail, G.Ferey и G.Villeneuve, Eur. J. Solid St. Inorg. Chem. 28 (1991) 131), и  III-VOHPO4·H2O (V.V.Gulliants, J.B.Benziger, S.Sundaresan, I.E.Wachs, J.M.Jehng и J.E.Roberts, Catal. Today 28 (1996) 275). Постоянные решеток различных систем, включающие нашу модификацию, представлены в приложенной Таблице 4, в то время как приложенная Таблица 5 дает обзор данных порошковой дифракции рентгеновских лучей Р-13. III-VOHPO4·H2O (V.V.Gulliants, J.B.Benziger, S.Sundaresan, I.E.Wachs, J.M.Jehng и J.E.Roberts, Catal. Today 28 (1996) 275). Постоянные решеток различных систем, включающие нашу модификацию, представлены в приложенной Таблице 4, в то время как приложенная Таблица 5 дает обзор данных порошковой дифракции рентгеновских лучей Р-13.
Специалистам будет понятно, что анализ порошковой дифракции рентгеновских лучей недвусмысленно показывает структурное разнообразие модификаций VOHPO4·2H2O, указанных в Таблице 4. Элементный анализ (расч. V 28,2%, Р-17,1%, смотри таблицу 1) и ТГА были использованы для определения элементного состава  -VOHPO4·2H2O. ТГА показывает потерю веса 14,82% относительно дегидратации, тогда как ожидалось 14,94% для конверсии VOHPO4·2H2O в (VO)2P2О7. Таким образом, как ТГА, так и элементный анализ недвусмысленно подтверждают элементный состав -VOHPO4·2H2O. ТГА показывает потерю веса 14,82% относительно дегидратации, тогда как ожидалось 14,94% для конверсии VOHPO4·2H2O в (VO)2P2О7. Таким образом, как ТГА, так и элементный анализ недвусмысленно подтверждают элементный состав  -VOHPO4·2H2O. -VOHPO4·2H2O.
Независимо от получения с использованием V2O5 и Н3PO4 можно также использовать другие исходные материалы. Обзор способов с альтернативными исходными материалами V и Р представлен в приложенной Таблице 6.
Таблица 6 показывает выгодность альтернативных исходных материалов в процессах получения в соответствии со способом А, как подчеркивалось выше. Показано, что вместо V2О5 могут быть использованы для получения VOHPO4·1/2H2O в смесях муравьиной кислоты и воды соединения ванадия наподобие NH4VO3 (P-16), VOPO4·2H2O (Р-17) и “VO2” (Р-18). Необходимо заметить, что получение с использованием NH4VO3 (P-16) требует добавки H2SO4 как агента кристаллизации. Кроме того, получение, исходя из VOPO4·2H2O (Р-17), требует добавки Н3PO4, чтобы избежать нежелательной кристаллизации VO(HCOO)2·11/2Н2O. Получение, включающее “VO2” (Р-18), подразумевает использование оксидов ванадия, содержащих ванадий в среднем окислительном состоянии существенно ниже 5, и включает, например, V7O13, V4O9, VO2. Только для краткости эти окислы или смеси их обозначают “VO2“. Получение с VO2 (Р-18) показывает, что успешное использование смесей муравьиной кислоты и воды не зависит от степени восстановления, имеющей место в течение этого процесса. Относительно соединений Р было показано, что вместо Н3PO4 можно использовать P2O5 (Р-19). Это соответствует ожиданиям, так как P2O5 превращается в Н3РО4 при реакции с водой. Применение  -VOHPO4·2H2O как предшественника для получения VOHPO4·1/2H2O было инициировано наблюдением, что применение непосредственно -VOHPO4·2H2O как предшественника для получения VOHPO4·1/2H2O было инициировано наблюдением, что применение непосредственно  -VOHPO4·2H2O как предшественника для селективного окисления бутана в малеиновый ангидрид не приводило к улучшению дела (см. ниже). Неожиданно было найдено, что -VOHPO4·2H2O как предшественника для селективного окисления бутана в малеиновый ангидрид не приводило к улучшению дела (см. ниже). Неожиданно было найдено, что  -VOHPO4·2H2O (Р-13) можно превратить в VOHPO4·1/2H2O (P-20) посредством процесса рекристаллизации в уксусной кислоте. Таким образом, новый предшественник P-20 был получен из -VOHPO4·2H2O (Р-13) можно превратить в VOHPO4·1/2H2O (P-20) посредством процесса рекристаллизации в уксусной кислоте. Таким образом, новый предшественник P-20 был получен из  -VOHPO4·2H2O (Р-13), показывая интересные каталитические свойства (см. ниже). Другая цель настоящего изобретения состоит в том, что принцип рекристаллизации может быть применен не только к -VOHPO4·2H2O (Р-13), показывая интересные каталитические свойства (см. ниже). Другая цель настоящего изобретения состоит в том, что принцип рекристаллизации может быть применен не только к  -VOHPO4·2H2O, но также и к (VO)3(PO4)2·5Н2O (Р-12, Р-14, Р-15). Специалистам хорошо известно, что лучшие промышленные ванадийфосфатные катализаторы имеют атомное отношение P/V немного выше единицы (D.Wang, M.C.Kung и H.H.Kung, Catal. Lett. 65 (2000) 9). Исследования, включающие предшественники с отношением P/V менее 1, показали, что это оказывает отрицательное влияние как на конверсию бутана, так и на селективность образования малеинового ангидрида. (N.Yamazoe, H.Morishige и Y.Teraoka, Stud. Surf. Sci. Catal. 44 (1988) 15). Так, (VO)3(PO4)2·5Н2O является невыгодным предшественником катализатора с атомным отношением P/V, равным 0,67. В этом отношении превращение (VO)3(PO4)2·5Н2O реакцией с Н3PO4 в VOHPO4·1/2H2O в уксусной кислоте (Р-21) является очень интересным. Более того, было показано, что превращение (VO)3(PO4)2·5Н2O в VOHPO4·1/2H2O может также быть проведено с использованием 60%-ной муравьиной кислоты (Р-22). Таким образом, интересующие предшественники катализаторов могут быть получены в смесях муравьиной кислоты и воды, содержащих 91-5% муравьиной кислоты, если это применять в сочетании с процессом рекристаллизации. -VOHPO4·2H2O, но также и к (VO)3(PO4)2·5Н2O (Р-12, Р-14, Р-15). Специалистам хорошо известно, что лучшие промышленные ванадийфосфатные катализаторы имеют атомное отношение P/V немного выше единицы (D.Wang, M.C.Kung и H.H.Kung, Catal. Lett. 65 (2000) 9). Исследования, включающие предшественники с отношением P/V менее 1, показали, что это оказывает отрицательное влияние как на конверсию бутана, так и на селективность образования малеинового ангидрида. (N.Yamazoe, H.Morishige и Y.Teraoka, Stud. Surf. Sci. Catal. 44 (1988) 15). Так, (VO)3(PO4)2·5Н2O является невыгодным предшественником катализатора с атомным отношением P/V, равным 0,67. В этом отношении превращение (VO)3(PO4)2·5Н2O реакцией с Н3PO4 в VOHPO4·1/2H2O в уксусной кислоте (Р-21) является очень интересным. Более того, было показано, что превращение (VO)3(PO4)2·5Н2O в VOHPO4·1/2H2O может также быть проведено с использованием 60%-ной муравьиной кислоты (Р-22). Таким образом, интересующие предшественники катализаторов могут быть получены в смесях муравьиной кислоты и воды, содержащих 91-5% муравьиной кислоты, если это применять в сочетании с процессом рекристаллизации.
Резюмируя, мы показали успешное получение VOHPO4·1/2H2O или  – VOHPO4·2H2O или (VO)3(PO4)2·5Н2O с использованием: – VOHPO4·2H2O или (VO)3(PO4)2·5Н2O с использованием:
1)способов А, Б, В;
2) смесей муравьиной кислоты и воды с содержанием муравьиной кислоты 91-5%;
3) V2O5, NH4VO3, VO2 и VOPO4·2H2O как предшественников соединений ванадия;
4) P2O5 и Н3PO4 как предшественников соединений фосфора;
5) рекристаллизацией  -VOHPO4·2H2O (с использованием уксусной кислоты) и (VO)3(PO4)2·5Н2O (с использованием уксусной кислоты или смеси муравьиной кислоты и воды). -VOHPO4·2H2O (с использованием уксусной кислоты) и (VO)3(PO4)2·5Н2O (с использованием уксусной кислоты или смеси муравьиной кислоты и воды).
Каталитическая активность предшественников VOHPO4·1/2H2O,  -VOHPO4·2H2O или (VO)3(PO4)2·5Н2O. -VOHPO4·2H2O или (VO)3(PO4)2·5Н2O.
Каталитическую активность предшественников VOHPO4·1/2H2O или  -VOHPO4·2H2O рассчитывали относительно селективного окисления бутана. Предшественники прессовали в таблетки после того, как получали их просеянную фракцию 0,3-0,7 мм. Этот материал активировали в соответствии с общими принципами, раскрытыми в патенте США US 4132670, то есть окислительным кальцинированием на воздухе с последующим приведением в равновесие с подаваемым газом. -VOHPO4·2H2O рассчитывали относительно селективного окисления бутана. Предшественники прессовали в таблетки после того, как получали их просеянную фракцию 0,3-0,7 мм. Этот материал активировали в соответствии с общими принципами, раскрытыми в патенте США US 4132670, то есть окислительным кальцинированием на воздухе с последующим приведением в равновесие с подаваемым газом.
Условия активации были следующими:
– нагревание на воздухе 1 час при данной температуре;
– конверсия газа до 1,29% н-бутана в искусственном воздухе с потоком 100 мл/мин·г,
– нагревание до данной равновесной температуры за 17 часов;
– охлаждение до 400°С и измерение каталитической активности при объемной скорости 6000 ч-1.
Анализ каталитической активности различных предшественников, включая ссылки, представлен в приложенной Таблице 7 и в приложенном чертеже.
Чертеж и Таблица 7 показывают явное улучшение каталитической активности большинства предшественников, полученных из процесса в муравьиной кислоте по сравнению с R-1 (современный спиртовый катализатор) и R-2 (современный водный катализатор). Низкая активность Р-13 показывает, что  -VOHPO4·2H2O не может быть использован как предшественник катализатора. Р-3, Р-16 и Р-22 показывают невысокую активность, которая еще сравнима с R-1 и явно лучше, чем у R-2. Следовательно, очевидно, что процессы получения в соответствии с Р-3, Р-16 и Р-22 менее предпочтительны. Обычно с предшественниками в муравьиной кислоте наблюдали селективность по малеиновому ангидриду 60%, которая слегка выше, чем R-1. Однако высокую селективность поддерживают при уровнях конверсии между 47 и 84%. Это является критическим свойством предшественников, полученных в муравьиной кислоте, которое очевидно из 14 предшественников, показанных в Таблице 7 и чертеже. Таким образом, целый ряд процессов может быть использован для получения предшественников, являющихся существенно более активными по сравнению с настоящим состоянием дел по ссылкам. -VOHPO4·2H2O не может быть использован как предшественник катализатора. Р-3, Р-16 и Р-22 показывают невысокую активность, которая еще сравнима с R-1 и явно лучше, чем у R-2. Следовательно, очевидно, что процессы получения в соответствии с Р-3, Р-16 и Р-22 менее предпочтительны. Обычно с предшественниками в муравьиной кислоте наблюдали селективность по малеиновому ангидриду 60%, которая слегка выше, чем R-1. Однако высокую селективность поддерживают при уровнях конверсии между 47 и 84%. Это является критическим свойством предшественников, полученных в муравьиной кислоте, которое очевидно из 14 предшественников, показанных в Таблице 7 и чертеже. Таким образом, целый ряд процессов может быть использован для получения предшественников, являющихся существенно более активными по сравнению с настоящим состоянием дел по ссылкам.
Примеры
Пример 1
Способ А, общий метод: синтез Р-2.
Суспензию V2O5 (9,10 г) нагревали при кипячении с обратным холодильником 44 ч в смеси муравьиной кислоты (250 мл), Н3PO4 (7,5 мл) и воды (25 мл). Затем зелено-серую суспензию охлаждали до комнатной температуры и фильтровали. Зеленовато-серое твердое вещество промывали водой и сушили при 110°С 16 часов.
Пример 2
Способ Б: синтез Р-3.
Суспензию V2O5 (3,64 г) нагревали при кипячении с обратным холодильником 72 ч в смеси муравьиной кислоты (100 мл) и воды (10 мл). Затем добавляли к темно-зеленой суспензии 1 мл Н3PO4 и кипячение продолжали 24 ч. Затем синюю суспензию охлаждали до комнатной температуры и фильтровали. Синее твердое вещество промывали водой и сушили при 110°С 16 часов.
Пример 3
Способ В: синтез Р-4.
Суспензию V2O5 (1,82 г) нагревали при кипячении с обратным холодильником 144 ч в смеси муравьиной кислоты (50 мл) и Н3PO4 (1,5 мл). Затем добавляли H2O (5 мл) к зеленой суспензии и кипячение продолжали 20 часов. Затем синюю суспензию охлаждали до комнатной температуры и фильтровали. Синее твердое вещество промывали водой и сушили при 110°С 16 часов.
Пример 4
Конверсия  -VOHPO4·2H2O (Р-13) в VOHPO4·1/2H2O (P-20). Суспензию -VOHPO4·2H2O (Р-13) в VOHPO4·1/2H2O (P-20). Суспензию  -VOHPO4·2H2O (11,60 г) в уксусной кислоте (400 мл) нагревали до кипения с обратным холодильником 20 часов. Светло-зеленую суспензию охлаждали до комнатной температуры и фильтровали. Слегка зеленовато-серое твердое вещество промывали водой и сушили при 110°С 16 часов. -VOHPO4·2H2O (11,60 г) в уксусной кислоте (400 мл) нагревали до кипения с обратным холодильником 20 часов. Светло-зеленую суспензию охлаждали до комнатной температуры и фильтровали. Слегка зеленовато-серое твердое вещество промывали водой и сушили при 110°С 16 часов.
Пример 5
Конверсия (VO)3(PO4)2·5Н2O (Р-12) в VOHPO4·1/2H2O (P-22). Суспензию (VO)3(PO4)2·5Н2O (3,21 г) в смеси Н3PO4 (590 мкл) и 60%-ной муравьиной кислоты (100 мл) нагревали до кипения с обратным холодильником 20 часов. Голубую суспензию охлаждали до комнатной температуры и фильтровали. Синее твердое вещество промывали водой и сушили при 110°С 16 часов.
Хотя характер этого изобретения описан с многочисленными примерами, это было сделано только как иллюстрация и без ограничения изобретения. Специалистам будет очевидно, что определенные особенности изобретения могут быть изменены, хотя они остаются внутри основного духа изобретения, который более точно определен в следующих пунктах формулы изобретения.
| Таблица 1 |
| Анализ получения (Р), использующего реакционные смеси V2O5/Н3PO4/муравьиная кислота/вода, включающий ссылки на современный уровень техники (R). |
| Предшественник |
Способ |
Муравьиная кислота(%) |
Время (ч) |
Цвет продукта |
Фаза по данным ПДРЛ |
D (001) (Е) |
БЭТ
м2/г |
V (%)1 |
Среднее ок. сост. V |
Р (%)1 |
| Р-1 |
А |
100 |
96 |
светло-зеленый |
VOHPO4·1/2H2O |
649 |
5 |
26,50 |
4,52 |
16,20 |
| Р-2 |
А |
91 |
44 |
зелено-серый |
VOHPO4·1/2H2O |
528 |
14 |
– |
4,01 |
– |
| Р-3 |
Б |
91 |
96 |
голубой |
VOHPO4·1/2H2O |
>1000 |
5 |
28,70 |
4,01 |
18,80 |
| Р-4 |
В |
91 |
164 |
голубой |
VOHPO4·1/2H2O |
890 |
5 |
– |
– |
– |
| Р-5 |
А |
82 |
44 |
зелено-серый |
VOHPO4·1/2H2O |
553 |
14 |
28,70 |
4,02 |
17,10 |
| Р-6 |
А |
60 |
44 |
зелено-серый |
VOHPO4·1/2H2O |
891 |
– |
29,10 |
4,03 |
17,10 |
| Р-73 |
А |
60 |
7 |
голубой |
VOHPO4·1/2H2O |
559 |
8 |
– |
– |
– |
| Р-83 |
А |
60 |
7 |
зелено-серый |
VOHPO4·1/2H2O |
>1000 |
11 |
– |
– |
– |
| Р-93 |
А |
60 |
7 |
зелено-серый |
VOHPO4·1/2H2O |
625 |
8 |
– |
– |
– |
| Р-10 |
А |
44 |
20 |
голубой |
VOHPO4·1/2H2O |
383 |
14 |
28,30 |
4,01 |
17,10 |
| р-11 |
А |
35 |
44 |
голубой |
VOHPO4·1/2H2O |
815 |
– |
– |
– |
– |
| Р-12 |
А |
27 |
65 |
голубой |
(VO)3(PO4)2·5Н2O4 |
– |
12 |
29,40 |
– |
12,40 |
| Р-13 |
А |
27 |
144 |
голубой |
 -VOHPO4·2H2O -VOHPO4·2H2O |
– |
5 |
27,60 |
4,01 |
17,10 |
| Р-14 |
А |
9 |
44 |
голубой |
(VO)3(PO4)2·5Н2O |
– |
7 |
29,30 |
3,96 |
12,20 |
| Р-15 |
А |
5 |
96 |
голубой |
(VO)3(PO4)2·5Н2O |
– |
– |
30,10 |
4,01 |
12,90 |
| R-16 |
– |
– |
24 |
голубой |
VOHPO4·1/2H2O |
109 |
33 |
28,10 |
4,01 |
18,00 |
| R-27 |
– |
– |
3 |
зеленый |
VOHPO4·1/2H2O |
>1000 |
1 |
– |
– |
– |
1 VOHPO4·1/2H2O требует Р 18,1%; V: 29,7
2 (VO)(VO2)2H4(PO4)2(P2O7)0,5×H2O также присутствует
3 Реакция в присутствии агентов кристаллизации (смотри текст)
4 Новое соединение (смотри текст)
5 Новое соединение, полученное в присутствии агентов кристаллизации (смотри текст)
6 Получено в смеси бензилового спирта и изобутанола (пат. США 4132670)
7 Получено в водной HCl согласно J.Catal. 162 (1996) 31. ПДРЛ – порошковая дифракция рентгеновских лучей |
| ТАБЛИЦА 2 |
| Данные порошковой дифракции рентгеновских лучей VO(HCOO)2·11/2H2O. |
| h |
k |
1 |
Рассчитанная d-постоянная [Å] |
Наблюденная d-постоянная [Å] |
Различие в d-постоянных [Å] |
Относительная интенсивность |
| 1 |
1 |
-1 |
4,649 |
4,656 |
-0,007 |
100 |
| 2 |
0 |
0 |
4,234 |
4,237 |
-0,004 |
7 |
| 2 |
1 |
0 |
3,780 |
3,782 |
-0,002 |
2 |
| 0 |
0 |
2 |
3,706 |
3,704 |
0,002 |
55 |
| 1 |
2 |
-1 |
3,356 |
3,356 |
-0,000 |
13 |
| 1 |
1 |
-2 |
3,154 |
3,153 |
0,001 |
9 |
| 2 |
2 |
0 |
2,982 |
2,980 |
0,002 |
20 |
| 2 |
0 |
2 |
2,778 |
2,779 |
-0,001 |
4 |
| 1 |
3 |
0 |
2,653 |
2,654 |
-0,002 |
9 |
| 3 |
1 |
1 |
2.510 |
2,512 |
-0,002 |
3 |
| 1 |
3 |
1 |
2.499 |
2,497 |
0,002 |
2 |
| 2 |
3 |
0 |
2,333 |
2,333 |
-0,000 |
10 |
| 1 |
1 |
-3 |
2,285 |
2,285 |
-0,001 |
18 |
| 3 |
2 |
-1 |
2,237 |
2,238 |
-0,000 |
6 |
| 1 |
3 |
-2 |
2,161 |
2,160 |
0,001 |
3 |
| 0 |
4 |
0 |
2,098 |
2,096 |
0,001 |
7 |
| 1 |
2 |
3 |
2,059 |
2,061 |
-0,002 |
16 |
| 2 |
3 |
-2 |
1,978 |
1,978 |
0,001 |
8 |
| 1 |
4 |
-1 |
1,964 |
1,963 |
0,001 |
3 |
| 3 |
3 |
-1 |
1,921 |
1,921 |
-0,000 |
6 |
| 2 |
2 |
3 |
1,895 |
1,897 |
-0,002 |
4 |
| 2 |
4 |
0 |
1,880 |
1,879 |
0,001 |
6 |
| 0 |
0 |
4 |
1,855 |
1,852 |
0,003 |
21 |
| 2 |
4 |
1 |
1,816 |
1,820 |
-0,004 |
33 |
| 2 |
3 |
-3 |
1,699 |
1,699 |
-0,000 |
9 |
| 5 |
1 |
-1 |
1,625 |
1,624 |
0,001 |
5 |
| 1 |
5 |
-1 |
1,607 |
1,606 |
0,001 |
6 |
| 2 |
2 |
-4 |
1,576 |
1,577 |
-0,001 |
10 |
| 3 |
3 |
-3 |
1,550 |
1,552 |
-0,002 |
13 |
| 2 |
4 |
3 |
1,493 |
1,493 |
-0,000 |
3 |
| 1 |
1 |
-5 |
1,440 |
1,440 |
0,001 |
9 |
| 3 |
5 |
-1 |
1,417 |
1,416 |
-0,000 |
4 |
| Таблица 3 |
| Данные порошковой дифракции рентгеновских лучей (VO)3(PO4)2·5Н2O (Р-12). |
| h |
k |
1 |
Рассчитанная d-постоянная
[Е] |
Наблюденная d-постоянная [Е] |
Различие в d-постоянных [Е] |
Относительная интенсивность |
| 2 |
0 |
0 |
9,734 |
9,694 |
0,039 |
100 |
| 1 |
1 |
0 |
6,837 |
6,818 |
0,020 |
30 |
| 1 |
1 |
-1 |
5,631 |
5,610 |
0,022 |
11 |
| 1 |
1 |
1 |
5,308 |
5,295 |
0,013 |
8 |
| 4 |
0 |
0 |
4,867 |
4,860 |
0,007 |
13 |
| 2 |
0 |
-2 |
4,423 |
4,416 |
0,006 |
29 |
| 3 |
1 |
1 |
4,064 |
4,062 |
0,002 |
5 |
| 4 |
1 |
0 |
4,050 |
4,046 |
0,004 |
3 |
| 5 |
0 |
0 |
3,893 |
3,886 |
0,007 |
19 |
| 2 |
0 |
2 |
3,865 |
3,864 |
0,001 |
11 |
| 1 |
1 |
2 |
3,680 |
3,676 |
0,004 |
12 |
| 0 |
2 |
0 |
3,651 |
3,650 |
0,001 |
9 |
| 5 |
1 |
0 |
3,436 |
3,431 |
0,004 |
9 |
| 1 |
2 |
-1 |
3,375 |
3,378 |
-0,003 |
27 |
| 6 |
0 |
0 |
3,245 |
3,245 |
-0,001 |
3 |
| 2 |
2 |
1 |
3,137 |
3,128 |
0,009 |
29 |
| 5 |
1 |
1 |
3,061 |
3,062 |
-0,002 |
24 |
| 6 |
0 |
-2 |
2,890 |
2,886 |
0,004 |
31 |
| 1 |
1 |
-3 |
2,834 |
2,832 |
0,002 |
5 |
| 4 |
2 |
1 |
2,699 |
2,701 |
-0,002 |
3 |
| 7 |
1 |
0 |
2,599 |
2,597 |
0,002 |
5 |
| 2 |
1 |
3 |
2,580 |
2,578 |
0,002 |
3 |
| 5 |
1 |
2 |
2,557 |
2,555 |
0,001 |
2 |
| 6 |
2 |
1 |
2,424 |
2,422 |
0,002 |
7 |
| 2 |
2 |
-3 |
2,339 |
2,343 |
-0,004 |
4 |
| 6 |
1 |
2 |
2,319 |
2,319 |
0,000 |
8 |
| 0 |
0 |
4 |
2,271 |
2,271 |
0,000 |
4 |
| 2 |
1 |
-4 |
2,196 |
2,195 |
0,001 |
4 |
| 4 |
3 |
0 |
2,177 |
2,177 |
0,000 |
3 |
| 0 |
1 |
4 |
2,168 |
2,172 |
-0,004 |
3 |
| 5 |
2 |
-3 |
2,130 |
2,129 |
0,001 |
2 |
| 1 |
3 |
2 |
2,114 |
2,114 |
0,000 |
2 |
| 2 |
3 |
2 |
2,060 |
2,060 |
0,000 |
3 |
| 3 |
0 |
4 |
2,035 |
2,036 |
0,000 |
2 |
| 8 |
2 |
0 |
2,025 |
2,024 |
0,001 |
2 |
| 9 |
1 |
-2 |
2,019 |
2,018 |
0,000 |
2 |
| 4 |
2 |
3 |
2,000 |
1,998 |
0,002 |
3 |
| 3 |
3 |
2 |
1,989 |
1,987 |
0,002 |
2 |
| 6 |
1 |
-4 |
1,960 |
1,960 |
0,001 |
2 |
| Таблица 3 (продолжение) |
| h |
k |
1 |
Рассчитанная d-постоянная [Å] |
Наблюденная d-постоянная [Å] |
Различие в d-постоянных [Å] |
Относительная интенсивность |
| 8 |
2 |
-2 |
1,958 |
1,957 |
0,002 |
2 |
| 9 |
1 |
1 |
1,952 |
1,954 |
-0,001 |
3 |
| 5 |
3 |
-2 |
1,948 |
1,950 |
-0,002 |
2 |
| 10 |
0 |
0 |
1,947 |
1,947 |
0,000 |
3 |
| 8 |
1 |
2 |
1,933 |
1,933 |
-0,001 |
2 |
| 10 |
0 |
-2 |
1,915 |
1,914 |
0,000 |
3 |
| 7 |
1 |
-4 |
1,868 |
1,867 |
0,001 |
1 |
| 0 |
4 |
0 |
1,826 |
1,826 |
-0,001 |
3 |
| 1 |
4 |
0 |
1,818 |
1.819 |
-0,001 |
3 |
| 5 |
3 |
2 |
1,817 |
1,816 |
0,001 |
3 |
| 8 |
2 |
-3 |
1,809 |
1,809 |
0,000 |
3 |
| 0 |
4 |
1 |
1,790 |
1,790 |
-0,001 |
3 |
| 2 |
1 |
-5 |
1,789 |
1,789 |
0,000 |
5 |
| 1 |
4 |
-1 |
1,788 |
1,788 |
0,000 |
3 |
| 6 |
2 |
3 |
1,783 |
1,782 |
0,001 |
3 |
| 4 |
1 |
-5 |
1,756 |
1,756 |
0,000 |
1 |
| 11 |
1 |
-1 |
1,745 |
1,745 |
0,000 |
3 |
| 10 |
1 |
-3 |
1,735 |
1,736 |
-0,001 |
2 |
| 10 |
2 |
0 |
1,718 |
1,718 |
0,000 |
2 |
| 4 |
3 |
3 |
1,706 |
1,706 |
0,000 |
1 |
| 0 |
4 |
-2 |
1,694 |
1,695 |
-0,001 |
1 |
| 2 |
4 |
-2 |
1,688 |
1,687 |
0,000 |
1 |
| 3 |
3 |
-4 |
1,660 |
1,659 |
0,001 |
1 |
| 2 |
2 |
-5 |
1,647 |
1,646 |
0,000 |
1 |
| 12 |
0 |
0 |
1,622 |
1,623 |
-0,001 |
3 |
| 7 |
1 |
4 |
1,586 |
1,587 |
-0,001 |
1 |
| 8 |
2 |
-3 |
1,580 |
1,580 |
0,000 |
1 |
| 6 |
3 |
3 |
1,565 |
1,565 |
0,000 |
5 |
| 4 |
2 |
5 |
1,475 |
1,475 |
0,000 |
1 |
| 6 |
4 |
-3 |
1,461 |
1,461 |
0,000 |
1 |
| 2 |
5 |
0 |
1,444 |
1,444 |
0,000 |
1 |
| 2 |
1 |
6 |
1,430 |
1,430 |
0,000 |
1 |
| 11 |
1 |
-5 |
1,371 |
1,371 |
0,000 |
1 |
| ТАБЛИЦА 4 |
| Обзор параметров ячейки модификаций VOHPO4·H2O |
| Название |
Пространственная группа |
a[Å] |
b[Å] |
с[Å] |
 [°] [°] |
V[Å3] |
 I-VOHPO4·H2O I-VOHPO4·H2O |
P21/c |
6,546 |
7,37 |
9,44 |
95,11 |
453,6 |
 II-VOHPO4·H2O II-VOHPO4·H2O |
P21/c |
6,92 |
7,26 |
9,32 |
70,91 |
442,5 |
 III-VOHPO4·H2O III-VOHPO4·H2O |
орторомбическая |
7,22 |
6,48 |
5,61 |
90 |
262,8 |
 -VOHPO4·H2O (Р-13) -VOHPO4·H2O (Р-13) |
P21/c |
6,90 |
7,36 |
9,27 |
104,8 |
455,3 |
| Таблица 5 |
Данные порошковой дифракции рентгеновских лучей  -VOHPO4·H2O (Р-13). -VOHPO4·H2O (Р-13). |
| h |
k |
1 |
Рассчитанная d-постоянная [Å] |
Наблюденная d-постоянная [Å] |
Различие в d-постоянных [Å] |
Относительная интенсивность |
| 1 |
0 |
0 |
6,677 |
6,687 |
-0,010 |
100 |
| 0 |
1 |
-1 |
5,689 |
5,687 |
0,002 |
16 |
| 1 |
1 |
0 |
4,946 |
4.950 |
-0,004 |
10 |
| о |
0 |
2 |
4,479 |
4,480 |
-0,001 |
11 |
| 1 |
0 |
-2 |
4,257 |
4,258 |
-0,001 |
4 |
| 1 |
1 |
1 |
4,020 |
4,018 |
0,002 |
6 |
| о |
1 |
2 |
3,827 |
3,827 |
-0,001 |
15 |
| 1 |
1 |
-2 |
3,685 |
3,684 |
0,001 |
2 |
| о |
2 |
1 |
3,406 |
3,405 |
0,001 |
9 |
| 1 |
0 |
2 |
3,345 |
3,346 |
-0,001 |
64 |
| 1 |
2 |
0 |
3,224 |
3,224 |
0,001 |
2 |
| 1 |
2 |
-1 |
3,161 |
3,159 |
0,002 |
36 |
| 2 |
1 |
-1 |
3,108 |
3,105 |
0,003 |
14 |
| 2 |
0 |
-2 |
3,080 |
3,080 |
0,000 |
25 |
| 2 |
1 |
-2 |
2,842 |
2,841 |
0,001 |
6 |
| 1 |
1 |
-3 |
2,802 |
2,801 |
0,001 |
15 |
| 2 |
1 |
1 |
2,695 |
2,693 |
0,002 |
3 |
| 1 |
2 |
2 |
2,476 |
2,476 |
0,000 |
2 |
| 2 |
1 |
-3 |
2,432 |
2,432 |
0,000 |
3 |
| 2 |
0 |
2 |
2,399 |
2,400 |
-0,001 |
55 |
| 2 |
2 |
-2 |
2,363 |
2,364 |
-0,001 |
3 |
| 1 |
0 |
-4 |
2,309 |
2,309 |
0,000 |
4 |
| 1 |
3 |
-1 |
2,280 |
2,279 |
0,001 |
6 |
| 3 |
0 |
-2 |
2,234 |
2,233 |
0,001 |
5 |
| 3 |
1 |
-1 |
2,197 |
2,198 |
-0,001 |
5 |
| 2 |
0 |
-4 |
2,128 |
2,129 |
0,000 |
8 |
| 2 |
2 |
-3 |
2,111 |
2,112 |
-0,001 |
4 |
| 1 |
2 |
3 |
2,067 |
2,068 |
0,000 |
4 |
| 2 |
1 |
-4 |
2,045 |
2,046 |
-0,001 |
5 |
| 2 |
2 |
2 |
2,010 |
2,010 |
0,000 |
3 |
| 2 |
3 |
0 |
1,978 |
1,977 |
0,001 |
4 |
| 3 |
2 |
-1 |
1,952 |
1,953 |
-0,001 |
4 |
| 1 |
3 |
-3 |
1,907 |
1,908 |
0,000 |
5 |
| 0 |
4 |
0 |
1,841 |
1,842 |
-0,001 |
4 |
| 3 |
0 |
-4 |
1,830 |
1,829 |
0,000 |
5 |
| 3 |
0 |
2 |
1,817 |
1,818 |
-0,001 |
5 |
| 3 |
2 |
-3 |
1,793 |
1,793 |
0,000 |
7 |
| 3 |
2 |
1 |
1,785 |
1,785 |
0,000 |
6 |
| 1 |
4 |
-1 |
1,764 |
1,764 |
0,000 |
5 |
| Таблица 5 (продолжение) |
| h |
k |
1 |
Рассчитанная d-постоянная [Å] |
Наблюденная d-постоянная [Å] |
Различие в d-постоянных [Å] |
Относительная интенсивность |
| 2 |
2 |
3 |
1,749 |
1,748 |
0,001 |
4 |
| 1 |
2 |
4 |
1,741 |
1,742 |
0,000 |
4 |
| 4 |
0 |
-2 |
1,714 |
1,714 |
0,000 |
11 |
| 1 |
4 |
-2 |
1,690 |
1,690 |
0,000 |
5 |
| 4 |
0 |
0 |
1,669 |
1,669 |
0,000 |
15 |
| 3 |
3 |
-2 |
1,652 |
1,652 |
0,000 |
5 |
| 2 |
3 |
-4 |
1,608 |
1,608 |
0,000 |
8 |
| 2 |
2 |
-5 |
1,602 |
1,603 |
-0,001 |
2 |
| 2 |
4 |
-2 |
1,580 |
1,580 |
0,000 |
6 |
| 1 |
0 |
-6 |
1,543 |
1,543 |
0,000 |
3 |
| 4 |
1 |
1 |
1.536 |
1,536 |
0,000 |
7 |
| 4 |
2 |
0 |
1,520 |
1,520 |
0,000 |
4 |
| 1 |
1 |
-6 |
1,511 |
1,510 |
0,001 |
3 |
| 4 |
2 |
-3 |
1,504 |
1,503 |
0,000 |
3 |
| 0 |
0 |
6 |
1,493 |
1,492 |
0,001 |
12 |
| 3 |
2 |
-5 |
1,476 |
1,476 |
0,000 |
2 |
| 0 |
1 |
6 |
1,463 |
1,463 |
0,001 |
4 |
| 1 |
4 |
-4 |
1,439 |
1,440 |
0,000 |
6 |
| 3 |
0 |
-6 |
1,419 |
1,419 |
0,000 |
6 |
| 3 |
0 |
4 |
1,409 |
1,409 |
0,000 |
6 |
| 2 |
1 |
5 |
1,407 |
1,407 |
0,000 |
3 |
| 5 |
0 |
-2 |
1,380 |
1,380 |
0,000 |
9 |
| 1 |
5 |
2 |
1,348 |
1,348 |
0,000 |
5 |
| Таблица 6 |
| Анализ получения согласно способу А с использованием альтернативных исходных материалов |
| Предшественник |
Соединение V |
Соединение Р |
Муравьиная кислота(%) |
Время (ч) |
Цвет продукта |
Фаза по данным ПДРЛ |
D (001) (Å) |
Данные-БЭТ м2/г |
| Р-16 |
NH4VO3 |
Н3PO4 |
60 |
72 |
голубой |
VOHPO4·1/2H2O 1 |
>1000 |
3,8 |
| Р-17 |
VOPO4·2H2O |
Н3PO4 2 |
60 |
7 |
зелено-серый |
VOHPO4·1/2H2O |
640 |
6,3 |
| Р-18 |
VO2 |
Н3PO4 |
82 |
17 |
зелено-серый |
VOHPO4·1/2H2O |
734 |
8,9 |
| Р-19 |
V2O5 |
Р2O5 |
60 |
18 |
зелено-серый |
VOHPO4·1/2H2O |
>1000 |
7,6 |
| Р-20 |
 -VOHPO4·H2O -VOHPO4·H2O |
– |
чистая 3 |
18 |
голубой |
VOHPO4·1/2H2O |
190 |
– |
| Р-21 |
(VO)3(PO4)2·5H2O |
Н3PO4 |
чистая 3 |
20 |
светло-зеленый |
VOHPO4·1/2H2O |
350 |
– |
| Р-22 |
(VO)3(PO4)2·5H2O |
Н3PO4 |
60 |
20 |
голубой |
VOHPO4·1/2H2O |
>1000 |
– |
1 Получен в присутствии H2SO4.
2 10 мол.% относительно VOPO4
3 Процесс рекристаллизации в уксусной кислоте ПДРЛ – порошковая дифракция рентгеновских лучей |
| Таблица 7 |
| Каталитическая активность 1 катализаторов из муравьиной кислоты (Р) в сравнении с современным уровнем техники (R). |
| Предшественник |
Прокаливание
(°С) |
Равновесие
(°С) |
Конверсия бутана (%) |
Селективность по малеиновому ангидриду (%) |
Выход малеинового ангидрида (%) |
| Р-2 |
350 |
420 |
80 |
58 |
47 |
| Р-3 |
370 |
420 |
28 |
58 |
16 |
| Р-4 |
350 |
420 |
54 |
55 |
30 |
| Р-5 |
350 |
420 |
66 |
63 |
42 |
| Р-6 |
350 |
420 |
67 |
60 |
41 |
| Р-7 |
350 |
420 |
54 |
60 |
32 |
| Р-8 |
350 |
420 |
84 |
57 |
48 |
| Р-9 |
350 |
420 |
75 |
61 |
46 |
| Р-10 |
360 |
420 |
62 |
62 |
39 |
| Р-11 |
360 |
420 |
47 |
61 |
29 |
| Р-13 |
350 |
420 |
5 |
29 |
1 |
| Р-16 |
350 |
420 |
19 |
59 |
11 |
| Р-17 |
350 |
420 |
66 |
61 |
40 |
| Р-18 |
350 |
420 |
79 |
56 |
44 |
| Р-19 |
350 |
420 |
70 |
57 |
40 |
| Р-20 |
350 |
420 |
54 |
58 |
31 |
| Р-21 |
350 |
420 |
48 |
61 |
29 |
| Р-22 |
350 |
420 |
28 |
55 |
15 |
| R-1 |
390 |
460 |
23 |
67 |
16 |
| R-2 |
365 |
420 |
40 |
36 |
14 |
| 1 Измерено при 400°С с объемной скоростью 6000 ч-1 после прокаливания на воздухе 1 час и уравновешивания в смеси бутана (1,29%), кислорода (19,69%) и азота (79,02%) за 17 часов. |
Формула изобретения
1. Ванадийфосфатное соединение  -VOHPO4·H2O, характеризующееся порошковой дифракцией рентгеновских лучей, показывающих моноклинную ячейку с пространственной группой Р21/с, а=6,90 Å; b=7,36 Å; с=9,27 Å; -VOHPO4·H2O, характеризующееся порошковой дифракцией рентгеновских лучей, показывающих моноклинную ячейку с пространственной группой Р21/с, а=6,90 Å; b=7,36 Å; с=9,27 Å;  =104,8°; V=455,3 Å3, где а, b, с, =104,8°; V=455,3 Å3, где а, b, с,  , V – параметры моноклинной ячейки. , V – параметры моноклинной ячейки.
2. Ванадийфосфатное соединение (VO)3(PO4)2·5Н2О, характеризующееся порошковой дифракцией рентгеновских лучей, показывающих моноклинную ячейку с пространственной группой Р21/с, а=19,77 Å; b=7,303 Å; с=9,226 Å;  =100,07°; V=1311,5 Å3, где а, b, с, =100,07°; V=1311,5 Å3, где а, b, с,  , V – параметры моноклинной ячейки. , V – параметры моноклинной ячейки.
РИСУНКИ
|
|