Патент на изобретение №2261250
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) СОЕДИНЕНИЯ ПИПЕРАЗИНА И ПИПЕРИДИНА
(57) Реферат:
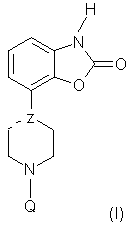
Изобретение относится к производным пиперазина и пиперидина формулы (I), где —Z представляет =C или -N и Q является бензилом или 2-, 3- или 4-пиридилметилом, которые могут быть замещены одним или более заместителями, выбранными из группы, содержащей галоген, циано, С1-С3-алкоксигруппу, CF3, OCF3, SCF3, С1-С4-алкил, С1-С3-алкилсульфонил, и их солям, а также к способу их получения. Было обнаружено, что данные соединения обладают интересными фармакологическими свойствами благодаря сочетанию (частичного) агонизма по отношению к членам D2-подтипа допаминовых рецепторов и аффинности (сродства) по отношению к соответствующим серотониновым и/или норадренергическим рецепторам и могут быть пригодны в получении композиций для лечения страха и/или депрессии или болезни Паркинсона. 2 н. и 5 з. п. ф-лы, 1 табл.
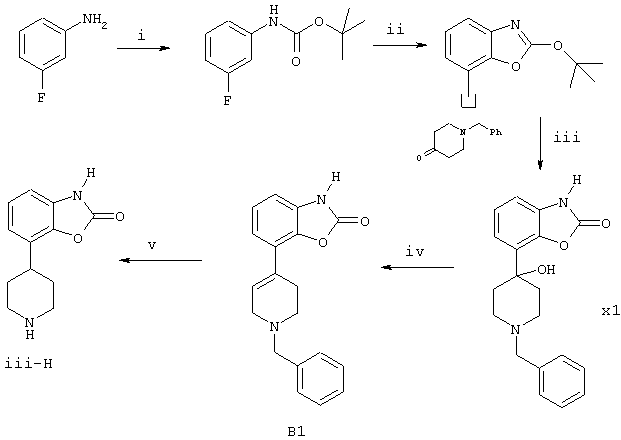
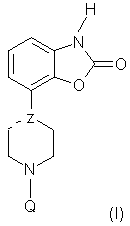
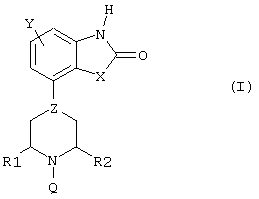
Настоящее изобретение относится к новой группе производных пиперазина и пиперидина, обладающих интересными фармакологическими свойствами благодаря сочетанию (частичного) агонизма по отношению к членам D2-подтипа допаминовых рецепторов и аффинности (сродства) по отношению к соответствующим серотониновым и/или норадренергическим рецепторам. Известно, что производные пиперазина, замещенные у одного из атомов азота фенилгетероциклической группой и незамещенные у второго атома азота, обладают психотропной активностью (Европейский патент EP 0189612). Кроме того, известно, что производные бензофуран- и бензодиоксолпиперазина, замещенные у другого атома азота пиперазиновой группы, также обладают психотропной активностью (Европейский патент EP 0190472). И, наконец, в Европейском патенте EP 0169148 сообщается, что 1,3-дигидро-4-(1-этил-1,2,3,6-тетрагидропиридин-4-ил)-2Н-индол-2-он и аналогичные соединения обладают анальгетическими свойствами. В настоящее время неожиданно было обнаружено, что небольшая группа производных пиперазина и пиперидина формулы (I) где – Y является водородом, галогеном, С1-С3-алкилом или CN, CF3, OCF3, SCF3, С1-С3-алкоксилом, амино- или моно- или ди(С1-С3-алкил)замещенной аминогруппой или гидроксигруппой, – Х является O, S, SO или SO2, – Z представляет -C, =C, -N, – R1 и R2 независимо представляют водород или С1-С3-алкил, – Q является бензилом или 2-, 3- или 4-пиридилметилом, группы которых могут быть замещены одним или более заместителями, выбранными из группы, содержащей галоген, нитро, циано, моно- или ди(С1-С3-алкил)аминогруппы, С1-С3-алкоксигруппу, CF3, OCF3, SCF3, С1-С4-алкил, С1-С3-алкилсульфонил или гидроксигруппу, а также их соли и пролекарства обладают как (частичным) агонизмом по отношению к членам D2-подтипа допаминовых рецепторов, так и аффинностью по отношению к соответствующим серотониновым и/или норадренергическим рецепторам. Предпочтительными соединениями по данному изобретению являются соединения формулы (I), в которых Y, R1 и R2 являются водородами, Х представляет кислород, а Z и Q имеют значения, указанные выше, а также их соли. Особенно предпочтительными являются соединения, в которых Y, R1 и R2 являются водородами, Х представляет кислород, Z представляет -N, а Q является необязательно замещенным бензилом. Соединения по данному изобретению проявляют аффинность, по меньшей мере, к двум членам D2-подтипа допаминовых рецепторов (PKi в интервале 6,0-9,5) и к соответствующим серотониновым рецепторам (5-НТ1А, 5-НТ5А, 5-НТ7), (PKi в интервале 5,0-8,0) и/или норадренергическим ( В качестве (частичных) агонистов указанные соединения проявляют различную активность по отношению к членам D2-подтипа допаминовых рецепторов и, что удивительно, к серотониновым рецепторам 5-НТ1А и/или норадренергическим Уникальное сочетание (частичного) агонизма по отношению к D2-подтипу допаминовых рецепторов и аффинности по отношению к соответствующим серотониновым и/или норадренергическим рецепторам дает в результате поразительно широкий спектр активности при исследованиях на животных, проводимых с использованием нескольких моделей, что позволяет прогнозировать применение данных соединений при психиатрических и неврологических расстройствах. Соединения демонстрируют удивительно высокую эффективность на терапевтической модели для изучения анксиолитической/антидепрессантной активности: внушенная ультразвуковая вокализация на крысах (см., например, Molewijk HE, Van der Poel AM, Mos J, Van der Heyden JAM and Oliver B (1995), Conditioned ultrasonic vocalizations in adult male rats as a paradigm for screening anto-panic drugs, Psychopharmacology, 1995, 117: 32-40). Активность соединений на данной модели проявляется при малых дозах (мг/кг) и неожиданно оказывается более высокой (в 100-3000 раз), чем активность соединений, описанных ранее в Европейских патентах EP 0190472 и EP 0398413. Кроме того, данные соединения (в более высоких дозах) также проявляют активность на моделях, прогнозирующих антидепрессантную активность (тест на вынужденное плавание см. Porsolt RD, Anton G, Blavet N and Jalfre M, 1978, Behavioural despair in rats: A new model sensitive to antidepressant treatments, Eur. J. Pharmacol 1978, 47: 379-391) и дифференцированное подкрепление низких скоростей модели отклика у крыс (см. McGuire PS and Seiden LS, The effects of tricyclic antidepressants on performance under a differential-reinforcement-of-low-rate schedule in rats, J. Pharmacol. Exp. Ther. 1980, 214: 635-641). В зависимости от степени частичного агонизма по отношению к D2-подтипу допаминовых рецепторов соединения склонны вести себя подобно полным агонистам допаминовых рецепторов в случае индуцированного поведения (карабкания) мышей, или (в присутствии полного допаминового агониста) они ведут себя как полные допаминовые антагонисты, например, при индуцированном апоморфином карабкании (climbing behavior) мышей, что описано в работе (Costall B, Naylor RJ and Nohria V, Differential actions of typical and atypical agents on two behavioural effects of apomorphine in the mouse, Brit J. Pharmacol. 1978, 63:381-382); при подавлении двигательной активности, например, (File SE and Hyde JRC, A test of anxiety and distinguishes between the actions of benzodiazepines and those of other minor tranquillisers or simulants, Pharmacol. Biochem. Behav. 1979, 11: 65-79). Продемонстрирована потенциальная эффективность соединений по данному изобретению на животных моделях, что позволяет прогнозировать их активность против болезни Паркинсона. Эти модели включают модель индуцированного 6-OH-DA поворачивания у крыс (Understedt U, 6-OH-DA induced generation of central monoamine neurons, Eur. J. Pharmacol. 1968 5: 107-110); модель нарушений, вызванных МФТП (MPTP) у игрункообразных обезьян (Nomoto M, Jenner P, Marsden CD: The dopamin agonist D2 agonist LY 141865 but not the D1 agonist SKF 38393, reverses Parkinsonism induced by 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine (MPTP) in the common Marmoset, Neurosci. Lett., (1985) 57: 37-41). Удивительно, что соединения по данному изобретению не имеют нежелательных побочных эффектов, связанных с используемыми в настоящее время дофаминовыми препаратами, они не вызывают стереотипию, тошноту, головокружение и рвоту. Соединения имеют (важное) значение для лечения поражений и заболеваний центральной нервной системы, вызванных нарушениями допанергической, серотонергической и/или норадренергической систем, например наркомании (алкоголизм) (включая тягу), нарушений, связанных с состоянием страха (включая, например, генерализованный страх, панику, навязчивые маниакальные расстройства), депрессии, аутизма, шизофрении, болезни Паркинсона, нарушений познавательных способностей и памяти. Приемлемыми кислотами, с которыми соединения по данному изобретению могут образовывать подходящие кислотно-аддитивные соли, являются, например, хлористоводородная кислота, серная кислота, фосфорная кислота, азотная кислота и органические кислоты, такие как лимонная кислота, фумаровая кислота, малеиновая кислота, винная кислота, уксусная кислота, бензойная кислота, п-толуолсульфокислота, метансульфокислота и нафталинсульфокислота. Пролекарства представляют собой соединения формулы (I), содержащие группу, которая может быть легко удалена после введения в организм. Приемлемыми пролекарствами, например, являются соединения, которые содержат одну из следующих групп: амидиновую, енаминогруппу, основание Манниха, гидроксиметиленовое производное, О-(ацилоксиметиленкарбамат) производное, карбамат или енаминон. Соединения и их соли могут быть получены в виде форм, предназначенных для введения (приема) обычными способами с помощью вспомогательных веществ, например жидких и твердых носителей. Соединения согласно данному изобретению могут быть получены способами, известными для синтеза аналогичных соединений. Способ А Соединения формулы (I), где Z представляет -N или -C, могут быть получены реакцией соответствующего соединения, в котором Q является водородом, с соединением Q-Hal, где Q имеет значения, указанные выше, а Hal является галогеном, предпочтительно бромом. Данную реакцию можно осуществить в растворителе, например в ацетонитриле, в присутствии основания, например этилдиизопропиламина или триэтиламина. Исходные соединения, в которых Q является водородом, а Z представляет -N, известны или могут быть получены по методике, описанной в Европейском патенте EP 0189612. Исходные соединения, в которых Q является водородом, а Z представляет -С, могут быть получены по схеме A.i., приведенной ниже (соединение III-H). Способ B Соединения В1, т.е. соединения формулы (I), где Z представляет =С, могут быть получены методом, представленным на приводимой ниже схеме A.i.: Схема A.i. Исходные соединения для стадии (ii) могут быть получены по методике, описанной в J. Org. Chem. 45, (1980), 4789, и саму стадию (ii) можно осуществить способом, описанным в J. Org. Chem. 47, (1982), 2804. Стадию (iii) осуществляют по методу, известному для такого типа химических реакций. Изобретение иллюстрируется следующими примерами: Пример 1 Общая методика для способа А (а) К 1 ммоль галогенида Q-Hal прибавляют 0,8 ммоль I-H (Z=-N) растворенного в 7,5 мл ацетонитрила. Затем прибавляют 0,43 мл (2,5 ммоль) (изо-Pr)2NEt и полученную смесь перемешивают при температуре 85°С в течение 3 ч. После того как температура реакционной смеси понизится до комнатной, прибавляют 7,5 мл дихлорметана; полученный раствор помещают в верхнюю часть экстракционной колонки с твердой фазой (Varian 5 г тип Si), а затем фракцию, содержащую целевой продукт, помещают в верхнюю часть экстракционной колонки с твердой фазой (Varian 5 г 0,8 м-экв./г сильный катионный обмен (Strong Cationic Exchange (SCX)); экстрагируют MeOH, затем CH2Cl2)), после экстракции колонку два раза промывают метанолом. Затем вторую колонку промывают 0,1 М NH3/MeOH и элюирование проводят 1,0 М NH3/MeOH. Элюат концентрируют в вакууме, удаляя растворитель и оставшийся (изо-Pr)2NEt и получают ожидаемый продукт. Возможно также проведение очистки по стандартным хроматографическим методикам. В единичном случае (т.е. в случае А1) в качестве растворителя используют диметилформамид (см. ниже). (b) Суспендируют 10,2 г (40 ммоль) I-H.HCl в 150 мл ДМФА, к полученной перемешиваемой смеси прибавляют 21 мл (120 ммоль) (изо-Pr)2NEt. При комнатной температуре в течение 10 мин прибавляют раствор 7,0 г (41 ммоль) бензилбромида в 25 мл ДМФА, процесс слабо экзотермичен (5-10°С). Продолжают перемешивание в течение 3 ч при комнатной температуре и затем реакционную смесь выливают в воду (700 мл). Затем проводят экстракцию этилацетатом (3×250 мл), объединенные органические фракции два раза промывают водой (2×150 мл) и сушат MgSO4. После удаления осушителя фильтрованием растворитель удаляют в вакууме и получают 10,5 г сырого продукта, который очищают флэш-хроматографией на колонке (SiO2, элюент CH2Cl2/MeOH 98/2), получая 8,5 г (69%) чистого продукта А1 в виде свободного основания, т.пл. 189-190°С. Соединения от А2 до А46, как показано в Таблице А, получают аналогично по методике (а) способа А.
Пример 2 Стадии ii и iii (схема А.i): В инертной атмосфере растворяют N-(трет-бутоксикарбонил)-м-фторанилин (16,5 г, 78,2 ммоль) в 230 мл сухого тетрагидрофурана (ТГФ), затем раствор охлаждают до -75°С (сухой лед, ацетон). Медленно при перемешивании прибавляют раствор трет.-бутиллития в гептане (приблизительно 156 ммоль, 2 мольных эквивалента) и перемешивают реакционную смесь еще 0,5 ч при -70°С, а затем 2 ч при -25°С. Реакционную смесь вновь охлаждают до 75°С и прибавляют раствор 14,4 мл N-бензилпиперидона (78 ммоль, 1 мольный эквивалент) в 25 мл сухого ТГФ. Реакционную смесь выдерживают до достижения комнатной температуры и дополнительно перемешивают в течение 16 ч. Затем осторожно прибавляют 250 мл 2M HCl, полученную смесь 3 раза экстрагируют этилацетатом (EtOAc). Водный слой при перемешивании выливают на NaHCO3 (84 г), после чего водный слой опять экстрагируют EtOAc. Полученный органический слой сушат над Na2SO4. Осушитель удаляют фильтрованием, а растворитель – выпариванием в вакууме и выделяют темно-желтое масло (15 г). После хроматографии на колонке (SiO2, элюент: CH2Cl2/MeOH в соотношении 9:1) получают 7,5 г (приблизительно 30%) светло-желтой пены. При перемешивании 1 г пены растирают с диэтиловым эфиром и небольшим объемом EtOAc. Через 50 ч отфильтровывают твердое вещество, промывают его смесью диэтиловый эфир/гексан и получают почти белый твердый продукт х1, т.пл. 125-8°С. Стадия iv (схема А.i): Соединение х1 (6,3 г, 19,4 ммоль) растворяют при перемешивании в 250 мл диоксана, затем прибавляют 150 мл концентрированной HCl и полученную смесь кипятят с обратным холодильником в течение 1,5 ч. Реакционную смесь выдерживают до достижения комнатной температуры и выливают на NaHCO3 (140 г), затем прибавляют около 250 мл EtOAc и воду в количестве, достаточном, чтобы растворить все твердое вещество, pH>7. Слои разделяют и водный слой дважды экстрагируют EtOAc. Органические фракции (3) объединяют и сушат над Na2SO4. Осушитель удаляют фильтрованием, а растворитель – упариванием в вакууме и выделяют темно-желтое масло (8 г), которое затвердевает при стоянии. После хроматографии на колонке (SiO2, элюент: EtOAc) получают почти белый продукт (4,56 г, приблизительно 30%), его суспендируют в гексане и перемешивают около 20 ч. После фильтрования и высушивания остатка получают 3,5 г (59%) белого твердого продукта B1 в виде свободного основания, т.пл. 153°С. Пример 3 Получение промежуточного соединения III-H в схеме A.i. Стадия v (схема А.i): Соединение В1 схемы А.i (2,71 г, 8,9 ммоль) растворяют в 250 мл абсолютного этанола (EtOH). К полученному раствору добавляют 0,6 г 20% раствора Pd(OH)2 на угле (0,6 г) и гидрируют реакционную смесь при комнатной температуре в течение 18 ч. Затем реакционную смесь фильтруют (hyflo supercel) и остаток (hyflo) промывают смесью метанола и триэтиламина (97:3). Фильтрат упаривают в вакууме и получают почти белое твердое вещество (1,87 г), которое затем суспендируют в EtOAc и перемешивают в течение 20 ч. Твердое вещество отделяют фильтрованием, сушат и получают 1,56 г (81%) промежуточного соединения III-H (схема А.i).
Формула изобретения
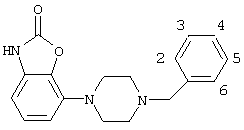
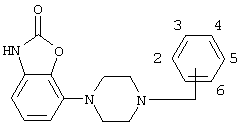
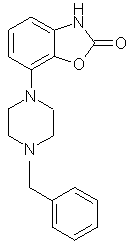
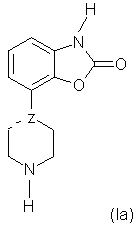
1. Соединения формулы (I) где —Z представляет =C или -N; – Q является бензилом или 2-, 3- или 4-пиридилметилом, которые могут быть замещены одним или более заместителями, выбранными из группы, содержащей галоген, циано, С1-С3-алкоксигруппу, CF3, OCF3, SCF3, С1-С4-алкил, С1-С3-алкилсульфонил, а также их соли. 2. Соединения по п.1, где Q является (замещенным) бензилом и —Z имеет значения, указанные в п.1. 3. Соединения по п.2, где —Z представляет -N. 4. Соединение по п.1, где —Z представляет собой азот и Q представляет собой бензил, и представленное формулой 5. Соединение по п.1, пригодное в получении композиции для лечения состояния страха и/или депрессии. 6. Соединение по п.1, пригодное в получении композиции для лечения болезни Паркинсона. 7. Способ получения соединений по п.1, включающий взаимодействие соединения формулы (Ia) где —Z представляет =C или -N, с соединением Q-Hal, в котором Q имеет значения, указанные в п.1, и Hal является галогеном.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 1,
1,