Патент на изобретение №2261094
|
||||||||||||||||||||||||||||||||||||
(54) ТВЕРДАЯ ЛЕКАРСТВЕННАЯ ФОРМА ДЛЯ ЛЕЧЕНИЯ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИИ И СПОСОБ ЕЕ ИЗГОТОВЛЕНИЯ
(57) Реферат:
Изобретение относится к химико-фармацевтической промышленности, в частности к твердой лекарственной форме, обладающей антигипертензивным, антиангиальным, вазодилатирующим, антиоксидантным и антипролиферативным действием, и найдет применение для лечения гипертензии, стенокардии, ишемии миокарда, хронической сердечной недостаточности. Изобретение заключается в том, что твердая лекарственная форма содержит следующие компоненты: карведилол, дисахарид, магний стеариновокислый, крахмал, кальция фосфат, гидроксипропилметилцеллюлозу, аэросил, натриевую соль карбоксиметилцеллюлозы. Раскрывается также способ изготовления данной формы. Изобретение обеспечивает получение формы, обладающей высокой скоростью и полнотой высвобождения действующего вещества в организме человека, обладающей стабильностью показателей качества в течение всего срока годности и позволяющей максимально эффективно использовать промышленное оборудование при производстве лекарственного средства. 2 н. и 3 з.п. ф-лы, 1 табл.
Изобретение относится к химико-фармацевтической промышленности, в частности к твердой лекарственной форме на основе карведилола, обладающей антигипертензивным, антиангиальным, вазодилатирующим, антиоксидантным и антипролиферативным действием, и найдет применение для лечения гипертензии, стенокардии, ишемии миокарда, хронической сердечной недостаточности. В середине 80-х годов на мировом фармацевтическом рынке появился карведилол – новый препарат для лечения артериальной гипертензии. Результаты многочисленных исследований свидетельствуют, что данное лекарственное средство при применении в терапевтических дозах действует как неселективный блокатор Карведилол выпускается в твердой форме, которая, как правило, содержит 12,5 или 25 мг карведилола в качестве действующего вещества и фармацевтически приемлемые вспомогательные вещества. Наиболее близкая к предложенной твердая лекарственная форма для лечения артериальной гипертензии раскрыта в патенте RU 2214243. Данная форма содержит карведилол и фармацевтически приемлемые вспомогательные вещества, в качестве которых используют крахмал, сахарид (маннит или лактозу), стеариновую кислоту и/или ее соль (стеарат кальция или магния), при следующем соотношении компонентов, мас.%: Карведилол – 1,0-25,0 Крахмал – 0,1-3,5 Сахарид – 70,0-96,9 Кислота стеариновая и/или ее соль – 0,6-1,5 Способ получения данной формы включает влажную грануляцию смеси действующего вещества с лактозой и, необязательно, крахмалом, сушку, введение остальных ингредиентов и формование окончательной смеси. Получаемая лекарственная форма на основе карведилола удовлетворяет требованиям действующей Госфармакопеи (ГФ XI) на лекарственное средство, а именно она устойчива при хранении, обеспечивает терапевтическую дозировку и легко распадается, что позволяет достигнуть высокой скорости высвобождения действующего вещества и, соответственно, быстро получить требуемую концентрацию препарата в крови. К недостаткам данной лекарственной формы относится то, что она содержит значительное количество лактозы, таблетки имеют недостаточную механическую прочность, что может вызывать снижение качества. Кроме того, получаемая в процессе производства смесь компонентов не обладает достаточно хорошей сыпучестью, что отрицательно сказывается на однородности распределения активного компонента. Технический результат изобретения заключается в повышении однородности распределения активного компонента при одновременном улучшении прессуемости и повышении прочности таблеток, а также снижении содержания сахара. Указанный технический результат достигается тем, что твердая лекарственная форма для лечения артериальной гипертензии, содержащая в качестве действующего вещества карведилол и в качестве фармацевтически приемлемых вспомогательных веществ магний стеариновокислый и крахмал, в соответствии с изобретением в качестве фармацевтически приемлемых вспомогательных веществ дополнительно содержит дисахарид, кальция фосфат, гидроксипропилметилцеллюлозу, аэросил и натриевую соль карбокси-метилцеллюлозы при следующем соотношении компонентов, мас.%:
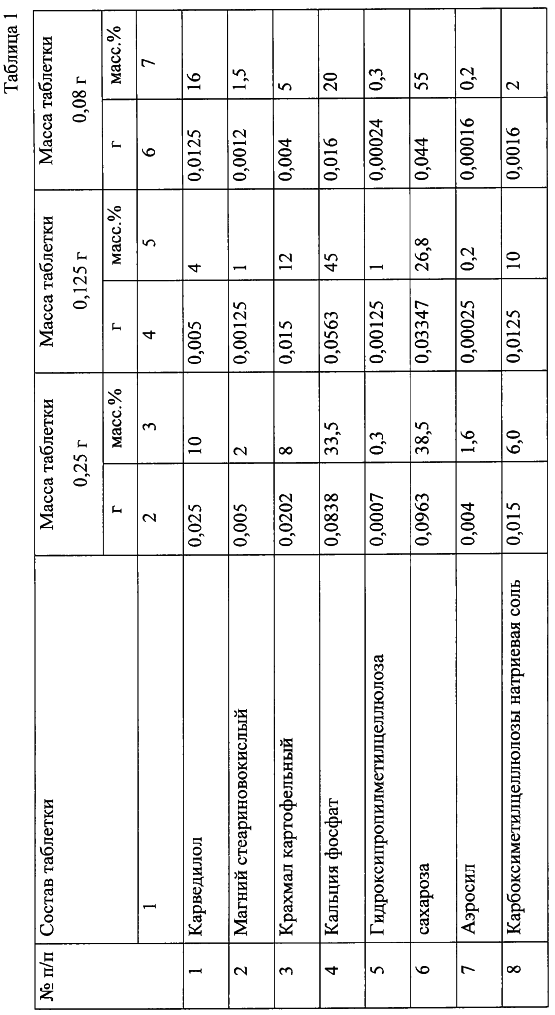
В частных воплощениях изобретения поставленная задача решается тем, что твердая лекарственная форма в качестве крахмала содержит картофельный крахмал, а в качестве дисахарида – сахарозу. Твердая лекарственная форма может быть выполнена в форме таблетки. Указанный технический результат достигается также способом изготовления лекарственной формы препарата для лечения артериальной гипертензии, заключающимся в том, что смешивают порошки карведилола и крахмала, увлажняют смесь, проводят влажную грануляцию и сушку, затем опудривают путем добавления магния стеариновокислого, смесь перемешивают и таблетируют, согласно изобретению смешивание карведилола и крахмала осуществляют с добавлением сахарозы, кальция фосфата и части аэросила, увлажнение осуществляют раствором гидроксипропилметилцеллюлозы, после сушки осуществляют сухую грануляцию, а при опудривании также добавляют оставшуюся часть аэросила и натриевую соль карбоксиметилцеллюлозы. Предпочтительно сушку осуществлять при 50-55°С, а сухую грануляцию проводят после охлаждения гранулята при комнатной температуре. Сущность предложенного изобретения состоит в том, что введение в форму в качестве фармацевтически приемлемых вспомогательных веществ кальция фосфата, гидроксипропилметилцеллюлозы, аэросила и натриевой соли карбоксиметилцеллюлозы позволяет улучшить технологические свойства таблеточной смеси, снизить усилие прессования при формовании таблеток, увеличить механическую прочность таблеток и улучшить их внешний вид. Введение в состав таблеток фосфата кальция и аэросила позволяет получить хорошо сыпучую массу с высокой однородностью распределения активного компонента, что позволяет снизить разброс содержания активного компонента в таблетках. Прочность таблетке и хорошую прессуемость смеси придают включенные в состав гидроксипропилметилцеллюлоза и сахароза. Хорошее высвобождение карведилола обусловлено присутствием натриевой соли карбоксиметилцеллюлозы, а также оптимальным соотношением остальных вспомогательных компонентов. Использование сахарозы позволяет уменьшить количество сахара в составе за счет ее лучших связующих свойств. Использование в способе операции сухой грануляции позволяет снизить разброс таблеток по массе. При этом готовый продукт полностью соответствует требованиям Государственной фармакопеи, обладает высокими показателями биодоступности (высвобождается 95-98% карведилола за 45 мин), однородности распределения действующего вещества. Кроме того, использование дисахарида, в частности сахарозы, улучшающей процесс усвоения лекарственного вещества, позволяет получить препарат, обладающий большим терапевтическим эффектом и стабильностью при хранении. Изобретение иллюстрируется примерами 1-3. Пример 1. Предварительно просеянные 838 г (33 мас.%) фосфата кальция, 20 г (0,8 мас.%) аэросила и 963 г (38 мас.%) сахара тщательно перемешивали. К полученной смеси прибавляли 250 г (10 мас.%) просеянного карведилола и 202 г (8 мас.%) крахмала. Затем, тщательно перемешав, в полученную смесь добавляли 300 г (0,28 мас.%) 2,3% раствора гидроксипропилметилцеллюлозы, повторно перемешивали до равномерного увлажнения и проводили влажную грануляцию. Влажные гранулы сушили при температуре 50-55°С до остаточной влаги 1±0,5%. Высушенные гранулы охлаждали до комнатной температуры и проводили сухую грануляцию, затем сухой гранулят опудривали путем добавления 50 г (2 мас.%) магния стеариновокислого, оставшейся части 20 г (0,8 мас.%) аэросила и 150 г (6 мас.%) натриевой соли карбоксиметилцеллюлозы, смесь перемешивали и таблетировали. Получали таблетки массой 0,25 г. Состав таблеток приведен в таблице 1 (столбцы 2 и 3). Пример 2. Получали таблетки с массой 0,125 г и содержанием карведилола 5%. Процесс производства осуществлялся в соответствии с режимами, приведенными в примере 1. Состав таблеток приведен в таблице 1 (столбцы 4-5). Пример 3. Получали таблетки с массой 0,08 г и содержанием карведилола 16%. Процесс производства осуществлялся в соответствии с режимами, приведенными в примере 1. Состав таблеток приведен в таблице 1 (столбцы 4-5). Пример 4. Получали таблетки с массой 0,25 г и содержанием карведилола 12%. Процесс производства осуществлялся в соответствии с режимами, приведенными в примере 1. Состав таблеток следующий: карведилол 0,03 г (12%), магний стеариновокислый 0,00025 г (0,1%), крахмал картофельный 0,03 г (12%), кальция фосфат 0,106 г (42,8%), гидроксипропилметилцеллюлоза 0,00025 г (0,1%), сахароза 0,05 г (20%), аэросил 0,0075 г (3%), натриевая соль карбоксиметилцеллюлозы 0,025 г (10%). Все полученные таблетки карведилола удовлетворяют требованиям на фармацевтическое средство. За 45 минут из таблетки высвобождается и переходит в раствор 95-98% действующего вещества, содержание карведилола соответствует необходимому для формы, однородность дозирования (содержание действующего вещества в каждой отдельной таблетке) составляет необходимое номинальное с допустимыми отклонениями (составляет ±6% при требуемом Государственной фармакопеей ±15%).
Формула изобретения
1. Твердая лекарственная форма для лечения артериальной гипертензии, содержащая в качестве действующего вещества карведилол, в качестве фармацевтически приемлемых вспомогательных веществ магний стеариновокислый и крахмал, отличающаяся тем, что в качестве фармацевтически приемлемых вспомогательных веществ она дополнительно содержит сахарозу, кальция фосфат, гидроксипропилцеллюлозу, аэросил и натриевую соль карбоксиметилцеллюлозы при следующем содержании компонентов, мас.%:
2. Твердая лекарственная форма по п.1, отличающаяся тем, что содержит в качестве крахмала картофельный крахмал. 3. Твердая лекарственная форма по п.1, отличающаяся тем, что выполнена в форме таблетки. 4. Способ изготовления лекарственной формы препарата для лечения артериальной гипертензии, заключающийся в том, что смешивают порошки карведилола и крахмала, увлажняют смесь, проводят влажную грануляцию и сушку, затем опудривают путем добавления магния стеариновокислого, смесь перемешивают и таблетируют, отличающийся тем, что смешивание карведилола и крахмала осуществляют с добавлением сахарозы, кальция фосфата и части аэросила, увлажнение осуществляют раствором гидроксипропилметилцеллюлозы, после сушки осуществляют сухую грануляцию, а при опудривании также добавляют оставшуюся часть аэросила и натриевую соль карбоксиметилцеллюлозы. 5. Способ по п.4, отличающийся тем, что сушку осуществляют при 50-55°С, а сухую грануляцию проводят после охлаждения гранулята при комнатной температуре.
HE4A – Изменение адреса для переписки с обладателем патента Российской Федерации на изобретение
Новый адрес для переписки с патентообладателем:
Извещение опубликовано: 10.06.2006 БИ: 16/2006
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 07.04.2007
Извещение опубликовано: 27.02.2008 БИ: 06/2008
NF4A Восстановление действия патента СССР или патента Российской Федерации на изобретение
Дата, с которой действие патента восстановлено: 10.06.2008
Извещение опубликовано: 10.06.2008 БИ: 16/2008
|
||||||||||||||||||||||||||||||||||||

 – и
– и  -адренорецепторов.
-адренорецепторов.