Патент на изобретение №2259369
|
||||||||||||||||||||||||||
(54) 5-АРИЛ-1-ФЕНИЛ-4-ГЕТЕРОИЛ-3-ГИДРОКСИ-3-ПИРРОЛИН-2-ОНЫ, ПРОЯВЛЯЮЩИЕ ПРОТИВОМИКРОБНУЮ АКТИВНОСТЬ
(57) Реферат:
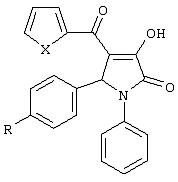
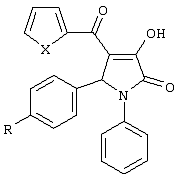
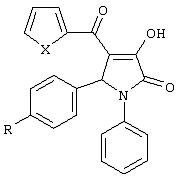
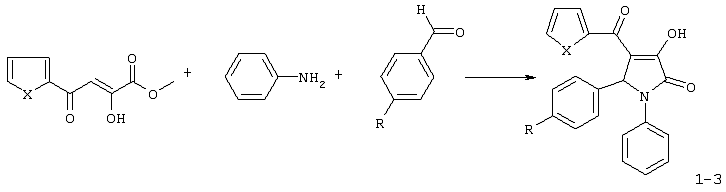
Изобретение относится к новым 5-арил-1-фенил-4-гетероил-3-гидрокси-3-пирролин-2-онам (1-3), формулы: где 1 X=S, R=(CH3)2CH; 2 X=S, R=(СН3)3С; 3 Х=O, R=(СН3)3С. Соединения I получают взаимодействием (соответствующего) метилового эфира гетероилпировиноградной кислоты со смесью анилина и ароматического альдегида в уксусной кислоте при кратковременном нагревании. Соединения проявляют противомикробную активность, в МИК 3,9-7,8 мкг/мл, против 62-1000 мкг/мл для аналога. 1 табл.
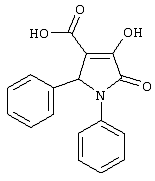
Изобретение относится к новым биологически активным веществам ряда пирролидин-2,3-диона, а именно к 5-арил-1-фенил-4-гетероил-3-гидрокси-3-пирролин-2-онам (1-3), формулы: где 1 X=S, R=(СН3)2СН; 2 X=S, R=(СН3)3С; 3 Х=O, R=(СН3)3С; обладающих бактериостатической активностью, что предполагает возможность использования их в медицине в качестве антимикробных препаратов. Из уровня техники известен следующий аналог по структуре и активности [1] 1,5-дифенил-3-гидрокси-2-оксо-3-пирролин-4-карбоновая кислота. Сущность изобретения-поиск в ряду пирролидин-2,3-дионов соединений с противомикробной активностью. Это достигается синтезом 5-арил-1-фенил-4-гетероил-3-гидрокси-3-пирролин-2-онов (1-3), обладающих противомикробным действием. Заявляемые соединения 1-3 получают взаимодействием метиловых эфиров гетероилпировиноградных кислот со смесью анилина и ароматического альдегида в уксусной кислоте при кратковременном нагревании с последующим выделением целевого продукта известными методами по схеме: где 1 X=S, R=(СН3)2СН; 2 X=S, R=(СН3)3С; 3 Х=O, R=(СН3)3С. Заявляемые соединения 1-3 представляют светло-желтые кристаллические вещества, нерастворимые в воде, растворимые при нагревании в спирте и ацетоне, хорошо растворимые в ДМСО и ДМФА. Пример получения заявляемых соединений 1-3. Пример 1. 3-гидрокси-5-(4-изопропилфенил)-4-(2-тиофеноил)-1-фенил-3-пирролин-2-он. К раствору 1.5 мл (0.01 моль) куминового альдегида и 0.91 мл (0.01 моль) анилина в 10 мл уксусной кислоты добавляют раствор метилового эфира тиофеноилпировиноградной кислоты 2.12 г (0.01 моль) в 5 мл уксусной кислоты. Реакционную смесь подвергали кратковременному нагреванию, а затем выдерживали в течение 4-6 часов при комнатной температуре. Выпавший осадок отфильтровывали и перекристаллизовывали из этилового спирта. Получают 2.1 г (52.1%) соединения 1. Т.пл.: 259-261°С. Найдено, %: С 71.35; Н 5.32; N 3.38; О 11.75; S 8.17. C24H21NO3S. Вычислено, %: С 71.44; Н 5.25; N 3.47; О 11.90; S 7.95. ПМР-спектр: (Bruker DRX500, DMSO-D6, TMS, ИК-спектр: (UR-20, вазелиновое масло, Пример 2. 3-гидрокси-4-(2-тиофеноил)-5-(4-третбутилфенил)-1-фенил-3-пирролин-2-он. К раствору 1.67 мл (0.01 моль) 4-третбутилбензальдегида и 0.91 мл (0.01 моль) анилина в 10 мл уксусной кислоты добавляют раствор метилового эфира тиофеноилпировиноградной кислоты 2.12 г (0.01 моль) в 5 мл уксусной кислоты. Реакционную смесь подвергали кратковременному нагреванию, а затем выдерживали в течение 4-6 часов при комнатной температуре. Выпавший осадок отфильтровывали и перекристаллизовывали из этилового спирта. Получают 3.56 г (85.37%) соединения 2. Т.пл.: 285-287°С. Найдено, %: С 71.70; Н 5.38; N 3.72; О 11.93; S 7.51. С25Н23НО3S. Вычислено, %: С 71.92; Н 5.55; N 3.36; О 11.50; S 7.68. ПМР-спектр: (Bruker DRX500, DMSO-D6, TMS, ИК-спектр: (UR-20, вазелиновое масло, Пример 3. 3-гидрокси-5-(4-третбутилфенил)-1-фенил-4-(2- фураноил)-3-пирролин-2-он. К раствору 1.67 мл (0.01 моль) 4-третбутилбензальдегида и 0.91 мл (0.01 моль) анилина в 10 мл уксусной кислоты добавляют раствор метилового эфира фураноилпировиноградной кислоты 1.96 г (0.01 моль) в 5 мл уксусной кислоты. Реакционную смесь подвергали кратковременному нагреванию, а затем выдерживали в течение 4-6 часов при комнатной температуре. Выпавший осадок отфильтровывали и перекристаллизовывали из этилового спирта. Получают 3.23 г (80.55%) соединения 3. Т.пл.: 269°С. Найдено, %: С 74.91; Н 5.40; N 3.75; О 16.13. C25H23NO4. Вычислено, %: С 74.79; Н 5.77; N 3.49; О 15.94. ПМР-спектр: (Bruker DRX500, DMSO-D6, TMS, ИК-спектр: (UR-20, вазелиновое масло, Полученные соединения 1-3 были исследованы на наличие бактериостатической активности. Использовали метод последовательных разделений в мясопептонном бульоне (МПБ). При этом делали смыв суточной культуры, выращенной на мясопептонном агаре, стерильным физиологическим раствором хлорида натрия и изготовили исходное разделение с концентрацией 500 млн. микробных тел в 1 мл смыва по бактериальному стандарту. Полученную смесь разводили стерильным МПБ в 100 раз. Этот рабочий раствор (концентрация 5 млн микробных тел в 1 мл) в количестве 0.1 мл вносили в 2 мл МПБ. Бактериальная нагрузка на 1 мл жидкости составляла 250000 микробных тел. Результаты опытов учитывали после 18-20 ч выдержки контрольных и опытных культур в термостате при 36-37°С. За действующую дозу принимали минимальную ингибирующую концентрацию веществ (МИК) в мкг/мл, которая задерживает рост соответствующего тест-микроба. Бактериостатическую активность соединений 1-3 исследовали по отношению к двум штаммам микроорганизмов: Stafilokokkus Aureus и Esherihia Coli.
Из таблицы видно, что заявляемые соединения обладают бактериостатическим действием по отношению к St. Aureus в 8-16, а к Е. Coli в 128-256 раза более высоким, чем аналог. Таким образом, 5-арил-1-фенил-4-гетероил-3-гидрокси-3-пирролин-2-оны 1-3 обладают высокой бактериостатической активностью. Целесообразно дальнейшее изучение заявляемых соединений с целью разработки на их основе лекарственных средств с антимикробным действием.
Формула изобретения
5-арил-1-фенил-4-гетероил-3-гидрокси-3-пирролин-2-оны (1-3) формулы где 1 X=S, R=(СН3)2СН; 2 X-S, R=(СН3)3С; 3 Х=O, R=(СН3)3С, проявляющие противомикробную активность.
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 05.11.2005
Извещение опубликовано: 27.01.2007 БИ: 03/2007
|
||||||||||||||||||||||||||

 , м.д.): 1.05 (6Н, д, (СН3)2); 2.72 (1Н, кв., С(изопр)Н); 6.24 (1Н, с, С(5)Н); 7.03-8.05 (аром. и гетероцикл. протоны); 11.93 (1Н, с, ОН).
, м.д.): 1.05 (6Н, д, (СН3)2); 2.72 (1Н, кв., С(изопр)Н); 6.24 (1Н, с, С(5)Н); 7.03-8.05 (аром. и гетероцикл. протоны); 11.93 (1Н, с, ОН). , см-1): 1691 (лактамный С=O), 1601 (кетонный С=O), 3170 (ОН).
, см-1): 1691 (лактамный С=O), 1601 (кетонный С=O), 3170 (ОН).