Патент на изобретение №2257200
|
||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) ЛЕКАРСТВЕННОЕ СРЕДСТВО
(57) Реферат:
Изобретение относится к области медицины и фармакологии и касается лекарственного средства, обладающего противоопухолевым и иммуномодулирующим действием и содержащего тетраметильное, пентаметильное или гексаметильное производное три-n-аминотрифенилхлорметана или их смесь с декстрином. Средство обладает повышенной активностью и сниженным побочным действием. 2 н. и 11 з.п. ф-лы, 1 табл.
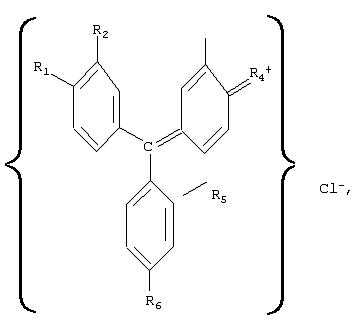
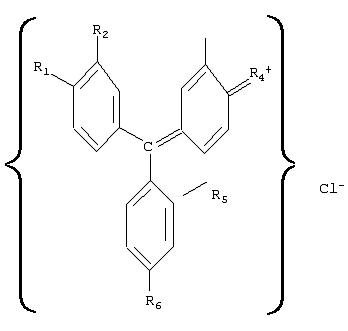
Предлагаемое изобретение относится к медицине, а именно к лекарственным противоопухолевым препаратам и к препаратам, воздействующим на иммунную систему. Известен лекарственный препарат “Адриамицин”, представляющий собой антибиотик группы антрациклинов и обладающий выраженной противоопухолевой активностью (см., например, М.Д.Машковский. Лекарственные средства. – М.: Медицина, 1985, т.2, с.460-461). Препарат применяют в виде раствора гидрохлорида строго внутривенно, так как при попадании раствора под кожу возможен некроз тканей. Кроме того, препарат обладает кардиотоксическим действием, может вызывать боли в области сердца, сердечную недостаточность, снижение артериального давления. Наиболее близким аналогом-прототипом является лекарственный препарат “Циклофосфан”, выпускаемый в виде белого кристаллического порошка, растворимого в воде (1:50), легко растворимого в спирте, трудно – в изотоническом растворе натрия хлорида (см., например, М.Д.Машковский. Лекарственные средства. – М.: Медицина, 1985, т.2, с.433-434). Этот препарат обладает относительно широким противоопухолевым спектром, а также является иммунодепрессивным средством, однако при его применении могут наблюдаться побочные явления, например головокружения, тошнота и рвота, часто через некоторое время после начала применения отмечается выпадение волос на голове. Предлагаемое изобретение решает задачу нахождения лекарственного средства, обладающего широким спектром воздействия без побочных явлений. Структурная формула три-n-аминотрифенилхлорметанов имеет вид: где, например, обозначено R1 При этом Methyl Violet 2В (тетраметил парарозанилина хлорид) – тетраметильная производная три-n-аминотрифенилхлорметана (в структурной формуле R6 Известны красители смесь метилвиолета с фуксином под названием “Далия фиолетовая” – зеленый кристаллический порошок, растворимый в воде и спирте, и смесь метилвиолета с равным количеством декстрина, названная “Генциана фиолетовая”, представляющая собой зеленый блестящий растворимый в воде порошок (см., например, “Вредные вещества в промышленности”, справочник, часть 1, “Органические вещества”, ГНТИ химической литературы, изд.4, Л., 1963, с.639). Известен декстрин, представляющий собой смесь полисахаридов и применяемый при выделке тканей (см., например, Н.Л.Глинка. Общая химия. М.: Химия, 1978, с.494). Сущность изобретения состоит в том, что лекарственное средство, обладающее иммуномодулирующими и противоопухолевыми свойствами, характеризуется тем, что оно содержит фармакологически приемлемые производные три-n-аминотрифенилхлорметана, имеющего структурную формулу: где, например, обозначено R1 При этом лекарственное средство содержит три-n-аминотрифенилхлорметан или в виде его тетраметильного производного, в структурной формуле которого R6 Кроме того, лекарственное средство содержит три-n-аминотрифенилхлорметан или в виде смеси его тетраметильного и пентаметильного производных при соотношении составляющих, об.%: тетраметильное производное 2,0-98,0; пентаметильное производное – остальное, или в виде смеси его тетраметильного и гексаметильного производных, при соотношении составляющих, об.%: тетраметильное производное 2,0-98,0; гексаметильное производное – остальное, или в виде смеси его пентаметильного и гексаметильного производных, при соотношении составляющих, об.%: пентаметильное производное 2,0-98,0; гексаметильное производное – остальное, или в виде смеси его тетраметильного, пентаметильного и гексаметильного производных, при соотношении составляющих, об.%: тетраметильное производное 1,5-97,0; пентаметильное производное 1,5-97,0; гексаметильное производное – остальное. Сущность изобретения состоит в том, что лекарственное средство, обладающее иммуномодулирующими и противоопухолевыми свойствами, характеризуется тем, что оно содержит смесь декстрина и фармакологически приемлемых производных три-n-аминотрифенилхлорметана в виде, например или тетраметильного, или пентаметильного, или гексаметильного производных, или смеси тетраметильного и пентаметильного производных, или смеси тетраметильного и гексаметильного производных, или смеси пентаметильного и гексаметильного производных, или смеси тетраметильного, пентаметильного и гексаметильного производных, при соотношении составляющих, об.%: соответствующая производная или соответствующая смесь соответствующих производных три-n-аминотрифенилхлорметана 10,0-95,5; декстрин – остальное. При этом смесь тетраметильного и пентаметильного производных три-n-аминотрифенилхлорметана выбрана при соотношении составляющих (для этой смеси), об.%: тетраметильное производное 2,0-98,0; пентаметильное производное – остальное, смесь тетраметильного и гексаметильного производных три-n-аминотрифенилхлорметана выбрана при соотношении составляющих (для этой смеси), об.%: тетраметильное производное 2,0-98,0; гексаметильное производное – остальное, смесь пентаметильного и гексаметильного производных три-n-аминотрифенилхлорметана выбрана при соотношении составляющих (для этой смеси), об.%: пентаметильное производное 2,0-98,0; гексаметильное производное – остальное, а смесь тетраметильного, пентаметильного и гексаметильного производных три-n-аминотрифенилхлорметана выбрана при соотношении составляющих (для этой смеси), об.%: тетраметильное производное 1,5-97,0; пентаметильное производное 1,5-97,0; гексаметильное производное – остальное. Лекарственные средства, содержащие фармакологически приемлемые производные три-n-аминотрифенилхлорметана, а также смесь декстрина и этих производных, оказывают противоопухолевое действие, которое сопровождается, например, установленным автором дисимметрирующим терапевтическим эффектом, который проявляется в различии температуры, измеряемой в разных точках тела, например, на 2-3° С через 0,5-2 часа после приема данного лекарственного средства и продолжительностью 3-4 часа (см., например, М.В.Кутушов. Рак. Исцеление возможно. С.-П.: Нева, 2003), а также обладают анаболической активностью, стимулируют клеточные и гуморальные факторы защиты организма. Механизм действия лекарственных средств, содержащих фармакологически приемлемые производные три-n-аминотрифенилхлорметана, основан на способности их ионов путем взаимодействия с фосфолипидами клеточных мембран нарушать равновесие трансмембранного ионного потенциала, приводящее к гибели клеток. Проведенные автором исследования показали также, что лекарственное средство является ингибитором ферментов митохондрий злокачественных клеток и вызывает гибель митохондрий раковых клеток, например, за счет подавления их NADPH-цитохром с-редуктазной активности, что ведет к блокировке энергии (см., например, Shumyantseva V.V., Uvarov V.Yu., Byakova O.E., Archakov, A.I. Biochem. Molec. Biol. Intern., 1996, №38, p.p.829-838). При этом было установлено, что эффективность действия лекарственного средства тем выше, чем больше сдвиг его спектра поглощения в сторону УФ-диапазона. Кроме того, оказалось, что включение в соответствующий препарат декстрина существенно снижает токсичность соответствующего лекарственного средства и соответственно расширяет диапазон дозировки его приема. Это подтверждено лабораторными исследованиями, а также обследованиями пациентов путем проведения анализа крови с целью проверки иммунологических показателей их (пациентов) лейкоцитарной и лимфоцитарной систем. Производные три-n-аминотрифенилхлорметана в виде их смеси с последующим выделением тетраметильных, пентаметильных и гексаметильных производных получают метилированием парафуксина йодистым метилом (см., например, А.Н.Несмеянов, Н.А.Несмеянов. Начала органической химии. – М.: Химия, 1974, книга 2, с.200), причем пентаметильную производную (основной фиолетовый К) можно получить также путем окисления диметиланилина в присутствии солей меди (см., например, Вредные вещества в промышленности. Справочник, часть 1, Органические вещества, ГНТИ химической литературы, изд.4, Л., 1963, с.639), а гексаметильную производную (кристаллический фиолетовый) в чистом виде получают конденсацией ди-(n-диметилоамино)-бензофенона (кетона Михлера) с диметиланилином и последующим подкислением (см., например, А.Н.Несмеянов, Н.А.Несмеянов. Начала органической химии. – М.: Химия, 1974, книга 2, с.200). Целевой продукт в виде пригодного для использования лекарственного средства получают за счет проведения соответствующей очистки полученных составов путем, например, перекристаллизации, а также с помощью адсорбционного хроматографирования путем пропускания в соответствующей хроматографической колонке водных растворов этих солей через слой сорбента, например через или целлюлозы для хроматографии, или бентонитовых глин. Декстрин получают путем нагревания сухого крахмала до (200-250)° С (см., например, Н.Л.Глинка. Общая химия. – М.: Химия, 1978, с.494). Требуемые смеси получают путем выбора соответствующих составляющих в заданных пропорциях. Выполненное в виде соответствующей или технической соли или химически чистой, или особой чистоты, или медикаментозной химически чистой, или медикаментозной особой чистоты лекарственное средство в соответствии с фармакопейными требованиями к лекарственным средствам (см., например, Федеральный закон РФ от 22.06.98 г. №86-ФЗ “О лекарственных средствах”, а также Отраслевой стандарт ОСТ 91500.05.001-00 “Стандарты качества лекарственных средств. Основные положения”, опубликованный в “Российской газете” от 28.11.2001 года) может быть введено пациенту с учетом степени очистки препарата внутривенно в изотоническом растворе натрия хлорида, перорально в капсулах, а также применяться в мазевых составах, в виде лекарственных клизм или в виде соответствующих свечей, причем его использование в указанных случаях не вызывает аллергических реакций и других побочных явлений, а эффективность (при лечении соответствующих заболеваний) в некоторых случаях выше, чем, например, у препарата, выбранного в качестве прототипа. Результаты исследований механизма действия предложенного лекарственного средства приведены в примерах 1-3, а возможность его применения для лечения подтверждается примерами 4-11. Пример 1. В пробирки (14 пробирок по 10 мл каждая) первой группы с культурой меланомы человека А 375 (human malignant melanoma) в буферном растворе введено лекарственное средство в разведении 10′7 ммоль/л соответственно в виде Methyl Violet 2В (тетраметильная производная три-n-аминотрифенилхлорметана), Methyl Violet 6B (пентаметильная производная три-n-аминотрифенилхлорметана), Methyl Violet 10B (гексаметильная производная три-n-аминотрифенилхлорметана), смесей (в равном соотношении составляющих) Methyl Violet 2B и Methyl Violet 6B, Methyl Violet 2B и Methyl Violet 10B, Methyl Violet 6B и Methyl Violet 10B, Methyl Violet 2B, Methyl Violet 6B и Methyl Violet 10B, смесей декстрина и этих солей, смесей декстрина и указанных смесей этих солей (в соотношении составляющих, об.%: декстрин – 50, соответствующая соль или соответственно смесь (в вышеуказанном соотношении) солей – остальное). Это же продублировано (также 14 пробирок по 10 мл каждая) для лекарственного средства в разведении 10-9 ммоль/л. В пробирки второй группы с помещенными в них фибробластами HFF (human forskm fibroblast) введено лекарственное средство в тех же вариантах и в таком же разведении. Кроме того, была сформирована третья (контрольная) группа пробирок (6 пробирок) с тем же пулом раковых клеток и с фибробластами, в которые введены в таком же разведении соответственно препараты адриамицин и циклофосфан, а также соответствующие пробирки, в которые введен физиологический раствор. После термостатирования вышеописанных пробирок в течение недели при температуре 37° С (в темноте) проведен анализ содержимого этих пробирок. Рассмотрение полученных результатов показало: В опытной группе с лекарственным средством в пробирках с разведением 10-7 ммоль/л наличие лекарственного средства угнетает пролиферацию клеток меланомы по сравнению с результатом пролиферации таких же клеток в пробирке с физиологическим раствором на (86-93)%, а пролиферацию фибробластов соответственно на (25-27)%, причем картина примерно одинакова для всех вариантов использованного лекарственного средства. При этом в пробирках контрольной группы с препаратом адриамицин отмечено уменьшение пролиферации клеток меланомы на 42%, с препаратом циклофосфан соответственно наблюдается уменьшение пролиферации клеток меланомы на 55%. В опытной группе с лекарственным средством в пробирках с разведением 10-9 ммоль/л наличие лекарственного средства угнетает пролиферацию клеток меланомы по сравнению с результатом пролиферации таких же клеток в пробирке с физиологическим раствором на (75-90)%, а пролиферацию фибробластов соответственно на (5-10)%, при этом в пробирках контрольной группы с препаратом адриамицин отмечено уменьшение пролиферации клеток меланомы на 30%, с препаратом циклофосфан соответственно наблюдается уменьшение пролиферации клеток меланомы на 35%. Полученные данные свидетельствуют о том, что предложенное лекарственное средство даже при чрезвычайно больших разведениях обладает выраженным противоопухолевым действием и более высокой активностью, чем известные противоопухолевые препараты, но при этом характеризуется слабым цитотоксическим эффектом к фитобластам. Пример 2. В пробирки (50 пробирок по 10 мл) опытной группы с “гладкими” микросомами раковых клеток MCF-7 (аденокарцинома молочной железы) в буферном растворе введено лекарственное средство в разведении 10-5 ммоль/л соответственно в виде смесей Methyl Violet 2В (тетраметильная производная три-n-аминотрифенилхлорметана) и Methyl Violet 6В (пентаметильная производная три-n-аминотрифенилхлорметана) в двух вариантах соотношений составляющих, об.%: 1. Methyl Violet 2В – 98,0; Methyl Violet 6B – остальное и 2. Methyl Violet 6B – 98,0; Methyl Violet 2B – остальное; Methyl Violet 2В и Methyl Violet 10B (гексаметильная производная три-n-аминотрифенилхлорметана) в двух вариантах соотношений составляющих, об.%: 1. Methyl Violet 2B – 98, остальное; Methyl Violet 6B и Methyl Violet 10B также в двух вариантах соотношений составляющих, об.%: 1. Methyl Violet 6В – 98,0; Methyl Violet 10B – остальное и 2. Methyl Violet 10B – 98,0; Methyl Violet 6B – остальное, смеси Methyl Violet 2B, Methyl Violet 6B и Methyl Violet 10B в четырех вариантах составляющих, об.%: 1. Methyl Violet 2B – 2,0; Methyl Violet 6B – 50,0 и Methyl Violet 10B – остальное; 2. Methyl Violet 2B – 50,0; Methyl Violet 6B – 2,0 и Methyl Violet 10B – остальное; 3. Methyl Violet 6B – 50,0; Methyl Violet 10B – 2,0 и Methyl Violet 2B – остальное; 4. Methyl Violet 2B – 20,0; Methyl Violet 6B – 25,0 и Methyl Violet 10B – остальное; а также смесей декстрина и этих солей, и указанных смесей этих солей (в вариантах вышеуказанного соотношения составляющих) в соотношении, об.%: декстрин – 10,0; 25,0; 75,0; 90,0; соответствующая соль или соответственно смесь солей – остальное). Это же продублировано для лекарственного средства в разведении 10-9 ммоль/л. В пробирки (10 мл) второй группы с помещенными в них микросомами печени крысы введено лекарственное средство в тех же вариантах и в таком же разведении. Кроме того, была сформирована третья (контрольная) группа пробирок с микросомами тех же пулов раковых клеток и печени крысы, в которые введены в таком же разведении соответственно препараты адриамицин и циклофосфан, а также соответствующие пробирки, в которые введен физиологический раствор. В пробирках групп определена концентрация цитохрома-С, которая составляет 50 мкМ для раковых микросом, и 20 мкМ для микросом из печени крысы. После термостатирования вышеописанных пробирок в течение 20 мин при температуре 25° С (в темноте) проведен анализ содержимого пробирок. Рассмотрение полученных результатов показало: В пробирках опытной группы концентрация цитохрома-с для пробирок с введенным лекарственным средством в виде смесей солей указанная концентрация определена в пределах 60 мкМ, а для пробирок с введенным лекарственным средством в виде смесей солей и декстрина указанная концентрация определена в пределах 65 мкМ. В пробирках с адриамицином и циклофосфаном концентрация цитохрома-с соответственно 40-45 мкМ. В пробирке с физиологическим раствором особых изменений концентрации цитохрома-с не отмечено. На микросомы печени крысы предложенные препараты не оказали ни какого влияния, концентрация цитохрома с во всех пробирках оставалась в пределах 19-20 мкМ. Полученные результаты дают основания считать, что предложенное лекарственное средство способствует высвобождению из мембран митохондрий раковых клеток “агрессивного” белка цитохрома-с, который, запуская механизм разрушения ДНК каспазами, вызывает апоптоз этих клеток (см., например, Wilson В.Е., Mochon E.A., Boxer L.M. Induction ofbcl-2 expression by phosphorylated CREB proteins during B-cell activation and rescue from apoptosis. Mol. CeU. Biol., 1996, v.16, p.p.5546-5556). Пример 3. На мышах породы В-57 проведена проверка реакции организма животного на введение лекарственного средства в виде солей Methyl Violet 2B, Methyl Violet 6В и Methyl Violet 10B, а также смесей этих солей с декстрином в двух вариантах соотношений соответствующей соли и декстрина, об.%: 1. декстрин – 5,0; соответствующая соль остальное и 2. декстрин – 95,0; соответствующая соль остальное. Опытная группа включала 60 мышей и была разбита на 6 подгрупп по 10 мышей в каждой, контрольная группа содержала 10 мышей, при этом подгруппы опытной группы и соответственно контрольная группа изолированы друг от друга, а мыши каждой подгруппы были пронумерованы соответственно от 1 до 10 путем нанесения соответствующих номеров красящим составом, в данном случае бриллиантовой зеленью. Опытная группа мышей в течение 10 дней получала лекарственное средство, соответственно 1-я подгруппа в виде смеси Methyl Violet 2B с декстрином в соотношении составляющих, об.%: декстрин – 2,0; Methyl Violet 2B – остальное, 2-я подгруппа в виде декстрин – 90,0; Methyl Violet 2B – остальное, 3-я подгруппа в виде декстрин – 5,0; Methyl Violet 6В – остальное, 4-я подгруппа в виде декстрин – 90,0; Methyl Violet 6В – остальное, 5-я подгруппа в виде декстрин – 5,0; Methyl Violet 10B – остальное, а 6-я подгруппа в виде декстрин – 90,0; Methyl Violet 10B – остальное, причем в каждой подгруппе мыши под номерами 1-8 получали соответствующий препарат в виде питья (в водном растворе), а мыши под номерами 9-10 – в виде инъекций в брюшину. При этом в каждой подгруппе мыши под номерами 1-2 получали соответствующий препарат в разовой дозе 2 мг, мыши под номерами 3-4 получали препарат в разовой дозе 5 мг, мыши под номерами 5-6 получали препарат в разовой дозе 10 мг, мыши под номерами 7-8 получали препарат в разовой дозе 20 мг, а мышам под номерами 9-10 инъекции соответствующего препарата проводили в разовой дозе 15 мг на 1 мл воды для инъекций. Мыши контрольной группы препарата не получали. Результаты: Через неделю после начала приема лекарственного средства различий в поведении животных четных подгрупп опытной группы и контрольной групп не наблюдается. Животные под номерами 5-6 нечетных подгрупп опытной группы малоподвижны, животные под номерами 7-8 нечетных подгрупп опытной группы погибли. Мыши с нечетными номерами во всех подгруппах забиты на 10 день, с четными номерами – на 21 день. Следы введения соответствующего лекарственного средства обнаружены в почках мышей с номерами 3-6 для нечетных подгрупп опытной группы, для мышей четных подгрупп следы введения лекарственного препарата обнаружены у мышей с номерами 5-8. При гистологии минимальное влияние лекарственного средства обнаружено при введении смеси, содержавшей Methyl Violet 10B (условное название О.Ф.2), наибольшее – для смеси, содержавшей Methyl Violet 2B. Отсюда с учетом весовых соотношений можно предположить, что для организма человека является приемлемой дозировка до 2,0 г разового приема данного лекарственного средства. Однако более точные данные могут быть получены только при проведении соответствующих исследований. Пример 4. Мышам породы В-57 опытной и контрольной групп (по 60 животных в каждой) привита меланома – 16. В опытной группе сформировано 6 подгрупп, в контрольной группе – три подгруппы по 10 мышей в каждой подгруппе. Мыши каждой подгруппы опытной группы в виде питья в разовой дозе по 5 мг получали лекарственное средство в виде водных растворов Methyl Violet 2B, Methyl Violet 6B и Methyl Violet 10B, а также смесей этих солей с декстрином в соотношении соответствующей соли и декстрина, об.%: 25:75 соответственно. Мыши 1-й и 2-й подгрупп контрольной группы в виде питья получали водные растворы соответственно адриамицина и циклофосфана в разовых дозах по 5 мг препарата, мыши 3-й подгруппы контрольной группы лекарственных препаратов не получали. Результаты: Из 60 мышей опытной группы на 36 день эксперимента выжили 39. При этом 11 мышей (4 из 1-й, по 3 из 2-й и 3-й подгрупп и 1 из 4 подгруппы) скончались на 19 день, 5 мышей (по 2 из 1 и 2-й подгрупп и 1 из 3-й подгруппы) – на 23 день и 5 мышей (2 из 1-й подгруппы и по 1 из 2, 4 и 5 подгрупп) на 34 день после начала эксперимента. Опухоли у 17 (1 из 1-й, 3 из 2-й, 1 из 3-й, по 4 из 4-й и 5-й подгрупп и 3 из 6-й подгруппы) выживших мышей размером примерно 0,2× 0,2 мм, у остальных мышей опухоли визуально не определялись. Выжившие мыши были забиты на 36 день эксперимента. При вскрытии у 9 мышей (1 из 1-й, 4 из 4-й и по 2 из 5-й и 6-й подгрупп) обнаружены единичные метастазы в легких, у 4 мышей из этих 9 (1 из 1-й, 2 из 4-й и 1 из 5-и подгрупп) также метастазы в печени. У остальных метастазы не обнаружены, внутренние органы без видимых изменений. Мыши 1-й и 2-й подгрупп контрольной группы. До 36 дня от начала эксперимента выжили 2 мыши 1-й и 5 мышей 2-й подгрупп. Опухоли в среднем 1,5× 1,5 см. При вскрытии отмечено поражение легких и печени. Мыши 3-й подгруппы контрольной группы скончались все на 10-12-20-25-й день. При осмотре – кровоточащие опухоли на спине, в среднем 2,5× 2,0 см. На гистологии тотальный лизис легких. Выводы: Лекарственное средство обладает противоопухолевой активностью, побочных действий не вызывает. Пример 5. Собака, 3 года, вес 16 кг. Диагноз: Неходжкинская лимфома. Состояние собаки тяжелое, одышка, кахексия. В области шеи опухоли – справа 7× 5 см, слева 11× 10 см. На рентгенограмме от 20.10.99 г. – множественные опухолевидные образования в средостении. Лечение лекарственным средством начато 30.10.99 г. Внутривенно капельно введено 500 мг Methyl Violet 2 В на 500 мл физиологического раствора. Через 3 дня внутривенное введение смеси Methyl Violet 2 В и Methyl Violet 6 В (по 250 мг каждого) на 500 мл физиологического раствора, а также начат прием (per os) no 2 раза в день с едой в порошке смесь декстрина и Methyl Violet 2 В, Methyl Violet 6 В и Methyl Violet 10B (в разовой дозе 200 мг по 50 мг каждой составляющей). Через неделю повторное в/в введение смеси Methyl Violet 2 В и Methyl Violet 6 В, прием вышеуказанной смеси (с декстрином) per os продолжен. Через две недели после начала лечения отмечено улучшение общего состояния, биохимических и клинических показателей крови. Через 3 недели видимые опухоли уменьшились примерно в 2,5 раза. Процедуры в/в введения смеси Methyl Violet 2 В и Methyl Violet 6 В проводились еженедельно в течение 3-х месяцев, прием вышеуказанной смеси (с декстрином) per os сокращен до одного в день. При обследовании после проведенного курса лечения состояние животного хорошее, вес 19,5 кг, опухоли на шее не определяются. Анализы крови без патологии. На рентгенограмме от 02.02.2000 единичные мелкие метастазы в легких. Пример 6. Собака, 6 лет, вес 21 кг. Диагноз: Саркома правого предплечья, метастазы в легкие. На рентгенограмме от 10.07.2002 г. – разрушение надкостницы и 1-7 ребер справа, множественные метастазы в обеих легких, опухоль 10× 15× 12 см. Лечение начато 12.07.2002 г. Внутривенно через день по 2 мл разведенного в 250 мл 0,9% раствора NaCl в воде 50 мг Methyl Violet 10B (условное обозначение О.Ф.2). Ежедневно на опухоль накладывались мазевые повязки (2% Methyl Violet 10B, детский крем – остальное). Через 3 недели после начала лечения опухоль – 7× 7× 3 см, состояние стабильное, еще через 2 недели состояние животного удовлетворительное, на рентгенограмме капсулизированная опухоль 2× 2,5× 1 см, в ребрах и легких следы метастазов. Пример 7. Больная И., 35 лет. Обратилась в ноябре 2002 года. В 2001 году проведена экстирпация матки и придатков в соответствии с выявленным раком правого яичника. На компьютерной томограмме от 28.08.02 рецидив – опухоль 8,6× 9,8× 14 см с прорастанием в мочевой пузырь и прямую кишку. Проведено лечение клизмами в прямую кишку по схеме: в течение первых пяти дней по 1-му разу каждый день, затем через 5 процедур через день, а потом 15 клизм по 1 разу в 3 дня. Разовая доза -20 мг данного лекарственного средства (О.Ф.2), предварительно растворенного в 2-х мл 70(этилового спирта, на 15-20 мл воды. Спустя две недели после начала лечения по результатам УЗИ – опухоль 3,8× 4,2× 3,1 см с ровными контурами, опухоль со стороны прямой кишки отошла от ее стенки, деформация стенки мочевого пузыря незначительная. После проведенного курса лечения по УЗИ – опухоль 1,3× 2,0× 1,6 см, капсулизирована, стенки капсулы до 0,5 см. Жалоб нет. Было рекомендовано продолжить лечение с перерывами между курсами (1,0-1,5) месяца. На контрольном УЗИ от 02.03.2004 г. опухоль не определяется. Анализ крови до начала лечения: Лейкоциты до 10 тысяч, эритроциты – 2,5 млн, тромбоциты – 110 тысяч единиц. Анализ крови после окончания курса лечения: Лейкоциты – 9 тысяч, эритроциты – 5,5 млн, тромбоциты – 300 тысяч единиц. Пример 8. Больной Р., 62 года. Диагноз: Папиллярная форма рака щитовидной железы. При обращении: по результатам УЗИ – опухоль в правой доле 5× 3× 1,7 см. Проведено лечение лекарственным средством (О.Ф.2) в течение 2-х недель: 2 раза в день после еды перорально по 1 капсуле с оболочкой из желатина, содержащей 20 мг препарата, и ежедневно лечебные клизмы в разовой дозе до 100 мл раствора, включающего 50 мг порошка лекарственного препарата, растворенного в 2 мл 70(этилового спирта, а затем разведенного в 100 мл водного раствора 0,9% NaCl. В течение первых 7 дней лечения у больного через 3 часа после приема препарата отмечался диссимметрирующий эффект, который выражался резким ознобом и на протяжении (1,0-1,5) часов разницей температур правой и левой половин тела, соответственно (35,4-36,9)° С и (37,3-38,6)° . При дальнейшем приеме препарата вышеотмеченные различия в температуре практически исчезли. После проведения курса по результатам УЗИ – первичная опухоль и метастазы не определяются. При контрольном обследовании через два месяца состояние удовлетворительное, жалоб нет. Пример 9. Больная Щ., 18 лет. В сентябре 2002 года обнаружена опухоль (2× 2,5× 2) см3 правой молочной железы. Маммография: фиброзно-кистозная мастопатия правой молочной железы. Биопсия: обнаружены атипичные клетки. Назначено смазывание 2-3 раза в день области нахождения опухоли мазевым составом, включающим лекарственное средство (О.Ф.2) – порошок и мазевую основу (детский крем) в соотношении составляющих, об%: 10% – лекарственного препарата и 90% – детского крема. Через 1,5 месяца лечения повторная биопсия: атипичные клетки не обнаруживаются, опухоль практически не прощупывается. Пример 10. Больной Ю., 48 лет. Диагноз: Аденокарциома прямой кишки с метастазами в печени. В апреле 1999 года произведена колонэктомия с выведением калостомы. Проводилась профилактическая химиотерапия, из-за неэффективности которой (появление болей в области живота, периодическая рвота, общая слабость) в августе 2002 года обратился за помощью. При поступлении: на КТ от 21.09.2002 в области селезеночного угла определяется опухолевидное образование 7,0× 5,5 см с неровными контурами, а также метастазы в правой доле печени. Проведено лечение – перорально в течение 10 дней разведенная в 100 мл воды смесь декстрина и Methyl Violet 2 В, Methyl Violet 6 В и Methyl Violet 10 В (в соотношении составляющих, об.%: декстрин – 25,0; Methyl Violet 2 B-30,0; Methyl Violet 6 B – 30,0; Methyl Violet 10 В (О.Ф.2) – 15,0) по 1,0 г по 2 раза в день за 30 минут до еды, а также в калостому утром и вечером 0,5 г препарата О.Ф.2, разведенного в 50 мл воды. Кроме того, для повышения эффективности лечения и с согласия пациента ему назначено еженедельное в/в введение 500 мл 1% раствора препарата О.Ф.2. Курс лечения продолжался 3 месяца. После проведенного курса лечения состояние пациента удовлетворительное, на КТ опухоли в брюшной полости и метастазы в печени не определяются, основные показатели крови по результатам клинических и биохимических анализов в норме. Пример 11. Больная П. 25 лет. Обратилась 23.07.1999 г. с жалобами на тотальное облысение – потерю волос на всем теле, периодическую слабость и депрессии. Облысение началось после перенесенного гриппа, 6 лет назад с ресниц и бровей, затем через полгода появились очаги облысения на волосистой части головы. В течение 2-х лет проводилось лечение гормонами, а также местное мазевое лечение. Из анамнеза удалось выяснить, что в возрасте 7 лет переболела ОРЗ и через неделю ветрянкой, что, по-видимому, и послужило началом латентно протекавшего аутоиммунного заболевания. Диагноз: Аутоиммунное заболевание, осложненное тотальной аллопецией. Диагноз подтвержден данными анализов крови по клеточному и гуморальному иммунитету. Проведено два курса лечения с помощью лекарственного средства. Первый курс – в течение 3-х месяцев прием смеси декстрина с Methyl Violet 2B, Methyl Violet 6B и Methyl Violet 10B в соотношении декстрина и соответствующей соли, об.%: 25:25:25:25 по схеме: 0,2 мл 1% водного раствора 2 раза в сутки за 30 мин до еды. Через 3 недели после начала лечения появились ноющие боли в проекции почек. Это было расценено нами как реакция надпочечников на подавление препаратом фиксированных гиперактивных макрофагов. КТ органов брюшной полости, почек и надпочечников показала, что правый и левый надпочечники несколько увеличены в размерах и деформированы. Лечение было продолжено, и через неделю боли в проекции почек исчезли. Через 2 месяца после начала лечения появились пушковые волосы на голове и ногах. После окончания первого курса лечения был сделан двухмесячный перерыв, а затем в течение 2-х месяцев проведен дополнительный курс, включавший прием Methyl Violet 10B (О.Ф.2) по схеме 0,5 мл 1% водного раствора 2 раза в сутки за 30 мин до еды. Через год после лечения, волосы на голове достигли нормальной толщины и структуры. В настоящее время выпадения волос нет. На контрольной КТ от 12.03.2003 г. надпочечники не увеличены, треугольной формы. Анализы крови в норме. Результаты исследования клеточного и гумморального иммунитета приведены в таблице:
Формула изобретения
1. Лекарственное средство, обладающее противоопухолевым и иммуномодулирующим действием, характеризующееся тем, что оно содержит фармакологически приемлемые производные три-n-аминотрифенилхлорметана, имеющего структурную формулу где, например, обозначено R1 2. Лекарственное средство по п.1, характеризующееся тем, что оно содержит три-n-аминотрифенилхлорметан в виде его тетраметильного производного, в структурной формуле которого R6 3. Лекарственное средство по п.1, характеризующееся тем, что оно содержит три-n-аминотрифенилхлорметан в виде его пентаметильного производного, в структурной формуле которого R6 4. Лекарственное средство по п.1, характеризующееся тем, что оно содержит три-n-аминотрифенилхлорметан в виде его гексаметильного производного, в структурной формуле которого R6 5. Лекарственное средство по пп.1-3, характеризующееся тем, что оно содержит три-n-аминотрифенилхлорметан в виде смеси его тетраметильного и пентаметильного производных при соотношении, об.%: тетраметильное производное – 2-98; пентаметильное производное – остальное. 6. Лекарственное средство по пп.1-3, характеризующееся тем, что оно содержит три-n-аминотрифенилхлорметан в виде смеси его тетраметильного и гексаметильного производных при соотношении, об.%: тетраметильное производное – 2-98; гексаметильное производное – остальное. 7. Лекарственное средство по пп.1, 3 и 4, характеризующееся тем, что оно содержит три-n-аминотрифенилхлорметан в виде смеси его пентаметильного и гексаметильного производных при соотношении, об.%: пентаметильное производное – 2-98; гексаметильное производное – остальное. 8. Лекарственное средство по пп.1-4, характеризующееся тем, что оно содержит три-n-аминотрифенилхлорметан в виде смеси его тетраметильного, пентаметильного и гексаметильного производных при соотношении, об.%: тетраметильное производное – 2-98; пентаметильное производное – 2-98; гексаметильное производное – остальное. 9. Лекарственное средство, обладающее противоопухолевым и иммуномодулирующим действием, характеризующееся тем, что оно содержит смесь декстрина и фармакологически приемлемых производных три-n-аминотрифенилхлорметана в виде, например, или тетраметильного, или пентаметильного, или гексаметильного производного, или смеси тетраметильного и пентаметильного производных, или смеси тетраметильного и гексаметильного производных, или смеси пентаметильного и гексаметильного производных, или смеси тетраметильного, пентаметильного и гексаметильного производных при соотношении, об.%: соответствующая производная или соответствующая смесь соответствующих производных три-n-аминотрифенилхлорметана – 10-95; декстрин – остальное. 10. Лекарственное средство по п.9, характеризующееся тем, что смесь тетраметильного и пентаметильного производных три-n-аминотрифенилхлорметана выбрана при соотношении, об.%: тетраметильное производное – 2-98; пентаметильное производное – остальное. 11. Лекарственное средство по п.9, характеризующееся тем, что смесь тетраметильного и гексаметильного производных три-n-аминотрифенилхлорметана выбрана при соотношении, об.%: тетраметильное производное – 2-98; гексаметильное производное – остальное. 12. Лекарственное средство по п.9, характеризующееся тем, что смесь пентаметильного и гексаметильного производных три-n-аминотрифенилхлорметана выбрана при соотношении, об.%: пентаметильное производное – 2-98; гексаметильное производное – остальное. 13. Лекарственное средство по п.9, характеризующееся тем, что смесь тетраметильного, пентаметильного и гексаметильного производных три-n-аминотрифенилхлорметана выбрана при соотношении, об.%: тетраметильное производное – 2-98; пентаметильное производное – 2-98; гексаметильное производное – остальное.
PC4A – Регистрация договора об уступке патента Российской Федерации на изобретение
(73) Патентообладатель(и):
(73) Патентообладатель:
(73) Патентообладатель:
Дата и номер государственной регистрации перехода исключительного права: 25.09.2008 № РД0041289
Извещение опубликовано: 10.11.2008 БИ: 31/2008
|
||||||||||||||||||||||||||||||||||||||||||||||||||||

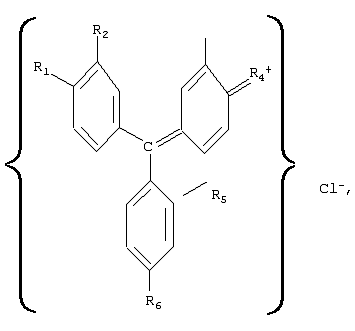

 N(CH3)2, R3
N(CH3)2, R3