|
|
(21), (22) Заявка: 2003113043/13, 05.05.2003
(24) Дата начала отсчета срока действия патента:
05.05.2003
(43) Дата публикации заявки: 27.11.2004
(45) Опубликовано: 20.07.2005
(56) Список документов, цитированных в отчете о
поиске:
RU 2196987 С2, 20.01.2003. Ф.Г.ХЕЙХОУ. Гематологическая цитохимия. Лабораторные методы., М.; “Медицина”, 1983, с.143-144. З.ЛОЙДА. Гистохимия ферментов. Лабораторные методы. М.; “Мир”, 1982, с.142-143.
Адрес для переписки:
350044, г.Краснодар, ул. Калинина, 13, КГАУ, ПИО
|
(72) Автор(ы):
Гугушвили Н.Н. (RU),
Мирцхулава В.М. (RU),
Плотников С.А. (RU),
Радуль Н.П. (RU),
Шахбалаев К.Б. (RU),
Киракосян М.Р. (RU)
(73) Патентообладатель(и):
Кубанский государственный аграрный университет (RU)
|
(54) СПОСОБ ОПРЕДЕЛЕНИЯ АКТИВНОСТИ КИСЛОЙ ФОСФАТАЗЫ В МАЗКАХ ГЕМОЛИМФЫ У ПЧЕЛ
(57) Реферат:
Способ относится к области ветеринарной медицины, в частности биохимии. Способ заключается в обработке мазков буферной смесью, промывании дистиллированной водой, высушивании, дополнительном окрашивании 0,5% раствором метиленовым синим, промывании, высушивании и определении активности фермента по количеству окрашенных гранул. Способ позволяет расширить технологические возможности в области иммунологических исследований. 5 ил., 1 табл.
Изобретение относится к области ветеринарной медицины, в частности иммунологии пчел.
В настоящее время иммунитет является актуальной проблемой в пчеловодстве. Для диагностики иммунитета определяют микробицидные свойства системы гемолимфы путем определения кислой фосфатазы в платоцитах.
Активность кислой фосфатазы присуща молодым клеткам. По повышению или понижению активности кислой фосфатазы в той или иной степени можно судить о патологическом процессе в организме пчел.
Известно определение кислой фосфатазы в тканях [см. Gomori (1952 г.) Ф.Г.Дж.Хейхоу, Д.Кваглино. Гематологическая цитохимия. Лабораторные методы. Пер. с англ. Е.В.Самочатовой, под ред. проф. Н.С.Кисляк, Москва, “Медицина”, 1983, стр.144-145] на гистологических срезах.
Также известен способ определения кислой фосфатазы в мазках крови и костного мозга человека (см. патент РФ №2196987, G 01 N 33/48, 2003), включающий подготовку биологического субстрата, обработку его буферно-инкубационной смесью с рН, равной 5.0, инкубацию биологического субстрата осуществляют в темноте 2 часа при температуре 37° С, промывают дистиллированной водой, высушивают, дополнительно окрашивают мазки биологического субстрата в течение 0,5-1 мин, затем промывают дистиллированной водой, сушат и по количеству окрашенных гранул в цитоплазме в биологическом субстрате определяют процент активности фермента кислой фосфатазы, микроскопируют и по степеням окрашенности определяют средний цитохимический индекс.
Недостатками данного метода являются ограниченные возможности, поскольку нельзя определить активность кислой фосфатазы в тканях пчел.
Техническим решением задачи является расширение технологических возможностей в области иммунологических исследований.
Поставленная задача достигается тем, что в способе определения активности кислой фосфатазы в мазках гемолимфы у пчел, включающем подготовку биологического субстрата, обработку его буферно-инкубационной смесью с рН равной 5.0, инкубацию биологического субстрата в темноте 2 часа при температуре 37° С, промывание дистиллированной водой, высушивание, дополнительное окрашивание мазков биологического субстрата в течение 0,5-1 мин, затем промывание дистиллированной водой, высушивание и определение по количеству окрашенных гранул в цитоплазме в биологическом субстрате процента активности фермента кислой фосфатазы, микроскопирование и определение по степеням окрашенности среднего цитохимического индекса, в качестве биологического субстрата используют мазки гемолимфы пчел, для приготовления буферной смеси используют 35-40 мл 0,1 М раствор лимонной кислоты – цитрат натрия С6Н8O7· Н2O и 60-65 мл 0,1 М раствор дигидрат тринатриевой соли С6Н8O7Nа3· 2Н2O, в который добавляют 12 мг ЭДТА (этилендиаминтетрауксусная кислота), для обеспечения рН 4,8-5,0, а затем в инкубационную смесь добавляли 1,5 мл буферной смеси для обеспечения рН 5,0. При этом инкубацию проводят в темноте 2 часа при температуре 37° С, промывают дистиллированной водой, высушивают, дополнительно окрашивают мазки крови краской 0,5% водным раствором метиленовым синим в течение 0,5-1 минуты, затем промывают дистиллированной водой, сушат и по количеству окрашенных гранул в цитоплазме платоцитов в красно-коричневый цвет, мембрана – в сине-фиолетовый, ядра клеток докрашены в голубой цвет, определяют активность фермента кислой фосфатазы по среднему цитохимическому индексу.
Активность кислой фосфатазы присуща зрелым клеткам у теплокровных животных, а у пчел, по нашим исследованиям, присуща как молодым платоцитам, так и зрелым. Определение активности кислой фосфатазы в мазках гемолимфы имеет важное значение в диагностике иммунобиологической реактивности организма пчел в разные физиологические периоды. Снижение иммунитета влечет за собой нарушение гомеостаза организма и вытекающих из него последствий: снижение сохранности жизнеспособности, как взрослых пчел, так и молодняка, работоспособности, репродуктивной способности и т.д.
Новизна заявляемого способа обусловлена тем, что повышается возможность определения активности кислой фосфатазы в платоцитах гемолимфы у пчел наиболее быстрым и точным по сравнению с известным методом определения щелочной фосфатазы в сыворотке крови у теплокровных животных, как с научной, так и с экономической стороны. Фермент поступает из тканей в форменные элементы гемолимфы и локализуется в цитоплазме платоцитов и в их мембране в виде гранул и во всей цитоплазматической жидкости. Данный способ может быть экспресс-методом для проведения цитохимического анализа активности кислой фосфатазы в платоцитах гемолимфы пчел. Применение методики основано на взаимодействии кислой фосфатазы с  -нафтилфосфатом натрия. Фосфатаза катализирует гидролиз -нафтилфосфатом натрия. Фосфатаза катализирует гидролиз  -нафтилфосфата натрия с образованием -нафтилфосфата натрия с образованием  -нафтола и фосфорнокислого двузамещенного натрия. Для активации кислой фосфатазы в систему вводили буферную смесь, предложенную нами, состоящую из лимонной кислоты, которая является естественным субстратом клеточных ферментов, участвующую в основном при внутриклеточном дыхании в синтезе АТР, а фосфатазы катализируют процессы с участием АТР. В буферную смесь также входит 0,1 М раствор дигидрат тринатриевая соль С6Н8О7Nа3· 2Н2О и трилон Б (ЭДТА), который ингибирует щелочную фосфатазу, -нафтола и фосфорнокислого двузамещенного натрия. Для активации кислой фосфатазы в систему вводили буферную смесь, предложенную нами, состоящую из лимонной кислоты, которая является естественным субстратом клеточных ферментов, участвующую в основном при внутриклеточном дыхании в синтезе АТР, а фосфатазы катализируют процессы с участием АТР. В буферную смесь также входит 0,1 М раствор дигидрат тринатриевая соль С6Н8О7Nа3· 2Н2О и трилон Б (ЭДТА), который ингибирует щелочную фосфатазу,  -нафтол взаимодействует с красителем – нейтральным прочным синим В с образованием комплексного соединения азокрасителя. Образовавшийся комплекс (азокраситель) комплекс (азокраситель) окрашивает, кислую фосфатазу, содержащуюся внутри в виде гранул в цитоплазме платоцитов. -нафтол взаимодействует с красителем – нейтральным прочным синим В с образованием комплексного соединения азокрасителя. Образовавшийся комплекс (азокраситель) комплекс (азокраситель) окрашивает, кислую фосфатазу, содержащуюся внутри в виде гранул в цитоплазме платоцитов.
Предложенный способ показывает непосредственное содержание изучаемого фермента в платоцитах гемолимфы у пчел. По активности кислой фосфатазы определяют состояние микробицидных систем гемолимфы, принимающих участие в формировании неспецифической резистентности организма пчел. Определяется активность кислой фосфатазы в платоцитах гемолимфы по четырем ступеням.
Сущность изобретения поясняется чертежами, где представлены окрашенные гранулы по степеням: фиг.1. 0-я – степень; фиг.2. 1-я степень; фиг.3. – 2я степень; фиг.4. – 3-я степень; фиг.5. – 4-я степень.
Пример конкретного осуществления способа определения активности кислой фосфатазы в мазках гемолимфы пчел
Подготовка мазков гемолимфы и фиксация
Для исследования гемолимфу у пчел берут из сердца, для этого (чтобы ток гемолимфы не замедлился) пчел берут пинцетом и помещают на кусочек паролона, придерживают их пальцами левой руки, затем стерильным тончайшим стеклянным капилляром (диаметром не более 10 мкм) делают прокол по центру спинной части брюшка между 5-и и 6-м тергитом под углом 10-15 градусов, чтобы капилляр попал в сердце пчелы. Капилляр опускают вглубь до появления в нем прозрачной жидкости (гемолимфы), заполнение капилляра происходит самотоком.
Из гемолимфы делают мазок. Для этого каплю гемолимфы наносят на край сухого обезжиренного стекла, которое удерживают между большим и средним пальцами левой руки. Впереди капли под углом 45° подводят шлифованный край покровного стекла так, чтобы образовавшейся угол между стеклами был равномерно заполнен гемолимфой. Движением правой руки от себя каплю распределяют тонким слоем по предметному стеклу, хорошим без просветов, в виде равномерной полоски, не выходящей за ее края. Мазки с гемолимфой сушат на воздухе и фиксируют в парах 40% формалина в течение 3-5 минут. Для этого на дно эксикатора наливают около 150 мл формалина, оставляют под закрытой крышкой на 30 минут для возгонки паров формалина. Затем осторожно снимают крышку и на решетку эксикатора помещают мазки и закрывают крышкой. Таким образом, мазки фиксируются.
Приготовление буферных растворов
Вначале проводили калибровку иономера рН – 150. В состав буферной смеси входили 35-40 мл 0,1М раствор лимонной кислоты – цитрат натрия С6Н8О7· Н2О и 60-65 мл 0,1М раствор дигидрат тринатриевой соли C6H8O7Na3· 2H2O, в который добавляют 12 мг ЭДТА (этилендиаминтетрауксусная кислота), для обеспечения рН 4,8-5,0.
Приготовление инкубационной смеси
Правильное приготовление инкубационной смеси имеет немаловажное значение для дальнейшей окраски мазков. Готовить инкубационную смесь желательно в затемненной комнате. Для ее приготовления готовят раствор 1 и 2.
Приготовление раствора 1
 -нафтилфосфата натрия берут 4,0-4,2 мг, оптимальным количеством -нафтилфосфата натрия берут 4,0-4,2 мг, оптимальным количеством  -нафтилфосфата является 4,0 мг. Для растворения добавляли 1,6 мл дистиллированной воды и 1,3 мл ацетона с добавлением 1,5 мл буферной смеси небольшими порциями, помешивая. -нафтилфосфата является 4,0 мг. Для растворения добавляли 1,6 мл дистиллированной воды и 1,3 мл ацетона с добавлением 1,5 мл буферной смеси небольшими порциями, помешивая.
Приготовление раствора 2
Берут 5 мг красителя нейтрального прочного синего В и растворяют его в 5 мл буферной смеси, смешивая их постепенно (рН 5,0). Полученные растворы 1 и 2 смешивают, фильтруют в темноте желательно через стеклянный фильтр.
Инкубация мазков гемолимфы
На фиксированные формалином мазки гемолимфы наносят равномерным слоем инкубационную смесь и помещают во влажную камеру, которая готовится следующим образом: для этого берут стерильную чашку петрии на дно, которой кладут хорошо смоченную дистиллированной водой фильтровальную бумагу и на нее помещают мазки гемолимфы и закрывают крышкой чашки Петри. Такая влажная камера не дает возможности испарению инкубационной, смеси включающая в себя легколетучее вещество ( -нафтол) за время инкубации, а также позволяет строго соблюдать температурный режим (18-20° С) в термостате, т.к. фермент активен при заданной температуре и экономии инкубационной смеси. -нафтол) за время инкубации, а также позволяет строго соблюдать температурный режим (18-20° С) в термостате, т.к. фермент активен при заданной температуре и экономии инкубационной смеси.
Инкубацию мазков проводят в темноте 2 часа при температуре 37°С, промывают дистиллированной водой, высушивают, дополнительно окрашивают мазки из гемолимфы краской 0,5% водным раствором метиленовым синим в течение 0,5-1 минуты, затем промывают дистиллированной водой, сушат и по количеству окрашенных гранул в цитоплазме платоцитов в красно-коричневый, мембрана – в сине-фиолетовый, ядра клеток докрашены в голубой цвет, определяют активность фермента кислой фосфатазы по среднему цитохимическому индексу.
Микроскопия мазков
Микроскопия проводят с использованием иммерсионной системы при увеличении (90× 15).
Результаты полученных данных при микроскопии мазков:
Активность кислой фосфатазы определяют и по количеству окрашенных гранул в цитоплазме платоцитов в красно-коричневый, мембрана – в сине-фиолетовый, ядра клеток докрашены в голубой цвет, определяют активность фермента кислой фосфатазы по среднему цитохимическому индексу.
Визуально проводят оценку цитохимической реакции:
0-я степень – окрашено только ядро в голубой цвет, цитоплазма не окрашена, контуры мембраны слабо окрашены в серо-фиолетовый цвет;
1-я степень вся цитоплазма диффузно окрашена в красно-коричневый цвет, контуры мембраны окрашены в сине-фиолетовый цвет, ядро – в голубой цвет;
2-я степень – в цитоплазме видны хорошо окрашенные гранулы в красно-коричневый цвет, окрашено более 1/4 цитоплазмы, контуры мембраны интенсивно окрашены в сине-фиолетовый цвет, в голубой цвет;
3-я – степень всю цитоплазму занимают гранулы, окрашенные в красно-коричневый цвет, но ядро свободно, 3/4 и более цитоплазмы контуры мембраны интенсивно окрашены в сине-фиолетовый цвет, в голубой цвет;
4-я степень – гранулы занимают всю цитоплазму и наслаиваются на ядро, окрашены в красно-коричневый цвет, контуры мембраны интенсивно окрашены в сине-фиолетовый цвет, в голубой цвет. Средний цитохимический индекс выводят по следующей формуле:
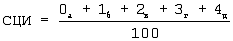
предварительно подсчитывая 100 платоцитов,
где а, б, в, г, д – количество клеток соответственно 0,1,2,3,4-ой степени.
Пример расчета среднего цитохимического индекса у пчел Серой горной кавказской породы:
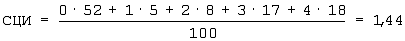
При расчете данного примера неактивных платоцитов, т.е. нулевых (0), было подсчитано в мазке гемолимфы в количестве 52 клеток, первой степени – 5, второй степени – 8 клеток, третьей степени – 17 клеток, четвертой степени – 18 клеток.
Таблица 1
Активность кислой фосфатазы в мазках гемолимфы у пчел (М±m; n=10) |
| Породы пчел |
Средний цитохимический индекс |
| Итало-карпатская помесь первою поколения |
2,2710,01 |
| Карпатская порода |
2,50±0,05 |
| Приокская |
1,82±0,08 |
| Серая горная кавказская |
1,44±0,02 |
Данная методика позволяет экспресс-методом определить микробицидные свойства системы гемолимфы, в частности определения активности кислой фосфатазы в платоцитах гемолимфы. Определение активности кислой фосфатазы в мазках гемолимфы является одним из важных тестов диагностики иммунитета организма пчел. Концентрация содержания фермента кислой фосфатазы указывает на состояние иммунного статуса и общее клиническое состояние организма. Чем выше показатели среднего цитохимического индекса кислой фосфатазы, тем выше ее активность, что указывает на высокий уровень иммунного статуса организма пчел. При снижении активности кислой фосфатазы, т.е. отсутствии или незначительном количестве 3 и 4-й степени активности платоцитов, указывает на снижение иммунного статуса организма, что способствует развитию или предрасположенности к различным заболеваниям и тем самым снижается жизнеспособность пчел.
Формула изобретения
Способ определения активности кислой фосфатазы в мазках гемолимфы у пчел, включающий подготовку мазков биологического субстрата, обработку их буферной смесью, для приготовления которой используют 35-40 мл 0,1 М раствор цитрата натрия и 60-65 мл 0,1 М раствор дигидрат тринатриевой соли, с добавлением 12 мг ЭДТА для достижения рН 4,8-5,0, инкубацию в темноте 2 ч при температуре 37°С, промывание дистиллированной водой, высушивание, дополнительное окрашивание мазков краской 0,5%-ным водным раствором метиленовым синим в течение 0,5-1 мин, последующее промывание дистиллированной водой, высушивание и определение активности фермента кислой фосфатазы по количеству окрашенных гранул в цитоплазме платоцитов.
РИСУНКИ
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 06.05.2005
Извещение опубликовано: 20.02.2007 БИ: 05/2007
|
|