|
|
(21), (22) Заявка: 2003136646/13, 19.12.2003
(24) Дата начала отсчета срока действия патента:
19.12.2003
(45) Опубликовано: 10.07.2005
(56) Список документов, цитированных в отчете о
поиске:
WO 02092803, 21.11.2002. US 5629193, 13.05.1997. NZ 529519, 19.12.2003.
Адрес для переписки:
119992, Москва, ГСП-2, Ленинские горы, 1, стр.3, Химический факультет МГУ им. М.В. Ломоносова, кафедра химической энзимологии, Е.Н.Ефременко
|
(72) Автор(ы):
Ефременко Е.Н. (RU),
Вотчицева Ю.А. (RU),
Алиев Т.К. (RU),
Варфоломеев С.Д. (RU)
(73) Патентообладатель(и):
Химический факультет МГУ им. М.В. Ломоносова (Химфак МГУ) (RU)
|
(54) РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК PTES-HIS-OPH, КОДИРУЮЩАЯ ПОЛИПЕПТИД СО СВОЙСТВАМИ ОРГАНОФОСФАТГИДРОЛАЗЫ, И ШТАММ БАКТЕРИЙ E.COLI – ПРОДУЦЕНТ ПОЛИПЕПТИДА СО СВОЙСТВАМИ ОРГАНОФОСФАТГИДРОЛАЗЫ
(57) Реферат:
Изобретение относится к генной инженерии и может быть использовано для гидролиза фосфорорганических соединений. Сконструирована рекомбинантная плазмидная ДНК pTES-His-OPH для экспрессии полипептида со свойствами орагнофосфатгидролазы, включающая ClaI/Hind III фрагмент плазмиды pTrcTEGF, фрагмент плазмиды pTES-ОРН, имеющий нуклеотидную последовательность, которая кодирует аминокислотную последовательность зрелой формы органофосфатгидролазы, и нуклеотидную последовательность, кодирующую 6 остатков гистидина, которая располагается на 5-конце нуклеотидной последовательности, кодирующей органофосфатгидролазу. На основе указанной плазмиды получен штамм Escherichia coli ЦКМИБХ-29 – продуцент полипептида со свойствами органофосфатгидролазы. Использование предложенного изобретения позволяет по упрощенной технологии получить полипептид со свойствами органофосфатгидролазы, который обладает улучшенной каталитической эффективностью действия по отношению к тиосодержащим триэфирам фосфорной кислоты. 2 н.п. ф-лы, 4 ил., 2 табл.
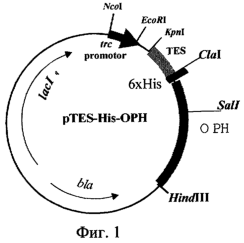
Изобретение относится к биотехнологии, в частности к генетической инженерии, и представляет собой сконструированную in vitro рекомбинантную плазмидную ДНК, содержащую ДНК процессированной формы фермента органофосфатгидролазы (ОРН), участок ДНК, кодирующий синтез аффинной последовательности, состоящей из шести аминокислотных остатков гистидина (6х-His), trc-промотор Escherichia coli и синтетический участок – усилитель трансляции, обуславливающие биосинтез His-OPH, а также штамм Escherichia coli – продуцент этого белка.
Органофосфатгидролаза (ОРН) (арилдиалкилфосфатаза, параоксоназа, фосфотриэстераза, ЕС 3.1.8.1) – фермент, катализирующий гидролиз эфирной связи в триэфирах фосфорной кислоты, содержит по два иона бивалентного металла (Zn2+ или Со2+
].
Известны попытки коструирования эффективных генно-инженерных продуцентов His-OPH на основе клеток E.coli.
Данное техническое решение, как наиболее близкое к заявляемому по своему назначению, а именно, получению экспрессионной системы, обеспечивающей максимальный выход His-OPH, принято за прототип.
Предлагаемое изобретение решает задачу получения His-OPH путем создания генно-инженерной конструкции и штамма клеток, которые обеспечивают синтез значительных количеств активной растворимой формы ОРН, содержащей олигогистидиновую последовательность, в цитоплазме клеток путем индуцибельного синтеза фермента с помощью индуктора (изопропил- -D-галактопиранозид, ИПТГ). -D-галактопиранозид, ИПТГ).
Поставленная задача решается путем конструирования рекомбинантной плазмидной ДНК pTES-His-OPH, кодирующей индуцибельный синтез фермента ОРН, содержащего олигогистидиновую последовательность, и штамма Escherichia coli SG13009[pREP4]/pTES-His-ОРН, обеспечивающего синтез этого белка с уровнем экспрессии, позволяющим получать не менее 5 мг очищенного белка из 1 г влажной биомассы за две стадии (ультразвуковое разрушение клеток и металл-хелатирующая хроматография).
Индуцибельный высокий уровень синтеза целевого полипептида обеспечивается наличием в плазмиде pTES-His-OPH trc-промотора Е. coli и синтетического усилителя трансляции гена 10 бактериофага Т7.
Рекомбинантная плазмидная ДНК pTES-His-OPH, кодирующая фермент органофосфатгидролазу, характеризуется следующими признаками:
– имеет молекулярную массу 3,48 Md (5,276 т.п.о.);
– кодирует аминокислотную последовательность фермента органофосфатгидролазы;
– содержит оптимизированную гексагистидиновую последовательность на 5′-конце гена, кодирующего аминокислотную последовательность фермента органофосфатгидролазы;
– состоит из Cla I/Hind III – фрагмента ДНК плазмиды pTrcTEGF (Патент RU 2185438 С2, кл. С 12 N 15/12, 1/21, 2002) длиной 4,232 т.п.о., содержащего trc-промотор Е. coli, синтетический усилитель трансляции TREN гена 10 бактериофага Т7, ген bla  -лактамазы, определяющий устойчивость трансформированных плазмидой pTES-His-OPH клеток к ампициллину и участок ori инициации репликации; а также из ДНК фермента органофосфатгидролазы длиной 1,011 т.п.о., фланкированного сайтами рестрикции Ваm HI и Hind III и оптимизированную гексагистидиновую последовательность; -лактамазы, определяющий устойчивость трансформированных плазмидой pTES-His-OPH клеток к ампициллину и участок ori инициации репликации; а также из ДНК фермента органофосфатгидролазы длиной 1,011 т.п.о., фланкированного сайтами рестрикции Ваm HI и Hind III и оптимизированную гексагистидиновую последовательность;
– содержит: trc-промотор Е. coli, уникальные сайты узнавания рестрикционными эндонуклеазами, имеющими следующие координаты: Nco I – 265, Eco RI – 270, Крn I – 286, Xba I – 340, Cla I – 377, Hind III – 1427.
Особенностью предложенной плазмидной конструкции является наличие trc-промотора Е. coli, контролирующего синтез ДНК фермента ОРН, а для усиления трансляции используется синтетический усилитель трансляции, что в совокупности обеспечивает индуцибельный синтез целевого белка с надежной регуляцией и высоким выходом, достигаемым при малых концентрациях индуктора.
Для получения штамма-продуцента фермента ОРН компетентные клетки Escherichia coli SG13009[pREP4] трансформируют рекомбинантной плазмидой pTES-His-OPH.
Полученный штамм Escherichia coli SG13009[pREP4]/pTES-His-OPH характеризуется следующими признаками:
Морфологические признаки. Клетки мелкие палочковидной формы, грамотрицательные, неспороносные, 1× 3-5 мкм, подвижные.
Культуральные признаки. При росте на агаризованной среде LB (Состав среды LB: триптон – 10,0 г/л; дрожжевой экстракт – 5,0 г/л; NaCl – 5,0 г/л; и 1,7% бактоагара) колонии круглые, гладкие, полупрозрачные, блестящие, серые, край ровный, диаметр колоний 1-3 мм; консистенция пастообразная. Рост в жидкой среде LB (триптон – 10,0 г/л; дрожжевой экстракт – 5,0 г/л; NaCl – 5,0 г/л) характеризуется ровным помутнением с образованием легкого осадка.
Физико-биохимические признаки. Клетки растут при температуре 4-42° С при оптимуме рН 6,8-7,2. В качестве источника азота используют как минеральные соли в аммонийной форме, так и органические соединения в виде пептона, триптона, дрожжевого экстракта, аминокислот. В качестве источника углерода используют аминокислоты, глицерин, углеводы.
Устойчивость к антибиотикам. Клетки проявляют устойчивость к ампициллину (до 200 мкг/мл), обусловленную наличием в плазмиде гена  -лактамазы, а также к канамицину (до 40 мкг/мл). -лактамазы, а также к канамицину (до 40 мкг/мл).
Штамм Е. coli SG13009[pREP4]/pTES-His-OPH обеспечивает индуцибельный синтез фермента органофосфатгидролазы, содержащего олигогистидиновую последовательность, с высоким содержанием растворимой формы фермента в цитоплазме, что позволяет получать не менее 5 мг очищенного белка из 1 г влажной биомассы за одну стадию. Совокупность перечисленных свойств штамма Е. coli SG13009[pREP4]/pTES-His-OPH делает получение рекомбинантной His-ОРН высокотехнологичным процессом.
Полученный штамм депонирован в коллекции культур микроорганизмов Института биоорганической химии им. М.М.Шемякина -Ю.А. Овчинникова Российской Академии Наук под номером 29.
На фиг.1 представлена физическая карта рекомбинантной плазмиды pTES-His-OPH; на фиг.2 – нуклеотидная последовательность ДНК фермента органофосфатгидролазы с прилегающими регуляторными элементами: trc – промотор (1-30 п.о.), усилитель трансляции TREN (93-188 п.о.), ген, кодирующий гексануклеотидную последовательность (189-221), ген органофосфатгидролазы (222-1232 п.о.); инициирующий и терминирующий кодоны подчеркнуты, в рамки взяты сайты рестриктаз: Eco RI, Cla I и Hind III; на фиг.3 – аминокислотная последовательность фермента органофосфатгидролазы, кодируемого рекомбинантной плазмидой pTES-His-OPH; на фиг.4 – электрофореграмма лизатов клеток штамма-реципиента Е. coli SG13009[pREP4] (дорожка 1), штамма-продуцента Е. coli SG13009[pREP4]/pTES-His-OPH (дорожка 2), белковых стандартов молекулярного веса (дорожка 3) в 12%-ном полиакриламидном геле (стрелкой указан фермент органофосфатгидролаза).
Изобретение иллюстрируется следующими примерами.
Пример 1. Конструирование рекомбинантной плазмиднои ДНК pTES-His-ОРН.
Проводят модификацию гена органофосфатгидролазы путем присоединения на 5′-конце нуклеотидной последовательности, кодирующей 6 остатков гистидина и несколько дополнительных аминокислотных остатков. Такую модификацию осуществляют следующим образом.
Проводят амплификацию гена органофосфатгидролазы с двумя праймерами: праймером For-Bam, имеющим нуклеотидную последовательность CTTCCGGATCCATCGGCACAGGCGATC, и Seq-Rev, имеющим нуклеотидную последовательность GTAACCACTCACACGGCA. Праймер For-Bam позволяет ввести сайт рестрикции эндонуклеазы Ваm HI в начало кодирующей области гена органофосфатгидролазы. Праймер Seq-Rev комплементарен внутренней области гена органофосфатгидролазы. Амплификацию осуществляют следующим образом. К 5 мкл раствора плазмидной ДНК pTES-OPH, состоящей из Cla I/Hind III – фрагмента ДНК плазмиды pTrcTEGF (Патент RU2185438 С2, кл. С 12 N 15/12, 1/21, 2002) длиной 4,232 т.п.о. и ДНК фермента органофосфатгидролазы длиной 1,011 т.п.о. (10 нг/мкл) (выделенной из хромосомной ДНК клеток Pseudomonas diminuta VKM B-1297 полимеразной цепной реакцией с праймерами FOR-Cla с нуклеотидной последовательностью СТТ ССА TCG АТА TGA GAG GAT CGC АТС и REV-Hind с нуклеотидной последовательностью ССА САА AGC TTC ATG ACG CCC GCA AGG ТС), прибавляют по 60 пмоль праймера For-Bam и 60 пмоль праймера Seq-Rev, 8 мкл смеси, содержащей 2,5 мМ каждого из дезоксинуклеозидтрифосфатов, 10 мкл 10-кратного буфера (100 мМ трис-HCl, рН 8,8, 500 мМ КСl, 15 мМ MgCl2), 2 ед. Taq ДНК-полимеразы и воду до общего объема реакционной смеси 100 мкл. Полимеразную цепную реакцию (ПЦР) проводят в следующем режиме: денатурация – 40 сек, 94° С; отжиг – 50 сек, 55° С; достройка – 1 мин, 72° С; количество циклов – 25. В результате амплификации получают ДНК длиной 530 п.н. Реакционную смесь после прохождения ПЦР экстрагируют равным объемом хлороформа, после чего осаждают этиловым спиртом. После центрифугирования и высушивания ДНК растворяют в 20 мкл 10 мМ трис-HCl, 1 мМ ЭДТА, рН 8,0. 5 мкл амплифицированной ДНК обрабатывают 10 ед. рестриктазы Ваm HI и 15 ед. рестриктазы Sal I (Fermentas, Литва) в течение 1 ч при 37° С в 20 мкл буферного раствора, содержащего 33 мМ трис-ацетата (рН 7,9), 10 мМ ацетата магния, 66 мМ ацетата калия, и из полученного гидролизата выделяют переносом из 1,5%-ного агарозного геля на DEAE-мембрану фрагмент ДНК органофосфатгидролазы длиной 218 т.п.о. (Ваm HI – Sal I фрагмент), осаждают этиловым спиртом, высушивают и растворяют в 20 мкл Н2О.
5 мкг плазмидной ДНК pTES-OPH размером 5243 т.п.о. (0,5 мкг/мкл) обрабатывают 10 ед. рестриктазы Сla I, 10 ед. рестриктазы Sal I и 15 ед. рестриктазы Hind III в течение 2 ч при 37° С в 30 мкл буферного раствора, содержащего 33 мМ трис-ацетата (рН 7,9), 10 мМ ацетата магния, 66 мМ ацетата калия, и из полученного гидролизата выделяют переносом из 0,8%-ного агарозного геля на DEAE-мембрану NA-45 3′-концевую часть кДНК органофосфатгидролазы длиной 796 т.п.о. (Sal I – Hind III фрагмент), а также векторную часть плазмидной ДНК длиной 4,232 т.п.о. (Sal I – Hind III фрагмент). Выделенные фрагменты осаждают этиловым спиртом, высушивают и растворяют в 20 мкл Н2О. Олигогистидиновую последовательность присоединяют в составе синтетического олигонуклеотидного дуплекса следующей структуры:
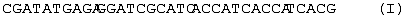
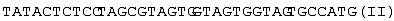
Данный дуплекс получают следующим образом: по 20 пмоль каждого из олигонуклеотидов (I) и (II) смешивают в водном растворе объемом 20 мкл, содержащем 40 мМ трис-HCl, рН 7,8 и 10 мМ MgCl2, после чего полученную смесь нагревают до 80° С в водяной бане и охлаждают до 20° С в течение 1 часа.
2 мкл раствора олигонуклеотидов после образования дуплекса смешивают с 0,02 мкг Sal I – Hind III фрагмента ДНК фермента органофосфатгидролазы длиной 696 т.п.о., 0,03 мкг Bam HI – SalI фрагмента длиной 418 и 0,05 мкг векторной части плазмидной ДНК pTrcTEGF(b) длиной 4,232 т.п.о. и проводят лигазную реакцию в течение 3 ч при 10° С в 15 мкл раствора, содержащего 40 мМ трис-НСl (рН 7,8), 10 мМ MgCl2, 10 мМ дитиотреитола, 0,5 мМ аденозинтрифосфата и 2 ед. Вейса Т4 ДНК-лигазы. 5 мкл реакционной смеси используют для трансформации 200 мкл компетентных клеток XL-1 Blue. 1/10 клеток, использованных для трансформации, высевают на LB-агар, содержащий 100 мкг/мл ампициллина. Из выросших клонов выделяют плазмидную ДНК, содержащую ДНК фермента органофосфатгидролазы, модифицированной добавлением гексагистидиновой последовательности.
Окончательно структуру рекомбинантной ДНК pTES-His-OPH подтверждают определением нуклеотидной последовательности в области встроенного гена органофосфатгидролазы. Аминокислотная последовательность органофосфатгидролазы, модифицированной добавлением гексагистидиновой последовательности, приведена на Фиг.3.
Пример 2. Получение штамма-продуцента фермента органофосфатгидролазы.
Компетентные клетки Escherichia coli SG13009[pREP4]: NalS StrS rifS, lac– ara– gal– mtl– F– recA+ uvr+ трансформируют рекомбинантной плазмидной ДНК pTES-His-OPH и получают штамм-продуцент фермента His-OPH.
Пример 3. Выделение и очистка рекомбинантного фермента органофосфатгидролазы, содержащей олигогистидиновую последовательность.
Для накопления биомассы клеток используют жидкую питательную среду TYE (триптон – 12,0 г/л, дрожжевой экстракт – 24,0 г/л, глицерин – 4,0 мл/л, КН2РO4 – 6,95 г/л, K2HPO4· 3H2O – 12,54 г/л, рН среды 7,0), в которую добавляют СоСl2· 6Н2О до концентрации 237 мг/л. Перед посевом клеток в среду добавляют раствор ампициллина (концентрация в среде 100 мкг/мл) и канамицина (концентрация в среде 25 мкг/мл).
Для получения инокулята производят посев культуры петлей с чашек Петри в 20 мл среды LB, содержащей ампициллин 100 мкг/мл, канамицин 25 мкг/мл. 16-часовой инокулят вносят в колбу, содержащую 100 мл полноценной питательной среды, культуру выращивают при 30° С и постоянном перемешивании (200 об/мин) до тех пор, пока оптическая плотность при длине волны 540 нм не достигнет 0,6, после чего добавляют ИПТГ до концентрации 0,4 мМ. Клетки культивируют в течение 24 часов. Полученную биомассу отделяют центрифугированием (5000 g, 15 мин), взвешивают и ресуспендируют в 50 мМ фосфатном буфере, рН 8,0, содержащем 300 мМ хлорида натрия (буфер для озвучивания) (массовое соотношение биомасса:буфер – 1:5). Клетки разрушают обработкой ультразвуком (частота 44 кГц) 6 раз по 45 секунд, между обработками биомассу выдерживают в течение 1 мин во льду. Осадок отделяют центрифугированием (15000 g, 30 мин).
К супернатанту добавляют равный объем 50% суспензии Ni-NTA агарозы, предварительно уравновешенной в буфере для озвучивания, и перемешивают в течение 1 ч. Колонку заполняют полученной суспензией, промывают (0,5 мл/мин) элюирующим буфером (50 мМ фосфат натрия (рН 6,0), 300 мМ хлорид натрия, 10% глицерин) и элюируют фермент с колонки градиентным раствором имидазола (от 0 до 0,5 М) в элюирующем буфере. Полученные фракции, содержащие His-OPH, объединяют и подвергают диализу против 20 мМ фосфатно-карбонатного буфера (рН 8,5).
В процессе очистки из 1 г влажной биомассы получают 5 мг высокоочищенного фермента со средней удельной активностью 6870 ед/мг белка. Выход фермента составляет 81,7% от исходного количества His-OPH, синтезированного клетками (табл.1).
Таблица 1.
Баланс процедуры очистки и выделения His-OPH из 1 г биомассы. |
| Этап очистки |
Суммарный белок, мг |
Суммарная активность, ед |
Удельная активность, ед/мг белка |
Очистка, раз |
Выход,
% |
| Обработка клеток |
312 |
43680 |
140 |
1 |
100 |
| ультразвуком |
|
|
|
|
|
| Ni-NTA колонка |
5,2 |
35730 |
6870 |
60 |
81,7 |
Пример 4. Исследование свойств рекомбинантного фермента органофосфатгидролазы, содержащей олигогистидиновую последовательность.
За скоростью исследуемой реакции следят спектрофотометрически по накоплению продукта 4-нитрофенолят аниона ( =18000 М-1см-1, рН 10,7, =18000 М-1см-1, рН 10,7,  =405 нм). Для определения каталитической активности His-OPH в водных растворах используют 0,05 М карбонатный буфер (рН 10,5). В качестве субстрата используют 1 мМ водные растворы параоксона, паратиона и метил-паратиона. =405 нм). Для определения каталитической активности His-OPH в водных растворах используют 0,05 М карбонатный буфер (рН 10,5). В качестве субстрата используют 1 мМ водные растворы параоксона, паратиона и метил-паратиона.
Каталитическую реакцию инициируют внесением в кювету с буфером и субстратом раствора His-OPH в 20 мМ фосфатно-карбонатном буфере (рН 8,5). Концентрация фермента в кювете составляет 10-10-10-9 М.
За единицу ферментативной активности принимают такое количество фермента, которое необходимо для того, чтобы гидролизовать 1 мМ субстрата за 1 мин при рН 10,5 и 20° С.
Расчет скоростей ферментативной реакции проводят по начальным линейным участкам кинетических кривых (vo=tg ). Максимальную скорость ферментативной реакции (Vm) и константу Михаэлиса (Km) определяют с использованием двойных обратных координат 1/vo-1[S] (Лайнуивера-Берка). ). Максимальную скорость ферментативной реакции (Vm) и константу Михаэлиса (Km) определяют с использованием двойных обратных координат 1/vo-1[S] (Лайнуивера-Берка).
Кинетические характеристики рекомбинантной органофосфатгидролазы приведены в табл.2. рН-оптимум действия фермента составляет 10,5.
Таблица 2.
Константы гидролиза ФОС олигогистидинсодержащей органофосфатгидролазой. |
| Субстрат |
kcat, с-1 |
Km, мкМ |
kcat/Km, M-1c-1 |
| Параоксон |
5100± 100 |
10± 0,5 |
5,1× 108 |
| Паратион |
530± 30 |
15± 0,5 |
3,5× 107 |
| Метил-паратион |
310± 20 |
73± 1,0 |
4,2× 106 |
Таким образом, заявляемое техническое решение представляет собой плазмиду уникальной конструкции для микробного синтеза полипептида, обладающего свойствами ОРН, и штамм E.coli, обеспечивающий экспрессию данной плазмиды. Данное техническое решение обеспечивает высокий выход растворимого белка His-OPH (не менее 5 мг из 1 г клеток) (Пример 3), который в 5 раз превышает выходы аналогичных гибридных белков, содержащих олигогистидиновую последовательность, в известных экспрессионных системах.
В отличие от известных аналогов, предлагаемое техническое решение позволяет:
– получить полипептид, каталитическая эффективность которого увеличена в 10 раз по ряду основных субстратов по сравнению с нативным ферментом ОРН (Пример 4);
– сократить процесс выделения His-OPH до двух стадий, позволяющих получить более 80% от исходного синтезированного белка в клетках (Пример 3) и получить каталитически активный фермент без необходимости отделения ОРН от посторонних белков-маркеров, в частности, от His-GFP-EK.
Все это позволяет значительно повысить технологичность и экономичность процесса получения высокоактивного рекомбинантного фермента органофосфатгидролазы.
Рекомбинантный фермент может быть использован для приготовления наборов для аналитического определения фосфорорганических соединений, а также для производства препаратов на основе ОРН, предназначенных для деградации фосфорорганических соединений.
Формула изобретения
1. Рекомбинантная плазмидная ДНК pTES-His-OPH, кодирующая полипептид со свойствами органофосфатгидролазы, с молекулярной массой 3,48 Md (5,276 т.п.о.), включающая
СlaI/Hind III фрагмент ДНК плазмиды pTrcTEGF длиной 4,232 т.п.о.,
фрагмент плазмиды pTES-OPH длиной 1,011 т.п.о., имеющий нуклеотидную последовательность, которая кодирует аминокислотную последовательность зрелой формы органофосфатгидролазы, и фланкированный сайтами рестрикции Barn HI и Hind III, и
нуклеотидную последовательность АТGАGАGGАТСGСАТСАССАТСАССАТСАСGGА, располагающуюся на 5′-конце нуклеотидной последовательности, кодирующей аминокислотную последовательность зрелой формы органофосфатгидролазы, а также содержащая уникальные сайты узнавания рестрикционными эндонуклеазами: Nco I – 265, Eco R1 – 270, Kpn I – 286, Xba I – 340, Cla I – 377, Hind III – 1427.
2. Штамм бактерий Escherichia coli ЦКМИБХ-29 – продуцент полипептида со свойствами органофосфатгидролазы.
РИСУНКИ
|
|