|
(21), (22) Заявка: 2001133341/04, 05.05.2000
(24) Дата начала отсчета срока действия патента:
05.05.2000
(30) Конвенционный приоритет:
07.05.1999 US 60/132967
10.12.1999 US 60/170441
(43) Дата публикации заявки: 20.07.2003
(45) Опубликовано: 10.07.2005
(15) Информация о коррекции:
Версия коррекции № 1 (4 1 ИНТЕГРИНА 1 ИНТЕГРИНА
(57) Реферат:
Изобретение относится к 6 вариантам производных пропионовой кислоты, фармацевтическим композициям, включающим такие соединения и способу селективного ингибирования связывания 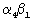 интегрина млекопитающего с клеткой, экспрессирующей VCAM-1. 9 н. и 17 з.п. ф-лы, 4 табл. интегрина млекопитающего с клеткой, экспрессирующей VCAM-1. 9 н. и 17 з.п. ф-лы, 4 табл.
Область техники, к которой относится изобретение
Изобретение относится в основном к ингибированию связывания 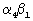 интегрина с его рецепторами, например с рецептором VCAM-1 (молекулой-1 адгезии клеток сосудов) и фибронектином. Изобретение относится также к соединениям, ингибирующим указанное связывание, фармацевтически активным композициям, включающим такие соединения, и к использованию таких соединений либо в отдельности, как указано выше, либо в составе композиций для лечения или предотвращения патологических состояний, ассоциированных с интегрина с его рецепторами, например с рецептором VCAM-1 (молекулой-1 адгезии клеток сосудов) и фибронектином. Изобретение относится также к соединениям, ингибирующим указанное связывание, фармацевтически активным композициям, включающим такие соединения, и к использованию таких соединений либо в отдельности, как указано выше, либо в составе композиций для лечения или предотвращения патологических состояний, ассоциированных с 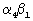 . .
Уровень техники
При поражении ткани микроорганизмом или ее повреждении основная роль в развитии воспалительного процесса принадлежит белым кровяным клеткам – лейкоцитам. Одним из наиболее важных аспектов воспалительного процесса является клеточная адгезия. Обычно лейкоциты циркулируют в кровотоке. Однако, когда ткань инфицируется или повреждается, лейкоциты распознают пораженную или поврежденную ткань, связываются со стенкой капилляра и мигрируют по капилляру к пораженной ткани. Эти процессы опосредуются семейством белков, называемых молекулами клеточной адгезии.
Существует три основных типа лейкоцитов: гранулоциты, моноциты и лимфоциты. 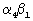 Интегрин (названный также очень поздним антигеном-4 или VLA-4) является гетеродимерным белком, экспрессированным на поверхности моноцитов, лимфоцитов и двух подклассов гранулоцитов – эозинофилов и базофилов. Этот белок играет ключевую роль в клеточной адгезии благодаря его свойству узнавать и связывать VCAM-1 и фибронектин, белки ассоциированные с эндотелиальными клетками, которые выстилают внутреннюю стенку капилляров. Интегрин (названный также очень поздним антигеном-4 или VLA-4) является гетеродимерным белком, экспрессированным на поверхности моноцитов, лимфоцитов и двух подклассов гранулоцитов – эозинофилов и базофилов. Этот белок играет ключевую роль в клеточной адгезии благодаря его свойству узнавать и связывать VCAM-1 и фибронектин, белки ассоциированные с эндотелиальными клетками, которые выстилают внутреннюю стенку капилляров.
После инфицирования или повреждения ткани, окружающей капилляр, эндотелиальные клетки экспрессируют ряд молекул адгезии, включая VCAM-1, ответственных за связывание лейкоцитов, необходимых для борьбы с инфекцией. Прежде чем связаться с VCAM-1 или фибронектином, лейкоциты сначала взаимодействуют с определенными молекулами адгезии для того, чтобы замедлить их движение и обеспечить “ролинг” клеток вдоль активированного эндотелия. Моноциты, лимфоциты, базофилы и эозинофилы обладают свойством прочно связываться с VCAM-1 или фибронектином на стенке кровеносного сосуда с помощью 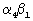 интегрина. Установлено, что такие взаимодействия включены также в процесс миграции таких лейкоцитов к поврежденной ткани, а также в процесс самого первичного “ролинга”. интегрина. Установлено, что такие взаимодействия включены также в процесс миграции таких лейкоцитов к поврежденной ткани, а также в процесс самого первичного “ролинга”.
Хотя миграция лейкоцитов к очагу повреждения помогает борьбе с инфекцией и влечет за собой деградацию постороннего материала, во многих случаях эта миграция может стать неконтролируемой, с притоком к очагу воспаления избытка лейкоцитов, вызывая обширное повреждение ткани. Следовательно, соединения, способные блокировать этот процесс, могут оказаться полезными в качестве терапевтических агентов. Таким образом, существует потребность в разработке ингибиторов, которые могут воспрепятствовать связыванию лейкоцитов с VCAM-1 и фибронектином.
Некоторые из заболеваний, которые могут быть излечены благодаря ингибированию связывания 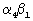 , включают, без ограничения перечисленным, атеросклероз, ревматоидный артрит, астму, аллергию, рассеянный склероз, волчанку, воспалительное заболевание кишечника, отторжение трансплантата, повышенную контактную чувствительность и диабет типа I. Кроме присутствия интегрина в некоторых в лейкоцитах, , включают, без ограничения перечисленным, атеросклероз, ревматоидный артрит, астму, аллергию, рассеянный склероз, волчанку, воспалительное заболевание кишечника, отторжение трансплантата, повышенную контактную чувствительность и диабет типа I. Кроме присутствия интегрина в некоторых в лейкоцитах,  4 4 1 найден также в различных опухолевых клетках, включая лейкемические клетки, клетки меланомы, лимфомы и саркомы. Предполагают, что клеточная адгезия с участием 1 найден также в различных опухолевых клетках, включая лейкемические клетки, клетки меланомы, лимфомы и саркомы. Предполагают, что клеточная адгезия с участием 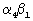 может сопровождать процесс метастазирования некоторых видов опухолей. Следовательно, ингибиторы связывания может сопровождать процесс метастазирования некоторых видов опухолей. Следовательно, ингибиторы связывания 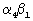 могут найти применение при терапии некоторых форм рака. могут найти применение при терапии некоторых форм рака.
Выделение и очистка пептида, ингибирующего связывание 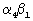 с белком, описано в патенте США No 5510332. Пептиды, ингибирующие связывание, описаны в заявках WO 95/15973, ЕР 0341915, ЕР 0422938 А1, патенте США No 5192746 и заявке WO 96/06108. Новые соединения, которые используют для ингибирования и предотвращения клеточной адгезии и заболеваний, опосредованных клеточной адгезией, описаны в заявках WO 96/22966, WO 98/04247 и WO 98/04913. с белком, описано в патенте США No 5510332. Пептиды, ингибирующие связывание, описаны в заявках WO 95/15973, ЕР 0341915, ЕР 0422938 А1, патенте США No 5192746 и заявке WO 96/06108. Новые соединения, которые используют для ингибирования и предотвращения клеточной адгезии и заболеваний, опосредованных клеточной адгезией, описаны в заявках WO 96/22966, WO 98/04247 и WO 98/04913.
Следовательно, целью изобретения является разработка новых соединений, ингибирующих связывание 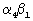 , и фармацевтических композиций, включающих такие новые соединения. , и фармацевтических композиций, включающих такие новые соединения.
Сущность изобретения
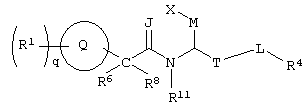
Изобретение направлено на новые соединения формулы I:
Формула I
где круг Q означает бензольное кольцо или моноциклическое, или бициклическое гетероциклическое кольцо, содержащее по меньшей мере один атом азота;
q означает целое число от нуля до шести;
М означает -(СН2)u-, где u означает 0 или 1;
J означает -О-;
Т означает -(СН2)b-, где b означает 0;
L означает -(СН2)v, где v означает 0;
Х означает -СО2В, где
В означает водород; R1 выбирают из группы, содержащей водород, галоген, гидроксил, алкил, алкиламино, арил, ароил, арилокси, гетероциклил, алкиларил, аралкил, гетероциклилалкил;
R4 означает арил, арилалкил или гетероциклил, причем R1 и R4 незамещены или замещены по крайней мере одной электронодонорной или электроноакцепторной группой;
R6, R8 и R11 каждый может означать водород, или один из R6 и R8 может означать водород, другой – алкил, или R6 и R8 могут быть объединены с образованием циклоалкила,
или к их фармацевтически приемлемым солям;
или к их производным, выбранным из группы, содержащей сложные эфиры, карбаматы, аминали, амиды и оптические изомеры.
В соединениях формулы I по настоящему изобретению круг Q означает бензольное кольцо или моноциклическое, или бициклическое гетероциклическое кольцо.
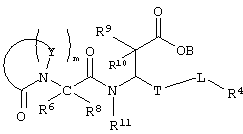
Более подробно, соединения по настоящему изобретению могут быть описаны формулой II, представленной ниже:
Формула II
где Y в каждом случае независимо выбирают из группы, содержащей N, CR7, C(R2)(R3), NR5, где R2 и R3 каждый может означать водород или арил, R5 означает аралкил, а R7 означает водород, алкил, алкиламино, арил, ароил, аралкил или гетероциклил,
m означает целое число от 2 до 5,
Т означает (СН2)b, где b означает 0,
L означает (СН2)n, где n означает 0, и
В, R9, R10 и R11 каждый означает водород,
R4 означает арил,
R6 и R8 каждый может означать водород, причем другой в это время – алкил;
или их фармацевтически приемлемой солью;
или их производными, выбранными из группы, содержащей сложные эфиры, карбаматы, аминали, амиды и оптические изомеры.
Более подробно соединения по настоящему изобретению могут быть описаны формулой III, представленной ниже:
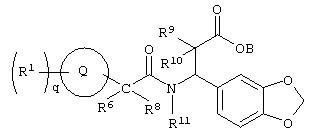
Формула III
где круг Q означает кольцо, выбранное из группы, содержащей
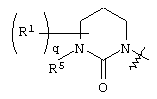 и и 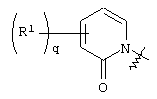
q означает целое число от нуля четырех,
R1 выбирают из группы, содержащей водород, галоген, гидроксил, алкил, алкиламино, арил, ароил, арилокси, гетероциклил, алкиларил, аралкил, гетероциклилалкил,где R1 незамещен или замещен по крайней мере одной электронодонорной или электроноакцепторной группой;
R5 означает аралкил,
R6 и R8 каждый может означать водород, причем другой в это время – алкил,
B, R9, R10 и R11 каждый означает водород;
или их фармацевтически приемлемой солью;
или их производными, выбранными из группы, содержащей сложные эфиры, карбаматы, аминали, амиды и оптические изомеры.
В соединениях формулы III по настоящему изобретению R1 в каждом случае независимо означают водород, 2-тиенилметил, бензил или метил.
Более конкретно, соединения по настоящему изобретению могут быть описаны нижеприведенной формулой IV
Формула IV
где q означает целое число от нуля до четырех;
Т означает (СН2)b, где b означает 0;
L означает (СН2)n, где n означает 0;
R1 означает водород, алкил, аралкил,
R4 означает арил,
где R1 и R4 незамещены или замещены по крайней мере одной электронодонорной или электроноакцепторной группой;
В, R9, R10 и R11 означают водород,
R6 и R8 каждый может означать водород, или один из R6 и R8 может означать водород, другой – алкил;
либо их фармацевтически приемлемой солью;
либо их производными, выбранными из группы, содержащей сложные эфиры, карбаматы, аминали, амиды и оптические изомеры.
В предпочтительных соединениях по настоящему изобретению формулы IV q равно одному или двум, R1 в каждом конкретном случае независимо означает аралкил или алкил; R6 означает алкил; В, R8, R9, R10 и R11 независимо означают водород, Т означает -(СН2)b-, где b равно 0; a L означает -(СН2)n-, где n равно 0, и R4 означает арил.
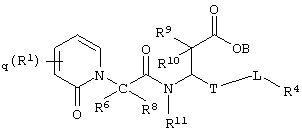
Более конкретно, соединения по настоящему изобретению могут быть описаны нижеприведенной формулой V
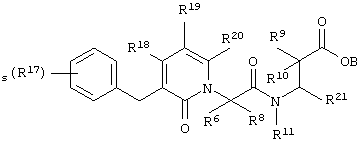
Формула V
где s означает целое число от нуля до пяти;
R21 выбирают из группы, включающей арил, гетероциклилалкил, алкиларил, биарил;
В, R6, R8, R9, R10, R11, R18, R19 и R20 означают водород, R17 означает водород, галоген, алкил, алкокси, арилалкил;
где R17 и R21 незамещены или замещены по крайней мере одной электронодонорной или электроноакцепторной группой;
либо их фармацевтически приемлемой солью;
либо их производными, выбранными из группы, содержащей сложные эфиры, карбамаматы, аминали, амиды и оптические изомеры.
В предпочтительных соединениях по настоящему изобретению формулы V каждый из В, R8, R9, R10, R11, R18 и R20 независимо означает водород; s означает целое число от нуля до трех; R17 в каждом конкретном случае независимо означает галоген, алкил, алкокси или; а R21 означает арил. В одном из наиболее предпочтительных соединений по настоящему изобретению формулы V s равно нулю; каждый из В, R8, R9, R10, R11, R18 и R20 независимо означает водород, а R21 означает 1,3-бензодиоксол-5-ил.
Соединения по настоящему изобретению могут быть также описаны нижеприведенной формулой VI.
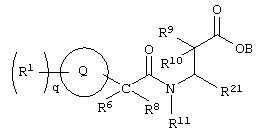
Формула VI
где круг Q означает кольцевую структуру, выбранную из группы, включающей
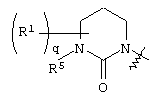 и и 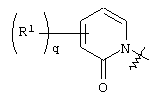
где q означает целое число от нуля до четырех.
R1 выбирают из группы, включающей водород, алкил, аралкил, В, R5, R6, R9, R10 и R11 означают водород, арил, биарил, аралкил, алкилгетероциклил,
R21 выбирают из группы, включающей арил, гетероциклилалкил, алкиларил, биарил;
где R1 и R21 незамещены или замещены по крайней мере одной электронодонорной или электроноакцепторной группой;
либо их фармацевтически приемлемой солью;
либо их производными, выбранными из группы, содержащей сложные эфиры, карбаматы, аминали, амиды и оптические изомеры.
В предпочтительных соединениях по настоящему изобретению формулы VI каждый из В, R6, R8, R9, R10 и R11 означает водород, R1 и R5 в каждом конкретном случае независимо означают водород, 2-тиенилметил, бензил или метил, а R21 означает арил.
Предпочтительные соединения по настоящему изобретению включают
(3S)-(1,3-бензодиоксол-5-ил)-3-(((2S)-2-(2-оксо-3-(2-тиенилметил)тетрагидро-1(2Н)-пиримидинил)гексаноил)амино)пропионовую кислоту,
(3S)-3-(1,3-бензодиоксол-5-ил)-3-((2R,S)-2-(3-бензил-5-метил-2-оксо-1(2Н)-пиридинил)гексаноил)амино)пропионовую кислоту,
(3S)-3-(1,3-бензодиоксол-5-ил)-3-((2R,S)-2-(3-(3-хлорбензил)-5-метил-2-оксо-1(2Н)-пиридинил)гексаноил)амино)пропионовую кислоту,
(3S)-3-(1,3-бензодиоксол-5-ил)-3-(((2S)-2-(2-оксо-3-(фенилметил)-1(2Н)-пиридинил)гексаноил)амино)пропионовую кислоту,
(3S)-3-(1,3-бензодиоксол-5-ил)-3-((2-(3-хлорфенил)метил)-5-метил-2-оксо-1(2Н)-пиридинил)гексаноил)амино)пропионовую кислоту,
(3S)-3-{[(2S)-2-(3-бензил-5-метил-2-оксопиридин-1(2Н)-ил)гексаноил]амино}-3-(3,5-диметоксифенил)пропионовую кислоту,
(3S)-3-{[(2S)-2-(3-бензил-5-метил-2-оксопиридин-1(2Н)-ил)гексаноил]амино}-3-(3-фтор-4-метоксифенил)пропионовую кислоту,
(3S)-3-{[2-(3-бензил-5-метил-2-оксопиридин-1(2Н)-ил)гексаноил]амино}-3-(3-изопропоксифенил)пропионовую кислоту,
(3S)-3-({2-[3-(3-хлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(3-изопропоксифенил)пропионовую кислоту,
(3S)-3-(3-изопропоксифенил)-3-({2-[3-(2-метоксибензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)пропионовую кислоту,
(3S)-3-{[2-(3-бензил-5-метил-2-оксопиридин-1(2Н)-ил)гексаноил]амино}-3-(3-этокси-4-метоксифенил)пропионовую кислоту,
(3S)-3-{[2-(3-бензил-5-метил-2-оксопиридин-1(2Н)-ил)гексаноил]амино}-3-(4-метокси-3-метилфенил)пропионовую кислоту,
(3S)-3-{[2-(3-бензил-5-метил-2-оксопиридин-1(2Н)-ил)гексаноил]амино}-3-фенилпропионовую кислоту,
(3S)-3-({2-[3-(2-хлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(4-метилфенил)пропионовую кислоту,
(3S)-3-({2-[3-(2-хлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(3-изопропоксифенил)пропионовую кислоту,
(3S)-3-({2-[3-(2-хлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-фенилпропионовую кислоту,
(3S)-3-(1-метил-1Н-индол-6-ил)-3-({2-[5-метил-2-оксо-3-(фенилметил)-1(2Н)-пиридинил]гексаноил}амино)пропионовую кислоту,
(3S)-3-{3-[(1-метилэтил)окси]фенил}-3-({2-[5-метил-3-(2-нафталинилметил)-2-оксо-1(2Н)-пиридинил]гексаноил}амино)пропионовую кислоту,
(3S)-3-({2-[5-метил-2-оксо-3-(фенилметил)-1(2Н)-пиридинил]гексаноил}амино)-3-[3-(2-метилпропил)фенил]пропионовую кислоту,
(3S)-3-[3-(дифторметил)фенил]-3-({2-[5-метил-2-оксо-3-(фенилметил)-1(2Н)-пиридинил]гексаноил}амино)пропионовую кислоту,
(3S)-3-{3-[(1-метилэтил)окси]фенил}-3-({2-[5-метил-3-[(2-метилфенил)метил]-2-оксо-1(2Н)-пиридинил]гексаноил}амино)пропионовую кислоту,
(3S)-3-(3-фторфенил)-3-({2-[5-метил-2-оксо-3-(фенилметил)-1(2Н)-пиридинил]гексаноил}амино)пропионовую кислоту,
(3S)-3-({2-[3-[(2-хлор-4-фторфенил)метил]-5-метил-2-оксо-1(2Н)-пиридинил]гексаноил}амино)-3-{3-[(1-метилэтил)окси]фенил}пропионовую кислоту и
(3S)-3-{3-[(1-метилэтил)окси]фенил}-3-({2-[5-метил-2-оксо-1-(фенилметил)-1,2-дигидро-3-пиридинил]-2-фенилацетил}амино)пропионовую кислоту, а также их фармацевтически приемлемые соли.
Другие предпочтительные соединения по настоящему изобретению включают следующие соединения:
(3S)-3-{[(2S)-2-(3-бензил-5-метил-2-оксопиридин-1(2Н)-ил)гексаноил]амино}-3-(3′,4′-диметокси-1,1′-бифенил-4-ил)пропионовую кислоту,
(3S)-3-({(2S)-2-[3-(2-хлорбензил)-5-метил-2-оксопиридин-1(2H)-ил]гексаноил}амино)-3-(3′,4′-диметокси-1,1′-бифенил-4-ил)пропионовую кислоту,
(3S)-3-(1,1′-бифенил-4-ил)-3-({(2S)-2-[3-(2-хлор-6-метилбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)пропионовую кислоту,
(3S)-3-{[(2S)-2-(3-бензил-5-метил-2-оксопиридин-1(2Н)-ил)гексаноил]амино}-3-(1,1′-бифенил-4-ил)пропионовую кислоту,
(3S)-3-(1,1′-бифенил-4-ил)-3-({(2S)-2-[3-(2-хлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)пропионовую кислоту,
(3S)-3-{[(2S)-2-(3-бензил-5-метил-2-оксопиридин-1(2Н)-ил)гексаноил]амино}-3-(4′-метил-1,1′-бифенил-4-ил)пропионовую кислоту,
(3S)-3-({(2S)-2-[3-(2-хлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(4′-метил-1,1′-бифенил-4-ил)пропионовую кислоту,
(3S)-3-({(2S)-2-[3-(2-хлор-6-метилбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(4′-метил-1,1′-бифенил-4-ил)пропионовую кислоту,
(3S)-3-{[(2S)-2-(3-бензил-5-метил-2-оксопиридин-1(2Н)-ил)гексаноил]амино}-3-(2′,6′-диметокси-1,1′-бифенил-4-ил)пропионовую кислоту,
(3S)-3-({(2S)-2-[3-(2-хлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(2′,6′-диметокси-1,1′-бифенил-4-ил)пропионовую кислоту,
(3S)-3-({(2S)-2-[3-(2-хлор-6-метилбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(2′,6′-диметокси-1,1′-бифенил-4-ил)пропионовую кислоту,
(3S)-3-{[(2S)-2-(3-бензил-5-метил-2-оксопиридин-1(2Н)-ил)гексаноил]амино}-3-(1,1′-бифенил-3-ил)пропионовую кислоту,
(3S)-3-(1,1′-бифенил-3-ил)-3-({(2S)-2-[3-(2-хлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)пропионовую кислоту,
(3S)-3-(1,1′-бифенил-3-ил)-3-({(2S)-2-[3-(2-хлор-6-метилбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)пропионовую кислоту,
(3S)-3-{[(2S)-2-(3-бензил-5-метил-2-оксопиридин-1(2Н)-ил)гексаноил]амино}-3-(2′-метокси-1,1′-бифенил-3-ил)пропионовую кислоту,
(3S)-3-({(2S)-2-[3-(2-хлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(2′-метокси-1,1′-бифенил-3-ил)пропионовую кислоту,
(3S)-3-({(2S)-2-[3-(2-хлор-6-метилбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(2′-метокси-1,1′-бифенил-3-ил)пропионовую кислоту,
(3S)-3-({(2S)-2-[3-(2-фтор-6-метоксибензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(4-метилфенил)пропионовую кислоту,
(3S)-3-({(2S)-2-[3-(2,6-диметилбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(4-метилфенил)пропионовую кислоту,
(3S)-3-({(2S)-2-[3-(3,5-диметилбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(4-метилфенил)пропионовую кислоту,
(3S)-3-({(2S)-2-[3-(2,6-дихлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(4-метилфенил)пропионовую кислоту,
(3S)-3-({(2S)-2-[3-(2-хлор-6-фторбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(4-метилфенил)пропионовую кислоту,
(3S)-3-({(2S)-2-[3-(2,6-дифторбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(4-метилфенил)пропионовую кислоту,
(3S)-3-(1,3-бензодиоксол-5-ил)-3-({(2S)-2-[3-(2,6-дифторбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)пропионовую кислоту,
(3S)-3-(1,3-бензодиоксол-5-ил)-3-({(2S)-2-[3-(2-хлор-6-фторбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)пропионовую кислоту,
(3S)-3-(1,3-бензодиоксол-5-ил)-3-({(2S)-2-[3-(2,6-дихлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)пропионовую кислоту,
(3S)-3-(1,3-бензодиоксол-5-ил)-3-({(2S)-2-[3-(2,6-диметилбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)пропионовую кислоту,
(3S)-3-(1,3-бензодиоксол-5-ил)-3-({(2S)-2-[3-(3,5-диметилбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)пропионовую кислоту,
(3S)-3-(1,3-бензодиоксол-5-ил)-3-({(2S)-2-[3-(2-фтор-6-метоксибензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)пропионовую кислоту,
(3S)-3-({(2S)-2-[3-(2-хлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(3,4-диэтоксифенил)пропионовую кислоту,
(3S)-3-(3,4-диэтоксифенил)-3-({(2S)-2-[3-(2,6-дифторбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)пропионовую кислоту,
(3S)-3-({(2S)-2-[3-(2,6-дифторбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(3-этоксифенил)пропионовую кислоту,
(3S)-3-({(2S)-2-[3-(2-хлор-6-фторбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(3-этоксифенил)пропионовую кислоту,
(3S)-3-({(2S)-2-[3-(2-хлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]-3-метилбутаноил}амино)-3-(4-метилфенил)пропионовую кислоту,
(3S)-3-({(2S)-2-[3-(2-хлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]-4-метилпентаноил}амино)-3-(4-метилфенил)пропионовую кислоту,
(3S)-3-(1,3-бензодиоксол-5-ил)-3-({(2S)-2-[3-(2-хлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]-4-метилпентаноил}амино)пропионовую кислоту,
(3S)-3-(1,3-бензодиоксол-5-ил)-3-({(2S)-2-[3-(2-хлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]-3-метилбутаноил}амино)пропионовую кислоту,
(3S)-3-(1,3-бензодиоксол-5-ил)-3-({(2S)-2-[3-(2-хлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]-3-фенилпропаноил}амино)пропионовую кислоту,
(3S)-3-({(2S)-2-[3-(2-хлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]-3-фенилпропаноил}амино)-3-(4-метилфенил)пропионовую кислоту,
(3S)-3-(1,3-бензодиоксол-5-ил)-3-(((2R)-2-(1-бензил-5-метил-2-оксо-1,2-дигидропиридин-3-ил)гексаноил)амино)пропионовую кислоту и их фармацевтически приемлемые соли.
Наиболее предпочтительным в настоящее время соединением является (3S)-3-(1,3-бензодиоксол-5-ил)-3-((2S)-2-(3-бензил-5-метил-2-оксо-1(2Н)-пиридинил)гексаноиламино)пропионовая кислота, либо ее фармацевтически приемлемая соль.
Включены также производные формул I, II, III, IV, V и VI, которые являются сложными эфирами, карбаматами, аминалями, амидами, оптическими изомерами и пролекарствами.
Настоящее изобретение относится также к фармацевтическим композициям, включающим физиологически приемлемый разбавитель и по крайней мере одно соединение по настоящему изобретению.
Настоящее изобретение относится также к способу ингибирования связывания 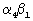 интегрина с VCAM-1, включающему контактирование клетки, экспрессирующей интегрина с VCAM-1, включающему контактирование клетки, экспрессирующей 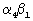 интегрин, с клеткой, экспрессирующей VCAM-1, в присутствии эффективного ингибирующего количества соединения по настоящему изобретению. VCAM-1 может присутствовать на поверхности эндотелиальных клеток кровеносных сосудов, на антиген-презентирующих клетках или на других типах клеток. интегрин, с клеткой, экспрессирующей VCAM-1, в присутствии эффективного ингибирующего количества соединения по настоящему изобретению. VCAM-1 может присутствовать на поверхности эндотелиальных клеток кровеносных сосудов, на антиген-презентирующих клетках или на других типах клеток. 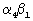 может присутствовать на лейкоцитах, таких как моноциты, лимфоциты, гранулоциты, на стволовых клетках или на любых других клетках, которые способны экспрессировать может присутствовать на лейкоцитах, таких как моноциты, лимфоциты, гранулоциты, на стволовых клетках или на любых других клетках, которые способны экспрессировать 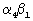 . .
Изобретение относится также к способу лечения патологических состояний, опосредованных связыванием 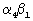 , который включает введение эффективного количества соединения по настоящему изобретению в отдельности или в составе композиции пациенту, подлежащему лечению. , который включает введение эффективного количества соединения по настоящему изобретению в отдельности или в составе композиции пациенту, подлежащему лечению.
Сведения, подтверждающие возможность осуществления изобретения
Определение терминов.
Термин “алкил”, используемый в тексте заявки, отдельно или в сочетании, означает С1-С12 линейные или разветвленные, замещенные или незамещенные насыщенные радикалы, образующиеся из насыщенных углеводородов при отщеплении одного атома водорода, при условии, если термину алкил не предшествует обозначение Сx-Сy. Типичные примеры алкильных групп включают наряду с прочими метил, этил, н-пропил, изо-пропил, н-бутил, втор-бутил, изо-бутил и трет-бутил.
Термин “алкенил”, используемый в тексте заявки, отдельно или в сочетании, означает замещенный или незамещенный линейный или замещенный или незамещенный разветвленный алкенильный радикал, содержащий от 2 до 10 атомов углерода. Примеры таких радикалов включают, без ограничения перечисленным, этенил, Е- и Z-пентенил, деценил и т.п.
Термин “алкинил”, используемый в тексте заявки, отдельно или в сочетании, означает замещенный или незамещенный линейный или замещенный или незамещенный разветвленный алкинильный радикал, содержащий от 2 до 10 атомов углерода. Примеры таких радикалов включают, без ограничения перечисленным, этинил, пропинил, пропаргил, бутинил, гексинил, децинил и т.п.
Термин “низший” модифицированный “алкил”, “алкенил”, “алкинил” или “алкокси” означает С1-С6 звено для конкретного функционального назначения. Например, низший алкил означает С1-С6 алкил.
Термин “алифатический ацил”, используемый в тексте заявки, отдельно или в сочетании, означает радикалы формулы алкил-С(О)-, алкенил-С(О)- и алкинил-С(О)-, образующиеся из алкан-, алкен- и алкинкарбоновой кислоты, где термины “алкил”, “алкенил” и “алкинил” имеют значения, указанные выше. Примеры таких алифатических ацильных радикалов включают наряду с прочими, без ограничения перечисленным, ацетил, пропионил, бутирил, валерил, 4-метилвалерил, акрилоил, кротил, пропиолил и метилпропиолил.
Термин “циклоалкил”, используемый в тексте заявки, означает алифатическую циклическую систему, содержащую от 3 до 10 атомов углерода и от 1 до 3 циклов, включая наряду с прочими, без ограничения перечисленным, циклопропил, циклопентил, циклогексил, норборнил и адамантил. Циклоалкильные группы могут быть незамещенными или замещенными одним, двумя или тремя заместителями, которые независимо выбирают из группы, содержащей низший алкил, галогеналкил, алкокси, тиоалкокси, амино, алкиламино, диалкиламино, гидрокси, галоген, меркапто, нитро, карбоксальдегид, карбокси, алкоксикарбонил и карбоксамид.
“Циклоалкил” включает цис или транс формы. Кроме того, заместители в бициклической системе с мостиковой связью могут находиться в эндо- и экзо- положениях.
Термин “циклоалкенил”, используемый в тексте заявки, отдельно или в сочетании, означает карбоциклическую систему, содержащую от 4 до 8 атомов углерода и одну или несколько двойных связей. Примеры таких циклоалкенильных радикалов включают, без ограничения перечисленным, циклопентенил, циклогексенил, циклопентадиенил и т.п.
Термин “циклоалкилалкил”, используемый в тексте заявки, означает циклоалкильную группу, присоединенную к низшему алкильному радикалу, включающую, без ограничения перечисленным, циклогексилметил.
Термин “галоген”, используемый в тексте заявки, означает I, Br, Cl или F.
Термин “галогеналкил”, используемый в тексте заявки, означает низший алкильный радикал, к которому присоединен по крайней мере один галогеновый заместитель, например, наряду с другими хлорметил, фторэтил, трифторметил и пентафторэтил.
Термин “алкокси”, используемый в тексте заявки, отдельно или в сочетании, означает простой радикал алкил-простой эфир, где термин “алкил” имеет значения, указанные выше. Примеры подходящих радикалов алкил-простой эфир включают, без ограничения перечисленным, метокси, этокси, н-пропокси, изо-пропокси, н-бутокси, изо-бутокси, втор-бутокси, трет-бутокси и т.п.
Термин “алкенокси”, используемый в тексте заявки, отдельно или в сочетании, означает радикал формулы алкенил-O-, при условии, что радикал не является енольным эфиром, где термин “алкенил” имеет значения, указанные выше. Примеры подходящих алкеноксирадикалов включают, без ограничения перечисленным, аллилокси, Е- и Z- 3-метил-2-пропенокси и т.п.
Термин “алкинокси”, используемый в тексте заявки, отдельно или в сочетании, означает радикал формулы алкинил-O-, при условии, что радикал не является инольным эфиром. Примеры подходящих алкиноксирадикалов включают, без ограничения перечисленным, пропаргилокси, 2-бутинилокси и т.п.
Термин “карбоксил”, используемый в тексте заявки, означает радикал карбоновой кислоты -С(O)ОН.
Термин “тиоалкокси” означает радикал тиоэфира формулы алкил-S-, где “алкил” имеет значения, указанные выше.
Термин “карбоксальдегид”, используемый в тексте заявки, означает -C(O)R, где R означает водород.
Термин “карбоксамид” или “амид”, используемый в тексте заявки, означает -C(O)NRaRb, где Ra и Rb каждый независимо означает водород, алкил или любой подходящий заместитель.
Термин “карбокси”, используемый в тексте заявки, означает -С(O)O-.
Термин “алкоксиалкокси”, используемый в тексте заявки, означает RсО-RdO-, где Rc означает низший алкил, имеющий значения, указанные выше, а Rd означает алкилен, где алкилен означает -(CH2)n-, где n’ является целым числом от 1 до 6. Типичные примеры алкоксиалкокси групп включают наряду с прочими метоксиметокси, этоксиметокси, трет-бутоксиметокси.
Термин “алкиламино”, используемый в тексте заявки, означает ReNH-, где Re означает наряду с прочими низший алкил, например этиламино, бутиламино.
Термин “алкениламино”, используемый в тексте заявки, отдельно или в сочетании, означает радикал формулы алкенил-NH- или (алкенил)2N-, где термин “алкенил” имеет значения, указанные выше, при условии, что радикал не является енамином. Примером такого алкениламинорадикала является аллиламинорадикал.
Термин “алкиниламино”, используемый в тексте заявки, отдельно или в сочетании, означает радикал формулы алкинил-NH- или (алкинил)2N-, где термин “алкинил” имеет значения, указанные выше, при условии, что радикал не является амином. Примером такого алкиниламинорадикала является пропаргиламинорадикал.
Термин “диалкиламино”, используемый в тексте заявки, означает RfRgN-, где Rf и Rg независимо выбирают наряду с прочими из группы, содержащей низший алкил, например диэтиламино и метилпропиламино.
Термин “амино”, используемый в тексте заявки, означает H2N-.
Термин “алкоксикарбонил”, используемый в тексте заявки, означает алкоксигруппу, имеющую значения, указанные выше, присоединенную к основному фрагменту молекулы через карбонильную группу. Примеры алкоксикарбонильной группы включают наряду с другими метоксикарбонил, этоксикарбонил и изопропоксикарбонил.
Термин “арил” или “ароматический”, используемый в тексте заявки, отдельно или в сочетании, означает замещенную или незамещенную карбоциклическую ароматическую группу, содержащую приблизительно от 6 до 12 атомов углерода, такую как фенил, нафтил, инденил, инданил, азуленил, фруоренил и антраценил; или гетероциклическую ароматическую группу, содержащую по крайней мере один эндоциклический атом N, О или S, такую как фурил, тиенил, пиридил, пирролил, оксазолил, тиазолил, имидазолил, пиразолил, 2-пиразолинил, пиразолидинил, изоксазолил, изотиазолил, 1,2,3-оксадиазолил, 1,2,3-триазолил, 1,3,4-тиадиазолил, пиридазинил, пиримидинил, пиразинил, 1,3,5-триазинил, 1,3,5-тритианил, индолизинил, индолил, изоиндолил, 3Н-индолил, индолинил, бензо[b]фуранил, 2,3-дигидробензофуранил, бензо[b]тиофенил, 1Н-индазолил, бензимидазолил, бензтиазолил, пуринил, 4Н-хинолизинил, изохинолинил, циннолинил, фталазинил, хиназолинил, хиноксалинил, 1,8-нафтиридинил, птеридинил, карбазолил, акридинил, феназинил, фенотиазинил, феноксиазинил, пиразоло[1,5-с]триазинил и т.п. В терминах “аралкил” и “алкиларил” термин “алкил” имеет значения, указанные выше. Циклы могут иметь несколько заместителей.
Термин “аралкил”, используемый в тексте заявки, отдельно или в сочетании, означает алкил, замещенный арилрадикалом, причем термины “алкил” и “арил” имеют значения, указанные выше. Типичные примеры радикалов “аралкил” включают, без ограничения перечисленным, фенилметил, фенетил, фенилгексил, дифенилметил, пиридилметил, тетразолилметил, фурилметил, имидазолилметил, индолилметил, тиенилпропил и т.п.
Термин “аралкенил”, используемый в тексте заявки, отдельно или в сочетании, означает алкенил, замещенный арилрадикалом, причем термины “арил” и “алкенил” имеют значения, указанные выше.
Термин “ариламино”, используемый в тексте заявки, отдельно или в сочетании, означает радикал формулы арил-NH-, где “арил” имеет значения, указанные выше. Примеры радикалов “ариламино” включают, без ограничения перечисленным, фениламино(анилидо), нафтиламино, 2-, 3- и 4-пиридиламино и т.п.
Термин “биарил”, используемый в тексте заявки, отдельно или в сочетании, означает радикал формулы арил-арил, где термин “арил” имеет значения, указанные выше.
Термин “тиоарил”, используемый в тексте заявки, отдельно или в сочетании, означает радикал формулы арил-S-, где термин “арил” имеет значения, указанные выше. Примером тиоарильного радикала является тиофенилрадикал.
Термин “ароил”, используемый в тексте заявки, отдельно или в сочетании, означает радикал формулы арил-СО-, где термин “арил” имеет значения, указанные выше. Примеры типичных радикалов ароматического ацила включают, без ограничения перечисленным, бензоил, 4-галогенбензоил, 4-карбоксибензоил, нафтоил, пиридилкарбонил и т.п.
Термин “гетероциклил”, используемый в тексте заявки, отдельно или в сочетании, означает неароматический 3-10-членный цикл, содержащий по крайней мере один эндоциклический атом N, О или S. Гетероцикл по выбору может быть конденсирован с арилом. Гетероцикл может быть также по выбору замещенным по крайней мере одним заместителем, который независимо выбирают из группы, содержащей наряду с прочими водород, галоген, гидроксил, амино, нитро, трифторметил, трифторметокси, алкил, аралкил, алкенил, алкинил, арил, циано, карбокси, карбоалкокси, карбоксиалкил, оксо, арилсульфонил и аралкиламинокарбонил.
Термин “алкилгетероциклил”, используемый в тексте заявки, означает алкильную группу, имеющую значения, указанные выше, присоединенную к основному фрагменту молекулы через гетероциклическую группу, включая, без ограничения перечисленным, 2-метил-5-тиазолил, 2-метил-1-пирролил и 5-этил-2-тиофенил.
Термин “гетероциклилалкил”, используемый в тексте заявки, означает гетероциклическую группу, имеющую значения, указанные выше, присоединенную к основному фрагменту молекулы через алкильную группу, включая, без ограничения перечисленным, 2-тиенилметил, 2-пиридинилметил и 2-(1-пиперидинил)этил.
Термин “аминаль”, используемый в тексте заявки, означает полуацеталь, имеющий структуру RhC(NRiRj)(NRkRi)-, где Rh, Ri, Rj, Rk и Rl каждый независимо означает водород, алкил или любой подходящий заместитель.
Термин “сложный эфир”, используемый в тексте заявки, означает -C(O)Rm, где Rm означает водород, алкил или любой подходящий заместитель.
Термин “карбамат”, используемый в тексте заявки, означает производные карбаминовой кислоты NH2C(O)OH.
Термин “оптические изомеры” в контексте настоящей заявки относится к соединениям, которые различаются только стереохимией по крайней мере у одного атома, включая энантиомеры, диастереомеры и рацематы.
Использование вышеуказанных терминов имеет целью охватить замещенные и незамещенные фрагменты молекулы. Замещение может быть осуществлено одной или более группами, такими как спирты, простые эфиры, сложные эфиры, амиды, сульфоны, сульфиды, гидроксил, нитро, циано, карбокси, амины, гетероатомы, низший алкил, низший алкокси, низший алкоксикарбонил, алкоксиалкокси, ацилокси, галогены, трифторметокси, трифторметил, алкил, аралкил, алкенил, алкинил, арил, циано, карбокси, карбоалкокси, карбоксиалкил, циклоалкил, циклоалкилалкил, гетероциклил, алкилгетероциклил, гетероциклилалкил, оксо, арилсульфонил и аралкиламинокарбонил или любой из заместителей, указанных в предшествующих разделах или любой из тех заместителей, которые присоединены непосредственно или через подходящие связующие группы. Обычно связующими группами являются короткие цепи, содержащие 1-3 атома, представляющие любую комбинацию следующих структур, такие как -С-, -С(O)-, -NH-, -S-, -S(O)-, -О-, -С(O)O- или -S(O)O-. Циклы могут иметь несколько заместителей.
Термины “электроноакцепторный” или “электронодонорный” относятся к способности какого-либо заместителя принимать или отдавать электроны, относительно соответствующей способности атома водорода, если он занимает то же положение в молекуле. Эти термины известны специалистам в данной области техники и обсуждаются в книге J. March, Advanced Organic Chemistry (Современная органическая химия), (1985), стр.16-18, включенной в текст настоящей заявки в качестве ссылки. Электроноакцепторные группы включают, помимо прочих, галоген, нитро, карбоксил, низший алкенил, низший алкинил, карбоксальдегид, карбоксамидо, арил, четвертичный аммоний, трифторметил, сульфонил и арил(низший алканоил). Электронодонорные группы включают, помимо прочих, гидрокси, низший алкил, амино, низший алкиламин, ди(низший алкил)амино, арилокси, меркапто, низший алкилтио, низший алкилмеркапто и дисульфид. Специалисту в данной области техники следует учитывать, что вышеупомянутые заместители могут иметь электронодонорные или электроноакцепторные свойства в различных химических условиях. Кроме того, в настоящее изобретение включены любые сочетания заместителей, выбранных из вышеуказанных групп.
Наиболее предпочтительными электронодонорными или электроноакцепторными группами являются галоген, нитро, алканоил, карбоксальдегид, арилалканоил, арилокси, карбоксил, карбоксамид, циано, сульфонил, сульфоксид, гетероциклил, гуанидин, четвертичный аммоний, низший алкенил, низший алкинил, соли сульфония, гидрокси, низший алкокси, низший алкил, амино, низший алкиламино, ди(низший алкил)амино, амино-низший алкилмеркапто, меркаптоалкил, алкилтио, алкилдитио, карбокси низший алкил, арилалкокси, алканоиламино, алканоил(низший алкил)амино, низший алкилсульфониламино, арилсульфониламино, алкилсульфонил(низший алкил)амино, арилсульфонил(низший алкил)амино, низший алкилкарбоксамид, ди(низший алкил)карбоксамид, сульфонамид, низший алкилсульфонамид, ди(низший алкил )сульфонамид, низший алкилсульфонил и арилсульфонил.
Термин “композиция (состав)”, используемый в тексте заявки, предназначен для обозначения продукта, включающего определенные компоненты в определенных количествах, а также любого продукта, который образуется, прямо или косвенно, из сочетания определенных компонентов в определенных количествах.
Цикл, включающий Y в формуле II или цикл Q в формулах I и III, может означать моноциклический гетероцикл или ароматическое кольцо, или бициклическую систему. Если более одного Y означают C(R2)(R3), то заместители атома С в каждом Y могут быть объединены с образованием цикла. Кроме того, в кольцевых структурах, включающих Y, две из независимых R2, R3, R5 и R7 групп могут быть объединены с образованием цикла.
Подходящие заместители для групп арил, алкил, циклоалкил, гетероциклил или цикла, определенного как Y, как указано выше, включают, если они имеются, спирты, амины, гетероатомы или любые сочетания следующих групп: арил, алкил, алкокси, алкоксиалкокси, алкил, циклоалкил или гетероциклил, присоединенных непосредственно или через подходящие связующие группы. Обычно связующими группами являются короткие цепи, содержащие 1-3 атома, представляющие любую комбинацию следующих структур, таких как С, С=O, СО2, О, N, S, S=O, SO2, как например, наряду с прочими, простые эфиры, амиды, амины, производные мочевины, сульфамиды, сульфонамиды и т.п.
В формулах I и IV-VI ранее определенные группы R1 и R17 могут потенциально замещать кольца, к которым они присоединены. В случае группы R1, если q равно нулю, то кольцо, к которому она присоединена, является незамещенным, содержащим атомы водорода в каждом возможном положении. Аналогично, в случае группы R17, если q равно нулю, то кольцо, к которому она присоединена, является незамещенным, содержащим атомы водорода в каждом возможном положении.
Например, R1, R2, R3, R5, R7, R11 и R13 в вышеуказанных формулах I – VI независимо могут означать, без ограничения перечисленным, следующие группы: фенил, тиенилметил, изобутил, н-бутил, 2-тиенилметил, 1,3-тиазол-2-илметил, бензил, тиенил, 3-пиридинилметил, 3-метил-1-бензо-тиофен-2-ил, аллил, 3-метоксибензил, пропил, 2-этоксиэтил, циклопропилметил, бензилсульфанилметил, бензилсульфонилметил, фенилсульфанилметил, фенетилсульфанилметил, 3-фенилпропил-сульфанилметил, 4-((2-толуидинокарбонил)амино)бензил, 2-пири-динилэтил, 2-(1Н-индол-3-ил)этил, 1Н-бензимидазол-2-ил, 4-пиперидинилметил, 3-гидрокси-4-метоксибензил, 4-гидроксифенетил, 4-аминобензил, фенилсульфонилметил, 4-(ацетиламино)фенил, 4-метоксифенил, 4-аминофенил, 4-хлорфенил, (4-(бензилсульфонил)амино)фенил, (4-(метилсульфонил)амино)фенил, 2-аминофенил, 2-метилфенил, изопропил, 2-оксо-1-пирролидинил, 3-(метилсульфанил)пропил, (пропилсульфанил)метил, октилсульфанилметил, 3-аминофенил, 4-((2-толуидинокарбонил)амино)фенил, 2-((метилбензил)амино)бензил, метилсульфанилэтил или этилсульфанилметил.
R4 и R13 могут быть объединены с образованием цикла, такого как, наряду с прочими, пирролидино, 1-пиперидино, 4-метил-1-пиперазино, 4-ацето-1-пиперазино и 4-морфилино. R9 и R10 могут быть объединены с образованием цикла, такого как циклопропил, циклобутил, циклопентил и циклогексил.
Заместитель R4 в вышеуказанных формулах I и II может означать, без ограничения перечисленным, следующие группы: 1,3-бензодиоксол-5-ил, 1-нафтил, тиенил, 4-изобутоксифенил, 2,6-диметилфенил, аллилоксифенил, 3-бром-4-метоксифенил, 4-бутоксифенил, 1-бензофуран-2-ил, 2-тиенилметил, фенил, метилсульфанил, фенилсульфанил, фенетилсульфанил, 4-бром-2-тиенил, 3-метил-2-тиенил или 4,5-дигидро-1,3-оксазол-2-ил.
Заместители R6 и R8 в вышеуказанных формулах I, II и III могут означать без ограничения перечисленным водород, бутил, бензил, бензилоксиметил, этил, пропил, фенилсульфанилметил, бензилсульфанилметил, метилсульфанилэтил, этилсульфанилметил, метил или карбоксиэтил.
Сокращения.
На схемах синтеза и в Примерах использованы следующие сокращения: ВОС означает трет-бутилоксикарбонил, EtOAc означает этилацетат, ДМФ означает диметилформамид, ТГФ означает тетрагидрофуран, TEA означает триэтиламин, Tos означает п-толуолсульфонил, ДЦКД означает дициклогексилкарбодиимид, ГОБТ означает 1-гидроксибензотриазол, ТФУА означает ангидрид трифторуксуной кислоты, NMM означает N-метилморфолин, ДИПЕА означает диизопропилэтиламин, ДХМ означает дихлорметан, ГМДСЛ означает гексаметилдисилазид лития, ГМДСН означает гексаметилдисилазид натрия, КДИ означает 1,1′-карбонилдиимидазол, ГБТУ – означает гексафторфосфат О-бензотриазол-1-ил-N,N,N’,N’-тетраметилурония, ЭКД означает гидрохлорид 1-[3-(диметиламино)пропил]-3-этилкарбодиимида, TBS означает солевой ТРИС-буферный раствор, LDA (ЛДА) означает литийдиизопропиламид, DME (ДМЭ) означает диметоксиэтан. Для аминокислот используются следующие сокращения: С означает L-цистеин, D означает L-аспарагиновую кислоту, Е означает L-глутаминовую кислоту, G означает глицин, Н означает L-гистидин, I означает L-изолейцин, L означает L-лейцин, N означает L-аспарагин, Р означает L-пролин, Q означает L-глутамин, S означает L-серин, Т означает L-треонин, V означает L-валин, W означает L-триптофан.
Примеры способов, которые были использованы для синтеза соединений, приведены на следующих схемах синтеза.
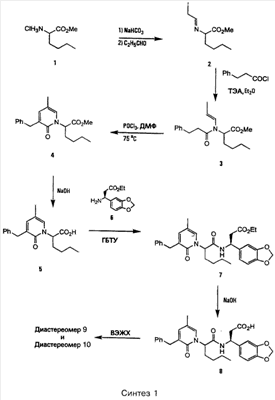
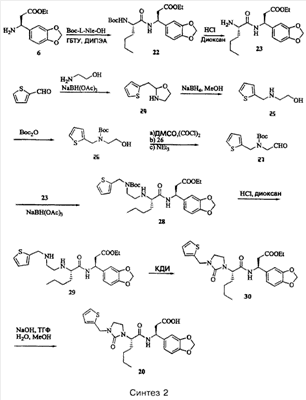
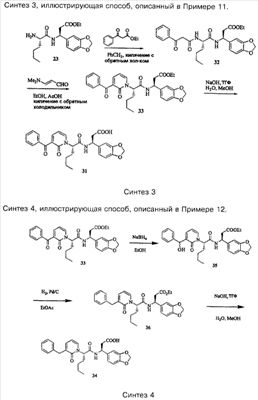
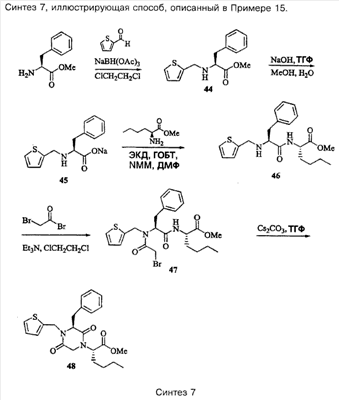
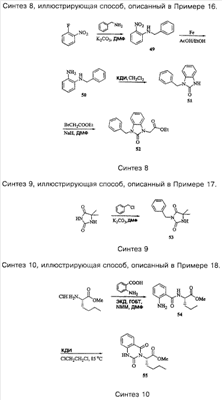
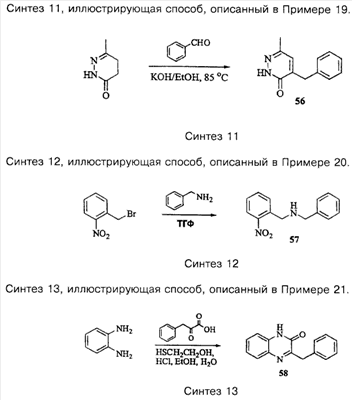
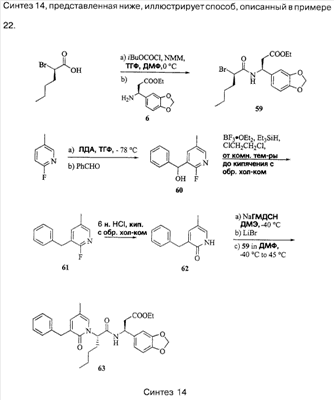
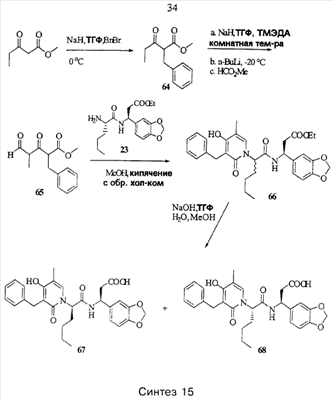
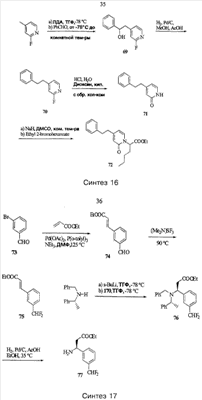
Подробное описание способа получения отдельных соединений по настоящему изобретению представлено в Примерах.
Соединения по настоящему изобретению могут быть использованы в форме фармацевтически приемлемых солей, полученных из органических и неорганических кислот. Определение “фармацевтически приемлемая соль” относится к тем солям, которые, в соответствии со сложившимся в медицине мнением, пригодны для контакта с тканями организма человека и низших животных, не вызывая заметных признаков токсичности, раздражения, аллергической реакции и т.п. и соответствуют приемлемому соотношению польза/риск. Фармацевтически приемлемые соли известны в данной области техники. Например, S.M. Berge и соавт. подробно описывают фармацевтически приемлемые соли в статье J. Pharmaceutical Sciences 1977, 66:1. Соли могут быть приготовлены in situ на конечной стадии выделения и очистки соединений по изобретению или на отдельной стадии путем взаимодействия свободного основания с подходящей органической кислотой. Типичные кислотно-аддитивные соли включают, без ограничения перечисленным, ацетат, адипат, альгинат, цитрат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, камфорат, камфорсульфонат, диглюконат, глицерофосфат, гемисульфат, гептаноат, гексаноат, фумарат, гидрохлорид, гидробромид, гидроиодид, 2-гидроксиэтансульфонат (изотионат), лактат, малеат, метансульфонат, никотинат, 2-нафталинсульфонат, оксалат, пальмитоат, пектинат, персульфат, 3-фенилпропионат, пикрат, пивалат, пропионат, сукцинат, тартрат, тиоцианат, фосфат, глутамат, бикарбонат, п-толуолсульфонат и ундеканоат. Основные азотсодержащие группы могут быть превращены в производные четвертичного аммония с помощью таких агентов, как низшие алкилгалогениды, такие как метил-, этил-, пропил- и бутилхлориды, бромиды и иодиды; диалкилсульфаты, такие как диметил-, диэтил-, дибутил- и диамилсульфаты; галогениды с длинной цепью, такие как децил-, лаурил-, миристил- и стеарилхлориды, бромиды и иодиды; арилалкилгалогениды, такие как бензил- и фенетилбромиды и др. Таким образом получают продукты, растворимые или диспергируемые в воде или масле. Примеры кислот, которые могут быть использованы для получения фармацевтически приемлемых кислотно-аддитивных солей включают такие неорганические кислоты, как соляную кислоту, бромисто-водородную кислоту, серную кислоту и фосфорную кислоту, а также такие органические кислоты, как щавелевую кислоту, малеиновую кислоту, янтарную кислоту и лимонную кислоту.
Основно-аддитивные соли могут быть получены in situ на конечной стадии выделения и очистки соединений по настоящему изобретению путем взаимодействия остатка, содержащего карбоновую кислоту, с подходящим основанием, таким как гидроксид, карбонат или бикарбонат фармацевтически приемлемого катиона металла, либо с аммиаком или первичным, вторичным или третичным органическим амином. Фармацевтически приемлемые соли включают, без ограничения перечисленным, катионы щелочных или щелочно-земельных металлов, таких как литий, натрий, калий, кальций, магний, алюминий и т.п., а также нетоксичные катионы четвертичного аммония и аминов, включающих, помимо прочих, аммоний, тетраметиламмоний, тераэтиламмоний, метиламмоний, диметиламмоний, триметиламмоний, триэтиламмоний, диэтиламмоний и этиламмоний. Другие типичные органические амины, применимые для образования основно-аддитивных солей, включают этилендиамин, этаноламин, диэтаноламин, пиперидин, пиперазин и т.п.
Лекарственные формы для местного введения соединения по настоящему изобретению включают порошки, спреи, мази и ингаляционные средства. Активное соединение смешивают в стерильных условиях с фармацевтически приемлемым носителем или любыми необходимыми консервантами, буферными агентами или газами-вытеснителями, которые могут потребоваться. Подразумевается, что офтальмологические составы, глазные мази, порошки и растворы также входят в область настоящего изобретения.
Фактические уровни доз активных компонентов в фармацевтических композициях по настоящему изобретению могут быть изменены таким образом, чтобы получить количество активного компонента (активных компонентов), которое является эффективным для достижения необходимого терапевтического эффекта для конкретного пациента, композиции и способа введения. Выбранный уровень доз зависит от активности конкретного соединения, способа введения, тяжести патологического состояния, подвергаемого лечению, а также общего состояния и предшествующей истории болезни пациента. Однако квалифицированные специалисты начинают с доз соединения на уровне ниже необходимой дозы, требуемой для достижения необходимого терапевтического эффекта, и постепенно увеличивают дозировку до достижения необходимого эффекта.
В случае применения в вышеупомянутых или иных способах лечения терапевтически эффективное количество одного из соединений по настоящему изобретению может быть использовано в чистой форме или, если такие формы существуют, в форме фармацевтически приемлемой соли, сложного эфира или пролекарства. В ином случае, соединение может быть введено в виде фармацевтически приемлемой композиции, содержащей соединение, о котором идет речь, в сочетании с одним или более фармацевтически приемлемых наполнителей. Определение “терапевтически эффективное количество” соединения по настоящему изобретению означает количество этого соединения, достаточное для лечения нарушений при приемлемом соотношении польза/риск, допустимом для любого вида лечения. Однако следует понимать, что общее суточное потребление соединений и композиций по настоящему изобретению определяется лечащим врачом в соответствии со сложившимся в медицине мнением. Индивидуальный уровень терапевтически эффективной дозы для любого конкретного пациента зависит от ряда факторов, включая нарушение, подлежащее лечению, и тяжесть нарушения; активность конкретного применяемого соединения, конкретная применяемая композиция; возраст, вес тела, общее состояние здоровья, пол и режим питания пациента; время введения, способ введения, а также скорость выведения конкретного применяемого соединения; продолжительность лечения; лекарственные препараты, применяемые в сочетании или одновременно с конкретным применяемым соединением; а также подобные факторы, хорошо известные в медицинской практике. Например, квалифицированные специалисты начинают с доз соединения на уровне ниже необходимой для достижения необходимого терапевтического эффекта и постепенно увеличивают дозировку до достижения необходимого эффекта.
Общая суточная доза соединения по настоящему изобретению, введенная человеку или низшему животному, может находиться в диапазоне от приблизительно 0,0001 до приблизительно 1000 мг/кг/сутки. Для орального введения более предпочтительными могут быть дозы в диапазоне от приблизительно 0,001 до приблизительно 5 мг/кг/сутки. При необходимости, эффективная суточная доза может быть разделена для введения на несколько доз; следовательно, композиции с однократной дозой могут содержать такое количество доз или порций, которые составляют суточную дозу.
Настоящее изобретение также относится к разработке фармацевтических композиций, содержащих соединения по настоящему изобретению, переработанные совместно с одним или более нетоксичными фармацевтически приемлемыми носителями. Эти фармацевтические композиции могут быть составлены специально для орального введения в твердой или жидкой форме, для парентеральных инъекций или для ректального введения.
Фармацевтические композиции по настоящему изобретению могут быть введены людям и другим млекопитающим оральным, ректальным, внутриполостным, внутривагинальным, внутрибрюшинным, местным способом (в виде порошков, мазей или капель), трансбуккальным способом, либо в форме перорального или назального спреев. Термин “парентеральный способ” в контексте данной заявки относится к способам введения, включающим внутривенную, внутримышечную, внутрибрюшинную, внутригрудинную, подкожную и внутрисуставную инъекцию и вливание.
Другой аспект настоящего изобретения относится к разработке фармацевтической композиции, содержащей компонент по настоящему изобретению и физиологически переносимый разбавитель. Настоящее изобретение включает одно или более соединения, как описано выше, переработанных в композиции совместно с одним или более нетоксичными физиологически переносимыми или приемлемыми разбавителями, носителями, адъювантами или наполнителями, которые в тексте настоящей заявки все вместе обозначены термином “разбавителями”, для парентеральной инъекции, интраназальной доставки, для перорального введения в твердой или жидкой формах, для ректального или местного введения и т.п.
Композиции могут также быть введены местным способом через катетер для доставки к участку-мишени, через внутрикоронарный стент (трубчатое устройство, изготовленное из тонкой проволочной сетки), или с помощью биодеградабельных полимеров. С целью направленной доставки соединения могут быть также получены в виде комплексов с лигандами, такими как антитела.
Композиции, пригодные для парентеральный инъекции могут включать в свой состав физиологически приемлемые стерильные водные и неводные растворы, дисперсии, суспензии или эмульсии и стерильные порошки, предназначенные для приготовления стерильных растворов или дисперсий для инъекций. Примеры подходящих водных или неводных носителей, разбавителей, растворителей или наполнителей включают воду, этанол, полиолы (пропиленгликоль, полиэтиленгликоль, глицерин и т.п.), растительные масла (такие как оливковое масло), сложные органические эфиры для инъекций, такие как этилолеат, а также их подходящие смеси.
Эти композиции могут также содержать адъюванты, такие как консерванты, смачивающие, эмульгирующие или диспергирующие агенты. Предотвращение воздействия микроорганизмов может быть обеспечено различными противомикробными и противогрибковыми агентами, например такими как парабены, хлорбутанол, фенол, сорбиновую кислоту и т.п. Может также потребоваться включение изотонических агентов, например сахаров, хлористого натрия и т.п. Пролонгированнная абсорбция фармацевтической формы для инъекции может быть осуществлена с помощью агентов замедляющих абсорбцию, например, моностеарата алюминия и желатина.
Помимо активных соединений суспензии могут содержать суспендирующие агенты, такие как, например, этоксилированные изостеариловые спирты, сложные эфиры полиоксиэтиленсорбита и сорбитола, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакант, либо смеси этих веществ, и т.п.
Соответствующая текучесть может быть обеспечена, например, путем использования материалов для покрытий, таких как лецитин, путем формирования требуемых размеров частиц в случае дисперсий, а также путем применения ПАВ.
В некоторых случаях, для пролонгирования действия лекарственного средства, необходимо замедлить абсорбцию лекарственного средства, введенного подкожным или внутримышечным способом. Это может быть достигнуто путем использования жидкой суспензии кристаллического или аморфного материала, имеющего низкую растворимость в воде. Скорость абсорбции лекарственного средства в этом случае зависит от скорости растворения, которая, в свою очередь, может зависеть от размеров кристаллов и формы кристаллов. В другом случае замедление абсорбции парентерально введенной лекарственной формы осуществляют растворением или суспендированием лекарственного средства в масляном наполнителе.
Формы пролонгированного действия для инъекций получают в виде микроинкапсулированного матрикса лекарственного средства в биодеградабельных полимерах, таких как полилактид-полигликоль.
В зависимости от соотношения лекарственное средство/полимер и природы конкретного применяемого полимера можно контролировать скорость высвобождения лекарственного средства. Примеры других биодеградабельных полимеров включают поли(ортоэфиры) и поли(ангидриды). Пролонгированные инъекционные составы получают также путем включения лекарственного средства в липосомы или микроэмульсии, совместимые с тканями организма. Инъекционные составы могут быть стерилизованы, например, фильтрацией через задерживающие бактерии фильтры или путем добавления стерилизующих агентов в виде стерильных твердых композиций, которые могут быть растворены или диспергированы в стерильной воде или другой стерильной среде для инъекций непосредственно перед применением.
Твердые лекарственные формы для орального введения включают капсулы, таблетки, пилюли, порошки и гранулы. В твердых лекарственных формах активный компонент может быть смешан по крайней мере с одним инертным фармацевтически приемлемым наполнителем или носителем, таким как цитрат натрия или дикальций фосфат и/или а) наполнителями или сухими разбавителями, такими как крахмалы, лактоза, сахароза, глюкоза, маннит или кремниевую кислоту; б) связующими, такими как карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и аравийская камедь; в) увлажнителями, такими как глицерин; г) дезинтегрирующими агентами, такими как агар-агар, карбонат кальция, картофельный или тапиоковый крахмал, альгиновую кислоту, некоторые силикаты и карбонат натрия; д) агентами, замедляющими растворение, такими как парафин; е) ускорителями абсорбции, такими как четвертичные аммониевые соединения; ж) смачивающими агентами, такими как цетиловый спирт и моностеарат глицерина; з) адсорбентами, такими как каолин и бентонитовая глина и и) замасливателями, такими как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия, а также их смеси. В случае капсул, таблеток или пилюль лекарственные формы могут также содержать буферные агенты.
Твердые композиции аналогичного типа могут также быть использованы в качестве наполнителей в мягких или твердых желатиновых капсулах с использованием таких наполнителей, как лактоза или молочный сахар, а также высокомолекулярные полиэтиленгликоли и т.п. Твердые лекарственные формы: таблетки, драже, капсулы, пилюли и гранулы могут быть изготовлены с покрытиями и оболочками, такими как энтеросолюбильные покрытия и другие покрытия, хорошо известные в фармацевтических композициях. Они могут по выбору содержать контрастные агенты и могут быть также получены в виде композиций, высвобождающих активный компонент (активные компоненты) только, или предпочтительно, в определенном участке желудочно-кишечного тракта, по выбору, замедленным способом. Примеры обволакивающих композиций, которые могут быть использованы, включают полимерные соединения и воски.
Активные соединения могут также быть изготовлены в форме микрокапсул, если необходимо, в смеси с одним или более вышеупомянутых наполнителей.
Жидкие лекарственные формы для орального введения включают фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы и эликсиры. Помимо активных соединений, жидкие лекарственные формы могут содержать инертные разбавители, обычно применяемые в данной области фармацевтики, такие как, например, вода или другие растворители; солюбилизирующие агенты и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла (прежде всего, хлопковое, арахисовое, кукурузное, масло зародышей зерновых культур, оливковое, касторовое и кунжутное масла), глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоли и сложные эфиры жирных кислот и сорбитана, а также их смеси.
Кроме инертных разбавителей композиции для орального введения могут также включать адъюванты, такие как смачивающие агенты, эмульгаторы и суспендирующие агенты, подсластители, вкусовые добавки и ароматизаторы.
Композиции для ректального или вагинального введения предпочтительно представляют собой суппозитории, которые могут быть получены путем смешивания соединений по настоящему изобретению с подходящими нераздражающими наполнителями или носителями, такими как масло какао, полиэтиленгликоль или воск для приготовления суппозиториев, которые являются твердыми при комнатной температуре, но жидкими при температуре тела и, следовательно, плавятся в прямой кишке или полости влагалища с высвобождением активного компонента.
Соединения по настоящему изобретению могут быть введены в виде липосом. Как известно специалистам в данной области медицины, липосомы обычно получают из фосфолипидов или других групп липидов. Липосомы образуют одно- и многослойные гидратированные жидкие кристаллы, диспергированные в водной среде. Может быть использован любой нетоксичный, физиологически приемлемый и подвергающийся метаболизму липид, способный образовывать липосомы. Композиции по настоящему изобретению в липосомной форме могут содержать кроме соединения по настоящему изобретению стабилизаторы, консерванты, наполнители и т.п. Предпочтительные липиды представляют собой натуральные и синтетические фосфолипиды и фосфатидилхолины (лецитины), применяемые раздельно или совместно друг с другом.
Способы образования липосом известны в данной области техники. Например, см. в обзоре Methods in Cell Biology (Методы биологии клеток) под ред. Prescott, т.XIV, Academic Press, New York, N.Y. (1976), стр.33 и далее.
Термин “фармацевтически приемлемые пролекарства” в контексте настоящей заявки означают соединения по настоящему изобретению, которые в соответствии со сложившимся в медицине мнением являются пригодными для применения в контакте с тканями организма человека и низших животных без заметных признаков токсичности, раздражения, аллергической реакции и т.п., соответствуют приемлемому соотношению польза/риск и эффективны при использовании, а также, если возможно, означают цвиттер-ионные формы соединений по настоящему изобретению. Пролекарства по настоящему изобретению могут быть быстро превращены in vivo в основное соединение вышеприведенной формулы, например за счет гидролиза в крови. Подробное обсуждение приводится в работах Т.Higuchi and V.Stella,” Pro-drugs as Novel Delivery Systems” (Пролекарства как новые системы доставки), т.14 A.C.S. Symposium Series и в книге “Bioreversible Carriers in Drug Design” (Биологически обратимые носители в конструировании лекарственных средств) под ред. Edward В. Roche, American Pharmaceutical Association and Pergamon Press (1987), включенных в текст настоящей заявки в качестве ссылки.
Соединения по настоящему изобретению, которые образуются за счет превращения in vivo другого соединения, введенного млекопитающему, также входят в область настоящего изобретения.
Соединения по настоящему изобретению могут существовать в виде стереоизомеров, в которых присутствуют асимметрические или хиральные центры. Эти стереоизомеры обозначаются знаками “R” или “S”, в зависимости от расположения заместителей вокруг хирального атома углерода. Настоящее изобретение включает различные стереоизомеры и их смеси. Стереоизомеры включают энантиомеры и диастереоизомеры, а также смеси энантиомеров или диастереоизомеров. Отдельные стереоизомеры соединений по настоящему изобретению могут быть получены синтетическим путем из выпускаемых в промышленности исходных материалов, содержащих асимметрические или хиральные центры, либо путем получения рацемических смесей с последующим их разделением способом, известным специалистам в данной области. Примерами этих способов разделения являются (1) связывание смеси энантиомеров с хиральным вспомогательным веществом, разделение образующейся смеси диастереомеров путем перекристаллизации или хроматографии и отделение оптически чистого продукта от вспомогательного вещества или (2) прямое разделение смеси оптических энантиомеров на хиральных хроматографических колонках.
Соединения по настоящему изобретению могут существовать как в несольватированных, так и в сольватированных, в том числе гидратированных формах, таких как полугидраты. Обычно для целей изобретения сольватированные формы с фармацевтически приемлемыми растворителями, такими как вода и этанол, наряду с прочими растворителями эквивалентны несольватированным формам.
Другой аспект настоящего изобретения включает способ ингибирования связывания 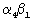 интегрина с VCAM-1. Способ по настоящему изобретению может быть использован in vitro или in vivo. В соответствии со способом по настоящему изобретению клетку, экспрессирующую интегрина с VCAM-1. Способ по настоящему изобретению может быть использован in vitro или in vivo. В соответствии со способом по настоящему изобретению клетку, экспрессирующую 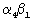 интегрин, вводят в контакт с клеткой, экспрессирующей VCAM-1, в присутствии эффективно ингибирующего количества соединения по настоящему изобретению. Клетка экспрессирующая интегрин, вводят в контакт с клеткой, экспрессирующей VCAM-1, в присутствии эффективно ингибирующего количества соединения по настоящему изобретению. Клетка экспрессирующая 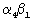 интегрин, может быть природным лейкоцитом, тучной клеткой (мастоцитом) или клеткой иного типа, которая экспрессирует интегрин, может быть природным лейкоцитом, тучной клеткой (мастоцитом) или клеткой иного типа, которая экспрессирует  4 4 1 в организме на клеточной поверхности, или клеткой, трансформированной (трансфектированной) вектором экспрессии, содержащим полинуклеотид (например, геномную ДНК или кДНК), кодирующий 1 в организме на клеточной поверхности, или клеткой, трансформированной (трансфектированной) вектором экспрессии, содержащим полинуклеотид (например, геномную ДНК или кДНК), кодирующий 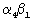 интегрин. В наиболее предпочтительном варианте воплощении изобретения интегрин. В наиболее предпочтительном варианте воплощении изобретения 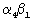 интегрин присутствует на поверхности лейкоцита, такого как моноцит, лимфоцит или гранулоцит (например, эозинофил или базофил). интегрин присутствует на поверхности лейкоцита, такого как моноцит, лимфоцит или гранулоцит (например, эозинофил или базофил).
Клетка, экспрессирующая VCAM-1, может быть природной клеткой (например, эндотелиальной клеткой) или клеткой, трансформированной (трансфектированной) вектором экспресии, содержащим полинуклеотид, который кодирует VCAM-1. Способы получения трансфертных клеток, экспрессирующих VCAM-1, известны в данной области техники.
В том случае, когда VCAM-1 присутствует на поверхности клетки, его экспрессия предпочтительно индуцируется воспалительными цитокинами, такими как  -фактор некроза опухоли, интерлейкин-4 и интерлейкин-1 -фактор некроза опухоли, интерлейкин-4 и интерлейкин-1 . .
Если в организме имеются клетки, экспрессирующие 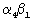 интегрин и VCAM-1, в живой организм вводят эффективное количество соединения по настоящему изобретению. Соединение предпочтительно находится в составе фармацевтической композиции по настоящему изобретению. Способ по настоящему изобретению прежде всего используется при лечении заболеваний, ассоциированных с неконтролируемой миграцией лейкоцитов к поврежденной ткани. Такие заболевания включают, без ограничения перечисленным, астму, атеросклероз, ревматический полиартрит, аллергию, рассеянный склероз, волчанку, воспаление кишечника, отторжение трансплантата, повышенную контактную чувствительность, диабет I типа, лейкемию, а также рак мозга. интегрин и VCAM-1, в живой организм вводят эффективное количество соединения по настоящему изобретению. Соединение предпочтительно находится в составе фармацевтической композиции по настоящему изобретению. Способ по настоящему изобретению прежде всего используется при лечении заболеваний, ассоциированных с неконтролируемой миграцией лейкоцитов к поврежденной ткани. Такие заболевания включают, без ограничения перечисленным, астму, атеросклероз, ревматический полиартрит, аллергию, рассеянный склероз, волчанку, воспаление кишечника, отторжение трансплантата, повышенную контактную чувствительность, диабет I типа, лейкемию, а также рак мозга.
Введение предпочтительно осуществляют внутрисосудистым, подкожным, интраназальным, чрескожным или оральным способами.
Настоящее изобретение относится также к способу селективного ингибирования связывания 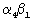 интегрина с белком, включающему контактирование интегрина с белком в присутствии эффективного ингибирующего количества соединения по настоящему изобретению. В предпочтительном варианте воплощения изобретения, интегрина с белком, включающему контактирование интегрина с белком в присутствии эффективного ингибирующего количества соединения по настоящему изобретению. В предпочтительном варианте воплощения изобретения,  4 4 1 интегрин экспрессируется на повехности клетки, природной или трансформированной с целью экспресии 1 интегрин экспрессируется на повехности клетки, природной или трансформированной с целью экспресии 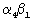 интегрина. интегрина.
Белок, с которым связывается 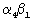 интегрин может быть экспрессирован либо на клеточной поверхности, либо входить в состав внеклеточного матрикса. Предпочтительными белками, прежде всего, являются фабронектин или инвазин. интегрин может быть экспрессирован либо на клеточной поверхности, либо входить в состав внеклеточного матрикса. Предпочтительными белками, прежде всего, являются фабронектин или инвазин.
Способность соединений по настоящему изобретению ингибировать связывание подробно описано ниже в разделе Примеры. Эти примеры приведены для описания предпочтительных вариантов воплощения и полезности настоящего изобретения и не предназначены для ограничения данного изобретения, если иное не указано в прилагаемых пунктах формулы изобретения.
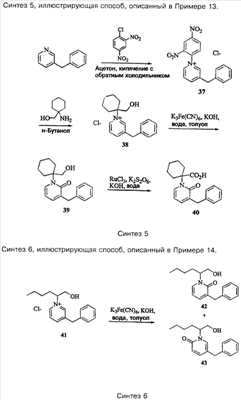
Пример 1
Соединение 8,(3S)-3-(1,3-бензодиоксол-5-ил)-3-((2R,S)-2-(3-бензил-5-метил-2-оксо-1(2Н)-пиридинил)гексаноиламино)пропионовую кислоту, имеющую структуру, указанную ниже, синтезируют по следующей методике.
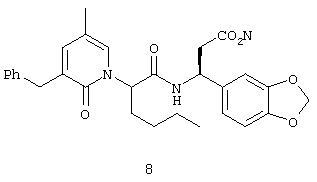
Номера соединений в данном Примере соответствуют номерам в схеме Синтеза 1, приведенной выше.
Стадия 1: Раствор 540 мг гидрохлорида метилового эфира 2-аминогексановой кислоты 1 в 20 мл хлористого метилена промывают избытком насыщенного раствора бикарбоната натрия. Органический слой отделяют, сушат над сульфатом магния и концентрируют в вакууме, при этом получают 365 мг метилового эфира 2-амино-гексановой кислоты в виде бесцветного масла. Это вещество смешивают с 5 мл бензола, 0,28 мл пропионового альдегида в присутствии избытка сульфата магния. После перемешивания в течение 15 мин реакционную смесь фильтруют и концентрируют в вакууме, при этом получают 420 мг соединения 2 в виде бесцветного масла. Соединение 2 используют без дальнейшей очистки.
Стадия 2: К 1050 мг раствора соединения 2 в 10 мл диэтилового эфира, охлажденного в ледяной бане, добавляют 0,8 мл триэтиламина и раствор 964 мг 3-фенилпропаноилхлорида в 2 мл диэтилового эфира. Реакцию проводят в атмосфере азота. Ледяную баню удаляют и реакционную смесь перемешивают в течение 30 мин. Затем реакционную смесь концентрируют в вакууме и остаток очищают на силикагеле с помощью хроматографии, используя в качестве элюента смесь 15% этилацетат/гексан, при этом получают 468 мг соединения 3 в виде бесцветного масла. Соединение 3: 1H ЯМР (CDCl3):  0,87 (t, J=7,0 Гц, 3H), 1,26 (m, 4Н), 1,68 (dd, J=7,0, 1,1 Гц, 3H), 1,74 (m, 1H), 1,97 (m, 1H), 2,70 (t, J=7,9 Гц, 2H), 2,96 (t, J=7,9 Гц, 2H), 3,68 (s, 3H), 4,96 (dd, J=10,1, 5,3 Гц, 1H), 5,32 (dq, J=13,9, 7,0 Гц, 1H), 6,13 (dd, J=13,9, 1,1 Гц, 1H), 7,20 (m, 2H), 7,25 (m, 3H). 0,87 (t, J=7,0 Гц, 3H), 1,26 (m, 4Н), 1,68 (dd, J=7,0, 1,1 Гц, 3H), 1,74 (m, 1H), 1,97 (m, 1H), 2,70 (t, J=7,9 Гц, 2H), 2,96 (t, J=7,9 Гц, 2H), 3,68 (s, 3H), 4,96 (dd, J=10,1, 5,3 Гц, 1H), 5,32 (dq, J=13,9, 7,0 Гц, 1H), 6,13 (dd, J=13,9, 1,1 Гц, 1H), 7,20 (m, 2H), 7,25 (m, 3H).
Стадия 3: N,N-диметилформамид (1,63 мл) добавляют по каплям к 4,57 мл оксихлорида фосфора, охлажденного на льду в закрытой колбе в атмосфере азота. Через 5 мин реакционную смесь подают по трубке в колбу c 2,22 мг соединения 3. Эту смесь перемешивают при комнатной температуре в атмосфере азота в течение 2 ч и затем нагревают при 75°С в течение 46 ч. Реакционную смесь темного цвета выливают в лед и смешивают с избытком бикарбоната натрия и этилацетата. Смесь насыщают хлоридом натрия и отделяют органический слой. Водный слой экстрагируют (три раза по 100 мл) этилацетатом. Объединенные органические экстракты сушат над сульфатом магния и концентрируют в вакууме, при этом получают 1,7 мг масла темного цвета. Трехкратная экстракция водного слоя хлористым метиленом позволяет получить после сушки (над MgSO4) и конденсации в вакууме дополнительные 200 мг вещества. Объединенный маслообразный остаток затем очищают на силикагеле с помощью хроматографии, используя в качестве элюента 20-25% этилацетат/гексан, при этом получают 815 мг соединения 4 в виде масла желтого цвета. Соединение 4: 1H ЯМР (CDCl3):  0,87 (t, J=7,2 Гц, 3H), 1,18 (m, 1H), 1,31 (m, 3H), 1,87 (m, 1H), 2,00 (d, J=0,7 Гц, 3H), 2,16 (m, 1H), 3,72 (s, 3H), 3,85 (br.s, 2H), 5,57 (dd, J=10,1, 5,7 Гц, 1H), 6,82 (br.s, 1H), 6,94 (br.s, 1H), 7,23 (m, 3H), 7,30 (m, 2H). 0,87 (t, J=7,2 Гц, 3H), 1,18 (m, 1H), 1,31 (m, 3H), 1,87 (m, 1H), 2,00 (d, J=0,7 Гц, 3H), 2,16 (m, 1H), 3,72 (s, 3H), 3,85 (br.s, 2H), 5,57 (dd, J=10,1, 5,7 Гц, 1H), 6,82 (br.s, 1H), 6,94 (br.s, 1H), 7,23 (m, 3H), 7,30 (m, 2H).
Стадия 4: К раствору 86 мг соединения 4 в 3 мл тетрагидрофурана добавляют 1 мл 2 н. гидроксида натрия и 2 мл метанола. После полного гидролиза реакционную смесь подкисляют 2 н. соляной кислотой и насыщают хлоридом натрия. Смесь трижды экстрагируют этилацетатом и объединенные экстракты сушат над сульфатом магния и концентрируют в вакууме, при этом получают 80 мг соединения 5 в виде масла светло-желтого цвета. Соединение 5: 1H ЯМР (CDCl3):  0,88 (t, J=7,1 Гц, 3H), 1,18 (m, 1H), 1,33 (m, 3H), 2,04 (d, J=0,7 Гц, 3H), 2,07 (m, 1H), 2,27 (m, 1H), 3,86 (d, J=16,1 Гц, 1H), 3,90 (d, J=16,1 Гц, 1H), 5,04 (dd, J=9,0, 6,8 Гц, 1H), 6,96 (br.s, 1H), 6,98 (br.s, 1H), 7,23 (m, 3H), 7,31 (m, 2H). 0,88 (t, J=7,1 Гц, 3H), 1,18 (m, 1H), 1,33 (m, 3H), 2,04 (d, J=0,7 Гц, 3H), 2,07 (m, 1H), 2,27 (m, 1H), 3,86 (d, J=16,1 Гц, 1H), 3,90 (d, J=16,1 Гц, 1H), 5,04 (dd, J=9,0, 6,8 Гц, 1H), 6,96 (br.s, 1H), 6,98 (br.s, 1H), 7,23 (m, 3H), 7,31 (m, 2H).
Стадия 5: К раствору 80 мг соединения 5 в 1 мл N,N-диметилформамида при комнатной температуре в атмосфере азота добавляют 78 мг (S)-соединения 6, 0,057 мл диизопропилэтиленамина и 137 мг ГБТУ. Смесь перемешивают в течение 16 ч и затем смешивают со смесью этилацетат/гексан 1:1. Эту смесь помывают 2 н. соляной кислотой, насыщенным раствором бикарбоната натрия, дважды промывают водой и, наконец, солевым раствором. Полученный раствор сушат над сульфатом магния и концентрируют под вакуумом, при этом получают 156 мг масла желтого цвета. Затем это вещество очищают на силикагеле с помощью хроматографии, используя в качестве элюента 25% этилацетат, при этом получают 109 мг соединения 7 в виде бесцветного масла. Соединение 7 (наименее полярный диастереомер): 1H ЯМР (CDCl3):  0,85 (t, J=7,1 Гц, 3H), 1,11 (t, J=7,1 Гц, 3H), 1,18 (m, 1H), 1,30 (m, 3H), 1,78 (m, 1H), 2,02 (d, J=0,8 Гц, 3H), 2,14 (m, 1H), 2,57 (dd, J=15,4, 7,1 Гц, 1H), 2,66 (dd, J=15,4, 6,6 Гц, 1H), 3,86 (br.s, 2H), 3,95 (q, J=7,1 Гц, 2H), 5,17 (m, 1H), 5,42 (t, J=7,7 Гц, 1H), 5,93 (s, 2H), 6,72 (m, 2H), 6,74 (m, 1H), 6,90 (m, 1H), 7,11 (br.s, 1H), 7,23 (m, 3H), 7,30 (m, 2H), 7,37 (d, J=7,7 Гц, 1H). 0,85 (t, J=7,1 Гц, 3H), 1,11 (t, J=7,1 Гц, 3H), 1,18 (m, 1H), 1,30 (m, 3H), 1,78 (m, 1H), 2,02 (d, J=0,8 Гц, 3H), 2,14 (m, 1H), 2,57 (dd, J=15,4, 7,1 Гц, 1H), 2,66 (dd, J=15,4, 6,6 Гц, 1H), 3,86 (br.s, 2H), 3,95 (q, J=7,1 Гц, 2H), 5,17 (m, 1H), 5,42 (t, J=7,7 Гц, 1H), 5,93 (s, 2H), 6,72 (m, 2H), 6,74 (m, 1H), 6,90 (m, 1H), 7,11 (br.s, 1H), 7,23 (m, 3H), 7,30 (m, 2H), 7,37 (d, J=7,7 Гц, 1H).
Стадия 6: Раствор, содержащий 109 мг соединения 7, 3 мл тетрагидрофурана, 1 мл 2 н. гидроксида натрия и 2 мл метанола, перемешивают при комнатной температуре до тех пор, пока не пройдет полный гидролиз. Далее смесь разбавляют водой и экстрагируют диэтиловым эфиром. Водный слой подкисляют 2 н. соляной кислотой и трижды экстрагируют этилацетатом. Объединенные экстракты сушат над сульфатом магния и концентрируют в вакууме, при этом получают 103 мг соединения 8 в виде пены грязно-белого цвета, представляющего смесь диастереомеров 1:1.
Смесь диастереомеров разделяют с помощью обращенно-фазовой ВЭЖХ в градиенте смеси ацетонитрил/вода 30-55%, при этом получают соединение 9 (R,S) и соединение 10 (S,S).
Соединение 9 (наиболее полярный диастереомер): 1H ЯМР (CD3SO2CD3):  0,83 (t, J=7,1 Гц, 3H), 1,13 (m, 2H), 1,26 (m, 2H), 1,76 (m, 1H), 1,96 (s с перекрыванием m, 4H), 2,62 (dd, J=15,8, 6,6 Гц, 1H), 2,70 (dd, J=15,8, 8,4 Гц, 1H), 3,69 (d, J=14,8 Гц, 1H), 3,73 (d, J=14,8 Гц, 1H), 5,09 (m, 1H), 5,47 (dd, J=9,2, 6,6 Гц, 1H), 6,71 (dd, J=8,0, 1,5 Гц, 1H), 6,77 (d, J=8,0 Гц, 1H), 6,84 (d, J=1,5 Гц, 1H), 7,00 (d, J=1,8 Гц, 1H), 7,14-7,30 (m, 6 H), 8,70 (d, J=8,1 Гц, 1H). 0,83 (t, J=7,1 Гц, 3H), 1,13 (m, 2H), 1,26 (m, 2H), 1,76 (m, 1H), 1,96 (s с перекрыванием m, 4H), 2,62 (dd, J=15,8, 6,6 Гц, 1H), 2,70 (dd, J=15,8, 8,4 Гц, 1H), 3,69 (d, J=14,8 Гц, 1H), 3,73 (d, J=14,8 Гц, 1H), 5,09 (m, 1H), 5,47 (dd, J=9,2, 6,6 Гц, 1H), 6,71 (dd, J=8,0, 1,5 Гц, 1H), 6,77 (d, J=8,0 Гц, 1H), 6,84 (d, J=1,5 Гц, 1H), 7,00 (d, J=1,8 Гц, 1H), 7,14-7,30 (m, 6 H), 8,70 (d, J=8,1 Гц, 1H).
Соединение 10 (наименее полярный диастереомер): 1H ЯМР (CD3SO2CD3):  0,76 (t, J=7,3 Гц, 3H), 1,01 (m, 2H), 1,20 (m, 2H), 1,98 (br.s, 3H), 2,60 (dd, J=15,8, 7,0 Гц, 1H), 2,68 (dd, J=15,8, 7,7 Гц, 1H), 3,71 (d, J=15,0 Гц, 1H), 3,76 (d, J=15,0 Гц, 1H), 5,05 (ddd, J=8,0, 7,7, 7,0 Гц, 1H), 5,51 (dd, J=9,2, 6,6 Гц, 1H), 5,98 (s, 2H), 6,77 (dd, J=8,0, 1,4 Гц, 1H), 6,83 (d, J=8,0 Гц, 1H), 6,89 (d, J=1,4 Гц, 1H), 7,02 (d, J=2,2 Гц, 1H), 7,18 (m, 1H), 7,25 (m, 4H), 7,38 (m, 1H), 8,79 (d, J=8,0 Гц, 1H), 12,08 (br.s, 1H). 0,76 (t, J=7,3 Гц, 3H), 1,01 (m, 2H), 1,20 (m, 2H), 1,98 (br.s, 3H), 2,60 (dd, J=15,8, 7,0 Гц, 1H), 2,68 (dd, J=15,8, 7,7 Гц, 1H), 3,71 (d, J=15,0 Гц, 1H), 3,76 (d, J=15,0 Гц, 1H), 5,05 (ddd, J=8,0, 7,7, 7,0 Гц, 1H), 5,51 (dd, J=9,2, 6,6 Гц, 1H), 5,98 (s, 2H), 6,77 (dd, J=8,0, 1,4 Гц, 1H), 6,83 (d, J=8,0 Гц, 1H), 6,89 (d, J=1,4 Гц, 1H), 7,02 (d, J=2,2 Гц, 1H), 7,18 (m, 1H), 7,25 (m, 4H), 7,38 (m, 1H), 8,79 (d, J=8,0 Гц, 1H), 12,08 (br.s, 1H).
Пример 2
Соединение 12, (3S)-3-((2R,S)-2-(3-бензил-5-метил-2-оксо-1(2S)-пиридинил)гексаноиламино)-3-(2,3-дигидро-1-бензофуран-5-ил)пропионовую кислоту, структурная формула которого приведена ниже, получают в соответствии с методикой, описанной в Примере 1.
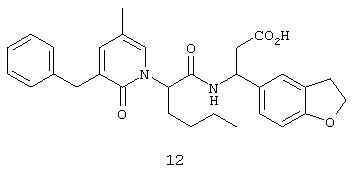
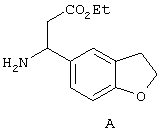
Исключение составляет стадия 5, на которой вместо соединения 6 используют соединение А, формула которого представлена ниже.
Пример 3
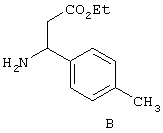
Соединение 13, (3S)-3-((2R,S)-2-(3-бензил-5-метил-2-оксо-1(2Н)-пиридинил)гексаноиламино)-3-(4-метилфенил)пропионовую кислоту, структурная формула которой приведена ниже, получают в соответствии с методикой, описанной в Примере 1.
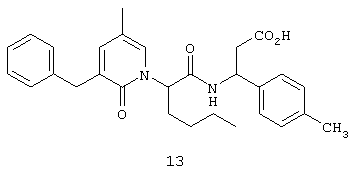
Исключение составляет стадия 5, на которой вместо соединения 6 используют соединение В, формула которого представлена ниже.
Пример 4
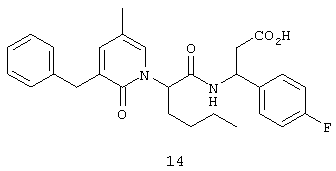
Соединение 14, (3S)-3-((2R,S)-2-(3-бензил-5-метил-2-оксо-1(2Н)-пиридинил)гексаноиламино)-3-(4-фторфенил)пропионовую кислоту, структурная формула которой приведена ниже, получают в соответствии с методикой, описанной в Примере 1.
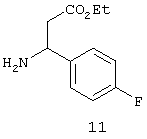
Исключение составляет стадия 5, на которой вместо соединения 6 используют соединение 11, формула которого представлена ниже.
Пример 5
Соединение 15, (3S)-3-(1,3-бензодиоксол-5-ил)-3-((2R,S)-2-(3-(4-метоксибензил)-5-метил-2-оксо-1(2Н)-пиридинил)гексаноиламино)-пропионовую кислоту, структурная формула которой приведена ниже, получают в соответствии с методикой, описанной в Примере 1.
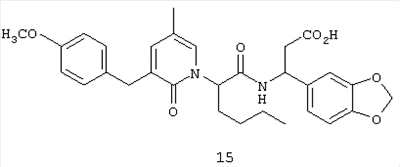
Исключение составляет стадия 2, на которой вместо 3-фенилпропаноилхлорида используют 3-(4-метоксифенил)пропаноилхлорид.
Пример 6
Соединение 16, (3S)-3-(1,3-бензодиоксол-5-ил)-3-((2R,S)-2-(3-(4-метилбензил)-5-метил-2-оксо-1(2Н)-пиридинил)гексаноиламино)пропионовую кислоту, структурная формула которой приведена ниже, получают в соответствии с методикой, описанной в Примере 1.
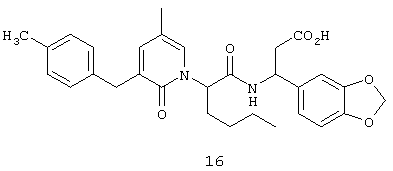
Исключение составляет стадия 2, на которой вместо 3-фенилпропаноилхлорида используют 3-(4-метилфенил)пропаноилхлорид.
Пример 7
Соединение 17, (3S)-3-(1,3-бензодиоксол-5-ил)-3-((2R,S)-2-(3-(4-фторбензил)-5-метил-2-оксо-1(2Н)-пиридинил)гексаноиламино)пропионовую кислоту, структурная формула которой приведена ниже, получают в соответствии с методикой, описанной в Примере 1.
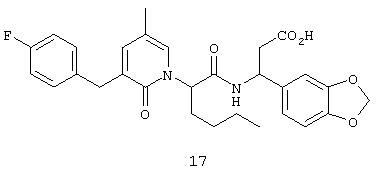
Исключение составляет стадия 2, на которой вместо 3-фенилпропаноилхлорида используют 3-(4-фторфенил)пропаноилхлорид.
Пример 8
Соединение 18, (3S)-3-(1,3-бензодиоксол-5-ил)-3-((2R,S)-2-(3-(4-хлорбензил)-5-метил-2-оксо-1(2Н)-пиридинил)гексаноиламино)пропионовую кислоту, структурная формула которой приведена ниже, получают в соответствии с методикой, описанной в Примере 1.
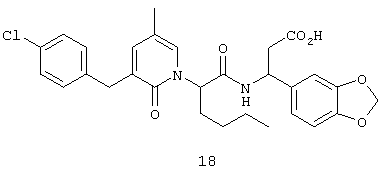
Исключение составляет стадия 2, на которой вместо 3-фенилпропаноилхлорида используют 3-(4-хлорфенил)пропаноилхлорид.
Пример 9
Соединение 19, (3S)-3-(1,3-бензодиоксол-5-ил)-3-((2R,S)-2-(3-(3-хлорбензил)-5-метил-2-оксо-1(2Н)-пиридинил)гексаноиламино)пропионовую кислоту, структурная формула которой приведена ниже, получают в соответствии с методикой, описанной в Примере 1.
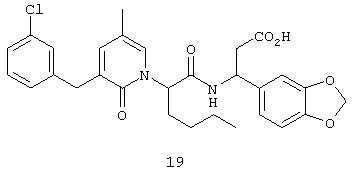
Исключение составляет стадия 2, на которой вместо 3-фенилпропаноилхлорида используют 3-(3-хлорфенил)пропаноилхлорид.
Пример 10
Синтез (3S)-3-(1,3-бензодиоксол-5-ил)-3-({(2S)-2-[2-оксо-3-(2-тиенилметил)-1-имидазолидинил]гексаноил}амино)пропионовой кислоты (20).
Стадия 1: К раствору соединения 6 (680 мг, 2,87 ммоль) и N-трет-бутоксикарбонил-L-норлейцина (696 мг, 3,01 ммоль) в ДМФ (14,4 мл) последовательно добавляют N,N-диизопропилэтиламин (0,52 мл, 3,0 ммоль) и ГБТУ (1,25 г, 3,3 ммоль) при комнатной температуре и в атмосфере сухого азота. Полученную смесь перемешивают при комнатной температуре в течение ночи, затем разбавляют смесью гексан/этилацетат 1:1 и промывают 2 н. HCl, H2O, насыщенным раствором NaHCO3, трижды H2O и солевым раствором. Органическую фазу сушат над MgSO4, фильтруют и фильтрат концентрируют при пониженном давлении, при этом получают соединение 22 (1,27 г, 98%) в виде твердого вещества светло-желтого цвета.
Стадия 2: В герметично закрытую резиновой перегородкой колбу, в которой содержится соединение 22 (1,27 г, 2,82 ммоль) при комнатной температуре и в атмосфере сухого азота, с помощью шприца добавляют HCl (7,2 мл, 4,0 М в диоксане, 28,8 ммоль). Иглу для подачи азота удаляют и в герметично закрытой колбе смесь перемешивают в течение 1 ч. Затем смесь разбавляют CH2Cl2 и промывают насыщенным раствором NaHCO3. Органическую фазу сушат над MgSO4 и фильтруют, фильтрат концентрируют при пониженном давлении, при этом получают соединение 23 (892 мг, 90%) в виде масла светло-желтого цвета.
Стадия 3: К раствору этаноламина ( 1,70 г, 27,8 ммоль) и 2-тиофенкарбоксальдегида (0,52 мл, 5,6 ммоль) в 1,2-дихлорэтане (22 мл) при комнатной температуре в атмосфере сухого азота добавляют триацетоксиборгидрид натрия (1,66 г, 7,8 ммоль). Полученную смесь перемешивают при комнатной температуре в течение ночи, затем разбавляют CH2Cl2 и промывают смесью насыщенный раствор NaHCO3/солевой раствор 1:1. Водную фазу экстрагируют CH2CI2 и органические фазы объединяют, сушат над MgSO4 и фильтруют. Фильтрат концентрируют при пониженном давлении, при этом получают соединение 24 (840 мг, 97%) в виде масла бледно-желтого цвета.
Стадия 4: Раствор аминаля 24 (840 мг, 5,41 ммоль) в метаноле (10 мл) перемешивают при комнатной температуре в течение 30 мин, охлаждают до 0°С и затем добавляют боргидрид натрия (106 мг, 2,8 ммоль). Смесь нагревают до комнатной температуры и перемешивают в течение 1 ч. Реакцию останавливают добавлением по каплям воды, затем разбавляют CH2Cl2 и смесью насыщенный раствор NaHCO3/солевой раствор 1:1. Водную фазу экстрагируют CH2Cl2 (дважды) и органические фазы объединяют, сушат над MgSO4 и фильтруют. Фильтрат концентрируют при пониженном давлении, при этом получают соединение 25 (420 мг, 49%) в виде вязкого масла бледно-желтого цвета.
Стадия 5: Раствор соединения 25 (420 мг, 2,67 ммоль) и ди-трет-бутилдикарбоната (650 мг, 2,98 ммоль) в CH2Cl2 (10 мл) перемешивают при комнатной температуре в атмосфере сухого азота в течение 20 мин и затем концентрируют. Остаток фильтруют через силикагель, элюцию проводят смесью гексан/этилацетат в градиенте от 7:3 до 3:2, при этом получают соединение 26 (610 мг, 88%) в виде бесцветного вязкого масла.
Стадия 6: К раствору метилсульфоксида (0,49 мл, 6,9 ммоль) в СН2Cl2 (11 мл), охлажденному до -78°С и находящемуся в атмосфере сухого азота, с помощью шприца добавляют оксалилхлорид (1,7 мл, 2,0 М в CH2Cl2, 3,4 ммоль). Полученную смесь перемешивают при -78°С в течение 15 мин, затем через трубку добавляют раствор соединения 26 (590 мг, 2,3 ммоль) в CH2Cl2 (10 мл) и трубку промывают CH2Cl2, (5 мл). Смесь перемешивают при -78°С в течение 30 мин, добавляют триэтиламин (0,96 мл, 6,9 ммоль) и смесь нагревают до комнатной температуры. Затем смесь разбавляют CH2Cl2 и промывают насыщенным раствором NaHCO3. Органическую фазу сушат над MgSO4, фильтруют и фильтрат концентрируют при пониженном давлении, при этом получают соединение 27 (630 мг) в виде масла светло-желтого цвета. Это соединение используют без очистки.
Стадия 7: К раствору соединения 27 (102 мг, 0,40 ммоль) и соединения 23 (140 мг, 0,40 ммоль) в 1,2-дихлорэтане (4 мл) при комнатной температуре и в атмосфере сухого азота добавляют триацетоксиборгидрид натрия (119 мг, 0,56 ммоль). Полученную смесь перемешивают в течение 2 ч, затем разбавляют этилацетатом и промывают насыщенным раствором NaHCO3 и солевым раствором. Органическую фазу сушат над MgSO4, фильтруют и фильтрат концентрируют при пониженном давлении, при этом получают соединение 28 (232 мг) в виде масла светло-желтого цвета. Это соединение используют без очистки.
Стадия 8: В герметично закрытую резиновой перегородкой колбу, в которой содержится соединение 28 (232 мг неочищенного вещества, полученного на предыдущей стадии, 0,40 ммоль, теоретически) при комнатной температуре в атмосфере сухого азота, с помощью шприца добавляют HCl (1,95 мл, 4,0 М в диоксане, 7,8 ммоль). Иглу для подачи азота удаляют и смесь в герметично закрытой колбе перемешивают в течение 15 мин. Полученный материал разбавляют CH2Cl2 и промывают смесью насыщенный раствор NaHCO3/солевой раствор 1:1. Органическую фазу сушат над MgSO4 и фильтруют, затем фильтрат концентрируют при пониженном давлении, при этом получают соединение 29 (180 мг) в виде масла светло-желтого цвета. Это соединение используют без очистки.
Стадия 9: К раствору соединения 29 (180 мг неочищенного вещества, полученного на предыдущей стадии, 0,40 ммоль, теоретически) в 1,2-дихлорэтане (3,7 мл) при комнатной температуре в атмосфере азота добавляют карбонилдиимидазол (66 мг, 0,41 ммоль). Смесь нагревают при 50°С (температура масляной бани) в течение 1 ч, затем концентрируют. Полученный остаток переносят в этилацетат и промывают 2 н. HCl, H2O, насыщенным раствором NaHCO3 и солевым раствором. Органическую фазу сушат над MgSO4, фильтруют и фильтрат концентрируют при пониженном давлении. Остаток фильтруют через силикагель, элюцию проводят смесью гексан/этилацетат в градиенте концентраций от 3:2 до 1:1, при этом получают соединение 30 (114 мг, 55% после 3 стадий) в виде бесцветного масла.
Стадия 10: К раствору соединения 30 (114 мг, 0,22 ммоль) в ТГФ (3 мл) при комнатной температуре добавляют NaOH (1 мл, 2 н. в Н2О, 2 ммоль) и метанол (для получения прозрачного раствора достаточно приблизительно 2 мл). Полученную смесь перемешивают в течение 15 мин, затем разбавляют водой и экстрагируют эфиром. Водную фазу подкисляют HCl (2 н.) и экстрагируют этилацетатом. Слой этилацетата промывают солевым раствором, сушат над MgSO4, фильтруют, а затем фильтрат концентрируют при пониженном давлении, при этом получают соединение 20 (111 мг, 100%) в виде пены белого цвета. 1H ЯМР (400 МГц, CD3SO2CD3)  0,82 (t, J=7,3 Гц, 3H), 1,09 (m, 2H), 1,25 (m, 2H), 1,48 (m, 1H), 1,64 (m, 1H), 2,61 (dd, J=15,8, 7,0 Гц, 1H), 2,70 (dd, J=15,8, 8,0 Гц, 1H), 3,20 (m, 3H), 3,50 (m, 1H), 4,27 (dd, J=9,5, 5,9 Гц, 1H), 4,38 (d, J=15,6 Гц, 1H), 4,54 (d, J=15,6 Гц, 1H), 5,08 (ddd, J=8,1, 8,0, 7,0 Гц, 1H), 5,91 (s, 2H), 6,76 (dd, J=8,0, 1,5 Гц, 1H), 6,83 (d, J=8,0 Гц, 1H), 6,88 (d, J=1,5 Гц, 1H), 6,99 (m, 2H), 7,43 (dd, J=4,4, 1,8 Гц, 1H), 8,43 (d, J=8,1 Гц, 1H). 0,82 (t, J=7,3 Гц, 3H), 1,09 (m, 2H), 1,25 (m, 2H), 1,48 (m, 1H), 1,64 (m, 1H), 2,61 (dd, J=15,8, 7,0 Гц, 1H), 2,70 (dd, J=15,8, 8,0 Гц, 1H), 3,20 (m, 3H), 3,50 (m, 1H), 4,27 (dd, J=9,5, 5,9 Гц, 1H), 4,38 (d, J=15,6 Гц, 1H), 4,54 (d, J=15,6 Гц, 1H), 5,08 (ddd, J=8,1, 8,0, 7,0 Гц, 1H), 5,91 (s, 2H), 6,76 (dd, J=8,0, 1,5 Гц, 1H), 6,83 (d, J=8,0 Гц, 1H), 6,88 (d, J=1,5 Гц, 1H), 6,99 (m, 2H), 7,43 (dd, J=4,4, 1,8 Гц, 1H), 8,43 (d, J=8,1 Гц, 1H).
Описанным выше методом синтеза могут быть получены следующие соединения: (3S)-(1,3-бензодиоксол-5-ил)-3-(((2S)-2-(2-оксо-3-(2-тиенилметил)тетрагидро-1(2Н)-пиримидинил)гексаноил)амино)пропионовую кислоту,(3S)-3-(1,3-бензодиоксол-5-ил)-3-(((2S)-2-(2-оксо-4-(2-тиенил)-3-(2-тиенилметил)тетрагидро-1((2Н)-пиримидинил)гексаноил)амино)пропионовую кислоту и (3S)-3-(1,3-бензодиоксол-5-ил)-3-(((2S)-2-(2-оксо-3-(2-тиенилметил)-1,3-диазепан-1-ил)гексаноил)амино)пропионовую кислоту.
Пример 11
Синтез (3S)-3-(1,3-бензодиоксол-5-ил)-3-({(2S)-2-[2-оксо-3-(фенилкарбонил)-1(2Н)-пиридинил]гексаноил}амино)пропионовой кислоты (31).
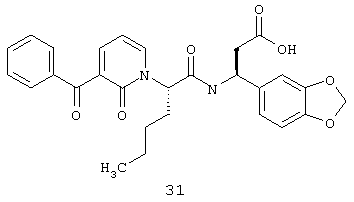
Стадия 1: Раствор соединения 23 (541 мг, 1,54 ммоль) и этилового эфира бензоилуксусной кислоты (0,53 мл, 3,09 ммоль) в толуоле (15 мл) нагревают с обратным холодильником в течение 2 ч. Полученную смесь охлаждают до комнатной температуры и концентрируют при пониженном давлении. Остаток перекристаллизовывают из смеси гексан/СН2Cl2, при этом получают соединение 32 (310 мг, 40%) в виде твердого вещества бледно-желтого цвета.
Стадия 2: К суспензии соединения 32 (851 мг, 1,71 ммоль) в этаноле (абсолютный, 6,8 мл) и уксусной кислоты (ледяная, 0,34 мл) при комнатной температуре, в атмосфере азота с помощью шприца добавляют 3-(диметиламино)акролеин (1,02 мл, 10,2 ммоль). Полученную смесь нагревают с обратным холодильником в течение ночи, затем охлаждают до комнатной температуры и разбавляют этилацетатом. Эту смесь промывают HCl (2 н., дважды) и солевым раствором. Органическую фазу сушат над MgSO4, фильтруют и фильтрат концентрируют при пониженном давлении. Остаток очищают на силикагеле с помощью хроматографии, используя в качестве элюента смесь гексан/этилацетат3:2, при этом получают соединение 33 (476 мг, 52%) в виде масла светло-желтого цвета.
Стадия 3: К раствору соединения 33 (115 мг, 0,22 ммоль) в ТГФ (6 мл) при комнатной температуре добавляют водный раствор NaOH (2 н., 2 мл) и метанол (4 мл). Полученный раствор перемешивают в течение 15 мин, разбавляют водой и экстрагируют Et2O. Водную фазу подкисляют HCl (2 н.) и экстрагируют этилацетатом. Слой этилацетата промывают водой и солевым раствором, сушат над MgSO4 и фильтруют. Фильтрат концентрируют при пониженном давлении, при этом получают (3S)-3-(1,3-бензодиоксол-5-ил)-3-({(2S)-2-[2-оксо-3-(фенилкарбонил)-1(2Н)-пиридинил]гексаноил}амино)-пропионовую кислоту (31, 100 мг, 92%) в виде пены бледно-желтого цвета. 1H ЯМР (400 МГц, CD3SO2CD3):  0,81 (t, J=7,3 Гц, 3H), 1,08 (m, 2H), 1,25 (m, 2H), 1,80 (m, 1H), 1,93 (m, 1H), 2,61 (dd, J=15,8, 6,8 Гц, 1H), 2,68 (dd, J=15,8, 7,9 Гц, 1H), 5,09 (m, 1H), 5,49 (dd, J=9,5, 6,2 Гц, 1H), 5,98 (s, 2H), 6,24 (t, J=7,0 Гц, 1H), 6,78 (dd, J=8,1, 1,4 Гц, 1H), 6,84 (d, J=8,1 Гц, 1H), 6,89 (d, J=1,4 Гц, 1H), 7,49 (t, J=7,7 Гц, 2H), 7,62 (m, 1H), 7,70 (m, 3H), 7,97 (dd, J=7,0, 2,2 Гц, 1H), 8,87 (d, J=8,1 Гц, 1H), 12,11 (br.s, 1H). 0,81 (t, J=7,3 Гц, 3H), 1,08 (m, 2H), 1,25 (m, 2H), 1,80 (m, 1H), 1,93 (m, 1H), 2,61 (dd, J=15,8, 6,8 Гц, 1H), 2,68 (dd, J=15,8, 7,9 Гц, 1H), 5,09 (m, 1H), 5,49 (dd, J=9,5, 6,2 Гц, 1H), 5,98 (s, 2H), 6,24 (t, J=7,0 Гц, 1H), 6,78 (dd, J=8,1, 1,4 Гц, 1H), 6,84 (d, J=8,1 Гц, 1H), 6,89 (d, J=1,4 Гц, 1H), 7,49 (t, J=7,7 Гц, 2H), 7,62 (m, 1H), 7,70 (m, 3H), 7,97 (dd, J=7,0, 2,2 Гц, 1H), 8,87 (d, J=8,1 Гц, 1H), 12,11 (br.s, 1H).
Пример 12
Синтез (3S)-3-(1,3-бензодиоксол-5-ил)-3-({(2S)-2-[2-оксо-3-(фенилметил)-1(2Н)-пиридинил]гексаноил}амино)пропионовой кислоты (34).
Стадия 1: К раствору соединения 33 (88 мг, 0,17 ммоль) в этаноле (абсолютный, 4 мл) при комнатной температуре добавляют NaBH4 (12,5 мг, 0,33 ммоль). Полученную смесь перемешивают в течение 20 мин, затем реакцию останавливают путем добавления HCl (2 н., 2 мл). Полученную смесь разбавляют водой и этилацетатом, затем органический слой промывают насыщенным водным раствором NaHCO3 и солевым раствором. Органический слой сушат над MgSO4, фильтруют и фильтрат концентрируют при пониженном давлении, при этом получают соединение 35 (85 мг, 96%) в виде масла бледно-желтого цвета. Это соединение используют без очистки.
Стадия 2: К раствору соединения 35 (85 мг, 0,16 ммоль) в этилацетате (4 мл) при комнатной температуре в атмосфере азота добавляют Pd/C (10% по массе сухого вещества, тип Дегасса Е101 NE/W, содержание воды 50%, 36 ммоль). Атмосферу реакционной смеси заменяют на водород (пятикратно переключают кран между вакуумной линией и баллоном с водородом) и смесь интенсивно перемешивают в течение 1,5 ч. Смесь фильтруют через целит, затем фильтрат концентрируют при пониженном давлении. Остаток очищают на силикагеле методом хроматографии, в качестве элюента используют смесь гексан/этилацетат 7:3, при этом получают содинение 36 (32 мг, 39%) в виде бесцветного масла.
Стадия 3: К раствору соединения 36 (32 мг, 0,062 ммоль) в ТГФ (3 мл) при комнатной температуре, добавляют водный раствор NaOH (2 н., 1 мл) и метанол (2 мл). Полученную смесь перемешивают в течение 15 мин, разбавляют водой и экстрагируют Et2O. Водную фазу подкисляют HCl (2 н.) и экстрагируют этилацетатом. Слой этилацетата промывают водой, солевым раствором, сушат над MgSO4 и фильтруют. Фильтрат концентрируют при пониженном давлении. Остаток переносят в ацетонитрил (3 мл) и воду (7 мл), смесь лиофилизируют, при этом получают (3S)-3-(1,3-бензодиоксол-5-ил)-3-({(2S)-2-[2-оксо-3-(фенилметил)-1(2Н)-пиридинил]гексаноил}амино)-пропионовую кислоту (34, 31 мг, 100%) в виде порошка белого цвета. 1H ЯМР (400 МГц, CD3SO2CD3):  0,76 (t, J=7,3 Гц, 3H), 1,01 (m, 2H), 1,22 (m, 2H), 1,7 (m, 1H), 1,87 (m, 1H), 2,60 (dd, J=15,8, 7,0 Гц, 1H), 2,68 (dd, J=15,8, 7,9 Гц, 1H), 3,72 (d, J=15,0 Гц, 1H), 3,77 (d, J=15,0 Гц, 1H), 5,06 (m, 1H), 5,54 (dd, J=9,2, 6,6 Гц, 1H), 5,98 (s, 2H), 6,16 (t, J=7,0 Гц, 1H), 6,77 (dd, J=8,1, 1,4 Гц, 1H), 6,83 (d, J=8,1 Гц, 1H), 6,89 (d, J=1,4 Гц, 1H), 7,13 (m, 1H), 7,18 (m, 1H), 7,26 (m, 4 H), 7,59 (dd, J=7,0, 1,8 Гц, 1H), 8,83 (d, J=8,1 Гц, 1H), 12,11 (br.s, 1H). 0,76 (t, J=7,3 Гц, 3H), 1,01 (m, 2H), 1,22 (m, 2H), 1,7 (m, 1H), 1,87 (m, 1H), 2,60 (dd, J=15,8, 7,0 Гц, 1H), 2,68 (dd, J=15,8, 7,9 Гц, 1H), 3,72 (d, J=15,0 Гц, 1H), 3,77 (d, J=15,0 Гц, 1H), 5,06 (m, 1H), 5,54 (dd, J=9,2, 6,6 Гц, 1H), 5,98 (s, 2H), 6,16 (t, J=7,0 Гц, 1H), 6,77 (dd, J=8,1, 1,4 Гц, 1H), 6,83 (d, J=8,1 Гц, 1H), 6,89 (d, J=1,4 Гц, 1H), 7,13 (m, 1H), 7,18 (m, 1H), 7,26 (m, 4 H), 7,59 (dd, J=7,0, 1,8 Гц, 1H), 8,83 (d, J=8,1 Гц, 1H), 12,11 (br.s, 1H).
Пример 13
Синтез (3S)-3-(1,3-бензодиоксол-5-ил)-3-[({1-[2-оксо-3-(фенилметил)-1 (2Н)-пиридинил]циклогексил} карбонил)амино]пропионовой кислоты.
Стадия 1: К раствору 3-бензилпиридина (1,65 г, 9,77 ммоль) в ацетоне (3,5 мл) добавляют 1-хлор-2,4-динитробензол (2,00 г, 9,56 ммоль) и смесь нагревают с обратным холодильником в течение ночи. Смесь охлаждают до комнатной температуры, разбавляют ацетоном и после осаждения вещества растворитель декантируют. Неочищенное твердое вещество промывают ацетоном (2 раза) и диэтиловым эфиром (1 раз) с удалением растворителя декантацией на каждой стадии, при этом получают соединение 37 (3,57 г, 100%) в виде твердого вещества серого цвета.
Стадия 2: К раствору 1-амино-1-гидроксиметилциклогексана (0,45 г, 3,5 ммоль) в н-бутаноле (8,75 мл) добавляют твердый хлорид N-(2,4-динитрофенил)-3-бензилпиридиния (37, 1,23 г, 3,3 ммоль). Полученный раствор нагревают с обратным холодильником в течение 2,5 сут. в атмосфере азота. Смесь охлаждают, разбавляют водой и фильтруют. Фильтрат подщелачивают концентрированным NH4OH (2 мл) и экстрагируют этилацетатом. Водный слой концентрируют досуха, при этом получают соединение 38 (0,56 г) в виде масла желтого цвета, его используют без дальнейшей очистки.
Стадия 3: К раствору неочищенного соединения 38 (0,56 г, теоретически 3,5 ммоль) в воде (10 мл) по каплям добавляют с помощью капельной воронки раствор феррицианида калия (3,3 г, 10 ммоль) в воде (15 мл) в течение 30 мин при 0°С. Затем в течение 30 мин добавляют раствор КОН (0,76 г, 13,5 ммоль) в воде (5 мл). Добавляют толуол (10 мл) и раствор перемешивают в течение 1 ч при 0°С. Слои разделяют, и водный слой снова экстрагируют толуолом. Объединенные экстракты сушат над Na2SO4 и фильтруют, фильтрат концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле, элюируют смесью гексан/этил ацетат 7:13, при этом получают соединение 39 (20 мг, 1,9% после двух стадий).
Стадия 4: К суспензии соединения 39 (20 мг, 0,068 ммоль) в водном КОН (1 М, 0,70 мл) добавляют персульфат калия (0,073 г, 0,270 ммоль), хлорид рутения (III) (1 мг, каталитическое количество) и ТГФ (0,25 мл). Смесь перемешивают в течение 1 ч и экстрагируют дихлорметаном. Водный слой подкисляют и экстрагируют этилацетатом (3 раза). Экстракты этилацетата объединяют, сушат над MgSO4 и фильтруют. Фильтрат концентрируют при пониженном давлении, при этом получают соединение 40 (0,0148 г, 70%) в виде твердого вещества желто-коричневого цвета.
(3S)-3-(1,3-бензодиоксол-5-ил)-3-[({1-[2-оксо-3-(фенилметил)-1(2Н)-пиридинил]циклогексил}карбонил)амино]пропионовую кислоту получают из соединения 40 в соответствии с методиками, описанными в Примере 1. 1H ЯМР (400 МГц, CD3SO2CD3):  1,40 (m, 4Н), 1,68 (m, 2H), 2,04 (m, 2H), 2,60 (d, J=7,0 Гц, 2H), 3,67 (d, J=15,2 Гц, 1H), 3,72 (d, J=15,2 Гц, 1H), 5,12 (m, 1H), 5,95 (m, 2H), 6,19 (t, J=7,0 Гц, 1H), 6,74 (dd, J=7,8, 1,4 Гц, 1H), 6,76 (d, J=7,8 Гц, 1H), 6,90 (d, J=1,4 Гц, 1H), 7,10 (d, J=5,8 Гц, 1H), 7,20 (m, 5Н), 7,57 (d, J=8,4 Гц, 1H), 7,66 (dd, J=7,7, 1,8 Гц, 1H). 1,40 (m, 4Н), 1,68 (m, 2H), 2,04 (m, 2H), 2,60 (d, J=7,0 Гц, 2H), 3,67 (d, J=15,2 Гц, 1H), 3,72 (d, J=15,2 Гц, 1H), 5,12 (m, 1H), 5,95 (m, 2H), 6,19 (t, J=7,0 Гц, 1H), 6,74 (dd, J=7,8, 1,4 Гц, 1H), 6,76 (d, J=7,8 Гц, 1H), 6,90 (d, J=1,4 Гц, 1H), 7,10 (d, J=5,8 Гц, 1H), 7,20 (m, 5Н), 7,57 (d, J=8,4 Гц, 1H), 7,66 (dd, J=7,7, 1,8 Гц, 1H).
Пример 14
Синтез (3S)-3-(1,3-бензодиоксол-5-ил)-3-({2-[2-оксо-5-(фенилметил)-1 (2Н)-пиридинил]гексаноил}амино)пропионовой кислоты.
Стадия 1: К смеси соединения 41 (полученного в соответствии с методиками, описанными в Примере 13, 1,75 г неочищенного масла оранжевого цвета, теоретически 5,0 ммоль) в воде (25 мл) по каплям добавляют при помощи капельной воронки раствор феррицианида калия (4,7 г, 14 ммоль) в воде (22 мл) в течение 30 мин при 0°С. Затем в течение 30 мин добавляют раствор КОН (1,1 г, 19 ммоль) в воде (7 мл). Добавляют толуол (15 мл) и раствор перемешивают в течение 1 ч при 0°С. Слои разделяют, и водный слой снова экстрагируют толуолом. Объединенные экстракты сушат над Na2SO4 и фильтруют, фильтрат концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле, элюируют смесью гексан/этилацетат 7:13, при этом получают соединение 42 (основной продукт, 0,36 г, 29%) и соединение 43 (минорный продукт, 0,10 г, 7,0%).
(3S)-3-(1,3-бензодиоксол-5-ил)-3-({2-[2-оксо-5-(фенилметил)-1(2Н)-пиридинил]гексаноил}амино)пропионовую кислоту получают из соединения 42 в соответствии с методиками, описанными в Примерах 1 и 13. 1H ЯМР (400 МГц, CD3SO2CD3):  0,77 (t, J=7,3 Гц, 3H), 1,00 (m, 2H), 1,20 (m, 2H), 1,75 (m, 1H), 1,88 (m, 1H), 2,65 (m, 2H), 3,70 (s, 2H), 5,08 (m, 1H), 5,49 (dd, J=9,9, 6,2 Гц, 1H), 5,98 (s, 2H), 6,32 (d, J=9,2 Гц, 1H), 6,77 (dd, J=8,1, 1,5 Гц, 1H), 6,83 (d, J=9,2 Гц, 1H), 6,89 (d, J=1,5 Гц, 1H), 7,20 (m, 4 H), 7,28 (m, 4Н), 7,61 (d, J=2,6 Гц, 1H), 8,81 (d, J=8,1 Гц, 1H), 12,10 (br. s, 1H). 0,77 (t, J=7,3 Гц, 3H), 1,00 (m, 2H), 1,20 (m, 2H), 1,75 (m, 1H), 1,88 (m, 1H), 2,65 (m, 2H), 3,70 (s, 2H), 5,08 (m, 1H), 5,49 (dd, J=9,9, 6,2 Гц, 1H), 5,98 (s, 2H), 6,32 (d, J=9,2 Гц, 1H), 6,77 (dd, J=8,1, 1,5 Гц, 1H), 6,83 (d, J=9,2 Гц, 1H), 6,89 (d, J=1,5 Гц, 1H), 7,20 (m, 4 H), 7,28 (m, 4Н), 7,61 (d, J=2,6 Гц, 1H), 8,81 (d, J=8,1 Гц, 1H), 12,10 (br. s, 1H).
Пример 15
Синтез (3S)-3-(1,3-бензодиоксол-5-ил)-3-({(2S)-2-[(3S)-2,5-диоксо-3-(фенилметил)-4-(2-тиофенилметил)тетрагидро-1(2Н)-пиразинил]гексаноил}амино)пропионовой кислоты.
Стадия 1: К раствору метилового эфира фенилаланина (2,32 г, 12,9 ммоль) в ДХЭ (50 мл) при комнатной температуре добавляют 2-тиофенкарбоксальдегид (1,2 мл, 12,9 ммоль) и NaBH(OAc)3 (4,11 г, 19,4 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 24 ч, разбавляют CH2Cl2 (300 мл) и промывают водой (300 мл). Органический слой сушат над MgSO4 и фильтруют, фильтрат концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле, элюируют смесью гексан/этилацетат 9:1, при этом получают соединение 44 (2,78 г, 78%).
Стадия 2: К раствору соединения 44 (1,50 г, 5,45 ммоль) в метаноле (10 мл), тетрагидрофуране (10 мл) и воде (10 мл) добавляют гидроксид натрия (880 мг, 21,8 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 48 ч. Полученную смесь концентрируют при пониженном давлении до водного раствора и затем лиофилизируют, при этом получают соединение 45 (1,42 г).
Стадия 3: К раствору соединения 45 (500 мг, 1,91 ммоль) и гидрохлорида метилового эфира норлейцина (382 мг, 2,10 ммоль) в ДМФ (10 мл) при комнатной температуре добавляют гидрохлорид 1-[3-(диметиламино)пропил]-3-этилкарбодиимида (401 мг, 2,10 ммоль), 1-гидроксибензотриазол (238 мг, 2,10 ммоль) и 4-метилморфолин (0,23 мл, 2,10 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 24 ч, а затем смесь переносят в этилацетат (200 мл) и промывают водой (2×200 мл). Органический слой сушат над MgSO4 и фильтруют, фильтрат концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле, элюируют смесью гексан/этилацетат 9:1, при этом получают соединение 46 (422 мг, 57%).
Стадия 4: К раствору соединения 46 (415 мг, 1,07 ммоль) в ДХЭ и триэтиламине (0,15 мл, 1,07 ммоль) при 0°С добавляют бромацетилбромид (0,090 мл, 1,07 ммоль), реакционную смесь нагревают при комнатной температуре и перемешивают в течение 24 ч. Смесь переносят в CH2Cl2 (150 мл) и промывают водой (150 мл). Органический слой сушат над MgSO4 и фильтруют, фильтрат концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле, элюируют смесью гексан/этилацетат 4:1, при этом получают соединение 47 (381 мг, 70%).
Стадия 5: К раствору соединения 47 (375 мг, 0,74 ммоль) в ТГФ (8 мл) добавляют Cs2СО3 (360 мг, 1,10 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 4 ч. Смесь переносят в этилацетат (150 мл) и промывают водой (150 мл). Органический слой сушат над MgSO4 и фильтруют, фильтрат концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле, элюируют смесью гексан/этилацетат 4:1, при этом получают соединение 48 (145,0 мг, 46%).
(3S)-3-(1,3-бензодиоксол-5-ил)-3-({(2S)-2-[(3S)-2,5-диоксо-3-(фенилметил)-4-(2-тиофенилметил)тетрагидро-1(2Н)-пиразинил]-гексаноил}амино)пропионовую кислоту получают из соединения 48 в соответствии с методиками, описанными в Примере 1. МС, рассчитано: (М-Н)–=604,2 m/z; найдено: (М-Н)–=604,4 m/z.
Пример 16
Синтез (3S)-3-(1,3-бензодиоксол-5-ил)-3-({2-[2-оксо-3-(фенилметил)-2,3-дигидро-1Н-бензимидазол-1-ил]ацетил}амино)пропионовой кислоты.
Стадия 1: Смесь 1-фтор-2-нитробензола (0,50 г, 3,54 ммоль), бензиламина (0,38 г, 3,54 ммоль) и К2СО3 (0,98 г, 7,08 ммоль) в ДМФ (10 мл) перемешивают при комнатной температуре в течение ночи. Затем смесь распределяют между EtOAc и водой. Органический слой промывают водой и солевым раствором, сушат над MgSO4 и фильтруют. Фильтрат концентрируют досуха, при этом получают соединение 49 (0,79 г, 98%) в виде твердого вещества оранжевого цвета.
Стадия 2: К раствору соединения 49 (0,79 г, 3,5 ммоль) в этаноле (7,0 мл) и уксусной кислоте (7,0 мл) при комнатной температуре добавляют порошок Fe (2,44 г, 34,6 ммоль) и полученную суспензию интенсивно перемешивают при 40°С до тех пор, пока по данным ТСХ не произойдет полное потребление соединения 49. Смесь фильтруют через слой целита, промывают хлороформом. Фильтрат разбавляют насыщенным бикарбонатом натрия, слой хлороформа сушат над Na2SO4 и фильтруют. Фильтрат концентрируют при пониженном давлении и остаток очищают хроматографией на силикагеле, элюируют смесью гексан/этилацетат в градиенте от 4:1 до 1:1, при этом получают соединение 50 (0,35 г, 50%).
Стадия 3: Раствор соединения 50 (0,25 г, 1,26 ммоль) и КДИ (0,22 г, 1,4 ммоль) в CH2Cl2 (12 мл) перемешивают при комнатной температуре в течение ночи. Смесь разбавляют EtOAc и промывают 1 н. HCl (3х) и солевым раствором. Органический слой сушат над MgSO4 и фильтруют, фильтрат концентрируют при пониженном давлении, при этом получают соединение 51 (0,23 г, 82%) в виде твердого вещества коричневого цвета.
Стадия 4: К раствору соединения 51 (0,19 г, 0,85 ммоль) в безводном ДМФ (5 мл) при 0°С добавляют NaH (60% дисперсия в минеральном масле, 0,044 г, 1,1 ммоль). Смесь перемешивают при 0°С в течение 10 мин, а затем добавляют этиловый эфир бромуксусной кислоты (0,21 г, 0,13 ммоль). После перемешивания при комнатной температуре в течение ночи смесь выливают в ледяную воду и экстрагируют EtOAc (2 раза). Органический слой промывают водой и солевым раствором, сушат над MgSO4 и фильтруют. Фильтрат концентрируют при пониженном давлении, при этом получают соединение 52 (0,25 г, 95%) в виде твердого вещества коричневого цвета.
(3S)-3-(1,3-бензодиоксол-5-ил)-3-({2-[2-оксо-3-(фенилметил)-2,3-дигидро-1Н-бензимидазол-1-ил]ацетил}амино)пропионовую кислоту получают из соединения 52 в соответствии с методиками, описанными в Примере 1. 1H ЯМР (400 МГц, CD3COCD3):  2,79 (m, 2H), 4,56 (m, 2H), 5,02 (s, 2H), 5,31 (m, 1H), 5,90 (s, 2H), 6,92 (m, 7H), 7,25 (m, 5H), 7,91 (d, J=8,4 Гц, 1H), 10,79 (br. s, 1H). 2,79 (m, 2H), 4,56 (m, 2H), 5,02 (s, 2H), 5,31 (m, 1H), 5,90 (s, 2H), 6,92 (m, 7H), 7,25 (m, 5H), 7,91 (d, J=8,4 Гц, 1H), 10,79 (br. s, 1H).
Пример 17
Синтез(3S)-3-(1,3-бензодиоксол-5-ил)-3-({2-[5,5-диметил-2,4-диоксо-3-(фенилметил)тетрагидро-1Н-имидазол-1-ил]гексаноил}амино)пропионовой кислоты.
Стадия 1: К раствору 5,5-диметилгидантоина (2,00 г, 15,6 ммоль) в ДМФ (30 мл) при комнатной температуре добавляют К2СО3 (6,5 г, 47 ммоль) и бензилхлорид (2,20 мл, 18,7 ммоль). Полученную смесь перемешивают в течение ночи, разбавляют водой и экстрагируют этилацетатом. Органический слой промывают солевым раствором, сушат над MgSO4 и фильтруют. Фильтрат концентрируют при пониженном давлении и остаток очищают хроматографией на силикагеле, элюируют смесью гексан/этилацетат в градиенте от 6:1 до 3:1, при этом получают соединение 53 (3,21 г, 94%).
(3S)-3-(1,3-бензодиоксол-5-ил)-3-({2-[5,5-диметил-2,4-диоксо-3-(фенилметил)тетрагидро-1Н-имидазол-1-ил]гексаноил}амино)пропионовую кислоту получают из соединения 53 в соответствии с методиками, описанными в Примерах 1 и 16, т.пл. 53-55°С.
Пример 18
Синтез (3S)-3-(1,3-бензодиоксол-5-ил)-3-({(2S)-2-[2,4-диоксо-1-(фенилметил)-1,4-дигидро-3(2Н)-хиназолинил]гексаноил}амино)пропионовой кислоты.
Стадия 1: К раствору антраниловой кислоты (450 мг, 3,30 ммоль) и гидрохлорида метилового эфира норлейцина (500 мг, 2,75 ммоль) в диметилформамиде (10 мл) при комнатной температуре добавляют гидрохлорид 1-[3-(диметиламино)пропил]-3-этилкарбодиимида (640 мг, 3,30 ммоль), 1-гидроксибензотриазол (450 мг, 3,30 ммоль) и 4-метилморфолин (610 мг, 5,50 ммоль). Полученную реакционную смесь перемешивают при комнатной температуре в течение 24 ч, затем смесь переносят в этилацетат (200 мл) и промывают водой (2×200 мл). Органический слой сушат над MgSO4 и фильтруют. Фильтрат концентрируют при пониженном давлении и остаток очищают хроматографией на силикагеле, элюируют смесью гексан/этилацетат в градиенте от 4:1 до 1:1, при этом получают соединение 54 (860 мг, 99%).
Стадия 2: Раствор соединения 54 (0,86 г, 3,26 ммоль) и КДИ (0,79 г, 4,89 ммоль) в безводном ClCH2CH2Cl (30 мл) нагревают при 85°С в течение ночи. Смесь охлаждают до комнатной температуры и концентрируют, остаток переносят в EtOAc. Органический слой промывают 1 н. HCl (3х) и солевым раствором, сушат над MgSO4 и фильтруют. Фильтрат концентрируют при пониженном давлении и остаток очищают хроматографией на силикагеле, элюируют смесью гексан/EtOAc в градиенте от 5:1 до 1:1, при этом получают соединение 55 (0,67 г, 71%) в виде твердого вещества белого цвета.
(3S)-3-(1,3-бензодиоксол-5-ил)-3-({(2S)-2-[2,4-диоксо-1-(фенилметил)-1,4-дигидро-3(2Н)-хиназолинил]гексаноил}амино)пропионовую кислоту получают из соединения 55 в соответствии с методиками, описанными в Примерах 1 и 16. 1H ЯМР (400 МГц, CD3SO2CD3):  0,80 (m, 3H), 1,1-1,6 (m, 4H), 2,03 (m, 1H), 2,20 (m, 1H), 2,63 (m, 2H), 5,20 (m, 2H), 5,35 (m, 1H), 5,47 (m, 1H), 5,91 (d, J=11,0 Гц, 1H), 5,96 (d, J=3,3 Гц, 1H), 6,64-6,87 (m, 3H), 7,30 (m, 6 H), 7,68 (m, 1H), 8,14 (m, 2H), 12,09 (br. s, 1H). 0,80 (m, 3H), 1,1-1,6 (m, 4H), 2,03 (m, 1H), 2,20 (m, 1H), 2,63 (m, 2H), 5,20 (m, 2H), 5,35 (m, 1H), 5,47 (m, 1H), 5,91 (d, J=11,0 Гц, 1H), 5,96 (d, J=3,3 Гц, 1H), 6,64-6,87 (m, 3H), 7,30 (m, 6 H), 7,68 (m, 1H), 8,14 (m, 2H), 12,09 (br. s, 1H).
Пример 19
Синтез (3S)-3-(1,3-бензодиоксол-5-ил)-3-({2-[3-метил-6-оксо-5-(фенилметил)-1(6Н)-пиридазинил]гексаноил}амино)пропионовой кислоты.
Стадия 1: К смеси дигидропиридазинона (2,50 г, 19,21 ммоль) в TtOH (6 мл) при комнатной температуре добавляют бензальдегид (2,04 г, 19,21 ммоль) и твердый КОН (1,3 г, 23,05 ммоль). Смесь нагревают при 85°С в течение ночи, охлаждают до комнатной температуры и выливают в ледяную воду. Полученную смесь подкисляют концентрированной HCI до рН=4 и полученный осадок собирают фильтрованием, промывают водой. Полученное твердое вещество высушивают в вакууме, при этом получают соединение 56 (3,6 г, 85%).
(3S)-3-(1,3-бензодиоксол-5-ил)-3-({2-[3-метил-6-оксо-5-(фенилметил)-1(6Н)-пиридазинил]гексаноил}амино)пропионовую кислоту получают из соединения 56 в соответствии с методиками, описанными в Примерах 1 и 16. 1H ЯМР(400 МГц, CD3SO2CD3):  0,80 (m, 3H), 1,18 (m, 4 Н), 1,95 (m, 2H), 2,18 (s, 3H), 2,65 (m, 2H), 3,79 (m, 2H), 5,06 (m, 1H), 5,26 (m, 1H), 5,97 (d, J=2,2 Гц, 2Н), 6,81 (m, 3H), 6,98 (s, 1H), 7,27 (m, 5Н), 8,27 (m, 1H), 12,14 (br. s, 1H). 0,80 (m, 3H), 1,18 (m, 4 Н), 1,95 (m, 2H), 2,18 (s, 3H), 2,65 (m, 2H), 3,79 (m, 2H), 5,06 (m, 1H), 5,26 (m, 1H), 5,97 (d, J=2,2 Гц, 2Н), 6,81 (m, 3H), 6,98 (s, 1H), 7,27 (m, 5Н), 8,27 (m, 1H), 12,14 (br. s, 1H).
Пример 20
Синтез (3S)-3-(1,3-бензодиоксол-5-ил)-3-({2-[2-оксо-3-(фенилметил)-3,4-дигидро-1(2Н)-хиназолинил]гексаноил}амино)пропионовой кислоты.
Стадия 1: Раствор 2-нитробензилбромида (0,50 г, 2,31 ммоль) и бензиламина (0,49 г, 4,62 ммоль) в ТГФ (5 мл) перемешивают при комнатной температуре в течение ночи и затем разбавляют EtOAc. Органический слой промывают 1 н. NaOH (дважды) и солевым раствором, сушат над MgSO4 и фильтруют. Фильтрат концентрируют при пониженном давлении и остаток очищают хроматографией на силикагеле, элюируют смесью гексан/EtOAc в градиенте от 3:1 до 1:1, при этом получают соединение 57 (0,5 г, 89%) в виде масла.
(3S)-3-(1,3-бензодиоксол-5-ил)-3-({2-[2-оксо-3-(фенилметил)-3,4-дигидро-1(2Н)-хиназолинил]гексаноил}амино)пропионовую кислоту получают из соединения 57 в соответствии с методиками, описанными в Примерах 1 и 16. 1H ЯМР(400 МГц, CD3SO2CD3): 0,78 (m, 3H), 1,21 (m, 4 Н), 1,88 (m, 1H), 2,14 (m, 1H), 2,65 (m, 2H), 4,26 (m, 2H), 4,43 (m, 1H), 4,80 (m, 1H), 5,03 (m, 1H), 5,18 (m, 1H), 5,92 (d, J=4,0 Гц, 1H), 5,97 (s, 1H), 6,70 (m, 2H), 6,80 (m, 1H), 6,95 (m, 2H), 7,12 (m, 2H), 7,30 (m, 5Н), 8,20 (m, 1H), 12,09 (br. s, 1H). 0,78 (m, 3H), 1,21 (m, 4 Н), 1,88 (m, 1H), 2,14 (m, 1H), 2,65 (m, 2H), 4,26 (m, 2H), 4,43 (m, 1H), 4,80 (m, 1H), 5,03 (m, 1H), 5,18 (m, 1H), 5,92 (d, J=4,0 Гц, 1H), 5,97 (s, 1H), 6,70 (m, 2H), 6,80 (m, 1H), 6,95 (m, 2H), 7,12 (m, 2H), 7,30 (m, 5Н), 8,20 (m, 1H), 12,09 (br. s, 1H).
Пример 21
Синтез (3S)-3-(1,3-бензодиоксол-5-ил)-3-({2-[2-оксо-3-(фенилметил)-1(2Н)-хиноксалинил]гексаноил}амино)пропионовой кислоты.
Стадия 1: К раствору 1,2-фенилендиамина (2,64 г, 14,4 ммоль) и фенилпировиноградной кислоты (2,00 г, 12,2 ммоль) в этаноле (абсолютный, 20 мл) добавляют раствор 2-меркаптоэтанола (1,6 мл) в 2 н. HCl (18,3 мл). Полученную смесь нагревают с обратным холодильником в течение 2 ч, затем охлаждают до комнатной температуры и фильтруют, осадок промывают этанолом (дважды). Осадок высушивают в вакууме, при этом получают соединение 58 (1,88 г, 65%) в виде твердого вещества белого цвета.
(3S)-3-(1,3-бензодиоксол-5-ил)-3-({2-[2-оксо-3-(фенилметил)-1(2Н)-хиноксалинил]гексаноил}амино)пропионовую кислоту получают из соединения 58 в соответствии с методиками, описанными в Примерах 1 и 16. МС, рассчитано: (М-Н)–=540,21; найдено: (М-Н)–=540,21.
Пример 22
Синтез (3S)-3-(1,3-бензодиоксол-5-ил-3-((2S)-2-(3-бензил-5-метил-2-оксо-1(2Н)-пиридинил)гексаноиламино)пропионовой кислоты, (10).
Стадия 1: К раствору (R)-(+)-2-бромгексановой кислоты (410 мг, 2,1 ммоль) и NMM (0,265 мл, 2,1 ммоль) в ТГФ (8 мл) при 0°С в атмосфере сухого азота добавляют изобутилхлорформиат (0,27 мл, 2,1 ммоль). Полученную суспензию перемешивают при 0°С в течение 10 мин, а затем добавляют раствор соединения 6 (500 мг, 2,1 ммоль) в ДМФ (2 мл). Через 1 ч суспензию отфильтровывают и фильтрат концентрируют при пониженном давлении. Остаток переносят в CH2Cl2 и промывают HCI (1 н., 2 раза). Объединенные органические слои промывают солевым раствором. Органический слой сушат над MgSO4, фильтруют и концентрируют при пониженном давлении, при этом получают соединение 59 (840 мг, 96%) в виде масла желтого цвета. Полученное вещество используют без дальнейшей очистки.
Стадия 2: К раствору 2-фтор-5-метилпиридина (3,23 г, 30 ммоль) в ТГФ (60 мл), охлажденному до -78°С, в атмосфере сухого азота по каплям добавляют диизопропиламид лития (22 мл, 2 М раствор в ТГФ, 44 ммоль). Полученный раствор красно-оранжевого цвета перемешивают при -78°С в течение 6 ч, а затем добавляют бензальдегид (3,1 мл, 35 ммоль). Реакционную смесь перемешивают еще 30 мин, реакцию останавливают добавлением H2O (75 мл) и смесь экстрагируют EtOAc (2 раза). Объединенные органические слои промывают солевым раствором, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении, при этом получают соединение 60 (6,5 г, выход колич.) в виде масла желтого цвета. Полученное вещество используют без дальнейшей очистки.
Стадия 3: Раствор соединения 60 (6,5 г, 30 ммоль), бор-трифтордиэтилэфирата (13 мл, 100 ммоль) и триэтилсилана (9 мл, 60 ммоль) в дихлорэтане (50 мл) нагревают с обратным холодильником в атмосфере сухого азота в течение 1 ч. Полученный раствор охлаждают до комнатной температуры и реакцию останавливают добавлением H2O (50 мл). Полученную смесь экстрагируют EtOAc (2 раза). Объединенные органические слои промывают солевым раствором, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении, при этом получают соединение 61 (5,9 г, 98%) в виде масла желтого цвета.
Стадия 4: К HCl (6 н., 50 мл) добавляют раствор соединения 61 (5,9 г, 30 ммоль) в диоксане (2 мл) и полученную смесь нагревают с обратным холодильником в течение 12 ч. Полученный раствор охлаждают до комнатной температуры и подщелачивают добавлением NaOH (2 н.). Полученную смесь экстрагируют EtOAc (100 мл ×2) и объединенные органические слои промывают солевым раствором, сушат над MgSO4 и фильтруют. Полученный фильтрат концентрируют при пониженном давлении. Остаток перекристаллизовывают из смеси метанол/гексан, при этом получают соединение 62 (3,1 г, 51%) в виде твердого вещества грязно-белого цвета.
Стадия 5: К раствору соединения 62 (48 мг, 0,24 ммоль) вДМЭ (1,5 мл) в атмосфере сухого азота, охлажденного до -40°С, добавляют ГМДСН (0,25 мл, 1 М в ТГФ, 0,25 ммоль). Полученную суспензию перемешивают при -40°С в течение 30 мин, а затем добавляют LiBr (21 мг, 0,25 ммоль). После перемешивания в течение еще 10 мин по каплям добавляют раствор соединения 59 (100 мг, 0,24 ммоль) в ДМФ (0,5 мл). Полученную смесь нагревают до комнатной температуры, а затем нагревают при 45°С в течение 3,5 ч. Смесь охлаждают до комнатной температуры и реакцию останавливают добавлением HCl (1 н., 15 мл). Полученную смесь экстрагируют CH2Cl2 (дважды). Объединенные органические слои промывают водным карбонатом натрия (5%) и солевым раствором. Органическую фазу сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Остаток перекристаллизовывают из смеси метанол/гексан, при этом получают соединение 63 (39 мг, 31%) в виде кристаллов белого цвета.
(3S)-3-(1,3-бензодиоксол-5-ил-3-((2S)-2-(3-бензил-5-метил-2-оксо-1(2Н)-пиридинил)гексаноиламино)пропионовую кислоту (10), получают из соединения 63 в соответствии с методиками, описанными в Примере 1.
Список соединений по настоящему изобретению, которые могут быть синтезированы в соответствии с методикой, описанной в Примере 22, из различных исходных веществ, включает следующие соединения:
(3S)-3-{[(2S)-2-(3-бензил-5-метил-2-оксопиридин-1(2Н)-ил)гексаноил]амино}-3-(3′,4′-диметокси-1,1′-бифенил-4-ил)пропионовая кислота,
(3S)-3-({(2S)-2-[3-(2-хлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(3′,4′-диметокси-1,1′-бифенил-4-ил)пропионовая кислота,
(3S)-3-(1,1′-бифенил-4-ил)-3-({(2S)-2-[3-(2-хлор-6-метилбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)пропионовая кислота,
(3S)-3-{[(2S)-2-(3-бензил-5-метил-2-оксопиридин-1(2Н)-ил)гексаноил]амино}-3-(1,1′-бифенил-4-ил)пропионовая кислота,
(3S)-3-(1,1′-бифенил-4-ил)-3-({(2S)-2-[3-(2-хлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)пропионовая кислота,
(3S)-3-{[(2S)-2-(3-бензил-5-метил-2-оксопиридин-1(2Н)-ил)гексаноил]амино}-3-(4′-метил-1,1′-бифенил-4-ил)пропионовая кислота,
(3S)-3-({(2S)-2-[3-(2-хлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(4′-метил-1,1′-бифенил-4-ил)пропионовая кислота,
(3S)-3-({(2S)-2-[3-(2-хлор-6-метилбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(4′-метил-1,1′-бифенил-4-ил)пропионовая кислота,
(3S)-3-{[(2S)-2-(3-бензил-5-метил-2-оксопиридин-1(2Н)-ил)гексаноил]амино}-3-(2′,6′-диметокси-1,1′-бифенил-4-ил)пропионовая кислота,
(3S)-3-({(2S)-2-[3-(2-хлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(2′,6′-диметокси-1,1′-бифенил-4-ил)пропионовая кислота,
(3S)-3-({(2S)-2-[3-(2-хлор-6-метилбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(2′,6′-диметокси-1,1′-бифенил-4-ил)пропионовая кислота,
(3S)-3-{[(2S)-2-(3-бензил-5-метил-2-оксопиридин-1(2Н)-ил)гексаноил]амино}-3-(1,1′-бифенил-3-ил)пропионовая кислота,
(3S)-3-(1,1′-бифенил-3-ил)-3-({(2S)-2-[3-(2-хлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)пропионовая кислота,
(3S)-3-(1,1′-бифенил-3-ил)-3-({(2S)-2-[3-(2-хлор-6-метилбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)пропионовая кислота,
(3S)-3-{[(2S)-2-(3-бензил-5-метил-2-оксопиридин-1(2Н)-ил)гексаноил]амино}-3-(2′-метокси-1,1′-бифенил-3-ил)пропионовая кислота,
(3S)-3-({(2S)-2-[3-(2-хлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(2′-метокси-1,1′-бифенил-3-ил)пропионовая кислота,
(3S)-3-({(2S)-2-[3-(2-хлор-6-метилбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(2′-метокси-1,1′-бифенил-3-ил)пропионовая кислота,
(3S)-3-({(2S)-2-[3-(2-фтор-6-метоксибензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(4-метилфенил)пропионовая кислота,
(3S)-3-({(2S)-2-[3-(2,6-диметилбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(4-метилфенил)пропионовая кислота,
(3S)-3-({(2S)-2-[3-(3,5-диметилбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(4-метилфенил)пропионовая кислота,
(3S)-3-({(2S)-2-[3-(2,6-дихлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(4-метилфенил)пропионовая кислота,
(3S)-3-({(2S)-2-[3-(2-хлор-6-фторбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(4-метилфенил)пропионовая кислота,
(3S)-3-({(2S)-2-[3-(2,6-дифторбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(4-метилфенил)пропионовая кислота,
(3S)-3-(1,3-бензодиоксол-5-ил)-3-({(2S)-2-[3-(2,6-дифторбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)пропионовая кислота,
(3S)-3-(1,3-бензодиоксол-5-ил)-3-({(2S)-2-[3-(2-хлор-6-фторбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)пропионовая кислота,
(3S)-3-(1,3-бензодиоксол-5-ил)-3-({(2S)-2-[3-(2,6-дихлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)пропионовая кислота,
(3S)-3-(1,3-бензодиоксол-5-ил)-3-({(2S)-2-[3-(2,6-диметилбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)пропионовая кислота,
(3S)-3-(1,3-бензодиоксол-5-ил)-3-({(2S)-2-[3-(3,5-диметилбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)пропионовая кислота,
(3S)-3-(1,3-бензодиоксол-5-ил)-3-({(2S)-2-[3-(2-фтор-6-метоксибензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)пропионовая кислота,
(3S)-3-({(2S)-2-[3-(2-хлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(3,4-диэтоксифенил)пропионовая кислота,
(3S)-3-(3,4-диэтоксифенил)-3-({(2S)-2-[3-(2,6-дифторбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)пропионовая кислота,
(3S)-3-({(2S)-2-[3-(2,6-дифторбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(3-этоксифенил)пропионовая кислота,
(3S)-3-({(2S)-2-[3-(2-хлор-6-фторбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(3-этоксифенил)пропионовая кислота,
(3S)-3-({(2S)-2-[3-(2-хлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]-3-метилбутаноил}амино)-3-(4-метилфенил)пропионовая кислота,
(3S)-3-({(2S)-2-[3-(2-хлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]-4-метилпентаноил}амино)-3-(4-метилфенил)пропионовая кислота,
(3S)-3-(1,3-бензодиоксол-5-ил)-3-({(2S)-2-[3-(2-хлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]-4-метилпентаноил}амино)пропионовая кислота,
(3S)-3-(1,3-бензодиоксол-5-ил)-3-({(2S)-2-[3-(2-хлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]-3-метилбутаноил}амино)пропионовая кислота,
(3S)-3-(1,3-бензодиоксол-5-ил)-3-({(2S)-2-[3-(2-хлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]-3-фенилпропаноил}амино)пропионовая кислота,
(3S)-3-(1,3-бензодиоксол-5-ил)-3-(((2R)-2-(1-бензил-5-метил-2-оксо-1,2-дигидропиридин-3-ил)гексаноил)амино)пропионовая кислота и
(3S)-3-({(2S)-2-[3-(2-хлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]-3-фенилпропаноил}амино)-3-(4-метилфенил)пропионовая кислота.
Пример 23
Синтез (3S)-3-(1,3-бензодиоксол-5-ил)-3-{[(2R)-2-(3-бензил-4-гидрокси-5-метил-2-оксопиридин-1(2Н)-ил)гексаноил]амино}пропионовой кислоты, 67, и (3S)-3-(1,3-бензодиоксол-5-ил)-3-{[(2S)-2-(3-бензил-4-гидрокси-5-метил-2-оксопиридин-1(2Н)-ил)гексаноил]амино}пропионовой кислоты, 68.
Стадия 1: К раствору метилового эфира пропионилуксусной кислоты (2,00 г, 15,4 ммоль) в безводном ТГФ (62 мл), охлажденному до 0°С, в атмосфере сухого азота добавляют двумя порциями гидрид натрия (60% дисперсия в минеральном масле, 0,644 г, 16,1 ммоль). Полученную смесь перемешивают при 0°С в течение 15 мин, при помощи шприца добавляют бензилбромид (2,75 г, 16,1 ммоль), а затем нагревают при комнатной температуре в течение ночи. Полученную смесь выливают в HCl (2 н.) и экстрагируют этилацетатом. Органический слой промывают солевым раствором, сушат над MgSO4 и фильтруют, фильтрат концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле, элюируют смесью гексан/этилацетат 9:1, при этом получают соединение 64 (2,86 г, 84%).
Стадия 2: К суспензии гидрида натрия (60% дисперсия в минеральном масле, 0,623 г, 15,6 ммоль) в ТГФ (52 мл) при комнатной температуре в атмосфере сухого азота добавляют N,N,N’,N’-тетраметилэтилендиамин (2,10 мл, 13,6 ммоль). Полученную суспензию охлаждают до -20°С, а затем медленно добавляют раствор соединения 64 (2,86 г, 13,0 ммоль) в ТГФ (5 мл). Смесь нагревают до комнатной температуры, перемешивают в течение 10 мин, а затем охлаждают до -20°С. К полученному раствору при помощи шприца по каплям добавляют н-бутиллитий (1,6 М в гексане, 15,4 мл, 24,9 ммоль). Смесь перемешивают при -20°С в течение еще 15 мин, затем реакцию останавливают быстрым добавлением при помощи шприца метилформиата (1,00 мл, 16,2 ммоль) и смесь перемешивают в течение еще 15 мин. Реакцию осторожно останавливают избытком водной HCl (2 н.) и разбавляют гексаном. Слой гексана промывают солевым раствором, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении, при этом получают соединение 65 (1,10 г, 34%) в виде масла желтого цвета. Полученное вещество используют без дальнейшей очистки.
Стадия 3: Раствор соединений 65 (0,75 г, 3,0 ммоль) и 23 (0,75 г, 2,1 ммоль) в метаноле (30 мл, 0,1 М) нагревают в атмосфере азота при 45°С в течение 1 ч, а затем кипятят с обратным холодильником в течение ночи. Смесь охлаждают и кон центрируют досуха. Остаток очищают хроматографией на силикагеле, элюируют в градиенте от смеси гексан/этилацетат 2:1 до 100% этилацетата, при этом получают соединение 66 (0,40 г, 35%) в виде пены белого цвета.
Стадия 4: К раствору соединения 66 (0,40 г, 0,73 ммоль) в ТГФ (3 мл) при комнатной температуре добавляют водный NaOH (1 мл) и метанол (2 мл). Полученный раствор перемешивают в течение 15 мин, разбавляют водой и экстрагируют этиловым эфиром. Водный слой подкисляют HCl (2 н.) и экстрагируют этилацетатом. Слой этилацетата промывают водой и солевым раствором, сушат над MgSO4 и фильтруют. Фильтрат концентрируют при пониженном давлении, остаток очищают обращенно-фазной ВЭЖХ (А: Н2О/СН3CN 19:1+0,1% ТФУ; В: CH3CN/H2O 19:1+0,1% ТФУ; градиент элюции от 30% В до 100% В в течение 31 мин; 254 нм). Фракции, содержащие каждый из диастереомеров, отдельно разбавляют водой и экстрагируют этилацетатом. Слои этилацетата отдельно промывают водой (3 раза) и солевым раствором, сушат над MgSO4 и фильтруют. Фильтраты отдельно концентрируют при пониженном давлении, при этом получают (3S)-3-(1,3-бензодиоксол-5-ил)-3-{[(2R)-2-(3-бензил-4-гидрокси-5-метил-2-оксопиридин-1(2Н)-ил)гексаноил]амино}пропионовую кислоту, 67 (18 мг, 5%), и (3S)-3-(1,3-бензодиоксол-5-ил)-3-{[(2S)-2-(3-бензил-4-гидрокси-5-метил-2-оксопиридин-1(2Н)-ил)гексаноил]амино}пропионовую кислоту, 68 (105 мг, 28%). МС для соединения 67, рассчитано: (М+Н)+=521,23; найдено: (М+Н)+=520,97. МС для соединения 68, рассчитано: (М+Н)+=521,23; найдено: (M+H)+=520,95.
Пример 24
Синтез (3S)-3-(3-изопропоксифенил)-3-({2-[2-оксо-4-(2-фенилэтил)пиридин-1(2Н)-ил]гексаноил}амино)пропионовой кислоты.
Стадия 1: К раствору диизопропиламина (2,94 г, 29,1 ммоль) в ТГФ (20 мл), охлажденному до -78°С, в атмосфере сухого азота при помощи шприца добавляют бутиллитий (12,8 мл, 2,5 М раствор в гексане, 32,0 ммоль) и перемешивают при -78°С в течение 15 мин. Полученный раствор с помощью трубки добавляют к раствору 2-фтор-4-метилпиридина (2,15 г, 9,40 ммоль) в ТГФ (20 мл), охлажденному до -78°С, в атмосфере сухого азота. Полученную реакционную смесь перемешивают при -78°С в течение 4 ч, затем реакцию останавливают добавлением бензальдегида (2,17 мл, 21,3 ммоль). Полученный раствор желтого цвета нагревают до комнатной температуры, разбавляют водой и экстрагируют этилацетатом. Органический слой промывают солевым раствором, сушат над MgSO4 и фильтруют. Фильтрат концентрируют при пониженном давлении и остаток очищают хроматографией на силикагеле, элюируют смесью гексан/этилацетат 7:3, при этом получают соединение 69 (1,92 г, 94%) в виде масла желтого цвета.
Стадия 2: К раствору соединения 69 (1,92 г, 8,84 ммоль) в безводном метаноле (20 мл) при комнатной температуре в атмосфере сухого азота добавляют палладий на угле (1,00 г, 10% Pd в расчете на сухую массу, тип Degussa E101 NE/W, влажный, 50% воды по массе) и четыре капли ледяной уксусной кислоты. Атмосферу азота заменяют на водородную (пятикратно переключают кран между вакуумной линией и баллоном с водородом) и смесь перемешивают при комнатной температуре в течение ночи. Смесь фильтруют через слой целита 521 и фильтрат концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле, элюируют смесью гексан/этилацетат 8:2, при этом получают соединение 70 (0,98 г, 55%) в виде твердого вещества белого цвета.
Стадия 3: К раствору соединения 70 (0,90 г, 4,47 ммоль) в хлористом водороде (2 мл, 4,0 М в диоксане, 8,0 ммоль) при комнатной температуре добавляют водный раствор соляной кислоты (6,0 М, 40 мл) и смесь кипятят с обратным холодильником в течение 3 ч. Раствор охлаждают до комнатной температуры, подщелачивают водным гидроксидом натрия (2 н.) и экстрагируют этилацетатом. Органический слой промывают солевым раствором, сушат над MgSO4 и фильтруют. Фильтрат концентрируют при пониженном давлении, при этом получают соединение 71 (0,81 г, 91%) в виде твердого вещества бледно-желтого цвета. Полученное вещество используют без очистки.
Стадия 4: К раствору соединения 71 (0,20 г, 1,0 ммоль) в метилсульфоксиде (4,0 мл) при комнатной температуре добавляют гидрид натрия (60% мас./мас. дисперсия в минеральном масле, 0,12 г, 3,0 ммоль). Полученную смесь перемешивают при комнатной температуре в атмосфере сухого азота в течение 1 ч. К полученной смеси добавляют этиловый эфир 2-бромгексановой кислоты (0,18 мл, 1,0 ммоль) и смесь перемешивают в течение 30 мин. Реакцию останавливают добавлением HCl (2 н., 50 мл) и смесь экстрагируют этилацетатом. Органический слой промывают солевым раствором, сушат над MgSO4 и фильтруют. Фильтрат концентрируют при пониженном давлении и остаток очищают хроматографией на силикагеле, элюируют смесью гексан/этилацетат в градиенте от 9:1 до 8:2, при этом получают соединение 72 (0,19 г, 0,55 ммоль) в виде твердого вещества.
(3S)-3-(3-изопропоксифенил)-3-({2-[2-оксо-4-(2-фенилэтил)пиридин-1(2Н)-ил]гексаноил}амино)пропионовую кислоту получают из соединения 72 в соответствии с методиками, описанными в Примере 1. МС, рассчитано: (М-Н)–=517,27; найдено: (М-Н)–=517,21.
Пример 25
Синтез (3S)-3-[3-(дифторметил)фенил]-3-({2-[5-метил-2-оксо-3-(фенилметил)-1(2Н)-пиридинил]гексаноил}амино)пропионовой кислоты.
Стадия 1: К раствору 3-бромбензальдегида, 73 (3,00 г, 16,2 ммоль) в ДМФ (69 мл) в атмосфере сухого азота добавляют ацетат палладия (73 мг, 0,32 ммоль), три-о-толилфосфин (197 мг, 0,65 ммоль), этиловый эфир акриловой кислоты (2,20 мл, 20,3 ммоль) и триэтиламин (4,50 мл, 32,4 ммоль). Из полученной смеси удаляют кислород (пятикратно переключают кран между вакуумной линией и баллоном с азотом), смесь нагревают при 125°С в течение 19 ч и затем охлаждают до комнатной температуры. Реакционную смесь выливают в воду и экстрагируют эфиром. Органический слой промывают HCl (4 н.) и солевым раствором, сушат над MgSO4 и фильтруют. Фильтрат концентрируют при пониженном давлении, при этом получают соединение 74 (2,74 г, 83%), которое используют без дальнейшей очистки.
Стадия 2: В колбу, содержащую соединение 74, (1,00 г, 4,9 ммоль) в атмосфере сухого азота добавляют при помощи шприца (диметиламино)трифторидсеры (0,96 мл, 9,8 ммоль). Смесь нагревают при 90°С с использованием противовзрывного экрана в течение 25 мин, а затем охлаждают до комнатной температуры. Полученную смесь разбавляют СН2Cl2 и промывают насыщенным водным NaHCO3 и H2O. Органический слой сушат над MgSO4 и фильтруют. Фильтрат концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле, элюируют смесью этилацетат/гексан 1:5, при этом получают соединение 75 (0,62 г, 56%).
Стадия 3: К раствору (R)-(+)-N-бензил- -метилбензиламина (0,70 г, 3,3 ммоль) в ТГФ (6,7 мл), охлажденному до -78°С, в атмосфере сухого азота по каплям добавляют втор-BuLi (4,22 мл, 1,3 М в циклогексане, 5,5 ммоль). Полученную смесь перемешивают при -78°С в течение 30 мин, а затем при помощи шприца по каплям добавляют раствор соединения 75 (0,62 г, 2,74 ммоль) в ТГФ (3,4 мл). Смесь перемешивают при -78°С в течение 5 ч, а затем реакцию останавливают добавлением ледяной АсОН (2 мл) в ТГФ (5 мл). Реакционную смесь нагревают до комнатной температуры, выливают в смесь насыщенный водный NaHCO3/EtOAc 1:1. Органический слой промывают Н2О (2 раза) и солевым раствором, сушат над MgSO4 и фильтруют. Фильтрат концентрируют при пониженном давлении и остаток очищают хроматографией на силикагеле, элюируют смесью этилацетат/гексан 1:5, при этом получают соединение 76 (1,2 г, 100%). Полученный продукт содержит минимальное количество примесей, но используется без дальнейшей очистки. -метилбензиламина (0,70 г, 3,3 ммоль) в ТГФ (6,7 мл), охлажденному до -78°С, в атмосфере сухого азота по каплям добавляют втор-BuLi (4,22 мл, 1,3 М в циклогексане, 5,5 ммоль). Полученную смесь перемешивают при -78°С в течение 30 мин, а затем при помощи шприца по каплям добавляют раствор соединения 75 (0,62 г, 2,74 ммоль) в ТГФ (3,4 мл). Смесь перемешивают при -78°С в течение 5 ч, а затем реакцию останавливают добавлением ледяной АсОН (2 мл) в ТГФ (5 мл). Реакционную смесь нагревают до комнатной температуры, выливают в смесь насыщенный водный NaHCO3/EtOAc 1:1. Органический слой промывают Н2О (2 раза) и солевым раствором, сушат над MgSO4 и фильтруют. Фильтрат концентрируют при пониженном давлении и остаток очищают хроматографией на силикагеле, элюируют смесью этилацетат/гексан 1:5, при этом получают соединение 76 (1,2 г, 100%). Полученный продукт содержит минимальное количество примесей, но используется без дальнейшей очистки.
Стадия 4: К раствору соединения 76 (0,50 г, 1,14 ммоль) в TtOH (10 мл) при комнатной температуре в атмосфере сухого азота добавляют Pd/C (0,25 г, 10% Pd в расчете на сухую массу, тип Degussa E101 NE/W, 50% воды по массе) и ледяную АсОН (0,5 мл). Атмосферу заменяют на водородную (пятикратно переключают кран между вакуумной линией и баллоном с водородом) и смесь нагревают при 35°С в течение 6 ч. Реакционную смесь охлаждают до комнатной температуры, фильтруют через слой целита 521 и фильтрат концентрируют при пониженном давлении. Остаток разбавляют CHCl3 и промывают насыщенным водным NaHCO3. Водный слой экстрагируют CHCl3 (2 раза) и объединенные органические слои сушат над MgSO4 и фильтруют. Фильтрат концентрируют при пониженном давлении и остаток очищаютхроматографией на силикагеле, элюируют смесью МеОН/CHCl3 1:10, при этом получают соединение 77 (180 мг, 67%).
(3S)-3-[3-(дифторметил)фенил]-3-({2-[5-метил-2-оксо-3-(фенилметил)-1(2Н)-пиридинил]гексаноил}амино)пропионовую кислоту получают из соединения 77 в соответствии с методиками, описанными в Примере 1. МС, рассчитано: (М-Н)–=509,23; найдено: (М-Н)–=509,19.
Пример 26
Для оценки эффективности синтезированных соединений используют методику, в которой 26-членный пептид, содержащий фрагмент CS1 фибронектина с М-концевым остатком цистеина (CDELPQLVTLPHPNLHGPEILDVPST) конденсируют с овальбумином, активированным с помощью имида малеиновой кислоты. Полистироловые 96-луночные планшеты покрывают раствором бычьего сывороточного альбумина (БСА) и конъюгата овальбумина и CS1 при концентрации 0,5 мкг/мл в буферном растворе TBS (50 mM Tris, рН 7,5; 150 тМ NaCl) при 4°С в течение 16 ч. Планшеты промывают три раза TBS и блокируют TBS, содержащим 3% БСА, при комнатной температуре в течение 4 ч. Перед проведением анализа блокированные планшеты промывают три раза буферным раствором для связывания (TBS; 1 mM MgCl2; 1 mM CaCl2; 1 mM MnCl2). Клетки Ramos, меченные флуоресцентным кальцеином AM, ресуспендируют в буферном растворе для связывания (107 клеток/мл) и разбавляют тем же буфером в соотношении 1:2 в присутствии или отсутствие соединения. Клетки немедленно добавляют в лунки (2,5×105 клеток в лунке) и инкубируют при 37°С в течение 30 мин. После трехкратного промывания буфером для связывания сросшиеся клетки лизируют и измеряют флуоресценцию на флуориметре. Результаты представлены в Таблицах 1-3. Величину IC50 определяют как дозу, которая требуется для 50%-ного ингибирования. Данные МС приведены в таблице 3, “н/о” означает “не определено”. Термин “%А” в таблице 2 означает % ингибирования, что означает ингибирование адгезии клеток в присутствии соединения при анализе при концентрации 100 мкМ. Чем ниже величина IC50 и выше степень (процент) ингибирования, тем выше эффективность соединения, которое обеспечивает предотвращение сращивания клеток.
| Таблица 1 |
| Номер соединения |
IC50 (нМ) |
Данные масс спектрометрии (m/z) |
| 8 |
7 |
Рассчитано (М-Н)–=503,22 Найдено (М-Н)–=503,24 |
| 9 |
2000 |
Рассчитано (М-Н)–=503,22 Найдено (М-Н)–=503,24 |
| 10 |
3 |
Рассчитано (М-Н)–=503,22 Найдено (М-Н)–=503,22 |
| 12 |
40 |
Рассчитано (М-Н)–=501,24 Найдено (М-Н)–=501,27 |
| 13 |
70 |
Рассчитано (М-Н)–=473,24 Найдено (М-Н)–=473,26 |
| 14 |
150 |
Рассчитано (М-Н)–=477,22 Найдено (М-Н)–=477,25 |
| 15 |
30 |
Рассчитано (M+H)+=535,25 Найдено (M+H)+=535,00 |
| 16 |
35 |
Рассчитано (М+Н)+=519,25 Найдено (М+Н)+=519,18 |
| Номер соединения |
IC50 (нМ) |
Данные масс спектрометрии (m/z) |
| 17 |
60 |
Рассчитано (М-Н)–=521,21 Найдено (М-Н)–=521,22 |
| 19 |
6 |
Рассчитано (М-Н)–=537,18 Найдено (М-Н)–=537,22 |
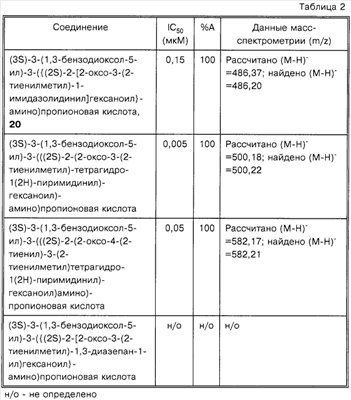 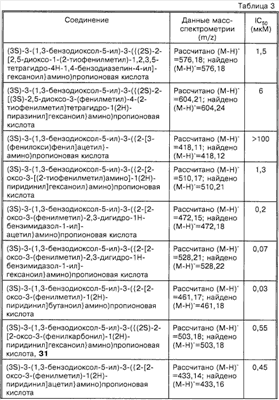 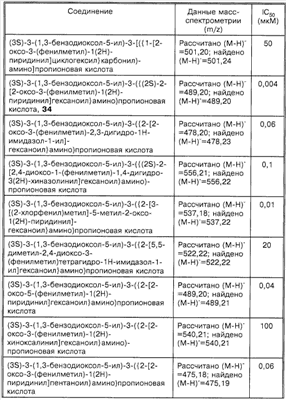 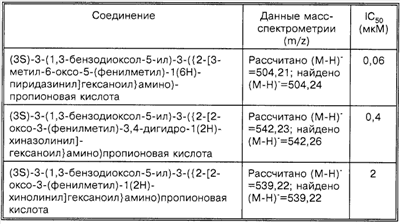 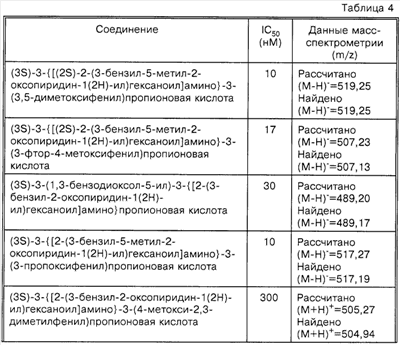 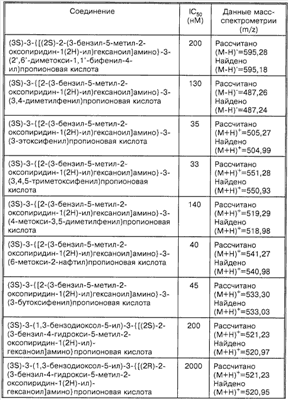 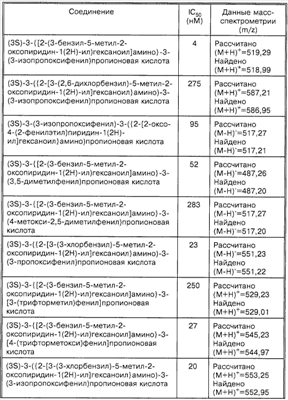 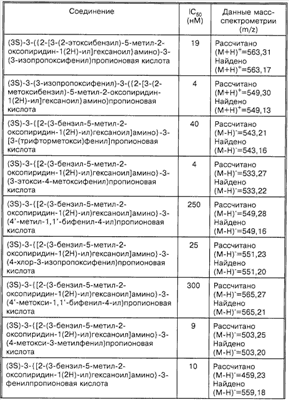 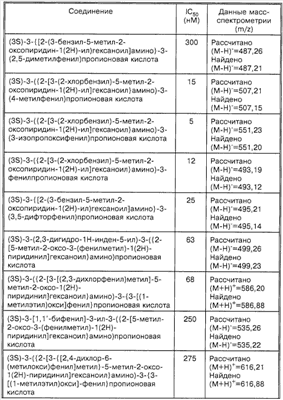 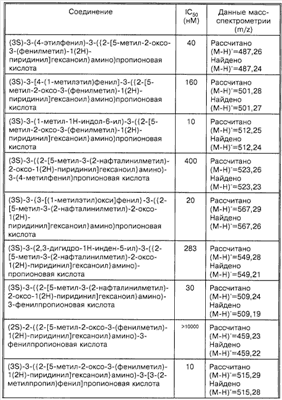 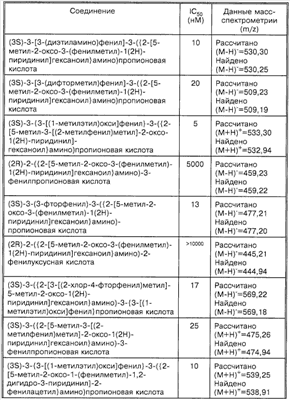 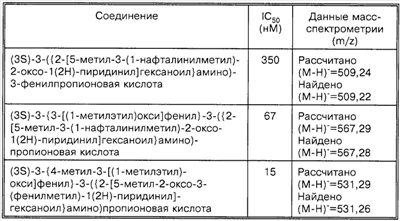
Все цитированные документы включены в текст описания в качестве ссылок.
Настоящее изобретение проиллюстрировано вышеприведенными описанием и Примерами. Вышеприведенное описание служит для иллюстрации изобретения без ограничения области изобретения, так как специалисту в данной области техники представляется очевидным, что с учетом вышеупомянутого описания возможны многочисленные варианты. Предполагается, что все такие варианты находятся в объеме притязаний изобретения, заявленного в пунктах формулы настоящего изобретения.
В состав композиции, осуществление и подготовку способа по настоящему изобретению, описанных в данном тексте, могут быть внесены изменения, не выходящие за пределы концепции и области изобретения, как определено в следующих пунктах формулы.
 
Формула изобретения
1. Соединение, имеющее структуру
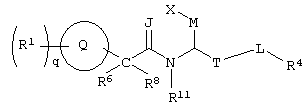
где круг Q означает бензольное кольцо или моноциклическое, или бициклическое гетероциклическое кольцо, содержащее по меньшей мере один атом азота;
q означает целое число от нуля до шести;
М означает -(СН2)u-, где u означает 0 или 1;
J означает -О-;
Т означает -(СН2)b-, где b означает 0;
L означает -(CH2)v-, где v означает 0;
Х означает -СО2В, где В означает водород;
R1 выбирают из группы, содержащей водород, галоген, гидроксил, алкил, алкиламино, арил, ароил, арилокси, гетероциклил, алкиларил, аралкил, гетероциклилалкил;
R4 означает арил, арилалкил или гетероциклил, причем R1 и R4 незамещены или замещены по крайней мере одной электронодонорной или электроноакцепторной группой;
R6, R8 и R11 каждый может означать водород или арил, или один из R6 и R8 может означать водород, другой – алкил, или R6 и R8 могут быть объединены с образованием циклоалкила,
или его фармацевтически приемлемая соль, или его производное, выбранное из группы, содержащей сложные эфиры, карбаматы, аминали, амиды и оптические изомеры.
2. Соединение по п.1, отличающееся тем, что круг Q означает бензольное кольцо или моноциклическое гетероциклическое кольцо, содержащее по меньшей мере один атом азота.
3. Соединение по п.1, отличающееся тем, что оно представляет собой производное, выбранное из группы, содержащей сложные эфиры, карбаматы, аминали, амиды и оптические изомеры.
4. Соединение, имеющее структуру
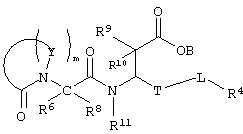
где Y в каждом случае независимо выбирают из группы, содержащей N, CR7, C(R2)(RЗ), NR5, где R2 и R3 каждый может означать водород или арил, R5 означает аралкил, а R7 означает водород, алкил, алкиламино, арил, ароил, аралкил или гетероциклил,
m означает целое число от 2 до 5,
Т означает (СН2)b, где b означает 0,
L означает (СН2)n, где n означает 0, и
В, R9, R10 и R11 каждый означает водород,
R4 означает арил,
R6 и R8 каждый может означать водород, причем другой в это время – алкил,
или его фармацевтически приемлемая соль, или его производное, выбранное из группы, содержащей сложные эфиры, карбаматы, аминали, амиды и оптические изомеры.
5. Соединение по п.4, отличающееся тем, что оно представляет собой производное, выбранное из группы, содержащей сложные эфиры, карбаматы, аминали, амиды и оптические изомеры.
6. Соединение, имеющее структуру
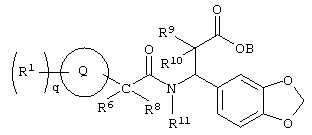
где круг Q выбирают из группы, содержащей
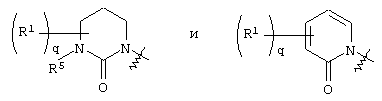
q означает целое число от нуля до четырех,
R1 выбирают из группы, содержащей водород, галоген, гидроксил, алкил, алкиламино, арил, ароил, арилокси, гетероциклил, алкиларил, аралкил, гетероциклилалкил, где R1 незамещен или замещен по крайней мере одной электронодонорной или электроноакцепторной группой;
R5 означает аралкил,
R6 и R8 каждый может означать водород, причем другой в это время – алкил;
В, R9, R10 и R11 каждый означает водород,
или его фармацевтически приемлемая соль, или его производное, выбранное из группы, содержащей сложные эфиры, карбаматы, аминали, амиды и оптические изомеры.
7. Соединение по п.6, отличающееся тем, что оно представляет собой производное, выбранное из группы, содержащей сложные эфиры, карбаматы, аминали, амиды и оптические изомеры.
8. Соединение по п.6, отличающееся тем, что R1 в каждом случае независимо выбирают из группы, содержащей водород, 2-тиенилметил, бензил и метил.
9. Соединение по п.4 или 6, отличающееся тем, что оно выбрано из группы, содержащей
(3S)-(1,3-бензодиоксол-5-ил)-3-(((2S)-2-(2-оксо-3-(2-тиенилметил)тетрагидро-1(2Н)-пиримидинил)гексаноил)амино)пропионовую кислоту,
(3S)-3-(1,3-бензодиоксол-5-ил)-3-((2R,S)-2-(3-бензил-5-метил-2-оксо-1(2Н)-пиридинил)гексаноиламино)пропионовую кислоту,
(3S)-3-(1,3-бензодиоксол-5-ил)-3-((2R,S)-2-(3-(3-хлорбензил)-5-метил-2-оксо-1(2Н)-пиридинил)гексаноиламино)пропионовую кислоту,
(3S)-3-(1,3-бензодиоксол-5-ил)-3-(((2S)-2-(2-оксо-3-(фенилметил)-1(2Н)-пиридинил)гексаноил)амино)пропионовую кислоту,
(3S)-3-(1,3-бензодиоксол-5-ил)-3-(((2-(3-хлорфенил)метил)-5-метил-(2-оксо-1(2Н)-пиридинил)гексаноиламино)пропионовую кислоту и их фармацевтически приемлемые соли, или их производные, выбранные из группы, содержащей сложные эфиры, карбаматы, аминали, амиды и оптические изомеры.
10. Соединение по п.9, отличающееся тем, что оно представляет собой производное, выбранное из группы, содержащей сложные эфиры, карбаматы, аминали, амиды и оптические изомеры.
11. Соединение, имеющее структуру
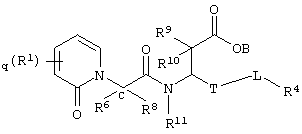
где q означает целое число от нуля до четырех;
Т означает (СН2)b где b означает 0;
L означает (CH2)n, где n означает 0;
R1 означает водород, алкил, аралкил;
R4 означает арил, где R1 и R4 незамещены или замещены по крайней мере одной электронодонорной или электроноакцепторной группой;
В, R9, R10 и R11 означают водород,
R6 и R8 каждый может означать водород или один из R6 и R8 может означать водород, другой – алкил,
либо его фармацевтически приемлемая соль, либо его производное, выбранное из группы, содержащей сложные эфиры, карбаматы, аминали, амиды и оптические изомеры.
12. Соединение по п.11, отличающееся тем, что q равно одному или двум, R1 в каждом конкретном случае независимо выбирают из группы, включающей аралкил и алкил; R6 означает алкил; В, R8, R9, R10 и R11 независимо означают водород, Т означает -(СН2)b-, где b равно 0; a L означает -(СН2)n-, где n равно 0, и R4 означает арил.
13. Соединение по п.11, отличающееся тем, что оно представляет собой производное, выбранное из группы, включающей сложные эфиры, карбаматы, аминали, амиды и оптические изомеры.
14. Соединение, имеющее структуру
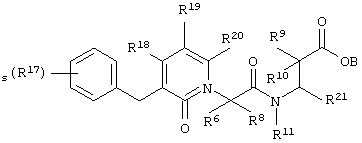
где s означает целое число от нуля до пяти;
R21 выбирают из группы, включающей арил, гетероциклилалкил, алкиларил, биарил;
В, R6, R8, R9, R10, R11, R18, R19 и R20 означают водород,
R17 означает водород, галоген, алкил, алкокси, арилалкил, где R17 и R21 незамещены или замещены по крайней мере одной электронодонорной или электроноакцепторной группой,
либо его фармацевтически приемлемая соль, либо его производное, выбранное из группы, содержащей сложные эфиры, карбаматы, аминали, амиды и оптические изомеры.
15. Соединение по п.14, отличающееся тем, что каждый из В, R8, R9, R10, R11, R18 и R20 независимо означает водород, s означает целое число от нуля до трех; R17 в каждом конкретном случае независимо выбирают из группы, включающей галоген, алкил, алкокси, а R21 означает арил.
16. Соединение по п.14, отличающееся тем, что оно представляет собой производное, выбранное из группы, включающей сложные эфиры, карбаматы, аминали, амиды и оптические изомеры.
17. Соединение по п.14, в котором s равно нулю; каждый из В, R8, R9, R10, R11, R18 и R20 независимо означает водород, а R21 означает 1,3-бензодиоксол-5-ил.
18. Соединение, имеющее структуру
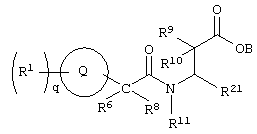
где круг Q означает кольцевую структуру, выбранную из группы, состоящей из
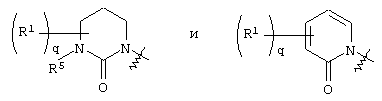
где q означает целое число от нуля до четырех;
R1 выбирают из группы, включающей водород, алкил, аралкил,
В, R5, R6, R8, R9, R10 и R11 означают водород, алкил, арил, биарил, аралкил, алкилгетероциклил,
R21 выбирают из группы, включающей арил, гетероциклилалкил, алкиларил, биарил, где R1 и R21 незамещены или замещены по крайней мере одной электронодонорной или электроноакцепторной группой,
либо его фармацевтически приемлемая соль, либо его производное, выбранное из группы, содержащей сложные эфиры, карбаматы, аминали, амиды и оптические изомеры.
19. Соединение по п.18, отличающееся тем, что оно представляет собой производное, выбранное из группы, включающей сложные эфиры, карбаматы, аминали, амиды и оптические изомеры.
20. Соединение по п.18, отличающееся тем, что каждый из В, R6, R8, R9, R10 и R11 означает водород, R1 и R5 в каждом конкретном случае независимо выбирают из группы, включающей водород, 2-тиенилметил, бензил и метил, а R21 означает арил.
21. Соединение по любому из пп.11,14 или 18, отличающееся тем, что оно выбрано из группы, содержащей
(3S)-3-{[(2S)-2-(3-бензил-5-метил-2-оксопиридин-1(2Н)-ил)гексаноил]амино}-3-(3,5-диметоксифенил)пропионовую кислоту,
(3S)-3-{[(2S)-2-(3-бензил-5-метил-2-оксопиридин-1(2Н)-ил)гексаноил]амино}-3-(3-фтор-4-метоксифенил)пропионовую кислоту,
(3S)-3-{[2-(3-бензил-5-метил-2-оксопиридин-1(2Н)-ил)гексаноил]амино}-3-(3-изопропоксифенил)пропионовую кислоту,
(3S)-3-({2-[3-(3-хлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(3-изопропоксифенил)пропионовую кислоту,
(3S)-3-(3-изопропоксифенил)-3-({2-[3-(2-метоксибензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)пропионовую кислоту,
(3S)-3-{[2-(3-бензил-5-метил-2-оксопиридин-1(2Н)-ил)гексаноил]амино}-3-(3-этокси-4-метоксифенил)пропионовую кислоту,
(3S)-3-{[2-(3-бензил-5-метил-2-оксопиридин-1(2Н)-ил)гексаноил]амино}-3-(4-метокси-3-метилфенил)пропионовую кислоту,
(3S)-3-{[2-(3-бензил-5-метил-2-оксопиридин-1(2Н)-ил)гексаноил]амино}-3-фенилпропионовую кислоту,
(3S)-3-({2-[3-(2-хлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(4-метилфенил)пропионовую кислоту,
(3S)-3-({2-[3-(2-хлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(3-изопропоксифенил)пропионовую кислоту,
(3S)-3-({2-[3-(2-хлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-фенилпропионовую кислоту,
(3S)-3-(1-метил-1Н-индол-6-ил)-3-({2-[5-метил-2-оксо-3-(фенилметил)-1(2Н)-пиридинил]гексаноил}амино)пропионовую кислоту,
(3S)-3-{3-[(1-метилэтил)окси]фенил}-3-({2-[5-метил-3-(2-нафталинилметил)-2-оксо-1(2Н)-пиридинил]гексаноил}амино)пропионовую кислоту,
(3S)-3-({2-[5-метил-2-оксо-3-(фенилметил)-1(2Н)-пиридинил]гексаноил)амино)-3-[3-(2-метилпропил)фенил]пропионовую кислоту,
(3S)-3-[3-(дифторметил)фенил]-3-({2-[5-метил-2-оксо-3-(фенилметил)-1(2Н)-пиридинил]гексаноил}амино)пропионовую кислоту,
(3S)-3-{3-[(1-метилэтил)окси]фенил}-3-({2-[5-метил-3-[(2-метилфенил)метил]-2-оксо-1(2Н)-пиридинил]гексаноил}амино)пропионовую кислоту,
(3S)-3-(3-фторфенил)-3-({2-[5-метил-2-оксо-3-(фенилметил)-1(2Н)-пиридинил]гексаноил}амино)пропионовую кислоту,
(3S)-3-({2-[3-[(2-хлор-4-фторфенил)метил]-5-метил-2-оксо-1(2Н)-пиридинил]гексаноил}амино)-3-{3-[(1-метилэтил)окси]фенил}пропионовую кислоту и
(3S)-3-{3-[(1-метилэтил)окси]фенил}-3-({2-[5-метил-2-оксо-1-(фенилметил)-1,2-дигидро-3-пиридинил]-2-фенилацетил}амино)пропионовую кислоту, а также их фармацевтически приемлемые соли.
22. Соединение по любому из п.п.6, 11, 14 или 18, отличающееся тем, что оно выбрано из группы, содержащей
(3S)-3-{[(2S)-2-(3-бензил-5-метил-2-оксопиридин-1(2Н)-ил)гексаноил]амино)-3-(3′,4′-диметокси-1,1′-бифенил-4-ил)пропионовую кислоту,
(3S)-3-({(2S)-2-[3-(2-хлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(3′,4′-диметокси-1,1′-бифенил-4-ил)пропионовую кислоту,
(3S)-3-(1,1′-бифенил-4-ил)-3-({(2S)-2-[3-(2-хлор-6-метилбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)пропионовую кислоту,
(3S)-3-{[(2S)-2-(3-бензил-5-метил-2-оксопиридин-1(2Н)-ил)гексаноил]амино)-3-(1,1′-бифенил-4-ил)пропионовую кислоту,
(3S)-3-(1,1′-бифенил-4-ил)-3-({(2S)-2-[3-(2-хлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)пропионовую кислоту,
(3S)-3-{[(2S)-2-(3-бензил-5-метил-2-оксопиридин-1(2Н)-ил)гексаноил]амино}-3-(4′-метил-1,1′-бифенил-4-ил)пропионовую кислоту,
(3S)-3-({(2S)-2-[3-(2-хлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(4′-метил-1,1′-бифенил-4-ил)пропионовую кислоту,
(3S)-3-({(2S)-2-[3-(2-хлор-6-метилбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(4′-метил-1,1′-бифенил-4-ил)пропионовую кислоту,
(3S)-3-{[(2S)-2-(3-бензил-5-метил-2-оксопиридин-1(2Н)-ил)гексаноил]амино}-3-(2′,6′-диметокси-1,1′-бифенил-4-ил)пропионовую кислоту,
(3S)-3-({(2S)-2-[3-(2-хлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(2′,6′-диметокси-1,1′-бифенил-4-ил)пропионовую кислоту,
(3S)-3-({(2S)-2-[3-(2-хлор-6-метилбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(2′,6′-диметокси-1,1′-бифенил-4-ил)пропионовую кислоту,
(3S)-3-{[(2S)-2-(3-бензил-5-метил-2-оксопиридин-1(2Н)-ил)гексаноил]амино}-3-(1,1′-бифенил-3-ил)пропионовую кислоту,
(3S)-3-(1,1′-бифенил-3-ил)-3-({(2S)-2-[3-(2-хлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)пропионовую кислоту,
(3S)-3-(1,1′-бифенил-3-ил)-3-({(2S)-2-[3-(2-хлор-6-метилбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)пропионовую кислоту,
(3S)-3-{[(2S)-2-(3-бензил-5-метил-2-оксопиридин-1(2Н)-ил)гексаноил]амино}-3-(2′-метокси-1,1′-бифенил-3-ил)пропионовую кислоту,
(3S)-3-({(2S)-2-[3-(2-хлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(2′-метокси-1,1′-бифенил-3-ил)пропионовую кислоту,
(3S)-3-({(2S)-2-[3-(2-хлор-6-метилбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(2′-метокси-1,1′-бифенил-3-ил )пропионовую кислоту,
(3S)-3-({(2S)-2-[3-(2-фтор-6-метоксибензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(4-метилфенил)пропионовую кислоту,
(3S)-3-({(2S)-2-[3-(2,6-диметилбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(4-метилфенил)пропионовую кислоту,
(3S)-3-({(2S)-2-[3-(3,5-диметилбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил} амино)-3-(4-метилфенил)пропионовую кислоту,
(3S)-3-({(2S)-2-[3-(2,6-дихлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(4-метилфенил)пропионовую кислоту,
(3S)-3-({(2S)-2-[3-(2-хлор-6-фторбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(4-метилфенил)пропионовую кислоту,
(3S)-3-({(2S)-2-[3-(2,6-дифторбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(4-метилфенил)пропионовую кислоту,
(3S)-3-(1,3-бензодиоксол-5-ил)-3-({(2S)-2-[3-(2,6-дифторбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)пропионовую кислоту,
(3S)-3-(1,3-бензодиоксол-5-ил)-3-({(2S)-2-[3-(2-хлор-6-фторбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)пропионовую кислоту,
(3S)-3-(1,3-бензодиоксол-5-ил)-3-({(2S)-2-[3-(2,6-дихлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)пропионовую кислоту,
(3S)-3-(1,3-бензодиоксол-5-ил)-3-({(2S)-2-[3-(2,6-диметилбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)пропионовую кислоту,
(3S)-3-(1,3-бензодиоксол-5-ил)-3-({(2S)-2-[3-(3,5-диметилбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)пропионовую кислоту,
(3S)-3-(1,3-бензодиоксол-5-ил)-3-({(2S)-2-[3-(2-фтор-6-метоксибензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)пропионовую кислоту,
(3S)-3-({(2S)-2-[3-(2-хлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(3,4-диэтоксифенил)пропионовую кислоту,
(3S)-3-(3,4-диэтоксифенил)-3-({(2S)-2-[3-(2,6-дифторбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил)амино)пропионовую кислоту,
(3S)-3-({(2S)-2-[3-(2,6-дифторбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(3-этоксифенил)пропионовую кислоту,
(3S)-3-({(2S)-2-[3-(2-хлор-6-фторбензил)-5-метил-2-оксопиридин-1(2Н)-ил]гексаноил}амино)-3-(3-этоксифенил)пропионовую кислоту,
(3S)-3-({(2S)-2-[3-(2-хлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]-3-метилбутаноил}амино)-3-(4-метилфенил)пропионовую кислоту,
(3S)-3-({(2S)-2-[3-(2-хлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]-4-метилпентаноил}амино)-3-(4-метилфенил)пропионовую кислоту,
(3S)-3-(1,3-бензодиоксол-5-ил)-3-({(2S)-2-[3-(2-хлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]-4-метилпентаноил}амино)пропионовую кислоту,
(3S)-3-(1,3-бензодиоксол-5-ил)-3-({(2S)-2-[3-(2-хлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]-3-метилбутаноил}амино)пропионовую кислоту,
(3S)-3-(1,3-бензодиоксол-5-ил)-3-({(2S)-2-[3-(2-хлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]-3-фенилпропаноил}амино)пропионовую кислоту,
(3S)-3-({(2S)-2-[3-(2-хлорбензил)-5-метил-2-оксопиридин-1(2Н)-ил]-3-фенилпропаноил}амино)-3-(4-метилфенил)пропионовую кислоту,
(3S)-3-(1,3-бензодиоксол-5-ил)-3-(((2R)-2-(1-бензил-5-метил-2-оксо-1,2-дигидропиридин-3-ил)гексаноил)амино)пропионовую кислоту и их фармацевтически приемлемые соли.
23. (3S)-3-(1,3-бензодиоксол-5-ил)-3-((2S)-2-(3-бензил-5-метил-2-оксо-1(2Н)-пиридинил)гексаноиламино)пропионовая кислота либо ее фармацевтически приемлемая соль.
24. Фармацевтическая композиция, обладающая способностью ингибировать связывание  4 4 1 интегрина, отличающаяся тем, что она содержит соединение по п.1 в фармацевтически приемлемом носителе. 1 интегрина, отличающаяся тем, что она содержит соединение по п.1 в фармацевтически приемлемом носителе.
25. Способ селективного ингибирования связывания  4 4 1 интегрина, отличающийся тем, что осуществляют контактирование клетки, экспрессирующей 1 интегрина, отличающийся тем, что осуществляют контактирование клетки, экспрессирующей  4 4 1 интегрин, с клеткой, экспрессирующей VCAM-1 в присутствии эффективного количества соединения по пп.1-23. 1 интегрин, с клеткой, экспрессирующей VCAM-1 в присутствии эффективного количества соединения по пп.1-23.
Разноска приоритета:
от 07.05.1999 пп.1-8, 11-20, 24,25 и пп.9 и 10 для соединений
(3S)-(1,3-бензодиоксол-5-ил)-3-(((2S)-2-(2-оксо-3-(2-тиенилметил)-тетрагидро-1(2Н)-пиримидинил)гексаноил)амино)пропионовая кислота и ее производные.
от 10.12.1999 пп.9-10 (за исключением вышеназванных соединений), пп.21-23, 25.
TH4A – Переиздание описаний изобретений к патентам Российской Федерации
Причина переиздания: Коррекция текстов описания и формулы изобретения
Извещение опубликовано: 20.11.2005 БИ: 32/2005
|
|