|
|
(21), (22) Заявка: 2004118276/15, 17.06.2004
(24) Дата начала отсчета срока действия патента:
17.06.2004
(45) Опубликовано: 10.07.2005
(56) Список документов, цитированных в отчете о
поиске:
US 6669842 А. 30.12.2003. US 4539399 A. 03.09.1985. US 5626757 A. 06.05.1997. US 5874005 A. 23.02.1999. US 5964996 A. 12.10.1999. RU 2203730 C1. 10.05.2003. RU 2121395 C1. 10.11.1998.
Адрес для переписки:
119992, Москва, Ленинские горы, МГУ, ЗАО “БиоХимМак СТ”, С.М. Староверову
|
(72) Автор(ы):
Староверов С.М. (RU),
Кузнецов М.А. (RU),
Катруха Г.С. (RU),
Федорова Г.Б. (RU),
Васияров Г.Г. (RU),
Нестеренко П.Н. (RU),
Волгин Ю.В. (RU)
(73) Патентообладатель(и):
Закрытое акционерное общество “БиоХимМак СТ” (RU)
|
(54) СОРБЕНТ ДЛЯ РАЗДЕЛЕНИЯ ОПТИЧЕСКИХ ИЗОМЕРОВ И СПОСОБ ЕГО ПОЛУЧЕНИЯ
(57) Реферат:
Изобретение относится к сорбентам для хроматографии и может быть использовано для анализа и препаративной очистки оптически активных соединений. Сущность изобретения состоит в том, что разработан новый сорбент для разделения изомеров оптически активных соединений, который в качестве хирального селектора содержит макроциклический гликопептидный антибиотик эремомицин, ванкомицин, ристомицин А, тейкопланин или их агликоны. Разработан способ иммобилизации макроциклических гликопептидных антибиотиков, который заключается в том, что вначале силикагель в водном буферном растворе обрабатывают 3-глицидоксипропилтриалкоксисиланом, а затем в щелочном водном или водно-органическом растворе к силикагелю, модифицированному эпоксигруппами, прививается макроциклический гликопептидный антибиотик, выбранный из ряда: эремомицин, ристомицин А, ванкомицин, тейкопланин или их агликоны. Изобретение позволяет достичь более высоких значений энантиоселективности и упрощает способ получения. 2 н. и 8 з. п. ф-лы, 12-ил., 5 табл.
Изобретение относится к сорбентам для хроматографии и может быть использовано для анализа и препаративной очистки оптически активных соединений.
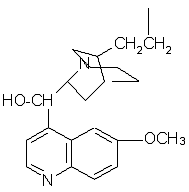
Известны сорбенты для разделения оптически активных соединений на основе силикагеля с привитыми оптически активными соединениями для разделения энантиомеров. Известен, например, сорбент, содержащий на поверхности силикагеля производные хинина (SU 1429016, 1988):
Известны сорбенты, содержащие привитые к кремнезему группы:
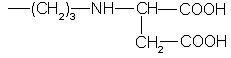
или
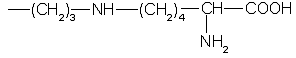
(SU 1132965, 1132966, 1985).
Известен хиральный оптически активный сорбент, содержащий оптически активный полимер, ковалентно связанный с твердым носителем, при этом полимер представляет собой сетчатый полимер, содержащий оптически активные производные дикарбоновых кислот, диаминов, диолов или гидроксикислот, предпочтительно производные винной кислоты, а носитель представляет собой органический или неорганический материал. Способ получения данного сорбента включает закрепление производных винной кислоты на поверхности носителя, которое производят путем сетевой полимеризации через гидроксилирование в присутствии гидросилана и гидросилоксана и закрепляют на носителе в присутствии катализатора (RU 2121395, 1998).
Известен сорбент для разделения рацематов оптически активных соединений, содержащий носитель и хиральный селектор – пер-6-аминопроизводные  -, -,  -, или -, или  -циклодекстрина или их ацетилированные аналоги. Способ получения данного сорбента включает ковалентную иммобилизацию хиральных селекторов на носителе, которую осуществляют путем последовательного взаимодействия аминированного носителя с конденсирующим агентом, затем с реагентом, выбранным из группы: пер-6-амино- -циклодекстрина или их ацетилированные аналоги. Способ получения данного сорбента включает ковалентную иммобилизацию хиральных селекторов на носителе, которую осуществляют путем последовательного взаимодействия аминированного носителя с конденсирующим агентом, затем с реагентом, выбранным из группы: пер-6-амино- -циклодекстрина, пер-6-амино- -циклодекстрина, пер-6-амино- -циклодекстрина, пер-6-амино- -циклодекстрина, пер-6-амино- -циклодекстрина, а затем с боргидридом металла (RU 2203730, 2003). -циклодекстрина, а затем с боргидридом металла (RU 2203730, 2003).
Однако известные сорбенты обладают энантиоселективностью лишь к определенным классам веществ или обладают недостаточной селективностью для полного разделения энантиомеров.
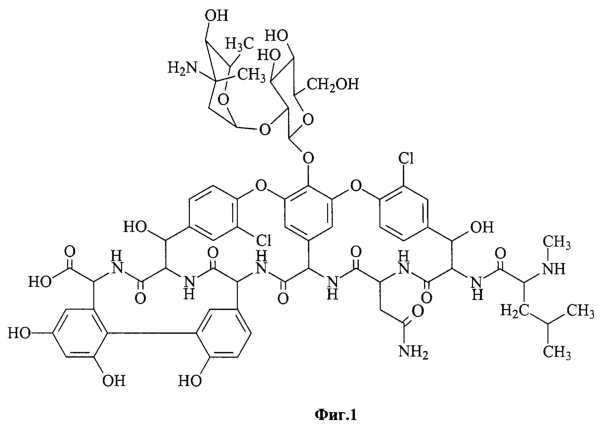
Наиболее близким по технической сущности и достигаемому результату является сорбент на основе силикагеля с химически привитыми гликопептидными антибиотиками, такими как ванкомицин, тейкопланин, тейкопланин агликон, ристомицин, структурные формулы которых приведены на фиг.1-4, а также способ его получения, описанный в (US 6669842, 2003).
Фиг.1 илюстрирует структурную формулу ванкомицина.
Фиг.2 илюстрирует структурную формулу тейкопланина.
Фиг.3 илюстрирует структурную формулу агликона тейкопланина.
Фиг.4 илюстрирует структурную формулу ристомицина А.
Сорбенты проявляют селективность в разделении широкого круга энантиомеров как в водно-органических, так и в неводных элюентах. Однако не всегда энантиоселективность является достаточно высокой.
Способ получения известных сорбентов заключается во взаимодействии антибиотика с кремнийорганическим модификатором с последующим химическим связыванием полученного соединения с поверхностью силикагеля.
Недостатком известного способа получения сорбентов с привитыми гликопептидами состоит в том, что модифицирование антибиотика и прививка его производного к силикагелю осуществляется при температуре 90-105°С, что может приводить к разрушению молекулы антибиотика. Неконтролируемое изменение структуры молекулы хирального селектора при прививке может приводить к неконтролируемому изменению селективности сорбента. Кроме того, недостатком известного способа является использование абсолютированных органических растворителей.
Задачей настоящего изобретения является повышение селективности сорбента в разделении оптических изомеров и разработка способа, позволяющего обеспечить воспроизводимое получение селективного сорбента и упрощение технологии.
Поставленная задача решается описывамым сорбентом для хроматографии оптических изомеров, который содержит силикагель с привитым через спейсер хиральным селектором – гликопептидным антибиотиком, в котором спейсер представлен группой формулы:
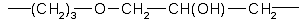
Предпочтительно в качестве гликопептидного антибиотика он содержит эремомицин или его агликон.
Сорбент может содержать также антибиотики, выбранные из группы: ванкомицин, ристомицин А, тейкопланин или их агликоны.
Поставленная задача решается также описываемым способом получения сорбента для хроматографии оптических изомеров, который включает химическую иммобилизацию гликопептидного антибиотика с помощью кремнийорганического модификатора на поверхности силикагеля, которую осуществляют, вначале обрабатывая силикагель 3-глицидоксипропилтриалкоксисиланом, а затем щелочным водно-органическим буферным раствором соответствующего антибиотика при температуре не выше 40°С.
Предпочтительно в качестве антибиотика используют эремомицин или его агликон.
Возможно также использование антибиотиков, выбранных из ряда: ванкомицин, ристомицин А, тейкопланин или их агликонов.
Ниже приведены конкретные примеры осуществления способа.
Пример 1.
Пример описывает методику иммобилизации эремомицина, который получен с использованием штамма-продуцента Amicolatopsis orientalis subsp (RU 2110578, 1998). Его структурная формула приведена на фиг.5.
101,1 г силикагеля Kromasil KR100-5-SIL суспендировали в 500 мл 0,1 М раствора ацетата натрия, доведенного ледяной уксусной кислотой до рН 5,5. К полученной суспензии добавили 78 мл 3-глицидоксипропилтриэтоксисилана. Реакционную смесь интенсивно перемешивали в течение 2-х часов, а затем оставили без нагревания и перемешивания на 4 суток. По окончании реакции модифицированный силикагель промыли водой, этанолом, ацетоном и отфильтровали. Сушили при температуре 105°С. По данным элементного анализа содержание углерода составляет 5,2%.
Получен силикагель, модифицированный эпоксигруппами. Затем 1 г макроциклического антибиотика – эремомицина – растворили в 15 мл дистиллированной воды. Довели рН до значения 8,75, прибавляя по каплям 1 М водный раствор КОН. Полученный раствор смешали с 3 г силикагеля с привитыми эпоксигруппами. Полученную реакционную смесь нагревали при температуре 40°С при перемешивании в течение 14 часов. После окончания реакции сорбент отфильтровали и отмыли последовательно водой, ацетонитрилом, метанолом и диэтиловым эфиром. Сушили в сушильном шкафу при 50°С в течение 4 часов. По данным элементного анализа содержание углерода составляет 9,5%.
Таким образом, получен силикагель с привитым хиральным селектором:
Силикагель – Si-(СН2)3O-СН2-СН(ОН)-СН2 – Эремомицин
Пример 2.
Силикагель, модифицированный эпоксигруппами, получен, как в примере 1.
3 г эремомицина растворили в 25 мл дистиллированной воды. Довели рН до значения 8,52, прибавляя по каплям 1 М водный раствор КОН. Полученный раствор смешали с 9,2 г силикагеля с привитыми эпоксигруппами. Полученную реакционную смесь нагревали при температуре 40°С при перемешивании в течение 14 часов. После окончания реакции сорбент отфильтровали и отмыли последовательно водой, метанолом и ацетоном. Сушили в сушильном шкафу при 50°С в течение 4 часов. По данным элементного анализа содержание углерода составляет 9,5%.
Пример 3.
Силикагель, модифицированный эпоксигруппами, получен, как в примере 1.
1,2 г ристомицина А растворили в смеси 15 мл дистиллированной воды и 4 мл этанола. Довели рН до значения 8,59, прибавляя по каплям 1 М водный раствор КОН. Полученный раствор прилили к 5 г силикагеля с привитыми эпоксигруппами. Полученную реакционную смесь нагревали при температуре 40°С при перемешивании в течение 14 часов. После окончания реакции суспензию отфильтровали и отмыли водой, метанолом, ацетоном. Сушили в сушильном шкафу при 50°С в течение 4 часов. По данным элементного анализа содержание углерода составляет 13,1%.
Пример 4.
30,1 г силикагеля КСК-Г суспендировали в 150 мл 0,1 М раствора ацетата натрия, доведенного ледяной уксусной кислотой до рН 5,5. К полученной суспензии добавили 24 мл 3-глицидоксипропилтриэтоксисилана. Реакционную смесь интенсивно перемешивали в течение 2-х часов, а затем оставили без нагревания и перемешивания на 4 суток. По окончании реакции твердую фазу промыли водой, этанолом, ацетоном и отфильтровали. Сушили при температуре 105°С. По данным элементного анализа содержание углерода составляет 4,8%.
1 г ванкомицина растворили в смеси 15 мл дистиллированной воды и 4 мл этанола. Довели рН до значения 8,50, прибавляя по каплям 1 М водный раствор КОН. Полученный раствор прилили к 5 г КСК-Г, модифицированного эпоксигруппами. Полученную реакционную смесь нагревали при температуре 40°С при перемешивании в течение 15 часов. После окончания реакции суспензию отфильтровали и отмыли водой, метанолом, ацетоном. Сушили в сушильном шкафу при 50°С в течение 4 часов. По данным элементного анализа содержание углерода составляет 8,3%.
Полученные в соответствии с настоящим изобретением сорбенты были испытаны при разделении оптических изомеров в следующих условиях.
Полученные по примерам 1-4 сорбенты упаковывали суспензионным методом в колонки из нержавеющей стали размером 4,0×250 мм и проводили разделение оптических изомеров с использованием метода высокоэффективной жидкостной хроматографии.
Хроматографический анализ осуществляли на ВЭЖХ хроматографе фирмы KNAUER (Германия) в составе: насос К-1001, спектрофотометрический детектор К-2501, термостат колонок Jetstream, с возможностью контроля температуры в диапазоне 5-85°С с точностью 0,1°С, ручной кран-дозатор с петлей на 20 мкл. Объем пробы 5-20 мкл. Хроматографические пики детектировали в диапазоне 210-280 нм в соответствии с максимумами поглощения разделяемых соединений.
Запись хроматограмм и расчеты факторов удерживания разделенных компонентов k, селективности  и разрешения RS проводили с помощью программно-аппаратного комплекса “Мультихром” (Амперсенд, Россия). и разрешения RS проводили с помощью программно-аппаратного комплекса “Мультихром” (Амперсенд, Россия).
В качестве подвижной фазы использовали водно-ацетонитрильные и водно-метанольные буферные растворы, метанол с добавками триэтиламина и ледяной уксусной кислоты. Порядок выхода L- и D-изомеров определяли по стандартным образцам оптически чистых соединений.
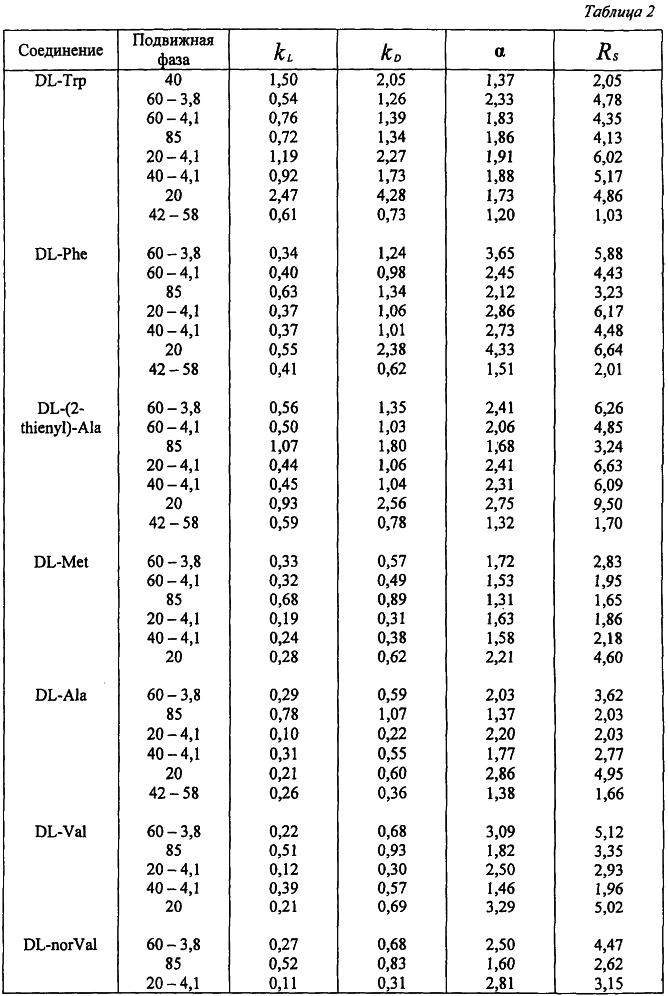
Пример 5.
В таблице 1 представлен состав подвижных фаз, а в таблице 2 результаты хроматографического разделения аминокислот и некоторых их производных на колонке с сорбентом, полученным по примеру 1, с привитым эремомицином.
| Таблица 1 |
| Шифр элюента |
Состав элюента |
| 40 |
40% СН3ОН – 60% Н2O |
| 60-3,8 |
60% СН3ОН – 40% водн. буфер (СН3СООН рН 3,8) |
| 60-4,1 |
60% СН3ОН – 40% водн. буфер (1% ТЕАА рН 4,1) |
| 85 |
85% СН3ОН – 15% водн. буфер (СН3СООNН4, 0,025М) |
| 20-4,1 |
20% СН3ОН – 80% водн. буфер (0,2% ТЕАА рН 4,1) |
| 40-4,1 |
40% СН3ОН – 60% водн. буфер (0,2% ТЕАА рН 4,1) |
| 20 |
20% СН3ОН – 80% водн. буфер (NaH2PO4, 0,1M) |
| 42-58 |
42% СН3СN – 58%H2O |
Пример 6.
В таблице 3 представлены результаты хроматографического разделения аминокислот и некоторых их производных на колонке с сорбентом, полученным по примеру 3 с привитым ристомицином А с подвижными фазами, выбранными из числа представленных в таблице 1.
| Таблица 3 |
| Соединение |
Подвижная фаза |
k’L |
k’D |
 |
RS |
| DL-Trp |
20-4,1
40-4,1
20 |
1,81
1,23
2,58 |
2,85
2,05
3,64 |
1,57
1,66
1,41 |
3,78
3,67
2,99 |
| DL-Phe |
20-4,1
40-4,1
20 |
0,67
0,57
0,84 |
1,34
1,20
1,69 |
2,00
2,10
2,01 |
3,69
3,30
2,80 |
| DL-(2-thienyl)-Ala |
20-4,1
40-4,1
20 |
0,78
0,73
1,15 |
1,06
1,07
1,46 |
1,36
1,46
1,27 |
2,19
2,70
1,94 |
| DL-Cit |
20-4,1
20 |
0,11
0,20 |
0,18
0,34 |
1,63
1,70 |
0,88
1,78 |
| DL-Met |
20-4,1
40-4,1
20 |
0,24
0,29
0,32 |
0,43
0,54
0,60 |
1,79
1,82
1,87 |
2,30
2,95
3,31 |
| DL-Ala |
20 |
0,09 |
0,33 |
3,66 |
3,16 |
| DL-Val |
20 |
0,16 |
0,58 |
3,62 |
3,40 |
Пример 7.
В примере представлены результаты разделения атенолола и фенопрофена на колонке с сорбентом, полученным по примеру 4 с иммобилизованным ванкомицином.
Результаты для разделения энантиомеров атенолола получены в системе 100% СН3ОН – 0,01% СН3СООН – 0,01% (С2Н5)3N а фенопрофена – в системе 10% ТГФ – 90% 0,1 M NaH2PO4 pH 6,5.
Результаты разделения представлены в таблице 4.
| Таблица 4 |
| Соединение |
k’L |
k’D |
 |
RS |
| атенолол |
1,34 |
1,48 |
1,10 |
0,95 |
| фенопрофен |
1,22 |
1,32 |
1,08 |
0,91 |
Пример 8.
3ОН – 50% Н2O.
| Таблица 5 |
| Соединение |
Колонка с сорбентом по примеру 1 |
Колонка с сорбентом по примеру 3 |
Колонка с сорбентом, полученным известным способом |
 |
RS |
 |
RS |
 |
RS |
| DL-DOPA |
4,28 |
10,03 |
2,50 |
5,11 |
1,33 |
1,4 |
| DL-Tyr |
5,05 |
9,91 |
2,66 |
4,50 |
1,30 |
1,52 |
| DL-Trp |
1,81 |
4,30 |
2,03 |
4,65 |
1,23 |
1,55 |
| DL-PhGly |
3,09 |
6,42 |
3,78 |
8,25 |
1,23 |
1,52 |
| DL-Asn |
1 |
0 |
1,53 |
2,35 |
1,17 |
1,56 |
| DL-Met |
2,23 |
4,19 |
2,13 |
4,22 |
1,15 |
1,52 |
DL- -amino-n-butyric acid -amino-n-butyric acid |
3,39 |
4,80 |
1,30 |
1,42 |
1,26 |
1,56 |
| DL-Cys |
2,02 |
3,45 |
1,34 |
1,54 |
1,18 |
1,4 |
| DL-Leu |
2,54 |
3,64 |
5,88 |
8,30 |
1,15 |
1,45 |
| DL-Val |
3,35 |
4,09 |
3,48 |
5,58 |
1,23 |
1,55 |
| DL-norVal |
2,65 |
3,76 |
3,08 |
4,80 |
1,25 |
1,58 |
| DL-Ala |
2,37 |
2,94 |
2,56 |
3,15 |
1,14 |
1,45 |
Из полученных результатов видно, что заявляемый сорбент и заявляемый способ иммобилизации макроциклических гликопептидных антибиотиков на силикагеле показывают более высокие результаты по энантиоселективности, чем известный.
Пример 9.
Способом, описанным в примере 3, был иммобилизован антибиотик тейкопланин и агликоны эремомицина, ристомицина А, ванкомицина и тейкопланина. Полученные сорбенты показали способность к разделению оптических изомеров различных соединений.
Хроматограммы разделения некоторых соединений представлены на фиг.6-12.
Фиг.6. Хроматограмма разделения DL-DOPA на колонке с иммобилизованным эремомицином. Элюент: 20% СН3ОН – 80% 0,1 М NaH2PO4 (pH 5,5); 0,7 мл/мин. Детектирование: УФ 280 нм. Температура: 22°С.
Фиг.7. Хроматограмма разделения DL-Met на колонке с иммобилизованным эремомицином. Элюент: 20% СН3ОН – 80% 0,1 М NaH2PO4; 0,7 мл/мин. Детектирование: УФ 210 нм. Температура: 5°С.
Фиг.8. Хроматограмма разделения DL-His на колонке с иммобилизованным эремомицином. Элюент: 20% СН3ОН – 80% 0,1 М NaH2PO4; 0,7 мл/мин. Детектирование: УФ 210 нм. Температура: 22°С.
Фиг.9. Хроматограмма разделения DL-Asp на колонке с иммобилизованным эремомицином. Элюент: 20% СН3ОН – 80% 0,l M NaH2PO4; 0,7 мл/мин. Детектирование: УФ 210 нм. Температура: 22°С.
Фиг.10. Хроматограмма разделения DL-PhGly на колонке с иммобилизованным ристомицином А. Элюент: 50% СН3ОН – 50% Н2O; 0,7 мл/мин. Детектирование: УФ 220 нм. Температура: 22°С.
Фиг.11. Хроматограмма разделения DL-Asn на колонке с иммобилизованным ристомицином А. Элюент: 20% СН3ОН – 80% 0,1 М NaH2PO4; 0,7 мл/мин. Детектирование: УФ 210 нм. Температура: 22°С.
Фиг.12. Хроматограмма разделения DL-Atenolol на колонке с иммобилизованным ванкомицином. Элюент: 100% СН3ОН – 0,01% TEA – 0.01% HOAc; 0,7 мл/мин. Детектирование: УФ 254 нм. Температура: 22°С.
Формула изобретения
1. Сорбент для хроматографии оптических изомеров, содержащий силикагель с привитым через спейсер хиральным селектором гликопептидным антибиотиком, отличающимся тем, что спейсер представлен группой
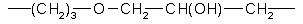
2. Сорбент по п.1, отличающийся тем, что в качестве антибиотика он содержит эремомицин или его агликон.
3. Сорбент по п.1, отличающийся тем, что в качестве антибиотика он содержит ристомицин А или его агликон.
4. Сорбент по п.1, отличающийся тем, что в качестве антибиотика он содержит ванкомицин или его агликон.
5. Сорбент по п.1, отличающийся тем, что в качестве антибиотика он содержит тейкопланин или его агликон.
6. Способ получения сорбента для хроматографии оптических изомеров, включающий химическую иммобилизацию гликопептидного антибиотика с помощью кремнийорганического модификатора на поверхности силикагеля, отличающийся тем, что вначале силикагель обрабатывают 3-глицидоксипропилтриалкоксисиланом, а затем водным или водно-органическим щелочным буферным раствором соответствующего антибиотика при температуре не выше 40°С.
7. Способ по п.6, отличающийся тем, что в качестве антибиотика используют эремомицин или его агликон.
8. Способ по п.6, отличающийся тем, что в качестве антибиотика используют ристомицин А или его агликон.
9. Способ по п.6, отличающийся тем, что в качестве антибиотика используют ванкомицин или его агликон.
10. Способ по п.6, отличающийся тем, что в качестве антибиотика используют тейкопланин или его агликон.
РИСУНКИ
|
|