|
|
(21), (22) Заявка: 2001132594/14, 03.05.2000
(24) Дата начала отсчета срока действия патента:
03.05.2000
(30) Конвенционный приоритет:
04.05.1999 US 60/132431
(43) Дата публикации заявки: 10.08.2003
(45) Опубликовано: 10.07.2005
(56) Список документов, цитированных в отчете о
поиске:
SU 1572646 A1, 23.06.1990. US 5713954 А, 03.02.1998. DE 4314269 A1, 03.11.1994. ЕР 0583012 A1, 16.02.1994. US 3827426 A, 06.08.1974.
(85) Дата перевода заявки PCT на национальную фазу:
04.12.2001
(86) Заявка PCT:
GB 00/01526 (03.05.2000)
(87) Публикация PCT:
WO 00/66196 (09.11.2000)
Адрес для переписки:
129010, Москва, ул. Б. Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. Ю.Д.Кузнецову, рег.№ 595
|
(72) Автор(ы):
ХОРНЕР Саймон Маркус (GB)
(73) Патентообладатель(и):
ХОРНЕР Саймон Маркус (GB)
|
(54) СПОСОБ И УСТРОЙСТВО ДЛЯ УСИЛЕНИЯ СЕРДЕЧНОЙ ФУНКЦИИ
(57) Реферат:
Изобретение относится к кардиохирургии. Размерные характеристики сердца циклически изменяются зацеплением мостика, по меньшей мере, между двумя точками на миокарде сердца и циклическим изменением длины мостика. Это регулирует промежуток между зацепленными частями миокарда, улучшая посредством этого сердечную функцию. Мостик может проходить через полость левого желудочка или между точками, разделенными промежутком, вокруг полости левого желудочка. Технический результат заключается в низкотравматическом обеспечении усиления сердечной функции. 5 н. и 16 з.п. ф-лы, 30 ил.
Настоящее изобретение относится к устройству и способу усиления сердечной функции.
Специалисты в области медицины в целом согласны с мнением, что в западном мире нарастает эпидемия сердечной недостаточности. Ежегодно приблизительно четверть миллиона случаев смерти в США непосредственно связаны с сердечной недостаточностью. При длительности выживания после первоначальных признаков сердечной недостаточности, обычно составляющих полтора года для мужчин и два с половиной года для женщин, прогноз при тяжелой сердечной недостаточности хуже, чем при многих видах рака.
В прошлом были предложены механические устройства вспомогательного кровообращения. Детали таких устройств описаны в Curr Probi Cardiol, December 1998, pages 726-764. Известные устройства охватывают диапазон от внутриаортального баллонного насоса, который широко использовался, и включает в себя раздуваемый баллон, вводимый в полость левого желудочка, причем баллон циклично раздувается и сдувается с тем, чтобы способствовать смещению крови в аорту, до устройств, полностью заменяющих сердце. Устройства, замещающие сердце, еще не разработаны до такой степени, которая делает их пригодными для общего применения. Даже относительно менее инвазивные процедуры, такие как внутриаортальный баллонный насос, имеют недостатки, не говоря о проблемах, связанных с сохранением; эффективности в течение продолжительных периодов времени, связанные с введением в сосудистую систему компонентов с относительно большими площадями поверхности.
Вносилось также предложение по улучшению сердечной функции предоставлением баллонного устройства, которое помещается между миокардом и перикардом. Вставленное баллонное устройство раздувается синхронно с нормальным сердечным сокращением с тем, чтобы сжать левый желудочек сердца при смещении крови в аорту в результате нормальной сердечной функции. Таким образом, устройство способствует нормальной сердечной функции. Однако одна из проблем, связанных с этим подходом, состоит в том, что объем заполнения баллона должен быть гораздо больше, чем получаемое в результате уменьшение объема полости левого желудочка. Это происходит потому, что сам перикард не является жесткой структурой и поэтому некоторая часть расширения баллона поглощается расширением перикарда. Кроме того, расширение баллона в перикарде будет проталкивать кровь из аорты назад в их соответствующие вены, поглощая значительное количество расширения баллона и нарушая заполнение сердца. Так, увеличение доставки крови лишь на 20 мл на сокращение может потребовать смещения баллона, скажем на 100 мл. Таким образом, устройство неэффективно и требует больше мощности, чем та, которую можно легко обеспечить в портативной подкожной форме.
Например, в патенте США № 6050936 было предложено лечить развивающуюся сердечную недостаточность уменьшением напряженного растянутого состояния стенки миокарда сердца. Упругие элементы располагаются, простираясь поперек левого и правого желудочков сердца, причем упругие элементы прикрепляются к стенке миокарда так, чтобы тянуть стенку миокарда внутрь по направлению к прилегающим зонам прикрепления. Это улучшает сердечную функцию, но является по существу статическим устройством. Нет предложения того, чтобы промежутки между точками прикрепления упругих элементов были установлены циклично, например, синхронно с циклом естественных сердечных сокращений.
Была предложена ксенотрансплантация, при которой людям имплантируют генетически измененные сердца животных. Одной из проблем этого подхода является отторжение. Процесс отторжения начинается с выявления иммунной системой того, что кусочек ткани не идентичен другим тканям организма и последующей атаки на него. У всех людей имеются по существу уникальные антигенные характеристики, и поэтому для того, чтобы можно было в целом имплантировать сердце животного, и оно не распознавалось как инородное, оно должно было бы точно соответствовать антигенным характеристикам этого человека. Таких животных нельзя получить заранее перед возникновением потребности в таком сердце. Было предложено выращивать животных, которые достаточно близки по антигенным характеристикам к нескольким группам потенциальных людей-реципиентов, но поскольку нельзя достичь точного подбора, остается необходимость в иммуносуппрессивных препаратах, причем применение таких препаратов связано с риском инфекции без полного исключения риска отторжения. Еще одной проблемой, связанной с ксенотрансплантацией, является возможность того, что трансплантированное сердце может содержать вирус животного, который при комбинации с вирусом человека у реципиента может привести к особенно вирулентной форме инфекции. Кроме того, неизвестна продолжительность жизни органов животных, например свиньи, не живут 80 лет, как могут жить люди.
Задачей настоящего изобретения является исключение или облегчение перечисленных выше проблем.
В соответствии с настоящим изобретением обеспечивается устройство для усиления сердечной функции, содержащее средство для циклического изменения размерных характеристик сердца, причем средство для изменения включает в себя мостик, проходящий, по меньшей мере, между двумя точками на миокарде сердца, и средство для регулировки длины мостика и для регулировки промежутка между указанными, по меньшей мере, двумя точками на миокарде.
Изобретение также обеспечивает способ усиления сердечной функции, в котором размерные характеристики сердца изменяются циклически, причем размерные характеристики изменяются зацеплением мостика, по меньшей мере, между двумя точками на миокарде сердца, и цикличным изменением длины мостика для регулировки промежутка между указанными, по меньшей мере, двумя точками на миокарде.
Изобретение по существу обеспечивает устройство, которое прикреплено к миокарду или внедряется в него в двух или более точках и изменяет относительное расстояние между этими точками для увеличения сердечного выброса. Устройство может размещаться эндоваскулярно или чрескожно под местной анестезией.
Предпочтительно, предоставляются средства для регистрации сердечных сокращений и средства для регулировки длины мостика синхронно с регистрируемыми сердечными сокращениями. Соотношение между количеством сердечных сокращений и количеством циклических модификаций размерных характеристик можно избирательно регулировать.
Предпочтительно, мостик приспособлен проходить через полость левого желудочка. Мостик может включать в себя средство для прикрепления, по меньшей мере, к двум точкам на миокарде сердца, и средство для приложения натягивающего усилия на элемент, такой как кабель, проходящий между точками прикреплений.
Кабель может проходить от одного конца оболочки, причем дистальный конец кабеля обеспечен средством для прикрепления к первой точке на миокарде, а конец оболочки, из которой выступает кабель, приспособлен для упора во вторую точку миокарда, причем средство регулировки мостика выполнено с возможностью регулирования длины кабеля, проходящего из оболочки. Кабель может включать в себя два или более кабелей, каждый из которых помещен внутри общей оболочки, причем дистальные концы двух кабелей обеспечены средствами для прикрепления к отдельным точкам на миокарде, или кабель может разветвляться на два или более подкабеля, причем каждый из них приспособлен для соединения с отдельной точкой на миокарде.
В альтернативном устройстве средство приложения натягивающего усилия может быть расположено между первым элементом для прикрепления к одной точке на миокарде, и вторым элементом для прикрепления ко второй точке на миокарде, для регулировки промежутка между первым и вторым элементами. Средство приложения натягивающего усилия может содержать устройство с поршнем и цилиндром, причем цилиндр устройства прикреплен к одному элементу, а поршень устройства прикреплен к другому элементу.
Устройство может обычно быть неподвижным, но включать в себя средство для выявления прекращения сердечной деятельности и средство для инициации циклического изменения размерных характеристик в ответ на выявление прекращения сердечной деятельности.
Изобретение может также обеспечивать хирургическую процедуру для введения устройства разгрузки левого желудочка для усиления сердечной функции, в котором кабель вставлен в сердце с тем, чтобы проходить через полость левого желудочка, дистальный конец кабеля прикреплен к миокарду сердца, оболочка, через которую проходит кабель, расположена так, что дистальный конец оболочки упирается в миокард в точке, отделенной промежутком от дистального конца кабеля, а привод соединен с кабелем и оболочкой для обеспечения возможности регулировки промежутка между дистальными концами кабеля и оболочки.
Изобретение, кроме того, обеспечивает хирургическую процедуру для введения устройства разгрузки левого желудочка для усиления сердечной функции, при которой, по меньшей мере, одним мостиком соединяются, по меньшей мере, две точки прикрепления к миокарду, прилегающему к полости левого желудочка, причём мостик содержит устройство для регулировки длины мостика между двумя точками прикрепления, а регулирующее устройство соединено с приводом, приспособленным регулировать промежуток между точками прикрепления.
Теперь с помощью приведенного примера будут описаны варианты реализации настоящего изобретения со ссылкой на сопровождающие чертежи, на которых:
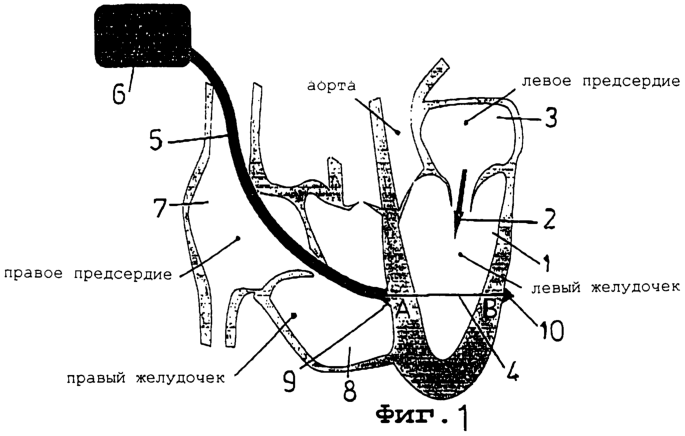
Фиг.1 представляет схематическое изображение сердца с установленным вариантом реализации настоящего изобретения, причем на чертеже показан левый желудочек в фазе диастолы (расслабления) сердечного цикла,
Фиг.2 иллюстрирует сердце на фиг.1, находящееся в фазе систолы (сокращения) сердечного цикла,
Фиг.3 схематически иллюстрирует еще один вариант реализации настоящего изобретения, при котором мостики установлены на эпикардиальной поверхности сердца,
Фиг.4 представляет схематическое изображение привода, используемого в устройстве, показанном на фиг.З,
Фиг.5 иллюстрирует устройства для регистрации циклического функционирования сердца,
Фиг.6 и 7 иллюстрируют устройства, альтернативные устройству, показанному на фиг.1,
Фиг.8, 9 и 10 иллюстрируют альтернативные мостики с гидравлическим приводом для использования в таком устройстве, как устройство, показанное на фиг.1,
На фиг.11, 12 и 13 показаны альтернативные мостики с механическим приводом для использования в таком устройстве как устройство, показанное на фиг.1,
Фиг.14, 15, 16, 17 и 18 иллюстрируют альтернативные устройства в виде мостиков для введения,
На фиг.19 схематически показано устройство для регистрации проникновения мостика в миокард,
Фиг.20 иллюстрирует способ фиксации мостика к миокарду,
Фиг.21 представляет вид с торца кончика мостика, показанного на фиг.20,
Фиг.22, 23 и 24 иллюстрируют альтернативные устройства фиксации мостиков, и
Фиг.25, 26, 27, 28, 29 и 30 иллюстрируют альтернативные устройства привода, которые могут использоваться в устройстве, показанном на фиг.1.
Обращаясь к фиг.1, схематически изображенное сердце находится в диастолической фазе сердечного цикла и, таким образом, в левый желудочек 1 поступает поток крови, как указано стрелкой 2, из левого предсердия 3. Мостик в форме кабеля 4 проходит поперек полости левого желудочка. Кабель 4 проходит через оболочку 5 от блока запуска или привода 6, причем оболочка введена через правое предсердие 7 и правый желудочек 8. Конец 9 оболочки 5 увеличен и упирается в наружную поверхность миокарда левого желудочка. Кабель 4 проходит из оболочки через отверстие, образованное в области А миокарда левого желудочка, поперек полости левого желудочка, через отверстие в области В миокарда левого желудочка и заканчивается фиксирующим устройством 10, которое входит в зацепление с наружной поверхностью миокарда левого желудочка, предотвращая вытягивание кабеля 4 из отверстия, через которое он выходит из полости левого желудочка.
На фиг.2 показано сердце, изображенное на фиг.1, но во время систолической фазы, когда миокард левого желудочка сократился с тем, чтобы заставить кровь течь, как показано стрелкой 11, из левого желудочка 1 в аорту 12. Хотя предполагается, что у сердца, показанного на фиг.1 и 2, естественная функция нарушена, в результате естественной сердечной функции некоторое количество крови будет течь в аорту. Однако для усиления этой функции показанный вариант реализации настоящего изобретения уменьшает промежуток между концом 9 оболочки 5 и фиксирующим устройством 10, уменьшая таким образом промежуток между частями А и В миокарда левого желудочка. Это просто достигается тем, что под действием привода 6 кабель 4 втягивается на небольшое расстояние в оболочку 5. В результате в аорту смещается больше крови, чем было бы в случае, если бы сокращению миокарда левого желудочка не способствовало уменьшение длины мостика, образуемого кабелем 4 между частями А и В миокарда левого желудочка.
В устройстве, показанном на фиг.1 и 2, сердечная функция улучшается механическим содействием сокращению миокарда левого желудочка укорочением длины мостика, проходящего через стенку миокарда в двух разделенных промежутком точках. Однако возможны альтернативные устройства. Например, мостик мог бы располагаться полностью снаружи миокарда, но поддерживаться таким образом, что уменьшение длины мостика способствовало бы сокращению миокарда. Например, в некоторых обстоятельствах можно расположить петлю, проходящую вокруг внешней поверхности миокарда левого желудочка так, что уменьшение длины этой петли вызвало бы сокращение миокарда левого желудочка. Альтернативно, как показано на фиг.3, подходящий мостик мог бы быть просто расположен на одной стороне миокарда левого желудочка.
На фиг.3 область 13 представляет эпикардиальную поверхность сердца. Два мостика фиксированы к эпикардиальной поверхности сердца швами, хотя швы могли бы быть заменены крючками, шипами или любым другим соответствующим механизмом. В устройстве, показанном на фиг.3, первое устройство в виде мостика включает в себя цилиндр 14, фиксированный на одном конце к мостику 15, конец которого пришит к эпикардиальной поверхности сердца. В цилиндр входит поршень, который поддерживает мостик 16, конец которого также пришит к эпикардиальной поверхности сердца. Второй цилиндр 17 фиксирован к двум мостикам 18 и мостику 19, который подвижен относительно цилиндра 17 в результате соединения с поршнем, входящим внутрь цилиндра 17. Привод 20 соединен гидравлическими линиями 21 с двумя цилиндрами 14 и 17. Конструкции поршневого и цилиндрического устройств, показанных на фиг.З, по существу одинаковы, но одно из них показано более детально на фиг.4.
На фиг.4 цилиндр 14 принимает поршень 22, который может смещаться, как показано стрелкой 23, и фиксирован к мостику 16. Цилиндр также соединен с мостиком 15. Внутрь цилиндра помещена пружина 24, и она находится в состоянии натяжения, так что вызывает стремление поршня 22 к смещению по направлению к мостику 15. Гидравлическая жидкость подается в цилиндр как показано стрелкой 25, причем увеличение гидравлического давления принуждает поршень 22 смещаться в сторону от мостика 15. Таким образом, пружина 24 имеет тенденцию уменьшать общую длину устройства, тогда как эта длина может быть увеличена возрастающим гидравлическим давлением внутри цилиндра 14.
Мостики, которые имеются в вариантах реализации, показанных на фиг.1-4, должны регулироваться таким образом, чтобы они способствовали сокращению миокарда левого желудочка, обычно синхронно с естественными сокращениями миокарда в результате нормального функционирования сердца. Поэтому необходимо регистрировать естественную сердечную функцию с тем, чтобы мостики могли регулироваться синхронно с естественной функцией сердца. На фиг.5 показаны устройства для достижения необходимого синхронизма. Общее устройство, показанное на фиг.5, соответствует устройству, показанному на фиг.1 и 2, хотя выбранное схематическое изображение сердца на фиг.5 отличается от изображения на фиг.1 и 2. Однако на фиг.1 и 2 и на фиг.5, где это целесообразно, используются одни и те же обозначающие цифры.
На фиг.5 на оболочку 5 мостика может быть установлен датчик 26, электрически соединенный с приводом 6. Датчик 26 может представлять собой, например, электроды для регистрации электрокардиограммы, допплеровский расходомер, датчик электромагнитного импеданса или датчик, реагирующий на изменения размеров сечения сердца, внутрь которого он помещен. Датчик 26 посылает сигналы к приводу 6, вызывая под влиянием привода 6 втягивание кабеля 4 в оболочку 5 во время систолической фазы функционального цикла сердца.
Хотя в иллюстрируемом устройстве датчик 26 установлен на оболочку 5 и расположен внутри правого желудочка 8, датчик 26 может быть расположен в другой точке на оболочке 5, например, в правом предсердии или в больших венах, через которые проходит оболочка 5. Кроме того, датчик 26 может быть полностью отделен от оболочки 5, например, располагаться в электроде 27, проходящем от привода 6 до точки 28 на стенке правого предсердия 7. Конечно, возможно также обеспечение параллельных регистрирующих устройств, таких как датчик 26 и регистрирующий электрод 27, как показано на фиг.5. Датчик может также помещаться на привод 6, например, для регистрации электрокардиограммы, или на кабель или устройство фиксации. Привод 6 включает в себя компоненты, целесообразные для обработки сигналов, поступающих от датчиков, регистрирующих функцию сердца, таких как датчик 26. Кроме того, на один электрод датчика может быть несколько датчиков. Кроме того, выходной сигнал датчика может быть таким, чтобы можно было контролировать степень сокращения миокарда, то есть изменение длины кабеля 4 между концом оболочки 9 и устройством фиксации 10. Это предоставит дополнительный сигнал обратной связи для обеспечения соответствующей регулировки работы привода 6.
В устройстве, показанном на фиг.1 и 2, одиночный кабель 4 проходит через полость левого желудочка, заканчиваясь устройством фиксации 10. Фиг.6 и 7 иллюстрируют альтернативные устройства, в которых или два кабеля 4 проходят из общей оболочки 5 к соответствующему устройству фиксации 10 (фиг.6), или одиночный кабель 4 разветвляется на два концевых отдела 29, которые заканчиваются соответствующими устройствами фиксации 10 (фиг.7). Такое устройство увеличило бы способность введенного устройства вызывать сокращение левого желудочка.
На фиг.8, 9 и 10 показаны три альтернативных устройства, в которых гидравлическая передача, подаваемая на оболочку 5, например, приводом 6, показанным на фиг.1, вызывает растяжение и отведение назад кабеля 4, который при использовании проходит через полость левого желудочка. В случае, показанном на фиг.8, кабель 4 соединен с простым поршнем 30, причем расстояние между поршнем 30 и концом 31 оболочки 5, который упирается в межжелудочковую перегородку, регулируется нагнетанием гидравлической жидкости в оболочку 5 и выкачиванием жидкости из оболочки, как показано стрелкой 32. В устройстве, показанном на фиг.9, между поршнем 30 и концом 31 оболочки 5 установлена компрессионная пружина 33 с тем, чтобы заставлять поршень смещаться в сторону от конца оболочки. Поэтому в таком устройстве пружина 33 обеспечивает действие силы, которая необходима для сокращения левого желудочка. В альтернативном устройстве, показанном на фиг.10, расположение поршня и цилиндра обратное, так что возрастание гидравлического давления внутри оболочки 5 отводит назад кабель 4. Для обеспечения минимального натяжения кабеля 4 ещё может быть предоставлена необязательная пружина 33.
Обратимся к фиг.11, 12 и 13, которые иллюстрируют механические устройства, в которых для регулирования растяжения кабеля 4 вместо гидравлической жидкости кабель 4 проходит на все расстояние до привода (например, привода 6 на фиг.1). Таким образом, кабель 4 непосредственно соединен с приводом 6. В устройстве, показанном на фиг.4, оболочка 5 имеет увеличенный конец 34, где она упирается в перегородку для обеспечения дополнительной точки приложения силы к миокарду. В устройстве на фиг.12, по меньшей мере, одна диафрагма 35 проходит поперек конца 34 оболочки 5 с тем, чтобы предотвратить проникновение жидкости в пространство между оболочкой 5 и кабелем 4. В устройстве, показанном на фиг.13, увеличенный конец 35 оболочки 5 показан упирающимся в стенку миокарда 36. Кабель проходит через стенку 36 и заканчивается концевым устройством фиксации 37. Кабель заключен в гибкое наружное покрытие 38 трубчатой формы, проходящее между концом 35 оболочки 5 и устройством фиксации 37, причем наружное покрытие складывается по типу гармошки, когда промежуток между концом 35 оболочки 5 и устройством фиксации 37 уменьшается, с тем, чтобы способствовать насосной функции левого желудочка.
В механических устройствах, таких как устройствах, показанных на фиг.11, 12 и 13, может быть желательно уменьшение трения между кабелем 4 и оболочкой 5 введением в оболочку 5 смазывающего средства. Этим смазывающим средством может быть масло или другая жидкость, которой можно промывать электрод, удаляя таким образом любые биологические жидкости, которые в противном случае могут попасть в пространство между кабелем 4 и оболочкой 5. Смазывающее средство может включать ферменты, фибринолитические средства или им подобные, которые могут содержаться в резервуаре в приводе, причем резервуар может заполняться, например, инъекцией через иглу. Альтернативно, смазывающее средство может быть получено обновляемым образом из собственных биологических жидкостей пациента.
Следует также понимать, что оболочка 5 может располагаться так, чтобы иметь встроенный электростимулятор сердца или возможность осуществлять дефибрилляцию сердца. Эти функции могут включаться в привод 6 или в отдельный блок.
В вариантах реализации изобретения, таких как вариант, показанный на фиг.1 и 2, необходимо, чтобы кабель 4 вводился через миокард. Миокард жесткий (отсюда его способность поддерживать действие сил, оказываемых натягивающими усилиями, действующими на кабель 4 в случае, например, варианта реализации, показанного на фиг.1), и поэтому для прокола миокарда требуется приложение существенной силы. Учитывая, что прилагаемая сила должна быть существенной, необходимо соблюдать осторожность, исключая повреждения у пациента, например, после выталкивания из левого желудочка через миокард приспособления, обеспечивающего проникновение. На фиг.14-18 показаны способы пунктирования миокарда.
На фиг.14 показан кожух 39, который может вводиться на временной основе для обеспечения канала, через который может вставляться, например, кабель 4 и оболочка 5 такие, как показаны на фиг.1. Кожух 39 может иметь заостренный кончик 40 с тем, чтобы обеспечить возможность первоначального зацепления с миокардом для обеспечения направляющего канала для вставляемого затем устройства для проникновения. Кожух 39 будет удален после введения кабеля 4 и оболочки 5. На фиг.15 показан кабель 4, который вставляется через кожух 39, показанный на фиг.14, причем кабель 4 имеет острый кончик 41, поддерживающий конструкцию в виде наконечника стрелы, которую можно относительно легко протолкнуть через миокард, но которая будет сильно сопротивляться последующему удалению в результате зацепления конструкции в виде наконечника стрелы 41 сзади наружной поверхности миокарда.
В устройстве, показанном на фиг.16, снова кабель 4 поддерживает конструкцию в виде наконечника стрелы 41, но она проводится через стенку миокарда с использованием отдельного стержня 42, который будет удален после введения кабеля 4. Относительно прочный стержень 42 может использоваться для подачи необходимой силы на заостренный конец кабеля 4, который сам по себе может быть относительно гибким, при условии, что он способен поддерживать натягивающие усилия во время последующего использования.
В устройстве, показанном на фиг.17, кабель 4 полый, но снова он поддерживает конструкцию 41 в виде наконечника стрелы зонда 43 с тем, чтобы передать необходимую силу на кончик кабеля 4 при его проталкивании через миокард. После введения кабель 4 останется на месте, но зонд 43 будет удален.
Обратимся к фиг.18, на которой показано еще одно альтернативное устройство, в котором относительно гибкий кабель 4 с конструкцией 41 в виде наконечника стрелы введен с помощью зацепления трубки 44 сзади концевой структуры 41, причем трубка 44 принимает зонд 45, который подает необходимую силу для проталкивания кончика 41 через миокард. После введения и трубка 44, и зонд 45 удаляются.
Следует понимать, что направляющие механизмы могут быть встроены или в зонды, или в направляющие трубки для обеспечения дополнительного направления с тем, чтобы обеспечить возможность доставки устройств к соответствующему участку работы. Кроме того, предпочтительно в устройстве для введения предоставляется средство для регистрации проникновения через миокард. Как показано на фиг.19, устройство 46 для введения может включать на своем переднем конце 47 датчик, который регистрирует приближение устройства для введения в направлении дальней стороны миокарда, через который оно было введено. Датчик может быть, например, на основе волоконной оптики, причем анализ спектра или части света, передаваемого через оптическое волокно и отражаемого назад через него, позволяет установить, когда дистальный кончик выйдет из дальней стороны миокарда. В альтернативном устройстве может использоваться электрическое регистрирующее устройство, причем устройство чувствительно к тому, когда дистальный кончик устройства для введения проник через миокард и наталкивается на париетальный перикард. В альтернативном устройстве для выявления положения кабеля 4 относительно миокарда может использоваться ультразвуковое устройство. Альтернативно кабель 4 и оболочка 5 могут визуализироваться с использованием внутреннего или внешнего ультразвукового устройства. Для содействия этому кабель 4 или оболочка 5 могут быть изготовлены для вибрации или включать в себя элементы для увеличения видимости для ультразвука кабеля 4 или оболочки 5 путем включения излучателя ультразвука или передатчика.
Теперь обратимся к фиг.20-24, на которых показаны альтернативные способы фиксации дистального конца вставленного кабеля 4. В устройстве, показанном на фиг.20 и 21, дистальный конец кабеля 4 выступает через дальнюю сторону миокарда и его удаление назад через миокард предотвращено зацеплением снабженной шипами головки 48 с внешней поверхностью миокарда. Во время введения снабженный шипами наконечник придавливается по направлению к оси кабеля 4, но расправляется как только он проникнет через миокард, и поэтому входит в зацепление с миокардом, когда на кабель 4 прикладывается натягивающее усилие. Для стабилизации положения шипов при приложении натягивающего усилия на кабель между шипами концевого устройства 48 может быть предоставлен материал 49. Заостренный наконечник кабеля 4 может также ограничивать винтовая резьба (не показана) для содействия регулируемому проникновению через миокард.
В устройстве, показанном на фиг.22, кончик кабеля поддерживает ответвления 50, которые могут складываться назад в прорези кабеля 4, и могут или расправляться, или выталкиваться после того, как кабель 4 проникнет через миокард 51.
В устройствах, показанных на фиг.23 и 24, механизм фиксации размещен внутри толщи миокарда. В случае, показанном на фиг.23, кончик 52 кабеля по существу такой же, как кончик, показанный на фиг.20 и 21, в то время как на фиг.24 кончик 53 кабеля по существу такой же, как кончик, показанный на фиг.22. В случае, показанном на фиг.24, будет особенно привлекательно иметь возможность вытаскивать концевое устройство, обеспечивая надежное зацепление с миокардом до того, как миокард будет полностью пунктирован. Во всех случаях, показанных на фиг.20-24, внешняя поверхность кабеля 4 может сама быть снабжена шипами для улучшения зацепления с миокардом.
Обратимся теперь к фиг.25-30, на которых показаны шесть альтернативных устройств привода, используемых для регулировки силы, действующей на сердце, во время использования устройства.
На фиг.25 показанный пускатель содержит корпус 54, который должен имплантироваться под кожу. Корпус 54 должен быть соединен с оболочкой 5, в которую входит кабель 4, но должен быть подвижен относительно оболочки 5, как описано для примера на фиг.1 и 2. Кабель 4 соединен с поршнем 55, вставленным внутрь цилиндра 56, в который подается гидравлическая жидкость насосом 57 из резервуара 58. Насос регулируется контуром 59, питаемым от аккумуляторной батареи 60. Альтернативно, поршень 55 может быть расположен около конца оболочки, которая упирается в миокард, с тем, чтобы питать кабель через устройство так, как показано на фиг.8, 9 или 10. Такое устройство имело бы преимущества в том, что было бы меньше потерь, связанных с трением, которые возникнут, если кабель 4 простирается по всей длине оболочки 5.
В устройстве, показанном на фиг.26, поршень 61, запускаемый пошаговым электромотором 62, замещает насос 57 и резервуар 58 устройства, показанного на фиг.25. Кроме того, пружина 63 соединена с поршнем 55 с тем, чтобы прикладывать натягивающее усилие на кабель 4. Устройство, изображенное на фиг.27, отличается от устройства на фиг.26 тем, что давление, подаваемое поршнем 61 и пошаговым электромотором 62, вызывает направленное смещение поршня 55, которое приводит к отведению назад кабеля 4. Для приложения натягивающего усилия на кабель 4 может быть предоставлена дополнительная необязательная пружина 64.
Фиг.28 иллюстрирует устройство, аналогичное устройству на фиг.26, но в котором оболочка проходит до устройства поршня и цилиндра, аналогичного устройству, показанному, например, на фиг.8, на конце оболочки 5, удаленном от корпуса 54.
На фиг.29 показано устройство, в котором имеется прямое механическое сцепление между пусковым двигателем 63, регулируемым контуром 64 и питаемым аккумуляторной батареей 60. Пусковой двигатель 63 вращает шестерни 65, которые входят в зацепление с резьбовым концом 66 на кабеле 4, проходящем по оболочке 5. Между двигателем и кабелем может быть промежуточный механизм соединения для содействия исключению контакта биологических жидкостей с приводным механизмом. Промежуточное соединение может иметь резьбу для привода двигателем и соединено с кабелем 4.
Устройство, изображенное на фиг.30, аналогично устройству на фиг.29, за исключением того, что ротор двигателя 63 входит в прямое зацепление с резьбовым концом 66 кабеля 4.
Во всех устройствах, показанных на фиг.25-30, аккумуляторная батарея 60 может перезаряжаться с использованием индукционной катушки или другого устройства, которое способно подавать энергию к расположенному под кожей корпусу 54. Корпус 54 будет имплантирован внутрь тела пациента, например в область около грудной мышцы.
Хотя предусмотрена в целом имплантация в организм всего блока, в некоторых ситуациях может быть необходимо или желательно иметь источник питания, расположенный вне организма.
Следует понимать, что хотя были описаны альтернативные пусковые механизмы, может использоваться любое удобное механическое устройство, например устройства с множеством двигателей или альтернативные устройства гидравлической накачки жидкости.
Так, на чертежах показаны различные устройства, которые могут использоваться, например, в виде устройств для разгрузки левого желудочка, которые могут имплантироваться через кожу под местной анестезией. Используемые процедуры могут быть аналогичны обычным процедурам, используемым для имплантации электростимуляторов. При условии, если питание, требуемое устройством, ограничено питанием, требуемым скорее для усиления, а не для замены нормальной функции сердца, потребности в питании относительно ограничены. Например, у пациента с сердечным выбросом 3 л/мин, это могло бы составить до 4 л/мин (более целесообразный сердечный выброс, совместимый с выживанием и приемлемым качеством жизни) путем обеспечения энергии, требуемой для нагнетания лишь одного литра крови. Требуемое питание подается прямо на целевые очаговые зоны, поскольку сила, действующая, например, на кабель 4 в устройстве на фиг.1, воздействует непосредственно на миокард. Эти относительно низкие требования к подаваемому питанию позволяют использовать относительно небольшие блоки питания. Кроме того, если происходит восстановление разгружаемого сердца, можно постепенно, поэтапно снять пациента со вспомогательного кровообращения, обеспечиваемого имплантированными устройствами. Например, в то время как первоначально устройство может быть предусмотрено для вспомогательного нагнетания в каждое нормальное сердечное сокращение, его можно уменьшить для вспомогательного нагнетания в каждое второе сокращение, затем в каждое третье сокращение, затем в каждое четвертое сокращение и т.д. Таким образом, описанные устройства могут быть удалены после постепенного снижения уровня помощи, избегая потенциально негативные последствия при переходе от полного вспомогательного кровообращения к его прекращению.
Описанные устройства имеют ряд преимуществ перед современными конструкциями устройств для разгрузки левого желудочка. Во-первых, как указано выше, потребление мощности относительно низкое. Во-вторых, меньше риск тромбоэмболии, поскольку через полость левого желудочка проходят в основном тонкие нити, или вообще ничего не проходит. В-третьих, устройство должно быть по существу бесшумным. В-четвертых, устройство может быть просто выключено или переключено на режим очень низкой активности. В-пятых, даже если питание отключается, это можно сделать на основе программы управления, которая оставила бы устройство в сокращенном состоянии, оставляя таким образом пациента в лучшей ситуации, чем было бы, если бы миокард не был сокращен. В-шестых, если устройство отказывает, пациент не теряет по существу весь сердечный выброс, как это происходит с современными устройствами разгрузки левого желудочка. Действительно, состояние пациента не ухудшается, по сравнению с тем, когда устройство не было имплантировано. При использовании других современных конструкций отказ устройства ставит пациента в худшую ситуацию, в-седьмых, конструкция обеспечивает возможность предусмотренного конструкцией дублирования функций, например предоставления нескольких кабелей, проходящих через полость левого желудочка, так что если один кабель сломается, то другие продолжат работу. В-восьмых, устройство подает пульсирующий поток, в отличие от недавно раскрытых устройств вспомогательного кровообращения, которые основаны на линейном двигателе, подающем в основном постоянный поток. Отдаленное воздействие постоянного потока на органы тела неизвестно.
Устройства в соответствии с изобретением могут использоваться в сочетании с бета-блокаторами, улучшая таким образом функцию остального миокарда. Применение бета-блокаторов невозможно у некоторых пациентов, поскольку функция миокарда у них настолько нарушена, что они не могут перенести неизбежное первоначальное ухудшение функции, которое сопровождает это лечение. Имплантированное устройство позволит миокарду получать адекватную поддержку во время первоначального угнетения функции миокарда, вызванного бета-блокаторами. После восстановления функции миокарда можно уменьшить степень поддержки, обеспечиваемой устройством.
Можно ожидать, что добавление в небольших количествах нагнетания, разгружающего левый желудочек, остановит спираль неблагоприятной перестройки архитектуры левого желудочка.
Можно ожидать, что оба из указанных выше эффектов доведут до максимума остающуюся сердечную функцию и позволят уменьшить разгружающее левый желудочек вспомогательное кровообращение и снизить количество зарядок, требуемых для аккумуляторных батарей устройства.
Размещение устройства в областях дискинезии может устранить необходимость в операциях аневризмэктомии. При условии, что устройство может быть отключено при прекращении подачи питания при кабеле, остающемся в укороченной конфигурации, это превратит дискинетический сегмент в актинетический сегмент со значительной экономией энергии желудочком. Кабель может быть затянут для образования на желудочке операции “типа Батисты”, увеличивая кривизну сегментов, прилегающих к точкам фиксации кабеля на миокарде.
Описанное чрескожно имплантируемое устройство для разгрузки левого желудочка может использоваться в качестве мостика к ксенотрансплантации, предоставляя время для выращивания животного с антигенно идентичным сердцем.
Устройство в соответствии с изобретением может быть имплантировано в эндоваскулярной форме способом, аналогичным имплантации сердечного электростимулятора. С использованием методики Seldinger (или модифицированной методики Seldinger) в подключичную вену будет помещена сосудистая трубка. Кабель и оболочка устройства будут проведены через устройство в венозную систему. Оно будет продвинуто в правые отделы сердца и размещено, упираясь в межжелудочковую перегородку. Перегородка будет затем пунктирована, возможно, под контролем эхокардиографии (или внутрисердечного ультразвукового исследования или другого способа визуализации) или под контролем датчика на кончике устройства.
Сила пунктирования перегородки будет обеспечена оператором. Передаче силы будет способствовать введение устройства в сосудистую систему в точке, позволяющей обеспечить максимальную передачу силы вследствие используемой траектории.
Примеры подходящих участков ввода могут включать внутренние яремные вены или левую подключичную вену.
Для увеличения передачи силы или обеспечения силы и действия рычага могут использоваться эндоваскулярные инструменты. Эти инструменты могут включать в себя боковые удлинения и/или раздуваемые баллоны. Они могут вводиться в сосудистую систему через другие точки доступа.
Участок, в котором пунктируется стенка левого желудочка, может быть выбран с точки зрения распределения коронарных артерий при коронарной ангиографии и данных ультразвуковых измерений движения стенки желудочка.
Существует два аспекта контролирования проколов миокарда. Во-первых, необходимо контролировать участок пункции, и это требует использования какого-нибудь способа управления вставленным устройством. Во-вторых, необходимо контролировать глубину прокола.
В самой грубой форме управление может быть достигнуто сгибанием устройства для введения с приданием ему определенной формы и с использованием этой одной формы в течение всей операции. Однако более практично, чтобы провод мог быть сконструирован так, чтобы зонд мог проводиться по каналу в конструкции. Этот канал может быть съемным (фиг.18). Он может быть удален, согнут с приданием новой формы и вновь введен для обеспечения следования определенным курсом к различным участкам в сердце. Дополнительный или альтернативный механизм сделал бы введенное устройство активно направляемым, то есть имеющим приспособления внутри введенного устройства, позволяющие изменять его форму во время введения. Это видно в электрофизиологических катетерах, применяемых для деструкции ткани проводящей системы сердца, которые могут сгибаться в различные конфигурации.
В случаях, когда фиксация дистального конца устройства, введенного в стенку левого желудочка, требует прокола стенки левого желудочка, может быть обеспечен механизм для определения момента, когда произошел прокол стенки левого желудочка (фиг.19). Еще одна возможность заключалась бы в наличии зубцов, которые бы выталкивались наружу при вхождении введенного устройства в полость перикарда (поскольку на них не действуют боковые силы сжатия со стороны миокарда) и которые видны на флюороскопических или других скрининговых устройствах.
Еще одним способом могло бы быть применение визуализации, такой как внутрисердечное или внесердечное ультразвуковое исследование для регистрации проникновения через стенку левого желудочка.
Следует помнить, что даже если прокол плохо контролируется, никаких катастрофических последствий не будет в том смысле, что единственной структурой, которая была бы повреждена, было бы легкое. Это максимум привело бы к возникновению пневмоторакса, то есть к попаданию воздуха в плевральную полость легких, который мог бы просто дренироваться оттуда.
Устройство могло бы помещаться в эпикардиальной форме, как показано на фиг.3. Доступ к сердцу обеспечивается предпочтительно минимально инвазивным путем с использованием эндоскопической хирургической манипуляции. Конструкция на конце устройства прикрепляется к миокарду. Это может повлечь поперечное расположение устройства на стенке левого желудочка. Конструкция на другом конце устройства также прикрепляется к миокарду. Затем может понадобиться произвести настройку длины /растягивающей силы устройства. Затем для подачи к устройству питания при необходимости изготавливается соединительный разъем для обеспечения его работы. Затем в тело в подходящий участок имплантируется насос/приводное устройство. Одним из возможных участков может быть имплантация под прямую мышцу живота.
Способом, аналогичным “эпикардиальной форме”, кабель может быть также помещен в эндоваскулярной форме в правый (или левый) желудочек между двумя частями миокарда. Таким образом, можно решить проблемы движения перегородки без необходимости прохождения инородного тела через левый желудочек, причем это достигается прикреплением устройства к межжелудочковой перегородке на стороне правого желудочка. Путем размещения устройства через межпредсердную перегородку и митральный клапан аналогичный механизм может использоваться в других участках в левом желудочке.
Изобретение также обеспечивает возможность улучшения сердечной функции без прямого содействия нагнетанию, например, путем циклического приложения натягивающего усилия на область сердца для улучшения эффективности клапана в этой области сердца.
Регулятор устройства (фиг.25-30) может быть имплантирован в организм и содержит, по меньшей мере, один привод. Несколько приводов могут питаться от одной аккумуляторной батареи, или от комплекта аккумуляторных батарей. К приводу может быть подсоединено несколько кабелей привода. Кабели привода могут размещаться в нескольких сегментах в левом желудочке с патологией движения стенки. Может быть несколько приводов, работающих на одном кабеле привода.
При формах изобретения, которые проходят через полость левого желудочка, может потребоваться антикоагулянтная и/или антитромбоцитарная терапия пациента. Альтернативно устройство может располагаться путем введения в перегородку и проведения вниз по перегородке с выходом на верхушке сердца так, что оно не входит в полость левого желудочка, и нет необходимости в антикоагулянтной терапии.
Действие устройства может регулироваться внешним программированием или путем обратной связи от датчиков (фиг.5). Для содействия определению времени требуемого вспомогательного кровообращения могут использоваться сигналы электрокардиограммы (посылаемые через электроды в устройстве). Для управления параметрами разгрузки сердца могут регистрироваться и использоваться различные другие сигналы, такие как поток крови, размеры камер сердца, датчики физической нагрузки пациента и импеданс грудной клетки, для целей управления могут также использоваться физические силы, действующие на кабель, или степень смещения кабеля.
В устройстве может быть обеспечена возможность управления работой устройства и уровнем зарядки аккумуляторной батареи или ритмом ЭКГ через спутник. Это может использоваться для вызова служб неотложной помощи или напоминания пациенту о необходимости зарядки или замены их устройств. Такая передача данных через Спутник может также осуществляться через приспособления, встроенные в электростимуляторы сердца или просто в имплантированные маленькие датчики.
Устройство может быть настроено на инъекцию адреналина во время остановки сердца или при начинающемся отключении питания устройства. Устройство может быть запрограммировано на работу лишь в дневное время или в ответ на частоту сердечных сокращений или поток крови, или в ответ на физическую нагрузку, или может иметь дневные колебания типа нагнетания.
Формула изобретения
1. Устройство для усиления сердечной функции, содержащее средство для циклического изменения размеров сердца, включающее в себя элемент, проходящий между и зацепляемый, по меньшей мере, двумя точками на миокарде, и средство для регулировки промежутка между указанными, по меньшей мере, двумя точками на миокарде путем приложения к указанному элементу натягивающего усилия, в котором указанный элемент выполнен с возможностью проходить через полость левого желудочка.
2. Устройство по п.1, содержащее средство для регистрации сокращений сердца и средство для регулировки длины указанного элемента синхронно с регистрируемыми сердечными сокращениями.
3. Устройство по п.2, содержащее средство для избирательной настройки соотношения между числом сердечных сокращений и числом циклических изменений размеров сердца.
4. Устройство по пп.1, 2 или 3, в котором указанный элемент сконструирован и приспособлен для прохождения, в основном, продольно между двумя точками на миокарде.
5. Устройство по п.1, в котором указанный элемент включает в себя кабель.
6. Устройство по п. 5, в котором кабель проходит от одного конца оболочки, причем дистальный конец кабеля обеспечен средством для прикрепления к первой точке на миокарде, а конец оболочки, из которой выступает кабель, приспособлен для упора во вторую точку миокарда с образованием мостика в виде кабеля, а средство регулировки мостика выполнено с возможностью регулировать длину кабеля, проходящего из оболочки.
7. Устройство по п.6, в котором кабель содержит два или более кабелей, каждый из которых помещен внутрь общей оболочки, причем дистальные концы двух кабелей обеспечены средствами для прикрепления к отдельным точкам на миокарде.
8. Устройство по п.6, в котором кабель разветвляется на два или более подкабелей, каждый из которых приспособлен для соединения с отдельной точкой на миокарде.
9. Устройство по п.1, в котором средство для регулировки промежутка между двумя точками на миокарде путем приложения натягивающего усилия содержит первый элемент для прикрепления к одной точке на миокарде, второй элемент для прикрепления ко второй точке на миокарде и средство для регулировки промежутка между первым и вторым элементами.
10. Устройство по п.9, в котором средство для регулировки промежутка между первым и вторым элементами содержит устройство, состоящее из поршня и цилиндра, причем цилиндр устройства выполнен с возможностью прикрепления к одному элементу, а поршень устройства выполнен с возможностью прикрепления к другому элементу.
11. Устройство по п. 1, содержащее средство для выявления остановки сердца и средство для запуска циклического изменения размеров сердца в ответ на выявление остановки сердца.
12. Способ усиления сердечной функции, в котором размеры сердца изменяют циклически, причем размеры сердца изменяют зацеплением элемента между, по меньшей мере, двумя точками на миокарде с возможностью прохода указанного элемента между указанными точками и через полость левого желудочка и циклическим изменением длины мостика для регулирования промежутка между указанными, по меньшей мере, двумя точками на миокарде.
13. Способ по п. 12, в котором сокращения сердца регистрируют, а длину мостика регулируют синхронно с регистрируемыми сердечными сокращениями.
14. Способ по п. 13, в котором соотношение числа сердечных сокращений и числа циклических изменений размеров сердца настраивают избирательно.
15. Способ по пп.12-14, в котором элемент прикреплен, по меньшей мере, в двух частях миокарда, а натягивающее усилие прикладывают к элементу, проходящему между точками прикрепления.
16. Способ по п. 15, в котором элемент содержит первый и второй элементы, которые соединены с соответствующими точками, и натягивающее усилие прилагают регулировкой промежутка между первым и вторым элементами.
17. Способ по п. 12 в котором указанное зацепление включает в себя сшивание указанного элемента с миокардом в каждой указанной точке.
18. Способ по п. 12, в котором указанное зацепление включает в себя зацепление миокарда в каждой указанной точке крючком или шипом на конце элемента.
19. Способ по п. 12, в котором указанный элемент проходит в основном линейно между двумя точками и в котором этап изменения длины элемента включает в себя уменьшение длины элемента между точками.
20. Хирургическая процедура для введения устройства разгрузки левого желудочка для усиления сердечной функции, в котором кабель вставлен в сердце для прохождения через полость левого желудочка, дистальный конец кабеля прикреплен к миокарду, оболочка, через которую проходит кабель, расположена так, что дистальный конец оболочки упирается в миокард в точке, отделенной промежутком от дистального конца кабеля, а привод соединен с кабелем и оболочкой для обеспечения регулировки промежутка между дистальными концами кабеля и оболочки.
21. Хирургическая процедура для введения устройства разгрузки левого желудочка для усиления сердечной функции, в котором, по меньшей мере, один элемент соединен между, по меньшей мере, двумя точками зацепления к миокарду левого желудочка с возможностью прохождения через полость левого желудочка, причем элемент содержит устройство для регулировки длины элемента между точками зацепления и устройство для регулировки соединено с приводом, приспособленным для регулирования промежутка между точками зацепления.
РИСУНКИ
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 04.05.2008
Извещение опубликовано: 20.07.2010 БИ: 20/2010
|
|