Патент на изобретение №2255758
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) БИОЛОГИЧЕСКИ АКТИВНЫЙ КАРНОЗИН-АНЗЕРИНСОДЕРЖАЩИЙ КОМПЛЕКС И СПОСОБ ЕГО ПОЛУЧЕНИЯ
(57) Реферат:
Изобретение относится к биотехнологии и касается производства биологически активного комплекса, обладающего антиоксидантной и иммуномодулирующей активностью, применяемого в медицине, косметике, ветеринарии, пищевой промышленностях. Сущность изобретения – биологически активный комплекс, получаемый ферментативным гидролизом мышечной ткани, представляет собой комплекс биологически активных соединений, включающий карнозин и анзерин в количестве, составляющем 85-97 мас.% от нативного содержания этих компонентов в мышечной ткани птицы, и 1-7 вес. частей аминокислот, 0,5-12 вес. частей олигопептидов с молекулярной массой не более 10 кДа и 0,1-15 вес. частей циклических и полициклических фенольных соединений в пересчете на 1 вес. часть карнозина и анзерина в комплексе. Данный комплекс получают ферментативным гидролизом измельченной и гомогенизированной в воде мышечной ткани при предпочтительном разбавлении гомогената водой в диапазоне 0,2-0,6 с применением протеолитических ферментов в количестве, составляющем 2-5 мас.% от содержания белка, работающих при рН 4,5-8,5 и при повышенной температуре, предпочтительно при 45-65°С. Продукт выделяют либо в виде экстракта, либо порошка, полученного при сушке экстракта. Изобретение обеспечивает повышение эффективности заявленного комплекса. 2 н. и 5 з.п.ф-лы, 6 табл.
Изобретение относится к биотехнологии и касается производства биологически активных средств, включающих гистидинсодержащие дипептиды, обладающих антиоксидантной, иммуномодулирующей активностью, получаемых на основе природного сырья – мышечной ткани курицы, которое может быть применено в медицинской, пищевой промышленностях, в косметике, ветеринарии, животноводстве. Известно, что антиоксидантной и иммуномодулирующей активностью обладают как природные, так и синтетические продукты различного строения и состава. К таким продуктам относятся, например, гистидинсодержащие дипептиды, аминокислоты. Большое внимание в последние годы уделялось исследованию гистидинсодержащих дипептидов с антиоксидантной активностью, а именно карнозина, имеющего структуру Ala-His и его производным, таким как анзерин структуры Ala-N-MeHis. Карнозин впервые был выделен и исследован уже в 1900 году (А.А.Болдырев. Карнозин. Биологическое значение и возможности применения в медицине. М., 1998). В настоящее время природный дипептид-карнозин, содержащийся в скелетных мышцах человека и позвоночных животных, охарактеризован как эффективный водорастворимый антиоксидант, иммуномодулятор и рН-буфер, применяемый как противоопухолевое, антигистаминное, антистрессорное, противоязвенное, антикатарактное средство, обладающее также ранозаживляющим и антинеопластическим действием (РФ, патент №2084457, С 07 К 5/062, 1997). Карнозин природный впервые был выделен из водной суспензии мясного фарша высаживанием этиловым спиртом (Gulewitsh WS Amiradzibi S Uber das Carnosin eine neue organische Base des Fleischxtraktes Ber Deutsch Chem Ges 1900, 33, 1902-1903). В клинической практике в настоящее время применяется как природный, так и синтетический карнозин, а также его гомологи, в частности анзерин. Синтетический карнозин в настоящее время выпускается зарубежными фирмами, например, такими как SERUA, SIGMA (Италия). Однако, как это известно из дополнительных экспериментальных исследований, а также из имеющихся информационных источников, синтетические гистидинсодержащие дипептиды и их смеси из-за наличия побочно образующихся при синтезе продуктов обладают достаточно высокой токсичностью, что ограничивает возможность их применения (РФ, патент №2084457, С 07 К 5/062, 1997). В 1996 году в России был освоен промышленный выпуск природного карнозина экстрагированием из говяжьего мяса. Продукт, полученный данным методом, был внесен в Регистр лекарственных средств России за №96/50/02. Природный карнозин признан малотоксичным по сравнению с его синтетическими аналогами. Его LD 50 составляла 21 г/кг массы тела. Однако сам карнозин в отсутствии активирующих добавок обладает сравнительно невысокой антиоксидантной активностью, что ограничивает его применение в качестве терапевтического препарата, и что привело к поиску более активных форм данного препарата, например, к подбору составов смесей, включающих карнозин. Так, известен состав, применяемый в качестве фармацевтического или диетического препарата, содержащий карнозин и/или его производные, такие как гомокарнозин, анзерин, офидин и/или их фармакологически приемлемые соли и/или их ацильные производные в смеси с аминокислотами разветвленной структуры, выбранными из группы: лейцин, изолейцин, валин, а также дополнительно содержащий соли органических и неорганических кислот, например карбонаты, лактаты, сульфаты, глюконаты магния, цинка, железа, и другие добавки, такие как витамины, флавоноиды (ЕР, патент №0825871, А 61 К 38/05, 2001). В известном составе карнозин и его гомологи составляют 1-0.5 мас.%, предпочтительно 15-25 мас.% к общему весу всей смеси, а смесь трех аминокислот составляет 50-70 мас.%, причем лейцин содержится в смеси на уровне 20 мас.%. Данная композиция применяется как оральный препарат в виде таблеток, капсул, жидких растворов. Композицию получают смешением входящих в нее компонентов, их термообработкой и последующим выделением. В качестве исходных дипептидов в данном составе применяются синтетические продукты. Антиоксидантная эффективность данного препарата проверялась на подопытных животных по изменению липопероксидов в плазме крови, печени и было установлено, что карнозин в комплексе с разветвленными аминокислотами снижает содержание пероксидов на 35,5%. Дозировки данного известного препарата зависят от характера и степени заболевания и составляют 0,1-500 мг/кг веса тела. Данная композиция близка по своему составу и области применения новому средству и поэтому выбрана в качестве его прототипа. Недостатком известной композиции прототипа является ее недостаточная эффективность, что ограничивает ее область применения. В известных публикациях отсутствуют сведения, касающиеся получения из природного сырья композиций, содержащих как аминокислотный комплекс, так и гистидинсодержащие дипептиды. Применение же природного белкового сырья широко описано для получения биологически активных аминокислотных комплексов методом ферментативного гидролиза. В качестве исходного сырья для получения известных ферментативных белковых гидролизатов применяются, например, спилки шкур млекопитающих (РФ, патент №2068879, С 12 N 1/00, 1992), внутренние органы птицы, подвергаемые гидролизу под действием эндогенных ферментов кишечника птицы в щелочной среде (СССР, а.с. №878780, С 12 N 1/20, 1979), мясное или мясокостное сырье убойных животных, измельченное и подвергнутое ферментативному гидролизу при рН 6,5-7,8 с применением протосубтилина Г20Х и протеолитических ферментов, полученных из поджелудочной железы убойных животных (РФ, патент №2112397, А 23 J 1/10, 1998), мышечная ткань крупного рогатого скота или свиней (СССР, а.с. №1025722, С 12 N 1/00, 1983). В последнем цитированном источнике тщательно измельченную мышечную ткань крупного рогатого скота или свиней подвергают ферментативному гидролизу в присутствии протеолитических ферментов, в качестве которых используют поджелудочную железу крупного рогатого скота или свиней либо панкреатин с активностью 45 ЕД. По завершению гидролиза при его глубине, составляющей 0,9-1,0, проводится осаждение высокомолекулярных соединений в изоэлектрической точке и последующая фильтрация и высушивание препарата. Получаемый известный сухой ферментативный гидролизат содержит не менее 18 аминокислот, суммарное количество которых составляет 63-69%. Однако данный комплекс не содержит карнозина с анзерином, что является основной целью нового изобретения. Ферментативный сухой гидролизат белков мышц крупного рогатого скота или свиней был применен для создания питательной среды для выращивания культур клеток и биопрепаратов. Однако из-за того, что крупный рогатый скот подвержен опасному заболеванию, так называемому коровьему бешенству, способному при определенных условиях передаться и человеку, в последнее время ограничивается использование мяса крупного рогатого скота и свиней для фармацевтической и пищевой промышленностей. Как говорилось выше, карнозин и его гомологи применяются в составе антиоксидантных композиций, в частности в косметических кремах, обладающих лечебным эффектом. Например, известны: композиция карнозина с арнитином и другими эффективными добавками, применяемыми при лечении и профилактике фотодерматозов (РСТ, патент №1175898, А 61 К 7/48, 2002), косметическая композиция в форме крема, обладающая противовоспалительным действием и применяемая для кожи, склонной к угревой сыпи. Количество карнозина в таком креме составляет 0,0009-0,0011 мас.% (РФ, патент №2045949, А 61 К 7/48, 1995). Для расширения ассортимента биологически активных препаратов, обладающих повышенной эффективностью и малой токсичностью, ферментативным способом из мышечной ткани курицы получен новый состав биологически активного комплекса, содержащего карнозин и анзерин в смеси с другими биологически активными веществами в следующих весовых частях по отношению к содержанию карнозина с анзерином: аминокислоты – 1-7 вес. частей, олигопептиды в количестве, составляющем 0,5-12 вес. частей, и циклические и полициклические фенольные соединения в количестве 0,1-15 вес. частей. Биологически активный комплекс выполняется в форме экстракта или твердого порошка. Данный биологически активный карнозин-анзеринсодержащий комплекс получается ферментативным гидролизом мышечной ткани курицы, которую после измельчения и гомогенизации в воде подвергают обработке протеолитическими ферментами при рН 4,5-5,5 или 8,0-9,0 при температуре 45-65°С с использованием 2-5 мас.% фермента по отношению к содержанию белка в гомогенате и последующему охлаждению и фильтрационной очистке. При этом гомогенизированное исходное сырье разбавляют водой, предпочтительно, в диапазоне соотношения 0,2-0,6. Перед стадией ферментативного гидролиза разбавленный водой гомогенат предварительно нагревается при 45-65°С. При получении продукта в виде порошка выделенный очищенный экстракт дополнительно подвергают вакуумному упариванию и/или распылительной или лиофильной сушке. Лечебно-косметическая композиция, содержащая указанный биологически активный комплекс и косметически приемлемую основу, содержит комплекс “Био Куратор” в эффективном количестве, зависящем от выбранной косметической формы (крема, эмульсии, лосьона и т.д. (и от других факторов) назначения, возраста клиента и т.д.) Получаемый биологически активный комплекс содержит смесь аминокислот, таких как аспарагин, триптофан, серин, глутамин, пролин, глицин, аланин, цистеин, валин, метионин, изолейцин, лейцин, тирозин, фенилаланин, гидроксилизин, лизин, гистидин, аргинин. Новое средство, в отличие от известного состава-прототипа, содержит всегда смесь двух гистидинсодержащих дипептидов (карнозина и анзерина), а также более широкий спектр аминокислот, что самое главное, дополнительно содержит олигопептиды, а также циклические и полициклические фенольные соединения неопределенной структуры, обеспечивающие значительный синергетический эффект, проявляющийся в повышенной эффективности нового комплекса, значительно превышающей известные препараты аналогичного действия и состава. Данные свойства у нового биологически активного комплекса создаются при определенной последовательности операций и соблюдении определенных режимов в процессе его получения. Для исследования антиоксидантного эффекта полученного комплекса был применен метод хемилюминесцентного анализа перекисного окисления липопротеидов донорской крови, индуцированного железом. Суть метода состоит в том, что при добавлении к образцам липопротеидов ионов двухвалентного железа происходит индукция активных форм кислорода, вызывающих цепную реакцию процесса образования свободных радикалов, сопровождающуюся возгоранием хемилюминесценции. Результаты тестирования антиоксидантной активности нового биологически активного комплекса в зависимости от концентрации в пробе биологически активных веществ приведены в таблице 3. Конечный объем пробы в исследованиях составил 1,0 мл. В таблице 3 приведены также результаты тестирования, в которых в качестве образца для сравнения участвовал синтетический карнозин. Полученные результаты указывают на высокую эффективность действия нового комплекса. Уже при добавлении пробы биологически активного комплекса в количестве, равном 10 мкл, отмечено достоверное увеличение продолжительности латентного периода и снижение интенсивности основной вспышки хемилюминесценции /Н/. Для сравнения действующие концентрации для карнозина и анзерина при их индивидуальном использовании в этой модели составляют 500 мМ и выше (Болдырев А.А. – Карнозин и защита тканей от окислительного стресса. Москва, 1999). Таким образом, получаемый новым способом препарат указанного состава благодаря своей эффективности может быть применен в фармацевтической, косметической промышленностях как отдельный препарат либо ингредиент композиций, например, лечебно-косметических композиций, обладающих антиоксидантной, УФ-отражающей активностью. Ниже приводятся примеры, иллюстрирующие новый препарат, и способ его получения и лечебно-косметические составы на его основе. Пример 1. Мышечную ткань кур в количестве 1 кг измельчают на мясорубке и гомогенизируют. Полученную смесь-гомогенат разводят 3 литрами очищенной воды при разбавлении в диапазоне 0,3 и проводят водную экстракцию при 45°С. После этого отделяют водный экстракт от осадка методом фильтрации, а белковые соединения в полученном экстракте подвергают ферментативному гидролизу при рН 5,5 с помощью протеолитического фермента Flavourzime, используемого в количестве 4 мас.% и при температуре 50°С до момента прекращения нарастания величины аминного азота. После этого экстракт нагревают для инактивации фермента при 75°С в течение 30 минут, далее проводят охлаждение и удаление сформировавшегося осадка, а насадочную жидкость фильтруют с помощью глубинных фильтров. Получают продукт с показателями, отраженными в таблицах 1-3. Пример 2. Пример 2 проводят аналогично примеру 1 при использовании филе куриных грудок, при этом процесс водной экстракции проводят с применением 4 литров воды, а ферментативную обработку проводят при температуре 55°С и рН 8,5 с применением того же протеолитического фермента в количестве, составляющем 5 мас.% от содержания белка в экстракте. Получаемый продукт охарактеризован в таблицах 1-3. Пример 3 Процесс экстракции и гидролиза проводят аналогично примеру 1. В конце экстракции конечный продукт концентрируют до конечной концентрации не менее 10 мас.% и сушат распылительной сушкой при 100°С. Пример 4. Мышечную ткань в количестве 1 кг измельчают и гомогенизируют, после чего полученный гомогенат смешивают с очищенной водой в количестве 4 литров и помещают в реактор. Используют комплексный амилопротеолитический фермент Протеаза “С” при рН 8.0 при температуре 50-55°С в количестве 4 мас.% от содержания белков в гомогенате. Гидролиз ведут до момента прекращения нарастания величины аминного азота. Полученный продукт охарактеризован в таблицах 1-3. Примеры 5, 6. Лечебно-косметические средства на основе препарата “Био Куратор” (выше рассмотренного биологически активного комплекса). В косметически приемлемую основу, содержащую перечисленные ниже компоненты, вводят эффективное количество водного экстракта препарата “Био Куратор”, перемешивают компоненты до получения гомогенной массы и фасуют. Ниже приводятся примеры составов на основе препарата “Био Куратор”. Однако приведенные примеры никак не ограничивают возможности создания других лечебно-косметических средств на основе этого препарата. Пример 5. Солнцезащитный крем состава (мас.%): Цетарет 25-2.0, Цетарет 6 – 2.0, цетиариловый спирт – 3.0, этилгексилметоксициномат – 5.0, бензофенон 3-1.0, бутилметоксидибензоилметан – 1,0, цетиарилизононаноат – 6.0, кокоглицериды – 2.0, глицерин – 5.0, карбомер – 0.3, триэтаноламин – 0.4, токоферолацетат – 0.5, глюкан – 0.5, циклометикон – 1.5, диметикон – 0.5, метилпарабен – 0.3, пропилпарабен – 0.2, “БиоКуратор – 0.5 (в виде 7%-ного водного раствора), вода – остальное до 100%. Пример 6. Противовоспалительный бальзам состава, (мас.%): Фитостеарин – 1.0, липидный комплекс – 2.0, пропилпарабен – 0.2. метилпарабен – 0.3, глицерин – 5.0, аллантоин – 0.2, карбомер – 0.4, триэтаноламин – 0.5, “Био Куратор” – 1.0 /в виде 5-%-ного водного раствора, Д-пантенол – 0.3, бисаболол – 0.3. Ниже приводятся таблицы, отражающие эффективность биологически активного комплекса.
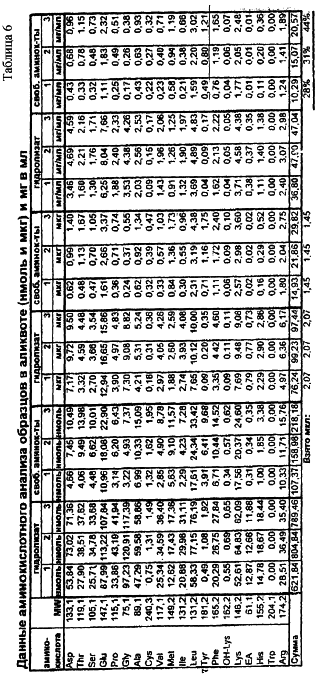
По данным аминокислотного анализа можно сделать заключение, что процесс аппаратного гидролиза проходит не до конца: в 1-ом и 2-ом образцах глубина гидролиза составила 28 и 31%, соответственно, в 3-ем – 44%. Выход дипептидов во 2-ом и 3-ем образцах практически одинаковый.
Антиоксидантную (АО) активность препаратов БИОКУРАТОРА определяли в двух тестах: Полученные результаты указывают на то, что по сравнению с карнозином препараты БИОКУРАТОРА обеспечивают большую АО активность, чем можно было бы ожидать, исходя из суммарного содержания в них гистидинсодержащих дипептидов (ГСД). При внесении в реакционную систему в тесте восстановления ДФПГ аликвот препаратов БИОКУРАТОР, обеспечивающих действующую концентрацию ГСД 0,19-0,22 мМ. АО активность в 20-40 раз превышает наблюдавшуюся для карнозина. Учитывая тот факт, что использованный тест выявляет антиоксидантную активность соединений, обладающих определенными гидрофобными свойствами, можно предположить, что АО активность препарата БИОКУРАТОР в значительной степени зависит от присутствия в их составе других (не ГСД) антиоксидантов. На это указывают и данные, полученные в тесте по подавлению накопления МДА: в этом тесте препараты БИОКУРАТОРА в 2-4 раза превосходят по своей АО активности карнозин.
Формула изобретения
1. Биологически активный карнозин-анзеринсодержащий комплекс, включающий аминокислоты, отличающийся тем, что дополнительно содержит олигопептиды и циклические и полициклические фенольные соединения и представляет собой комплекс биологически активных веществ природного происхождения, полученный ферментативным гидролизом мышечной ткани курицы, характеризуемый следующим весовым соотношением компонентов смеси, вес. ч.: Карнозин и анзерин 1 Аминокислоты 1-7 Олигопептиды 0,5-12 Циклические и полициклические фенольные соединения 0,1-1 2. Биологически активный комплекс по п.1, отличающийся тем, что выполнен в форме водного экстракта либо твердого порошкообразного продукта. 3. Биологически активный комплекс по пп.1 и 2, отличающийся тем, что является составной частью наружно-косметических лечебных средств. 4. Способ получения биологически активного карнозин-анзеринсодержащего комплекса, отличающийся тем, что в качестве исходного сырья используют измельченную гомогенизированную мышечную ткань курицы, которую подвергают ферментативному гидролизу с последующим охлаждением и фильтрационной очисткой выделяемого конечного продукта, причем после измельчения и гомогенизации гомогенат разбавляют водой и подвергают обработке протеолитическими ферментами, работающими при рН 4,5-5,5 или 8,0-9,0 и температуре 45-65°С и используемыми в количестве, составляющем 2-5 мас.% от содержания белка в гомогенате. 5. Способ по п.4, отличающийся тем, что измельченное гомогенизированное исходное сырье разбавляют водой предпочтительно в диапазоне отношения, равном 0,2-0,6. 6. Способ по п.4, отличающийся тем, что перед стадией ферментативного гидролиза разбавленный водой гомогенат нагревают при 45-65°С и подвергают фильтрационной очистке. 7. Способ по любому из пп.4-6, отличающийся тем, что при получении продукта в виде порошка выделенный очищенный экстракт дополнительно подвергают вакуумному упариванию и/или распылительной или лиофильной сушке.
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 19.09.2007
Извещение опубликовано: 10.05.2009 БИ: 13/2009
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 ), % от контроля
), % от контроля