|
|
(21), (22) Заявка: 2003138259/04, 26.12.2003
(24) Дата начала отсчета срока действия патента:
26.12.2003
(45) Опубликовано: 27.06.2005
(56) Список документов, цитированных в отчете о
поиске:
P.Moreau et al. Synthesis, Mode of Action, and Biological Activities of Rebeccamycin Bromo Derivatives.J.Med.Chem., 1999, 42, 1816-1822. RU 2167880, C2, 27.05.2001. RU 2117671, C1, 20.09.1998.
Адрес для переписки:
197022, Санкт-Петербург, а/я 32, ЗАО “АСГЛ-Исследовательские лаборатории”, ген. директору В.К. Осиповичу
|
(72) Автор(ы):
Мельник С.Я. (RU),
Островская Л.А. (RU),
Аданин В.М. (RU),
Бахмедова А.А. (RU),
Блюхтерова Н.В. (RU),
Власенкова Н.К. (RU),
Гараева Л.Д. (RU),
Горюнова О.В. (RU),
Миникер Т.Д. (RU),
Плихтяк И.Л. (RU),
Рыкова В.А. (RU),
Фомина М.М. (RU),
Эктова Л.В. (RU),
Ярцева И.В. (RU)
(73) Патентообладатель(и):
Закрытое акционерное общество “АСГЛ-Исследовательские лаборатории” (RU)
|
(54) ПРОИЗВОДНЫЕ ГЛИКОЗИДОВ ИНДОЛО[2,3-А]ПИРРОЛО[3,4-С]КАРБАЗОЛ-5,7-ДИОНОВ, ОБЛАДАЮЩИЕ ЦИТОТОКСИЧЕСКОЙ И ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ
(57) Реферат:
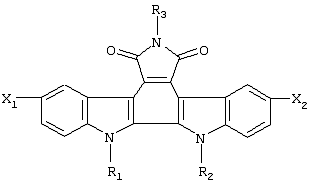
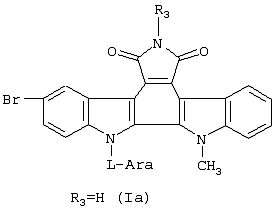
Изобретение касается новых гликозидов индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов общей формулы (1), где R1 означает остаток моно- или дисахарида в пиранозной форме, выбранный из группы: D-Rib, L-Ara, D-Xyl, D-Gal, D-GIc, D-Lac; R2 означает атом водорода, метильную группу или остаток моно- или дисахарида; R3 означает водород, гидроксильную группу, аминогруппу или формамидогруппу; X1 и Х2 означают, каждый независимо друг от друга, атом водорода или атом брома, при условии, что они не могут означать одновременно атом водорода, а также при условии, что если R1 означает дисахаридный остаток, R2 отличен от водорода. Полученные производные обладают цитотоксической и противоопухолевой активностью, в частности в отношении меланомы В 16 и опухоли Эрлиха. 2 з.п. ф-лы, 3 табл., 2 ил.
Формула (I):
Изобретение относится к области химии, медицины и биологии и касается гликозидов производных индолокарбазола и, в частности, L-арабинопиранозидов индолокарбазолов, проявляющих цитотоксическую и противоопухолевую активность.
В ряду гликозидов индолокарбазолов с противоопухолевыми свойствами известны, например, противоопухолевый антибиотик ребеккамицин (патенты США 4487925 и 4552842), имеющий природное происхождение, его модифицированный водорастворимый аналог (патент США 4785085), противоопухолевые соединения, представляющие собой производные индолопирролокарбазолов с моносахаридными остатками (заявка РСТ 95/30682 А1). Описаны гликозидные производные индолопирролокарбазолов (заявка РСТ 98/07433 А1), содержащие в качестве углевода остатки аминосахаров. Известны также производные индолопирролокарбазолов, содержащие в качестве углеводного остатка дисахарид и проявляющие противоопухолевые свойства (заявка РСТ 96/04293 А1).
Известные способы введения гликозидного остатка в молекулу индолокарбазола можно условно разделить на две группы. Первую группу составляют микробиологические методы, описанные в патенте США 5468849; 5668271, в Европейском патенте 0602597 А2 и в заявке РСТ 96/04293 А1. Однако эти способы позволяют ввести лишь немногие сахара, в основном – глюкозу. К этой же группе можно отнести методы химической модификации полученного микробиологическим способом ребеккамицина (патент США 4785085). Вторую группу составляют методы химического гликозилирования с использованием реакции Мицунобу (патенты США 5804564 и 5922860, заявка РСТ 95/30682 А1) и метод солей – ртутных, серебряных и др. (патенты США 5668271 и 5591842 и заявка РСТ 96/04293 А1). Эти методы являются достаточно трудоемкими, поскольку требуют введения защитных групп в индолокарбазол и последующего их удаления, а также многостадийного синтеза производного углевода, применяемого в реакции гликозилирования.
Задачей настоящего изобретения является получение новых соединений аналогичной структуры, проявляющих значительную эффективность против различного рода опухолей.
Поставленная задача реализуется предлагаемыми новыми производными гликозидов индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов общей формулы (I)
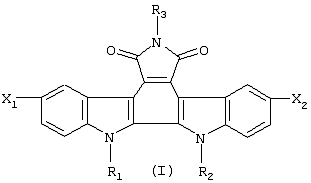
где
R1 означает остаток моно- или дисахарида в пиранозной форме, предпочтительно, D-Rib, L-Ara, D-Xyl, D-Gal, D-Glc, D-Lac;
R2 означает атом водорода, метильную группу или остаток моно- или дисахарида;
R3 означает водород, гидроксильную группу, аминогруппу или формамидо-группу;
X1 и X2 означают, каждый независимо друг от друга, атом водорода или атом брома,
при условии, что они не могут означать одновременно атом водорода, а также при условии, что если R1 означает дисахаридный остаток, R2 отличен от водорода.
Заявляемые соединения могут быть получены известным способом (Мельник С.Я., Бахмедова А.А. и др. Биоорган. химия, 22, 458-467, 1996; Мельник С.Я., Бахмедова А.А. и др. Биоорган. химия, 22, 832-837, 1996; Бахмедова А.А., Гараева Л.Д. и др. Биоорган. химия, 23, 667-674, 1997), а также альтернативным способом путем взаимодействия гликозида индол-3-илуксусной кислоты с индолом или N-метилиндолом в дихлорэтане при нагревании. Для получения гликозидов индол-3-илуксусной кислоты в качестве исходных соединений используют пер-O-ацетилированные гликозиды индола, получаемые с помощью “индолин-индольного метода” (Preobrazhenskaya M.N., Korbukh I.A. in: “Chemistry Nucleosides and Nucleotides”. Ed. L.B. Townsend, Plenum Press, NY, 1993, p.1-105). Полученные таким образом N-гликозиды индола обрабатывают последовательно оксалилхлоридом и водой с образованием не описанных ранее гликозидов индол-3-илглиоксиловой кислоты в виде пер-O-ацетатов. Избирательное восстановление  -карбонильной группы в остатке глиоксиловой кислоты приводит к не описанньм ранее гликозидам индол-3-илуксусной кислоты в виде пер-O-ацетатов. -карбонильной группы в остатке глиоксиловой кислоты приводит к не описанньм ранее гликозидам индол-3-илуксусной кислоты в виде пер-O-ацетатов.
Предложенный заявителями метод отличается от описанных ранее тем, что обеспечивает заданную конфигурацию гликозидной связи, позволяет использовать широкий набор углеводов, включая дисахариды, не требует предварительного синтеза производного углевода, пригодного для гликозилирования, и защиты агликона и, таким образом, позволяет получать ряды соединений, отличающихся не только природой углеводного остатка, но и заместителями в гетероциклическом агликоне и представляющих интерес для биологии и медицины.
Синтезированные гликозиды охарактеризованы данными тонкослойной хроматографии (ТСХ), 1Н-ЯМР – и масс-спектров высокого разрешения. Спектры 1H-ЯМР синтезированных соединений записаны на приборе Bruker WH-360 (Германия), внутренний стандарт – тетраметилсилан; для отнесения сигналов в спектрах и уточнения констант спин-спинового взаимодействия использовали метод двойного резонанса при разных мощностях подавления спин-спиновой связи; при описании формы сигналов приведены следующие сокращения: с – синглет, д – дублет, т – триплет, м – мультиплет, дд – дублет дублетов, ддд – дублет дублета дублетов, уш. с – уширенный синглет, значения констант спин-спинового взаимодействия (J) приведены в Герцах, для ароматических протонов 3J=8.2-8.3. Масс-спектры регистрировали на масс-спектрометре Finnigan MAT 8430 (Германия) с системой обработки данных SS-300 при ускоряющем напряжении 3 кВ, энергии ионизирующих электронов 70 эВ, температуре источника ионов 250° С, температуре испарения образца 170-250° С, применяя систему прямого ввода вещества в область ионизации; приведены значения m/z. ТСХ проводили на силуфоле UV254, препаративную хроматографию – на пластинах (20× 20 см) с силикагелем LSL254, 5-40 мкм (Chemapol, ЧР) при толщине слоя 1 мм.
Краткое описание рисунков
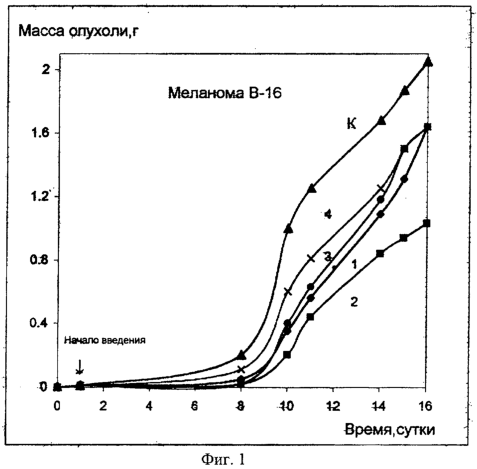
Фиг.1. Кинетика развития меланомы В 16 у животных, получавших соединение (Iа) в ряде доз, в сравнении с контролем (мыши BDF1). По оси абсцисс – время после перевивки опухоли в сутках, по оси ординат – масса опухоли в г.
1-70 мг/кг, однократно, в/б; 2 – 40 мг/кг, пятикратно, в/б; 3 – 30 мг/кг пятикратно, в/б; 4 – 20 мг/кг, пятикратно, в/б.
Фиг.2. Изменение показателей ростингибирующего эффекта соединения (Iа) во времени на модели меланомы В 16 (мыши BDF1).
А – зависимость показателя торможения роста опухоли (ТРО, %) от времени воздействия препарата. Б – зависимость кинетического критерия активности 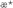 от времени после воздействия препарата. от времени после воздействия препарата.
1 – 70 мг/кг, однократно, в/б; 2 – 40 мг/кг, пятикратно, в/б; 3 – 30 мг/кг пятикратно, в/б; 4 – 20 мг/кг, пятикратно, в/б.
Примеры осуществления изобретения
Пример 1. Синтез 9-бром-13-метил-12-( -L-арабинопиранозил)индоло-[2,3-а]пирроло-[3,4-с]карбазол-5,7-иона (Ia) -L-арабинопиранозил)индоло-[2,3-а]пирроло-[3,4-с]карбазол-5,7-иона (Ia)
а) К раствору 1,2 ммоль 1-(2,3,4-три-O-ацетил- -L-арабинопиранозил)-5-броминдола (ХФЖ, 13(6), 47, 1979)) в 10 мл хлористого метилена при перемешивании и охлаждении до -5-0° С прибавляли раствор 1,8 ммоль оксалилхлорида в 6 мл хлористого метилена. Реакционную смесь выдерживали 18 ч при 20-22° С, затем упаривали досуха. К остатку, растворенному в 12 мл дихлорэтана, при 0° С прибавляли 1,2 ммоль 1-метилиндол-3-илуксусной кислоты и 2,4 ммоль триэтиламина. Реакционную смесь нагревали при кипении в течение 6 ч. Растворитель упаривали в вакууме, остаток очищали препаративной ТСХ в системе бензол – ацетон, 4:1. Получали 3-(1-метилиндол-3-ил)-4-[1-(2,3,4-три-O-ацетил- -L-арабинопиранозил)-5-броминдола (ХФЖ, 13(6), 47, 1979)) в 10 мл хлористого метилена при перемешивании и охлаждении до -5-0° С прибавляли раствор 1,8 ммоль оксалилхлорида в 6 мл хлористого метилена. Реакционную смесь выдерживали 18 ч при 20-22° С, затем упаривали досуха. К остатку, растворенному в 12 мл дихлорэтана, при 0° С прибавляли 1,2 ммоль 1-метилиндол-3-илуксусной кислоты и 2,4 ммоль триэтиламина. Реакционную смесь нагревали при кипении в течение 6 ч. Растворитель упаривали в вакууме, остаток очищали препаративной ТСХ в системе бензол – ацетон, 4:1. Получали 3-(1-метилиндол-3-ил)-4-[1-(2,3,4-три-O-ацетил- -L-арабинопиранозил)-5-броминдол-3-ил]-фуран-2,5-дион, выход 61%. Масс-спектр (m/z): 678.0917 (М+), 420, 422, 376, 378, 348, 350, 269, 268, 259, 199, 157, 139, 97, 43. 1H-ЯМР (CDCl3): 7.96 (с, 1Н), 7.84 (с, 1H), 7.42 (д, 1Н), 7.32 (д, 1H), 7.20-7.05 (м, 2Н), 6.85-6.70 (м, ЗН), 3.92 (с, 3Н, СН3), 5.43 (д, 1H, H1′, J1′,2′ 8.9), 5.70 (дд, 1H, H2′, J2′,3′ 10.2), 5.27 (дд, 1H, Н3′, J3′,4′ 3.4), 5.47 (ддд, 1H, Н4′, J4′, 5а’ 2.1, J4′,5б’ -L-арабинопиранозил)-5-броминдол-3-ил]-фуран-2,5-дион, выход 61%. Масс-спектр (m/z): 678.0917 (М+), 420, 422, 376, 378, 348, 350, 269, 268, 259, 199, 157, 139, 97, 43. 1H-ЯМР (CDCl3): 7.96 (с, 1Н), 7.84 (с, 1H), 7.42 (д, 1Н), 7.32 (д, 1H), 7.20-7.05 (м, 2Н), 6.85-6.70 (м, ЗН), 3.92 (с, 3Н, СН3), 5.43 (д, 1H, H1′, J1′,2′ 8.9), 5.70 (дд, 1H, H2′, J2′,3′ 10.2), 5.27 (дд, 1H, Н3′, J3′,4′ 3.4), 5.47 (ддд, 1H, Н4′, J4′, 5а’ 2.1, J4′,5б’ 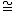 0), 4.20 (дд, 1H, Н5’а, Jгем. 13.6), 3.98 (д, 1H, Н5’б), 2.26 (с, 3Н, Ас), 2.03 (с, 3Н, Ас), 1.81 (с, 3Н, Ас). 0), 4.20 (дд, 1H, Н5’а, Jгем. 13.6), 3.98 (д, 1H, Н5’б), 2.26 (с, 3Н, Ас), 2.03 (с, 3Н, Ас), 1.81 (с, 3Н, Ас).
б) Раствор 0,41 ммоль 3-(1-метилиндол-3-ил)-4-[1-(2,3,4-три-O-ацетил- -L-арабинопиранозил)-5-броминдол-3-ил]фуран-2,5-диона и 20 мг иода в 220 мл бензола помещали в кварцевую пробирку и при барботировании воздуха облучали под Hg-лампой в течение 6 ч (контроль по ТСХ в системе бензол-ацетон, 4:1). Растворитель упаривали в вакууме, остаток хроматографировали в системе бензол-ацетон, 4:1. Получали 9-бром-13-метил-12-(2,3,4-три-O-ацетил- -L-арабинопиранозил)-5-броминдол-3-ил]фуран-2,5-диона и 20 мг иода в 220 мл бензола помещали в кварцевую пробирку и при барботировании воздуха облучали под Hg-лампой в течение 6 ч (контроль по ТСХ в системе бензол-ацетон, 4:1). Растворитель упаривали в вакууме, остаток хроматографировали в системе бензол-ацетон, 4:1. Получали 9-бром-13-метил-12-(2,3,4-три-O-ацетил- -L-арабинопиранозил)индоло-[2,3-а]фурано[3,4-с]карбазол-5,7-дион, выход 66%. Масс-спектр (m/z): 676.0774 (М+), 417, 419, 259, 199, 157, 139, 97, 69, 43. 1Н-ЯМР(СDСl3): 9.12 (д, 1Н), 9.00 (дд, 1Н), 7.91 (д, 1Н), 7.73 (т, 1Н), 7.68 (дд, 1Н), 7.63 (д, 1Н), 7.40 (ддд, 1Н), 4.24 (с, 3Н, СН3), 5.88 (д, 1Н, H1′, J1′,2′ 9.3), 5.56 (дд, 1H, H2′, J2′,3′ 10.3), 5.08 (дд, 1H, Н3′, J3′,4′ 3.2), 5.47 (дд, 1H, Н4′, J4′,5a’ 2.0, J 4′,5б’ -L-арабинопиранозил)индоло-[2,3-а]фурано[3,4-с]карбазол-5,7-дион, выход 66%. Масс-спектр (m/z): 676.0774 (М+), 417, 419, 259, 199, 157, 139, 97, 69, 43. 1Н-ЯМР(СDСl3): 9.12 (д, 1Н), 9.00 (дд, 1Н), 7.91 (д, 1Н), 7.73 (т, 1Н), 7.68 (дд, 1Н), 7.63 (д, 1Н), 7.40 (ддд, 1Н), 4.24 (с, 3Н, СН3), 5.88 (д, 1Н, H1′, J1′,2′ 9.3), 5.56 (дд, 1H, H2′, J2′,3′ 10.3), 5.08 (дд, 1H, Н3′, J3′,4′ 3.2), 5.47 (дд, 1H, Н4′, J4′,5a’ 2.0, J 4′,5б’ 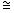 0.7), 4.48 (дд, 1H, Н5’а, Jгем. 13.8), 4.07 (д, 1H, Н5’б), 2.35 (с, 3Н, Ac), 1.87 (с, 3Н, Ac), 0.87 (с, 3Н, Ас). 0.7), 4.48 (дд, 1H, Н5’а, Jгем. 13.8), 4.07 (д, 1H, Н5’б), 2.35 (с, 3Н, Ac), 1.87 (с, 3Н, Ac), 0.87 (с, 3Н, Ас).
в) Смесь, состоящую из 0,33 ммоль 9-бром-13-метил-12-(2,3,4-три-О-ацетил- -L-арабинопиранозил)индоло-[2,3-а]фурано[3,4-с]карбазол-5,7-диона в 5 мл DMF и 5 мл 33%-ного водного аммиака, нагревали 4 ч при 140° С в автоклаве, оставляли на 18 ч при 20-22° С. Растворитель упаривали в вакууме. Остаток хроматографировали в системе хлороформ-метанол 4:1. Получали 9-бром-13-метил-12-( -L-арабинопиранозил)индоло-[2,3-а]фурано[3,4-с]карбазол-5,7-диона в 5 мл DMF и 5 мл 33%-ного водного аммиака, нагревали 4 ч при 140° С в автоклаве, оставляли на 18 ч при 20-22° С. Растворитель упаривали в вакууме. Остаток хроматографировали в системе хлороформ-метанол 4:1. Получали 9-бром-13-метил-12-( -L-арабинопиранозил)индоло-[2,3-а]пирроло[3,4-с]карбазол-5,7-дион (1а), выход 62%. Масс-спектр (m/z): 549.0476 (М+), 417, 419, 402, 04, 338, 267. 1Н-ЯМР (DMSO-d6): 9.27 (д, 1H), 9.09 (дд, 1H), 8.02 (д, 1H), 7.77 (дд, 1H), 7.72-7.65 (м, 2Н), 7.44 (т, 1Н), 4.20 (с, 3Н, СН3), 5.62 (д, 1H, H1′, J1′,2′ 8.7), 4.32 (дд, 1H, H2′, J2′,3′ -L-арабинопиранозил)индоло-[2,3-а]пирроло[3,4-с]карбазол-5,7-дион (1а), выход 62%. Масс-спектр (m/z): 549.0476 (М+), 417, 419, 402, 04, 338, 267. 1Н-ЯМР (DMSO-d6): 9.27 (д, 1H), 9.09 (дд, 1H), 8.02 (д, 1H), 7.77 (дд, 1H), 7.72-7.65 (м, 2Н), 7.44 (т, 1Н), 4.20 (с, 3Н, СН3), 5.62 (д, 1H, H1′, J1′,2′ 8.7), 4.32 (дд, 1H, H2′, J2′,3′ 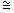 10.0), 4.15-3.80 (м, 4Н, Н3′, Н4′, НН5′), 5.04, 4.76 (2-ОН). 10.0), 4.15-3.80 (м, 4Н, Н3′, Н4′, НН5′), 5.04, 4.76 (2-ОН).
Пример 2. Синтез 6-амино-9-бром-13-метил-12-(1- -L-арабинопиранозил)индоло-[2.3-а]пирроло[3,4-с]карбазол-5,7-диона (Ib, R3=NH2) -L-арабинопиранозил)индоло-[2.3-а]пирроло[3,4-с]карбазол-5,7-диона (Ib, R3=NH2)
Смесь, состоящую из 0,43 ммоль 9-бром-13-метил-12-(2,3,4-три-O-ацетил- -L-арабинопиранозил)индоло-[2,3-а]фурано[3,4-с]карбазол-5,7-диона и 5 мл гидразин-гидрата, нагревали 6 ч при 50° С. Реакционную смесь упаривали в вакууме, остаток затирали с водой, осадок желтого цвета отделяли, сушили над Р2O5. Получали соединение (Ib), выход 41%. Масс-спектр (m/z): 564, 566 (М+), 434, 432, 417, 419, 338, 339, 268, 267. 1Н-ЯМР (DMSO-d6): 9.27 (д,1Н), 9.09 (дд, 1H), 8.0 (д, 1Н), 7.40-7-80 (м, 3Н), 7.42 (т, 1H), 4.93 (уш. с, 2Н, NH2), 4.20 (с, 3Н, СН3), 5.60 (д, 1H, H1′, J1′,2′ 8.6), 3.90-4.15 (м, 3Н, Н2′, НН5′), 3.53 (м, 1Н, Н3′), 3,85 (уш. с, 1Н, Н4′), 5.04, 4.76 (2-ОН), 4.37 (д, 1Н, 1-ОН, Jон,н 6.0). -L-арабинопиранозил)индоло-[2,3-а]фурано[3,4-с]карбазол-5,7-диона и 5 мл гидразин-гидрата, нагревали 6 ч при 50° С. Реакционную смесь упаривали в вакууме, остаток затирали с водой, осадок желтого цвета отделяли, сушили над Р2O5. Получали соединение (Ib), выход 41%. Масс-спектр (m/z): 564, 566 (М+), 434, 432, 417, 419, 338, 339, 268, 267. 1Н-ЯМР (DMSO-d6): 9.27 (д,1Н), 9.09 (дд, 1H), 8.0 (д, 1Н), 7.40-7-80 (м, 3Н), 7.42 (т, 1H), 4.93 (уш. с, 2Н, NH2), 4.20 (с, 3Н, СН3), 5.60 (д, 1H, H1′, J1′,2′ 8.6), 3.90-4.15 (м, 3Н, Н2′, НН5′), 3.53 (м, 1Н, Н3′), 3,85 (уш. с, 1Н, Н4′), 5.04, 4.76 (2-ОН), 4.37 (д, 1Н, 1-ОН, Jон,н 6.0).
Пример 3. Синтез 6-гидрокси-9-бром-13-метил-12-(1- -L-арабинопиранозил)индоло-[2,3-а]пирроло[3,4-с]карбазол-5,7-диона (Ic, R3=OH) -L-арабинопиранозил)индоло-[2,3-а]пирроло[3,4-с]карбазол-5,7-диона (Ic, R3=OH)
Смесь, состоящую из 0,15 ммоль 9-бром-13-метил-12-(2,3,4-три-O-ацетил- -L-арабинопиранозил)индоло-[2,3-а]фурано[3,4-с]карбазол-5,7-диона, 13,9 ммоль хлоргидрата гидроксиламина, 13,9 ммоль триэтиламина и 2 мл DMF, перемешивали 1 ч при 70° С. Реакционную смесь разбавляли водой, выпавший осадок оранжевого цвета фильтровали, хроматографировали на силикагеле в системе хлороформ-метанол, 5:1. Получали соединение (I с), выход 24%. Масс-спектр (m/z): – (М+), 550, 433, 432, 419, 418, 339, 338, 268, 267. 1Н-ЯМР (DMSO-d6): 10.52 (уш. с, 1Н, N-OH), 9.24 (д, 1Н), 9.06 (д, 1H), 8.01 (дд, 1Н). 7.60-7.80 (м, 3Н), 7.43 (т, 1Н), 4.19 (с, 3Н, СН3), 5.60 (д, 1H, Н1′, J1′,2′ 8.3), 3.80-4.25 (м, 5Н, Н2′, Н3′, Н4′, НН5′), 5.01, 4.73, 4.37 (3 уш. д, 3Н, 3-ОН). -L-арабинопиранозил)индоло-[2,3-а]фурано[3,4-с]карбазол-5,7-диона, 13,9 ммоль хлоргидрата гидроксиламина, 13,9 ммоль триэтиламина и 2 мл DMF, перемешивали 1 ч при 70° С. Реакционную смесь разбавляли водой, выпавший осадок оранжевого цвета фильтровали, хроматографировали на силикагеле в системе хлороформ-метанол, 5:1. Получали соединение (I с), выход 24%. Масс-спектр (m/z): – (М+), 550, 433, 432, 419, 418, 339, 338, 268, 267. 1Н-ЯМР (DMSO-d6): 10.52 (уш. с, 1Н, N-OH), 9.24 (д, 1Н), 9.06 (д, 1H), 8.01 (дд, 1Н). 7.60-7.80 (м, 3Н), 7.43 (т, 1Н), 4.19 (с, 3Н, СН3), 5.60 (д, 1H, Н1′, J1′,2′ 8.3), 3.80-4.25 (м, 5Н, Н2′, Н3′, Н4′, НН5′), 5.01, 4.73, 4.37 (3 уш. д, 3Н, 3-ОН).
Пример 4. Синтез 6-формамидо-9-бром-13-метил-12-(1- -L-арабинопиранозил)индоло-[2,3-а]пирроло[3,4-с]карбазол-5,7-диона (Id) -L-арабинопиранозил)индоло-[2,3-а]пирроло[3,4-с]карбазол-5,7-диона (Id)
Смесь, состоящую из 0,12 ммоль 9-бром-13-метил-12-(2,3,4-три-O-ацетил- -L-арабинопиранозил)индоло-[2,3-а]фурано[3,4-с]карбазол-5,7-диона, 1 мл DMF и 0,017 мл концентрированной соляной кислоты, нагревали 12 ч при 50° С. Реакционную смесь упаривали в вакууме, остаток хроматографировали на силикагеле в системе хлороформ-метанол, 5:1. Получали соединение (Id), выход 15%. Масс-спектр (m/z): – (М+), 566, 564,460, 434, 432,419, 417, 339, 338. 1H-ЯМР (DMSO-d6): 10.82 (с, 1H, NH), 8.44 (с, 1H, СНО), 9.21 (д, 1Н), 9.04 (д, 1H), 8.04 (д, 1H), 7.80 (д, 1H), 7.73 (т, 1H), 7.71 (т, 1H), 7.47 (т, 1H), 4.23 (с, 3Н, СН3), 5.64 (д, 1H, Н1′, J1′,2′ 8.8), 3.96-4.21 (м, 5Н, Н2′, Н3′, Н4′, НН5′), 5.1 (д, 1H, 1-ОН), 4.83 (д, 1H, 1-ОН, Jон,н5.8), 4.41 (д,1Н, 1-ОН, Jон,н6.0). -L-арабинопиранозил)индоло-[2,3-а]фурано[3,4-с]карбазол-5,7-диона, 1 мл DMF и 0,017 мл концентрированной соляной кислоты, нагревали 12 ч при 50° С. Реакционную смесь упаривали в вакууме, остаток хроматографировали на силикагеле в системе хлороформ-метанол, 5:1. Получали соединение (Id), выход 15%. Масс-спектр (m/z): – (М+), 566, 564,460, 434, 432,419, 417, 339, 338. 1H-ЯМР (DMSO-d6): 10.82 (с, 1H, NH), 8.44 (с, 1H, СНО), 9.21 (д, 1Н), 9.04 (д, 1H), 8.04 (д, 1H), 7.80 (д, 1H), 7.73 (т, 1H), 7.71 (т, 1H), 7.47 (т, 1H), 4.23 (с, 3Н, СН3), 5.64 (д, 1H, Н1′, J1′,2′ 8.8), 3.96-4.21 (м, 5Н, Н2′, Н3′, Н4′, НН5′), 5.1 (д, 1H, 1-ОН), 4.83 (д, 1H, 1-ОН, Jон,н5.8), 4.41 (д,1Н, 1-ОН, Jон,н6.0).
Пример 5. Результаты изучения цитотоксической активности in vitro гликозидов индолокарбазолов
Цитотоксические свойства синтезированных гликозидов изучали in vitro на культурах клеток меланомы линии MS (меланома Симпсона), Соlо38 и рака яичника человека линии CaOv. Цитотоксический эффект оценивали с помощью МТТ анализа (Microculture Tetrazolium Assay) в модификации Alley, включенной в Программу скрининга противоопухолевых веществ Национального института рака США. Принцип метода основан на превращении МТТ (нетоксичная желтая соль тетразолия) дегидрогеназами живых клеток в кристаллы голубого формазана, количество которого оценивается спектрофотометрически. Образовавшиеся кристаллы формазана растворяли DMSO и измеряли парциальное поглощение на сканирующем спектрофотометре (Titertec Multiskan MCC/340) при  =540 нм. Клеточную суспензию помещали в 96-луночные планшеты, к клеткам в фазе экспоненциального роста добавляли исследуемые вещества, а затем инкубировали в течение 72 часов. Время инкубации было достаточным для реализации метаболических эффектов исследуемых веществ, что выражалось в гибели клеток. Выжившую часть клеток определяли в процентах по соотношению величины парциального поглощения в опытных образцах и контроле (клетки в среде роста без препарата). Полученные результаты приведены в таблице 1. =540 нм. Клеточную суспензию помещали в 96-луночные планшеты, к клеткам в фазе экспоненциального роста добавляли исследуемые вещества, а затем инкубировали в течение 72 часов. Время инкубации было достаточным для реализации метаболических эффектов исследуемых веществ, что выражалось в гибели клеток. Выжившую часть клеток определяли в процентах по соотношению величины парциального поглощения в опытных образцах и контроле (клетки в среде роста без препарата). Полученные результаты приведены в таблице 1.
Характеристика используемых моделей: культуры клеток меланомы человека линии MS и Соlо38 (время удвоения 36 часов) и рака яичника человека линии CaOv (время удвоения 48 часов) выращивали в виде монослоя в среде роста RPMI-1640 с добавлением 10% FBS, 2 мМ глютамина, 40 мкг/мл гентамицина в атмосфере 5% СО3 и 95% воздуха, при 37° С.
Из приведенных данных следует, что у всех предлагаемых соединений показатель цитотоксичности IС50 10-5 соответствует критерию отбора для изучения противоопухолевой активности in vivo. 10-5 соответствует критерию отбора для изучения противоопухолевой активности in vivo.
Противоопухолевую активность гликозидов изучали на мышах колонии SK, мышах-гибридах первого поколения BDF1 (C57B1/DBA2), весом 18-20 г, разведения питомника “Столбовая”. Экспериментальными моделями служили лейкозы L1210 и Р388 (мыши BDF1), опухоль Эрлиха (колония SHK), перевиваемые в асцитной форме внутрибрюшино (в/б) 5× 106 оп) по сравнению с контрольными ( оп) по сравнению с контрольными ( к), выраженное в процентах: к), выраженное в процентах:
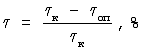 . .
Торможение роста опухоли (ТРО) у леченных животных (Роп) по сравнению с контрольными (Рк), выраженное в процентах:
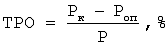
Кинетический критерий ростингибирующей активности 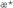 , позволяющий сопоставить относительные скорости роста опухоли у леченных ( , позволяющий сопоставить относительные скорости роста опухоли у леченных ( оп) и контрольных ( оп) и контрольных ( к) животных: к) животных:
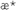 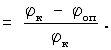
Пример 6. Противоопухолевая активность соединения формулы (Iа) на модели лейкоза L1210 (мыши BDF1)
Препарат вводили, начиная со следующих суток после перевивки опухоли. Результаты испытания препарата в широком диапазоне суточных доз при однократном и многократном применении представлены в таблице 2.
Как видно из приведенных данных, препарат обладает определенным антилейкемическим эффектом и в зависимости от примененной дозы приводит к увеличению сроков жизни животных на 12-25% по сравнению с контролем. Наибольшее увеличение продолжительности жизни животных наблюдается при применении препарата однократно в дозе 80 мг/кг ( 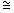 25%) либо шестикратно по 20 мг/кг в сутки ( 25%) либо шестикратно по 20 мг/кг в сутки ( 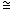 20%) 20%)
Пример 7. Противоопухолевая активность соединения формулы (Iа) на модели асцитной опухоли Эрлиха (мыши колонии SHK)
Введение препарата начинали со следующих суток после перевивки опухоли. Эффект оценивали на 12 сутки после перевивки опухоли. Результаты приведены в таблице 3.
Как следует из приведенных данных, соединение (Iа) проявляет исключительно высокую противоопухолевую активность, полностью подавляя развитие данной опухоли при применении во всех изученных дозах, включая низкую дозу 10 мг/кг в сутки, введенную шестикратно. Ревизия брюшной полости леченных животных на 12 сутки после перевивки опухоли выявила отсутствие у них асцитической жидкости при стандартном развитии опухоли у контрольных животных, имевших на указанный срок в среднем около 9 мл асцита в брюшной полости. Терапевтический индекс (ТИ100) соединения (Iа), рассчитанный как соотношение МПД (максимально переносимой дозы) к ЕД100 (доза, ингибирующая рост опухоли на 100%), составил для этой модели величину, равную 8.
Пример 8. Противоопухолевая активность соединения (Iа) на модели меланомы В16
Кинетика развития меланомы В16 у мышей, получавших различные дозы препарата (однократно 70 мг/кг либо пятикратно по 40, 30, 20 мк/кг в сутки), а также у контрольных животных, представлена на фиг.1.
Приведенные зависимости свидетельствуют о значительной ростингибирующей эффективности препарата в отношении данной опухоли. Так, торможение роста опухоли при оценке эффекта на третьи сутки после окончания курса лечения составляют 100%, 90% и 80% соответственно, при однократном (70 мг/кг) и пятикратном (40 или 30 мг/кг в сутки) введениях препарата. Применение препарата в относительно низкой дозе 20 мг/кг в сутки пятикратно приводит к торможению роста опухоли на 45-50% (первые сутки после окончания курса лечения).
Терапевтический индекс (ТИ50) препарата, определяемый для данной модели как отношение LD50 к ED50, составляет величину, равную 4.
Сопоставление кинетики развития опухоли у леченных и контрольных животных позволяет оценить длительность сохранения ростингибирующего эффекта препарата.
Как видно из представленных на фиг.2 зависимостей, торможение роста опухоли сохраняется на уровне не менее 70% на протяжении 7 суток после окончания введения препарата в дозе 70 мг/кг однократно и в течение 4 суток после пятикратного введения препарата по 40 мг/кг в сутки.
Даже в более отдаленные сроки – через 10 суток после применения препарата в указанных дозах – торможение роста опухоли составляет не менее 50% по сравнению с контролем (фиг.2А).
Характер изменения во времени кинетического критерия 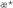 (фиг.2Б) также свидетельствует о том, что после применения препарата в дозе 70 мг/кг однократно значения этого показателя на протяжении 7 суток после введения соединения (1а) остаются в области величин, соответствующих значительному ростиингибирующему эффекту ( (фиг.2Б) также свидетельствует о том, что после применения препарата в дозе 70 мг/кг однократно значения этого показателя на протяжении 7 суток после введения соединения (1а) остаются в области величин, соответствующих значительному ростиингибирующему эффекту (  >0.4). Кинетическая оценка противоопухолевого эффекта препарата при различных режимах введения дает основание полагать, что оптимальными схемами его применения являются однократное введение в дозе 70 мг/кг либо пятикратное применение по 40 мг/кг в сутки (фиг.2). >0.4). Кинетическая оценка противоопухолевого эффекта препарата при различных режимах введения дает основание полагать, что оптимальными схемами его применения являются однократное введение в дозе 70 мг/кг либо пятикратное применение по 40 мг/кг в сутки (фиг.2).
Таким образом, на примере соединения (Iа) показана значительная противоопухолевая эффективность в отношении меланомы В16 (торможение развитие опухоли в зависимости от режима введения препарата составляет 70-90%), а также в отношении опухоли Эрлиха, развитие которой полностью ингибируется. Аналогичные результаты были получены для остальных описанных соединений.
Полученные результаты позволяют сделать вывод о перспективности дальнейших испытаний заявленных соединений с целью создания новых противоопухолевых лекарственных средств.
| Таблица 1 |
| № соед. |
X1 |
X2 |
R2 |
R2 |
R3 |
Линия клеток |
IC50, M |
| Ia |
Br |
H |
L-ara |
СН3 |
Н |
CaOv |
>10-6 |
| Ia |
Br |
H |
L-ara |
СН3 |
Н |
MS |
3× 10-6 |
| Ib |
Br |
H |
L-ara |
СН3 |
NH2 |
CaOv |
0.8× 10-6 |
| Ib |
Br |
H |
L-ara |
СН3 |
NH2 |
Colo38 |
6× 10-6 |
| Ic |
Br |
H |
L-ara |
СН3 |
ОН |
CaOv |
>10-5 |
| Ic |
Br |
H |
L-ara |
СН3 |
ОН |
Colo38 |
>10-5 |
| Id |
Br |
H |
L-ara |
СН3 |
NHCHO |
CaOv |
2× 10-5 |
| Id |
Br |
H |
L-ara |
СН3 |
NHCHO |
Colo38 |
10-5 |
| If |
H |
H |
D-Lac |
СН3 |
NH2 |
MS |
10-5 |
| Ig |
H |
H |
D-Lac |
СН3 |
ОН |
Colo38 |
>10-5 |
| Ih |
H |
H |
D-Lac |
СН3 |
NHCHO |
CaOv |
>10-5 |
| Таблица 2 |
| Доза, мг/кг в сутки |
Схема введения |
Средняя продолжительность жизни животных, сутки |
Увеличение средней продолжительности жизни животных по сравнению с контролем |
| 80* |
Однократно |
13.2±1.8 |
23.4 |
| 60 |
однократно |
10.2±1.1 |
17.6 |
| 30* |
пятикратно |
12.5±1.2 |
16.8 |
| 20 |
шестикратно |
10.4±0.9 |
19.2 |
| 10 |
шестикратно |
9.6±0.55 |
14.3 |
| 5 |
шестикратно |
9.4±0.55 |
12 |
| Контроль |
– |
8.4±0.55 |
– |
| *Средняя продолжительность жизни животных в контроле для указанного опыта составила 10.7±1.2 суток. |
| Таблица 3 |
| Доза, мг/кг в сутки |
Схема введения |
Объем асцитической жидкости, мл |
Торможение роста опухоли, % |
| 60 |
однократно |
0 |
100 |
| 30 |
шестикратно |
0 |
100 |
| 20 |
шестикратно |
0 |
100 |
| 10 |
шестикратно |
0 |
100 |
| Контроль |
– |
8.6±2.1 |
– |
Формула изобретения
1. Производные гликозидов индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов общей формулы
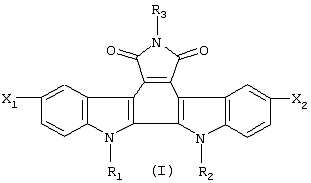
где R1 означает остаток моно – или дисахарида в пиранозной форме, выбранный из группы D-Rib, L-Ara, D-Xyl, D-Gal, D-Glc, D-Lac;
R2 означает атом водорода, метальную группу или остаток моно- или дисахарида;
R3 означает водород, гидроксильную группу, аминогруппу или формамидогруппу;
X1 и Х3 означают каждый независимо друг от друга атом водорода или атом брома, при условии, что они не могут означать одновременно атом водорода, а также при условии, что если R1 означает дисахаридный остаток, R2 отличен от водорода.
2. Соединение по п.1, обладающее цитотоксической активностью в отношении клеток меланомы MS, Colo38 и рака яичника человека CaOv.
3. Соединение по п.1, обладающее противоопухолевой активностью в отношении лейкоза L1210, асцитной опухоли Эрлиха и солидной опухоли-меланомы B16.
РИСУНКИ
PC4A – Регистрация договора об уступке патента Российской Федерации на изобретение
(73) Патентообладатель(и):
ЗАО “АСГЛ-исследовательские лаборатории”
(73) Патентообладатель:
ГУ Российский онкологический научный центр имени Н.Н. Блохина РАМН
Дата и номер государственной регистрации перехода исключительного права: 14.12.2005 № РД0004905
Извещение опубликовано: 20.02.2006 БИ: 05/2006
|
|