Патент на изобретение №2255088
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) ПРОИЗВОДНОЕ БЕНЗОИЛПИРИДИНА ИЛИ ЕГО СОЛЬ, СОДЕРЖАЩИЙ ЕГО В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА ФУНГИЦИД, СПОСОБЫ ЕГО ПОЛУЧЕНИЯ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ ДЛЯ ЕГО ПОЛУЧЕНИЯ
(57) Реферат:
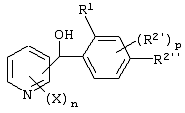
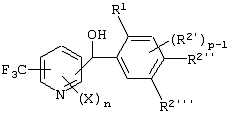
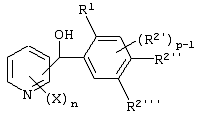
Описывается производное бензоилпиридина формулы (I) или его соль где Х представляет атом галогена, C1-6 алкоксигруппу, необязательно замещенную заместителем, выбранным из галогена, фенила, метокси, метилтио, диметиламино, винила и этинила; феноксигруппу; С3-6 циклоалкоксигруппу; гидроксильную группу; C1-6 алкильную группу; С2-6 алкенильную группу; CF3; C1-6-алкилтиогруппу; цианогруппу; C1-6 алкоксикарбонильную группу; C1-6 диалкиламинокарбонильную группу; C1-6 алкилкарбонилоксигруппу; C1-6 алкилкарбонильную группу; аминогруппу; С1-4 алкиламиногруппу; или ди-С1-4алкиламиногруппу; n представляет 1, 2, 3 или 4; R1 представляет C1-6 алкильную группу; R2 представляет C1-6 алкильную группу; C1-6 алкоксигруппу, необязательно замещенную фенилом; феноксигруппу; С3-10 циклоалкоксигруппу или гидроксильную группу; и m равняется 1, 2 или 3, при условии, что если m равняется 2, то R2 может образовывать кольцо -ОСН2О- (за исключением случая, когда пиридиновое кольцо замещено бензоильной группой в 2-положении; пиридиновое кольцо замещено C1-6 алкоксигруппой, гидроксильной группой или бензилоксигруппой в 3-положении; n равно 1, m равно 1 или 2). Описываются фунгицид, содержащий соединение формулы (I), или его соль в качестве активного ингредиента, способы получения производных бензоилпиридина, фенилпиридилметанол, являющийся промежуточным соединением для получения соденинения формулы (I). Технический результат заключается в фунгицидных свойствах соединения формулы (I) или его соли. 5 н. и 12 з.п. ф-лы, 36 табл.
(56) (продолжение): CLASS=”b560m”TETRAHEDRON LETT., 1998, 39(11), 1377-1380. ES 506367 А, 13.06.1996. SU 538662, 23.08.1977. RU 2172312 С2, 20.08.2001.
Область изобретения Настоящее изобретение относится к новому производному бензоилпиридина или его соли, к содержащему его в качестве активного ингредиента фунгициду, к способу его получения и к промежуточным соединениям для его получения. Предпосылки изобретения Производные бензоилпиридина, которые являются аналогами соединений настоящего изобретения, могут быть соединениями, раскрытыми, например, в WO99/41237, WO99/38845, WO96/17829, JP-A-7-309837 и JP-A-2-275858. Однако они отличаются от соединений настоящего изобретения. Кроме того, цели использования этих соединения отличаются от целей использования соединений настоящего изобретения. Многие из обычно используемых фунгицидов отличаются специфическими характеристиками в плане борьбы с вредителями, которые вызывают заболевания растений. Некоторые из них (фунгицидов) отличаются несколько более слабым оздоравливающим действием по сравнению с профилактическим действием, а у некоторых наблюдается остаточное действие, которое длится всего лишь относительно короткий промежуток времени, так что в некоторых случаях их способность борьбы с вредителями оказывается на практике недостаточной. Соответственно было весьма желательно создать новые соединения, которые были бы весьма эффективны в борьбе с вредителями, вызывающими болезни растений. Описание изобретения Авторы настоящего изобретения предприняли интенсивные исследования с целью преодоления вышеуказанных проблем и в результате обнаружили, что использование соединения, представленного формулой (I), в качестве активного ингредиента обеспечивает великолепный профилактический эффект и оздоравливающее действие против различных заболеваний растений, особенно против настоящей мучнистой росы ячменя, овощей, фруктов и цветочных растений, и, таким образом, было совершено настоящее изобретение. Итак, настоящее изобретение относится к производному бензоилпиридина, представленному формулой (I), или к его соли где Х представляет атом галогена, нитрогруппу, замещаемую алкоксигруппу, замещаемую арилоксигруппу, замещаемую циклоалкоксигруппу, гидроксильную группу, замещаемую углеводородную группу, замещаемую алкилтиогруппу, цианогруппу, карбоксильную группу, которую можно эстерифицировать или амидировать, или замещаемую аминогруппу; n равняется 1, 2, 3 или 4; R1 представляет замещаемую алкильную группу; R2 представляет замещаемую алкильную группу, замещаемую алкоксигруппу, замещаемую арилоксигруппу, замещаемую циклоалкоксигруппу или гидроксильную группу; и m равняется 1, 2, 3 или 4, при условии, что если m равняется, по крайней мере, 2, R2 может содержать атом кислорода с образованием конденсированного кольца (за исключением случая, когда пиридиновое кольцо замещено бензоильной группой в 2-положении; пиридиновое кольцо замещено алкоксигруппой, гидроксильной группой или бензилоксигруппой в 3-положении; и n равняется 1, m равняется 1 или 2), фунгициду, содержащему его в качестве активного ингредиента, способу его получения и промежуточному соединению для его получения. Атом галогена, обозначенный X, может быть, например, фтором, хлором, бромом или йодом, и предпочтительно можно использовать, например, фтор, хлор или бром. Алкокси-фрагмент в замещаемой алкоксигруппе, обозначенной каждым из Х и R2, может быть, например, C1-6 алкокси (таким как метокси, этокси, пропокси, изопропокси, бутокси, изо-бутокси или трет-бутокси), и предпочтительно может быть, например, C1-4 алкокси (таким как метокси или этокси). Кроме того, вторичными заместителями замещаемой алкоксигруппы могут быть от 1 до 5 заместителей, которые могут быть одинаковы или различны и которые выбирают из группы, состоящей из арила, арилокси, гидроксила, нитро, нитрокси, галогена (такого как фтор, хлор, бром или йод), галогеналкокси (такого как C1-4 галогеналкокси, как, например, СF3О или HCF2O), циклоалкила, амино, алкилтио и циано. Из этих замещаемых алкоксигрупп предпочтительна незамещенная алкоксигруппа, особенно предпочтительна C1-4 алкоксигруппа. В качестве арильного фрагмента в замещаемой арилоксигруппе, обозначенной как X, можно указать полициклические группы конденсированного типа, такие как нафтил и фенил, причем предпочтителен фенил. Вторичным заместителем у замещаемой арилоксигруппы может быть, например, галоген, алкил, алкокси или гидроксил. Из замещаемых арилоксигрупп наиболее предпочтительна феноксигруппа. Циклоалкильным фрагментом в замещаемой циклоалкоксигруппе, обозначенной X, обычно бывает фрагмент, содержащий от 3 до 10 атомов углерода, и моноциклическая группа, такая как циклопропил, циклобутил, циклопентил, циклогексил или циклооктил, а также могут быть упомянуты полициклические группы конденсированного типа. Однако предпочтительна моноциклическая группа. Вторичным заместителем замещаемой циклоалкоксигруппы может быть, например, галоген, алкил, алкокси или гидроксил. Из этих замещаемых циклоалкоксигрупп наиболее предпочтительна циклогексилоксигруппа. Углеводородным фрагментом в замещаемой углеводородной группе, представленной X, может быть, например, группа C1-6 алкил (такой как метил, этил, пропил, изопропил, бутил, изобутил или трет-бутил), С2-6 алкенил (такой как винил, аллил, изопропенил или 3-метил-2-бутенил), С2-6 алкинил (такой как этинил, 1-пропинил или 2-пропинил), С3-6 циклоалкил (такой как циклопропил, циклопентил или циклогексил), или С6-10 арил. Кроме того, вторичными заместителями замещаемой углеводородной группы могут быть от одного до пяти заместителей, которые могут быть одинаковыми или различными и которые выбирают из группы, состоящей из арила, арилокси, гидроксила, нитро, нитрокси, галогена (такого как фтор, хлор, бром или йод), галогеналкокси (такой как C1-4 галогеналкокси, как, например, СF3О или HCF2O), циклоалкила, амино, алкилтио и циано. Из этих замещаемых углеводородных групп предпочтительны замещаемые алкильные группы и особенно предпочтительны алкильные группы. Кроме того, среди алкильных групп наиболее предпочтительны C1-4 алкильные группы. Фрагмент алкилтио в замещаемой алкилтиогруппе, обозначенной X, может быть, например, C1-6 алкилтио (такой как метилтио, этилтио, пропилтио, изопропилтио, бутилтио, изобутилтио или трет-бутилтио) и предпочтительно C1-4 алкилтио (такой как метилтио или этилтио). Из этих алкилтиогрупп, у которых могут быть заместители, предпочтительна алкилтиогруппа, особенно предпочтительна C1-4 алкилтиогруппа. Вторичными заместителями у замещаемой алкилтиогруппы могут быть от одного до пяти заместителей, которые могут быть одинаковыми или различными и которые выбирают из группы, состоящей из арила, арилокси, гидроксила, нитро, нитрокси, галогена (такого как фтор, хлор, бром или йод), галогеналкокси (такой как C1-4 галогеналкокси, как, например, СF3О или HCF2O) и циано. Карбоксильной группой, которая может быть эстерифицирована или амидирована, обозначенной как X, может быть, например, карбоксильная группа, которая может быть эстерифицирована, такая как C1-6 алкоксикарбонильная группа (как, например, метоксикарбонильная группа, этоксикарбонильная группа, пропоксикарбонильная группа, изопропоксикарбонильная группа, бутоксикарбонильная группа, изобутоксикарбонильная группа или трет-бутоксикарбонильная группа), нитрокси-C1-4-алкоксиаминокарбонильная группа (такая как 2-нитроксиэтоксикарбонильная группа или 3-нитроксипропоксикарбонильная группа), фенил-C1-4-алкоксикарбонильная группа (такая как бензилоксикарбонильная группа или фенэтилоксикарбонильная группа); или карбоксильная группа, которая может быть амидирована, такая как карбамоильная группа, C1-6 моноалкиламинокарбонильная группа (такая как метиламинокарбонильная группа, этиламинокарбонильная группа, пропиламинокарбонильная группа, изопропиламинокарбонильная группа, бутиламинокарбонильная группа, изобутиламинокарбонильная группа или трет-бутиламинокарбонильная группа), C1-6 диалкиламинокарбонильная группа (такая как диметиламинокарбонильная группа, диэтиламинокарбонильная группа, дипропиламинокарбонильная группа, диизопропиламинокарбонильная группа, дибутиламинокарбонильная группа или изобутиламинокарбонильная группа), нитрокси-C1-4-алкиламинокарбонильная группа (такая как 2-нитроксиэтиламинокарбонильная группа или 3-нитроксипропиламинокарбонильная группа), фенил-C1-4-алкиламинокарбонильная группа (такая как бензиламинокарбонильная группа или фенэтиламинокарбонильная группа), С3-6-циклоалкиламинокарбонильная группа (такая как циклопропиламинокарбонильная группа), циклопентиламинокарбонильная группа или циклогексиламинокарбонильная группа, циклическая аминокарбонильная группа (такая как морфолинокарбонильная группа, пиперидинокарбонильная группа, пирролидинокарбонильная группа или тиоморфолинокарбонильная группа) или аминокарбонильная группа. Замещаемая аминогруппа, обозначенная X, может быть, например, аминогруппой или алкиламиногруппой, такой как моноалкиламиногруппа или диалкиламиногруппа. Алкильный фрагмент в алкиламиногруппе (моноалкиламиногруппе или диалкиламиногруппе) представляет предпочтительно C1-4 алкил. Вторичными заместителями у замещаемой аминогруппы могут быть от одного до пяти заместителей, которые могут быть одинаковы или различны и которые выбирают из группы, состоящей из арила, арилокси, гидроксила, нитро, нитрокси, галогена (такого как фтор, хлор, бром или йод), галогеналкокси (такой как C1-4 галогеналкоксигруппа, как, например, СF3О или HCF2O), циклоалкила, амино, алкилтио и циано. Алкильный фрагмент в замещаемой алкильной группе, обозначенной каждым из R1 и R2, предпочтительно представляет C1-6 алкил (такой как метил, этил, пропил, изопропил, бутил, изобутил или трет-бутил), и среди них предпочтителен C1-4 алкил. Вторичными заместителями замещаемой алкильной группы могут быть от одного до пяти заместителей, которые могут быть одинаковы или различны и которые выбирают из группы, состоящей из арила, арилокси, гидроксила, нитро, нитрокси, галогена (такого как фтор, хлор, бром или йод), галогеналкокси (такого как C1-4 галогеналкокси, как, например, СF3О или HCF2O), циклоалкила, амино, алкилтио и циано. Из этих замещаемых алкильных групп предпочтительна незамещенная алкильная группа и особенно предпочтительна C1-4 алкильная группа. Среди них наиболее предпочтительна метильная группа. Алкокси-фрагментом в замещаемой алкоксигруппе, обозначенной как R2, предпочтительно является C1-6 алкокси (такая как метокси, этокси, пропокси, изопропокси, бутокси, изобутокси или трет-бутокси), и среди них предпочтительна C1-4 алкокси. Вторичными заместителями замещаемой алкильной группы могут быть от одного до пяти заместителей, которые могут быть одинаковы или различны и которые выбирают из группы, состоящей из арильной группы, арилоксигруппы, гидроксильной группы, нитрогруппы, нитроксигруппы, атомов галогенов (таких как фтор, хлор, бром или йод), галогеналкоксигрупп (таких как C1-4 галогеналкоксигруппа, как, например, СF3О или HCF2O), циклоалкильной группы, аминогруппы, алкилтиогруппы и цианогруппы. Из этих замещаемых алкоксигрупп предпочтительна незамещенная алкоксигруппа. В качестве арильного фрагмента в замещаемой арилоксигруппе, обозначенной R2, можно указать полициклические группы конденсированного типа, такие как нафтил, а также фенил, причем предпочтителен фенил. Вторичными заместителями замещаемой арилоксигруппы могут быть, например, атом галогена, алкильная группа, алкоксигруппа или гидроксильная группа. Из этих замещаемых арилоксигрупп наиболее предпочтительна незамещенная феноксигруппа. Циклоалкильный фрагмент в замещаемой циклоалкоксигруппе, обозначенной R2, обычно является фрагментом, который содержит от 3 до 10 атомов углерода, и моноциклической группой, такой как циклопропил, циклобутил, циклопентил, циклогексил или циклооктил, а также полициклической группой конденсированного типа. Однако предпочтительна моноциклическая группа. Вторичным заместителем у замещаемой циклоалкоксигруппы может, например, быть атом галогена, алкил, алкокси или гидроксил. Из этих замещаемых циклоалкоксигрупп наиболее предпочтительна незамещенная циклогексилоксигруппа. И, наконец, арильный фрагмент, циклоалкильная группа и алкилтиогруппа во вторичном заместителе в составе заместителя, обозначенного X, R1 и R2, имеют значения, указанные для заместителей, обозначенных X, R1, R2 и R3. Соединение, представленное формулой (I), может образовывать соль с кислотным соединением, и оно может образовывать, например, неорганическую соль, такую как гидрохлорид, гидробромид, фосфат, сульфат или нитрат, или органическую соль, такую как ацетат, бензоат, пара-толуолсульфонат, метансульфонат или пропансульфонат. Предпочтительный способ осуществления изобретения Некоторые предпочтительные варианты производных бензоилпиридина, представленные формулой (I), показаны ниже. Эти соединения можно сочетать друг с другом. Кроме того, эти соединения полезны в качестве фунгицидов. R2′, R2” и R2”’ имеют значения, указанные для R2 и X1, X2, X3 и X4, имеют значения, указанные выше для X. (1) Производное бензоилпиридина, представленное формулой (I’), или его соль где X, n и R1 имеют указанные выше для общей формулы (I) значения, R2′ представляет замещаемую алкильную группу, замещаемую алкоксигруппу, замещаемую арилоксигруппу, замещаемую циклоалкоксигруппу или гидроксильную группу, р равно 1, 2 или 3, и R2” представляет замещаемую алкоксигруппу или гидроксильную группу при условии, что, по крайней мере, два из R2′ и R2” могут содержать атом кислород с образованием конденсированного кольца (исключая случай, когда пиридиновое кольцо замещено группой бензоила в 2-положении; пиридиновое кольцо замещено алкоксигруппой, гидроксильной группой или бензилоксигруппой в 3-положении; и n равно 1, р равно 1). (2) Производное бензоилпиридина или его соль по вышеуказанному пункту (1), которое представлено формулой (I”) где Х представляет атом галогена, нитрогруппу, замещаемую алкоксигруппу, замещаемую арилоксигруппу, замещаемую циклоалкоксигруппу, замещаемую углеводородную группу, замещаемую алкилтиогруппу, цианогруппу, карбоксильную группу, которая может быть эстерифицирована или амидирована, или замещаемую аминогруппу; n равно 1, 2,3 или 4; R1 представляет алкильную группу; R2′ представляет замещаемую алкильную группу, замещаемую алкоксигруппу, замещаемую арилоксигруппу или замещаемую циклоалкоксигруппу; р равно 1, 2 или 3; и каждый из R2” и R2”’ представляет замещаемую алкоксигруппу. (3) Производное бензоилпиридина или его соль по вышеуказанному пункту (2), где Х представляет атом галогена, нитрогруппу, замещаемую алкоксигруппу, замещаемую циклоалкоксигруппу, алкильную группу, замещаемую алкилтиогруппу или аминогруппу. (4) Производное бензоилпиридина или его соль по вышеуказанному пункту (3), представленное формулой (I”): где Х представляет атом галогена, нитрогруппу, замещаемую алкоксигруппу, замещаемую циклоалкоксигруппу, алкильную группу, замещаемую алкилтиогруппу или замещаемую аминогруппу; n равно 1, 2, 3, или 4; R1 представляет алкильную группу; R2 представляет замещаемую алкильную группу, замещаемую алкоксигруппу, замещаемую арилоксигруппу или замещаемую циклоалкоксигруппу; р равно 1, 2 или 3; каждый из R2” и R2”’ представляет замещаемую алкоксигруппу (исключая случай, когда пиридиновое кольцо замещено бензоильной группой в 3-положении, и пиридиновое кольцо содержит группу СF3, по крайней мере, в одном из 2,6-положений). (5) Производное бензоилпиридина или его соль по вышеуказанному пункту (1), представленное формулой (I”’) где X представляет атом галогена, замещаемую алкоксигруппу, алкильную группу, группу СF3 или алкилтиогруппу; n равно 1, 2, 3 или 4; R1 представляет алкильную группу; R2 представляет замещаемую алкильную группу, замещаемую алкоксигруппу или замещаемую циклоалкоксигруппу; р равно 1, 2 или 3; и каждый из R2” и R2”’ представляет замещаемую алкоксигруппу. (6) Производное бензоилпиридина или его соль по вышеуказанному пункту (5), представленное формулой (I”’) где Х представляет атом галогена, замещаемую алкоксигруппу, алкильную группу, группу СF3 или алкилтиогруппу; n равно 1, 2, 3, или 4; R1 представляет алкильную группу; R2′ представляет замещаемую алкильную группу, замещаемую арилоксигруппу или замещаемую циклоалкоксигруппу; р равно 1, 2 или 3; каждый из R2” и R2”’ представляет замещаемую алкоксигруппу (исключая случай, когда пиридиновое кольцо замещено группой бензоила в 3-положении, и пиридиновое кольцо содержит группу СF3, по крайней мере, в одном из 2,6-положений). (7) Производное бензоилпиридина или его соль по вышеуказанному пункту (5) или (6), где атом галогена, представленный X, является атомом фтора или атомом хлора. (8) Производное бензоилпиридина или его соль по вышеуказанному пункту (5) или (6), где n равно 3 или 4. (9) Производное бензоилпиридина или его соль по вышеуказанному пункту (5) или (6), где в том случае, когда n равно 1 или 2, атом галогена, представленный X, является атомом фтора или атомом хлора. (10) Производное бензоилпиридина или его соль по вышеуказанному пункту (5), представленное формулой (I””) где Х представляет атом галогена, алкоксигруппу, алкильную группу, группу CF3 или алкилтиогруппу; n равно 1, 2 или 3; R1 представляет алкильную группу; R2′ представляет алкоксигруппу; р равно 1, 2 или 3; и каждый из R2” и R2”’ представляет алкоксигруппу. (11) Производное бензоилпиридина или его соль по вышеуказанному пункту (10), представленное формулой (I””) где Х представляет атом галогена, алкоксигруппу, алкильную группу, группу СF3 или алкилтиогруппу; n равно 1, 2 или 3; R1 представляет алкильную группу; R2′ представляет алкоксигруппу; р равно 1, 2 или 3; и каждый из R2” и R2”’ представляет алкоксигруппу (исключая случай, когда пиридиновое кольцо замещено группой бензоила в 3-положении, и пиридиновое кольцо содержит группу СF3, по крайней мере, в одном из 2,6-положений). (12) Производное бензоилпиридина или его соль по вышеуказанному пункту (8), представленное формулой (I””’) где В представляет -СХ4=, когда А представляет -N=; В представляет -N=, когда А представляет -СН=; каждый из X1 и X2, которые независимы друг от друга, представляет атом галогена, алкоксигруппу, алкильную группу, группу СF3 или алкилтиогруппу; X3 представляет атом водорода, атом галогена, алкоксигруппу, алкильную группу, группу СF3 или алкилтиогруппу; X4 представляет атом водорода, атом галогена, алкоксигруппу, алкильную группу, группу СF3 или алкилтиогруппу; R1 представляет алкильную группу; R2′ представляет алкоксигруппу; р равно 1, 2 или 3; и каждый из R2” и R2”’ представляет алкоксигруппу. (13) Производное бензоилпиридина или его соль по вышеуказанному пункту (8), представленное формулой (I””’) где В представляет -СХ4=, когда А представляет -N=; В представляет -N=, когда А представляет -СН=; каждый из X1 и X2, которые независимы друг от друга, представляют атом галогена, алкоксигруппу, алкильную группу, группу СF3 или алкилтиогруппу; X3 представляет атом водорода, атом галогена, алкоксигруппу, алкильную группу, группу СF3 или алкилтиогруппу; X4 представляет атом водорода, атом галогена, алкоксигруппу, алкильную группу, группу СF3 или алкилтиогруппу; R1 представляет алкильную группу; R2′ представляет алкоксигруппу; р равно 1, 2 или 3; и каждый из R2” и R2”’ представляет алкоксигруппу (исключая случай, когда А представляет -СН= и В представляет -N=, a X2 представляет группу СF3). Соединение, представленное формулой (I), или его соль можно получить в соответствии с известным способом получения аналогичного соединения (таким как способ, раскрытый в WO 96/17829). Однако в качестве предпочтительных способов можно указать способы 1-3, представленные на следующих схемах. Здесь X, R1, R2, n и m в формулах имеют указанные выше значения. Один из заместителей, представленных M1 в формуле (II) и M2 в формуле (III), представляет цианогруппу, а другой представляет атом металла, или его смешанную соль; заместитель, представленный W в формуле (V) представляет атом галогена или трифторметансульфонилоксигруппу; один из заместителей, представленных М3 в формуле (VI) и М4 в формуле (VII), представляет группу формила, а другой представляет атом металла или его смешанную соль. Способ 1 Способ получения соединения, представленного формулой (I), который включает осуществление реакции конденсации соединения, представленного формулой (II), и соединения, представленного формулой (III), с получением иминосоединения, представленного формулой (VIII) где X, R1, R2, n и m имеют указанные ранее значения, a Z представляет атом металла или его смешанную соль, и осуществление гидролиза полученного соединения. Атом металла, обозначенный каждым из М1 и М2 в формулах (II) и (III), может быть, например, атомом типичного металла, такого как литий, магний, цинк или медь; или атомом переходного металла, такого как палладий или рутений. Кроме того, вместо атома металла можно использовать смешанную соль атома металла. Соединение формулы (II), где М1 представляет цианогруппу, и соединение формулы (III), где М2 представляет цианогруппу, можно получить известным способом, таким как раскрыт в Journal of the Chemical Society, Perkin transactions 1 pages 2323-2326, 1999. Реакцию конденсации для получения иминосоединения осуществляют в подходящем растворителе (таком инертном растворителе, как тетрагидрофуран, диэтиловый эфир, диметоксиэтан, гексан, бензол, толуол, метиленхлорид, или в их смесях) при температуре реакции от -100 до 70°С, предпочтительно от -80 до 30°С. Эту реакцию осуществляют предпочтительно в атмосфере инертного газа, например азота или аргона. Иминосоединение, полученное в результате реакции конденсации, гидролизуют известным способом и превращают в соединение, представленное формулой (I). Реакцию гидролиза можно вести в присутствии, например, воды, спирта или их смеси. В способе 1 реакцию конденсации и реакцию гидролиза обычно осуществляют непрерывно и не выделяют никакого иминосоединения. Кроме того, для получения соединения, представленного формулой (I), с высоким выходом предпочтительно осуществлять реакцию гидролиза после того, как реакция конденсации полностью завершена. Способ 2 Способ получения соединения, представленного формулой (I), который включает осуществление реакции конденсации соединения, представленного формулой (IV), и соединения, представленного формулой (V), с получением соединения, представленного формулой (IX) где X, R1, R2, n и m имеют указанные ранее значения, и осуществление окислительного децианирования в присутствии основания. Реакцию для получения соединения, представленного формулой (IX), на стадии первой половины способа 2 обычно осуществляют в присутствии основания, предпочтительно в растворителе. Основанием, которое можно использовать в этой реакции, может быть, например, гидрид лития, гидрид натрия, метоксид натрия, этоксид натрия или трет-бутоксид калия. Растворителем может быть, например, тетрагидрофуран, диэтиловый эфир, бензол, толуол, метиленхлорид, хлороформ или ДМФА, или смеси этих растворителей. Эту реакцию предпочтительно осуществляют при температуре от 0 до 100°С. Кроме того, ее предпочтительно осуществляют в атмосфере инертного газа, например азота или аргона. Кроме того, в тех случаях, когда требуется ускорить реакцию, можно добавить бензолсульфинат натрия или пара-толуолсульфинат натрия. Реакцию окислительного децианирования на стадии последней половины способа 2 осуществляют в присутствии основания. Основанием может быть, например, гидрид натрия, гидрид калия, карбонат натрия или карбонат калия. Кроме того, при необходимости можно использовать межфазный катализатор (такой как бензилтриэтиламмонийхлорид или тетрабутиламмонийгидросульфат). Эту реакцию обычно осуществляют в подходящем растворителе (таком как инертный растворитель, как, например, метиленхлорид, хлороформ, 1,2-дихлорэтан, бензол, толуол, ДМФА или ДМСО, или в содержащем воду растворителе, или в их смесях), при температуре реакции от 0 до 50°С. Способ 3 Способ получения соединения, представленного формулой (I), который включает осуществление взаимодействия соединения, представленного формулой (VI), и соединения, представленного формулой (VII), с получением фенилпиридилметанола, представленного формулой (X) (где X, n, m, R1 и R2 имеют указанные ранее для формулы (I) значения), и осуществление реакции окисления полученного соединения. Каждый из атомов металла, обозначенных М3 и М4 в способе 3, может быть, например, атомом типичного металла, такого как литий, магний, цинк или медь; или атомом переходного металла, такого как палладий или рутений. Кроме того, вместо атома металла можно использовать смешанную соль атома металла. Соединение формулы (VI), где заместителем, обозначенным М3, является группа формила, и соединение формулы (VII), где заместителем, обозначенным М4, является группа формила, обычно можно получить известным способом, таким как способ, раскрытый в Journal of Organic Chemistry, vol.57, pages 6847-6852, 1992. Фенилпиридилметанол, представленный формулой (X), полученный из соединения, представленного формулой (VI), и соединения, представленного формулой (VII), может быть окислен известными способами с использованием содержащего металл окисляющего агента, такого как диоксид марганца или хромовая кислота, способом окисления по Суэрну (Swern) (диметилсульфоксид+ оксалилхлорид) или способом окисления с использованием рутения (тетрапропиламмонийперрутенат+N-метилморфолин-N-оксид), и превращен в соединение, представленное формулой (I). Далее раскрыт способ осуществления способа 3. (1) Способ получения соединения, представленного формулой (I), который включает осуществление взаимодействия замещенного бензальдегида, представленного формулой (VI-1) (где R1, R2 и m имеют указанные ранее значения), и соли замещенного производного пиридина с металлом, представленной формулой (VII-1) (где Х имеют указанные ранее значения, a Z представляет атом металла или его смешанную соль) до получения фенилпиридилметанола, представленного формулой (X), и его окисление. (2) Способ получения соединения, представленного формулой (I), который включает осуществление взаимодействия соли замещенного производного бензола с металлом, представленной формулой (VI-2): (где R1, R2 и m имеют указанные ранее значения, и Z представляет атом металла или его смешанную соль), и замещенного пиридилальдегида, представленного формулой (VII-2) (где Х имеют указанные ранее значения), с получением фенилпиридилметанола, представленного формулой (X), и его окисление. Далее представлены предпочтительные разновидности фенилпиридилметанола, представленного формулой (X), который является промежуточным соединением для получения соединения, представленного формулой (I). (1) Фенилпиридилметанол, представленный формулой (X’) где X, n и R1 имеют указанные ранее для формулы (I) значения, R2′ представляет замещаемую алкильную группу, замещаемую алкоксигруппу, замещаемую арилоксигруппу, замещаемую циклоалкоксигруппу или гидроксильную группу, р равно 1, 2 или 3; и R2” представляет замещаемую алкоксигруппу или гидроксильную группу, при условии, что, по крайней мере, два из R2′ и R2” могут содержать атом кислорода с образованием конденсированного кольца (исключая случай, когда пиридиновое кольцо замещено группой бензоила в 2-положении; пиридиновое кольцо замещено алкоксигруппой, гидроксильной группой или бензилоксигруппой в 3-положении; и n равно 1, р равно 1). (2) Фенилпиридилметанол по вышеуказанному п.(1), представленный формулой (X”) где Х представляет атом галогена, нитрогруппу, замещаемую алкоксигруппу, замещаемую арилоксигруппу, замещаемую циклоалкоксигруппу, замещаемую углеводородную группу, замещаемую алкилтиогруппу, цианогруппу, карбоксильную группу, которая может быть эстерифицирована или амидирована, или замещаемую аминогруппу; n равно 1, 2, 3 или 4; R1 представляет алкильную группу; R2′ представляет замещаемую алкильную группу, замещаемую алкоксигруппу, замещаемую арилоксигруппу или замещаемую циклоалкоксигруппу, р равно 1, 2 или 3, и каждый из R2” и R2”’ представляет замещаемую алкоксигруппу. (3) Фенилпиридилметанол по вышеуказанному п.(2), где Х представляет атом галогена, нитрогруппу, замещаемую алкоксигруппу, замещаемую циклоалкоксигруппу, алкильную группу, замещаемую алкилтиогруппу или замещаемую аминогруппу. (4) Фенилпиридилметанол по вышеуказанному п.(2) или (3), где пиридиновое кольцо замещено группой бензоила в 4-положении. (5) Фенилпиридилметанол по вышеуказанному п.(1), представленный формулой (X”’) где Х представляет атом галогена, замещаемую алкоксигруппу, алкильную группу, группу СF3 или алкилтиогруппу; n равно 1, 2, 3 или 4; R1 представляет алкильную группу; R2′ представляет замещаемую алкильную группу, замещаемую алкоксигруппу или замещаемую циклоалкоксигруппу; р равно 1, 2 или 3; и каждый из R2” и R2”’ представляет замещаемую алкоксигруппу. (6) Фенилпиридилметанол по вышеуказанному п.(5), представленный формулой (X””) где X представляет атом галогена, алкоксигруппу, алкильную группу, группу СF3 или алкилтиогруппу; n равно 1, 2 или 3; R1 представляет алкильную группу; R2′ представляет алкоксигруппу; р равно 1, 2 или 3; и каждый из R2” и R2”’ представляет алкоксигруппу. (7) Фенилпиридилметанол по вышеуказанному п.(5) или (6), где пиридиновое кольцо замещено группой бензоила в 4-положении. (8) Фенилпиридилметанол по вышеуказанному п.(6), представленный формулой (X””’) где В представляет -СХ4=, если А представляет -N=; В представляет -N=, если А представляет -СН=; каждый из Х1 и X2 независимо друг от друга представляет атом галогена, алкоксигруппу, алкильную группу, группу СF3 или алкилтиогруппу; X3 представляет атом водорода, атом галогена, алкоксигруппу, алкильную группу, группу СF3 или алкилтиогруппу; X4 представляет атом водорода, атом галогена, алкоксигруппу, алкильную группу, группу СF3 или алкилтиогруппу; R1 представляет алкильную группу; R2′ представляет алкоксигруппу; р равно 1, 2 или 3; и каждый из R2” и R2”’ представляет алкоксигруппу. (9) Фенилпиридилметанол по вышеуказанному п.(8), где А представляет -N=. Кроме того, в соединение, представленное формулой (I), можно дополнительно вводить заместители электрофильно или нуклеофильно. То есть соединение, представленное формулой (I), можно превратить в соединение, представленное формулой (I-а) или (I-b), что проиллюстрировано на следующей схеме. Кроме того, в соединение, представленное формулой (I), можно ввести заместитель радикально. Здесь в формуле (I-a) E представляет электрофильный реагент, а в формуле (I-b) Nu представляет нуклеофильный реагент. n’ и n” имеют указанные ранее для n значения. Реакция для получения соединения, представленного формулой (I-а), варьируется надлежащим образом в зависимости от электрофильного агента, и реакцию обычно ведут известными способами или представленным здесь способом. Например, можно использовать вышеуказанный способ 1. Нуклеофильное замещение для получения соединения, представленного формулой (I-b), варьируется надлежащим образом в зависимости от нуклеофильного агента, и реакцию обычно ведут известными способами или представленным здесь способом. Например, в случае этилоксинуклеофильного реагента предпочтительно вести реакцию в присутствии инертного растворителя, такого как этанол или диоксан, толуол или октан, при температуре реакции от 0 до 120°С в течение соответствующего промежутка времени. Этилоксинуклеофильный реагент используют в количестве от 0,1 до 10 мольных эквивалентов, предпочтительно от 0,5 до 5 мольных эквивалентов. Кроме того, соединение, представленное формулой (1-с) (соединение формулы (I), где Х представляет атом галогена), можно далее превратить в соединение, представленное формулой (I-d) в результате удаления заместителя-галогена, что представлено на следующей схеме. В реакции, проиллюстрированной далее на схеме, можно соответствующим образом использовать каталитическое гидрирование, реакцию переноса водорода или реакцию восстановления металлом. На схеме Hal представляет атом галогена. Каталитическое гидрирование можно осуществить в присутствии катализатора в атмосфере газообразного водорода при нормальном давлении или при повышенном давлении в соответствующем растворителе. Катализатором, который можно использовать, может быть, например, каталитическая система, включающая платину, палладий, родий, рутений, никель или иридий. В качестве растворителя можно использовать, например, воду, спирт (такой как метанол или этанол), этилацетат, уксусную кислоту, диоксан, эфир, бензол или гексан. В таком случае катализатор используют в количестве от 0,01 до 1,2 молей в расчете на соединение, представленное формулой (I-c). Кроме того, реакцию можно вести в присутствии основания, такого как триэтиламин или бикарбонат натрия. Кроме того, можно использовать известную реакцию восстановления, такую как реакция переноса водорода (например, используя палладий-на-угле, аммонийформиат в качестве источника водорода или дигидрофосфат натрия), или реакцию восстановления металлом (например, дииодидом самария). Далее представлены конкретные примеры получения производных бензоилпиридина, представленных формулой (I), и промежуточных соединений для их получения (названия соединений в примерах получения основаны на номенклатуре IUPAC, и положения заместителей могут отличаться от положений, представленных в приводимых далее таблицах). Пример получения 1 Получение 3-(2,3,4-триметокси-6-метилбензоил)-2,6-дихлор-4-трифторметилпиридина (соединение №3) (а) 14 мл (20 ммоль) н-бутиллития (1,5 М гексановый раствор) добавляют по каплям при 0°С к раствору, содержащему 2,9 мл (21 ммоль) диизопропиламина, растворенного в 62 мл тетрагидрофурана, с последующим перемешиванием в течение 30 мин. Раствор охлаждают до -20°С, к полученному добавляют раствор, содержащий 4,0 г (19 ммоль) 2,6-дихлор-4-трифторметилпиридина, растворенного в 5 мл тетрагидрофурана, с последующим перемешиванием в течение 5 мин, и к полученному добавляют раствор, содержащий 3,8 г (18 ммоль) 2,3,4-триметокси-6-метилбензальдегида, растворенного в 7 мл тетрагидрофурана, с последующим перемешиванием в течение 1,5 час. К смеси добавляют 30 мл воды для окончания реакции и тетрагидрофуран отгоняют при пониженном давлении. Осуществляют экстрагирование этилацетатом, органический слой сушат над безводным сульфатом натрия, фильтруют и растворитель отгоняют при пониженном давлении. Полученный таким образом сырой продукт очищают на хроматографической колонке с силикагелем, получая 6,2 г (выход 81%) (2,3,4-триметокси-6-метилфенил)(2,6-дихлор-4-трифторметил-3-пиридил)метанола (маслянистое вещество коричневого цвета). (b) 14 г диоксида магния добавляют к раствору, содержащему 5,4 г (2,3,4-триметокси-6-метилфенил)(2,6-дихлор-4-трифторметил-3-пиридил)метанола, полученного на стадии (а) и растворенного в 140 мл толуола, с последующим перемешиванием при кипении с обратным холодильником при нагревании в течение 6 час. Смесь охлаждают, затем фильтруют и толуол отгоняют при пониженном давлении, получая 4,4 г (выход 81%) 3-(2,3,4-триметокси-6-метилбензоил)-2,6-дихлор-4-трифторметилпиридина соединение №3; Т.пл. 81-83°С). Пример получения 2 Получение 3-(2,3,4-триметокси-6-метилбензоил)-2-хлор-4-трифторметилпиридина (соединение №11) и 3-(2,3,4-триметокси-6-метилбензоил)-4-трифторметилпиридина (соединение №7) 2,4 мл (17 ммоль) триэтиламина и 0,3 г 5% палладия-на-угле добавляют к раствору, содержащему 3,4 г (8,0 ммоль) 3-(2,3,4-триметокси-6-метилбензоил)-2,6-дихлор-4-трифторметилпиридина (соединение №3), полученного в примере получения 1, растворенного в 50 мл метанола, с последующим перемешиванием в атмосфере водорода в течение 6,5 час. Смесь фильтруют, добавляют к ней 50 мл воды и метанол отгоняют при пониженном давлении. Осуществляют экстрагирование этилацетатом, органический слой сушат над безводным сульфатом натрия, фильтруют и растворитель отгоняют при пониженном давлении. Полученный таким образом сырой продукт очищают на хроматографической колонке с силикагелем, получая 1,7 г (выход 55%) 3-(2,3,4-триметокси-6-метилбензоил)-2-хлор-4-трифторметилпиридина (соединение №11; Т.пл. 110-112°С) и 1,1 г (выход 37%) 3-(2,3,4-триметокси-6-метилбензоил)-4-трифторметилпиридина (соединение №7; Т.пл. 59-62°С). Пример получения 3 Получение 4-(2,3,4-триметокси-6-метилбензоил)-2,5-дихлор-3-трифторметилпиридина (соединение №90) (а) 17 мл (25 ммоль) н-бутиллития (1,5 М гексановый раствор) по каплям добавляют при 0°С к раствору, содержащему 3,6 мл (25 ммоль) диизопропиламина, растворенного в 60 мл диэтилового эфира, с последующим перемешиванием в течение 45 мин. Раствор охлаждают до -78°С, к полученному добавляют раствор, содержащий 6,0 г (24 ммоль) 2,3,6-трихлор-5-трифторметилпиридина, растворенного в 8 мл диэтилового эфира, с последующим перемешиванием в течение 5 мин, и к полученному добавляют раствор, содержащий 5,0 г (24 ммоль) 2,3,4-триметокси-6-метилбензальдегида, растворенного в 12 мл толуола, с последующим перемешиванием в течение 1 час. К смеси добавляют 30 мл воды для окончания реакции, водный слой экстрагируют этилацетатом, и затем органический слой сушат над безводным сульфатом натрия, фильтруют и растворитель отгоняют при пониженном давлении, получая (2,3,4-триметокси-6-метилфенил)(2,3,6-трихлор-5-трифторметил-4-пиридил)метанол (Т.пл. 131-135°С). (b) 2,7 мл (19 ммоль) триэтиламина и 0,9 г 5% палладия-на-угле добавляют к раствору, содержащему (2,3,4-триметокси-6-метилфенил) (2,3,6-трихлор-5-трифторметил-4-пиридил)метанол, полученный на стадии (а), растворенный в 200 мл метанола, с последующим перемешиванием в атмосфере водорода в течение 14 час. Смесь фильтруют, добавляют к ней 30 мл воды и метанол отгоняют при пониженном давлении. Осуществляют экстрагирование этилацетатом, органический слой сушат над безводным сульфатом натрия, фильтруют и растворитель отгоняют при пониженном давлении. Полученный таким образом сырой продукт очищают на хроматографической колонке с силикагелем, получая 2,38 г (выход 24%) (2,3,4-триметокси-6-метилфенил)(2,5-дихлор-3-трифторметил-4-пиридил)метанола (Т. пл.162-165°С). (c) 14 г диоксида марганца добавляют к раствору, содержащему 3,5 г (8,2 ммоль) (2,3,4-триметокси-6-метилфенил)(2,5-дихлор-3-трифторметил-4-пиридил)метанола, полученного на стадии (b), растворенного в 100 мл толуола, с последующим перемешиванием при кипении с обратным холодильником при нагревании в течение 6 час. Смесь охлаждают, затем фильтруют и толуол отгоняют при пониженном давлении. Полученный таким образом сырой продукт очищают на хроматографической колонке с силикагелем, получая 3,1 г (выход 89%) 4-(2,3,4-триметокси-6-метил-бензоил-2,5-дихлор-3-трифторметилпиридин (соединение №90; Т.пл. 106-109°С). Пример получения 4 Получение 3-(4,5-диметокси-2-метилбензоил)-2-метокси-4-трифторметилпиридина (соединение №32) 0,9 г (16 ммоль) метоксида натрия добавляют к раствору, содержащему 1,5 г (4,2 ммоль) 3-(4,5-диметокси-2-метилбензоил)-2-хлор-4-трифторметилпиридина, синтезированного по способу примера получения 1 и растворенного в 20 мл толуола, с последующим перемешиванием при кипении с обратным холодильником при нагревании в течение 4 час. Смесь охлаждают и затем добавляют к ней 20 мл воды для окончания реакции, водный раствор экстрагируют этилацетатом, органический слой сушат над безводным сульфатом натрия и фильтруют, используя лепешку силикагеля. Растворитель отгоняют при пониженном давлении, получая 1,5 г (выход 99%) 3-(4,5-диметокси-2-метилбензоил)-2-метокси-4-трифторметилпиридина (соединение №32; Т.пл. 125-127°С). Пример получения 5 Получение 3-[4,5-(метилендиокси)-2-метилбензоил]-2-хлор-4-трифторметилпиридина (соединение №13) (а) 3,2 мл (62 ммоль) брома по каплям добавляют при 0°С к раствору, содержащему 7,0 мл (58 ммоль) 3,4-(метилендиокси)толуола и 5,5 мл (68 ммоль) пиридина, растворенного в 110 мл дихлорметана, с последующим перемешиванием в течение 30 мин, и температуру повышают до комнатной, с последующим перемешиванием в течение 22 час. Смесь промывают водным раствором гидроксида натрия, сушат над безводным сульфатом натрия, фильтруют и растворитель отгоняют при пониженном давлении. Полученный таким образом сырой продукт очищают на хроматографической колонке с силикагелем, получая 13 г (выход 99%) 2-бром-4,5-(метилендиокси)толуола. (b) 13 мл (20 ммоль) н-бутиллития (1,5 М гексановый раствор) по каплям добавляют при -78°С к раствору, содержащему 4,0 г (19 ммоль) 2-бром-4,5-(метилендиокси)толуола, растворенного в 50 мл тетрагидрофурана, с последующим перемешиванием в течение 30 мин, и к полученному добавляют 1,5 мл (19 ммоль) диметилформамида с последующим перемешиванием в течение 70 мин. К смеси добавляют 30 мл воды для окончания реакции и тетрагидрофуран отгоняют при пониженном давлении. Осуществляют экстрагирование хлороформом, органический слой сушат над безводным сульфатом натрия, фильтруют, используя лепешку силикагеля, и растворитель отгоняют при пониженном давлении, получая 3,1 г (выход 99%) 2-метил-4,5-(метилендиокси)бензальдегида (Т.пл. 84-86°С). (c) Используя 1,5 г (8,3 ммоль) 2-хлор-4-трифторметилпиридина и 1,4 г (8,2 ммоль) 2-метил-4,5-(метилендиокси)бензальдегида, по способу стадии (а) примера получения 1 получают 2,1 г (выход 73%) (2-метил-4,5-(метилендиокси)фенил)(2-хлор-4-трифторметил-3-пиридил)метанола (Т.пл. 127-130°С). (d) Используя 1,5 г (4,3 ммоль) (2-метил-4,5-(метилендиокси)фенил)(2-хлор-4-трифторметил-3-пиридил)метанола, полученного на стадии (с), и 8,0 г (92 ммоль) диоксида марганца по способу стадии (b) примера получения 1, получают 0,3 г (выход 22%) 3-[4,5-(метилендиокси)-2-метилбензоил]-2-хлор-4-трифторметилпиридина (соединение №13; Т.пл. 119-122°С). Пример получения 6 Получение 3-(5-бензилокси-4-метокси-2-метилбензоил)-2-хлор-4-трифторметилпиридина (соединение №27) (а) Раствор 2-метокси-4-метилфенола (6,91 г) в диметилформамиде (15 мл) по каплям добавляют к суспензии гидрид натрия (2,4 г) в диметилформамиде (20 мл) при охлаждении льдом с последующим перемешиванием в течение 30 мин. К полученному добавляют по каплям диметилфорамидный (15 мл) раствор бензилбромида (9,41 г) и к полученному добавляют каталитическое количество тетрабутиламмонийбромида с последующим перемешиванием при той же температуре в течение 30 мин. Температуру повышают до комнатной, и перемешивание продолжают в течение ночи. Реакционный раствор выливают в воду (250 мл) и экстрагируют этилацетатом (100 мл) трижды. Этилацетатную фазу промывают водой (100 мл) трижды и затем промывают водным раствором хлорида натрия (100 мл). После сушки над сульфатом магния растворитель отгоняют при пониженном давлении, остаток очищают на хроматографической колонке с силикагелем (гексан-этилацетат), получая 11,4 г 4-бензилокси-3-метокситолуола (Т.пл. 38-39°С) количественно, и строение продукта подтверждают с помощью спектра ядерного магнитного резонанса. (b) 4-бензилокси-3-метокситолуол (8,0 г) растворяют в диметилформамиде (30 мл) и к полученному по каплям добавляют диметилформамидный раствор (15 мл) N-бромсукцинимида (6,36 г) с последующим перемешиванием при комнатной температуре в течение ночи. Реакционный раствор выливают в ледяную воду (400 мл) и выпавшие при этом в осадок кристаллы собирают фильтрованием, соответствующим образом промывают водой и сушат в течение ночи, получая 10,64 г 4-бензилокси-2-бром-5-метокситолуола (Т.пл. 110-111°С) практически количественно, и строение этого соединения подтверждают с помощью спектра ядерного магнитного резонанса. (c) Гексановый раствор (17 мл) н-бутиллития по каплям добавляют к тетрагидрофурановому раствору (190 мл) 4-бензилокси-2-бром-5-метокситолуола (7,83 г) при -78°С в течение 20 мин с последующим перемешиванием при той же температуре в течение 1 часа. К полученному по каплям добавляют тетрагидрофурановый раствор (10 мл) диметилформами да (3,73 г) при -78°С с последующим перемешиванием при той же температуре в течение 1 часа. Температуру постепенно повышают до комнатной температуры, и перемешивание продолжают в течение ночи. Реакционный раствор выливают в водный раствор аммонийхлорида (200 мл) и экстрагируют этилацетатом (150 мл) дважды. Этилацетатную фазу промывают водным раствором хлорида натрия (100 мл) дважды, сушат над сульфатом магния и растворитель отгоняют при пониженном давлении. Остаток очищают на хроматографической колонке с силикагелем (гексан-этилацетат), получая 3,14 г (выход 48%) 5-бензилокси-4-метокси-2-метилбензальдегида (Т.пл. 107-109°С), и его строение подтверждают с помощью спектра ядерного магнитного резонанса. (d) Гексановый раствор (11,4 мл) н-бутиллития по каплям добавляют к тетрагидрофурановому раствору (45 мл) диизопропиламина (2,81 г) при 0°С с последующим перемешиванием в течение 1 часа до получения тетрагидрофуранового раствора литийдиизопропиламида. Раствор охлаждают до -50°С и к полученному постепенно добавляют тетрагидрофурановый раствор (7,5 мл) 2-хлор-4-трифторметилпиридина (2,81 г) с последующим перемешиванием при той же температуре в течение 30 мин. Раствор охлаждают до -78°С и к полученному постепенно добавляют тетрагидрофурановый раствор (37,5 мл) 5-бензилокси-4-метокси-2-метилбензальдегида (3,97 г) с последующим перемешиванием при той же температуре в течение 1 часа. К полученному добавляют насыщенный водный раствор аммонийхлорида (50 мл), температуру повышают до комнатной температуры, смесь выливают в насыщенный водный раствор бикарбоната натрия (50 мл), экстрагируют этилацетатом (150 мл) дважды. Этилацетатную фазу промывают водным раствором хлорида натрия (100 мл), сушат над сульфатом магния и растворитель отгоняют при пониженном давлении. Остаток очищают на хроматографической колонке с силикагелем (гексан-этилацетат), получая 6,48 г (выход 96%) (5-бензилокси-4-метокси-2-метилфенил)(2-хлор-4-трифторметил-3-пиридил)метанола в виде красно-желтого маслянистого вещества, строение которого подтверждают с помощью спектра ядерного магнитного резонанса. (e) (5-бензилокси-4-метокси-2-метилфенил)(2-хлор-4-трифторметил-3-пиридил) метанол (5,9 г) растворяют в смешанном растворителе, состоящем из безводного метиленхлорида (50 мл) и ацетонитрила (5 мл), и к полученному последовательно добавляют тетрапропиламмонийперрутенат (95 мг), N-метилморфолин-N-оксид (2,38 г) и молекулярные сита 4А (6,8 г) с последующим перемешиванием в потоке аргона при комнатной температуре в течение трех ночей. Реакционную смесь отгоняют при пониженном давлении, полученный таким образом остаток суспендируют в метиленхлориде и фильтруют через целит; остаток соответствующим образом промывают метиленхлоридом (200 мл). Растворитель отгоняют при пониженном давлении, и остаток очищают на хроматографической колонке с силикагелем (гексан-этилацетат), получая 4,93 г (выход 84%) 3-(5-бензилокси-4-метокси-2-метилбензоил)-2-хлор-4-трифторметилпиридина (соединение №27; Т.пл. 116-117°С), строение которого подтверждают с помощью спектра ядерного магнитного резонанса. Пример получения 7 Получение 3-(2,3,4-триметокси-6-метилбензоил)-2-метилтио-4-трифторметилпиридина (соединение №50) Метантиолат натрия (0,32 г) добавляют к диметилформамидному раствору (15 мл) 0,9 г 3-(2,3,4-триметокси-6-метилбензоил)-2-хлор-4-трифторметилпиридина (соединение №11) при комнатной температуре с последующим перемешиванием в течение 1 часа. Смесь выливают в воду (50 мл) и экстрагируют этилацетатом. Этилацетатную фазу сушат над сульфатом натрия, растворитель отгоняют при пониженном давлении, и остаток очищают на хроматографической колонке с силикагелем (гексан-этилацетат), получая 0,54 г (выход 58%) 3-(2,3,4-триметокси-6-метилбензоил)-2-метилтио-4-трифторметилпиридина (соединение №50; бледно-желтое маслянистое вещество), строение которого подтверждают с помощью спектра ядерного магнитного резонанса. Пример получения 8 Получение 5-(2,3,4-триметокси-6-метилбензоил)-3-ацетил-2, 6-дихлор-4-трифторметилпиридина (соединение №62) (a) 9,6 мл (14 ммоль) н-бутиллития (1,5 М гексановый раствор) по каплям добавляют к тетрагидрофурановому (16 мл) раствору 2,0 мл (14 ммоль) диизопропиламина при 0°С с последующим перемешиванием в течение 30 мин. Раствор охлаждают до -50°С, к полученному добавляют тетрагидрофурановый (11 мл) раствор 2,9 г (7 ммоль) (2,3,4-триметокси-6-метилфенил)(2,6-дихлор-4-трифторметил-3-пиридил)метанола с последующим перемешиванием в течение 30 мин, затем раствор охлаждают до -78°С и к полученному добавляют избыточное количество ацетальдегида с последующим перемешиванием в течение 2 час. К смеси добавляют 30 мл воды для окончания реакции, и тетрагидрофуран отгоняют при пониженном давлении. Смесь экстрагируют этилацетатом, органический слой сушат над безводным сульфатом натрия, фильтруют и растворитель отгоняют при пониженном давлении. Полученный таким образом сырой продукт очищают на хроматографической колонке с силикагелем, получая 2,5 г (выход 78%) (2,3,4-триметокси-6-метилфенил)(2,6-дихлор-5-(1-гидроксиэтил)-4-трифторметил-3-пиридил)метанола. (b) 10 г диоксида марганца добавляют к толуольному (80 мл) раствору 2,3 г (5 ммоль) (2,3,4-триметокси-6-метилфенил)(2,6-дихлор-5-(1-гидроксиэтил)-4-трифторметил-3-пиридил)метанола, полученного на стадии (а), с последующим перемешиванием при кипении с обратным холодильником при нагревании в течение 1 часа. Реакционный раствор охлаждают до комнатной температуры, затем фильтруют, и толуол отгоняют при пониженном давлении. Полученный таким образом сырой продукт очищают на хроматографической колонке с силикагелем, получая 1,5 г (выход 66%) 5-(2,3,4-триметокси-6-метилбензоил)-3-ацетил-2,6-дихлор-4-трифторметилпиридина (соединение №62; Т.пл. 109-112°С). Пример получения 9 Получение 4-(2,3,4-триметокси-6-метилбензоил)-2-хлор-3-трифторметил-5-метоксипиридина (соединение №123) (а) 70,0 мл (106 ммоль) н-бутиллития (1,5 М гексановый раствор) по каплям добавляют к раствору 15,0 мл (107 ммоль) диизопропиламина в диэтиловом эфире (120 мл) при 0°С с последующим перемешиванием в течение 1 часа. Раствор охлаждают до -78°С, к полученному добавляют раствор 22,1 г (102 ммоль) 2,3-дихлор-5-трифторметилпиридина в диэтиловом эфире (10 мл) с последующим перемешиванием в течение 30 мин и затем к полученному добавляют толуольный раствор (40 мл) 21,0 г (100 ммоль) 2,3,4-триметокси-6-метилбензальдегида с последующим перемешиванием в течение 2 часов. К смеси добавляют 30 мл воды для окончания реакции, водный слой экстрагируют этилацетатом, и затем органический слой сушат над безводным сульфатом натрия, фильтруют и растворитель отгоняют при пониженном давлении. Полученный таким образом сырой продукт очищают на хроматографической колонке с силикагелем, получая 24,8 г (выход 58%) (2,3,4-триметокси-6-метилфенил)(2,3-дихлор-5-трифторметил-4-пиридил)метанола (Т.пл. 95-98°С). (b) 2,1 г 5% палладия-на-угле добавляют к метанольному раствору (200 мл) 24,8 г (58,1 ммоль) (2,3,4-триметокси-6-метилфенил)(2,3-дихлор-5-трифторметил-4-пиридил)метанола, полученного на стадии (а), и 9,50 мл (68,2 ммоль) триэтиламина с последующим перемешиванием в атмосфере водорода в течение 4 час. Смесь фильтруют, добавляют к ней 50 мл воды и метанол отгоняют при пониженном давлении. Водный слой экстрагируют этилацетатом и органический слой сушат над безводным сульфатом натрия, фильтруют и растворитель отгоняют при пониженном давлении. Полученный таким образом сырой продукт очищают на хроматографической колонке с силикагелем, получая 15,9 г (выход 70%) (2,3,4-триметокси-6-метилфенил)(3-хлор-5-трифтор-метил-4-пиридил)метанола (Т.пл. 102-105°С). (c) 45 г диоксида марганца добавляют к толуольному раствору (220 мл) 15,9 г (40,6 ммоль) (2,3,4-триметокси-6-метилфенил) (3-хлор-5-трифторметил-4-пиридил)метанола, полученного на стадии (b), с последующим перемешиванием при кипении с обратным холодильником при нагревании в течение 2 час. Смесь фильтруют и растворитель отгоняют при пониженном давлении, получая 14,9 г (выход 94%) 4-(2,3,4-триметокси-6-метилбензоил)-3-хлор-5-трифторметилпиридина (соединение №102; Т.пл. 75-77°С). (d) 16,4 г (304 ммоль) метоксида натрия добавляют к толуольному раствору (150 мл) 18,5 г (47,5 ммоль) 4-(2,3,4-триметокси-6-метилбензоил)-3-хлор-5-трифторметилпиридина, полученного на стадии (с), и 16,6 мл (95,4 ммоль) гексаметилфосфортриамида с последующим перемешиванием при кипении с обратным холодильником при нагревании в течение 30 мин. К смеси добавляют воду для окончания реакции, водный слой экстрагируют этилацетатом и органический слой сушат над безводным сульфатом натрия, фильтруют и растворитель отгоняют при пониженном давлении. Полученный таким образом сырой продукт очищают на хроматографической колонке с силикагелем, получая 11,7 г (выход 64%) 4-(2,3,4-триметокси-6-метилбензоил)-3-метокси-5-трифторметилпиридина (соединение №122; Т.пл. 103-106°С). (e) 6,1 г (28 ммоль) м-хлорпербензойной кислоты (м-СРВА) добавляют к хлороформовому раствору (100 мл) 5,6 г (15 ммоль) 4-(2,3,4-триметокси-6-метилбензоил)-3-метокси-5-трифторметилпиридина (соединение №122) при 0°С с последующим перемешиванием при комнатной температуре в течение 18 час. Реакционный раствор промывают насыщенным водным раствором гидроксида натрия и растворитель отгоняют при пониженном давлении, получая 5,8 г (выход 99%) 4-(2,3,4-триметокси-6-метилбензоил)-3-метокси-5-трифторметилпиридин-N-оксида (Т.пл. 128-134°С). (f) 1,8 мл (19 ммоль) хлорокиси фосфора добавляют к 4 мл толуола и 8 мл диметилформамида при 0°С с последующим перемешиванием в течение 10 мин и к полученному добавляют 4,0 г (10 ммоль) 4-(2,3,4-триметокси-6-метилбензоил)-3-метокси-5-трифторметилпиридин-N-оксида с последующим перемешиванием в течение 20 мин. Перемешивание осуществляют при комнатной температуре в течение 2 час, и затем реакционный раствор выливают в ледяную воду для окончания реакции. Водный слой экстрагируют этилацетатом, затем органический слой сушат над безводным сульфатом натрия, фильтруют и растворитель отгоняют при пониженном давлении. Полученный таким образом сырой продукт очищают на хроматографической колонке с силикагелем, получая 3,57 г (выход 85%) 4-(2,3,4-триметокси-6-метилбензоил)-2-хлор-3-трифторметил-5-метоксипиридина (соединение №123; Т.пл. 117-119°С). Пример получения 10 Получение 4-(2,3,4-триметокси-6-метилбензоил)-2-бром-3-трифторметил-5-метоксипиридина (соединение №124) Используя 7,2 г (18 ммоль) 4-(2,3,4-триметокси-6-метилбензоил)-3-метокси-5-трифторметилпиридин-N-оксида, 7 мл толуола, 17 мл диметилформамида и 10 г (35 ммоль) бромокиси фосфора, по способу примера получения 9 стадии (f) получают 4,1 г (выход 49%) 4-(2,3,4-триметокси-6-метилбензоил)-2-бром-3-трифторметил-5-метоксипиридина (соединение №124; Т.пл. 145-147°С). Пример получения 11 Получение 4-(2,3,4-триметокси-6-метилбензоил)-2,3,5-трихлорпиридина (соединение №186) (а) 17,2 мл (26,7 ммоль) н-бутиллития (1,56 М гексановый раствор) по каплям добавляют к раствору 2,7 г (26,7 ммоль) диизопропиламина в диэтиловом эфире (20 мл) при 0°С с последующим перемешиванием в течение 1 час. Раствор охлаждают до -78°С, к полученному по каплям добавляют толуольный раствор 4,8 г (26,7 ммоль) 2,3,5-трихлорпиридина и затем к полученному по каплям добавляют толуольный раствор 5,0 г (24,0 ммоль) 2,3,4-триметокси-6-метилбензальдегида с последующим перемешиванием в течение 30 мин. Температуру доводят до комнатной температуры и перемешивание осуществляют далее в течение 1 часа. К смеси добавляют 30 мл воды для окончания реакции, и для экстрагирования добавляют этилацетат. Органический слой сушат над безводным сульфатом натрия, фильтруют и растворитель отгоняют при пониженном давлении. Полученный таким образом сырой продукт очищают на хроматографической колонке с силикагелем, получая 6,7 г (выход 72%) аморфного (2,3,4-триметокси-6-метилфенил)(2,3,5-трихлор-4-пиридил)метанола. (b) 16,2 г диоксида марганца добавляют к толуольному раствору (180 мл) 5,6 г (2,3,4-триметокси-6-метилфенил)(2,3,5-трихлор-4-пиридил)метанола, полученного на стадии (а), с последующим перемешиванием при кипении с обратным холодильником при нагревании в течение 3 час. После того как смесь охлаждают, ее фильтруют и растворитель отгоняют при пониженном давлении, получая 4,7 г (выход 87%) 4-(2,3,4-триметокси-6-метилбензоил)-2,3,5-трихлорпиридина (соединение №186; Т.пл. 60-61°С). Пример получения 12 Получение 4-(2,3,4-триметокси-6-метилбензоил)-3,5-дихлорпиридина (соединение №191) 4,6 г (6,9 ммоль) триэтиламина и 1,8 г 10% палладия-на-угле добавляют к метанольному раствору (280 мл) 17,8 г (4,6 ммоль) 4-(2,3,4-триметокси-6-метилбензоил)-2,3,5-трихлорпиридина (соединение №186) с последующим перемешиванием в атмосфере водорода при комнатной температуре в течение 7 часов. Смесь фильтруют и растворитель отгоняют при пониженном давлении. Полученный таким образом сырой продукт очищают на хроматографической колонке с силикагелем, получая 11,6 г (выход 72%) 4-(2,3,4-триметокси-6-метилбензоил)-3,5-дихлорпиридина (соединение №191; Т.пл. 109-111°С). Пример получения 13 Получение 4-(2,3,4-триметокси-6-метилбензоил)-3-хлор-5-метоксипиридина (соединение №244) 5,0 г (2,8 ммоль) гексаметилфосфортриамида и 1,1 г (2,1 ммоль) метоксида натрия добавляют к толуольному раствору (60 мл) 5,0 г (1,4 ммоль) 4-(2,3,4-триметокси-6-метилбензоил)-3,5-дихлорпиридина (соединение №191) с последующим перемешиванием при кипении с обратным холодильником при нагревании в течение 5 час. После того как смесь охлаждают, добавляют к ней 50 мл воды для окончания реакции и к полученному добавляют этилацетат для экстрагирования. Органический слой сушат над безводным сульфатом натрия, фильтруют и растворитель отгоняют при пониженном давлении. Полученный таким образом сырой продукт очищают на хроматографической колонке с силикагелем, получая 3,4 г (выход 69%) 4-(2,3,4-триметокси-6-метилбензоил)-3-хлор-5-метоксипиридина (соединение №244; бледно-желтое маслянистое вещество). Пример получения 14 Получение 4-(2,3,4-триметокси-6-метилбензоил)-2,3-дихлор-5-метоксипиридина (соединение №193) (а) Хлороформовый (60 мл) раствор 3,4 г (1 ммоль) 4-(2,3,4-триметокси-6-метилбензоил)-3-хлор-5-метоксипиридина (соединение №244) охлаждают льдом, к полученному добавляют 4,1 г (1,6 ммоль) м-хлорпербензойной кислоты с последующим перемешиванием при охлаждении льдом в течение 2 час, и перемешивание продолжают при комнатной температуре в течение 2 час. К смеси добавляют 30 мл 0,5 моль/л водного раствора гидроксида натрия для окончания реакции, органический слой сушат над безводным сульфатом натрия, фильтруют и растворитель отгоняют при пониженном давлении, получая 3,5 г (выход 85%) 4-(2,3,4-триметокси-6-метилбензоил)-3-хлор-5-метоксипиридин-N-оксида (Т. пл. 160-166°С). (b) 5 мл диметилформамида добавляют к 2,5 мл толуола, смесь охлаждают льдом и добавляют к ней по каплям 1,3 мл (1,4 ммоль) оксихлорида фосфора. Смесь перемешивают при охлаждении льдом в течение 10 мин, к полученному добавляют 2,5 г (0,7 ммоль) 4-(2,3,4-триметокси-6-метилбензоил)-3-хлор-5-метоксипиридин-N-оксида. После того как смесь перемешивают при охлаждении льдом в течение 30 мин, температуру доводят до комнатной температуры с последующим перемешиванием в течение 2 час. К смеси добавляют 30 мл воды для окончания реакции и к полученному добавляют этилацетат для экстрагирования. Органический слой сушат над безводным сульфатом натрия, фильтруют и очищают на хроматографической колонке с силикагелем, получая 2,0 г (выход 76%) 4-(2,3,4-триметокси-6-метилбензоил)-2,3-дихлор-5-метоксипиридина (соединение №193; Т.пл. 98-99°С). Пример получения 15 Получение 4-(2,3,4-триметокси-6-метилбензоил)-2-бром-3-хлор-5-метоксипиридина (соединение №245) 5 мл диметилформамида добавляют к 2,5 мл толуола, смесь охлаждают льдом и добавляют к ней по каплям 0,7 г (0,2 ммоль) оксибромида фосфора. После того как смесь перемешивают при охлаждении льдом в течение 10 мин, к полученному добавляют 0,42 г (0,1 ммоль) 4-(2,3,4-триметокси-6-метилбензоил)-3-хлор-5-метоксипиридин-N-оксида, полученного в примере получения 14(а). После того как смесь перемешивают при охлаждении льдом в течение 30 мин, температуру доводят до комнатной температуры с последующим перемешиванием в течение 2 час. К смеси добавляют 10 мл воды для окончания реакции и к полученному добавляют этилацетат для осуществления экстрагирования. Органический слой сушат над безводным сульфатом натрия, фильтруют и очищают на хроматографической колонке с силикагелем, получая 0,32 г (выход 65%) 4-(2,3,4-триметокси-6-метилбензоил)-2-бром-3-хлор-5-метоксипиридина (соединение №245; Т.пл. 97-99°С). Пример получения 16 Получение 4-(2,3,4-триметокси-6-метилбензоил)-3-бром-5-метилпиридина (соединение №228) (а) 57,0 мл (88,9 ммоль) н-бутиллития (1,56 М гексановый раствор) по каплям добавляют к раствору 12,5 мл (89,2 ммоль) диизопропиламина в диэтиповом эфире (110 мл) при 0°С с последующим перемешиванием в течение 60 мин. Раствор охлаждают до -78°С, к полученному добавляют толуольный (80 мл) раствор 20 г (85 ммоль) 3,5-дибромпиридина с последующим перемешиванием в течение 5 мин, и затем к полученному добавляют толуольный (50 мл) раствор 21,0 г (100 ммоль) 2,3,4-триметокси-6-метилбензальдегида с последующим перемешиванием в течение 2 час. К смеси добавляют 50 мл воды для окончания реакции, водный слой экстрагируют этилацетатом, и органический слой сушат над безводным сульфатом натрия, фильтруют и растворитель отгоняют при пониженном давлении. Полученный таким образом сырой продукт очищают на хроматографической колонке с силикагелем, получая 11,8 г (выход 31%) (2,3,4-триметокси-6-метилфенил)(3,5-дибром-4-пиридил)метанола (желтое маслянистое вещество). (b) Тетрагидрофурановый (15 мл) раствор 2,0 г (4,6 ммоль) (2,3,4-триметокси-6-метилфенил)(3,5-дибром-4-пиридил)метанола, полученного на стадии (а), охлаждают до -78°С, к полученному по каплям добавляют 6,0 мл (9,4 ммоль) н-бутиллития (1,56 М гексановый раствор) с последующим перемешиванием в течение 5 мин, и к полученному добавляют 0,5 мл (8,0 ммоль) метилиодида с последующим перемешиванием в течение 2,5 час. Добавляют 20 мл воды, и тетрагидрофуран отгоняют при пониженном давлении. Водный слой экстрагируют этилацетатом, органический слой сушат над безводным сульфатом натрия, фильтруют и растворитель отгоняют при пониженном давлении. Полученный таким образом сырой продукт очищают на хроматографической колонке с силикагелем, получая 0,44 г (выход 25%) (2,3,4-триметокси-6-метилфенил)(3-бром-5-метил-4-пиридил)метанола. (c) 3 г диоксида марганца добавляют к толуольному (30 мл) раствору 0,43 г (1,1 ммоль) (2,3,4-триметокси-6-метилфенил) (3-бром-5-метил-4-пиридил)метанола, полученного на стадии (b), с последующим перемешиванием при кипении с обратным холодильником при нагревании в течение 2 час. Смесь фильтруют, растворитель отгоняют при пониженном давлении, и полученный таким образом сырой продукт очищают на хроматографической колонке с силикагелем, получая 0,23 г (выход 54%) 4-(2,3,4-триметокси-6-метилбензоил)-3-бром-5-метилпиридин (соединение №228; Т.пл. 88-93°С). Пример получения 17 Получение 3-(2,3,4-триметокси-6-метилбензоил)-2,6-дихлор-4-метилпиридина (соединение №320) (a)Синтез 3-циано-2,6-дихлор-4-метилпиридина Смесь 4,76 г (32 ммоль) 3-циано-2,6-дигидрокси-4-метилпиридина и 26 г (133 ммоль) дихлорида фенилфосфорной кислоты перемешивали при 150°С в течение 2 дней. Реакционную смесь выливали в ледяную воду (200 мл) и фильтровали при помощи целита с последующей промывкой толуолом (100 мл). Водный слой дважды экстрагировали этилацетатом (100 мл) и объединяли с органическим слоем с последующей промывкой водой (100 мл) (два раза) и насыщенным водным раствором хлорида натрия (100 мл), сушили над сульфатом магния и отгоняли растворитель при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (гексан-этилацетат) с получением 5,45 г бледно-желтых кристаллов 3-циано-2,6-дихлор-4-метилпиридина. 1H-ЯМР (400 МГц, СDСl3): (b) Синтез 2,6-дихлор-3-формил-4-метилпиридина 1,54 г (8,23 ммоль) 3-циано-2,6-дихлор-4-метилпиридина растворяли в метиленхлориде (40 мл), охлаждали до -70°С и затем медленно по каплям добавляли толуольный раствор (1М, 10 мл) гидрида диизобутилалюминия. После перемешивания при -78°С в течение 15 минут температуру жидкости повышали до комнатной температуры и продолжали перемешивание в течение ночи. Поскольку исходные вещества не были полностью израсходованы, жидкость снова охлаждали до -78°С, снова добавляли толуольный раствор гидрида диизобутилалюминия и продолжали перемешивание при -78°С в течение 15 минут и при комнатной температуре в течение ночи. Реакционную смесь выливали в 1н. раствор хлористоводородной кислоты и три раза экстрагировали метиленхлоридом (50 мл). Метиленхлоридный слой последовательно промывали насыщенным раствором бикарбоната натрия (100 мл), насыщенным водным раствором хлорида натрия (100 мл) и сушили над сульфатом магния, а затем отгоняли растворитель при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (гексан-этилацетат) с получением 0,81 г 2,6-дихлор-3-формил-4-метилпиридина. 1H-ЯМР (400 МГц, СDСl3): (с) Синтез (2,3,4-триметокси-6-метилфенил)(2,6-дихлор-4-метил-3-пиридил)метанола (Промежуточное соединение №302) Раствор 3,4,5-триметокси-2-бромтолуола (1,53 г, 5,9 ммоль) в тетрагидрофуране (25 мл) охлаждали до -78°С и по каплям добавляли н-BuLi (1,5 М раствор в гексане, 4 мл) с последующим перемешиванием при этой же температуре в течение 40 минут с получением 2,3,4-триметокси-6-метилфениллития. Затем к нему по каплям добавляли раствор 2,6-дихлор-3-формил-4-метилпиридина (0,93 г, 4,9 ммоль) в тетрагидрофуране (5 мл) с последующим перемешиванием при -78°С в течение 1 часа. Для завершения реакции добавляли насыщенный водный раствор хлорида аммония (15 мл) и температуру реакционной смеси повышали до комнатной, затем реакционную смесь выливали в насыщенный раствор бикарбоната натрия и два раза экстрагировали этилацетатом (100 мл). Этилацетатный слой промывали насыщенным водным раствором хлорида натрия (100 мл), сушили над сульфатом магния и отгоняли растворитель при пониженном давлении. Остаток очищали хроматографией на силикагеле (гексан-этилацетат) с получением 0,73 г бледно-желтого маслянистого (2,3,4-триметокси-6-метилфенил)(2,6-дихлор-4-метил-3-пиридил)метанола. 1H-ЯМР (400 МГц, СDСl3): (d) Синтез 3-(2,3,4-триметокси-6-метилбензоил)-2,6-дихлор-4-метилпиридина 1,06 г (2,85 ммоль) (2,3,4-триметокси-6-метилфенил)(2,6-дихлор-4-метил-3-пиридил)метанола растворяли в толуоле (50 мл) и добавляли 4,23 г (чистота: 88%, 42,8 ммоль) диоксида марганца с последующим нагреванием в течение 5 часов при температуре кипения с обратным холодильником. Жидкости давали охладиться и реакционную смесь фильтровали через целит, затем остаток промывали этилацетатом (100 мл). Фильтрат и промывочный раствор объединяли и растворитель отгоняли при пониженном давлении с последующей очисткой колоночной хроматографией на силикагеле (гексан-этилацетат) с получением 0,81 г бледно-желтого маслянистого 3-(2,3,4-триметокси-6-метилбензоил)-2,6-дихлор-4-метилпиридина. 1H-ЯМР (400 МГц, СDСl3): Пример получения 18 Получение 3-(2,3,4-триметокси-6-метилбензоил)-2,5-дихлор-4-метилпиридина (Соединение №321) (a) Синтез 2-амино-3-бром-5-хлорпиридина 25,34 г (197 ммоль) 2-амино-5-хлорпиридина и 16,16 г (197 ммоль) ацетата натрия растворяли в 120 мл уксусной кислоты и нагревали до 43°С, затем в течение 1,5 час добавляли по каплям при температуре 43-45°С 31,5 г (10,2 мл, 197 ммоль) брома в уксусной кислоте (10 мл). Реакционной смеси давали охладиться, а затем ее выливали в ледяную воду, раствор делали слабо щелочным (рН 8-9) путем добавления 1 н. гидроксида натрия (200 мл), а затем твердого гидроксида натрия и экстрагировали 100 мл этилацетата (5 раз). Этилацетатные слои объединяли, последовательно промывали два раза 100 мл 10% водного раствора сульфита натрия и 100 мл насыщенного водного раствора хлорида натрия, сушили над сульфатом натрия и фильтровали. Растворитель отгоняли при пониженном давлении с получением 40,0 г неочищенных кристаллов 2-амино-3-бром-5-хлорпиридина. 1H-ЯМР (400 МГц, СDСl3): (b) Синтез 3-бром-5-хлор-2-гидроксипиридина 40,0 г неочищенных кристаллов 2-амино-3-бром-5-хлорпиридина растворяли в растворе концентрированной хлористоводородной кислоты (52 мл) в воде (326 мл) и охлаждали на бане лед – хлорид натрия. При поддержании температуры раствора ниже -1°С постепенно в течение 80 минут по каплям добавляли водный раствор (109 мл) 13,6 г нитрита натрия (чистота 98%, 193 ммоль) и реакционную смесь перемешивали в течение 20 минут при 0°С, а затем в течение ночи при комнатной температуре. Полученные кристаллы собирали фильтрованием, промывали 100 мл воды, а затем 100 мл гексана и сушили при 40°С при пониженном давлении с получением 28,86 г неочищенных кристаллов 3-бром-5-хлор-2-гидроксипиридина. (c) Синтез 3-бром-2,5-дихлорпиридина 28,86 г неочищенных кристаллов 3-бром-5-хлор-2-гидроксипиридина растворяли в 35 мл диметилформамида и постепенно в течение 4 часов по каплям добавляли 31,7 г (19,3 мл) оксихлорида фосфора. Реакционную смесь нагревали до 70°С и перемешивали при этой же температуре в течение 3 дней. После того как смеси давали охладиться, ее выливали в ледяную воду (500 мл) и полученные кристаллы собирали фильтрованием, промывали в достаточной степени 300 мл воды и сушили при комнатной температуре и пониженном давлении в течение 8 часов и (после слегка заметной сублимации) при атмосферном давлении в течение 1 недели с получением 21,33 г неочищенных кристаллов 3-бром-2,5-дихлорпиридина. 1H-ЯМР (400 МГц, СDСl3): (d) Синтез 2,5-дихлор-3-формилпиридина 10,0 г (44,1 ммоль) 3-бром-2,5-дихлорпиридина в безводном диэтиловом эфире (250 мл) охлаждали до -78°С в атмосфере аргона и постепенно по каплям добавляли 29,4 мл н-бутиллития (1,5 М раствор в гексане, 44,1 ммоль). Полученную смесь перемешивали при -78°С в течение 1 часа. К полученному раствору 2,5-дихлор-3-пиридиллития постепенно по каплям добавляли 3,27 г (44,1 ммоль) этилформиата в 20 мл безводного диэтилового эфира и полученную смесь перемешивали при -78°С в течение 2 часов. После подтверждения прохождения реакции методом ТСХ реакцию заканчивали добавлением к реакционной смеси 23 мл насыщенного водного раствора хлорида аммония, а затем 200 мл воды. После нагревания до комнатной температуры реакционную смесь 3 раза экстрагировали 150 мл этилацетата и этилацетатные слои объединяли, промывали 200 мл насыщенного водного раствора хлорида натрия, сушили над сульфатом натрия и фильтровали. Растворитель отгоняли при пониженном давлении и остаток очищали на колонке с силикагелем с получением 4,83 г 2,5-дихлор-3-формилпиридина (выход 62%). 1H-ЯMP (400 МГц, СDСl3): (е) Синтез 2,5-дихлор-3-диметоксиметилпиридина 8,55 г (48,6 ммоль) 2,5-дихлор-3-формилпиридина растворяли в 60 мл метанола и нагревали в течение 12 часов с 15,47 г (146 ммоль) метилортоформиата и 0,61 г (2,4 ммоль) п-толуолсульфоната пиридиния при кипячении с обратным холодильником. После охлаждения летучие вещества отгоняли при пониженном давлении, смешивали с 100 мл воды и 3 раза экстрагировали 100 мл этилацетата. Этилацетатные слои объединяли, сушили над сульфатом магния, фильтровали и растворитель отгоняли при пониженном давлении. Остаток очищали на колонке с силикагелем с получением 9,60 г 2,5-дихлор-3-диметоксиметилпиридина (выход 89%). 1H-ЯМР (400 МГц, СDСl3): (f) Синтез 2,5-дихлор-3-диметоксиметил-4-метилпиридина 5,0 г (22,5 ммоль) 2,5-дихлор-3-диметоксиметилпиридина растворяли в 100 мл безводного тетрагидрофурана и охлаждали до -78°С в атмосфере аргона, затем добавляли по каплям 26,3 мл фениллития (0,94 М раствор в циклогексане-диэтиловом эфире, 24,7 ммоль). Полученную смесь перемешивали при -78°С в течение 4 часов с получением 2,5-дихлор-3-диметоксиметил-4-пиридиллития. Затем добавляли по каплям 6,39 г (45 ммоль) метилиодида в 25 мл тетрагидрофурана и смесь перемешивали при -78°С в течение 1 часа, а затем в течение ночи при комнатной температуре. После добавления 100 мл воды реакционную смесь экстрагировали 3 раза 100 мл этилацетата. Этилацетатные слои объединяли, промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом магния и фильтровали. Растворитель отгоняли и остаток очищали на колонке с силикагелем с получением 0,51 г 2,5-дихлор-3-диметоксиметил-4-метилпиридина (выход 9,6%). 1H-ЯМР (400 МГц, СDСl3): (g) Синтез 2,5-дихлор-3-формил-4-метилпиридина 0,51 г (2,16 ммоль) 2,5-дихлор-3-диметоксиметил-4-метилпиридина растворяли в 40 мл диметилформамида и перемешивали с 20 мл 1 н. хлористоводородной кислоты при комнатной температуре в течение ночи. После добавления 40 мл воды реакционную смесь нейтрализовали водным раствором гидроксида натрия и экстрагировали 3 раза 50 мл диэтилового эфира. Диэтилэфирные слои объединяли, сушили над сульфатом магния и фильтровали. Растворитель отгоняли и остаток очищали на колонке с силикагелем. Очищенный продукт затем подвергали деацетализации, поскольку анализ ЯМР показал присутствие остатка исходного вещества. Очищенный продукт растворяли в 1 мл уксусной кислоты и перемешивали при комнатной температуре в течение ночи. Протекание реакции отслеживали при помощи ВЭЖХ и оказалось, что некоторый процент исходного вещества остался непрореагировавшим. Поэтому реакционную смесь нагревали при 50-60°С, а затем при 70-80°С. Реакционной смеси давали охладиться и после добавления 20 мл воды реакционную смесь нейтрализовали водным раствором гидроксида натрия и экстрагировали 3 раза 50 мл диэтилового эфира. Слои диэтилового эфира объединяли, промывали 3 раза 50 мл воды, сушили над сульфатом магния и фильтровали. Растворитель отгоняли с получением 0,22 г 2,5-дихлор-3-формил-4-метилпиридина. 1H-ЯМР (400 МГц, СDСl3): (h) Синтез (2,3,4-триметокси-6-метилфенил)(2,5-дихлор-4-метил-3-пиридил)метанола К 0,30 г (1,16 ммоль) 3,4,5-триметокси-2-бромтолуола в тетрагидрофуране (6 мл), охлажденному до -78°С, в атмосфере аргона добавляли по каплям 0,75 мл н-бутиллития (1,5 М раствор в гексане, 1,13 ммоль) и полученную смесь перемешивали при этой температуре в течение 30 минут с получением 2,3,4-триметокси-6-метилфениллития. Затем добавляли по каплям 0,22 г (1,16 ммоль) 2,5-дихлор-3-формил-4-метилпиридина в тетрагидрофуране (2 мл) и полученную смесь перемешивали при -78°С в течение 1 часа. Для завершения реакции добавляли последовательно 1,5 мл насыщенного водного раствора хлорида аммония и 40 мл воды. Реакционную смесь нагревали до комнатной температуры и 3 раза экстрагировали 40 мл этилацетата. Этилацетатные слои объединяли, промывали 40 мл насыщенного водного раствора хлорида натрия, сушили над сульфатом магния и фильтровали. Растворитель отгоняли при пониженном давлении и остаток очищали на колонке с силикагелем с получением 0,14 г (2,3,4-триметокси-6-метилфенил)(2,5-дихлор-4-метил-3-пиридил)метанола (выход 32,4%). 1H-ЯМР (400 МГц, СDСl3): (i) Синтез 3-(2,3,4-триметокси-6-метилбензоил)-2,5-дихлор-4-метилпиридина (Соединение №321) 0,14 г (0,38 ммоль) (2,3,4-триметокси-6-метилфенил)(2,5-дихлор-4-метил-3-пиридил)метанола растворяли в 5 мл толуола и нагревали в течение 2 часов с 0,67 г (6,8 ммоль) активированного диоксида марганца при перемешивании и кипячении с обратным холодильником. После того как реакционной смеси давали охладиться, ее фильтровали через целит и фильтровальную лепешку промывали в достаточной степени толуолом, а затем этилацетатом. Фильтрат и промывочные жидкости объединяли и растворитель удаляли отгонкой при пониженном давлении, остаток очищали на колонке с силикагелем с получением 0,10 г желаемого продукта. Т.пл. 77-79°С. 1H-ЯМР (400 МГц, СDСl3): Пример получения 19 Получение 3-(2,3,4-триметокси-6-метилбензоил)-5-хлор-2-метилпиридина (Соединение №322) (а) Синтез 5-хлор-3-диметоксиметил-2-метилпиридина 3,0 г (13,5 ммоль) 2,5-дихлор-3-диметоксиметилпиридина растворяли в 30 мл 1,4-диоксана и нагревали в течение 6 часов с 5,6 г (40,5 ммоль) карбоната калия, 1,56 г (1,35 ммоль) тетракистрифенилфосфинпалладия и 1,69 г триметилбороксина (50% раствор в тетрагидрофуране, 6,75 ммоль) при перемешивании и кипячении с обратным холодильником. Поскольку было обнаружено присутствие непрореагировавшего исходного вещества, добавляли 0,84 г (3,35 ммоль) триметилбороксина и реакционную смесь нагревали при перемешивании и кипячении с обратным холодильником еще 6 часов. После того как реакционной смеси давали охладиться, ее фильтровали через целит и фильтровальную лепешку, промывали 15 мл этилацетата и 15 мл тетрагидрофурана. Фильтрат и промывочные жидкости объединяли, растворитель удаляли отгонкой при пониженном давлении и остаток очищали на колонке с силикагелем с получением 0,81 г 5-хлор-3-диметоксиметил-2-метилпиридина (выход 30%). 1H-ЯMP (400 МГц, СDСl3): (b) Синтез 5-хлор-3-формил-2-метилпиридина 0,81 г (4 ммоль) 5-хлор-3-диметоксиметил-2-метилпиридина растворяли в 1,6 мл уксусной кислоты и перемешивали при комнатной температуре в течение 3 часов, а затем при 60-70°С в течение 23,5 часов. Реакционной смеси давали охладиться и после добавления 30 мл воды ее нейтрализовали водным раствором гидроксида натрия и 3 раза экстрагировали 50 мл диэтилового эфира. Диэтилэфирные слои объединяли, промывали водой (50 мл), сушили над сульфатом магния и фильтровали. Растворитель отгоняли при пониженном давлении и остаток очищали на колонке с силикагелем с получением смеси желаемого продукта и исходного вещества приблизительно 1:1. Смесь растворяли в 5 мл уксусной кислоты и перемешивали при 60-70°С в течение 23,5 час. Реакционной смеси давали охладиться, а затем подвергали обработке и очистке, как указано выше, с получением 0,30 г 5-хлор-3-формил-2-метилпиридина (выход 48%). 1H-ЯМР (400 МГц, СDСl3): (с) Синтез (2,3,4-триметокси-6-метилфенил)(5-хлор-2-метил-3-пиридил)метанола К 0,50 г (1,91 ммоль) 3,4,5-триметокси-2-бромтолуола в тетрагидрофуране (10 мл), охлажденному до -78°С, в атмосфере аргона добавляли по каплям 1,3 мл н-бутиллития (1,5 М раствор в гексане, 1,95 ммоль) и полученную смесь перемешивали при этой же температуре в течение 30 минут с получением 2,3,4-триметокси-6-метилфениллития. Затем добавляли по каплям 0,30 г (1,93 ммоль) 5-хлор-3-формил-2-метилпиридина в тетрагидрофуране (3 мл) и полученную смесь перемешивали при -78°С в течение 2 часов. Для завершения реакции последовательно добавляли 26 мл насыщенного водного раствора хлорида аммония и 70 мл воды. Реакционную смесь нагревали до комнатной температуры и 3 раза экстрагировали 70 мл этилацетата. Этилацетатные слои объединяли, промывали 70 мл насыщенного водного раствора хлорида натрия, сушили над сульфатом магния и фильтровали. Растворитель отгоняли при пониженном давлении и остаток очищали на колонке с силикагелем с получением 0,33 г (2,3,4-триметокси-6-метилфенил)(5-хлор-2-метил-3-пиридил)-метанола (выход 51,4%). 1H-ЯМР (400 МГц, СDСl3): (d) Синтез 3-(2,3,4-триметокси-6-метилбензоил)-5-хлор-2-метилпиридина (Соединение №322) 0,33 г (0,98 ммоль) (2,3,4-триметокси-6-метилфенил)(5-хлор-2-метил-3-пиридил)метанола растворяли в 12 мл толуола и нагревали в течение 2 часов при перемешивании и кипячении с обратным холодильником с 1,73 г (17,5 ммоль) активированного диоксида марганца. После того как реакционной смеси давали охладиться, ее фильтровали через целит и фильтровальную лепешку промывали в достаточной степени толуолом, а затем этилацетатом. Фильтрат и промывочные жидкости объединяли, отгоняли при пониженном давлении для удаления растворителя и остаток очищали на колонке с силикагелем с получением 0,22 г желаемого продукта (выход 67%). Т.пл. 49-50°С. 1H-ЯМР (400 МГц, СDСl3): Пример получения промежуточного соединения Далее представлен пример получения 2,3,4-триметокси-6-метилбензальдегида, который используют в качестве промежуточного соединения в вышеуказанных примерах получения 1, 3, 9, 11 и 16. Получение 2,3,4-триметокси-6-метилбензальдегида 128 г (0,7 моль) 3,4,5-триметокситолуола, растворенного в сухом метиленхлориде (100 мл), по каплям постепенно добавляют к раствору 112 г (0,84 моль) алюминийхлорида в сухом метиленхлориде (500 мл) при охлаждении льдом. Смесь перемешивают при той же температуре в течение 45 мин, к ней постепенно по каплям добавляют раствор 88,5 г (0,77 моль) дихлорметилметилового эфира в сухом метиленхлориде в течение более 2 час. Перемешивание продолжают при той же температуре в течение 2 часов, и смесь постепенно доводят до комнатной температуры с последующим перемешиванием при комнатной температуре в течение ночи. Реакционную смесь выливают в 1 л ледяной воды, метиленхлоридную фазу выделяют, и водную фазу дважды экстрагируют 200 мл метиленхлорида. Экстракт и метиленхлоридную фазу объединяют, последовательно промывают 200 мл воды, 200 мл насыщенного водного раствора бикарбоната натрия, сушат над безводным сульфатом магния и растворитель отгоняют при пониженном давлении. В остаток вводят зародыши для кристаллизации и полученные кристаллы собирают фильтрованием, промывают гексаном и сушат воздухом, получая 128 г 2,3,4-триметокси-6-метилбензальдегида (Т.пл. 55-57°С). Соединения, полученные по способам примеров получения 1-19, представлены в приводимых далее таблицах 1-18. Соединения, представленные формулами с (I-1) до (I-9) в таблицах являются следующими соединениями. Кроме того, в таблицах Me представляет метильную группу, Et представляет этильную группу, Бутил представляет бутильную группу, изо-Пропил представляет изопропильную группу, Ph представляет фенильную группу, Аллил представляет аллильную группу, с-Гексил представляет циклогексильную группу, Бензил представляет бензильную группу, Пропаргил представляет пропаргильную группу и Пентил представляет пентильную группу.
Соединения, представленные формулой (X), которые используют в качестве промежуточных соединений, полученные по способам в соответствии с примерами получения 1, 3, 5, 6, 8, 9, 11 и 16, представлены в следующих таблицах 19-36. Соединения, представленные общими формулами (Х-1) до (Х-9) в таблицах, являются следующими соединениями. Кроме того, в этих таблицах Me представляет метильную группу, Et представляет этильную группу, Бутил представляет бутильную группу, изо-Пропил представляет изопропильную группу, Ph представляет фенильную группу, Аллил представляет аллильную группу, с-Гексил представляет циклогексильную группу, Бензил представляет бензильную группу, Пропаргил представляет пропаргильную группу и Пентил представляет пентильную группу.
Дополнение к таблице 36: данные для соединений табл. 36
Производное бензоилпиридина, представленное формулой (I), или его соль можно использовать в качестве активного ингредиента или фунгицида, особенно в качестве активного ингредиента для сельскохозяйственного и садоводческого фунгицида. В качестве сельскохозяйственного и садоводческого фунгицида оно эффективно для борьбы с такими заболеваниями, как пирикуляриоз, коричневая пятнистость или ризоктониоз влагалищ риса (Oryza sativa); настоящая мучнистая роса, парша, ржавчина, снежная плесень, пыльная головня, глазковая пятнистость, пятнистость листьев или пятнистость чешуек ячменя (Hordeum vulgare); меланоз или парша цитрусовых (Citrus); серая гниль, настоящая мучнистая роса, альтернариозная пятнистость листьев или парша яблок (Malus pumila); парша или черная пятнистость груш (Pyrus serotina, Pyrus ussuriensis, Pyrus coiroiunis); ризоктониоз, парша или вызываемая возбудителем Fomitopsis гниль персиков (Prunus persica); антракноз, гломереллезная гниль, настоящая мучнистая роса или ложная мучнистая роса винограда (Vitis vinifera); антракноз или круговая пятнистость листьев японской хурмы (Diospyros kaki); антракноз, настоящая мучнистая роса, черная микосфереллезная гниль или ложная мучнистая роса тыквы (Cucumis melo); бурая пятнистость, плесень листьев или фитофтороз томатов (Lycopersicon esculentum); пятнистость кресса (Brassica sp., Raphanus sp., etc); бурая пятнистость или фитофтороз картофеля (Solanum tuberosum); настоящая мучнистая роса земляники (Fragaria chiloensis); серая плесень или стеблевая гниль различных злаков. Оно оказывает превосходное действие особенно в отношении борьбы с настоящей мучнистой росой ячменя и овощей и пирикуляриозом риса. Кроме того, оно также эффективно для борьбы с почвенными заболеваниями, вызываемыми фитопатогенными грибами, такими как Fusarium, Pythium, Rhizoctonia, Verticillium и Plasmodiophora. Соединение настоящего изобретения может быть использовано в комбинации с сельскохозяйственными вспомогательными веществами для получения различных препаратов фунгицидов, содержащих это соединение, таких как дусты, гранулы, гранулированные смачиваемые порошки, смачиваемые порошки, водные суспензии, масляные суспензии, водорастворимые порошки, эмульгируемые концентраты, водные растворы, пасты, аэрозоли или микродозы дустов. Соединение настоящего изобретения может быть приготовлено в виде любых препаратов, которые обычно используют в сельском хозяйстве или садоводстве, если только удовлетворяются цели настоящего изобретения. В качестве вспомогательных веществ, которые можно использовать для получения препаратов, можно указать, например, твердый носитель, такой как диатомовая земля, известь-пушонка, карбонат кальция, тальк, белая сажа, каолин, бентонит, смесь каолина и серецита, глина, карбонат натрия, бикарбонат натрия, глауберова соль, цеолиты или крахмал; растворители, такие как вода, толуол, ксилол, нафта, диоксан, ацетон, изофорон, метил-изобутилкетон, хлорбензол, циклогексан, диметилсульфоксид, диметилформамид, диметилацетамид, N-метил-2-пирролидон или спирт; анионные поверхностно-активные агенты или распределяющие агенты, такие как соли жирных кислот, бензоаты, алкилсульфосукцинаты, диалкилсульфосукцинаты, поликарбоксилаты, соли алкиловых сложных эфиров серной кислоты, алкилсульфаты, алкиларилсульфаты, сульфаты алкилдигликолевых простых эфиров, соли сложных эфиров серной кислоты и спирта, алкилсульфонаты, алкиларилсульфонаты, арилсульфонаты, лигнинсульфонаты, дисульфонаты алкилдифенилового простого эфира, полистиролсульфонаты, соли сложных эфиров алкилфосфорной кислоты, алкиларилфосфаты, стириларилфосфаты, соль сложного эфира серной кислоты и полиоксиэтилен алкилового простого эфира, сульфатполиоксиэтилен-алкиларилового простого эфира, соль сложного эфира серной кислоты и полиоксиэтилен-алкиларилового простого эфира, фосфатполиоксиэтилен-алкилового простого эфира, соль полиоксиэтилен-алкиларилфосфорного сложного эфира или соль конденсата нафталинсульфоновой кислоты и формалина; неионогенные поверхностно-активные или распределяющие агенты, такие как сорбитановые сложные эфиры жирных кислот, глицериновые сложные эфиры жирных кислот, полиглицериды жирных кислот, простые эфиры полигликолей и спиртов-производных жирных кислот, ацетиленгликоли, ацетиленспирты, оксиалкиленовые блок-полимеры, полиоксиэтиленовые алкиловые эфиры, полиоксиэтилен-алкилариловые простые эфиры, полиоксиэтилен-стирилариловые простые эфиры, алкиловые простые эфиры полиоксиэтиленгликоля, полиоксиэтиленовые сложные эфиры жирных кислот, полиоксиэтиленсорбитановые сложные эфиры жирных кислот, полиоксиэтиленглицериновые сложные эфиры жирных кислот, отвержденное полиоксиэтиленом касторовое масло или полиоксипропиленовые эфиры жирных кислот; растительные масла или минеральные масла, такие как оливковое масло, масло капок, касторовое масло, пальмовое масло, камеллиевое масло, кокосовое масло, кунжутное масло, кукурузное масло, рисовое масло, арахисовое масло, хлопковое масло, льняное масло, тунговое масло или жидкий парафин. Известные вспомогательные вещества можно выбрать из вспомогательных веществ, которые известны в области сельского хозяйства и садоводства, не выходя за рамки предмета настоящего изобретения. Кроме того, можно использовать вспомогательные вещества, которые обычно используют, такие как увеличивающие объем агенты, загустители, агенты, препятствующие осаждению, предохраняющие от замерзания агенты, стабилизаторы дисперсий, агенты, снижающие поражения растений, или агенты, защищающие от мучнистой росы. Обычно соотношение в смеси соединения настоящего изобретения к вспомогательному веществу составляет от 0,005:99,995 до 95:5, предпочтительно от 0,2:99,8 до 90:10. Такие композиции на практике можно использовать либо как они есть, либо при разбавлении их разбавителем, таким как вода, до нужных концентраций, и при необходимости к ним добавляют распыляющий агент. Концентрация соединения настоящего изобретения меняется в зависимости от обрабатываемых растений, способа нанесения, формы препарата или дозы и, следовательно, не может быть указана в общем случае. Однако в случае обработки листвы концентрация соединения в качестве активного ингредиента обычно составляет от 0,1 до 10000 млн-1, предпочтительно от 1 до 2000 млн-1. В случае обработки почвы концентрация обычно составляет от 10 до 100000 г/га, предпочтительно от 200 до 20000 г/га. Препарат фунгицида, содержащий соединение настоящего изобретения, или его разбавленный продукт можно наносить любым из обычно используемых способов нанесения, таких как рассеивание (рассеивание, распыление, туманообразование, распыление мельчайших частиц, разбрасывание в виде зерен или нанесение на воду), внесение в почву (например, смешивание или орошение) или нанесение на поверхность (например, созданием покрытия, нанесения дуста или покрытия поверхности). Кроме того, его можно вносить, используя так называемые сверхмалые объемы. При таком способе препарат может содержать 100% активного ингредиента. Фунгицид настоящего изобретения можно смешать или использовать, например, вместе с другим сельскохозяйственным химикатом, таким как инсектицид, митицид, нематоцид, фунгицид, противовирусный агент, аттрактант, гербицид или регулятор роста растений. Иногда в таком случае можно достичь еще более значительного эффекта. Примеры соединений – активных ингредиентов (общее название; включая рассматриваемые соединения), инсектицидов, митицидов или нематоцидов, т.е. пестицидов, из вышеуказанных сельскохозяйственных химикатов включают органические соединения фосфора, такие как профенофос, дихлорофос, фенамифос, фенитротион, EPN, диазинон, хлорпирифос-метил, ацефат, протиофос, фостиазат, фосфокарб, кадусафос и дислуфотон; соединения типа карбаматов, такие как карбарил, пропоксур, алдикарб, карбофуран, тиодикарб, метомил, оксамил, этиофенкарб, пиримикарб, фенобукарб, карбосульфан и бенфуракарб; производные нелицетоксина, такие как картап и тиоциклам; органические соединения хлора, такие как дикофол и тетрадифон; органические соединения металлов, такие как фенбутатиноксид; пиретроидные соединения, такие как фенвалерат, перметрин, циперметрин, дельтаметрин, цигалотрин, тефлутрин, этофенпрокс и флуфенпрокс; соединения типа бензоилмочевины, такие как дифлубензурон, хлорфлуазурон, тефлубензурон и флуфеноксурон; соединения, подобные ювенильному гормону, такие как метопрен; соединения пиридазинонового типа, такие как пиридабен; соединения пиразольного типа, такие как фенпироксимат, фипронил, тебуфенпирад, этипрол, толефенпирад и ацетопрол; неоникотиноиды, такие как имидаклоприд, нитенпирам, ацетамиприд, тиаклоприд, тиаметоксам, клотианидин, нидинотефуран и динотефуран; соединения типа гидразина, такие как тебуфенозид, метоксифенозид и хромафенозид; соединения типа пиридина, такие как пиридарил и флоникамид; соединения типа тетроновой кислоты, такие как спиродиклофен; соединения, типа стробилурина, такие как флуакрипирин; динитросоединения, органические соединения серы, соединения типа мочевины, соединения типа триазина, соединения типа гидразона и другие соединения, такие как бупрофезин, гекситиазокс, амитраз, хлордимеформ, силафлуофен, триазамат, пиметрозин, пиримидифен, хлорфенапир, индоксакарб, ацехиноцил, этоксазол, циромазин и 1,3-дихлорпропен; AKD-1022 и IKA-2000. Кроме того, фунгицид настоящего изобретения можно смешать или использовать вместе с микробным пестицидом, таким как агент ВТ, или с патогенным вирусом насекомого, или с антибиотиком, таким как авермектин, милбемицин, спиносад или эмамектин бензоат. Из числа других сельскохозяйственных химикатов примеры соединений – активных ингредиентов фунгицидов (общее название; включая рассматриваемые соединения) включают соединения типа пиримидинамина, такие как мепанипирим, пириметанил и ципродинил, соединения типа пиридинамина, такие как флуазинам; соединения типа азола, такие как триадимефон, битертанол, трифлумезол, этаконазол, пропиконазол, пенконазол, флузилазол, миклобутанил, ципроконазол, тербуконазол, гексаконазол, фурконазол-цис, прохлораз, метконазол, эпиконазол, тетраконазол, окспоконазолфумарат и сипконазол; соединения типа хиноксалина, такие как хинометионат; соединения типа дитиокарбамата, такие как манеб, цинеб, манкозеб, поликарбамат, метирам и пропинеб; или органические соединения хлора, такие как фталид, хлорталонил и хинтозен; соединения типа имидазола, такие как беномил, тиофанат-метил, карбендазим и циазофамид; соединения типа цианоацетамида, такие как цимоксанил; соединения типа фениламида, такие как металаксил, металаксил М, оксадиксил, офурас, беналаксил, фуралаксил и ципрофурам; соединения типа сульфеновой кислоты, такие как дихлофлуанид; соединения меди, такие как гидроокись меди и Oxine Copper; соединения типа изоксазола, такие как гидроксиизоксазол; фосфорорганические соединения, такие как фосетил-Al, толкофос-метил, 3-бензил О,O-диизопропилфосфоротиоат, O-этил S,S-дифенилфосфородитиоат и алюминий этил гидрофосфонат; соединения типа N-галогентиоалкила, такие как каптан и фолпет; соединения типа дикарбоксиимида, такие как процимидон, ипродион и винклозолин; соединения типа бензанилина, такие как флутоланил, мепронил и зоксамид; соединения типа пиперазина, такие как трифорин; соединения типа пиридина, такие как пирифенокс; соединения типа карбинола, такие как фенаримол и флутриафол; соединения типа пиперидина, фенпропидин; соединения типа морфолина, такие как фенпропиморф; оловоорганические соединения, такие как фентингидроксид и фентинацетат; соединения типа мочевины, такие как фенцикурон; соединения типа коричной кислоты, такие как диметоморф; соединения типа карбамата, такие как диэтофенкарб; соединения типа цианопиррола, такие как флудиоксонил и фенпиклонил; соединения типа стробилурина, такие как азоксистробин, крезоксим-метил, метоминофен, трифлуоксистробин, пикоксистробинипирахлостробин: (ВАS 500F); соединения типа оксазолидинона, такие как фамоксадон; соединения типа тиазолкарбоксамида, такие как этабоксам; соединения типа силиламида, такие как силтиофам; соединения типа амидкарбаматов аминокислот, такие как ипроваликарб и бентиаваликарб; соединения типа имидазолидина, такие как фенамидон; соединения типа гидроксианилида, такие как фенгексамид; соединения типа бензолсульфонамида, такие как флусульфамид; соединения типа эфиров оксима, такие как цифлуфенамид; соединения типа феноксиамида, такие как феноксанил; соединения типа триазола, такие как симеконазол; соединения типа антрахинона; соединения типа кротоновой кислоты; антибиотики и другие соединения, такие как изопротиолан, трициклазол, пирохилон, дикломезин. Pro. бензол, хиноксифен, пропамокарбгидрохлорид, спироксамин, хлорпикрин, дазомет и метам-натрий; и BJL-993, BJL-994, ВАS-510, ВАS-505, MTF-753 и UIBF-307. Далее представлены тестовые примеры для сельскохозяйственных и садоводческих фунгицидов настоящего изобретения. Однако эти примеры никоим образом не ограничивают настоящее изобретение. В каждом из тестов определяют показатель эффективности подавления заболеваний (показатель контроля) на основании следующих критериев. [показатель контроля]:[Степень вспышки заболевания: визуальное наблюдение] 5: Не заметно ни поражений, ни спорогоний 4: Площадь поражений, число поражений или площадь спорогоний составляет менее 10% от соответствующих значений для необработанных экземпляров 3: Площадь поражений, число поражений или площадь спорогоний составляет менее 40% от соответствующих значений для необработанных экземпляров 2: Площадь поражений, число поражений или площадь спорогоний составляет менее 70% от соответствующих значений для необработанных экземпляров 1: Площадь поражений, число поражений или площадь спорогоний составляет, по меньшей мере, 70% от соответствующих значений для необработанных экземпляров. ТЕСТОВЫЙ ПРИМЕР 1 Тест по определению защитного эффекта против настоящей мучнистой росы пшеницы Пшеницу (сорт Norin-61-go) выращивают в полиэтиленовых горшках диаметром 7,5 см, и когда пшеница достигает стадии полутора листьев, ее опрыскивают 10 мл раствора, содержащего определенную концентрацию соединения по настоящему изобретению, с помощью опрыскивателя. После высыхания раствора пшеницу заражают, нанося конидиоспоры гриба настоящей мучнистой росы, затем пшеницу содержат в термостатируемой камере при 20°С. Через 6-8 дней после инокуляции исследуют площадь спорогоний для определения показателя контроля, используя указанные выше критерии. В результате указанные выше соединения №№1, 2, 8, 47, 58, 61, 62, 69, 73, 76, 77, 78, 83, 87, 91, 107, 110, 112, 114, 117, 119, 138, 250, 262 и 274 продемонстрировали результаты, соответствующие показателям контроля 4 или выше при концентрации 500 млн-1, а соединения №№3, 4, 5, 6, 7, 9, 10, 11, 13, 14, 18, 19, 23, 27, 30, 31, 32, 33, 34, 35, 36, 38, 40, 41, 43, 49, 50, 51, 54, 55, 56, 59, 65, 72, 74, 75, 82, 84, 89, 90, 92, 93, 94, 99, 100, 101, 102, 103, 104, 105, 106, 108, 109, 111, 113, 118, 120, 121, 122, 123, 124, 133, 136, 142, 158, 159, 186, 187, 188, 189, 190 191, 192, 193, 194, 199, 200, 210, 211, 213, 228, 243, 245, 249 252, 254, 272, 287, 288, 289, 290, 291, 292, 293, 294, 296, 297, 298, 299, 300, 302, 303, 304, 305, 306, 307, 308, 309, 310, 311, 312, 313, 314, 315, 316, 320 и 321 продемонстрировали результаты, соответствующие показателям контроля 4 или выше при концентрации 125 млн-1. ТЕСТОВЫЙ ПРИМЕР 2 Тест по определению защитного эффекта против пирикуляриоза риса Рис (сорт: Nihonbare) выращивают в полиэтиленовых горшках диаметром 7,5 см, и когда рис достигает стадии полутора листьев, его опрыскивают 10 мл раствора, содержащего определенную концентрацию соединения по настоящему изобретению с помощью опрыскивателя. После высыхания раствора рис заражают, нанося суспензию конидиоспор гриба пирикуляриоза риса, затем рис выдерживают в боксе для инокулирования при 20°С в течение 24 часов, и затем содержат в термостатируемой камере при 20°С. Через 6-11 дней после инокуляции исследуют количество пораженных участков для определения показателя контроля, используя указанные выше критерии. В результате из указанных выше соединений, соединения №№31, 56, 76, 90, 103, 136, 158, 293, 294, 307, 308, 309, 314, 315, 316 и 321 продемонстрировали результаты, соответствующие показателям контроля 4 или выше при концентрации 500 млн-1, и соединения №№50, 74, 75 и 102 продемонстрировали результаты, соответствующие показателям контроля 4 или выше при концентрации 125 млн-1. ТЕСТОВЫЙ ПРИМЕР 3 Тест по определению защитного эффекта против настоящей мучнистой росы баклажанов Баклажаны (сорт Senryo-2-go) выращивают в полиэтиленовых горшках диаметром 7,5 см, и когда растения баклажанов достигают стадии двух листьев, их опрыскивают 10 мл раствора, содержащего определенную концентрацию соединения по настоящему изобретению, с помощью опрыскивателя. После высыхания раствора баклажаны заражают, нанося конидиоспоры гриба настоящей мучнистой росы баклажанов, затем баклажаны содержат в термостатируемой камере при 20°С. Через 16 дней после инокулирования исследуют площадь спорогоний для определения показателя контроля, используя указанные выше критерии. В результате из указанных выше соединений соединения №№1, 3, 5, 7, 92, 101 и 103 продемонстрировали результаты, соответствующие показателям контроля 4 или выше при концентрации 500 млн-1, а соединения №№9, 11, 55, 90 и 102 продемонстрировали результаты, соответствующие показателям контроля 4 или выше при концентрации 125 млн-1. ТЕСТОВЫЙ ПРИМЕР 4 Тест по определению защитного эффекта против настоящей мучнистой росы огурцов Огурцы (сорт Suyo) выращивают в полиэтиленовых горшках диаметром 7,5 см, и когда огурцы достигают стадии полутора листьев, их опрыскивают 10 мл раствора, содержащего определенную концентрацию соединения по настоящему изобретению, с помощью опрыскивателя. После высыхания раствора огурцы заражают, нанося суспензию конидиоспор гриба настоящей мучнистой росы, затем огурцы содержат в термостатируемой камере при 20°С. Через 7-11 дней после инокулирования исследуют площадь спорогоний для определения показателя контроля, используя указанные выше критерии. В результате из указанных выше соединений соединение №98 продемонстрировало результаты, соответствующие показателям контроля 4 или выше при концентрации 500 млн-1, и соединения №№1, 5, 7, 9, 49, 55, 74, 90, 92, 93, 102, 103, 123, 124, 158, 159, 293, 294, 296, 297, 299, 300, 302, 303, 304, 305, 306, 307, 308, 313, 314, 315, 316 и 321 продемонстрировали результаты, соответствующие показателям контроля 4 или выше при концентрации 125 млн-1. Далее приводятся примеры композиций, содержащих соединения по настоящему изобретению. Однако приводимые примеры ни коим образом не ограничивают дозы композиций, формы дозировки и т.п. ПРИМЕР КОМПОЗИЦИИ 1 (1) Соединение настоящего изобретения 20 вес. частей (2) Глина 72 вес. частей (3) Натрийлигнинсулфонат 8 вес. частей Вышеуказанные компоненты смешивают до однородности, получая смачиваемый порошок. ПРИМЕР КОМПОЗИЦИИ 2 (1) Соединение настоящего изобретения 5 вес. частей (2) Тальк 95 вес. частей Указанные выше компоненты смешивают до однородности, получая дуст. ПРИМЕР КОМПОЗИЦИИ 3 (1) Соединение настоящего изобретения 20 вес. частей (2) N,N-диметилацетамид 20 вес. частей (3) Алкилфениловый эфир полиоксиэтилена 10 вес. частей (4) Ксилол 50 вес. частей Указанные выше компоненты смешивают до однородности и растворяют, получая эмульгируемый концентрат. ПРИМЕР КОМПОЗИЦИИ 4 (1) Глина 68 вес. частей (2) Натрийлигнинсульфонат 2 вес.части (3) Полиоксиэтилен-алкиларилсульфат 5 вес. частей (4) Тонкоизмельченная двуокись кремния 25 вес. частей Смесь вышеуказанных компонентов и соединение настоящего изобретения смешивают в весовом отношении 4:1, получая смачиваемый порошок. ПРИМЕР КОМПОЗИЦИИ 5 (1) Соединение настоящего изобретения 50 вес. частей (2) Окисленный полиалкилфенилфосфат-триэтаноламин 2 вес.части (3) Силикон 0,2 вес. части (4) Вода 47,8 вес. части Указанные выше компоненты смешивают до однородности и измельчают, получая исходный раствор, и затем добавляют к нему (5) Поликарбоксилат натрия 5 вес. частей (6) Безводный сульфат натрия 42,8 вес. частей Затем все перемешивают до однородности, гранулируют и сушат, получая гранулированный смачиваемый порошок. ПРИМЕР КОМПОЗИЦИИ 6 (1) Соединение настоящего изобретения 5 вес. частей (2) Полиоксиэтилен-октилфениловый эфир 1 вес. часть (3) Полиоксиэтиленфосфат 0,1 вес. части (4) Измельченный карбонат кальция 93,9 вес. части Вышеуказанные компоненты (1)-(3) предварительно смешивают до однородности и разбавляют соответствующим количеством ацетона, разбавленной смесью опрыскивают компонент (4) и ацетон удаляют, получая гранулы. ПРИМЕР КОМПОЗИЦИИ 7 (1) Соединение настоящего изобретения 2,5 вес. части (2) N-метил-2-пирролидон 2,5 вес. частей (3) Соевое масло 95,0 вес. частей Указанные выше компоненты смешивают до однородности и растворяют, получая композицию сверхмалого объема. ПРИМЕР КОМПОЗИЦИИ 8 (1) Соединение настоящего изобретения 20 вес. частей (2) Окисленный полиалкилфенолфосфат-триэтаноламин 2 вес. части (3) Силикон 0,2 вес. части (4) Смола ксантановая 0,1 вес. части (5) Этиленгликоль 5 вес. частей (6) Вода 72,7 вес. части Указанные выше компоненты смешивают до однородности и измельчают, получая водную суспензию. Промышленная применимость Как было указано выше, производные бензоилпиридина, представленные формулой (I), или их соли обладают превосходным действием в качестве активного ингредиента фунгицидов.
Формула изобретения
1. Производное бензоилпиридина, представленное формулой (I), или его соль где Х представляет атом галогена, С1-6 алкоксигруппу, необязательно замещенную заместителем, выбранным из галогена, фенила, метокси, метилтио, диметиламино, винила и этинила; феноксигруппу; С3-6 циклоалкоксигруппу; гидроксильную группу; С1-6 алкильную группу; С2-6 алкенильную группу; группу СF3; С1-6-алкилтиогруппу; цианогруппу; С1-6 алкоксикарбонильную группу; С1-6 диалкиламинокарбонильную группу; С1-6 алкилкарбонилоксигруппу; С1-6 алкилкарбонильную группу; аминогруппу; C1-4 алкиламиногруппу; или ди-С1-4алкиламиногруппу; n представляет 1, 2, 3 или 4; R1 представляет С1-6 алкильную группу; R2 представляет С1-6 алкильную группу; С1-6 алкоксигруппу, необязательно замещенную фенилом; феноксигруппу; С3-10 циклоалкоксигруппу или гидроксильную группу; и m равняется 1, 2 или 3, при условии, что если m равняется 2, то R2 может образовывать кольцо -ОСН2O- (за исключением случая, когда пиридиновое кольцо замещено бензоильной группой в 2-положении; пиридиновое кольцо замещено С1-6 алкоксигруппой, гидроксильной группой или бензилоксигруппой в 3-положении; и n равно 1, m равно 1 или 2) в качестве активного ингредиента фунгицида. 2. Производное бензоилпиридина или его соль по п.1 в качестве активного ингредиента фунгицида, где Х представляет атом галогена, С1-6 алкоксигруппу, необязательно замещенную заместителем, выбранным из галогена, фенила, метокси, метилтио, диметиламино, винила и этинила; феноксигруппу; С3-6 циклоалкоксигруппу; гидроксильную группу; С1-6 алкильную группу; С3-6 алкенильную группу; группу СF3; С1-6 алкилтиогруппу; цианогруппу или аминогруппу; С1-4 алкиламиногруппу; ди-С1-4алкиламиногруппу. 3. Производное бензоилпиридина или его соль по п.1 в качестве активного ингредиента фунгицида, где m равно 2 или 3. 4. Производное бензоилпиридина или его соль по п.1 в качестве активного ингредиента фунгицида, где R1 представляет С1-6 алкильную группу и R2 представляет С1-6 алкильную группу, С1-6 алкоксигруппу или гидроксильную группу. 5. Производное бензоилпиридина или его соль по п.1, представленное формулой (I’) где X, n и R1 имеют указанные в п.1 значения, R2′ представляет С1-6 алкильную группу, С1-6 алкоксигруппу, феноксигруппу, С3-10 циклоалкоксигруппу или гидроксильную группу, р равно 1 или 2, и R2” представляет С1-6 алкоксигруппу или гидроксильную группу, при условии, что два из R2’ и R2” могут образовывать кольцо -ОСН2О- (за исключением того случая, когда (1) пиридиновое кольцо замещено группой бензоила в 2-положении; пиридиновое кольцо замещено С1-6 алкоксигруппой, гидроксильной группой или бензилоксигруппой в 3-положении; и n равно 1, р равно 1; и (2) пиридиновое кольцо замещено атомом хлора или атомом брома в 2-положении и n равно 1). 6. Производное бензоилпиридина или его соль по п.5, представленное формулой (I”) где Х представляет атом галогена, С1-6 алкоксигруппу, необязательно замещенную заместителем, выбранным из галогена, фенила, метокси, метилтио, диметиламино, винила и этинила; феноксигруппу, С3-10-циклоалкокси группу, С1-6 алкилтиогруппу, цианогруппу, С1-6 алкоксикарбоксильную группу, С1-6 диалкиламинокарбонильную группу, С1-6 алкилкарбонилокси группу, С1-6 алкилкарбонильную группу, аминогруппу, С1-4 алкиламиногруппу или ди-С1-4-алкиламиногруппу; n равно 1, 2, 3 или 4; R1 представляет С1-6 алкильную группу; R2′ представляет С1-6 алкоксигруппу; р равно 1 или 2; и каждый из R2” и R2”’ представляет С1-6 алкоксигруппу. 7. Производное бензоилпиридина или его соль по п.5, представленное формулой (I”’) где X представляет атом галогена, С1-6 алкоксигруппу, С1-6 алкильную группу, группу СF3 или С1-6 алкилтиогруппу; n равно 1, 2, 3 или 4; R1 представляет С1-6 алкильную группу; R2′ представляет С1-6 алкоксигруппу; р равно 1 или 2; и каждый из R2” и R2”’ представляет С1-6 алкоксигруппу. 8. Производное бензоилпиридина или его соль по п.5, представленное формулой (I””) где Х представляет атом галогена, С1-6 алкоксигруппу, С1-6 алкильную группу, группу СF3 или С1-6 алкилтиогруппу; n равно 1, 2 или 3; R1 представляет С1-6 алкильную группу; R2′ представляет С1-6 алкоксигруппу, р равно 1 или 2; и каждый из R2” и R2”’ представляет С1-6 алкоксигруппу. 9. Производное бензоилпиридина или его соль по п.8, представленное формулой (I””’) где В представляет -СХ4=, если А представляет -N=; В представляет -N=, если А представляет -СН=; каждый из X1 и X2, которые независимы друг от друга, представляет атом галогена, С1-6 алкоксигруппу, С1-6 алкильную группу, группу СF3 или С1-6 алкилтиогруппу; X3 представляет атом водорода, атом галогена, С1-6 алкоксигруппу или С1-6 алкильную группу; Х4 представляет атом водорода, атом галогена, С1-6 алкоксигруппу или С1-6 алкилтиогруппу; R1 представляет С1-6 алкильную группу; R2′ представляет С1-6 алкоксигруппу; р равно 1 или 2; и каждый из R2” и R2”’ представляет С1-6 алкоксигруппу. 10. Фунгицид, который содержит в качестве активного ингредиента производное бензоилпиридина, представленное формулой (I’), или его соль по п.5. 11. Способ получения производного бензоилпиридина, представленного формулой (I’), или его соли где X, n и R1 имеют указанные в п.1 значения, R2′ представляет С1-6 алкильную группу, С1-6 алкоксигруппу, феноксигруппу, С3-10 циклоалкоксигруппу или гидроксильную группу; р равняется 1 или 2, и R2” представляет С1-6 алкоксигруппу или гидроксильную группу, при условии, что два из R2′ и R2” могут образовывать кольцо -ОСН2О- (за исключением случая, когда пиридиновое кольцо замещено бензоильной группой в 2-положении; пиридиновое кольцо замещено С1-6 алкоксигруппой, гидроксильной группой или бензилоксигруппой в 3-положении; и n равно 1, р равно 1), который включает осуществление взаимодействия замещенного бензальдегида, представленного формулой (VI-1) (где R1, R2’, R2” и р имеют указанные выше значения), и соли замещенного производного пиридина с металлом, представленной формулой (VII-1) (где Х имеет указанные выше значения, a Z представляет атом металла или его смешанную соль) с получением фенилпиридилметанола, представленного формулой (X’) (где X, n, р, R1, R2′ и R2” имеют указанные выше значения, при соблюдении условий, указанных для формулы (I’)), и его окисление. 12. Способ получения производного бензоилпиридина, представленного формулой (I’), или его соли где X, n и R1 имеют указанные в п.1 значения; R2′ представляет С1-6 алкильную группу, С1-6 алкоксигруппу, феноксигруппу, С3-6 циклоалкоксигруппу или гидроксильную группу; р равняется 1 или 2, и R2” представляет С1-6 алкоксигруппу или гидроксильную группу; при условии, что два R2′ и R2” могут образовывать кольцо -ОСН2О- (за исключением случая, когда пиридиновое кольцо замещено бензоильной группой в 2-положении; пиридиновое кольцо замещено С1-6 алкоксигруппой, гидроксильной группой или- бензилоксигруппой в 3-положении; и n равно 1, р равно 1), который включает осуществление взаимодействия соли замещенного производного бензола с металлом, представленной формулой (VI-2) (где R1, R2′ и р имеют указанные выше значения, и Z представляет атом металла или его смешанную соль), и замещенного пиридилальдегида, представленного формулой (VII-2) (где Х имеет указанные выше значения), с получением фенилпиридилметанола, представленного формулой (X’) (где X, n, р, R1 R2′ и R2” имеют указанные выше значения, при соблюдении условий, указанных для формулы (I’)), и его окисление. 13. Фенилпиридилметанол, представленный формулой (X) где Х представляет атом галогена, С1-6 алкоксигруппу, С1-6 алкильную группу, С2-6 алкенильную группу, группу СF3; или С1-6 алкоксикарбонильную группу; n равняется 1, 2, 3 или 4; R1 представляет C1-4 алкильную группу; R2 представляет С1-4 алкильную группу, С1-6 алкоксигруппу, С3-10 циклоалкоксигруппу, или два R2, находящиеся в положениях 4 и 5, образуют группу -ОСН2О-; и m равняется 1, 2 или 3, (за исключением случая, когда пиридиновое кольцо замещено 14. Фенилпиридилметанол по п.13, представленный формулой (X’) где X, n и R1 имеют указанные в пункте 13 значения, R2′ представляет С1-4 алкильную группу, С1-6 алкоксигруппу, или С3-10 циклоалкоксигруппу; р равняется 1 или 2, и R2” представляет С1-6 алкоксигруппу, при условии, что два R2′ и R2” могут образовывать группу (-ОСН2О-) (за исключением случая, когда пиридиновое кольцо замещено 15. Фенилпиридилметанол по п.14, представленный формулой (X”) где Х представляет атом галогена, С1-6 алкоксигруппу, С1-4 алкильную группу, С2-6 алкенильную группу, группу СF3; С1-6 алкоксикарбонильную группу, n равно 1, 2, 3 или 4; R1 представляет С1-4 алкильную группу; R2′ представляет С1-6 алкоксигруппу, р равно 1 или 2, и каждый из R2” и R2”’ представляет С1-6 алкоксигруппу. 16. Фенилпиридилметанол по п.14, представленный формулой (X”’) где Х представляет атом галогена, С1-6 алкоксигруппу, С1-4 алкильную группу или группу СF3; n равно 1, 2, 3 или 4; R1 представляет C1-4 алкильную группу; R2′ представляет С1-6 алкоксигруппу; р равно 1 или 2; и каждый из R2” и R2”’ представляет С1-6 алкоксигруппу. 17. Фенилпиридилметанол по п.16, представленный формулой (X””’) где В представляет -СХ4=если А представляет -N=; В представляет -N=, если А представляет -СН=; каждый из X1 и X2, которые независимы друг от друга, представляет атом галогена, С1-6 алкоксигруппу, C1-4 алкильную группу или группу СF3; X3 представляет атом галогена или группу СF3; X4 представляет атом водорода или атом галогена; R1 представляет C1-4 алкильную группу; R2′ представляет С1-6 алкоксигруппу; р равно 1 или 2; и каждый из R2” и R2”’ представляет С1-6 алкоксигруппу.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

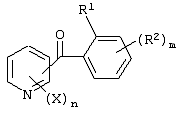
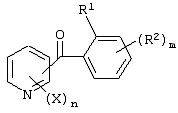
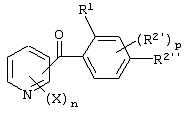
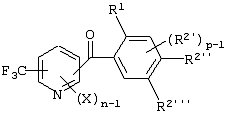

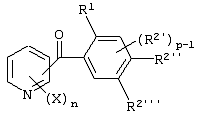
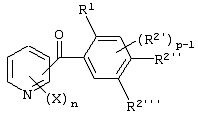
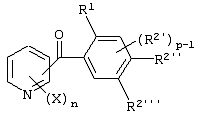
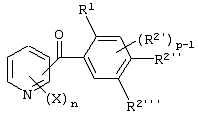
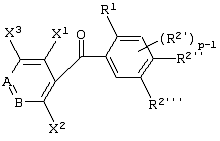
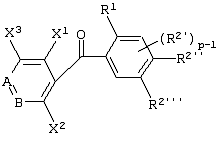
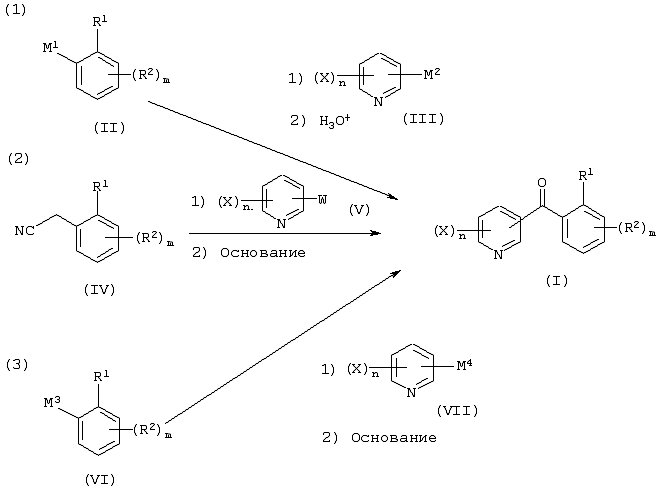
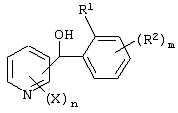
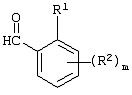
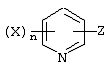
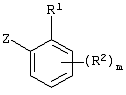
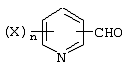
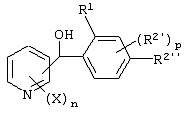
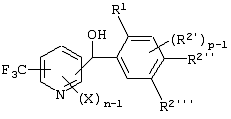
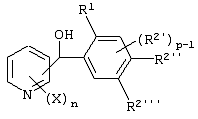
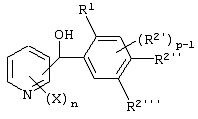
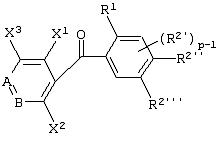
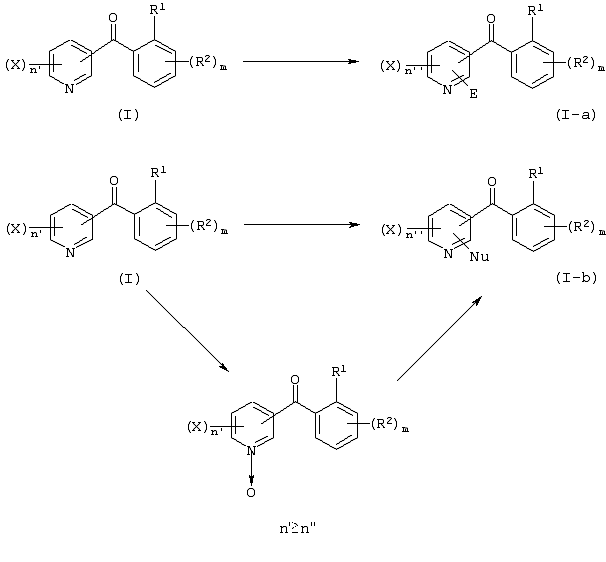
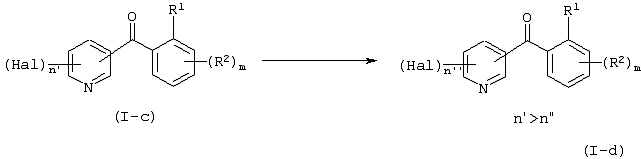
 (м.д.) 2,59 (с, 3Н), 7,28 (с, 1Н).
(м.д.) 2,59 (с, 3Н), 7,28 (с, 1Н).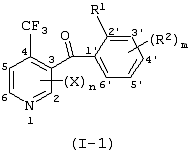
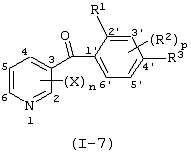
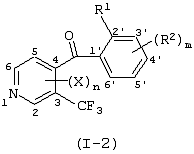
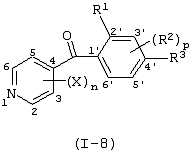
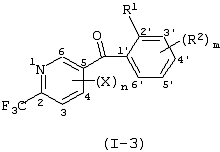
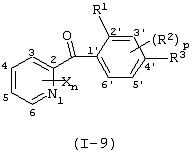
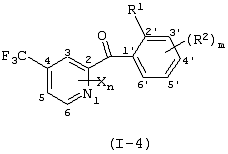
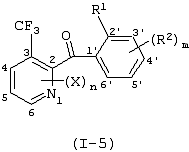
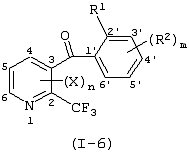
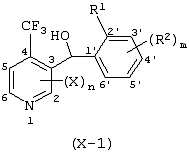
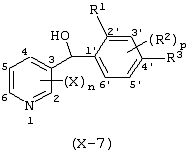
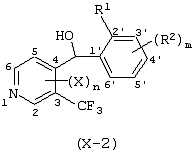
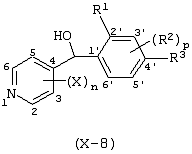
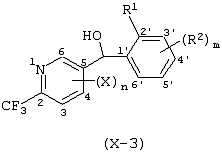
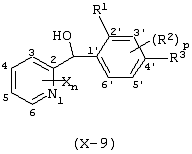
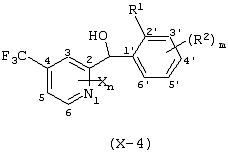
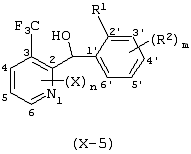
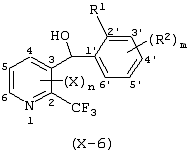
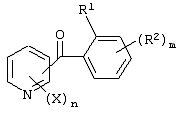
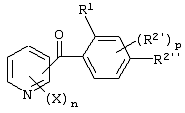
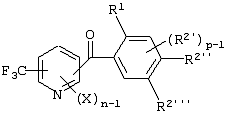
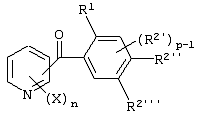
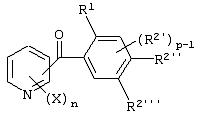
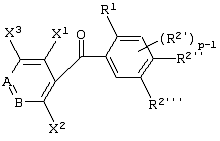
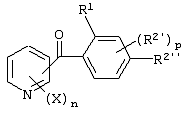
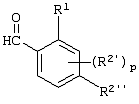
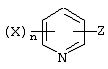
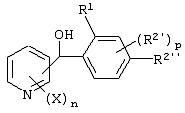
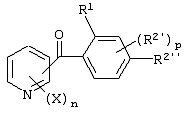
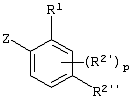
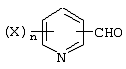
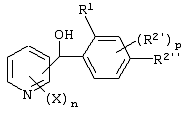
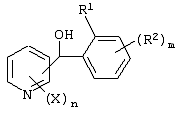
 -гидроксибензильной группой в 2-положении; пиридиновое кольцо замещено С1-6 алкоксигруппой в 3-положении; и n равно 1, m равно 1 или 2).
-гидроксибензильной группой в 2-положении; пиридиновое кольцо замещено С1-6 алкоксигруппой в 3-положении; и n равно 1, m равно 1 или 2).