Патент на изобретение №2255085
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ N-ФЕНИЛ-2-ГИДРОКСИ-2-МЕТИЛ-3,3,3-ТРИФТОРПРОПАНАМИДА, ПОВЫШАЮЩИЕ АКТИВНОСТЬ ПИРУВАТДЕГИДРОГЕНАЗЫ
(57) Реферат:
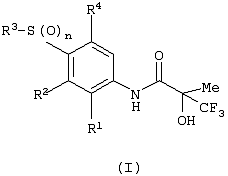
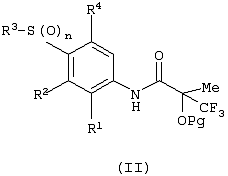
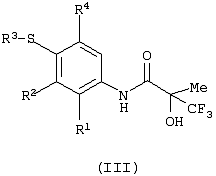
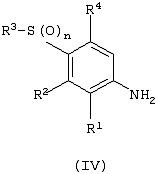
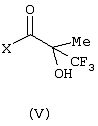
Изобретение относится к замещенным производным N-фенил-2-гидрокси-2-метил-3,3,3-трифторпропанамида формулы (I) где n равняется 1 или 2; R1 представляет хлор, фтор, бром, метил или метокси; R2 выбирают из одной из следующих трех групп: i) галогена, нитро, гидрокси, амино или циано; ii) –X1-R5, в которой X1 представляет -О-, -S-, -SO-, -SO2-, NR6-, -CO-, -CONR6-, -NR6CO-, где R6 представляет водород, и R5 выбран из C1-6алкила, необязательно замещенного одним или несколькими А, и т.д., iii) присоединенной атомом азота 4-8-членной гетероциклической группы, которая является насыщенным моноциклическим кольцом, содержащим 4-8 атомов углерода, из которых, по крайней мере, один является атомом азота, и т.д.; R3 представляет С1-6алкил, необязательно замещенный одним или несколькими А, и т.д.; А выбран из гидрокси, амино, галогена, карбокси, N-(С1-С4алкил)амино, N,N-ди(С1-4алкил)амино, карбамоил и C1-6алкокси; D выбран из: i) –Xa-Rc, где Xa представляет –SO2-, -CO-, -NRdCO-, -NRd– или –CONRd-; iv) циано или галогено; v) –Xc-Rf где Xc представляет -С(O)- и Rf представляет присоединенную атомом азота 4-8-членную гетероциклическую группу, которая является насыщенным моноциклическим кольцом, содержащим 4-8 атомов углерода, из которых, по крайней мере, один является атомом азота, с необязательно, дополнительным гетероатомом независимо выбранным из G, необязательно замещенную у атома углерода кольца группой гидрокси, галогена, С1-С4алкокси, С1-С4алкила или циано; G представляет собой C1-6алканоил; R4 представляет водород или фтор; или его фармацевтически приемлемая соль, или его гидролизуемый in vivo сложный эфир. Предложен способ получения соединения формулы (I). Также предложена фармацевтическая композиция, повышающая активность ПДГ, включающая замещенные производные N-фенил-2-гидрокси-2-метил-3,3,3-трифторпропанамида формулы (I) или его фармацевтически приемлемую соль или гидролизуемый in vivo сложный эфир в сочетании с фармацевтически приемлемым разбавителем или носителем. Технический результат – производные N-фенил-2-гидрокси-2-метил-3,3,3-трифторпропанамида, повышающие активность пируватдегидрогеназы. 4 н. и 10 з.п. ф-лы, 1 табл.
Настоящее изобретение относится к соединениям, которые повышают активность пируватдегидрогеназы (ПДГ), способам их получения, фармацевтическим композициям, содержащим их в качестве активных ингредиентов, к способам лечения болезненных состояний, связанных с пониженной ПДГ-активностью, к их применению в качестве лекарств и к их применению при производстве лекарств для использования в повышении ПДГ-активности у теплокровных животных, таких как человек, в частности, при лечении сахарного диабета, заболевания периферических сосудов и ишемической болезни миокарда у теплокровных животных, таких как человек, более конкретно, к их применению при производстве лекарств для использования при лечении сахарного диабета у теплокровных животных, таких как человек. Аденозинтрифосфат (АТФ) обеспечивает энергию для синтеза сложных молекул в тканях и для сокращения мышц. АТФ образуется при распаде богатых энергией субстратов, таких как глюкоза или свободные жирные кислоты с длинной цепью. В окислительных тканях, таких как мышцы, большая часть АТФ образуется из ацетил СоА, который входит в цикл лимонной кислоты, и таким образом, поступление ацетил СоА является критическим параметром продуцирования АТФ в окислительных тканях. Ацетил СоА продуцируется или При болезненных состояниях, таких как и неинсулинзависимый сахарный диабет (НИЗСД), и инсулинзависимый сахарный диабет (ИЗСД), окисление липидов возрастает при сопутствующем снижении утилизации глюкозы, которое способствует гипергликемии. Пониженная утилизация глюкозы как при ИЗСД, так и при НИЗСД связана со снижением ПДГ-активности. Кроме того, дополнительным следствием пониженной ПДГ-активности может быть то, что увеличение концентрации пирувата приводит к увеличенной доступности лактата как субстрата для гепатического глюконеогенеза. Есть основания полагать, что повышение активности ПДГ может повысить скорость окисления глюкозы и, следовательно, общей утилизации глюкозы в дополнение к пониженному выходу гепатической глюкозы. Еще одним фактором, ответственным за сахарный диабет, является ослабленная секреция инсулина, которая, как было показано, связана с пониженной ПДГ-активностыо в Окисление глюкозы способно давать больше молекул АТФ на моль кислорода, чем окисление жирных кислот. При состояниях, при которых потребность в энергии может превышать снабжение энергией, таких как ишемическая болезнь миокарда, перемежающаяся хромота, церебральная ишемия и реперфузия (Zaidan et al., 1998; J. Neurochem. 70: 233-241), можно ожидать, что сдвиг баланса утилизации субстрата в сторону метаболизма глюкозы путем повышения ПДГ-активности улучшит способность поддерживать уровни АТФ и, следовательно, функцию. Можно также ожидать, что агент, который способен повышать ПДГ-активность, является благоприятным при лечении состояний, при которых проявляется избыток циркулирующей молочной кислоты, таких как некоторые случаи сепсиса. Было показано, что агент дихлоруксусная кислота (ДХУК), которая увеличивает ПДГ-активность после острого введения животным (Vary et al., 1988; Circ. Shock, 24:3-18), оказывает предсказуемое действие при гликемии (Stacpoole et al., 1978; N. Engl. J. Med. 298: 526-530), в качестве средства терапии от ишемической болезни миокарда (Bersin and Stacpoole, 1997; American Heart Journal, 134: 841-855) и молочной ацидемии (Stacpoole et al., 1983; N. Engl. J. Med. 309: 390-396). ПДГ представляет внутримитохондриальный многоферментный комплекс, состоящий из множественных копий нескольких субъединиц, включающих три ферментных активности E1, E2 и Е3, требуемые для завершения превращения пирувата в ацетил СоА (Patel and Roche 1990; FASEB J., 4: 3224-3233). E1 катализирует необратимое удаление СO2 из пирувата; Е2 образует ацетил СоА, и Е3 восстанавливает NAD в NADH. С комплексом связаны две дополнительные ферментные активности: специфическая киназа, которая реверсирует фосфорилировать Е1 по трем сериновым остаткам, и свободно связанная специфичная фосфатаза, которая обращает фосфорилирование. Фосфорилирование только одного из трех сериновых остатков делает Е1 неактивным. Доля ПДГ в ее активном (дефосфорилированном) состоянии определяется балансом между активностью киназы и фосфатазы. Активность киназы может регулироваться in vivo относительными концентрациями метаболических субстратов, таких как NAD/NADH, СоА/ацетил СоА и адениндифосфат (АДФ)/АТФ, а также доступностью самого пирувата. Европейские патентные публикации №№617010 и 524781 описывают соединения, которые способны расслаблять гладкую мышцу мочевого пузыря и которые могут использоваться при лечении недержания мочи. Нами было найдено, что соединения настоящего изобретения являются очень эффективными при повышении ПДГ-активности; свойство, которое нигде не раскрыто в ЕР 0617010 и ЕР 524781. Настоящее изобретение основано на неожиданном открытии того, что некоторые соединения повышают ПДГ-активность; обладая ценным свойством для лечения болезненных состояний, связанных с расстройствами утилизации глюкозы, такими как сахарный диабет, ожирение (Curto et al., 1997; Int. J. Obes. 21: 1137-1142) и молочная ацидемия. Дополнительно можно ожидать, что данные соединения являются полезными при заболеваниях, при которых ограничено снабжение тканей энергетически богатым субстратом, таких как заболевание периферических сосудов (включая перемежающуюся хромоту), сердечная недостаточность и некоторые сердечные миопатии, мышечная слабость, гиперлипидемия и атеросклероз (Stacpoole et al., 1978; N. Engl. J. Med. 298: 526-530). Соединение, которое активизирует ПДГ, может быть также полезным при лечении болезни Альцгеймера (БА) (J.Neural Transm. (1998) 105, 855-870). Соответственно настоящее изобретение предоставляет соединения формулы (I): в которой: n равняется 1 или 2; R1 представляет хлор, фтор, бром, метил или метокси; R2 выбран из одной из следующих трех групп: i) галогена, нитро, гидрокси, амино или циано; ii) –X1-R5, в которой X1 представляет прямую связь, -О-, -S-, -SO-, -SO2-, -NR6-, -CO-, -CONR6-, -NR6CO-, -NR6SO2– или NR6ONR7-, где R6 и R7 независимо представляют водород или С1-4алкил, необязательно замещенный одним или несколькими А; и R5 выбран из C1-6алкила, необязательно замещенного одним или несколькими А, С3-7циклоалкила, необязательно замещенного одним или несколькими А, С3-7циклоалкилС1-6алкила, необязательно замещенного одним или несколькими А, С2-6алкенила, необязательно замещенного одним или несколькими А, С1-6алкинила, необязательно замещенного одним или несколькими А, фенила, необязательно замещенного одним или несколькими D, фенилС1-6алкила, необязательно замещенного одним или несколькими D, гетероарильного кольца, необязательно замещенного у углерода кольца одним или несколькими D, или (гетероарильное кольцо)C1-6алкила, необязательно замещенного у углерода кольца одним или несколькими D, в котором указанное гетероарильное кольцо представляет присоединенное атомом углерода 6-членное кольцо, содержащее 1-2 атома азота, или присоединенное атомом углерода 5-членное кольцо, содержащее 1-3 гетероатома, выбранных независимо из О, N и S, и где, если указанное 5-членное гетероарильное кольцо содержит -NH-фрагмент, данный азот может быть необязательно замещен группой, выбранной из G; iii) присоединенной атомом азота 4-8-членной гетероциклической группы, необязательно замещенной у атома углерода кольца одним или несколькими D, и в которой, если указанная гетероциклическая группа содержит -NH-фрагмент, данный азот может быть необязательно замещен группой, выбранной из G; R3 представляет C1-6алкил, необязательно замещенный одним или несколькими А, С3-7циклоалкил, необязательно замещенный одним или несколькими А, фенил, необязательно замещенный одним или несколькими D, присоединенное атомом углерода 6-членное гетероарильное кольцо, содержащее 1-2 атома азота, необязательно замещенное у атома углерода кольца одним или несколькими D, или присоединенное атомом углерода 5-членное гетероарильное кольцо, содержащее 1-3 гетероатома, выбранных независимо из О, N и S, необязательно замещенное у атома углерода кольца одним или несколькими D, и где, если указанное 5-членное гетероарильное кольцо содержит -NH-фрагмент, данный азот может быть необязательно замещен группой, выбранной из G; А выбран из гидрокси, амино, галогена, карбокси, N-(C1-4алкил)амино, N,N-ди(С1-4алкил) амино, карбамоила и C1-6алкокси; D выбран из: i) –Xa-Rc, где Xa представляет прямую связь, -О-, -S-, -SO-, -SO2-, -СО-, -NRdSO2-, -NRdCO-, -NRdCONRe-, -NRd– или –CONRd-; где Rd и Re независимо представляют водород или С1-4алкил, необязательно замещенный одним или несколькими гидрокси или С1-4алкокси; и Rc выбран из водорода или C1-6алкила, необязательно замещенного одним или несколькими гидрокси или С1-4алкокси; ii) 4-8-членной Het группы, которая необязательно замещена у атома углерода кольца одной или несколькими группами, выбранными из гидрокси, галогена, С1-4алкокси, С1-4алкила или циано, и где, если указанная 4-8-членная Het группа содержит -NH-фрагмент, данный азот может быть необязательно замещен группой, выбранной из G; iii) –Хa-С1-6алкил-Хb-Rc где Xa и Rc имеют значения, определенные выше, и Xb представляет -S-, -SO-или –SО2-; iv) циано или галогена; и v) –Хc-Rf, где Xc представляет -С(О)- или –SO2-, и Rf представляет присоединенную атомом азота 4-8-членную гетероциклическую группу, необязательно замещенную у атома углерода кольца одной или несколькими группами, выбранными из гидрокси, галогена, С1-4алкокси, С1-4алкила или циано, и где, если указанная гетероциклическая группа содержит -NH-фрагмент, данный азот может быть необязательно замещен группой, выбранной из G; G выбран из C1-6алкила, необязательно замещенного одним или несколькими А, C1-6алканоила, необязательно замещенного одним или несколькими А, C1-6алкилсульфонила, необязательно замещенного одним или несколькими А, C1-6алкоксикарбонила, необязательно замещенного одним или несколькими А, карбамоила, N-(C1-6алкил) карбамоила, необязательно замещенного одним или несколькими A, N-(С1-6алкил)2карбамоила, необязательно замещенного одним или несколькими А, и бензоила, необязательно замещенного одним или несколькими А; и R4 представляет водород или фтор; или их фармацевтически приемлемые соли, или их гидролизуемые in vivo сложные эфиры. В данном описании термин “алкил” включает алкильные группы как с прямой, так и с разветвленной цепью, но указания на индивидуальные алкильные группы, такие как “пропил” являются конкретными только для вариантов с прямой цепью. Например, термин “C1-6алкил” включает С1-4алкил, С2-4 алкил, пропил, изопропил и трет-бутил. Однако указания на индивидуальные алкильные группы, такие как “пропил” являются специфичными только для вариантов с прямой цепью, а указания на индивидуальные алкильные группы с разветвленной цепью, такие как “изопропил”, являются конкретными только для вариантов с разветвленной цепью. Термин “галоген” относится к фтор, хлор, бром и йодгруппам. Подходящие значения для “присоединенного атомом углерода 6-членного гетероарильного кольца, содержащего 1-2 атома азота”, включают пиридил, пиримидил, пиразинил и пиридазинил. Предпочтительно “присоединенным атомом углерода 6-членным гетероарильным кольцом, содержащим 1-2 атома азота”, является пиридил. В другом аспекте изобретения “присоединенным атомом углерода 6-членным гетероарильным кольцом, содержащим 1-2 атома азота”, предпочтительно является пиридазинил. Подходящие значения для “присоединенного атомом углерода 5-членного гетероарильного кольца, содержащего 1-3 гетероатома”, включают пирролил, фурил, тиенил, пиразолил, оксазолил, оксадиазолил, имидазолил и триазолил. “Присоединенной атомом азота 4-8-членной гетероциклической группой” является насыщенное, частично насыщенное или ненасыщенное моноциклическое кольцо, содержащее 4-8 атомов, из которых, по крайней мере, один является атомом азота, с необязательно, 1-3 дополнительными гетероатомами, независимо выбраными из О, N и S, где группа –СН2– может быть необязательно заменена группой -С(O)-, а атом азота кольца и/или серы может быть необязательно окислен, образуя N-оксид и/или S-оксиды. Очевидно, ясно, что при образовании данной азотной связи атом азота не кватернизирован, т.е. образуется нейтральное соединение. Подходящие значения для “присоединенной атомом азота 4-8-членной гетероциклической группы” включают морфолино, пиперидил, пиперазинил, пирролидинил, тиоморфолино, пирролинил, гомопиперазинил, пирролил, пиразолил, пиразолинил, имидазолил, имидазолинил, имидазолидинил, пиразолидинил и триазолил. Дополнительные подходящие значения для “присоединенной атомом азота 4-8-членной гетероциклической группы” включают азетидинил, морфолино, пиперидил, пиперазинил, пирролидинил, тиоморфолино, пирролинил, гомопиперазинил, пирролил, пиразолил, пиразолинил, имидазолил, имидазолинил, имидазолидинил, пиразолидинил и триазолил. Предпочтительно “присоединенной атомом азота 4-8-членной гетероциклической группой” является морфолино, пиперидил, пиперазинил, пирролидинил, тиоморфолино, пирролинил или гомопиперазинил. Более предпочтительно “присоединенная атомом азота 4-8-членная гетероциклическая группа” представляет азетидинил, морфолино, пиперидил, пиперазинил, пирролидинил, тиоморфолино, пирролинил или гомопиперазинил. Дополнительные подходящие значения для “присоединенной атомом азота 4-8-членной гетероциклической группы” включают азетидинил, морфолино, пиперидил, пиперазинил, пиррролидинил, тиоморфолино, 1-оксотиоморфолино, 1,1-диоксотиоморфолино, пирролинил, гомопиперазинил, пирролил, пиразолил, пиразолинил, имидазолил, имидазолинил, имидазолидинил, пиразолидинил и триазолил. Предпочтительно “присоединенная атомом азота 4-8-членная гетероциклическая группа” представляет морфолино, 1-оксотиоморфолино, 1,1-диоксотиоморфолино, пиперидил, пиперазинил, пирролидинил, тиоморфолино, пирролинил или гомопиперазинил. Более предпочтительно “присоединенная атомом азота 4-8-членная гетероциклическая группа” представляет азетидинил, морфолино, пиперидил, пиперазинил, пирролидинил, тиоморфолино, 1-оксотиоморфолино, 1,1-диоксотиоморфолино, пирролинил или гомопиперазинил. В частности, Rf в качестве “присоединенной атомом азота 4-8-членной гетероциклической группы” представляет азетидинил, морфолино или пирролидинил. В частности, когда R2 представляет “присоединенную атомом азота 4-8-членную гетероциклическую группу”, ею является тиоморфолино. В другом аспекте изобретения, в частности когда R2 представляет “присоединенную атомом азота 4-8-членную гетероциклическую группу”, ею является тиоморфолино, пиперазинил, 1-оксотиоморфолино, 1,1-диоксотиоморфолино или морфолино. “Присоединенная атомом азота 4-6-членная гетероциклическая группа” представляет насыщенное, частично насыщенное или ненасыщенное моноциклическое кольцо, содержащее 4-6 атомов, из которых, по крайней мере, один является атомом азота, с необязательно 1-3 дополнительными гетероатомами независимо выбранными из О, N и S, где группа –CH2– может быть необязательно заменена группой -С(О)-, а атом азота кольца и/или серы может быть необязательно окислен, образуя N-оксид и/или S-оксиды. Очевидно, ясно, что при образовании данной азотной связи атом азота не квартенизирован, т.е. образуется нейтральное соединение. Подходящие значения для “присоединенной атомом азота 4-6-членной гетероциклической группы” включают азетидинил, морфолино, пиперидил, пиперазинил, пирролидинил, тиоморфолино, пирролинил, пирролил, пиразолил, пиразолинил, имидазолил, имидазолинил, имидазолидинил, пиразолидинил и триазолил. Предпочтительно “присоединенная атомом азота 4-6-членная гетероциклическая группа” представляет азетидинил, морфолино или пирролидинил. “Присоединенная атомом азота 5-или 6-членная гетероциклическая группа” представляет насыщенное, частично насыщенное или ненасыщенное моноциклическое кольцо, содержащее 5 или 6 атомов, из которых, по крайней мере, один является атомом азота, с необязательно 1-3 дополнительными гетероатомами, независимо выбранными из О, N и S, где группа –CH2– может быть необязательно заменена группой -С(О)-, а атом азота кольца и/или серы может быть необязательно окислен, образуя N-оксид и/или S-оксиды. Очевидно, ясно, что при образовании данной азотной связи атом азота не кватернизирован, т.е. образуется нейтральное соединение. Подходящие значения для “присоединенной атомом азота 5-или 6-членной гетероциклической группы” включают морфолино, пиперидил, пиперазинил, пирролидинил, тиоморфолино, пирролинил, пирролил, пиразолил, пиразолинил, имидазолил, имидазолинил, имидазолидинил, пиразолидинил и триазолил. Предпочтительно “присоединенная атомом азота 5-6-членная гетероциклическая группа” представляет морфолино, пиперидил, пиперазинил, пирролидинил, тиоморфолино или пирролинил. “Присоединенная атомом азота 6-членная гетероциклическая группа” представляет насыщенное, частично насыщенное или ненасыщенное моноциклическое кольцо, содержащее 6 атомов, из которых, по крайней мере, один является атомом азота с необязательно 1-3 дополнительными гетероатомами, независимо выбранными из О, N и S, где группа –СН2– может быть необязательно заменена группой -С(О)-, а атом азота кольца и/или серы может быть необязательно окислен, образуя N-оксид и/или S-оксиды. Очевидно, ясно, что при образовании данной азотной связи атом азота не кватернизирован, т.е. образуется нейтральное соединение. Подходящие значения для “присоединенной атомом азота 6-членной гетероциклической группы” включают морфолино, пиперидил, пиперазинил, тиоморфолино. “4-8-членная Het” группа представляет насыщенное, частично насыщенное или ненасыщенное моноциклическое кольцо, содержащее 4-8 атомов, включающее 1-4 гетероатома, независимо выбранных из О, N и S, которое может быть присоединено атомом углерода или азота, где группа –CH2– может быть необязательно заменена группой -С(О)-, а атом азота кольца и/или серы может быть необязательно окислен, образуя N-оксид и/или S-оксиды. Подходящие значения для “4-8-членной Het” группы включают морфолино, пиперидил, пиридил, пиранил, пирролил, изотиазолил, тиенил, тиадиазолил, пиперазинил, тиазолидинил, пирролидинил, тиоморфолино, пирролинил, гомопиперазинил, тетрагидропиранил, имидазолил, пиримидил, пиразинил, пиридазинил, изоксазолил, 4-пиридон, 2-пирролидон, 4-тиазолидон, пиридин-N-оксид и хинолин-N-оксид. “5 или 6-членная Het” группа представляет насыщенное, частично насыщенное или ненасыщенное моноциклическое кольцо, содержащее 4-8 атомов, включающих 1-4 гетероатома, независимо выбранных из О, N и S, которое может быть присоединено атомом углерода или азота, где группа –СН2– может быть необязательно заменена группой -С(О)-, а атом азота кольца и/или серы может быть необязательно окислен, образуя N-оксид и/или S-оксиды. Подходящие значения для “5 или 6-членной Het” группы включают морфолино, пиперидил, пиридил, пиранил. пирролил, изотиазолил, тиенил, тиадиазолил, пиперазинил, тиазолидинил, пирролидинил, тиоморфолино, пирролинил, тетрагидропиранил, имидазолил, пиримидил, пиразинил, пиридазинил, изоксазолил, 4-пиридон, 2-пирролидон, 4-тиазолидон, пиридин-N-оксид и хинолин-N-оксид. Примеры “C1-6алкоксикарбонила” включают метоксикарбонил, этоксикарбонил, н- и трет-бутоксикарбонил. Примеры “C1-6алкокси” включают С1-4алкокси, метокси, этокси и пропокси. Примеры “С1-4алкилсульфинила” включают метилсульфинил и этилсульфинил. Примеры “C1-6алкилсульфонила” включают С1-4алкилсульфонил, мезил и этилсульфонил. Примеры “C1-6алканоила” включают С1-4алканоил, пропионил и ацетил. Примерами “С3-7циклоалкила” являются циклопропил и циклогексил. Примерами “С2-6алкенила” являются винил, аллил и 1-пропенил. Примерами “С2-6алкинила” являются этинил, 1-пропинил и 2-пропинил. Примерами “N-(C1-6алкил)карбамоила” являются метиламинокарбонил и этиламинокарбонил. Примерами “N-(С1-6алкил)2карбамоила” являются диметиламинокарбонил и метилэтиламинокарбонил. Примеры “N-(С1-4алкил)амино” включают метиламино и этиламино. Примеры “N-(С1-4алкил)2амино” включают ди-N-метиламино, ди-(N-этил)амино и N-этил-N-метиламино. Примеры “фенилС1-6алкила” включают фенилС1-6алкил, бензил и фенетил. Примеры “С3-7циклоалкилС1-6алкила” включают циклопропилметил, циклопентилэтил и 2-циклогексилпропил. Примеры “(гетероарильное кольцо)C1-6алкила” включают пиридилметил, пиразинилэтил и имидазолилпропил. Согласно следующему аспекту настоящего изобретения предоставляются соединения формулы (I) (как она изображена выше), в которой: n равняется 1 или 2; R1 представляет хлор, фтор, бром, метил или метокси; R2 выбран из одной из следующих трех групп: i) галогена, нитро, гидрокси, амино или циано; ii) -X1-R5, в которой X1 представляет прямую связь, -О-, -S-, -SO-, -SO2-, -NR6-, -CO-, -CONR6-, -NR6CO-, -NR6SO2-или NR6ONR7-, где R6 и R7 независимо представляют водород или С1-4алкил, необязательно замещенный одним или несколькими А; и R5 выбран из C1-6алкила, необязательно замещенного одним или несколькими А, С3-7-циклоалкила, необязательно замещенного одним или несколькими А, С2-6алкенила, необязательно замещенного одним или несколькими А, С2-6алкинила, необязательно замещенного одним или несколькими А, фенила, необязательно замещенного одним или несколькими D, присоединенного у углерода 6-членного гетероарильного кольца, содержащего 1-2 атома азота, необязательно замещенного у атома углерода кольца одним или несколькими D, или присоединенного атомом углерода 5-членного гетероарильного кольца, содержащего 1-3 гетероатома, выбранных независимо из О, N и S, необязательно замещенного у атома углерода кольца одним или несколькими D, где, если указанное 5-членное гетероарильное кольцо содержит -NH-фрагмент, данный азот может быть необязательно замещен группой, выбранной из G; iii) присоединенной атомом азота 4-8-членной гетероциклической группы, необязательно замещенной у атома углерода кольца одним или несколькими D, и где, если указанная гетероциклическая группа содержит -NH-фрагмент, данный азот может быть необязательно замещен группой, выбранной из G; R3 представляет C1-6алкил, необязательно замещенный одним или несколькими А, С3-7циклоалкил, необязательно замещенный одним или несколькими А, фенил, необязательно замещенный одним или несколькими D, присоединенное атомом углерода 6-членное гетероарильное кольцо, содержащее 1-2 атома азота, необязательно замещенное у атома углерода кольца одним или несколькими D, или присоединенное атомом углерода 5-членное гетероарильное кольцо, содержащее 1-3 гетероатома, выбранных независимо из О, N и S, необязательно замещенное у атома углерода кольца одним или несколькими D, и где, если указанное 5-членное гетероарильное кольцо содержит -NH-фрагмент, данный азот может быть необязательно замещен группой, выбранной из G; А выбран из гидрокси, амино, галоген, карбокси и C1-6алкокси; D выбран из: i) –Хa-Rc, где Xa представляет прямую связь, -О-, -S-, -SO-, -SO2-, -CO-, -NRdSO2-, -NRdCO-, -NRdCONRe-, -NRd– или –CONRd-; где Rd и Re независимо представляют водород или С1-4алкил, необязательно замещенный одним или несколькими гидрокси или С1-4алкокси; и Rc выбран из водорода или C1-6алкила, необязательно замещенного одним или несколькими гидрокси или С1-4алкокси; ii) 4-8-членной Het группы, которая необязательно замещена у атома углерода кольца одной или несколькими группами, выбранными из гидрокси, галогена, С1-4алкокси, С1-4алкила или циано, и где, если указанная 4-8-членная Het группа содержит -NH-фрагмент, данный азот может быть необязательно замещен группой, выбранной из G; iii) –Хa-С1-6алкил-Хb-Rc, где Xa и Rc имеют значения, определенные выше, и Xb представляет -S-, -SO-или –SO2-; iv) циано или галогена; G выбран из C1-6алкила, необязательно замещенного одним или несколькими А, C1-6алканоила, необязательно замещенного одним или несколькими А, C1-6алкилсульфонила, необязательно замещенного одним или несколькими А, C1-6алкоксикарбонила, необязательно замещенного одним или несколькими А, карбамоила, N-(C1-6алкил)карбамоила, необязательно замещенного одним или несколькими A, N-(C1-6алкил)2карбамоила, необязательно замещенного одним или несколькими А, и бензоила, необязательно замещенного одним или несколькими А; и R4 представляет водород или фтор; или их фармацевтически приемлемые соли, или их гидролизуемые in vivo сложные эфиры. Соответственно в качестве дополнительного аспекта настоящего изобретения предоставляются соединения формулы (I) (как она изображена выше), в которой: n равняется 1 или 2; R1 представляет хлор, фтор, бром, метил или метокси; R2 выбран из одной из следующих трех групп: i) галогена, нитро, гидрокси, амино или циано; ii) –X1-R5, где X1 представляет прямую связь, -О-, -S-, -SO-, -SO2-, -NR6-, -CO-, -CONR6-, -NR6CO-, -NR6SO2-или NR6CONR7-, где R6 и R7 независимо представляют водород или С1-4алкил, необязательно замещенный одним или несколькими А; и R5 выбран из C1-6алкила, необязательно замещенного одним или несколькими А, С3-7циклоалкила, необязательно замещенного одним или несколькими А, С2-6алкенила, необязательно замещенного одним или несколькими А, С2-6алкинила, необязательно замещенного одним или несколькими А, фенила, необязательно замещенного одним или несколькими D, присоединенного у углерода 6-членного гетероарильного кольца, содержащего 1-2 атома азота, необязательно замещенного атомом углерода кольца одним или несколькими D, или присоединенного у углерода 5-членного гетероарильного кольца, содержащего 1-3 гетероатома, выбранных независимо из О, N и S, необязательно замещенного у атома углерода кольца одним или несколькими D, где, если указанное 5-членное гетероарильное кольцо содержит -NH-фрагмент, данный азот может быть необязательно замещен группой, выбранной из G; iii) присоединенной атомом азота 4-8-членной гетероциклической группы, необязательно замещенной у атома углерода кольца одним или несколькими D, и где, если указанная гетероциклическая группа содержит -NH-фрагмент, данный азот может быть необязательно замещен группой, выбранной из G; R3 представляет C1-6алкил, необязательно замещенный одним или несколькими А, С3-7циклоалкил, необязательно замещенный одним или несколькими А, фенил, необязательно замещенный одним или несколькими D, присоединенное атомом углерода 6-членное гетероарильное кольцо, содержащее 1-2 атома азота, необязательно замещенное у атома углерода кольца одним или несколькими D, или присоединенное атомом углерода 5-членное гетероарильное кольцо, содержащее 1-3 гетероатома, выбранных независимо из О, N и S, необязательно замещенное у атома углерода кольца одним или несколькими D, и где, если указанное 5-членное гетероарильное кольцо содержит -NH-фрагмент, данный азот может быть необязательно замещен группой, выбранной из G; А выбран из гидрокси, амино, галогена, карбокси, N-(C1-4алкил)амино, N,N-ди(С1-4алкил)амино и C1-6алкокси; D выбран из: i) -Xa-Rc, где Xa представляет прямую связь, -О-, -S-, -SO-, -SO2-, -СО-, -NRdSO2-, -NRdCO-, -NRdCONRe-, -NRd– или –CONRd-; где Rd и Re независимо представляют водород или С1-4алкил, необязательно замещенный одним или несколькими гидрокси или С1-4алкокси; и Rc выбран из водорода или C1-6алкила, необязательно замещенного одним или несколькими гидрокси или С1-4алкокси; ii) 4-8-членной Het группы, которая необязательно замещена у атома углерода кольца одной или несколькими группами, выбранными из гидрокси, галогена, С1-4алкокси, С1-4алкила или циано, и где, если указанное 4-8-членная Het группа содержит -NH-фрагмент, данный азот может быть необязательно замещен группой, выбранной из G; iii) –Хa-С1-6алкил-Хb-Rc, где Xa и Rc имеют значения, определенные выше, и Х12 представляет -S-, -SO- или –SO2-; iv) циано или галогена; и v) –Хc-Rf, где Xc представляет -С(О)- или –SO2-, и Rf представляет присоединенную атомом азота 4-8-членную гетероциклическую группу, необязательно замещенную у атома углерода кольца одной или несколькими группами, выбранными из гидрокси, галогена, С1-4алкокси, С1-4алкила или циано, и где, если указанная гетероциклическая группа содержит -NH- фрагмент, данный азот может быть необязательно замещен группой, выбранной из G; G выбран из C1-6алкила, необязательно замещенного одним или несколькими А, C1-6алканоила, необязательно замещенного одним или несколькими А, C1-6алкилсульфонила, необязательно замещенного одним или несколькими А, C1-6алкоксикарбонила, необязательно замещенного одним или несколькими А, карбамоила, N-(C1-6алкил)карбамоила, необязательно замещенного одним или несколькими А, N-(C1-6алкил)2карбамоила, необязательно замещенного одним или несколькими А, и бензоила, необязательно замещенного одним или несколькими А; и R4 представляет водород или фтор; или их фармацевтически приемлемые соли, или их гидролизуемые in vivo сложные эфиры. Предпочтительными значениями R1, R2, R3 и R4 являются следующие. Такие значения могут использоваться, когда это соответствует любому из определений, пунктов формулы изобретения или осуществлении, приведенных выше или далее. В одном аспекте изобретения n предпочтительно равно 1. В другом аспекте изобретения n предпочтительно равно 2. R1 предпочтительно представляет хлор, фтор или бром. Более предпочтительно R1 представляет хлор или фтор. В частности, R1 представляет хлор. В другом аспекте изобретения R1 предпочтительно представляет метил, хлор, фтор или бром. В другом аспекте изобретения более предпочтительно R1 представляет метил, хлор или фтор. В другом аспекте изобретения R1, в частности, представляет метил или хлор. Когда R2 выбран из группы i): Предпочтительно группа i) представляет галоген или гидрокси. Более предпочтительно группа i) представляет галоген. В частности, группа i) представляет хлор или фтор. Более конкретно группа i) представляет хлор. В другом аспекте изобретения, когда R2 выбран из группы i): Предпочтительно группа i) представляет нитро, галоген, амино или гидрокси. Более предпочтительно группа i) представляет нитро, амино или галоген. В частности, группа i) представляет нитро, бром, йод, амино, хлор или фтор. Когда R2 выбран из группы ii): Предпочтительно в группе ii) X1 представляет -S-, -SO-, -SO2-, -NR6– или –NR6CO-; предпочтительно R6 представляет водород; и предпочтительно R5 выбран из C1-6алкила, необязательно замещенного одним или несколькими А, фенила, необязательно замещенного одним или несколькими D, или присоединенного атомом углерода 6-членного гетероарильного кольца, содержащего 1-2 атома азота, необязательно замещенного у атома углерода кольца одним или несколькими D. Более предпочтительно в группе ii) X1 представляет -S-, -SO-, -SO2– или –NR6CO-; более предпочтительно R6 представляет водород; и более предпочтительно R5 выбран из С1-4алкила, необязательно замещенного одним или несколькими А, фенила, необязательно замещенного одним или несколькими D, или присоединенного атомом углерода пиридила, необязательно замещенного у атома углерода кольца одним или несколькими D. В частности, в группе ii) X1 представляет -S- или –NR6CO-; R6 представляет водород; и R5 выбран из метила, необязательно замещенного одним или несколькими А, этила, необязательно замещенного одним или несколькими А, фенила, необязательно замещенного одним или несколькими D, или присоединенного атомом углерода пиридила, необязательно замещенного у атома углерода кольца одним или несколькими D. В другом аспекте изобретения, когда R2 выбран из группы ii): Предпочтительно в группе ii) X1 представляет -S-, -SO-, -SO2-, -NR6– или –NR6CO-; предпочтительно R6 представляет водород; и предпочтительно R5 выбран из C1-6алкила, необязательно замещенного одним или несколькими А, или фенила, необязательно замещенного одним или несколькими D. Более предпочтительно в группе ii) X1 представляет -S-, -SO-, -SO2– или –NR6CO-; более предпочтительно R6 представляет водород; и более предпочтительно R5 выбран из С1-4алкила, необязательно замещенного одним или несколькими А, или фенила, необязательно замещенного одним или несколькими D. В частности, в группе ii) X1 представляет -S-или –NR6CO-; R6 представляет водород; и R5 выбран из метила, необязательно замещенного одним или несколькими А, этила, необязательно замещенного одним или несколькими А, или фенила, необязательно замещенного одним или несколькими D. В другом аспекте изобретения, когда R2 выбран из группы ii): Предпочтительно в группе ii) X1 представляет -О-, -S-, -SO-, -SO2-, -NR6– или –NR6CO-; предпочтительно R6 представляет водород; и предпочтительно R5 выбран из C1-6алкила, необязательно замещенного одним или несколькими А, фенила, необязательно замещенного одним или несколькими D, или фенилC1-6алкила, необязательно замещенного одним или несколькими D. Более предпочтительно в группе ii) Х1 представляет -О-, -S-, -SO-, -SO2– или –NR6CO-; более предпочтительно R6 представляет водород; и более предпочтительно R5 выбран из С1-4алкила, необязательно замещенного одним или несколькими А, фенила, необязательно замещенного одним или несколькими D, или фенилС1-4алкила, необязательно замещенного одним или несколькими D. Когда R2 выбран из группы iii): Предпочтительно группа iii) представляет присоединенную атомом азота 5- или 6-членную гетероциклическую группу, необязательно замещенную у атома углерода кольца одним или несколькими D, и где, если указанная гетероциклическая группа содержит -NH-фрагмент, данный азот может быть необязательно замещен группой, выбранной из G. Более предпочтительно группа iii) представляет присоединенную атомом азота 6-членную гетероциклическую группу, необязательно замещенную у атома углерода кольца одним или несколькими D, и где, если указанная гетероциклическая группа содержит -NH-фрагмент, данный азот может быть необязательно замещен группой, выбранной из G. В частности, группа iii) представляет морфолино, необязательно замещенный у атома углерода кольца одним или несколькими D, пиперидин-1-ил, необязательно замещенный у атома углерода кольца одним или несколькими D, или пиперазин-1-ил, необязательно замещенный у атома углерода кольца одним или несколькими D, и необязательно замещенный у фрагмента -NH-группой, выбранной из G. В другом аспекте изобретения, когда R2 выбран из группы iii): В частности, группа iii) представляет морфолино, необязательно замещенный у атома углерода кольца одним или несколькими D, тиоморфолино, необязательно замещенный у атома углерода кольца одним или несколькими D, пиперидин-1-ил, необязательно замещенный у атома углерода кольца одним или несколькими D, или пиперазин-1-ил, необязательно замещенный у атома углерода кольца одним или несколькими D, и необязательно замещенный у фрагмента -NH-группой, выбранной из G. Более конкретно группа iii) представляет тиоморфолино. В другом аспекте изобретения, когда R2 выбран из группы iii): В частности, группа iii) представляет морфолино, тиоморфолино, 1-оксотиоморфолино, 1,1-диоксотиоморфолино или пиперазин-1-ил, необязательно замещенный у фрагмента -NH-группой, выбранной из G. Предпочтительно А представляет гидрокси, амино, галоген, карбокси и метокси. Более предпочтительно А представляет гидрокси. В другом аспекте изобретения предпочтительно А представляет гидрокси, амино, диметиламино, галоген, карбокси и метокси. В другом аспекте изобретения более предпочтительно А представляет гидрокси, метокси и диметиламино. В другом аспекте изобретения предпочтительно А представляет гидрокси, амино, диметиламино, галоген, карбокси, метокси и карбамоил. Когда D выбран из группы i): Предпочтительно Xa в группе i) представляет -S-, -SO-, -SO2-, -NRd-, -NRdCONRe– или –CONRd-; предпочтительно Rd представляет водород или С1-4алкил, необязательно замещенный одним или несколькими гидрокси; и предпочтительно Rc выбран из водорода или C1-6алкила, необязательно замещенного одним или несколькими гидрокси. Более предпочтительно Xa в группе i) представляет -S-, -SO-, -SO2-, -NRd– или –CONRd-; более предпочтительно Rd представляет водород, метил или этил, необязательно замещенный гидрокси; и более предпочтительно Rc выбран из водорода или С1-4алкила, необязательно замещенного одним или несколькими гидрокси. Более предпочтительно Xa в группе i) представляет -SO-, -SO2-, -NRd– или –CONRd-; более предпочтительно R6 представляет водород, метил или этил, необязательно замещенный гидрокси; и более предпочтительно Rc выбран из водорода, метила или этила, необязательно замещенного гидрокси. В другом аспекте изобретения, когда D выбран из группы i): Предпочтительно Xa в группе i) представляет -SO-, -SO2-, -NRd– или –CONRd-; более предпочтительно Rd представляет водород, метил или этил, необязательно замещенный гидрокси; и более предпочтительно Rc выбран из водорода, метила, этила или бутила, необязательно замещенного гидрокси. Когда D выбран из группы ii): Предпочтительно группа ii) представляет 5- или 6-членную Het группу, которая необязательно замещена у атома углерода кольца одной или несколькими группами, выбранными из гидрокси, галогена, С1-4алкокси, С1-4алкила или циано, и где, если указанная 5- или 6-членная Het группа содержит -NH-фрагмент, данный азот может быть необязательно замещен группой, выбранной из G. Более предпочтительно группа ii) представляет 5-или 6-членную Het группу, которая необязательно замещена у атома углерода кольца одной или несколькими группами, выбранными из гидрокси, галогена, метила, этила, метокси, этокси или циано, и где, если указанная 5- или 6-членная Het группа содержит -NH-фрагмент, данный азот может быть необязательно замещен группой, выбранной из G. В частности, группа ii) представляет морфолино, морфолинил, пиперидинил или пиперазинил, необязательно замещенный у фрагмента -NH-группой, выбранной из G. Когда D выбран из группы iii): Предпочтительно группа iii) представляет –Хa-С2-4алкил-Хb-Rc, где Xa и Rc имеют значения, определенные выше, и Xb предпочтительно представляет -SO-или –SO2-. Когда D выбран из группы iv): Предпочтительно группа iv) представляет циано, фтор или хлор. Более предпочтительно группа iv) представляет фтор или хлор. В другом аспекте изобретения, когда D выбран из группы iv): предпочтительно группа iv) представляет фтор. Когда D выбран из группы v): Предпочтительно Xc представляет -С(О)-, и Rf представляет присоединенную атомом азота 4-6-членную гетероциклическую группу, необязательно замещенную гидрокси. Более предпочтительно Xc представляет -С(О)-, и Rf представляет азетидинил, морфолино или пирролидинил (необязательно замещенный гидрокси). В частности, Xc представляет -С(О)-, и Rf представляет азетидинил, морфолино или 3-гидроксипирролидинил. Предпочтительно G представляет C1-6алканоил, необязательно замещенный одним или несколькими А, или C1-6алкил, необязательно замещенный одним или несколькими А. Более предпочтительно G представляет С1-4алканоил, необязательно замещенный одним или несколькими. А, или C1-4алкил, необязательно замещенный одним или несколькими А. Предпочтительно G представляет ацетил или С2-4алкил, замещенный одним или несколькими А. Более конкретно G представляет ацетил. Предпочтительно R2 представляет хлор, фтор, метилтио, ацетиламино, гидрокси, С1-4алкилсульфинил (необязательно замещенный гидрокси), С1-4алкилсульфонил (необязательно замещенный гидрокси), фенилсульфонил [необязательно замещенный галогеном, амино, N-(С1-4алкил)2карбамоилом (необязательно замещенным гидрокси), N-(С1-4алкил)карбамоилом (необязательно замещенным гидрокси), N-(С1-4алкил)амино (необязательно замещенным гидрокси), N-(С1-4алкил)2амино (необязательно замещенным гидрокси), С1-4алкилсульфинилом (необязательно замещенным гидрокси), С1-4алкилсульфонилом (необязательно замещенным гидрокси), 4-ацетилпиперазин-1-илом, 4-метилпиперазин-1-илом, 4-(2-гидроксиэтил)пиперазин-1-илом, 4-(3-гидроксипропил)пиперазин-1-илом или 4-(2-гидроксипропил)пиперазин-1-илом], пиридилсульфонил [необязательно замещенный галогеном, амино, N-(С1-4алкил)2амино (необязательно замещенным гидрокси), N-(С1-4алкил)2карбамоилом (необязательно замещенным гидрокси), N-(С1-4алкил) карбамоилом (необязательно замещенным гидрокси), N-(С1-4алкил)амино (необязательно замещенным гидрокси), С1-4алкилсульфинилом (необязательно замещенным гидрокси), С1-4алкилсульфонилом (необязательно замещенным гидрокси), 4-ацетилпиперазин-1-илом, 4-метилпиперазин-1-илом, 4-(2-гидроксиэтил)пиперазин-1-илом, 4-(3-гидроксипропил) пиперазин-1-илом или 4-(2-гидроксипропил)пиперазин-1-илом], N-(С1-4алкил) амино (необязательно замещенный гидрокси), морфолино, 4-ацетилпиперазин-1-ил, 4-метилпиперазин-1-ил, 4-(2-гидроксиэтил)пиперазин-1-ил, 4-(3-гидроксипропил)пиперазин-1-ил или 4-(2-гидроксипропил)-пиперазин-1-ил. Более предпочтительно R2 представляет хлор, фтор, метилтио, ацетиламино, гидрокси, метилсульфинил, этилсульфинил (необязательно замещенный гидрокси), мезил, этилсульфонил (необязательно замещенный гидрокси), фенилсульфонил [необязательно замещенный галогеном, амино, N,N-диметилкарбамоилом, N,N-диэтилкарбамоилом (необязательно замещенным гидрокси), N-метил-N-этилкарбамоилом (необязательно замещенным гидрокси), N-метилкарбамоилом, N-этилкарбамоилом (необязательно замещенным гидрокси), метиламино, этиламино (необязательно замещенным гидрокси), N,N-диметиламино, N,N-диэтиламино (необязательно замещенным гидрокси), N-метил-N-этиламино (необязательно замещенным гидрокси), метилсульфинилом, этилсульфинилом (необязательно замещенным гидрокси), мезилом, этилсульфонилом (необязательно замещенным гидрокси), 4-ацетилпиперазин-1-илом, 4-метилпиперазин-1-илом, 4-(2-гидроксиэтил)пиперазин-1-илом, 4-(3-гидроксипропил)пиперазин-1-илом или 4-(2-гидроксипропил)пиперазин-1-илом], пиридилсульфонил [необязательно замещенный галогеном, амино, N,N-диметилкарбамоилом, N,N-диэтилкарбамоилом (необязательно замещенным гидрокси), N-метил-N-этилкарбамоилом (необязательно замещенным гидрокси), N-метилкарбамоилом, N-этилкарбамоилом (необязательно замещенным гидрокси), N,N-диметиламино, N,N-диэтиламино (необязательно замещенным гидрокси), N-метил-N-этиламино (необязательно замещенным гидрокси), метилсульфинилом, этилсульфинилом (необязательно замещенным гидрокси), метиламино, этиламино (необязательно замещенным гидрокси), мезилом, этилсульфонилом (необязательно замещенным гидрокси), 4-ацетилпиперазин-1-илом, 4-метилпиперазин-1-илом, 4-(2-гидроксиэтил)пиперазин-1-илом, 4-(3-гидроксипропил)пиперазин-1-илом или 4-(2-гидроксипропил) пиперазин-1-илом], метиламино, этиламино (необязательно замещенный гидрокси), морфолино, 4-ацетилпиперазин-1-ил, 4-метилпиперазин-1-ил, 4-(2-гидроксиэтил)пиперазин-1-ил, 4-(3-гидроксиэтил)пиперазин-1-ил или 4-(2-гидроксипропил)пиперазин-1-ил. В частности, R2 представляет хлор, фтор, метилтио, ацетиламино или гидрокси. Согласно другому аспекту изобретения предпочтительно R2 представляет хлор, фтор, бром, йод, нитро, амино, метилтио, ацетиламино, гидрокси, С1-4алкилсульфанил (необязательно замещенный гидрокси), С1-4алкилсульфинил (необязательно замещенный гидрокси), С1-4алкилсульфонил (необязательно замещенный гидрокси), N-(С1-4алкил)амино (необязательно замещенный гидрокси, метокси или диметиламино), фенилсульфонил (необязательно замещенный галогеном, амино, N-(C1-4алкил)2карбамоилом (необязательно замещенным гидрокси), N-(C1-4алкил)карбамоилом (необязательно замещенным гидрокси), N-(C1-4алкил)амино (необязательно замещенным гидрокси), N-(C1-4алкил)2амино (необязательно замещенным гидрокси), C1-4алкилсульфинилом (необязательно замещенным гидрокси), C1-4алкилсульфонилом (необязательно замещенным гидрокси), 4-ацетилпиперазин-1-илом, 4-метилпиперазин-1-илом, 4-(2-гидроксиэтил)пиперазин-1-илом, 4-(3-гидроксипропил)пиперазин-1-илом или 4-(2-гидроксипропил)пиперазин-1-илом], пиридилсульфонил [необязательно замещенный галогеном, амино, N-(С1-4алкил)2амино (необязательно замещенным гидрокси), N-(C1-4алкил)2карбамоилом (необязательно замещенным гидрокси), N-(C1-4алкил)карбамоилом (необязательно замещенным гидрокси), N-(C1-4алкил)амино (необязательно замещенным гидрокси), С1-4алкилсульфинилом (необязательно замещенным гидрокси), С1-4алкилсульфонилом (необязательно замещенным гидрокси), 4-ацетил-пиперазин-1-илом, 4-метилпиперазин-1-илом, 4-(2-гидроксиэтил) пиперазин-1-илом, 4-(3-гидроксипропил)пиперазин-1-илом или 4-(2-гидроксипропил) пиперазин-1-илом], N-(С1-4алкил)амино (необязательно замещенный гидрокси), морфолино, 4-ацетилпиперазин-1-ил, 4-метилпиперазин-1-ил, 4-(2-гидроксиэтил)пиперазин-1-ил, 4-(3-гидроксипропил)пиперазин-1-ил или 4-(2-гидроксипропил)пиперазин-1-ил, тиоморфолино, фенилсульфанил (необязательно замещенный N-(С1-4алкил)2карбамоилом) или фенилсульфинил (необязательно замещенный N-(С1-4алкил)2карбамоилом). В следующем аспекте изобретения R2 предпочтительно представляет хлор, фтор, бром, йод, нитро, гидрокси, амино, метилтио, ацетиламино, С1-4алкилсульфанил (необязательно замещенный гидрокси), С1-4алкилсульфинил, С1-4алкилсульфонил, N-(С1-4алкил)амино (необязательно замещенный гидрокси, метокси или диметиламино), тиоморфолино, фенилсульфанил (необязательно замещенный N-(С1-4алкил)2карбамоилом) или фенилсульфинил (необязательно замещенный N-(С1-4алкил)2карбамоилом). В другом аспекте изобретения более предпочтительно R2 представляет хлор, фтор, бром, йод, нитро, амино, метилтио, ацетиламино, гидрокси, метилсульфанил, этилсульфанил (необязательно замещенный гидрокси), метилсульфинил, этилсульфинил (необязательно замещенный гидрокси), мезил, этилсульфонил (необязательно замещенный гидрокси), метиламино, этиламино (необязательно замещенный гидрокси, метокси или диметиламино), фенилсульфонил (необязательно замещенный галогеном, амино, N,N-диметилкарбамоилом, N,N-диэтилкарбамоилом (необязательно замещенным гидрокси), N-метил-N-этилкарбамоилом (необязательно замещенным гидрокси), N-метилкарбамоилом, N-этилкарбамоилом (необязательно замещенным гидрокси), метиламино, этиламино (необязательно замещенным гидрокси), N,N-диметиламино, N,N-диэтиламино (необязательно замещенным гидрокси), N-метил-N-этиламино (необязательно замещенным гидрокси), метилсульфинилом, этилсульфинилом (необязательно замещенным гидрокси), мезилом, этилсульфонилом (необязательно замещенным гидрокси), 4-ацетил-пиперазин-1-илом, 4-метилпиперазин-1-илом, 4-(2-гидроксиэтил) пиперазин-1-илом,. 4-(3-гидроксипропил)пиперазин-1-илом или 4-(2-гидроксипропил)пиперазин-1-илом], пиридилсульфонил [необязательно замещенный галогеном, амино, N,N-диметилкарбамоилом, N,N-диэтилкарбамоилом (необязательно замещенным гидрокси), N-метил-N-этилкарбамоилом (необязательно замещенным гидрокси), N-метилкарбамоилом, N-этилкарбамоилом (необязательно замещенным гидрокси), N,N-диметиламино, N,N-диэтиламино (необязательно замещенным гидрокси), N-метил-N-этиламино (необязательно замещенным гидрокси), метилсульфинилом, этилсульфинилом (необязательно замещенным гидрокси), метиламино, этиламино (необязательно замещенным гидрокси), мезилом, этилсульфонилом (необязательно замещенным гидрокси), 4-ацетилпиперазин-1-илом, 4-метилпиперазин-1-илом, 4-(2-гидроксиэтил)пиперазин-1-илом, 4-(3-гидроксипропил) пиперазин-1-илом или 4-(2-гидроксипропил)пиперазин-1-илом], метиламино, этиламино (необязательно замещенный гидрокси), морфолино, 4-ацетилпиперазин-1-ил, 4-метилпиперазин-1-ил, 4-(2-гидроксиэтил)пиперазин-1-ил, 4-(3-гидроксипропил)пиперазин-1-ил или 4-(2-гидроксипропил)пиперазин-1-ил, тиоморфолино или фенилсульфанил [необязательно замещенный N,N-диметил-карбамоилом, N,N-диэтилкарбамоилом (необязательно замещенным гидрокси), N-метил-N-этилкарбамоилом (необязательно замещенным гидрокси)]. В другом аспекте изобретения предпочтительно R2 представляет фтор, хлор, бром, йод, нитро, амино, гидрокси, метилтио, этилсульфинил, мезил, 2-гидроксиэтиламино, 2-метоксиэтиламино, 2-диметиламиноэтиламино, 2, 3-дигидрокси-пропиламино,-2-гидроксиэтилсульфанил, ацетиламино, 4-N,N-диметилкарбамоилфенилсульфанил, 4-N,N-диметилкарбамоилфенилсульфинил или тиоморфолино. В другом аспекте изобретения предпочтительно R2 представляет хлор, фтор, бром, йод, нитро, амино, метокси, ацетиламино, гидрокси, С1-4алкилсульфанил (необязательно замещенный гидрокси), С1-4алкилсульфинил, С1-4алкилсульфонил, N-(С1-4алкил)амино (необязательно замещенный гидрокси, метокси, диметиламино или карбамоилом), морфолино, 4-ацетилпиперазин-1-ил, тиоморфолино, 1-оксотиоморфолино, 1,1-диоксотиоморфолино, бензиламино, фенокси, фенилсульфанил (необязательно замещенный N-(С1-4алкил)2карбамоилом) или фенил сульфинил (необязательно замещенный N-(С1-4-алкил)2карбамоилом). В другом аспекте изобретения R2 предпочтительно представляет хлор, фтор, бром, йод, нитро, амино, метокси, ацетиламино, гидрокси, метилтио, 2-гидроксиэтилтио, метилсульфинил, мезил, 2-гидроксиэтиламино, 2-метоксиэтил-амино, карбамоилметиламино, 2-диметиламиноэтиламино, 2,3-дигидроксипропиламино, морфолино, 4-ацетилпиперазин-1-ил, тиоморфолино, 1-оксотиоморфолино, 1,1-диоксотиоморфолино, бензиламино, фенокси, 4-(N,N-диметилкарбамоил)фенилсульфанил или 4-(N,N-диметилкарбамоил)фенилсульфинил. В другом аспекте изобретения R2 предпочтительно представляет метилтио, морфолино, 4-ацетилпиперазин-1-ил, 1-оксотиоморфолино или 1,1-диоксотиоморфолино. В следующем аспекте изобретения R2 более предпочтительно представляет амино, 2-гидроксиэтиламино или 2-метокси-этиламино. В дополнительном аспекте изобретения R2 более предпочтительно представляет фтор или хлор. Предпочтительно R3 представляет C1-6алкил, необязательно замещенный одним или несколькими А, фенил, необязательно замещенный одним или несколькими D, или присоединенное атомом углерода 6-членное гетероарильное кольцо, содержащее 1-2 атома азота, необязательно замещенное у атома углерода кольца одним или несколькими D. Более предпочтительно R3 представляет С1-4алкил, необязательно замещенный одним или несколькими А, фенил, необязательно замещенный одним или несколькими D, или присоединенный атомом углерода пиридил, необязательно замещенный у атома углерода кольца одним или несколькими D. В частности, R3 представляет метил, необязательно замещенный одним или несколькими А, этил, необязательно замещенный одним или несколькими А, фенил, необязательно замещенный одним или несколькими D, или присоединенный атомом углерода пиридил, необязательно замещенный у атома углерода кольца одним или несколькими D. В частности, R3 представляет метил, этил, необязательно замещенный одним или несколькими А, фенил, необязательно замещенный одним или несколькими D, или присоединенный атомом углерода пиридил, необязательно замещенный у атома углерода кольца одним или несколькими D. Следовательно, в другом аспекте изобретения предпочтительно R3 представляет С1-4алкил, необязательно замещенный одним или несколькими гидрокси, фенил (необязательно замещенный галогеном, амино, N-(C1-4алкил)2карбамоилом (необязательно замещенным гидрокси), N-(C1-4алкил)карбамоилом (необязательно замещенным гидрокси), N-(C1-4алкил)амино (необязательно замещенным гидрокси), N-(C1-4алкил)2амино (необязательно замещенным гидрокси), C1-4алкилсульфинилом (необязательно замещенным гидрокси), C1-4алкилсульфонилом (необязательно замещенным гидрокси), 4-ацетилпиперазин-1-илом, 4-метилпиперазин-1-илом, 4-(2-гидроксиэтил)пиперазин-1-илом, 4-(3-гидроксипропил)пиперазин-1-илом или 4-(2-гидроксипропил)пиперазин-1-илом], или присоединенный атомом углерода пиридил [необязательно замещенный галогеном, амино, N-(С1-4алкил)2амино (необязательно замещенным гидрокси), N-(С1-4алкил)2карбамоилом (необязательно замещенным гидрокси), N-(С1-4алкил)карбамоилом (необязательно замещенным гидрокси), N-(С1-4алкил)амино (необязательно замещенным гидрокси), С1-4алкилсульфинилом (необязательно замещенным гидрокси), С1-4алкилсульфонилом (необязательно замещенным гидрокси), 4-ацетилпиперазин-1-илом, 4-метилпиперазин-1-илом, 4-(2-гидроксиэтил)пиперазин-1-илом, 4-(3-гидроксипропил)пиперазин-1-илом или 4-(2-гидроксипропил) пиперазин-1-илом]. В частности, R3 представляет метил, этил (необязательно замещенный гидрокси), фенил [необязательно замещенный галогеном, амино, N,N-диметилкарбамоилом, N,N-диэтилкарбамоилом (необязательно замещенным гидрокси), N-метил-N-этилкарбамоилом (необязательно замещенным гидрокси), N-метилкарбамоилом, N-этилкарбамоилом (необязательно замещенным гидрокси), метиламино, этиламино (необязательно замещенным гидрокси), N,N-диметиламино, N,N-диэтиламино (необязательно замещенным гидрокси), N-метил-N-этиламино (необязательно замещенным гидрокси), метилсульфинилом, этилсульфинилом (необязательно замещенным гидрокси), мезилом, этилсульфонилом (необязательно замещенным гидрокси), 4-ацетилпиперазин-1-илом, 4-метилпиперазин-1-илом, 4-(2-гидроксиэтил)пиперазин-1-илом, 4-(3-гидроксипропил)пиперазин-1-илом или 4-(2-гидроксипропил)пиперазин-1-илом], или присоединенный атомом углерода пиридил [необязательно замещенный галогеном, амино, N,N-диметилкарбамоилом, N,N-диэтилкарбамоилом (необязательно замещенным гидрокси), N-метил-N-этилкарбамоилом (необязательно замещенным гидрокси), N-метилкарбамоилом, N-этилкарбамоилом (необязательно замещенным гидрокси), метиламино, этиламино (необязательно замещенным гидрокси), N,N-диметиламино, N,N-диэтиламино (необязательно замещенным гидрокси), N-метил-N-этиламино (необязательно замещенным гидрокси), метил сульфинилом, этилсульфинилом (необязательно замещенным гидрокси), мезилом, этилсульфонилом (необязательно замещенным гидрокси), 4-ацетилпиперазин-1-илом, 4-метилпиперазин-1-илом, 4-(2-гидроксиэтил)пиперазин-1-илом, 4-(3-гидроксипропил)пиперазин-1-илом или 4-(2-гидроксипропил)пиперазин-1-илом]. Более конкретно R3 представляет метил, этил, необязательно замещенный гидрокси, или фенил (необязательно замещенный галогеном). Особенно предпочтительный R3 представляет этил или 4-фторфенил. Следовательно, в другом аспекте изобретения R3 предпочтительно представляет С1-4алкил (необязательно замещенный одним или несколькими гидрокси), фенил [необязательно замещенный галогеном, амино, N-(C1-4алкил)2карбамоилом (необязательно замещенным гидрокси), N-(C1-4алкил)карбамоилом (необязательно замещенным гидрокси), N-(C1-4алкил)амино (необязательно замещенным гидрокси), N-(C1-4алкил)2амино (необязательно замещенным гидрокси), C1-4алкилсульфинилом (необязательно замещенным гидрокси), C1-4алкилсульфонилом (необязательно замещенным гидрокси), 4-ацетилпиперазин-1-илом, 4-метилпиперазин-1-илом, 4-(2-гидроксиэтил)пиперазин-1-илом, 4-(3-гидроксипропил)пиперазин-1-илом, 4-(2-гидроксипропил)пиперазин-1-илом, азетидинилкарбонилом, морфолинокарбонилом или пирролидинилкарбонилом (необязательно замещенным гидрокси)], или присоединенный атомом углерода пиридил [необязательно замещенный галогеном, амино, N-(С1-4алкил)2амино (необязательно замещенным гидрокси), N-(С1-4алкил)2карбамоилом (необязательно замещенным гидрокси), N-(С1-4алкил)карбамоилом (необязательно замещенным гидрокси), N-(С1-4алкил) амино (необязательно замещенным гидрокси), C1-4алкилсульфинилом (необязательно замещенным гидрокси), C1-4алкилсульфонилом (необязательно замещенным гидрокси), 4-ацетилпиперазин-1-илом, 4-метилпиперазин-1-илом, 4-(2-гидроксиэтил)пиперазин-1-илом, 4-(3-гидроксипропил)пиперазин-1-илом или 4-(2-гидроксипропил)пиперазин-1-илом]. В следующем аспекте изобретения R3 предпочтительно представляет С1-4алкил (необязательно замещенный одним или несколькими гидрокси), фенил [необязательно замещенный галогеном, N-(С1-4алкил)2карбамоилом, N-(С1-4алкил) карбамоилом, N-(С1-4алкил)амино (необязательно замещенным гидрокси), C1-4алкилсульфонилом, азетидинилкарбонилом, морфолинокарбонилом или пирролидинкарбонилом (необязательно замещенным гидрокси)], или присоединенный атомом углерода пиридил [необязательно замещенный амино]. В частности, R3 представляет метил, этил (необязательно замещенный гидрокси), бутил (необязательно замещенный гидрокси), фенил [необязательно замещенный галогеном, амино, N,N-диметил-карбамоилом, N,N-диэтилкарбамоилом (необязательно замещенным гидрокси), N-метил-N-этилкарбамоилом (необязательно замещенным гидрокси), N-метилкарбамоилом, N-этилкарбамоилом (необязательно замещенным гидрокси), метиламино, этиламино (необязательно замещенным гидрокси), N,N-диметиламино, N,N-диэтиламино (необязательно замещенным гидрокси), N-метил-N-этиламино (необязательно замещенным гидрокси), метилсульфинилом, этилсульфинилом (необязательно замещенным гидрокси), мезилом, этилсульфонилом (необязательно замещенным гидрокси), 4-ацетилпиперазин-1-илом, 4-метилпиперазин-1-илом, 4-(2-гидроксиэтил)пиперазин-1-илом, 4-(3-гидроксипропил) пиперазин-1-илом, 4-(2-гидроксипропил)пиперазин-1-илом, азетидинилкарбонилом, морфолинокарбонилом или пирролидинилкарбонилом (необязательно замещенным гидрокси)], или присоединенный атомом углерода пиридил [необязательно замещенный галогеном, амино, N,N-диметилкарбамоилом, N,N-диэтилкарбамоилом (необязательно замещенным гидрокси), N-метил-N-этилкарбамоилом (необязательно замещенным гидрокси), N-метилкарбамоилом, N-этилкарбамоилом (необязательно замещенным гидрокси), метиламино, этиламино (необязательно замещенным гидрокси), N,N-диметиламино, N,N-диэтиламино (необязательно замещенным гидрокси), N-метил-N-этиламино (необязательно замещенным гидрокси), метилсульфинилом, этилсульфинилом (необязательно замещенным гидрокси), мезилом, этилсульфонилом (необязательно замещенным гидрокси), 4-ацетилпиперазин-1-илом, 4-метилпиперазин-1-илом, 4-(2-гидроксиэтил)пиперазин-1-илом, 4-(3-гидроксипропил)пиперазин-1-илом или 4-(2-гидроксипропил)-пиперазин-1-илом]. Более конкретно, R3 представляет метил, этил, 2-гидроксиэтил, 2-гидроксибутил, 4-фторфенил, 4-мезилфенил, 4-(2-гидроксиэтиламино)фенил, 4-(N-метилкарбамоил)фенил, 4-(N-этилкарбамоил)фенил, 4-(N,N-диметилкарбамоил)фенил, 4-(N-метил-N-этилкарбамоил)фенил, 4-(азетидинилкарбонил)фенил, 4-(морфолинокарбонил)фенил, 4-(3-гидроксипирролидинилкарбонил) фенил или 6-аминопирид-2-ил. В другом аспекте изобретения R3, в частности, представляет метил, этил (необязательно замещенный гидрокси), изопропил, бутил (необязательно замещенный гидрокси), фенил [необязательно замещенный галогеном, N,N-диметилкарбамоилом, N-метил-N-этилкарбамоилом, N-метилкарбамоилом, N-этилкарбамоилом, этиламино (необязательно замещенным гидрокси), мезилом, азетидинилкарбонилом, морфолинокарбонилом или пирролидинилкарбонилом (необязательно замещенным гидрокси)], или присоединенный атомом углерода пиридил [необязательно замещенный амино]. В другом аспекте изобретения R3 более конкретно представляет метил, этил, 2-гидроксиэтил, изопропил, 2-гидроксибутил, 4-фторфенил, 4-(2-гидроксиэтиламино)фенил, 4-мезилфенил, 4-(N,N-диметилкарбамоил)фенил, 4-(N-этилкарбамоил)фенил, 4-(N-метил-N-этилкарбамоил)фенил, 4-(N-метилкарбамоил)фенил, 4-(азетидинилкарбонил)фенил, 4-(морфолинокарбонил)фенил, 4-(3-гидроксипирролидинилкарбонил)фенил или 2-аминопирид-6-ил. В другом аспекте изобретения более конкретно предпочтительный R3 представляет метил, этил или изопропил. В следующем аспекте изобретения R3 более предпочтительно представляет 4-(N-метилкарбамоил)фенил или 4-(N,N-диметилкарбамоил)фенил. В следующем аспекте изобретения R3 особенно предпочтительно представляет 4-(N,N-диметилкарбамоил)фенил. В одном аспекте изобретения R4 предпочтительно представляет водород. В другом аспекте изобретения R4 предпочтительно представляет фтор. При хиральном центре -С(ОН)(Me)(СF3) предпочтительной стереохимией обычно является R-конфигурация. Поэтому в другом аспекте изобретения предоставляются соединения формулы (I), изображенной выше, в которой: n равняется 1 или 2; R1 представляет метил, хлор или фтор; R2 представляет хлор, фтор, бром, йод, нитро, амино, метокси, ацетиламино, гидрокси, С1-4алкилсульфанил (необязательно замещенный гидрокси), С1-4алкилсульфинил, C1-4алкилсульфонил, N-(С1-4алкил)амино (необязательно замещенный гидрокси, метокси, диметиламино или карбамоилом), морфолино, 4-ацетилпиперазин-1-ил, тиоморфолино, 1-оксотиоморфолино, 1,1-диоксотиоморфолино, бензиламино, фенокси, фенилсульфанил (необязательно замещенный N-(С1-4алкил)2карбамоилом) или фенил сульфинил (необязательно замещенный N-(С1-4алкил)2карбамоилом). R3 представляет метил, этил (необязательно замещенный гидрокси), изопропил, бутил (необязательно замещенный гидрокси), фенил [необязательно замещенный галогеном, N,N-диметилкарбамоилом, N-метил-N-этилкарбамоилом, N-метилкарбамоилом, N-этилкарбамоилом, этиламино (необязательно замещенным гидрокси), мезилом, азетидинилкарбонилом, морфолинокарбонилом или пирролидинилкарбонилом (необязательно замещенным гидрокси)], или присоединенный атомом углерода пиридил [необязательно замещенный амино]; и R4 представляет водород. или их фармацевтически приемлемые соли, или их гидролизуемые in vivo сложные эфиры. Поэтому в другом аспекте изобретения предлагаются соединения формулы (I), приведенной выше, в которой: n равняется 1 или 2; R1 представляет хлор; R2 представляет метилтио, морфолино, 4-ацетилпиперазин-!-ил, 1-оксотиоморфолино или 1,1-диоксотиоморфолино; R3 представляет метил, этил или изопропил; R4 представляет водород; или их фармацевтически приемлемые соли, или их гидролизуемые in vivo сложные эфиры. Предпочтительным соединением изобретения является любое соединение примеров, или его фармацевтически приемлемая соль, или его гидролизуемый in vivo сложный эфир. Более предпочтительными соединениями изобретения являются соединения примеров 7, 8, 22, 23, 24, 28, 48, 64, 69, 70, 74, 75, или их фармацевтически приемлемые соли, или гидролизуемые in vivo сложные эфиры. В другом аспекте изобретения более предпочтительными соединениями изобретения являются соединения примеров 32, 35 и 61, или их фармацевтически приемлемые соли, или гидролизуемые in vivo сложные эфиры. В следующем аспекте изобретения более предпочтительными соединениями изобретения являются соединения примеров 17, 18 и 58, или их фармацевтически приемлемые соли, или гидролизуемые in vivo сложные эфиры. Предпочтительными аспектами изобретения являются аспекты, которые относятся к соединению и его фармацевтически приемлемой соли. В настоящем изобретении следует понимать, что соединение формулы (I) или его соль может проявлять явление таутомеризма и что формулы в данном описании могут представлять только одну из возможных таутомерных форм. Следует понимать, что изобретение охватывает все таутомерные формы, которые повышают ПДГ-активность, и не ограничивается лишь какой-либо одной таутомерной формой, использованной при изображении формул. Изображения формул в данном описании могут представлять только одну из возможных таутомерных форм, и следует понимать, что описание охватывает все возможные таутомерные формы изображенных соединений, а не только те формы, которые показаны здесь графически. Специалистам очевидно ясно, что некоторые соединения формулы (I) содержат один или несколько ассиметрически замещенных атомов углерода и/или серы и соответственно могут существовать и быть выделенными в виде энантиомерно чистых, или в виде смеси диастереоизомеров, или в виде рацематов. Некоторые соединения могут проявлять полиморфизм. Следует понимать, что настоящее изобретение охватывает любые рацемические, оптически активные, энантиомерно чистые формы, смеси диастереоизомеров, полиморфные или стереоизомерные формы или их смеси, которые обладают свойствами, полезными для повышения ПДГ-активности, причем хорошо известно в данной области техники, как получить оптически активные формы (например, разделением рацемической формы методами перекристаллизации, синтезом из оптически активных исходных материалов, хиральным синтезом, ферментативным разделением (например, WO 9738124), биотрансформацией или хроматографическим разделением с использованием хиральной стационарной фазы) и как определить эффективность повышения ПДГ-активности стандартными тестами, описанными здесь далее. Следует также понимать, что некоторые соединения формулы (I) и их соли могут существовать в сольватированных, а также несольватированных формах, таких как, например, гидратированные формы. Следует понимать, что изобретение охватывает все такие сольватированные формы, которые повышают ПДГ-активность. Соединение формулы (I) или его соль и другие соединения изобретения (определенные здесь ниже) могут быть получены любым способом, который известен для получения химически родственных соединений. Такие способы включают, например, способы, проиллюстрированные в публикациях европейских патентных заявок 0524781, 0617010, 0625516 и в GB 2278054, WO 9323358 и WO 9738124, Еще один аспект настоящего изобретения предоставляет способ получения соединения формулы (I), или его фармацевтически приемлемой соли, или гидролизуемого in vivo сложного эфира, который (в данном способе изменяемые группы имеют значения, определенные для формулы (I), если не указано иное) включает: (а) снятие защиты с защищенного соединения формулы (II): в которой Рg представляет защитную группу спирта; (b) окисление соединения формулы (III): (с) сочетание соединений формулы (IV): с кислотой формулы (V): в которой Х представляет ОН; (d) сочетание анилина формулы (IV) с активированным производным кислоты формулы (V); и затем, если необходимо: i) превращение соединения формулы (I) в другое соединение формулы (I); ii) удаление любых защитных групп; или iii) образование фармацевтически приемлемой соли или гидролизуемого in vivo сложного эфира. Подходящими значениями для Рg являются бензильная группа, силильная группа (например, триалкилсилильная группа или алкилдифенилсилильная группа) или защитная группа ацетила. Если формула (V) представляет активированное производное кислоты, подходящие значения для Х включают галоген (например, хлор или бром), ангидриды, арилокси (например, 4-нитрофенокси или пентафторфенокси) или имидазол-1-ил. Конкретными условиями для приведенных выше реакций являются следующие: Процесс а) Примерами подходящих реагентов для снятия защиты со спирта формулы (II) являются: 1) когда Рg представляет бензил: (i) водород в присутствии катализатора палладий/уголь, т.е. гидрогенолиз; или (ii) бромистый водород или йодистый водород; 2) когда Рg представляет силильную защитную группу: (i) фторид тетрабутиламмония или (ii) водная фтористоводородная кислота; 3) когда Рg представляет ацетил: (i) мягкое водное основание, например гидроксид лития; или (ii) аммиак или амин, такой как диметиламин. Реакцию можно проводить в подходящем растворителе, таком как EtOH, MeOH, ацетонитрил или ДМСО, и удобно можно проводить при температуре в интервале от -40 до 100°С. Соединения формулы (II) могут быть получены по следующей схеме: Е представляет защитную группу карбоксигруппы. Подходящие значения для Е включают C1-6алкил, такой как метил и этил. Соединения формулы (IIа) являются промышленно доступными, или они известны из литературы, или их получают стандартными способами, известными в данной области техники. Синтез соединений формулы (IV) описан ниже. Процесс b) Подходящие окислительные агенты включают перманганат калия, OXONE, перйодат калия, гидроперекись трет-бутила (в виде раствора в толуоле), перкислоты (такие как, например, 3-хлорпероксибензойная кислота), перекись водорода, ТРАР (перрутенат тетрапропиламмония) или кислород. Реакцию можно проводить в подходящем растворителе, таком как диэтиловый эфир, DCM (ДХМ), МеОН, EtOH, вода, уксусная кислота или смеси двух или более из данных растворителей. Реакцию можно удобно проводить при температуре в интервале от -40 до 100°С. Соединения формулы (III) могут быть получены в соответствии со следующими схемами: Специалисту очевидно ясно, что порядок стадий 1 и 2 в схеме 2 может быть изменен на обратный. где М представляет щелочной металл. Подходящие значения для М включают литий, натрий или калий. Х представляет уходящую группу, подходящие значения для Х включают галоген, мезил и тозил. X представляет уходящую группу, подходящие значения для Х включают галоген, мезил и тозил. Соединения формулы (IIIa) и (IIId) являются промышленно доступными или известны из литературы, или могут быть получены стандартными способами, известными в данной области техники. Процесс с) Реакцию можно проводить в присутствии подходящего агента сочетания. В качестве подходящих агентов сочетания могут применяться известные в данной области техники стандартные пептидные агенты сочетания, например, такие как описаны выше для сочетания (IId) и (IV), или, например, дициклогексилкарбодиимид, необязательно в присутствии катализатора, такого как диметиламинопиридин или 4-пирролидинопиридин, необязательно в присутствии основания, например, триэтиламина, пиридина или 1, 6-диалкилпиридинов (таких как 2,6-лутидин или 2,6-ди-трет-бутилпиридин) или 2,6-дифенилпиридина. Подходящие растворители включают DMA, ДХМ, бензол, ТГФ и ДМФ. Реакцию сочетания можно удобно проводить при температуре в интервале от -40 до 40°С. Соединения формулы (IV) являются промышленно доступными или известны из литературы или их получают стандартными способами, известными в данной области техники, например, они могут быть получены окислением соединений формулы (IIIf) (с анилином, защищенным подходящей защитной группой в стандартных условиях окисления, например, перекисью водорода или мета-хлорпероксибензойной кислотой (с последующим снятием защиты), или они могут быть получены по следующей схеме: Соединения формул (IVa) и (V) являются промышленно доступными или известны из литературы или их получают стандартными способами, известными в данной области техники. Если требуется разделенная кислота формулы (V), она может быть получена любым из известных методов получения оптически активных форм (например, перекристаллизацией хиральной соли (например, WO 9738124), ферментативным разделением или хроматографическим разделением с использованием хиральной стационарной фазы). Если, например, требуется выделенная (R)-(+) кислота, она может быть получена по способу схемы 2 международной публикации патентной заявки WO 9738124 для получения (S)-(-) кислоты, т.е. с использованием классического метода разделения, описанного в ЕР публикации 0524781 также для получения (S)-(-) кислоты, за исключением того, что вместо (S)-(-)-1-фенилэтиламина может быть использован (1S,2R)-норэфедрин. Хиральная кислота может быть получена также с использованием способа ферментативного разделения, описанного в Tetrahedron Assymetry, 1999, 10, 679. Процесс d) Данное сочетание может быть осуществлено необязательно в присутствии основания, например триэтиламина, пиридина или 2,6-диалкилпиридинов (таких как 2,6-лутидин или 2,6-ди-трет-бутилпридин) или 2,6-дифенилпиридина. Подходящие растворители включают DMA, ДХМ, бензол, ТГФ и ДМФ. Реакцию сочетания можно удобно проводить при температуре в интервале от -40 до 40°С. Необходимые исходные вещества для таких процедур, как описаны выше, если они промышленно не доступны, могут быть получены с помощью процедур, выбранных из стандартных приемов органической химии, приемов, которые являются аналогами синтеза известных структурно сходных соединений, или приемов, которые являются аналогами описанной выше процедуры или процедур, описанных в примерах. Например, очевидно ясно, что некоторые из необязательных ароматических заместителей в соединениях настоящего изобретения могут быть введены стандартными реакциями ароматического замещения или получены обычной модификацией функциональных групп или внутренним превращением или до, или непосредственно после указанных выше процедур, и как таковые включены в аспект, касающийся способа изобретения. Такие реакции и модификации включают, например, введение заместителя реакцией ароматического замещения, восстановление заместителей, алкилирование заместителей и окисление заместителей. Реагенты и условия реакций для таких процедур хорошо известны в данной области химии. Конкретные примеры реакций ароматического замещения включают введение нитрогруппы с использованием концентрированной азотной кислоты, введение ацильной группы с использованием, например, ацилгалогенида и кислоты Льюиса (такой как трихлорид алюминия) в условиях реакции Фриделя-Крафтса, и введение галогенгруппы. Конкретные примеры реакций модификации включают восстановление нитрогруппы в аминогруппы, например, каталитическим гидрированием с никелевым катализатором или обработкой железом в присутствии хлористоводородной кислоты при нагревании; окисление алкилтио в алкилсульфинил или алкилсульфонил с использованием, например, перекиси водорода в уксусной кислоте при нагревании или 3-хлорпербензойной кислоты. Конкретными примерами внутреннего превращения функциональной группы являются, например, превращение анилина в галогенфенил, например, диазотированием в присутствии галогенидов меди. Отмечено, что многие из исходных материалов для описанных выше синтетических методов являются промышленно доступными и/или широко известны из научной литературы, или могут быть получены из промышленно доступных соединений с использованием адаптации способов, известных из научной литературы. Очевидно, также ясно, что в некоторых из указанных здесь реакций может быть необходимо/желательно защитить любые чувствительные группы в соединении. Примеры, когда защита необходима или желательна, и подходящие способы защиты известны специалистам в данной области. Так, если реагенты включают такие группы, как амино, карбокси или гидрокси, может оказаться желательным защитить группу в некоторых из указанных здесь реакций. Подходящей защитной группой для амино или алкиламино группы является, например, ацильная группа, например, алканоильная группа, такая как ацетил, алкоксикарбонильная группа, например, метоксикарбонильная, этоксикарбонильная или трет-бутилкарбонильная группа, арилметоксикарбонильная группа, например бензилоксикарбонил, или ароильная группа, например, бензоил. Условия снятия защиты для указанных выше защитных групп обязательно меняются в зависимости от выбора защитной группы. Так, например, ацильная группа, такая как алканоил, или алкоксикарбонильная группа, или ароильная группа, может быть удалена, например, гидролизом подходящим основанием, таким как гидроксид щелочного металла, например, гидроксид лития или гидроксид натрия. Альтернативно, ацильная группа, такая как трет-бутилкарбонильная группа, может быть удалена, например, обработкой подходящей кислотой, такой как, например, хлористоводородная, серная или фосфорная кислота или ТФУК, а арилметоксикарбонильная группа, такая как бензилоксикарбонильная группа, может быть удалена, например, гидрированием в присутствии катализатора, такого как палладий-на-угле, или обработкой кислотой Льюиса, например, трис(трифторацетатом)бора. Подходящей альтернативной защитной группой для первичной аминогруппы является, например, фталоильная группа, которая может быть удалена обработкой алкиламином, например, диметиламинопропиламином или гидразином. Подходящей защитной группой для гидроксигруппы является, например, ацильная группа, например, алканоильная группа, такая как ацетил, ароильная группа, например, бензоил, или арилметильная группа, например, бензил. Условия снятия защиты для указанных выше защитных групп будут меняться в зависимости от выбора защитной группы. Так, например, ацильная группа, такая как алканоильная или ароильная группа, может быть удалена, например, гидролизом подходящим основанием, таким как гидроксид щелочного металла, например, гидроксид лития или гидроксид натрия. Альтернативно, арилметильная группа, такая как бензильная группа, может быть удалена, например, гидрированием в присутствии катализатора, такого как палладий-на-угле. Подходящей защитной группой для карбокси группы является, например, этерифицирующая группа, например, метильная или этильная группа, которая может быть удалена, например, гидролизом основанием, таким как гидроксид натрия, или, например, трет-бутильная группа, которая может быть удалена, например, обработкой кислотой, например, органической кислотой, такой как ТФУК, или, например, бензильная группа, которая может быть удалена, например, гидрированием на катализаторе, таком как паладий-на-угле. Защитные группы могут быть удалены на любой удобной стадии синтеза с использованием обычных приемов, хорошо известных в данной области химии. В случаях когда соединения формулы (I) являются достаточно основными или кислотными для образования стабильных кислых или основных солей, может быть подходящим введение соединения в виде соли и фармацевтически приемлемые соли могут быть получены обычными методами, такими как описанные далее. Примерами подходящих фармацевтически приемлемых солей являются соли присоединения органических кислот, образованные с кислотами, которые образуют физиологически приемлемый анион, например, тозилат, метансульфонат, ацетат, тартрат, цитрат, сукцинат, бензоат, аскорбат, Фармацевтически приемлемые соли могут быть получены при использовании стандартных процедур, хорошо известных в данной области техники, например, реакцией достаточно основного соединения формулы (I) (или его сложного эфира) с подходящей кислотой, дающей физиологически приемлемый анион. С большинством соединений изобретения возможно также образование соли соответствующего щелочного металла (например, натрия, калия или лития) или щелочноземельного металла (например, кальция) обработкой соединения формулы (I) (и в некоторых случаях его сложного эфира) одним эквивалентом гидроксида или алкоксида (например, метоксида или этоксида) щелочного металла или щелочноземельного металла в водной среде с последующими обычными методами очистки. Соединения формулы (I) могут вводиться в форме пролекарства, которое распадается в организме человека или животного, образуя соединение формулы (I). Примеры пролекарств включают гидролизуемые in vivo сложные эфиры соединений формулы (I). Гидролизуемым in vivo сложным эфиром соединения формулы (I), содержащего карбокси или гидрокси группу, является, например, фармацевтически приемлемый сложный эфир, который гидролизуется в организме человека или животного, давая исходные кислоту или спирт. Подходящие гидролизуемые in vivo сложные эфиры для соединения формулы (I), содержащего карбоксигруппу, включают C1-6алкоксиметиловые эфиры, например, метоксиметиловый; C1-6алканоилоксиметиловые эфиры, например, пивалоилоксиметиловый; фталидиловые эфиры; С3-8циклоалкоксикарбонилоксиС1-6алкиловые эфиры, например, 1-циклогексилкарбонилоксиэтиловый; 1,3-диоксолен-2-онилметиловые эфиры, например, 5-метил-1,3-диоксолен-2-онилметиловый; и C1-6алкоксикарбонилоксиэтиловые эфиры, например, 1-метоксикарбонилоксиэтиловый, и они могут быть образованы по любой карбоксигруппе соединений данного изобретения. Подходящие гидролизуемые in vivo сложные эфиры для соединения формулы (I), содержащего гидроксигруппу, включают неорганические эфиры, такие как фосфатные эфиры, и Разлагаемые in vivo пролекарства соединений формулы (I) включают также гидролизуемые in vivo амиды соединений формулы (I), содержащие карбоксигруппу, например, N-C1-6алкил-или N-ди-С1-6алкиламид, такие как N-метил-, N-этил-, N-пропил-, N-диметил-, N-этил-N-метил- или N-диэтиламид. Идентификация соединений, которые повышают ПДГ-активность, является предметом настоящего изобретения. Данные свойства могут оцениваться, например, с использованием одной или нескольких процедур, представленных ниже. (а) Повышение ПДГ-активности in vitro Данный тест определяет способность испытуемого соединения повышать ПДГ-активность. Кодирующая ПДГ-киназу с-ДНК может быть получена цепной реакцией полимеразы (PCR) и последующим клонированием. Она может быть экспрессирована в подходящей системе экспресии с получением полипептида с ПДГ-киназной активностью. Например, было обнаружено, что ПДГкиназаII крыс (rPDHKII), полученная экспрессией рекомбинантного протеина у Escherichia coli (E.coli), проявляет ПДГкиназную активность. В случае rPDHKII (Genbank accession No U10357) 1,3 т.п.н. фрагмент, кодирующий протеин, выделяли с помощью PCR из сДНК печени крыс и клонировали в вектор (например, pQE32-Quiagen Ltd). Рекомбинантный конструкт трансформировали в E.coli (например, M15pRep4 – Quiagen Ltd.). Рекомбинантные клоны идентифицировали, выделяли плазмиду ДНК и проводили анализ последовательности ДНК. Для работ по экспрессии выбирали один клон, который имел ожидаемую последовательность нуклеиновой кислоты. Подробности способов сборки молекул рекомбинантной ДНК и экспрессии рекомбинантных протеинов в бактериальные системы можно найти в стандартных работах, например, в Sambrook et al., 1989, Molecular Cloning – A Laboratory Manual, 2nd Edition, Cold Spring Harbour Laboratory Press. Другие известные ПДГкиназы для использования в тестах могут быть клонированы и экспрессированы аналогичным образом. Для экспрессии rPDHKII-активности клетки штамма E.coli M15pRep4 трансформировали вектором pQE32, содержащим rPDHKII сДНК. Данный вектор вводит в протеин по его N-концу метку 6-His. E.coli выращивали до оптической плотности 0,6 (600 нм) и индуцировали экспрессию протеина добавлением 10 мкМ изопропилтио- Каждую новую партию исходного раствора фермента при анализе титровали для определения концентрации, дающей примерно 90% ингибирование ПДГ в условиях опыта. Для типичной партии исходный раствор фермента разводили до 7,5 мкг/мл. Для оценки активности новых соединений соединения разводили 10% ДМСО и 10 мкл переносили в отдельные лунки 96-луночных тест-планшетов. Контрольные лунки содержали 20 мкл 10% ДМСО вместо соединения. 40 мкл буфера, содержащего 50 мМ калий-фосфатный буфер, рН 7,0, 10 мМ этиленгликоль-бис ( (b) Повышение ПДГ-активности in vitro в изолированных первичных клетках Данный тест определяет способность соединений стимулировать окисление пирувата в первичных гепатоцитах крыс. Гепатоциты выделяли с помощью процедуры двухступенчатого расщепления коллагеназой, описанной Seglen (Methods Cel. Biol. (1976) 13, 29-33) и помещали в 6-луночный культуральный планшет (Falcon Primaria) no 600000 жизнеспособных клеток на лунку в модифицированной по способу Дюльбеко среде Игла (DMEM, Gibco BRL), содержащей 10% фетальной бычьей сыворотки (ФБС), 10% смеси пенициллин/стрептомицин (Gibco BRL) и 10% заменимых аминокислот (NEAA, Gibco BRL). После 4 часов инкубации при 37°С в 5% СO2 среду заменяли минимальной средой (MEM, Gibco BRL), содержащей, как и предыдущая, NEAA и пенициллин/стрептомицин в дополнение к 10 нМ дексаметазону и 10 нМ инсулину. На следующий день клетки промывали фосфатно-солевым буфером (PBS) и заменяли среду раствором Кребса забуференным HEPES (25 мМ HEPES, 0,15 М хлорида натрия, 25 мМ бикарбоната натрия, 5 мМ хлорида калия, 2 мМ хлорида кальция, 1 мМ сульфата магния, 1 мМ дигидрофосфата калия), содержащим испытуемое соединение с требуемой концентрацией в 0,1% ДМСО. Контрольные лунки содержали только 0,1% ДМСО, и максимальную ответную реакцию определяли с использованием обработки 10 мкМ известного активного соединения. После периода прединкубации в течение 40 минут при 37°С в 5% CO2 клетки в течение 12 минут подвергались воздействию пируватом натрия до конечной концентрации 0,5 мМ (содержащим 1-14C пируват натрия (продукт Amersham CFA85) 0,18Ci/ммоль). Затем среду удаляли и переносили в пробирку, которую немедленно герметично закрывали пробкой, содержащей подвешенный центровой колодец. Абсорбент внутри центрового колодца насыщали 50% фенилэтиламином, и при добавлении 0,2 мкл 60% (мас./об.) перхлорной кислоты (РСА) из среды выделялся СО2. Высвобожденный 14СО2, уловленный абсорбентом, определяли методом жидкостного сцинтилляционного подсчета. Величину ED50 для испытуемого соединения определяли обычным путем с использованием результатов 7 концентраций соединения. (с) Повышение ПДГ-активности in vivo Способность соединений увеличивать активность ПДГ в соответствующих тканях крыс может быть измерена с использованием описанного ниже теста. Обычно увеличение доли ПДГ в ее активной нефосфорилированной форме может быть обнаружено в ткани мышц, сердца, печени и жировой ткани после единичного введения активного соединения. Можно ожидать, что это ведет к уменьшению содержания глюкозы в крови после повторного введения соединения. Например, единичное введение 150 мг/кг внутрибрюшинно DCA, соединения, известного как активирующего ПДГ путем ингибирования ПДГ-киназы (Whitehouse, Cooper and Randle (1974) Biochem.J. 141, 761-774) увеличивало долю ПДГ в ее активной форме (Vary et al., (1988) Circ. Shock 24, 3-18) и после повторного введения приводило к значительному понижению содержания глюкозы в плазме (Evans and Stacpoole (1982) Biochem. Pharmacol. 31, 1295-1300). Группу крыс (весовой интервал 140-180 г) обрабатывали единичной дозой или множественными дозами соединения, представляющего интерес, кормлением через рот в подходящем носителе. Контрольную группу крыс обрабатывали только носителем. В фиксированное время после конечного введения соединения животных полностью анестезировали, ткани удаляли и замораживали в жидком азоте. Для определения ПДГ-активности образцы мышечной ткани расщепляли в атмосфере жидкого азота перед гомогенизацией импульсом в одну тридцатую секунды в гомогенизаторе Polytron в 4 объемах буфера, содержащего 40мМ фосфата калия, рН 7,0/0,5 мМ EDTA, 2 мМ DTT, 1% Triton X-100, 10 мМ пирувата натрия, 10 мкМ фенилметилсульфонилхлорида (PMSF) и по 2 мкг/мл каждого из лейпептина, пепстатина А и апротинина. Экстракты центрифугировали перед анализом. Порцию экстракта обрабатывали ПДГ-фосфатазой, полученной из свиных сердец по методу Siess and Wieland (Eur.J.Biochem (1972) 26, 96): 20 мкл экстракта, 40 мкл фосфатазы (разведение 1:20) в конечном объеме 125 мкл, содержащем 25 мМ хлорида магния, 1 мМ хлорида кальция. Активность необработанного образца сравнивали с активностью приготовленного таким образом дефосфорилированного экстракта. ПДГ-активность определяли по методу Stansbie et al. (Biochem.J. (1976) 154, 225). 50 мкл экстракта инкубировали с 0,75 мМ NAD, 0,2 мМ СоА, 1,5 мМ тиаминпирофосфата (ТРР) и 1,5 мМ пирувата натрия в присутствии 20 мкг/мл п-(п-аминофенилазо) бензолсульфоновой кислоты (AABS) и 50 мЕ/мл ариламинтрансферазы (ААТ) в буфере, содержащем 100 мМ трис(гидроксиметил)аминометана, 0,5 мМ EDTA, 50 мМ фторида натрия, 5 мМ 2-меркаптоэтанола и 1 мМ хлорида магния, рН 7,8. ААТ получали из печени голубей по методу Tabor et al. (J.Biol. Chem. (1953) 204, 127). Скорость образования ацетилСоА определяли по скорости снижения AABS, которую определяли по уменьшению оптической плотности при 460 нм. Образцы печени готовили практически аналогичным методом за исключением того, что пируват натрия был исключен из экстракционного буфера и введен при инкубации с фосфатазой до конечной концентрации 5 мМ. Лечение животных активным соединением приводило к повышению активности ПДГ-комплекса в тканях. На это указывает увеличение количества активного ПДГ (определенное по активности необработанного экстракта в процентах от общей ПДГ-активности в том же самом экстракте после обработки фосфатазой). Согласно следующему аспекту изобретения предлагается фармацевтическая композиция, которая включает соединение формулы (I), определенной выше, или его фармацевтически приемлемую соль, или его гидролизуемый in vivo сложный эфир в сочетании с фармацевтически приемлемым эксципиентом или носителем. Композиция может быть в форме, подходящей для перорального введения, например, в виде таблетки или капсулы, для парентеральной инъекции (включая внутривенную, подкожную, внутримышечную, внутрисосудистую или инфузию), например, в виде стерильного раствора, суспензии или эмульсии, для местного введения, например, в виде мази или крема, или для ректального введения, например, в виде суппозиторя. В целом, указанные выше композиции могут быть приготовлены обычным образом с использованием обычных эксципиентов. Композиции настоящего изобретения предпочтительно представлены в форме единичных доз. Соединение обычно вводится теплокровному животному в единичной дозе в интервале 5-5000 мг на квадратный метр площади тела животного, т.е. приблизительно 0,1-100 мг/кг. Предусматривается единичная доза в интервале, например, 1-100 мг/кг, предпочтительно 1-50 мг/кг, и это обычно представляет терапевтически эффективную дозу. Форма единичных доз, такая как таблетка или капсула, обычно содержит, например, 1-250 мг активного ингредиента. Согласно следующему аспекту настоящего изобретения предложено соединение формулы (I), или его фармацевтически приемлемая соль, или его гидролизуемый in vivo сложный эфир, определенные выше, для применения в способе лечения организма человека или животного методом терапии. Было найдено, что соединения настоящего изобретения повышают ПДГ-активность и поэтому представляют интерес благодаря их снижающему содержание глюкозы в крови действию. Следующим аспектом настоящего изобретения являются соединения формулы (I), или их фармацевтически приемлемые соли, или гидролизуемые in vivo сложные эфиры для применения в качестве лекарства. Преимущественно им является соединение формулы (I), или его фармацевтически приемлемая соль, или гидролизуемый in vivo сложный эфир для применения в качестве лекарства, вызывающего повышение ПДГ-активности у теплокровных животных, таких как человек. В частности, им является соединение формулы (I), или его фармацевтически приемлемая соль, или гидролизуемый in vivo сложный эфир для применения в качестве лекарства для лечения сахарного диабета у теплокровных животных, таких как человек. В другом аспекте изобретения, в частности, им является соединение формулы (I), или его фармацевтически приемлемая соль, или гидролизуемый in vivo сложный эфир для применения в качестве лекарства для лечения сахарного диабета, заболевания периферических сосудов и ишемической болезни миокарда у теплокровных животных, таких как человек. Согласно следующему аспекту изобретения предлагается применение соединения формулы (I), или его фармацевтически приемлемой соли, или его гидролизуемого in vivo сложного эфира в производстве лекарства, используемого для повышения ПДГ-активности у теплокровных животных, таких как человек. Согласно следующему аспекту изобретения предлагается применение соединения формулы (I), или его фармацевтически приемлемой соли, или его гидролизуемого in vivo сложного эфира в производстве лекарства для использования при лечении сахарного диабета у теплокровных животных, таких как человек. Согласно следующему аспекту изобретения предлагается применение соединения формулы (I), или его фармацевтически приемлемой соли, или его гидролизуемого in vivo сложного эфира в производстве лекарства для использования при лечении сахарного диабета, заболевания периферических сосудов и ишемической болезни миокарда у теплокровных животных, таких как человек. Согласно следующему признаку изобретения предлагается способ повышения ПДГ-активности у теплокровных животных, таких как человек, нуждающихся в таком лечении, который включает введение указанному животному эффективного количества соединения формулы (I), или его фармацевтически приемлемой соли, или его гидролизуемого in vivo сложного эфира, определенных выше. Согласно следующему признаку изобретения предлагается способ лечения сахарного диабета у теплокровных животных, таких как человек, нуждающихся в таком лечении, который включает введение указанному животному эффективного количества соединения формулы (I), или его фармацевтически приемлемой соли, или его гидролизуемого in vivo сложного эфира, определенных выше. Согласно следующему признаку изобретения предлагается способ лечения сахарного диабета, заболевания периферических сосудов и ишемической болезни миокарда у теплокровных животных, таких как человек, нуждающихся в таком лечении, который включает введение указанному животному эффективного количества соединения формулы (I), или его фармацевтически приемлемой соли, или его гидролизуемого in vivo сложного эфира, определенных выше. Как указано выше, размер дозы, необходимой для терапевтического или профилактического лечения конкретного болезненного состояния, обязательно будет меняться в зависимости от пациента, способа введения и тяжести заболевания, подвергаемого лечению. Предпочтительно применяют суточную дозу в интервале 1-50 мг/кг. Однако суточная доза будет обязательно меняться в зависимости от пациента, конкретного способа введения и тяжести заболевания. Соответственно оптимальная дозировка может быть определена лечащим врачом конкретного пациента. Описанное здесь повышение ПДГ-активности может применяться в качестве единственной терапии или может вовлекать в дополнение к предмету настоящего изобретения одно или несколько других веществ и/или способов лечения. Такое совместное лечение может быть достигнуто путем одновременного, последовательного или раздельного введения индивидуальных компонентов лечения. Например, при лечении сахарного диабета химиотерапия может включать следующие основные категории лечения: i) инсулин; ii) агенты, повышающие секрецию инсулина, предназначенные для стимулирования секреции инсулина (например, глибенкламид, толбутамид, другие сульфонилмочевины); iii) пероральные гипогликемические агенты, такие как метформин, тиазолилиндионы; iv) агенты, предназначенные для понижения абсорбции глюкозы из кишечника (например, акарбоза); v) агенты, предназначенные для лечения осложнений продолжительной гипергликемии; vi) другие агенты, используемые для лечения молочной ацидемии; vii) ингибиторы окисления жирных кислот; viii) агенты снижения липидов; ix) агенты, используемые для лечения коронарной болезни сердца и заболевания периферических сосудов, такие как аспирин, пентоксифиллин, цилостазол; и/или х) тиамин. Как указывалось выше, соединения, описанные в настоящем изобретении, представляют интерес благодаря их способности повышать активность ПДГ. Такие соединения изобретения, следовательно, могут быть полезными в случае ряда болезненных состояний, включающих сахарный диабет, заболевание периферических сосудов (включая перемежающуюся хромоту), сердечную недостаточность и некоторые сердечные миопатии, ишемическую болезнь сердца, ишемическую болезнь мозга и обратную перфузию, мышечную слабость, гиперлипидемию, болезнь Альцгеймера и/или атеросклероз. Альтернативно, такие соединения могут быть полезными в ряде болезненных состояний, включающих заболевание периферических сосудов (включая перемежающуюся хромоту), сердечную недостаточность и некоторые сердечные миопатии, ишемическую болезнь сердца, ишемическую болезнь мозга и обратную перфузию, мышечную слабость, гиперлипидемию, болезнь Альцгеймера и/или атеросклероз, в частности заболевание периферических сосудов и ишемическую болезнь сердца. В дополнении к их применению в терапевтической медицине соединения формулы (I) и их фармацевтически приемлемые соли являются также полезными в качестве фармакологических средств для разработки и стандартизации тест-систем in vitro и in vivo для оценки эффективности средств повышения ПДГ-активности на лабораторных животных, таких как кошки, собаки, кролики, обезьяны, крысы и мыши, как части поиска новых терапевтических средств. Изобретение иллюстрируется далее следующими неограничивающими примерами, в которых, если не указано другое: (i) температуры даны в градусах Цельсия (°С); операции проводили при комнатной температуре или температуре окружающей среды, т.е. при температуре в интервале 18-25°С, и в атмосфере инертного газа, такого как аргон; (ii) органические растворы сушили над безводным сульфатом магния; выпаривание растворителя проводили, с использованием роторного испарителя, при пониженном давлении (600-4000 Па; 4,5-30 мм рт.ст.) при температуре бани до 60°С; (iii) хроматография означает флэш-хроматографию на силикагеле; тонкослойную хроматографию (ТСХ) проводили на силикагельных пластинках; если дается ссылка на колонку с двуокисью кремния Меgа Bond Elut, это означает колонку, содержащую 10 или 20, или 50 г двуокиси кремния с размером частиц 40 микрон, причем двуокись кремния содержится в 60 мл одноразовом шприце и поддерживается пористым диском, выпускается Varian, Harbor City, California, USA под названием “Меgа Bond Elut SI”; “Меgа Bond Elut” является торговой маркой; если указывается патрон Biotage, это означает патрон, содержащий двуокись кремния KP-SIL (iv) если указывается колонка Chem Elut, это означает экстракционный патрон “Hydromatrix” для абсорбции водного материала, т.е. полипропиленовую трубку, содержащую особый сорт прокаленной в расплаве высокочистой инертной диатомитовой земли, предварительно забуференной до рН 4,5 или 9,0, включающую фильтрующий материал для разделения фаз, используемую согласно инструкции производителя, выпускаемый Varian, Harbor City, California, USA под названием “Extube, Chem Elut”, “Extube” является зарегистрированной торговой маркой International Sorbent Technology Limited; (v) если указывается колонка ISOLUTE, это означает “ионообменный” экстракционный патрон для абсорбции основного или кислотного материала, т.е. полипропиленовую трубку, содержащую особый сорт ионообменного сорбента высокой чистоты с рН~7, включающую фильтрующий материал для разделения фаз, используемую согласно инструкции производителя, выпускаемую Varian, Harbor City, California, USA под названием “Extube, Chem Elut, ISOLUTE”; “Extube” является зарегистрированной торговой маркой International Sorbent Technology Limited; (vi) обычно за ходом реакции следят с помощью ТСХ, и время реакции приведено только для иллюстрации; (vii) конечные продукты имели удовлетворительные данные спектра протонного ядерно-магнитного резонанса (ЯМР) или данные масс-спектра; (viii) выходы приведены только для иллюстрации и не обязательно являются такими, какие могут быть получены при тщательном совершенствовании способа; если требовалось больше материала, получение повторяли; (ix) если данные ЯМР приведены в виде значений дельта для главных диагностических протонов в миллионных долях (м.д.) относительно тетраметилсилана (ТМС) в качестве внутреннего стандарта, определенных при 300 мГц, с использованием в качестве растворителя пердейтерированного диметилсульфоксида (ДМСО- (х) химические символы имеют свои обычные значения; использованы единицы и символы системы СИ; (xi) пониженные давления приведены в виде абсолютных давлений в паскалях (Па); повышенные давления приведены в виде избыточных давлений в барах; (xii) соотношения растворителей приведены по объему: объемные величины (об./об.); (xiii) масс-спектры (МС) снимали при энергии электрона 70 э-В методом химической ионизации (CI), с использованием зонда прямой экспозиции; если указанную ионизацию осуществляли электронным ударом (EI), бомбардировкой быстрыми атомами (FAB) или распылением электронов (ESP), приведены значения m/z; обычно приведены только ионы, которые указывают исходную массу, и, если не указано иное, приведены значения (М-Н); (xiv) Oxone является торговой маркой E.I. du Pont de Nemours & Co., Inc. и относится к пероксимоносульфату калия; (xv) использованы следующие сокращения: эфир – диэтиловый эфир; ДМФ – N,N-диметилформамид; DMA – N,N-диметилацетамид; ТФУК – трифторуксусная кислота; NMP – N-метилпирролидин-2-он; ИМ – исходный материал; ДМСО – диметилсульфоксид; EtOAc – этилацетат; МеОН – метанол; EtOH – этанол; ДХМ (DCM) – дихлорметан; и ТГФ – тетрагидрофуран; и (xvi) если в начале названия указывается стереохимия (R) или (S), то, если нет дополнительных пояснений, следует понимать, что указанная стереохимия относится к центру -NH-С(O)-С*(Me)(СF3)(ОН), как изображено в формуле (I). Пример 1 (R)-N-(2,3-Дихлор-4-этилсульфинилфенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамид Гидроперекись трет-бутила (2,4 мл 5,5 М раствора в декане) добавляли к раствору (R)-N-[2,3-дихлор-4-этилсульфанилфенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамида (метод I) (0,23 г) и d-10-камфорсульфоновой кислоты (0,018 г) в хлороформе (10 мл) и смесь перемешивали в течение 18 часов. Летучие вещества удаляли выпариванием и остаток очищали хроматографией на колонке с силикагелем Меgа Bond Elut при элюировании смесью 0-50% EtOAc/изогексан, получая указанное в заголовке соединение (0,22 г) в виде белого твердого вещества. ЯМР (СDСl3 + 1 капля ДМСО): 1,21-1,28 (м, 3Н), 1,71 (с, 3Н), 2,77-2,89 (м, 1Н), 3,04-3,16 (м, 1Н), 7,14 (с, 1Н), 7,78 (д, 1Н), 8,66 (д, 1Н), 9,73 (с, 1Н); m/z: 376. Примеры 2-8 Следуя методике примера 1 и используя соответствующие исходные вещества, получали следующие соединения: 1 Продукт получен добавлением ДХМ к остатку после выпаривания с последующим фильтрованием. 2 Продукт представлял смесь двух диастереоизомеров, пример 4 представляет менее полярный диастереоизомер. 3 Остаток очищали в патроне Biotage с 8 г двуокиси кремния при элюировании 3% МеОН/ДХМ. 4 Остаток очищали в патроне Biotage с 8 г двуокиси кремния при элюировании 10% MeOH/EtOAc. Пример 9 (R)-N-(2,3-Дихлор-4-этилсульфонилфенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамид Перекись водорода (15 мл 30%-ного раствора в воде) добавляли к раствору (R)-N-[4-этилсульфанил-2,3-дихлорфенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамида (метод I) (1,88 г) в ледяной уксусной кислоте (26 мл) и смесь нагревали при 95°С в течение 1,5 часов и затем охлаждали. Добавляли EtOAc (200 мл) и смесь промывали насыщенным водным раствором бикарбоната натрия (4×200 мл) и рассолом (250 мл), затем сушили. Летучие вещества удаляли выпариванием и остаток очищали хроматографией, при элюировании смесью 0-50% EtOAc/изогексан, получая указанное в заголовке соединение (1,11 г) в виде белого твердого вещества. ЯМР: 1,1 (т, 3Н), 1,61 (с, 3Н), 3,5 (кв., 2Н), 8,02 (д, 1Н), 8,31 (д, 1Н); m/z: 392. Примеры 10-26 Следуя методике примера 9 и используя соответствующие исходные вещества, получали следующие соединения: 1 К охлажденной реакционной смеси добавляли воду и продукт получали фильтрованием. Пример 27 (R)-N-(2-Хлор-4-этилсульфонил-3-гидроксифенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамид Следуя процедуре метода I и используя в качестве исходного материала 2-хлор-4-этилсульфонил-3-гидроксианилин (метод 9), получали указанное в заголовке соединение (с 10% выходом) в виде твердого вещества. ЯМР: 0,92 (т, 3Н), 1,45 (с, 3Н), 3,25 (кв, 2Н), 7,55 (д, 1Н), 7,79 (д, 1Н), 7,85 (д, 1Н), 9,67 (с, 1Н); m/z: 374. Пример 28 (R)-N-[2-Хлор-4-этилсульфонил-3-метилсульфанилфенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид Метантиолат натрия (0,16 г) добавляли при перемешивании к раствору (R)-N-[2,3-дихлор-4-этилсульфонилфенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамида (Пример 9) (0,60 г) в безводном DMA. Реакционную смесь нагревали при кипячении с обратным холодильником в течение 3 часов, затем добавляли еще метантиолат натрия (0,27 г) и нагревание продолжали в течение еще 18 часов. Реакционной смеси давали остывать, добавляли EtOAc (150 мл), смесь промывали рассолом (4×100 мл) и сушили. Летучие вещества удаляли выпариванием и остаток очищали на колонке с силикагелем Меgа Bond Elut при элюировании смесью 0-40% EtOAc/изогексан, получая указанное в заголовке соединение (0,114 г) в виде смолы. ЯМР (СDСl3): 1,26 (т, 3Н), 1,78 (с, 3Н), 2,50 (с, 3Н), 3,64 (кв, 2Н), 3,75 (с, 1Н), 8,13 (д, 1Н), 8,67 (д, 1Н), 9,44 (с, 1Н); m/z: 404. Пример 29 (R)-N-[3-Ацетамидо-2-хлор-4-[4-(2-гидроксиэтиламино)фенил-сульфонил]фенил-2-гидрокси-2-метил-3,3,3-трифторпропанамид (R)-N-[3-Ацетамидо-2-хлор-4-(4-фторфенилсульфонил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид (683 мг) (Пример 10), этаноламин (177 мг, 2 экв.) и ацетонитрил (6 мл) смешивали и нагревали (85°С) в атмосфере аргона в течение 24 часов. Растворитель удаляли, оставшуюся смолу снова растворяли в МеОН (10 мл) и выливали на дезактивированную двуокись кремния (5 г). Смесь концентрировали, получая свободно текучий порошок, который переносили в верхнюю часть колонки ISOLUTE (50 г двуокиси кремния). Осуществляли хроматографирование при элюировании смесью МеОН/ДХМ, получая указанное в заголовке соединение (247 мг) в виде коричневого твердого вещества. ЯМР (400 МГц): 1,59 (с, 3Н), 1,95 (с, 3Н), 3,08-3,19 (м, 2Н), 3,53 (кв, 2Н), 4,66-4,73 (т, 1Н), 6,62 (д, 2Н), 6,67 (т, 1Н), 7,0 (шир.с, 1Н), 7,44 (д, 2Н), 8,06 (д, 1Н), 8,29 (д, 1Н), 9,61 (шир.с, 1Н), 9,82 (шир.с, 1Н); m/z: 524 (М+Н)+. Пример 30 (R)-N-[2-Хлор-3-(2-гидроксиэтиламино)-4-(4-фторфенилсульфонил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид Этаноламин (47 мг, 2,5 экв.) добавляли к раствору (R)-N-(2-хлор-3-фтор-4-[4-фторфенилсульфонил]фенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамида (пример 11) (135 мг) в NMP (1 мл), смесь перемешивали и нагревали (масляная баня, 120°С) в атмосфере аргона в течение 24 часов. Реакционную смесь охлаждали и распределяли между насыщенным водным раствором хлорида аммония (10 мл) и эфира (3×20 мл). Объединенные эфирные экстракты промывали водой (50 мл), сушили и концентрировали, получая смолу. Остаток растворяли в МеОН/ДХМ и выливали на дезактивированную двуокись кремния (1 г). Затем смесь концентрировали, получая свободно текучий порошок, который переносили в колонку ISOLUTE (10 г двуокиси кремния) и хроматографировали, при элюировании смесью EtOAc/изогексан, получая указанное в заголовке соединение (50 мг) в виде смолы. ЯМР: 1,65 (с, 3Н), 3,2 (м, 2Н), 3,42 (м, 2Н), 4,92 (т, 1Н), 5,91 (т, 1Н), 7,47 (т, 2Н), 7,89 (д, 1Н), 7,96-8,08 (м, 3Н), 9,85 (шир.с, 1Н); m/z: 483. Пример 31 (R)-N-{2-Хлор-3-(2-гидроксиэтиламино)-4-[4-(2-гидроксиэтил-амино)фенилсульфонил]фенил}-2-гидрокси-2-метил-3,3,3-трифторпропанамид Указанное в заголовке соединение также выделяли из смеси, полученной в примере 30, в виде желтой пены. ЯМР (400 мГц): 1,6 (c, 3Н), 3,2 (м, 4Н), 3,52 (м, 4Н), 4,74 (т, 1Н), 4,95 (т, 1Н), 5,98 (т, 1Н), 6,69 (д, 2Н), 6,76 (т, 1Н), 7,62 (д, 2Н), 8,0 (шир.с, 1Н); m/z: 524. Примеры 32-39 Следуя методике примера 30 и используя соответствующие исходные материалы, получали следующие соединения: Пример 40 (R)-N-[2-Хлор-3-мезил-4-(4-фторфенилсульфонил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид Реакцию (R)-N-(2-Хлор-3-фтор-4-{4-фторфенилсульфонил}фенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамида (пример 11) (222 мг) с метилтиолатом натрия (62 мг) в NMP (2 мл) проводили при 120°С в атмосфере аргона в течение 18 часов. Охлажденную реакционную смесь распределяли между насыщенным водным раствором хлорида аммония (20 мл) и эфиром (40 мл), органический слой отделяли, а водный слой экстрагировали дополнительным количеством эфира (2×40 мл). Объединенные эфирные экстракты промывали водой (30 мл), сушили и концентрировали, получая желтое твердое вещество (242 мг), которое являлось смесью трех соединений. Твердое вещество перемешивали и нагревали (100°С) в ледяной уксусной кислоте (2 мл) и перекиси водорода (100 об., 0,42 мл) в атмосфере аргона в течение 80 минут. Реакционную смесь распределяли между водой (20 мл) и EtOAc (50 мл). Органический слой промывали водой, сушили и концентрировали, получая смолу. Остаток растворяли в ДХМ и вводили в патрон Biotage (40 г двуокиси кремния), элюировали смесью 50% EtOAc/изогексан, получая указанное в заголовке соединение (42 мг) в виде белого твердого вещества. ЯМР (CDCl3 + 1 капля ДМСО; 500 мГц): 1,63 (с, 3Н), 3,37 (с, 3Н), 7,09 (т, 2Н), 7,49 (с, 1Н), 7,76 (м, 2Н), 8,45 (д, 1Н), 8,89 (д, 1Н), 10,1 (шир.с, 1Н); m/z: 502. Примеры 41-42 Другие соединения, выделенные из указанной выше смеси, показаны в следующей таблице: Пример 43 (R)-N-[4-Этилсульфонил-3-метилсульфинил-2-хлорфенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид К раствору (R) -N-[4-этилсульфонил-3-метилсульфанил-2-хлорфенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамида (пример 28) (0,636 г) в ДХМ при перемешивании добавляли мета-хлорпероксибензойную кислоту (0,17 г). Спустя 1 час при температуре окружающей среды добавляли дополнительную порцию мета-хлорпероксибензойной кислоты (0,14 г) и продолжали перемешивание при температуре окружающей среды в течение 16 часов. Добавляли еще мета-хлорпероксибензойную кислоту (0,08 г) и спустя 30 минут добавляли раствор бикарбоната натрия (50 мл). Органический слой отделяли, сушили и летучие вещества удаляли выпариванием. Остаток очищали хроматографией на колонке Меgа Bond Elut (20 г) при элюировании смесью 10-80% EtOAc/изогексан, получая указанное в заголовке соединение (0,55 г) в виде белой пены. ЯМР: 1,19 (т, 3Н), 1,62 (с, 3Н), 3,14 (с, 3Н), 3,52-3,60 (м, 2Н), 8,00 (д, 1Н), 8,14 (шир.с, 1Н), 8,45-8,49 (м, 1Н), 10,11 (шир.с, 1Н); m/z: 420. Примеры 44-47 Следуя процедуре примера 43 и используя соответствующие исходные материалы, получали следующие соединения: Пример 48 (R)-N-(4-Мезил-3-метилсульфанил-2-хлорфенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамид Метантиолат натрия (48 мг) добавляли к дезоксигенированному раствору (R)-N-[4-мезил-3-фтор-2-хлор-фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамида (Пример 14) (0,20 г) в безводном NMP (1 мл). Реакционную смесь нагревали до 120°С в атмосфере аргона в течение ночи. Добавляли еще метантиолат натрия (50 мг) и нагревание продолжали в течение 2 часов. Реакционной смеси давали остывать до температуры окружающей среды. Добавляли насыщенный хлорид аммония (50 мл) и смесь экстрагировали эфиром (4×50 мл). Эфирные экстракты объединяли, промывали рассолом (50 мл) и сушили. Летучие вещества удаляли выпариванием и остаток очищали хроматографией на патроне Biotage с 8 г силикагеля, при элюировании смесью 3:7 EtOAc/изогексан, получая указанное в заголовке соединение (0,14 г) в виде белой пены. ЯМР: 1,62 (с, 3Н), 2,47 (с, 3Н), 8,05 (д, 1Н), 8,36 (д, 1Н); m/z: 390. Пример 49 (R)-N-[4-Этилсульфинил-3-метилсульфанил-2-хлорфенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид Указанное в заголовке соединение получали из (R)-N-[4-этилсульфинил-3-фтор-2-хлорфенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамида (Пример 3) (0,223 г) по методике, описанной в примере 48, получая указанное в заголовке соединение в виде белого твердого вещества (55%). ЯМР: 1,03-1,09 (м, 3Н), 1,61 (с, 3Н), 2,41 (с, 3Н), 2,71-2,82 (м, 1Н), 3,08-3,20 (м, 1Н), 7,69 (д, 1Н), 7,96 (шир.с, 1Н), 8,28-8,32 (м, 1Н), 9,92 (шир.с, 1Н); m/z: 388. Пример 50 (R)-N-{2-Xлоp-3-(2-гидроксиэтилтио)-4-[4-(N,N-диметилкарбамоил)фенилсульфонил]фенил}-2-гидрокси-2-метил-3,3,3-трифторпропанамид К (R)-N-{2-хлор-3-фтор-4-[4-(N,N-диметилкарбамоил) фенилсульфонил]фенил}-2-гидрокси-2-метил-3,3,3-трифторпропанамиду (пример 18) (600 мг) в виде раствора в NMP (5 мл) добавляли 2-гидроксиэтантиол (0,1 мл) и метоксид натрия (0,65 г) и реакционную смесь нагревали до 120°С в течение ночи в атмосфере аргона. Раствор разбавляли насыщенным рассолом и экстрагировали эфиром (3×30 мл). Эфирные экстракты объединяли и сушили. Летучие вещества удаляли выпариванием и остаток очищали хроматографией на колонке Меgа Bond Elut (20 г силикагеля) при элюировании смесью гексан/EtOAc, получая указанное в заголовке соединение в виде белого твердого вещества (60 мг, 12%). ЯМР: 1,60 (с, 3Н), 2,60-2,65 (м, 2Н), 2,85 (с, 3H), 2,95 (с, 3Н), 3,10-3,20 (м, 2Н), 4,75 (дд, 1Н), 7,60 (д, 2Н), 7,95 (д, 2Н), 8,05 (с, 1Н), 8,35 (д, 1Н), 8,45 (д, 1Н), 9,95 (с, 1Н); m/z: 553. Пример 51 (R)-N-(4-Этилсульфонил-3-[4-(N,N-диметилкарбамоил)фенилсульфанил]-2-хлорфенил}-2-гидрокси-2-метил-3,3,3-трифторпропанамид К раствору (R)-N-[4-этилсульфонил-3-[4-карбоксифенил-сульфанил)-2-хлорфенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамида (метод 59) (0,64 г) в ДХМ и ДМФ (3 капли) добавляли при перемешивании оксалилхлорид (0,25 мл). Реакционной смеси давали перемешиваться при температуре окружающей среды в течение ночи. Летучие вещества выпаривали, остаток повторно растворяли в ДХМ (20 мл) и добавляли диметиламин (1 мл, 5,6 М раствор в EtOH). Смеси давали перемешиваться при комнатной температуре в течение ночи. Добавляли НСl (2 М, 50 мл), органическую фазу отделяли, сушили и летучие вещества удаляли выпариванием. Остаток очищали хроматографией на колонке Меgа Bond Elut (50 г двуокиси кремния) при элюировании смесью 1-3% МеОН/ДХМ, получая указанное в заголовке соединение в виде коричневой пены (0,67 г). ЯМР (CDCl3): 1,20 (т, 3Н), 1,64 (с, 3Н), 2,89 (с, 3Н), 3,01 (с, 3Н), 3,44-3,48 (кв, 2Н), 5,37 (с, 1Н), 7,03 (д, 2Н), 7,22 (д, 2Н), 8,18 (д, 1Н), 8,72 (д, 1Н), 9,56 (с, 1Н); m/z: 537. Примеры 52-60 Следуя процедуре примера 51 и используя соответствующие исходные материалы, получали следующие соединения: 1Масло, полученное после хроматографии, растворяли в EtOA, промывали водой, рассолом и сушили. Летучие вещества удаляли выпариванием и затем остаток растирали с эфиром. 2 Остаток хроматографировали, используя градиентные растворители EtOAc/гексан. Пример 61 (R)-N-{2-Хлор-3-амино-4-[4-(N,N-диметилкарбамоил)фенил]-сульфонилфенил}-2-гидрокси-2-метил-3,3,3-трифторпропанамид К суспензии (R)-N-{2-хлор-3-нитро-4-[4-(N,N-диметилкарбамоил)фенил]сульфонилфенил}-2-гидрокси-2-метил-3,3,3-три-фторпропанамида (пример 63) (305 мг) в воде (0,25 мл) и EtOH (1 мл) добавляли железо (324 мг) и конц. хлористоводородную кислоту (1 каплю). Смесь перемешивали в течение 1,5 часов при 75°С и давали ей остывать до температуры окружающей среды. Добавляли насыщенный NаНСО3 (10 мл) и раствор экстрагировали EtOAc (100 мл). Экстракты промывали рассолом (40 мл) и сушили. Летучие вещества удаляли выпариванием. Реакция прошла не полностью, поэтому к суспензии остатка в воде (0,25) и EtOH (1 мл) добавляли железо (324 мг) и конц. хлористоводородную кислоту (3 капли). Смесь перемешивали в течение 3 часов при 75°С. После того как смеси давали остывать до температуры окружающей среды, добавляли насыщенный NаНСО3 (10 мл) и раствор экстрагировали EtOAc (100 мл). Экстракты промывали рассолом (40 мл) и сушили. Летучие вещества удаляли выпариванием, получая пену. Пену очищали хроматографией на силикагеле при элюировании 4% МеОН в ДХМ, получая названное в заголовке соединение в виде пены (250 мг). ЯМР: 1,58 (с, 3Н), 2,81 (с, 3Н), 2,95 (с, 3Н), 6,31 (с, 2), 7,60 (м, 3Н), 7,81 (д, 1Н), 7,96 (м, 3Н), 9,73 (шир.с, 1Н); m/z: 492. Пример 62 (R)-N-[4-{2-Аминопирид-6-илсульфонил}-2,3-дихлорфенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид (R)-N-[4-{2-Нитропиридил}-6-сульфонил-2,3-дихлорфенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид (метод 71) (220 мг, 0,45 ммоль) перемешивали и нагревали при 75°С в течение 1 часа с порошком железа (272 мг), EtOH (0,3 мл), водой (0,11 мл) и 1 каплей конц. НСl. Реакционной смеси давали остывать до комнатной температуры и смесь подщелачивали насыщенным раствором NaHCO3. Добавляли EtOAc и смесь фильтровали через слой диатомитовой земли и тщательно промывали смесью EtOAc/вода. Объединенные органические слои промывали рассолом, загружали в колонку Chem Elut и элюировали EtOAc. Очищали с помощью колонки Меgа Bond Elut и градиентного элюирования растворителем 10-80% EtOAc/гексан, получая названное в заголовке соединение (115 мг) в виде белой пены. ЯМР: 1,6 (с, 3Н), 6,4 (с, 2Н), 7,0 (д, 1Н), 7,9 (т, 2Н), 8,0 (с, 1Н), 8,3 (кв., 2Н), 9,9 (с, 1Н); m/z: 456. Пример 63 (R)-N-(2-Хлор-3-нитро-4-[4-N,N-диметилкарбамоилфенилсульфонил]фенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамид К раствору (R)-N-(2-хлор-3-нитро-4-[4-карбоксифенилсульфонил]фенил)-2-гидрокси-2-метил-3,3,3-три-фторпропанамида (метод 62) (260 мг) в ДХМ (15 мл) добавляли оксалилхлорид (0,07 мл) и ДМФ (2 капли). Смесь перемешивали в течение 16 часов при температуре окружающей среды. Летучие вещества удаляли выпариванием и остаток растворяли в ДХМ (15 мл). Добавляли диметиламин в EtOH (5,6 М, 0,6 мл) и раствор перемешивали в течение 16 часов при температуре окружающей среды. Летучие вещества удаляли выпариванием и остаток распределяли между EtOAc (100 мл) и водой (50 мл). Органическую фазу промывали рассолом (50 мл) и сушили. Летучие вещества удаляли выпариванием, получая названное в заголовке соединение (324 мг) в виде твердого вещества. ЯМР: 1,58 (с, 3Н), 2,83 (с, 3Н), 2,97 (с, 3Н), 7,66 (д, 2Н), 7,93 (д, 2Н), 8,08 (шир.с, 1Н), 8,35 (д, 1Н), 8,42 (д, 1Н); m/z: 522. Пример 64 (R)-N-[2-Xлоp-3-(4-ацетилпиперазин-1-ил)-4-(этилсульфонил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид (R)-N-[2-Хлор-3-фтор-4-(этилсульфонил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид (пример 15; 2,0 г) добавляли в атмосфере аргона к раствору 1-ацетилпиперазина (2,0 г, 3 экв.) в безводном NMP (3 мл), смесь перемешивали и нагревали при 147°С в течение 24 часов. Реакционную смесь охлаждали и распределяли между насыщенным водным раствором хлорида аммония (80 мл) и эфиром (4×200 мл). Объединенные эфирные слои промывали рассолом (200 мл), сушили и концентрировали, получая смолу. Остаток очищали хроматографией на колонке Меgа Bond Elut (50 г) при элюировании смесью 0-4% МеОН/ДХМ, получая названное в заголовке соединение (0,895 г) в виде белой пены. ЯМР: 1,14 (т, 3Н), 1,61 (с, 3Н), 2,05 (с, 3Н), 2,75-2,82 (м, 1Н), 2,94 (шир.м, 2Н), 3,25-3,44 (м, 3Н), 3,49-3,56 (кв.,2Н), 3,85 (д, 1Н), 4,39 (д, 1Н), 7,94 (д, 1Н), 8,07 (шир.с, 1Н), 8,26 (д, 1Н), 9,94 (шир.с, 1Н); m/z: 484. Примеры 65-76 Следуя процедуре примера 64 и используя соответствующие исходные материалы, получали следующие соединения: 1 Остаток хроматографировали с использованием в качестве элюента смеси 0-50% EtOAc/изогексан. 2 Использовали этаноламин (1/5 экв.) при 120°С в течение 3 часов. 3 Остаток очищали в патроне Biotage, 8 г двуокиси кремния, при элюировании смесью 1:1 EtOAc/изогексан. 4 Использовали бензиламин (1,5 экв.) при 120°С в течение 3 часов. 5 Остаток очищали, используя в качестве элюента смесь 0-40% EtOAc/изогексан. 6 Использовали глицинамид гидрохлорид (3 экв.) и триэтиламин (3 экв.) при 120°С в течение 3 часов. 7 Остаток очищали в патроне Biotage, 8 г двуокиси кремния при элюировании EtOAc. 8 Исходный материал: Пример 14. 9 После хроматографии остаток фильтровали из горячего EtOAc. 10 Использовали метоксиэтиламин (1,5 экв.) при 120°С в течение 3 часов. 11 Остаток очищали в патроне Biotage, 8 г двуокиси кремния при элюировании смесью 40% EtOAc/изогексан. 12 Остаток очищали, используя в качестве элюента смесь 0-50% EtOAc/изогексан. 13 Исходный материал: Пример 80. 14 После хроматографии остаток перекристаллизовывали из МеОН. Пример 77 (R)-N-[2-Хлор-3-фенокси-4-(этилсульфонил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид (R)-N-[2-Хлор-3-фтор-4-(этилсульфонил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид (пример 15; 0,308 г) добавляли при перемешивании к суспензии фенола (0,150 г) и безводного карбоната калия (0,220 г) в безводном ДМФ (2 мл). Реакционную смесь нагревали до 150°С в атмосфере аргона в течение 17 часов и давали ей остывать до температуры окружающей среды. Добавляли EtOAc (50 мл), органическую фазу промывали рассолом (4×50 мл), разделяли и летучие вещества удаляли выпариванием. Остаток очищали в патроне Biotage, 8 г двуокиси кремния, при элюировании смесью 40% EtOAc/изогексан, получая названное в заголовке соединение (0,073 г) в виде бледно-желтой пены. ЯМР (CDCl3): 1,18 (т, 3Н), 1,69 (с, 3Н), 3,23-3,30 (кв., 2Н), 3,48 (с, 1Н), 6,78 (д, 2Н), 7,02 (т, 1Н), 7,24 (т, 2Н), 7,97 (д, 1Н), 8,50 (д, 1Н), 9,24 (шир.с, 1Н); m/z: 450, Пример 78 (R)-N-[2-Хлор-3-метокси-4-(этилсульфонил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид Названное в заголовке соединение получали из 2-хлор-З-метокси-4-этилсульфониланилина (метод 10) по методике, описанной в методе 11 с выходом 19% в виде белого твердого вещества. ЯМР (CDCl3): 1,15 (т, 3Н), 1,71 (с, 3Н), 3,27-3,34 (кв., 2Н), 3,57 (с, 1Н), 3,98 (с, 3Н), 7,81 (д, 1Н), 8,36 (д, 1Н), 9,24 (с, 1Н); m/z: 388. Пример 79 (R)-N-[2-Хлор-3-метилсульфанил-4-(изопропилсульфонил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид Метантиолат натрия (0,16 г) добавляли при перемешивании к раствору (2R)-N-[2-хлор-3-фтор-4-(изопропилсульфонил)фенил]-2-гидрокси-2-метил-З,3,3-трифторпропанамида (пример 80; 0,862 г) в 1-метил-2-пирролидиноне (3 мл). Реакционную смесь нагревали до 128°С в течение 20 часов. Реакционной смеси давали остывать, добавляли EtOAc (100 мл), смесь промывали водой (2×50 мл), рассолом (50 мл) и сушили. Летучие вещества удаляли выпариванием и получали масло. Масло растворяли в эфире (100 мл) и промывали рассолом (50 мл). Летучие вещества удаляли выпариванием и получали пену, которую перекристаллизовывали из смеси EtOA/гексан, получая названное в заголовке соединение (0,495 г) в виде твердого вещества. ЯМР: 1,20 (м, 6Н), 1,60 (с, 3Н), 2,46 (с, 3Н), 4,14 (м, 1Н), 8,00 (д, 1Н), 8,39 (д, 1Н); m/z: 418. Пример 80 (R)-N-[2-Хлор-3-фтор-4-(изопропилсульфонил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид Перекись водорода (100 объемов, 20 мл) добавляли к раствору (2R)-N-[2-хлор-3-фтор-4-(изопропилсульфанил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамида (метод 80; 1,21 г) в 1 ледяной уксусной кислоте (20 мл) и смесь перемешивали в течение 4,5 часов при 100°С. Смеси давали остывать до температуры окружающей среды и летучие вещества удаляли выпариванием. Остаток растворяли в EtOAc (100 мл), промывали водой (50 мл), рассолом (50 мл), сушили и летучие вещества удаляли выпариванием, получая названное в заголовке соединение (1,196 г) в виде твердого вещества. ЯМР: 1,20 (д, 6Н), 1,60 (с, 3Н), 3,50 (м, 1Н), 7,83 (т, 1Н), 8,10 (с, 1Н), 8,19 (д, 1Н), 9,99 (с, 1Н); m/z: 390. Пример 81 (R)-М-{2-Хлор-3-метилсульфанил-4-[4-(N,N-диметилкарбамоил)фенилсульфонил]фенил}-2-гидрокси-2-метил-3,3,3-трифторпропанамид Смесь (R)-N-{2-хлор-3-фтор-4-[4-(N,N-диметилкарбамоил)фенилсульфонил]фенил}-2-гидрокси-2-метил-3,3,3-трифторпропанамида (пример 18; 300 мг, 0,6 ммоль) и метантиолата натрия (135 мг) в DMA (5 мл) перемешивали в течение ночи при 100°С. Смеси давали остывать до комнатной температуры и распределяли ее между EtOAc/водой. Органические слои промывали водой и сушили, пропуская через колонку Chem Elut при элюировании EtOAc. При стоянии образовывалось 110 мг бесцветных иглоподобных кристаллов названного в заголовке соединения, которые отфильтровывали и промывали гексаном. ЯМР: 1,6 (с, 3Н), 1,9 (с, 3Н), 2,8 (с, 3Н), 3,0 (с, 3Н), 7,6 (д, 2Н), 7,9 (д, 2Н), 8,3 (д, 1Н), 8,5 (д, 1Н); m/z: 523. Пример 82 (R)-N-{2-Хлор-3-метилсульфанил-4-[4-(N-метил-N-этилкарбамоил)фенилсульфонил]фенил}-2-гидрокси-2-метил-3,3,3-трифторпропанамид (R)-N-{2-Хлор-3-фтор-4-[4-(N-метил-N-этилкарбамоил) фенилсульфонил]фенил}-2-гидрокси-2-метил-3,3,3-трифторпропанамид (пример 83; 290 мг, 0,57 ммоль) подвергали реакции с метантиолатом натрия (1,5 ммоль) согласно методике примера 81. Остаток очищали хроматографией на колонке Меgа Bond Elut при элюировании смесью 10-100% EtOAc/гексан, получая названное в заголовке соединение (200 мг) в виде белого твердого вещества. ЯМР: 1,1 (м, 3Н), 1,6 (с, 3Н), 1,9 (с, 3Н), 2,9 (д, 3Н), 3,1 (д, 3Н), 3,5 (д, 1Н), 7,6 (д, 2Н), 7,9 (д, 2Н), 8,1 (с, 1Н), 8,4 (д, 1Н), 8,5 (д, 1Н), 9,9 (с, 1Н); m/z: 537 Пример 83 (R)-N-{2-Хлор-3-фтор-4-[4-(N-метил-N-этилкарбамоил)фенилсульфонил]фенил}-2-гидрокси-2-метил-3,3,3-трифторпропанамид Смесь (R)-N-{2-хлор-3-фтор-4-[4-(N-метил-N-этилкарбамоил)фенилсульфанил]фенил}-2-гидрокси-2-метил-3,3,3-трифторпропанамида (метод 85; 370 мг, 0,77 ммоль), ледяной уксусной кислоты (5 мл) и перекиси водорода (1,8 мл) перемешивали при 95°С в течение 3 часов и давали остывать до комнатной температуры. Раствор экстрагировали EtOAc. Органические слои промывали насыщенным раствором бикарбоната натрия, водой и рассолом, переносили в колонку Chem Elut и элюировали EtOAc, получая названное в заголовке соединение (400 мг) в виде белого твердого вещества. ЯМР: 1,2 (м, 3Н), 1,6 (с, 3Н), 2,8 (д, 3Н), 3,1 (д, 1Н), 3,5 (д, 1Н), 7,6 (д, 2Н), 8,0 (д, 2Н), 8,1 (т, 1Н), 8,2 (д, 1Н); m/z: 509. Пример 84 (R)-N-{2-Хлор-3-фтор-4-[4-(N-этилкарбамоил)фенилсульфонил]фенил}-2-гидрокси-2-метил-3,3,3-трифторпропанамид (R)-N-{2-хлор-3-фтор-4-[4-(N-этилкарбамоил)фенилсульфанил]фенил}-2-гидрокси-2-метил-3,3,3-трифторпропанамид (метод 86; 90 мг), ледяную уксусную кислоту (1,3 мл) и раствор перекиси водорода (0,45 мл) нагревали при перемешивании при 95°С в течение 3 часов. Реакционной смеси давали остывать до комнатной температуры и экстрагировали EtOAc. Органические слои промывали насыщенным раствором бикарбоната натрия. Органические слои отделяли, промывали водой и затем сушили, подавая в колонку Chem Elut и элюировали EtOAc. Полученный раствор упаривали досуха и остаток очищали хроматографией на колонке Bond Elut при элюировании смесью 20-70% EtOAc/гексан, получая названное в заголовке соединение (80 мг) в виде белого твердого вещества. ЯМР: 1,1 (т, 3Н), 1,6 (с, 3Н), 3,2 (м, 2Н), 8,1 (м, 6Н), 8,7 (с, 1Н), 9,9 (с, 1Н); m/z: 495. Получение исходных материалов Исходные материалы для приведенных выше примеров являются или промышленно доступными, или легко получаются стандартными методами из известных материалов. Например, нижеследующие реакции являются иллюстрацией, но не ограничением, синтезов некоторых из исходных веществ, использованных в приведенных выше реакциях. Метод 1 (R)-N-(2,3-Дихлор-4-этилсульфанилфенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамид Оксалилхлорид (0,75 мл) добавляли при перемешивании к суспензии (R)-(+)-2-гидрокси-2-метил-3,3,3-трифторпропаноевой кислоты (метод 25) (1,37 г) в ДХМ, содержащей ДМФ (1 каплю). Смесь перемешивали при температуре окружающей среды в течение 18 часов и затем добавляли раствор 4-этилсульфанил-2,3-дихлоранилина (метод 7) (1,92 г) и 2,6-дифенилпиридина (2,0 г) в ДХМ (50 мл). Смесь перемешивали в течение 3 часов при комнатной температуре, летучие вещества удаляли выпариванием и остаток очищали хроматографией при элюировании смесью 0-20% EtOAc/изогексан, получая названное в заголовке соединение (2,12 г) в виде твердого вещества. ЯМР (СDСl3): 1,35 (т, 3Н), 1,76 (с, 3Н), 2,97 (кв., 2Н), 3,61 (с, 1Н), 7,22 (д, 1Н), 8,27 (д, 1Н), 8,91 (с, 1Н); m/z; 360. Методы 2-5 Следуя процедуре метода 1 за исключением того, что вместо 2,6-дифенилпиридина использовали 2,6-ди-трет-бутилпиридин, и используя соответствующие исходные материалы, получали следующие соединения: Метод 6 2,3-Дихлор-4-этилсульфанилбензойная кислота Охлажденный раствор гипохлорита натрия (120 мл раствора с 4% свободного хлора) добавляли к раствору 4-этилсульфанил-2,3-дихлорацетофенона (10,0 г, получен, как описано в европейской патентной заявке ЕР 0195247) в диоксане (80 мл). Реакционную смесь перемешивали при температуре окружающей среды в течение 15 минут, затем медленно нагревали до 80°С в течение 30 минут и нагревание поддерживали при данной температуре в течение 1 часа. Реакционной смеси давали остывать до комнатной температуры, добавляли водную хлористоводородную кислоту (100 мл 2 М раствора), и полученное твердое вещество собирали и сушили. Твердое вещество повторно растворяли в ДХМ (200 мл) и МеОН (20 мл), промывали гидроксидом натрия (10% мас./об., 300 мл), и водную фазу отделяли и подкисляли водной хлористоводородной кислотой (2 М, 300 мл). Осадок собирали и сушили, получая названное в заголовке соединение (5,4 г) в виде твердого вещества. ЯМР: 1,28 (т, 3Н), 3,05 (кв., 2Н), 7,36 (д, 1Н), 7,68 (д, 1Н); m/z: 249. Метод 7 2,3-Дихлор-4-этилсульфаниланилин Суспензию 2,З-дихлор-4-этилсульфанилбензойной кислоты (метод 6) (2,71 г) в трет-бутаноле (70 мл) и триэтиламине (1,6 мл) нагревали при перемешивании до 60°С. Добавляли по каплям дифенилфосфорилазид (2,5 мл) и смесь нагревали при 90°С в течение 4 часов. Реакционной смеси давали остывать до комнатной температуры и растворитель выпаривали при пониженном давлении. Добавляли EtOAc (150 мл) и органическую фазу промывали насыщенным водным раствором бикарбоната натрия (2×100 мл) и затем сушили. Летучие вещества удаляли выпариванием и получали смесь 1:1 2,3-дихлор-4-этилсульфаниланилина и трет-бутилуретана (2,51 г). К данному веществу добавляли по каплям ТФУК (6 мл) и смесь перемешивали при температуре окружающей среды в течение 30 минут. Добавляли гидроксид натрия (20% мас./об.) для доведения рН до 10-11 и смесь экстрагировали EtOAc (4×250 мл). Экстракты сушили, летучие вещества удаляли выпариванием и остаток очищали хроматографией при элюировании смесью 10-50% EtOAc/изогексан, получая названное в заголовке соединение (1,9 г) в виде масла. ЯМР (CDCl3): 1,26 (т, 3Н), 2,85 (кв., 2Н), 4,2 (с, 2Н), 6,65 (д, 1Н), 7,21 (д, 1Н); m/z: 220. Методы 8-10 Следуя процедуре метода 7 и используя соответствующие исходные материалы, получали следующие соединения: Метод 11 (R)-N-(3-Ацетамидо-2-хлор-4-{4-фторфенилсульфанил}фенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамид Раствор (S)-3,3,3-трифтор-2-(триметилсилилокси)-2-метил-пропаноилхлорида (полученного из (R)-3,3,3-трифтор-2-гидрокси-2-метилпропионовой кислоты (метод 25), как описано в J. Med. Chem., 1999, 42, 2741-2746) (1,179 г) в ДХМ (10 мл) по каплям добавляли при перемешивании к охлажденной льдом суспензии 3-ацетамидо-2-хлор-4-(4-фторфенилсульфанил)анилина (метод 18) (1,315 г) в ДХМ (20 мл) и триэтиламине (1,72 мл). Смесь оставляли подогреваться до температуры окружающей среды в течение ночи. Добавляли еще триэтиламин (0,8 мл) и затем (S)-3,3,3-трифтор-2-(триметилсилилокси)-2-метилпропаноилхлорид (0,6 г) в ДХМ (5 мл). Спустя еще 6 часов смесь концентрировали выпариванием. Добавляли МеОН (50 мл) и 2М водный раствор НСl (5 мл), смесь оставляли в течение ночи при перемешивании и затем разбавляли водой (20 мл). МеОН удаляли выпариванием и добавляли 2М водный раствор НСl (30 мл). Затем смесь экстрагировали эфиром (2×80 мл). Экстракты промывали рассолом и сушили. Летучие вещества удаляли выпариванием и остаток очищали хроматографией в патроне Biotage (40 г двуокиси кремния) при элюировании смесью 50% EtOAc/изогексан, получая названное в заголовке соединение (1,04 г) в виде пены. ЯМР: 1,6 (с, 3Н), 2,05 (с, 3Н), 7,0 (д, 1Н), 7,26 (т, 2Н), 7,38-7,48 (м, 2Н), 7,8-7,9 (м, 2Н), 9,76 (шир.с., 1Н); m/z: 449. Методы 12-14 Следуя процедуре метода 11 и используя соответствующие исходные материалы, получали следующие соединения: Метод 15 3-Ацетамидо-2-хлор-4-(4-фторфенилсульфанил)нитробензол 4-Фторбензотиол (0,128 мл) добавляли по каплям при перемешивании к суспензии гидрида натрия (0,049 г 60%-ной дисперсии в минеральном масле) в ТГФ (3 мл). Смесь перемешивали в течение 30 минут, затем прибавляли по каплям при перемешивании к охлажденному (-65°С) раствору 3-ацетамидо-2-амино-4-фторнитробензола (0,233 г) в ТГФ (2 мл). Смесь перемешивали в течение 3 часов при -65°С, затем ей давали подогреваться до температуры окружающей среды. Добавляли насыщенный водный раствор хлорида аммония (5 мл), затем воду (5 мл) и смесь экстрагировали эфиром (2×25 мл). Экстракты объединяли, промывали водой (25 мл) и рассолом (25 мл), затем сушили. Летучие вещества удаляли выпариванием и остаток очищали на силикагеле в колонке Меgа Bond Elut при элюировании смесью 0-40% EtOAc/изогексан, получая названное в заголовке соединение. С помощью хроматографии в патроне Biotage (40 г двуокиси кремния) при элюировании смесью 40% EtOAc/изогексан получали названное в заголовке соединение (0,193 г) в виде твердого вещества. ЯМР: 2,14 (с, 3Н), 6,76 (д, 1Н), 7,4 (т, 2Н), 7,6 (м, 2Н), 7,88 (д, 1Н), 10,1 (шир.с., 1Н); m/z: 339. Методы 16-17 Следуя процедуре метода 15 и используя 2-амино-3,4-дифторнитробензол и соответствующие исходные материалы, получали следующие соединения: Метод 18 3-Ацетамидо-2-хлор-4-(4-фторфенилсульфанил)анилин Смесь 3-ацетамидо-2-хлор-4-(4-фторфенилсульфанил)нитро-бензола (метод 15) (0,1 г), гексагидрата хлорида железа (0,238 г) и цинковой пыли (0,192 г) в ДМФ (1 мл) и воде (1 мл) перемешивали и нагревали (масляная баня, 100°С) в течение 1 часа и затем охлаждали. Добавляли воду (15 мл) и смесь подщелачивали до рН 11 насыщенным водным раствором карбоната натрия (3 мл), затем экстрагировали ДХМ (3×15 мл). Экстракты промывали рассолом, затем сушили. Летучие вещества удаляли выпариванием и остаток оставляли в течение ночи под глубоким вакуумом (2 мм рт.ст.), получая названное в заголовке соединение (0,087 г) в виде твердого вещества. ЯМР: 1,95 (с, 3Н), 5,72 (шир.с., 2Н), 6,73 (д, 1Н), 7,05-7,20 (м, 5Н), 9,54 (шир.с., 1Н); m/z: 309. Методы 19-21 Следуя процедуре метода 18 и используя соответствующие исходные материалы, получали следующие соединения: Метод 22 2-Хлор-3-фтор-4-(4-фторфенилсульфанил)нитробензол 2-Амино-3-фтор-4-(4-фторфенилсульфанил)нитробензол (метод 16) (0,846 г) за 5 минут добавляли порциями при перемешивании к нагретой (масляная баня, 100°С) смеси трет-бутилнитрита (0,59 мл) и хлорида двухвалентной меди (0,484 г) в ацетонитриле (12 мл). Нагревание продолжали в течение 1 часа, затем смесь оставляли остывать и фильтровали. Добавляли эфир (60 мл), смесь промывали 20% хлористоводородной кислотой (2×60 мл) и затем сушили. Летучие вещества удаляли выпариванием и остаток очищали хроматографией в патроне Biotage (40 г двуокиси кремния) при элюировании смесью 5% EtOAc/изогексан, получая названное в заголовке соединение (0,57 г) в виде твердого вещества. ЯМР: 6,96 (т, 1Н), 7,41 (т, 2Н), 7,7 (м, 2Н), 7,91 (д, 1Н); MS (EI): 302 (M+H)+. Методы 23-24 Следуя процедуре метода 22 и используя соответствующие исходные материалы, получали следующие соединения: Метод 25 (R)-(+)-2-гидрокси-2-метил-3,3,3-трифторпропаноевая кислота Названное в заголовке соединение выделяли с помощью способа разделения, описанного в европейской патентной заявке ЕР 524781 (приведенного для получения (S)-(-)-кислоты), за исключением того, что вместо (1R/2S)-норэфедрина или (S)-(-)-1-фенилэтиламина использовали (1S,2R)-норэфедрин. ЯМР-анализ кислоты в присутствии (R)-(+)-1-фенилэтиламина показал энантиомерную чистоту >98%; ЯМР (CDCl3): 1,27 (3Н) для (R)-энантиомера, 1,21(с, 3Н) для (S)-энантиомера. Метод 26 2-Фтор-3-метилсульфанил-6-нитроанилин К раствору 2,3-дифтор-6-нитроанилина (13,3 г) в ДМФ (250 мл) при перемешивании в атмосфере аргона добавляли метантиолат натрия (5,7 г). Реакционной смеси давали остывать до температуры окружающей среды в течение 5 часов. Добавляли EtOAc (500 мл), смесь промывали рассолом (6×500 мл) и сушили. Летучие вещества удаляли выпариванием, получая названное в заголовке соединение (1,49 г) в виде желтого твердого вещества. ЯМР (СDСl3): 2,51 (с, 3Н), 6,09 (шир.с., 2Н), 6,48-6,54 (м, 1Н), 7,92 (д, 1Н); m/z (EI+): 202 (М+). Метод 27 (R)-N-[4-Этилсульфанил-3-фтор-2-хлорфенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид Суспензию (R)-N-[4-метилсульфинил-3-фтор-2-хлорфенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамида (пример 2) (5,41 г) в трифторуксусном ангидриде (65 мл) нагревали при кипячении с обратным холодильником в течение 30 минут. Реакционную смесь выпаривали, остаток повторно растворяли в МеОН (32 мл) и триэтиламине (32 мл) и добавляли йодистый этил (2,2 мл). Реакционную смесь нагревали при кипячении с обратным холодильником в течение 3 часов, давали ей остывать до комнатной температуры, и летучие вещества удаляли выпариванием. Остаток распределяли между EtOAc (150 мл) и рассолом (100 мл); органическую фазу отделяли, сушили и летучие вещества удаляли выпариванием. Остаток очищали флэш-хроматографией при элюировании смесью 10-20% EtOAc/изогексан, получая названное в заголовке соединение (2,16 г) в виде желтого твердого вещества. ЯМР (CDCl3): 1,27 (с, 3Н), 1,76 (с, 2Н), 2,88-2,95 (кв., 2Н), 3,55 (с, 1Н), 7,32 (т, 1Н), 8,15 (д, 1Н), 8,92 (с, 1Н); m/z: 344. Метод 28 (R)-N-[4-Этилсульфанил-3-йод-2-хлорфенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид К раствору (R)-N-[4-меркапто-3-йод-2-хлорфенил]-2-гидрокси-2-метил-З,3,3-трифторпропанамида (метод 29) (5,85 г) в безводном ТГФ (40 мл) при перемешивании в атмосфере аргона добавляли метоксид натрия (0,44 г) и затем йодистый этил (0,65 мл). Смесь нагревали при кипячении с обратным холодильником в течение 1 часа и давали ей остывать до температуры окружающей среды. Добавляли EtOAc (200 мл), органическую фазу промывали рассолом (100 мл) и сушили. Летучие вещества удаляли выпариванием и остаток очищали флэш-хроматографией при элюировании смесью 5-30% EtOAc/изогексан, получая названное в заголовке соединение (2,08 г) в виде бледно-желтого твердого вещества. ЯМР (CDCl3): 1,36 (т, 3Н), 1,75 (с, 3Н), 2,92-2,99 (кв., 2Н), 7,15 (д, 1Н), 8,34 (д, 1Н), 8,89 (с, 1Н); m/z: 452. Метод 29 (R)-N-[4-Меркапто-3-йод-2-хлорфенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид К охлажденному до 0°С раствору трифенилфосфина (6,41 г) в ДХМ (35 мл) и ДМФ (0,30 мл) добавляли при перемешивании раствор (R)-N-[4-хлорсульфонил-3-йод-2-хлорфенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамида (метод 30) (4,0 г) в ДХМ (40 мл). Реакционную смесь перемешивали при температуре окружающей среды в течение 45 минут, добавляли НСl (50 мл, 2М) и продолжали перемешивание в течение еще 30 минут. Органическую фазу сушили и летучие вещества удаляли выпариванием. Добавляли эфир (70 мл) и суспензию фильтровали. Фильтрат выпаривали, получая названное в заголовке соединение (5,85 г) в виде коричневой пены. M/z: 452. Метод 30 (R)-N-[4-Хлорсульфонил-3-йод-2-хлорфенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид (R)-N-[3-Йод-2-хлорфенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид (метод 31) (4,92 г) добавляли порциями к хлорсульфоновой кислоте (18 мл) при 0°С. Реакционную смесь нагревали до 80°С в течение 4 часов, давали ей остывать до температуры окружающей среды и выливали в ледяную воду (200 г). Смесь экстрагировали ДХМ (2×250 мл, органическую фазу промывали рассолом (300 мл) и сушили. Летучие вещества удаляли выпариванием, получая названное в заголовке соединение (4,8 г) в виде коричневой смолы. ЯМР (CDCl3): 1,78 (с, 3Н), 3,59 (с, 1Н), 8,23 (д, 1Н), 8,74 (д, 1Н), 9,53 (с, 1Н); m/z: 490. Метод 31 (R)-N-[3-Йод-2-хлорфенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид К охлажденному раствору (R)-N-[3-амино-2-хлорфенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамида (метод 32) (12,5 г) в концентрированной серной кислоте (25 мл) и воде (70 мл) по каплям добавляли раствор нитрита натрия (3,15 г) в воде (70 мл). Реакционную смесь перемешивали в течение 10 минут и в течение 1 часа при температуре окружающей среды. Осторожно добавляли раствор йодида калия (22,2 г) в воде (70 мл) и смесь нагревали до 100°С в течение 2,5 часов. Смеси давали остывать до температуры окружающей среды, добавляли EtOAc (500 мл), органическую фазу промывали рассолом (300 мл) и сушили. Летучие вещества удаляли выпариванием и остаток очищали флэш-хроматографией при элюировании смесью 5-20% EtOAc/изогексан, получая названное в заголовке соединение (13,5 г) в виде твердого вещества кремового цвета. ЯМР (CDCl3): 1,76 (с, 3Н), 3,63 (с, 1Н), 7,05 (т, 1Н), 7,68 (д, 1Н), 8,36 (д, 1Н), 8,97 (шир.с., 1Н); m/z: 392. Метод 32 (R)-N-[3-Амино-2-хлорфенилЗ-2-гидрокси-2-метил-3,3,3-трифторпропанамид К перемешиваемому раствору (R)-N-[3-нитро-2-хлорфенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамида (метод 3) (14,3 г) в EtOAc (250 мл) в атмосфере водорода добавляли 10% палладий на угле (1,6 г). Реакционную смесь перемешивали при комнатной температуре в течение ночи; смесь фильтровали через слой диатомитовой земли и летучие вещества удаляли выпариванием, получая названное в заголовке соединение (13 г) в виде коричневого твердого вещества. ЯМР (СDСl3): 1,75 (с, 3Н), 4,00 (с, 1Н), 4,10 (шир.с., 2Н), 6,61 (д, 1Н), 7,08 (т, 1Н), 7,72 (д, 1Н), 8,77 (шир.с., 1Н); m/z: 281. Метод 33 (R)-N-[4-Метилсульфанил-2,3-дихлорфенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид (R)-N-[4-Йод-2,3-дихлорфенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид (метод 4) (5,17 г, 12,08 ммоль) растворяли в DMA (30 мл) и нагревали до 155°С в течение 6 часов, при перемешивании в атмосфере аргона с метантиолатом натрия (1,1 г, 1,3 экв.) и хлоридом одновалентной меди (670 мг). Реакционной смеси давали остывать до комнатной температуры и гасили реакцию добавлением EtOAc и воды. Реакционную смесь фильтровали через слой диатомитовой земли и тщательно промывали смесью EtOAc/вода. Органический слой промывали водой и затем рассолом, сушили и выпаривали досуха. Остаток хроматографировали в колонке Меgа Bond Elut при элюировании смесью 2-30% EtOAc/гексан и полученный продукт растирали с 10% EtzO/гексан, получая названное в заголовке соединение в виде твердого вещества кремового цвета (2,97 г). ЯМР: 1,6 (с, 3Н), 2,5 (с, 3Н), 7,3 (д, 1Н), 7,8 (д, 1Н); m/z: 346. Метод 34 (R)-N-[4-(2-Гидроксибутилсульфанил)-2,3-дихлорфенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид Метоксид натрия (0,075 г) добавляли к перемешиваемому раствору (R)-N-[2,3-дихлор-4-меркаптофенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамида (метод 35) (0,44 г) в безводном ТГФ (10 мл). Реакционную смесь перемешивали при температуре окружающей среды в течение 5 минут и добавляли 1,2-эпоксибутан (0,11 мл). Смесь нагревали при кипячении с обратным холодильником в течение 2 часов и давали ей остывать до температуры окружающей среды. Добавляли EtOAc (150 мл) и смесь промывали рассолом (100 мл) и сушили. Летучие вещества удаляли выпариванием и остаток очищали на колонке Меgа Bond Elut (20 г двуокиси кремния) при элюировании смесью 1-40% EtOAc/изогексан, получая названное в заголовке соединение (0,259 г) в виде оранжевого твердого вещества. ЯМР: 0,88 (т, 3Н), 1,35-1,49 (м, 1Н), 1,58 (с, 3Н), 2,97-3,08 (м, 1Н), 3,53-3,62 (м, 1Н), 5,00 (д, 1Н), 7,42 (д, 1Н), 7,77 (д, 1Н), 9,79 (шир.с., 1Н); m/z: 404. Метод 35 (R)-N-[2,3-Дихлор-4-меркаптофенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид Триизопропилсилантиол (2,0 мл) добавляли при перемешивании в атмосфере аргона к охлажденной до 0°С суспензии гидрида натрия (0,37 г, 60%-ная дисперсия в минеральном масле) в безводном ТГФ (30 мл). Спустя 20 минут при данной температуре реакционную смесь добавляли к перемешиваемой суспензии (R)-N-[4-йод-2,3-дихлорфенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамида (метод 4) (4,0 г) и тетракис(трифенилфосфин)палладия(0) (0,86 г) в безводном толуоле (40 мл). Смесь нагревали при 85°С в течение 5 часов и добавляли ДМФ (10 мл), получая прозрачный раствор. Нагревание продолжали в течение еще 17 часов. Смеси давали остывать до температуры окружающей среды, добавляли EtOAc (200 мл), смесь промывали рассолом (3×100 мл) и сушили. Летучие вещества удаляли выпариванием и остаток очищали хроматографией при элюировании смесью 1-50% EtOAc/изогексан, получая названное в заголовке соединение (0,448 г) в виде оранжевого твердого вещества. ЯМР: 1,58 (с, 3Н), 7,55 (д, 1Н), 7,66 (д, 1Н), 7,73 (с, 1Н), 9,80 (с, 1Н); m/z: 332. Метод 36 (R)-N-[2,3-Дихлор-4-{4-(N,N-диметилкарбамоил)фенилсульфанил}фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид (R)-N-[2,3-Дихлор-4-тиоцианатофенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид (метод 39) (0,5 г) в виде раствора в ДМФ обрабатывали раствором сульфида натрия (403 мг) в воде (2 мл) и смесь нагревали при 50°С в течение 1 часа. Затем реакционную смесь обрабатывали раствором N,N-диметилкарбамоил-4-йодбензола (0,455 г) в ДМФ (5 мл), а затем оксидом одновалентной меди (0,121 г). Реакционную смесь нагревали при 150°С в течение 4,5 часов в атмосфере аргона. Реакционную смесь гасили водой (100 мл), добавляли ДХМ (100 мл) и смесь фильтровали через диатомитовую землю. Водный слой отделяли и промывали ДХМ (3×50 мл). Органические экстракты объединяли и сушили. Летучие вещества удаляли выпариванием и продукт очищали хроматографией, с использованием колонки Меgа Bond Elut (20 г двуокиси кремния) при элюировании смесью 0-5% МеОН/ДХМ, получая названное в заголовке соединение в виде белого твердого вещества (0,53 г, 80%). ЯМР: 1,60 (с, 3Н), 2,95 (д, 6Н), 7,30 (д, 1Н), 7,30-7,50 (м, 4Н), 7,85 (с, 1Н), 7,90 (д, 1Н), 9,90 (с, 1Н); m/z: 479. Методы 37-38 Следуя процедуре метода 36 и используя соответствующие исходные материалы, получали следующие соединения: Метод 39 (R)-N-[2,3-Дихлор-4-тиоцианатофенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид (R)-(+)-2-Гидрокси-2-метил-3,3,3-трифторпропаноевую кислоту (метод 25) (1 г) в виде суспензии в ДХМ обрабатывали безводным ДМФ (1 капля). На протяжении периода 15 минут добавляли по каплям оксалилхлорид (1,15 мл) в виде раствора в ДХМ. Смесь оставляли перемешиваться в течение ночи в атмосфере аргона. Летучие вещества удаляли выпариванием и остаток повторно растворяли в ДХМ (20 мл). Данный раствор использовали для обработки раствора 2,3-дихлор-4-тиоцианатанилина (метод 40) (1,37 г) и ди-трет-бутилпиридина 1,55 мл) в ДХМ путем добавления на протяжении 15 минут. Реакционную смесь оставляли перемешиваться в течение ночи в атмосфере аргона. Летучие вещества удаляли выпариванием и остаток очищали хроматографией на колонке Меgа Bond Elut (20 г двуокиси кремния), получая названное в заголовке соединение в виде белого твердого вещества, 1,08 г (48%). ЯМР (CDCl3): 1,65 (с, 3Н), 7,80 (д, 1Н), 7,95 (с, 1Н), 8,10 (д, 1Н), 9,95 (с, 1Н); m/z: 357. Метод 40 2,3-Дихлор-4-тиоцианатоанилин К холодному (0-5°С) раствору 2,3-дихлоранилина (2 г) и тиоцианата натрия (3 г) в МеОН (30 мл) добавляли раствор брома (2 г) в МеОН (10 мл), насыщенный бромидом натрия. Раствор оставляли перемешиваться в течение 1 часа. Реакционную смесь выливали в воду (200 мл) и нейтрализовали карбонатом натрия до рН 8. Твердое вещество собирали фильтрованием и сушили, получая названное в заголовке соединение в виде белого твердого вещества (2,38 г, 88%). ЯМР (СDСl3): 6,35 (с, 2Н), 6,81 (д, 1Н), 7,55 (д, 1Н); m/z (EI+): 218. Методы 41-42 Следуя процедуре метода 40 и используя соответствующие исходные материалы, получали следующие соединения: Метод 43 (R)-N-(2-Метил-3-фтор-4-[4-фторфенил]сульфанилфенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамид К раствору (R)-N-(2-метил-3-фтор-4-йодфенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамида (метод 45) (782 мг) в ДМФ (6 мл) добавляли 4-фтортиофенол (0,32 мл) и Cu2O (143 мг). Смесь нагревали в атмосфере аргона до 150°С в течение 4,5 часов. Все летучие вещества удаляли выпариванием и остаток растворяли в EtOAc (100 мл). Смесь фильтровали через диатомитовую землю и все летучие вещества удаляли выпариванием. Остаток очищали хроматографией на силикагеле при элюировании 15% EtOAc в изогексане, получая названное в заголовке соединение (544 мг) в виде твердого вещества. ЯМР: 1,57 (с, 3Н), 2,06 (с, 3Н), 7,15 (т, 1Н), 7,26 (м, 3Н), 7,39 (м, 2Н), 7,52 (шир.с, 1Н), 9,78 (шир.с, 1Н); m/z: 390. Метод 44 Следуя процедуре метода 43 и используя соответствующие исходные материалы, получали следующее соединение: Метод 45 (R)-N-(2-Метил-3-фтор-4-йодфенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамид Оксалилхлорид (0,7 мл) добавляли при перемешивании к суспензии (R)-(+)-2-гидрокси-2-метил-3,3,3-трифторпропаноевой кислоты (метод 25) (1,26 г) в ДХМ (40 мл), содержащей ДМФ (3 капли). Смесь перемешивали при температуре окружающей среды в течение 4 часов и добавляли 2,6-ди-трет-бутилпиридин (2,25 мл) и 4-йод-3-фтор-2-метиланилин (метод 48) (1,368 г). Полученную смесь перемешивали при температуре окружающей среды в течение 72 часов. Летучие вещества удаляли выпариванием и остаток очищали хроматографией на силикагеле при элюировании смесью 25% EtOAc/изогексан, получая названное в заголовке соединение (1,668 г) в виде твердого вещества. ЯМР: 1,56 (с, 3Н), 2,08 (с, 3Н), 7,03 (д, 1Н), 7,66 (т, 1Н); m/z: 390. Методы 46-47 Следуя процедуре метода 45 и используя соответствующие исходные материалы, получали следующие соединения: Метод 48 4-Йод-3-фтор-2-метиланилин Монохлорид йода (0,5 мл) добавляли к раствору З-фтор-2-метиланилина (1,25 г) в ледяной уксусной кислоте (15 мл). Смесь перемешивали в течение двух часов при 70°С. Смеси давали остывать до температуры окружающей среды и добавляли насыщенный раствор сульфита натрия (50 мл). Раствор экстрагировали EtOAc (2×100 мл), экстракты объединяли, промывали насыщенным раствором бикарбоната натрия (100 мл) и сушили. Летучие вещества удаляли выпариванием и остаток очищали хроматографией на силикагеле при элюировании 0-10% EtOAc в гексане, получая названное в заголовке соединение (1,53 г) в виде твердого вещества. ЯМР: 1,98 (с, 3Н), 5,32 (с, 2Н), 6,30 (д, 1Н), 7,20 (т, 1Н); m/z: 250. Методы 49-51 Следуя процедуре метода 48 и используя соответствующие исходные материалы, получали следующие соединения: 1 Растворитель для хроматографии: 0-15% EtOAc/гексан. Дает вязкую темную жидкость, которая затвердевает при растирании с гексаном. Метод 52 (R)-N-(2-Метил-3-фтор-4-[4-N,N-диметилкарбамоилфенил]судьфанилфенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамид 4-[N,N-Диметилкарбамоил]тиофенол (метод 53) (751 мг), (R)-N-(2-метил-3-хлор-4-йодфенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамид (метод 45) (1,433 г) и Cu2O (250 мг) соединяли в ДМФ (10 мл). Смесь перемешивали в течение 4,5 часов при 150°С в атмосфере аргона. Смеси давали остывать до температуры окружающей среды, добавляли EtOAc (100 мл) и полученную суспензию фильтровали через диатомитовую землю, прежде чем все летучие вещества удаляли выпариванием. Остаток очищали хроматографией при элюировании 1-5% МеОН в ДХМ, получая названное в заголовке соединение (1,02 г). ЯМР: 1,60 (c, 3Н), 2,12 (с, 3Н), 2,97 (шир.с, 6Н), 7,20 (д, 2Н), 7,37 (м, 4Н), 9,81 (шир.с, 1Н); m/z: 443. Метод 53 4-[4-N,N-диметилкарбамоилфенил]тиофенол Дифосфористый пентоксид (923 г) добавляли к раствору 4-меркаптобензойной кислоты (2000 мг) в ДМФ (10 мл). Смесь перемешивали в течение шестнадцати часов при 150°С в атмосфере аргона. Смеси давали остывать до температуры окружающей среды, затем добавляли EtOAc (150 мл). Раствор промывали водой (100 мл), рассолом (50 мл) и сушили. Летучие вещества удаляли выпариванием и остаток очищали хроматографией на силикагеле при элюировании 2,5% МеОН в ДХМ, получая два образца. Один образец, содержавший смесь тиола и дисульфида, очищали хроматографией на силикагеле при элюировании 1-2,5% МеОН в ДХМ, получая названное в заголовке соединение (760 мг) в виде твердого вещества. ЯМР: 2,94 (с, 6Н), 5,63 (с, 1Н), 7,30 (м, 4Н); m/z: 180. Метод 54 (R)-N-[4-(2-Гидроксиэтилсульфанил)-2,3-дихлорфенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид (R)-N-[4-Йод-2,3-дихлорфенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид (метод 4) (1,22 г) добавляли к деоксигенированному раствору 2-меркаптоэтанола (0,26 мл), метоксида натрия (0,20 г) и хлорида меди(I) (0,11 г) в хинолине (3 мл) и пиридине (1 мл). Смесь перемешивали при 190°С в атмосфере аргона в течение 18 часов. Смеси давали остывать до комнатной температуры и добавляли EtOAc (200 мл). Смесь промывали хлористоводородной кислотой (10% об., 2×250 мл), рассолом (200 мл) и сушили. Летучие вещества удаляли выпариванием и остаток очищали хроматографией на колонке Меgа Bond Elut с 50 г силикагеля при элюировании смесью 5-50% EtOAc/изогексан, получая названное в заголовке соединение в виде оранжевого твердого вещества. ЯМР: 1,59 (с, 3Н), 3,15 (т, 2Н), 3,60-3,63 (м, 2Н), 4,98 (т, 1Н), 7,43 (д, 1Н), 7,80 (д, 1Н), 9,78 (шир.с, 1Н); m/z: 376. Метод 59 (R)-N-[4-Этилсульфонил-З(4-карбоксифенилсульфанил)-2-хлорфенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид Следуя процедуре примера 48 при использовании 4-меркаптобензойной кислоты (1,5 экв.) и метоксида натрия вместо метантиолата, получали названное в заголовке соединение в виде коричневой пены. ЯМР: 1,13 (т, 3Н), 1,61 (с, 3Н), 3,49-3,56 (кв., 2Н), 7,15 (д, 2Н), 8,20 (д, 1Н), 8,56 (д, 1Н), 9,99 (шир.с, 1Н); m/z: 510. Методы 60-62 Следуя процедуре примера 9 и используя соответствующие исходные материалы, получали следующие соединения: Метод 63 (R)-N-(2-Метил-3-хлор-4-[4-N,N-карбоксифенилсупьфанил]фенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамид 4-Меркаптобензойную кислоту (308 мг) добавляли к суспензии оксида меди(I) (93 мг) и (R)-N-(2-метил-3-хлор-4-йодфенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамида (метод 46) (530 мг) в ДМФ (5 мл). Смесь нагревали до 150°С в атмосфере аргона в течение 4,5 часов. Смеси давали остывать до температуры окружающей среды, добавляли EtOAc (100 мл), полученную суспензию фильтровали через диатомитовую землю и летучие вещества удаляли выпариванием. Остаток очищали хроматографией при элюировании 5-10% МеОН в ДХМ, получая названное в заголовке соединение (504 мг). ЯМР: 1,58 (с, 3Н), 2,26 (с, 3Н), 7,34 (м, 4Н), 7,51 (шир.с, 1Н), 7,92 (шир.с, 2Н), 9,94 (с, 1Н), 13,00 (шир.с, 1Н); m/z: 432. Методы 64-65 Следуя процедуре метода 63 и используя соответствующие исходные материалы, получали следующие соединения: Метод 66 (R)-N-4-[4-(4-Карбоксифенилсульфонил)-2,3-дихлорфенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид (R)-N-[4-(4-Карбоксифенилсульфанил)-2,3-дихлорфенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид (метод 67) (3,83 г, 8,45 ммоль) суспендировали при перемешивании в ледяной уксусной кислоте. Добавляли перекись водорода (19 мл). Смесь нагревали при перемешивании до 95°С в течение 3 часов и давали ей остывать до комнатной температуры. Смесь выпаривали досуха, получая твердое вещество кремового цвета, которое растирали с гексаном. Твердое вещество отфильтровывали и промывали, получая названное в заголовке соединение (3,97 г) в виде твердого вещества кремового цвета. ЯМР: 1,6 (с, 3Н), 8,0 (д, 2Н), 8,1 (д, 2Н), 8,4 (кв., 2Н), 9,9 (с, 1Н); m/z: 484. Метод 67 (R)-N-[4-(4-Карбоксифенилсульфанил)-2,3-дихлорфенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид (R)-N-[4-Йод-2,3-дихлорфенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид (метод 4) (4,58 г, 10,7 ммоль) нагревали при перемешивании в атмосфере аргона в течение 4 часов в ДМФ (30 мл) с 4-меркаптобензойной кислотой (2,31 г, 14,98 ммоль) и оксидом одновалентной меди (765 мг) и давали смеси остывать до комнатной температуры. Добавляли EtOAc и воду, реакционную смесь фильтровали через слой диатомитовой земли и промывали смесью EtOAc/вода. Органический слой отделяли, промывали водой, рассолом, сушили и выпаривали досуха. Полученное твердое вещество очищали с использованием колонки Меgа Bond Elut при элюировании смесью 5-50% EtOAc/изогексан, получая названное в заголовке соединение (4,0 г) в виде розового твердого вещества. ЯМР: 1,6 (с, 3Н), 7,3 (д, 2Н), 7,5 (д, 1Н), 7,9 (м, 3Н), 8,0 (д, 1Н), 9,9 (с, 1Н), 13,0 (с, 1Н); m/z: 452. Метод 68 (R)-N-(2-Хлор-3-нитро-4-йодфенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамид К раствору (R)-N-(2-хлор-3-нитро-4-йодфенил)-2-триметилсилилокси-2-метил-3,3,3-трифторпропанамида (метод 69) (1150 мг) в МеОН добавляли 2 М хлористоводородную кислоту (2,5 мл) и реакционную смесь перемешивали в течение 4 часов при температуре окружающей среды. Летучие вещества удаляли выпариванием и остаток распределяли между EtOAc (150 мл) и водой (75 мл). Органическую фазу отделяли, промывали рассолом (75 мл) и сушили. Летучие вещества удаляли выпариванием, получая названное в заголовке соединение (943 мг). ЯМР: 1,58 (с, 3Н), 7,70 (д, 1Н), 8,00 (д, 1Н); m/z: 437. Метод 69 (R)-N-(2-Хлор-3-нитро-4-йодфенил)-2-триметилсилилокси-2-метил-3,3,3-трифторпропанамид 4-Йод-3-нитро-2-хлоранилина (метод 70) (1269 мг) и 2,6-ди-трет-бутилпиридин (1,5 мл) добавляли к раствору (S)-3,3,3-трифтор-2-(триметилсилилокси)-2-метилпропаноилхлорида (получен из (R)-3,3,3-трифтор-2-гидрокси-2-метилпропионовой кислоты (метод 25), как описано в J. Med. Chem., 1999, 42, 2741-2746) (6 ммоль) в ДХМ (40 мл). Смесь перемешивали в течение 3 суток при температуре окружающей среды. Летучие вещества удаляли выпариванием и остаток очищали хроматографией при элюировании 10% EtOAc в гексане, получая названное в заголовке соединение (1160 мг). ЯМР: 0,27 (с, 9Н), 1,70 (с, 3Н), 7,70 (д, 1Н), 8,05 (д, 1Н), 9,72 (шир.с, 1Н); m/z: 509. Метод 70 4-Йод-3-нитро-2-хлоранилин Монохлорид йода (1,25 мл) добавляли к раствору 3-нитро-2-хлоранилина (4265 мг) в ледяной уксусной кислоте (40 мл). Смесь перемешивали в течение четырех часов при 70°С. После того как смеси давали остыть до температуры окружающей среды, добавляли насыщенный раствор сульфита натрия (100 мл). Раствор экстрагировали EtOAc (200 мл), летучие вещества удаляли выпариванием и остаток повторно растворяли в EtOAc (150 мл), промывали насыщенным раствором бикарбоната натрия (75 мл), рассолом (75 мл) и сушили. Летучие вещества удаляли выпариванием и остаток очищали хроматографией при элюировании 5-15% EtOAc в гексане, получая смесь названного в заголовке соединения и исходного материала (1,933 мг) (отношение 1:1,75). Монохлорид йода (0,28 мл) добавляли к раствору смеси (1919 мг) в ледяной уксусной кислоте (10 мл). Смесь перемешивали в течение четырех часов при 70°С. После того как смеси давали остыть до температуры окружающей среды, добавляли насыщенный раствор сульфита натрия (50 мл). Раствор экстрагировали EtOAc (100 мл), летучие вещества удаляли выпариванием и остаток распределяли между EtOAc (100 мл) и насыщенным раствором бикарбоната натрия (50 мл). Органическую фазу отделяли, промывали рассолом (50 мл) и сушили. Летучие вещества удаляли выпариванием и остаток очищали хроматографией при элюировании 5-15% EtOAc в гексане, получая названное в заголовке соединение (1286 мг) в виде твердого вещества. ЯМР: 6,19 (с, 2Н), 6,73 (д, 1Н), 7,50 (д, 1Н); m/z: 297. Метод 71 (R)-N-[4-{2-Нитропирид-6-илсульфонил}-2,3-дихлорфенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид Смесь (R)-N-[2,3-Дихлор-4-(хлорсульфонил)фенил]-2-гидрокси-2-метил-З,3,3-трифторпропанамида (2 г, 5 ммоль) (метод 73), сульфита натрия (1,25 г) и бикарбоната натрия (1,05 г) в воде (10 мл) перемешивали при 75°С в течение 1 часа. Раствор выпаривали досуха, получая белое твердое вещество. К нему добавляли 2-хлор-6-нитропиридин (метод 72; 713 мг) и ДМФ (15 мл). Смесь нагревали при перемешивании при 75°С в течение 4 часов и затем давали смеси остывать до комнатной температуры. Остаток распределяли между водой и EtOAc. Водный слой экстрагировали EtOAc, органические слои объединяли, промывали рассолом, сушили и летучие вещества удаляли выпариванием. Очистку проводили на колонке Меgа Bond Elut при градиентном элюировании растворителем 0-40% EtOAc/гексан. Таким образом, получали названное в заголовке соединение (250 мг) в виде бледно-желтой пены. ЯМР: 1,6 (с, 3Н), 8,1 (с, 1Н), 8,4 (кв, 2Н), 8,6 (д, 1Н), 8,9 (д, 1Н), 9,4 (с, 1Н); m/z: 486. Метод 72 2-Хлор-6-нитропиридин Хлорид меди(II) (5,8 г) и трет-бутилнитрит (6,1 мл) перемешивали в ТГФ (150 мл) в атмосфере аргона и нагревали до 65°С. Порциями добавляли 2-амино-6-нитропиридин (Shurko, О.Р., Mamaev, V.P., Chem. Heterocycl. Comp., 26, 1990, 1, 47-52; 5 г, 36 ммоль). Реакционную смесь перемешивали при 65°С в течение 1 часа и затем давали ей остывать до комнатной температуры. Добавляли EtOAc (200 мл), органический слой промывали 2М НСl, водой и сушили. Летучие вещества удаляли выпариванием, получая липкое оранжевое твердое вещество, которое растирали с гексаном, получая названное в заголовке соединение (3,4 г) в виде коричнево-оранжевого твердого вещества. ЯМР: 7,8 (д, 1Н), 8,6 (д, 1Н), 9,2 (с, 1Н). Метод 73 (R)-N-[2,3-Дихлор-4-(хлорсульфонил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид (R)-N-{2,3-Дихлорфенил}-2-гидрокси-2-метил-3,3,3-трифторпропанамид (метод 74) (5,0 г, 16,6 ммоль) за 15 минут добавляли порциями к охлажденной (0°С) хлорсульфоновой кислоте (5,3 мл, 81 ммоль) и затем смесь нагревали при 85°С в течение 4,5 часов. Реакционную смесь охлаждали на бане со льдом и затем медленно выливали в перемешиваемую смесь лед-вода (60 мл). Смесь экстрагировали ДХМ (2×75 мл), ДХМ экстракт промывали рассолом, сушили и выпаривали. Остаток очищали с помощью хроматографии на двуокиси кремния с 20% EtOAc в гексане в качестве элюента, получая названное в заголовке соединение в виде твердого вещества (3,0 г, 7,5 ммоль). ЯМР (СDСl3): 1,8 (с, 3Н), 3,4 (с, 1Н), 8,15 (д, 1Н), 8,65 (д, 1Н) и 9,55 (шир.с, 1Н); m/z: 400. Метод 74 (R)-N-{2,3-Дихлорфенил}-2-гидрокси-2-метил-3,3,3-трифторпропанамид К раствору 2,3-дихлоранилина (6,85 г, 42,5 ммоль) и пиридина (5,1 мл, 75 ммоль) в ДХМ (100 мл) добавляли раствор S-3,3,3-трифтор-2-триметилсилилокси-2-метилпропаноилхлорида (полученного из (R)-3,3,3-трифтор-2-гидрокси-2-метилпропионовой кислоты (метод 25), как описано в J. Med. Chem., 1999, 42, 2741-2746) (12,2 г, 150 ммоль) в ДХМ (50 мл). Смесь перемешивали при температуре окружающей среды в течение 24 часов, затем промывали 1М хлористоводородной кислотой, насыщенным раствором бикарбоната натрия и рассолом, затем сушили и выпаривали. Остаток растворяли в МеОН (50 мл), обрабатывали 1М хлористоводородной кислотой (25 мл) и смесь перемешивали при температуре окружающей среды в течение 18 часов. МеОН выпаривали, водный слой экстрагировали EtOAc (2×25 мл), EtOAc экстракты промывали насыщенным раствором бикарбоната натрия и рассолом, затем сушили и выпаривали. Остаток очищали с помощью хроматографии на двуокиси кремния с ДХМ в качестве элюента, получая названное в заголовке соединение в виде твердого вещества (5,2 г, 17,3 ммоль). ЯМР: 1,6 (с, 3Н), 7,4 (дд, 1Н), 7,5 (д, 1Н), 7,8 (с, 1Н), 7,9 (д, 1Н), 9,8 (с, 1Н); m/z: 300. Метод 75 2-Хлор-3-фтор-4-(4-N,N-диметилкарбамоилфенилсульфанил) нитробензол Названное в заголовке соединение получали из 2-хлор-З-фтор-4-(4-карбоксифенилсульфанил)нитробензола (метод 24) по процедуре примера 51. ЯМР: 2,95 (д, 6н), 7,20 (дд, 1Н), 7,50 (д, 2Н), 7,60 (д, 2Н), 7,95 (д, 1Н); m/z (ES+): 355 (М+Н)+. Метод 76 (R)-N-{2-Хлор-3-(4-карбоксифенилсульфанил)-4-[4-(N,N-диметилкарбамоил)фенилсульфонил]фенил}-2-гидрокси-2-метил-3,3,3-трифторпропанамид (R)-N-{2-Хлор-3-фтор-4-[4-(N,N-диметилкарбамоил)фенилсульфонил] фенил}-2-гидрокси-2-метил-3,3,3-трифторпропанамид (пример 18) обрабатывали 4-меркаптобензойной кислотой по процедуре примера 50, получая названное в заголовке соединение в виде белого твердого вещества (0,39 г, 25%). ЯМР: 1,60 (с, 3Н), 2,90 (с, 3Н), 3,00 (с, 3Н), 7,55-7,65 (м, 4Н), 7,90-7,95 (м, 4Н), 8,05 (с, 1Н), 8,55 (д, 1Н), 8,65 (д, 1Н), 9,95 (с, 1Н), 10,60 (с, 1Н); m/z: 629. Метод 77 2-Фтор-3-(изопропилсульфанил)-6-нитроанилин К раствору 2,3-дифтор-6-нитроанилина (10,04 г) в ДМФ (200 мл) добавляли 2-пропантиолат натрия (5,66 г). Смесь перемешивали при температуре окружающей среды в течение 16 часов, затем разбавляли EtOAc (300 мл) и промывали рассолом (500 мл). Промывную жидкость экстрагировали EtOAc (300 мл). Органические фазы объединяли, промывали рассолом (500 мл), сушили и летучие вещества удаляли выпариванием, получая названное в заголовке соединение (14,1 г) в виде твердого вещества. ЯМР: 1,30 (д, 6Н), 3,70 (септет, 1Н), 6,70 (дд, 1Н), 7,26 (с, 2Н), 7,80 (дд, 1Н); m/z: 229. Метод 78 2-Хлор-3-фтор-4-(изопропилсульфанил)нитробензол Раствор 2-фтор-3-(изопропилсульфанил)-6-нитроанилина (метод 77; 14,0 г) в ацетонитриле (100 мл) добавляли при перемешивании при 65°С в атмосфере аргона к смеси хлорида меди(II) (8,95 г) и трет-бутилнитрита (9,9 мл) в ацетонитриле (300 мл) и смесь перемешивали в течение 2,5 часов. Реакционной смеси давали остывать, добавляли EtOAc (300 мл), смесь промывали 2М хлористоводородной кислотой (2×200 мл), рассолом (200 мл) и сушили. Летучие вещества удаляли выпариванием и получали масло. Масло очищали хроматографией на силикагеле при элюировании 10-25% EtOAc в гексане, получая названное в заголовке соединение (10,16 г). ЯМР: 1,33 (д, 6Н), 3,78 (м, 1Н), 7,65 (т, 1Н), 7,98 (д, 1Н); m/z: 249 (М+). Метод 79 2-Хлор-3-фтор-4-(изопропилсульфанил)анилин Раствор гексагидрата трихлорида железа (32,7 г) в воде (100 мл) добавляли к смеси 2-хлор-3-фтор-4-(изопропилсульфанил)нитробензола (метод 78; 10,07 г) и цинковой пыли (26,36 г) в ДМФ (100 мл). Смесь нагревали до 100°С в течение двух часов и затем давали ей остывать до температуры окружающей среды. Затем смесь разбавляли EtOAc (500 мл), фильтровали через диатомитовую землю, промывали рассолом (4×250 мл), сушили над сульфатом магния и летучие вещества удаляли выпариванием и получали масло. Масло очищали хроматографией на силикагеле при элюировании 10% EtOAc в гексане, получая названное в заголовке соединение (5,29 г) в виде твердого вещества. ЯМР: 1,11 (д, 6Н), 3,10 (септет, 1Н), 5,92 (с, 2Н), 6,57 (д, 1Н, 7,11 (т, 1Н); m/z: 219 (М+). Метод 80 (2R)-N-[2-Хлор-3-фтор-4-(изопропилсульфанил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамид К раствору (R)-(+)-2-гидрокси-2-метил-3,3,3-трифтор-пропановой кислоты (метод 25; 4,424 г) в ДХМ (75 мл) добавляли 1,3-бис(триметилсилил)мочевину (5,73 г) и смесь перемешивали в течение 16 часов при температуре окружающей среды. Твердое вещество отфильтровывали и промывали ДХМ (20 мл). Органические растворы объединяли, охлаждали на бане со льдом и добавляли оксалилхлорид (2,7 мл) и ДМФ (кат.). Затем раствор нагревали до температуры окружающей среды и перемешивали в течение 24 часов. Летучие вещества удаляли выпариванием, остаток растворяли в ДХМ (50 мл) и добавляли к охлажденной на бане со льдом смеси 2-хлор-3-фтор-4-(изопропилсульфанил)анилина (метод 79; 5,105 г) и триэтиламина (11,7 г) в ДХМ (50 мл). Смеси давали подогреться до температуры окружающей среды и перемешивали ее в течение 18 часов. Летучие вещества удаляли выпариванием и получали масло. Масло очищали хроматографией на силикагеле при элюировании 10%-25% EtOAc в гексане, получая твердое вещество. Вещество растворяли в безводном ТГФ (15 мл) и охлаждали до -78°С. Добавляли 1М тетрабутиламмонийфторид (3,6 мл) и смесь перемешивали в течение 45 минут при -78°С в атмосфере аргона. Затем смеси давали подогреться до температуры окружающей среды и перемешивали ее дополнительно в течение 45 минут. Добавляли 2 М хлористоводородную кислоту (50 мл) и смесь экстрагировали EtOAc (100 мл). Экстракт промывали рассолом (50 мл), сушили, летучие вещества удаляли выпариванием и получали названное в заголовке соединение (1,23 г) в виде твердого вещества. ЯМР: 1,21 (д, 6Н), 1,58 (с, 3Н), 3,45 (м, 1Н), 7,50 (т, 1Н), 7,79 (д, 1Н), 7,84 (с, 1Н), 9,79 (с, 1Н); m/z: 358,35. Метод 81 2-Хлор-3-фтор-4-[4-(N-метил-N-этилкарбамоил)фенилсульфанил]-нитробензол 2-Хлор-3-фтор-4-(4-карбоксифенилсульфанил)нитробензол (метод 24; 5,5 г, 16,8 ммоль) суспендировали при перемешивании в ДХМ (100 мл) и добавляли оксалилхлорид (3,22 мл). Добавляли пару капель ДМФ для инициирования реакции и оставляли смесь при перемешивании в течение ночи. Смесь упаривали досуха и затем повторно растворяли в ДХМ (20 мл). N-Этил-N-метиламин (0,46 мл, 5,28 ммоль) растворяли в ДХМ (1 мл) и к нему при перемешивании добавляли немного описанного выше раствора гидрохлорида (2,4 ммоль). Раствор оставляли при перемешивании в течение ночи и затем промывали водой, рассолом и сушили, выливали в колонку Chem Elut и элюировали EtOAc. Полученный раствор упаривали досуха и затем очищали с помощью хроматографии на колонке Меgа Bond Elut при элюировании градиентным растворителем гексан/EtOAc, получая названное в заголовке соединение (680 мг). ЯМР: 1,1 (с, 3Н), 2,9 (д, 3Н), 3,2 (с, 1Н), 3,4 (с, 1Н), 7,2 (м, 1Н), 7,5 (д, 2Н), 7,6 (д, 2Н), 8,0 (м, 1Н); m/z: 369. Метод 82 2-Хлор-3-фтор-4-[4-(N-этилкарбамоил)фенилсульфанил]нитробензол Раствор этиламина (2М в абсолютном EtOH; 2,65 мл) помещали в реакционный сосуд с ДХМ (1 мл). Туда добавляли порцию раствора хлорангидрида (2,4 ммоль), приготовленного по методу 81. Раствор оставляли перемешиваться в течение ночи и затем промывали водой, рассолом и сушили, выливали в колонку Chem Elut и элюировали EtOAc. Раствор упаривали досуха и очищали с помощью хроматографии на колонке Меgа Bond Elut при элюировании градиентным растворителем гексан/EtOAc, получая названное в заголовке соединение (380 мг). ЯМР: 1,1 (т, 3Н), 3,2 (м, 2Н), 7,1 (т, 1Н), 7,6 (д, 2Н), 7,9 (м, 2Н), 8,6 (с, 1Н). Метод 83 2-Хлор-3-фтор-4-[4-(N-метил-N-этилкарбамоил)фенилсульфанил]анилин 2-Хлор-3-фтор-4-[4-(N-метил-N-этилкарбамоил)фенилсульфанил]нитробензол (метод 81; 650 мг, 1,76 ммоль) нагревали при перемешивании при 75°С в течение 45 минут с порошком железа (1,06 г), EtOH (1,2 мл), водой (0,5 мл) и 2 каплями конц. НСl. Затем смеси давали остывать до комнатной температуры, подщелачивали насыщенным раствором бикарбоната натрия и добавляли EtOAc. Реакционную смесь фильтровали через слой диатомитовой земли, тщательно промывая водой и EtOAc. Органические слои объединяли и промывали водой, сушили, фильтровали и упаривали досуха, получая названное в заголовке соединение (600 мг) в виде бледно-желтой смолы. ЯМР: 1,0 (с, 3Н), 2,8 (С, 3Н), 3,2 (д, 2Н), 6,2 (с, 1Н), 7,0 (м, 2Н), 7,2 (м, 3Н). Метод 84 2-Хлор-3-фтор-4-[4-(N-этилкарбамоил)фенилсульфанил]анилин 2-Хлор-3-фтор-4-[4-(N-этилкарбамоил)фенилсульфанил] нитробензол (метод 82; 360 мг, 1,02 ммоль), порошок железа (617 мг), EtOH (0,68 мл), воду (0,28 мл) и 1 каплю конц. НСl нагревали при 75°С при перемешивании в течение 45 минут. Смеси давали остывать до комнатной температуры и затем подщелачивали насыщенным раствором бикарбоната натрия. Добавляли EtOAc и раствор выливали в колонку Chem Elut и элюировали EtOAc, получая названное в заголовке соединение (260 мг) в виде бледно-желтого липкого твердого вещества. ЯМР: 1,1 (т, 3Н), 3,2 (кв.,2Н), 6,1 (с, 1Н), 7,0 (кв.,2Н), 7,7 (т, 2Н), 8,3 (д, 1Н). Метод 85 (R)-N-{2-Хлор-3-фтор-4-[4-(N-метил-N-этилкарбамоил)фенилсульфанил]фенил}-2-гидрокси-2-метил-3,3,3-трифторпропанамид 2-Хлор-3-фтор-4-[4-(N-метил-N-этилкарбамоил)фенилсульфанил]анилин (метод 83; 580 мг, 1,7 ммоль) растворяли в ДХМ (6 мл) и добавляли пиридин (0,28 мл). S-3,3,3-Трифтор-2-(триметилсилилокси)-2-метилпропаноилхлорид (полученный из (R)-3,3,3-трифтор-2-гидрокси-2-метилпропионовой кислоты (метод 25), как описано в J. Med. Chem., 1999, 42, 2741-2746) (508 мг) растворяли в ДХМ (1 мл) и добавляли к анилину. Раствор перемешивали в течение 4 часов и затем промывали НСl (2М), чтобы удалить избыточный пиридин. Органический слой упаривали досуха, растворяли в МеОН (17 мл) и добавляли НСl (2М, 1,7 мл). Раствор оставляли в течение ночи при перемешивании при комнатной температуре. МеОН удаляли и остаток распределяли между водой и EtOAc. Водный слой дважды экстрагировали EtOAc, органические слои объединяли, промывали водой, рассолом и сушили, выливали в колонку Chem Elut и элюировали EtOAc. Полученный раствор упаривали досуха и очищали с помощью хроматографии на колонке Bond Elut при элюировании смесью 5-65% EtOAc/изогексан, получая названное в заголовке соединение (390 мг) в виде белого твердого вещества. ЯМР: 1,0 (с, 3Н), 1,6 (с, 3Н), 2,8 (с, 3Н), 3,2 (д, 2Н), 7,2 (д, 2Н), 7,3 (д, 2Н), 7,6 (т, 1Н), 7,9 (с, 1Н), 9,9 (с, 1Н); m/z: 477. Метод 86 (R)-N-{2-Хлор-3-фтор-4-[4-(N-этилкарбамоил)фенилсульфанил]фенил}-2-гидрокси-2-метил-3,3,3-трифторпропанамид 2-Хлор-3-фтор-4-[4-(N-этилкарбамоил)фенилсульфанил]анилин (метод 84) подвергали реакции с (S)-3,3,3-трифтор-2-(триметилсилилокси)-2-метилпропаноилхлоридом согласно процедуре метода 85 с получением указанного в заголовке соединения в виде желтой смолы. M/z: 463. Пример 85 Далее иллюстрируются представительные фармацевтические дозированные формы, содержащие соединение формулы (I), или его фармацевтически приемлемую соль, или гидролизуемый in vivo сложный эфир (далее соединение X), для терапевтического или профилактического применения людьми:
Примечание: Формы, приведенные выше, могут быть получены обычными способами, хорошо известными в области фармацевтической технологии. Таблетки (а)-(с) могут быть известными способами покрыты энтеросолюбильным покрытием, например, с получением покрытия из ацетатфталатцеллюлозы.
Формула изобретения
1. Замещенные производные N-фенил-2-гидрокси-2-метил-3,3,3,-трифторпропанамида формулы (I) где n равняется 1 или 2; R1 представляет хлор, фтор, бром, метил или метокси; R2 выбирают из одной из следующих трех групп: i) галогено, нитро, гидрокси, амино или циано; ii) –X1-R5, где X1 представляет -О-, -S-, -SO-, -SO2-, -NR6-, -CO-, -CONR6-, -NR6CO-, где R6 представляет водород; и R5 выбирают из С1-6алкила, необязательно замещенного одним или несколькими А, С3-7циклоалкила, необязательно замещенного одним или несколькими А, С3-7циклоалкилС1-6алкила, необязательно замещенного одним или несколькими А, С2-6алкенила, необязательно замещенного одним или несколькими А, С2-6алкинила, необязательно замещенного одним или несколькими А, фенила, необязательно замещенного одним или несколькими D, фенилС1-6алкила, необязательно замещенного одним или несколькими D; iii) присоединенной атомом азота 4-8-членной гетероциклической группы, которая является насыщенным моноциклическим кольцом, содержащим 4-8 атомов углерода, из которых, по крайней мере, один является атомом азота с необязательно дополнительным гетероатомом, независимо выбранным из О, N и S, где атом серы в кольце может быть необязательно окислен и где, если указанная гетероциклическая группа содержит -NH-группу, азот может быть необязательно замещен группой, выбранной из G; R3 представляет C1-6алкил, необязательно замещенный одним или несколькими А, С3-7циклоалкил, необязательно замещенный одним или несколькими А, фенил, необязательно замещенный одним или несколькими D, присоединенное атомом углерода 6-членное гетероарильное кольцо, содержащее 1-2 атома азота, необязательно замещенное у атома углерода кольца одним или несколькими D; А выбирают из гидрокси, амино, галогено, карбокси, N-(C1-4алкил)амино, N,N-ди(С1-4алкил) амино, карбамоил и C1-6алкокси; D выбирают из: i) –Xa-Rc, где Xa представляет -SO2-, -СО-, -NRdCO-, -NRd или –CONRd-; где Rd независимо представляет водород или С1-4алкил, необязательно замещенный гидрокси; и Rc выбирают из водорода или С1-6алкила, необязательно замещенного одним или несколькими гидрокси или C1-4алкокси; iv) циано или галогено; v) –Xс-Rf, где Xc представляет -С(O)- и Rf представляет присоединенную атомом азота 4-8-членную гетероциклическую группу, которая является насыщенным моноциклическим кольцом, содержащим 4-8 атомов углерода, из которых, по крайней мере, один является атомом азота, с необязательно, дополнительным гетероатомом независимо выбранным из О, необязательно замещенную у атома углерода кольца группой гидрокси, галогена, С1-4алкокси, С1-4алкил или циано; G представляет собой С1-6алканоил; R4 представляет водород или фтор; или его фармацевтически приемлемая соль или его гидролизуемый in vivo сложный эфир. 2. Соединение формулы (I) по п.1, в котором n равняется 2, или его фармацевтически приемлемая соль или его гидролизуемый in vivo сложный эфир. 3. Соединение формулы (I) по п.1 или 2, в котором R1 представляет метил, хлор или фтор, или его фармацевтически приемлемая соль или его гидролизуемый in vivo сложный эфир. 4. Соединение формулы (I) по любому из пп.1-3, в котором R2 представляет хлор, фтор, бром, йод, нитро, амино, метокси, ацетиламино, гидрокси, С1-4алкилсульфанил (необязательно замещенный гидрокси), С1-4алкилсульфинил, С1-4алкилсульфонил, N-(С1-4алкил)-амино (необязательно замещенный гидрокси, метокси, диметиламино или карбамоилом), морфолино, 4-ацетилпиперазин-1-ил, тиоморфолино, 1-оксотиоморфолино, 1,1-диоксотиоморфолино, бензиламино, фенокси, фенилсульфанил (необязательно замещенный N-(С1-4алкил)2карбамоилом), или его фармацевтически приемлемая соль или его гидролизуемый in vivo сложный эфир. 5. Соединение формулы (I) по любому из пп.1-4, в котором R3 представляет метил, этил (необязательно замещенный гидрокси), изопропил, бутил (необязательно замещенный гидрокси), фенил [необязательно замещенный галогеном, N,N-диметилкарбамоилом, N-метил-N-этилкарбамоилом, N-метилкарбамоилом, N-этилкарбамоилом, этиламино (необязательно замещенным гидрокси), мезилом, азетидинилкарбонилом, морфолинокарбонилом или пирролидинил-карбонилом (необязательно замещенным гидрокси)] или присоединенный атомом углерода пиридил (необязательно замещенный амино), или его фармацевтически приемлемая соль, или его гидролизуемый in vivo сложный эфир. 6. Соединение формулы (I) по любому из пп.1-5, в котором R4 представляет водород, или его фармацевтически приемлемая соль или его гидролизуемый in vivo сложный эфир. 7. Соединение формулы (I), выбранное из (R)-N-[2-хлор-3-(1-оксотиоморфолино)-4-(этилсульфонил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамида; (R)-N-[2-хлор-3-(1-оксотиоморфолино)-4-(изопропилсульфонил)-фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамида; (R)-N-[2-хлор-3-(1,1-диоксотиоморфолино)-4-(метилсульфонил)-фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамида; (R)-N-[2-хлор-3-(1,1-диоксотиоморфолино)-4-(этилсульфонил)-фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамида; (R)-N-[2-хлор-3-(1,1-диоксотиоморфолино)-4-(изопропил-сульфонил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамида; (R)-N-[2-хлор-3-(4-ацетилпиперазин-1-ил)-4-(этилсульфонил)-фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамида; (R)-N-{2-хлор-3-[1-(4-ацетил)пиперазинил]-4-(метил-сульфонил)фенил}-2-гидрокси-2-метил-3,3,3-трифторпропанамида; (R)-N-[2-хлор-3-морфолино-4-(метилсульфонил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамида; (R)-N-[2-хлор-3-(4-ацетилпиперазин-1-ил)-4-(изопропил-сульфонил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамида; и (R)-N-[2-хлор-3-морфолино-4-(изопропилсульфонил)фенил]-2-гидрокси-2-метил-3,3,3-трифторпропанамида; или его фармацевтически приемлемая соль или его гидролизуемый in vivo сложный эфир. 8. Соединение формулы (I), представляющее собой (R)-N-(2-xлop-4-этилсульфонил-3-метилсульфанилфенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамид. 9. Соединение формулы (I) по п.1, представляющее собой (R)-N-(4-мезил-3-метилсульфанил-2-хлорфенил)-2-гидрокси-2-метил-3,3,3-трифторпропанамид. 10. Способ получения соединения формулы (I) по п.1 или его фармацевтически приемлемой соли, или его гидролизуемого in vivo сложного эфира, где способ (в котором изменяемые группы являются таковыми, как определено для формулы (I), если не указано иное) включает: (а) снятие защиты с защищенного соединения формулы (II), в которой Рg представляет спиртовую защитную группу (b) окисление соединения формулы (III) (с) сочетание соединений формулы (IV) с кислотой формулы (V) в которой Х представляет ОН; (d) сочетание анилина формулы (IV) с активированным производным кислоты формулы (V); и после этого, если необходимо: i) превращение соединения формулы (I) в другое соединение формулы (I); ii) удаление всех защитных групп; или iii) образование фармацевтически приемлемой соли или гидролизуемого in vivo сложного эфира. 11. Фармацевтическая композиция, повышающая активность ПДГ, которая включает замещенные производные N-фенил-2-гидрокси-2-метил-3,3,3-трифторпропанамида формулы (I) по любому из пп.1-7 или его фармацевтически приемлемую соль или гидролизуемый in vivo сложный эфир в сочетании с фармацевтически приемлемым разбавителем или носителем. 12. Соединение формулы (I) по любому из пп.1-7 или его фармацевтически приемлемая соль или его гидролизуемый in vivo сложный эфир для применения в методе терапевтического лечения организма человека или животного. 13. Соединение формулы (I) по любому из пп.1-7 или его фармацевтически приемлемая соль или его гидролизуемый in vivo сложный эфир, пригодное при изготовлении лекарства для применения при лечении сахарного диабета, заболевания периферических сосудов и ишемической болезни миокарда у теплокровных животных, таких как человеческие существа. 14. Соединение формулы (I) по любому из пп.1-7 или его фармацевтически приемлемая соль или его гидролизуемый in vivo сложный эфир, пригодное в качестве лекарства для лечения сахарного диабета, заболевания периферических сосудов (включая перемежающуюся хромоту), сердечной недостаточности и определенной сердечной миопатии, миокардиальной ишемии, церебральной ишемии, реперфузии, мышечной слабости, гиперлипидемии, болезни Альцгеймера и/или атеросклероза. Приоритеты по пунктам: пп.1-7, 10-14 от 30 августа 2000 г.; п.8 GB №9920814.2, от 4 сентября 1999 г.; п.9 GB №000641.5, от 21 марта 2000 г.
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 31.08.2009
Извещение опубликовано: 27.07.2010 БИ: 21/2010
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

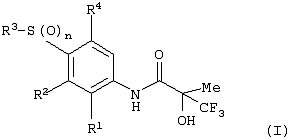
 -окислением жирных кислот или в результате метаболизма глюкозы по гликолитическому пути. Ключевым регуляторным ферментом, регулирующим скорость образования ацетил СоА из глюкозы, является ПДГ, которая катализирует окисление пирувата в ацетил СоА и двуокись углерода с сопутствующим восстановлением никотинамид-аденин-динуклеотида (NAD) в NADH.
-окислением жирных кислот или в результате метаболизма глюкозы по гликолитическому пути. Ключевым регуляторным ферментом, регулирующим скорость образования ацетил СоА из глюкозы, является ПДГ, которая катализирует окисление пирувата в ацетил СоА и двуокись углерода с сопутствующим восстановлением никотинамид-аденин-динуклеотида (NAD) в NADH.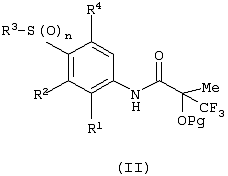
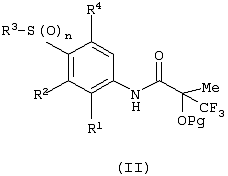
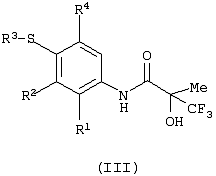
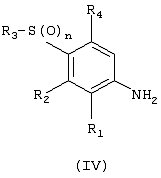
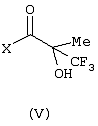
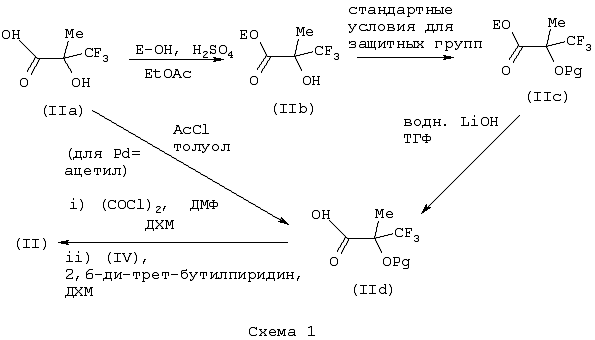
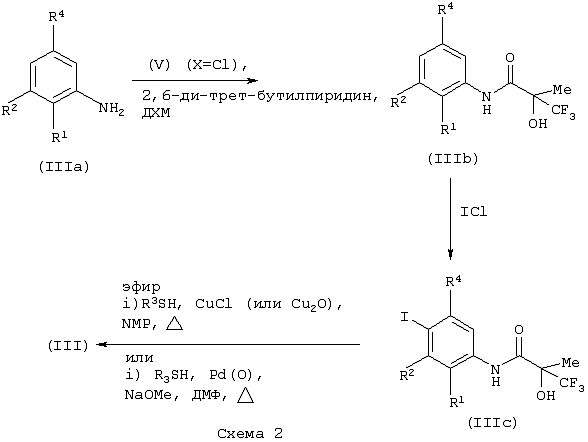
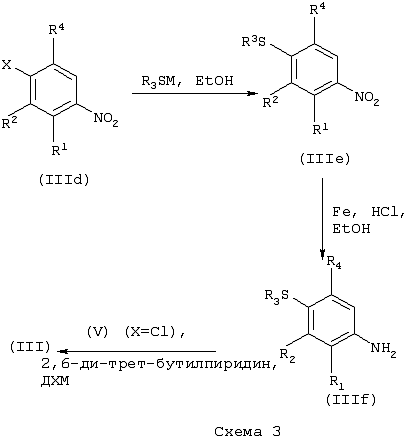
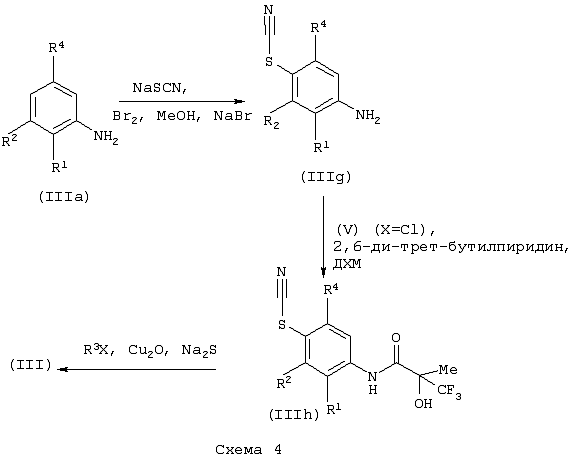
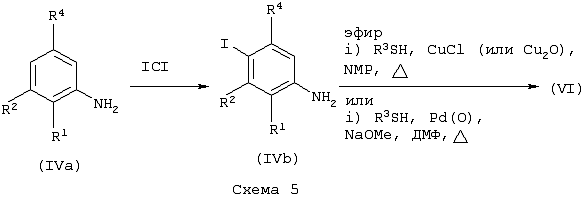
 -кетоглутарат и
-кетоглутарат и  , 60А, размер частиц 32-63 мкм, поставляемый Biotage, отделением Dyax Corp., 1500 Avon Street Extended, Charlottesville, VA 22902, USA;
, 60А, размер частиц 32-63 мкм, поставляемый Biotage, отделением Dyax Corp., 1500 Avon Street Extended, Charlottesville, VA 22902, USA; 6), если не указано иное; другие растворители (когда они указаны в тексте) включают дейтерированный хлороформ – CDCl3; константы сочетания (J) приведены в Гц; Аr, когда указывается такой символ, означает ароматический протон;
6), если не указано иное; другие растворители (когда они указаны в тексте) включают дейтерированный хлороформ – CDCl3; константы сочетания (J) приведены в Гц; Аr, когда указывается такой символ, означает ароматический протон;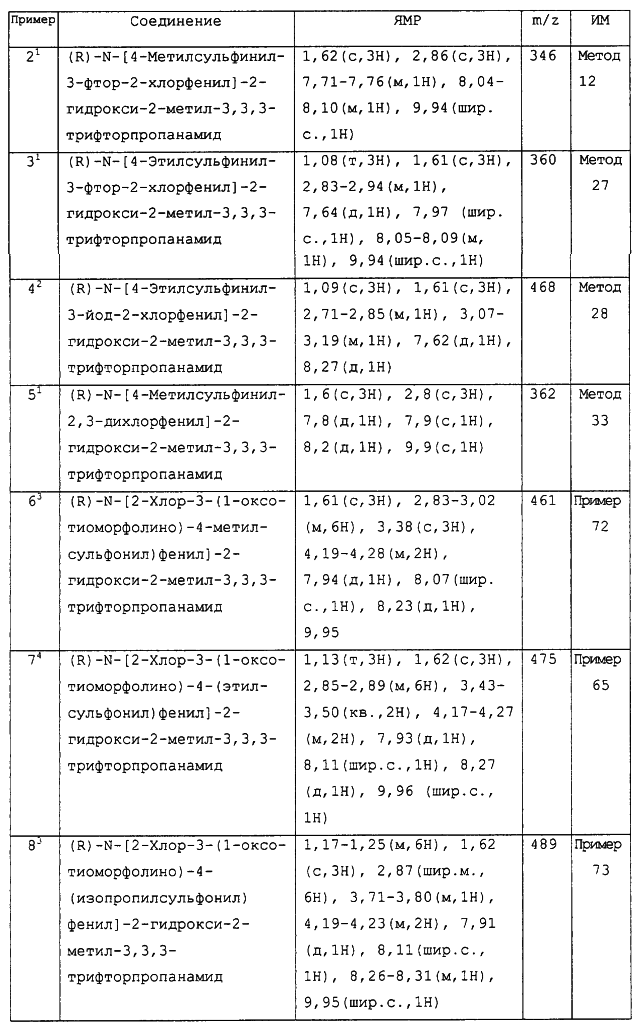

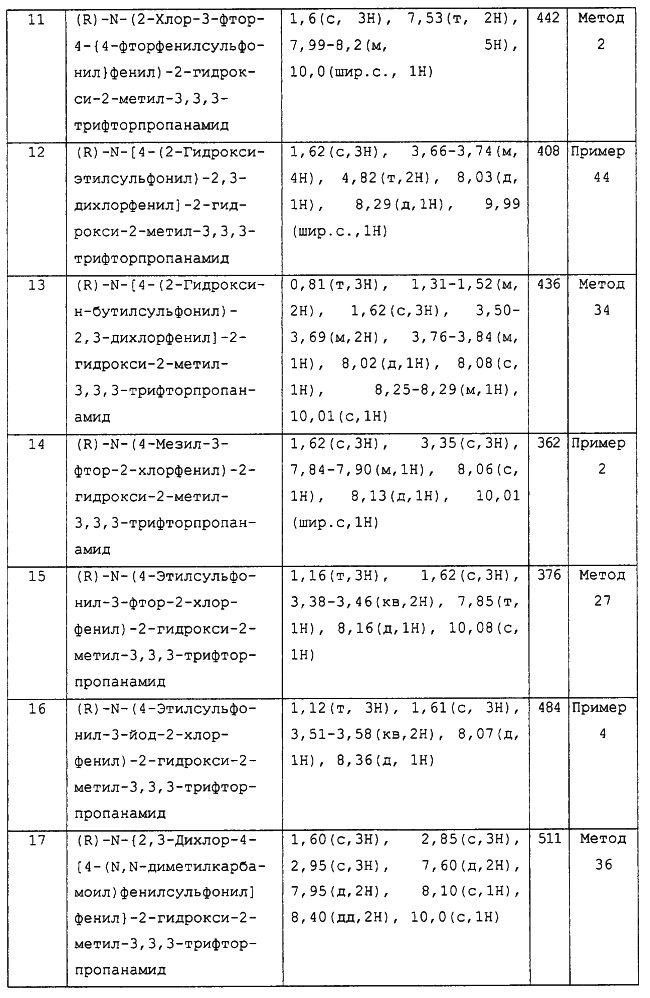
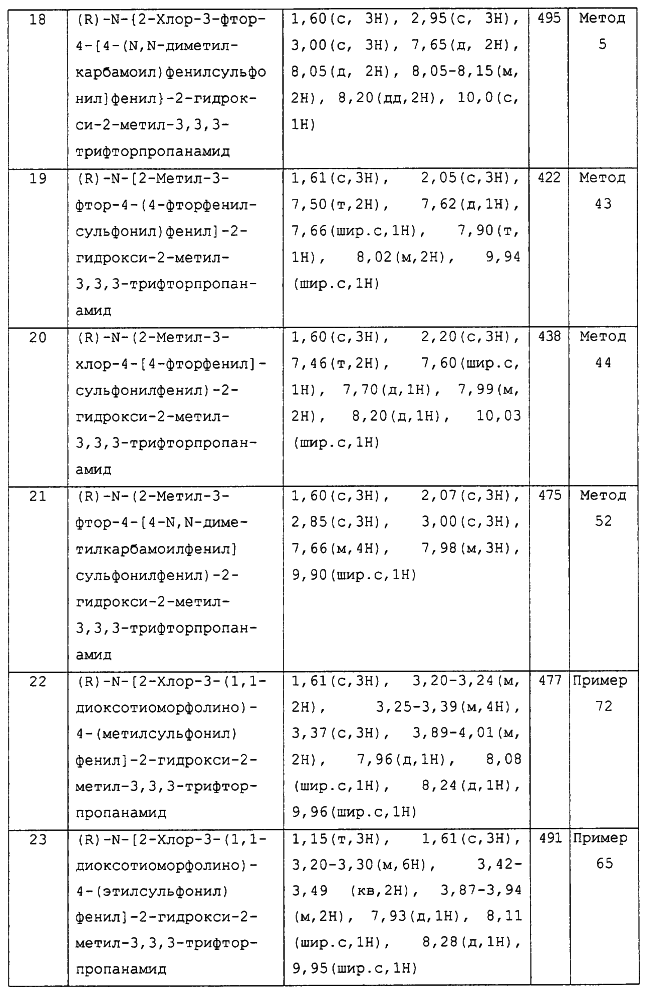

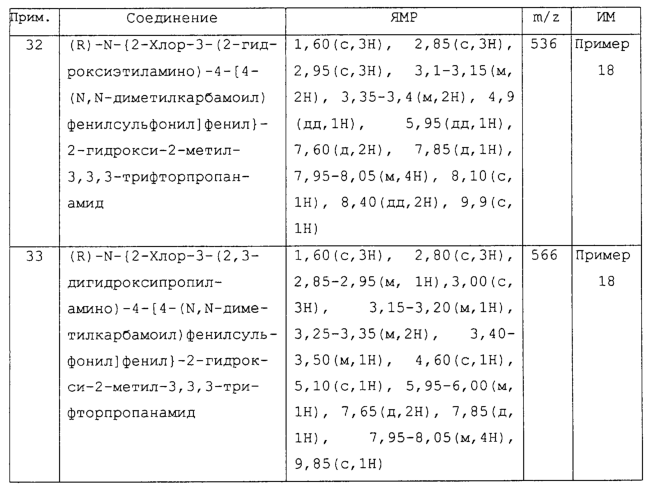
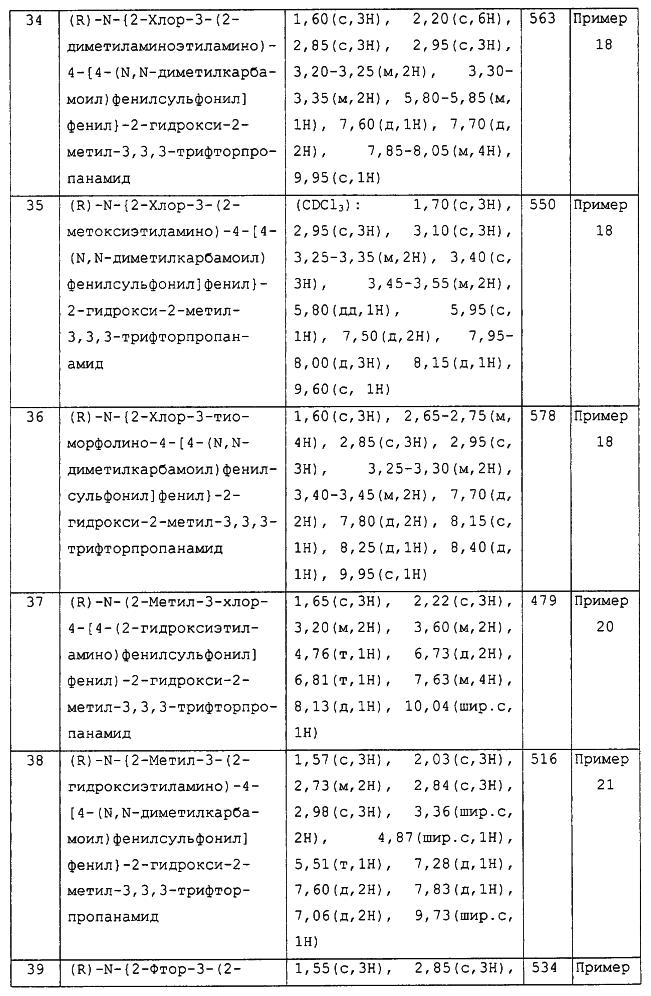

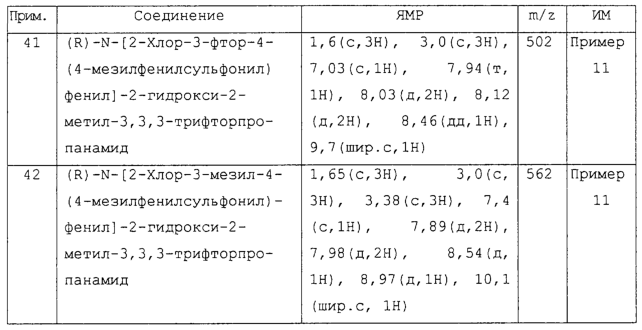
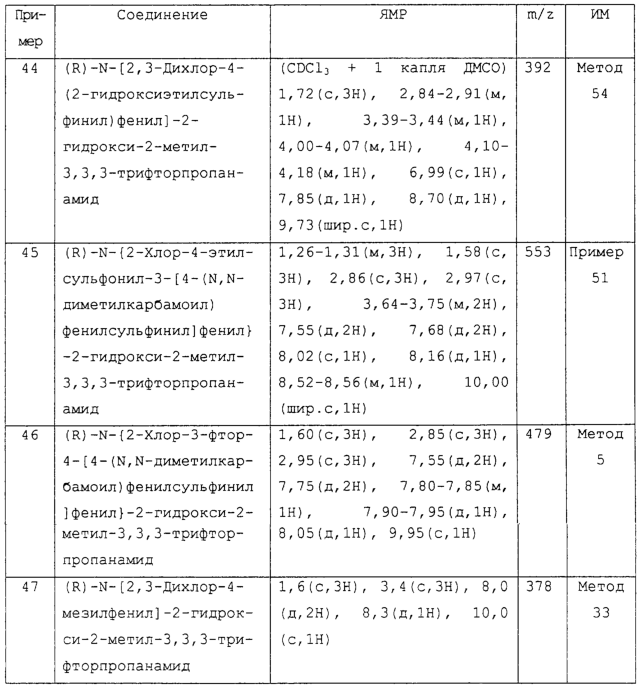
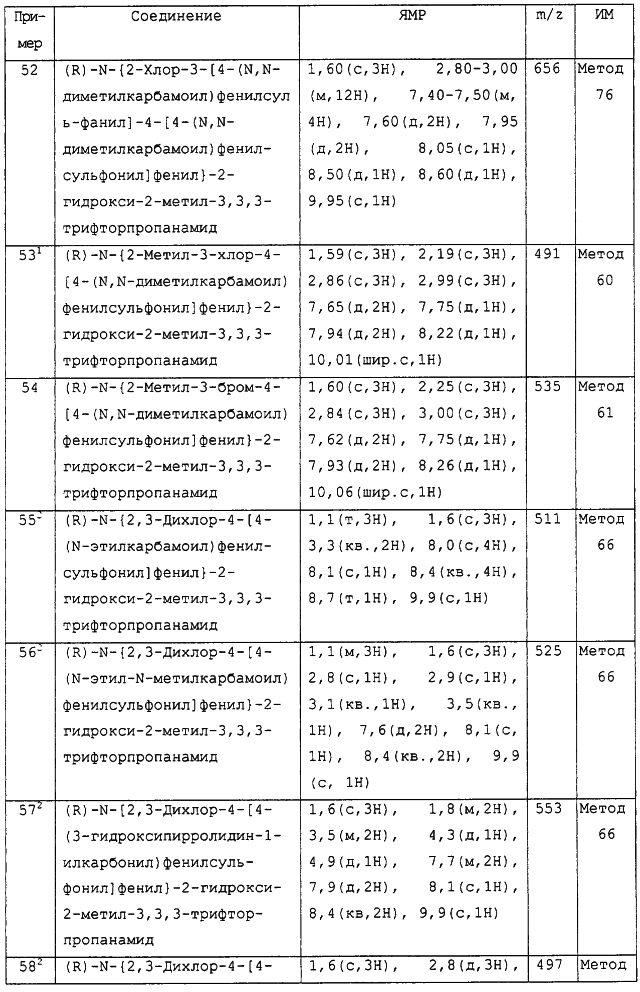
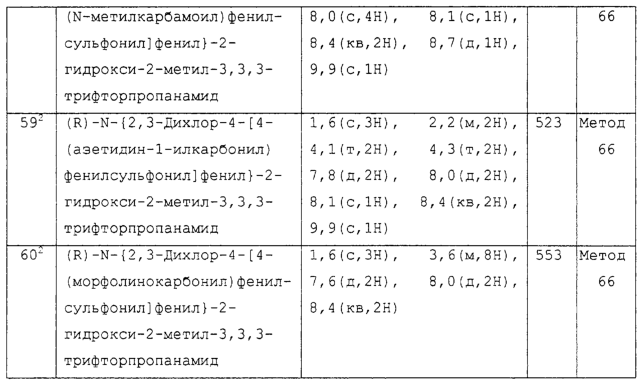


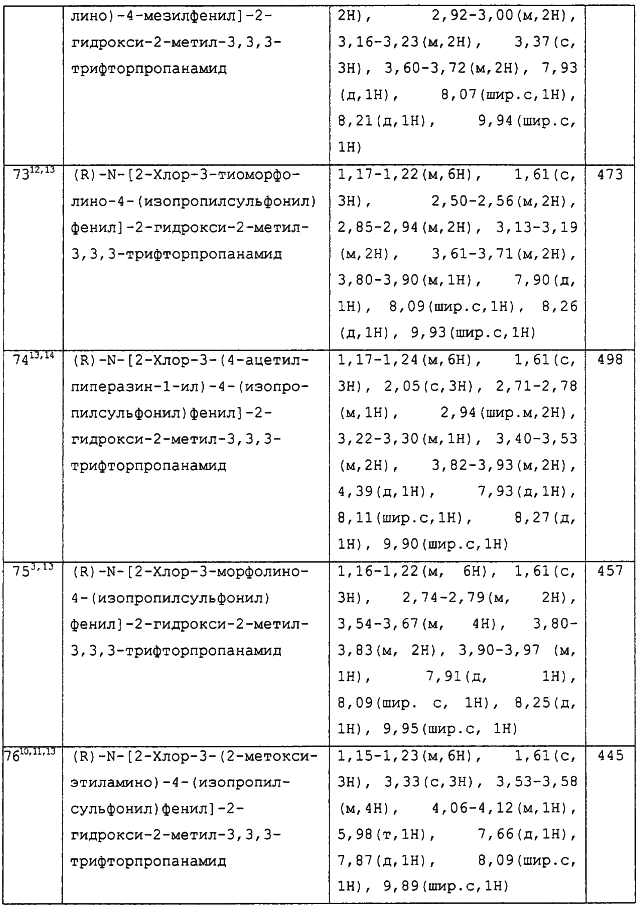
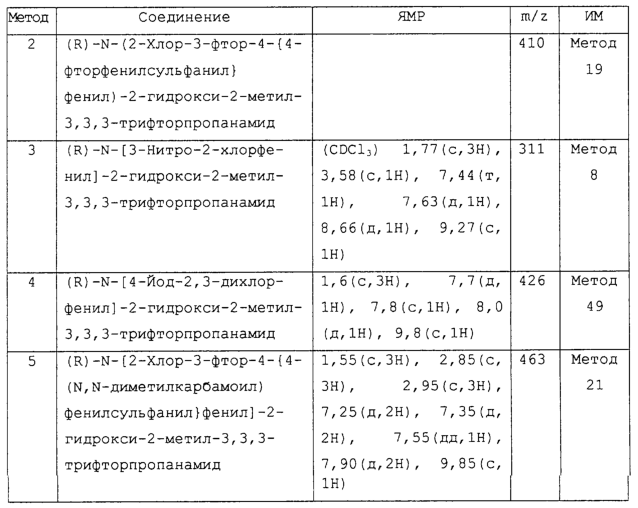
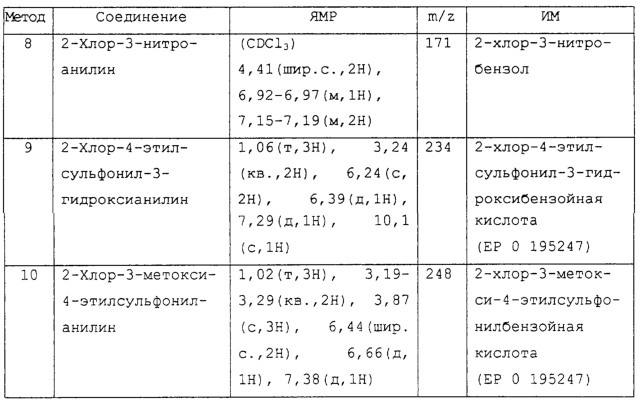
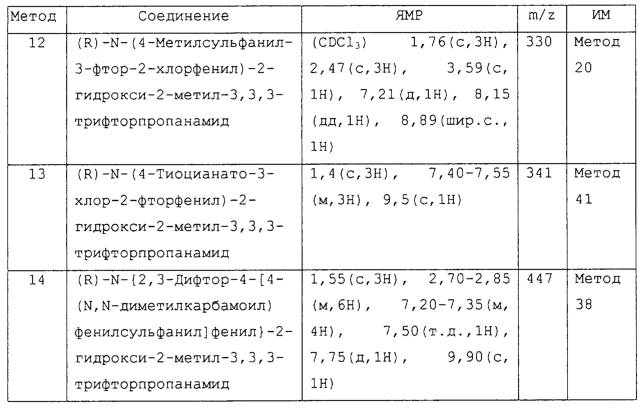
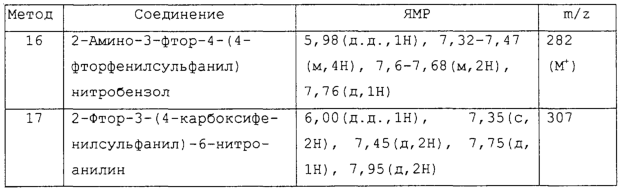
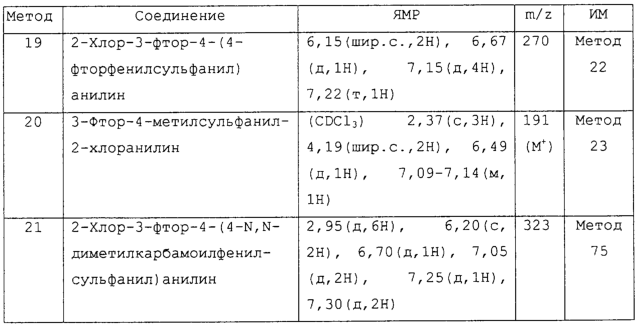



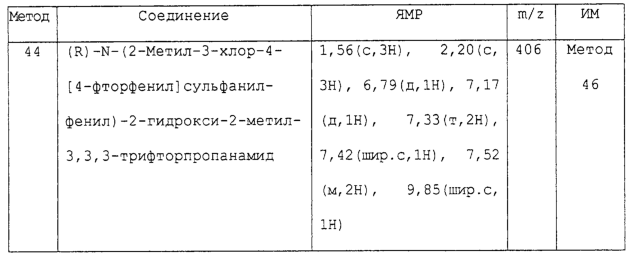
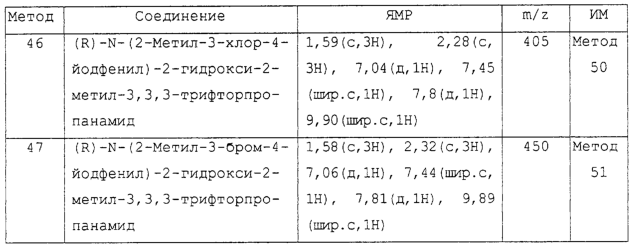
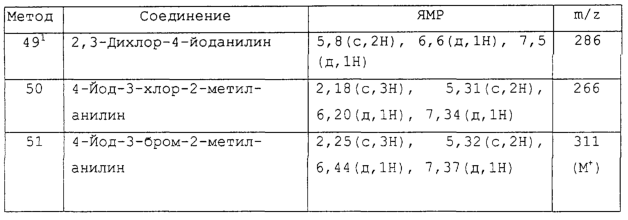
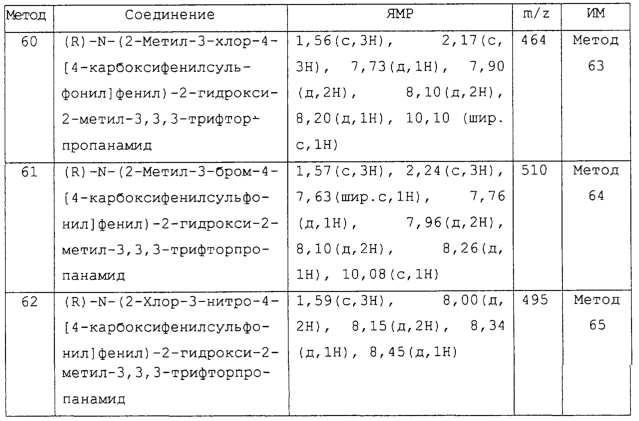

 М)
М)