|
|
(21), (22) Заявка: 2003114554/04, 15.05.2003
(24) Дата начала отсчета срока действия патента:
15.05.2003
(43) Дата публикации заявки: 10.01.2005
(45) Опубликовано: 27.06.2005
(56) Список документов, цитированных в отчете о
поиске:
RU 2058321 С1, 20.04.1996. US 4730064, А, 08.03.1988. RU 2191190, С1, 20.10.2002. R.B.LANSEWAR et al Quadrupole hyperfine in iron (III) dicarboxylic acid complexes J.of Radioanalytical and nuclear chemistry, 1988, 125(1), p75-84.
Адрес для переписки:
350040, г.Краснодар, ул. Ставропольская, 149, КубГУ, отдел интеллектуальной собственности
|
(72) Автор(ы):
Шабанова И.В. (RU),
Фролов В.Ю. (RU),
Панюшкин В.Т. (RU),
Зеленов В.И. (RU),
Стороженко Т.П. (RU)
(73) Патентообладатель(и):
Государственное образовательное учреждение Кубанский государственный университет (КубГУ) (RU)
|
(54) ГЕТЕРОМЕТАЛЛИЧЕСКИЙ МАЛАТ НЕОДИМА (III) И ЖЕЛЕЗА (III) И СПОСОБ ЕГО ПОЛУЧЕНИЯ
(57) Реферат:
Изобретение относится к координационной химии, точнее к получению гетерометаллического малата неодима(III) и железа(III) формулы 1, используемого для получения смешанных оксидов со структурой перовскита, нашедших широкое применение как катализаторы в окислительном катализе ненасыщенных ациклических углеводородов и как материалы в технике сверхвысоких частот и запоминающих устройствах ЭВМ. Описан способ получения малата железа(III) и неодима(III) путем электролиза концентрированного водного раствора хлорида неодима(III) и яблочной кислоты, взятых в соотношении 1:3, в присутствии пиридина, с анодом, спрессованным из восстановленного железа, и инертным катодом при анодной плотности тока 1 А/см2, с последующим выделением осадка, его промывкой органическим растворителем и сушкой. 2 н.п. ф-лы, 2 табл., 1 ил.
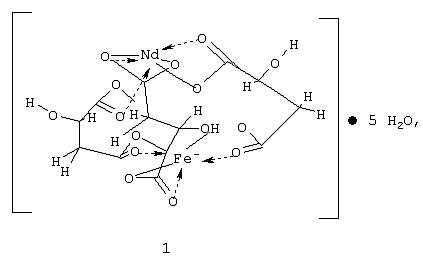
Изобретение относится к координационной химии, точнее к получению гетерометаллического малата неодима(III) и железа(III) формулы 1
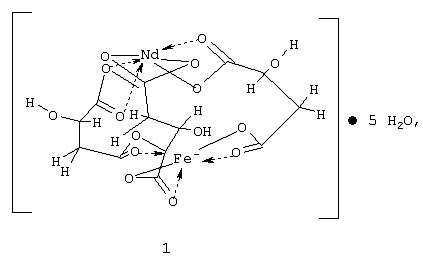
используемого для получения смешанных оксидов со структурой перовскита, нашедших широкое применение как катализаторы в окислительном катализе ненасыщенных ациклических углеводородов и как материалы в технике сверхвысоких частот и запоминающих устройствах ЭВМ.
3· M(NO3)2· nH2O, где Ln – ион лантаноида (III), М – Co(II), Ni(II), L – ион салицилиденсемикарбазида, полученные добавлением к суспензии, содержащей 10 ммоль салицилиденсемикарбазидата редкоземельного элемента в 50 мл очищенного хлороформа, при постоянном перемешивании на магнитной мешалке 10 ммоль нитрата кобальта(II) или нитрата никеля(II), растворенного в минимальном количестве метанола, с последующим нагреванием при 50-55° С с обратным холодильником в течение 1.5-2.0 ч, охлаждением, фильтрованием, промыванием хлороформом, высушиванием в вакууме над силикагелем. Выделенные соединения используются для получения смешанных оксидов со структурой перовскита, однако, из-за высокой себестоимости исходного органического реагента получение заданного продукта экономически невыгодно.
Известен основный гетероядерный ацетат Fe(III) и Mg(II) состава [Fе2МgО(СН3СОО)6(Н2O)3]· 2Н2
Наиболее близким аналогом к заявляемому соединению являются мостиковые гексаядерные комплексы Ln(III)-Cr(III) общей формулы [Ln2( -Ох){Сr(Diру)( -Ох){Сr(Diру)( -Ох)(Ох)}4(Н2O)6]· 13Н2O, где Ох-оксалат-дианион, Ln=Pr,Gd, полученные путем взаимодействия комплексных частиц [Cr(Dipy)(Ox)2]– -Ох)(Ох)}4(Н2O)6]· 13Н2O, где Ох-оксалат-дианион, Ln=Pr,Gd, полученные путем взаимодействия комплексных частиц [Cr(Dipy)(Ox)2]–
Вышеописанные соединения используются для получения смешанных оксидов со структурой шпинели, которые в отличие от смешанных оксидов со структурой перовскита не нашли широкого применения в оптоэлектронике.
Известен способ получения гетерометаллических комплексных соединений с органическими лигандами, описанный в работе [Гарновский А.Д., Васильченко И.С., Гарновский Д.А. Современные аспекты синтеза металоокомплексов. Основные лиганды и методы. Ростов-на-Дону, ЛаПО, 2000], который включает в себя реакции ионного обмена между исходными реагентами. Недостатком является невозможность получения гетерометаллического малата железа(III) и неодима(III) с яблочной кислотой вышеописанным способом.
3, где Ln – ион лантаноида, а АА – ацетилацетон, получали электролизом ацетилацетона и хлорида лития в ацетонитриле, взятых в отношении (1:1:500) с металлическим редкоземельным анодом и инертным катодом при потенциале анода в пределах 0,5-1 В, с использованием единичного полупроводникового диода, включенного последовательно с электролизером для создания асимметричного переменного тока. Образовавшийся в результате электролиза осадок отделяют, промывают абсолютным спиртом и сушат.
К недостаткам прототипа можно отнести невозможность получения в описанных условиях гетерометаллического малата железа(III) и неодима(III), а кроме того использование дорогого растворителя ацетонитрила.
Ни одним из предложенных способов заявляемое соединение формулы 1 не было получено.
Технической задачей изобретения является получение малата железа(III) и неодима(III), при пиролизе которого образуются смешанные оксиды со структурой перовскита, простым, одностадийным способом.
Для решения технической задачи предлагается путем электролиза концентрированного водного раствора хлорида неодима(III) и яблочной кислоты, взятых в соотношении 1:3 в присутствии пиридина с анодом, спрессованным из восстановленного железа, и инертным катодом при анодной плотности тока 1 А/см2, с последующим выделением осадка, его промывкой органическим растворителем и сушкой получать малат железа(III) и неодима(III) общей формулы 1 NdFe(C4H4O5)3· 5H2O.
Предлагаемый способ получения отличается от наиболее близкого аналога тем, что позволяет выделить соединение, описанное формулой 1, электролизом раствора хлорида неодима(III) и яблочной кислоты в соотношении 1:3 в воде вместо ацетонитрила, в присутствии пиридина, с анодом, спрессованным из восстановленного железа марки “х.ч” вместо анода из редкоземельного металла, полученный твердый продукт отделяют, промывают этиловым спиртом с диэтиловым эфиром вместо абсолютного спирта.
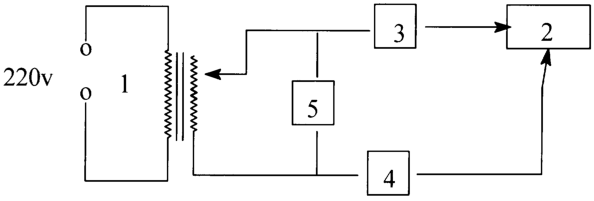
На чертеже изображена схема, использованная для осуществления заявляемого способа.
Электросинтез гетерометаллического малата неодима(III) и железа(III) проводят следующим образом:
составляют электрическую цепь (изображенную на чертеже), содержащую в качестве источника тока регулируемый понижающий трансформатор 1 на 220 В, электролизер 2, включенный последовательно выпрямительный диод 3 серии кд 226, амперметр 4 на 100 мA, вольтметр 5 на 100 В.
Электролизер 2, составленный из стеклянного сосуда (термостатируемый химический стакан (298 К), в который помещены два электрода – один спрессованный из восстановленного железа, другой из платины или графита (не изображено), заполняют электролитом, состоящим из водного раствора хлорида неодима(III) и яблочной кислоты, взятых в соотношении 1:3, в присутствии пиридина.
Трансформатор 1 устанавливают в положение минимального выходного напряжения, включают в цепь переменного тока на 220 В 50 Гц и регулируют таким образом, чтобы вольтметр 5 показал напряжение между электродами 1-20 В, проходящий через электролизер 2 ток при этом должен соответствовать анодной плотности тока 1 А/см2, рассчитанной по показаниям амперметра 4. Использование диода 3 позволяет упростить процедуру получения асимметричного тока, что приводит к уменьшению адгезии получаемого соединения к аноду. Полученный в результате электролиза продукт отделяют, промывают спиртом с диэтиловым эфиром и сушат.
Пример конкретного выполнения
Электролизер 2, снабженный двумя электродами – один спрессованный из восстановленного железа марки “х.ч”, другой из гладкой платины, заполняли электролитом, состоящим из водного раствора хлорида неодима(III) 0.3 М и яблочной кислоты 0.9 М в присутствии пиридина, подключали через диод 3 к трансформатору 1, устанавливали напряжение на вольтметре 5 так, чтобы плотность анодного тока, регулируемого по показаниям амперметра 4, была 1 А/см2, которую отделяли, образовавшийся после электролиза осадок промывали этиловым спиртом с диэтиловым эфиром и сушили на воздухе до постоянной массы.
Содержание металлов в полученном соединении определяли комплексонометрически: совместным титрованием железа(III) и неодима(III) ЭДТА с индикатором ксиленоловым оранжевым в уротропиновом буфере, в присутствии аскорбиновой кислоты; и титрованием железа(III) ЭДТА с сульфосалициловой кислотой рН=2-3 при 70° С; содержание неодима(III) находили по разности. Для определения содержания малат-ионов использовали реакцию ионного обмена между соединением и катионитом КУ-2-8 с последующим титрованием яблочной кислоты щелочью с фенолфталеином. Соотношение компонентов в соединении составило Fe:Nd: (С4Н4O5)=1:1:3. Кроме того, в комлексном соединении содержатся 5 молекул воды. Индивидуальность полученного соединения подтверждали ИК-спектроскопическим (см. табл. 1) и термическим методом анализа (см. табл.2).
Формула соединения: NdFe(C4H4O5)3· 5H2O
ИК-спектроскопический метод анализа. Образец для записи ИК-спектров приготовлен путем прессования исследуемых веществ с КВr (10 мг вещества на 200 мг общей массы таблетки)
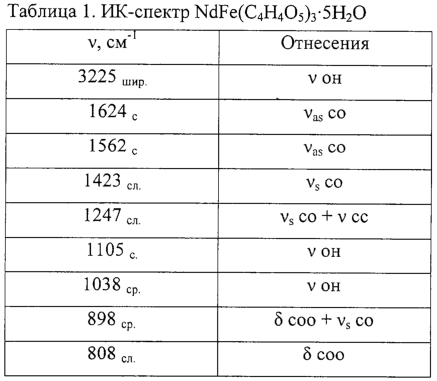
Из данных табл.1 следует, что полосы поглощения в области 1700-1750 см-1 отсутствуют, а в области 1630-1500 см-1 появляются, что свидетельствует об образовании средней соли.
Термический метод анализа. Скорость нагрева 10 град/мин, температурный интервал 20-1000° С.
| Таблица 2 |
| Данные термического анализа NdFe(C4H4O5)3· 5H2O |
 Т, ° С Т, ° С |
Тs ° С |
 m, % m, % |
 Н Н |
| 65-230 |
|
13.8 |
|
| 230-255 |
245 |
5.3 |
>0 |
| 255-325 |
|
6.4 |
|
| 325-385 |
340 |
20.2 |
>0 |
| 385-450 |
420 |
5.3 |
>0 |
| 450-600 |
560 |
12.73 |
>0 |
| 65-1000 |
|
63.78 |
|
Термический анализ показал, что в области 65-230° С NdFe(C4H4O5)3· 5H2O теряет кристаллизационную воду, а при температуре около 300° С переходит в смешанный карбонат, который при температуре выше 325° С начинает разлагаться и при 600° С переходит в оксид.
Предложен одностадийный, простой электрохимический метод синтеза гетерометаллического малата железа(III) и неодима(III). Предлагаемый способ отличается возможностью получения высокочистого целевого продукта формулы 1 в одну стадию с использованием более доступных и дешевых реагентов: пиридина вместо дипиридина, воды вместо ацетонитрила, хлорида неодима(III) вместо металлического неодима, безопасностью, что способствует дальнейшему использованию способа для получения искомого продукта в промышленности.
Формула изобретения
1. Гетерометаллический малат неодима (III) и железа (III) формулы 1
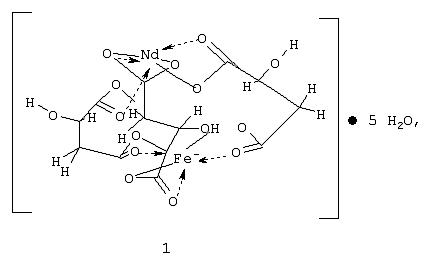
применяемый для получения смешанного оксида со структурой перовскита.
2. Способ получения соединения описанного формулой 1, включающий электролиз раствора исходных компонентов, взятых в определенных соотношениях, с инертным катодом, при анодной плотности тока 1 А/см2, выделение осадка, промывку и сушку, отличающийся тем, что в качестве исходных компонентов взяты концентрированные водные растворы хлорида неодима (III) и яблочной кислоты в соотношении 1:3 в присутствии пиридина с анодом, спрессованным из восстановленного железа, промывку осуществляли спиртом с диэтиловым эфиром.
РИСУНКИ
|
|