Патент на изобретение №2254862
|
||||||||||||||||||||||||||
(54) ТВЕРДАЯ ЛЕКАРСТВЕННАЯ ФОРМА ХОНДРОИТИНА СУЛЬФАТА
(57) Реферат:
Изобретение относится к области фармацевтики и касается твердой лекарственной формы хондроитина сульфата. Изобретение заключается в том, что лекарственная форма содержит действующего вещества в количестве 250 мг на одну, включает хондроитин сульфат, наполнитель, связующее, антифрикционные вещества и дополнительно может содержать солюбилизатор. Фармацевтическая композиция выполнена в виде таблетки. Изобретение обеспечивает создание препарата для перорального ведения с меньшим количеством действующего вещества с характеристиками, удовлетворяющими требованиям Государственной Фармакопеи. 7 з.п. ф-лы, 17 табл.
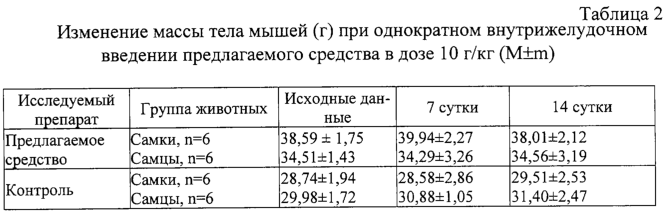
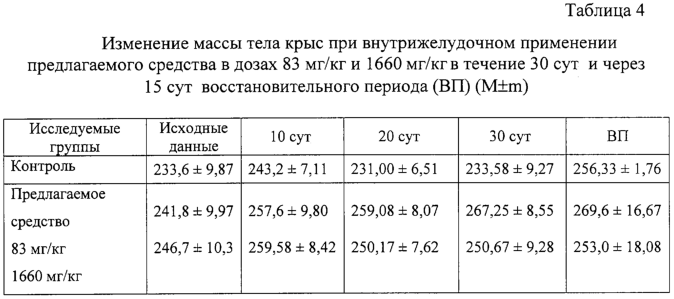
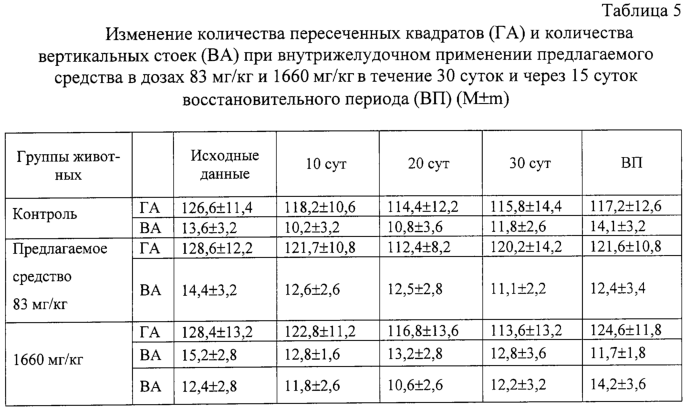
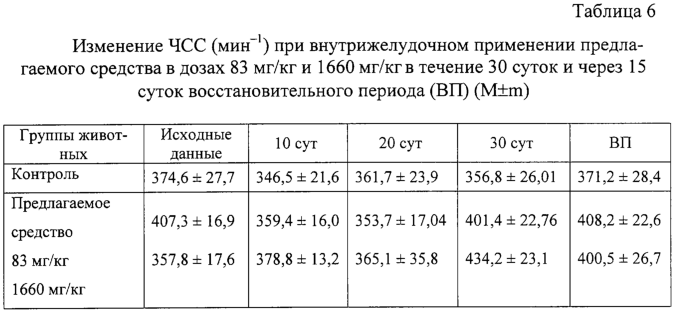
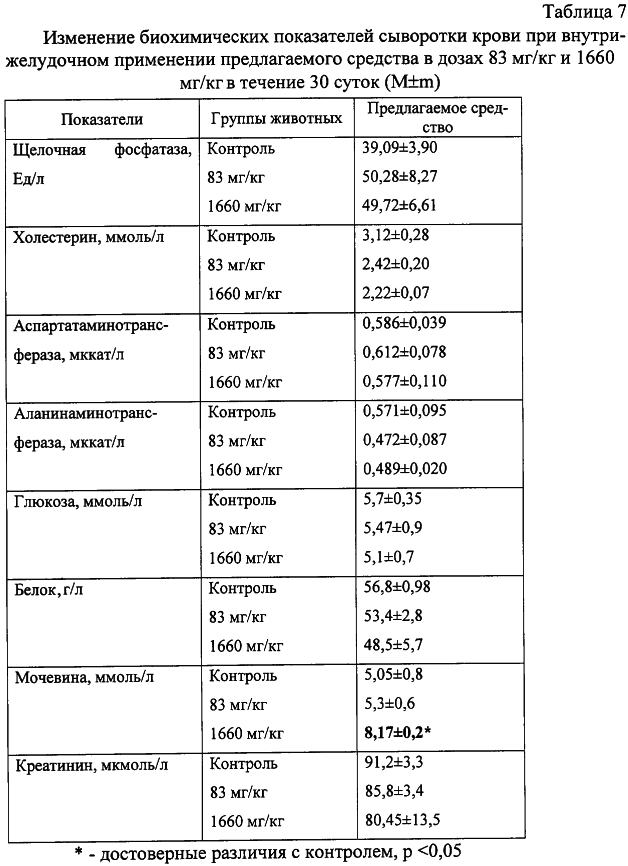
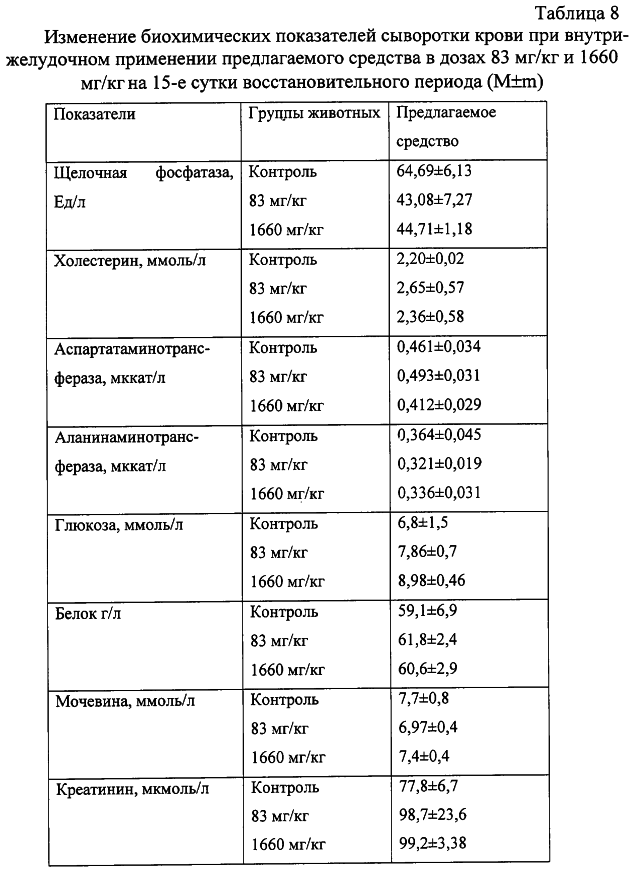
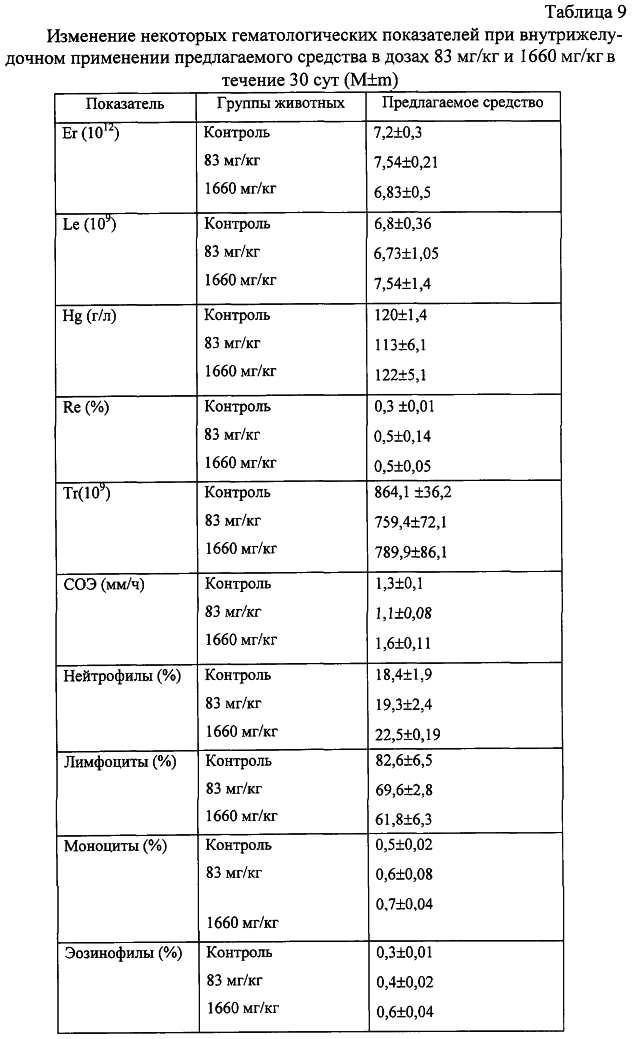
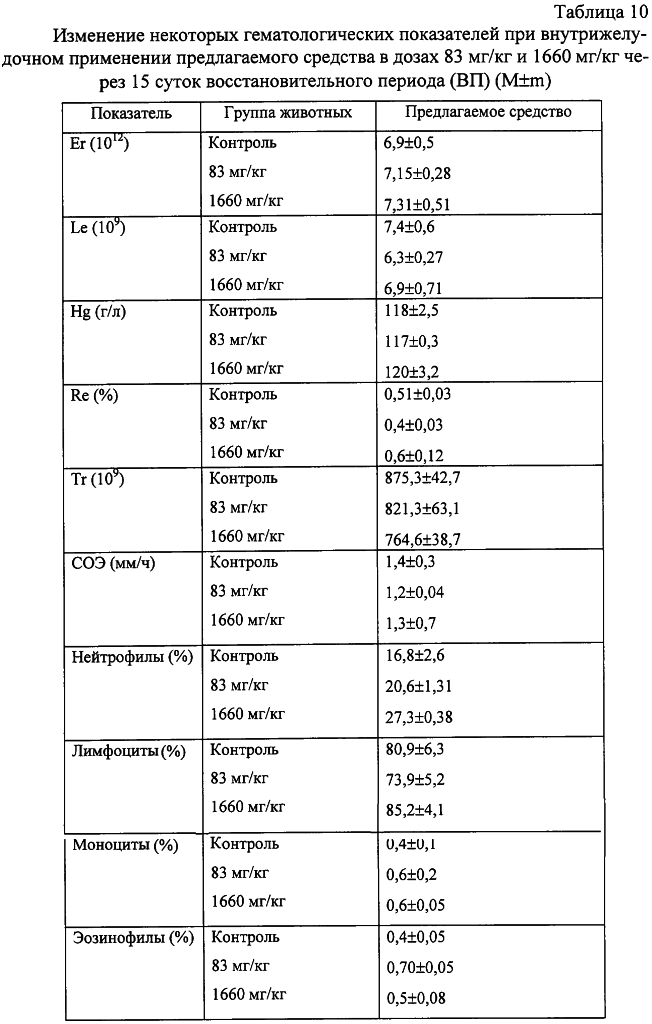
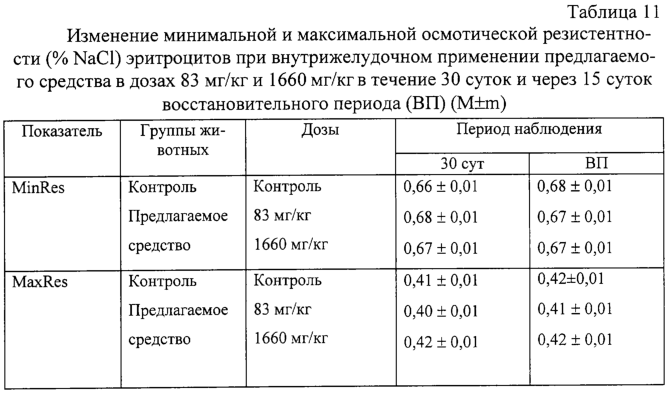
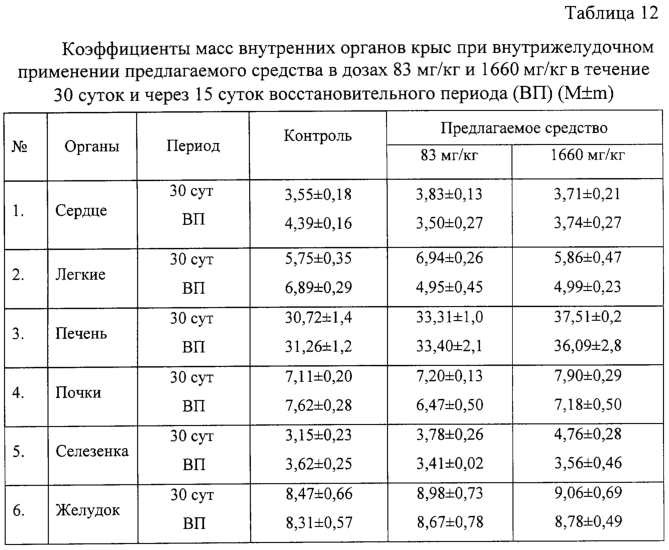
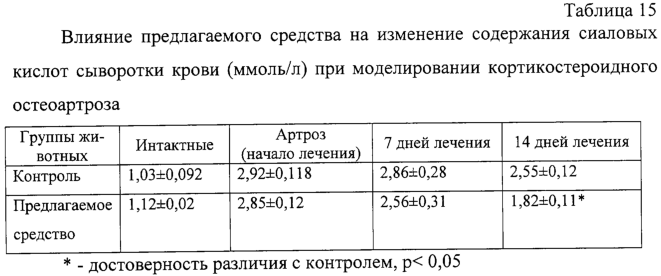
Изобретение относится к области медицины и касается создания лекарственного средства в виде таблетки на основе хондроитина сульфата, применяемого для лечения дегенеративных заболеваний суставов и позвоночника. По данным Всемирной организации здравоохранения более 50% населения старше 50 лет страдает патологией суставов и позвоночника. Основные изменения обменных процессов при дегенеративных заболеваниях суставов связаны с нарушением метаболизма хряща и его обеднением основным полисахаридом животной ткани – хондроитин сульфатом. Вследствие этого хрящ утрачивает свои механические свойства: эластичность, прочность, резистентность, сокращается в объеме и деградирует. В связи с этим важной является проблема поиска новых надежных и в тоже время безопасных средств хондропротективного действия. Известна мазь для лечения суставов “Хондроксид” [1]. Средство является “наружным”. Следует отметить, что с учетом комплаентности к лечению более предпочтительными являются препараты, принимаемые энтерально. Известна лекарственная форма в виде таблетки, покрытой оболочкой [2] “Картилаг Витрум”, содержащая хондроитина сульфат в количестве 750 мг, состав вспомогательных веществ в данном источнике не раскрыт. Данная лекарственная форма выбрана авторами в качестве прототипа. Иных сведений о таблетках на основе хондроитина сульфата в доступных источниках не обнаружено. Известная лекарственная форма является таблеткой большого объема, так как содержит большое количество активного вещества, вследствие чего вызывает трудности для проглатывания. Задачей предлагаемого изобретения является создание препарата для перорального введения в виде таблетки с меньшим количеством действующего вещества хондроитина сульфат, меньшего объема комфортного для приема внутрь, с характеристиками, удовлетворяющими требованиям Государственной Фармакопеи, который необходим для пополнения реестра лекарственных средств. Техническим результатом, достигаемым при реализации настоящего изобретения, является получение твердой лекарственной формы, а именно таблетки на основе хондроитина сульфата, удобной для перорального применения, в которой содержание действующего вещества снижено до 250 мг преимущественно, и обеспечивающее хондростимулирующее, регенерирующее, противовоспалительное действие. При этом композиция соответствует требованиям Государственной Фармакопеи XI издания и расширяет арсенал лекарственных препаратов, пригодных для применения в медицинской практике. Указанный технический результат достигается созданием твердой лекарственной формы, содержащей хондроитина сульфат в качестве действующего вещества, согласно изобретению она дополнительно содержит антифрикционные вещества, связующее и наполнитель при следующем содержании ингредиентов, мас.%: Хондроитина сульфат 49,58-55,83 Связующее 1,0-3,5 Антифрикционные вещества 0,5-1,0 Наполнитель До 100 Предпочтительно в качестве связующего форма содержит поливинилпирролидон низкомолекулярный, или коллидон, или пласдон, или пазели. Предпочтительно в качестве антифрикционных веществ форма содержит аэросил, или тальк, или кальция стеарат, или магния стеарат, или смесь магния/кальция стеарата и аэросила, или смесь магния/кальция стеарата и талька, или смесь магния/кальция стеарата, талька и аэросила. Предпочтительно в качестве наполнителя форма содержит магния карбонат основной, или микрокристаллическую целлюлозу, или смесь магния карбоната и микрокристаллической целлюлозы, или примогран. Предпочтительно, что твердая лекарственная форма дополнительно может содержать солюбилизатор в количестве не более 6,0 мас.%. Предпочтительно в качестве солюбилизатора она содержит полипласдон, или кросповидон, или примогель, или примелозу. Предпочтительно, что твердая лекарственная форма выполнена в виде таблетки. Предпочтительно, что твердая лекарственная форма может быть покрыта оболочкой. Предлагаемое соотношение ингредиентов найдено экспериментальным путем и является оптимальным. Связующие – это вспомогательные вещества, которые способствуют образованию гранул из компонентов таблетной массы, обеспечивая тем самым прессуемость массы и прочность таблетки [3, стр.343]. В предлагаемой композиции используется поливинилпирролидон низкомолекулярный, например по ФС 42-1194-98, или Коллидон (НД 42-8482-98), или пласдон К-25 (НД 42-10112-99), или пласдон К 29/32 (НД 42-10109-99), или пазели (USP). Антифрикционные вещества, в свою очередь, делятся на скользящие и смазывающие, закрепляясь на поверхности гранул (частиц), устраняют их шероховатость и тем самым повышают текучесть таблеточной массы, что обеспечивает равномерное наполнение матриц таблеточного пресса и приводит к получению однородных по массе таблеток. Кроме того, снижают трение на контактных (масса и пресс) участках, значительно облегчают деформацию частиц вследствие адсорбционного понижения их прочности [3, стр.344]. В предлагаемом составе данный компонент может быть представлен следующими вариантами: – аэросил (ГОСТ 14922-77); – тальк (ФС 42-006601); – кальция стеарат (ТУ 6-09-4233-76); – магния стеарат (ТУ 6-09-129-75); – смесь магния/кальция стеарата и аэросила (ГОСТ 14922-77); – смесь магния/кальция стеарата и талька; – смесь магния/кальция стеарата, талька и аэросила. Солюбилизаторы – вещества, способствующие растворению действующего компонента [3, стр.345], в предлагаемом составе могут быть представлены следующими вариантами: – полипласдон XL-10 (НД 42-10113-99); – кросповидон (НД 42-8871-98); – примогель (ЕР, USP); – примелоза (ЕР, USP). Наполнитель придает массе требуемые качества, позволяет иметь постоянную массу таблетки [4], в предлагаемой фармкомпозиции может быть представлен следующими вариантами: – магния карбонат основной (ГОСТ 6419-78); – микрокристаллическая целлюлоза (ФС 42-3728-99); – смесь магния карбоната и микрокристаллической целлюлозы; – примогран (USP, ЕР) При покрытии оболочкой используют готовую смесь “Opadry” фирмы “Colorcon” (США), или пленкообразователи Колликут фирмы “BASF” (Германия), или Ойдрагит фирмы “Рем-фарма” (Германия), а также покрытия на основе целлюлозных производных, обеспечивающих растворение действующего вещества в желудке. Заявляемая композиция обеспечивает указанное фармакологическое действие, соответствует требованиям Государственной фармакопеи XI изд., стабильна при хранении и имеет срок годности не менее двух лет. Предлагаемый состав может быть проиллюстрирован следующими примерами. Пример 1. мас.% Хондроитина сульфат 49,58 Поливинилпирролидон низкомолекулярный 1,0 Полипласдон 6,0 Кальция стеарат 1,0 Магния карбонат основной До 100 Пример 2. Состав по примеру 2 аналогичен составу из примера 1, только в качестве связующего используется коллидон. Пример 3. Состав по примеру 3 аналогичен составу из примера 1, только в качестве связующего используется пласдон. Пример 4. Состав по примеру 4 аналогичен составу из примера 1, только в качестве связующего используется пазели. Пример 5. Состав по примеру 5 аналогичен составу из примера 1, только в качестве антифрикционного вещества используется аэросил. Пример 6. Состав по примеру 6 аналогичен составу из примера 1, только в качестве антифрикционного вещества используется тальк. Пример 7. Состав по примеру 7 аналогичен составу из примера 1, только в качестве антифрикционного вещества используется магния стеарат. Пример 8. Состав по примеру 8 аналогичен составу из примера 1, только в качестве антифрикционного вещества используется смесь магния стеарата и аэросила. Пример 9. Состав по примеру 9 аналогичен составу из примера 1, только в качестве антифрикционного вещества используется смесь кальция стеарата и аэросила. Пример 10. Состав по примеру 10 аналогичен составу из примера 1, только в качестве антифрикционного вещества используется смесь кальция стеарата и талька. Пример 11. Состав по примеру 11 аналогичен составу из примера 1, только в качестве антифрикционного вещества используется смесь магния стеарата и талька. Пример 12. Состав по примеру 12 аналогичен составу из примера 1, только в качестве антифрикционного вещества используется смесь кальция стеарата, талька и аэросила. Пример 13. Состав по примеру 13 аналогичен составу из примера 1, только в качестве антифрикционного вещества используется смесь магния стеарата, талька и аэросила. Пример 14. Состав по примеру 14 аналогичен составу из примера 1, только в качестве солюбилизатора используется кросповидон. Пример 15. Состав по примеру 15 аналогичен составу из примера 1, только в качестве солюбилизатора используется примогель. Пример 16. Состав по примеру 16 аналогичен составу из примера 1, только в качестве солюбилизатора используется примелоза. Пример 17. мас.% Хондроитина сульфат 49,58 Поливинилпирролидон низкомолекулярный 1,0 Магния стеарат 1,0 Микрокристаллическая целлюлоза До 100 Пример 18. Состав по примеру 18 аналогичен составу из примера 17, только в качестве связующего используется коллидон. Пример 19. Состав по примеру 19 аналогичен составу из примера 17, только в качестве связующего используется пласдон. Пример 20. Состав по примеру 20 аналогичен составу из примера 17, только в качестве связующего используется пазели. Пример 21. Состав по примеру 21 аналогичен составу из примера 17, только в качестве антифрикционного вещества используется аэросил. Пример 22. Состав по примеру 22 аналогичен составу из примера 17, только в качестве антифрикционного вещества используется тальк. Пример 23. Состав по примеру 23 аналогичен составу из примера 17, только в качестве антифрикционного вещества используется кальция стеарат. Пример 24. Состав по примеру 24 аналогичен составу из примера 17, только в качестве антифрикционного вещества используется смесь магния стеарата и аэросила. Пример 25. Состав по примеру 25 аналогичен составу из примера 17, только в качестве антифрикционного вещества используется смесь кальция стеарата и аэросила. Пример 26. Состав по примеру 26 аналогичен составу из примера 17, только в качестве антифрикционного вещества используется смесь кальция стеарата и талька. Пример 27. Состав по примеру 27 аналогичен составу из примера 17, только в качестве антифрикционного вещества используется смесь магния стеарата и талька. Пример 28. Состав по примеру 28 аналогичен составу из примера 17, только в качестве антифрикционного вещества используется смесь кальция стеарата, талька и аэросила. Пример 29. Состав по примеру 29 аналогичен составу из примера 17, только в качестве антифрикционного вещества используется смесь магния стеарата, талька и аэросила. Пример 30. мас.% Хондроитина сульфат 55,83 Поливинилпирролидон низкомолекулярный 3,5 Магния стеарат 0,5 Смесь магния карбоната основного и микрокристаллической целлюлозы при соотношении 1:1 До 100 Пример 31. Состав по примеру 31 аналогичен составу из примера 30, только в качестве антифрикционного вещества используется аэросил. Пример 32. Состав по примеру 32 аналогичен составу из примера 30, только в качестве антифрикционного вещества используется тальк. Пример 33. Состав по примеру 33 аналогичен составу из примера 30, только в качестве антифрикционного вещества используется кальция стеарат. Пример 34. Состав по примеру 34 аналогичен составу из примера 30, только в качестве антифрикционного вещества используется смесь магния стеарата и аэросила. Пример 35. Состав по примеру 35 аналогичен составу из примера 30, только в качестве антифрикционного вещества используется смесь кальция стеарата и аэросила. Пример 36. Состав по примеру 36 аналогичен составу из примера 30, только в качестве антифрикционного вещества используется смесь кальция стеарата и талька. Пример 37. Состав по примеру 37 аналогичен составу из примера 30, только в качестве антифрикционного вещества используется смесь магния стеарата и талька. Пример 38. Состав по примеру 38 аналогичен составу из примера 30, только в качестве антифрикционного вещества используется смесь кальция стеарата, талька и аэросила. Пример 39. Состав по примеру 39 аналогичен составу из примера 30, только в качестве антифрикционного вещества используется смесь магния стеарата, талька и аэросила. Вышеуказанные составы по качествам удовлетворяют требованиям ГФ XI, выпуск 2, стр.154. Способ изготовления предлагаемой композиции заключается в следующем. Наполнитель, возможно с частью солюбилизатора, увлажняют связующим, сушат и гранулируют, затем опудривают действующим веществом, антифрикционными и возможно частью солюбилизатора. Полученную массу таблетируют и возможно покрывают оболочкой в количестве, не превышающем 0,024 г на одну таблетку. Содержание хондроитина сульфата в одной таблетке определяется терапевтической дозой. При количестве связующего вещества менее 1% не достигается необходимой прочности таблетки, а при количестве более 3,5% – ухудшается растворение таблетки. Увеличение количества антифрикционных веществ более 1% технологически нецелесообразно, а менее 0,5% не обеспечивает сыпучесть гранулята. Увеличение количества солюбилизатора более 6% технологически нецелесообразно. С целью определения общетоксического действия и доказательства эффективности предлагаемого средства, а именно таблетки на основе хондроитина сульфата, удобной для перорального применения, в которой содержание действующего вещества снижено до 250 мг преимущественно, и обеспечивающее хондростимулирующее, регенерирующее, противовоспалительное действие, были проведены его доклинические испытания. Доклинические испытания были проведены на базе центральной научно-исследовательской лаборатории Нижегородской государственной медицинской академии в 2004 году. Для испытания предлагаемое средство было представлено в виде таблетки следующего состава (табл.17). Для установления токсических доз предлагаемого средства были проведены острые опыты при внутрижелудочном способе его введения экспериментальным животным разных видов. В экспериментах было использовано 60 белых мышей обоих полов и 18 крыс самцов. Количество животных в каждой группе равнялось 6. Изменений в поведении, внешнем виде и массе тела мышей сразу после введения и на протяжении 14 суток не выявлено (табл.1, 2). Среднесмертельная доза при внутрижелудочном введении предлагаемого средства белым нелинейным мышам была не достигнута. Результаты острых опытов с внутрижелудочным введением предлагаемого средства мышам позволили отнести его к 4 классу малоопасных соединений (ГОСТ 12.1.007-76). Половой чувствительности животных к предлагаемому средству не установлено. Внутрижелудочное введение предлагаемого средства крысам в дозе 20 г/кг также не вызвало гибели животных (табл.3). Таким образом, предлагаемое средство не представляет опасности в плане острого отравления с учетом специфического фармакологического пути поступления в организм. При однократном внутрижелудочном введении предлагаемого средства у опытных животных при вскрытии и макроскопическом описании жизненно важных органов (размеры, форма, цвет, консистенция) через 14 суток изменений относительно контрольной серии не выявлено. С целью изучения общетоксического действия предлагаемого средства с учетом пути поступления, рекомендованного для клинического применения, изучено его действие при повторном внутрижелудочном применении крысам в эквитерапевтических дозах (83 мг/кг) и дозах, превышающих эквитерапевтические в 20 раз (1660 мг/кг). Продолжительность введения составила 30 суток. При внутрижелудочном применении предлагаемого средства в эквитерапевтических и высоких дозах не было выявлено различий в динамике массы тела (табл.4), показателях состояния высшей нервной деятельности (табл.5), состояния сердечно-сосудистой системы (табл.6). Изучение основных биохимических показателей сыворотки крови выявило повышенное содержание мочевины в группах подопытных животных по сравнению с контрольными группами (табл.7). На 15-е сутки восстановительного периода статистически достоверных различий уровня мочевины в исследуемых группах животных выявлено не было (табл.8), концентрация мочевины была в пределах физиологической нормы. Результаты гематологических исследований показали, что многократное внутрижелудочное применение предлагаемого средства не вызывает достоверных различий в показателях как в течение первых суток после введения, так и на протяжении всего периода наблюдения по сравнению с контрольной серией (табл.9, 10). Соотношение отдельных форм лейкоцитов в лейкоцитарной формуле при этом остается неизменным. При оценке мембранотропного эффекта предлагаемого средства при внутрижелудочном применении не выявлено достоверных различий с контролем (табл.11). Полученные данные измерения осмотической резистентности эритроцитов указывают на отсутствие отрицательного влияния предлагаемого средства на мембраны эритроцитов при внутрижелудочном применении в дозах 83 мг/кг и 1660 мг/кг в течение 30 суток. При вскрытии животных и макроскопическом описании жизненно важных органов (размер, форма, консистенция, цвет) изменений не выявлено. Патоморфологическое изучение структуры сердца, легких, печени, почек, селезенки, желудка и тонкого кишечника не выявило каких-либо патологических изменений в этих органах у опытных животных при внутрижелудочном применении предлагаемого средства в эквитерапевтической дозе (83 мг/кг). Через 15 суток после отмены введения предлагаемого средства в эквитерапевтической дозе (83 мг/кг) патоморфологическое исследование в контрольной и опытных группах животных не выявило нарушений в микроскопическом строении всех изученных органов. При изучении микроструктуры сердца, легких, печени, почек, селезенки, желудочно-кишечного тракта не отмечено каких-либо отличий в строении этих органов у опытных и контрольных животных при внутрижелудочном применении предлагаемого средства в дозе, значительно превышающий терапевтическую (1660 мг/кг). Через 15 суток после отмены введения предлагаемого средства в дозе, значительно превышающей эквитерапевтическую (1660 мг/кг), патологических изменений в микроскопическом строении всех изученных органов не обнаружено. Ежедневное внутрижелудочное введение предлагаемого средства крысам в дозах 83 мг/кг и 1660 мг/кг в течение 30 суток не приводит к достоверному различию в изменениях весовых коэффициентов органов крысы по сравнению с контролем как после окончания курса введения предлагаемого средства, так и после восстановительного периода (табл.12). Проведенное сравнительное патоморфологическое исследование жизненно важных органов крыс в опытах по изучению хронической 30-дневной токсичности предлагаемого средства в дозах 83 мг/кг и 1660 мг/кг не выявило каких-либо структурных нарушений в ткани сердечной мышцы, легких, печени, почек, селезенки, желудка и тонкого кишечника. Местное действие предлагаемого средства изучалось при аппликациях в дозе 20 мг/см2 на освобожденной от волосяного покрова коже кроликов. После 4-х часовой экспозиции на коже кроликов не отмечалось увеличения кожной складки. Окраска кожных покровов через 4 ч слегка изменялась, наблюдалось слабое покраснение. Состояние опытного участка кожи через 1, 24, 48 часов после однократной аппликации предлагаемым средством не отличалось от контрольного (табл.13). Оценка сенсибилизирующих свойств предлагаемого средства проводилась на кроликах путем повторных аппликаций в разведении 1:10 в течение 20 дней. Разрешающие дозы наносили в разведении 1:50 и 1:100. Сенсибилизирующие свойства при накожном нанесении не установлены. Местная реакция кожи отсутствовала. Толщина кожной складки не изменялась. Количество эозинофилов в крови экспериментальных животных достоверно не отличалось от исходного состояния (табл.14). Регенеративное действие препаратов изучали при моделировании остеоартроза у крыс. Предлагаемое средство с целью коррекции вызванных нарушений вводили животным опытных групп внутрибрюшинно ежедневно, в течение 14 сут., начиная с 8-го дня после введения кортикостероидов в эквитерапевтической дозе 83 мг/кг. После завершения эксперимента было проведено определение содержания сиаловых кислот в сыворотке крови (табл.15) и патоморфологическое исследование ткани коленного сустава задних лап крыс в контрольной группе (без лечения) и после лечения предлагаемым средством в течение 14 суток. На протяжении всего эксперимента оценивали внешний вид животных, общее функциональное состояние, прирост массы тела (табл.16). Определение содержания сиаловых кислот, являющихся маркерами воспаления или белками острой фазы, показало, что применение предлагаемого средства снижает их содержание, что свидетельствует об уменьшении активности воспалительного процесса. В рамках доклинических исследований дана оценка общетоксического и специфического фармакологического действия предлагаемого средства. Таким образом, проведенные исследования доказывают, что предлагаемое средство обладает выраженным специфическим фармакологическим эффектом, проявляя хондропротективное и регенеративное действие при экспериментальных артритах и артрозах, и не оказывает выраженного общетоксического действия при различных дозах и путях поступления в организм экспериментальных животных. Экспериментальные исследования проведены в соответствии с требованиями нормативного документа “Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. – 2000 г.”. Литература 1. РЛС. Энциклопедия лекарств. 2004, стр.969. 2. Прототип. РЛС. Энциклопедия лекарств, 2003, стр.389. 3. И.А.Муравьев. Технология лекарств, т.1. M.: Медицина, 1980. 4. Государственная фармакопея XI, вып.2, стр.154.
Формула изобретения
1. Твердая лекарственная форма, содержащая хондроитина сульфат в качестве действующего вещества, отличающаяся тем, что дополнительно содержит антифрикционные вещества, связующее и наполнитель при следующем содержании ингредиентов, мас.% Хондроитина сульфат 49,58-55,83 Связующее 1,0-3,5 Антифрикционные вещества 0,5-1,0 Наполнитель До 100 2. Твердая лекарственная форма по п.1, отличающаяся тем, что в качестве связующего форма содержит поливинилпирролидон низкомолекулярный, или коллидон, или пласдон, или пазели. 3. Твердая лекарственная форма по п.1, отличающаяся тем, что в качестве антифрикционных веществ он содержит аэросил, или тальк, или кальция стеарат, или магния стеарат, или смесь магния/кальция стеарата и аэросила, или смесь магния/кальция стеарата и талька, или смесь магния/кальция стеарата, талька и аэросила. 4. Твердая лекарственная форма по п.1, отличающаяся тем, что в качестве наполнителя форма содержит магния карбонат основной, или микрокристаллическую целлюлозу, или смесь магния карбоната и микрокристаллической целлюлозы, или примогран. 5. Твердая лекарственная форма по п.1, отличающаяся тем, что она дополнительно может содержать солюбилизатор в количестве не более 6,0 мас.%. 6. Твердая лекарственная форма по п.5, отличающаяся тем, что в качестве солюбилизатора она содержит полипласдон, или кросповидон, или примогель, или примелозу. 7. Твердая лекарственная форма по п.1, отличающаяся тем, что она выполнена в виде таблетки. 8. Твердая лекарственная форма по п.7, отличающаяся тем, что она может быть покрыта оболочкой.
|
||||||||||||||||||||||||||