|
|
(21), (22) Заявка: 2003134868/15, 01.12.2003
(24) Дата начала отсчета срока действия патента:
01.12.2003
(45) Опубликовано: 27.06.2005
(56) Список документов, цитированных в отчете о
поиске:
реферат из Medline: Utsunomiya T et al. Glycyrrhizin, an active component of licorice roots, reduces morbidity and mortality of mice infected with lethal doses of influenza virus. Antimicrob Agents Chemother. 1997 Mar;41(3):551-6. US 6383525 B1, 07.05.2002. SU 1499901 A1, 21.12.1987. SU 1626663 A1, 15.03.1994. RU 2073009 C1, 10.02.1997.
Адрес для переписки:
630559, Новосибирская обл., Новосибирский р-н, пгт Кольцово, ГНЦ ВБ “Вектор”, пат.отдел, Ю.Н.Мистюрину
|
(72) Автор(ы):
Покровский А.Г. (RU),
Федюк Н.В. (RU),
Абдуллаев С.М. (RU),
Балтина Л.А. (RU),
Толстиков Г.А. (RU)
(73) Патентообладатель(и):
Государственный научный центр вирусологии и биотехнологии “Вектор” (RU)
|
(54) ИНДУКТОР ГАММА-ИНТЕРФЕРОНА
(57) Реферат:
Изобретение относится к медицине и фармакологии, а именно к исследованию влияния производного глицирризиновой кислоты – ниглизина. Предложено средство для индукции секреции гамма-интерферона в условиях in vitro и in vivo. В качестве такового предлагается пента-О-никотинат глицирризиновой кислоты, ранее известный как противовоспалительное средство и ингибитор репродукции ВИЧ. Ниглизин в диапазоне концентраций 0,167-6 мкг/мл статистически достоверно повышает секрецию гамма-интерферона мононуклеарами крови, что позволит использовать его для неспецифической защиты организма. 3 ил., 1 табл.
(56) (продолжение):
CLASS=”b560m”IL 61006 A, 31.01.1984. Балтина Л.А. и др. Способ получения глицирризиновой кислоты из глицирама. Фармакологические свойства. “Химико-фармацевтический журнал”. 2001, т.35 №1, с.38-41.
Изобретение относится к медицине и фармакологии, а именно к исследованию влияния производного глицирризиновой кислоты – ниглизина на секрецию гамма-интерферона в условиях in vitro и in vivo.
Основой нормального функционирования иммунной системы является сбалансированная продукция цитокинов. Одним из основных эндогенных иммуномодуляторов, влияющих на функцию Т-клеток, макрофагов является гамма-интерферон. Помимо иммуностимулирующего эффекта для гамма-интерферона характерно антипролиферативное, противовирусное и противопаразитарное действие. Главными источниками гамма-интерферона являются хелперные Т-клетки 1-го типа, цитотоксические лимфоциты и нормальные килерные клетки. В клинической практике гамма-интерферон применяется для лечения опухолевых заболеваний, у пациентов со СПИДом при лечении оппортунистических инфекций. Также показано, что введение гамма-интерферона улучшает выживаемость больных с сепсисом.
Известно применение ниглизина для ингибирования репродукции вирусов Марбург и иммунодефицита человека [1, 2], как антиревматическое, гепатопротекторное и антидотное средство [3], однако в качестве индуктора интерферона это вещество не применялось.
Наиболее близким к заявляемому техническому решению (прототипом) является глицирризин (препарат, выпускаемый японской фармацевтической компанией “Minophagen”), который состоит из одной молекулы глицирризиновой кислоты и двух молекул глюкуроновой кислоты [4]. Этот препарат способен стимулировать продукцию гамма-интерферона в культуре клеток моноцитов и макрофагов [5] и Т-клеток [6]. Он используется для лечения ВИЧ-инфекции и вирусных гепатитов в суточной дозе до 1,6 грамма при внутривенном введении [7, 8].
Ниглизин (пента-о-никотинат глицирризиновой кислоты) применяется в таблетках (per os) и в суточной дозе 0,3 грамма не влияет на функциональное состояние сердечно-сосудистой и кроветворной систем, на функцию печени и почек, не вызывает патологических изменений мозга, сердца, легких, печени, селезенки, желудка и кишечника, а также не обладает тератогенными и канцерогенными свойствами [9].
Задачей изобретения является поиск нового препарата, повышающего секрецию гамма-интерферона в организме и не обладающего побочными эффектами.
Поставленная задача решается использованием производного глицирризиновой кислоты – (пента-о-никотината глицирризиновой кислоты) в качестве индуктора гамма-интерферона в организме.
Ниглизин растворяют в ДМСО, а затем раствором ФСБ доводят до необходимой концентрации. Группам по 3 мыши вводят раствор ниглизина объемом 0,5 мл с концентрацией 400 мкг/мл, 40 мкл/мл и 4 мкг/мл интраперитонально однократно, через 12, 24 и 48 ч забирают селезенки и оценивают секрецию гамма-интерферона. В качестве контроля мышам вводят 4% ДМСО.
Предложенный индуктор интерферона ниглизин в литературе не описан, следовательно, можно сделать вывод о соответствии технического решения критериям изобретения “новизна” и “изобретательский уровень”.
Перечень фигур графических изображений.
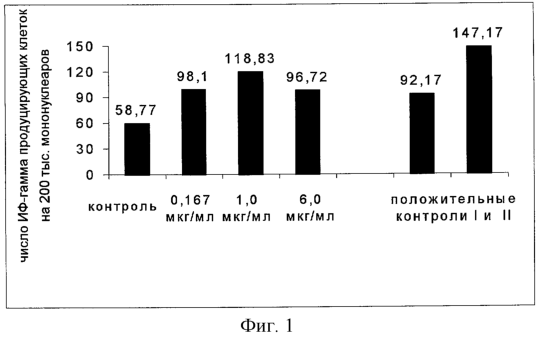
Фиг.1 – Эффект ниглизина на секрецию гамма-интерферона мононуклеарами крови. Контроль – клеточная среда; 0,167 мкг/мл; 1,0 мкг/мл; 6,0 мкг/мл – концентрации ниглизина; положительные контроли: I – иономицин с РМА; II – моноклональные антитела анти-СD3.
Фиг.2 – зависимость числа гамма-интерферон продуцирующих клеток от концентрации ниглизина.
Фиг.3 – дозозависимый эффект ниглизина на число ИФ-гамма секретирующих клеток через 48 ч после однократного интраперитонального введения мышам (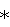 – р<0,01; – р<0,01; 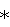 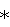 – статистически не достоверно). – статистически не достоверно).
Далее следует пример выполнения способа.
1. Доноры крови, забор образцов и выделение мононуклеаров.
Отбирают 10 волонтеров в возрасте от 22 до 52 лет, средний возраст 37 лет. В исследуемой группе 9 женщин и 1 мужчина. Кровь объемом 4-5 мл забирают путем венепункции в пробирки, содержащие в качестве антикоагулянта ЭДТА. Затем кровь разбавляют фосфатным буфером в соотношении 1:1 и разведенную кровь наносят на раствор Ficoll-Hypaque. Разделение проводят центрифугированием при 1500 об/мин в течение 40 мин. Клетки интерфазы собирают, ресуспендируют в 3 мл фосфатного буфера и дважды отмывают центрифугированием в течение 5 мин при 1500 об/мин. Третью отмывку проводят в среде RPMI 1640 в объеме 2 мл. После третьей отмывки мононуклеары ресуспендируют в 1 мл среды.
2. Реагенты.
Ниглизин (пента-о-никотинат глицирризиновой кислоты) растворяют в ДМСО, а затем раствором фосфатного буфера (ФСБ) доводят до необходимой концентрации. Форбол-12-миристат-13-ацетат (РМА) и иономицин, а также моноклональные антитела анти-СД3 используют в качестве положительного контроля. Клетки инкубируют в среде RPMI 1640 с 10% фетальной сыворотки с добавлением антибиотиков.
3. Определение гамма-интерферон секретирующих мононуклеаров методом ELISPOT.
Для сорбции антител используют 96-луночный планшет с нитроцеллюлозным дном (Milliliter, Millipore). Сорбцию мышиных анти-гамма-интерферон моноклональных антител проводят в фосфатном буфере в течение ночи при 4°С, при этом в лунку добавляют по 100 мкл раствора с концентрацией антител 5 мкг/мл. На следующий день лунки промывают фосфатным буфером и добавляют по 150 мкл/лунку среды RPMI 1640 с 10% фетальной сывороткой для блокирования свободных сайтов. Планшет инкубируют в течение 2 ч при 37°С. Затем в лунки вносят мононуклеары таким образом, чтобы в конечном объеме, равном 200 мкл, содержалось 200000 клеток. Ниглизин добавляют в лунки до конечной концентрации 0,167, 1 и 6 мкг/мл. В качестве позитивного контроля используют форбол-12-миристат-13-ацетат с иономицином в концентрациях 30 нг/мл и 500 нг/мл соответственно и анти-СD3 моноклональные антитела в разведении 1:30. Планшет инкубируют 36-40 ч при 37°С и 5% СО2. После периода инкубации клетки удаляют, а лунки промывают раствором фосфатного буфера с твином (ФСБ-Т). Затем добавляют мышиные анти-гамма-интерферон моноклональные антитела в концентрации 2,5 мкг/мл при 37°С в течение 2 ч. После трехкратного промывания раствором ФСБ-Т в лунки добавляют кроличьи антимышиные IgG меченные пероксидазат хрена в разведении 1:800 и инкубируют 1 ч при 37°С. После удаления не связавшихся компонентов и промывания лунок, образовавшиеся комплексы (пятна) проявляют свежеприготовленным раствором 4-хлоро-1-нафтола. Через 20-30 мин субстрат удаляют, лунки промывают дистиллированной водой и оставляют сушиться.
4. Животные
В эксперименте используют линейных мышей линии BALB/C с массой 18-20 г обоего пола, всего 36 особей.
5. Инъекции ниглизина
Ниглизин растворяют в ДМСО, а затем раствором ФСБ доводят до необходимой концентрации. Группам по три мыши вводят раствор ниглизина объемом 0,5 мл с концентрацией 400 мкг/мл; 40 мкг/мл и 4 мкг/мл интраперитонально однократно, через 12, 24 и 48 ч забирают селезенки и оценивают секрецию гамма-интерферона. В качестве контроля мышам вводят 4% раствор ДМСО.
6. Выделение селезенок и приготовление спленоцитов.
Спустя 12, 24 и 48 ч после инъекции ниглизина мышей умерщвляют методом цервикальной транслокации и в асептических условиях производят изъятие селезенок. Затем селезенки протирают через металлическое сито, суспендируют в среде RPMI 1640, после промывают трижды в той же среде, каждый раз центрифугируют при 1500 об/мин в течение 10 мин.
7. Определение продукции гамма-интерферона спленоцитами мышей методом ELISPOT
Анти-мышиные гамма-интерферон связывающие моноклональные антитела в концентрации 5 мкг/мл в объеме 100 мкл сорбируют на планшете с нитроцеллюлозным дном. На следующий день не связавшиеся сайты блокируют 150 мкл/лунку раствора RPMI 1640 с 10% фетальной сывороткой. После промывания в лунки добавляют суспензию спленоцитов объемом 200 мкл с концентрацией клеток 1 млн/мл. Планшет инкубируют 36-40 ч при 37°С, 5% СО2. После периода инкубации клетки удаляют, а лунки промывают раствором ФСБ-Т. Затем добавляют вторые анти-гамма-интерферон обнаруживающие моноклональные антитела, меченные биотином, в концентрации 0,5 мкг/мл и инкубируют при 37°С 2 ч. После трехкратного промывания раствором ФСБ-Т в лунки добавляют конъюгат авидина с пероксидазой хрена в разведении 1:100 и инкубируют 1 ч при 37°С. Затем удаляют не связавшиеся компоненты и промывают лунки, образовавшиеся комплексы (пятна) проявляют свежеприготовленным раствором 4-хлоро-1-нафтола. Через 20-30 мин субстрат удаляют, лунки промывают дистиллированной водой и оставляют сушиться.
8. Подсчет числа образовавшихся пятен
Образовавшиеся пятна подсчитывают под бинокуляром, при 50-кратном увеличении. Среднее число пятен определяют по двум повторам.
9. Статистический анализ
Сравнение экспериментальной и контрольной групп производят с использованием двухвыборочного t-теста с различными дисперсиями (Excel). Результаты считают статистически достоверными для р<0,05.
РЕЗУЛЬТАТЫ
1. Эффект ниглизина на продукцию гамма-интерферона у здоровых волонтеров in vitro
Как показано на фиг.1, ниглизин в диапазоне концентраций 0,167-6 мкг/мл статистически достоверно (р<0,05) повышает секрецию гамма-интерферона мононуклеарами крови.
Исследуя влияние разных концентраций ниглизина на секрецию гамма-интерферона, можно заключить, что максимальную стимуляцию наблюдают при количестве ниглизина в среде равном 1 мкг/мл (фиг.2). При этом в среднем наблюдают более чем двукратное увеличение числа пятен (от 1,2 до 5,5 раз).
2. Эффект ниглизина на продукцию гамма-интерферона спленоцитами мышей in vivo
Результаты эксперимента in vivo, проведенного на мышах, показаны в табл.1. Увеличение секреции гамма-интерферона спленоцитами наблюдают только спустя 48 ч после однократного введения ниглизина в дозе 1 и 10 мкг/кг (фиг.3). Через 12 и 24 ч после однократного введения ниглизина в исследуемых дозах число определяемых пятен не отличается от контроля.
Из вышеизложенного можно заключить, что использование ниглизина увеличивает секрецию гамма-интерферона, что позволяет применять его в качестве противовирусного препарата, для неспецифической защиты организма.
|
Таблица 1
Влияние ниглизина на продукцию гамма-интерферона спленоцитами мышей |
| Ниглизин, мг/кг/мышь |
Среднее число пятен±стандартное отклонение |
| 12 часов |
24 часа |
48 часов |
| Контроль |
18,33±6,17 |
36,50±8,23 |
29,17±6,62 |
| 0,1 |
19,50±5,24 |
39,50±15,50 |
26,33±7,66 |
| 1 |
19,33±4,50 |
31,83±5,04 |
44,50±19,98 |
| 10 |
18,33±6,01 |
34,50±7,09 |
50,60±12,28 |
Литература
1. Авторское свидетельство СССР №1804848 “Ингибитор размножения вируса иммунодефицита человека”, А 61 К 31/705, опубликован БИ №12, 1993.
2. Патент РФ №2088232 “Ингибитор репродукции вируса Марбург”, А 61 К 31/70, опубликован БИ №24, 1997.
3. “Глицирризиновая кислота”. Толстяков Г.А., Балтина Л.А., Шульц Э.Э., Покровский А.Г., Биоорганическая химия, 1997, том 23, №9, с.691-709.
4. Utsunomiya Т., Kobayshi M., Pollard R.B., Suzuki F., Glycyrrhizin, an Active Component of Licorice Roots, Reduces Moriditily and Mortality of Mice Infected with Lethal Doses of Influenza Virus, Antimicrobial Agents and Chemotherapy. 1997, v.41, N3, p.551-556.
5. Shinada M., Azuma M., Kawai H., Sazaki К., Yoshida Т., Suzutani Т., Enhancement of interferon- prodaction in glycyrrhizin-treated human peripheral lymphocytes in responce to concavalin A and to surfase antigen of Hepatitis В virus (42241), Proc. Soc. Exp. Biol. Med., 1986, v.181, p.205-210. prodaction in glycyrrhizin-treated human peripheral lymphocytes in responce to concavalin A and to surfase antigen of Hepatitis В virus (42241), Proc. Soc. Exp. Biol. Med., 1986, v.181, p.205-210.
6. Abe N., Ebina Т., Ishida N. Interferon induction by glycyrrhizin and glycyrretinic acid in mice. Microbiol. Immunol., 1982, v.26, p.535-539.
7. Rossum T.G.J., Vulto A.G., Man R.A., Brouwer J.T., Schalm S.W., Review article: glycyrrhizin as potential treatment for chronic hepatitis C., Alymentary pharmacology and therapeutics, 1998, v.12, №3, p.199-205.
8. Hattori Т., Ikematsu S., Matsushita S., Maeda Y., Hada M., Fujimaki M., Takatsuki K., Prelimenary evidence for inhibitory effect of glycyrrhizin on replication in patients with AIDS, Antiviral Res., 1989, v.11 (5-6), p.255-261.
9. Насыров Х.М., Механизм действия антифлогистиков как основа изыскания новых противовоспалительных средств. Диссертация доктора мед. наук, Казань: Мед. институт, 1986, с.365.
Формула изобретения
Применение пента-O-никотината глицирризиновой кислоты в качестве индуктора гамма-интерферона.
РИСУНКИ
PC4A Государственная регистрация перехода исключительного права без заключения договора
(73) Патентообладатель(и):
Федеральное государственное унитарное предприятие «Государственный научный центр вирусологии и биотехнологии «Вектор»
(73) Патентообладатель:
Федеральное государственное учреждение науки «Государственный научный центр вирусологии и биотехнологии «Вектор» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека
Дата и номер государственной регистрации перехода исключительного права: 16.04.2010 № РП0000704
Извещение опубликовано: 27.05.2010 БИ: 15/2010
|
|