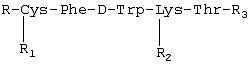Патент на изобретение №2254139
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) СРЕДСТВО, ОБЛАДАЮЩЕЕ ПРОТИВООПУХОЛЕВЫМ ДЕЙСТВИЕМ
(57) Реферат:
Изобретение относится к фармацевтической химии, в частности к созданию лекарственных средств пептидной природы, обладающих противоопухолевым действием, и может быть использовано для лечения опухолей, в том числе эндокринных и гормонзависимых. Средство представляет собой пептид общей формулы: Изобретение обеспечивает повышение терапевтического эффекта, снижение токсичности. 2 з.п. ф-лы, 4 табл.
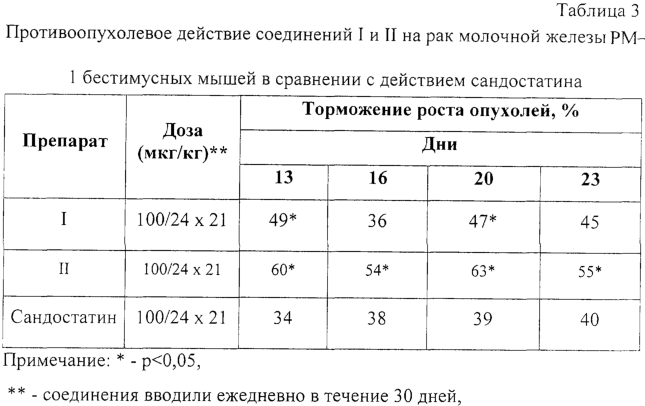
Изобретение относится к фармацевтической химии, в частности к созданию лекарственных средств пептидной природы, обладающих противоопухолевым действием, и может быть использовано для лечения опухолей, в том числе эндокринных и гормонозависимых. В современной практике противоопухолевой химиотерапии используется весьма широкий арсенал лекарственных средств, таких как алкилирующие вещества, антиметаболиты, противоопухолевые антибиотики, гормональные препараты и их антагонисты, ферменты. Широко применяют цитостатики сарколизин, циклофосфан, миелосан, производные нитрозометилмочевины, из антиметаболитов – метотрексат, меркаптопурин, фторурацил, фторафур, среди противоопухолевых антибиотиков – дактиномицин, рубомицин, доксорубицин, карминомицин и другие. Для лечения гормонозависимых опухолей часто используют гормональные препараты, в частности андрогены, эстрогены, кортикостероиды, и антагонисты гормонов. Так, для лечения рака предстательной железы применяют эстрогены, так как в этом случае показано подавление действия в организме андрогенов или усиление активности эстрогенов. Андрогены используют, когда показано повышение активности андрогенов или уменьшение активности эстрогенов, например при раке молочной железы. Для лечения злокачественных лимфом и острых лейкозов используют глюкокортикоиды. В современной медицинской онкологической практике для лечения гормонозависимых опухолей используют такие препараты, как анастрозол, мегестрол, медроксипрогестерон, тамоксифен, флутамид и другие (РЛС Россия, Энциклопедия лекарств, выпуск 9, 2002 год). Однако упомянутые лекарственные средства, помимо серьезных побочных явлений, имеют и абсолютные противопоказания, такие как нарушение функции печени и почек, тромбофлебит, заболевания щитовидной железы и сердца, детский возраст, беременность. В последние десятилетия ведется активный поиск противоопухолевых лекарственных средств пептидной природы, проявляющих высокую специфическую активность и в то же время не имеющих серьезных противопоказаний. Известна фармацевтическая композиция, обладающая противоопухолевым действием, содержащая Известно противоопухолевое средство, представляющее собой комплексный препарат производных гематопорфирина и фактора некроза опухоли альфа в определенном молярном соотношении (Патент RU 2136278, 1998), средство обладает невысокой токсичностью. Известен пентапептид, обладающий противоопухолевой активностью в форме гидрохлорида M2Val-Val-MVal-Pro-Pro-NH-Bzl НСl, где М – металл, Bzl – бензил (патент RU 2153504, 1995). Известно противоопухолевое средство, представляющее собой нетоксичный гексапептид формулы Leu-Val-Val-Tyr-Pro-Trp (патент RU 2067870, 1993). Известен фармацевтический состав на основе пептидов, обладающий антипролиферативным действием в отношении опухолей (патент RU 2156774, 1995). Все более широкое применение в клинической терапии опухолей, особенно эндокринных опухолей, находит сандостатин, препарат на основе циклического октапептида, выпускаемый фирмой «Сандос» (Н.Ф.Орел и др., ж. «Современная онкология», т.2, №1, 2000). По фармакологическому спектру действия и специфической противоопухолевой активности сандостатин является наиболее близким к заявляемому средству, поэтому выбран заявителем в качестве прототипа. Задачей настоящего изобретения является создание отечественного противоопухолевого средства, обладающего высоким терапевтическим эффектом, широким спектром противоопухолевого действия и низкой токсичностью. Поставленная задача решается тем, что предложено средство, обладающее противоопухолевым действием, представляющее собой пептид общей формулы: R – трет-бутилоксикарбонил, R1 – тетрагидропиранил, R2-N R-Н, R1 – тетрагидропиранил, R2-N R-Н, R1-H, R2-Н, R3 – метил (III); R – трет-бутилоксикарбонил, R1 – тетрагидропиранил, R2-N Технический результат, получаемый при использовании изобретения, выражается в расширении арсенала противоопухолевых средств, снижении токсичности, повышении терапевтического эффекта. Синтез заявляемого средства проводили классическими методами пептидной химии. Для блокирования боковой цепи лизина применяли карбобензилокси (Z) группу, цистеина – тетрагидропиранильную (Thp), a для временной защиты N Для повышения устойчивости к тканевым ферментам в состав пептидов введена неприродная аминокислота D-триптофан. Полученные пептиды были охарактеризованы углом оптического вращения и данными элементного анализа, тонкослойной хроматографией, высокоэффективной жидкостной хроматографией, данными ЯМР-спектроскопии и аминокислотного анализа. Изобретение поясняется следующими примерами Пример 1 В качестве примера приводится синтез гидрохлорида метилового эфира S-тетрагидропиранилцистеинилфенилаланил-D-триптофил-N HCl·H-Cys(Thp)-Phe-D-Trp-Lys(Z)-Thr-OMe (II) Пентапептид (II) получали удалением Вос-защитной группы с пентапептида (I) 3,4 N НСl в этилацетате при комнатной температуре в течение 20 минут. В этих условиях не наблюдалась побочная реакция отщепления Z-группы с N Пример 2 Пептид, полученный по описанному способу, был испытан на адекватных моделях: аденокарциноме предстательной железы Даннинга крыс Copenhagen и раке молочной железы РМ-1 на бестимусных мышах. В эксперименте на крысах препарат вводили в дозе 100 мкг/кг в течение 30 дней, на мышах также в дозе 100 мкг/кг в течение 21 дня. Как показали экспериментальные данные, пептид проявляет равный противоопухолевый эффект на аденокарциноме предстательной железы Даннинга R3327-H крыс и раке молочной железы РМ-1 бестимусных мышей. Пептид тормозит рост этих опухолей на 63-65%. Экспериментально было установлено, что заявляемое средство обладает широким спектром противоопухолевого действия, а именно эффективно на перевиваемых опухолях: аденокарцинома молочной железы Са-755, меланома В-16, аденокарцинома легкого Льюис LLC, аденокарцинома предстательной железы Даннинга R-3327-H, рак молочной железы РМ-1 бестимусных мышей и ДМБА – индуцированных опухолях молочной железы. Были проведены испытания заявленного средства. 1. Изучение токсичности. 2. Изучение специфической противоопухолевой активности. 1. Исследование токсичности заявляемого средства соединений I, II, III, IY проводили на мышах-гибридах BDF1 и беспородных крысах-самках. Все соединения не проявляют токсического действия на мышах в разовых дозах 60-80 мг/кг (суммарная доза 300-400 мг/кг). При пересчете на человека ежедневная доза составляет 300000-400000 мкг, что в 50-65 раз превышает применяемые при неоперабельном раке поджелудочной железы высокие дозы сандостатина (6000 мкг/сут). На беспородных крысах все соединения также не проявляют токсического действия при курсовой дозе 6000 мкг/кг. Представленные данные показывают, что заявляемое средство не проявляет токсичность при использовании даже в высоких дозах. 2. Изучение противоопухолевой активности проводили на адекватных моделях. Критерием эффективности лечения служило торможение роста опухоли (ТРО). Противоопухолевую активность изучали на аденокарциноме предстательной железы Даннинга 3327-Н крыс Copenhagen. Данные представлены в таблице 1. Как видно из таблицы 1, соединения I, III, IY на аденокарциноме предстательной железы Даннинга R3327-H крыс проявляют противоопухолевое действие: соединение I тормозит рост опухоли на 55%, соединение III – на 66%, соединение IY – на 46%. Противоопухолевую активность заявляемого средства изучали на ДМБА-индуцированных опухолях молочной железы крыс в сравнении с сандостатином. Изучаемые препараты вводили подкожно в дозе 100 мкг/кг в течение 30 дней. Данные представлены в таблице 2. Как видно из таблицы 2, все соединения проявляют высокий противоопухолевый эффект. Терапевтический эффект соединения I составляет 91% ТРО. У соединения III максимальный терапевтический эффект равен 75% ТРО, у соединения IY – 79% ТРО, а у сандостатина – 68% ТРО. Противоопухолевую активность заявляемого средства изучали также на бестимусных мышах с подкожно перевитым раком молочной железы РМ-1 в сравнении с сандостатином. Соединение вводили подкожно в дозе 100 мкг/кг в течение 21 дня. Данные представлены в таблице 3. Как видно из данных таблицы 3, на фоне введения соединений максимальный терапевтический эффект составил для соединения I – 47% ТРО, для соединения II – 63% ТРО и превышал противоопухолевое действие сандостатина (39% ТРО). Непосредственно после окончания лечения терапевтический эффект сохранялся и составил для соединения I – 45% ТРО, для соединения II – 55% ТРО, для сандостатина – 40% ТРО. В эксперименте показан статистически достоверный противоопухолевый эффект заявляемого средства на перевиваемых гормононезависимых опухолях: аденокарциноме молочной железы Са-755, аденокарциноме легкого Льюис LLC и меланоме В-16 Изучаемые препараты вводили в дозах 60-80 мг/кг подкожно в течение 5 дней. Данные представлены в таблице 4. Как следует из данных таблицы 4, максимальное ТРО на аденокарциноме молочной железы Са-755 составляет 91%, на аденокарциноме легкого Льюис – 97% и на меланоме В-16 – 85%. Таким образом, заявленное средство обладает высоким противоопухолевым эффектом на широком спектре опухолей, в том числе гормонозависимых, и низкой токсичностью, что позволит ему занять достойное место в онкологической практике.
Индукция опухолей осуществлялась четырехкратным еженедельным внутривенным введением ДМБА (диметилбензантрацен) в водно-жировой эмульсии в суммарной дозе 8 мг на крысу.
ЛИТЕРАТУРА 1. Romy Lea Topper, Pharm D.Ocreotide: Drug review and clinical indications. The cancer bulletin, 1989, 41, 5, 334-335. 2. Гарин А.М. Принципы и возможности современной эндокринной терапии опухолей. М., 2000, 82-85. 3. Agthony L.B., Krozely M.G., Jonhson D.H., Shaff M.I., Hande K.R., Oates J.A.Somatuline is antitumor efficacy and phase I trial in neuroendocrine tumors. Proc. Annu Meet Am Soc Clin Oncol, 1992, 11:А484. 4. Jean-Christophe Souget. Long-acting somatostatin analogues in pancreatic islet cell carcinoma. Horm. Res., 1989, 32, 74-76. 5. Weckbecker G., Raulf F., Stolz В., Bruns С. Somatostatin analogs for diagnosis and treatment of cancer. Pharm. Ther. Vol. 60, p. 245-264, 1993. 6. Cavanac et al. Somatostatin analogue composition and in treating beastm cancer U.S.P. 7. Н.Ф.Орел, Т.Н.Лопаткина. Возможности применения сандостатина у онкологических больных. Современная онкология, 2, 1, 2000.
Формула изобретения
1. Средство, обладающее противоопухолевым действием, содержащее пептид и физиологически приемлемый растворитель, отличающееся тем, что в качестве пептида оно содержит линейный пептид общей формулы: R – трет-бутилоксикарбонил или Н, R1 – тетрагидропиранил или Н, R2-N R3 – O-метил или S-тетрагидропиранилцистеина метиловый эфир. 2. Средство по п.1, отличающееся тем, что оно предназначено для парентерального введения и содержит действующее вещество в дозе 0,1-100,0 мг/кг. 3. Средство по п.1, отличающееся тем, что оно предназначено для парентерального введения, выполнено в липосомальной форме и содержит действующее вещество в дозе 0,05-100 мг/кг веса.
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 15.11.2009
Извещение опубликовано: 10.07.2010 БИ: 19/2010
NF4A Восстановление действия патента СССР или патента Российской Федерации на изобретение
Дата, с которой действие патента восстановлено: 10.10.2010
Извещение опубликовано: 10.10.2010 БИ: 28/2010
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

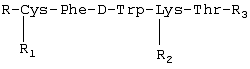
 -гептилгликозид-N-ацетилмурамил-L-аланил-D-изоглутамина в липосомальной форме для перорального и внутривенного введения (патент RU 2121363, 1997 г.), композиция обладает низкой токсичностью.
-гептилгликозид-N-ацетилмурамил-L-аланил-D-изоглутамина в липосомальной форме для перорального и внутривенного введения (патент RU 2121363, 1997 г.), композиция обладает низкой токсичностью.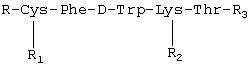
 – бензилоксикарбонил, R3, – метил (I);
– бензилоксикарбонил, R3, – метил (I); -функций трет-бутилоксикарбонильную (Воc) группы.
-функций трет-бутилоксикарбонильную (Воc) группы.