|
|
(21), (22) Заявка: 2003109619/13, 05.09.2001
(24) Дата начала отсчета срока действия патента:
05.09.2001
(30) Конвенционный приоритет:
06.09.2000 US 60/230,397
(43) Дата публикации заявки: 27.11.2004
(45) Опубликовано: 10.06.2005
(56) Список документов, цитированных в отчете о
поиске:
WO 9911656 А1, 11.03.1999. US 3937654 А, 10.02.1976.
(85) Дата перевода заявки PCT на национальную фазу:
07.04.2003
(86) Заявка PCT:
US 01/27513 (05.09.2001)
(87) Публикация PCT:
WO 02/20720 (14.03.2002)
Адрес для переписки:
129010, Москва, ул. Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. Е.Е.Назиной
|
(72) Автор(ы):
ХАЛТИН Герберт О. (US),
КЕЛЛЕХЕР Стефен Д. (US),
ФЕНГ Юминг (US),
КРИСТИНССОН Хордур (US),
РИЧАРДЗ Марк П. (US),
УНДЕИУЛАНД Ингрид (SE),
КЕ Шуминг (US)
(73) Патентообладатель(и):
ЮНИВЕРСИТИ ОФ МАССАЧУСЕТС (US)
|
(54) СПОСОБ ВЫДЕЛЕНИЯ ПИЩЕВОГО БЕЛКА ИЗ МЫШЕЧНОЙ ТКАНИ ЖИВОТНЫХ (ВАРИАНТЫ)
(57) Реферат:
Изобретение относится к пищевой биотехнологии и касается выделения съедобного белка в щелочном водном растворе. Способ выделения пищевого (съедобного) белка из мышечной ткани животных предусматривает солюбилизацию белка в щелочном водном растворе. Это обеспечивает повышение выхода белка. 4 с. и 58 з.п. ф-лы, 1 ил., 10 табл.
Область изобретения
Настоящее изобретение относится к способу выделения пищевого белка из мышц животных путем солюбилизации белка в щелочном водном растворе.
Предпосылки изобретения
Сурими, или рыбные палочки, производят в Японии уже около тысячи лет. Только в последнее время сурими появилось в супермаркетах Северной Америки в виде имитации мяса краба, кусков лобстера, креветок и моллюсков. В Северной Америке сурими, как правило, производят из постной белой рыбы, такой как сайда или мерланг.
Дешевые мышцы животных (например, из жирной морской рыбы или остатков на костях домашней птицы), как правило, являются нежелательными в качестве источника пищи для потребления людьми. После обработки выделенный белок часто характеризуется непривлекательной текстурой, темным цветом и сильным запахом, часто вследствие окисления мембранных липидов.
Краткое описание изобретения
Настоящее изобретение основывается на обнаружении того факта, что если белок из мышц животных солюбилизируется в щелочном растворе, то полученный в результате растворимый белок может быть выделен с высоким выходом и, по существу, в нативной и неокисленной форме, более пригодной для потребления людьми. Обнаружено, что щелочная обработка мышц животных минимизирует окислительные эффекты дезоксигемоглобина и гидролиз миозина, главного мышечного белка липосомными протеазами. После солюбилизации мышечного белка в щелочном водном растворе различные нежелательные компоненты (например, кости, нейтральные липиды, мембранные липиды, жирные куски, кожа, хрящи и другой нерастворимый материал) могут быть удалены. Затем растворимый белок преципитирует, и его собирают в форме, пригодной для употребления в пищу.
Соответственно, настоящее изобретение предусматривает способ для выделения пищевого (т.е. съедобного) белка из мышц животных (например, рыбы, такой как морская рыба, или кур) путем получения смеси, содержащей мышцы животных и воду; повышения значения рН смеси до уровня, достаточного для солюбилизации по меньшей мере части нерастворимого животного белка в смеси белков из мышц животных; удаления по меньшей мере около 50% масс. от всех мембранных липидов в смеси; преципитации солюбилизированного белка, содержащегося в смеси белков из мышц животных; и сбора преципитированного белка, и тем самым выделения пищевого белка из мышц животных. Этот выделенный белок может быть использован для формирования гелей из съедобных белков, которые могут быть использованы в пищевых продуктах, таких, например, как хот-доги и готовая сурими. Чтобы дополнительно ограничить степень окисления, в особенности мембранных липидов, смесь может включать в себя хелатирующий железо агент (то есть, соединение, которое связывает и инактивирует окислительный потенциал атома или иона железа), такой как этилендиаминтерауксусная кислота (EDTA), диэтилентриаминпентауксусная кислота (DTPA), карнозин, ансерин, мочевая кислота, лимонная кислота, фосфат, полифосфат, ферритин или трансферрин.
Способ необязательно может включать в себя стадию промывки, на которой сырые мышцы животных промываются водой перед солюбилизацией; или стадию для удаления нерастворимого материала, такого как кости, кожу и хрящи, из солюбилизированного белка. Это может быть достигнуто с использованием необязательной стадии низкоскоростного центрифугирования перед осаждением белка. Как здесь используется, “низкоскоростное” означает около 4000×g или ниже (например, 2000, 2500, 3000, 3250, 3500, или 3750×g), и “высокоскоростное” означает около 5000×g или выше (например, 5500, 6000, 7500, 8500, 10000 или выше × g). Центрифугирование может осуществляться в течение времени, достаточного (например, 5, 10, 15, 20, 25, 30, 40, 60, или более минут) для достижения желаемого результата, такого как удаление мембранных липидов или удаление нерастворимого материала из смеси.
Мышцы животных могут, в целом, составлять 50% или менее (например, 40, 30, 20, 15, 10 или 5%, или менее) от массы смеси. Когда желательным является удаление мембранных липидов из растворимых белков, процент мышц животных в смеси должен быть ниже, например, 15, 10 или 8%, или менее от массы смеси, чтобы сделать вязкость раствора достаточно низкой для выделения мембранных липидов от водной части смеси. Когда вязкость солюбилизированного белка понижается, может быть удалено по меньшей мере около 50% (например, по меньшей мере около 60, 70, 80 или 90%) массы всех мембранных липидов, присутствующих в смеси.
Мембранные липиды могут быть удалены из смеси с использованием ряда способов. Например, центрифугирование смеси при около 5000×g или выше (например, 6000, 7000, 8000, 9000 или 10000×g, или выше) является достаточным для преципитации мембранных липидов под водным слоем, содержащим солюбилизированный белок. Там, где это является необходимым или желательным, нейтральные липиды (например, масла) могут быть удалены из верхней части водного слоя. Другие способы удаления мембранных липидов из смеси включают в себя фильтрование и добавление агрегирующего агента. Здесь “агрегирующий агент” представляет собой материал, который, когда его добавляют к смеси, вызывает агрегацию одного или нескольких из диспергированных в смеси компонентов, тем самым, облегчая выделение одного или нескольких компонентов из смеси.
Начальная солюбилизация белка из мышц животных может достигаться путем повышения значения рН смеси до около 10,0 или выше (например, 10,5 или выше). Значение рН можно повысить путем добавления полифосфата к смеси.
Солюбилизированный белок может быть осажден путем понижения значения рН щелочной смеси, например, до около 5,5 или ниже. Например, значение рН может быть понижено до около 4,0 или ниже (например, до 2,5-3,5, в частности 3,0), а затем повышена до около 5,0 или выше. Значение рН водной фазы можно уменьшить путем добавления кислоты, например, хлористоводородной кислоты, к водной фазе. Концентрацию солей необязательно можно подбирать таким образом, чтобы она способствовала преципитации (например, путем добавления соли, такой как NaCl), и к осажденному белку необязательно можно добавлять криопротектор. Осажденный белок может быть собран путем центрифугирования и/или с помощью агрегирующего агента, такого как полиамин (например, спермин или спермидин), нейтральный или ионный полимер или любого другого конкретного агрегирующего агента, который также является пригодным для использования при агрегации мембранных липидов.
В другом аспекте, настоящее изобретение включает в себя способ выделения пищевого белка из мышц животных (например, рыб или кур) путем получения смеси, содержащей мышцы животных и воду; повышения значения рН смеси до уровня, достаточного для солюбилизации, по меньшей мере части нерастворимого животного белка в смеси белков из мышц животных; преципитации солюбилизированного белка из смеси белков из мышц животных; и сбора осажденного белка и, тем самым, выделения съедобного белка из мышц животных. В этом способе температура смеси поддерживается при 15°С или ниже (например, 10° или 5° или ниже), на каждой стадии, чтобы свести к минимуму денатурацию белка и вредное окисление примесей, таких как мембранные липиды. Собранный осажденный белок обеспечивает выход по меньшей мере 70% (например, по меньшей мере 80, 90, 95%) массы всего белка из мышц животных в смеси до повышения значения рН. В этом способе, там, где это применимо, могут быть использованы дополнительные необязательные стадии и материалы, как здесь описывается.
В качестве альтернативы повышению значения рН смеси, содержащей мышцы животных и воду, мышцы животных могут сначала быть получены, а затем смешаны с водным раствором, имеющим значение рН достаточно щелочное для солюбилизации по меньшей мере части животного белка.
Настоящее изобретение имеет несколько преимуществ. Способы согласно изобретению позволяют инактивировать или понижать окислительный потенциал гемоглобина, а также минимизировать гидролиз миозина, главного компонента мышц животных. Кроме того, необязательные особенности настоящего изобретения позволяют удалить по существу все мембранные липиды, тем самым, дополнительно стабилизируя пищевой белок в отношении окисления. Таким образом, настоящее изобретение воплощает стратегию инактивирования оксидантов и удаления нежелательных субстратов для окисления, обе эти особенности помогают получить продукт пищевого белка, соответствующий коммерческим пищевым продуктам.
Способы, описываемые здесь, являются пригодными для обработки жирных мышечных тканей в качестве исходной композиции, что является типичным для дешевых исходных материалов, таких как те, которые можно найти в жирных видах рыбы или в мясе домашней птицы, освобожденном от костей механическим способом. Кроме того, эти способы являются пригодными для использования при выделении пищевого белка из постных мышц животных, таких как мясо белой рыбы (например, трески).
Способ согласно изобретению также обеспечивает увеличение выхода белка из мышц животных. С использованием способов согласно изобретению, как правило, из мышечной ткани может быть получено более чем около 70% масс. белка. В некоторых случаях выход белка может составлять больше 90% масс. Наряду с очевидной коммерческой выгодой при получении лучших выходов, улучшение выхода приводит к уменьшению количества белка в сточных водах во время промышленной обработки, так что уменьшается загрязнение окружающей среды.
Способы согласно изобретению не требуют свежих или постных мышц животных в качестве исходного материала. Любое повреждение (посторонние запахи или цвета), вызванное окисленными липидами, может быть удалено с использованием новых способов. Кроме того, могут быть использованы части животных, содержащие другие жирные ткани, такие как кожа, поскольку вредные липиды, а также сами части могут быть удалены. В случае переработки рыбы новые способы устраняют необходимость в разделке рыбы перед выделением белка, тем самым понижая стоимость переработки. Подобным же образом, путем удаления липидов, способы согласно изобретению понижают количество жирорастворимых токсинов (например, полихлорированных бифенилов или РСВ) в пищевом продукте.
Если не определено иначе, все технические и научные термины, используемые здесь, имеют такие же значения, какие обычно понимаются специалистом в области, к которой относится настоящее изобретение. Хотя пригодные для использования способы и материалы для осуществления или исследования настоящего изобретения описаны ниже, также могут быть использованы и другие способы и материалы, подобные или эквивалентные тем, которые описаны здесь и которые хорошо известны в данной области. Все публикации, заявки на патенты, патенты и другие ссылки, рассмотренные здесь, включаются в качестве ссылок во всей их полноте. В случае конфликта, настоящее описание, включая определения, будет иметь преимущество. Кроме того, материалы, способы и примеры являются только иллюстративными и не предназначены для ограничения.
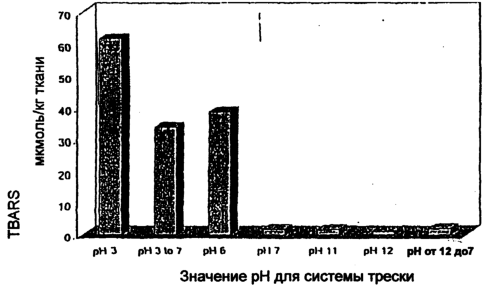
На чертеже представлена диаграмма количества реакционно-способных веществ тиобарбитуровой кислоты (TBARS) в мышцах трески при конкретных значениях рН. Столбик “рН 3-7” соответствует рН 3 в течение 1 часа после добавления гемолизата перед доведением значения рН до 7 и последующим хранением.
Подробное описание
Настоящее изобретение относится к новому способу выделения пищевого белка из мышц животных. Получаемый пищевой белок является относительно свободным от продуктов окисления, способен к формированию геля и может быть переработан в пищевые продукты для людей. Например, способы согласно изобретению могут быть использованы для производства сурими из жирной рыба, а также из более постной белой рыбы.
I. Выделение пищевого белка, не содержащего липидов
В целом, настоящее изобретение связано со способом выделения пищевого белка из мышц животных (например, мышц рыб или кур) путем получения сначала смеси, содержащей мышцы животных и воду, при этом, мышцы животных могут составлять менее чем примерно 15% (например, от 5% до 12%, или 10%) от массы смеси. Может быть использован любой водный растворитель, например, вода. Кроме того, мышцы могут быть промыты водным раствором перед любыми механическими манипуляциями. Мышцы могут быть по существу разбавлены в воде, так что суспензия/раствор солюбилизированного белка, производимый на последующих стадиях способа, имеет достаточно низкую вязкость, так что липиды или нерастворимый материал может быть удален путем центрифугирования. Более низкая вязкость может также способствовать удалению компонентов смеси с использованием способов, иных, чем центрифугирование, как описано здесь. Вязкость суспензии/раствора белка предпочтительно составляет около 75 мПа·сек или менее (например, около 35 мПа·сек или менее). Вязкость измеряют, например, с помощью вискозиметра Brookfield Model LVF (Brookfield Engineering, Stoughton, MA), используя шпиндель #3 или #4, при 60 об/мин. Затем прилагаемая производителем диаграмма преобразования используется для вычисления вязкости. Мышцы животных могут быть измельчены механически, гомогенизированы или нарезаны вручную.
После разбавления мышц животных водой или водным раствором, значение рН смеси затем повышают, например, до значения, превышающего 10,0 (например, от около 10,0 до 11,5, или около 10,5), так что солюбилизируется по меньшей мере 50%, например по меньшей мере 60, 70, 75, 80, 85 или 90% масс. животного белка. Альтернативно, водный раствор, содержащий достаточное количество основания для повышения значения рН смеси до значения более высокого, чем примерно 10,0 (например, от около 10,0 до 11,5 или около 10,5), может быть добавлен к мышцам животного для достижения такого же уровня солюбилизации.
Денатурация белка и гидролиз белка зависят от температуры и времени, проведенного в растворе, при этом увеличение температуры и времени, проведенного в растворе, способствует денатурации и гидролизу белка. Таким образом, желательно уменьшить температуру и время пребывания белка в растворе. В результате, способы согласно изобретению предпочтительно осуществляются при температуре от около 0°С до 10°С (например, 0°С, 1°С, 4°С или 6°С). Способы согласно изобретению также могут осуществляться с использованием замороженного исходного материала, например, замороженной мышечной ткани. Водная композиция также может содержать компоненты, такие как консерванты, которые защищают белки от деградации. Ионная сила раствора может быть подобрана таким образом, чтобы предотвратить преципитацию белка. Мышечная ткань также может быть гомогенизирована, например, измельчена на куски приблизительно 5 мм или меньше, для достижения быстрого экстрагирования при установлении значения рН, чтобы дополнительно помешать денатурации белков.
Для удаления мембранных липидов из солюбилизированного белка смесь можно центрифугировать (например, примерно от 5000×g до 10,000×g или выше), так, чтобы заряженные мембранные липиды отделить от водной фазы, которую собирают, например, путем декантирования водной фазы. После центрифугирования может образоваться несколько слоев. На самом дне осаждаются заряженные мембранные липиды и любые другие остатки. Массовый процент остатка может быть меньше 20% (например, меньше 10%), поскольку больший процент осадка указывает на то, что некоторая часть нужного белка удаляется вместе с нежелаемыми липидами. Массовый процент осадка определяется как масса осадка после центрифугирования, деленная на общую массу гомогената. Над осадком находится водный слой, содержащий солюбилизированный белок. В верхней части нейтральные липиды (жиры и масла), если они есть, всплывают над водным слоем. Нейтральные липиды могут быть удалены с помощью пипетки перед декантированием водной фазы. Могут также присутствовать промежуточные слои, в зависимости от источника мышц. Например, гель из захваченной воды, содержащей солюбилизованный белок, может образовываться между водным слоем и осадком. Этот гель может удерживаться вместе с водным слоем для увеличения выхода белка. Разумеется, в промышленных применениях водная фаза (и другие фазы, если это желательно) может быть удалена во время центрифугирования с использованием непрерывно-проточной центрифуги или другого устройства промышленного масштаба.
Для отделения мембранных липидов от водной фазы могут быть использованы и другие способы, наряду с центрифугированием. Например, специалисту в данной области доступно множество фильтровальных устройств, в зависимости от размера и объема материала, который должен быть разделен. В отсутствие агрегирующих агентов для мембранных липидов устройство для микрофильтрации является пригодным для разделения молекул, имеющих молекулярные массы в пределах от 500000 до 20 миллионов. Если липиды агрегируются, может быть пригодным для использования фильтрование частиц. Эти фильтровальные узлы, как правило, работают под давлением в диапазоне от 2 до 350 кПа. Кроме того, катионобменные мембраны (sc-1) и анионобменные мембраны (sa-1) являются пригодными для удаления мембранных липидов из смеси. Кроме того, для выделения или устранения мышечных белков конкретного размера могут быть использованы различные способы фильтрования.
В некоторых обстоятельствах может быть использован узел для ультрафильтрации HF-lab-5 (Romicon, Inc., Woburn, MA), с входным танком, содержащим погруженный охлаждающий змеевик для поддержания относительно постоянной температуры. Также может быть использован процесс с поперечным потоком, который имеет то преимущество, что осадок с фильтром непрерывно удаляется. Для извлечения воды или понижения содержания соли в смеси фильтрационные мембраны могут быть использованы вместе с электродиализом для вывода ионов из смеси. Для этой конкретной цели может быть использован пакетный узел (Stantech, Inc., Hamburg, Germany). Этот узел содержит несколько пар ячеек, заключенных между двумя электродными отделениями.
Удаление мембран также может быть облегчено, если подвергнуть смесь воздействию высокого давления, используя, например, устройство MPF 7000 (Mitsubishi Heavy Industries, Ltd.) или устройство High Pressure ACB 665 (Gee, Alsthom; Nantes, Frances). Обработка с помощью высокого давления, сопровождаемая соответствующей тепловой обработкой, имеет то дополнительное преимущество, что убивает известные патогены, в дополнение к отделению и агрегации мембранных липидов.
В дополнение к использованию высокого давления, к смеси также может быть добавлен агрегирующий агент для облегчения удаления мембранных липидов. Соответствующие полимерные агрегирующие агенты включают в себя карагенан, альгин, деметилированный пектин, аравийская камедь, хитозан, полиэтиленимин, спермин и спермидин. Другие агрегирующие агенты включают в себя соли, такие как соль кальция, соль магния, сульфат, фосфат и полиамин.
Затем значение рН водной фазы может быть понижено таким образом, чтобы солюбилизированные белки осаждались. Выход может составлять по меньшей мере 70% (например, по меньшей мере 90%) от массы всего исходного белка в смеси. Выход определяется как масса осажденного белка, разделенная на общую массу мышечного белка. В одном из воплощений, значение рН уменьшается до около 5,5 или меньше, для осаждения и сбора белка, например, путем центрифугирования. В другом воплощении, значение рН водной фазы понижают до значения, приблизительно меньше 4,0 (например, от около 2,5 до 3,5, или около 3,0), а затем увеличивают до значения примерно больше 5,0, для осаждения белка. Это дополнительное уменьшение рН может облегчить преципитацию саркоплазматических белков при более высоких значениях рН. Криопротекторы (например, дисахариды и/или многоатомные спирты, такие как полисорбатол) могут быть добавлены к осажденному белку для его консервации и защиты продукта во время заморозки и хранения.
Любая кислота, которая не вызывает нежелательного загрязнения конечного продукта, может быть использована для понижения значения рН центрифугируемой смеси. Например, пригодными для использования являются органические кислоты (например, яблочная кислота или винная кислота) или минеральные кислоты (например, хлористоводородная кислота или серная кислота). Лимонная кислота, которая имеет благоприятное значение рКа, может обеспечить буферную емкость при рН 3 и рН 5,5.
Кислоты, которые обладают значительной летучестью и придают нежелательные запахи, такие как уксусная кислота или масляная кислота, являются нежелательными. Подобным же образом, несколько оснований могут быть использованы для увеличения значения рН. Полифосфат является пригодным для использования, поскольку он также функционирует в качестве антиоксиданта и улучшает функциональные свойства мышечных белков.
Поскольку управление значением рН смеси часто может быть сложным, смесь может включать в себя буфер, который поддерживает целевое кислотное значение рН или целевое щелочное значение рН. Например, соединение, такое как цитрат, которое имеет значение рКа в диапазоне около 5,97, может быть добавлено к смеси, содержащей солюбилизированный белок, если солюбилизированный белок должен осаждаться при значении рН около 6,0 или ниже. В результате цитрат может действовать как “тормоз”, обеспечивая, чтобы значение рН смеси не переходило за пределы целевого значения рН. При заданном целевом рН выбор буфера осуществляется специалистом в области науки о пищевых продуктах. Буферы, пригодные для использования для целевых рН в пределах от 8,0 до 9,0, включают в себя глицин, аргинин, аспаргин, цистеин, карнозин, таурин, пирофосфат и ортофосфат. Буферы, пригодные для использования для целевых рН в пределах от 5,5 до 6,5, включают в себя гистидин, сукцинат, цитрат, пирофосфат и малонат. Буферы, пригодные для использования для целевых рН в пределах от 2,0 до 2,5, включают в себя аланин, глутаминовую кислоту, лимонную кислоту, молочную кислоту, фосфорную кислоту или пировиноградную кислоту.
Вместо понижения значения рН раствора осаждение белка может осуществляться путем добавления таких полимеров, как полисахариды, заряженные полимеры, морские гидроколлоиды, включая альгинаты или карагенан, или что-либо подобное, либо сами по себе, либо в сочетании с центрифугированием. Концентрация соли в водной фазе также может подбираться для облегчения осаждения.
В дополнение к этому, различные промывки, супернатанты и проточные фракции могут рециклироваться назад на более ранние стадии, для извлечения дополнительного белка с использованием рассматриваемых способов. Например, после осаждения солюбилизированного белка водную фракцию можно вводить в другую загрузку мышц животных, которые еще подлежат солюбилизации.
II. Использование пищевого белка, не содержащего липидов
Новые способы могут быть использованы в переработке для потребления людьми материалов, которые в настоящее время не используются в качестве пищевых продуктов для человека, из-за их нестабильности и неблагоприятных сенсорных качеств. Некоторые виды рыбы малого размера, такие как сельдь, макрель, американская сельдь, мойва, анчоусы или сардины, либо используются недостаточно, либо используются не для человека. Приблизительно половина всей рыбы, вылавливаемой в мире в настоящее время, не используется в пищу человеку. Новые способы дают возможность лучшего использования доступных источников пищевых продуктов. Рассматриваемые способы могут использовать как белую, так и темную рыбу, а также кур и другие материалы. Качество нежирных мышц животных (например, трески) может быть улучшено, с точки зрения выхода, путем использования способов согласно изобретению. Способы согласно изобретению приводят к получению изолятов белка, которые способны образовывать гели, например, гели из куриного мяса, освобожденного от костей механическим способом, которые являются более прочными, чем гели, изготовленные из материалов, не обработанных способами согласно изобретению. Кроме того, эти гели имеют меньше жира и повышенную способность к связыванию воды, по сравнению с гелями, изготовленными из необработанных материалов. Кроме того, изоляты белка, полученные с помощью способов согласно изобретению, могут быть использованы в качестве функционального ингредиента для замены частей белка, например, мяса, в различных пищевых продуктах, таких как сосиски.
III. Источники мышц животных
Способ согласно изобретению может быть использован для обработки мяса, которое извлекается из рыбы после того, как удаляется филе. Этот материал, как правило, не используется в пищу человеку. Подобным же образом, существует очень мало применений для куриных скелетов после удаления частей для продажи в розницу. Способы согласно изобретению позволяют обрабатывать такие части кур и рыбы для получения пищевого белка, пригодного для потребления человеком. Другие недостаточно используемые источники мышц, пригодные для использования в способах согласно изобретению, включают в себя антарктический криль, который является доступным в больших количествах, но который трудно превратить в пищевые продукты для человека из-за его малого размера.
Примеры исходных источников мышц животных, пригодных для использования в способах согласно изобретению, включают в себя филе рыбы, обезглавленную и потрошеную рыбу, ракообразных (например, криль), моллюсков (например, кальмар), кур и другую домашнюю птицу (например, индейку), говядину, свинину или баранину.
Настоящее изобретение будет далее описываться в следующих примерах, которые не ограничивают рамки настоящего изобретения, определяемые формулой изобретения.
ПРИМЕРЫ
Пример 1: Титрование рН для оптимальной солюбилизации белка
Приготовление рыбы. Атлантическая треска превосходного качества поступает от местных переработчиков рыбы. Мышцы трески тщательно разделываются, измельчаются на куски в 1/8 дюйма, смешиваются с девятью частями холодной (6°С) деионизованной, дистиллированной воды на каждую часть мышц и гомогенизируются в устройстве Polytron® PCU 1 (Brinkman Instruments, Westbury, NY) со скоростью 76 в течение 1 минуты.
Щелочная солюбилизация. Значение рН гомогената трески составляет 6,85. Одномолярный раствор NaOH добавляют к гомогенату до тех пор, пока значение рН гомогената не достигнет конкретных щелочных уровней в пределах от 9,04 до 11,50. Вязкость растворов при 4-6°С, при конкретных значениях рН, измеряют с помощью вискозиметра Brookfield Model LVF® (Brookfield Engineering, Stoughton, MA), с использованием шпинделя #3 или #4 при 60 об/мин. Поставляемая производителем диаграмма преобразования используется для вычисления вязкости. Затем смесь центрифугируют при 9300 об/мин в роторе №35 (10,000×g) в течение 60 мин, используя ультрацентрифугу L5-65B®, с образованием верхнего слоя эмульсифицированного масла, среднего водного слоя, содержащего солюбилизованный белок, и осадка из мембран. В некоторых случаях, когда используется постная белая рыба, слой эмульсифицированного масла может и не присутствовать. Водный слой собирают путем удаления масла с помощью пипетки, а затем декантирования водного раствора. Результаты по вязкости и растворимости представлены в таблице 1.
| ТАБЛИЦА 1 |
| рн |
Вязкость (мПа·сек) |
% растворимости белка |
% масс. осадка |
| 9,04 |
373,5 |
33,37 |
31,18 |
| 9,50 |
409,0 |
36,85 |
40,42 |
| 10,00 |
638,5 |
78,82 |
28,22 |
| 10,49 |
59,5 |
88,90 |
15,08 |
| 10,99 |
57,4 |
99,56 |
13,52 |
| 11,50 |
29,5 |
>99,9 |
4,95 |
| 6,85 |
222,5 |
– |
– |
Масса белка определяется путем использования реакции Biuret, как описано у Torten et al., J. Food Sci. 168:168-174,1963. Процент растворимости белка определяется как масса белка в водном слое, деленная на массу белка в исходном гомогенате. Массовый процент осадка представляет собой массу осадка после центрифугирования, деленную на общую массу гомогената. Высокие значения массы осадка указывают на наличие белка, удаляемого вместе с мембранными липидами. Нижняя строчка в таблице 1 соответствует гомогенату перед установлением рН с помощью 1М NaOH.
Таблица 1 показывает, что растворимость белка, превышающая 70%, осуществляется при значениях рН, превышающих 10,0, вязкость падает ниже 75 мПа·сек при значениях рН в пределах между 10,0 и 10,5 и выше, и массовый процент осадка падает ниже 15%, при значении рН около 10,5 или выше. Данные в таблице 1 показывают, что эффективная растворимость белка (>70%) осуществляется при значениях рН, примерно больших, чем 10,5. Когда вязкость падает ниже 75 мПа·сек и когда значение рН примерно больше, чем 10,5, процент растворимости белка увеличивается более чем до 75%. Подобным же образом, массовый процент осадка понижается ниже 15%, когда значение рН возрастает выше чем 10,5. Если вязкость является слишком высокой, белок седиментирует вместе с мембраной и удаляется. Для удаления мембранных липидов путем центрифугирования, без удаления значительной части белка вместе с ними, как правило, требуется вязкость 75 мПа·сек или меньше. При значении рН 10, образец является очень вязким, с хорошей растворимостью белка. Однако с этим образцом было бы сложно работать в промышленных условиях. Массовые проценты осадка около 15% или ниже рассматриваются как приемлемые. Таким образом, хотя значение рН около 10,0 и может быть использовано, более высокие значения рН, достигающие и превышающие 10,5, представляют больший коммерческий интерес.
Пример 2: Производство сурими из трески и макрели
Треску приготавливают, как описывается выше в примере 1. Атлантическую макрель также получают от местных переработчиков рыбы и обрабатывают, как описывается в примере 1. Макрель имеет качество сорта II, согласно оценки способом, описанным у Kelleher et al., J. Food. Sci. 57:1103-1108 и 1119, 1992. Смеси доводят до значения рН 10,5 для солюбилизации белка. Затем смеси центрифугируют, и водный слой собирают, как описывается в примере 1.
Одномолярный раствор НСl добавляют к водному раствору белка до тех пор, пока не будет получено значение рН 5,5. Преципитированный белок собирают путем центрифугирования при 15000 об/мин (34600×g) в роторе №19 в течение 20 минут, в ультрацентрифуге Beckman® L5-65B. Супернатант декантируют. Раствор криопротектора, содержащий 4% сахарозы, 4% сорбита и 1,2% натрийтриполифосфата, добавляют к белковому осадку. Смесь формируют в виде сурими путем измельчения в течение 30 секунд с использованием измельчающего устройства модели Oskar® (Sunbeam-Oster, Hattiesburg, MS) в малой морозильной камере. Сурими упаковывают в полиэтиленовые мешки Whirl-pak7® и замораживают при -40°С по меньшей мере в течение 12 часов.
Замороженные сурими размораживают в малой холодильной камере (4°С) в течение 30 минут перед измельчением в течение 2 минут в измельчающем устройстве Oskar®. Во время измельчения добавляют NaCl до 3% (масс/масс) от всей сурими. Измельченную пасту набивают в трубки из нержавеющей стали (19 мм диаметр × 175 мм) и готовят при 90°С в течение 20 минут. Приготовленные сурими выкладывают на 20 минут на лед перед выгрузкой из трубок и выдерживают в течение 24 часов при 6°С. Физические свойства готового пищевого продукта представлены в таблице 2. Значения прочности и смещения геля определяют с использованием 5 мм зонда из нержавеющей стали, прикрепленного к Instron® Model 1000 Universal Materials Testing Instrument (Instron Corp., Canton, MA), снабженного 5 кг загрузочной ячейкой со скоростью поперечного перемещения 100 мм/мин. Значения измеряются и вычисляются, как описано у Lanier, “Measurement of Surimi Composition and Functional Properties” In: Surimi Technology (Lanier et al., eds.), pp 123-163, Marcel Dekker, Inc., New York, 1992.
| ТАБЛИЦА 2 |
| Источник мышц |
Деформация |
Напряжение (кПа) |
| Треска |
2,21±0,10 |
128,13±7,33 |
| Макрель |
1,95±0,08 |
91,2±0,00 |
Для трески значения представляют собой среднее значение и среднеквадратичное отклонение из трех приготовленных трубок от одного образца геля. Для макрели значения представляют собой среднее значение и среднеквадратичное отклонение для двух приготовленных трубок из одного образца геля.
Все гели хорошего качества. Как правило, значения деформации (упругий компонент) большие, чем 1,9-2,0, оцениваются как относящиеся к гелям класса А. Значения напряжений (компонент твердости), обнаруженные во всех гелях, являются превосходными, при этом большинство коммерчески доступных гелей имеют по меньшей мере около 30-35 кПа.
Пример 3: Производство изолятов белка из светлых мышц сельди
Приготовление рыбы. Свежую сельдь получают от D&B Bait, Gloucester, MA, и транспортируют на льду на морскую базу Университета в Массачусетсе (время перевозки приблизительно составляет 15 мин). По прибытии в лабораторию рыбу оценивают визуально и разделяют на четыре класса: окоченелую, класса I, II и III (Kelleher et al., J. Food. Sci. 57:1103-1108 и 1119, 1992). Время после смерти, как правило, составляет 6-36 часов. Белые мышцы иссекаются вручную и пропускаются через пластину с 3 мм отверстиями, с использованием кухонной мясорубки (Kitchen Aid Inc., St. Joseph, MI, USA).
Выделение белка. Измельченные мышцы (120-300 г) гомогенизируют в течение 1 минуты (скорость 50 [об/мин] при 120 в) вместе с 9 объемами охлажденной на льду дистиллированной воды, с использованием Kinematica Gmb H Polytron (Westbury, NY, USA), соединенного с автотрансформатором с измененным выходным напряжением (Dayton, Ohio USA). Белки в гомогенате солюбилизируются путем добавления по каплям 2 н NaOH до достижения рН 10,8. Суспензию белка центрифугируют 15 минут (20 минут) при 18000×g, что приводит к образованию четырех фаз: всплывающего “эмульсионного слоя”, прозрачного супернатанта, мягкого гелеобразного осадка и чуть более твердого осадка на дне. Супернатант отделяют от “эмульсионного слоя” путем фильтрования этих двух фаз через двойную марлю для отцеживания творога. Растворимые белки осаждают путем доведения рН до значений в пределах между рН 4,8 и 7, например, 5,5, с использованием 2 н НСl. Преципитированные белки собирают путем второго центрифугирования при 10000×g.
Производство сурими. Избыток воды в преципитатах белка, полученных с помощью щелочи, отжимается вручную или удаляется с помощью центрифугирования (20 минут, 18000×g). Это снижает содержание влаги (Me) в преципитатах, полученных с помощью щелочи, от 88±1% до 72±3% (n=7). Оба преципитата затем доводятся до Мс 80% с помощью дистиллированной воды и перемешиваются вместе со смесью криопротекторов (4% сахарозы, 4% сорбита, 0,3% натрий триполифосфата). Конечное значение Мс составляет 73,2±0,5%. Сурими замораживают в пластиковых мешках при 80°С.
Производство гелей из сурими. Гели приготавливают, как описано у Kelleher & Hultin, (Kelleher & Hultin, Functional Chiken muscle protein isolates prepared using low ionic strength and acid solubilization/precipitation. In Meat Science in новые Millennium, Procedings from the 53rd annual reciprocal meat conference. The Ohio State University, June 18-21, pp 76-81 (2000)), с тем исключением, что значение рН сурими доводят до 7,1-7,2 с помощью 10% NaOH или 10% НСl после измельчения в 2% NaCl. Сурими упаковывают либо в казеин из целлюлозы (The Sausage Maker Inc., Buffalo, NY) или в 19 мм металлические трубки, в зависимости от того, какой тип измерений геля будет осуществляться.
Качество гелей. Деформация и напряжение (при структурном разрушении) анализируются с использованием торсионной методики Wu et al., J. Тех. Studies, 16: 53-74 (1985) либо с помощью гелеметра модели Rheo Тех АР-83 (Sun Sciences Co. Seattle, WA, USA). Последний измеряет деформацию (мм) и максимальную силу (г), необходимую для проникновения через 2,5 см срезы гелей. Гели также подвергаются исследованию на складывание, описанному Kudo et al. (1973), путем складывания 3 мм пластинки геля один или два раза. Цветовые числа по Hunter, “L”, “а” и “b” измеряют
на гелях, согласно Kelleher и Hultin. Выше.
В таблице 3 приведены данные по приготовлению сурими и гелей сурими с помощью щелочи, с использованием свежих светлых мышц сельди и светлых мышц сельди, состариваемой 6 дней на льду, которые обрабатываются одним и тем же способом. Смесь криопротекторов состоит из 4% сорбита, 4% сахарозы и 0,3% натрий триполифосфата. Гели содержат 2% NaCl и формируются при 90°С в течение 30 минут. Усилие разрыва и деформация измеряются с помощью Rheotex АР-83 (Sun Science Co. Ltd, Nichimo International Inc, Seattle, WA, USA). Значения в пределах одной и той же строки, содержащие различные числа, являются значимо различными (р 0,05). Данные показывают, что сурими и гели сурими хорошего качества могут быть приготовлены как из свежей, так и из состаренной сельди, с использованием способов согласно изобретению. 0,05). Данные показывают, что сурими и гели сурими хорошего качества могут быть приготовлены как из свежей, так и из состаренной сельди, с использованием способов согласно изобретению.
| ТАБЛИЦА 3 |
| Характеристики сырого материала/сурими |
Свежая сельдь рН 10,8 |
Состаренная сельдь рН 10,8 |
| Содержание влажности (Мс) в мышцах (%) |
79,6 |
80,6 |
| Содержание липидов в мышцах (% масс) |
11,1 |
8,8 |
| TBARS в мышцах (мкмоль ТВА/кг) |
5 |
28 |
| Мс осажденного белка (%) |
87,3 |
87,7 |
| Мс в обезвоженном осажденном белке (%) |
74,4 |
74,5 |
| Мс в сурими с криопротекторами |
72,5 |
73,1 |
| рН в сурими с криопротекторами |
6,87 |
6,42 |
| рН перед гелеобразованием |
7,15 |
7,11 |
| Мс в конечном геле сурими (%) |
70,7 |
69,9 |
| Характеристики геля |
|
|
| Исследование на сгибание |
5 |
3 |
| Усилие разрыва (г) |
871±62 |
464±11 |
| Деформация (мм) |
9,2±0,7 |
6,2±0,3 |
В таблице 4 приведены данные по приготовлению сурими и гелей сурими из светлых мышц свежей сельди с использованием щелочи.
Смесь криопротекторов состоит из 4% сорбита, 4% сахарозы и 0,3% натрий триполифосфата. Гели содержат 2% NaCl и формируются при 90°С в течение 30 минут. Напряжение и деформация измеряются с использованием торсионной методики (Wu et al., J. Тех. Studies 16: 53-64 (1985)) с использованием Brookfield Digital viscometer (Model DV-II, Brookfield engineering Inc. Stoughton, MA, USA). Результаты выражены как среднее значение ± стандартное отклонение (n=4). Цвет измеряют с помощью колориметра Hunter LabScan II (Hunter Associates Laboratories, Reston, VA). Измерение цвета выражено в виде средних значений ± стандартное отклонение (n=5). Белизна вычисляется согласно следующей офрмуле: 100-((100-L)2+a2+b2)0,5 (Lanier, “Measurement of Surimi Composition and Functional Properties” In: Surimi Technology (Lanier et al., eds.), pp 123-163, Marcel Dekker, Inc., New York, 1992) с использованием средних значений L, а и b (смотри Kelleher и Hultin (2000), выше).
| ТАБЛИЦА 4 |
| Характеристики сырого материала/сурими |
рН 10,8 |
| Мс в мышцах (%) |
80 |
| Содержание липида в мышцах (% масс) |
11,3 |
| Мс в осажденном белке (%) |
87,5 |
| Мс в обезвоженном осажденном белке (%) |
72,8 |
| Мс сурими с криопротекторами (%) |
73,6 |
| рН сурими с криопротекторами |
6,0 |
| рН до гелеобразования |
7,1 |
| Характеристики геля |
|
| Мс в конечном геле сурими (%) |
74,1 |
| Исследование на сгибание |
5 |
| Напряжение (кПа) |
56,1+2,4 |
| Деформация |
1,6+0,1 |
| G |
35,4+2,1 |
| L |
66,5+0,3 |
| а |
-2,4+0,4 |
| b |
8,1+0,9 |
| Белизна |
65,5 |
Пример 4: Производство изолятов белка из мяса кур
механически отделенного от костей (MSDC)
Изолят белка приготавливают из MSDC с помощью щелочного способа, подобного тому, который описан в примере 3. Изолят белков собирают при рН 5,5. Затем изоляты белков разделяют на две загрузки, и к каждой загрузке добавляют 2,5% NaCl. Значение рН одного образца доводят до 6,0, а другого образца доводят до рН 7,0. Затем материал набивают в формы и нагревают на водяной бане в течение 30 минут при 90°С. Затем материал удаляют, охлаждают на ледяной бане и хранят в течение ночи перед исследованием в холодильнике. Гели также приготавливают непосредственнно из MSDC в качестве контроля.
Характеристики гелеобразования изолята белка (приготовленного в соответствии со способом согласно изобретению) и исходного MSDC сравнивают. Результаты приведены в таблице 5.
| ТАБЛИЦА 5 |
| |
Изолят белка рН6,0 |
Изолят белка рН7.0 |
MSDC |
| Исходный % липидов (по отношению к сухому) |
– |
– |
52,2 |
| % липидов (по отношению к сухому) |
9,1 |
9,5 |
41,7 |
| рН |
6,18 |
7,03 |
6,66 |
| % воды |
78 |
79 |
64 |
| Значение L |
54 |
52 |
48 |
| Торсионное исследование |
|
|
|
| Напряжение (кПа) |
78 |
– |
44 |
| Деформация |
1,45 |
– |
1,45 |
| Прокалывание, прочность геля, г·см |
|
|
|
| Меньше нагреваa |
677 |
463 |
395 |
| Больше нагреваa |
842 |
517 |
255 |
аПодвергается действию температуры приготовления в течение более короткого или более длинного периода времени, в зависимости от локализации в образце.
Изоляты белка, приготовленного в соответствии со cпособом согласно изобретению, демонстрируют улучшение в отношении связывания воды и прочности геля. Постная часть изолята белка, приготовленная при рН 6, имеет на 28% больше воды (и на 21,1% большую массу), чем постная часть MSDC. Изоляты белка также имеют более низкое содержание липидов, чем MSDC.
Пример 5: Использование изолята белка в качестве функционального ингредиента и влияние различных способов измельчения на качество геля
Исследуется эффект использования изолята белка, приготовленного с помощью способов согласно изобретению, в качестве ингредиента пищевых продуктов. Конкретно, изоляты белка, абстрагированные с помощью щелочи, заменяют мышцы куриных грудок в венских сосисках, приготовленных из мышц куриных грудок. Кроме того, исследуется воздействие различных способов измельчения на качество геля.
Приготовление изолята белка. 4800 мл воды добавляют к 600 г MSDC (1:8 масс/объем). Смесь гомогенизируют с помощью Polytron в течение 2 минут, и удаляют жир из верхней части смеси. Значение рН доводят до 10,5. Смесь центрифугируют при 10000×g в течение 30 минут. Нейтральный жир из верхней части смеси и нерастворимую фракцию в осадке (которая содержит в основном коллаген и остатки костей) удаляют.
Супернатант пропускают через двойной слой марли для процеживания творога, для удерживания глобул жира, и значение рН доводят до 5,5, для преципитации белка. Затем смесь дважды центрифугируют при 10000×g в течение 30 минут. Осадок центрифугируют снова при той же скорости в течение 30 минут для дальнейшего понижения содержания влаги.
Приготовление венских сосисок. Венские сосиски, содержащие 0%, 25% и 50% изолята белка (PI), приготавливают в соответствии с формулами, представленными в таблице 6.
| ТАБЛИЦА 6 |
| Ингредиенты |
Контроль 100% СВМ |
25% PI Замещение |
50% PI Замещение |
| СВМ |
124,13 |
93,09 |
62,06 |
| PI |
0,00 |
31,03 |
62,06 |
| Лед |
12,41 |
12,41 |
12,41 |
| Соль |
2,89 |
2,89 |
2,89 |
| STP |
0,49 |
0,49 |
0,49 |
| Нитрит Na |
0,02 |
0,02 |
0,02 |
| Erythobate |
0,07 |
0,07 |
0,07 |
| Жир (свиной, 30%) |
60,00 |
60,00 |
60,00 |
Способы измельчения. Используемыми способами измельчения являются следующие: способ (а): смесь, содержащая все ингредиенты, измельчается в течение 2,5 минут; способ (b): смесь, содержащая все ингредиенты, за исключением жира, измельчается в течение 1 минуты, затем следует добавление жира и дополнительное измельчение (1,5 минут); способ (с): смесь, содержащая все ингредиенты, за исключением жира и изолята белка, измельчается в течение 1 минуты, затем следует добавление жира и дополнительное измельчение (0,5 минут), затем следует добавление изолята белка и дополнительное измельчение (1 минута). Перемешивание вручную осуществляется через каждые 30 секунд измельчения, при температуре меньшей, чем 18°С. Результаты изображены в таблицах 7-10.
| ТАБЛИЦА 7 |
| Процент потерь воды после приготовления и охлаждения |
| Белковая композиция |
Способ измельчения |
% общих потерь жира |
% общих потерь воды |
| 100% СВМ |
а |
Не наблюдается |
3,8±0,6 |
| 75% СВМ + 25% РI |
а |
Не наблюдается |
4,5±0,7 |
| 75% СВМ + 25% PI |
b |
Не наблюдается |
4,3±0,4 |
| 75% СВМ + 25% PI |
с |
Не наблюдается |
4,5±0,3 |
| 50% СВМ + 50% PI |
а |
Не наблюдается |
7,5±0,6 |
| ТАБЛИЦА 8 |
| Значения рН получаемого геля |
| Белковая композиция |
рН |
| 100% СВМ |
6,27 |
| 75% СВМ + 25% PI |
6,21 |
| 75% СВМ + 25% PI |
6,19 |
| 75% СВМ + 25% PI |
6,20 |
| 50% СВМ + 50% PI |
6,18 |
| ТАБЛИЦА 9 |
| Торсионное исследование |
| Белковая композиция |
Напряжение |
Деформация |
| 100% СВМ |
81,1±4,9 |
1,68±0,02 |
| 75% СВМ + 25% PI |
80,8±3,8 |
1,66±0,06 |
| 75% СВМ + 25% PI |
97,5±10,7 |
1,78±1,72 |
| 75% СВМ + 25% PI |
88,9±8,9 |
1,72±0,11 |
| 50% СВМ + 50% PI |
76,22±9,9 |
1,46±0,11 |
| ТАБЛИЦА 10 |
| Сравнение цветов |
| Белковая композиция |
L |
а |
b |
| 100% СВМ |
78,44±0,45 |
4,7±0,68 |
10,43±0,64 |
| 75% СВМ + 25% РI |
73,22±0,48 |
7,47±0,19 |
10,48±0,05 |
| 75% СВМ + 25% PI |
73,72±0,35 |
7,43±0,17 |
10,59±0,17 |
| 75% СВМ + 25% PI |
71,64±0,88 |
8,28±0,18 |
10,61±0,18 |
| 50% СВМ + 50% PI |
70,03±0,54 |
7,29±0,14 |
10,16±0,10 |
Наблюдается, что по меньшей мере 25% мышц куриных грудок может быть заменено изолятом белка без каких-либо значительных потерь в функциональных характеристиках, за исключением цвета.
Пример 6: Щелочная обработка мышц животных предотвращает окисление путем инактивации дезоксигемоглобина
Чтобы определить, ведет ли щелочная солюбилизация белка из мышц животных к преимуществам, незаивисмо от возникновения возможности для удаления мембранных липидов, промытые мышцы трески приготавливают, таким образом, как описано у Richards et al, J. Agric. Food Chem. 48:3141-3147, 2000. Затем гемолизат форели добавляют к промытым образцам трески для достижения концентрации гемоглобина 6 мкмоль/кг. Затем образцы хранятся при 5°С в течение 15 часов после установления значения рН, стабильного для данного образца. По окончании инкубации, реакционноспособные вещества тиобарбитуровой кислоты (TBARS), суррогат продуктов окисления, количественно определяются, как описано у Richards et al., выше. Результаты представлены на чертеже и указывают на то, что гемоглобин-зависимое окисление уменьшается или устраняется при значениях рН около 7 или выше. При значениях рН меньших, чем 7, наблюдается значительное окисление. Как правило, значение TBAR, большее чем 20 мкмоль/кг, указывает на сильное окисление. Как описано у Richards et al., выше, это уменьшение гемоглобин-зависимого окисления совпадает с уменьшением пропорции общего гемоглобина, который находится в форме дезоксигемоглобина. Таким образом, эти результаты свидетельствуют о том, что щелочная обработка мышц животных, в частности, красных мышц животных, предотвращает взаимодействие дезоксигемоглобина с биологическими молекулами в смеси мышц животных и их окисление, тем самым частично объясняя преимущества описываемого здесь изобретения.
Пример 7: Щелочная обработка мышц животных улучшает выход пищевого и гелеобразующего белка по меньшей мере по двум механизмам
Чтобы лучше понять механизм (механизмы) высоких показателей выхода белка и хорошего качества гелей, описываемых здесь, мышцы сельди приготавливают в хлористоводородной кислоте (рН 2,6), как описано у Kelleher et al., “Functional chicken muscle isolates prepared using low ionic strength, and solubilization/precipitation,” 53rd Ann. Reciprocal Meat Conf., June 18-21, 2000, Am. Meat Sci. Assoc., Savoy, II, pp.76-81. Такая же самая процедура используется для производства изолята белка в основании (рН 10,7), за исключением того, что в этом случае солюбилизация и инкубация проводятся при щелочных значениях рН с использованием гидроксида натрия. Образцы инкубируют на льду в течение около 165 минут, а затем загружают на гель из 4-20% додецилсульфата натрия – полиакриламида при стандартных восстанавливающих условиях. Электрофорез геля и окрашивание Coomassie Blue делает возможной визуализацию полосы белка миозина с тяжелой цепью при около 205 кДа. Заметим, что в мышцах сельди, инкубируемых при рН 2,6, обнаруживаются значительные разрывы тяжелой цепи миозина, в то время как никаких потерь тяжелой цепи миозина не детектируется в мышцах сельди, инкубируемых при рН 10,7. Предполагается, что щелочные условия ингибируют липосомные протеазы (например, катепсины), которые являются отвественными за гидролиз миозина при более кислотных значениях рН.
Во втором эксперименте приготавливают белок из мышц замороженной Аляскинской сайды, солюбилизируют его при различных условиях рН и преципитируют, как описано в примере 1. Массовый процент белка, извлекаемого после преципитации, составляет 22,7% при нейтральных рН, 66,1% при рН 11,0 и 58,5% при рН 3,0. Можно заметить, что белок, извлеченный из образца с рН 11,0, способен образовывать гель. Этот результат частично приводит к следующей гипотезе.
Рыба из семейства тресковых, такие как Аляскинская сайда, тихоокеанский хек и голубой мерланг, представляют собой важные виды рыбы, употребляемой в пищу, и используются для производства сурими. Когда тресковые виды заморены, фермент в их мясе, триметиламиноксиддеметилаза, разрушает триметиламиноксид в мясе до диметиламина и формальдегида. Производимый формальдегид, в свою очередь, вызывает денатурацию белка в мышцах, тем самым, делая его нерастворимым даже в щелочных условиях. Предполагается, что описанная щелочная обработка может солюбилизировать некоторые из модифицированных белков благодаря высокому отрицательному заряду на белках при этом значении рН. Возможно также, что щелочная обработка может изменить направление, по меньшей мере частично, реакции белков рыб с формальдегидом, тем самым делая белок рыб растворимым.
Результаты этого примера свидетельствует о том, что преимущества настоящего изобретения могут осуществляться с помощью более чем одного механизма.
Другие воплощения
Необходимо понять, что хотя настоящее изобретение описывается в рамках приведенного здесь подробного описания, приведенное выше описание предназначается для иллюстрации, а не ограничения рамок изобретения, которое определяется формулой изобретения. Другие аспекты, преимущества и модификации находятся в рамках следующей далее формулы изобретения.
Формула изобретения
1. Способ выделения пищевого белка из мышцы животного, включающий в себя получение смеси, содержащей мышцу животного и воду, увеличение значения рН смеси до уровня, достаточного для солюбилизации по меньшей мере части нерастворимого животного белка в смеси, удаление по меньшей мере около 50 мас.% всех мембранных липидов из смеси, преципитацию солюбилизпрованного белка из смеси мышечных белков животного, сбор преципитированного белка и, тем самым, выделение пищевого белка из мышцы животного.
2. Способ по п.1, где собранный преципитированный белок способен образовывать пищевой гель.
3. Способ по п.1, дополнительно включающий в себя образование пищевого геля из собранного преципитированного белка.
4. Способ по п.1, где мышца животного содержит около 15 мас.% или менее от смеси до повышения значения рН смеси.
5. Способ по п.1, где мышца животного содержит около 10 мас.% или менее от смеси до повышения значения рН смеси.
6. Способ по п.1, где значение рН смеси повышают примерно до 10,0 или выше.
7. Способ по п.1, где значение рН смеси повышают примерно до 10,5 или выше.
8. Способ по п.1, где значение рН смеси повышают путем добавления полифосфата к смеси.
9. Способ по п.1, где по меньшей мере около 70 мас.% общего количества мембранных липидов удаляют из смеси.
10. Способ по п.1, где по меньшей мере около 90 мас.% общего количества мембранных липидов удаляют из смеси.
11. Способ по п.1, где мембранные липиды удаляют путем центрифугирования смеси.
12. Способ по п.11, где смесь центрифугируют примерно при 5000×g или выше.
13. Способ по п.11, где смесь центрифугируют примерно при 7000×g или выше.
14. Способ по п.11, где смесь центрифугируют примерно при 10,000×g или выше.
15. Способ по п.1, где мембранные липиды удаляют путем фильтрования.
16. Способ по п.1, где мембранные липиды удаляют путем добавления к смеси агрегирующего агента.
17. Способ по п.16, где агрегирующий агент представляет собой полимер.
18. Способ по п.16, где агрегирующий агент представляет собой катионный полимер.
19. Способ по п.16, где агрегирующий агент представляет собой анионный полимер.
20. Способ по п.16, где агрегирующий агент выбран из группы, состоящей из карагенана, альгина, деметилированного пектина, аравийской камеди, хитозана, полиэтиленимина, спермина и спермидина.
21. Способ по п.16, где агрегирующий агент представляет собой соль.
22. Способ по п.21, где соль выбрана из группы, состоящей из соли кальция, соли магния, сульфата, фосфата и полиамина.
23. Способ по п.1, где солюбилизпрованный белок преципитирует в результате понижения значения рН смеси.
24. Способ по п.23, где значение рН смеси понижают примерно до 5,5 или ниже.
25. Способ по п.23, где значение рН смеси понижают примерно до 4,0 или ниже, а затем повышают примерно до 5,0 или выше.
26. Способ по п.23, дополнительно включающий в себя добавление к смеси буфера до преципитации солюбилизованного белка.
27. Способ по п.26, где буфер выбран из группы, состоящей из гистидина, сукцината, цитрата, пирофосфата, малоната, аланина, глутаминовой кислоты, лимонной кислоты, молочной кислоты, фосфорной кислоты и пировиноградной кислоты.
28. Способ по п.1, где преципитированный белок собирают путем центрифугирования.
29. Способ по п.1, где солюбилизпрованный белок преципитирует в результате добавления к смеси агрегирующего агента после удаления мембранных липидов.
30. Способ по п.29, где агрегирующий агент представляет собой полиамин.
31. Способ по п.1, где смесь содержит буфер до повышения значения рН смеси.
32. Способ по п.31, где буфер выбран из группы, состоящей из глицина, аргинина, аспарагина, цистеина, дипептида карнозина, таурина, пирофосфата и ортофосфата.
33. Способ по п.1, где смесь содержит хелатирующий железо агент.
34. Способ по п.33, где хелатирующий железо агент выбран из группы, состоящей из этилендиаминтетрауксусной кислоты, диэтилентриаминпентауксусной кислоты, карнозина, ансерина, мочевой кислоты, лимонной кислоты, фосфата, полифосфата, ферритина и трансферрина.
35. Способ по п.1, дополнительно включающий в себя промывку мышцы животного водным раствором до повышения значения рН смеси.
36. Способ по п.1, дополнительно включающий в себя удаление нерастворимого материала из смеси до преципитации солюбилизпрованного белка.
37. Способ по п.36, где нерастворимый материал удаляют путем центрифугирования при около 4000×g или ниже.
38. Способ по п.1, где мышца животного представляет собой мышцу рыб.
39. Способ по п.1, где мышца животного представляет собой мышцу кур.
40. Способ выделения пищевого белка из мышцы животного, включающий в себя получение смеси, содержащей мышцу животного и воду; увеличение значения рН смеси до уровня, достаточного для солюбилизации по меньшей мере части нерастворимого животного белка из смеси мышечных белков животного, преципитацию солюбилизированного белка из смеси мышечных белков животного, сбор преципитированного белка и, тем самым, выделение пищевого белка из мышцы животных, при этом на каждой стадии способа температура смеси поддерживается при 15°С или ниже, и обеспечивается выход собранного преципитированного белка, по меньшей мере составляющий около 70 мас.% от общего количества мышечного белка животного, содержащегося в смеси до повышения значения рН.
41. Способ по п.40, где собранный преципитированный белок способен образовывать пищевой гель.
42. Способ по п.40, дополнительно включающий в себя образование пищевого геля из собранного преципитированного белка.
43. Способ по п.40, где мышца животного содержит около 50 мас.% или менее от смеси до повышения значения рН смеси.
44. Способ по п.40, где мышца животного содержит около 30 мас.% или менее от смеси до повышения значения рН смеси.
45. Способ по п.40, где значение рН смеси повышают примерно до 10,0 или выше.
46. Способ по п.40, где значение рН смеси повышают примерно до 10,5 или выше.
47. Способ по п.40, где значение рН смеси повышают путем добавления полифосфата к смеси.
48. Способ по п.40, где солюбилизпрованный белок преципитирует в результате понижения значения рН смеси.
49. Способ по п.48, где значение рН смеси понижают примерно до 5,5 или ниже.
50. Способ по п.48, где значение рН смеси понижают примерно до 4,0 или ниже, а затем повышают примерно до 5,0 или выше.
51. Способ по п.48, дополнительно включающий в себя добавление к смеси буфера до преципитации солюбилизованного белка.
52. Способ по п.51, где буфер выбран из группы, состоящей из гистидина, сукцината, цитрата, пирофосфата, малоната, аланина, глутаминовой кислоты, лимонной кислоты, молочной кислоты, фосфорной кислоты и пировиноградной кислоты.
53. Способ по п.40, где преципитированный белок собирают путем центрифугирования.
54. Способ по п.40, дополнительно включающий в себя промывку мышцы животного водным раствором до повышения значения рН смеси.
55. Способ по п.40, дополнительно включающий в себя удаление нерастворимого материала из смеси до преципитации солюбилизпрованного белка.
56. Способ по п.55, где нерастворимый материал удаляют путем центрифугирования при около 4000×g или ниже.
57. Способ по п.40, дополнительно включающий в себя удаление мембранных липидов из смеси после повышения значения рН смеси.
58. Способ по п.57, где по меньшей мере около 50 мас.% от общего количества мембранных липидов, удаляются из смеси.
59. Способ по п.40, где мышца животного представляет собой мышцу рыб.
60. Способ по п.40, где мышца животного представляет собой мышцу кур.
61. Способ выделения пищевого белка из мышцы животного, включающий в себя получение мышцы животного; добавление водного раствора к мышце животного с образованием смеси, где значение рН водного раствора представляет собой значение рН, достаточно щелочное для солюбилизации по меньшей мере части белка из мышцы животного, содержащегося в смеси мышцы животного; удаление по меньшей мере около 50 мас.% от общего количества мембранных липидов из смеси; преципитацию солюбилизированного белка из смеси белков, содержащихся в смеси мышц животного; и сбор преципитированного белка и, тем самым, выделение пищевого белка из мышцы животного.
62. Способ выделения пищевого белка из мышцы животного, включающий в себя получение мышцы животного, добавление водного раствора к мышце животного с образованием смеси, где значение рН водного раствора представляет собой значение рН, достаточно щелочное для солюбилизации по меньшей мере части белка из мышцы животного, содержащегося в смеси мышцы животного, преципитацию солюбилизированного белка из смеси белков мышцы животного; и сбор преципитированного белка и, тем самым выделение пищевого белка из мышцы животного, при этом на каждой стадии способа температура смеси поддерживается на уровне 15°С или ниже, и выход собранного преципитированного белка составляет по меньшей мере около 70 мас.% от общего количества белка из мышцы животного в смеси до повышения значения рН.
РИСУНКИ
|
|