|
|
(21), (22) Заявка: 2003104673/15, 19.06.1998
(24) Дата начала отсчета срока действия патента:
19.06.1998
(30) Конвенционный приоритет:
20.06.1997 (пп.1-34) US 60/054,333
(43) Дата публикации заявки: 27.08.2004
(45) Опубликовано: 27.05.2005
(56) Список документов, цитированных в отчете о
поиске:
US 5445934 А, 29.08.1995. RU 2058032 С1, 10.04.1996. US 5384264 А, 24.01.1995. WO 9428418 А, 21.06.1988.
(62) Номер и дата подачи первоначальной заявки, из которой данная заявка выделена: 2000101318 19.06.1998
Адрес для переписки:
119034, Москва, Пречистенский пер., 14, стр.1, 4 этаж, “Гоулингз Интернэшнл Инк.”, В.Н.Дементьеву
|
(72) Автор(ы):
ХАТЧИНС Т. Уильям (US),
ЙИП Тай-Танг (US)
(73) Патентообладатель(и):
СИФЕРДЖЕН БИОСИСТЕМЗ, ИНК. (US)
|
(54) СПОСОБЫ РЕТЕНТАТНОЙ ХРОМАТОГРАФИИ ДЛЯ РАЗДЕЛЕНИЯ АНАЛИТОВ В ОБРАЗЦЕ
(57) Реферат:
Изобретение относится к биохимии и медицине и касается способа получения субстрата для обнаружения аналитов в образце путем обработки образца, по меньшей мере в двух условиях селективности, определяемых комбинацией адсорбента и элюанта, что дает возможность удержания аналита адсорбентом, идентификации путем десорбционной спектрометрии, при котором удерживается аналит и получение субстрата, содержащего по меньшей мере один адсорбент при идентифицированном условии селективности. А также способ диагностики с использованием заявленного субстрата. Изобретение обеспечивает повышение специфичности диагностики с использованием заявленного субстрата. 4 н. и 30 з.п. ф-лы, 33 ил.
Область, к которой относится изобретение
Настоящее изобретение относится к области сепарационных технологий и аналитической биохимиии.
Заявленные в настоящем изобретении способы могут иметь применение в биологии и медицине, включая анализ функции гена, дифференциальную экспрессию генов, обнаружение белков, клеточную и клиническую диагностику и скрининг новых лекарственных препаратов.
Функция клетки как нормальной, так и патологической, по меньшей мере частично зависит от экспрессируемых в клетке генов (т.е. функции гена). Экспрессия гена имеет как качественный, так и количественный аспекты. То есть клетки могут отличаться как набором конкретных экспрессируемых генов, так и относительным уровнем экспрессии одного и того же гена. Дифференциальная экспрессия генов может проявляться, например, в различной экспрессии белков, кодируемых геном, или в посттрансляционных модификациях экспрессированных белков. Например, белки могут быть модифицированы углеводными или фосфатными группами или претерпевать разрезание. Таким образом, на биохимическом уровне клетка представляет собой сложную смесь органических биомолекул.
Одной из целей функциональной геномики (“протеомики”) является индентификация и характеристика органических биомолекул, которые дифференциально экспрессируются в клетках различных типов. При сравнении экспрессии можно идентифицировать молекулы, которые могут быть ответственны за определенную патологическую активность клетки. Например, идентификация белка, экспрессирующегося в раковых клетках, но не в нормальных клетках, может оказаться полезной при диагностике и, в конечном счете, для подбора лекарственных препаратов и лечения патологии. По завершении программы Геном Человека все гены человека будут клонированы, секвенированы и информация о них будет сведена в базы данных. В этом “пост-геномном” мире способность идентифицировать дифференциально экспрессирующиеся белки приведет, в свою очередь, к идентификации генов, которые их кодируют. Таким образом, мощь генетики приведет к решению проблем функции клетки.
Дифференциальные химические анализы экспрессии генов и их функции требуют таких инструментов, которые могут разделять сложную смесь молекул в клетке, идентифицировать их и определять количественно, даже в том случае, когда они присутствуют в следовых количествах. Однако существующие для этих целей методы аналитической химии ограничены для каждой из перечисленных задач. Одним из популярных методов разделения биомолекул является электрофорез. Часто первое разделение белков изоэлектрическим фокусированием в геле сочетают со вторым разделением электрофорезом в полиакриламидном геле, содержащем додецил-сульфат натрия (ДСН-ПААГЕ). Результатом является карта, на которой белки разделены по изоэлектрической точке (суммарному заряду) и размеру (т.е. массе). Однако, будучи полезным, данный метод имеет несколько ограничений. Во-первых, этим методом можно получить информацию только о двух характеристиках биомолекулы – массе и изоэлектрической точке (“рI”). Во-вторых, разрешающая способность при каждом разделении ограничена разрешающей способностью геля. Например, часто трудно разделить молекулы, масса которых отличается менее чем на 5%, или изоэлектрическая точка отличается менее чем на 0.5 pI. В-третьих, нагрузка на гель ограничена и, соответственно, ограничена чувствительность; часто не удается обнаружить биомолекулы, экспрессируемые в малых количествах. В-четвертых, малые белки и пептиды с молекулярной массой менее 10-20 кД данным методом неразрешимы.
Другие аналитические методы могут преодолеть одно или несколько из перечисленных ограничений, но эффективно сочетать их достаточно затруднительно. Например, аналитической хроматографией можно разделять биомолекулы на основе разнообразия взаимодействий аналит/адсорбент, но многомерный анализ затруднен и требует много времени. Кроме того, данные методы имеют ограниченную чувствительность.
В клинической диагностике требуется специфически обнаруживать известные маркеры заболевания. Однако развитие таких диагностических подходов затруднено необходимостью получения реагентов, специфически связывающихся с маркерами или способных дискриминировать маркер в сложной смеси.
При разработке новых лекарственных препаратов необходимо быстро скринировать агенты, которые модулируют взаимодействия лиганд/рецептор. Часто лимитирующим этапом при таком скрининге является этап обнаружения взаимодействия лиганд/рецептор. Поэтому быстрые и специфичные методы идентификации события связывания будут обладать значительными преимуществами.
До недавнего времени процесс идентификации потенциального маркера или члена пары лиганд/рецептор с получением агента, специфически связывающегося с маркером или лигандом/рецептором, был весьма затруднен. Согласно одному из подходов, сравнивают нормальные и поврежденные (больные) ткани с тем, чтобы идентифицировать виды мРНК или экспрессируемые маркерные последовательности (“EST”), уровень которых повышен или понижен в поврежденной ткани. Эти виды РНК выделяют и получают кодируемые ими полипептиды при помощи рутинных методов рекомбинантных ДНК. Затем полипептиды выделяют и используют в качестве иммуногенов для получения специфичных относительно маркера антител. Антитела могут быть использованы, например, в ELISA для определения количества маркера во взятом от больного образце.
Данный процесс долог и утомителен. Для получения таких антител требуется от девяти месяцев до года, при этом не меньше времени требуется на разработку протоколов выделения такого количества полипептида, которое достаточно для иммунизации. Кроме того, метод основан на заключении, что различия в экспрессии РНК отражаются как различия в экспрессии белка. Однако это заключение не всегда справедливо. Поэтому методы, при помощи которых можно прямо обнаруживать дифференциально экспрессируемые белки и при помощи которых можно в значительно более короткое время получать специфические лиганды, будут обладать значительными преимуществами.
Таким образом, для аналитической биохимии, биологии и медицины необходимы способы и инструменты для разделения сложных смесей органических биомолекул, идентификации индивидуальных биомолекул в смеси и идентификации специфических молекулярных событий распознавания с участием одного или нескольких аналитов-мишеней.
Краткое описание изобретения
В настоящем изобретении описаны устройства и способы для ретентатной хроматографии. Ретентатная хроматография является комбинаторным методом высокоинформативного разделения аналитов в сложных смесях посредством применения способов многомерного разделения. Она обеспечивает надежное обнаружение аналита и функциональный анализ применимости для биологии и медицины, что достигается на основе единой интегрированной операционной системы для прямого обнаружения характера экспрессии аналита, связанного с функцией гена, функцией белка, функцией клетки и функцией организма в целом.
Более конкретно, аналиты могут быть разрешены в различных двухмерных форматах, при этом становится доступна многомерная информация. Сначала аналиты разделяют на основе их способности адсорбироваться на стационарную фазу при как минимум двух различных условиях селективности, таких как анион/катионный потенциал, гидрофобность/гидрофильность или специфическое биомолекулярное распознавание. Затем аналиты разделяют в другом измерении на основе их массы при помощи десорбционной спектрометрии (т.е. лазерной десорбционной масс-спектрометрии), которая дает возможность обнаружить разделенные аналиты. Природа адсорбента, на который сорбируются аналиты, дает информацию о физико-химических свойствах аналита.
Таким образом, в изобретении заявлен инструмент для молекулярного обнаружения и диагностики, сочетающий возможности как для параллельного, так и мультиплексного процессинга аналитов. Поскольку аналиты детектируются непосредственно, изобретение дает возможность одновременного переноса сигналов от двух и более независимых аналитов-мишеней от одной “ячейки” (т.е. предопределенной локализации чипа) в ходе одного операционного цикла.
Ретентатная хроматография отличается от обычной хроматографии по нескольким параметрам. Во-первых, в ретентатной хроматографии обнаруживаются аналиты, которые удержаны на адсорбенте. В методах обычной хроматографии аналиты элюируют с адсорбента до обнаружения. Для обычной хроматографии обнаружение аналита, который не элюирован с адсорбента, не является рутинным или обычным подходом. Таким образом, ретентатная хроматография дает прямую информацию о химических или структурных характеристиках удержанных аналитов. Во-вторых, сочетание адсорбционной хроматографии с обнаружением путем десорбционной спектрометрии обеспечивает крайне высокую чувствительность в фемтомолярном интервале и необычно тонкое разрешение. В-третьих, отчасти в силу прямого обнаружения аналитов ретентатная хроматография дает возможность быстрого анализа ретентатов (удержанных аналитов) во множестве различных условий селективности, обеспечивая тем самым быструю многомерную характеристику аналитов в образце. В-четвертых, адсорбенты могут быть присоединены к субстрату в ряду предопределенных локализаций. Это дает возможность параллельной обработки аналитов, нанесенных на различные пятна адсорбента (т.е. “сайты аффинности” или “пятна”) на матрице в различных условиях элюции.
Ретентатная хроматография имеет множество применений в биологии и медицине. К ним относятся комбинаторное биохимическое разделение и очистка аналитов, изучение дифференциальной экспрессии генов и молекулярных событий распознавания, диагностика и скрининг потенциальных лекарственных препаратов.
Одно из основных применений ретентатной хроматографии в качестве аналитического инструмента предусматривает приведение образца в контакт с комбинаторным набором различных сочетаний адсорбент/элюант и определение поведения аналита в различных условиях. Этим достигается очистка аналита и определение условий, нужных для обнаружения аналита в образце. Субстраты с идентифицированными таким образом адсорбентами могут служить в качестве специфических детекторов аналита или аналитов. При осуществлении метода последовательной экстракции образец приводят в контакт с первым сочетанием адсорбент/элюант и промывают, истощают аналиты, адсорбированные первым адсорбентом и приводят в контакт со вторым адсорбентом для истощения других аналитов. Условия селективности, в которых удерживаются аналиты, могут быть также использованы в процедурах препаративной очистки, когда неочищенный образец, содержащий аналит, последовательно приводят в контакт с адсорбентами, которые его удерживают, примеси удаляются, а удержанный аналит собирают с адсорбента для последующих циклов.
Один из аспектов изобретения состоит в том, что каждый класс или тип событий молекулярного распознавания (т.е. взаимодействие “адсорбент-мишень: аналит-мишень”) характеризуется конкретным условием селективности в пределах предопределенной локализации на матрице и детектируется непосредственно пока связанные молекулы еще локализованы (т.е. “удержаны”) в предопределенной локализации. Таким образом, селекция и обнаружение не требуют элюции, выделения, амплификации или мечения аналита-мишени.
Другой аспект настоящего изобретения состоит в том, что детекция одного или нескольких молекулярных событий распознавания в одной или нескольких предопределенных локализациях на матрице не требует удаления или использования больше, чем небольшой фракции всего адсорбента-аналита. Таким образом, неиспользованная порция может быть исследована далее в ходе одного или нескольких циклов “вторичного процессинга”, проводимых непосредственно in situ (т.е., в пределах предопределенной локализации) для целей выяснения структуры и функции, включая последующие сборку, дезинтеграцию, модификацию или амплификацию (прямые или непрямые).
В ходе интерактивного процесса, обозначаемого как “последовательное разрешение”, могут быть получены адсорбенты с повышенной специфичностью к аналиту. При этом адсорбенты или элюанты, для которых уже показана способность удерживать аналит, тестируют с дополнительными переменными для определения комбинаций с лучшими характеристиками связывания. Другой метод дает возможность быстрого создания субстратов с антительными адсорбентами, специфичными к аналиту. Метод предусматривает связывание аналита на адсорбенте и скрининг фаговой библиотеки для обнаружения фага, связывающего аналит.
Ретентатная хроматография имеет также применения в молекулярной и клеточной биологии. Аналиты, которые дифференциально представлены в двух образцах (напр., дифференциально экспрессируемые белки в двух клеточных экстрактах), могут быть идентифицированы путем приведения образцов в контакт сразнообразными сочетаниями адсорбент/элюант с последующим анализом десорбционной спектрометрией. При этом реализуется высокоинформативная разрешающая способность системы, которая недостижима в других системах разделения и обнаружения. Неизвестные белки-мишени можно идентифицировать путем определения физико-химических характеристик, включая молекулярную массу, на основе химических характеристик сочетания адсорбент/элюант. Полученная информация может применяться при скрининге баз данных для поиска белков с аналогичными профилями.
Методы сепарационной биохимии и адсорбенты, разработанные в соответствии с заявленными способами, применимы в диагностике. Более конкретно, могут быть разработаны как химические, так и биоспецифические адсорбенты для обнаружения важных диагностических маркеров. В отдельных вариантах осуществления изобретения субстрат может содержать матрицу пятен адсорбента, выбранных соответственно комбинации маркеров, диагностических для данного заболевания или синдрома.
Ретентатная хроматография полезна при скрининге потенциальных лекарственных препаратов. Один из членов пары рецептор/лиганд присоединяют к адсорбенту и его способность связывать партнера проверяется в присутствии агента. В силу быстроты, с которой может быть установлена адсорбция, можно легко тестировать комбинаторные библиотеки агентов на их способность модулировать взаимодействие.
В качестве одного из аспектов изобретения заявлен способ высокоинформативного разделения по меньшей мере одного аналита в образце. Данный способ представляет собой комбинаторный метод, включающий параллельное разделение и обнаружение множественных аналитов. Метод включает следующие этапы: а) обработка аналита по меньшей мере в двух условиях селективности, при этом каждое условие селективности определяется сочетанием адсорбента и элюанта, что делает возможным удержание аналита адсорбентом; и б) обнаружение аналита, удержанного в различных условиях селективности, при помощи десорбционной спектрометрии. Обнаружение аналита, удержанного в различных условиях селективности, обеспечивает высокоинформативное разделение аналита.
Согласно одному из вариантов осуществления изобретения каждое различное условие селективности определяют в различной предопределенной локализации для параллельного процессинга. Другой вариант предусматривает способ, включающий следующие этапы: i) обработка аналита при первом условии селективности в определенной локализации, что создает условия для удержания аналита адсорбентом; ii) обнаружение аналита, удержанного при первом условии селективности, десорбционной спектрометрией; iii) отмывка адсорбента при втором, отличающемся условии селективности в определенной локализации, что создает условия для удержания аналита адсорбентом; iv) обнаружение удержанного аналита десорбционной сектрометрией.
Согласно одному из вариантов осуществления изобретения аналит представляет собой органическую биомолекулу, мультимерный молекулярный комплекс или макромолекулярный комплекс. Согласно другому варианту осуществления изобретения органическая биомолекула является ферментом, иммуноглобулином, рецептором клеточной поверхности или внутриклеточным рецептором.
Согласно одному из вариантов осуществления изобретения адсорбент представляет собой анион, катион, адсорбент гидрофобного взаимодействия, полипептид, нуклеиновая кислота, углевод, лектин, краситель, редуцирующий агент, гидрокарбон или их сочетания. Согласно другому варианту осуществления изобретения адсорбент прикреплен к субстрату, представляющему собой стекло, керамику, магнитный материал, органический полимер, проводящий полимер, природный биополимер, металл или металл, покрытый органическим полимером. Согласно другому варианту осуществления изобретения адсорбент имеет форму микроэмульсии, латекса, слоя или бус. Согласно другому варианту осуществления изобретения субстрат организован в линию или прямоугольную матрицу. Согласно другому варианту осуществления изобретения адсорбенты располагают на субстрате в различных локализациях до того, как аналиты подвергают условиям селективности. Согласно другому варианту осуществления изобретения адсорбенты располагают на субстрате в различных локализациях после того, как аналиты подвергают условиям селективности. Согласно другому варианту осуществления изобретения различные условия селективности представляют собой различные условия связывания или различные условия элюции.
Согласно одному из вариантов осуществления изобретения этап обнаружения включает определение массы аналита при помощи лазерной десорбционной масс-спектрометрии.
Согласно другому варианту осуществления изобретения условия селективности выбирают так, чтобы оптимизировать удержание аналита адсорбентом. Согласно другому варианту осуществления изобретения условия селективности определяют для различных адсорбентов и одного элюанта.
Другой вариант осуществления изобретения включает этап получения субстрата, содержащего адсорбенты в предопределенных локализациях, при этом каждый адсорбент отвечает условию селективности, определенному для удержания аналита. Согласно другому варианту осуществления изобретения условия элюции отличаются в отношении рН, буферной емкости, ионной силы, характеристик структуры воды, типа детергента, силы детергента, гидрофобности или диэлектрической константы. Согласно другому варианту осуществления изобретения множество условий селективности определяются одним и тем же элюантом.
Согласно другому варианту осуществления изобретения заявлен способ последовательной экстракции аналитов из образца. Это комбинаторный последовательный способ разделения и очистки многих аналитов параллельно. Метод включает этапы: а) обработка образца в первом условии селективности для удержания аналитов первым адсорбентом с получением неудержанного образца; б) сбор неудержанного образца, содержащего аналиты, обработка неудержанного образца во втором условии селективности для удержания аналитов вторым адсорбентом с получением неудержанного образца; в) обнаружение удержанного в различных условиях селективности аналита маркера десорбционной спектрометрией.
В качестве другого аспекта изобретения заявлен субстрат для десорбционной спектрометрии, содержащий адсорбент с характеристиками связывания, градиентно изменяющимися по одной или нескольким линейным осям.
Другим аспектом настоящего изобретения является способ последовательной идентификации условия селективности с улучшенным разрешением аналита в образце. Метод включает этапы: а) идентификации условия селективности, при котором удерживается содержащийся в образце аналит путем i) обработки образца в наборе условий селективности, при этом каждое условие селективности определяется по меньшей мере одной характеристикой связывания и по меньшей мере одной характеристикой элюции; ii) обнаружение десорбционной спектрометрией аналита, удержанного в каждом условии селективности; (iii) идентификация условия селективности, в котором удерживается аналит; и б) идентификация условия селективности с улучшенным разрешением аналита путем i) выбора по меньшей мере одной характеристики связывания или характеристики элюции из идентифицированного условия селективности и введение его в постоянный набор характеристик селективности; ii) обрботка образца в модифицированном наборе условий селективности, при том, что каждое условие селективности в модифицированном наборе включает (1) характеристики селективности из постоянного набора и (2) характеристику связывания или характеристику элюции, не входящие в постоянный набор; и (iii) идентификация десорбционной спектрометрией условия селективности из модифицированного набора, которое обеспечивает удержание аналита с повышенным разрешением по сравнению с ранее идентифицированным условием селективности. Согласно одному из вариантов осуществления изобретения на данной стадии хотя бы один раз повторяется этап б). Согласно другому варианту осуществления изобретения этап б) повторяют до тех пор, пока не будет идентифицировано условие селективности, в котором из образца удерживается только аналит-мишень.
Другим аспектом настоящего изобретения является субстрат для десорбционной спектрометрии, содержащий адсорбент из условий селективности, которые разрешают аналит методом последовательного разрешения. Согласно одному из вариантов осуществления изобретения субстрат поставляется в виде набора, содержащего элюант из условия селективности, или инструкции по использованию элюанта в сочетании с адсорбентом.
Другим аспектом настоящего изобретения является способ препаративной очистки аналита от содержащихся в образце примесей. Способ включает следующие этапы: а) приведение образца в контакт с субстратом во множестве различных условий селективности; обнаружение удержанного во множестве различных условий селективности аналита десорбционной спектрометрией; идентификация условий селективности, в которых удерживается аналит; б) очистка аналита путем повторения для множества различных индетифицированных условий селективности последовательных этапов, включающих i) приведение образца в контакт с адсорбентом в идентифицированном условии селективности, что обеспечивает удержание аналита адсорбентом; ii) отделение аналита от примесей, которые не удерживаются субстратом; и iii) сбор аналита с адсорбента.
Другим аспектом настоящего изобретения является способ получения субстрата для обнаружения как минимум одного аналита в образце. Данный способ является комбинаторным методом конструирования и идентификации аналит-специфических асдорбентов. Он полезен для обнаружения аналитов-мишеней. Способ включает следующие этапы: а) обработка образца в по меньшей мере двух различных условиях селективности, причем каждое условии селективности определяется сочетанием адсорбента и элюанта и делает возможным удержание аналита адсорбентом; б) идентификация при помощи десорбционной спектрометрии по меньшей мереодного условия селективности, при котором ужерживается аналит; и в) получение субстрата, содержащего по меньшей мере один адсорбент из идентифицированного условия селективности. Согласно одному из вариантов осуществления изобретения этап идентификации включает идентификацию по меньшей мере одного условия селективности, при котором ужерживается множество аналитов. Согласно другому варианту осуществления изобретения этап получения субстрата предусматривает получения множества адсорбентов, которые удерживают аналит при определенном условии селективности, выступая в качестве мультиплексного адсорбента.
Другим аспектом настоящего изобретения является способ диагностики у субъекта заболевания, для которого характерен как минимум один маркер. Это комбинаторный метод одновременного обнаружения множественных диагностических маркеров. Данный метод включает следующие этапы: а) получение субстрата для десорбционной спектрометрии, который содержит по меньшей мере одну предопределенную локализацию, при этом каждая предопределенная локализация содержит адсорбент, разрешающий по меньшей мере один диагностический маркер при определенном условии элюции; б)
приведение субстрата в контакт с взятым от субъекта биологическим образцом в таком условии элюции, которое обеспечивает удержание диагностического маркера; и в) обнаружение удержанного диагностического маркера десорбционной спектрометрией. Обнаружение удержанного диагностического маркера обеспечивает диагностику заболевания.
Другим аспектом настоящего изобретения является набор для обнаружения аналита в образце, включающий (1) субстрат, применимый в десорбционной спектрометрии, содержащий как минимум одну предопределенную локализацию, при этом каждая предопределенная локализация содержит адсорбент, который разрешает аналит в условии селективности, определяемым адсорбентом и элюантом, и (2) элюант или инструкции по обработке образца в условии селективности. Согласно одному из вариантов осуществления изобретения данный набор характеризуется множеством диагностических маркеров и субстрат содержит множество предопределенных локализаций, при этом каждая предопределенная локализация содержит адсорбент, который разрешает по меньшей мере один диагностический маркер.
Другим аспектом настоящего изобретения является субстрат, применимый в десорбционной спектрометрии, содержащий как минимум один адсорбент как минимум в одной предопределенной локализации, при этом как минимум один адсорбент разрешает множество диагностических маркеров патологического состояния во взятом от больного образце.
Другим аспектом настоящего изобретения является способ отбора кандидатов на идентичность белку-аналиту. Это комбинаторный метод идентификации белков на основе как минимум двух физико-химических свойств. Метод включает следующие этапы: а) определение набора совпадающих параметров, определяющих как минимум первое и второе физико-химическое свойство белка-аналита в образце, путем i) приведения аналита в контакт со множеством различных условий селективности, в которых адсорбция белка-аналита субстратом происходит на основе аффинности, обусловленной физико-химическим свойством белка-аналита; и ii) обнаружение удержанного в различных условиях селективности аналита десорбционной спектрометрией; и б) осуществление на программируемом цифровом компьютере следующих
этапов: i) осуществление доступа к базе данных, содержащей для каждого члена набора референсных полипептидов набор параметров, определяющих как минимум первое и второе физико-химическое свойство референсных полипептидов; ii) введение набора параметров, определяющих физико-химические свойства белка-аналита; iii) сортировка из базы данных референсных полипептидов, имеющих совпадающий набор параметров. Отсортированные референсные полипептиды служат кандидатами на идентичность белку-аналиту. Неотсортированные референсные полипептиды исключают из кандидатов на идентичность.
Другим аспектом настоящего изобретения является способ последовательного удержания аналитов. Данный способ является способом мониторинга мультимерной макромолекулярной или супрамолекулярной сборки. Он применим для скрининга потенциальных лекарственных препаратов по интерференции молекулярного распознавания. Метод включает следующие этапы: а) приведение первого образца в контакт с первичным адсорбентом и элюантом, что делает возможным удержание первого аналита адсорбентом, и обнаружение адсорбированного аналита десорбционной спектрометрией, при этом удержанный первый аналит становится вторичным адсорбентом; б) приведение второго образца в контакт со вторичным адсорбентом и обнаружение адсорбированного второго аналита десорбционной спектрометрией, при этом удержанный второй аналит становится четвертичным адсорбентом.
Другим аспектом настоящего изобретения является обнаружение фермента в образце. Данный метод включает следующие этапы: а) получение твердой фазы, содержащей адсорбент и субстрат фермента, присоединенный к адсорбенту, при этом активность фермента в отношении субстрата фермента приводит к образованию продукта с характерной молекулярной массой; б) приведение субстрата в контакт с образцом; и в) обнаружение продукта при помощи десорбционной спектрометрии. Обнаружение продукта означает обнаружение фермента.
Другим аспектом настоящего изобретения является способ установления дифференциального присутствия аналита (т.е. дифференциальной экспрессии) в первом и втором биологическом образце. Метод применим в качестве комбинаторного для мониторинга дифференциальной экспрессии генов путем дифференциального выявления белков. Метод включает следующие этапы: а) составление первой ретенционной карты для аналита в первом образце при как минимум одном условии селективности; б) составление второй ретенционной карты для аналита во втором образце при том же самом условии селективности; и в) обнаружение различий между первой и второй ретенционными картами. Различия в ретенционных картах дают возможность установить факт дифференциального присутствия аналита в первом и втором образце.
Согласно одному из вариантов осуществления изобретения метод служит для установления факта дифференциальной экспрессии белка в двух различных клетках, а первый и второй образцы представляют собой клетки или клеточный материал. В соответствии с другим вариантом целью метода является установление факта изменения агентом экспрессии белка в биологическом образце и метод включает этап введения агента в первый биологический образец, но не во второй биологический образец. В соответствии с другим вариантом, первый биологический образец получен от здорового субъекта, а второй биологический образец от субъекта, страдающего каким-либо заболеванием. Образцом может служить, например, кровь, моча, сыворотка или ткань. Те аналиты, которые обнаруживаются в повышенных количествах в образцах, полученных от больных, являются возможными диагностическими маркерами. Обычно подтверждение диагностического маркера предусматривает его обнаружение у многих субъектов.
Другим аспектом настоящего изобретения является способ идентификации лиганда к рецептору. Метод включает следующие этапы: а) получение субстрата, содержащего адсорбент, при том, что рецептор связан с адсорбентом; б) приведение связанного рецептора в контакт с образцом, содержащим лиганд, в таких условиях, которые делают возможным связывание рецептора и лиганда; и в) обнаружение связанного лиганда десорбционной спектрометрией.
Другим аспектом настоящего изобретения является способ скрининга для установления факта модулирования агентом связывания между аналитом-мишеныо и адсорбентом. Это комбинаторный метод скрининга потенциальных лекарственных препаратов. Метод включает следующие этапы: а) получение субстрата, содержащего адсорбент, при том, что аналит-мишень связывается в условиях элюции; б) приведение субстрата в контакт с аналитом-мишенью и адсорбентом; в) определение уровня связывания между аналитом-мишенью и адсорбентом десорбционной спектрометрией; и г) установление факта отличия определенного уровня от контрольного уровня связывания, когда субстрат приведен в контакт с аналитом-мишенью в условиях элюции без агента. Различие между установленным экспериментально уровнем и контрольным уровнем свидетельствует о том, что агент модулирует связывание.
Другим аспектом настоящего изобретения является способ детекции генотипа, содержащего полинуклеотид, который кодирует полипептидный агент, специфически связывающий адсорбент-мишень. С одной стороны, это комбинаторный метод отбора аналит-специфического фага из библиотеки, включая использование белков-мишеней, выделенных ретентатным картированием, или белков-мишеней, полученных in situ путем транскрипции и трансляции in vitro. Метод включает следующие этапы: а) получение субстрата, содержащего адсорбент-мишень; б) получение библиотеки, содержащей множество различных генотипов, при этом каждый различный генотип (организм) содержит полинуклеотид, в котором представлена нуклеотидная последовательность, кодирующая полипептидный агент, и каждый различный генотип (организм) имеет поверхность, на которой представлен кодируемый полипептидный агент; в) приведение субстрата в контакт с библиотекой в таких условиях элюции, которые делают возможным специфическое связывание полипептидного агента с адсорбентом-мишенью, при этом содержащий полипептидный агент генотип (организм) удерживается на субстрате; и г) обнаружение генетического материала, удержанного на субстрате, при помощи десорбционной спектрометрии.
Согласно одному из вариантов осуществления изобретения библиотека представляет собой фаговую библиотеку. Согласно еще одному варианту осуществления изобретения фаг является фагом М13. Согласно еще одному варианту осуществления изобретения полипептид является одноцепочечным антителом. Согласно другому варианту осуществления изобретения, аналит-мишень является полипептидным аналитом, который дифференциально экспрессируется в клетках различных фенотипов. Согласно другому варианту осуществления изобретения субстрат является клеткой или клеточной мембраной.
Согласно одному из вариантов осуществления изобретения этап получения субстрата, содержащего адсорбент-мишень, включает следующие стадии: i) получение субстрата, содержащего адсорбент, при этом адсорбент удерживает аналит-мишень в условии элюции; и ii) приведение адсорбента в контакт с аналитом-мишенью в условиях элюции, в которых возможно удержание аналита-мишени адсорбентом, при этом аналит-мишень становится адсорбентом-мишенью. Согласно другому варианту осуществления изобретения аналит-мишень является полипептидом-мишенью и этап ii) включает получение полипептида-мишени in situ на адсорбенте путем трансляции in vitro полинуклеотида, кодирующего полипептид-мишень, а также может включать амплификацию полинуклеотидной последовательности in situ на субстрате.
Согласно другому варианту осуществления изобретения субстрат содержит (1) адсорбент, который связывает заякоривающий полипептид и (2) по меньшей мере один организм-мишень, на поверхности которого представлен заякоривающий полипептид и полипептид-мишень, играющий роль адсорбента. Организм-мишень содержит полинуклеотид, который кодирует адсорбент-мишень, при этом организм-мишень связан с адсорбентом посредством заякоривающего полипептида.
Согласно другому варианту осуществления изобретения способ дополнительно включает любые из следующих этапов: секвенирование нуклеотидной последовательности, кодирующей полипептидный агент; выделение удержанного генотипа или получение полипептидного агента.
Другим аспектом настоящего изобретения является субстрат для десорбционной спектрометрии, состоящий из адсорбента, который связывает заякоренный полипептид, представленный на поверхности организма, при этом на поверхности организма также представлен полипептид-мишень, а генотип данного организма содержит полинуклеотид, имеющий нуклеотидную последовательность, которая кодирует полипептид-мишень.
Другим аспектом настоящего изобретения является способ обнаружения трансляции полинуклеотида. Способ включает следующие этапы: а) получение субстрата, содержащего адсорбент для десорбционной спектрометрии; б) приведение субстрата в контакт с кодирующим полипептид полинуклеотидом и с агентами для трансляции полинуклеотида in vitro, в результате чего образуется полипептид; в) обработка субстрата элюантом, что делает возможным удержание полипептида адсорбентом; г) обнаружение удержанного полипептида десорбционной спектрометрией. Обнаружение полипептида обеспечивает подтверждение трансляции полинуклеотида.
Краткое описание чертежей
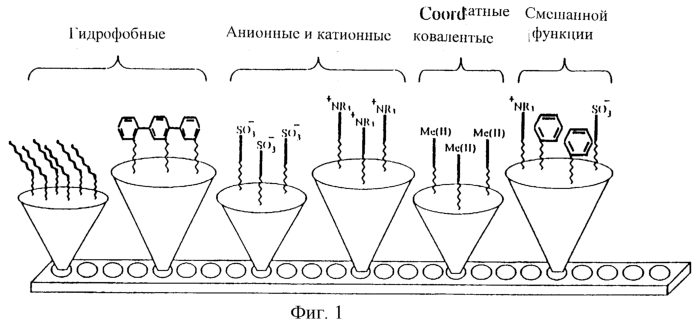
На фиг.1 изображен субстрат, содержащий множество адсорбирующих пятен в виде полосы. Полоса содержит шесть различных наборов адсорбентов, классифицируемых на основе сил взаимодействия (гидрофобных, ионных, координатных ковалентных и смешанной функции). Полоса содержит несколько пятен адсорбента каждого типа, что дает возможность обработки пятен в различное время различными элюантами или архивирования и последующего анализа.
На фиг.2 изображена прямоугольная матрица адсорбентов (потенциалов поверхностного взаимодействия) в предопределенных локализациях. Матрица может также иметь форму пластины. Матрица содержит различные адсорбенты. При контакте с аналитом каждая полоса может быть промыта различными элюантами (модификаторами порога селективности). Анализ удержания при различных уловиях селективности дает ретенционную карту или профиль распознавания.
На фиг.3 представлен количественный анализ аналитов путем десорбции аналита в данных локализациях матрицы и количественного определения десорбированного аналита лазерной десорбционной масс-спектрометрией.
На фиг.4А показана компьютерная система 1, которая включает монитор 3, экран 5, корпус 7, клавиатуру 9 и мышь 11. Мышь 11 может иметь одну или несколько кнопок, таких как кнопки 13. В корпусе 7 находятся CD-ROM 15 и жесткий диск (не показано), которые могут использоваться для хранения и вызова компьютерных программ, включая код, необходимый для реализации настоящего изобретения. При том, что в качестве носителя информации показан CD-ROM 17, могут использоваться и другие носители, включая дискеты, DRAM, жесткие диски, флэш-память, кассеты и др. В корпусе 7 находятся также такие обычные компьютерные компоненты (не показано), как процессор, память и др.
На фиг.4В показана блок-схема компьютерной системы 1, используемой для осуществления программ, необходимых для анализа данных, получаемых в ходе осуществления настоящего изобретения. Как и на фиг.4А, компьютерная система 1 включает монитор 3 и клавиатуру 9. Компьютерная система 1 включает также такие подсистемы, как центральный процессор 102, системную память 104, I/O контроллер 106, адаптер дисплея 108, удаляемый диск 112, фиксированный диск 116, сетевой интерфейс 118 и динамик 120. Удаляемый диск 112 может быть любым удаляемым носителем информации, таким как дискеты, кассеты, CD-ROM, съемный твердый диск, флэш-память и т.п. Фиксированный диск 116 может быть внутренним жестким диском, DRAM и т.п. Другие компьютерные системы, приемлемые для целей настоящего изобретения, могут включать дополнительные подсистемы или содержать меньше таких подсистем. Например, другая компьютерная система может содержать более чем один процессор 102 (т.е. мультипроцессорная система) или кэш-память.
На фиг.5A-5F приведены ретенционные карты для лизоцима в селективных условиях, включая шесть различных адсорбентов и несколько различных элюантов.
На фиг.6А-6В показано разрешение низкомолекулярных и высокомолекулярных аналитов в сыворотке человека на адсорбенте с иммобилизованным металлом.
На фиг.7А-7В показано разрешение низкомолекулярных и высокомолекулярных аналитов в сыворотке человека на различных адсорбентах одним и тем же элюантом.
На фиг.8А-8В показано разрешение низкомолекулярных и высокомолекулярных аналитов в моче недоношенного ребенка на различных адсорбентах с использованием воды в качестве элюанта.
На фиг.9 показано разрешение аналитов в моче недоношенного ребенка с использованием гидрофобного фенильного адсорбента и трех различных элюантов, при этом обнаружено селективное удержание однго из аналитов (*) при промывке Твином.
На фиг.10A-10D показано разрешение аналитов в культуральной среде клеток двух различных линий рака молочной железы.
На фиг.11 приведена композитная ретенционная карта мочи недоношенного ребенка, обработанной в селективных условиях, определенных для шести различных адсорбентов и трех различных элюантов.
На фиг.12 показано разделение в двухмерном полиакриламидной геле (рI и явная молекулярная масса) мочи недоношенного ребенка.
На фиг.13 показан метод пэннинга фаговых библиотек для выделения фага с поверхностным белком, который специфически связывает аналит-мишень. Приведенный наверху субстрат показывает, что даже несколько специфически связывающих фагов могут быть обнаружены десорбционной спектрометрией посредством обнаружения многих поверхностных белков, которые содержит фаг. Внизу показан субстрат с несколькими пятнами адсорбента, разработанный таким образом, что специфически связывается аналит-мишень. Фаг наносят на пятна. Связавшийся фаг обнаруживают десорбционной спектрометрией. Фаг, связавшийся с другим пятном, можно выделить и вырастить.
На фиг.14 показан лигандный агент, в данном случае одноцепочечное антитело, идентифицированное методом пэннинга, который может быть использован в качестве адсорбента для удержания белка-мишени и последующего исследования белок-белковых взаимодействий. Мишень очищают in situ (пятно 2) и используют для пэннинга фаговой библиотеки (пятно 4). Одноцепочечное антитело выделено и прикреплено к субстрату (пятно 6) в качестве адсорбента. Затем мишень адсорбируется одноцепочечным антителом. Теперь мишень удерживается для исследования белок-белковых взаимодействий (пятно 8).
На фиг.15 показан способ скрининга потенциальных лекарственных препаратов на способность интерферировать со связыванием белка с лигандом, в данном случае с одноцепочечным антителом. Одноцепочечное антитело, специфичное к белку-мишени, удерживается на пятне субстрата посредством, например, антифагового антитела, которое, в свою очередь, может удерживаться посредством белка А или белка G. Одноцепочечное антитело приводят в контакт с белком-мишенью и потенциальным препаратом. Способность препарата связывать белок-аналит и интерферировать со связыванием лиганда аналитом контролируется десорбционной спектрометрией.
На фиг.16 приведен способ скрининга потенциальных лекарственных препаратов на способность интерферировать со связыванием белка с лигандом. Способ аналогичен приведенному на предыдущем чертеже с той разницей, что десорбционной спектрометрией контролируется способность препарата интерферировать со связываниме аналита путем связывания лиганда.
На фиг.17 приведен способ скрининга потенциальных лекарственных препаратов на способность интерферировать со связыванием белка мишени (Белок-мишень 1) со вторичным лигандом (Белок-мишень II). Как и на предыдущих двух чертежах, мишень, удерживаемая на субстрате, становится адсорбентом лиганда. В данном случае аналит удерживается посредством одноцепочечного антитела. Мишень приводят в контакт с белком-мишенью и потенциальным препаратом. Способность препарата интерферировать со связыванием между аналитом и лигандом (напр., связывая аналит-мишень) контролируется десорбционной спектрометрией.
На фиг.18 представлена диаграмма всего процесса, который начинается с идентификации дифференциально экспрессирующихся мРНК или полипептидов и заканчивается созданием диагностической платформы для специфического связывания полипептидов с последующим обнаружением десорбционной спектрометрией.
На фиг.19A-19D приведена ретенционная карта лизата Hemophilus на адсорбирующей матрице. Фиг.19А: антионный адсорбент; фиг.19В: нормально-фазный адсорбент; фиг.19С: Ni(II)-адсорбент; фиг.19D: гидрофобный адсорбент.
На фиг.20А-20С показано последовательное разрешение аналита в лизате Hemophilus. Адсорбент в каждом случае являлся анионным адсорбентом. Фиг.20А: на первом этапе, после нанесения образца пятно промыли 150 мкл 20 мМ натрий-фосфата, 0.5 М NaCl, pH 7.0. На втором этапе к постоянному набору характеристик были добавлены адсорбент и характеристика натрий-фосфата в элюанте. Была введена новая характеристика элюции. Фиг. 20В: в присутствии 20 мМ натрий-фосфата, pH 7.0, пятно промыли 0.05% Тритоном Х100 и 0.15 М
NaCl (всего 150 мкл). Фиг.20С: в присутствии 20 мМ натрий-фосфата, рН 7.0, пятно промыли 100 мМ имидазола, 0.15 М NaCl (всего 150 мкл).
На фиг.21A-21D приведены результаты сравнения компонентов сыворотки нормальных и больных людей. фиг. 21А: Ретенционная карта нормальной сыворотки на сайте Cu(II) адсорбирующей матрицы. Фиг.21В: Ретенционная карта сыворотки больного на сайте Cu(II) адсорбирующей матрицы. Фиг.21С: Удержанные аналиты из обоих образцов сыворотки сопоставляются путем наложения. Для упрощения картины каждый пик удержанного аналита представлен прямой линией, при этом пунктирные линии представляют аналиты, удержанные из нормальной сыворотки, а жирные линии представляют аналиты, удержанные из сыворотки больных. Фиг.21D: Для более четкого выявления различий между двумя образцами был построен график сравнения, на котором приведены вычисленные отношения удержанных аналитов в образцах. Для двух аналитов, обозначенных “*”, отмечено значительное повышение в сыворотках больных (превышение в 5-10 раз).
На фиг.22A-22D приведено сравнение ретенционных карт мочи контрольной, больной и обработанной препаратом мышей на Сu(II)-адсорбенте и количественное определение маркера в моче больной и обработанной препаратом мышей.
На фиг.23A-23D приведены ретенционные карты аналитов в моче раковых больных, показанные в “гелевом” формате. На диффренционных картах больных 1, 2 и 3 видны два общих аналита, присутствующие у данных больных в повышенных количествах.
На Фиг.24А-24Е приведено обнаружение фага М13 десорбционной масс-спектрометрией посредством обнаружения поверхностного белка гена VIII. Разведения исходного стокового раствора фага с содержанием частиц 1012 на мл, составляли от 1:10 до 1:10,000,000,000.
На фиг.25А-25В приведено обнаружение удержанного фага М13 десорбционной спектрометрией с использованием в качестве адсорбента анти-М13 антитела. На фиг.25А показан удержанный фаг М13, а пики представляют белки гена VIII и гена III. На фиг.25В показаны контрольные пики антительного адсорбента (единично и дважды заряженного).
На фиг.26A-26D показана адсорбция адсорбентом с tat-белком фага М13, несущего одноцепочечное анти-tat антитело. Единичные пики получены при разведениях фага от 1:10 до 1:10,000.
На фиг.27А-27В приведены ретенционные карты связывания TGF-b при использовании в качестве адсорбента слитого белка рецептора TGF-b в концентрации 1 мкг/мл (Рис.27А) и 100 мг/мл (фиг.27В). Жирной линией показано связывание в отсутствие свободного рецептора TGF-b. Пунктирной линией показано связывание в присутствии рецептора TGF-b.
Чертежи с 28 по 31 демонстрируют разрешающую способность ретентатной хроматографии. На фиг.28А-28С показано разрешение белков лизата Hemophilus с использованием гидрофобного, катионного и Cu(II) адсорбентов в интервале молекулярных масс от 0 кДа до 30 кДа. Каждый удержанный аналит представлен прямой линией, высота которой отражает интенсивность удержанного аналита. На фиг.29А-29С показано разрешение белков лизата Hemophilus с использованием гидрофобного, катионного и Cu(II) адсорбентов в интервале молеклярных масс от около 30 кДа до около 100 к Да. На фиг.30 показано сочетанное разрешение белков Hemophilus в интервале от 0 кДа до 30 кДа на каждом из трех адсорбентов. На фиг.31 показано сочетанное разрешение белков Hemophilus в интервале от 20 кДа до 100 кДа на каждом из трех адсорбентов.
На фиг.32 показано связывание слитого белка GST нормальным адсорбентом.
На фиг.33А-33В показано связывание специфического лиганда со слитым рецептором GST, удерживаемым на адсорбирующей матрице (фиг.33А), и отсутствие связывания лиганда на контрольной матрице, которая не содержит слитого рецептора GST (фиг.33B).
Подробное описание изобретения
1. ОПРЕДЕЛЕНИЯ
Если не указано обратное, все технические и научные термины имеют значение, обычно понимаемое специалистами в той области, к которой принадлежит изобретение. В следующих изданиях квалифицированный специалист найдет общие определения многих терминов, использованных в настоящем описании: Singleton et al., DICTIONARY OF MICROBIOLOGY AND MOLECULAR BIOLOGY (2nd ed. 1994); THE CAMBRIDGE DICTIONARY OF SCIENCE AND TECHNOLOGY (Walker ed., 1988); THE GLOSSARY OF GENETICS, 5TH ED., R.Rieger et al., (eds.), Springer Verlag (1991); и Hale & Marham, THE HARPER COLLINS DICTIONARY OF BIOLOGY (1991). Следующие термины имеют следующие приписанные им значения, если не указано обратное.
Термин “Аналит” означает компонент образца, который нужно удержать и обнаружить. Термин может означать как один компонент, так и набор компонентов в образце.
Термин “Адсорбент” означает любой материал, способный адсорбировать аналит. Термин “адсорбент” в настоящем контексте может означать как единичный материал (“моноплексный адсорбент”) (т.е. соединение и функциональная группа), в контакт с которым приводится аналит, так и множество различных материалов (“мультиплексный адсорбент”), в контакт с которыми приводится образец. Адсорбирующие матриалы в мультиплексном адсорбенте обозначаются как “вида адсорбента”. Например, предпоределенная локализация на субстрате может содержать много различных видов адсорбента (т.е. анионообменные материалы, хелаторы металлов или антитела), имеющих различные характеристики связывания.
Термин “Адсорбировать” означает обнаружимое связывание между адсорбентом и аналитом до или после промывки элюантом (модификатором порога селективности).
Термин “Субстрат” означает твердую фазу, к которой прикреплен или на которой удерживается адсорбент.
Термин “Характеристика связывания” означает химические и физические условия, которые определяют привлечение аналита адсорбентом. Два адсорбента имеют различные характеристики связывания, если в одних и тех же условиях элюции адсорбенты связывают один и тот же аналит с различной степенью афчфинности. К характеристикам связывания относятся, например, степень соле-зависимого взаимодействия, степень гидрофобного взаимодействия, степень
гидрофильного взаимодействия, степень электростатического взаимодействия и др.
Термин “Условия связывания” означает характеристики связывания, в которых обрабатывается аналит.
Термин “Элюант” означает агент, обычно раствор, который используют для опосредовывания адсорбции аналита на адсорбенте. Элюанты также называют “модификаторами порога селективности”.
Термин “Характеристика элюции” означает свойство, которое определяет способность конкретного элюанта (модификатора порога селективности) опосредовывать адсорбцию между аналитом и адсорбентом. Два элюанта имеют различные характеристики элюции если при приведении в контакт аналита и адсорбента степени аффинности аналита к адсорбенту отличаются. К характеристикам элюции относятся, например, рН, ионная сила, модификация водной структуры, сила детергента, модификация гидрофобных взаимодействий и др.
Термин “Условия элюции” означает характеристики элюции, в которых обрабатывется аналит.
Термин “Характеристика селективности” означает сочетание адсорбента, имеющего конкретные характеристики связывания и элюанта, имеющего конкретные характеристики характеристики элюции, при этом данное сочетание определяет специфичность, с которой аналит будет удерживаться адсорбентом после промывки элюантом.
Термин “Условия селективности” означает характеристики селективности, в которых обрабатывется аналит.
Термин “Основа привлечения” означает химические или физико-химические свойства, которые вызывают привлечение одной молекулы к другой.
Термин “Сила привлечения” означает интенсивность привлечения одной молекулы к другой (известно также как аффинность).
Термин “Разрешать”, “разрешение” или “разрешение аналита” означает обнаружение по меньшей мере одного аналита в образце. Разрешение подразумевает обнаружение множества аналитов в образце путем разделения и последующего дифференциального обнаружения. Разрешение не обязательно требует полного отделения аналита от других аналитов в смеси.
Термин “высокоинформативное разрешение” означает разрешение аналита таким образом, который позволяет не только обнаружить аналит, но также оценить хотя бы одно физико-химическое свойство аналита, напр., молекулярную массу.
Термин “Десорбционная спектрометрия” означает метод обнаружения аналита, при котором аналит подвергается воздействию энергии, которая десорбирует аналит со стационарной фазы в газовую фазу и десорбированный аналит или его неразличимая часть прямо обнаруживается детектором без промежуточной стадии удерживания аналита на второй стационарной фазе.
Термин “Обнаруживать” означает установление присутствия, отсутствия или определение количества обнаруживаемого объекта.
Термин “Удержание” (ретенция) означает адсорбцию аналита адсорбентом после промывки элюантом.
Термин “Данные удержания” означает данные, указывающие на обнаружение (дополнительно включающие детектируемую массу) аналита, удержанного в конкретных условиях селективности.
Термин “Ретенционная карта” означает набор значений, характеризующих параметры удержания аналита, удерживаемого при множестве селективных условий.
Термин “Профиль распознавания” означает набор значений, характеризующих относительное удержание аналита при множестве селективных условий.
Термин “Комплекс” означает аналиты, образующиеся при соединении двух или более аналитов.
Термин “Фрагмент” означает продукты химическиго, энзиматического или физического расщепления аналита. Фрагменты могут быть нейтральными или ионными.
Термин “Диференциальная экспрессия” означает обнаружимую разницу в количественном или качественном присутствии аналита.
Термин “Биологический образец” означает образец, полученный из вируса, клетки, ткани, органа или организма, включая, без ограничений, лизаты или гомогенаты клетки, ткани или органа, или образцы жидкостей тела, такие как кровь, моча или спинно-мозговая жидкость.
Термин “Органическая биомолекула” означает органическую молекулу биологического происхождения, т.е. стероиды, аминокислоты, нуклеотиды, сахара, полипептиды, полинуклеотиды, сложные углеводы или жиры.
Термин “Малая органическая молекула” означает органическую молекулу, сравнимую по размерам с органическими молекулами, обычно используемыми в фармакологии. Термин исключает органические биополимеры (т.е. белки, нуклеиновые кислоты и т.д.). Малые органические молекулы предпочтительно имеют размер до 5000 Да, до 2000 Да или до 1000 Да.
Термин “Биополимер” означает полимер биологического происхождения, т.е. полипептиды, полинуклеотиды, полисахариды или полишлицериды (т.е. ди- или триглицериды).
Термин “Полипептид” означает полимер, состоящий из аминокислотных остатков, родственных природных структурных вариантов и синтетических, не встречающихся в природе аналогов. Можно синтезировать синтетические полипептиды, например, с помощью автоматического синтезатора полипептидов. Термин “белок” обычно относится к большим полипептидам. Термин “пептид” обычно относится к коротким полипептидам.
Термин “Полинуклеотид” означает полимер, состоящий изнуклеотидных единиц. К полинуклеотидам относятся встречающиеся в природе нуклеиновые кислоты, такие как дезоксирибонуклеиновая кислота (“ДНК”) и рибонуклеиновая кислота (“РНК”), а также аналоги нуклеиновых кислот. К аналогам нуклеиновых кислот относятся такие полинуклеотиды, в состав которых входят неприродные основания, нуклеотиды, обеспечивающие связь с другими нуклеотидами, отличающуюся от природной фосфодиэфирной связи, или которые содержат основания, присоединенные связями, отличными от фосфодиэфирных связей.
Таким образом, к аналогам нуклеотидов относятся, например, без ограничения перечисленными, фосфоротиоаты, фосфородитиоаты, фосфоротриэфиры, фосфороамидаты, боранофосфаты, метилфосфанаты, хирал-метил фосфанаты, 2-O-метил рибонуклеотиды, пептид-нуклеиновые кислоты (ПНК) и им подобные. Такие полинуклеотиды могут быть синтезированы, например, с помощью автоматического ДНК-синтезатора. Термин “нуклеиновая кислота” обычно относится к большим полинуклеотидам. Термин “олигонуклеотид” обычно относится к коротким полинуклеотидам, не превышающим по длине 50-ти нуклеотидов. Понятно, что когда нуклеотидная последовательность представляет собой последовательность ДНК (т.е. А, Т, Г, Ц), то это также относится и к последовательности РНК (т.е. А, У, Г, Ц), где “У” заменяет “Т”.
Термин “Обнаружимая сущность” или “метка” означает соединение, обнаружимое спектроскопическими, фотохимическими, биохимическими, иммунохимическими или химическими способами. Например, к полезным меткам относятся 32Р, 35S, флуоресцентные красители, электронно-плотные реагенты, ферменты (напр., такие, которые обычно используют в ELISA), биотин-стрептавидин, диоксигенин, гаптены и белки, для которых доступны антисыворотки или моноклональные антитела, или молекулы нуклеиновых кислот с последовательностью, комплементарной мишени. Обнаружимая сущность часто дает измеримый сигнал, например, радиоактивный, хромогенный или флуоресцентный сигнал, который может быть использован для количественного определения связанной обнаружимой сущности в образце. Обнаружимую сущность можно встроить или присоединить к праймеру или зонду как ковалентно, так и при помощи ионных, вандерваальсовых или водородных связей, например встраивание радиоактивных нуклеотидов или биотинилированных нуклеотидов, распознаваемых стрептавидином. Обнаружимую сущность можно детектировать прямо или косвенно. Непрямое обнаружение может предусматривать связывание второй прямо или косвенно обнаружимой сущности. Например, обнаружимая сущность может являться лигандом для связывающего партнера, такого как биотин, являющийся связывающим партнером стрептавидина, или нуклеотидная последовательность, которая является связывающим партнером комплементарной последовательности, с которой она может специфически гибридизоваться. Связывающий партнер сам по себе может быть прямо обнаружимым, например, антитело само по себе может быть помечено флуоресцентной молекулой. Связывающий партнер может быть также обнаружимым косвенно, например, нуклеиновая кислота с комплементарной нуклеотидной последовательностью может являться частью разветвленной молекулы ДНК, которая в свою очередь обнаружима путем гибридизации с другими мечеными молекулами нуклеиновой кислоты. (См., P.D.Fahrlander and A.Klausner, Bio/Technology (1988) 6:1165). Количественную оценку сигнала можно провести, например, сцинтилляционным подсчетом, денситометрией или проточной цитометрией.
“Множество” означает не менее двух.
“Очищать” или “очистка” означает удаление по меньшей мере одной примеси из очищаемой композиции. Очистка не обязательно подразумевает достижения 100% чистоты очищаемого соединения.
Термин “Лиганд” означает соединение, которое специфически связывается с молекулой-мишенью.
Термин “Рецептор” означает означает соединение, которое специфически связывается с лигандом.
Термин “Антитело” означает полипептидный лиганд, по существу кодируемый геном иммуноглобулина или генами иммуноглобулинов, или их фрагментами, который специфически связывается и распознается эпитопом (т.е. антигеном). К известным генам иммуноглобулинов относятся каппа и лямбда легкая цепь константной области генов, альфа, гамма, дельта, эпсилон и мю тяжелая цепь константной области генов, и мириады вариабельных областей генов иммуноглобулинов. Антитела существуют в виде интактных иммуноглобулинов или в виде ряда хорошо охарактеризованных фрагментов, образующихся в результате гидролиза различными пептидазами. К ним относятся Fab’ и F(ab)’2 фрагменты. Термин “антитело”, как он используется в настоящем контексте, также включает фрагменты антител, полученные в результате модификации целых антител или синтезированные de novoc использованием методологии рекомбинантных ДНК. К ним также относятся поликлональные антитела, моноклональные антитела, химерные антитела и гуманизированные антитела. ‘Fс”-фрагмент антитела означает ту часть тяжелой цепи иммуноглобулина, которая содержит один или несколько доменов константной области тяжелой цепи, CH1, CH2 и CH3, но не содержит вариабельной области тяжелой цепи.
Лиганд или рецептор (т.е. антитело) “специфически связывается с” или “специфически иммунореактивно к” аналиту, когда лиганд или рецептор функционируют в реакции связывания, что указывает на присутствие аналита в образце гетерогенных соединений. Таким образом, в определенных условиях тестирования (напр. в иммунотесте) лиганд или рецептор связывает предпочтительно конкретный аналит и не связывает занчительное количество других компонентов образца. Например, полинуклеотид специфически связывает в условиях гибридизации полинуклеотид-аналит, имеющий комплементарную последовательность; антитело специфически связывает в условиях иммунотеста антиген-аналит, несущий эпитоп, против которого было получено антитело; адсорбент специфически связывает аналит в соответствующих условиях элюции.
Термин “Агент” означает химическое соединение, смесь химических соединений, образец неопределенного состава, комбинаторный порядок малых молекул, биологическую макромолекулу, пептидую библиотеку бактриофагов, библиотеку бактриофагов, несущих антитела (т.е., scFv), пептидую полисомальную библиотеку или экстракт, приготовленный из таких биологических материалов, как бактерии, растения, грибы или животные клетки и ткани. К приемлемым методикам относится скрининг библиотек рекомбинантных антител в фагах или аналогичных векторах. См., Huse et al., (1989) Science 246:1275-1281; и Ward et al., (1989) Nature 341:544-546. Приведенный Huse протокол более эффективен в сочетании с технологией фаговых библиотек. См. напр., Dower et al., WO 91/17271 и McCafferty et al., WO 92/01047.
Термин “Рекомбинантный полинуклеотид” означает полинуклеотид, содержащий последовательности, которые в природе не соединены. Амплифицированный или “собранный” рекомбинантный полинуклеотид может быть введен в приемлемый вектор, а вектор – использован для трансформации приемлемой клетки-хозяина. Клетка-хозяин, содержащая рекомбинантный полинуклеотид, обозначается как “рекомбинантная клетка-хозяин”. Затем в рекомбинантной клетке-хозяине ген экспрессируется с образованием “рекомбинантного полипептида”, Рекомбинантный полинуклеотид может выполнять также и некодирующую функцию (т.е. служить промотором, началом репликации, сайтом связывания рибосом и т.д.). К примелемым одноклеточным хозяевам относятся любые, рутинно используемые для экспрессии полинуклеотидов эукариот или млекпитающих, включая, например, прокариотов, таких как E.coli; эукариотов, таких, например, как грибы и дрожжи; культивируемые клетки, включая клетки насекомых (напр., Sf9) и клетки животных, такие как СНО, R1.1, B-W, L-M, клетки почки зеленой африканской мартышки (напр., COS 1, COS 7, BSC 1, BSC 40 и ВМТ 10), а также культивируемые клетки человека.
Термин “Последовательность, контролирующая экспрессию” означает нуклеотидную последовательность в полинуклеотиде, которая регулирует экспрессию (транскрипцию и/или трансляцию) оперативно связанной с ней нуклеотидной последовательности. “Оперативно связанная” означает функциональные отношения между двумя частями, при которых активность одной части (т.е. способность регулировать экспрессию) приводит к реализации активности второй части (т.е. к транскрипции последовательности). К последовательностям, контролирующим экспрессию, относятся, например, (без ограничения перечисленными) последовательности промоторов (напр., индуцибельных, подавляемых или конституитивных), энхансеры, терминаторы транскрипции, старт-кодон (т.е. ATG), сигналы сплайсинга интронов и стоп-кодоны.
Термин “Вектор экспрессии” означает вектор, содержащий рекомбинантный полинуклеотид, в котором находятся контролирующие экспрессию последовательности, оперативно связанные с подлежащей экспрессии нуклеотидной последовательностью. Вектор экспрессии содержит необходимые для экспрессии цис-действующие элементы; другие необходимые для экспрессии элементы могут быть обеспечены клеткой-хозяином или системой экспрессии in vitro. К векторам экспрессии относятся все подобные векторы, известные из уровня техники, например космиды, плазмиды (как “голые”, так и заключенные в липосомы) и вирусы, содержащие рекомбинантный полинуклеотид.
Термин “Кодирующий” означает наследуемое свойство специфических последовательностей нуклеотидов в полинуклеотиде, таком как ген, кДНК или мРНК, служить матрицами для синтеза других полимеров и макромолекул в биологических процессах, определяя при этом или конкретную последовательность нуклеотидов (т.е. рРНК, тРНК и мРНК), или конкретную последовательность аминокислот и биологические свойства ими обусловленные. Таким образом, ген кодирует белок если транскрипция и трансляция мРНК, синтезированной на данном гене, приводит к образованию белка в клетке или другой биологической системе. Как кодирующая цепь, нуклеотидная последовательность которой идентична последовательности мРНК и обычно приводится в базах данных, так и некодирующпя цепь, использующаяся как матрица для транскрипции, могут рассматриваться как кодирующие белок или другой продукт данного гена или кДНК. Если не указано обратное, под “нуклеотидной последовательностью, кодирующей аминокислотную последовательность” понимают все нуклеотидные последовательности, которые являются вырожденными версиями друг друга и которые кодируют одну и ту же аминокислотную последовательность. Нуклеотидные последовательности, которые кодируют белки и РНК, могут содержать интроны.
Термин “Молекула, поглощающая энергию” означает молекулу, которая поглощает энергию от источника энергии при десорбционной спектрометрии, обеспечивая десорбцию аналита с поврехности зонда. Поглощающие энергию молекулы, применяемые в MALDI, часто обозначают как “матрикс”. Производные циннаминовой кислоты, цинапиновая кислота и дигидроксибензоиловая кислота часто используются в качестве поглощающих энергию молекул при лазерной десорбции биоорганических молекул.
II РЕТЕНТАТНАЯ ХРОМАТОГРАФИЯ
Ретентатная хроматография является методом многомерного разрешения аналитов в образце. Метод включает (1) селективное адсорбирование аналитов их образца на субстрате во множестве различных сочетаний адсорбент/элюант (“условия селективности”) и (2) обнаружение удержания адсорбированных аналитов десорбционной спектрометрией. Каждое условие селективности обеспечивает один параметр разделения или разделение в одном измерении, при этом происходит отделение адсорбированных аналитов от неадсорбированных. Десорбционная спектрометрия обеспечивает второй параметр разделения, разделяя адсорбированные аналиты друг от друга по массе. Поскольку в ретентатной хроматографии используется множество различных условий селективности, то достигается многомерное разделение. Может быть также определена относительная адсорбция одного или нескольких аналитов в двух условиях селективности. Такое многомерное разделение обеспечивает как разрешение аналитов, так и их характеристику.
Кроме того, разделенные таким образом аналиты остаются на ретентатных картах, которые можно подвергать дальнейшим процедурам анализа, например, для определения структуры аналита и/или его функции. Также удержанные аналиты сами по себе могут служить в качестве адсорбентов, связывая другие ненесенные на субстрат аналиты. В итоге, в настоящем изобретении заявлено быстрое, многомерное и высокоинформативное разрешение аналитов.
Метод может быть осуществлен в нескольких видах или формах. Согласно одному из вариантов осуществления изобретения, аналит адсорбируют на двух различных адсорбентах в двух физически различных локализациях и каждый адсорбент промывают одним и тем же элюантом (модификатором порога селективности). Согласно другому варианту аналит адсорбируют на одном и том же адсорбенте в двух физически различных локализациях и промывают двумя различными элюантами. Согласно другому варианту аналит адсорбируют на на двух различных адсорбентах в двух физически различных локализациях и промывают двумя различными элюантами. Согласно другому варианту аналит адсорбируют на адсорбенте, промывают первым элюантом и регистрируют удержание; затем адсорбированный аналит промывают вторым отличающимся элюантом и регистрируют последующее удержание.
А. Способы осуществления ретентатной хроматографии
1.Перенос аналита в селективные условия
а. Приготовление субстрата
При осуществлении ретентатной хроматографии аналит, удерживаемый адсобентом, экспонируется источнику энергии на субстрате. Образец, содержащий аналит, может быть приведен в контакт с адсорбентом до или после того, как адсорбент зафиксирован на субстрате, который будет служить для десорбции аналита. Для обеспечения контакта адсорбент может быть представлен в жидкой или твердой форме (т.е. находиться на субстрате или твердой фазе). Специфический адсорбент может иметь форму раствора, суспензии, дисперсии, эмульсии вода/масло, эмульсии масло/вода или микроэмульсии. Когда адсорбент имеет форму суспензии, дисперсии или микроэмульсии, в его состав может входить также приемлемый сурфактант. В данном варианте осуществления изобретения образец можно привести в контакт с адсорбентом путем смешивания жидкого образца с жидким адсорбентом. Альтернативно, образец может быть нанесен на твердую подложку, а контакт осуществлен погружением, намачиванием или окунанием несущей образец твердой подложки в жидкий адсорбент. Кроме того, образец можно привести в контакт путем разбрызгивания или смывания твердой подложки жидким адсорбентом. Согласно данному варианту осуществления изобретения, различные адсорбенты могут находится в различных контейнерах.
Согласно одному из вариантов осуществления изобретения адсорбент наносят на субстрат. Субстратом может быть любой материал, который способен связывать и удерживать. Обычно субстратом может являться стекло; керамика;
электропроводящие полимеры (т.е. карбонизированный PEEK); материалы, покрытые TEFLONB; органические полимеры, природные биополимеры; металлы (т.е. никель, латунь, сталь или алюминий); пленки; пористые и непористые шарики и поперечно-сшитые полимеры (т.е. агароза, целлюлоза или декстран); другие нерастворимые полимеры или их сочетания.
Согласно одному из вариантов осуществления изобретения субстрат имеет форму зонда или образца, вставляемого в десорбционный детектор. Например, как видно из фиг.1, субстрат может иметь форму полоски. Адсорбент может быть прикреплен к субстрату в виде линейного порядка пятен, каждое из которых приводится в контакт с аналитом. Несколько полос могут быть объединены так, что множество адсорбентов образуют матрицу с отдельными пятнами в каждом конкретном ряду. Субстрат также может иметь форму пластины, состоящей из горизонтальных и вертикальных рядов адсорбентов, образующих правильный геометрический порядок, такой как квадрат, прямоугольник или круг.
Пробы могут быть получены следующим образом. Субстрат может быть представлен любым твердым материалом, например решетки из нержавеющей стали, алюминия или кремния. Металлический субстрат затем покрывают материалом, который допускает дериватизацию поверхности. Например, металлическую поверхность можно покрыть окисью кремния, окисью титана или золотом.
Затем поверхность дериватизируют бифункциональным линкером, на одном конце линкер содержит функциональную группу, которая ковалентно связывается с функциональной группой на поверхности. Эта функциональная группа может быть неорганическим оксидом или сульфгидрильной группой в случае золота. На другом конце линкер обычно имеет аминогруппу. К полезным бифункциональным линкерам относятся аминопропил триэтоксисилан или аминоэтил дисульфид.
После того, как линкеры привязаны к поверхности, их далее дериватизируют группами, которые функционируют в качестве адсорбента. Обычно адсорбент наносят в предопределенные локализации на зонде. В одном случае пятна зонда имеют около 3 мм в диаметре и собраны в виде прямоугольной матрицы. Адсорбенты могут быть сами по себе частью бифункциональных молекул, содержащих группу, реагирующую с доступной аминогруппой, и функциональную группу, работающую как адсорбент. К функциональным группам относятся, например, нормально-фазная (окись кремния), обратно-фазная (C18 алифатический углеводород), четвертичный амин и сульфонат. Кроме того, поверхность можно далее дериватизировать другими бифункциональными молекулами, такими как карбодиимид и N-гидроксисукцинимид, с получением преактивированной заготовки. Такие заготовки можно дериватизировать биоорганическими адсорбентами (т.е. нуклеиновыми кислотами, антителами и другими белковыми лигандами). Биополимеры могут связываться с функциональными группами заготовок посредством аминных остатков или сульфгидрильных остатков.
Согласно одному из вариантов осуществления изобретения адсорбенты присоединены к поперечно-сшитым полимерам (т.е. пленкам), которые связаны с поврехностью зонда посредством доступных функциональных групп. К таким полимерам относятся, например, целлюлоза, декстран, карбоксиметил декстран, полиакриламид и их смеси. Зонды с присоединенными адсорбентами готовы для использования.
Согласно другому варианту осуществления изобретения адсорбент присоединен к первому субстрату с получением твердой фазы, например, к полимерным или стеклянным бусам, которые затем помещают на второй субстрат, который служит для презентации образца десорбирующей энергии детектора десорбции. Например, второй субстрат может иметь форму пластины с рядами ячеек в предопределенных локализациях. Ячейки могут служить контейнерами для первого субстрата, дериватизированного адсорбентом, например полимерных бус, дериватизированных адсорбентом. Одним из преимуществ данного варианта является то, что аналит может быть адсорбирован первым субстратом в одном физическом контексте и перенесен на представляющий субстрат для анализа десорбционной спектрометрией.
Обычно субстрат адаптируют для использования с применяемыми детекторами, которые в соответствии с настоящим изобретением применяют для обнаружения аналита, связанного адсорбентом и удерживаемого им. Согласно одному из вариантов осуществления изобретения субстрат вставляется в десорбционный детектор, где источник энергии может быть направлен на пятно и вызвать десорбцию аналита. Субстрат может быть приспособлен для монтажа на вертикально и/или горизонтально перемещаемом носителе, который вертикально и/или горизонтально перемещает субстрат в последовательные положения, подставляя источнику энергии предопределенные локализации адсорбента для детекции связанных на них аналитов. Субстрат может иметь форму обычного масс-спектрометрического зонда.
Полоски, пластины или зонды субстрата можно получить обычными методами. Затем адсорбент прямо или непрямо должен быть связан, совмещен или расположен на субстрате до приведения в контакт с образцом, содержащим аналит. Адсорбент можно прямо или непрямо соединить с субстратом любым приемлемым способом прикрепления или иммобилизации. Например, адсорбент может быть прямо присоединен к субстрату дериватизацией субстрата адсорбентом путем образования ковалентных или нековалентных связей.
Прикрепление адсорбента к субстрату может быть осуществлено посредством различных механизмов. Субстрат можно дериватизировать полностью готовой молекулой адсорбента путем присоединения ранее приготовленной молекулы адсорбента к субстрату. Альтернативно, адсорбент можно сформировать на субстрате путем прикрепления к субстрату молекул-предшественников с последующим добавлением дополнительных молекул-предшественников к растущей цепи, присоединенной к сусбстрату первой молекулой-предшественником. Этот механизм построения адсорбента на субстрате особенно полезен, когда адсорбент является полимером, в частности таким биополимером, как молекула ДНК или РНК. Биополимерный адсорбент может быть получен последовательным добавлением оснований к первому основанию, прикрепленному к субстрату с использованием методов технологии олигонуклеотидных чипов. См., напр., Патент США No.5,445,934 (Fodor et al.).
Как видно из фиг.2, всего лишь два или такое множество, как 10, 100, 1000, 10000 или более адсорбентов могут быть связаны с одним субстратом. Размер сайта адсорбента может варьировать в зависимости от способа постановки эксперимента и его целей. Однако он не должен быть больше, чем диаметр используемого источника энергии (т.е. диаметр лазерного пятна). Пятна могут содержать один и тот же или различные адсорбенты. В некоторых случаях предпочтительно получать один и тот же адсорбент во множественных локализациях на субстрате с тем, чтобы оценить воздействие множества различных элюантов, и для того, чтобы связанный аналит мог быть сохранен для дальнейшего использования в качестве референса или для последующей обработки. Получая субстрат со множеством различных адсорбентов, можно использовать множество характеристик связывания, обеспечиваемых сочетанием различных адсорбентов в отношении одного образца, и потому связывать и обнаруживать более широкое разнообразие различных аналитов. Применение множества различных адсорбентов на субстрате для оценки одного образца является, по-существу, эквивалентом конкурентно осуществляемых множественных хроматографических экспериментов, каждый из которых требует отдельной хроматографической колонки. Преимущество настоящего изобретения состоит в том, что для его осуществления требуется только одна хроматографическая система.
Когда субстрат содержит множество адсорбентов, особенно полезно получать адсорбенты в предопределенных локализациях. Получая адсорбенты в предопределенных локализациях, можно промывать адсорбент в первой предопределенной локализации первым элюантом и промывать адсорбент во второй предопределенной локализации вторым элюантом. Таким образом, характеристики связывания одного адсорбента в отношении данного аналита можно оценить в присутствии множественных элюантов, каждый из которых по своему селективно модифицирует характеристики связывания адсорбента.
Предопределенные локализации можно организовать в порядок, при этом предпочтительнее правильные порядки, такие как ряды, прямоугольные матрицы, или правильные кривые, такие как круги. Аналогично, когда субстрат содержит множество адсорбентов, можно оценить один конкретный элюант в отношении каждого различного адсорбента с получением характеристик связывания данного адсорбента в присутствии элюанта. Можно также оценить характеристики связывания различных адсорбентов в присутствии различных элюантов.
(1) Нарастающие или градиентные адсорбирующие поверхности
Можно получить серии адсорбентов с различающимися характеристиками связывания, синтезируя множество различных полимерных адсорбентов на субстрате. Различные полимерные адсорбенты можно получить путем прикрепления к субстрату молекулы-предшественника, инициализацией реакции полимеризации и терминацией реакции полимеризации на различных стадиях завершения для каждого адсорбента. Терминальные функциональные группы полимеров могут быть химически дериватизированы в различной степени различными аффинными реагентами (напр., -NН3, или СОО–). При терминации реакции полимеризации или дериватизации получают адсорбенты с различной степенью полимеризации или дериватизации. Различные степени полимеризации или дериватизации обеспечивают различающиеся характеристики связывания для каждого индивидуального полимерного адсорбента. Данный вариант осуществления изобретения особенно применим для получения множества различных биополимерных адсорбентов на субстрате.
По желанию реакцию полимеризации можно осуществить в реакционном сосуде, а не собственно на субстрате. Например, полимерные адсорбенты с различающимися характеристиками связывания можно получить, извлекая аликвоту продукта из реакционного сосуда в ходе реакции полимеризации/дериватизации. Аликвоты, отобранные в различных временных точках в ходе реакции полимеризации/дериватизации, будут обладать различной степенью полимеризации/дериватизации с полученим множества различных адсорбентов. Различные аликвоты продукта затем можно использовать в качестве адсорбентов с различными характеристиками связывания. Альтернативно, множество различных адсорбентов можно получить последовательно повторяя этап терминации реакции, отбирая аликвоту продукта и повторно запуская реакцию полимеризации/дериватизации. Продукты, полученные в каждой точке терминации, будут обладать различной степенью полимеризации/дериватизации и в результате давать множество адсорбентов, обладающих различающимися характеристиками связывания.
Согласно одному из вариантов осуществления изобретения субстрат получают в виде полосы или пластины, покрытой адсорбентом, в которой одна или несколько характеристик связывания варьируют в одно- или двухмерном градиенте. Например, получают полосу с адсорбентом, который слабогидрофобен на одном конце и сильногидрофобен на другом. Или получают пластину, которая слабогидрофобна и анионна в одном углу и сильногидрофобна и анионна в диагонально противоположном углу. Такие градиенты адсорбции полезны при качественном анализе аналита. Градиенты адсорбции можно получить контролируемым распылением или наливом материала на поверхность в течение такого времени, которое обеспечивало бы возрастающее завершение реакции с формированием градиента. Этот процесс можно повторить под прямым углом с получением прямоугольных градиентов сходных или различных адсорбентов с различающимися характеристиками связывания.
Содержащий аналит образец можно привести в контакт с адсорбентом до или после того, как адсорбент расположен на субстрате удобным способом, обеспечивающим связывание между аналитом и адсорбентом. Адсорбент можно просто смешать с образцом. Образец можно привести в контакт с адсорбентом окунанием или погружением субстрата в образец, распылением образца над субстратом, промывкой субстрата образцом или же путем непосредственного образования образца или аналита в контакте с адсорбентом. Кроме того, образец можно привести в контакт с адсорбентом солюбилизацией образца или смешиванием образца с элюантом и приведением в контакт с адсорбентом раствора элюанта с образцом с применением любого из указанных далее способов (напр., окунанием, погружением, распылением или промывкой).
б. Приведение аналита в контакт с адсорбентом
Обработка образца элюантом до связывания аналита асдорбентом оказывает модифицирующий эффект на селективность адсорбента, при этом одновременно происходит контакт образца с адсорбентом. К тем компонентам образца, которые будут связываться с адсорбентом и потому удерживаться, относятся только те компоненты, которые будут связываться с адсорбентом в присутствии конкретного элюанта, а не все компоненты, которые будут связываться с адсорбентом в отсутствие характеристик элюции, которые модифицируют селективность адсорбента.
Образец должен быть приведен в контакт с адсорбентом в течение такого периода времени, который достаточен для связывания аналита с адсорбентом. Обычно образец приводят в контакт с адсорбентом в течение периода времени от 30 секунд до 12 часов. Предпочтительно образец приводят в контакт с адсорбентом в течение периода времени от 30 секунд до 15 минут.
Температура, при которой образец приводят в контакт с адсорбентом, зависит от конкретного отбразца и выбранных адсорбентов. Обычно образец приводят в контакт с адсорбентом при нормальных температуре и давлении, однако, для некоторых образцов могут потребоваться измененная температура (обычно от 4°С до 37°С) и давление, которые достаточно легко определяются квалифицированным специалистом.
Другим преимуществом настоящего изобретения над обычными способами детекции является то, что оно дает возможность проведения многочисленных различных экспериментов с очень небольшим количеством образца. Обычно в объеме образца содержится от нескольких атоммолей до 100 пикомолей аналита в объеме от 1 мкл до 500 мкл, что достаточно для связывания с адсорбентом. Аналит можно сохранить для последующих экспериментов после связывания адсорбентом, поскольку любые локализации адсорбента, которые не были подвергнуты этапам десорбции и детекции всего удерживаемого аналита, будут сохранять на себе аналит. Соответственно в тех случаях, когда для анализа доступен образец очень малого объема, настоящее изобретение имеет преимущество и дает возможность проведения множества экспериментов в различными адсорбентами и/или элюантами в различные сроки без отмывки образца.
в. Промывка адсорбента элюантами
После того, как образец приведен в контакт с аналитом, что обеспечивает связывание аналита с адсорбентом, адсорбент промывают элюантом. Обычно при проведении многомерного анализа адсорбент в каждом пятне промывают как минимум первым и вторым отличающимися элюантами. Промывка элюантами модифицирует популяцию аналита, удерживаемую специфическим адсорбентом. Комбинация характеристик связывания адсорбента и характеристик элюции элюанта обеспечивает условия селективности, удерживающие аналиты на адсорбенте после промывки. Таким образом, стадия промывки селективно удаляет компоненты образца из адсорбента.
Стадию промывки можно проводить с использованием разнообразных методов. Например, как показано выше, образец можно солюбилизировать или смешать с первым элюантом до приведения образца в контакт с адсорбентом. Обработка образца первым элюантом до или одновременно с приведением в контакт с адсорбентом по сути оказывает такой же эффект, как и связывание аналита с адсорбентом с последующей промывкой адсорбента первым элюантом. После того, как смешанный раствор нанесен на адсорбент, адсорбент можно промыть вторым или последующим элюантами.
Промывка адсорбента с присоединенным к нему аналитом достигается окунанием, погружением субстрата в элюант; или ополаскиванием, разбрызгиванием или наливом элюанта на субстрат. Введение элюанта в пятна аффинного реагента малого диаметра лучше всего достигается процессом микрофлюидизации.
Когда аналит присоединен к адсорбенту только в одной локализации, а на этапах промывки используется множество различных элюантов, можно получить информацию относительно селективности адсорбента индивидуально в присутствии каждого элюанта. Аналит, присоединенный к адсорбенту в одной локализации, можно определить после каждой промывки элюантом, последовательно осуществляя промывку первым элюантом, десорбцию и детекцию удержанного аналита, промывку вторым элюантом, десорбцию и детекцию удержанного аналита. Десорбция и детекция, следующие за этапами промывки, могут последовательно повторяться со множеством различных элюантов на одном и том же адсорбенте. Таким образом, адсорбент с присоединенным к нему в единственной локализации аналитом можно перепроверить со множеством различных элюантов, получая информацию об аналитах, удерживаемых после каждой индивидуальной промывки.
Описываемые далее методы также применимы когда адсорбенты находятся во множестве предопределенных локализаций, независимо от того, один ли это адсорбент или разные. Однако, когда аналит связан с одним и тем же адсорбентом или с различными адсорбентами во множестве локализаций, этап промывки можно альтернативно осуществить, используя более систематический и эффективный подход параллельной обработки. А именно, этап промывки осуществляют, промывая адсорбент элюантом в первой локализации, затем промывая второй адсорбент элюантом, затем десорбируя и детектируя аналит, удержанный первым адсорбентом, а затем десорбируя и детектируя аналит, удержанный вторым адсорбентом. Другими словами, все адсорбенты промывают элюантом, а затем удержанный каждым из них аналит десорбируют и детектируют для каждой локализации адсорбента. По желанию, после детекции в каждой локализации адсорбента, может быть проведен второй этап промывки каждой локализации адсорбента за которым следует второй этап десорбции и детекции. Этапы промывки всех локализаций адсорбента, за которыми следуют десорбция и детекция в каждой локализации адсорбента, могут быть повторены для множества различных элюантов. Таким способом вся матрица может быть использована для эффективного определения характера аналитов в образце. Данный метод применим независимо от того, все ли локализации адсорбента промывают одним элюантом на первом этапе промывки или же множество адсорбентов промывают множеством различных элюантов на первом этапе промывки.
2. Детекция
Аналиты, удержанные адсорбентом после промывки, адсорбированы на субстрате. Удерживаемые на субстрате аналиты обнаруживают десорбционной спектрометрией: десорбируют аналит с адсорбента и прямо определяют десорбированные аналиты.
а. Способы десорбции
Десорбция аналита с адсорбента предусматривает обработку аналита соответствующим источником энергии. Обычно это означает обработку аналита излучением или энергетическими частицами. Например, энергия может быть в виде энергии света, например лазерной энергией (т.е. УФ лазер), или энергией от лампы-вспышки. Альтернативно, энегрия может быть в виде потока быстрых атомов. Тепло также можно использовать для индукции десорбции.
Способы десорбции и/или ионизации аналитов для прямого анализа хорошо известны из уровня техники. Один из таких способов называется матриксная лазерная десорбция/ионизация или MALDI. При проведении MALDI раствор аналита смешивают с раствором матрикса и смеси дают закристаллизоваться на поверхности инертного зонда, удержание аналита в кристаллах создает возможность десорбции. Матрикс выбирают таким образом, чтобы он поглощал энергию лазера и непосредственно передавал ее аналиту, делая возможными десорбцию и ионизацию. Обычно матрикс поглощает в УФ области. MALDI для крупных белков описана, например, в Патенте США No.5,118,937 (Hillenkamp et al.) и Патенте США No.5,045,694 (Beavis and Chait).
Поверхностно-усиленная лазерная десорбция/ионизация, или SELDI, имеет существенное примущество над MALDI в отношении специфичности, селективности и чувствительности. SELDI описана в Патенте США No.5,719,060 (Hutchens and Yip). SELDI является твердофазным методом десорбции, согласно которому аналит презентируется источнику энергии на поверхности, которая усиливает удержание и/или десорбцию аналита. Наоборот, MALDI является жидкофазным методом и аналит смешивают в жидким материалом, который кристаллизуется вокруг аналита.
Один из вариантов SELDI, называемый SEAC (Surface-Enhanced Affinity Capture), подразумевает презентацию аналита источнику десорбирующей энергии в сочетании с аффинным удерживающим устройством (т.е., адсорбентом). Было показано, что когда аналит адсорбирован таким образом, его можно презентировать источнику десорбирующей энергии с большими возможностями достижения десорбции аналита-мишени. Для облегчения десорбции к зонду может быть добавлен абсорбирующий энергию материал. Затем зонд презентируют источнику энергии для десорбции аналита.
Другая версия SELDI, называемая SEND (Surface-Enhanced Neat Desorption) подразумевает использование слоя абсорбирующего энергию материала, на котором размещается аналит. Поверхность субстрата содержит слой абсорбирующих энергию молекул, химически связанных с поверхностью и/или практически свободных от кристаллов. Затем чистый (неразбавленный) аналит наносят на поверхность слоя без существенного перемешивания с ним. Абсорбирующие энергию молекулы, как и матрикс, абсорбируют десорбирующую энергию, что приводит к десорбции аналита. Это усовершенствование существенно, поскольку аналиты могут могут быть представлены источнику энергии более простым и однородным способом, поскольку исключается вклад смешанных растворов и случайной кристаллизации. Это дает более однородные и предсказуемые результаты и создает возможность автоматизации процесса. Абсорбирующий энергию материал может представлять собой классический матриксный материал, или же быть матриксным материалом, чей рН нейтрализован или находится в основном интервале. Абсорбирующие энергию молекулы могут быть присоединены к зонду ковалентно или нековалентно.
В другой версии SELDI, называемой SEPAR (Surface-Enhanced Photolabile Attachment and Release) используются фотолабильные молекулы прикрепления. Фотолабильная молекула прикрепления – это дивалентная молекула, у которой один сайт ковалентно связан с твердой фазой, такой как плоская поверхность зонда, или с другой твердой фазой, такой как бусы, а второй сайт может может быть ковалентно связан с аффиным реагентом или аналитом. Фотолабильная молекула прикрепления, будучи связана с поверхностью и аналитом, также содержит фотолабильную связь, которая может высвобождать аффинный реагент или аналит под действием света. Фотолабильная связь может находиться как в молекуле прикрепления, так и в сайте прикрепления аналита (или аффинного реагента) или поверхности зонда.
б. Способ прямого обнаружения аналитов
Десорбированный аналит можно обнаружить различными способами. Когда аналит ионизируется в процессе десорбции, как это происходит при лазерной десорбционно-ионизационной масс-спектрометрии, детектор может быть детектором ионов. Масс-спектрометры обычно могут определять время полета десорбированных ионов. Эта информация дает представление о массе ионов. Однако для разрешения и детекции десорбированных ионов нет необходимости определять их массу: тот факт, что ионизированные аналиты ударяются о детектор в различное время, обеспечивает их разрешение и детекцию.
Альтернативно, аналит может быть помечен, например, флуоресцентной или радиоактивной меткой. В этих случаях детектор может быть детектором флуоресценции или радиоактивности.
Можно последовательно использовать множество способов детекции для полного исследования компонентов аналита или функции, связанной с удержанным на каждой локализации матрицы аналитом.
в. Детекторы десорбции
Детекторы десорбции дают возможность десорбировать аналит с адсорбента, а также возможность прямой детекции десорбированного аналита. То есть детектор десорбции обнаруживает десорбированный аналит без промежуточного этапа удержания аналита на другой твердой фазе. Детекция аналита обычно подразумевает определение силы сигнала. Она, в свою очередь, отражает количество аналита, адсорбированного адсорбентом.
Кроме этих двух элементов детектор десорбции может также включать и другие элементы. Один из таких элементов дает возможность разгонять десорбированный аналит по направлению к детектору. Другой элемент дает возможность определять время полета аналита от момента десорбции до момента детекции детектором.
Предпочтительным детектором десорбции является лазерный десорбционно-ионизационный масс-спектрометр, хорошо известный из уровня техники. Масс-спектрометр имеет порт, в который вставляется зонд, т.е. субстрат, несущий адсорбированные аналиты. Десорбция осуществляется за счет передаваемой аналиту энергии, в частности энергии лазера. Устройство обеспечивает перемещение поверхности таким образом, чтобы под луч лазера попадало любое пятно на матрице. Обработка аналита лазером приводит к десорбции интактного аналита в рукав (flight tube) и его ионизации. В рукаве обычно создается вакуум. Заряженные пластины, расположенные на некотором участке рукава, создают электрический потенциал, который разгоняет ионизированный аналит в направлении детектора. Часы измеряют время полета, а электронная система определяет скорость аналита и конвертирует ее в массу. Как очевидно любому квалифицированному специалисту, любой из этих элементов можно комбинировать с другими описанными элементами при сборке детекторов десорбции, в которых используются различные подходы для десорбции, акселерации, детекции, измерения времени и т.д.
Б. Условия селективности
Одно из преимуществ настоящего изобретения состоит в возможности обработки аналитов во множестве разнобразных условий связывания и элюции, получая тем самым повышенное разрешение аналитов и информацию о них в виде профиля распознавания. Как и в случае обычных хроматографических методов, способность адсорбента удерживать аналит прямо зависит от привлечения или аффинности аналита к адсорбенту по сравнению с привлечением или аффинностью аналита к элюанту или элюанта к адсорбенту. Некоторые компоненты образца могут не иметь аффинности к адсорбенту и потому не будут связываться адсорбентом, когда образец приводят в контакт с данным адсорбентом. В силу их неспособности связываться адсорбентом эти компонеты будут немедленно отделены от аналита, подлежащего разрешению. Однако в зависимости от природы образца и конкретного используемого адсорбента, к адсорбенту могут быть изначально присоединены различные компоненты.
1. Адсорбенты
Адсорбенты являются материалами, которые связывают аналиты. В ретентатной хроматографии может быть использовано множество адсорбентов. Различные адсорбенты могут обладать сильно различающимися характеристиками связывания, умеренно различающимися характеристиками связывания или слегка различающимися характеристиками связывания. Адсорбенты, обладающие сильно различающимися характеристиками связывания, обычно отличаются по основам аффинности или способу взаимодействия. Основа аффинности обычно является функцией химического или биологического молекулярного распознавания. К основам аффинности между адсорбентом и аналитом относятся, например, (1) взаимодействия, потенцируемые солью, т.е. гидрофобные взаимодействия, тиофильные взаимодействия и взаимодействия с иммобилизованными красителями; (2) взаимодействия на основе водородных связей и/или сил Ван дер Ваальса, а также взаимодействия на основе переноса заряда, как в случае гидрофильных взаимодействий; (3) электростатические взаимодействия, такие как взаимодействия ионных зарядов, в частности взаимодействия положительных и отрицательных ионов; (4) способность аналита образовывать координатные ковалентные связи (т.е. образование координатного комплекса) с ионом металла в адсорбенте; (5) связывание с активным сайтом фермента; (6) обратимые ковалентные взаимодействия, например взаимодействия на основе замены дисульфида; (7) гликопротеиновые взаимодействия; (8) биоспецифические взаимодействия; или (9) сочетания двух или более перечисленных типов взаимодействий. Адсорбент, обладающий двумя или более основами аффинности, называют асдорбентом “смешанной функциональности”.
а. Адсорбенты взаимодействия, потенцируемого солью
К адсорбентам, которые применимы для изучения взаимодействия, потенцируемого солью, относятся адсорбенты гидрофобного взаимодействия. Примерами адсорбентов гидрофобного взаимодействия могут служить матриксы с алифатическими углеводородами, в частности C1-C18 алифатическими углеводородами, и матриксы с ароматическими углеводородными функциональными группами, такими как фенильные группы. Адсорбенты гидрофобного взаимодействия связывают аналиты, на которых экспонированы незаряженные аминокислотные остатки, в частности такие аминокислотные остатки, как неполярные, ароматические и гидрофобные аминокислотные остатки, такие как фенилаланин и триптофан. Конкретными примерами аналитов, которые будут связываться с адсорбентом гидрофобного взаимодействия, являются лизоцим и ДНК. Без стремления ограничиваться какой-либо конкретной теорией, полагают, что ДНК связывается с адсорбентами гидрофобного взаимодействия посредством ароматических нуклеотидов, в частности пуриновых и пиримидиновых групп.
Другим типом адсорбентов, которые применимы для изучения взаимодействия, потенцируемого солью, относятся адсорбенты тиофильного взаимодействия, такие, например, как T-GELB, который является одним из типов адсорбентов тиофильного взаимодействия, коммерчески доступных от Pierce, Rockford, Illinois. Адсорбенты тиофильного взаимодействия связывают, например, такие иммунологобулины, как IgG. Механизм взаимодействия между IgG и T-GELB полностью не установлен, но, по-видимому, в нем играют роль экспонированные остатки триптофана.
Третьим типом адсорбентов, в которых задействованы промотируемые солью ионные взаимодействия и также гидрофобные взаимодействия, являются адсорбенты взаимодействия с иммобилизованным красителем. К адсорбентам взаимодействия с иммобилизованным красителем относятся матрицы с иммобилизованнымм красителями, такие как CIBACRON голубой, производимый Pharmacia Biotech, Piscataway, New Jersey. Адсорбенты взаимодействия с иммобилизованным красителем связывают белки и ДНК вообще. Одним специфическим примером белка, который связывается адсорбентами взаимодействия с иммобилизованным красителем, является бычий сывороточный альбумин (БСА). голубой, производимый Pharmacia Biotech, Piscataway, New Jersey. Адсорбенты взаимодействия с иммобилизованным красителем связывают белки и ДНК вообще. Одним специфическим примером белка, который связывается адсорбентами взаимодействия с иммобилизованным красителем, является бычий сывороточный альбумин (БСА).
б. Адсорбенты гидрофильного взаимодействия
К адсорбентам, которые применимы для изучения водородных связей или сил Вандерваальса как основы гидрофильного взаимодействия, относятся поверхности, содержащие нормально-фазный адсорбент, такой как окись кремния (т.е., стекло). Нормально-фазная или кремний-оксидная поверхность действует как функциональная группа. Кроме того, адсорбенты, представленные поверхностями, модифицированными гидрофильными полимерами, такими как полиэтиленгликоль, декстран, агароза или целлюлоза, также могут действовать как адсорбенты гидрофильного взаимодействия. Большинство белков будет связываться адсорбентами гидрофильного взаимодействия из-за наличия групп или сочетаний аминокислотных остатков (т.е. гидрофильных аминокислотных остатков), которые связываются путем гидрофильного взаимодействия с участием водородных связей или сил Вандерваальса. Примерами белков, которые будут связываться адсорбентами гидрофильного взаимодействия, являются миоглобин, инсулин и цитохром С.
В целом, белки с высокой долей полярных или заряженных аминокислот будут удерживаться на гидрофильной поверхности. Альтернативно гликопротеины с экспонированными гидрофильными граппами Сахаров также имеют высокую аффинность к гидрофильным адсорбентам.
в. Адсорбенты электростатического взаимодействия
К адсорбентам, применимым для изучения электростатических или ионно-заряженных взаимодействий, относятся такие анионные адсорбенты, как, например, матрицы с анионами сульфата (т.е., SO3 –), матрицы с анионами карбоксилата (т.е. СОO–) или анионами фосфата (OPO3 –). Матрицы с анионами сульфата постоянно заряжены отрицательно. Однако матрицы с анионами карбоксилата заряжены отрицательно только при рН выше рКа. При рН ниже рКа матрицы обладают по существу нейтральным зарядом. К приемлемым анионным адсорбентам относятся также матрицы с сочетанием сульфатных, карбоксилатных и фосфатных анионов. Сочетание обеспечивает такую интенсивность отрицательного заряда, которая может постоянно варьировать как функция рН. Эти адсорбенты привлекают и связывают белки и макромолекулы, имеющие положительные заряды, такие, например, как рибонуклеаза и лактоферрин, без стремления ограничиваться какой-либо конкретной теорией, полагают, что электростатическое взаимодействие между адсорбентом и положительно заряженными аминокислотными остатками, включая остатки лизина, остатки аргинина и остатки гистидила, ответственны за взаимодействие связывания.
Другими адсорбентами, применимыми для изучения электростатических или ионно-заряженных взаимодействий, являются катионные адсорбенты. Конкретными примерами катионных адсорбентов являются матрицы вторичных, третичных и четвертичных аминов. Четвертичные амины постоянно положительно заряжены. Однако заряд вторичных и четвертичных аминов зависит от рН. При рН ниже рКа вторичные и четвертичные амины заряжены положительно, а при рН выше рКа они заряжены отрицательно. К приемлемым катионным адсорбентам также относятся катионные адсорбенты, представляющие собой матрицы с сочетанием различных вторичных, третичных и четвертичных аминов. Сочетание обеспечивает такую интенсивность положительного заряда, которая может постоянно варьировать как функция рН. Адсорбенты катионного взаимодействия связывают анионные сайты на молекулах, к которым относятся, например, белки с экспонированными аминокислотными остатками, такими как остатки аспарагиновой кислоты и глутаминовой кислоты.
В случае адсорбентов ионного взаимодействия (как анионных, так и катионных) часто требуется получать асдорбенты смешанного действия, содержащие как анионы, так и катионы. Такие адсорбенты обеспечивают постоянную буферную емкость как функцию рН. Постоянная буферная емкость дает возможность обрабатывать сочетания аналитов элюантами, имеющими различные буферные компоненты, особенно в интервале рН от 2 до 11. Это приводит к образованию локального рН окружения на адсорбенте, которое определяется иммобилизованными титруемыми протоно-обменными группами. Подобные системы эквивалентны методу твердофазного разделения, известного как хроматофокусировка. Изоформы фолликуло-стимулирующего гормона, которые различаются в основном содержанием заряженных углеводов, разделяют на хроматофокусирующем адсорбенте.
К другим адсорбентам, полезным для изучения электростатических взаимодействий, относятся адсорбенты диполь-дипольного взаимодействия, при котором взаимодействие является электростатическим, но в нем не участвуют формальный заряд или титруемый донор или акцептор.
г. Адсорбенты координатного ковалентного взаимодействия
К адсорбентам, применимым для изучения способности образовывать координатные ковалентные связи с ионами металлов, относятся матрицы, несущие, например, ионы двухвалентных и трехвалентных металлов. Матрицы с иммобилизованными хелаторами ионов металлов получают на основе иммобилизованных органических синтетических молекул, которые имеют одну или несколько электронно-донорных групп, которые образуют основу для координатных ковалентных взаимодействий с ионами переходных металлов. К первичным электронно-донорным группам, функционирующим как иммобилизованные хелаторы ионов металлов, относятся кислород, азот и сера. Ионы металлов связываются с иммобилизованными хелаторами ионов металлов, что приводит к образованию комплекса ионов металлов, у которого еще остается некоторое число сайтов для взаимодействия с электронно-донорными группами аналита. К приемлемым ионам металлов относятся вообще ионы переходных металлов, таких, как медь, никель, кобальт, цинк, железо, а также ионы других металлов, например алюминий и кальций. Без стремления ограничиваться какой-либо конкретной теорией, полагают, что ионы металлов взаимодействуют селективно со специфическими аминокислотными остатками пептидов, белков, или с нуклеиновыми кислотами. Обычно к аминокислотным остаткам, участвующим в таких взаимодействиях, относятся остатки гистидина, остатки тирозина, остатки триптофана, остатки цистеина и аминокислотные остатки, содержащие кислородные группы, такие как аспарагиновая кислота и глутаминовая кислота. Например, иммобилизованные ионы железа взаимодействуют с фосфосериновыми, фосфотирозиновыми и фосфотреониновыми остатками в белках. В зависимости от иммобилизованного иона металла адсорбентом будут удерживаться только те белки, которые обладают достаточной локальной плотностью предыдущих аминокислотынх остатков. В некоторых случаях взаимодействие между ионами металла и белками бывают такими сильными, что обычными способами освободить белок из комплекса не удается b-казеин человека, который высоко фосфорилирован, очень сильно связывается с иммобилизованным Fe(III). Рекомбинантные белки, несущие метку в виде 6-гистидина, очень сильно связываются с иммобилизованными Cu(II) и Ni(II).
д. Адсорбенты на основе взаимодействия с активным сайтом фермента
К адсорбентам, применимым для изучения взаимодействия с активным сайтом фермента, относятся протеазы (такие как трипсин), фосфатазы, киназы и пуклеазы. В данном случае взаимодействие является оследовательность-специфичным взаимодействием сайта связывания фермента на аналите (обычно биополимере) с каталитическим сайтом связывания фермента. К сайтам связывания фермента данного типа относятся, например, активные сайты трипсина, взимодействующие с белками и пептидами, имеющими в своих последовательностях лизин-лизиновые и лизин-аргининовые фрагменты. Более конкретно, ингибитор трипсина из соевых бобов взаимодействует и связывается с адсорбентом с иммобилизованным трипсином. Альтернативно сериновые протеазы селективно удерживаются на адсорбенте с иммобилизованным L-аргинином.
е. Адсорбенты обратимого ковалентного взаимодействия
К адсорбентам, применимым для изучения обратимого ковалентного взаимодействия, относятся адсорбенты дисульфидного взаимодействия. Адсорбенты дисульфидного взаимодействия включают адсорбенты с иммобилизованными сульфгидрильными группами, т.е. меркапоэтанол или иммобилизованный дитиотрейтол. Взаимодействие основано на образовании ковалентных дисульфидных связей между имеющимися на аналите остатками цистеина после приведения в контакт с адсорбентом и растворителем. Такие адсорбенты связывают белки или пептиды, имеющие остатки цистеина, а также нуклеиновые кислоты, которые содержат основания, модифицированные восстановленной серой.
ж. Адсорбенты гликопротеинового взаимодействия
К адсорбентам гликопротеинового взаимодействия относятся такие, как адсорбенты с иммобилизованными пектинами (т.е. белками, несущими олигосахариды), примером которых служит CONCANAVALIN , производимый Pharmacia Biotech, Piscataway, New Jersey. Такие адсорбенты функционируют на основе взаимодействия, в котором участвует молекулярное распознавание углеводородной части макромолекул. Примерами аналитов, которые взаимодействуют и связываются адсорбентами гликопротеинового взаимодействия, являются гликопротеины, в частности гликопротеины, богатые гистиднном, целые клетки и выделенные субклеточные фракции. , производимый Pharmacia Biotech, Piscataway, New Jersey. Такие адсорбенты функционируют на основе взаимодействия, в котором участвует молекулярное распознавание углеводородной части макромолекул. Примерами аналитов, которые взаимодействуют и связываются адсорбентами гликопротеинового взаимодействия, являются гликопротеины, в частности гликопротеины, богатые гистиднном, целые клетки и выделенные субклеточные фракции.
з. Адсорбенты биоспецифического взаимодействия
Адсорбенты, применимые для изучения биоспецифических взаимодействий, обычно называют “адсорбентами биоспецифической аффинности”. Адсорбция считается биоспецифической если она специфична и аффинность (константа равновесной диссоциации, Kd) составляет по меньшей мере 10-3 М (напр., 10-5 М, 10-7 М, 10-9 М). Примерами адсорбентов биоспецифической аффинности служат любые адсорбенты, которые специфически взаимодействуют с конкретной биомолекулой и связывают ее. К адсорбентам биоспецифической аффинности относятся, например, иммобилизованные антитела, которые связывают антигены; иммобилизованные ДНК, которые связывают ДНК-связывающие белки, ДНК и РНК; иммобилизованные субстраты или ингибиторы, которые связывают белки и ферменты; иммобилизованные препараты, которые связывают препарат – связывающие белки; иммобилизованные лиганды, которые связывают рецепторы; иммобилизованные рецепторы, которые связывают лиганды; иммобилизованные РНК, которые связывают ДНК- и РНК-связывающие белки; иммобилизованный авидин или стрептавидин, которые связывают биотин и биотинилированные молекулы; иммобилизованные фосфолипидные мембраны и везикулы, которые связывают липид-связывающие белки. Ферменты служат полезными адсорбентами, которые могут модифицировать адсорбированный аналит. Клетки также могут быть полезными адсорбентами. На их поверхностях представлен комплекс связывающих характеристик. Адсорбция клетками полезна, например, для идентификации лигандов или сигнальных молекул, связывающихся с рецепторами поверхности. Вирусы или фаги также могут быть полезными адсорбентами. Вирусы часто несут лиганды к рецепторам клеточной поверхности (напр., gp l20 для CD4). Также в виде фаговой библиотеки фаговые поверхностные белки выступают в качестве агентов для тестирования связывания с мишенями. Адсорбенты биоспецифического взаимодействия основаны на известных специфических взаимодействиях, подобным перечисленным выше.
Согласно одному из вариантов осуществления изобретения биоспецифический адсорбент может также содержать дополнительную или “хелперную” молекулу, которая прямо не участвует в связывании аналита-мишени.
ж. Степень специфичности связывания
Приведением в контакт с адсорбентами, имеющими различные способы взаимодействия, содержащиеся в образце компоненты, могут быть в основном разделены на основе их взаимодействия с различными адсорбентами. Таким образом, привлечение аналита адсорбентами, имеющими различные способы взаимодействия, обеспечивает первый параметр разделения. Например, приведение образца, содержащего аналит, в контакт с первым адсорбентом, аффиность которого основана на гидрофобности, и вторым адсорбентом, аффиность которого основана на ионном заряде, можно выделить из образца те аналиты, которые связываются с гидрофобным адсорбентом, и разделить те аналиты, которые связываются с адсорбентом, имеющим конкретный ионный заряд.
Адсорбенты, имеющие различные основы аффиности, обеспечивают резрешение аналита с низкой степенью специфичности, поскольку адсорбент будет связывать не только аналит, но также и любые другие компоненты образца, имеющие ту же основу аффиности. Например, гидрофобный адсорбент будет связывать не только гидрофобный аналит, но также и любые другие гидрофобные компоненты образца; отрицательно заряженный адсорбент будет связывать не только положительно заряженный аналит, но также и любые другие положительно заряженные компоненты образца; и т.д.
Разрешение аналитов на основе аффинности аналита к адсорбенту может быть повышено применением характеристик связывания относительно промежуточной специфичности или измененной силы привлечения. Может быть достигнуто разделение аналита на основе характеристик связывания промежуточной специфичности, например, при использовании адсорбентов смешанной функциональности. После того, как разрешение аналита завершено с относительно низкой специфичностью, характеристика связывания, для которой показано привлечение интересующего аналита, может быть использована в сочетании с другими разнообразными характеристиками связывания или элюции для удаления большего числа нежелательных компонентов и, тем самым, с достижением более высокого разрешения аналита.
Например, если аналит связывается гидрофобными адсорбентами, то его можно далее разрешить от других гидрофобных компонентов образца, получая адсорбент смешанной функциональности, у которого одной основой аффинности служит гидрофобное взаимодействие, но имеется еще и отличная, другая основа аффинности. Адсорбент смешанной функциональности может обладать гидрофобным взаимодействием и взаимодействием на основе отрицательно заряженных ионов, связывая гидрофобные аналиты, которые заряжены положительно. Альтернативно, адсорбент смешанной функциональности может обладать гидрофобным взаимодействием и и способностью образовывать координатные ковалентные связи и ионами металлов, связывая гидрофобные аналиты, которые обладают способностью образовывать координатные комплексы с ионами металлов на адсорбенте. Другие примеры адсорбентов, обладающих характеристиками связывания промежуточной специфичности, будут очевидны квалифицированному специалисту с учетом описания и примеров, приведенных в настоящей заявке.
Разделение аналитов на основе характеристик связывания промежуточной специфичности может быть далее повышено использованием характеристик связывания относительно высокой специфичности. Характеристики связывания относительно высокой специфичности можно использовать, применяя различные адсорбенты с одной и той же основой аффинности, но различающейся силой аффинности. Другими словами, при том, что основа аффинности остается той же самой, может быть достигнуто более тонкое разрешение аналита от других компонентов образца путем использования адсорбентов, имеющих различные степени аффинности к аналиту.
Например, аналит, который связывается адсорбентом на основе кислой природы аналита, может быть отделен от других кислых компонентов образца при испоьзовании адсорбентов с аффинностью к аналитам в конкретных кислых интервалах рН. Таким образом, аналит можно разрешить, применяя один адсорбент, извлекающий компоненты образца в интервале рН 1-2, другой адсорбент, извлекающий компоненты образца в интервале рН 3-4, и третий адсорбент, извлекающий компоненты образца в в интервале рН 5-6. Таким образом, аналит, обладающий специфической аффинностью к адсорбенту, связывающему аналит в интервале рН 5-6, будет разделен от компонентов образца, имеющих рН в интервале рН 1-4. Адсорбенты возрастающей специфичности можно использовать снижая интервал аффиности, т.е., различия в характеристиках связывания адсорбентов, основанных на одной и той же природе аффинности.
Первичный аналит, адсорбированный на первичном адсорбенте, сам по себе может обладать свойствами адсорбента. В этом случае первичный аналит, адсорбированный на субстрате, может становиться вторичным адсорбентом для выделения вторичных аналитов. В свою очередь, удержанный вторичный аналит может функционировать как четвертичный адсорбент для выделения четвертичных аналитов из образца. Этот процесс может повторяться несколько раз.
2. Элюанты
Элюанты или промывочные растворы селективно модифицируют порог адсорбции между аналитом и адсорбентом. Способность элюанта десорбировать и элюировать связанный аналит является функцией его характеристик элюции. Различные элюанты могут иметь сильно различающиеся характеристики элюции, умеренно различающиеся характеристики элюции или незначительно различающиеся характеристики элюции.
Обычно элюант приводят в контакт с адсорбентом при температуре от 0°С до 100°С, предпочтительно в интервале от 4°С до 37°С. Однако для некоторых элюантов может потребоваться другая температура, которая легко определима квалифицированным специалистом.
Как и в случае адсорбентов, элюанты с сильно различающимися характеристиками элюции, обычно различаются по основе аффинности. Например, к различным основам аффинности между элюантом и аналитом относятся заряд или рН, ионная сила, структура воды, сонцентрации специфических конкурентных связывающих агентов, поверхностное натяжение, диэлектрическая константа и сочетания двух или более перечисленных факторов.
а. Элюанты на основе рН
К элюантам, которые модифицируют селективность адсорбента на основе рН (т.е. заряда), относятся известные рН буферы, кислые растворы и основные растворы. Помывкой аналита, присоединенного к данному адсорбенту, буфером с конкретным значением рН, заряд может быть модифицирован и, соответственно, сила связывания между адсорбентом и аналитом в присутствии буфера с конкретным значением рН, также изменяется. Те аналиты, которые менее конкурентны в отношении адсорбента, чем другие, при данном значении рН элюанта будут десорбироваться с адсорбента и элюироваться. При этом будут оставаться связанными только те аналиты, которые более прочно связаны с адсорбентом при данном значении рН элюанта.
б. Элюанты на основе ионной силы
К элюантам, которые модифицируют селективность адсорбента в отношении ионной силы, относятся растворы солей различных типов и концентраций. Количество соли, солюбилизированной в растворе элюанта, влияет на ионную силу элюанта и, соответственно, модифицирует связывающую способность адсорбента. Элюанты с низкой концентрацией соли обеспечивают слабую модификацию связывающей способности адсорбента в отношении ионной силы. Элюанты с высокой концентрацией соли обеспечивают более сильную модификацию связывающей способности адсорбента в отношении ионной силы.
в. Элюанты на основе структуры воды
К элюантам, которые модифицируют селективность адсорбента изменением структуры воды или концентраций, относятся мочевина и растворы хаотропных солей. Обычно используют растворы мочевины в интервале концентраций от 0.1 до 8 М. При получении элюантов можно использовать хаотропные соли, включая тиоцианат натрия. Элюанты на основе структуры воды модифицируют способность адсорбента связывать аналит в силу изменений гидратации или структуры связанной воды. К элюантам этого типа относятся глицерин, этиленгликоль и органические растворители. Хаотропные анионы повышают растворимость в воде неполярных веществ, ослабляя тем самым гидрофобные взаимодействия между аналитом и адсорбентом.
г. Элюанты на основе детергентов
К элюантам, которые модифицируют селективность адсорбента в отношении поверхностного натяжения и структуры аналита, относятся детергенты и сурфактанты. К приемлемым в качестве элюантов детергентам относятся такие ионные и неионные детергенты, как CHAPS, Твин и NP40. Элюанты на основе детергентов модифицируют способность адсорбента связывать аналит на основе модификаций гидрофобных взаимодействий, когда вводятся гидрофобные и гидрофильные группы детергента. При этом модифицируются гидрофобные взаимодействия между аналитом и адсорбентом, а также в аналите, и вводятся заряженные группы, например, происходит денатурация белков такими ионными детергентами, как SDS.
д. Элюанты на основе гидрофобности
Элюанты, которые модифицируют селективность адсорбента в отношении диэлектрической константы, являются элюантами, модифицирующими селективность адсорбента в отношении гидрофобного взаимодействия. Примерами приемлемых элюантов, которые функционируют таким образом, являются мочевина (0.1-8М), такие органические растворители, как пропанол, ацетонитрил, этиленгликоль и глицерин, а также детергенты, аналогичные перечисленным выше. Применение ацетонитрила в качестве элюанта является обычным для обратнофазной хроматографии. Введение в состав элюанта этиленгликоля эффективно при элюции имуноглобулинов после соле-зависимого взаимодействия с тиофильными адсорбентами.
е. Сочетания элюантов
Приемлемые элюанты можно выбрать из любой перечисленной выше категории или же они могут представлять собой сочетание двух или более перечисленных элюантов. Элюанты, представляющие собой два или более из перечисленных элюантов, способны модифицировать селективность адсорбента к аналиту на основе множественных характеристик элюции.
3. Переменные двух параметров
Возможность получать различные характеристики связывания выбирая различные адсорбенты и возможность получать различные характеристики элюции промывками различными элюантами позволяют варьировать два различных параметра, каждый из которых может индивидуально влиять на селективность, с которой аналиты связываются адсорбентом. Тот факт, что эти два параметра могут широко варьировать, обеспечивает широкий спектр аффинностей связывания и условий элюции, так что заявленные в настоящем изобретении способы могут применяться для связывания и, соответственно, обнаружения аналитов многих различных типов.
Выбор адсорбентов и элюантов для анализа конкретного образца будет зависеть от природы образца, конкретного аналита или класса аналитов, которые надо охарактеризовать, даже если природа аналитов неизвестна. Обычно преимущество представляет получение системы, обладающей широким разнообразием характеристик связывания и широким разнообразием характеристик элюции, особенно если неизвестен состав подлежащего анализу образца. С получением системы, обладающей широким спектром условий селективности, значительно возрастает вероятность удержания одним или несколькими адсорбентами представляющего интерес аналита.
Квалифицированный специалист с опытом химического или биохимического анализа сможет определить условия селективности, необходимые для удержания конкретного аналита, получая систему с широким спектром характеристик связывания и элюции, и определяя характеристики связывания и элюции, которые обеспечивают наилучшее разрешение аналита. Поскольку в настоящем изобретении заявлены системы, включающие широкий спектр условий селективности, квалифицированным специалистом без излишних экспериментов могут быть определены оптимальные характеристики связывания и элюции для данного аналита.
С. Аналиты
Настоящее изобретение дает возможность разрешения аналитов на основе различных биологических, химических или физико-химических свойств аналита путем учета этих свойств при выборе соответствующих условий селективности. Ко многим свойствам аналитов, которые можно использовать при выборе соответствующих условий селективности, относятся гидрофобный индекс (или степень гидрофобности остатков аналита), изоэлектрическая точка (т.е. то значение рН, при котором аналит не имеет заряда), гидрофобный момент (или степень амфипатичности аналита, или степень асимметричности в распределении полярных и неполярных состков), латеральный дипольный момент (или степень асимметричности в распределении заряда в аналите), фактор молекулярной структуры (наличие вариаций в поверхностном контуре молекулы аналита, например, в силу распределения массивных боковых цепей по скелету молекулы), компоненты вторичной структуры (т.е. спираль, параллельные и антипараллельные плоскости), дисульфидные связи, экспонированные электронно-донорные группы (т.е. His), ароматичность (или степень пи-пи взаимодействия между ароматическими остатками в аналите) и линейное расстояние между заряженными атомами.
Здесь приведены примеры типов свойств, которые могут использоваться для разрешения данного аналита из образца при выборе соответствующих условий селективности в соответствии с заявленными способами. Другие полезные свойства аналитов, которые могут служить основой разрешения конкретного аналита из образца, известны или могут быть определены квалифицированным специалистом и рассматриваются в настоящем изобретении.
Заявленный способ не ограничен в отношении типов образцов, которые могут быть проанализированы. Образцы могут быть в твердом, жидком или газообразном состоянии, хотя обычно используют жидкие пробы. Твердые или газообразные образцы предпочтительно солюбилизировать в приемлемом растворителе с получением жидкого образца в соответствии с известными из уровня техники способами. Образец может быть биологическим соединением, небиологическим органическим соединением или неорганическим соединением. Заявленные в настоящем изобретении способы особенно полезны для разрешения аналитов в биологическом образце, в частности в биологических жидкостях и экстрактах, а также для разрешения аналитов в небиологических органических соединениях, особенно в смесях малых органических и неорганических молекул.
Аналитами могут быть молекулы, мультимерные молекулярные комплексы, макромолекулярные структуры, клетки, субклеточные органеллы, вирусы, фрагменты молекул, ионы или атомы. Аналит может быть единственным компонентом образца или относиться к классу структурно, химически, биологически или функционально родственных компонентов, имеющих одну или несколько общих характеристик (т.е. молекулярный вес, изоэлектрическая точка, ионный заряд, гидрофобные/гидрофильные взаимодействия и т.д.).
Конкретными примерами аналитов, которые могут быть разрешены с использованием заявленных в настоящем изобретении методов ретентатной хроматографии, относятся биологические макромолекулы, такие как пептиды, белки, ферменты, полинуклеотиды, олигонуклеотиды, нуклеиновые кислоты, углеводы, олигосахариды, полисахариды; фрагменты перечисленных выше биологических макромолекул, такие как фрагменты нуклеиновых кислот, фрагменты пептидов и фрагменты белков; комплексы перечисленных выше биологических макромолекул, такие как комплексы нуклеиновых кислот, ДНК-белковые комплексы, комплексы рецептор-лиганд, фермент-субстратные комплексы, комплексы фермент-ингибитор, пептидные комплексы, белковые комплексы, углеводородные комплексы и полисахаридные комплексы; малые биологические молекулы, такие как аминокислоты, нуклеотиды, нуклеозиды, сахара, стероиды, липиды, ионы металлов, лекарственные препараты, гормоны, амиды, амины, карбоксиловые кислоты, витамины и коферменты, спирты, альдегиды, кетоны, жирные кислоты, порфирины, каротеноиды, регуляторы роста растений, эфиры фосфатов и нуклеозид-дифосфосахара, такие малые синтетические молекулы, как фармацевтически или терапевтически эффективные агенты, мономеры, аналоги пептидов, аналоги стероидов, ингибиторы, мутагены, канцерогены, антимитотические препараты, антибиотики, ионофоры, антиметаболиты, аналоги аминокислот, антимикробные агенты, ингибиторы транспорта, поверхностно-активные агенты (сурфактанты), ингибиторы функции митохондрий и хлоропластов, доноры, переносчики и акцепторы электронов, синтетические субстраты протеаз, субстраты фосфатаз, субстраты эстераз и липаз, реагенты, модифицирующие белки; синтетические полимеры, олигомеры и кополимеры, такие как полиалкилены, полиамиды, поли(мет)акрилаты, полисульфоны, полистиролы, полиэфиры, поливиниловые эфиры, сложные поливиниловые эфиры, поликарбонаты, поливиниловые галиды, полисилоксаны, РОМА, полиэтиленгликоли, и кополимеры двух или более перечисленных веществ.
III. ОБРАБОТКА ИНФОРМАЦИИ
Детекция аналитов, адсорбированных адсорбентом в конкретных условиях элюции, дает информацию об аналитах в образце и их химических свойствах. Адсорбция частично зависит от характеристик связывания адсорбента: аналиты, которые связываются адсорбентом, обладают свойствами, которые делают связывание возможным. Например, молекулы, которые являются катионными при определенном значении рН, будут связываться анионным адсорбентом в условиях элюции, которые включают данное значение рН. Сильно катионные молекулы будут элюироваться с адсорбента только в очень жестких условиях элюции. Молекулы с гидрофобными областями будут связываться гидрофобными адсорбентами, а молекулы с гидрофильными областями – гидрофильными адсорбентами. Опять же, сила взаимодействия будет зависеть частично от степени представленности в аналите гидрофобных или гидрофильных областей. Таким образом, определение факта связывания определенных аналитов в образце адсорбентом в определенных условиях элюции не только разрешает аналиты в смеси, разделяя их друг от друга и от аналитов, не обладающих химическим свойством, необходимым для связывания, но и определяет класс аналитов или индивидуальных аналитов, имеющих конкретные химические свойства. Собирая информацию об удержании аналита на одном или нескольких конкретных адсорбентах в определенных условиях элюции, можно получить не только подробное разрешение аналитов в смеси, но и химическую информацию об аналитах, что может вести к их идентификации. Эти данные называются “ретенционными данными”.
Данные, полученные в ретенционных тестах, удобнее всего анализировать с помощью программируемого цифрового компьютера. Компьютерная программа обычно содержит читаемую среду, в которой хранятся коды. Определенные коды посвящены памяти и содержат информацию о локализациях на субстратной матрице, идентичности адсорбента и условиях элюции, использованных для промывки адсорбента. Используя эту информацию, программа может идентифицировать набор свойств матрицы, определяющих конкретные характеристики селективности. Компьютер также содержит коды, которые обрабатывают данные о силе сигнала от различных молекулярных масс, полученные от конкретных предопределенных локализаций на зонде. Эти данные могут указывать на количество обнаруженных аналитов и дополнительно включать для каждого аналита силу сигнала и определенную молекулярную массу.
Компьютер также содержит коды для обработки данных. Настоящим изобретением предусматривается разнообразие способов обработки данных. Согласно одному из вариантов предусматривается создание профиля распознавания аналита. Например, данные об удержании конкретного аналита, идентифицированного по молекулярной массе, можно отсортировать в соответствии с конкретными характеристиками связывания, например связывания анионными адсорбентами или гидрофобными адсорбентами. Совокупность этих данных составляет профиль химических свойств конкретного аналита. Характеристики удержания отражают функцию аналита, которая, в свою очередь, отражает структуру. Например, удержание координатными ковалентными хелаторами металлов может отражать присутствие остатков гистидина в аналите-полипептиде. Комбинируя данные об уровне удержания на множестве катионных и анионных адсорбентов при элюции с варьирующим рН, можно получить информацию, на основе которой определить изоэлектрическую точку белка. В свою очередь, этот параметр отражает возможное число ионных аминокислот в белке. Соответственно, компьютер может содержать коды, которые переводят информацию о связывании в структурную информацию. Кроме того, вторичный процессинг аналита (т.е. посттрансляционые модификации) приводят к изменению профиля распознавания, что отражается в различиях в связывании или массе.
Согласно другому варианту ретенционные тесты проводят с одним и тем же набором порогов селективности для клеток двух различных типов и сравнивают ретенционные данные двух тестов. Различия в ретенционных картах (т.е. наличие и сила сигнала в любой предопределенной локализации) указывают на аналиты, которые экспрессируются дифференциально в клетках двух различных типов. Это может включать, например, создание дифференциальных карт, указывающих на различия в силе сигналов в двух ретенционных тестах, что свидетельствует о том, что аналиты сильнее или слабее удерживаются адсорбентом в двух тестах.
Компьютерная программа может также включать код, который на входе получает инструкции от программиста. Последовательный и логичный путь избирательной десорбции аналитов с конкретных предопределенных локализаций на матрице можно предусмотреть и запрограммировать заранее.
Компьютер может перевести данные в другой формат для представления (демонстрации). Анализ данных может включать этапы определения, т.е. установления силы сигнала как функции предопределенной локализации на основе собранных данных, удаления “выбросов” (данные, отклоняющиеся от предопределенного статистического распределения) и вычисления относительной аффинности связывания аналитов на основе ретенционных данных.
Полученные данные могут быть представлены в различных форматах. В одном формате силу сигнала отображают на графике как функцию молекулярной массы. В другом формате, обозначаемом как “гелевый формат”, силу сигнала откладывают по горизонтальной оси, отражающей интесивность потемнения, что напоминает появление аналогичных послов в геле. В другом формате, сигналы, достигающие определенного порога, представляют в виде вертикальных линий или полосок на горизонтальной оси, по которой откладывается молекулярная масса. Соответственно, каждая линия представляет обнаруженный аналит. Данные также могут быть представлены в виде графиков силы сигналов для конкретных аналитов, сгруппированных в соответствии с характеристикой связывания и/или характеристикой элюции.
IV. ПРИМЕНЕНИЯ РЕТЕНТАТНОЙ ХРОМАТОГРАФИИ
Ретентатная хроматография включает комбинаторные методы разделения, включая и параллельное обнаружение и характеристику многих аналитов. Эти комбинаторные методы имеют много применений. К ним относятся, без ограничения перечисленными, разработка схем обнаружения аналита-мишени; разработка стратегии очистки белка; методы очистки белка; идентификация специфического фага из фаговой библиотеки, связывающего аналит-мишень, включая идентификацию эпитопа-мишени с использованием комплементарных фаговых библиотек; очистка белка на основе физико-химических свойств аналита; мониторинг экспрессии генов и дифференциальной представленности белков; скрининг веществ в токсикологии; одновременное обнаружение многих диагностических маркеров; открытие новых лекартвенных препаратов; мониторинг сборки мультимерных белков и обнаружение трансляции нуклеотида in vitro.
А. Способы последовательной экстракции аналитов из образца
Ретентатная хроматография предусматривает анализ удержания аналита во множестве условий асдорбент/элюант. Одним из вариантов данного метода является последовательная экстракция. При последовательной экстракции образец не обрабатывают независимо в двух различных условиях селективности. Скорее, образец обрабатывают в первом условии селективности для экстракции из образца отдельных аналитов адсорбентом, при этом неадсорбированные аналиты остаются в элюанте. Затем образец обрабатывают во втором условии селективности. При этом происходит экстракция различных аналитов из элюанта. Часто если адсорбенты, используемые в первом и втором циклах, имеют различные основы аффинности (напр., нормально-фазный и гидрофобный), то адсорбенты будут экстрагировать различный набор аналитов из элюанта. Этот второй элюант затем обрабатывают в третьем условии селективности, и так далее. При осуществлении метода последовательной экстракции адсорбент помещают на дно ячейки, так что образец может быть нанесен поверх него. Элюант добавляют к адсорбенту и после связывания между аналитами в образце элюант собирают. Собранный смыв затем наносят на второй адсорбент и аналиты экстрагируются из образца путем связывания.
Согласно одному из вариантов осуществления изобретения цель последовательной экстракции больше препаративная, нежели аналитическая. Более конкретно, целью может быть экстракция из образца всех аналитов, кроме нужных. В данном случае образец весьма мал, т.е. несколько микролитров на пятне диаметром несколько миллиметров. Адсорбенты выбирают таким образом, чтобы они не адсорбировали аналит, который не должен исключаться из образца. После нескольких циклов окончательно собранный смыв лишен нежелательных аналитов и содержит только аналиты, нужные для последующего анализа, например, десорбционной спектрометрией или традиционными хроматографическими методами.
Согласно другому варианту неудержанный образец анализируют на присутствие аналитов любым аналитическим методом. Даже после одного этапа удержания этот процесс дает возможность установить какие материалы адсорбированы адсорбентом, а какие аналиты нет.
Б. Способы последовательного разрешения аналитов в образце
Целью ретентатной хроматографии является однозначное разрешение амалита из сложной смеси образца. Это особенно важно для применения в клинической диагностике, разработке новых лекарственных препаратов и в функциональной геномике. В этих областях требуется идентификация одного или нескольких аналитов из биологического образца. В настоящем изобретении заявлен способ идентификации условий селективности, в которых удерживается аналит, и в повторяющемся, циклическом процессе введение дополнительных характеристик связывания или характеристик элюции в условие селективности, которое обеспечивает улучшенное разрешение аналита.
Масс-спектр сложного образца, обработанного в условии селективности, обычно содержит сигналы от многих компонентов образца. Комплексность сигналов может препятствовать однозначному разрешению аналита. Методы последовательного разрешения аналита дают возможность идентифицировать условия селективности с улучшенным разрешением аналита для однозначного обнаружения аналита в образце. Условие селективности обеспечивает “улучшенное разрешение” аналита в сравнении с другим условием селективности, если сигнал от аналита более легко отличим от сигналов других компонентов. К этому относится, например, уменьшение числа аналитов, связанных с адсорбентом, снижая тем самым общее количество сигналов, или же повышая избирательность условия селективности к аналиту, усиливая сигнал аналита по сравнению с другими сигналами. Конечно, когда аналит связывается с субстратом исключительно, то при детекции образуется только сигнал аналита.
Способы последовательного разрешения подразумевают повторяющийся процесс, в ходе которого дополнительные характеристики селективности (связывания или элюции) последовательно вводят в постоянный набор характеристик селективности, при которых удерживается аналит. На первом этапе проверяют ряд условий селективности для идентификации одного, в котором удерживается аналит-мишень. На следующем этапе выбирают одну или несколько характеристик селективности для постоянного набора условий селективности, используемого для дальнейшего анализа.
Так получают новый набор условий селективности. Каждое из условий нового набора включает выбранные характеристики из постоянного набора и по меньшей мере одно новое условие, не входящее в постоянный набор. Например, если постоянный набор включает анионный адсорбент и низкосолевой элюант, то новое условие может подразумевать варьирование рН элюанта. Каждую из этих новых переменных проверяют на способность улучшать разрешение аналита и определяют одно модифицированное условие селективности, которое обеспечивает улучшенное разрешение. На следующем этапе это дополнительное условие селективности вводят в постоянный набор.
Модифицированный постоянный набор опять же проверяют аналогичным образом, получая набор новых условий селективности, который включает характеристики из постоянного набора и новые характеристики. Таким образом, на каждом этапе условия селективности выбирают так, чтобы разрешение аналита улучшалось по сравнению с условием селективности, использованным на предыдущем этапе.
Способ хорошо иллюстрируется примером. Клеточный образец обычно содержит сотни или, возможно, тысячи белков. Предположим, что стоит задача однозначного разрешения единственного аналита-мишени, белка из данного образца. На первом этапе получают ретенционную карту для аналита-мишени, используя множество условий селективности. Например, адсорбенты могут быть анионообменником, катионообменником, нормально-фазным адсорбентом и обратно-фазным адсорбентом. Условия элюции, проверяемые на каждом адсорбенте, могут варьировать в отношении рН, ионной силы, концентраций тех или иных детергентов и степени гидрофобности. Например, четыре различных условия элюции могут быть проверены для каждого условия селективности. Таким образом, в данном случае шестнадцать различных условий селективности проверяют на способность адсорбировать аналит-мишень.
На основе ретенционной карты можно выбрать по меньшей мере одно условие селективности, при котором удерживается аналит-мишень. Можно выбрать условие селективности, при котором мишень связывается максимально. Однако выбор условия селективности, при котором мишень связывается немаксимально, может представлять преимущество, если данное условие селективности более избирательно в отношении мишени, нежели другие условия селективности. Предположим, например, что анализ ретенционной карты показывает, что мишень удерживается анионообменными адсорбентами при значениях рН, близких к нейтральному, но также слабо адсорбируется и гидрофобным адсорбентом.
Один из переменных адсорбентов или элюантов из условия селективности, определенного в результате удержания аналита, выбирают для использования во всех последующих условиях селективности. Таким образом, его добавляют к “набору констант условий селективности”.
В ходе следующего цикла проверяется способность аналита-мишени связываться во втором множестве условий селективности. Каждое условие селективности во втором наборе включает элементы условий селективности из постоянного набора. Однако каждое условие селективности также включает другую переменную – другой адсорбент или элюант, введенные условие селективности. Таким образом, с учетом необходимости использовать по меньшей мере один набор констант, второй набор условий селективности также выбирают так, чтобы он был более разнообразным, чем первый набор. К способам повышения разнообразия относятся, например, проверка более тонких градаций условия элюции или изменение силы адсорбента. К ним также может относиться, например, введение в условия селективности новой характеристики селективности.
Продолжая пример, к набору констат может быть добавлен анионообменный адсорбент. Теперь это условие проверяют с широким разообразием переменных, т.е. элюантов или адсорбентов. К проверяемым элюантам могут относиться различные буферы с низкими значениями рН с более тонкими градациями, нежели проверяемые в первом цикле. Например, в первом цикле можно проверить буферы с рН 3.0, рН 5.0, рН 7.0 и рН 9.0, и увидеть, что мишень что мишень удерживается анионообменным адсорбентом при значениях рН, близких к нейтральному. В ходе второго цикла проверяемые буферы могут иметь рН 5.0, рН 5.5, рН 6.0, рН 6.5, рН 7.0, рН 7.5 и рН 8.0. Кроме того, каждый из этих буферов может варьировать по другим характеристикам элюции, т.е., ионной силе, гидрофобности и т.д.
Анализ второй ретенционной карты, полученной на данном этапе, обычно позволяет определить условие, которое обеспечивает улучшенное разрешение аналита, нежели условие селективности, идентифицированное на первом этапе. Опять же, выбирают одну из переменных данного условия селективности и вводят в набор констант условия селективности для дальнейшего тестирования в ходе следующего цикла.
Продолжая пример, предположим, что условие селективности во втором цикле, в котором разрешается аналит, включает буфер с рН 6.5. Этот элюант теперь может быть введен в набор констант, который теперь включает анионообменную смолу и буфер с рН 6.5. В ходе следующего цикла данное условие селективности вводят в постоянный набор, а варьируют следующее условие селективности. К переменным могут относиться, например, введение нового компонента в элюант, меняющего ионную силу; или же другой адсорбент может быть введен в смесь, так что различные гидрофобные адсорбенты смешиваются с анионообменным адсорбентом; или же можно варьировать плотность анионообменной смолы. Опять же, из данного набора идентифицируют условие селективности, которое обеспечивает улучшенное разрешение аналита.
Процесс может продолжаться до тех пор, пока аналит не будет очищен до необходимой гомогенности. В данном случае, условие селективности специфично в отношении аналита.
Как можно видеть, повышением числа переменных, используемых на каждом этапе, можно уменьшить количество циклов, необходимых для идентификации приемлемого условия селективности.
В. Способы препаративной очистки аналита
В качестве одного из аспектов настоящего изобретения заявлены способы очистки аналита. В этих методах используется преимущество ретентатной хроматографии, состоящее в быстрой идентификации основы аффинности для адсорбции аналита. На первом этапе происходит обработка аналита во множестве условий селективности для определения удержания аналита в данных условиях путем ретентатной хроматографии. В результате получают профиль распознавания аналита. Условия селективности, в которых аналит удерживается, используют для разработки протокола препаративной очистки аналита.
Для препаративной очистки аналита аналит последовательно адсорбируют и элюируют на серии сочетаний адсорбент/элюант, для которых показано связывание аналита. Так, например, карта распознавания может указывать на то, что аналит связывается нормально-фазным адсорбентом и хелатором металлов. Затем аналит наносят на первую хроматографическую колонку, содержащую, например, нормально-фазный адсорбент, который связывает аналит. Не связавшийся материал отмывают. Затем аналит элюируют достаточно жесткой промывкой. Элюант наносят, например, на колонку с хелатором металлов, который связывает аналит. Не связавшийся материал отмывают. Затем связавшийся материал, содержащий аналит, элюируют с хелатирующей металл колонки. Таким образом, аналит выделяют в препаративных количествах. Препаративное количество образца составляет не менее 10 мкл, не менее 100 мкл, не менее 1 мл, не менее 10 мл.
Информация, полученная в ходе последовательного разрешения аналитов, может быть использована для разработки стратегии крупномасштабной хроматографической (основанной на элюции) очистки белка. Основу аффинности адсорбента, условия связывания и условия элюции (т.е. условия селективности) для белкового аналита-мишени определяют ретентатной хроматографией. Получение такой информации экономит огромное количество времени, энергии и дорогих аналитов, которые в противном случае были бы потрачены при пробах и ошибках при разработке стратегии очистки. В настоящем разделе также описаны примеры препаративной очистки, осуществленной с коммерчески доступными адсорбентами.
Г. Способы приготовления зондов для специфического обнаружения аналитов
В настоящем изобретении заявлены зонды для специфической детекции одного или нескольких аналитов десорбционной спектрометрией, а также способы получения таких зондов. Такие аналит-разрешающие зонды полезны для специфического обнаружения аналитов при осуществлении диагностических и аналитических методов.
Первым этапом получения зонда для разрешения одного или более аналитов является получение ретенционной карты аналитов во множестве различных сочетаний адсорбент/элюант. Например, разрешение аналита можно установить для четырех различных адсорбентов, промытых одним из пяти различных элюантов. Анализ полученной ретенционной карты покажет, какое условие или условия селективности лучше всего разрешает аналиты. Предпочтительно идентифицировать одно условие селективности, которое однозначно разрешает все аналиты. Затем выбирают одно или несколько условий селективности для использования в аналит-разрешающем зонде таким образом, чтобы каждый из аналитов разрешался как минимум на одном пятне адсорбента. Зонд также может содержать адсорбент, который не связывает аналит или аналиты. Это пятно адсорбента используют как контрольное. Зонды могут содержать множество пятен адсорбента в предопределенных локализациях, выбранных по их способности удерживать и разрешать аналит или аналиты. В этом случае адсорбенты выбирают так, чтобы аналит связывался в условии обработки одним элюантом. Это может оказаться полезным, поскольку в процессе детекции весь зонд можно промывать одним элюантом.
Ретенционную карту, полученную для конкретного аналита, можно использовать для создания специального, “заказного” адсорбента для данного аналита. Например, природа адсорбентов, удерживающих аналит, указывает на набор основ аффинности аналита. “Заказной” адсорбент можно сконструировать, готовя мультиплексный адсорбент, включающий элементы адсорбентов, которые обеспечивают эти основа аффинности. Такой “заказной” адсорбент очень избирателен в отношении аналита-мишени. Один или всего несколько “заказноых” адсорбентов могут обеспечить получение карты распознавания амалита. Например, если показано, что в определенных условиях элюции аналит удерживается адсорбентами, которые связывают материалы с определенной степенью гидрофобности, положительным зарядом и ароматичностью, то можно создать “заказной” адсорбент, сочетая комбинаторными синтетическими методами такие функциональные группы, которые будут обеспечивать все три перечисленные выше свойства. Аналит идентифицируют по обнаружению связывания с таким адсорбентом.
Такие зонды полезны для обнаружения аналита или аналитов в образце. Образец обрабатывают в условиях селективности и зонд исследуют десорбционной спектрометрией. Поскольку зонд разрешает аналиты, их присутствие может быть установлено по характеристикам профиля распознавания. Такие зонды особенно полезны для идентификации набора диагностических маркеров в образце, полученном от больного.
Согласно одному из вариантов осуществления изобретения, конструируют матрицу для связывания представляющих интерес белков определенного класса. К ним относятся диагностические маркеры, а также аналиты с определенной функцией. Например, можно получить матрицу, которая будет специфически связывать белки клеточной поверхности, ферменты определенного класса (напр., киназы), транскрипционные факторы, внутриклеточные рецепторы и т.п. Адсорбенты могут быть специфичны в отношении биополимеров, например, антител.
Согласно одному из вариантов осуществления изобретения адсорбентами являются организмы, такие как фаг, несущие на своей поверхности белковые лиганды к белкам определенного класса. В этом случае фаговую библиотеку можно прескринировать молекулами определенного класса с тем, чтобы исключить фаги, связывающие молекулы данного класса. Затем фаг, который был вычленен из популяции таким образом, используют как адсорбент.
Д. Диагностические зонды и способы диагностики
При диагностике патологических состояний часто требуется обнаруживать во взятом от больного образце один или несколько молекулярных маркеров заболевания. Многие заболевания можно диагностировать по наличию единственного диагностического маркера. Диагностика других заболеваний может потребовать обнаружения множества диагностических маркеров. Кроме того, обнаружение нескольких маркеров может повысить достоверность диагноза. Соответственно, в настоящем изобретении заявлены зонды для десорбционной спектрометрии, содержащие как минимум один адсорбент, который способен разрешать по меньшей мере один диагностический маркер патологического состояния.
Получение таких зондов предусматривает прежде всего выбор подлежащих обнаружению маркеров. Такой маркер может являться маркером любого болезненного состояния, т.е. рака, заболевания сердца, аутоиммунного заболевания, вирусной инфекции болезни Альцгеймера или диабета. Например, обнаружение простата-специфического антигена (PSA) с высокой вероятностью указывает на рак предстательной железы. ВИЧ-инфекцию можно диагностировать обнаружением антител к нескольким белкам ВИЧ, таким как один из р17, р24 или р55 и один из р31, р51 или р66 и один из gp41 или gp120/160. Обнаружение в спинномозговой жидкости амилоида-b42 или белка тау с высокой вероятностью указывает на болезнь Альцгеймера. Маркеры можно также идентифицировать при помощи заявленных способов установления дифференциального присутствия аналита у здоровых субъектов в отличие от больных.
На следующем этапе получают адсорбенты, удерживающие один или более диагностический маркер. Предпочтительно получить один адсорбент, который разрешал бы все маркеры. Этого можно достичь, например, созданием пятна, содержащего несколько антител, каждое из которых связывает один из представляющих интерес маркеров. Альтернативно, зонд может содержать множество пятен адсорбента, при этом каждое пятно в данных условиях селективности может разрешать по меньшей мере один-аналит-мишень. Согласно одному из вариантов осуществления изобретения, адсорбент является мультиплексным адсорбентом, содержащим лиганды, которые специфичны к маркерам. Например, адсорбент может содержать антитело, полипептидный лиганд или полинуклеотид, который специфически связывает аналит-мишень. Согласно одному из вариантов осуществления изобретения антитело является одноцепочечным антителом, идентифицированным при скрининге комбинаторной библиотеки. Одноцепочечные антитела, специфичные к конкретным маркерам, можно получить при скрининге фаговых библиотек в соответствии с описанными в настоящей заявке методами.
Согласно другому варианту осуществления изобретения, адсорбент содержит неорганические биомолекулярные компоненты, которые или специфически удерживают аналит-мишень или удерживают аналит со специфичностью, достаточной для однозначного разрешения десорбционной спектрометрией. Получение адсорбентов для обнаружения специфических аналитов также описывается в настоящей заявке.
Важно, что единичное пятно адсорбента, используемое в данных способах, не должно быть специфичным к единичному аналиту, и, потому не требуется специфической аффинности между мишенью и адсорбентом, обусловленной биополимером. Более ранние способы обнаружения аффинности основывались в основном на специфическом связывании между биополимером и мишенью. К таким видам связывания относятся, например, специфическая аффинность антитела к белку, полинуклеотида к комплементарному полинуклеотиду или пектина к углеводу. Такая специфичность была необходима в силу непрямых способов детекции: идентифицировалась не мишень, а метка, часто связанная с адсорбентом. Соответственно, чем более специфичен адсорбент, тем меньше вероятность того, что примеси будут связываться с асдорбентом и препятствовать специфическому обнаружению. Однако десорбционная спектрометрия обнаруживает аналит непосредственно. Соответственно, присутствие примесей не влияет на специфичность обнаружения, если только сигнал от примеси не перекрывает сигнал от мишени.
Способы диагностики предусматривают, прежде всего, получение от больного образца для тестирования. Образцом, например, может служить ткань, кровь, моча, кал или другие жидкости тела (лимфа, спинно-мозговая жидкость, внутрисуставная жидкость и т.д.). Затем образец приводят в контакт с субстратом, содержащим диагностические адсорбенты, в таких условиях, которые делают возможным удержание диагностических маркеров. Адсорбент промывают соответствующим элюантом. Затем маркеры обнаруживают (т.е. разрешают) десорбционной спектрометрией (т.е. масс-спектрометрией).
В настоящем изобретении также заявлены наборы для специфического обнаружения диагностических маркеров, включающие (1) субстрат для десорбционной спектрометрии, содержащий как минимум один адсорбент как минимум в одной предопределенной локализации, который разрешает как минимум один диагностический маркер в условии селективности, которое включает адсорбент и элюант, и (2) элюант или инструкции по приготовлению элюанта. При приведении образца в контакт с адсорбентом и промывке элюантом, т.е. при выполнении условия селективности, аналит очищается в достаточной степени или специфически связывается, что делает возможным его разрешение десорбционной спектрометрией.
Е. Способы идентификации белков
В качестве другого аспекта в настоящем изобретении заявлен способ, помогающий идентифицировать белки. Данным способом предусматривается определение совпадающих параметров в физико-химических характеристиках белка-аналита с использованием ретентатной хроматографии и скрининга белковых баз данных с целью идентификации белков с совпадающими параметрами. Обработка физико-химической информации на основе характеристик удержания (ретенции) обсуждалась выше. Из баз данных обычно можно извлечь аминокислотную последовательность и/или нуклеотидную последовательность, кодирующую аминокислотную последовательность каждого белка. Из этой информации легко вывести структурные характеристики, такие как молекулярная масса, гидрофобность, рI, масса фрагментов и т.д. Белок-аналит будет иметь конкретную структурную характеристику, общую только с некоторой подгруппой белков, имеющихся в базе данных. Соответственно, идентификация возможных белков-кандидатов проводится на основе сортировки белков по тем структурным характеристикам, которые являются общими с белком-аналитом. Таким образом, с учетом неточностей, степени специфичности или уровня доверительности, присущими установлению одного или нескольких физико-химических свойств, нельзя ожидать, что белки базы данных будут точно совпадать со стандартом по всем характеристикам. Соответственно, совпадающие параметры можно использовать для установления, например, близости характеристик белка-аналита и характеристик референсных полипептидов в базе данных.
С ростом количества идентифицированных генов генома возрастает вероятность того, что любой белковый аналит представлен в базах данных как референсный полипептид.
Соответственно, заявленный метод дает возможность быстро разрешать представляющий интерес белок в образце с получением структурной информации о белке и затем использовать данную информацию для идентификации белка.
Ж. Способы сборки мультимерных молекул
Способность адсорбентов удерживать нужные молекулы можно использовать при построении мультимерных молекул и для получения соединений, которые влияют на такую сборку. Единицу мультимерной молекулы присоединяют к адсорбенту. Затем ее приводят в контакт с образцом, содержащим другую единицу мультимерной молекулы. Такой контакт может быть осуществлен в разнообразных условиях, что позволяет контролировать условия связывания. Присоединение субъединицы к мультимеру можно контролировать десорбционной спектрометрией. Затем таким же образом можно контролировать присоединение последующих субъединиц. Способы скрининга потенциальных лекарственных препаратов, приведенные в настоящем описании, применимы при тестировании агентов на способность интерферировать со сборкой мультимерных молекул. Соответственно, аналит на одной стадии процесса становится адсорбентом на другой стадии.
3. Способы постановки энзиматических тестов
В настоящем изобретении также заявлены способы постановки энзиматических тестов. Энзиматические тесты обычно предусматривают приведение теституемого образца в контакт с субстратом фермента в таких условиях, в которых фермент активен. После воздействия фермента на субстрат оценивают количество продукта эезиматической реакции. При количественном анализе определяют количество продукта. Это количество обычно сравнивают с контролем или стандартной кривой, определяя тем самым уровень энзиматической активности в образце.
В настоящем изобретении заявлен способ обнаружения фермента, включая определение уровня энзиматической активности в образце. Преимущество способа состоит в том факте, что активность фермента часто приводит к образованию продукта, чья масса отлична от массы исходного субстрата. При осуществлении способа готовят твердую фазу, содержащую адсорбент, который связывает субстрат. Количество субстрата, связанного с адсорбентом, фиксировано. Затем адсорбент приводят в контакт с образцом на такое время и в таких условиях, которые позволяют ферменту воздействовать на субстрат.
Любой связавшийся материал обнаруживают десорбционной спектрометрией. Обнаружение аналита с молекулярной массой, характерной для продукта ферментативной активности, указывает на присутствие фермента. Сила сигнала будет являться функцией уровня энзиматической активности в образце.
И. Способы идентификации аналитов, которые экспрессируются дифференциально в различных биологических материалах
В качестве одного из аспектов настоящего изобретения заявлены способы идентификации органических биомолекул, в особенности белков, которые дифференциально экспрессируются в двух или более образцах. “Дифференциальная экспрессия” означает различия в количестве или качестве аналита между двумя образцами. Такие различия могут возникать на любом этапе экспрессии белка, начиная с транскрипции и кончая пост-трансляционной модификацией. Данные способы обладают преимуществами крайне высокой разрешающей способности ретентатной хроматографии. Сначала для аналитов, содержащихся в двух образцах, получают профили распознавания с использованием одного и того же набора условий селективности. Чем больше число использованных условий селективности, тем выше разрешение аналитов в образце и, соответственно, можно сравнить большее число аналитов. Затем сравнивают карты распознавания для идентификации аналитов, которые дифференциально удерживаются двумя наборами адсорбентов. Дифференциальная ретенция (удержание) подразумевает количественное удержание. Это указывает на повышенную или полниженную экспрессию. Дифференциальная ретенция также указывает на качественные отличия аналита. Например, различия в пост-трансляционной модификации белка могут приводить к различиям в картах распознавания, обнаружимых как различия в характеристиках связывания (например, если белок гилкозилирован, он будет иначе связываться с лектиновыми адсорбентами), или как различия в массах (например, как результат различий в пост-трансляционном разрезании). Анализ может быть выполнен на программируемом цифровом компьютере.
Способ особенно применим для обнаружения генов, которые дифференциально экспрессируются в клетках двух различных типов. Такие пары клеток могут быть представлены нормальными и патологическими клетками, например, раковыми клетками, или же клетками, находящимися на различных стадиях развития или дифференцировки, или на различных стадиях клеточного цикла. Однако метод также применим для исследования двух клеток одного типа, находящихся в различных условиях. Например, метод применим в токсикологии для скрининга и тестирования агентов на их способность модулировать экспрессию гена в клетке. В этом случае один биологический образец приводят в контакт с тестируемым агентом, а другой нет. Затем сравнивают ретентатные карты образцов. Метод может указывать на факт пониженной или повышенной экспрессии белка или другой биомолекулы или на изменения, являющиеся результатом отличающихся характеристик удержания или изменений массы.
С использованием информации о физико-химических свойствах дифференциально экспрессирующихся белков, полученной из ретенционных карт, с использованием описанных методов можно определить белки-кандидаты на идентичность.
Данный метод применим для идентификации диагностических маркеров заболеваний. Белки, которые дифференциально экспрессируются во взятых от больных образцах или в культивируемых клетках больных в сравнении с нормальными образцами или клетками, могут оказаться диагностическими маркерами. Вообще, предпочтительно сравнивать с нормальными образцы, взятые от статистически значимой выборки больных. Таким образом можно собрать информацию для идентификации диагностических маркеров, общих для всех или многих индивидуумов, страдающих данной патологией.
К. Повышение чувствительности амплификацией катабодического сигнала
Чувствительность обнаружения дифференциального присутствия (являющегося результатом дифференциальной экспрессии) в сложной смеси может быть значительно повышена путем фрагментации большого белка на маленькие кусочки и обнаружения именно этих фрагментов. Чувствительность повышается в силу нескольких факторов. Во-первых, когда все белки в образце фрагментированы, например, энзиматическим перевариванием, то большие белки образуют больше фрагментов, чем малые белки. Во-вторых, общая чувствительность десорбционной спектрометрии выше, чем ниже молекулярные массы аналитов. В-третьих, фрагментирование белка повышает количество сигналов от мишени, увеличивая тем самым вероятность обнаружения мишени. В-четвертых, фрагментирование белка повышает вероятность удержания и, следовательно, обнаружения по меньшей мере фрагмента белка. В-пятых, если белок по-разному представлен в двух образцах, то увеличением количества сигналов повышается вероятность обнаружения разницы в количестве.
Обычно стремятся понизить комплексность смеси аналитов до анализа. Фрагментация повышает комплексность.
Соответственно, согласно одному из вариантов осуществления изобретения чувствительность обнаружения аналита повышается путем конвертации аналита во фрагменты меньшей молекулярной массы до обнаружения. Фрагментацию можно осуществить любыми известными из уровня техники способами. Например, белковые аналиты можно фрагментировать эндопротеазами. Нуклеиновые кислоты можно фрагментировать при помощи эндонуклеаз. Образец можно подвергнуть фрагментации до или после нанесения на адсорбент.
Л. Способы идентификации лигандов к рецептору
В функциональных связях в биологических системах часто используются взаимодействия между рецептором и лигандом. Например, при активации транскрипции часто имеет место предварительное связывание лиганда с транскрипционным фактором. При многих патологических состояниях имеет место ненормальное взаимодействие между рецептором и лигандом. Нарушение связывания рецептора и лиганда часто является целью при разработке новых препаратов. Однако часто неизвестен лиганд к конкретному рецептору; такой рецептор называют “сиротским”.
В настоящем изобретении заявлен способ применения ретентатной хроматографии для идентификации лигандов к рецепторам. Способ предусматривает прикрепление рецептора к адсорбенту. Затем образец, в котором предполагают наличие лиганда к рецептору, приводят в контакт с прикрепленным рецептором в таком условии элюции, которое способствует связыванию между рецептором и лигандом. Затем связанные с рецептором лиганды детектируют десорбционной спектрометрией. Разрешающая способность данного метода от части обусловлена чувствительностью десорбционной спектрометрии при обнаружении малых количеств материала, присоединенных к адсорбенту.
Присоединение рецептора к адсорбенту требует идентификации адсорбента, который удерживает и, предпочтительно, специфически связывает рецептор. В настоящем описании приведены способы идентификации адсорбентов, которые специфически связывают белок. Согласно одному из методов адсорбент содержит антитело, специфичное к рецептору. Согласно другому варианту рецептор получают как рекомбинантный слитой белок, содержащий сущность для специфического связывания. Например, рецептор может быть слит с Fc-фрагментом антитела. Этот фрагмент связывает белок А, который может быть встроен в адсорбент.
Выбор образца для обнаружения лиганда определяется экспериментатором. Например, если рецептор является ядерным рецептором, то образец может быть ядерным экстрактом. Если рецептор является цитоплазматическим рецептором, то образцом может служить жидкость, омывающая поверхность клеток, например сыворотка в случае рецептора поверхности эпителиальных клеток.
Обычно образец инкубируют с рецептором в физиологических условиях в течение необходимого для связывания времени, например несколько часов при 37°С. Затем несвязавшийся материал отмывают. Этот метод дает возможность быстрой идентификации лигандов, что требует месяцев при использовании обычных методов.
Ретентатная хроматография дает возможность параллельной обработки образцов на нескольких пятнах адсорбента. Соответственно, метод может предусматривать тестирование множества различных образцов на присутствие лиганда, а также тестирование единственного образца во множестве условий инкубации и элюции.
Путем определения массы идентифицированного лиганда и различных физико-химических свойств лиганд можно идентифицировать с использованием информации геномных баз данных.
Согласно другому варианту осуществления изобретения готовят набор зондов, на которых удерживаются белки из клетки. Такие зонды применимы в качестве вторичных зондов для идентификации молекул из клетки, которые
связываются с удерживаемыми молекулами. После получения на основе зонда ретентатной карты зонд повторно приводят в контакт с тестируемым материалом, обычно в менее жестких условиях, чем те, которые использовали для получения вторичного зонда, и анализируют предопределенные локализации. Заново связанными оказываются те молекулы, которые связались с ранее удержанными молекулами.
М. Способы идентификации новых лекарственных препаратов
Идентификация молекул, которые предотвращают связывание между рецептором и лигандом к нему, является важным этапом при разработке новых лекарственных препаратов. В настоящем изобретении заявлены способы скрининга соединений на их способность модулировать связывание между адсорбентом и аналитом (т.е. рецептором-адсорбентом и лигандом-аналитом) путем приведения адсорбента и аналита в контакт с тестируемым соединением и детекции связывания между адсорбентом и аналитом десорбционной спектрометрией.
Для быстрого скрининга комбинаторных библиотек на потенциальные лекарственные препараты требуется возможность тестировать взаимодействия тысяч препаратов и идентификации агентов, которые препятствуют такому взаимодействию или наоборот способствую ему. Ретентатная хроматография дает возможность присоединить один член пары лиганд/рецептор к субстрату и использовать его в качестве вторичного адсорбента. Затем, после приведения члена пары в контакт с его партнером и агентом, десорбционной спектрометрией можно определить имеется ли связь между партнерами и насколько она сильна. К преимуществам ретентатной хроматографии в методах скрининга относятся возможность специфического связывания рецептора с субстратом посредством адсорбента, возможность быстрого размещения рецептора на многих пятнах адсорбента для параллельной обработки и скорость обработки, которая достижима при учете результатов десорбционной спектрометрией.
1. Скринирующий тест
Способ предусматривает получение адсорбента; приведение адсорбента в контакт с аналитом-мишенью в присутствии или в отсутствие агента в одном или нескольких условиях селективности и определение уровня связывания в присутствии и в отсутствие агента. Уровень связывания определяют ретентатной хроматографией (т.е. получением профиля распознавания). Эксперимент можно осуществить с контролем без добавления агента или с контролем, когда добавляются другое количество или тип агента, а нулевое количество определяют экстраполяцией. Статистически значимая разница в уровне связывания (р<0.05) указывает на то, что агент модулирует связывание.
Данный метод особенно удобен для скрининга аналитов (т.е. белков) – кандидатов в лекарственные препараты. После получения ретенционной карты белков или профиля распознавания из сыворотки или каких-либо других клеток-мишеней агент приводят в контакт с матрицей, на которой в предопределенных локализациях удерживается аналит. После того, как связывание произошло, несвязавшийся агент элюируют или отмывают. Те аналиты, которые удерживают связанный агент в условиях селективности, идентифицируют прямо десорбционной спектрометрией, поскольку агент сам по себе является новым компонентом ретенционной карты (т.е. агент десорбируется и детектируется непосредственно). Данный метод особенно приемлем для скрининга потенциальных лекарственных препаратов как агонистов, так и антагонистов по их способности связывать аналиты или моделировать один или несколько биологических процессов.
2. Рецептор и лиганд
Адсорбент и аналит-мишень не обязательно должны участвовать в специфическом связывании. Однако в особенно применимых методах адсорбент и аналит-мишень представляют собой пару лиганд/рецептор.
Согласно одному из вариантов осуществления изобретения членами пары лиганд/рецептор являются гормон и рецептор клеточной поверхности или внутриклеточный рецептор. Адсорбент может представлять собой целую клетку или клеточную мембрану в случае рецептора, ассоциированного с мембраной. Белковый рецептор или другой потенциальный препарат-мишень могут использоваться в качестве адсорбента при скрининге комбинаторных библиотек препаратов. Сотни или тысячи потенциальных лекарственных препаратов могут быть нанесены на рецептор одного типа и предопределенную локализацию на адсорбенте. После удаления не связавшихся или слабо связавшихся потенциальных лекарственных препаратов (т.е. агентов), связавшиеся агенты детектируют и идентифицируют десорбционной спектрометрией.
Согласно другому варианту осуществления изобретения адсорбент является ферментом, который связывается с субстратом-мишенью и модифицирует его. Агенты скринируют на способность модулировать энзиматическую трансформацию аналита. Например, энзиматическая активность может быть обнаружена потому, что профиль распознавания аналита может отличаться от такового для продукта энзиматической активности. Дифференциальная ретенция указывает на изменение связывания агентом.
Рецептор/лиганд может быть удержан на субстрате различными способами. Согласно одному из методов рецептор/лиганд прямо удерживается неспецифическим адсорбентом. Согласно другому методу, адсорбент специфичен к рецептору/лиганду. Например, адсорбент может содержать антитело, специфичное к рецептору/лиганду. Рецептор/лиганд может быть слитым белком, в котором один из фрагментов специфически связывает адсорбент, например как Fc-фрагмент связывает белок А. Согласно одному из методов к субстрату присоединяют организм, например фаг из фаговой билиотеки, который имеет на своей поверхности полипептид, специфически связывающий рецептор/лиганд. Лиганд захватывается полипептидом. Адсорбент также может являться аналитом, уже удержанным на субстрате, т.е. может быть вторичным адсорбентом, четвертичным адсорбентом и т.д.
В настоящем изобретении заявлен особенно полезный метод оценки как прямых, так и непрямых последствий связывания с мишенью препарата (или другого агента). Обнаружение одного ли нескольких аналитов на ретентатной карте, полученной для белков определенных клеток-мишеней, может быть изменено в силу действия агента (т.е. потенциального лекарственного препарата) на 1) собственно связывающий белок-мишень, 2) какой-либо другой аналит (несвязывающий препарат белок), или 3) на эксспрессию гена (или ее подавление). Именно высокая разрешающая способность и высокая информативность ретентатной хроматографии позволяет обнаруживать такие изменения, т.е. индуцированные прапаратом различия в ретентатных картах или профилях распознавания в присутствии и в отсутсвие препарата, что делает данный метод одним из наиболее мощных инструментов, доступных для протеомики, функциональной геномики, разработки новых лекарственных препаратов, мониторинга терапевтических препаратов и клинической диагностики.
3. Тестируемые агенты
Тестируемый агент, который должен быть проверен на способность модулировать экспрессию протимозина, вводят экспериментальному животному или в клетки, культивируемые in vitro. Выбор тестируемого агента находится в компетенции экспериментатора. Однако в силу их разннобразия и легкости введения в качестве фармацевтических препаратов малые молекулы предпочтительнее в качестве тестируемых агентов.
а. Химия
Агенты для тестирования могут быть получены из различных источников. Например, для скрининга доступны комбинаторные библиотеки молекул. С использованием таких библиотек тысячи молекул можно проскринировать на регуляторную активность. Согласно одному из предпочтительных вариантов осуществления изобретения высокоэффективные методы скрининга предусматривают получение библиотеки, содержащей большое число потенциальных терапевтических соединений (соединения-кандидаты). Такие “комбинаторные химические библиотеки” затем скринируют одним или несколькими методами, подобными описанным здесь, с целью идентификации тех представителей библиотеки (конкретных химических видов или подклассов), которые обладают нужной характерной активностью. Идентифицированные таким образом соединения служат в качестве обычных “лидирующих соединений” или же сами могут использоваться как потенциальные или настоящие лекарственные препараты.
Получение и скрининг комбинаторных химических библиотек хорошо известны из уровня техники. К таким комбинаторным химическим библиотекам относятся, без ограничения перечисленными, пептидные библиотеки (См., напр., Патент США 5,010,175, Furka (1991) Int. J.Pept.Prot. Res., 37:487-493, Houghton et al., (1991) Nature, 354:84-88). Пептидный синтез безусловно является одним из подходов, применимых при осуществлении настоящего изобретения. Могут быть также использованы и другие химические подходы получения библиотек химического разнообразия. К таким химическим соединениям относятся, без ограничения перечисленными: пептоиды (Публикация РСТ No. WO 91/19735, 26 декабря 1991), кодируемые пептиды (Публикация РСТ WO 93/20242, 14 октября 1993), случайные био-олигомеры (Публикация РСТ WO 92/00091, 9 января 1992), бензодиазепины (Патент США No.5,288,514), такие диверсомеры, как гидантоины, бензодиазепины и дипептиды (Hobbs et al., (1993) Proc. Natl. Acad. Sci. USA 90:6909-6913), винилоговые полипептиды (Hagihara et al., (1992) J.Amer.Chem.Soc. 114:6568), непептидные пептидомиметики с Бета-О-глюкозной оболочкой (Hirschmann et al., (1992) J.Amer.Chem.Soc. 114:9217-9218), аналоги органического синтеза из библиотек малых соединений (Chen et al., (1994) J.Amer.Chem.Soc. 116:2661), олигокарбаматы (Cho et al., (1993) Science 261:1303), и/или пептидил фосфанаты (Campbell et al., (1994) J.Org. Сhem. 59:658). См., Gordon et al., (1994) J. Med.Chem.37-.1385, библиотеки нуклеиновых кислот, пептидные библиотеки нуклеиновых кислот (см., напр., Патент США 5,539,083), библиотеки антител (см., напр., Vaughin et al., (1996) Nature Biotechnology, 14(3):309-3144 и PCT/US96/10287), библиотеки углеводов (см., напр., Liang et al. (1996) Science, 274, 1520-1522 и Патент США 5,593,853), и библиотеки малых органических соединений (см., напр., бензодиазепины, Baum (1993) C&EN, 18 января, стр.33, изопреноиды Патент США 5,569,588, тиазолидиноны и метатиазаноны Патент США 5,549,974, пирролидины Патенты США 5,525,735 и 5,519,134, морфолиновые соединения Патент США 5,506,337, бензодиазепины 5,288,514 и т.п.).
Устройства для получения комбинаторных библиотек коммерчески доступны (см., напр., 357 MPS, 390 MPS, Advanced Chem Tech. Louisville KY, Symphony, Rainin, Woburn, MA, 433A Applied Biosystems, Foster City, CA, 9050 Plus, Millipore, Bedford, MA).
H. Способы получения агентов, которые специфически связывают аналит
В настоящем изобретении заявлены способы получения агентов, например одноцепочечных антител, которые специфически связывают аналит-мишень.
Такие агенты применимы, например, в качестве специфических диагностических агентов для присоединения мишеней при изучении взаимодействий лиганд/рецептор. Данный метод особенно полезен для получения агентов против мишеней, которые могут быть получены в столь малых количествах, что получить антитела иммунизацией животных практически невозможно. Метод предусматривает этапы получения субстрата с присоединенной к нему мишенью; получение библиотеки организмов, несущих предназначенные для скрининга агенты; приведение библиотеки в контакт с мишенью для специфического удержания организмов посредством взаимодействия с мишенью и обнаружение удержанных организмов десорбционной спектрометрией.
Эти этапы могут осуществляться параллельно с большим числом кандидатов адсорбент-аналит в больших популяциях без потерь, обусловленных переносом, и неопределенностей, связанных с раздельными процедурами селекции и детекции, включая амплификацию и мечение для непрямого обнаружения.
1. Получение субстрата
На первом этапе метод предусматривает получение субстрата, содержащего адсорбент, который будет служить мишенью для полипептидного агента, представленного в подлежащей скринингу библиотеке. Согласно одному из вариантов осуществления изобретения получают субстрат с уже присоединенным адсорбентом-мишенью. Согласно другому варианту осуществления изобретения получают субстрат с адсорбентом, который связывает аналит-мишень, приводят адсорбент в контакт с аналитом в таких условиях элюции, которые обеспечивают удержание аналита, и используют асдобент-мишень в качестве мишени для библиотеки. Согласно одному из вариантов осуществления изобретения мишень дифференциально экспрессируется в клетках двух типов, которые подлежат сравнению. Например, мишени могут быть получены на основе дифференциально экспрессирующихся мРНК или могут быть дифференциально экспрессирующимися белками. Способы идентификации таких дифференциально экспрессирующихся белков методами ретентатной хроматографии описаны выше.
После того, как дифференциально экспрессирующийся белок-аналит идентифицирован, можно определить условие селективности, в котором аналит однозначно разрешается. Более предпочтительно, удержание аналита должно быть специфическим или исключительным. Методы последовательного разрешения аналитов, описанные выше, дают возможность идентифицировать условия селективности, при которых происходит специфическое связывание аналита-мишени из сложного образца. Согласно одному из вариантов осуществления изобретения связанная мишень может быть модифицирована, например, обработкой ферментом.
Альтернативно, метод может начинаться на стадии мРНК или EST. В этом случае дифференциально экспрессирующиеся мРНК или EST идентифицируют рутинными способами. Затем эти молекулы транскрибируют и транслируют in vitro и in situ для связывания на адсорбенте. Например, готовят субстрат для десорбционной спектрометрии со множеством пятен адсорбента. Субстрат наносят на цилиндрическую трубку, получая таким образом ячейку, на дне которой находится адсорбент. В ячейку помещают реагенты для транскрипции и трансляции in vitro дифференциально экспрессирующихся мРНК (обычно в виде кДНК). (О методах см., напр., Sambrook et al., Molecular Cloning – A Laboratory Manual, Cold Spring Harbor Laboratory, Cold Spring Harbor, NY, (1989) и Current Protocols in Molecular Biology, F.M. Ausubel et al., eds., (Current Protocols, a joint venture between Greene Publishing Associates, Inc. and John Wiley & Sons, Inc.)). Трансляция мРНК или EST приводит к образованию полипептида, который адсорбируется. Цилиндрическую трубку удаляют, а пятна адсорбента промывают элюантом, идентифицируя условие селективности, при котором удерживается полипептид-аналит.
2. Получение библиотек
Второй этап предусматривает получение библиотек. Библиотеки содержат организмы (генотипы), которые несут на своих поверхностях любые комбинаторные библиотеки пептидов (“полипептидные агенты”). Однако однонитчатные антитела привлекательны потому, что они могут впоследствии использоваться в иммунотестах.
Из уровня техники известно множество библиотек и способов их применения. Основная концепция подобных методов состоит в установлении физической ассоциации между полипептидным лигандом, подлежащим скринингу, и полинуклеотидом, кодирующим полипептид. Такая физическая ассоциация обеспечивается мельтимерным молекулярным комплексом, в данном случае, организмом, т.е. фаговой частицей, которая несет полипептид, как часть капсида, заключающего в себе геном фага, в котором закодирован данный полипептид. Установление физической ассоциации между полипептидами и кодирующим их генетическим матриалом дает возможность одновременного массированного скрининга очень большого числа организмов, несущих различные полипептиды. Организмы, несущие полипептид, который обладает аффинностью к мишени, связывают мишень, и данные организмы обогащаются аффинным скринингом мишени. Идентичность полипептидов, представленных на данных организмах, может быть определена на основе их геномов. С использованием данных методов полипептид, для которого показана аффинность к мишени, можно затем синтезировать обычными способами в больших количествах.
К организмам, которые наиболее часто используются для получения библиотек, относятся бактериофаг, в частности, нитчатый фаг, и, в особенности, фаги М13, Fd и F1. В большинстве работ для представления полипептидов в библиотеках использованы гены gIII или gVIII этих фагов с образованием слитых белков. См., Dower, WO 91/19818; Devlin, WO 91/18989; MacCafferty, WO 92/01047 (ген III); Huse, WO 92/06204; Kang, WO 92/18619 (ген VIII). См., также Cwirla et al., Proc. Natl. Acad. Sci. USA 87, 6378-6382 (1990); Devlin et al., Science 249, 404-406 (1990), Scott & Smith, Science 249, 386-388 91990); Ladner et al., US 5,223,409 и Ladner et al., US 5,571,698. Такие слитые белки содержат сигнальную последовательность, обычно принадлежащую секретируемому белку, отличному от поверхностного белка фага, а также белок гена III или VIII или их фрагменты. Экзогенные кодирующие последовательности часто встраивают возле N-конца гена III или VIII, хотя возможны и другие сайты встраивания. Были сконструированы отдельные векторы на основе нитчатых фагов для получения второй копии гена III или VIII. В таких векторах экзогенные последовательности представлены только одной или двумя копиями. Экспрессия второй копии эффективно снижает долю слитого белка, встроенного в фаговые частицы, и может служить преимуществом при снижении селекции в отношении полипептидов, неблагоприятных для роста фага. Представленность фрагментов антител на поверхности вирусов, инфицирующих бактерии (бактериофага или фага), дает возможность получать человеческие sFVs с широким спектром аффинностей и кинетических характеристик.
Согласно другому варианту экзогенные полипептидные последовательности клонируют в фагемидные векторы, кодирующие поверхностный белок фага и фаговые упаковочные последовательности, но неспособные к репликации. Фагемиды трансфицируют в клетки и упаковывают посредством инфекции фагом-помощником. Использование фагемидной системы также оказывает эффект на разбавление слитых белков, образованных из поверхностного белка и представляемого полипептида копиями поверхностного белка дикого типа, экспрессируемого фагом-помощником. См. нanp., Garrard, WO 92/09690.
Вирусы эукариот могут быть использованы для представления полипептидов аналогичным образом. Например, представление герегулина человека, слитого с gp70 вируса лейкоза мышей Молони, было описано Han et al., Proc. Natl. Acad. Sci. USA 92:9747-9751 (1995). Споры также могут быть использованы как реплицирующиеся организмы. В этом случае полипептиды представлены на внешней поверхности спор. Например, показано, что приемлемы споры B.subtilis. Последовательности поверхностных белков таких спор приведены Donovan et al., J.Mol.Biol 196, 1-10 (1987).
Клетки также можно использовать как реплицирующиеся организмы. Полипептиды, предназначенные для представления, встраивают в ген, кодирующий клеточный белок, который экспрессируется на поверхности клеток. К предпочтительным бактериальным клеткам относятся Salmonella typhimurium, Bacillus subtilis, Pseudomonas aeruginosa, Vibrio cholerae, Klebsiella pneumonia, Neisseria gonorrhoeae, Neisseria meningitidis, Bacteroides nodosus, Maraxella bovis и, в особенности, Escherichia coli. Подробно белки внешней поверхности обсуждаются Ladner et al., US 5,571,698 и Georgiou et al., Nature Biotechnology, 15,29-34 (1997). Например, удобен белок lamB E.coli.
3. Скрининг библиотеки
Третий этап предусматривает скрининг библиотеки для идентификации лиганда, который специфически связывает мишень. Субстрат, несущий мишень, приводят в контакт с библиотекой полипептидных агентов в таких условиях элюции, которые соответствуют специфическому связыванию между полипептидом и молекулой-мишенью. Организмы, на которых представлена агенты, распознающие мишень, связывают уже прикрепленную к субстрату мишень. Удаление несвязавшихся частиц и удержание связавшихся частиц достигается определенными условиями элюции.
Популяцию оганизмов, в данном случае фаг М13, содержащую приблизительно 1011 бляшкообразующих единиц (бое) на мл, наносят на субстрат матрицы с предопределенными локализациями, содержащими связанные адсорбенты-мишени (т.е. белки). При контакте выбирают условие селективности, оптимизированное для адсорбента-мишени (т.е. модификатор порога селективности или элюант), с тем, чтобы лишь небольшая часть всех фаговых генотипов селективно удерживалась, предпочтительно менее 5-10. Не связавшийся фаг (т.е. фаг, не связавшийся с адсорбентом-мишенью) и фаг, слабосвязанный с адсорбентом-мишенью, отмываются элюантом, который нарушает все взаимодействия “аналит/адсорбент-мишень”, кроме наиболее селективных. Селективно удерживаются те фаги, которые несут полипептиды, обладающие наивысшей аффинностью к адсорбенту-мишени.
4. Обнаружение удержанных организмов, содержащих агенты, которые специфически связывают мишень
На четвертом этапе связывание организмов с мишенью детектируется десорбционной спектрометрией. Например, фаг М13 имеет тысячи копий единственного поверхностного белка. При обработке фага лазерным излучением в ходе десорбционной спектрометрии поверхностные белки отсоединяются и становятся обнаружимы. Таким образом, можно определить содержит ли библиотека фаг несущий агент, который связывается с мишенью. Для получения организмов для дальнейших исследований этап скринирования можно осуществить параллельно в различных локализациях на зонде, или же субстрат может иметь такие физические размеры, которые достаточно велики, чтобы лазер не отсоединял все организмы, связанные на поверхности. Данный метод особенно чувствителен, поскольку им можно обнаружить даже несколько фаговых частиц, связанных с аналитом.
В случае фага М13 предпочтительный метод детекции предусматривает контроль при помощи десорбционной спектрометрии появления поверхностного белка гена VIII как сигнала “маркерного” белка. Таким образом, мы обнаружили “положительные” адсоррбенты-мишени, с которыми было связано всего 5 фаговых частиц (бое) (число фаговых частиц вычисляют из известных разведении). К другим фаговым маркерам, в порядке предпочтительности, относятся ген V, ген Х и ген III (включая его слитые продукты).
После определения предопределенных локализаций с наиболее аффинными адсорбентами, то есть тех локализаций на матрице, на которых после обработки в условиях высокой селективности (т.е. сильными элюантами) удерживается наименьшее количество фаговых частиц, связанный организм можно использовать как отправную точку для дальнейших исследований.
5. Выделение организма
Согласно одному из вариантов осуществления изобретения метод может включать выделение организма (генотипа) для дальнейшего анализа. Этот анализ может предусматривать репродуцирование организма и выделение из него полинуклеотида. Выделенный фаг репродуцируют обычными методами. Например, удержанный фаг можно привести в контакт с вектором биологической амплификации, например Е. соli, плюс питательная среда, для выращивания организмов для последующего анализа. Единичные клоны затем можно протестировать на способность связывать аналит, удержанный на субстрате.
6. Секвенирование нуклеотидной последовательности, кодирующей полипептидный агент
Секвенирование нуклеотидной последовательности, кодирующей полипептидный агент удержанного организма, дает информацию для получения полипептидного агента. Секвенирование может предусматривать выделение организма с адсорбента, его репродуцирование, выделение из него полинуклеотида и секвенирование нуклеотидной последовательности любым доступным способом. Согласно другому варианту осуществления изобретения организм можно репродуцировать in situ путем приведения субстрата в контакт с соответствующими матриалами, таким как клетки, подлежащий инфекции данным организмом. Согласно другому варианту секвенирование осуществляют in situ. Метод может включать лизирование организма и амплифицирование нуклеотидной последовательности любым известным способом, напр. ПЦР. Несколько различных организмов могту быть связаны с различными эпитопами, имеющимися на поверхности. В этом случае можно так изменить условия элюции, чтобы с эпитопом связывался только один тип фага.
7. Получение полипептидного агента
Следующий важный этап предусматривает получение полипептидного агента. Выделенный агент можно использовать, например, в качестве адсорбента для специфического обнаружения мишени при диагностике или для изучения взаимодействий лиганд/рецептор.
Согласно одному из подходов получение полипептида предусматривает первоначальное секвенирование нуклеотидной последовательности, кодирующей полипептид. Аминокислотная последовательность может быть выведена из нуклеотидной последовательности. Секвенирование можно осуществить описанным выше способом. Последовательность может служить основой для рекомбинантного или химического синтеза полипептидного агента.
Согласно другому варианту полипептид можно получить путем репродуцирования организма. Это особенно эффективно, когда организм содержит много копий полипептидного агента. Организм можно репродуцировать in situ или после выделения.
Метод рекомбинантного получения полипептида может быть осуществлен следующим образом. Кодирующую полипептид нуклеотидную последовательность секвенируют или выделяют любым способом. Затем нуклеотидную последовательность вводят в вектор экспрессии. Вектор экспрессии содержит повледовательность, котролирующую экспрессию, оперативно связанную с нуклеотидной последовательностью, кодирующей полипептид. Вектор экспрессии затем можно использовать для рекомбинантной экспрессии полипептидного агента известными из уровня техники способами.
Понятно, что мишень может содержать более чем один эпитоп. Соответственно, данным способом можно получить более чем один полипептидный агент, специфичный к мишени.
Мишень-специфические агенты могут быть использованы в качестве адсорбентов при получении зондов, применяемых в клинической диагностике или скрининге потенциальных лекарственных препаратов. То есть, поскольку такие зонды несут на своей поверхности агенты, которые специфически связывают мишень, их можно применять для выделения мишени из сложных смесей, таких как биологические образцы, и для обнаружения мишени десорбционной спектрометрией. Кроме того, поскольку взаимодействие между агентом и мишенью может быть биоспецифическим, то при нем возможна более высокая аффчинность между двумя компонентами, нежели в случае адсорбента, полученного описанным выше способом последовательного разрешения.
8. Выделение пептидных эпитопов на мишени
Один из вариантов данного метода позволяет выделять пептидные эпитопы на аналите-мишени. В методе использован “анти-идиотипический” подход. Вкратце, эпитопы аналита-мишени скринируют, например, с помощью фаговой библиотеки. Выделенный фаг содержит, например, одноцепочечные антитела, которые распознают эпитопы на аналите. Данный фаг в свою очередь используют для скрининга второй библиотеки. Фаг из второй библиотеки, который связывает одноцепочечные антитела из первой библиотеки, содержит полипептиды, структура которых имитирует структуру эпитопа, распознаваемого одноцепочечными антителами.
Согласно одному из вариантов осуществления данного метода нуклеотидная последовательность, кодирующая полипептидный агент, который связывает аналит-мишень, используется для получения фага М13, в котором агент представлен в виде слитого белка с геном VIII. Таким образом, данный фаг имеет оболочку, на которой представлены сотни копий пептида-мишени. Этот фаг затем связывают с адсорбентом. Связывание можно осуществить посредством, например, лиганда, который связывает ген III, или же ген III можно модифицировать введением рецептора к лиганду на субстрате. Затем фаг приводят в контакт со второй библиотекой. Представленные в библиотеке организмы, которые связывают прикрепленный фаг, обнаруживают и выделяют как описано. Предпочтительно, чтобы вторая библиотека содержала какую-либо метку с тем, чтобы белок гена VIII в данной библиотеке отличался от белка гена VIII фага, удерживаемого на субстрате. Таким образом, идентификации субстанции как “аналита-мишени” или как адсорбента может зависеть от того, может ли использованная связанная субстанция последовательно связывать другую субстанцию. Как можно видеть, способность связанной субстанции связывать другую субстанцию может воспроизводиться и служить для идентификации условий, в которых избирательно удаляется окончательно связанная субстанция.
ПРИМЕРЫ
Следующие примеры приведены только в целях иллюстрации и не ограничивают объем изобретения.
В приведенных примерах использованы следующие продукты и термины. Лизоцим яичного белка (1 мкл, разведенный водой до концентрации 10 пикомоль/мкл), доступен от Sigma Chemical Company, St.Louis, МО. Термин “Сыворотка человека” обозначает состав 1 мкл сыворотки человека, разведенной 1 к 5 в 20 мМ натрий-фосфатном буфере, 0.5 М NaCl, pH 7.0.
В данном контексте “мг” означает миллиграмм(ы); “мл” означает миллилитр(ы); “мкл” означает микролитр(ы); “см” означает сантимер(ы); “нм” означает нанометр(ы); “М” означает молярный; “мМ” означает миллимолярный; “мин” означает минуту (минуты); “%” или “процент”означает весовой процент, если не указано иначе; “NaCl” означает хлорид натрия; “ТФУ” означает трифторуксусную кислоту.
1. ПРОТОКОЛЫ РЕТЕНТАТНОЙ ХРОМАТОГРАФИИ
Следующие протоколы являются примерами процедур, применяемых при осуществлении ретентатной хроматографии.
А. Протокол ретентатного картирования (с использованием последовательных хроматографических матриц)
1. Обработка пробы
Разведите биологический образец (т.е. сыворотку, мочу, клеточный экстракт или среду культивируемых клеток) в 0.01% Тритоне Х100 в HEPES или 20 мМ Na-фосфате, рН 7.2. При необходимости осветлите пробу центрифугированием.
2. Нанесение пробы
Нанесите образец (1-5 мкл) на пятно анионного, номально-фазного или TED-Cu(II) адсорбента. В случае гидрофобного адсорбента предварительно увлажните каждое пятно 0.5 мкл ацетонитрила, содержащего 0.5% ТФУ. Нанесите образец на пятно до высыхания ацетонитрила. Дайте возможность образцу сконцентрироваться в пятне (почти до сухости).
3. Промывка
а. Матрица с анионным адсорбентом Промойте пятно 1 20 мМ HEPES или Na-фосфатом, рН 7.2. Добавьте к пятну первые 2 мкл промывочного раствора до того, как образец полностью высохнет.
Оставьте промывочный раствор на пятне как минимум на 15 секунд.
Пропипетируйте 10 раз. Полностью удалите первый промывочный раствор, повторите промывку со второй порцией (2 мкл) раствора.
Промойте пятно 2 0.2 М Nacl в 20 мМ Na-фосфате, рН 7.2, как указано выше.
Промойте пятно 3 1 М Naсl в 20 мМ Na-фосфате, рН 7.2, как указано выше.
Промойте пятно 4 20 мМ Tris HCl, рН 8.5, как указано выше.
Промойте пятно 5 0.1 М ацетатом Na, рН 4.5, как указано выше.
Промойте пятно 6 0.05% Тритоном Х100 в 20 мМ HEPES или Na-фосфате, рН 7.2, как указано выше.
Промойте пятно 7 3 М мочевиной в 20 мМ HEPES или Na-фосфате, рН 7.2, как указано выше.
Промойте пятно 8 10% ацетонитрилом в воде, как указано выше.
Тщательно промойте водой всю матрицу.
Высушите чип на воздухе.
Добавьте 0.3 мкл поглощающей энергию молекулы (насыщенный раствор, полученный в 50% ацетонитриле, 0.5% трифторуксусной кислоте).
Высушите чип на воздухе.
Анализируйте удержанный белок в каждом пятне при помощи лазерного десорбционно-ионизационного масс-спектрометра.
6. Матрица с нормально-фазным адсорбентом
Промойте пятно 1 5 мМ HEPES, рН 7.0. Добавьте к пятну первые 2 мкл промывочного раствора до того, как образец полностью высохнет. Оставьте промывочный раствор на пятне как минимум на 15 секунд. Пропипетируйте 10 раз. Полностью удалите первый промывочный раствор, повторите промывку со второй порцией (2 мкл) раствора.
Промойте пятно 2 20 мМ Na-фосфатом, 0.15 М NaCl, pH 7.2, как указано выше.
Промойте пятно 3 20 мМ Na-фосфате, 0.5 М NaCl, pH 7.2, как указано выше.
Промойте пятно 4 0.1 М Na-ацетатом, рН 4.0, как указано выше.
Промойте пятно 5 0.05% Тритоном Х100 в 20 мМ Na-фосфате, 0.15 М NaCl, рН 7.2, как указано выше.
Промойте пятно 6 3 М мочевиной в 20 мМ Na-фосфате, 0.15 М NaCl, рН 7.2, как указано выше.
Промойте пятно 7 1% ТФУ, как указано выше.
Промойте пятно 8 30% смесью изопропанол: ацетонитрил в воде, как указано выше.
Тщательно промойте водой всю матрицу.
Высушите чип на воздухе.
Добавьте 0.3 мкл поглощающей энергию молекулы (насыщенный раствор, полученный в 50% ацетонитриле, 0.5% трифторуксусной кислоте).
Высушите чип на воздухе.
Анализируйте удержанный белок в каждом пятне при помощи лазерного десорбционно-ионизационного масс-спектрометра.
в. Матрица с адсорбентом TED-Cu(II)
Промойте пятно 1 20 мМ HEPES, 0.5 M NaCl, pH 7.2. Добавьте к пятну первые 2 мкл промывочного раствора до того, как образец полностью высохнет.
Оставьте промывочный раствор на пятне как минимум на 15 секунд.
Пропипетируйте 10 раз. Полностью удалите первый промывочный раствор, повторите промывку со второй порцией (2 мкл) раствора.
Промойте пятно 2 20 мМ имидазола в 20 мМ Na-фосфате, 0.5 М NaCl, pH 7.2, как указано выше.
Промойте пятно 3 100 мМ имидазола в 20 мМ Na-фосфате, 0.5 М NaCl, pH 7.2, как указано выше.
Промойте пятно 4 0.1 М Na-ацетатом, 0.5 М NaCl, pH 4.0, как указано выше.
Промойте пятно 5 0.05% Тритоном Х100 в 20 мМ Na-фосфате, 0.15 М NaCl, pH 7.2, как указано выше.
Промойте пятно 6 3 М мочевиной в 20 мМ Na-фосфате, 0.15 М NaCl, pH 7.2, как указано выше.
Промойте пятно 7 1% ТФУ, как указано выше.
Промойте пятно 8 10% ацетонитрилом в воде, как указано выше. Тщательно промойте водой всю матрицу. Высушите чип на воздухе.
Добавьте 0.3 мкл поглощающей энергию молекулы (насыщенный раствор, полученный в 50% ацетонитриле, 0.5% трифторуксусной кислоте).
Высушите чип на воздухе.
Анализируйте удержанный белок в каждом пятне при помощи лазерного десорбционно-ионизационного масс-спектрометра.
г. Матрица с гидрофобным адсорбентом
Промойте пятно 15% ацетонитрилом в 0.1% ТФУ. Добавьте к пятну первые 2 мкл промывочного раствора до того, как образец полностью высохнет. Оставьте промывочный раствор на пятне как минимум на 15 секунд. Пропипетируйте 10 раз. Полностью удалите первый промывочный раствор, повторите промывку со второй порцией (2 мкл) раствора.
Промойте пятно 2 50% ацетонитрилом в 0.1% ТФУ, как указано выше.
Промойте пятно 3 0.05% Тритоном Х100 в 20 мМ Na-фосфате, 0.15 М NaCl, pH 7.2, как указано выше.
Промойте пятно 4 3 М мочевиной в 20 мМ Na-фосфате, 0.15 М Nad, pH 7.2, как указано выше.
Тщательно промойте водой всю матрицу.
Высушите чип на воздухе.
Добавьте 0.3 мкл поглощающей энергию молекулы (насыщенный раствор, полученный в 50% ацетонитриле, 0.5% трифторуксусной кислоте).
Высушите чип на воздухе.
Анализируйте удержанный белок в каждом пятне при помощи лазерного десорбционно-ионизационного масс-спектрометра.
В. Протокол теста антитело-антиген; теста рецептор-лиганд (с использованием преактивированной адсорбирующей матрицы)
1. Иммобилизация антитела на предактивированной адсорбирующей матрице
Поместите преактивированную адсорбирующую матрицу на чистую плоскую поверхность. Нанесите антитело, или рецептор, или контрольный раствор на каждое пятно преактивированной адсорбирующей матрицы, предварительно увлажненное 0.5 мкл изопропанола (добавьте 1 мкл антитела на пятно до того, как изопропанол высохнет).
Инкубируйте (при 4°С или комнатной температуре, 2-18 час) во влажной камере.
Удалите пипеткой оставшийся на пятне раствор.
Блокируйте оставшиеся активные саайты в пятнах добавлением 1 мл 1 М этаноламина, pH 7.4 в ФБР на весь чип и инкубируйте во влажной камере (при комнатной температуре 30 мин).
Промойте 0.5 М NaCl в 0.1 М ацетате натрия, pH 4.0, как указано выше.
Промойте 0.5 М NaCl в 0.1 М Трис-HCl, pH 8.0, как указано выше.
Ополосните ФБР, как указано выше. Затем заключите чип в ФБР и храните при 4°С до готовности к использованию.
2. Связывание антигена или лиганда
Аккуратно стряхните или промокните ФБР с чипа.
Добавьте 1-5 мкл образца на каждое пятно. В случае образцов с низкими концентрациями антигена или лиганда поместите адсорбирующую матрицу в биопроцессор. Промойте пятна на чипе и ячейки биопроцессора 200 мкл ФБР два раза. Добавьте 300 мкл образца в каждую ячейку. Заклейте липкой пленкой. Инкубируйте при встряхивании (при 4°С или комнатной температуре, 1-18 час).
3 Промывка
Удалите обарзец с пятен, промойте каждое пятно дважды 2 мкл ) 0.1% Тритоном Х100 в ФБР, рН 7.2. Нанесите на пятно первые 2 мкл промывочного раствора. Дайте раствору находиться на пятне не менее 15 секунд. Пропипетируйте 10 раз. Удалите полностью первый промывочный раствор, повторите промывку 2 мкл второго промывочного раствора. Затем следует промывка 0,5 М NaCl в 0.1 М HEPES, рН 7.4. Тщательно промойте водой всю матрицу.
4. Анализ удержанных белков
Высушите чип на воздухе.
Добавьте 0.3 мкл поглощающей энергию молекулы (насыщенный раствор синапиновой кислоты или ЕАМ1 или СНСА, приготовленный в 50% ацетонитриле, 0.5% три фторуксусной кислоте).
Высушите чип на воздухе.
Анализируйте удержанный белок в каждом пятне при помощи лазерного десорбционно-ионизационного масс-спектрометра.
II. ПРОФИЛЬ РАСПОЗНАВАНИЯ ЛИЗОЦИМА
Мы получили профиль распознавания лизоцима с применением ретентатной хроматографии высокого разрешения. Профиль включает разрешение лизоцима на шести адсорбентах с различными модификаторами порога селективности. Результат представлен в виде 40 различных спектрограмм, которые дифференциально характеризуют физико-химические свойства лизоцима.
А. Профиль распознавания лизоцима с использованием гидрофильной адсорбирующей матрицы
Лизоцим из яичного белка добавляют к различным пятнам хроматографической адсорбирующей матрицы, нанесенной на покрытый окисью кремния субстрат из нержавеющей стали. После инкубации во влажной камере при комнатной температуре в течение 15 минут каждое индивидуальное пятно адсорбента промывают одним из следующих элюантов (модификаторов порога селективности):
(1) 20 мМ натрий-фосфатный буфер, рН 7.
(2) 0.2 М NaCl в 20 мМ натрий-фосфатном буфере, рН 7.0,
(3) 0.4 М NaCl в 20 мМ натрий-фосфатном буфере, рН 7.0,
(4) 25 мМ натрий-ацетатный буфер, 0.125 М NaCl, рН 4.5,
(5) 1% ТФУ
(6) 10% ацетонитрил в воде,
(7) 20% ацетонитрил в воде,
(8) 0.05% Твин 20 в 20 мМ натрий-фосфатном буфере, 0.15 М NaCl, рН 7,0, и
(9) 3М мочевина в 20 мМ натрий-фосфатном буфере, рН 7.0
Каждая промывка включает трехкратное пипетирование 1 мкл промывочного раствора на пятне адсорбента. Этот процесс повторяют со свежей аликвотой промывочного раствора. Затем пятно адсорбента промывают два раза 1 мкл воды. Добавляют 0.3 мкл аликвоту синапиновой кислоты (5 мг/мл 50% ацетонитрил: 0.5% ТФУ) и высушивают на воздухе. Матрицу анализируют на масс-спектрометре с использованием азотного лазера (355 нм) и рукава длиной 60 см. Данные анализируют при помощи компьютера и переносят в GRAMS/32с (доступен от Galactic Industries Corporation) для последующего представления.
На фиг.5А представлен композитный масс-спектр для профиля распознавания лизоцима на нормально-фазной хроматографической адсорбирующей матрице. Нижний профиль представляет сигналы интенсивности лизоцима, удержанного на адсорбенте с оксидом кремния после промывки только буфером с рН 7.0. Добавление хлорида натрия (0.2-0.4 М) в качестве модификатора порога селективности снижает удержание лизоцима. Это указывает на тот факт, что взаимодействие лизоцима (основного белка) с адсорбентом – окисью кремния (отрицательно заряженным при рН 7), происходит по ионообменному механизму. Снижение рН модификатора порога селективности, например, до рН 4.5 в буфере ацетата натрия, или <2 в 1% ТФУ, почти полностью снимает отрицательный заряд с кремний-оксидного адсорбента и лизоцим на нем не задерживается. Введение агентов, модулирующих полярность (т.е. органических растворителей (напр., ацетонитрила), или детергента (Твина 20), или мочевины в качестве модификатора порога селективности также снижает взаимодействие лизоцима с кремний-оксидным адсорбентом.
Б. Профиль распознавания лизоцима с использованием гидрофобной адсорбирующей матрицы
Лизоцим из яичного белка добавляют к различным пятнам хроматографической адсорбирующей матрицы, нанесенной на покрытый окисью кремния субстрат из нержавеющей стали. После инкубации во влажной камере при комнатной температуре в течение 15 минут каждое индивидуальное пятно адсорбента промывают одним из следующих элюантов (модификаторов порога селективности):
(1) 0.1% ТФУ
(2) 10% ацетонитрил в 0.1% ТФУ,
(3) 20% ацетонитрил в 0.1% ТФУ,
(4) 50% ацетонитрил в 0.1% ТФУ,
(5) 0.05% Твин 20 в 20 мМ натрий-фосфатном буфере, 0.15 М NaCl, pH 7,0, и
(6) 3М мочевина в 20 мМ натрий-фосфатном буфере, 0.15 М NaCl, pH 7.0.
Каждая промывка включает трехкратное пипетирование 1 мкл промывочного раствора на пятне адсорбента. Этот процесс повторяют со свежей аликвотой промывочного раствора. Затем пятно адсорбента промывают два раза 1 мкл воды. Добавляют 0.3 мкл аликвоту синапиновой кислоты (5 мг/мл 50% ацетонитрил: 0.5% ТФУ) и высушивают на воздухе. Матрицу анализируют на масс-спектрометре с использованием азотного лазера (355 нм) и рукава длиной 60 см. Данные анализируют при помощи компьютера и переносят в GRAMS/32с для последующего представления.
На фиг.5В представлен композитный масс-спектр для профиля распознавания лизоцима на хроматографической адсорбирующей матрице с гидрофобным Cз. Нижний профиль представляет сигналы интенсивности лизоцима, удержанного на адсорбенте с гидрофобным Сз после промывки только 0.1% ТФУ. Использование агента, моделирующего полярность (т.е. ацетонитрила) в качестве модификатора порога селективности снижает удержание лизоцима на гидрофобном С3-адсорбенте. Концентрации ацетонитрила, использованного для элюции лизоцима с гидрофобного С3-адсорбента, варьировали в пределах 20-50%. Введение детергента (Твина 20) или мочевины в качестве модификатора порога селективности незначительно снижает удержание лизоцима на гидрофобном С3 адсорбенте.
В. Профиль распознавания лизоцима с использованием фенил-гидрофобной адсорбирующей матрицы
Дизоцим из яичного белка добавляют к различным пятнам хроматографической адсорбирующей матрицы с полипропиленовым (С3-гидрофобным) адсорбентом, нанесенным на покрытый окисью кремния субстрат из нержавеющей стали. После инкубации во влажной камере при комнатной температуре в течение 15 минут каждое индивидуальное пятно адсорбента промывают одним из следующих элюантов (модификаторов порога селективности):
(1) 0.1% ТФУ
(2) 10% ацетонитрил в 0.1% ТФУ,
(3) 20% ацетонитрил в 0.1% ТФУ,
(4) 50% ацетонитрил в 0.1% ТФУ,
(5) 0.05% Твин 20 в 20 мМ натрий-фосфатном буфере, 0.15 М NaCl, pH 7,0, и
(6) 3М мочевина в 20 мМ натрий-фосфатном буфере, 0.15 М NaCl, pH 7.0.
Каждая промывка включает трехкратное пипетирование 1 мкл промывочного раствора на пятне адсорбента. Этот процесс повторяют со свежей аликвотой промывочного раствора. Затем пятно адсорбента промывают два раза 1 мкл воды. Добавляют 0.3 мкл аликвоту синапиновой кислоты (5 мг/мл 50% ацетонитрил: 0.5% ТФУ) и высушивают на воздухе. Матрицу анализируют на масс-спектрометре с использованием азотного лазера (355 нм) и рукава длиной 60 см. Данные анализируют при помощи компьютера и переносят в GRAMS/32с для последующего представления.
На фиг.5С представлен композитный масс-спектр для профиля распознавания лизоцима на хроматографической адсорбирующей матрице с гидрофобным фенилом. Нижний профиль представляет сигналы интенсивности лизоцима, удержанного на адсорбенте с гидрофобным фенилом после промывки только 0.1% ТФУ. Использование агента, моделирующего полярность (т.е. ацетонитрила), в качестве модификатора порога селективности снижает удержание лизоцима. Концентрации ацетонитрила, использованного для элюции лизоцима с гидрофобного С3-адсорбента, варьировали в пределах 20-50%, однако, когда интенсивности пиков лизоцима, удержанного на С3 и фениле, сравнивали в одних и тех же условиях промывки ацетонитрилом (20%), то взаимодействие лизоцима с фенильным адсорбентом было менее сильным. Использование детергента (т.е. Твина 20) или мочевины в качестве модификатора порога селективности также значительно снижает удержание лизоцима на адсорбенте с гидрофобным фенилом.
Г. Профиль распознавания лизоцима с использованием анионной адсорбирующей матрицы
Лизоцим из яичного белка добавляют к различным пятнам адсорбирующей матрицы с анионной группой (SO3 –) (т.е. катионообменного адсорбента), нанесенной на покрытый окисью кремния субстрат из нержавеющей стали. После инкубации во влажной камере при комнатной температуре в течение 15 минут каждое индивидуальное пятно адсорбента промывают одним из следующих элюантов (модификаторов порога селективности):
(1) 20 мМ натрий-фосфатный буфер, рН 7.0.
(2) 0.1 М NaCl в 20 мМ натрий-фосфатном буфере, рН 7.0,
(3) 0.2 М NaCl в 20 мМ натрий-фосфатном буфере, рН 7.0,
(4) 0.4 М NaCl в 20 мМ натрий-фосфатном буфере, рН 7.0,
(5) 25 мМ натрий-ацетатный буфер, 0.125 М NaCl, рН 4.5,
(6) 0.05% Твин 20 в 20 мМ натрий-фосфатном буфере, 0.15 М NaCl, рН 7,0, и
(7) 3М мочевина в 20 мМ натрий-фосфатном буфере, рН 7.0
Каждая промывка включает трехкратное пипетирование 1 мкл промывочного раствора на пятне адсорбента. Этот процесс повторяют со свежей аликвотой промывочного раствора. Затем пятно адсорбента промывают два раза 1 мкл воды. Добавляют 0.3 мкл аликвоту синапиновой кислоты (5 мг/мл 50% ацетонитрил: 0.5%ТФУ) и высушивают на воздухе. Матрицу анализируют на масс-спектрометре с использованием азотного лазера (355 нм) и рукава длиной 60 см. Данные анализируют при помощи компьютера и переносят в GRAMS/32c для последующего представления.
На фиг.5D представлен композитный масс-спектр для распознавания лизоцима на катионообменной хроматографической адсорбирующей матрице. Нижний профиль представляет сигналы интенсивности лизоцима, удержанного на анионном адсорбенте после промывки только буфером с рН 7.0. Введение повышающихся концентраций хлорида натрия (0.2-0.4 М) в качестве модификатора порога селективности снижает удержание лизоцима. Это указывает на тот факт, что взаимодействие лизоцима (основного белка) с анионным адсорбентом происходит по ионообменному механизму. Для элюции лизоцима требовалась концентрация NaCl, равная -0.4 М. Снижение рН модификатора порога селективности, например, до рН 4.5 в буфере ацетата натрия не влияло на удержание лизоцима сильным анионным адсорбентом. Введение агентов, модулирующих полярность (т.е. таких детергентов, как Твин 20, или мочевины в качестве модификатора порога селективности снижает взаимодействие лизоцима с анионным адсорбентом. Это свидетельствует о том, что взаимодействие гидрофобного белка – лизоцима с анионным адсорбентом модулируется полярностью элюанта.
Д. Профиль распознавания лизоцима с использованием катионной адсорбирующей матрицы
Лизоцим из яичного белка добавляют к различным пятнам адсорбирующей матрицы с катионным адсорбентом (четвертичным амином), нанесенной на покрытый окисью кремния субстрат из нержавеющей стали. После инкубации во влажной камере при комнатной температуре в течение 15 минут каждое индивидуальное пятно адсорбента промывают одним из следующих элюантов (модификаторов порога селективности):
(1) 20 мМ натрий-фосфатный буфер, рН 7.0.
(2) 0.1 М NaCl в 20 мМ натрий-фосфатном буфере, рН 7.0,
(3) 0.2 М NaCl в 20 мМ натрий-фосфатном буфере, рН 7.0,
(4) 0.4 М NaCl в 20 мМ натрий-фосфатном буфере, рН 7.0,
(5) 25 мМ натрий-ацетатный буфер, 0.125 М NaCl, рН 4.5,
(6) 0.05% Твин 20 в 20 мМ натрий-фосфатном буфере, 0.15 M NaCl, pH 7,0, или
(7) 3М мочевина в 20 мМ натрий-фосфатном буфере, pH 7.0
Каждая промывка включает трехкратное пипетирование 1 мкл промывочного раствора на пятне адсорбента. Это процесс повторяют со свежей аликвотой промывочного раствора. Затем пятно адсорбента промывают два раза 1 мкл воды. Добавляют 0.3 мкл аликвоту синапиновой кислоты (5 мг/мл 50% ацетонитрил: 0.5% ТФУ) и высушивают на воздухе. Матрицу анализируют на масс-спектрометре с использованием азотного лазера (355 нм) и рукава длиной 60 см. Данные анализируют при помощи компьютера и переносят в GRAMS/32c для последующего представления.
На фиг.5Е представлен композитный масс-спектр для профиля распознавания лизоцима на хроматографической адсорбирующей матрице с катионным (анионообменным) адсорбентом. Удержание основного белка лизоцима на катионном адсорбенте очень невелико. Эффект модулирования модификаторов порога селективности на удержание лизоцима минимален.
Е. Профиль распознавания лизоцима с использованием адсорбирующей матрицы с иммобилизованными ионами металла
Лизоцим из яичного белка добавляют к различным пятнам адсорбирующей матрицы с иммобилизованными ионами металла (иминодиацетат-Сu), нанесенной на покрытый окисью кремния субстрат из нержавеющей стали. После инкубации во влажной камере при комнатной температуре в течение 15 минут каждое индивидуальное пятно адсорбента промывают одним из следующих элюантов (модификаторов порога селективности):
(1) 20 мМ натрий-фосфатный буфер, 0.5 М NaCl, pH 7.0.
(2) 5 мМ имидазол в 20 мМ натрий-фосфатном буфере, 0.5 М NaCl, pH 7.0.
(3) 0.1 М натрий-ацетатный буфер, 0.5 М NaCl, pH 4.5,
(4) 0.05% Твин 20 в 20 мМ натрий-фосфатном буфере, 0.15 М NaCl, pH 7.0 или
(5) 3М мочевина в 20 мМ натрий-фосфатном буфере, 0.5 М NaCl, pH 7.0.
Каждая промывка включает трехкратное пипетирование 1 мкл промывочного раствора на пятне адсорбента. Это процесс повторяют со свежей аликвотон промывочного раствора. Затем пятно адсорбента промывают два раза 1 мкл воды. Добавляют 0.3 мкл аликвоту синапиновой кислоты (5 мг/мл 50% ацетонитрил: 0.5% ТФУ) и высушивают на воздухе. Матрицу анализируют на масс-спектрометре с использованием азотного лазера (355 нм) и рукава длиной 60 см. Данные анализируют при помощи компьютера и переносят в GRAMS/32с для последующего представления.
На фиг.5F представлен композитный масс-спектр для профиля распознавания лизоцима на хроматографической адсорбирующей матрице с иммобилизованным металлом. Нижний профиль представляет сигналы интенсивности лизоцима, удержанного на адсорбенте с иммобилизованной медью после промывки только буфером с рН 7.0. Использование гистидинсвязывающего конкурентно-аффинного лиганда (т.е. имидазола) в качестве модификатора порога селективности отменяет удержание лизоцима. Этот факт свидетельствует о том, что во взаимодействии лизоцима (который имеет единственный остаток гистидина в своей последовательности) с адсорбентом на основе ионов иммобилизованной меди задействован механизм координатного ковалентного связывания. Понижение значения рН модификатора порога селективности до 4,5 в натрий-ацетатном буфере также снижает удержание лизоцима на адсорбенте с иммобилизованной медью. Полагают, что это является результатом протонирования остатка гистидина в лизоциме, что подавляет координатное ковалентное взаимодействие. Использование детергента (т.е. Твина 20) не влияет на взаимодействие. Использование мочевины полностью отменяет удержание лизоцима на адсорбенте с иммобилизованной медью.
III. ОБНАРУЖЕНИЕ АНАЛИТОВ В СЫВОРОТКЕ ЧЕЛОВЕКА
Мы разрешили аналиты в сыворотке человека с использованием разнообразных адсорбентов и элюантов. Полученные результаты показывают, что аналиты дифференциально удерживаются различными адсорбентами, и что ретенционная хроматография обеспечивает получение информации об аналитах как низких, так и высоких молекулярных масс.
А. Профиль распознавания белков сыворотки человека с использованием адсорбирующей матрицы с иммобилизованными ионами металлов
Сыворотку человека наносят на различные пятна адсорбирующей матрицы с иммобилизованными ионами металла (трис(карбоксиметил)этилендиамин-Сu), нанесенной на покрытый окисью кремния субстрат из нержавеющей стали. После инкубации во влажной камере при комнатной температуре в течение 15 минут каждое индивидуальное пятно адсорбента промывают одним из следующих элюантов (модификаторов порога селективности):
(1) 20 мМ натрий-фосфатный буфер, 0.5 М NaCl, pH 7.0.
(2) 5 мМ имидазол в 20 мМ натрий-фосфатном буфере, 0.5 М NaCl, pH 7.0,
(3) 0.1 М натрий-ацетатный буфер, 0.5 М NaCl, pH 7.0,
(4) 0.05% Твин 20 в 20 мМ натрий-фосфатном буфере, 0.15 М NaCl, pH 7.0 и
(5) 3М мочевина в 20 мМ натрий-фосфатном буфере, 0.5 М NaCl, pH 7.0.
Каждая промывка включает трехкратное пипетирование 1 мкл промывочного раствора на пятне адсорбента. Это процесс повторяют со свежей аликвотой промывочного раствора. Затем пятно адсорбента промывают два раза 1 мкл воды. Добавляют 0.3 мкл аликвоту синапиновой кислоты (5 мг/мл 50% ацетонитрил: 0.5%ТФУ) и высушивают на воздухе. Матрицу анализируют на масс-спектрометре с азотным лазером (355 нм) и трубой 60 см. Данные анализируют при помощи компьютера и переносят в GRAMS/32с для последующего представления.
На фиг6А и 6В представлен композитный масс-спектр для профиля распознавания белков сыворотки низких и высоких молекулярных весов на хроматографической адсорбирующей матрице с иммобилизованным металлом. Нижний профиль представляет белки сыворотки, удержанные на адсорбенте с иммобилизованной медью после промывки только буфером с pH 7.0. Использование гистидин-связывающего конкурентно-аффинного лиганда (т.е. имидазола) или детергента (т.е. Твина 20), или мочевины в качестве модификатора порога селективности, или же снижение pH модификатора порога селективности до pH 4.5 дифференциально усиливает или снижает удержание различных компонентов сложной смеси белков на одном адсорбенте.
Б. Профиль распознавания белков сыворотки человека с использованием множества различных адсорбентов
Сыворотку человека наносили на различные пятна адсорбирующей матрицы со следующими различными адсорбентами:
(1) С3 гидрофобным,
(2) фенил-гидрофобным,
(3) анионобменным,
(4) катионобменным, и
(5) иммобилизованным металлом (трис(карбоксиметил)этилендиамин-Сu).
Каждый адсорбент нанесен на покрытый окисью кремния субстрат из нержавеющей стали. После инкубации во влажной камере при комнатной температуре в течение 15 минут каждое пятно адсорбента промывают 0.05% Твином 20 в 20 мМ фосфатном буфере, 0.15 М NCl, pH 7.0 в качестве модификатора порога селективности.
Каждая промывка включает трехкратное пипетирование 1 мкл промывочного раствора на пятне адсорбента. Это процесс повторяют со свежей аликвотой промывочного раствора. Затем пятно адсорбента промывают два раза 1 мкл воды. Добавляют 0.3 мкл аликвоту синапиновой кислоты (5 мг/мл 50% ацетонитрил: 0.5% ТФУ) и высушивают на воздухе. Матрицу анализируют на масс-спектрометре с азотным лазером (355 нм) и трубой 60 см. Данные анализируют при помощи компьютера и переносят в GRAMS/32c для последующего представления.
На фиг.7А и 7В представлен композитный масс-спектр для профиля распознавания белков сыворотки на различных адсорбентах хроматографических адсорбирующих матриц. Использование единственного модификатора селективности с множеством различных адсорбентов (каждый из которых имеет различающиеся характеристики связывания) дифференциально усиливает или снижает удержание различных компонентов сложной смеси белков на различных адсорбентах.
IV. ОБНАРУЖЕНИЕ АНАЛИТОВ В МОЧЕ НЕДОНОШЕННЫХ ДЕТЕЙ
А. Разрешение аналитов в моче недоношенного ребенка с применением различных адсорбентов непрямо и одного элюанта (воды)
Мочу недоношенного ребенка (2 мкл) наносят на различные пятна карбонизированного полимерного субстрата PEEK, покрытого следующими различными адсорбентами:
(1) C8 гидрофобным (Октил Сефароза, доступна от Sigma)
(2) фенил-гидрофобным (Фенил Сефароза, доступна от Sigma)
(3) анионобменным (Q-Сефароза, доступна от Sigma)
(4) катионобменным (S-Сефароза, доступна от Sigma)
(5) иммобилизованным металлом (IDA-Cu, Хелатирующая Сефароза, доступна от Pharmacia)
(6) иммобилизованным металлом (трис(карбоксиметил)этилендиамин-Сu Сефароза ).
После инкубации во влажной камере при комнатной температуре в течение 15 минут каждое пятно адсорбента промывают водой в качестве модификатора порога селективности. Каждая промывка включает трехкратное пипетирование 1 мкл промывочного раствора на пятне адсорбента. Этот процесс повторяют со свежей аликвотой промывочного раствора. Затем пятно адсорбента промывают 1 мкл воды два раза. Добавляют 0.3 мкл аликвоту синапиновой кислоты (5 мг/мл 50% ацетонитрил: 0.5% ТФУ) и высушивают на воздухе. Матрицу анализируют на десорбционно-ионизационном масс-спектрометре (Hewlett Packard, Model 2030) с азотным лазером (355 нм) и трубой 150 см. Данные анализируют при помощи компьютерной программы HP MALDI TOF и переносят в GRAMS/32с для последующего представления.
На фиг.8А и 8В представлен композитный масс-спектр для профиля распознавания белков низких и высоких молекулярных весов, содержащихся в моче недоношенного ребенка, на различных адсорбентах хроматографических адсорбирующих матриц. Использование единственного модификатора селективности (т.е. воды) с различными адсорбентами (каждый из которых имеет различающиеся характеристики связывания) дифференциально усиливает или снижает удержание различных компонентов
Б. Разрешение аналитов в моче недоношенного ребенка с применением фенил-гидрофобного адсорбента, непрямо связанного с субстратом, и трех различных элюантов
Мочу недоношенного ребенка (2 мкл) наносят на различные пятна карбонизированного полимерного субстрата PEEK, покрытого фенил-гидрофобным адсорбентом (Фенил Сефароза, доступна от Sigma). После инкубации во влажной камере при комнатной температуре в течение 15 минут каждое пятно адсорбента промывают одним из следующих элюантов (модификаторов порога селективности):
(1) вода
(2) 2 М мочевина в 20 мМ натрий-фосфатном буфере, 0.15 М NaCl, pH 7.0, и
(3) 0.1% Твин 20 в 20 мМ натрий-фосфатном буфере, 0.15 М NaCI, pH 7.0.
Каждая промывка включает трехкратное пипетирование 1 мкл промывочного раствора на пятне адсорбента. Это процесс повторяют со свежей аликвотой промывочного раствора. Затем пятно адсорбента промывают два раза 1 мкл воды. Добавляют 0.3 мкл аликвоту синапиновой кислоты (5 мг/мл 50% ацетонитрил: 0.5%ТФУ) и высушивают на воздухе. Матрицу анализируют на десорбционно-ионизационном масс-спектрометре (Hewlett Packard, Model 2030) с азотным лазером (355 нм) и трубой 150 см. Данные анализируют при помощи компьютерной программы HP MALDI TOF и переносят в GRAMS/32с для последующего представления.
На фиг.9 представлен композитный масс-спектр профиля распознавания мочи недоношенного ребенка на гидрофобном фенильном адсорбенте хроматографических матриц. Использование с одним адсорбентом различных элюантов с различающимися характеристиками элюции дифференциально усиливает или ослабляет удержание различных компонентов сложной белковой смеси. Один из компонентов (обозначенный “*”) селективно удерживался на гидрофобном фенильном адсорбенте при использовании в качестве элюанта 0.1% Твина 20 в ФБР.
V. ИДЕНТИФИКАЦИЯ БЕЛКОВ В КУЛЬТУРАЛЬНОЙ СРЕДЕ ДВУХ РАЗЛИЧНЫХ КЛЕТОЧНЫХ ЛИНИЙ
Настоящий пример иллюстрирует идентификацию при помощи хроматографических адсорбирующих матриц белков, которые дифференциально экспрессируются в клетках.
Клетки двух различных линий рака молочной железы культивировали в течение одного промежутка времени в культуральной среде постоянного состава. После концентрирования в фильтровальной ячейке аликвоту каждой культуральной среды объемом 1 мкл наносили на различные пятна адсорбирующей матрицы (Ciphergen Biosystems, Inc., Palo Alto, CA) с иммобилизованным металлом (трис(карбоксиметил)этилендиамин-Сu), нанесенным на субстрат из нержавеющей стали, покрытой оксидом кремния. После инкубации во влажной камере при комнатной температуре в течение 15 минут каждое пятно адсорбента промывают одним из следующих элюантов (модификаторов порога селективности):
(1) 20 мМ натрий-фосфатный буфер, 0.5 М NaCl, pH 7.0.
(2) 20 мМ имидазол в 20 мМ натрий-фосфатном буфере,0.5 М NaCl, pH 7.0,
(3) 0.1 М натрий-ацетатный буфер, 0.5 М NaCl, pH 4.5,
(4) 0.1% Твин 20 в 20 мМ натрий-фосфатном буфере, 0.15 М NaCl, pH 7.0.
(5) 3М мочевина в 10 мМ натрий-фосфатном буфере,
(6) 1% ТФУ.
Каждая промывка включает трехкратное пипетирование 1 мкл промывочного раствора на пятне адсорбента. Это процесс повторяют со свежей аликвотой промывочного раствора. Затем пятно адсорбента промывают два раза 1 мкл воды. Добавляют 0.3 мкл аликвоту синапиновой кислоты (5 мг/мл 50% ацетонитрил: 0.5% ТФУ) и высушивают на воздухе. Матрицу анализируют на масс-спектрометре с азотным лазером (355 нм) и трубой 60 см. Данные анализируют при помощи компьютера и переносят в GRAMS/32с (Galactic Industries Corporation) для последующего представления.
На фиг.10А представлен композитный масс-спектр профиля распознавания для белков, секретируемых клеточной линией 1 на хроматографических адсорбирующих матрицах с иммобилизованным металлом (Сu). Применение на одном адсорбенте различных элюантов с различающимися порогами селективности дифференицально усиливает или ослабляет удержание различных компонентов такой сложной белковой смеси, как культуральная среда клеток.
На фиг.10В представлен композитный масс-спектр профиля распознавания для белков, секретируемых обеими клеточными линиями, на хроматографических адсорбирующих матрицах с иммобилизованным металлом (Сu). Тот же самый элюант 1.0% Твин 20+3 М мочевина в 10 мМ натрий-фосфатном буфере, 0.5 М NaCl, pH 7.0 применяли для отмывки несвязавшегося материала. Пик, обозначенный 7532 Да, представляет собой мажорный удержанный белок из набора белков, секретируемых клеточной линией 1, который не экспрессируется в клеточной линии 2.
На фиг.10С представлен композитный масс-спектр профиля распознавания для белков, секретируемых клеточной линией 2 на хроматографических адсорбирующих матрицах с иммобилизованным металлом (Ni). При использовании одного и того же элюанта 1.0% Твин 20+3 М мочевина в 10 мМ натрий-фосфатном буфере, 0.5 М NaCl, pH 7.0, но адсорбентов с различными потенциалами поверхностного взаимодействия (т.е. иммобилизованный Ni против иммобилизованной Сu) пик 7532 Да представляет единственный удержанный белок среди белков, секретируемых клеточной линией 1. На врезке приведен тот же самый масс-спектр в увеличенном масштабе. Меньший пик 3766 Да представляет тот же самый белок, но с двойным зарядом.
На фиг.10D представлен композитный масс-спектр профиля распознавания для белков, секретируемых клеточной линией 1 на хроматографических адсорбирующих матрицах с иммобилизованным металлом (Ni) до (нижний профиль) и после (верхний профиль) обработки трипсином in situ. Пептидная карта, полученная для чистого белка, представляет собой фингерпринт данного белка и может быть использована для идентификации.
VI. СРАВНЕНИЕ РЕТЕНТАТНОЙ ХРОМАТОГРАФИИ С ДВУХМЕРНЫМ ЭЛЕКТРОФОРЕЗОМ В ГЕЛЕ
Одним из преимуществ ретентатной хроматографии является возможность быстрого разрешения аналитов в различных измерениях, что дает информацию высокой плотности о различных физико-химических характеристиках. Наоборот, двухмерных гель-электрофорез обеспечивает разрешение только в двух измерениях.
На фиг.11 приведен профиль распознавания мочи недоношенного ребенка на гидрофобном фенильном адсорбенте хроматографических матриц. Применение различных элюантов и адсорбентов дает многопараметрическую информацию. Использование различных условий селективности дифференицально усиливает или ослабляет удержание различных компонентов сложной белковой смеси (такой как моча недоношенного ребенка), что приводит к детальному разрешению аналитов.
Наоборот, на фиг.12 показано двухмерное разрешение белков, содержащихся в моче недоношенного ребенка по рI и молекулярной массе. Гель дает информацию только о двух параметрах по сравнению с шестью параметрами адсорбентов, использованных для ретентатной хроматографии. Пятна не так хорошо разрешимы, как при масс-спектрометрии и разрешение в областях очень высоких и очень низких молекулярных масс ограничено.
VII. ПОСЛЕДОВАТЕЛЬНАЯ ЭКСТРАКЦИЯ АНАЛИТОВ ИЗ ОБРАЗЦА
Аналиты можно последовательно экстрагировать из образца, последовательно обрабатывая образец в различных условиях селективности с последующим сбором незадержанного образца.
Готовят лизат нокаут-мутанта Hemophilus в 10% глицерине, 50 мМ ЭДТА. После центрифугирования супернатант разводят 1:3 в 0.01% Тритоне Х100, 25 мМ HEPES, рН 7.4. Аликвоту (2 мкл) разведенного образца наносят на анионный сайт адсорбирующей матрицы. После инкубации при комнатной температуре в течение 30 минут оставшийся на анионном сайте материал переносят на нормально фазный сайт адсорбирующей матрицы. Пятно анионного сайта дважды промывают 2 мкл 0.01% Тритона Х100, 25 мМ HEPES. Каждая промывка включает десятикратное пипетирование промывочного раствора на пятне адсорбента. Смывы смешивают с образцом, первоначально ненесенным на нормально-фазный сайт.
После инкубации при комнатной температуре в течение 30 минут оставшийся на нормально-фазном сайте материал переносят на Ni(II)-сайт адсорбирующей матрицы. Пятно нормально фазного сайта дважды промывают 2 мкл фосфатного буферного раствора. Каждая промывка включает десятикратное пипетирование промывочного раствора на пятне адсорбента. Смывы смешивают с образцом, первоначально ненесенным на пятно Ni(II).
После того, как образец сконцентрирован почти до сухости на пятне Ni(II), несвязавшиеся аналиты выделяют двукратной промывкой 2 мкл 10 мМ имидазола в фосфатном буферном растворе. Каждая промывка включает десятикратное пипетирование промывочного раствора на пятне адсорбента.
Смывы переносят на пятно алифатического гидрофобного сайта адсорбирующей матрицы.
Образцу дают возможность сконцентрироваться почти до сухости на гидрофобном сайте, несвязавшиеся аналиты удаляют двукратной промывкой 2 мкл 5% ацетонитрила в 0.1% ТФУ. Каждая промывка включает десятикратное пипетирование промывочного раствора на пятне адсорбента.
Каждое пятно анионного, нормально-фазного, Ni(II) и гидрофобного сайта промывают 2 мкл воды для удаления оставшегося буфера. Добавляют 0.3 мкл аликвоту раствора синапиновой кислоты в 50% ацетонитриле, 0.5% ТФУ добавляют к каждому пятну. Удержанные на каждом сайте аналиты анализируют на лазерном десорбционно-ионизационном масс-спектрометре.
На фиг.19А-190 приведена ретенционная карта лизата Hemophilus на адсорбирующей матрице. На адсорбентах наблюдаются многочисленные пики в интервале масс от 3000 до 25000 Да. Обратите внимание, что каждый адсорбент проявляет различное удержание каждого из присутствующих в образце аналитов.
VIII. ПОСЛЕДОВАТЕЛЬНОЕ РАЗРЕШЕНИЕ АНАЛИТА
Путем добавления новых характеристик связывания или элюции к условию селективности, которое разрешает аналит, можно получить такое условие селективности, которое обеспечивает улучшенное разрешение аналита. В данном примере образец связывают на Сu(II)-адсорбенте и обрабатывают первым элюантом, а затем двумя вторыми элюантами. Вторые элюанты отличаются от первого добавлением отличного условия элюции. Каждое добавленное условие улучшает разрешение аналита.
Лизат Hemophilus дикого типа, взятого в стационарной фазе, приготовленный в 10% глицерине, разводят 1:120 мМ фосфатом натрия, 0.5 М хлоридом натрия, рН 7.0. После центрифугирования аликвоту супернатанта объемом 150 мкл инкубируют с пятнами Сu(II)-сайта адсорбирующей матрицы в биопроцессоре. После перемешивания на холоду в течение 30 минут образец удаляют. Каждое пятно промывают различным элюантом. Первое пятно промывают 150 мкл 20 мМ фосфата натрия, 0.5 М хлорида натрия, рН 7.0. Второе пятно промывают 150 мкл 0.05% Тритоном Х100 с добавлением 0.15 М NaCl, pH 7.0. Третье пятно промывают 150 мкл 100 мМ имидазола с добавлением 20 мМ фосфата натрия, 0.15 М NaCl, pH 7.0. Каждая отмывка включает инкубацию промывочного раствора на пятне в течение 5 минут с перемешиванием. Промывку повторяют дважды. Затем каждое пятно промывают водой для удаления детергента и буфера.
Адсорбирующую матрицу удаляют из биопроцессора. К каждому пятну добавляют 0.3 мкл аликвоту синапиновой кислоты в 50%-ном ацетонитриле, 0.5% ТФУ. Удержанные на каждом пятне аналиты анализируют при помощи дерсобционно-ионизационного масс-спектрометра.
На фиг.20А-20С представлена ретенционная карта лизата Hemophilus на сайте Cu(II) адсорбирующей матрицы после промывки в трех условиях элюции, описанных выше. Наблюдаются многочисленные пики в интервале масс от 2000 до 18000 Да. Белок, обозначенный “*”, является единственным минорным компонентом на ретенционной карте, приведенной на фиг.20А. Когда условие селективности модифицируется добавлением к тому же самому буферу детергента, Тритона Х100 (фиг.20В), белок “*” удерживается лучше, чем другие аналиты, и потому разрешается лучше. Когда условие селективности модифицируется добавлением к тому же самому буферу заменителя аффинности, имидазола (фиг.20С), белок “*” высоко разрешим от других аналитов на ретенционной карте.
Данная стратегия последовательной идентификации условий селективности с улучшенным разрешением аналита может быть адаптирована для разработки метода препаративной очистки данного белка из суммарного лизата Hemophilus.
IX. ДИФФЕРЕНЦИАЛЬНАЯ ЭКСПРЕССИЯ АНАЛИТА: ОБНАРУЖЕНИЕ МАРКЕРНОГО БЕЛКА
А. Сыворотка человека
Аликвоты сыворотки крови объемом 0.5 мкл, взятые от здорового и больного людей, разводят равным объемом 20 мМ фосфата натрия, 0.5 М NaCl, pH 7.0. Каждый образец наносят на отдельное пятно Сu(II)-сайта адсорбирующей матрицы. После инкубации при 4°С в течение 1 часа каждое пятно промывают два раза 2 мкл 20 мМ фосфата натрия, 0.5 М NaCl, pH 7.0 два раза. Каждая промывка включает десятикратное пипетирование промывочного раствора на пятне адсорбента. Окончательно каждое пятно промывают 2 мкл воды для удаления оставшегося буфера. К каждому пятну добавляют 0.3 мкл аликвоту синапиновой кислоты в 50%-ном ацетонитриле, 0.5% ТФУ. Удержанные на каждом пятне аналиты анализируют при помощи дерсобционно-ионизационного масс-спектрометра.
Белок, обозначенный “*” на фиг.21D, присутствует в значительно более высоких количествах в сыворотке больного, нежели в сыворотке здорового человека. Приведенные результаты свидетельствуют о том, что способ обнаружения маркеров заболевания может быть применен для клинической диагностики.
Б. Моча мыши
Аликвоты (1 мкл) мочи, взятой от нормальной, больной и обработанной препаратом мышей, наносят на пятна Сu(II)-сайта адсорбирующей матрицы. После инкубации при комнатной температуре в течение 10 минут каждое пятно промывают 2 мкл 100 мМ имидазола в 20 мМ фосфате натрия, 0.15 М NaCl, pH 7.0 два раза. Каждая промывка включает десятикратное пипетирование промывочного раствора на пятне адсорбента. Окончательно каждое пятно промывают 2 мкл воды для удаления оставшегося буфера. К каждому пятну добавляют 0.3 мкл аликвоту синапиновой кислоты в 50%-ном ацетонитриле, 0.5% ТФУ. Удержанные на каждом пятне аналиты анализируют при помощи дерсобционно-ионизационного масс-спектрометра.
На фиг.1 приведены ретенционные карты мочи нормальной (контроль), больной и обработанной препаратом мышей. Один из аналитов присутствовал в моче больной мыши в значительно более высоких количествах (средняя панель), тот же аналит не обнаруживался в моче нормальной мыши (верхняя панель) и обнаруживался в значительно более низких количествах в моче мыши, обработанной препаратом (нижняя панель). Данный аналит может использоваться как потенциальный маркер заболевания. Для иллюстрации достоверности количественного диагностического теста была вычислена площадь пика удержанного маркерного белка, которая приведена в таблице. Четкие количественные различия наблюдаются между образцами мочи больной и обработанной препаратом мышей. Для компенсации экспериментальных отклонений был использован внутренний стандартный аналит. Нормализованная площадь пика маркера заболевания (т.е. площадь пика маркера, деленная на площадь пика внутреннего стандарта) для каждого образца мочи представлена на нижней панели. Наблюдается по меньшей мере десятикратное снижение маркера заболевания в моче после лечения препаратом.
В. Моча человека
Образцы мочи нормальных людей и раковых больных разбавляли 1:2 в 1.01% Тритон X100 в фосфатном буферном растворе. Аликвоты мочи здоровых или больных людей, объемом 1,5 мкл наносили на различные пятна алифатического гидрофобного сайта адсорбирующей матрицы, увлажненные 0.5 мкл смеси изопропанол/ацетонитрил (1:2), 0,1% ТФУ. После инкубации при 4°С в течение 30 минут каждое пятно промывают два раза 2 мкл 50% этиленгликоля в 10 мМ Tris HCl, 0.05 М NaCl, pH 7.5. Каждая промывка включает десятикратное пипетирование промывочного раствора на пятне адсорбента. Окончательно каждое пятно промывают 2 мкл воды для удаления оставшегося этиленгликоля и буфера. К каждому пятну добавляют 0.3 мкл аликвоту синапиновой кислоты в 50%-ном ацетонитриле, 0.5% ТФУ. Удержанные на каждом пятне аналиты анализируют при помощи дерсобционно-ионизационного масс-спектрометра.
Ретенционные карты образцов мочи четырех раковых больных и здорового человека приведены на фиг. 23А. На гидрофобном сайте адсорбирующей матрицы после промывки 50% этиленгликолем в Tris/NaCl буфере были удержаны многочисленные белковые пики. Для идентификации возможных маркеров заболеваний были построены дифференционные карты для образцов мочи индивидуальных больных и образца нормальной мочи. Каждая прямая на диаграмме различий, превышающая среднее значение, представляет аналит, который присутствует в моче больных в повышенных количествах. (фиг.23В-23D). Вариации в характере дифференционных карт отражают индивидуальные флуктуации в популяции. Однако аналит в области 5000 Да (обозначенный “*”) и кластер аналитов в области 7500 Да (обозначенный “*”), постоянно присутствовали в повышенных количествах у всех больных и потому могут быть идентифицированы как возможные маркеры заболевания.
X. УДЕРЖАНИЕ ФАГА ИЗ ФАГОВОЙ БИБЛИОТЕКИ
Вирусы, адсорбированные на поверхности белкового чипа, можно обнаружить десорбционной спектрометрией. Антитела к вирусным поверхностным белкам, используемые в качестве адсорбентов, могут удерживать вирусы. Белок-мишень, используемый как адсорбент, может удерживать фаг, несущий одноцепочечное антитело к мишени.
А. Определение чувствительности антитела при помощи адсорбирующего субстрата
Фаг М13 (1012 частиц/мл) в ростовой среде последовательно разводили 0.01% Тритоном Х100 в 25 мМ HEPES, рН 7.4. Аликвоты (0.25 мкл) каждого разведения фаговой суспензии наносят на пятна алифатического гидрофобного сайта адсорбирующей матрицы. Затем добавляют аликвоты (0.3 мкл) СНСА в 50% ацетонитриле, 0.5% ТФУ. Образцы анализировали лазерной десорбционно-ионизационной масс-спектрометрией.
Белок гена VIII фага М13 был обнаружен на матрице с высокой чувствительностью. фиг.24А-24Е. Обнаружимый сигнал (сигнал/шум >2) был получен при разведении фаговой суспензии в 10,000,000 раз.
Б. Идентификация фага М13 на адсорбирующей матрице
Кроличьи анти-М13 антитела (Stratagene) были иммобилизованы на Белке A Hyper D (BioSepra) и тщательно отмыты фосфатным буферным раствором, рН 7.0. Аликвоту 1-10 мкл суспензии фага М13 (1012 частиц/мл) в ростовой среде инкубировали с 1 мкл аликвотой иммобилизованных анти-М13 антител при 4°С в течение ночи. После промывки 0.05% Твином 20 в фосфатном буферном растворе, рН 7.0, а затем водой для удаления детергента и буфера, аликвоту удержанного фага анализировали лазерной десорбционно-ионизационной спектрометрией в присутствии синапиновой кислоты.
Контроль анти-М13 антитела показал только сигнал антитела (единично и дважды заряженного). фиг.25А. Когда фаг М13 удерживался антителом, то наиболее легко идентифицируемыми белковыми пиками фага были белок гена III и белок гена VIII, слитые с одноцепочечным антителом фиг.25В. Поскольку белок гена VIII фага М13 обнаруживается данным методом с большой эффективностью, он может служить индикатором удержания фага.
В. Специфическое удержание фага М13, несущего одноцепочечное антитело
Белок HIV-1 Tat (McKesson BioServices) был соединен с преактивированным субстратом. После блокирования этаноламином матрицу промыли 0.005% Твином 20 в фосфатном буферном растворе, рН 7-0, и затем 0.1% БСА в фосфатном буферном растворе, рН 7.0. Последовательные разведения фага М13, несущего одноцепочечное антитело против белка Tat, инкубировали на адсорбирующей матрице с белком Tat при 4°С в течение ночи. Отрицательный контроль последовательных разведении фага М13, не несущего одноцепочечного антитела против белка Tat, также инкубировали на адсорбирующей матрице с белком Tat в аналогичных условиях. Матрицы промывали 0.005% Твином 20 в фосфатном буферном растворе, 1 М мочевиной в фосфатном буферном растворе, рН 7.0, и, наконец, водой для удаления буфера и мочевины. Затем добавляют 0.3 мкл аликвоту СНСА в 50% ацетонитриле, 0.5% ТФУ. Удержанный фаг анализируют при помощи дерсобционно-ионизационного масс-спектрометра.
Специфическое связывание фага М13, несущего одноцепочечное антитело против белка Tat, зависело от концентрации (жирная линия). фиг.26А-260. Неспецифическое связывание неспецифического фага М13 на адсорбирующей матрице было минимальным (пунктирная линия). Эти результаты иллюстрирую очень чувствительный метод обнаружения фага, который содержит ген, кодирующий одноцепочечное антитело, специфически распознающее аналит-мишень.
XI. СКРИНИНГ НА ПОДАВЛЕНИЕ СОЕДИНЕНИЕМ СВЯЗЫВАНИЯ РЕЦЕПТОРА И ЛИГАНДА
Заявленный в настоящем изобретении способ может быть применен для установления того факта, что тестируемый агент модулирует связывание лиганда с рецептором. На данном примере мы показываем, что ретентатная хроматография может обнаруживать подавление связывания между TGF-b и иммобилизованным рецептором TGF-b с использованием в качестве адсорбента свободного рецептора ТСР-b.
Рекомбинантный рецептор TGF-b-слитый Fc белок (R&D, Миннесота) был специфически прикреплен к адсорбирующей матрице с белком G. TGF-b (R&D, Миннесота) последовательно разводили кондиционированной средой клеток (сконцентрированной 2.5х) и инкубировали в течение ночи при 4°С на адсорбирующей матрице с рецептор-Fc белок G. Другой набор последовательных разведении TGF-b в кондиционированной среде клеток инкубировали на адсорбирующей матрице с рецептор-Fc белок G в присутствии модулирующего агента. В данном случае модулирующимо агентом был свободный рецептор TGF-b. После инкубации в тех же условиях чип промывали 0.05% Тритоном Х100 в ФБР и затем 3 М мочевиной в ФБР. К каждому пятну добавляют 0.3 мкл аликвоту стнапиновой кислоты и анализируют при помощи дерсобционно-ионизационного масс-спектрометра.
На фиг.27А представлено специфическое связывание 1 мкг/мл TGF-b на адсорбирующей матрице с рецептор-Fc белок G (жирная линия). Белков из кондиционированной среды клеток связывалось немного или не связывалось совсем. На фиг.27В представлено специфическое связывание 100 нг/мл TGF-b на адсорбирующей матрице с рецептор-Fc белок G (жирная линия). Когда инкубацию TGF-b на адсорбирующей матрице с рецептор-Fc белок G проводили в присутствии модулирующего агента (свободного рецептора TGF-b), связывание полностью отменялось при добавлении 100 нг/мл TGF-b (фиг.27А, пунктирная линия) и наблюдалось лишь следовое связывание при добавлении 1 мкг/мл TGF-b (фиг.27В, пунктирная линия). В данном примере модулирующий агент (тот же самый рецептор) обладал высокой специфической аффинностью связывания к лиганду, обеспечивая тем самым аналиту-мишени очень эффективную конкуренцию за связывание. В других случаях отношение связанного с адсорбентом аналита-мишени в присутствии и в отсутствии модулирующего агента служит указанием на эффективность модулирующего агента.
XII. РАЗРЕШАЮЩАЯ СПОСОБНОСТЬ РЕТЕНТАТНОЙ ХРОМАТОГРАФИИ
Данный пример демонстрирует способность ретентатной хроматографии параллельно с обработкой образца в различных условиях селективности разрешать белки в образце.
Был приготовлен лизат Hemophilis influenzae в 10% глицерине. После центрифугирования супернатант развели 1:3 в 0.01% Тритоне Х100 в 25 мМ HEPES, рН 7.4. Аликвоту разбавленного образца объемом 2 мкл наносят на пятно катионного сайта на сорбирующей матрице. После инкубации при комнатной температуре в течение 30 минут пятно промывают 25 мМ HEPES, рН 7.4. Вторую аликвоту разбавленного образца объемом 2 мкл наносят на пятно алифатического гидрофобного сайта на сорбирующей матрице. После инкубации при комнатной температуре в течение 30 минут пятно промывают водой. Третью аликвоту разбавленного образца объемом 2 мкл наносят на пятно Сu(II)-сайта на сорбирующей матрице. После инкубации при комнатной температуре в течение 30 минут пятно промывают 0.05% Тритоном Х100 и фосфатном буферном растворе, рН 7.4. Затем к каждому пятну добавляют 0.3 мкл аликвоту синапиновой кислоты в 50%-ном ацетонитриле, 0.5% ТФУ. Удержанные на каждом сайте аналиты анализируют при помощи дерсобционно-ионизационного масс-спектрометра.
Результаты приведены на фиг.28-31. Данный результат иллюстрирует способ комбинаторного разделения, включая параллельное разделение и обнаружение множественных аналитов.
XIII. ПОСЛЕДОВАТЕЛЬНАЯ СБОРКА МНОГОМЕРНЫХ СТРУКТУР
Данный пример иллюстрирует способ связывания вторичного адсорбента на первичном адсорбенте. Вторичный адсорбент служит в качестве специфического адсорбента для аналита-мишени.
Аликвоту слитого рецептора GST объемом 0.5 мкл разводят 20 мМ Tris, 100 мМ хлорида натрия. К нормальному сайту адсорбирующей матрицы добавляют 0.4% NP40, рН 7.2- Раствору дают сконцентрироваться на пятне почти до сухости. Пятно промывают 2 мкл 10 мМ Трис, 50 мМ хлорида натрия, рН 7.2 три раза. Окончательно пятно промывают 2 мкл воды два раза для удаления оставшегося буфера. Затем к пятну добавляют 0.3 мкл аликвоту синапиновой кислоты в 50%-ном ацетонитриле, 0.5% ТФУ. Удержанный слитой рецептор GST анализируют при помощи дерсобционно-ионизационного масс-спектрометра (фиг.32).
Аликвоту слитого рецептора GST объемом 0.5 мкл в 20 мМ Трис, 100 мМ хлорида натрия, 0.4% NP40, рН 7.2 наносят на нормальный сайт адсорбирующей матрицы. В качестве отрицательного контроля на другое пятно наносят образец, содержащий только белок GST (без рецептора). Раствору дают сконцентрироваться на пятне почти до сухости. Затем к каждому пятну добавляют 0.5 мкл 10 мМ Трис, 50 мМ хлорида натрия, рН 7.2. Раствор удаляют пипеткой через 10 секунд инкубации при комнатной температуре.
К пятну немедленно добавляют аликвоту (1 мкл) раствора, содержащего один специфический лиганд из библиотеки 96-ти других лигандов. Адсорбирующую матрицу инкубируют во влажной камере при комнатной температуре 1 час. Затем каждое пятно промывают 2 мкл смеси 30% изопропанол: ацетонитрил (1:2) в воде два раза. Каждая промывка включает десятикратное пипетирование промывочного раствора на пятне адсорбента. Затем к пятну добавляют 0.3 мкл аликвоту раствора а-циано-4-гидроксициннаминовой кислоты в 50%-ном ацетонитриле, 0.5% ТФУ. Удержанный на рецепторе лиганд анализируют при помощи дерсобционно-ионизационного масс-спектрометра.
На фиг.33А показано связывание специфического лиганда из библиотеки 96-ти других лигандов со слитым рецептором GST, удержанным на нормальном сайте адсорбирующей матрицы. На фиг.33В видно, что не происходит связывания лиганда только с белком GST (без рецептора), удержанным на той же матрице, что служит отрицательным контролем эксперимента.
В настоящем изобретении заявлены новые материалы и способы для ретентатной хроматографии. При том, что приведены конкретные примеры, описание является иллюстративным и не ограничивает объем изобретения. При знакомстве с данным описанием для квалифицированного специалиста будут очевидны многие возможные вариации изобретения. Поэтому объем изобретения определяется безотносительно приведенного описания последующей формулой изобретения.
Формула изобретения
1. Способ получения субстрата для обнаружения по меньшей мере одного аналита в образце, предусматривающий следующие этапы:
а) обработки образца по меньшей мере в двух условиях селективности, определяемых комбинацией адсорбента и элюанта, что дает возможность удержания аналита адсорбентом;
б) идентификации путем десорбционной спектрометрии по меньшей мере одного условия селективности, при котором удерживается аналит; и
в) получение субстрата, содержащего по меньшей мере один адсорбент при идентифицированном условии селективности.
2. Способ по п.1, отличающийся тем, что этап идентификации предусматривает идентификацию по меньшей мере одного условия селективности, при котором удерживается множество аналитов.
3. Способ по п.1, отличающийся тем, что этап получения субстрата предусматривает получение субстрата, содержащего множество адсорбентов, которые удерживают аналит при данном условии селективности как мультиплексный адсорбент.
4. Способ диагностики у субъекта заболевания при помощи обнаружения множества диагностических маркеров, включающий этапы:
а) контактирования по меньшей мере одного адсорбента, прикрепленного к субстрату, с биологическим образцом, взятым у субъекта, так, что по меньшей мере один адсорбент связывается с диагностическими маркерами;
б) промывки по меньшей мере одного адсорбента по меньшей мере одним элюантом для удаления несвязавшегося материала и обеспечения удержания диагностических маркеров;
в) обнаружения удержанных диагностических маркеров десорбционной спектрометрией; и
д) установления диагноза, базирующегося на обнаружении множества диагностических маркеров.
5. Способ по п.4, отличающийся тем, что множество адсорбентов присоединено к по меньшей мере одному субстрату, причем каждый адсорбент присоединен в разной предопределенной локализации.
6. Способ по п.4, отличающийся тем, что диагностируемое заболевание представляет собой рак, сердечное заболевание, аутоиммунное заболевание, вирусную инфекцию, болезнь Альцгеймера и диабет.
7. Способ по п.4, отличающийся тем, что биологический образец выбран из группы, включающей ткань, кровь, мочу, кал, лимфу, спинно-мозговую жидкость и внутрисуставную жидкость.
8. Способ по п.4, отличающийся тем, что биологический образец получают из патологической клетки.
9. Способ по п.4, отличающийся тем, что по меньшей мере один адсорбент представляет собой гидрофобный адсорбент.
10. Способ по п.4, отличающийся тем, что по меньшей мере один адсорбент представляет собой адсорбент тиофильного взаимодействия.
11. Способ по п.4, отличающийся тем, что по меньшей мере один адсорбент представляет собой нормально-фазный адсорбент.
12. Способ по п.4, отличающийся тем, что по меньшей мере один адсорбент представляет собой анионный адсорбент.
13. Способ по п.4, отличающийся тем, что по меньшей мере один адсорбент представляет собой катионный адсорбент.
14. Способ по п.4, отличающийся тем, что по меньшей мере один адсорбент представляет собой металлионный адсорбент.
15. Способ по п.4, отличающийся тем, что по меньшей мере один адсорбент представляет собой адсорбент гликопротеинового взаимодействия.
16. Способ по п.4, отличающийся тем, что по меньшей мере один адсорбент содержит нуклеиновую кислоту.
17. Способ по п.4, отличающийся тем, что по меньшей мере один адсорбент содержит множество антител, которые связываются с диагностическими маркерами.
18. Способ по п.17, отличающийся тем, что антитела прикреплены к субстрату в одних и тех же предопределенных локализациях.
19. Способ по п.17, отличающийся тем, что диагностические маркеры связаны антителами в различных предопределенных локализациях.
20. Способ по п.4, отличающийся тем, что маркеры содержат полипептид.
21. Способ по п.4, отличающийся тем, что маркеры содержат нуклеиновую кислоту.
22. Способ по п.4, отличающийся тем, что десорбционная спектрометрия представляет собой лазерную десорбционно/ионизационную масс-спектрометрию.
23. Способ по п.20, отличающийся тем, что десорбционная спектрометрия представляет собой лазерную десорбционно/ионизационную масс-спектрометрию.
24. Способ по п.21, отличающийся тем, что десорбционная спектрометрия представляет собой лазерную десорбционно/ионизационную масс-спектрометрию.
25. Набор для обнаружения аналита в образце, содержащий субстрат для десорбционной спектрометрии, содержащий по меньшей мере одну предопределенную локазацию, а каждая предопределенная локазация содержит адсорбент, который разрешает аналит в условии селективности, представленном адсорбентом и элюантом, и элюант или инструкции по обработке образца в условии селективности.
26. Набор по п.25, отличающийся тем, что предназначенный для диагностики заболевания по меньшей мере один аналит является как минимум одним диагностическим маркером заболевания.
27. Набор по п.26, отличающийся тем, что заболевание характеризуется множеством диагностических маркеров, и субстрат содержит множество предопределенных локазаций, а каждая предопределенная локазация содержит адсорбент, который разрешает как минимум один из диагностических маркеров.
28. Набор по п.27, отличающийся тем, что как минимум один адсорбент является мультиплексным адсорбентом, содержащим такие виды адсорбента, каждый из которых задерживает по меньшей мере один диагностический маркер.
29. Набор по п.27, отличающийся тем, что по меньшей мере один адсорбент не содержит биополимера.
30. Набор по п.27, отличающийся тем, что как минимум одна предопределенная локазация содержит лиганд, специфичный для диагностического маркера.
31. Набор по п.30, отличающийся тем, что лиганд представляет собой антитело.
32. Субстрат для десорбционной спектрометрии, содержащий по меньшей мере один адсорбент в по меньшей мере одной предопределенной локазации, и при этом по меньшей мере один адсорбент разрешает множество диагностических маркеров патологического состояния во взятом у больного образце.
33. Субстрат по п.32, отличающийся тем, что по меньшей мере один адсорбент не содержит биополимера.
34. Субстрат по п.32, отличающийся тем, что один адсорбент обнаруживает множество диагностических маркеров.
РИСУНКИ
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 20.06.2009
Извещение опубликовано: 20.07.2010 БИ: 20/2010
|
|