|
|
(21), (22) Заявка: 2002115268/13, 28.03.2000
(24) Дата начала отсчета срока действия патента:
28.03.2000
(30) Конвенционный приоритет:
08.11.1999 JP PCT/JP99/06213
(43) Дата публикации заявки: 27.01.2004
(45) Опубликовано: 27.05.2005
(56) Список документов, цитированных в отчете о
поиске:
RU 2107729 C1, 27.03.1998. ЕР 0549107 A1, 30.06.1993. JP 7143900 A, 06.06.1995. WO 96/01327 A1, 18.01.1996. US 5874260 A, 23.02.1999. WO 93/17127 A1, 02.09.93.
(85) Дата перевода заявки PCT на национальную фазу:
10.06.2002
(86) Заявка PCT:
JP 00/01919 (28.03.2000)
(87) Публикация PCT:
WO 01/34790 (17.05.2001)
Адрес для переписки:
129010, Москва, ул. Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. Е.Е.Назиной
|
(72) Автор(ы):
НОТОМИ Цугунори (JP),
ХАСЕ Тецу (JP)
(73) Патентообладатель(и):
ЭЙКЕН КАГАКУ КАБУСИКИ КАЙСЯ (JP)
|
(54) СПОСОБ И НАБОР ДЛЯ СИНТЕЗА НУКЛЕИНОВОЙ КИСЛОТЫ, ИМЕЮЩЕЙ НУКЛЕОТИДНУЮ ПОСЛЕДОВАТЕЛЬНОСТЬ, ГДЕ В ОДНОЙ ЦЕПИ ПОПЕРЕМЕННО СВЯЗАНЫ КОМПЛЕМЕНТАРНЫЕ НУКЛЕОТИДНЫЕ ПОСЛЕДОВАТЕЛЬНОСТИ
(57) Реферат:
Изобретение относится к области биотехнологии и может быть использовано в фармацевтической промышленности и в медицине. Предложен набор и способ для синтеза нуклеиновой кислоты. Указанный набор включает ДНК-полимеразу, катализирующую реакцию синтеза комплементарной цепи по механизму вытеснения, субстрат для нее, два внутренних праймера и два олигонуклеотида. Предложенный способ предусматривает смешивание данного набора с образцом нуклеиновой кислоты и инкубирование смеси при температуре, обеспечивающей сохранение ферментативной активности ДНК-полимеразы и устойчивое спаривание оснований последовательностей, составляющих внутренние праймеры, с комплементарными им последовательностями. В результате осуществления способа получают нуклеиновую кислоту, имеющую нуклеотидную последовательность, где в одной цепи попеременно связаны комплементарные нуклеотидные последовательности. Применение предложенного изобретения позволяет синтезировать нуклеиновую кислоту при пониженных расходах и повысить специфичность ее синтеза. 2 н. и 5 з.п. ф-лы, 18 ил.
Данное изобретение относится к способу синтеза нуклеиновой кислоты, состоящей из специфической последовательности нуклеотидов, который применим в качестве способа амплификации нуклеиновой кислоты.
Предпосылки изобретения
Способ анализа, основанный на комплементарности нуклеотидной последовательности нуклеиновой кислоты, может непосредственно анализировать генетические признаки. Таким образом, этот анализ является очень эффективным средством для идентификации генетических заболеваний, малигнизации, микроорганизмов и т.д. Далее, сам ген является объектом обнаружения, и, следовательно, отнимающие много времени и обременительные процедуры, например процедуры культивирования, могут быть в некоторых случаях опущены.
Тем не менее, обнаружение гена-мишени, присутствующего в очень небольшом количестве в образце, является обычно нелегким, так что является необходимой амплификация самого гена-мишени или его определяемого сигнала. В качестве способа амплификации гена-мишени известен способ ПЦР (полимеразной цепной реакции) (Science, 230, 1350-1354, 1985). В настоящее время способ ПЦР является наиболее популярным способом в качестве способа амплификации нуклеиновых кислот in vitro. Этот способ хорошо устоялся как превосходный способ определения, благодаря высокой эффективности на основе эффекта экспоненциальной амплификации. Кроме того, поскольку продукт амплификации может быть извлечен в виде ДНК, этот способ широко используется в качестве важного инструмента, обеспечивающего способы генетической инженерии, такие как клонирование и определения структуры генов. Однако в способе ПЦР имеются следующие известные проблемы: для его применения необходим специальный терморегулятор; экспоненциальное развитие реакции амплификации обусловливает проблему количественного определения, и образцы, и реакционные растворы легко загрязняются извне, что делает возможным ошибочное смешивание нуклеиновых кислот для функционирования в качестве матрицы.
По мере накопления информации о геноме привлекает внимание анализ полиморфизмов единственного нуклеотида (SNP). Детектирование SNP при помощи ПЦР является возможным вследствие конструирования праймера таким образом, что его нуклеотидная последовательность содержит SNP. То есть присутствует ли нуклеотидная последовательность, комплементарная этому праймеру, или не присутствует, может быть выяснено определением, присутствует или не присутствует продукт реакции. Однако, как только комплементарная цепь синтезируется случайно ошибочно в ПЦР, этот продукт функционирует в качестве матрицы в последующей реакции, давая ошибочный результат. На практике считается, что строгий контроль ПЦР является трудным при различии только одного основания, имеющегося на конце праймера. Таким образом, требуется улучшение специфичности для применения ПЦР с целью обнаружения SNP.
С другой стороны, на практике используют также способ синтеза нуклеиновой кислоты при помощи лигазы. Способ ЛЦР (лигазной цепной реакции, Laffler TG; Garrino JJ; Marshall RL; Ann. Biol. Clin. (Paris), 51:9, 821-6, 1993) основан на реакции, в которой два смежных зонда гибридизуются с последовательностью-мишенью и лигируются друг с другом лигазой. Эти два зонда не могут быть лигированы в отсутствие нуклеотидной последовательности-мишени, и, следовательно, присутствие лигированного продукта является указанием на наличие нуклеотидной последовательности-мишени. Поскольку способ ЛЦР также требует регуляции температуры для отделения комплементарной цепи от матрицы, возникает та же самая проблема, что и в способе ПЦР. Для ЛЦР имеется также сообщение о способе улучшения специфичности посредством добавления стадии обеспечения пропуска между соседними зондами и заполнения этого пропуска ДНК-полимеразой. Однако то, что может ожидаться в этом способе, это только специфичность, но все еще остается проблема, заключающаяся в том, что необходима регуляция температуры. Кроме того, применение дополнительного фермента приводит к увеличению в стоимости.
Способ, названный способом SDA (амплификацией с вытеснением (замещением) цепи) [Proc. Natl. Acad. Sci. USA, 89, 392-396, 1992] [Nucleic Acid. Res., 20, 1691-1696, 1992], известен также как способ амплификации ДНК, имеющей последовательность, комплементарную последовательности-мишени, в качестве матрицы. В способе SDA используют особую ДНК-полимеразу для синтеза комплементарной цепи, начинающейся от праймера, комплементарного 3′-стороне определенной нуклеотидной последовательности, с вытеснением (замещением) двухцепочечной цепи, если она имеется, на 5′-стороне этой последовательности. В данном описании простое выражение “5′-сторона” или “3′-сторона” относится к стороне цепи, служащей в качестве матрицы. Поскольку двухцепочечная цепь на 5′-стороне вытесняется вновь синтезированной комплементарной цепью, этот способ назван способом SDA. Стадия изменения температуры, необходимая в способе ПЦР, может быть исключена в этом способе SDA предварительным встраиванием последовательности узнавания рестрикционного фермента (рестриктазы) в гибридизуемую последовательность в виде праймера. То есть ник (одноцепочечный разрыв), генерируемый рестрикционным ферментом, дает 3′-ОН-группу, действующую в качестве затравки синтеза комплементарной цепи, а ранее синтезированная комплементарная цепь высвобождается в виде однонитевой цепи посредством синтеза с замещением цепи и затем снова используется в качестве матрицы для последующего синтеза комплементарной цепи. Таким образом, сложная регуляция температуры, необходимая в способе ПЦР, не требуется в способе SDA.
Однако в способе SDA должен быть использован рестрикционный фермент, генерирующий ник, кроме ДНК-полимеразы вытесняющего цепь типа. Это требование дополнительного фермента является главной причиной более высокой стоимости. Далее, поскольку рестриктаза должна использоваться не для расщепления обеих цепей двухцепочечной нуклеиновой кислоты, а для введения ника (т.е. расщепления только одной из этих цепей), производное dNTP, такое как  -тио-dNTP, должно быть использовано в качестве субстрата для синтеза, чтобы сделать другую цепь устойчивой к расщеплению этим ферментом. Таким образом, продукт амплификации по способу SDA имеет структуру, отличающуюся от структуры природной нуклеиновой кислоты, и, следовательно, ограничивает расщепление рестрикционными ферментами или использование амплифицированного продукта для клонирования генов. Также и в этом отношении присутствует веская причина для более высоких расходов. Кроме того, при применении способа SDA для неизвестной последовательности существует возможность, что та же самая нуклеотидная последовательность, что и последовательность узнавания рестриктазы, используемая для введения ника, может присутствовать в области, подлежащей синтезу. В этом случае, возможно, что полная комплементарная цепь не сможет быть синтезирована. -тио-dNTP, должно быть использовано в качестве субстрата для синтеза, чтобы сделать другую цепь устойчивой к расщеплению этим ферментом. Таким образом, продукт амплификации по способу SDA имеет структуру, отличающуюся от структуры природной нуклеиновой кислоты, и, следовательно, ограничивает расщепление рестрикционными ферментами или использование амплифицированного продукта для клонирования генов. Также и в этом отношении присутствует веская причина для более высоких расходов. Кроме того, при применении способа SDA для неизвестной последовательности существует возможность, что та же самая нуклеотидная последовательность, что и последовательность узнавания рестриктазы, используемая для введения ника, может присутствовать в области, подлежащей синтезу. В этом случае, возможно, что полная комплементарная цепь не сможет быть синтезирована.
NASBA (амплификация на основе последовательности нуклеиновой кислоты, также называемая опосредованным ТМА/транскрипцией способом амплификации) известна также в качестве способа амплификации нуклеиновой кислоты, в котором сложная регуляция температуры не является необходимой. NASBA является системой реакций, где ДНК синтезируется ДНК-полимеразой в присутствии РНК-мишени в качестве матрицы с зондом, имеющим добавленный к нему промотор Т7, и этот продукт образует со вторым зондом двухнитевую цепь, с последующей транскрипцией РНК-полимеразой Т7 с образованной двухнитевой цепью в качестве матрицы для амплификации большого количества РНК (Nature, 350, 91-92, 1991). NASBA требует некоторых стадий денатурации нагреванием, пока не завершается синтез двухцепочечной ДНК, но последующая реакция транскрипции РНК-полимеразой Т7 протекает при изотермических условиях. Однако необходимо комбинирование многочисленных ферментов, таких как обратная транскриптаза, РНКаза Н, ДНК-полимераза и РНК-полимераза Т7, что неблагоприятно сказывается на стоимости, аналогично SDA. Далее, поскольку сложно устанавливать условия для реакции многочисленных ферментов, этот способ едва ли является широко распространенным в качестве общего аналитического способа. В известных реакциях амплификации нуклеиновой кислоты остаются проблемы, такие как сложная регуляция температуры и необходимость применения множественных ферментов, как описано выше.
В отношении этих известных реакций синтеза нуклеиновой кислоты имеются несколько сообщений о попытке дополнительного улучшения эффективности синтеза нуклеиновой кислоты без ухудшения специфичности или расходов. Например, в способе, называемом RCA (амплификация катящегося кольца), было показано, что одноцепочечная ДНК, имеющая ряд нуклеотидных последовательностей, комплементарных подобному “висячему замку” зонду, может синтезироваться непрерывно в присутствии нуклеотидной последовательности-мишени (Paul M. Lizardi et al., Nature Genetics, 19, 225-232, July, 1998). В RCA используется подобный “висячему замку” зонд, имеющий особую структуру, в которой каждый из 5′- и 3′-концов единственного олигонуклеотида составляют смежный зонд в LCR. Затем, непрерывная реакция синтеза комплементарной цепи с зондом типа “висячего замка” в качестве матрицы, который был лигирован и циклизован в присутствии нуклеотидной последовательности-мишени, запускается объединением с полимеразой, катализирующей реакцию по типу вытеснения (замещения) цепи синтеза комплементарной цепи. Таким образом, образуется одноцепочечная нуклеиновая кислота, имеющая структуру из ряда районов, каждый из которых состоит из одной и той же последовательности нуклеотидов. Затем праймер дополнительно гибридизуют с этой одноцепочечной нуклеиновой кислотой для синтеза ее комплементарной цепи, и, следовательно, осуществляется высокая степень амплификации. Однако все еще остается проблема необходимости множества ферментов. Далее, запуск синтеза комплементарной цепи зависит от реакции лигирования двух смежных районов, и ее специфичность является в основном такой же, что и в LCR.
Для цели обеспечения З’-ОН существует известный способ, в котором нуклеотидную последовательность обеспечивают на 3′-конце последовательностью, комплементарной ей, и на этом конце образуется петля в виде шпильки (Gene, 71, 29-40, 1988). Синтез комплементарной цепи с самой последовательностью-мишенью в качестве матрицы начинается при петле-шпильке с образованием одноцепочечной нуклеиновой кислоты, состоящей из комплементарной нуклеотидной последовательности. Например, структура, в которой гибридизация происходит в той же самой цепи на конце, к которому была присоединена комплементарная нуклеотидная последовательность, получена в PCT/FR95/00891. Однако в этом способе необходимой является стадия, в которой этот конец отменяет спаривание оснований с комплементарной цепью, и спаривание оснований происходит опять в той же самой цепи. По оценкам, эта стадия протекает в зависимости от тонкого состояния равновесия на этом конце взаимно комплементарных нуклеотидных последовательностей, в том числе спаривания оснований. То есть используется равновесное состояние, поддерживаемое между спариванием оснований с комплементарной цепью и спариванием оснований в той же самой цепи, и только одна цепь, гибридизующаяся с нуклеотидной последовательностью в одной и той же цепи, служит в качестве затравки синтеза комплементарной цепи. Таким образом, считается, что для получения высокой эффективности реакции должны быть установлены строгие условия реакции. Кроме того, в этом существующем ранее способе сам праймер образует структуру петли. Таким образом, как только образуется димер праймера, реакция амплификации автоматически инициируется независимо от того, присутствует нуклеотидная последовательность-мишень или нет, и таким путем образуется неспецифический синтетический продукт. Это может быть серьезной проблемой. Далее, образование димера праймера и последующее использование этого праймера не специфической синтетической реакцией приводит к снижению эффективности амплификации желаемой реакции.
Кроме того, сообщают, что область, не служащую в качестве матрицы для ДНК-полимеразы, использовали для реализации гибридизации 3′-концевой структуры с той же самой цепью (ЕР713922). Это сообщение означает ту же самую проблему, что и в PCT/FR95/00891 выше в отношении использования динамического равновесия при этом конце или возможности неспецифической синтетической реакции вследствие образования димерного праймера. Кроме того, особая область, не служащая в качестве матрицы для ДНК-полимеразы, должна быть приготовлен в качестве праймера.
Далее, в различных сигнальных реакциях амплификации, для которых используют принцип описанной здесь NASBA, часто используют олигонуклеотид, имеющий структуру шпильки на его конце для обеспечения двухцепочечного района промотора (патент Японии JP-A5-211873). Однако эти способы не являются способами, позволяющими последовательное обеспечение 3′-ОН для синтеза комплементарной цепи. Кроме того, структура петли-шпильки, имеющая 3′-конец, гибридизованный гибридизацией в той же самой цепи, используется с целью получения ДНК-матрицы, транскрибируемой РНК-полимеразой, в патенте Японии JP-A 10-510161 (WO96/17079). В этом способе матрицу амплифицируют с использованием транскрипции в РНК и обратной транскрипции из РНК в ДНК. Однако в этом способе реакционная система не может быть составлена без комбинирования множества ферментов.
Описание изобретения
Целью данного изобретения является обеспечение способа синтеза нуклеиновой кислоты на основе нового принципа. Более конкретной целью является обеспечение способа, способного осуществлять синтез нуклеиновой кислоты в зависимости от последовательности эффективно при низких расходах. То есть целью данного изобретения является обеспечение способа, способного осуществлять синтез и амплификацию нуклеиновой кислоты с использованием единственного фермента даже при изотермических условиях реакции. Другой целью данного изобретения является обеспечение способа синтеза нуклеиновой кислоты, который может давать высокую специфичность, трудно достигаемую в случае известных принципов реакций синтеза нуклеиновых кислот, а также способа амплификации нуклеиновых кислот с использованием указанного синтетического способа.
Авторы данного изобретения сконцентрировали внимание на том факте, что использование полимеразы, катализирующей синтез комплементарной цепи по типу вытеснения (замещения) цепи, применимо для синтеза нуклеиновых кислот, не зависящего от сложной регуляции температуры. Такая ДНК-полимераза является ферментом, используемым в SDA и RCA. Однако даже при использовании такого фермента реакция другого фермента всегда требуется для обеспечения 3′-ОН в качестве затравки синтеза в хорошо известном способе на основе праймеров, таком как SDA.
В этих условиях авторы данного изобретения исследовали обеспечение 3′-ОН с совершенно иной точки зрения в сравнении с известным подходом. В результате авторы данного изобретения нашли, что с использованием олигонуклеотида, имеющего особую структуру, 3′-ОН может обеспечиваться без дополнительной ферментативной реакции, посредством чего была достигнута цель данного изобретения. То есть данное изобретение относится к способу синтеза нуклеиновой кислоты, способу амплификации нуклеиновой кислоты с применением указанного способа синтеза нуклеиновой кислоты и новому олигонуклеотиду, делающему возможными указанные способы, следующим образом:
1. Способ синтеза нуклеиновой кислоты, имеющей комплементарные нуклеотидные последовательности, связанные попеременно в однонитевой цепи, предусматривающий:
a) стадию обеспечения нуклеиновой кислоты, которая обеспечена на ее 3′-конце областью F1, способной гибридизоваться с частью F1c в той же самой цепи, и которая при гибридизации области F1 с F1c способна образовывать петлю, содержащую область F2c, способную к спариванию оснований,
b) стадию выполнения синтеза комплементарной цепи, где 3′-конец F1, присоединенный гибридизацией к F1c, служит в качестве затравки синтеза,
c) стадию гибридизации с областью F2c олигонуклеотида, обеспеченного его 3′-концом, с F2, состоящим из последовательности, комплементарной области F2c, с последующим синтезом, с указанным олигонуклеотидом в качестве затравки синтеза, комплементарной цепи полимеразой, катализирующей реакцию вытеснения (замещения) цепи синтеза комплементарной цепи, для вытеснения комплементарной цепи, синтезированной в стадии b), и
d) стадию гибридизации, с комплементарной цепью, вытесненной в стадии с), для подготовки для спаривания оснований, полинуклеотида, обеспеченного на его 3′-конце последовательностью, комплементарной произвольной области в указанной цепи, синтезированной в стадии с), с последующим синтезом, с указанным 3′-концом в качестве затравки синтеза, комплементарной цепи полимеразой, катализирующей реакцию вытеснения цепи синтеза комплементарной цепи, для вытеснения комплементарной цепи, синтезированной в стадии с).
2. Способ по п.1, где в стадии d) затравка синтеза представляет собой область R1, присутствующую на 3′-конце в той же самой цепи и способную гибридизоваться с областью R1c, а петля, содержащая область R2c, способную к спариванию оснований, образуется гибридизацией R1 с R1c.
3. Олигонуклеотид, состоящий по меньшей мере из двух областей Х2 и Х1с ниже, и Х1с связана с 5′-стороной Х2,
Х2: область, имеющая нуклеотидную последовательность, комплементарную произвольной области Х2с в нуклеиновой кислоте, имеющей специфическую нуклеотидную последовательность, и
X1c: область, имеющая по существу ту же самую нуклеотидную последовательность, что и в области X1c, расположенной на 5′-стороне области Х2с в нуклеиновой кислоте, имеющей специфическую нуклеотидную последовательность.
4. Способ по п.1, где нуклеиновая кислота в стадии а) является второй нуклеиновой кислотой, обеспеченной следующими стадиями:
i) стадией гибридизации с областью F2c в нуклеиновой кислоте, служащей в качестве матрицы, области F2 в олигонуклеотиде, описанном в п.3, где область Х2 является областью F2, а область X1c является областью F1c,
ii) стадией синтеза первой нуклеиновой кислоты, имеющей нуклеотидную последовательность, комплементарную матрице, причем F2 в этом олигонуклеотиде служит в качестве затравки синтеза,
iii) стадией превращения произвольной области в первой нуклеиновой кислоте, синтезированной в стадии ii), в область, готовую для спаривания оснований, и
iv) стадией гибридизации олигонуклеотида, имеющего нуклеотидную последовательность, комплементарную области, превращенной в область, готовую для спаривания оснований, в первой нуклеиновой кислоте в стадии iii), с последующим синтезом второй нуклеиновой кислоты с указанным олигонуклеотидом в качестве затравки синтеза и превращения F1 на ее 3′-конце в область, готовую для спаривания оснований.
5. Способ по п.4, где область, способная к спариванию оснований, в стадии iii) представляет собой R2c, a олигонуклеотид в стадии iv) представляет собой олигонуклеотид, описанный в п.3, где область Х2с является областью R2c, a область Х1с является областью R1c.
6. Способ по п.4 или 5, где стадию придания способности спаривания оснований в стадиях iii) и iv) проводят синтезом с вытеснением цепи комплементарной цепи полимеразой, катализирующей реакцию вытеснения цепи синтеза комплементарной цепи, где внешний праймер, гибридизующийся с 3′-стороной F2c в матрице, и внешний праймер, гибридизующийся с 3′-стороной области, используемой в качестве затравки синтеза в стадии iv) для первой нуклеиновой кислоты, служат в качестве затравки синтеза.
7. Способ по п.6, где температура плавления каждого олигонуклеотида и его комплементарной области в матрице, используемой в этой реакции, находится в следующем соотношении при одной и той же жесткости:
(внешний праймер/область на 3′-стороне в матрице) (F2c/F2 и R2c/R2) (F2c/F2 и R2c/R2) (F1c/F1 и R1c/R1). (F1c/F1 и R1c/R1).
8. Способ по любому из пунктов 4-7, где нуклеиновая кислота, служащая в качестве матрицы, является РНК, и синтез комплементарной цепи в стадии ii) проводят ферментом, имеющим обратную транскриптазную активность.
9. Способ амплификации нуклеиновой кислоты, имеющей комплементарные нуклеотидные последовательности, связанные попеременно в однонитевой цепи, с использованием повторяемого проведения следующих стадий:
A) стадии обеспечения матрицы, которая обеспечивается на ее 3′- и 5′-концах областью, состоящей из нуклеотидной последовательности, комплементарной каждой концевой области в той же самой цепи, и которая при гибридизации этих взаимно комплементарных нуклеотидных последовательностей образует петлю, способную к спариванию оснований между ними,
B) стадии выполнения синтеза комплементарной цепи, где 3′-конец указанной матрицы, гибридизующийся с той же самой цепью, служит в качестве затравки синтеза,
C) стадии гибридизации, с петлевой частью, олигонуклеотида, обеспеченного на его 3′-конце комплементарной нуклеотидной последовательностью, с петлей, которая среди указанных петель расположена на 3′-концевом сайте, с последующим синтезом, с олигонуклеотидом в качестве затравки синтеза, комплементарной цепи полимеразой, катализирующей реакцию вытеснения цепи синтеза комплементарной цепи, для вытеснения комплементарной цепи, синтезированной в стадии В), с получением ее 3′-конца, готового для спаривания оснований, и
D) стадии, в которой цепь с 3′-концом, сделанным готовым к спариванию оснований в стадии С), служит в качестве новой матрицы.
10. Способ по п.9, где олигонуклеотид в стадии С) обеспечивается на его 5′-конце нуклеотидной последовательностью, комплементарной 3′-концу, служащему в качестве затравки синтеза в стадии В).
11. Способ по п.10, дополнительно предусматривающий стадию, в которой комплементарную цепь, синтезированную с олигонуклеотидом в стадии С) в качестве затравки синтеза, используют в качестве матрицы в стадии А).
12. Способ по п.9, где матрица в стадии А) синтезируется по способу, описанному в п.5.
13. Способ по п.1 или 9, где реакцию вытеснения цепи синтеза комплементарной цепи проводят в присутствии регулятора температуры плавления.
14. Способ по п.13, где регулятором температуры плавления является бетаин.
15. Способ по п.14, где 0,2-3,0 М бетаин может присутствовать в реакционном растворе.
16. Способ обнаружения нуклеотидной последовательности-мишени в образце, предусматривающий выполнение способа амплификации, описанного в любом из пунктов 9-15, и наблюдение, генерируется или не генерируется продукт реакции амплификации.
17. Способ по п.16, где зонд, содержащий нуклеотидную последовательность, комплементарную петле, добавляют к продукту реакции амплификации и наблюдают гибридизацию между ними.
18. Способ по п.17, где этот зонд является меченным на частицах, и наблюдают реакцию агрегации, имеющую место при гибридизации.
19. Способ по п.16, где способ амплификации, описанный в любом из пунктов 9-15, проводят в присутствии детектора для нуклеиновой кислоты, и определение, генерируется или не генерируется продукт реакции амплификации, наблюдают на основании изменения в сигнале детектора.
20. Способ обнаружения мутации в нуклеотидной последовательности-мишени по способу определения, описанному в п.16, где мутация в нуклеотидной последовательности в качестве объекта амплификации предотвращает синтез любой из комплементарных цепей, участвующих в способе амплификации.
21. Набор для синтеза нуклеиновой кислоты, имеющей комплементарные цепи, попеременно связанные с однонитевой цепью, содержащий следующие элементы:
i) олигонуклеотид, описанный в п.3, где область F2c в нуклеиновой кислоте в качестве матрицы является Х2с, a F1с, расположенная на 5′-стороне F2c, является Х1с;
ii) олигонуклеотид, содержащий нуклеотидную последовательность, комплементарную произвольной области в комплементарной цепи, синтезированной с олигонуклеотидом в (i), в качестве праймера;
iii) олигонуклеотид, имеющий нуклеотидную последовательность, комплементарную области F3c, расположенной на 3′-стороне области F2c, в нуклеиновой кислоте, служащей в качестве матрицы;
iv) ДНК-полимеразу, катализирующую реакцию типа вытеснения цепи синтеза комплементарной цепи; и
v) нуклеотид, служащий в качестве субстрата для элемента iv).
22. Набор по п.21, где олигонуклеотид в ii) является олигонуклеотидом, описанным в п.3, где произвольная область R2c в комплементарной цепи, синтезированной с олигонуклеотидом в 1) в качестве затравки синтеза, является Х2с, a R1c, расположенная при 5′ R2c, является Х1с.
23. Набор по п.22, дополнительно содержащий: vi) олигонуклеотид, имеющий нуклеотидную последовательность, комплементарную области R3c, расположенную на 3′-стороне произвольной R2c в комплементарной цепи, синтезированной с олигонуклеотидом в i) в качестве затравки синтеза.
24. Набор для обнаружения нуклеотидной последовательности-мишени, содержащий детектор для определения продукта синтетической реакции нуклеиновой кислоты дополнительно в наборе, описанном в любом из пунктов 21-23.
Нуклеиновая кислота, имеющая комплементарные нуклеотидные последовательности, связанные попеременно в однонитевой цепи, в качестве объекта синтеза в данном изобретении, означает нуклеиновую кислоту, имеющую взаимно комплементарные нуклеотидные последовательности, непосредственно связанные в однонитевой цепи. Кроме того, в данном изобретении она должна содержать нуклеотидную последовательность для образования петли между этими комплементарными цепями. В данном изобретении эта последовательность называется петлеобразующей последовательностью. Нуклеиновая кислота, синтезированная по данному изобретению, состоит по существу из взаимно комплементарных цепей, связанных через петлеобразующую последовательность. Обычно цепь, не разделяющуюся на 2 или более молекулы при диссоциации спаривания оснований, называют однонитевой цепью, независимо от того, включает она в себя спаривание оснований или нет. Комплементарная нуклеотидная последовательность может образовывать спаривание оснований в той же самой цепи. Внутримолекулярный продукт со спаренными основаниями, который может быть получен при разрешении нуклеиновой кислоте иметь комплементарные нуклеотидные последовательности, связанные попеременно в однонитевой цепи в соответствии с данным изобретением, чтобы иметь спаренные основания в той же самой цепи, дает область, состоящую из, очевидно, двухнитевой цепи и петли, не имеющей спаривания оснований.
То есть нуклеиновая кислота, имеющая комплементарные нуклеотидные последовательности, связанные попеременно в однонитевой цепи согласно данному изобретению, содержит комплементарные нуклеотидные последовательности, способные гибридизоваться в той же самой цепи, а ее гибридизованный продукт может быть определен в виде одноцепочечной нуклеиновой кислоты, состоящей из петли, не содержащей спаривания оснований в изогнутой, шарнирной части. Олигонуклеотид, имеющий нуклеотидную последовательность, комплементарную этой части, может гибридизоваться с этой петлей, не имеющей спаривания оснований. Петлеобразующая последовательность может быть произвольной нуклеотидной последовательностью. Петлеобразующая последовательность способна к спариванию оснований таким образом, чтобы инициировать синтез комплементарной молекулы для вытеснения, и обеспечена предпочтительно последовательностью, отличающейся от нуклеотидной последовательности, расположенной в другой области для получения специфической гибридизации. Например, в предпочтительном варианте, петлеобразующая последовательность содержит ту же самую нуклеотидную последовательность, что и область F2c (или R2c), расположенную на 3′-стороне области (т.е. F1с или R1c), происходящую из нуклеиновой кислоты в качестве матрицы, и отожженной (гибридизованной) в той же самой цепи.
В данном изобретении по существу та же самая нуклеотидная последовательность определяется следующим образом. А именно, когда комплементарная цепь, синтезированная с определенной последовательностью в качестве матрицы, гибридизуется с нуклеотидной последовательностью-мишенью с образованием затравки синтеза комплементарной цепи, эта определенная последовательность является, по существу, той же самой, что и нуклеотидная последовательность-мишень. Например, термин “по существу, такая же последовательность, что и F2”, включает в себя не только абсолютно ту же самую нуклеотидную последовательность, что и F2, но также нуклеотидную последовательность, способную функционировать в качестве матрицы, дающей нуклеотидную последовательность, способную гибридизоваться с F2 и действовать в качестве затравки синтеза комплементарной цепи. Термин “гибридизоваться” в данном изобретении означает образование двухцепочечной структуры нуклеиновой кислоты через спаривание оснований на основе закона Уотсона-Крика. Таким образом, даже если цепь нуклеиновой кислоты, имеющая спаривание оснований, является однонитевой цепью, гибридизация имеет место, если внутримолекулярные комплементарные нуклеотидные последовательности являются последовательностями со спаренными основаниями. В данном изобретении отжиг и гибридизация имеют одно и то же значение, заключающееся в том, что нуклеиновая кислота образует двухцепочечную структуру посредством спаривания оснований.
Число пар комплементарных нуклеотидных последовательностей, составляющих нуклеиновую кислоту в соответствии с данным изобретением, равно по меньшей мере 1. Согласно желаемому варианту осуществления данного изобретения оно может быть равно 2 или более. В этом случае теоретически не существует верхнего предела числа пар комплементарных нуклеотидных последовательностей, составляющих эту нуклеиновую кислоту. Когда эта нуклеиновая кислота в качестве синтетического продукта данного изобретения составлена из множественных наборов комплементарных нуклеотидных последовательностей, эта нуклеиновая кислота состоит из повторяемых нуклеотидных последовательностей.
Нуклеиновая кислота, имеющая комплементарные нуклеотидные последовательности, связанные попеременно в однонитевой цепи, синтезированная данным изобретением, может не иметь такой же структуры, какую имеет природно встречающаяся нуклеиновая кислота. Известно, что, если производное нуклеотида используют в качестве субстрата, когда синтезируется нуклеиновая кислота под действием ДНК-полимеразы, может быть синтезировано производное нуклеиновой кислоты. Используемое производное нуклеиновой кислоты включает в себя нуклеотиды, меченные радиоактивным изотопом или производными нуклеотидов, меченными связывающим лигандом, например, биотином или дигоксином. Эти нуклеотидные производные могут быть использованы для мечения производных нуклеиновых кислот в качестве продукта. Альтернативно, если в качестве субстрата используют флуоресцентные нуклеотиды, нуклеиновая кислота в качестве продукта может быть флуоресцентным производным. Далее, этот продукт может быть либо ДНК, либо РНК. Какой продукт из них образуется, определяется комбинацией структуры праймера, типа субстрата для полимеризации и реагентов полимеризации для проведения полимеризации нуклеиновой кислоты.
Синтез нуклеиновой кислоты, имеющей структуру, описанную выше, может быть инициирован применением ДНК-полимеразы, имеющей активность вытеснения цепи, и нуклеиновой кислотой, которая обеспечена на ее 3′-конце областью F1, способной гибридизоваться с частью F1с в той же самой цепи, и которая при гибридизации области F1 с F1с способна образовывать петлю, содержащую область F2c, способную к спариванию оснований. Имеются многочисленные сообщения о реакции синтеза комплементарной цепи, в которой образуется петля в виде шпильки, и сама последовательность образца используется в качестве матрицы, тогда как в данном изобретении часть петли в виде шпильки обеспечена областью, способной к спариванию оснований, и, следовательно, имеется новый признак, заключающийся в использовании этой области в синтезе комплементарной цепи. Посредством использования этой области в качестве затравки синтеза комплементарная цепь, синтезированная ранее с самой последовательностью образца в виде матрицы, вытесняется. Затем область R1c (произвольная область), расположенная на 3′-конце вытесняемой цепи, находится в состоянии, готовом для спаривания оснований. Область, имеющая комплементарную последовательность к этому R1c, гибридизуется с ним, приводя к образованию нуклеиновой кислоты (2 молекул), имеющей нуклеотидную последовательность, простирающуюся от F1 до R1c, и ее комплементарную цепь, связанную попеременно через образующую петлю последовательность. В данном изобретении произвольная область, такая как R1c, описанная выше, может быть выбрана произвольно, при условии, что она может быть гибридизована с полинуклеотидом, имеющим нуклеотидную последовательность, комплементарную этой области, и что комплементарная цепь, синтезируемая с этим полинуклеотидом в качестве затравки синтеза, имеет необходимые функции для данного изобретения.
В данном изобретении используется термин “нуклеиновая кислота”. Нуклеиновая кислота в данном изобретении обычно включает в себя как ДНК, так и РНК. Однако нуклеиновая кислота, нуклеотид которой замещен искусственным производным или модифицированной нуклеиновой кислотой, произведенной из природной ДНК или РНК, также включена в термин нуклеиновой кислоты данного изобретения, пока он функционирует в качестве матрицы для синтеза комплементарной цепи. Нуклеиновая кислота данного изобретения обычно содержится в биологическом образце. Биологический образец включает в себя животные, растительные или микробные ткани, клетки, культуры и экскреции или экстракты из них. Биологический образец данного изобретения включает в себя геномную ДНК или РНК внутриклеточных паразитов, таких как вирус или микоплазма. Нуклеиновая кислота данного изобретения может происходить из нуклеиновой кислоты, содержащейся в указанном биологическом образце. Например, кДНК, синтезированная из мРНК, или нуклеиновая кислота, амплифицированная на основе нуклеиновой кислоты, происходящей из биологического образца, является типичным примером нуклеиновой кислоты данного изобретения.
Нуклеиновая кислота, характерная для данного изобретения, которая обеспечена на ее 3′-конце области F1, способной гибридизоваться с частью F1с в той же самой цепи, и которая при гибридизации области F1 с F1с способна образовывать петлю, содержащую область F2c, способную к спариванию оснований, может быть получена различными способами. В наиболее предпочтительном варианте реакция синтеза комплементарной цепи с использованием олигонуклеотида, имеющего следующую структуру, может быть использована для получения данной структуры.
То есть олигонуклеотид, применимый в данном изобретении, состоит по меньшей мере из двух областей Х2 и Х1с, описанных ниже, где Х1с лигирован с 5′-стороной Х2.
Х2: область, имеющая нуклеотидную последовательность, комплементарную области Х2с в нуклеиновой кислоте, имеющей специфическую нуклеотидную последовательность.
Х1с: область, имеющая по существу такую же нуклеотидную последовательность, что и область Х1с, расположенная на 5′-стороне области Х2с в нуклеиновой кислоте, имеющей специфическую нуклеотидную последовательность.
Здесь нуклеиновой кислотой, имеющей специфическую нуклеотидную последовательность, которой определяется структура олигонуклеотида данного изобретения, называют нуклеиновую кислоту, служащую в качестве матрицы при использовании олигонуклеотида данного изобретения в качестве праймера. В случае обнаружения нуклеиновой кислоты на основе синтетического способа данного изобретения нуклеиновая кислота, имеющая специфическую нуклеотидную последовательность, является мишенью определения или нуклеиновой кислотой, происходящей из этой мишени определения. Нуклеиновой кислотой, имеющей специфическую нуклеотидную последовательность, называют нуклеиновую кислоту, в которой по меньшей мере часть нуклеотидной последовательности является обнаруживаемой или предсказуемой. Частью обнаруживаемой нуклеотидной последовательности является область Х2с и область Х1с, расположенная на ее 5′-стороне. Можно предположить, что эти 2 области являются смежными или локализованными отдельно друг от друга. Относительным позиционным отношением этих двух областей определяется состояние петли, образуемой при самогибридизации нуклеиновой кислоты в качестве продукта. Расстояние между этими двумя областями предпочтительно является не очень далеким друг от друга, так что нуклеиновая кислота в качестве продукта подвергается самогибридизации, преобладающей над межмолекулярной гибридизацией. Таким образом, позиционное отношение между этими двумя областями предпочтительно является таким, что они является соседними при интервале между ними обычно 0-100 оснований. Однако в образовании петли посредством описанной ниже самогибридизации может быть случай, когда для образования петли было бы неблагопрятным, что эти две области находятся слишком близко друг к другу. В этой петле существует необходимость в структуре для гибридизации нового олигонуклеотида и для легкой инициации реакции вытеснения цепи синтеза комплементарной цепи с указанным олигонуклеотидом в качестве затравки синтеза. Более предпочтительно, расстояние между областью Х2с и областью Х1с, расположенной на 5′-стороне Х2с, составляет 0-100 оснований, более предпочтительно 10-70 оснований. Эта цифровая величина показывает длину за исключением длины Х1с и Х2. Число оснований, составляющих петлевую часть, равно этой длине плюс длина области, соответствующей Х2.
Как термин “идентичная”, так и термин “комплементарная”, используемые для характеристики нуклеотидной последовательности, составляющей олигонуклеотид на основе данного изобретения, не означают “абсолютно идентичная” или “абсолютно комплементарная”. То есть выражение “идентичная последовательность, что и определенная последовательность” включает в себя последовательности, комплементарные нуклеотидным последовательностям, способным гибридизоваться с определенной последовательностью. С другой стороны, комплементарная последовательность обозначает последовательность, способную гибридизоваться при жестких условиях с образованием 3′-конца, служащего в качестве затравки синтеза комплементарной цепи.
Обычно области Х2 и Х1с, составляющие олигонуклеотид данного изобретения, для нуклеиновой кислоты, имеющей специфическую нуклеотидную последовательность, расположены смежно без перекрывания друг с другом. Если в обеих нуклеотидных последовательностях имеется общая часть, то эти две нуклеотидных последовательности могут быть частично перекрывающимися. Поскольку Х2 должен функционировать в качестве праймера, он должен быть всегда 3′-концом. С другой стороны, Х1с должен придавать функцию праймера, как описано ниже, 3′-концу комплементарной цепи, синтезированной с этой нуклеиновой кислотой в качестве матрицы, и, следовательно, он должен быть помещен на 5′-конце. Комплементарная цепь, полученная с этим олигонуклеотидом в качестве затравки синтеза, служит в качестве матрицы для синтеза комплементарной цепи в обратном направлении в следующей стадии, и, наконец, часть олигонуклеотида данного изобретения копируется в качестве матрицы в комплементарную цепь. 3′-конец, генерированный копированием, имеет нуклеотидную последовательность X1, которая гибридизуется с Х1с в той же самой цепи с образованием петли.
В данном изобретении термин “олигонуклеотид” обозначает олигонуклеотид, который удовлетворяет двум требованиям, то есть он должен быть способен образовывать комплементарное спаривание оснований и давать -ОН-группу, служащую в качестве затравки синтеза комплементарной цепи, на 3′-конце. Таким образом, его скелет не должен ограничиваться только структурой, содержащей фосфодиэфирные связи. Например, он может состоять из фосфотиоатного производного, имеющего S вместо О, в качестве скелета, или пептид-нуклеиновой кислоты на основе пептидных связей. Основаниями могут быть основания, способные к комплементарному связыванию оснований. В природе существуют 5 оснований, то есть А, С, Т, G и U (А, Ц, Т, Г и У), но основание может быть также аналогом, например бромдезоксиуридином. Олигонуклеотид, используемый в данном изобретении, функционирует предпочтительно не только в качестве затравки синтеза, но также в качестве матрицы для синтеза комплементарной цепи. Термин полинуклеотид в данном изобретении включает в себя олигонуклеотиды. Термин “полинуклеотид” используется в том случае, когда длина цепи не является ограниченной, тогда как термин “олигонуклеотид” используется для обозначения нуклеотидного полимера, имеющего относительно короткую длину цепи.
Олигонуклеотид в соответствии с данным изобретением имеет такую длину цепи, чтобы быть способным к спариванию оснований с комплементарной цепью и сохранять необходимую специфичность в конкретной среде в различных реакциях синтеза нуклеиновой кислоты, описанных ниже. Конкретно, он состоит из 5-200 п.н., более предпочтительно 10-50 п.н. Длина цепи праймера, узнаваемого известной полимеразой, катализирующей зависимую от последовательности реакцию синтеза нуклеиновой кислоты, равна по меньшей мере приблизительно 5 оснований, так что длина цепи гибридизующейся части должна быть больше этой длины. Кроме того, длина 10 оснований или более является желательной статистически для ожидания специфичности этой нуклеотидной последовательности. С другой стороны, получение слишком длинной нуклеотидной последовательности химическим синтезом является трудным, и, следовательно, описанная выше длина цепи приводится в качестве примера как желательный диапазон. Приведенная в качестве примера здесь длина цепи относится к длине цепи части, гибридизующейся с комплементарной цепью. Как описано ниже, олигонуклеотид в соответствии с данным изобретением может гибридизоваться в конечном счете по меньшей мере с 2 областями индивидуально. Таким образом, должно быть понятно, что приведенная здесь в качестве примера длина цепи является длиной цепи каждой области, составляющей данный олигонуклеотид.
Далее, олигонуклеотид в соответствии с данным изобретением может быть помечен известным метящим веществом. Меченый субстрат включает в себя связывающие лиганды, такие как дигоксин и биотин, фермент, флуоресцентные вещества и люминесцентные вещества и радиоактивные изотопы. Способы замены основания, находящегося в олигонуклеотиде, флуоресцентным аналогом также известны (WO95/05391, Рrос. Natl. Acad. Sci. USA, 91, 6644-6648, 1994).
Другие олигонуклеотиды в соответствии с данным изобретением могут быть также связаны с твердой фазой. Альтернативно, произвольная часть олигонуклеотида может быть меченной связывающим лигандом, таким как биотин, и может быть иммобилизована непосредственно через партнера связывания, такого как иммобилизованный авидин. При использовании иммобилизованного олигонуклеотида в качестве затравки синтеза нуклеиновая кислота в качестве синтетического продукта реакции улавливается этой твердой фазой, облегчая таким образом его отделение. Отделенный продукт может определяться специфическим для нуклеиновых кислот индикатором или гибридизацией с метящим зондом. Фрагменты нуклеиновой кислоты-мишени могут быть также извлечены расщеплением продукта произвольными рестрикционными ферментами (рестриктазами).
Термин “матрица”, используемый в данном изобретении, обозначает нуклеиновую кислоту, служащую в качестве матрицы для синтеза комплементарной цепи. Комплементарная цепь, имеющая нуклеотидную последовательность, комплементарную матрице, обозначает цепь, соответствующую матрице, но это взаимоотношение между этими двумя цепями является лишь относительным. То есть цепь, синтезированная в виде комплементарной цепи, может опять функционировать в качестве матрицы. То есть комплементарная цепь может становиться матрицей.
Олигонуклеотид, применимый в данном изобретении, не ограничивается 2 областями, описанными выше, и может содержать дополнительную область. В то время как Х2 и Х1с расположены на 3′- и 5′-концах, соответственно, произвольная последовательность может быть расположена между ними. Например, она может быть сайтом узнавания рестриктазы, промотором, узнаваемым РНК-полимеразой, или ДНК, кодирующей рибозим. С использованием ее в качестве последовательности узнавания рестрикционного фермента, нуклеиновая кислота, имеющая комплементарную последовательность, попеременно связанную в однонитевой цепи в виде синтетического продукта данного изобретения, может расщепляться на двухцепочечные нуклеиновые кислоты одинаковой длины. Посредством помещения промоторной последовательности, узнаваемой РНК-полимеразой, синтетический продукт данного изобретения служит в качестве матрицы, делая возможной дальнейшую транскрипцию в РНК. Дополнительным помещением ДНК, кодирующей рибозим, осуществляется система, в которой продукт транскрипции является саморасщепляемым. Эти дополнительные нуклеотидные последовательности являются последовательностями, функционирующими после образования их в двухнитевую цепь. Таким образом, когда одноцепочечная нуклеиновая кислота в соответствии с данным изобретением образует петлю, эти последовательности не функционируют. Они не функционируют до тех пор, пока эта нуклеиновая кислота не элонгируется и не гибридизуется в отсутствие петли в цепь, имеющую комплементарную нуклеотидную последовательность.
При объединении промотора с олигонуклеотидом на основе данного изобретения в таком направлении, чтобы сделать возможной транскрипцию синтезированной области, продукт реакции данного изобретения, где одна и та же нуклеотидная последовательность повторяется, реализует высокоэффективную систему транскрипции. Посредством объединения этой системы с подходящей экспрессионной системой становится возможной также трансляция в белок. То есть эта система может быть также использована для транскрипции и трансляции в белок в бактериях или клетках животных или in vitro.
Олигонуклеотид данного изобретения, имеющий описанную выше структуру, может быть синтезирован химическим путем. Альтернативно, природная нуклеиновая кислота может быть расщеплена, например, рестриктазами и модифицирована таким образом, чтобы состоять из описанной выше нуклеотидной последовательности или быть лигированной в описанную выше нуклеотидную последовательность.
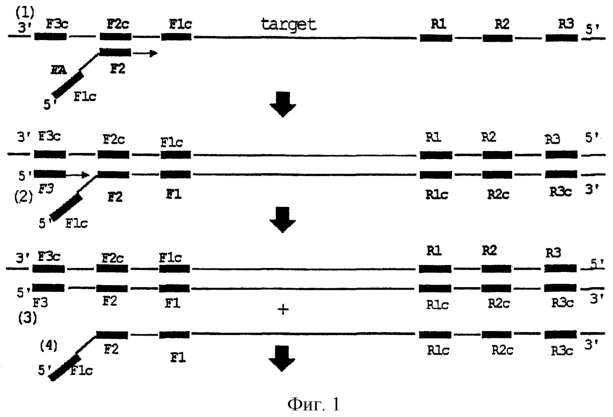
Основной принцип реакции для выполнения синтеза с использованием ценного олигонуклеотида, описанного выше, в комбинации с ДНК-полимеразой, имеющей активность вытеснения цепи, в реакции синтеза нуклеиновой кислоты в соответствии с данным изобретением, описывается со ссылкой на фиг.5-6. Олигонуклеотид, описанный выше (FA на фиг.5) гибридизуют при Х2 (соответствующем F2) с нуклеиновой кислотой в качестве матрицы для получения затравки синтеза комплементарной цепи. На фиг.5 комплементарная цепь, синтезированная от FA в качестве затравки синтеза, вытесняется синтезом комплементарной цепи (описанным ниже) от внешнего праймера (F3) с образованием однонитевой цепи (фиг.5-А). Когда синтез комплементарной цепи в полученную комплементарную цепь проводят далее, 3′-конец нуклеиновой кислоты, синтезированной в виде комплементарной цепи на фиг.5-А, имеет нуклеотидную последовательность, комплементарную олигонуклеотиду данного изобретения. То есть, поскольку 5′-конец олигонуклеотида данного изобретения имеет такую же последовательность, что и область Х1с (соответствующая F1c), 3′-конец синтезированной таким образом нуклеиновой кислоты имеет комплементарную последовательность X1 (F1). Фиг.5 показывает, что комплементарная цепь, синтезированная от R1 в качестве затравки синтеза, вытесняется синтезом комплементарной цепи праймером R3 в качестве затравки синтеза. Как только 3′-концевая часть делается готовой для спаривания основанием посредством этого вытеснения, X1 (F1) на 3′-конце гибридизуется с X1c (F1c) в той же самой цепи, и происходит реакция элонгации с самой собой в качестве матрицы (фиг.5-В). Затем Х2с (F2c), расположенный на ее 3′-конце, остается в виде петли, не участвующей в спаривании оснований. Х2 (F2) в олигонуклеотиде в соответствии с данным изобретением гибридизуется с этой петлей, и комплементарная цепь синтезируется с указанным олигонуклеотидом в качестве затравки синтеза (фиг.5-В). Продукт синтетической реакции комплементарной цепи с ранее синтезированным продуктом в качестве матрицы вытесняется посредством реакции вытеснения цепи таким образом, что он делается готовым к спариванию оснований.
Посредством составления оснований с использованием одного типа олигонуклеотида данного изобретения и произвольного обратного праймера, способного проводить синтез нуклеиновой кислоты, в котором комплементарная цепь, синтезированная с указанным олигонуклеотидом в качестве праймера, используется в качестве матрицы, можно получить множество синтетических продуктов нуклеиновых кислот, как показано на фиг.6. Как видно из фиг.6, (D) является желаемым продуктом нуклеиновой кислоты данного изобретения, имеющим комплементарную нуклеотидную последовательность, попеременно связанную в однонитевой цепи. После превращения в одноцепочечную цепь такой обработкой, как денатурация нагреванием, другой продукт (Е) служит снова в качестве матрицы для образования (D). Если продукт (D) в виде нуклеиновой кислоты в форме двухцепочечного тяжа превращают в одноцепочечный тяж денатурацией нагреванием, происходит гибридизация в той же самой цепи с высокой вероятностью без образования исходного двухцепочечного тяжа. Это объясняется тем, что комплементарная цепь, имеющая ту же самую температуру плавления (Тm), подвергается внутримолекулярной реакции, преобладающей над межмолекулярной реакцией. Каждый одноцепочечный тяж, произведенный из продукта (D), отожженного в той же самой цепи, гибридизуется в той же самой цепи и возвращается в состояние (В), и каждая цепь дополнительно дает одну молекулу (D) и (Е), соответственно. Посредством повторения этих стадий можно успешно синтезировать нуклеиновую кислоту, имеющую комплементарные нуклеотидные последовательности, связанные попеременно в однонитевой цепи. Матрица и продукт, образованные в цикле 1, увеличиваются экспоненциально, делая, следовательно, эту реакцию очень эффективной.
Для осуществления состояния фиг.5(А) первоначально синтезируемая комплементарная цепь, по меньшей мере в части, с которой гибридизуется обратный праймер, должна быть готова для спаривания оснований. Эта стадия достигается посредством произвольного способа. То есть внешний праймер (F3), который гибридизуется с первой матрицей в области F3c на 3′-стороне области F2c, с которой гибридизуется олигонуклеотид данного изобретения, готовят отдельно. Если этот внешний праймер используют в качестве затравки синтеза для синтеза комплементарной цепи полимеразой, катализирующей синтез комплементарной цепи по типу вытеснения цепи, то комплементарная цепь, синтезированная от F2c в качестве затравки синтеза в данном изобретении, вытесняется, и в результате область R1c, которая должена гибридизоваться с R1, делается готовой для спаривания оснований (фиг.5). При помощи реакции вытеснения цепи реакция теперь протекает при изотермических условиях.
Когда используют внешний праймер, синтез от внешнего праймера (F3) должен инициироваться после синтеза от F2c. В наиболее простом способе концентрацию внутреннего праймера делают более высокой, чем концентрация внешнего праймера. Конкретно, эти праймеры используют обычно при концентрациях, различающихся в 2-5 раз, предпочтительно в 4-10 раз, вследствие чего эта реакция может протекать, как ожидалось. Кроме того, температуру плавления (Тm) внешнего праймера устанавливают таким образом, что она ниже, чем Тm X1 (соответствующего F1 и R1) во внутреннем праймере, посредством чего может регулироваться тайминг синтеза. То есть (внешний праймер F3:F3c) (F2c/F2) (F2c/F2) (F1c/F1) или (внешний праймер/область на 3′-стороне в матрице) (F1c/F1) или (внешний праймер/область на 3′-стороне в матрице) (Х2с:Х2) (Х2с:Х2) (Х1с:X1). Здесь причина для (F2c/F2) (Х1с:X1). Здесь причина для (F2c/F2) (F1c/F1) заключается в необходимости гибридизации между F1c/F1 перед гибридизацией F2 с петлей. Гибридизация между F1c/F1 является внутримолекулярной реакцией и может, следовательно, протекать преимущественно с высокой вероятностью. Однако имеет смысл учитывать Tm, чтобы создать более желательные условия реакции. Само собой разумеется, подобные условия должны учитываться даже в конструировании обратного праймера. С использованием такой взаимосвязи могут быть достигнуты статистически идеальные условия реакции. Если остальные условия являются фиксированными, температура плавления (Tm) может быть теоретически рассчитана комбинированием длины гибридизующейся комплементарной цепи и оснований, участвующих в спаривании оснований. Таким образом, специалисты в данной области могут разработать предпочтительные условия на основе изложенного в данном описании материала. (F1c/F1) заключается в необходимости гибридизации между F1c/F1 перед гибридизацией F2 с петлей. Гибридизация между F1c/F1 является внутримолекулярной реакцией и может, следовательно, протекать преимущественно с высокой вероятностью. Однако имеет смысл учитывать Tm, чтобы создать более желательные условия реакции. Само собой разумеется, подобные условия должны учитываться даже в конструировании обратного праймера. С использованием такой взаимосвязи могут быть достигнуты статистически идеальные условия реакции. Если остальные условия являются фиксированными, температура плавления (Tm) может быть теоретически рассчитана комбинированием длины гибридизующейся комплементарной цепи и оснований, участвующих в спаривании оснований. Таким образом, специалисты в данной области могут разработать предпочтительные условия на основе изложенного в данном описании материала.
Далее, феномен, называемый непрерывным стекингом, может быть также использован для регуляции тайминга гибридизации внешнего праймера. Непрерывный стекинг является феноменом, в котором олигонуклеотид, неспособный гибридизоваться независимо, становится способным к гибридизации, когда он является частью двухцепочечного тяжа. (Chiara Borghesi-Nicoletti et al., Bio Techniques, 12, 474-477 (1992)). То есть внешний праймер конструируют таким образом, чтобы он был смежным с F2c (X2c) и не был способен гибридизоваться независимо. В результате этого гибридизации внешнего праймера не происходит, пока не гибридизуется F2c (X2c), и, следовательно гибридизация F2c (X2c) происходит преимущественно. На основе этого принципа примеры показывают установку нуклеотидной последовательности олигонуклеотида, необходимого в качестве праймера, для ряда реакций. Эта стадия может также достигаться денатурацией при нагревании или с использованием ДНК-геликазы.
Если матричной нуклеиновой кислотой, имеющей F2c (X2c), является РНК, состояние 5-(А) может быть также реализовано отличающимся способом. Например, если эту цепь РНК разрушают, R1 становится готовым для спаривания оснований. То есть F2 гибридизуется с F2c в РНК и синтезируется комплементарная цепь в виде ДНК обратной транскриптазой. РНК, служащую в качестве матрицы, разрушают щелочной денатурацией или обработкой ферментом с использованием рибонуклеазы, действующей на РНК в двухцепочечном тяже ДНК/РНК, посредством чего ДНК, синтезированная из F2, образуется в одноцепочечный тяж. Для фермента, селективно разрушающего РНК в двухцепочечном тяже ДНК/РНК, может быть использована РНКаза Н или некоторые обратные транскриптазы. Таким путем обратный праймер может гибридизоваться с R1, сделанным способным к спариванию оснований. Таким образом, внешний праймер, для придания R1c способности спаривания с основаниями, становится ненужным.
Альтернативно, активность вытеснения цепи обратной транскриптазы может быть использована для вытеснения цепи внешним праймером, как описано выше. В этом случае реакционная система может состоять только из обратной транскриптазы. То есть с использованием РНК в качестве матрицы можно сделать возможным синтез обратной транскриптазой комплементарной цепи из F2, гибридизованной с F2c в матрице, и синтезировать комплементарную цепь от внешнего праймера F3 в качестве затравки синтеза, гибридизованного с F3c, локализованным на 3′-стороне F2c, и одновременно вытеснять ранее синтезированную комплементарную цепь. Когда обратная транскриптаза выполняет реакцию синтеза комплементарной цепи с ДНК в качестве матрицы, все реакции синтеза комплементарных цепей, в том числе синтез комплементарной цепи R1 в качестве затравки синтеза, гибридизующегося с R1c в вытесняемой комплементарной цепи, в качестве матрицы, синтез комплементарной цепи с R3 в качестве затравки синтеза, гибридизующегося с R3c, расположенным на 3′-стороне R1c, и одновременная реакция вытеснения, происходят под действием обратной транскриптазы. Если нельзя ожидать, что эта обратная транскриптаза проявляет активность вытеснения ДНК/РНК-цепи при конкретных условиях реакции, может также использоваться в комбинации ДНК-полимераза, имеющая активность вытеснения цепи, описанная выше. Вариант получения первой одноцепочечной нуклеиновой кислоты с РНК в качестве матрицы, описанный выше, является предпочтительным вариантом осуществления данного изобретения. С другой стороны, если используют ДНК-полимеразу, такую как ДНК-полимераза Вса, имеющую как активность вытеснения цепи, так и активность обратной транскриптазы, не только синтез первой одноцепочечной нуклеиновой кислоты из РНК, но также последующая реакция с ДНК в качестве матрицы могут протекать подобным образом с использованием одного и того же фермента.
Реакционная система, описанная выше, позволяет различные вариации, присущие данному изобретению, посредством использования обратного праймера, имеющего специфическую структуру. Наиболее эффективная вариация описана ниже. То есть олигонуклеотид, сконструированный, как описано в [5], используют в качестве обратного праймера в наиболее выгодном варианте осуществления данного изобретения. Олигонуклеотид, описанный в [5], является олигонуклеотидом, в котором произвольные области R2c и R1c в комплементарной цепи, синтезированные с F2 в качестве праймера, являются Х2с и Х1с, соответственно. С использованием такого обратного праймера ряд реакций для образования петли и для синтеза и вытеснения комплементарной цепи из этой петли происходят как в смысловой, так и в антисмысловой цепях (прямая сторона и обратная сторона). В результате эффективность реакции для синтеза нуклеиновой кислоты, имеющей комплементарные нуклеотидные последовательности, связанные попеременно в однонитевой цепи в соответствии с данным изобретением, является сильно улучшенной, тогда как ряд из этих реакций являются возможными при изотермических условиях. В дальнейшем этот способ описан более подробно со ссылкой на фиг.1-3, где этот способ суммируется.
В следующем варианте готовят 2 типа олигонуклеотидов на основе данного изобретения. Для объяснения они обозначаются как FA и RA. Области, составляющие FA и RA, являются следующими:
| |
Х2 |
X1c |
| FA |
F2 |
F1c |
| RA |
R2 |
R1c |
Здесь F2 является комплементарной нуклеотидной последовательностью относительно области F2c в нуклеиновой кислоте в качестве матрицы. R2 является нуклеотидной последовательностью, комплементарной области R2c, содержащейся в комплементарной цепи, синтезированной с F2 в качестве праймера. F1c и R1c являются произвольными нуклеотидными последовательностями, расположенными по ходу транскрипции от F2c и R2c, соответственно. Расстояние между F2 и R2 может быть произвольным. Даже если его длина равна приблизительно 1 т.п.н., достаточный синтез является возможным при подходящих условиях, хотя он и зависит от синтетической способности ДНК-полимеразы выполнять синтез комплементарной цепи. Конкретно, когда используют ДНК-полимеразу Bct, желаемый продукт определенно синтезируется, если расстояние между F2 и R2c равно 800 п.н., предпочтительно 500 п.н. или менее. Считается, что в ПЦР с температурным циклом уменьшение активности фермента под действием стресса изменения температуры уменьшает эффективность синтеза длинной нуклеотидной последовательности. В предпочтительном варианте осуществления данного изобретения температурный цикл в стадии амплификации нуклеиновой кислоты не требуется, и, следовательно, синтез и амплификация даже длинной нуклеотидной последовательности могут быть определенно достигнуты.
Сначала F2 в FA гибридизуют с нуклеиновой кислотой в качестве матрицы и используют в качестве затравки синтеза комплементарной цепи. Последующие стадии реакции до фиг.1(4) являются такими же, как описанные в ранее описанном основном способе (фиг.5) в данном изобретении. Последовательность, гибридизованная, как F3 на фиг.1(2), является внешним праймером, описанным выше. ДНК-полимеразу для проведения синтеза комплементарной цепи по типу вытеснения цепи с этим праймером в качестве затравки синтеза используют таким образом, что комплементарная цепь, синтезированная из FA, вытесняется и делается готовой для спаривания оснований.
Когда R2c подготовлен для спаривания оснований в (4), RA в качестве обратного праймера гибридизуют с ним в комбинации R2c/R2. Синтез комплементарной цепи с этим сайтом в качестве затравки синтеза происходит до тех пор, пока эта цепь не достигнет F1c в 5′-конце FA. После этой реакции синтеза комплементарной цепи внешний праймер R3 для вытеснения гибридизуют с ней для синтеза комплементарной цепи, во время которого происходит также вытеснение цепи таким образом, что комплементарная цепь, синтезированная из RA в качестве затравки синтеза, вытесняется. В комплементарной цепи, вытесненной таким образом, RA расположен на ее 5′-стороне, а последовательность, комплементарная FA, расположена на ее 3′-конце.
На 3′-стороне одноцепочечной нуклеиновой кислоты, вытесненной таким образом, имеется последовательность F1, комплементарная F1c в той же самой цепи. F1 быстро гибридизуется с F1c в той же самой молекуле для инициации синтеза комплементарной цепи. При гибридизации 3’-конца (F1) с F1c в той же самой цепи образуется петля, содержащая F2c. Как также очевидно из фиг.2-(7), часть этой петли остается готовой для спаривания оснований. Олигонуклеотид FA данного изобретения, имеющий нуклеотидную последовательность, комплементарную F2c, гибридизуется с частью этой петли и действует в качестве затравки синтеза комплементарной цепи (7). Синтез комплементарной цепи от петли протекает, в то время как продукт реакции в предварительно инициированном синтезе от F1 комплементарной цепи вытесняется. В результате комплементарная цепь, синтезированная с самой собой в качестве матрицы, делается готовой для спаривания оснований опять на 3′-конце. Этот 3′-конец обеспечен областью R1, способной гибридизоваться с R1c в той же самой цепи, и эти две области гибридизуются преимущественно вследствие быстрой внутримолекулярной реакции. Та же самая реакция, что и вышеописанная реакция, начинающаяся от 3′-конца, синтезированного с FA в качестве матрицы, протекает также и в этой области. В результате нуклеиновая кислота, имеющая комплементарную нуклеотидную последовательность, связанную попеременно в той же самой однонитевой цепи в соответствии с данным изобретением, продолжает элонгироваться от R1 в качестве стартовой точки на 3′-конце последовательным синтезом комплементарной цепи и последующим вытеснением его. Поскольку R2c всегда содержится в петле, образованной внутримолекулярной гибридизацией 3′-концевого R1, олигонуклеотид (RA), обеспеченный R2, гибридизуется с петлей на 3′-конце в последующей реакции.
Когда обращается внимание на нуклеиновую кислоту, синтезированную в качестве комплементарной цепи из олигонуклеотида, гибридизуемого с петлей в одноцепочечной нуклеиновой кислоте, элонгированной с самой собой в качестве матрицы, синтез нуклеиновой кислоты, имеющей комплементарные нуклеотидные последовательности, связанные попеременно в той же самой однонитевой цепи в соответствии с данным изобретением, также происходит при этом. То есть синтез комплементарной цепи от петли завершается, когда он достигает RA, например, в фиг.2-(7). Затем, когда нуклеиновая кислота, вытесненная этим синтезом нуклеиновой кислоты, инициирует синтез комплементарной цепи (фиг.3-(8)), эта реакция доходит до петли, которая когда-то была затравкой синтеза, и вновь иницируется вытеснение. Таким способом, нуклеиновая кислота, синтез которой инициируется от этой петли, также вытесняется, и в результате получают 3′-концевой R1, способный гибридизоваться с той же самой цепью (фиг.3-(10)). Этот 3′-концевой R1 гибридизуется с R1c в той же самой цепи для инициации синтеза комплементарной цепи. Эта реакция является такой же, что и на фиг.2-(7), за исключением того, что вместо R используется F. Таким образом, структура, показанная на фиг.3-(10), может функционировать в качестве новой нуклеиновой кислоты, которая продолжает самоэлонгироваться и образовывать новую нуклеиновую кислоту.
Реакция синтеза нуклеиновой кислоты, инициируемая от нуклеиновой кислоты, показанной на фиг.3-(10), вызывает элонгацию от 3′-концевого F1 в качестве затравки синтеза, в противоположность реакции, описанной выше. То есть в данном изобретении, когда одна нуклеиновая кислота элонгируется, реакция продолжения поставки новой нуклеиновой кислоты, инициирующей элонгацию, протекает отдельно. Далее, когда цепь элонгируется, возникает множество образующих петлю последовательностей не только на конце, но также в самой цепи. Когда эти образующие петли последовательности делаются готовыми для спаривания оснований посредством синтетической реакции вытеснения, олигонуклеотид гибридизуется с ними, чтобы служить основой для реакции образования новой нуклеиновой кислоты. Затем эффективная амплификация достигается синтетической реакцией, начинающейся не только на конце, но также в цепи. Олигонуклеотид RA, основанный на данном изобретении, комбинируют в качестве обратного праймера, как описано выше, посредством чего происходит элонгация и последующее образование новой нуклеиновой кислоты. Далее, в данном изобретении, эта вновь образованная нуклеиновая кислота сама элонгируется и вызывает последующее образование новой нуклеиновой кислоты. Ряд этих реакций продолжается теоретически постоянно с получением очень эффективной амплификации нуклеиновой кислоты. Кроме того, эта реакция в данном изобретении может проводиться при изотермических условиях.
Накапливаемые таким образом продукты реакции обладают структурой, имеющей нуклеотидную последовательность между F1 и R1 и ее комплементарную последовательность, связанные попеременно в ней. Однако оба конца этой повторяющейся единицы имеют область, состоящую из последовательных нуклеотидных последовательностей F2-F1 (F2c-F1c) и R2-R1 (R2c-R1c). Например, на фиг.3-(9) последовательности (R2-F2c)-(F1-R2c)-(R1-F1c)-(F2-R2c) связаны в этом порядке от 5′-стороны. Это объясняется тем, что реакция амплификации, основанная на данном изобретении, протекает по такому принципу, что эта реакция инициируется от F2 (или R2) с олигонуклеотидом в качестве затравки синтеза, и затем комплементарная цепь элонгируется синтетической реакцией от F1 (или R1) с 3′-концом в качестве затравки синтеза.
Здесь, в наиболее предпочтительном варианте осуществления изобретения, олигонуклеотиды FA и RA в соответствии с данным изобретением использовали в качестве олигонуклеотидов, гибридизующихся с частью петли. Однако, даже если эти олигонуклеотиды, имеющие ограниченную структуру, не используются, реакция амплификации согласно данному изобретению может проводиться с использованием олигонуклеотида, способного инициировать синтез комплементарной цепи от петли. То есть элонгация 3′-конца, однажды вытесненного комплементарной цепью, синтезированной от петли, опять дает часть петли. Поскольку эта нуклеиновая кислота, имеющая комплементарные нуклеотидные последовательности, связанные попеременно в однонитевой цепи, всегда используется в качестве матрицы в синтезе комплементарной цепи, начинаясь от петли, очевидно, что нуклеиновая кислота, желаемая в данном изобретении, может быть синтезирована. Однако синтезированная таким образом нуклеиновая кислота выполняет синтез комплементарной цепи посредством образования петли после вытеснения, но нет 3′-конца, доступного для последующего образования петли, и, следовательно, она не может функционировать в качестве новой матрицы. Таким образом, нельзя ожидать, что продукт в этом случае, в противоположность нуклеиновой кислоте, инициируемой к синтезу посредством FA или RA, может быть экспоненциально амплифицирован. По этой причине олигонуклеотид, имеющий структуру FA или RA, применим для высокоэффективного синтеза нуклеиновой кислоты на основе данного изобретения.
Серия этих реакций протекает посредством добавления следующих компонентов к одноцепочечной нуклеиновой кислоте в качестве матрицы и затем инкубирования этой смеси при такой температуре, что нуклеотидная последовательность, составляющая FA и RA, может образовывать стабильное спаривание оснований с ее комплементарной нуклеотидной последовательностью, в то время как ферментативная активность может быть сохраненной.
– 4 типа олигонуклеотидов:
FA,
RA,
внешний праймер F3 и
внешний праймер R3,
– ДНК-полимераза для выполнения синтеза комплементарной цепи по типу вытеснения цепи,
– нуклеотид, служащий в качестве субстрата для ДНК-полимеразы.
Таким образом, температурный цикл, такой как в ПЦР, не является необходимым. Стабильное спаривание оснований, упоминаемое здесь, обозначает состояние, в котором по меньшей мере часть олигонуклеотида, присутствующего в этой реакционной системе, может давать затравку синтеза комплементарной цепи. Например, желательное условие для вызывания стабильного спаривания оснований заключается в установлении более низкой температуры, чем температура плавления (Tm). Обычно температура плавления (Tm) рассматривается как температура, при которой 50% нуклеиновых кислот, имеющих взаимно комплементарные нуклеотидные последовательности, являются последовательностями со спаренными основаниями. Установка при температуре плавления (Tm) или более низкой температуре не является обязательным условием в данном изобретении, но является одним из условий реакции, которое должно приниматься во внимание для получения высокой эффективности синтеза. Если нуклеиновая кислота, подлежащая применению в качестве матрицы, является двухнитевой цепью, эта нуклеиновая кислота должна, по меньшей мере в области, с которой гибридизуют олигонуклеотид, быть сделана готовой для спаривания оснований. Для этого обычно проводят денатурацию нагреванием, и ее можно проводить только один раз в виде предобработки перед инициацией реакции.
Эту реакцию проводят в присутствии буфера, дающего подходящий рН для ферментативной реакции, солей, необходимых для гибридизации или для сохранения каталитической активности фермента, защитного агента для фермента и, в случае необходимости, регулятора для температуры плавления (Tm). В качестве буфера используют, например, Трис-HCl, имеющий буферящее действие в нейтральном-слабощелочном диапазоне. рН корректируют (доводят) в зависимости от используемой ДНК-полимеразы. В качестве солей удобно добавлять КСl, NaCl, (NH4)2SO4 и т.д. для поддержания активности фермента и для регуляции температуры плавления (Тm) нуклеиновой кислоты. В качестве защитного агента для фермента используют бычий сывороточный альбумин или сахара. Далее, обычно используют диметилсульфоксид (ДМСО) или формамид в качестве регулятора температуры плавления (Tm). Посредством применения регулятора для температуры плавления (Tm) гибридизация олигонуклеотида может регулироваться при условиях ограниченной температуры. Далее, бетаин (N,N,N-триметилглицин) или тетраалкиламмониевая соль являются также эффективными для улучшения эффективности вытеснения цепи вследствие ее изостабилизации. При добавлении бетаина в количестве 0,2-3,0 М, предпочтительно 0,5-1,5 М, к реакционному раствору можно ожидать его стимулирующего действия на амплификацию данного изобретения. Поскольку эти регуляторы температуры плавления действуют понижающим температуру плавления образом, условия, дающие подходящую жесткость и реактивность, определяют эмпирически с учетом концентрации солей, температуры реакции и т.д.
Важным признаком в данном изобретении является то, что ряд реакций не происходит, если не сохраняется позиционное взаимоотношение множества областей. Посредством этого признака неспецифическая синтетическая реакция, сопровождаемая неспецифическим синтезом комплементарной цепи, эффективно предотвращается. То есть, даже если некоторая неспецифическая реакция имеет место, возможность того, что продукт этой реакции служит в качестве исходного материала в последующей стадии амплификации, является минимизированной. Далее, регуляция развития реакций многими областями вызывает возможность того, что система определения, способная строго идентифицировать желаемый продукт в аналогичных нуклеотидных последовательностях, может быть произвольным образом сконструирована.
Этот признак может быть использован для обнаружения мутаций в гене. В способе данного изобретения, где используют внешний праймер, применяют 4 праймера, т.е. 2 внешних праймера и 2 праймера, состоящих из олигонуклеотидов данного изобретения. То есть пока 6 областей, содержащихся в этих 4 олигонуклеотидах, не работают, как это запланировано, синтетическая реакция данного изобретения не имеет места. В частности, важными являются последовательности 3′-конца каждого олигонуклеотида в качестве затравки синтеза комплементарной цепи и 5′-конец области Х1с, где комплементарная цепь служит в качестве затравки синтеза. Следовательно, эти важные последовательности конструируют таким образом, что они соответствуют мутации, подлежащей определению, и продукт синтетической реакции данного изобретения наблюдают, посредством чего может исчерпывающим образом анализироваться присутствие или отсутствие мутации, такой как делеция или инсерция основания, или генетический полиморфизм, такой как SNP. Конкретно, основания, оцениваемые как имеющие мутацию или полиморфизм, конструируют таким образом, чтобы они соответствовали близости 3′-конца олигонуклеотида в качестве затравки синтеза комплементарной цепи, или его 5′-конца, когда комплементарная цепь является затравкой синтеза. Если присутствует ошибочное спаривание на 3′-конце в качестве затравки синтеза комплементарной цепи или вблизи от него, реакция синтеза комплементарной цепи к нуклеиновой кислоте значимо ингибируется. В данном изобретении высокая степень реакции амплификации не достигалась, пока структура этих концов продукта в исходной реакции не вызывала повторяемые реакции. Таким образом, даже если имеет место ошибочный синтез, синтез комплементарной цепи, составляющий реакцию амплификации, всегда прерывался в некоторых стадиях, и, следовательно, высокая степень реакции амплификации не имеет места в присутствии ошибочного спаривания. В результате ошибочное спаривание эффективно ингибирует реакцию амплификации, и в конце концов достигается точный результат. То есть можно сказать, что реакция амплификации нуклеиновой кислоты на основе данного изобретения имеет высокосовершенный механизм для проверки нуклеотидной последовательности. Эти признаки являются преимуществом, едва ли ожидаемым, например, в способе ПЦР, где реакция амплификации выполняется лишь в 2 областях.
Область Х1с, отличающая олигонуклеотид, используемый в данном изобретении, может служить в качестве затравки синтеза после того как синтезирована комплементарная последовательность, и эта комплементарная последовательность гибридизуется с последовательностью X1 в той же самой вновь синтезированной цепи, посредством чего имеет место синтетическая реакция с самой собой в качестве матрицы. Таким образом, даже если образуется так называемый димер праймера, что часто является проблемой в существующем уровне техники, этот олигонуклеотид не образует петлю. Таким образом, неспецифическая амплификация, связанная с димером праймера, не может происходить теоретически, и, следовательно, данный олигонуклеотид способствует улучшению специфичности этой реакции.
Далее, согласно данному изобретению, внешние праймеры, показанные в виде F3 (фиг.1-(2)) или R3 (фиг.2-(5)), комбинируют, посредством чего ряд описанных выше реакций могут проводиться при изотермических условиях. То есть данное изобретение обеспечивает способ амплификации нуклеиновой кислоты, имеющей комплементарные последовательности, связанные попеременно в однонитевой цепи, что составляет стадии, показанные в пункте 9 выше. В этом способе выбирают температурные условия, в которых имеет место стабильная гибридизиция между F2c/F2, между R2c/R2, между F1c/F1 и между R1c/R1, и предпочтительно F3c/F3 и R3c/R3 устанавливают таким образом, чтобы гибридизация происходила посредством феномена непрерывного стекинга, облегченного гибридизацией F2c/F2 и R2c/R2, соответственно.
В данном изобретении используются термины “синтез” и “амплификация” нуклеиновой кислоты. Синтез нуклеиновой кислоты в данном изобретении означает элонгацию нуклеиновой кислоты от олигонуклеотида, служащего в качестве затравки синтеза. Если не только этот синтез, но также образование другой нуклеиновой кислоты и реакция элонгации этой образовавшейся нуклеиновой кислоты происходят непрерывно, ряд этих реакций называют всеобъемлюще амплификацией.
Одноцепочечная нуклеиновая кислота, которая обеспечена на ее 3′-конце областью F1, способной гибридизоваться с частью F1c в той же самой цепи, и которая при гибридизации области F1 с F1c в одной и той же цепи способна образовывать петлю, содержащую область F2c, способную к спариванию оснований, является важным элементом данного изобретения. Такая одноцепочечная нуклеиновая кислота может также поставляться по следующему принципу. А именно, синтезу комплементарной цепи дают протекать на основе праймера, имеющего следующую структуру. 5′[область X1, гибридизующаяся с областью X1c, локализованной в праймере]-[образующая петлю последовательность, готовая к спариванию оснований]-[область X1c]-[область, имеющая последовательность, комплементарную матрице]-3′.
В качестве области, имеющей последовательность, комплементарную матрице, готовят две нуклеотидные последовательности, то есть нуклеотидную последовательность (праймер FA), комплементарную F1, и нуклеотидную последовательность (праймер RA), комплементарную R1c. Нуклеотидная последовательность, составляющая нуклеиновую кислоту, которая должна быть синтезирована, содержит нуклеотидную последовательность, простирающуюся от области F1 до области R1c, и нуклеотидную последовательность, простирающуюся от области R1, имеющей нуклеотидную последовательность, комплементарную этой нуклеотидной последовательности, до области F1c. X1c и X1, способные гибридизоваться внутри этого праймера, могут быть произвольными последовательностями. Однако в области между праймерами FA и RF последовательность области X1c/X1 делают предпочтительно отличающейся.
Сначала проводят синтез комплементарной цепи праймером FA от области F1 в матричной нуклеиновой кислоте. Затем область R1c в синтезированной комплементарной цепи делают готовой для спаривания оснований, с которым гибридизуют другой праймер с образованием затравки синтеза комплементарной цепи. 3′-конец комплементарной цепи, синтезированной в этой стадии, имеет нуклеотидную последовательность, комплементарную праймеру FA, составляющему 5′-конец исходно синтезированной цепи, так что он был обеспечен на его 3′-конце областью X1, которая гибридизуется с областью Х1с в той же самой цепи с образованием петли. Характерная 3′-концевая структура в соответствии с данным изобретением обеспечивается таким образом, и последующая реакция составляет реакционную систему, описанную ранее в качестве наиболее предпочтительного варианта осуществления. Олигонуклеотид, гибридизующийся с частью этой петли, обеспечивают на его 3′-конце областью Х2, комплементарной области Х2с, расположенной в петле, а на его 5′-конце областью X1. В предыдущей реакционной системе праймеры FA и RA использовали для синтеза цепи, комплементарной нуклеиновой кислоте-матрице, с получением посредством этого структуры петли на 3′-конце нуклеиновой кислоты. В данном способе концевую структуру, характерную для данного изобретения, обеспечивают короткими праймерами. В этом варианте осуществления, с другой стороны, всю нуклеотидную последовательность, составляющую петлю, обеспечивают в качестве праймера, и синтез этого более длинного праймера является необходимым.
Если нуклеотидную последовательность, содержащую область узнавания рестрикционного фермента, используют в качестве обратного праймера, может быть получен отличающийся вариант осуществления данного изобретения. Реакция с обратным праймером, содержащим последовательность узнавания рестриктазы, конкретно описана со ссылкой на фиг.6. После завершения фиг.6-(D) генерируется ник (разрыв одной цепи) с использованием рестриктазы, соответствующей сайту узнавания рестриктазы в обратном праймере. Реакцию синтеза комплементарной цепи по типу вытеснения цепи инициируют от этого ника в качестве затравки синтеза. Поскольку обратные праймеры расположены на обоих концах двухцепочечной нуклеиновой кислоты, составляющей (D), реакция синтеза комплементарной цепи инициируется также на обоих концах. Хотя в основном основанная на способе SDA, описанном в предшествующем уровне техники, нуклеотидная последовательность, служащая в качестве матрицы, имеет структуру, имеющую комплементарную нуклеотидную последовательность, попеременно связанную согласно данному изобретению, так что образуется система синтеза нуклеиновой кислоты, уникальная для данного изобретения. Часть, служащая в качестве комплементарной цепи обратного праймера, которая должна быть разорвана ником, должна быть сконструирована для включения dNTP-производного, так чтобы он придавал устойчивость к нуклеазам для предотвращения расщепления двухнитевой цепи данным рестрикционным ферментом.
Можно также встроить промотор для РНК-полимеразы в этот обратный праймер. Транскрипцию от обоих концов на фиг.6-(D) выполняют РНК-полимеразой, узнающей этот промотор, в этом случае очень сходно с предыдущим вариантом осуществления, в котором применяли способ SDA.
Нуклеиновая кислота, синтезированная в данном изобретении, является однонитевой цепью, но состоит из частичных комплементарных последовательностей, и, следовательно, большинство этих последовательностей являются спаренными на основе спаривания оснований. С использованием этого признака может быть определен синтезированный продукт. Посредством проведения этого способа синтеза нуклеиновой кислоты в соответствии с данным изобретением в присутствии флуоресцентного пигмента в качестве специфического для двухнитевой цепи интеркалятора, такого как бромид этидия, SYBR Green I или Pico Green, наблюдают увеличивающуюся плотность флуоресценции по мере увеличения количества продукта. Посредством мониторинга этого увеличения можно прослеживать синтетическую реакцию реального времени в закрытой системе. Применение этого типа системы определения для способа ПЦР также рассматривается, но считается, что имеется много проблем, так как сигнал от продукта невозможно отличить от сигналов от димеров праймеров, и т.д. Однако при применении этой системы к данному изобретению возможность увеличения неспецифического спаривания оснований является очень низкой, и, следовательно, может одновременно ожидаться высокая чувствительность и низкие шумы. Аналогично применению специфического для двухнитевой цепи интеркалятора перенос флуоресцентной энергии может быть использован для способа осуществления системы определения в однородной системе.
Способ синтеза нуклеиновой кислоты в соответствии с данным изобретением подкрепляется ДНК-полимеразой, катализирующей реакцию типа вытеснения цепи для синтеза комплементарной цепи. Во время этой описанной выше реакции имеется также стадия реакции, не требующая обязательно полимеразы, действующей по типу вытеснения цепи. Однако, для упрощения используемого реагента и с экономической точки зрения, выгодно использовать один тип ДНК-полимеразы. В качестве ДНК-полимераз этого типа известны следующие ферменты. Кроме того, различные мутанты этих ферментов могут быть использованы в данном изобретении, пока они имеют как зависимую от последовательности активность в отношении синтеза комплементарной цепи, так и активность вытеснения цепи. Мутанты, на которые делается здесь ссылка, включают в себя такие мутанты, которые имеют только структуру, вызывающую каталитическую активность, требуемую для этого фермента, или такие мутанты, которые имеют модификации в отношении каталитической активности, стабильности или термостабильности, например, мутации в аминокислотах.
ДНК-полимераза Bst
(экзо-)ДНК-полимераза Вса
Фрагмент Кленова ДНК-полимеразы I
ДНК-полимераза Vent
(экзо-)ДНК-полимераза Vent (ДНК-полимераза Vent, дефектная по экзонуклеазной активности)
ДНК-полимераза Deep Vent
(экзо-)ДНК-полимераза Deep Vent (ДНК-полимераза Deep Vent, дефектная по экзонуклеазной активности)
ДНК-полимераза фага Ф29
ДНК-полимераза фага MS-2
ДНК-полимераза Z-Taq (Takara Shuzo Co., Ltd.)
ДНК-полимераза KOD (Toyobo Co., Ltd.)
Среди этих ферментов ДНК-полимераза Bst и (экзо-)ДНК-полимераза Вса являются особенно предпочтительными ферментами, так как они имеют некоторую степень термостабильности и высокую каталитическую активность. Реакция данного изобретения может проводиться изотермически в предпочтительном варианте, но вследствие коррекции температуры плавления (Тm) и т.д. не всегда можно использовать температурные условия, желательные для стабильности фермента. Таким образом, одним из желаемых условий является то, что данный фермент должен быть термостабильным. Хотя изотермическая реакция является возможной, денатурация нагреванием может проводиться для обеспечения нуклеиновой кислоты в качестве первой матрицы, и в этом отношении также применение термостабильного фермента расширяет выбор протокола анализа.
(Экзо-)ДНК-полимераза Vent является ферментом, имеющим как активность вытеснения цепи, так и высокую степень термостабильности. Известно, что реакция синтеза комплементарной цепи, включающая в себя вытеснение цепи ДНК-полимеразой, стимулируется добавлением связывающего одиночную цепь белка (Paul M. Lizardi et al., Nature Genetics, 19, 225-232, July, 1998). Это действие применяют в данном изобретении, и при добавлении связывающего одиночную цепь белка может ожидаться эффект стимуляции синтеза комплементарной цепи. Например, ген 32 Т4 является эффективным в качестве связывающего одиночную цепь белка для ДНК-полимеразы Vent.
Для ДНК-полимеразы, не имеющей 3′-5′-экзонуклеазной активности, существует известный феномен, заключающийся в том, что синтез комплементарной цепи не останавливается при 5′-конце матрицы, что приводит к генерированию выступа, состоящего из одного основания. В данном изобретении этот феномен не является предпочтительным, так как, когда синтез комплементарной цепи достигает этого конца, последовательность 3′-конца приводит к инициации следующего синтеза комплементарной цепи. Однако, вследствие добавления основания “А” с высокой вероятностью к 3′-концу этой ДНК-полимеразой, эта последовательность может быть выбрана таким образом, что синтез от 3′-конца начинается при “А”, так что нет проблемы, если дополнительное основание ошибочно добавляется dATP. Далее, даже если 3′-конец имеет выступ во время синтеза комплементарной цепи, 3′ 5′-экзонуклеазная активность может быть использована для отщепления этого выступа, чтобы сделать этот конец тупым. Например, поскольку природная ДНК-полимераза Vent имеет эту активность, этот фермент может быть использован в виде смеси с (экзо-)ДНК-полимеразой Vent для решения этой проблемы. 5′-экзонуклеазная активность может быть использована для отщепления этого выступа, чтобы сделать этот конец тупым. Например, поскольку природная ДНК-полимераза Vent имеет эту активность, этот фермент может быть использован в виде смеси с (экзо-)ДНК-полимеразой Vent для решения этой проблемы.
Различные реагенты, необходимые для способа синтеза или амплификации нуклеиновой кислоты в соответствии с данным изобретением, могут быть предварительно упакованы и обеспечены в виде набора. Конкретно, обеспечен набор для данного изобретения, содержащий различные типы олигонуклеотидов, необходимые в качестве праймеров для синтеза комплементарной цепи и в качестве внешних праймеров для вытеснения, dNTP в качестве субстрата для синтеза комплементарной цепи, ДНК-полимеразу для проведения синтеза по типу вытеснения цепи, буфер, создающий подходящие условия для ферментативной реакции, и в случае необходимости реагенты, необходимые для обнаружения продуктов синтетической реакции. В частности, добавление реагентов является необходимым во время реакции в предпочтительном варианте осуществления данного изобретения, и, следовательно, реагенты, необходимые для одной реакции, подаются после пипетирования в реакционный сосуд, посредством чего реакция может инициироваться добавлением только образца. С применением системы, в которой продукт реакции может детектироваться in situ в реакционном сосуде с использованием люминесцентного сигнала или флуоресцентного сигнала, необязательно открывать и закрывать этот сосуд после реакции. Это является очень желательным для предотвращения загрязнения.
Нуклеиновая кислота, имеющая комплементарные нуклеотидные последовательности, попеременно связанные в однонитевой цепи, синтезированнная в соответствии с данным изобретением, имеет, например, следующее применение. Первым признаком является использование преимущества, возникающего из особой структуры, имеющей комплементарные последовательности в одной молекуле. Ожидается, что этот признак будет облегчать определение. То есть имеется известная система для обнаружения нуклеиновой кислоты, в которой ее сигнал варьируется в зависимости от спаривания оснований с комплементарной нуклеотидной последовательностью. Например, посредством комбинирования со способом использования специфического для двухнитевой цепи интеркалятора в качестве детектора, как описано выше, может быть обеспечена система определения, полно использующая свойства синтетического продукта данного изобретения. Если продукт синтетической реакции данного изобретения один раз денатурируют нагреванием в указанной системе определения и возвращают к исходной температуре, имеет место преимущественно внутримолекулярный отжиг (гибридизация), что делает возможным, следовательно, быстрое спаривание комплементарных последовательностей. Если имеются продукты неспецифической реакции, они не имеют комплементарных последовательностей в молекуле, так что после разделения денатурацией нагреванием на 2 или более молекул они не могут сразу вернуться к исходной двухнитевой цепи. Обеспечением стадии денатурации нагреванием перед определением могут быть уменьшены шумы, сопутствующие неспецифической реакции. Если используют ДНК-полимеразу, неустойчивую к нагреванию, эта стадия денатурации нагреванием имеет значение терминации реакции и является, следовательно, выгодной для контроля температуры реакции.
Второй признак заключается в том, что всегда образуется петля, способная к спариванию оснований. Структура петли, способной к связыванию оснований, показана на фиг.4. Как видно из фиг.4, эта петля состоит из нуклеотидной последовательности F2c (X2c), которая может быть отожжена (гибридизована) праймером, и нуклеотидной последовательности, вставленной между F2c-F1c (X1c). Последовательность между F2c-F1c (или между Х2с-Х1с в более универсальной форме) является происходящей из нуклеотидов последовательностью, полученной из матрицы. Таким образом, если зонд, имеющий комплементарную нуклеотидную последовательность, гибридизуется с этой областью, возможным является матрица-специфическое определение. Кроме того, эта область всегда готова для спаривания оснований, и, следовательно, денатурация нагреванием перед гибридизацией не является необходимой. Нуклеотидная последовательность, составляющая петлю в продукте реакции амплификации, может иметь произвольную длину. Таким образом, если желательна гибридизация с зондом, область, подлежащую гибридизации с праймером, и область, подлежащую гибридизации с зондом, помещают раздельно для предотвращения их конкуренции, посредством чего могут быть обеспечены идеальные условия реакции.
Согласно предпочтительному варианту осуществления данного изобретения, большое число петель, способных к спариванию оснований, обеспечиваются в одной цепи нуклеиновой кислоты. Это означает, что большое число зондов могут быть гибридизованы с одной молекулой нуклеиновой кислоты, что делает возможным чувствительное определение. Таким образом может быть не только реализовано улучшение чувствительности, но также реализован способ определения нуклеиновой кислоты на основе принципа особой реакции, например агрегации. Например, зонд, иммобилизованный на мелких частицах, таких как полистироловый латекс, добавляют к продукту реакции данного изобретения, агрегацию частиц латекса наблюдают по мере гибридизации продукта с этим зондом. Высокочувствительное и количественное наблюдение возможно с использованием оптического измерения прочности агрегации. Поскольку агрегацию можно также наблюдать невооруженным глазом, может быть также обеспечена реакционная система, не использующая оптическое измерительное устройство.
Далее, продукт реакции данного изобретения, позволяющий связывание с ним большого числа меток на одну молекулу нуклеиновой кислоты, делает возможным хроматографическое определение. В области иммуноанализа, на практике используют аналитический способ (иммунохроматографию) с применением хроматографической среды, использующей визуально определяемую метку. Этот способ основан на принципе, что аналит заключается, как в сэндвиче, между антителом, иммобилизованным на хроматографической среде, и меченым антителом, а непрореагировавший меченый компонент вымывается. Продукт реакции данного изобретения позволяет применять этот принцип для анализа нуклеиновой кислоты. А именно, готовят меченый зонд для части петли и иммобилизуют его на хроматографической среде для получения захватывающего зонда для улавливания, что делает возможным анализ в этой хроматографической среде. В качестве захватывающего зонда может быть использована последовательность, комплементарная части петли. Поскольку продукт реакции данного изобретения имеет большое число петель, этот продукт связывается с большим числом меченых зондов, давая визуально узнаваемый сигнал.
Продукт реакции в соответствии с данным изобретением, всегда дающий область в виде петли, способную к спариванию оснований, делает возможным большое разнообразие других систем определения. Например, возможной является система определения, использующая резонанс поверхностных плазмонов, с применением иммобилизованного зонда для этой части петли. Далее, если зонд для части петли является меченным специфическим для двухнитевой цепи интеркалятором, может проводиться более чувствительный флуоресцентный анализ. Альтернативно, можно также положительно использовать способность нуклеиновой кислоты, синтезированной согласно данному изобретению, к образованию петли, способной к спариванию оснований, на обеих 3′- и 5′-сторонах. Например, одну петлю конструируют таким образом, что она имеет обычную нуклеотидную последовательность между нормальным и отклоняющимся от нормы типом, тогда как другую петлю конструируют для генерирования различия между ними. Можно создать характерную аналитическую систему, в которой присутствие гена подтверждают зондом для общей части, тогда как присутствие отклонения от нормы подтверждают в указанной другой области. Поскольку реакция синтеза нуклеиновой кислоты согласно данному изобретению может также протекать изотермически, очень важным преимуществом является то, что может выполняться анализ реального времени при помощи обычного флуоресцентного фотометра. До этого структура нуклеиновой кислоты, подлежащей гибридизации в той же самой цепи, является известной. Однако нуклеиновая кислота, имеющая комплементарные нуклеотидные последовательности, связанные попеременно в однонитевой цепи, полученная данным изобретением, является новой, поскольку она содержит большое число петель, способных к спариванию оснований с другими олигонуклеотидами.
С другой стороны, само большое число петель, образованных продуктом реакции в соответствии с данным изобретением, может быть использовано в качестве зондов. Например, в наборе матриц (чипах) ДНК зонды должны накапливаться при высокой плотности в ограниченной зоне. Однако в данной технологии число олигонуклеотидов, которое может быть иммобилизовано в определенной зоне, является ограниченным. Таким образом, посредством применения продукта реакции данного изобретения большое число зондов, способных гибридизоваться, может быть иммобилизовано при высокой плотности. А именно, продукт реакции в соответствии с данным изобретением может быть иммобилизован в качестве зондов на чипе (наборе матриц) ДНК. После амплификации продукт реакции может быть иммобилизован любыми способами, известными в данной области, или иммобилизованный олигонуклеотид используют в качестве олигонуклеотида в реакции амплификации данного изобретения, что приводит к генерированию иммобилизованного продукта реакции. Посредством применения зонда, иммобилизованного таким образом, большое число ДНК образца может быть гибридизовано в ограниченной зоне, и, вследствие этого, могут ожидаться высокие сигналы.
Краткое описание чертежей
Фиг.1 является иллюстрацией части (1)-(4) принципа реакции в предпочтительном варианте осуществления данного изобретения.
Фиг.2 является иллюстрацией части (5)-(7) принципа реакции в предпочтительном варианте осуществления данного изобретения.
Фиг.3 является иллюстрацией части (8)-(10) принципа реакции в предпочтительном варианте осуществления данного изобретения.
Фиг.4 является иллюстрацией структуры петли, образованной одноцепочечной нуклеиновой кислотой, в соответствии с данным изобретением.
Фиг.5 является иллюстрацией части (А)-(В) в основном варианте осуществления данного изобретения.
Фиг.6 является иллюстрацией части (С)-(D) в основном варианте осуществления данного изобретения.
Фиг.7 является рисунком, показывающим позиционное взаимоотношение каждой нуклеотидной последовательности, составляющей олигонуклеотид, в нуклеотидной последовательности-мишени M13mp18.
Фиг.8 является фотографией, показывающей результат электрофореза в агарозе продукта, полученного по способу синтеза одноцепочечной нуклеиновой кислоты с M13mp18 в качестве матрицы в соответствии с данным изобретением.
Дорожка 1: маркер размера XIV
Дорожка 2: 1 фмоль dsДНК M13mp18
Дорожка 3: без нуклеиновой кислоты-мишени
Фиг.9 является фотографией, показывающей результат электрофореза в агарозном геле расщепленного рестриктазой продукта, полученного в примере 1 реакцией синтеза нуклеиновой кислоты в соответствии с данным изобретением.
Дорожка 1: маркер размера XIV
Дорожка 2: продукт расщепления BamHI очищенного продукта
Дорожка 3: продукт расщепления PvuII очищенного продукта
Дорожка 4: продукт расщепления HindIII очищенного продукта
Фиг.10 является фотографией, показывающей результат электрофореза в агарозном геле продукта, полученного по способу синтеза одноцепочечной нуклеиновой кислоты в соответствии с данным изобретением с использованием M13mp18 в качестве матрицы в присутствии бетаина. 0, 0,5, 1 и 2 указывают концентрацию (М) бетаина, добавленного к реакционному раствору. N указывает негативный контроль, а –21 указывает концентрацию 10-21 моль ДНК-матрицы.
Фиг.11 является рисунком, показывающим позиционное взаимоотношение каждой нуклеотидной последовательности, составляющей олигонуклеотид, в нуклеотидной последовательности-мишени, произведенной из HVB.
Фиг.12 является фотографией, показывающей результат электрофореза в агарозном геле продукта, полученного по способу синтеза одноцепочечной нуклеиновой кислоты в соответствии с данным изобретением, где HBV-M13mp18, интегрированный в М13mр18, использовали в качестве матрицы.
Дорожка 1: маркер размера XIV
Дорожка 2: 1 фмоль dsДНК HBV-M13mp18
Дорожка 3: без нуклеиновой кислоты-мишени
Фиг.13 является фотографией, показывающей результат электрофореза в агарозном геле денатурированного щелочью продукта, полученного по способу синтеза одноцепочечной нуклеиновой кислоты в соответствии с данным изобретением.
Дорожка 1: фрагмент расщепления HindIII из фага лямбда
Дорожка 2: продукт реакции в примере 1
Дорожка 3: продукт реакции в примере 3
Фиг.14 является фотографией, показывающей результат электрофореза в агарозном геле продукта, полученного по способу синтеза одноцепочечной нуклеиновой кислоты в соответствии с данным изобретением, где концентрация М13mр18 в качестве мишени варьировалась. Верхняя и нижняя фотографии показывают результат реакции в течение 1 и 3 часов, соответственно.
Дорожка 1: 1×10-15 моль на пробирку dsДНК М13mp18
Дорожка 2: 1×10-16 моль на пробирку dsДНК М13mр18
Дорожка 3: 1×10-17 моль на пробирку dsДHK М13mр18
Дорожка 4: 1×10-18 моль на пробирку dsДНК М13mр18
Дорожка 5: 1×10-19 моль на пробирку dsДНК М13mр18
Дорожка 6: 1×10-20 моль на пробирку dsДНК М13mр18
Дорожка 7: 1×10-21 моль на пробирку dsДНК М13mр18
Дорожка 8: 1×10-22 моль на пробирку dsДHK М13mр18
Дорожка 9: без нуклеиновой кислоты-мишени
Дорожка 10: маркер размера XIV
Фиг.15 является рисунком, показывающим положение мутации и позиционное взаимоотношение каждой области нуклеотидной последовательности-мишени (мишени). Подчеркнутый гуанин заменен аденином в мутанте.
Фиг.16 является фотографией, показывающей результат электрофореза в агарозном геле продукта в соответствии с реакцией амплификации данного изобретения.
М: 100 – п.н. – лестница (New England Biolabs)
N: без матрицы (очищенная вода)
WT: 1 фмоль матрицы М13mр18 дикого типа
МТ: 1 фмоль матрицы мутантного М13mр18
Фиг.17 является рисунком, показывающим позиционное взаимоотношение каждой нуклеотидной последовательности, составляющей олигонуклеотид, в нуклеотидной последовательности, кодирующей мРНК-мишень.
Фиг.18 является фотографией, показывающей результат электрофореза в агарозном геле продукта, полученного по способу синтеза одноцепочечной нуклеиновой кислоты в соответствии с данным изобретением с использованием мРНК в качестве мишени.
Наилучший вариант для проведения данного изобретения.
Пример 1. Амплификация области в М13mр18
Способ синтеза нуклеиновой кислоты, имеющей комплементарные цепи, попеременно связанные в однонитевой цепи в соответствии с данным изобретением, испытывали с использованием М13mр18 в качестве матрицы. В этом эксперименте использовали четыре типа праймеров, а именно, M13FA, M13RA, M13F3 и M13R3. M13F3 и M13R3 были внешними праймерами для вытеснения первой нуклеиновой кислоты, полученной соответственно с M13FA и M13RA в качестве затравки синтеза. Поскольку внешние праймеры являются праймерами, служащими в качестве затравки синтеза комплементарной цепи после синтеза с M13FA (или M13RA), они были сконструированы для гибридизации с областью, смежной с M13FA (или M13RA) с использованием феномена непрерывного стекинга. Далее, концентрации этих праймеров устанавливали высокими, так что гибридизация M13FA (или M13RA) происходила преимущественно.
Нуклеотидная последовательность, составляющая каждый праймер, показана в Списке последовательностей (см. в конце описания). Структурные характеристики этих праймеров суммированы ниже. Далее, позиционное взаимоотношение каждой области относительно нуклеотидной последовательности (мишени) показано на фиг.7.
Праймер Область на 5′-стороне/область на 3′-стороне
M13FA Тот же самый, что и область F1c в комплементарной цепи, синтезированной М13FА/комплементарной области F2c в М13mр18
M13RA Тот же самый, что и область R1c в комплементарной цепи, синтезированной М13RА/комплементарной области R2c в комплементарной цепи, синтезированной M13FA
M13F3 Комплементарный F3c, смежной с 3′-стороной области F2c в М13mр18
M13R3 Комплементарный R3c, смежной с 3′-стороной области F2c в комплементарной цепи, синтезированной M13FA
С использованием таких праймеров синтезировали нуклеиновую кислоту, в которой область, простирающаяся от F1c до R1c в М13mр18, и его комплементарная нуклеотидная последовательность попеременно связаны через образующую петлю последовательность, содержащую F2c в однонитевой цепи. Состав реакционного раствора для способа синтеза нуклеиновой кислоты с использованием этих праймеров в соответствии с данным изобретением показан ниже.
Состав реакционного раствора (в 25 мкл)
20 мМ Трис-НСl рН 8,8
10 мМ КСl
10 мM (NH4)2SO4
6 мМ MgSO4
0,1% Тритон Х-100
5% диметилсульфоксид (ДМСО)
0,4 мМ dNTP
Праймеры:
800 нМ M13FA/SEQ ID NO:1
800 нМ M13RA/SEQ ID NO:2
200 нМ M13F3/SEQ ID NO:3
200 нМ M13R3/SEQ ID NO:4
Мишень: dsAHK M13mp18/SEQ ID NO:5
Реакция: Описанный выше раствор нагревали при 95°С в течение 5 мин и мишень денатурировали в однонитевую цепь. Реакционный раствор переносили на смесь воды со льдом и к ней добавляли 4 Е ДНК-полимеразы Bst (New England Biolabs), и эта смесь реагировала при 65°С в течение 1 часа. После реакции реакцию останавливали при 80°С в течение 10 мин и опять переносили на смесь воды со льдом.
Подтверждение реакции: 1 мкл буфера для нанесения добавляли к 5 мкл описанного выше реакционного раствора и этот образец подвергали электрофорезу в течение 1 час при 80 мВ на 2% агарозном геле (0,5% ТВЕ). В качестве маркера молекулярной массы использовали XIV (100 п.н. – лестницу, Boehringer Mannheim). Гель после электрофореза окрашивали SYBR Green I (Molecular Probes, Inc.) для подтверждения нуклеиновой кислоты. Результаты показаны на фиг.8. Соответствующие дорожки соответствуют следующим образцам.
1. Маркер размера XIV.
2. Дорожка 2: 1 фмоль dsДHK M13mp18.
Дорожка 3: без мишени.
В дорожке 3 не было полосы, за исключением того, что непрореагировавшие праймеры были окрашены. В дорожке 2 в присутствии мишени продукты подтверждались в виде лестницы полос низкого размера, в виде смазанного окрашивания при высоком размере и в виде полосы, едва входящей в гель при электрофорезе. Среди полос низкого размера полосы вблизи 290 п.н. и 450 п.н. согласуются с продуктами, приближенно оцененными в синтетической реакции данного изобретения, а именно двухнитевыми цепями SEQ ID NO:11 и 12 (соответствующими двухнитевым цепям, образованным, как показано на фиг.2-(7) и 3-(10), и однонитевой цепью на фиг.3-(9)), и, следовательно было подтверждено, что реакция происходит, как ожидалось. Было приближенно оценено, что результаты электрофореза со смазанной картиной при высоком размере и полоса, не входившая в гель при электрофорезе, возникали вследствие того, что эта реакция была в основном непрерывной реакцией, позволяющей образование варьирующих молекулярных масс продукта реакции, и вследствие того, что этот продукт имеет сложную структуру, так как состоит из частично однонитевой цепи и двухцепочечного комплекса.
Пример 2. Подтверждение продуктов реакции посредством расщепления рестриктазами
Для цели выяснения структуры нуклеиновой кислоты, имеющей комплементарные нуклеотидные последовательности, связанные попеременно в однонитевой цепи, полученной в примере 1 в соответствии с данным изобретением, проводили расщепление этих продуктов рестрикционными ферментами. Если фрагменты теоретически генерируются их расщеплением рестриктазами и одновременно исчезают смазанная картина при высоком размере и полоса, не поддающаяся электрофорезу, наблюдаемые в примере 1, то можно приближенно оценить, что любые из этих продуктов являются нуклеиновой кислотой, имеющей комплементарные последовательности, связанные попеременно в однонитевой цепи, синтезированной в соответствии с данным изобретением.
Реакционный раствор (200 мкл) из 8 пробирок в примере 1 объединяли и очищали обработкой фенолом и осаждением этанолом. Полученные осадки извлекали и растворяли опять в 200 мкл ТЭ-буфера и аликвоту 10 мкл расщепляли при 37°С в течение 2 час рестриктазами BamHI, PvuII и HindIII, соответственно. Продукт расщепления подвергали электрофорезу в течение 1 час при 80 мВ на 2% агарозном геле (0,5% ТВЕ). В качестве молекулярного маркера использовали Super Ladder-Low (100 п.н. – лестницу) (Gensura Laboratories, Inc.). Гель после электрофореза окрашивали SYBR Green I (Molecular Probes, Inc.) для подтверждения нуклеиновой кислоты. Результаты показаны на фиг.9. Соответствующие дорожки соответствуют следующим образцам.
1. Маркер размера XIV.
2. Продукт расщепления BamHI очищенного продукта.
3: Продукт расщепления PvuII очищенного продукта.
4: Продукт расщепления HindIII очищенного продукта.
Было оценено, что нуклеотидные последовательности, составляющие относительно короткие продукты амплификации, являются последовательностями SEQ ID NO: 13, 14, 15 и 16. На основании этих нуклеотидных последовательностей оцененный размер каждого фрагмента, полученного расщеплением рестриктазами, является таким, какой показан в таблице 1. “L” в этой таблице указывает на то, что его положение в электрофорезе не установлено, так как L является фрагментом, содержащим петлю (однонитевая цепь).
Таблица 1. Фрагменты, полученные при расщеплении рестриктазами продуктов амплификации в соответствии с данным изобретением
| SEQ ID NO: |
BamHI |
PvuII |
HindIII |
| 13 |
177 + L |
56 + L |
147 + L |
| 14 |
15+101 + L |
– |
142 + L |
| 15 |
171+101 + L |
56 + L |
147+161 + L |
| 16 |
11+101+230 + L |
237 + L |
142+170 + L |
| Всего |
101, 177, 230 |
56, 237 |
142, 147, 161, 170 |
(11, 15; не подтверждены)
Поскольку почти все полосы перед расщеплением изменялись в оцененные полосы, было подтверждено, что были амплифицированы продукты рассматриваемой реакции. Далее, было также показано, что не было неспецифических продуктов или было меньше неспецифических продуктов.
Пример 3. Стимуляция реакции амплификации добавлением бетаина
Проводили эксперимент для испытания действия бетаина (N,N,N-триметилглицина, Sigma), добавленного к реакционному раствору реакции амплификации, на реакцию амплификации нуклеиновой кислоты. Синтез нуклеиновой кислоты, имеющей комплементарные цепи, связанные попеременно в однонитевой цепи в соответствии с данным изобретением, проводили с использованием М13mр18 в качестве матрицы, аналогично описанному в примере 1, в присутствии бетаина при различных концентрациях. Праймеры, использованные в этом эксперименте, были идентичны праймерам, использованным в примере 1. Количество матричной ДНК было 10-21 моль (М13mр18), а воду использовали в качестве отрицательного контроля. Бетаин добавляли в концентрациях 0, 0,5, 1 и 2 М к реакционному раствору. Состав реакционного раствора показан ниже.
Состав реакционного раствора (в 25 мкл)
20 мМ Трис-НСl рН 8,8
4 мМ MgSO4
0,4 мМ dNTPs
10 мМ КСl
10 MM (NH4)2SO4
0,1% Тритон Х-100
Праймеры:
800 нМ M13FA/SEQ ID NO:1
800 нМ M13RA/SEQ ID NO:2
200 нМ M13F3/SEQ ID NO:3
200 нМ M13R3/SEQ ID NO:4
Мишень: dsДНК M13mp18/SEQ ID NO:5
Полимераза, условия реакции и условия для электрофореза после реакции были идентичными описанным в примере 1.
Результаты показаны на фиг.10. В реакции в присутствии бетаина в концентрации 0,5 или 1,0 М количество продукта амплификации увеличивалось. Далее, если его концентрацию увеличивали до 2,0 М, не наблюдали амплификации. Таким образом, было показано, что реакция амплификации стимулировалась в присутствии бетаина при подходящей концентрации. Приближенно оцененной причиной того, что количество продукта амплификации уменьшалось, когда концентрация бетаина была 2 М, было то, что Тm понижалась слишком сильно.
Пример 4. Амплификация последовательности гена HBV
Испытывали способ синтеза нуклеиновой кислоты в соответствии с данным изобретением, в котором использовали dsДНК М13mр18, имеющую частичную последовательность, гена HBV, интегрированную в нее, в качестве матрицы. В этом эксперименте использовали четыре типа праймеров, а именно HB65FA (SEQ ID NO:6), HB65RA (SEQ ID NO:7), HBF3 (SEQ ID NO:8) и HBR3 (SEQ ID NO:9). HBF3 и HBR3 были внешними праймерами для вытеснения первой нуклеиновой кислоты, полученной соответственно с HB65FA и HB65RA в качестве затравки синтеза. Поскольку внешние праймеры являются праймерами, служащими в качестве затравки синтеза комплементарной цепи после синтеза с HB65FA (или HB65RA), они были сконструированы для гибридизации с областью, смежной с HB65FA (или HB65RA) с использованием феномена непрерывного стекинга. Далее, концентрации этих праймеров устанавливали высокими, так что гибридизация HB65FA (или HB65RA) происходила преимущественно. Последовательность-мишень (430 п.н.) в этом примере, происходящая из HBV, интегрированного в М13тр18, показана в SEQ ID NO:10.
Нуклеотидная последовательность, составляющая каждый праймер, показана в Списке последовательностей (см. в конце описания). Структурный признак каждого праймера показан ниже. Далее, позиционное взаимоотношение каждой области относительно нуклеотидной последовательности (мишени) показано на фиг.11.
Праймер Область на 5′-стороне/область на 3′-стороне
HB65FA Тот же самый, что и область F1c в комплементарной цепи, синтезированной НВ65FА/комплементарным области F2c в HBV-M13mp18
HB65RA Тот же самый, что и область R1c в комплементарной цепи, синтезированной НВ65RА/комплементарным области R2c в комплементарной цепи, синтезированной HB65FA
HBF3 Комплементарный F3c, смежной с 3′-стороной области F2c в HBV-M13mp18
HBR3 Комплементарный R3c, смежной с 3′-стороной области F2c в комплементарной цепи, синтезированной HB65FA
С использованием таких праймеров синтезировали нуклеиновую кислоту, в которой область, простирающаяся от F1c до R1c в М13mр18 (HBV-M13mp18), и его комплементарная нуклеотидная последовательность попеременно связаны через образующую петлю последовательность, содержащую F2c в однонитевой цепи. Реакцию проводили при тех же самых условиях, которые описаны в примере 1, за исключением того, что использовали описанные выше праймеры и реакционный раствор анализировали электрофорезом в агарозном геле. Результаты показаны на фиг.12. Соответствующие дорожки соответствуют следующим образцам.
1. Маркер размера XIV.
2. 1 фмоль dsДНК HBV-M13mp18.
3: Без мишени.
Подобно примеру 1, продукты подтверждали только в присутствии мишени в виде лестницы полос низкого размера, в виде смазанного окрашивания при высоком размере и в виде полосы, едва входящей в гель при электрофорезе (дорожка 2). Среди полос низкого размера полосы вблизи 310 п.н. и 480 п.н. согласуются с продуктами, приближенно оцененными в синтетической реакции данного изобретения, а именно двухнитевыми цепями SEQ ID NO:17 и 18, и, следовательно, было подтверждено, что реакция происходит, как ожидалось. Как описано в результатах в примере 1, было приближенно оценено, что смазанная картина при высоком размере и полоса, не входившая в гель при электрофорезе, были обусловлены структурой синтетического продукта, характерной для данного изобретения. На основании этого эксперимента было подтверждено, что данное изобретение может практиковаться даже в том случае, если для амплификации используют отличающуюся последовательность (мишень).
Пример 5. Подтверждение размеров продуктов этих синтетических реакций
Для подтверждения структуры нуклеиновой кислоты, синтезированной в соответствии с данным изобретением, ее длину анализировали электрофорезом в условиях щелочной денатурации. 1 мкл щелочного буфера для нанесения добавляли к 5 мкл каждого реакционного раствора в присутствии мишени в примере 1 или 4 и подвергали электрофорезу при 50 мА в 0,7% агарозном геле (50 мМ NaOH, 1 мМ ЭДТА) в течение 14 час. В качестве маркера молекулярных масс использовали фрагменты расщепления HindIII фага лямбда. Гель после электрофореза нейтрализовали 1 М Трисом, рН 8 и окрашивали SYBR Green I (Molecular Probes, Inc.) для подтверждения нуклеиновой кислоты. Результаты показаны на фиг.13. Соответствующие дорожки соответствуют следующим образцам.
1. Фрагменты расщепления HindIII из фага лямбда.
2. Продукт реакции в примере 1.
3. Продукт реакции в примере 4.
При электрофорезе продукта реакции в условиях денатурации щелочью его размер можно было подтвердить в одноцепочечном состоянии. Было подтверждено, что размеры основных продуктов как в примере 1 (дорожка 2), так и в примере 4 (дорожка 3) были в пределах 2 т.п.н. Далее, выяснилось, что продукт в соответствии с данным изобретением был удлинен до размера по меньшей мере 6 т.п.н. или более в пределах диапазона, поддающегося подтверждению с использованием этого анализа. Кроме того, опять подтвердили, что полосы, которые не перемещались в электрофорезе при неденатурирующих условиях в примерах 1 и 4, разделялись в денатурированном состоянии на индивидуальные однонитевые цепи меньшего размера.
Пример 6. Подтверждение зависимости амплификации от концентрации мишени в амплификации области в M13mp18
Наблюдали влияние варьирующих концентраций мишени на способ синтеза нуклеиновой кислоты в соответствии с данным изобретением. Способ синтеза нуклеиновой кислоты в соответствии с данным изобретением проводили в тех же самых условиях, что и в примере 1, за исключением того, что количество dsДНК M13mp18 в качестве мишени было 0-1 фмоль и время реакции было 1 час или 3 час. Подобно примеру 1, образец подвергали электрофорезу в 2% агарозном геле (0,5 ТВЕ) и окрашивали SYBR Green I (Molecular Probes, Inc.) для подтверждения нуклеиновой кислоты. В качестве маркера молекулярной массы использовали XIV (100 п.н.-лестницу, Boehringer Mannheim). Результаты показаны на фиг.14 (верхний: 1-часовая реакция, нижний: 3-часовая реакция). Соответствующие дорожки соответствуют следующим образцам.
1. 1×10-15 моль на пробирку dsДНК M13mp18
2. 1×10-16 моль на пробирку dsДНК M13mp18
3. 1×10-17 моль на пробирку dsДНК M13mp18
4. 1×10-18 моль на пробирку dsДНК M13mp18
5. 1×10-19 моль на пробирку dsДНК M13mp18
6. 1×10-20 моль на пробирку dsДНК M13mp18
7. 1×10-21 моль на пробирку dsДНК M13mp18
8. 1×10-22 моль на пробирку dsДНК M13mp18
9. Без мишени
10. Маркер размера XIV.
Общая полоса среди соответствующих дорожек появляется в нижней части в электрофоретическом профиле и показывает непрореагировавшие окрашенные праймеры. Независимо от времени реакции, в отсутствие мишени не наблюдали продукта амплификации. Картину окрашивания амплифицированного продукта, в зависимости от концентрации мишени, получали только в присутствии мишени. Далее, продукт амплификации мог быть подтвержден при более низкой концентрации по мере увеличения времени реакции.
Пример 7. Детектирование точковой мутации
(1) Получение M13mp18FM (мутанта)
Используемой ДНК-мишенью был М13mр18 (дикого типа) и M13mp18FM (мутант). Для конструирования мутанта M13mp18FM использовали набор для мутагенеза in vitro La PCR in vitro Mutagenesis Kit (Takara Shuzo Co., Ltd.) для замены одного нуклеотида на мутацию. После этого последовательность подтверждали секвенированием. Последовательность области F1 показана ниже: in vitro Mutagenesis Kit (Takara Shuzo Co., Ltd.) для замены одного нуклеотида на мутацию. После этого последовательность подтверждали секвенированием. Последовательность области F1 показана ниже:
Дикий типа: CCGGGGATCCTCTAGAGTCG (SEQ ID NO:19)
Мутант: CCGGGGATCCTCTAGAGTCA (SEQ ID NO:20)
(2) Конструирование праймеров
Праймеры FA, использованные для дикого типа и мутанта, были обеспечены на 5′-конце их области F1c различными нуклеотидными последовательностями, соответственно. Положение мутации и позиционное взаимоотношение каждой области относительно нуклеотидной последовательности-мишени показаны на фиг.15.
(3) Реакция амплификации
Проводили эксперимент для испытания, происходит ли специфическая в отношении матрицы реакция амплификации с использованием комбинации специфических праймеров, показанных ниже, с использованием М13mр18 (дикого типа) и M13mp18FM (мутанта) в качестве праймеров.
Набор праймеров для амплификации дикого типа: FAd4, RAd4, F3, R3
Набор праймеров для амплификации мутанта: FAMd4, RAd4, F3, R3
Нуклеотидная последовательность каждого праймера является следующей:
FAd4: CGACTCTAGAGGATCCCCGGTTTTTGTTGTGTGGAATTGTGAGCGGAT (SEQ ID NO:21)
FAMd4: TGACTCTAGAGGATCCCCGGTTTTTGTTGTGTGGAATTGTGAGCGGAT (SEQ ID NO:22)
RAd4: CGTCGTGACTGGGAAAACCCTTTTTGTGCGGGCCTCTTCGCTATTAC (SEQ ID NO:23)
F3: ACTTTATGCTTCCGGCTCGTA (SEQ ID NO:24)
R3: GTTGGGAAGGGCGATCG (SEQ ID NO:25)
(4) Определение точковой мутации в М13mр18
Состав реакционного раствора является следующим:
1 фмоль (2 мкл) мишени M13mp18 или M13mp18FM добавляли к реакционному раствору и нагревали при 95°С в течение 5 мин, вследствие чего мишень денатурировалась в однонитевую цепь. Реакционный раствор переносили в смесь воды со льдом и добавляли к нему 1 мкл (8 Е) ДНК-полимеразы Bst (NEW ENGLAND Biolab) и давали реагировать в течение 1 час при 68°С или 68,5°С. После реакции реакцию останавливали при 80°С в течение 10 мин и реакционный раствор переносили опять в смесь воды со льдом.
Как показано на фиг.16, при применении FAd4 для дикого типа в качестве праймера FA эффективную амплификацию наблюдали только в присутствии матрицы дикого типа. С другой стороны, при применении FAMd4 для мутанта в качестве праймера FA, эффективную амплификацию наблюдали только в присутствии матрицы дикого типа [sic.] (именно так).
Из описанных выше результатов видно, что точковая мутация могла детектироваться эффективно с использованием реакции амплификации данного изобретения.
Пример 8. Реакция амплификации мРНК в качестве мишени
Способ синтеза нуклеиновой кислоты в соответствии с данным изобретением испытывали с использованием мРНК в качестве нуклеиновой кислоты-мишени. Для получения мРНК-мишени клетки линии клеток LNCaP рака предстательной железы (АТСС No. CRL-1740), экспрессирующие специфический антиген (PSA) предстательной железы, смешивали с клетками линии К562 хронического миелоидного лейкоза (АТСС No. CCL-243) в качестве неэкспрессирующих клеток при 1:106-100:106, с последующей экстракцией тотальной РНК с использованием мининабора RNeasy Mini kit из Qiagen (Germany). В этом эксперименте использовали четыре типа праймеров, а именно PSAFA, PSARA, PSAF3 и PSAR3. PSAF3 и PSAR3 являются внешними праймерами для вытеснения первой нуклеиновой кислоты, полученной соответственно с PSAFA и PSARA в качестве затравки синтеза. Далее, концентрации этих праймеров устанавливали такими высокими, что имела место преимущественно гибридизация PSAFA (или PSARA). Нуклеотидные последовательности, составляющие соответствующие праймеры, являются следующими.
Праймер:
PSAFA: TGTTCCTGATGCAGTGGGCAGCTTTAGTCTGCGGCGGTGTTCTG (SEQ ID NO:26)
PSARA: TGCTGGGTCGGCACAGCCTGAAGCTGACCTGAAATACCTGGCCTG (SEQ ID NO:27)
PSAF3: TGCTTGTGGCCTCTCGTG (SEQ ID NO:28)
PSAR3: GGGTGTGGGAAGCTGTG (SEQ ID NO:29)
Структурные признаки этих праймеров суммированы ниже. Далее, позиционное взаимоотношение каждого праймера относительно нуклеотидной последовательности ДНК, кодирующей мРНК-мишень, и сайты узнавания рестриктазы Sau3AI показаны на фиг.17.
Праймер Область на 5′-стороне/область на 3′-стороне
PSAFA Тот же самый, что и область F1c в комплементарной цепи, синтезированной PSAFA/комплементарным области F2c в нуклеотидной последовательности-мишени
PSARA Тот же самый, что и область R1c в комплементарной цепи, синтезированной PSARA/комплементарным области R2c в комплементарной цепи, синтезированной PSAFA
PSAF3 Комплементарный F3c, смежной с 3′-стороной области F2c в нуклеотидной последовательности-мишени
PSAR3 Комплементарный R3c, смежной с 3′-стороной области R2c в комплементарной цепи, синтезированной PSAFA
Состав реакционного раствора для способа синтеза нуклеиновой кислоты в соответствии с данным изобретением является следующим:
20 мМ Трис-HCl рН 8,8
4 мМ МgSO4
0,4 мМ dNTPs
10 мМ КСl
10 мM (NH4)2SO4
0,1% Тритон Х-100
0,8 М бетаин
5 мМ ДТТ
1600 нМ праймеры PSAFA и PSARA
200 нМ праймеры PSAF3 и PSAR3
8 Е ДНК-полимеразы Bst
100 Е Rever Tra Асе (обратной транскриптазы) (Toyobo Co., Ltd., Japan)
5 мкг тотальной РНК
Все ингредиенты смешивали на льду. В этом эксперименте в качестве мишени использовали мРНК (однонитевую цепь), и, следовательно, стадия получения однонитевой цепи денатурацией нагреванием не является необходимой. Реакцию проводили при 65°С в течение 45 мин и реакцию останавливали при 85°С в течение 5 мин. После реакции реакционный раствор подвергали электрофорезу в 2% агарозе и определяли окрашиванием SYBR Green I.
Результаты показаны на фиг.18. Соответствующие дорожки соответствуют следующим образцам.

В отсутствие либо ДНК-полимеразы Bst, либо обратной транскриптазы Rever Tra Асе не удалось получить продукта амплификации (дорожки 1-4). В присутствии обоих ферментов продукт амплификации детектировали (дорожки 5-7), если присутствовала РНК, полученная из LNCaP. РНК, экстрагированная из смеси одна клетка LNCaP/один миллион клеток К562, могла быть детектирована (дорожка 6). При расщеплении продукта амплификации в сайте рестикционного фермента Sau3AI, расположенном внутри мишени, продукт расщеплялся с образованием фрагмента оцененного размера (дорожки 8 и 9).
Как видно из описанных выше результатов, было подтверждено, что желаемый продукт реакции может быть получен в способе синтеза нуклеиновой кислоты в соответствии с данным изобретением даже при использовании РНК в качестве мишени.
Промышленная применимость
В соответствии с новым олигонуклеотидом данного изобретения и способом синтеза нуклеиновой кислоты с использованием указанного олигонуклеотида обеспечен способ синтеза нуклеиновой кислоты, имеющей комплементарные нуклеотидные последовательности, попеременно связанные в однонитевой цепи, без необходимости какой-либо сложной регуляции температуры. Комплементарная цепь, синтезированная с этим олигонуклеотидом в качестве праймера на основе данного изобретения, служит в качестве затравки синтеза новой комплементарной цепи с 3′-концом указанной синтезированной цепи в качестве матрицы. Это сопровождается образованием петли, вызывающей гибридизацию нового праймера, и продукт реакции синтеза комплементарной цепи с ранее синтезированной цепью в качестве матрицы вытесняется опять синтезом комплементарной цепи от петли и делается готовым к спариванию оснований. Полученную таким образом нуклеиновую кислоту, синтезированную с самой собой в качестве матрицы, комбинируют, например, с известным способом синтеза нуклеиновых кислот, таким как SDA, для улучшения эффективности синтеза нуклеиновой кислоты.
Согласно дополнительному предпочтительному варианту осуществления данного изобретения, обеспечен новый способ синтеза нуклеиновой кислоты, который дает улучшение эффективности известного способа синтеза нуклеиновой кислоты, не требует сложного контроля температуры, может, как ожидается, достигать высокой эффективности амплификации и может обеспечивать высокую специфичность. А именно, олигонуклеотид на основе данного изобретения применяют с цепью матрицы и ее комплементарной цепью, посредством чего может быть успешно синтезирована нуклеиновая кислота, имеющая комплементарные последовательности, связанные попеременно в однонитевой цепи. Эта реакция продолжается теоретически до тех пор, пока не истощаются исходные материалы, необходимые для синтеза, и во время этого процесса продолжает образовываться новая нуклеиновая кислота, синтез которой инициируется от петли. Элонгация от олигонуклеотида, отожженного с петлей, выполняет вытеснение цепи для обеспечения 3′-OH для элонгации длинной одноцепочечной нуклеиновой кислоты (а именно, нуклеиновой кислоты, имеющей множественные пары комплементарных цепей, связанных вместе). С другой стороны, 3′-ОН этой длинной однонитевой цепи выполняет реакцию синтеза комплементарной цепи с самой собой в качестве матрицы, посредством чего достигается ее элонгация, во время которой новая комплементарная цепь, синтез которой инициируется от петли, вытесняется. Такая стадия реакции амплификации протекает при изотермических условиях с сохранением высокой специфичности.
Олигонуклеотиды данного изобретения могут, когда две смежных области размещены, как задумано, функционировать в качестве праймеров для реакции синтеза нуклеиновой кислоты в соответствии с данным изобретением. Это способствует в значительной степени сохранению специфичности. Посредством сравнения, например, с ПЦР, где неспецифическая реакция амплификации инициируется неспецифической ошибочной гибридизацией, независимо от предполагаемого позиционного взаимоотношения 2 праймеров, можно легко объяснить, что в данном изобретении может ожидаться высокая специфичность. Этот признак может быть использован для высокочувствительного и точного обнаружения SNP.
Характерным признаком данного изобретения является то, что такая реакция может быть легко достигнута с использованием очень простого набора реагентов. Например, олигонуклеотид в соответствии с данным изобретением имеет особую структуру, но это является результатом выбора нуклеотидной последовательности, и он, как вещество, является простым олигонуклеотидом. Далее, в предпочтительном варианте осуществления, эта реакция может проводиться только ДНК-полимеразой, катализирующей реакцию типа вытеснения цепи синтеза комплементарной цепи. Далее, если данное изобретение проводят с РНК в качестве матрицы, используют ДНК-полимеразу, например ДНК-полимеразу Вса, имеющую как активность обратной транскриптазы, так и активность ДНК-полимеразы типа вытеснения цепи, так что все ферментативные реакции могут проводиться с единственным ферментом. Принцип реакции, осуществляющей высокую степень реакции амплификации нуклеиновой кислоты посредством такой простой ферментативной реакции, неизвестен. Даже для применения данного изобретения к известной реакции синтеза нуклеиновой кислоты, такой как SDA, для их комбинации не требуется дополнительный фермент, и такая простая комбинация с олигонуклеотидом на основе данного изобретения может быть применима к различным реакционным системам. Таким образом, можно сказать, что способ синтеза нуклеиновой кислоты в соответствии с данным изобретением является выгодным в отношении стоимости.
Как описано выше, способ синтеза нуклеиновой кислоты в соответствии с данным изобретением и применяемый в нем олигонуклеотид обеспечивают новый принцип одновременного решения множества трудных проблем, такого как оперативность (устранение необходимости регуляции температуры), улучшение эффективности синтеза, экономичность и высокая специфичность.












Формула изобретения
1. Набор для синтеза нуклеиновой кислоты, имеющей нуклеотидную последовательность, где в одной цепи попеременно связаны комплементарные нуклеотидные последовательности, содержащий следующие элементы:
i) внутренний праймер FA, содержащий 3′-концевую нуклеотидную последовательность, которая служит точкой начала синтеза цепи, имеющей последовательность одной цепи, которая образует указанные комплементарные нуклеотидные последовательности, и 5′-концевую нуклеотидную последовательность, комплементарную произвольной области указанной цепи;
ii) внутренний праймер RA, содержащий 3′-концевую нуклеотидную последовательность, которая служит точкой начала синтеза цепи, имеющей последовательность другой цепи, которая образует указанные комплементарные нуклеотидные последовательности, и 5′-концевую нуклеотидную последовательность, комплементарную произвольной области указанной цепи;
iii) олигонуклеотид, имеющий нуклеотидную последовательность, комплементарную произвольной области, расположенной на 3′-стороне гибридизующейся с внутренним праймером FA области, в нуклеиновой кислоте, служащей в качестве матрицы;
iv) олигонуклеотид, имеющий нуклеотидную последовательность, комплементарную произвольной области, расположенной на 3′-стороне гибридизующейся с внутренним праймером RA области, в комплементарной цепи, синтезированной с использованием внутреннего праймера FA в качестве точки начала синтеза;
v) ДНК-полимераза, катализирующая реакцию синтеза комплементарной цепи по механизму вытеснения цепи;
vi) нуклеотиды, служащие субстратом для элемента v).
2. Способ синтеза молекулы нуклеиновой кислоты, имеющей нуклеотидную последовательность, где в одной цепи попеременно связаны комплементарные нуклеотидные последовательности, предусматривающий:
а) смешивание образца нуклеиновой кислоты в качестве матрицы со следующими компонентами:
i) внутренний праймер FA, содержащий 3′-концевую нуклеотидную последовательность, которая служит точкой начала синтеза цепи, имеющей последовательность одной цепи, которая образует указанные комплементарные нуклеотидные последовательности, и 5′-концевую нуклеотидную последовательность, комплементарную произвольной области указанной цепи;
ii) внутренний праймер RA, содержащий 3′-концевую нуклеотидную последовательность, которая служит точкой начала синтеза цепи, имеющей последовательность другой цепи, которая образует указанные комплементарные нуклеотидные последовательности, и 5′-концевую нуклеотидную последовательность, комплементарную произвольной области указанной цепи;
iii) олигонуклеотид, имеющий нуклеотидную последовательность, комплементарную произвольной области, расположенной на 3′-стороне гибридизующейся с внутренним праймером FA области, в нуклеиновой кислоте, служащей в качестве матрицы;
iv) олигонуклеотид, имеющий нуклеотидную последовательность, комплементарную произвольной области, расположенной на 3′-стороне гибридизующейся с внутренним праймером RA области, в комплементарной цепи, синтезированной с использованием внутреннего праймера FA на стадии i) в качестве точки начала синтеза;
v) ДНК-полимераза, обладающая активностью вытеснения цепи;
vi) один или несколько типов нуклеотидов, используемых ДНК-полимеразой для удлинения праймеров,
b) инкубирование смеси при такой температуре, при которой нуклеотидная последовательность, составляющая FA и RA, способна к устойчивому спариванию оснований с комплементарной ей нуклеотидной последовательностью с сохранением ферментативной активности.
3. Способ по п.2, где смесь дополнительно содержит регулятор температуры плавления.
4. Способ по п.3, где регулятором температуры плавления является бетаин.
5. Способ по п.4, где используется 0,2-3,0 М бетаин.
6. Способ по п.2, где образец нуклеиновой кислоты представляет собой РНК, а ДНК-полимераза обладает обратнотранскриптазной активностью.
7. Способ по п.2, где расстояние между гибридизующейся с FA областью нуклеиновой кислоты образца и произвольной областью и между гибридизующейся с RA областью другой цепи и произвольной областью составляет 0 – 100 п.н.
РИСУНКИ
|
|