Патент на изобретение №2252938
|
||||||||||||||||||||||||||||||||
(54) ХАЛКОНЫ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ
(57) Реферат:
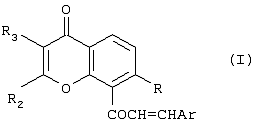
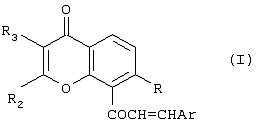
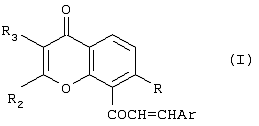
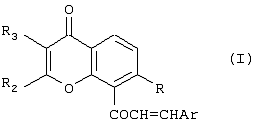
Изобретение относится к новым соединениям халконам формулы (I) или их фармацевтически приемлемым солям либо сольватам, где: Ar представляет собой замещенную или незамещенную карбоциклическую группу, содержащую в циклической структуре от 5 до 10 атомов углерода, или 5- или 6-членную гетероциклическую группу, содержащую в циклической структуре атом серы, причем заместители при группе Ar выбраны независимо друг от друга из группы, состоящей из Cl, Br, F, CN, SCH3 и OR10, где R10 представляет собой углеводородный радикал С1-С6 нормального или разветвленного строения; R представляет собой ОН или OR10, где R10 представляет собой насыщенный или ненасыщенный низший углеводородный радикал C1-C6 нормального или разветвленного строения; и (A) R2 и R3 независимо друг от друга выбраны из следующих групп: (i) фенил; (ii) насыщенный углеводородный радикал C1-C6 нормального или разветвленного строения; или нормального или разветвленного строения; и или (B) R2 и R3 совместно с атомами углерода, к которым они присоединены, образуют 5- или 6-членную карбоциклическую группу; при условии, что в соединениях, где R-OH и оба R2 и R3 – метилы, группа Ar не может представлять собой фенил, 4-хлорфенил, 4-метилфенил, 2-хлорфенил, 3,4-диметоксифенил или 4-метоксифенил. Изобретение также относится к компоненту лекарственного средства для лечения или профилактики новообразований и фармацевтической композиции на основе соединений формулы 1, обладающей антипролиферативной активностью. Технический результат-получение новых производных халконов, обладающих ценным биологически активным действием. 3 с. и 17 з.п. ф-лы, 2 табл.
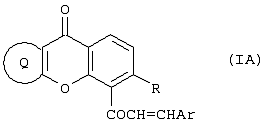
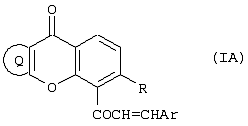
Настоящее изобретение относится к новому классу соединений, аналогичных по структуре некоторым встречающимся в природе и синтетическим халконам, а также к способам получения таких соединений и к их фармацевтическому применению. Соединение 1,3-дифенил-2-пропен-1-он известно под ненаучным названием “халкон”. Многие встречающиеся в природе флавоноиды по структуре аналогичны халкону и обозначаются общим термином “халконы”. В последнее время показано, что некоторые флавоноиды, в том числе те, которые называются также халконами, обладают противораковым действием (Cancer Research 48, 5754, 1988) и химиопрофилактическим действием на некоторые опухоли (J. Nat. Prod. 53, 23, 1990). В частности, показано, что кверцетин – повсеместно обнаруживаемый в растениях флавоноид – воздействует на пролиферацию клеток лейкемии человека (Вr. J. Haematology, 75, 489, 1990) и на другие линии клеток (Br. J. Cancer, 62, 94, 942, 1990; Int. J. Cancer, 46, 112. 1990; Gynaecologic Oncology, 45, 13, 1992) и обладает синергическим эффектом в сочетании с обычными лекарственными средствами, противодействующими росту микроорганизмов и опухолевых клеток. Кроме того, обнаружено, что некоторые природные или синтетические халконы, описанные в нашей международной заявке WO 91/17749 и в международной заявке WO 96/19209 (Baylor College of Medicine), обладают значительным антипролиферативным действием по отношению к различным культурам клеток. Хотя механизм антипролиферативного действия флавоноидов и халконов в настоящее время неизвестен, считается, что он связан со взаимодействием этих соединений с рецепторами эстрогена типа II. Действие этих соединений класса полифенолов in vivo несомненно, еще более сложно. Все эти соединения характеризуются, как правило, почти полной нерастворимостью в воде и крайне низкой биодоступностью in vivo, связанной с быстрым метаболизмом фенолов и сильно выраженным сродством к жирам и протеинам. Ныне неожиданно обнаружено, что некоторые новые халконы, производные халконов и аналоги халконов и, в частности, соединения, в которых фенильный цикл в положении 1 замещен или заменен циклами, содержащими один или несколько гетероатомов, обладают повышенным антипролиферативным действием в отношении как чувствительных раковых клеток, так и клеток, устойчивых к обычным химиотерапевтическим средствам, в том числе к противоопухолевым лекарственным средствам последнего поколения, паклитакселу и доцетакселу. Таким образом, в соответствии с одним аспектом настоящего изобретения, предлагается соединение формулы (I): или его фармацевтически приемлемая соль либо сольват, где: Аr представляет собой замещенную или незамещенную (предпочтительно ароматическую) карбоциклическую или гетероциклическую группу, причем упомянутая карбоциклическая или гетероциклическая группа содержит в циклической структуре от 5 атомов до 10 атомов, причем упомянутые атомы в циклической структуре образуют один или два цикла, где цикл или каждый из циклов содержит 5 атомов или 6 атомов, любые гетероатомы выбраны из группы, состоящей из N, О и S, а любые заместители при группе Аr выбраны независимо друг от друга из группы, состоящей из: (а) Сl, (b) Вr, (с) F, (d) ОН, (е) NO2, (f) СF3, (g) низший алкил C1-C4 (в частности, СН3), (h) SСН3, (i) NHCOCH3, (j) N(R6)(R8), где R6 и R8 одинаковы или различны и каждый из них представляет собой Н или низший алкил C1-C4, (k) OR10, где R10 представляет собой насыщенный или ненасыщенный низший углеводородный радикал C1-C6 нормального или разветвленного строения, который может быть незамещенным или замещенным одним, двумя или тремя заместителями, выбранными из следующих: Cl, Br, F, OMe, NO2 и СF3, и (1) -OCOR11, где R11 представляет собой насыщенный или ненасыщенный низший углеводородный радикал C1-C6 нормального или разветвленного строения или фенил; R представляет собой ОН, OR10 или OCOR11, где R10 и R11 соответствуют вышеприведенным определениям; и (А) R2 и R3 независимо друг от друга выбраны из следующих групп: (i) замещенная или незамещенная, предпочтительно ароматическая, карбоциклическая или гетероциклическая группа, содержащая в циклической структуре от 5 атомов до 10 атомов, причем упомянутые атомы в циклической структуре образуют один или два цикла, где цикл или каждый из циклов содержит 5 атомов или 6 атомов, любые гетероатомы выбраны из группы, состоящей из N, О и S, а любые заместители выбраны из группы, состоящей из следующих заместителей: Cl, Вr, F, ОН, NO2, СF3, низший алкил C1-C4 (в частности, СН3), SСН3, NHCOCH3, N(R6)(R8), OR10 и OCOR11, где R6, R8, R10 и R11 соответствуют вышеприведенным определениям; (ii) Cl, (iii) Br, (iv) F, (v) OH, (vi) NO2, (vii) насыщенный или ненасыщенный низший углеводородный радикал C1-C4 нормального или разветвленного строения, который может быть незамещенным или замещенным одним, двумя или тремя заместителями, выбранными из следующих: Cl, Вr, F, OMe, NO2 и СF3, (viii) NНСОСН3, (ix) N(R6)(R8), (x) SR10, (xi) OR10 и (xii) OCOR11, где R6, R8, R10 и R11 соответствуют вышеприведенным определениям; или (В) R2 и R3 совместно с атомами углерода, к которым они присоединены, образуют карбоциклическую или гетероциклическую группу, содержащую в цикле 5 атомов или 6 атомов, причем любой гетероатом выбран из группы, состоящей из N, О или S, причем упомянутая карбоциклическая или гетероциклическая группа может быть насыщенной или ненасыщенной и незамещенной или замещенной одним или несколькими заместителями, выбранными из следующих: Сl, Вr, F, ОН, NO2, СF3, низший алкил C1-С6, SСН3, NНСОСН3, N(R6)(R8), OR10 и OCOR11, где R6, R8, R10 и R11 соответствуют вышеприведенным определениям, при условии, что в соединениях, где R-ОН и оба R2 и R3 – метилы, группа Аr не может представлять собой: фенил, 4-хлорфенил, 4-метилфенил, 2-хлорфенил, 3,4-диметоксифенил, 4-метоксифенил, 4-(N,N-диметиламино)фенил), 2-гидроксифенил или 2-гидрокси-1-нафтил. Вышеописанные соединения, в которых R2 и R3 совместно с атомами углерода, к которым они присоединены, образуют циклическую группу, могут быть представлены формулой (IA): где заместители R и Аr соответствуют вышеприведенным определениям, а R2 и R3 совместно образуют Цикл Q, при этом упомянутый Цикл Q представляет собой пяти- или шестичленную, предпочтительно ароматическую, карбоциклическую или гетероциклическую группу, любой гетероатом выбран из группы, состоящей из N, О или S, причем упомянутая циклическая группа может быть ненасыщенной или насыщенной, упомянутая карбоциклическая или гетероциклическая группа может быть незамещенной или замещенной одним или несколькими заместителями, выбранными из следующих: Сl, Вr, F, ОН, NO2, СF3, низший алкил C1-C4, SСН3, NHCOCH3, N(R6)(R8), OR10 и OCOR11, где R6, R8, R10 и R11 соответствуют определениям, относящимся к формуле (I). Соединения в соответствии с изобретением, имеющие структурную формулу (IA), представляют собой производные ксантонов, охватываемые настоящим изобретением. Настоящее изобретение охватывает также соединения формулы (I), в которых R и Аr соответствуют вышеприведенным определениям, относящимся к формуле (I), и в которых каждый из заместителей R2 и R3 независимо от другого выбран из следующих групп: (i) замещенная или незамещенная, предпочтительно ароматическая, карбоциклическая или гетероциклическая группа, содержащая в циклической структуре от 5 атомов до 10 атомов, причем упомянутые атомы в циклической структуре образуют один или два цикла, где цикл или каждый из циклов содержит 5 атомов или 6 атомов, любые гетероатомы выбраны из группы, состоящей из N, О и S, а любые заместители выбраны из группы, состоящей из следующих заместителей: Cl, Br, F, ОН, NO2, СF3, низший алкил C1-C4 (в частности, СН3), SСН3, NHCOCH3, N(R6)(R8), OR10 и OCOR11, где R6, R8, R10 и R11 соответствуют вышеприведенным определениям; (ii) Cl, (iii) Br, (iv) F, (v) OH, (vi) NO2, (vii) насыщенный или ненасыщенный низший углеводородный радикал C1-C4 нормального или разветвленного строения, который может быть незамещенным или замещенным одним, двумя или тремя заместителями, выбранными из следующих: Cl, Br, F, OMe, NO2 и CF3, (viii) NHCOCH3, (ix) N(R6)(R8), (x) SR10, (xi) OR10 и (xii) OCOR11, где R6, R8, R10 и R11 соответствуют вышеприведенным определениям; Такие соединения включают производные флавонов, соответствующие настоящему изобретению. К одному из предпочтительных классов соединений, соответствующих формуле (I), принадлежат соединения, в которых Аr, R и R3 соответствуют определениям, приведенным в предыдущем абзаце, а R2 представляет собой замещенную или незамещенную, предпочтительно ароматическую, карбоциклическую или гетероциклическую группу, содержащую в циклической структуре от 5 атомов до 10 атомов, причем упомянутые атомы в циклической структуре образуют один или два цикла, где цикл или каждый из циклов содержит 5 атомов или 6 атомов, любые гетероатомы выбраны из группы, состоящей из N, О и S, а любые заместители выбраны из группы, состоящей из следующих заместителей: Cl, Br, F, ОН, NO2, СF3, низший алкил С1-С4 (в частности, СН3), SCH3, NHCOCH3, N(R6)(R8), OR10 и OCOR11, где R6, R8, R10 и R11 соответствуют вышеприведенным определениям, относящимся к формуле (I), представляют собой производные флавонов, соответствующие настоящему изобретению. В вышеописанных соединениях R3 предпочтительно выбран из группы, состоящей из следующих заместителей: Cl, Br, F, ОН, NO2, насыщенный или ненасыщенный низший углеводородный радикал C1-С6 нормального или разветвленного строения, который может быть незамещенным или замещенным одним, двумя или тремя заместителями, выбранными из: Cl, Br, F, OMe, NO2 и СF3; NHCOCH3, N(R6)(R8), SR10, OR10 и OCOR11, где R6, R8, R10 и R11 соответствуют вышеприведенным определениям, относящимся к формуле (I). В другой предпочтительной группе соединений в соответствии с настоящим изобретением R2 представляет собой: замещенную или незамещенную, предпочтительно ароматическую, карбоциклическую или гетероциклическую группу, содержащую в циклической структуре от 5 атомов до 10 атомов, причем упомянутые атомы в циклической структуре образуют один или два цикла, где цикл или каждый из циклов содержит 5 атомов или 6 атомов, любые гетероатомы выбраны из группы, состоящей из N, О и S, а любые заместители выбраны из группы, состоящей из следующих заместителей: Cl, Br, F, ОН, NO2, СF3, низший алкил C1-C4 (в частности, СН3), SСН3, NHCOCH3, N(R6)(R8), OR10 и OCOR11, где R6, R8, R10 и R11 соответствуют определениям, приведенным в п.1; и R3 выбран из группы, состоящей из следующих групп: Cl, Br, F, ОН, NO2, насыщенный или ненасыщенный низший углеводородный радикал C1-C6 нормального или разветвленного строения, который может быть незамещенным или замещенным одним, двумя или тремя заместителями, выбранными из: Сl, Вr, F, OMe, NO2 и СF3; NHCOCH3, N(R6)(R8), SR10, OR10 и OCOR11, где R6, R8, R10 и R11 соответствуют вышеприведенным определениям. К еще одной предпочтительной группе соединений в соответствии с настоящим изобретением относятся те, в которых R3 выбран из группы, состоящей из следующих заместителей: Cl, Br, F, ОН, NO2, СF3, низший алкил C1-C4, SСН3, NHCOCH3, N(R6)(R8), OR10 и OCOR11, где R6, R8, R10 и R11 соответствуют определениям, относящимся к формуле (I). Особо предпочтительной группой R3 является низший алкил C1-C4, в частности, метил. В еще одном предпочтительном классе соединений R2 предпочтительно представляет собой замещенную или незамещенную (предпочтительно ароматическую) карбоциклическую или гетероциклическую группу, содержащую в циклической структуре от 5 атомов до 10 атомов, причем упомянутые атомы в циклической структуре образуют один или два цикла, где цикл или каждый из циклов содержит 5 атомов или 6 атомов, а любые заместители выбраны независимо друг от друга из группы, состоящей из: Cl, Br, F, ОН, NO2, СF3, низший алкил C1-C4 (в частности, СН3), SСН3, NHCOCH3, N(R6)(R8), OR10 и OCOR11, где R6, R8, R10 и R11 соответствуют вышеприведенным определениям. Среди этих соединений предпочтение отдается таким, в которых R2 предпочтительно представляет собой незамещенную, предпочтительно ароматическую, карбоциклическую группу, содержащую в циклической структуре от 5 атомов до 10 атомов, причем упомянутые атомы в циклической структуре образуют один или два цикла. Особо предпочтительной группой R2 является фенил. В соединениях формулы (I) Аr предпочтительно представляет собой фенил, который может быть незамещенным или замещенным одним или несколькими заместителями, выбранными из группы, состоящей из следующих заместителей: Cl, Br, F, ОН, NO2, СF3, низший алкил C1-C4 (в частности, СН3), SСН3, NHCOCH3, N(R6)(R8), OR10 и OCOR11, где R6, R8, R10 и R11 соответствуют вышеприведенным определениям, относящимся к формуле (I). К особо предпочтительным группам Аr относятся фенил или фенил, замещенный одной, двумя или тремя метоксигруппами. В группах Аr, R2 и R3 формулы (I) группы R10 и R11 предпочтительно представляют собой насыщенные или ненасыщенные низшие углеводородные радикалы C1-С6 нормального или разветвленного строения. К особо предпочтительным радикалам относятся метил, этил, n-пропил и изопропил. Особенно предпочтительной группой является метил. Группа R в соединениях настоящего изобретения предпочтительно представляет собой группу OR10. В пределах этой группы соединений предпочтительными группами OR10 являются -ОСН2СН=СМе2, -ОСН2СМе=СН2, -ОСН2СН=СН2 и -ОСН2С Кроме того, предпочтительной группой соединений настоящего изобретения являются соединения формулы (I), в которых Аr представляет собой фенил, который может быть незамещенным или замещенным одним, двумя или тремя заместителями, каждый из которых независимо от других выбран из группы, состоящей из следующих заместителей: Cl, Br, F, ОМе2, NO2, СF3, низший алкил C1-C4 (в частности, СН3), NMe2, NEt2, SСН3 и NHCOCH3; тиенил, 2-фурил, 3-пиридил, 4-пиридил или индолил; и R представляет собой ОН или OCH2R1, где R1 выбран из группы, включающей -СН=СМе2, -СМе=СН2, -СН=СН2 и -С В этой группе соединений Аr предпочтительно выбран из группы, включающей триметоксифенил, 3-пиридил, 4-пиридил и 3-индолил, а R предпочтительно выбран из группы, включающей -ОСН2СН=СМе2, -ОСН2СМе=СН2, -ОСН2СН=СН2 и -ОСН2С В предпочтительном классе соединений Аr содержит основную азотсодержащую функцию, например, обусловленную присутствием гетероциклического атома азота в цикле, или Аr может нести заместитель, содержащий основный атом азота, такой как аминогруппа или ацетамидогруппа. Таким образом, предпочтительной группой Аr является замещенная или незамещенная, предпочтительно ароматическая, гетероциклическая группа, содержащая в циклической структуре от 5 атомов до 10 атомов, по меньшей мере один из которых является атомом азота, причем упомянутые атомы в циклической структуре образуют один или два цикла, где цикл или каждый из циклов содержит 5 атомов или 6 атомов, а любой заместитель при цикле соответствует определению, относящемуся к формуле (I). Другой предпочтительной группой соединений являются те, в которых группа Аr несет по меньшей мере один заместитель, выбранный из группы, состоящей из NНСОСН3 и N(R6)(R8), где R6 и R8 одинаковы или различны и каждый из них представляет собой Н или низший алкил C1-C4. К особо предпочтительным группам Аr, содержащим основную азотную функцию, относятся 3-пиридил, 4-пиридил, 3-индолил, 4-диметиламинофенил и 4-ацетамидофенил. Подразумевается, что соединения формулы (I), содержащие основную аминогруппу, могут быть превращены в соответствующие соли фармакологически приемлемых кислот, например, хлористоводородной кислоты и фосфорной кислоты. Такие соли также охватываются настоящим изобретением. Настоящее изобретение также предлагает применение соединения формулы (I) или его фармацевтически приемлемой соли либо сольвата, где: Аr представляет собой замещенную или незамещенную (предпочтительно ароматическую) карбоциклическую или гетероциклическую группу, причем упомянутая карбоциклическая или гетероциклическая группа содержит в циклической структуре от 5 атомов до 10 атомов, причем упомянутые атомы в циклической структуре образуют один или два цикла, где цикл или каждый из циклов содержит 5 атомов или 6 атомов, любые гетероатомы выбраны из группы, состоящей из N, О и S, а любые заместители при группе Аr выбраны независимо друг от друга из группы, состоящей из: (а) Сl, (b) Вr, (с) F, (d) ОН, (е) NO2, (f) CF3, (g) низший алкил C1-C4 (в частности, СН3), (h) SСН3, (i) NНСОСН3, (j) N(R6)(R8), где R6 и R8 одинаковы или различны и каждый из них представляет собой Н или низший алкил C1-C4, (к) OR10, где R10 представляет собой насыщенный или ненасыщенный низший углеводородный радикал C1-C6 нормального или разветвленного строения, который может быть незамещенным или замещенным одним, двумя или тремя заместителями, выбранными из следующих: Сl, Вr, F, OMe, NO2 и СF3, и (l) -OCOR11, где R11 представляет собой насыщенный или ненасыщенный низший углеводородный радикал C1-С6 нормального или разветвленного строения или фенил; R представляет собой ОН, OR10 или OCOR11, где R10 и R11 соответствуют вышеприведенным определениям; и (А) R2 и R3 независимо друг от друга выбраны из следующих групп: (i) замещенная или незамещенная, предпочтительно ароматическая, карбоциклическая или гетероциклическая группа, содержащая в циклической структуре от 5 атомов до 10 атомов, причем упомянутые атомы в циклической структуре образуют один или два цикла, где цикл или каждый из циклов содержит 5 атомов или 6 атомов, любые гетероатомы выбраны из группы, состоящей из N, О и S, а любые заместители выбраны из группы, состоящей из следующих заместителей: Сl, Вr, F, ОН, NO2, СF3, низший алкил C1-C4 (в частности, СН3), SСН3, NHCOCH3, N(R6)(R8), OR10 и OCOR11, где R6, R8, R10 и R11 соответствуют вышеприведенным определениям; (ii) Cl, (iii) Br, (iv) F, (v) ОН, (vi) NO2, (vii) насыщенный или ненасыщенный низший углеводородный радикал C1-C4 нормального или разветвленного строения, который может быть незамещенным или замещенным одним, двумя или тремя заместителями, выбранными из следующих: Cl, Br, F, OMe, NO2 и СF3, (viii) NHCOCH3, (ix) N(R6)(R8), (x) SR10, (xi) OR10 и (xii) OCOR11, где R6, R8, R10 и R11 соответствуют вышеприведенным определениям; или (В) R2 и R3 совместно с атомами углерода, к которым они присоединены, образуют карбоциклическую или гетероциклическую группу, содержащую в цикле 5 или 6 атомов, причем любой гетероатом выбран из группы, состоящей из N, О или S, причем упомянутая карбоциклическая или гетероциклическая группа может быть насыщенной или ненасыщенной и незамещенной или замещенной одним или несколькими заместителями, выбранными из следующих: Cl, Br, F, ОН, NO2, СF3, низший алкил C1-C6, SСН3, NHCOCH3, N(R6)(R8), OR10 и OCOR11, где R6, R8, R10 и R11 соответствуют вышеприведенным определениям, в производстве антипролиферативного лекарственного средства. В частности, соединения настоящего изобретения могут быть полезны для изготовления лекарственного средства для лечения или профилактики новообразований, в частности, опухолей, локализующихся в матке, яичниках или молочных железах. В частности, эти соединения могут быть полезны для приготовления лекарственного средства для поражения раковых клеток, стойких к действию паклитаксела и доцетаксела. Соединения формулы (I) могут быть эффективно применены в комбинированных схемах терапии, включающих совместное использование соединения формулы (I) с другим противоопухолевым препаратом, в частности, с паклитакселом или доцетакселом. Комбинированная терапия может включать одновременное или последовательное применение соединения формулы (I) и противоопухолевого препарата. Такая комбинированная терапия является еще одним аспектом настоящего изобретения. Далее, соединения настоящего изобретения могут быть применены при приготовлении лекарственного средства для лечения или предупреждения расстройств, возникающих в климактерический период, и остеопороза. Кроме того, настоящее изобретение охватывает фармацевтическую композицию, содержащую одно или несколько соединений формулы (I) в соответствии с вышеприведенным определением, с условием, что в соединениях, где R-ОН, а оба заместителя R2 и R3 – метилы, группа Аr не может представлять собой: фенил, 4-хлорфенил, 4-метилфенил, 2-хлорфенил, 3,4-диметоксифенил, 4-метоксифенил, 4-(N,N-диметиламино)фенил), 2-гидроксифенил или 2-гидрокси-1-нафтил, в сочетании с одной или несколькими фармацевтически приемлемыми добавками. Изобретение предлагает также компонент антипролиферативного лекарственного средства для комбинированной терапии, для лечения или профилактики новообразований, представляющий собой одно из указанных выше соединений. Такое лекарственное средство может включать в себя также один или несколько противоопухолевых агентов. Изобретение описано ниже в форме иллюстративных примеров со ссылками на прилагаемые рисунки формул. ПРИМЕРЫ Пример 1. Общие условия получения халконов Методика А 50%-ный раствор КОН (3 мл) добавляют к эквимолярному раствору ацетофенона (0,0075 моль) и альдегида (0,0075 моль) в 95%-ном этаноле; добавление производят при интенсивном перемешивании при комнатной температуре. Реакционную смесь выдерживают при перемешивании в течение ночи, затем разбавляют водой и подкисляют; осадок отделяют фильтрованием и сушат в вакууме. Соединения кристаллизуют из этанола или вначале разделяют хроматографированием, а затем кристаллизуют из этанола. Методика В Раствор ацетофенона (0,0075 моль), альдегида (0,0075 моль), пиперидина (15 мл) и уксусной кислоты (75 мл) в 95%-ном этаноле (80 мл) нагревают в противотоке в течение 5 ч. Добавляют к раствору молекулярные сита для удаления воды и оставляют смесь стоять (без перемешивания) в течение ночи. Как правило, образуется осадок, который собирают и кристаллизуют. Если продукт в этих условиях не выпадает в осадок, то выпаривают растворитель в вакууме и остаток очищают хроматографированием на колонке с силикагелем. Пример 2. 1-[3-(3-метилбут-2-енилокси)ксантен-9-он-4-ил]-3-фенилпропен-1-он (см. прилагаемую формулу VIB 176) 50%-ный раствор КОН (3 мл) добавляют к эквимолярному раствору 3-(3-метилбут-2-енилокси)-4-ацетилксантен-9-она (2,4 г, 0,0075 моль) и бензальдегида (0,8 г, 0,0075 моль) в 95%-ном этаноле; добавление производят при интенсивном перемешивании при комнатной температуре. Реакционную смесь выдерживают при перемешивании в течение ночи, затем разбавляют водой и подкисляют; осадок отделяют фильтрованием и сушат в вакууме. Соединение кристаллизуют из метанола и получают 2,1 г продукта с т.пл. 116-118°С. 1H-ЯМР: (СDСl3) Пример 3. 1-[3-(3-метилбут-2-енилокси)ксантен-9-он-4-ил]-3-(3-метоксифенил)пропен-1-он (см. прилагаемую формулу VIB 177) 50%-ный раствор КОН (3 мл) добавляют к эквимолярному раствору 3-(3-метилбут-2-енилокси)-4-ацетилксантен-9-она (2,4 г, 0,0075 моль) и 3-метокси-бензальдегида (1,01 г, 0,0075 моль) в 95%-ном этаноле; добавление производят при интенсивном перемешивании при комнатной температуре. Реакционную смесь выдерживают при перемешивании в течение ночи, затем разбавляют водой и подкисляют; осадок отделяют фильтрованием и сушат в вакууме. Соединение кристаллизуют из метанола и получают 1,9 г продукта с т.пл. 134-136°С. 1H-ЯМР: (СDСl3) Пример 4. 1-[3-(3-метилбут-2-енилокси)ксантен-9-он-4-ил]-3-(3,4,5-триметоксифенил)пропен-1-он (см. прилагаемую формулу VIB 178) 50%-ный раствор КОН (3 мл) добавляют к эквимолярному раствору 3-(3-метилбут-2-енилокси)-4-ацетилксантен-9-она (2,4 г, 0,0075 моль) и 3,4,5-три-метокси-бензальдегида (1,47 г, 0,0075 моль) в 95%-ном этаноле; добавление производят при интенсивном перемешивании при комнатной температуре. Реакционную смесь выдерживают при перемешивании в течение ночи, затем разбавляют водой и подкисляют; осадок отделяют фильтрованием и сушат в вакууме. Соединение кристаллизуют из метанола и получают 2,2 г продукта с т.пл. 153-155°С. 1Н-ЯМР: (CDCl3) Пример 5. 1-[3-(аллилокси)ксантен-9-он-4-ил]-3-фенилпропен-1-он (см. прилагаемую формулу VIB 175) 50%-ный раствор КОН (3 мл) добавляют к эквимолярному раствору 3-аллилокси-4-ацетилксантен-9-она (2,2 г, 0,0075 моль) и бензальдегида (0,8 г, 0,0075 моль) в 95%-ном этаноле; добавление производят при интенсивном перемешивании при комнатной температуре. Реакционную смесь выдерживают при перемешивании в течение ночи, затем разбавляют водой и подкисляют; осадок отделяют фильтрованием и сушат в вакууме. Соединение кристаллизуют из метанола и получают 2 г продукта с т.пл. 150-152°С. 1H-ЯМР: (CDCl3) Пример 6. 1-[3-метил-7-(3-метилбут-2-енилокси)флавон-8-ил]-3-фенилпропен-1-он (см. прилагаемую формулу VIB 166) 50%-ный раствор КОН (3 мл) добавляют к эквимолярному раствору 7-(3-метилбут-2-енилокси)-8-ацетил-3-метилфлавона (2,71 г, 0,0075 моль) и бензальдегида (0,8 г, 0,0075 моль) в 95%-ном этаноле; добавление производят при интенсивном перемешивании при комнатной температуре. Реакционную смесь выдерживают при перемешивании в течение ночи, затем разбавляют водой и подкисляют; осадок отделяют фильтрованием и сушат в вакууме. Соединение кристаллизуют из метанола и получают 2,3 г продукта с т.пл. 83-84°С. 1H-ЯМР: (CDCl3) Пример 7. 1-[3-метил-7-(3-метилбут-2-енилокси)флавон-8-ил]-3-(3-метокси)фенилпропен-1-он (см. прилагаемую формулу VIB 170) 50%-ный раствор КОН (3 мл) добавляют к эквимолярному раствору 7-(3-метилбут-2-енилокси)-8-ацетил-3-метилфлавона (2,71 г, 0,0075 моль) и 3-метоксибензальдегида (1,01 г, 0,0075 моль) в 95%-ном этаноле; добавление производят при интенсивном перемешивании при комнатной температуре. Реакционную смесь выдерживают при перемешивании в течение ночи, затем разбавляют водой и подкисляют; осадок отделяют фильтрованием и сушат в вакууме. Соединение кристаллизуют из метанола и получают 2,2 г продукта с т.пл. 134-136°С. 1Н-ЯМР: (CDCl3) Пример 8. 1-[3-метил-7-(3-метилбут-2-енилокси)флавон-8-ил]-3-(3,4,5-триметокси)фенилпропен-1-он (см. прилагаемую формулу VIB 173) 50%-ный раствор КОН (3 мл) добавляют к эквимолярному раствору 7-(3-метилбут-2-енилокси)-8-ацетил-3-метилфлавона (2,71 г, 0,0075 моль) и 3,4,5-триметоксибензальдегида (1,47 г, 0,0075 моль) в 95%-ном этаноле; добавление производят при интенсивном перемешивании при комнатной температуре. Реакционную смесь выдерживают при перемешивании в течение ночи, затем разбавляют водой и подкисляют; осадок отделяют фильтрованием и сушат в вакууме. Соединение кристаллизуют из метанола и получают 2 г продукта с т.пл. 153-155°С. 1Н-ЯМР: (CDCl3) Пример 9. 1-[3-метил-7-(аллилокси)флавон-8-ил]-3-фенилпропен-1-он (см. прилагаемую формулу VIB 164) 50%-ный раствор КОН (3 мл) добавляют к эквимолярному раствору 7-аллилокси-8-ацетил-3-метилфлавона (2,5 г, 0,0075 моль) и бензальдегида (0,8 г, 0,0075 моль) в 95%-ном этаноле; добавление производят при интенсивном перемешивании при комнатной температуре. Реакционную смесь выдерживают при перемешивании в течение ночи, затем разбавляют водой и подкисляют; осадок отделяют фильтрованием и сушат в вакууме. Соединение кристаллизуют из метанола и получают 2,3 г продукта с т.пл. 145-147°С. 1H-ЯМР: (CDCl3) Пример 10. 1-[3-метил-7-(аллилокси)флавон-8-ил]-3-(3-метоксифенил)пропен-1-он (см. прилагаемую формулу VIB 168) 50%-ный раствор КОН (3 мл) добавляют к эквимолярному раствору 7-аллилокси-8-ацетил-3-метилфлавона (2,5 г, 0,0075 моль) и 3-метокси-бензальдегида (1,01 г, 0,0075 моль) в 95%-ном этаноле; добавление производят при интенсивном перемешивании при комнатной температуре. Реакционную смесь выдерживают при перемешивании в течение ночи, затем разбавляют водой и подкисляют; осадок отделяют фильтрованием и сушат в вакууме. Соединение кристаллизуют из метанола и получают 2,4 г продукта с т.пл. 90-92°С. 1Н-ЯМР: (СDСl3) Пример 11. 1-[3-метил-7-(аллилокси)флавон-8-ил]-3-(3,4,5-триметоксифенил)пропен-1-он (см. прилагаемую формулу VIB 171) 50%-ный раствор КОН (3 мл) добавляют к эквимолярному раствору 7-аллилокси-8-ацетил-3-метилфлавона (2,5 г, 0,0075 моль) и 3,4,5-триметокси-бензальдегида (1,47 г, 0,0075 моль) в 95%-ном этаноле; добавление производят при интенсивном перемешивании при комнатной температуре. Реакционную смесь выдерживают при перемешивании в течение ночи, затем разбавляют водой и подкисляют; осадок отделяют фильтрованием и сушат в вакууме. Соединение кристаллизуют из метанола и получают 2,4 г продукта с т.пл. 121-123°С. 1H-ЯМР: (CDCl3) Пример 12. 1-[3-метил-7-(2-метилаллилокси)флавон-8-ил]-3-фенилпропен-1-он (см. прилагаемую формулу VIB 165) 50%-ный раствор КОН (3 мл) добавляют к эквимолярному раствору 7-(2-метилаллилокси)-8-ацетил-3-метилфлавона (2,61 г, 0,0075 моль) и бензальдегида (0,8 г, 0,0075 моль) в 95%-ном этаноле; добавление производят при интенсивном перемешивании при комнатной температуре. Реакционную смесь выдерживают при перемешивании в течение ночи, затем разбавляют водой и подкисляют; осадок отделяют фильтрованием и сушат в вакууме. Соединение кристаллизуют из метанола и получают 2,8 г продукта с т.пл. 145-147°С. 1h-ямр: (CDCl3) Пример 13. 1-[3-метил-7-(2-метилаллилокси)флавон-8-ил]-3-(3-метоксифенил)пропен-1-он (см. прилагаемую формулу VIB 169) 50%-ный раствор КОН (3 мл) добавляют к эквимолярному раствору 7-(2-метилаллилокси)-8-ацетил-3-метилфлавона (2,61 г, 0,0075 моль) и 3-метокси-бензальдегида (1,01 г, 0,0075 моль) в 95%-ном этаноле; добавление производят при интенсивном перемешивании при комнатной температуре. Реакционную смесь выдерживают при перемешивании в течение ночи, затем разбавляют водой и подкисляют; осадок отделяют фильтрованием и сушат в вакууме. Соединение кристаллизуют из метанола и получают 2,4 г продукта с т.пл. 131-134°С. 1H-ЯМР: (CDCl3) Пример 14. 1-[3-метил-7-(2-метилаллилокси)флавон-8-ил]-3-(3,4,5-триметоксифенил)пропен-1-он (см. прилагаемую формулу VIB 172) 50%-ный раствор КОН (3 мл) добавляют к эквимолярному раствору 7-(2-метилаллилокси)-8-ацетил-3-метилфлавона (2,61 г, 0,0075 моль) и 3,4,5-три-метоксибензальдегида (1,47 г, 0,0075 моль) в 95%-ном этаноле; добавление производят при интенсивном перемешивании при комнатной температуре. Реакционную смесь выдерживают при перемешивании в течение ночи, затем разбавляют водой и подкисляют; осадок отделяют фильтрованием и сушат в вакууме. Соединение кристаллизуют из метанола и получают 2,4 г продукта с т.пл. 82-84°С. 1H-ЯМР: (СDСl3) Пример 15. 1-[3-метил-7-(лроп-2-инилокси)флавон-8-ил]-3-фенилпропен-1-он (см. прилагаемую формулу VIB 167) 50%-ный раствор КОН (3 мл) добавляют к эквимолярному раствору 7-(проп-2-инилокси)-8-ацетил-3-метилфлавона (2,49 г, 0,0075 моль) и бензальдегида (0,8 г, 0,0075 моль) в 95%-ном этаноле. Добавление производят при интенсивном перемешивании при комнатной температуре. Реакционную смесь выдерживают при перемешивании в течение ночи, затем разбавляют водой и подкисляют; осадок отделяют фильтрованием и сушат в вакууме. Соединение кристаллизуют из метанола и получают 2,8 г продукта с т.пл. 157-159°С. 1H-ЯМР: (CDCl3), Пример 16. 1-[3-метил-7-(проп-2-инилокси)флавон-8-ил]-3-(3,4,5-триметоксифенил)пропен-1-он (см. прилагаемую формулу VIB 174) 50%-ный раствор КОН (3 мл) добавляют к эквимолярному раствору 7-(проп-2-инилокси)-8-ацетил-3-метилфлавона (2,49 г, 0,0075 моль) и 3,4,5-триметоксибензальдегида (1,47 г, 0,0075 моль) в 95%-ном этаноле. Добавление производят при интенсивном перемешивании при комнатной температуре. Реакционную смесь выдерживают при перемешивании в течение ночи, затем разбавляют водой и подкисляют; осадок отделяют фильтрованием и сушат в вакууме. Соединение кристаллизуют из метанола и получают 2,8 г продукта с т.пл. 152-154°С. 1H:ЯМР (СDСl3) Пример 17. 1-[3-метил-7-(3-метилбут-2-енилокси)флавон-8-ил]-3-(2-тиенил)пропен-1-он (см. прилагаемую формулу VIB 238) 50%-ный раствор КОН (3 мл) добавляют к эквимолярному раствору 7-(3-метилбут-2-енилокси)-8-ацетил-3-метилфлавона (2,71 г, 0,0075 моль) и 2-тиофен-карбоксиальдегида (0,84 г, 0,0075 моль) в 95%-ном этаноле; добавление производят при интенсивном перемешивании при комнатной температуре. Реакционную смесь выдерживают при перемешивании в течение ночи, затем разбавляют водой и подкисляют; осадок отделяют фильтрованием и сушат в вакууме. Соединение кристаллизуют из метанола и получают 2,5 г продукта с т.пл. 158-160°С. 1H-ЯМР: (CDCl3) Пример 18. 1-[3-метил-7-метоксифлавон-8-ил]-3-(4-цианфенил)пропен-1-он (см. прилагаемую формулу VIB 247) 50%-ный раствор КОН (3 мл) добавляют к эквимолярному раствору 7-метокси-8-ацетил-3-метилфлавона (2,31 г, 0,0075 моль) и 4-цианбензальдегида (0,98 г, 0,0075 моль) в 95%-ном этаноле; добавление производят при интенсивном перемешивании при комнатной температуре. Реакционную смесь выдерживают при перемешивании в течение ночи, затем разбавляют водой и подкисляют; осадок отделяют фильтрованием и сушат в вакууме. Соединение кристаллизуют из метанола и получают 2,1 г продукта с т.пл. 223-224°С. 1H-ЯМР: (CDCl3) Пример 19. 1-(2-метилаллилоксиксантен-9-он-4-ил)-3-(4-фторфенил)пропен-1-он (см. прилагаемую формулу VIB 245) 50%-ный раствор КОН (3 мл) добавляют к эквимолярному раствору 3-(2-метилаллилокси)-4-ацетилксантен-9-она (2,31 г, 0,0075 моль) и 4-фтор-бензальдегида (0,93 г, 0,0075 моль) в 95%-ном этаноле; добавление производят при интенсивном перемешивании при комнатной температуре. Реакционную смесь выдерживают при перемешивании в течение ночи, затем разбавляют водой и подкисляют; осадок отделяют фильтрованием и сушат в вакууме. Соединение кристаллизуют из метанола и получают 2,2 г продукта с т.пл. 135-137°С. 1Н-ЯМР: (CDCl3) Пример 20. 1-(2-аллилоксиксантен-9-он-4-ил)-3-(4-метилтиофенил)пропен-1-он (см. прилагаемую формулу VIB 244) 50%-ный раствор КОН (3 мл) добавляют к эквимолярному раствору 3-(аллилокси)-4-ацетилксантен-9-она (2,21 г, 0,0075 моль) и 4-метилтио-бензальдегида (1,13 г, 0,0075 моль) в 95%-ном этаноле; добавление производят при интенсивном перемешивании при комнатной температуре. Реакционную смесь выдерживают при перемешивании в течение ночи, затем разбавляют водой и подкисляют; осадок отделяют фильтрованием и сушат в вакууме. Соединение кристаллизуют из метанола и получают 2,1 г продукта с т.пл. 142-144°С. 1H:ЯМР (CDCl3) Пример 21. 1-[3-метил-7-(3-метилбут-2-енилокси)флавон-8-ил]-3-(4-хлорфенил)пропен-1-он (см. прилагаемую формулу VIB 239) 50%-ный раствор КОН (3 мл) добавляют к эквимолярному раствору 7-(3-метилбут-2-енилокси)-8-ацетил-3-метилфлавона (2,71 г, 0,0075 моль) и 4-хлор-бензальдегида (1,05 г, 0,0075 моль) в 95%-ном этаноле; добавление производят при интенсивном перемешивании при комнатной температуре. Реакционную смесь выдерживают при перемешивании в течение ночи, затем разбавляют водой и подкисляют; осадок отделяют фильтрованием и сушат в вакууме. Соединение кристаллизуют из метанола и получают 1,9 г продукта с т.пл. 130-133°С. 1H:ЯМР (CDCl3) Пример 22. 1-(2-метилаллилоксиксантен-9-он-4-ил)-3-(2,6-дихлорфенил)пропен-1-он (см. прилагаемую формулу VIB 246) 50%-ный раствор КОН (3 мл) добавляют к эквимолярному раствору 3-(2-метилаллилокси)-4-ацетилксантен-9-она (2,31 г, 0,0075 моль) и 2,6-дихлор-бензальдегида (1,31 г, 0,0075 моль) в 95%-ном этаноле; добавление производят при интенсивном перемешивании при комнатной температуре. Реакционную смесь выдерживают при перемешивании в течение ночи, затем разбавляют водой и подкисляют; осадок отделяют фильтрованием и сушат в вакууме. Соединение кристаллизуют из метанола и получают 2,1 г продукта с т.пл. 135-137°С. 1H-ЯМР: (CDCl3) БИОЛОГИЧЕСКИЕ ИСПЫТАНИЯ Соединения VIB 167, VIB 178 и VIB 173 были испытаны с целью определения их цитотоксичности в отношении устойчивых к лекарственным средствам раковых клеток как по отдельности, так и в сочетании с паклитакселом. Ниже представлены результаты этих исследований. При испытаниях соединений VIB 167, VIB 178 и VIB 173 в отдельности было обнаружено, что они обладают сравнительно низкой цитотоксичностью (IС50>1 мкМ) в отношении устойчивых к лекарственным средствам раковых клеток. Затем соединения испытывали в сочетании с паклитакселом для определения цитостатической активности в отношении стойких к лекарственным средствам клеток рака молочной железы MDA-435/LCC6-MDR. В этих экспериментах упомянутые соединения применяли в сочетании с паклитакселом, концентрация паклитаксела составляла 0,3 мкМ. Паклитаксел при применении его в отдельности показал значение IC50 426 нМ. Однако, как следует из данных, представленных в Таблице 1, при применении паклитаксела совместно с каждым из соединений VIB 167, VIB 178 и VIB 173, его IС50 понижается в 5-20 раз, т.е. с 426 нМ до 82-21 нМ, по сравнению с применением индивидуального паклитаксела. Следовательно, в присутствии этих соединений паклитаксел может проявить свою высокую ингибирующую активность в отношении устойчивых к лекарственным средствам раковых клеток.
Методика эксперимента Испытания заключались в одновременной обработке клеток MDA-435/LCC-MDR паклитакселом в присутствии или отсутствии испытываемых соединений (1 мкМ) in vitro в течение 72 ч. Оценку цитотоксичности, т.е. ингибирования роста клеток, производили в соответствии с методикой Скехана и др. (Skehan et al.), описанной в J. Nat. Cancer Inst. 82, 1107, 1990. Вкратце методику можно описать следующим образом. Клетки высевали в 96-луночную чашку Петри в количестве 400-1200 клеток на лунку и перед введением лекарственного средства инкубировали при 37°С в течение 15-18 ч для обеспечения прикрепления культуры к лунке. Испытываемые соединения растворяли в 100%-ном диметилсульфоксиде и затем разбавляли средой RPMI-1640, содержащей 10 мМ HEPES (N-2-гидроксиэтилпиперазин-N’-2-гидрокси-пропансульфокислоты). После 72 ч инкубации в каждую лунку добавляли 100 мкл 50%-ной трихлоруксусной кислоты, охлажденной льдом, и инкубировали в течение 1 ч при 4°С. Затем чашки промывали 5 раз водопроводной водой для удаления трихлоруксусной кислоты, низкомолекулярных продуктов метаболизма и сывороточных протеинов. Добавляли в каждую лунку 50 мкл сульфородамина В (0,4%). После 5-минутной инкубации при комнатной температуре чашки промывали 5 раз 0,1%-ной уксусной кислотой и сушили на воздухе. Связанный краситель растворяли трис(гидроксиметил)-метиламинометаном (TRIS) (основание, 10 мМ, рН 10,5) в течение 5 мин на вращательном приборе для встряхивания. Оптическую плотность измеряли на длине волны 570 нм. Данные, показывающие активность в отношении клеток аденокарциномы яичников человека (2008)
Формула изобретения
1. Халконы формулы (I) или их фармацевтически приемлемые соли либо сольваты, где Аr представляет собой замещенную или незамещенную карбоциклическую группу, содержащую в циклической структуре от 5 до 10 атомов углерода, или 5- или 6-членную гетероциклическую группу, содержащую в циклической структуре атом серы, причем заместители при группе Аr выбраны независимо друг от друга из группы, состоящей из Сl, Вr, F, CN, SСН3 и OR10, где R10 представляет собой углеводородный радикал C1-С6 нормального или разветвленного строения; R представляет собой ОН или OR10, где R10 представляет собой насыщенный или ненасыщенный низший углеводородный радикал C1-С6 нормального или разветвленного строения; и (A) R2 и R3 независимо друг от друга выбраны из следующих групп: (i) фенил; (ii) насыщенный углеводородный радикал C1-С6 нормального или разветвленного строения; или (B) R2 и R3 совместно с атомами углерода, к которым они присоединены, образуют 5- или 6-членную карбоциклическую группу, при условии, что в соединениях, где R-ОН и оба R2 и R3 – метилы, группа Аr не может представлять собой фенил, 4-хлорфенил, 4-метилфенил, 2-хлорфенил, 3,4-диметоксифенил или 4-метоксифенил. 2. Халконы по п.1, имеющие структуру (IA) где заместители R и Аr соответствуют определениям, приведенным в п.1, a R2 и R3 совместно образуют цикл Q, который представляет собой пяти- или шестичленную карбоциклическую группу. 3. Халконы по п.1, причем R и Аr соответствуют определениям, приведенным в п.1, а R2 и R3 независимо друг от друга выбраны из следующих заместителей: (i) фенил; (ii) насыщенный углеводородный радикал C1-C6 нормального или разветвленного строения. 4. Халконы по п.3, причем R2 представляет собой фенил, R3 представляет собой насыщенный углеводородный радикал C1-C6 нормального или разветвленного строения. 5. Халконы по любому из предыдущих пунктов, причем R3 – метил. 6. Халконы по любому из предыдущих пунктов, причем R представляет собой -ОСН2СН=СМе2, -ОСН2СМе=СН2, -ОСН2СН=СН2 или -ОСН2С 7. Халконы по любому из предыдущих пунктов, причем Аr представляет собой фенил, который может быть незамещенным или замещенным одним или несколькими заместителями, выбранными из группы, состоящей из следующих заместителей: Сl, Вr, F, CN и OR10, где R10 соответствует определению, приведенному в п.1. 8. Халконы по любому из предыдущих пунктов, причем Аr представляет собой фенил, который может быть незамещенным или замещенным одним, двумя или тремя заместителями, каждый из которых независимо от других выбран из группы, состоящей из следующих заместителей: Cl, Br, F, CN и ОМе, либо Аr представляет собой тиенил; R представляет собой ОН или ОСН2R1, где R1 выбран из группы, состоящей из -СН=СМе2, -СМе=СН2, -СН=СН2 и -С 9. Халконы по п.1: 1-[3-(3-метилбут-2-енилокси)ксантен-9-он-4-ил]-3-фенилпропен-1-он (VIB 176), 1-[3-(3-метилбут-2-енилокси)ксантен-9-он-4-ил]-3-(3-метоксифенил)-пропен-1-он (VIB 177), 1-[3-(3-метилбут-2-енилокси)ксантен-9-он-4-ил]-3-(3,4,5-триметоксифенил)пропен-1-он (VIB 178), 1-[3-(аллилокси)ксантен-9-он-4-ил]-3-фенилпропен-1-он (VIB 175), 1-[3-метил-7-(3-метилбут-2-енилокси)флавон-8-ил]-3-фенилпропен-1-он (VIB 166), 1-[3-метил-7-(3-метилбут-2-енилокси)флавон-8-ил]-3-(3-метокси)фенилпропен-1-он (VIB 170), 1-[3-метил-7-(3-метилбут-2-енилокси)флавон-8-ил]-3-(3,4,5-триметоксифенил)-пропен-1-он (VIB 173), 1-[3-метил-7-(аллилокси)флавон-8-ил]-3-фенилпропен-1-он (VIB 164), 1-[3-метил-7-(аллилокси)флавон-8-ил]-3-(3-метоксифенил)пропен-1-он (VIB 168), 1-[3-метил-7-(аллилокси)флавон-8-ил]-3-(3,4,5-триметоксифенил)пропен-1-он (VIB 171), 1-[3-метил-7-(2-метилаллилокси)флавон-8-ил]-3-фенилпропен-1-он (VIB 165), 1-[3-метил-7-(2-метилаллилокси)флавон-8-ил]-3-(3-метоксифенил)пропен-1-он (VIB 169), 1-[3-метил-7-(2-метилаллилокси)флавон-8-ил]-3-(3,4,5-триметоксифенил)-пропен-1-он (VIB 172), 1-[3-метил-7-(проп-2-инилокси)флавон-8-ил]-3-фенилпропен-1-он (VIB 167), 1-[3-метил-7-(проп-2-инилокси)флавон-8-ил]-3-(3,4,5-триметоксифенил)-пропен-1-он (VIB 174). 10. Халконы по любому из предыдущих пунктов для применения в качестве антипролиферативного лекарственного средства. 11. Компонент лекарственного средства для лечения или профилактики новообразований, представленный соединением формулы (I) или их фармацевтически приемлемой солью либо сольватом, где Аr представляет собой замещенную или незамещенную карбоциклическую группу, содержащую в циклической структуре от 5 до 10 атомов углерода, или 5- или 6-членную гетероциклическую группу, содержащую в циклической структуре атом серы, причем заместители при группе Аr выбраны независимо друг от друга из группы, состоящей из Сl, Вr, F, CN, SСН3 и OR10, где R10 представляет собой углеводородный радикал C1-С6 нормального или разветвленного строения; R представляет собой ОН или OR10, где R10 представляет собой насыщенный или ненасыщенный низший углеводородный радикал C1-C6 нормального или разветвленного строения; (A) R2 и R3 независимо друг от друга выбраны из следующих групп: (i) фенил; (ii) насыщенный углеводородный радикал C1-C6 нормального или разветвленного строения; или (B) R2 и R3 совместно с атомами углерода, к которым они присоединены, образуют 5- или 6-членную карбоциклическую группу; при условии, что в соединениях, где R-ОН и оба R2 и R3 – метилы, группа Аr не может представлять собой фенил, 4-хлорфенил, 4-метилфенил, 2-хлорфенил, 3,4-диметоксифенил или 4-метоксифенил. 12. Компонент лекарственного средства для лечения или профилактики новообразований по п.11, причем новообразования локализованы в яичниках или молочных железах. 13. Компонент лекарственного средства для лечения или профилактики новообразований по п.11 или 12, причем упомянутое лекарственное средство предназначено для лечения раковых клеток, устойчивых к паклитакселу и доцетакселу. 14. Компонент лекарственного средства для лечения или профилактики новообразований по любому из пп.11-13, причем упомянутое лекарственное средство является антипролиферативным лекарственным средством для комбинированной терапии. 15. Компонент лекарственного средства для лечения или профилактики новообразований по любому из пп.11-14, причем упомянутое лекарственное средство включает в себя также один или несколько противоопухолевых агентов. 16. Компонент лекарственного средства для лечения или профилактики новообразований по п.15, причем упомянутый противоопухолевый агент содержит паклитаксел или доцетаксел. 17. Компонент лекарственного средства для лечения или профилактики новообразований по п.11, причем упомянутое лекарственное средство предназначено для лечения или профилактики расстройств, возникающих в климактерическом периоде, и остеопороза. 18. Фармацевтическая композиция, обладающая антипролиферативной активностью, отличающаяся тем, что она содержит одно или несколько соединений по любому из пп.1-9 в сочетании с одной или несколькими фармацевтически приемлемыми добавками. 19. Фармацевтическая композиция по п.18, дополнительно содержащая один или несколько противоопухолевых агентов. 20. Фармацевтическая композиция по п.19, отличающаяся тем, что упомянутый противоопухолевый агент выбран из группы, включающей паклитаксел и доцетаксел.
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 29.08.2008
Извещение опубликовано: 27.11.2010 БИ: 33/2010
|
||||||||||||||||||||||||||||||||

 СН.
СН.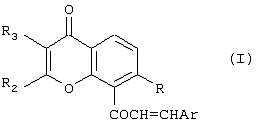
 : 1,69 (s, 3Н); 1,72 (s, 3H); 4,71 (d, 2H, J=6,5); 5,38-5,40 (m, 1H); 7,05-7,10 (m, 2H); 7,08 (d, 1H, J=8,8 Гц); 7,10 (d, 1H, J=16 Гц); 7,30-7,48 (m, 6H); 7,50-7,58 (m,2H); 7,65-7,60 (m, 1H); 8,30-8,33 (m, 1H); 8,42 (d, 1H, J=8,9 Гц).
: 1,69 (s, 3Н); 1,72 (s, 3H); 4,71 (d, 2H, J=6,5); 5,38-5,40 (m, 1H); 7,05-7,10 (m, 2H); 7,08 (d, 1H, J=8,8 Гц); 7,10 (d, 1H, J=16 Гц); 7,30-7,48 (m, 6H); 7,50-7,58 (m,2H); 7,65-7,60 (m, 1H); 8,30-8,33 (m, 1H); 8,42 (d, 1H, J=8,9 Гц).