|
|
(21), (22) Заявка: 2003131106/15, 23.10.2003
(24) Дата начала отсчета срока действия патента:
23.10.2003
(45) Опубликовано: 20.05.2005
(56) Список документов, цитированных в отчете о
поиске:
US 4563420 A1, 07.01.1986. US 6297023 A1, 02.10.2001. RU 2121690 C1, 10.11.1998. RANBY M. et al. In: Progress in Fibrinolysys. Vol.V, Editors: J.F.Davidson et al., Edinburg, 1981. SU 1691749 А1, 11.07.1989. RU 2046827 С1, 27.10.1995. US 5472851 A1, 05.12.1995. US 5175087 A1, 29.12.1992. US 5096811 A1, 17.03.1992. WO 0142488 A1, 14.06.2001.
Адрес для переписки:
123242, Москва, ул. Б. Грузинская, 16, кв.74, Р.Б. Айсиной
|
(72) Автор(ы):
Айсина Р.Б. (RU),
Булыгин О.Ю. (RU),
Варфоломеев С.Д. (RU),
Воюшина Т.Л. (RU),
Мухаметова Л.И. (RU),
Мамаев А.Н. (RU),
Момот А.П. (RU)
(73) Патентообладатель(и):
Айсина Роза Бакировна (RU),
Булыгин Олег Юрьевич (RU),
Варфоломеев Сергей Дмитриевич (RU),
Воюшина Татьяна Львовна (RU),
Мухаметова Лилия Инилевна (RU),
Мамаев Андрей Николаевич (RU),
Момот Андрей Павлович (RU)
|
(54) СПОСОБ ОПРЕДЕЛЕНИЯ ТКАНЕВОГО АКТИВАТОРА ПЛАЗМИНОГЕНА
(57) Реферат:
Изобретение относится к медицине, а именно к диагностическим методам. Способ определения тканевого активатора плазминогена заключается в инкубации образца с плазминогеном, стимулятором превращения плазминогена в плазмин под действием тканевого активатора плазминогена и хромогенным синтетическим субстратом плазмина и определении активности тканевого активатора плазминогена по концентрации окрашенного продукта гидролиза субстрата плазмином. В качестве плазминогена используют Лиз-плазминоген, предварительно обработанный панкреатическим ингибитором трипсина, или Глу-плазминоген. В качестве субстрата плазмина используют специфический субстрат HCO-Ala-Phe-Lys-p-nitroanilide. В качестве стимулятора превращения плазминогена в плазмин под действием тканевого активатора плазминогена используют растворимый фибрин-мономер, полученный с помощью тромбино-подобного фермента анцистрона из яда змеи Agkistrodon halys. Инкубацию проводят при рН 7,0-8,5. Наиболее оптимальной концентрацией для Лиз- или Глу-плазминогена является
0,3 мкМ, для специфического субстрата HCO-Ala-Phe-Lys-p-nitroanilide – 0,6 мМ, для фибрин-мономера – 0,025 мг/мл. Способ обладает высокой чувствительностью и точностью. 9 ил.
Настоящее изобретение относится к области медицины, в частности к способу определения тканевого активатора плазминогена (ТАП) в биологических образцах для диагностических целей.
ТАП и урокиназа являются эндогенными активаторами плазминогена. Они превращают плазминоген в плазмин, который растворяет фибрин сгустка. ТАП, обладающий сродством к фибрину, играет ключевую роль в фибринолизе in vivo. Нормальная плазма содержит 4-6 нг/мл ТАП. Уровень ТАП в крови человека понижен при тромботических и повышен при онкологических заболеваниях и кровотечениях. Кроме того, рекомбинантный ТАП вводится внутривенно пациентам при инфаркте миокарда и инсульте для растворения фибрина окклюдированного тромба. Таким образом, точное определение уровня ТАП в крови необходимо для диагноза тромбофилии и гемофилии, а также для контроля активности ТАП во время тромболитической терапии.
ТАП секретируется клетками эндотелия в циркуляцию и быстро удаляется печенью ( 1/2=8 мин). В крови содержатся специфический ингибитор активаторов плазминогена ПАИ-1, 1/2=8 мин). В крови содержатся специфический ингибитор активаторов плазминогена ПАИ-1,  2-антиплазмин и С1-ингибитор, которые образуют с ТАП неактивные комплексы ТАП/ингибитор. Типичный базальный уровень активного ТАП в крови равен 1 нг/мл (0.5 МЕ/мл) и неактивного комплекса ТАП/ингибитор – 5 нг/мл [Wiman В. et all, J. Lab. Clin. Med. 105, 265-270, 1985]. Обычно ТАП не определяется в цельной крови, большая часть активности ТАП найдена в плазме крови. Для предотвращения взаимодействия ТАП с плазменными ингибиторами пробу крови подкисляют до рН 4.0 и выделяют плазму [Chmielewska et all, Thromb. Res., 31, 427-436, 1983]. Эуглобулиновая фракция стабилизированной цитратом плазмы содержит активность ТАП и не содержит ингибиторов. 2-антиплазмин и С1-ингибитор, которые образуют с ТАП неактивные комплексы ТАП/ингибитор. Типичный базальный уровень активного ТАП в крови равен 1 нг/мл (0.5 МЕ/мл) и неактивного комплекса ТАП/ингибитор – 5 нг/мл [Wiman В. et all, J. Lab. Clin. Med. 105, 265-270, 1985]. Обычно ТАП не определяется в цельной крови, большая часть активности ТАП найдена в плазме крови. Для предотвращения взаимодействия ТАП с плазменными ингибиторами пробу крови подкисляют до рН 4.0 и выделяют плазму [Chmielewska et all, Thromb. Res., 31, 427-436, 1983]. Эуглобулиновая фракция стабилизированной цитратом плазмы содержит активность ТАП и не содержит ингибиторов.
Существуют три различных способа определения ТАП: иммуноферментный метод, прямой и непрямой функциональные методы. Иммуноферментный метод [Bergsdorf N., Nilsson Т., Wallen P. Thromb. Haemost. 50, 740-744 (1993)] позволяет определять вплоть до 1-2 нг/мл антигена ТАП, но он не дает информации об активности фермента. К недостаткам этого метода относятся также малая доступность и высокая стоимость иммуноферментных реагентов. В прямом функциональном методе синтетический хромогенный или флуорогенный специфический субстрат ТАП инкубируют с образцом и измеряют скорость образования продукта гидролиза субстрата под действием ТАП [USA Patent N 4 278 762, (1981)]. Однако этот метод недостаточно чувствителен. В непрямом функциональном методе плазминоген активируют под действием ТАП в присутствии субстрата плазмина и активность ТАП определяют по гидролизу субстрата образующимся плазмином. К непрямым функциональным методам, в которых используют природный субстрат плазмина фибрин, относятся методы, основанные на измерении площади зоны лизиса фибриновой пластины [Astrup Т., Mullerts S. Arch. Biochem. Biophys. 40, 346-351 (1952)] или времени полного лизиса фибринового сгустка [Christensen L.R. Proc. Soc. Biol. Med. 46, 674-679 (1941)]. Недостатками этих методов являются неясность кинетики протекания реакций, вовлеченных в процесс растворения твердофазного субстрата, и трудность интерпретации полученных результатов.
Существенные недостатки трех вышеописанных способов исправляются наиболее близким по техническому решению способом (прототипом), описанным Verheijen J.P. et all [USA Patent №4563420 (1986)]. В этом способе образец, в котором измеряют активность ТАП, инкубируют с Лиз-плазминогеном и пептидным субстратом плазмина Н-D-Val-Leu-Lys-pNA (S-2251) в присутствии растворимых BrCN-фрагментов фибриногена в качестве стимулятора активации плазминогена ТАП. Плазмин (Пл), образующийся при активации плазминогена (Пг) ТАП, катализирует гидролиз субстрата (С), при этом образуется окрашенный продукт п-нитроанилин (НА), который измеряют спектрофотометрически при 405 им. Схему реакции можно представить уравнениями (1 и 2):
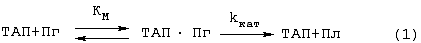
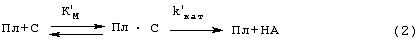
Преимуществами этого способа являются: 1) возможность количественного описания сопряженного процесса в растворе (кинетические параметры Км, kКАТ, К’М и k’КАТ могут быть определены из кинетики отдельных реакций) и 2) высокая чувствительность метода, так как фрагменты фибриногена повышают каталитическую эффективность (kКАТ/КМ) активации плазминогена ТАП на 2-3 порядка благодаря резкому снижению Км и некоторому увеличению kКАТ.
Недостатками способа являются использование: 1) высокотоксичного цианистого брома, необходимого для получения фрагментов фибриногена из фибриногена; 2) коммерческого дорогостоящего субстрата плазмина H-D-Val-Leu-Lys-pNA (S-2251), для гидролиза которого плазмином характерно высокое значение константы Михаэлиса (К’M=0.6 мМ) и недостаточно высокая каталитическая эффективность (kКАТ/KM=42 мМ-1с-1) [Kiss I., Biochem. Biophys. Res. Comm. 131, 928-934 (1985)]) и измерение активности ТАП проводится не при [С]0>>К’M (когда скорость максимальна), а при [C]0  K’M, что снижает чувствительность метода и 3) Лиз-плазминогена, обычно содержащего примесь плазмина, который приводит к значительному фоновому гидролизу субстрата и повышает погрешность определения низких концентраций ТАП. K’M, что снижает чувствительность метода и 3) Лиз-плазминогена, обычно содержащего примесь плазмина, который приводит к значительному фоновому гидролизу субстрата и повышает погрешность определения низких концентраций ТАП.
Задачей предлагаемого способа определения ТАП является повышение чувствительности и точности детекции ТАП за счет использования каталитически более эффективного субстрата плазмина и снижения примеси плазмина в препарате плазминогена, а также упрощение способа путем использования стимулятора активации плазминогена ТАП, полученного без применения цианистого брома.
Для решения поставленной задачи предлагается способ определения ТАП, который заключается в том, что образец ТАП инкубируют с раствором плазминогена в присутствии хромогенного специфического субстрата плазмина и стимулятора активации плазминогена ТАП с последующим измерением скорости накопления продукта гидролиза субстрата образующимся плазмином. Согласно изобретению в качестве субстрата ТАП используют Глу-плазминоген, практически не содержащий примеси плазмина, или Лиз-плазминоген желательно после ингибирования в нем примеси плазмина, в качестве субстрата плазмина используют новый отечественный специфический субстрат HCO-Ala-Phe-Lys-p-mtroanilide (APL-pNA) [Патент N 98100177/14 (1998), Россия] и в качестве стимулятора активации плазминогена ТАП используют растворимый Дез-АА-фибрин-мономер, полученный с помощью отечественного тромбиноподобного фермента анцистрона из яда змеи Agkistrodon halys.
Глу-плазминоген выделяют из свежезамороженной плазмы крови человека методом аффинной хроматографии на Lys-Sepharose 4B в присутствии панкреатического ингибитора трипсина (для исключения образования плазмина) по методике, описанной в работе [Castellino F.J et al., Methods Enzymol., 80, 365-378 (1981)]. Препарат электрофоретически гомогенен и практически не содержит примеси плазмина.
Лиз-плазминоген выделяют из плазмы человека аффинной хроматографией на Lys-sepharose 4B в отсутствии панкреатического ингибитора трипсина по методу, описанному в работе [Deutsch D.G. et al., Science, 170, 1095-1096 (1970)]. Полученный препарат Лиз-плазминогена, в котором обычно содержится 0.5-5% примеси активного плазмина, обрабатывают избытком панкреатического ингибитора и очищают путем ультрафильтрации.
Для выделения эуглобулиновой фракции образец плазмы (100 мкл), содержащей ТАП, разбавляют в 0.9 мл дистиллированной воды, затем раствор подкисляют добавлением 100 мкл 0.25% уксусной кислоты и инкубируют в течение 1 ч при 4° С. После центрифугирования в течение 5 минут при 2000 об/мин надосадочную жидкость декантируют. Полученный осадок растворяют в 100 мкл исследуемого буфера.
Для измерения большого числа образцов в рутинных экспериментах реакцию проводят в 96-луночных стриповых планшетах с использованием мультиканального спектрофотометра.
Реакцию проводят при 25° С или 37° С, но скорость реакции при 25° С в 3 раза ниже. Инкубацию реакционных растворов при 37° С проводят в закрытых ячейках во избежание испарения.
Реакцию проводят при рН 7.0-8.3 в присутствии 0.1% Тритона Х-100 для элиминирования сорбции ТАП к стенкам сосуда.
При насыщающих условиях (когда [Пг]0>>КM и [С]0>>К’M) и отсутствии спонтанного гидролиза субстрата образование продукта п-нитроанилина в ходе реакций (1 и 2), измеряемое спектрофотометрически при 405 нм, описывается уравнением
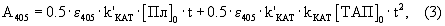
где  405 – коэффициент экстинкции п-нитроанилина. 405 – коэффициент экстинкции п-нитроанилина.
Если плазминоген не содержит примеси плазмина ([Пл]0=0), то уравнение (3) преобразуется в уравнение
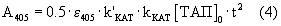
и скорость реакции пропорциональна концентрации ТАП.
Пример 1
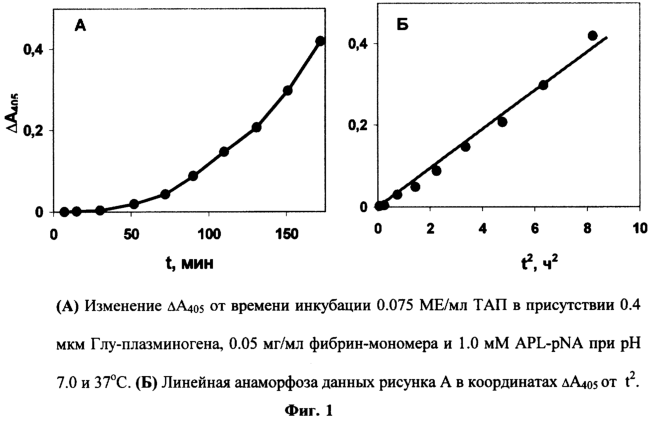
ТАП (0.075 МЕ/мл) инкубируют при 37° С в 0.2 мл Трис-ацетатного буфера (0.1 М, рН 7.0), содержащего 0.4 мкМ Глу-плазминогена, 0.05 мг/мл фибрин-мономера, 0.1% Тритона Х-100 и 1 мМ хромогенного субстрата плазмина – APL-pNA, в ячейке 96-луночной стриповой планшеты. Контрольная ячейка, не содержащая ТАП, служит для измерения фонового гидролиза. В ходе инкубации в течение 3 часов измеряют оптическую плотность образца (A405) и контроля (А405° ) на планшетном фотометре Antos 2020. Скорость реакции прямо пропорциональна концентрации ТАП в образце, которую определяют либо из значения  А405(A405-А405° ) через 2 часа реакции, либо из значения тангенса угла наклона зависимости А405(A405-А405° ) через 2 часа реакции, либо из значения тангенса угла наклона зависимости  A405 от t2. Как видно, в присутствии ТАП зависимость A405 от t2. Как видно, в присутствии ТАП зависимость  А405 от t имеет параболический вид (Фиг.1,А), а от t2 – линейный вид (Фиг.1,Б). А405 от t имеет параболический вид (Фиг.1,А), а от t2 – линейный вид (Фиг.1,Б).
Пример 2
ТАП (0.4 МЕ/мл) инкубируют при 25° С в 0.2 мл Трис-ацетатного буфера (0.1 М, рН 8.5), содержащего 0.4 мкМ Лиз-плазминогена, 0.05 мг/мл фибрин-мономера, 0.1% Тритона Х-100 и 1 мМ APL-pNA. Изменение оптической плотности образца и контроля (без ТАП) регистрируют в течение 9 часов. Активность ТАП определяют по величине  А405, наблюдаемой через 7 часов (Фиг.2). А405, наблюдаемой через 7 часов (Фиг.2).
Пример 3
ТАП (0.25 МЕ/мл) инкубируют при 37° С в 0.2 мл 0.1 М Трис-ацетатного буфера (0.1% тритона Х-100) с различными значениями рН. Концентрации Глу-плазминогена, фибрин-мономера и APL-pNA такие же, как в примере 1. При каждом значении рН измеряют фоновый гидролиз субстрата в отсутствие ТАП (А405° ). Фиг.3 показывает зависимость  A405/t2 от рН. Оптимальное значение рН сопряженной реакции 8.3. A405/t2 от рН. Оптимальное значение рН сопряженной реакции 8.3.
Пример 4
ТАЛ (0.25 МЕ/мл) инкубируют при 37° С в 0.2 мл 0.1 М Трис-ацетатного буфера рН 8.3, содержащего 0.4 мкМ Глу-плазминогена, 0.1% Тритона Х-100, 1 мМ APL-pNA и разные концентрации фибрин-мономера. Для каждой концентрации стимулятора измеряют фоновый гидролиз субстрата в отсутствие ТАП. Из зависимости  A405/t2 от концентрации фибрин-мономера видно, что плато достигается при концентрации стимулятора 0.025 мг/мл (Фиг.4). A405/t2 от концентрации фибрин-мономера видно, что плато достигается при концентрации стимулятора 0.025 мг/мл (Фиг.4).
Пример 5
Эксперименты по примеру 4 проводят в присутствии 0.025 мг/мл фибрин-мономера и различных концентраций Глу-плазминогена. Для каждой концентрации Глу-плазминогена измеряют фоновый гидролиз субстрата в отсутствие ТАП. Скорость реакции ( A405/t2) достигает максимума при концентрации Глу-плазминогена 0.3 мкМ (Фиг.5). A405/t2) достигает максимума при концентрации Глу-плазминогена 0.3 мкМ (Фиг.5).
Пример 6
Эксперименты по примеру 4 проводят в присутствии 0.3 мкМ Глу-плазминогена, 0.025 мг/мл фибрин-мономера и различных концентраций хромогенного субстрата плазмина – APL-pNA. Измеряют фоновый гидролиз для каждой концентрации субстрата в отсутствие ТАП. Зависимость  A405/t2 от концентрации субстрата показывает, что плато достигается при 0.6 мМ APL-pNA (Фиг.6). A405/t2 от концентрации субстрата показывает, что плато достигается при 0.6 мМ APL-pNA (Фиг.6).
Пример 7
0.25 МЕ/мл ТАП инкубируют в присутствии 0.3 мкМ Глу-плазминогена, 0.025 мг/мл фибрин-мономера и 1 мМ APL-pNA или S-2251 ( Sigma Sigma , США) при рН 8.3 и 37° С. Для каждого субстрата измеряют фоновый гидролиз в отсутствие ТАП. Фиг.7 показывает, что скорость сопряженной реакции под действием ТАЛ значительно выше в присутствии APL-pNA, используемого в предлагаемом способе, чем в присутствии S-2251, используемого в прототипе. Это связано с более высокой каталитической эффективностью гидролиза плазмином APL-pNA (kКАТ/Км=82 мМ-1с-1) в сравнении с гидролизом S-2251 (kКАТ/Км=42 мМ-1с-1 [Kiss I., Biochem. Biophys. Res. Comm. 131, 928-934 (1985)]). Кроме того, при используемой концентрации субстратов гидролиз плазмином APL-pNA (К’M=0.13 мМ) протекает в условиях, когда [С]0>>К’M и скорость гидролиза максимальна, в то время как S-2251 (К’M=0.6 мМ, [Kiss I., Biochem. Biophys. Res. Comm. 131, 928-034 (1985)]) гидролизуется плазмином в условиях [С]0 , США) при рН 8.3 и 37° С. Для каждого субстрата измеряют фоновый гидролиз в отсутствие ТАП. Фиг.7 показывает, что скорость сопряженной реакции под действием ТАЛ значительно выше в присутствии APL-pNA, используемого в предлагаемом способе, чем в присутствии S-2251, используемого в прототипе. Это связано с более высокой каталитической эффективностью гидролиза плазмином APL-pNA (kКАТ/Км=82 мМ-1с-1) в сравнении с гидролизом S-2251 (kКАТ/Км=42 мМ-1с-1 [Kiss I., Biochem. Biophys. Res. Comm. 131, 928-934 (1985)]). Кроме того, при используемой концентрации субстратов гидролиз плазмином APL-pNA (К’M=0.13 мМ) протекает в условиях, когда [С]0>>К’M и скорость гидролиза максимальна, в то время как S-2251 (К’M=0.6 мМ, [Kiss I., Biochem. Biophys. Res. Comm. 131, 928-034 (1985)]) гидролизуется плазмином в условиях [С]0  К’M. К’M.
Пример 8
Эксперименты по примеру 4 проводят в присутствии 0.3 мкМ Глу-плазминогена, 0.025 мг/мл фибрин-мономера и различных концентраций стандартного рекомбинантного ТАЛ (3-й Международный стандарт N 98/714, National Institute of Biological Standards and Control, NIBSC, Великобритания). В контрольной ячейке ТАП отсутствует. Каждый тест повторяют трижды. Из кинетических кривых изменения оптической плотности от времени строят калибровочный график: либо зависимость  A405/2ч (изменение поглощения за 2 часа реакции) от концентрации ТАП (Фиг.8, А), либо зависимость A405/2ч (изменение поглощения за 2 часа реакции) от концентрации ТАП (Фиг.8, А), либо зависимость  A405/t2 от концентрации ТАП (Фиг.8, Б). Эти линейные графики используют для определения ТАП в испытуемых образцах. A405/t2 от концентрации ТАП (Фиг.8, Б). Эти линейные графики используют для определения ТАП в испытуемых образцах.
Пример 9
В стандартную плазму добавляют различные концентрации стандартного ТАП до конечной концентрации 1-40 нг/мл. Из образцов плазмы (100 мкл) с различным содержанием ТАП выделяют осадки эуглобулиновой фракции плазмы, как описано выше, и растворяют их в 100 мкл исследуемого буфера. В экспериментах по примеру 8 в качестве исследуемого образца используют предварительно разбавленные в 20 раз растворы эуглобулиновой фракции плазмы с различным содержанием ТАЛ. Активность ТАП в образцах определяют по величине  A405/t2, используя калибровочный график (Фиг.8, Б). Фиг.9 иллюстрирует линейную зависимость активности ТАП, измеренной по заявляемому способу, от концентрации ТАП в плазме человека. A405/t2, используя калибровочный график (Фиг.8, Б). Фиг.9 иллюстрирует линейную зависимость активности ТАП, измеренной по заявляемому способу, от концентрации ТАП в плазме человека.
Формула изобретения
1. Способ определения тканевого активатора плазминогена, заключающийся в том, что образец инкубируют с плазминогеном в присутствии субстрата плазмина и стимулятора превращения плазминогена в плазмин под действием тканевого активатора плазминогена и измеряют окрашенный продукт гидролиза субстрата плазмином, отличающийся тем, что в качестве плазминогена используют Лиз-плазминоген, предварительно обработанный панкреатическим ингибитором трипсина, или Глу-плазминоген, в качестве субстрата плазмина используют специфический субстрат HCO-Ala-Phe-Lys-p-nitroanilide и в качестве стимулятора превращения плазминогена в плазмин под действием тканевого активатора плазминогена используют растворимый фибрин-мономер, полученный с помощью тромбиноподобного фермента анцистрона из яда змеи Agkistrodon halys, инкубацию проводят при рН 7,4-8,5.
2. Способ по п.1, отличающийся тем, что Лиз- или Глу-плазминоген используют в концентрации 0,025-0,3 мкМ, специфический субстрат HCO-Ala-Phe-Lys-p-nitroanilide используют в концентрации 0,6 мМ и фибрин-мономер используют в концентрации мг/мл.
РИСУНКИ
|
|