|
(21), (22) Заявка: 2004111861/04, 21.04.2004
(24) Дата начала отсчета срока действия патента:
21.04.2004
(45) Опубликовано: 20.05.2005
(15) Информация о коррекции:
Версия коррекции № 1 (
Изобретение также относится к способу получения этого соединения. Технический результат – получение нового соединения в кристаллической форме, которое обладает антиокислительной активностью и может найти применение для улучшения свойств нефтей, нефтепродуктов, резинолатексных изделий, шин, полимеров, пластмасс, клеев, красок, органических стекол, биологических объектов, как биологически активное вещество, аналитический реагент, ловушка для радикалов. 2 н.п. ф-лы, 13 ил., 2 табл.
Изобретение относится к области органической химии и касается малоизвестного, азотсодержащего гетероциклического соединения из класса гидрированных хинолинов, а именно 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина (I) в кристаллической форме, обладающего высокой антиокислительной активностью. Также раскрыт способ получения этого соединения, заключающийся в том, что 6-этокси-2,2,4-триметил-1,2-дигидрохинолин (III) подвергают гидрированию в спиртовой среде на новом катализаторе состава 1-8% титана, 30-60% никеля, 0,2-1,5% железа и 35-65% алюминия путем последующей его активации, а также известных никелевых катализаторах, других металлов, активных в реакции гидрирования, с последующим выделением целевого продукта в кристаллической форме из спиртовой среды сразу или после предварительной очистки.
Изобретение может быть использовано в качестве вещества, улучшающего свойства нефтей, нефтепродуктов, резинолатексных изделий, шин, полимеров, пластмасс, клеев, красок, органических стекол, биологических объектов, как биологически активное вещество, аналитический реагент, ловушка для радикалов.
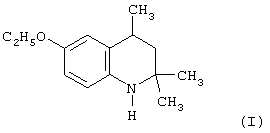
Известен 8-метокси-2,2,4-триметил-1,2-дигидрохинолин (II), являющийся аналогом 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина (I) и который был получен в виде вязкой массы путем конденсации о-анизидина с ацетоном в присутствии йода (Иванов Ю.А. Дис.Канд. хим. наук, г. Москва, 1983 г.).
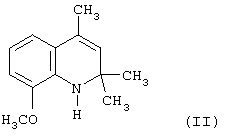
При сравнении относительной антиокислительной активности 8-метокси-2,2,4-триметил-1,2-дигидрохинолина с известным антиоксидантом фенольного типа ионолом (2,6-ди-трет-бутил-4-метилфенолом), принятого за стандарт, в концентрациях 1,5·10-4 моль/л в процессе автоокисления жира печени минтая при 70°С и определения кинетики окисления по поглощению кислорода было установлено, что относительная антиокислительная активность данного соединения оказалась ниже, чем у ионола, в два раза.
Известен 6-этокси-2,2,4-триметил-1,2,-дигидрохинолин (III), являющийся аналогом I, который был получен в виде вязкой массы путем конденсации п-фенетидина с ацетоном в присутствии йода или 4-толуолсулфокислоты [Tung С.С. 1,2-Dihydroqinoline studien. I. The structure of the arylamine-acetone condensation products,- tetrahedron, 1963, vol.19, №11, p.1685-1689; Патент США №2748100 от 29.05.1956 г.; Иванов Ю.А. Дис.Канд. хим. наук, г. Москва, 1983 г.].
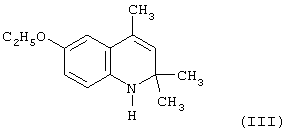
При сравнении относительной антиокислительной активности 6-этокси-2,2,4-триметил-1,2,-дигидрохинолина (III) с известным антиоксидантом фенольного типа ионолом (2,6-ди-трет-бутил-4-метилфенолом), принятого за стандарт, в процессе автоокисления жира печени минтая при 70°С и определения кинетики окисления по поглощению кислорода было установлено, что относительная антиокислительная активность III составила 0,6 относительных единиц.
Известен 6-гидрокси-2,2,4-триметил-1,2-дигидрохинолин (IV), являющийся аналогом соединению 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина (I), полученный путем кипячения 6-этокси-2,2,4-триметил-1,2-дигидрохинолина (III) в концентрированной бромистоводородной кислоте (Иванов Ю.А. Дис.Канд. хим. наук, г. Москва, 1983 г.).
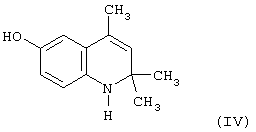
Исследования антиокислительной активности 6-гидрокси-2,2,4-триметил-1,2-дигидрохинолина (IV) показали его относительную антиокислительную активность по сравнению с известным антиоксидантом ионолом (2,6-ди-трет-бутил-4-метилфенолом), принятого за стандарт, в концентрациях 2,1·10-4 моль/л в процессе автоокисления жира печени минтая при 70°С и определения кинетики окисления по поглощению кислорода относительная антиокислительная активность IV составила 0,78 относительных единиц.
Известен 8-метокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолин (V), являющийся аналогом 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина (I), полученный путем гидрирования 8-метокси-2,2,4-триметил-1,2-дигидрохинолина (II) на никеле Ренея в виде вязкой массы (Иванов Ю.А. Дис.Канд. хим. наук, г. Москва, 1983 г.).
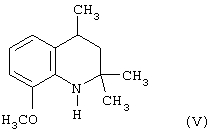
При сравнении относительной антиокислительной активности 8-метокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина (V) с известным антиоксидантом фенольного типа ионолом (2,6-ди-трет-бутил-4-метилфенолом), принятого за стандарт, в концентрациях 1,5·10-4 моль/л в процессе автоокисления жира печени минтая при 70°С и определения кинетики окисления по поглощению кислорода было установлено, что относительная антиокислительная активность V составила 0,6 относительных единиц.
Известен 8-гидрокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолин (VI) являющийся аналогом 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина (I), полученный из 8-метокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина (V) кипячением его в бромистоводородной кислоте и переводом полученной бромистоводородной соли VI в основание (Иванов Ю.А. Дис.Канд. хим. наук, г. Москва, 1983 г.).
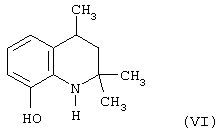
Исследование антиокислительных свойств 8-гидрокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина (VI) показали его относительную антиокислительную активность по сравнению с известным антиоксидантом фенольного типа ионолом (2,6-ди-трет-бутил-4-метилфенолом), принятого за стандарт, в концентрациях 1,5-10-4 моль/л в процессе автоокисления жира печени минтая при 70°С и определения кинетики окисления по поглощению кислорода, которая составила 1,0 относительных единиц.
Известен 6-гидрокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолин (VII), являющийся аналогом 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина (I), полученный переводом бромистоводородной соли VII в основание (Иванов Ю.А. Дис.Канд. хим. наук, г. Москва, 1983 г.).
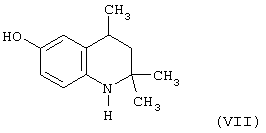
Исследование антиокислительных свойств VII показали его относительную антиокислительную активность по сравнению с известным антиоксидантом фенольного типа ионолом (2,6-ди-трет-бутил-4-метилфенолом), принятого за стандарт, в концентрациях 1,5·10-4 моль/л в процессе автоокисления жира печени минтая при 70°С и определения кинетики окисления по поглощению кислорода, которая составила 0,8 относительных единиц.
Известен 6-ацетокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолин (VIII), являющийся наиболее близким аналогом по структуре и свойствам и принятый нами за прототип 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина (I), полученный из 6-гидрокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина (VII) путем его ацилирования хлорангидридом уксусной кислоты (Иванов Ю.А. Дис.Канд. хим. наук, г. Москва, 1983 г.; А.Е.Ободовская, З.А.Старикова, Ю.А.Иванов, И.Е.Покровская. Журнал структурной химии, 1985. т.26, №5, с.99-102).
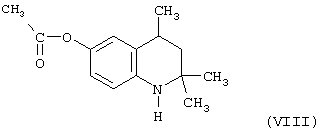
Исследование антиокислительных свойств VIII показали его относительную антиокислительную активность по сравнению с известным антиоксидантом фенольного типа ионолом (2,6-ди-трет-бутил-4-метилфенолом), принятого за стандарт, в концентрациях 1,5·10-4 моль/л в процессе автоокисления жира печени минтая при 70°С и определения кинетики окисления по поглощению кислорода, которая составила 1,1 относительных единиц.
Сравнение относительной антиокислительной активности 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина (I) с ионолом (2,6-ди-трет.бутил-4-метилфенол), принятого за стандарт, в концентрациях 1,5·10-4 моль/л в процессе автоокисления жира печени минтая при 70°С и определении кинетики окисления по поглощению кислорода показало, что относительная антиокислительная активность данного соединения I составила 1,5 относительных единиц.
В ограниченных научных источниках информации иногда встречается упоминание о 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолине, как о промежуточном соединении или полупродукте в синтезе некоторых веществ (патент США №3991042 от 9.11.1976 г.). Однако убедительных сведений, доказывающих его строение и другие параметры, не приводятся, что не дает оснований считать ранее приводимую формулу 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина полностью достоверной. Ранее имеющиеся сведения никак не подтверждают и не характеризуют само это вещество, хотя известно, что от чистоты соединения зависят не только его физико-химические свойства, включая его агрегатное состояние при обычных условиях, но также и другие свойства, например его ингибирующая активность.
Применение гидрирования в спиртовой среде 6-этокси-2,2,4-триметил-1,2-дигидрохинолина (III) на никелевом катализаторе при получении 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина (I), хотя и приводит к образованию 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина (I), но ниже технической квалификации, то есть с содержанием основного вещества  49%, что не дает основания считать его индивидуальным соединением. Известно, что чистота вещества, полученного различными методами, может сильно отличаться своими свойствами в зависимости от способа его получения, так как присутствующие в нем даже микропримеси, трудно обнаруживаемые известными методами, определяют не только его агрегатное состояние при обычных условиях, но и физико-химические свойства, включая его стабилизирующую активность, например антиокислительную. 49%, что не дает основания считать его индивидуальным соединением. Известно, что чистота вещества, полученного различными методами, может сильно отличаться своими свойствами в зависимости от способа его получения, так как присутствующие в нем даже микропримеси, трудно обнаруживаемые известными методами, определяют не только его агрегатное состояние при обычных условиях, но и физико-химические свойства, включая его стабилизирующую активность, например антиокислительную.
Отсутствие в периодической литературе, патентах и других публикациях достоверных сведений о способах получения 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина (I) и его физико-химических свойствах дает все основания считать его неопределенным, новым.
Задачей настоящего изобретения является создание нового 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина (I), обладающего высокоэффективной антиокислительной активностью и разработка оптимального способа его получения на новом катализаторе с использованием высокоскоростного перемешивания.
Поставленная задача достигается новым 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолином (I), обладающим высокоэффективной антиокислительной активностью, и способом его получения, заключающимся в том, что 6-этокси-2,2,4-триметил-1,2-дигидрохинолин (III) подвергают гидрированию в спиртовой среде на новом катализаторе, а также известных никелевых катализаторах, других металлах, активных в реакции гидрирования при интенсивном перемешивании, с последующим выделением целевого продукта сразу или после предварительной дробной фракционной перегонки с последующей дополнительной очисткой.
Настоящее изобретение описывает способ получения I на новом катализаторе при интенсивном перемешивании, полностью охарактеризовывает его различными физико-химическими методами исследования, а также физическими и пожаровзрывобезопасными данными.
Результаты исследований, способы получения 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина (I), приведенные ниже, подтверждают, но не ограничивают данное изобретение.
Исследование 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина (I) методом ЯМР.
Спектры ЯМР 1H и 13С раствора 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина в DMSO-d6 измерены на спектрометре ЯМР Broker AM-360 на частотах 360 и 90 МГц, относительно внутреннего эталона ТМС.
В спектре 1Н (фиг.1) наблюдается группа сигналов при 1,05-1,3 м.д. суммарной интенсивностью 13Н, их можно подразделить на следующие компоненты.
Два синглета 1,05 и 1,14 м.д. от протонов метильных групп при С2, наложившиеся друг на друга в области 1,18 и 1,28 м.д., синглет от одного из протонов при С3, триплет протонов СН3 – фрагмента этоксигруппы и дуплет протонов метальной группы при С4;
При 1,25 м.д. триплет протонов СН3 – фрагмента этоксигруппы; J(H-H)=6,7;
При 1,65 м.д. находится мультиплет от другого протона при С3; J(H-H)=5,7; J(H-H)=12,4;
При 2,75 м.д. находится мультиплет от протона при С4;
При 3,86 находится квадруплет протонов метиленового фрагмента этоксигруппы;
J(H-H)=6.7;
При 4,95 м.д. находится плохо разрешенный сигнал протона NH;
При 6,36 м.д. находится дуплет протона при C7, J(H-H)=8,6;
При 6,46 м.д. находится двойной дуплет протона при C8; J(H-H)=1,9 и 8,7;
При 6,64 м.д. находится дуплет протона при С5; J(H-H)=1,9.
Спектр ЯМР 13С 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина (I) зарегистрирован с подавлением спин спиновых взаимодействий с протонами. В спектре ЯМР 13С (фиг.2) наблюдаются химические сдвиги, принадлежащие следующим углеродным атомам:
При 14,9 м.д. – сигнал метильного углерода этоксигруппы;
При 20,5 м.д. – сигнал углерода метильной группы при С4;
При 26,8 м.д. – сигнал углерода С4;
При 27,4 и 30,8 – сигналы углеродов метильных групп при С2;
При 44,3 м.д. – сигнал углерода С3;
При 48,2 м.д. – сигнал углерода C2;
При 63,3 м.д. – сигнал метиленового углерода этоксигруппы;
При 113,3 м.д. – сигналы углеродов С5 и С7;
При 125,0 – сигнал углерода С10;
При 138,6 – сигнал углерода С9;
При 149,5 – сигнал углерода С6;
При 114,5 – сигнал углерода C8.
Таким образом, спектры спектры ЯМР 1H и 13С полностью подтверждают химическую структуру (порядок соединения атомов в молекуле) 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина (I).
Масс-спектрометрические исследования 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина (I).
Масс-спектрометрический анализ (фиг.3) проводился на квадрупольном хромато-масс-спектрометре марки Hewlett Packard HP 5973, на кварцевой капиллярной колонке HP-5MS (30 м × 0,25 мм × 0,25 мк) в режиме програмирования температуры от 50 до 300°С со скоростью 10°С /мин; температура инжектора составляла 280°С, скорость сканирования – 1 спектр/с, диапазон регистрируемых масс 40-450 в режиме полного ионного тока. Ионизирующее напряжение – 70 В.
На основании полученных данных хромато-масс-спектрограммы (фиг.4.) содержание основного вещества 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина составляет 100%.
Основные процессы фрагментации по мостиковым группам 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина (I) представлены на схеме, приведенной в конце описания.
Как видно из схемы, молекулярный ион отвечает массе 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина (I) (М 219), а процессы фрагментации, происходящие по мостиковым группам подтверждает структуру I. Основной осколочный ион отвечает фрагменту с массой m/е 204 (max. инт., 100%). Он образуется при потере метильной группы. Распад по мостиковым группам определяет образование осколочных ионов на шкале массовых чисел, отвечающих потере одной этильной группы, с образованием осколочного иона m/е 190 (16,1%) и дальнейшим его распадом, приводящим к образованию осколочных ионов с m/е 176 (8,8%) и m/е 160 (9,4%), еще группа ионов на шкале массовых чисел отвечает разрыву связи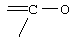 (2-2) и образований ионов с m/е 174 (4,8%), m/е 175 (7,4%). (2-2) и образований ионов с m/е 174 (4,8%), m/е 175 (7,4%).
Исследования 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина (I) методом ИК-спектрофотометрии.
ИК-спектр был получен на спектрофотометре SPECORD M80. Образец был запрессован с КВr. 1 мг вещества в 200 мг КВr. (фиг.5);
образец в вазелиновом масле, тонкий слой между пл. КВr. (фиг.6).
Отнесение некоторых полос поглощения на основе обобщенных литературных данных, v 1/см:
3368 (NH-вал.кол.), 3060, 3020 (=СН-вал.кол.), 2972, 2912,2872 (СН3, СН2-вал.кол.), 1576, 1500 (вал.кол. ароматического кольца), 1472, 1444 (деформационные кол. метильных и метиленовых групп), 1388, 1380 (дуплет, характерный для гем-диметильных групп), 1280 и 1052 (вал.кол. Ph-O-C-группы), 876, 804 (неплоские деформ. кол. Н-атомов бензольного кольца, отвечающие 1,2,4-замещению).
Основные характеристические частоты поглощения соответствуют и подтверждают данную структуру молекулы 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина (I).
Исследования 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина (I) методом УФ-спектрофотометрии.
УФ-спектр 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина (I) получен на UV-VIS спектрофотометре Agilent 8453 фирмы Agilent Technologies. Образец был растворен в этаноле (фиг.7), в гексане (фиг.8). В УФ-спектрах наблюдаются по две основные характеристических полосы:
–  нм=244.0 и нм=244.0 и  нм=313.0 (в этиловом спирте) фиг.7; нм=313.0 (в этиловом спирте) фиг.7;
–  нм=248.0 и нм=248.0 и  нм=320.0 (в гексане) фиг.8. нм=320.0 (в гексане) фиг.8.
На основе обобщенных литературных данных можно предположить, что полосы 244 нм (этаноле) и 248 нм (в гексане) являются полосами    * перехода, а 313 нм и 320 нм – полосами n * перехода, а 313 нм и 320 нм – полосами n  * – перехода. * – перехода.
Кристаллическая и молекулярная структура 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина (I) и сравнение ее со структурой 6-ацетокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина (VIII), принятого за прототип I.
С целью установления точного строения молекулы 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина (I) впервые проведено рентгеноструктурное исследование бесцветных монокристаллов I, выращенных медленным испарением гексанового раствора, Тпл.=38-39°С.
Рентгеноструктурное исследование проводилось на дифрактометре Enraf Nonius FR 590 при комнатной температуре. Основные сведения о рентгеноструктурном эксперименте и кристаллографических параметрах 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина (I) приведены в таблице 1. Структура расшифрована прямым методом (программный комплекс SHELXL-97). Положения атомов водорода рассчитаны из геометрических соображений. Уточнения проводились в анизотропном (для неводородных атомов) и изотропном (для атомов водорода) полноматричном приближении по F2 (программный комплекс SHELXL-97). Полные таблицы координат атомов, температурных факторов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных.
Таблица 1
Кристаллографические данные и параметры уточнения кристаллической структуры 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина |
| ПАРАМЕТР |
ЗНАЧЕНИЕ |
| Брутто-формула |
C14H21NO |
| Молекулярная масса |
219.32 |
| Т/°К (расч.) |
293(2) |
| Дифрактометр |
Enraf Nonius FR 590 |
| Тип сканирования |
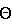 /2 /2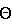 |
| Интервал сканирования |
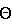 =3.35°-74.86° =3.35°-74.86° |
| Излучение |
CuK |
| длина волны / |
1.54180 |
| Размеры кристалла |
0.3×0,3×0,3mm |
| Сингония, пространственная группа |
Моноклинная P21/c |
| Параметры кристаллической ячейки |
A=13,196 (4) |
 =90.00° =90.00° |
| |
В=8.865 (6) |
 =90.77(6)° =90.77(6)° |
| |
C=11.330 (11) |
 =90.00° =90.00° |
| Объем ячейки |
1325.3(16) A3 |
| Плотность (вычисл.) |
1.099 г/см3 |
| Число молекул в ячейки |
4 |
| Коэффициент поглощения |
0,580 см.-1 |
| F(000) |
480 |
| Общее число зарегистрированных отражений |
5533 |
| Общее число независимых отражений |
2717 |
Окончательный R-фактор [по 1805 отражениям сI>2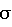 (I)] (I)] |
|
| R1 |
0,0530 |
| wR2 |
0,1254 |
Для исследования молекулярной и кристаллической структуры 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина (I) методом рентгеноструктурного анализа при ее расшифровки была использована нумерация атомов, входящих в состав молекулы I, приведенная на фиг.9. Основные величины длин связей и валентных углов представлены на фиг.10 и в таблице 2.
Таблица 2
Величины основных межатомных расстояний и валентных углов молекулы 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина |
| Связь |
d/A |
Валентный угол |
 /град. /град. |
| N1-C10 |
1.399(2) |
C10-N1-C2 |
118.3(1) |
| N1-C2 |
1.469(2) |
C10-N1-H1 |
121.70) |
| N1-H1 |
0.80(2) |
C2-N1-H1 |
116.8(1) |
| С2-СЗ |
1.514(2) |
N1-С2-С3 |
106.4(1) |
| С2-С22 |
1.521(3) |
С22-С2-С21 |
109.5(2) |
| С2-С21 |
1.537(2) |
С2-С3-С4 |
114.3(1) |
| СЗ-С4 |
1.522(3) |
С3-С4-С5 |
109.9(1) |
| С4-С41 |
1.514(3) |
С41-С4-С3 |
111.3(2) |
| С4-С5 |
1.523(2) |
С41-С4-С5 |
113.7(1) |
| С5-С6 |
1.388(2) |
С4-С5-С10 |
120.8(1) |
| С5-С10 |
1.399(2) |
С7-С8-С9 |
119.3(1) |
| С6-С7 |
1.390(2) |
С8-С9-С10 |
121.9(2) |
| С7-С8 |
1.375(2) |
С9-С10-С5 |
118.7(1) |
| С7-07 |
1.377(2) |
С6-С5-С10 |
118.5(1) |
| 07-С71 |
1.413(2) |
С5-С6-С7 |
122.3(1) |
| С71-С72 |
1.489(3) |
С7-О7-С71 |
118.2(1) |
| С8-С9 |
1.386(2) |
О7-С71-С72 |
108.3(2) |
| С9-С10 |
1.398(2) |
|
|
Бициклическая система молекулы I состоит из двух фрагментов – плоского бензольного кольца и неплоского тетрагидропиридинового цикла. Среднеквадротичное отклонение атомов бензольного кольца от плоскости составляет 0,006 Å. В этой же плоскости лежат и атомы N1, С4 и О7, связанные с атомами углерода бензольного кольца. Двугранные углы С8-С9-С10- N1, С4-С5-С6-С7 и С5-С6-С7-07 равны соответственно 176,8°, 179,7° и 178,6°. Незначительно отклоняются от этой плоскости и связанные с кислородом О7 атомы углерода С71 и С72. Двугранный угол С7-O7-С71-С72 равен 177,3°. Длины связей С-С бензольного кольца те же, что и в других молекулах замещенных бензолов (Alien F. Н., (2002). Acta Cryst. Sect. В, 58, 380).
Атомный радиус sp3-гибридизованного атома углерода С71 больше атомного радиуса углерода С7 бензольного кольца, поэтому связь С71-O7 длиннее связи С7-O7 (1,413(2) и 1,377(2)Å). В молекуле же 6-ацетокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина (VIII), наоборот, связь С-O, аналогичная связи С7-O7 в I, длиннее следующей связи O-С (1,441(8) и 1,335(8)Å) (А.Е.Ободовская, З.А.Старикова, Ю.А.Иванов, И.Е.Покровская. Журнал структурной химии 1985, т.26, №5, с.99-102), хотя атомные радиусы углеродов, с которыми связан ацетильный кислород в VIII, примерно одинаковы.
1,2 аллильного напряжения, существующего в циклогексеновых циклах (Johanson, F., 1968, Chem. Rev. p.68. 4. 375.), углерод С41 занимает псевдоаксильное положение. Атом азота N1 имеет плоскую конфигурацию связей (сумма валентных углов равна 356,9°). Длины связей С-С обычны для замещенных тетрагидропиридинов.
Как уже упоминалось выше, в молекуле I реализуется плоская конфигурация этих связей, в VIII конфигурация связей – пирамидальная (сумма валентных углов равна 341,7°). При такой конфигурации связей у атома азота должна существовать неподеленная электронная пара, занимающая определенную область около атомного пространства. Поэтому минимум энергии напряжения тетрагидропиридинового кольца в I и VIII достигается при разной ориентации N-H относительно связи (СН3)2С-СН2. В структуре I торсионный угол H-N-C(CH3)2-CH2 равен 151,8°, в структуре (VIII) равен – 176,7°.
Различные электронные состояния атома азота (и соответствующие им конфигурации связей) в молекулах I и VIII возникают скорее всего из-за того, что в кристаллах VIII N-Н – группа участвует в межмолекулярной водородной связи С=О…Н-N, см. (фиг.12), а в кристаллах I (фиг.13) таких связей нет, упаковка молекул в структуре определяется только ван-дер-ваальсовым взаимодействием.
Интересно отметить, что в кристаллах 6-окси-2,2,4-триметил-1,2-дигидрохинолина (IV), где имеются межмолекулярные водородные связи Н-O…H-N (А.Е.Ободовская, З.А.Старикова, Ю.А.Иванов, И.Е.Покровская. Журнал структурной химии 1985, т.26, №5, с.93-98), конфигурация связей атома азота также пирамидальная (сумма валентных углов -338,3° – почти такая же, как в VIII).
Способы получения 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина (I) на новом и известных катализаторах.
Поэтому создание новых катализаторов на основе никельсодержащих является весьма актуальным. С целью повышения селективности процесса гидрирования на никельсодержащих катализаторах, выхода и качества 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина (I) нами был использован новый никельсодержащий катализатор состава: 1-8% титана, 30-60% никеля, 0,2-1,5% железа и 35-65% алюминия.
Скорость перемешивания реакционной массы в процессе гидрирования 6-этокси-2,2,4-триметил-1,2-дигидрохинолина (III) на твердом катализаторе оказывает влияние на многие факторы этой реакции, включая не только концентрацию водорода в реакционной массе, но и на время контакта вещества с катализатором, что также определяется активностью и селективностью самого катализатора.
Оптимизация процесса гидрирования определяется активностью и селективностью катализатора, давлением водорода, температурой, скоростью перемешивания реакционной массы и временем его проведения. Данные параметры рассчитываются в каждом конкретном случае.
Приготовление нового катализатора процесса гидрирования.
Сплав, содержащий 1-8% титана, 30-60% никеля, 0,2-1,5% железа и 35-65% алюминия, размалывают на роторно-шаровой мельнице МРШ-150, или др., обеспечивающей требуемое размельчение. Исходный сплав размалывают до порошка с размерами частиц, проходящих через сито 125 мкм.
ПРИМЕР 1.
650 г технического 6-этокси-2,2,4-триметил-1,2-дигидрохинолина (III) в виде густой жидкости черно-бурого цвета подвергают очистке вакуумной перегонкой в колбе Кляйзена. Получают 642 г (98,7%) соединения III, светло-желтого цвета с т. кип. 131-132°С при 2 мм рт. ст. (т. кип. 168-170°С при 12 мм рт. ст.) и 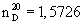 . .
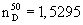 (определен впервые), (определен впервые),  =1,089 г/см3. =1,089 г/см3.
В аналогичных условиях проводили реакции на катализаторах W2, W3, W4, в среде этанола, изопропанола, что незначительно повлияло на скорость реакции и выход целевого продукта.
Элементный анализ
Найдено: С 76,65; Н 9,71; N 6,43%, М+219 (масс-спектром). C14H21NO.
Вычислено: для C14H21NO: С 76,67; Н 9,65; N 6,39%.
ПРИМЕР 2.
В литровый реактор из нержавеющей стали, снабженный механической мешалкой (1000 об/мин), термопарой загружают 642 г (295 моля) перегнанного сантохина, 30 г нового катализатора, приготовленного по методике, приведенной выше, и 150 мл абсолютного этанола и по окончании загрузки реагентов его тщательно продувают азотом, затем при комнатной температуре в реактор закачивают водород до 15 атмосфер, в течение часа, при 400 об/мин, давление снижается в реакторе до 5 атмосфер затем давление водорода доводят до 15 атмосфер и нагревают реакционную массу до 70°С, процесс повторяют, пока давление после очередной подкачки водорода не изменится. Реактор охлаждают до комнатной температуры, реакционную массу выгружают на фильтр и отфильтровывают катализатор в токе азота. Затем катализатор промывают дважды этанолом по 50 мл. фильтрат загружают в перегонный куб и перегоняют в вакууме, собирая в качестве легколетучих продуктов этанол, а в качестве высококипящей фракции 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолин (I), с температурой кипения 128-130°С при остаточном давлении 2-3 мм рт.ст. Выход 632 г (97% от теор.). После перекристаллизации изопропилового спирта выход I составляет 622 г (95,5% от теор.) бесцветных кристаллов I с температурой плавления 38-39°С, 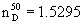 , ,  =1,089 г/см3. =1,089 г/см3.
Элементный анализ
Найдено: С 76,68; Н 9,64; N 6,41%, М+219 (масс-спектром). C14H21NO.
Вычислено: для C14H21NO: С 76,67; Н 9,65; N 6,39%.
В аналогичных условиях проводили реакции в среде этанола, изопропанола, что незначительно повлияло на скорость реакции и выход целевого продукта.
Проба смешения 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина (I), полученного вышеописанными методами, депрессии температуры плавления не дала, а также ЯМР, Масс-, ИК, УФ-спектры и показатели преломления полностью идентичны.
– Температуру вспышки в закрытом тигле 143°С по ГОСТ 12.1.044-89 (п.4.4);
– Температуры вспышки и воспламенения в открытом тигле по ГОСТ 12.1.044-89 (п.п 4.5, 4.6) 147°С и 161°С соответственно;
– Температуру самовоспламенения 330°С по ГОСТ 12.1.044-89 (п.4.8);
– Температурные пределы распространения пламени по паровоздушным смесям по ГОСТ 12.1.044-89 (п.4.12): нижний 146°С, верхний 159°С.
Впервые, исходя из вышеизложенного, был получен и полностью исследован спектральными методами, рентгеноструктурным анализом, элементным анализом 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолин (I) в кристаллической форме, а также определены его температура плавления, показатель преломления и показатели его пожаровзрывоопасности.
Формула изобретения
1. 6-Этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолин (I) в кристаллической форме (Т.пл.=38-39°С), обладающий высокой антиокислительной активностью.
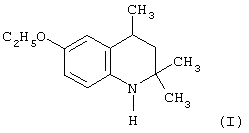
2. Способ получения 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина (I), заключающийся в том, что 6-этокси-2,2,4-триметил-1,2-дигидрохинолин (III) подвергают гидрированию в спиртовой среде при температуре 20-120°С и давлении водорода 2-170 атм., скорости вращения 20-3000 об/мин, на новом катализаторе полученном из сплава состава: 1-8% титана, 30-60% никеля, 0,2-1,5% железа и 35-65% алюминия, путем последующей его активации, а также известных никелевых катализаторах с последующим выделением целевого продукта (I) сразу или после предварительной его очистки.
РИСУНКИ
TH4A – Переиздание описаний изобретений к патентам Российской Федерации
Причина переиздания: Коррекция текста описания изобретения
Извещение опубликовано: 20.09.2005 БИ: 26/2005
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 22.04.2009
Извещение опубликовано: 20.12.2010 БИ: 35/2010
|
|